ABSTRAK
ABAS KURNIAWAN. Studi Histopatologi Potensi Radioprotektif Ekstrak Kelopak Bunga Rosela (Hibiscus sabdariffa L.) dalam Radiasi Ionisasi Radiodiagnostik Berulang pada Lambung Mencit (Mus musculus). Dibimbing oleh SRI ESTUNINGSIH dan DENI NOVIANA.
Penelitian ini bertujuan untuk mengetahui efek radioprotektif dari ekstrak kelopak bunga Rosela (Hibiscus sabdariffa L.) terhadap radiasi ionisasi radiodiagnostik berulang pada lambung mencit (Mus musculus). Sebanyak 48 ekor mencit jantan dewasa digunakan dalam penelitian ini dan dibagi menjadi 4 kelompok; kontrol (K-), radiasi (K+), rosela tanpa radiasi (R-) dan rosela dengan radiasi (R+). Mencit diberi perlakuan ekstrak rosela peroral dengan dosis 50 mg / kg berat badan setiap dua hari sekali sebelum dilakukan radiasi berulang selama 4 dan 8 minggu. Mencit kemudian dieutanasi dengan pemberian obat bius Ketamin overdosis dan dilakukan nekropsi untuk mengambil lambung pada berbagai waktu setelah iradiasi. Sampel organ lambung kemudian di buat menjadi preparat histopatologi dengan menggunakan pewarnaan Hematoksilin-Eosin (HE). Kelainan pada lambung dan perubahan lainnya diamati dengan cara menghitung jumlah sel parietal, sel chief dan sel radang setelah dilakukan radiasi pada seluruh tubuh. Data kuantitaif kemudian dianalisa secara statistik menggunakan uji ANOVA dan uji lanjut Duncan. Radiasi selama 4 minggu menghasilkan total dosis radiasi 2.9 mSv dan radiasi selama 8 minggu menghasilkan dosis radiasi 5.3 mSv. Hasil penelitian menunjukkan bahwa pemberian ekstrak rosela mampu melindungi sel parietal dan sel chief terhadap radiasi ionisasi radiodiagnostik berulang. Pemberian ekstrak rosela juga menghambat proses peradangan dengan mengurangi jumlah nekrosis dari sel parietal dan sel chief. Pemberian ekstrak rosela secara signifikan mampu mengurangi efek biologis dari radiasi pada sel parietal dan sel chief (p<0.05). Rosela dapat dimanfaatkan sebagai radioprotektor alami terhadap radiasi ionisasi.
ABSTRACT
ABAS KURNIAWAN. Histopathology Study of Radioprotective Potential Calyx Roselle (Hibiscus sabdariffa L.) Extract on Recurrent Radiodiagnostic Ionizing Radiation in the Gastric of Mice (Mus musculus). Under direction of SRI ESTUNINGSIH and DENI NOVIANA.
The aim of this study was to determine the radioprotective effect of calyx Roselle (Hibiscus sabdariffa L.) extract in recurrent radiodiagnostic ionizing radiation on the gastric of mice (Mus musculus). Fourty eight adult males of mice were used and divided into 4 groups: control (K-), radiation (K+), roselle without radiation (R-) and roselle with radiation (R+). Mice were treated with 50 mg/kg of body weight orally of Roselle extract every two days prior to recurrent irradiation for 4 and 8 weeks. The mice were euthanized by overdose Ketamine and then necropsied followed gastric collection at various time points after irradiation. Sample of gastric were processed to prepare histopathology slides with Haematoxylin-Eosin stain. The changes on the gastric alterations were studied by count the amount of parietal, chief cells and infiltration of inflammatory cells after whole body irradiation. Quantitative data were analysed with ANOVA test and followed by Duncan test. Radiation during 4 week produce total radiation 2.9 mSv and 8 week produce 5.3 mSv. The result showed that Roselle extract was protect parietal and chief cells from radiation effect by recurrent radiodiagnostic ionizing radiation. Roselle extract also inhibiting inflammation process by decreasing necrosis in parietal and chief cells. Administration of Roselle extract significantly (p<0.05) reduced the bioeffects of radiation. Roselle could be useful as natural radioprotector against ionizing radiation.
PENDAHULUAN
Latar Belakang
Sinar-X pertama kali ditemukan oleh Wilhelm Conrad Roentgen pada tahun 1895 dan dikenal juga dengan sebutan Sinar Roentgen. Penemuan ini berpengaruh sangat besar terhadap perkembangan dunia kedokteran manusia dan saat ini telah berkembang penggunaannya dalam dunia kedokteran hewan. Seiring dengan berkembangnya zaman, sinar-X kini berkembang pesat menjadi sarana penunjang radiodiagnostik untuk mendiagnosa suatu penyakit (Thrall 2002). Sinar-X juga dimanfaatkan untuk terapi radiasi atau radioterapi pada penanganan kasus kanker. Radioterapi dalam pelaksanaannya juga dapat dikombinasikan dengan tindakan bedah dan kemoterapi (Henriksen dan Maillie 2003).
Energi yang dihasilkan oleh sinar-X merupakan energi radiasi ionisasi yang berbahaya bagi kesehatan. Kerusakan yang disebabkan oleh energi radiasi sinar-X yang dapat langsung terjadi disebut dengan efek deterministik dan kerusakan yang
tertunda dalam kurun waktu tertentu berupa efek stokastik. Berbagai kerusakan juga terjadi akibat radiasi ionisasi berupa kerusakan pada krosomom (Mozdarani et al. 2002), DNA (Reynolds dan Shecker 1995), pertumbuhan tumor (Thrall 2002), katarak (Yoshinaga et al. 2005), kerusakan pada kripta usus (Matsuyama et al. 2006), kerusakan pada sel darah putih perifer (Rask et al. 2008), serta gangguan pada lambung yaitu gastritis erosive dan colitis akibat dosis akut tunggal (Breiter et al. 2009). Penggunaan sarana radiodiagnostik sinar-X di Indonesia berada dalam pengawasan Badan Pengawas Tenaga Nuklir (BAPETEN) (Ulum dan Noviana 2008) dan di dunia oleh International Atomic Energy Agency (IAEA) dan International Commission on Radiological Protection (ICRP) (IAEA 2002).
radiasi internal dapat dilakukan dengan menggunakan sediaan herbal sebagai sediaan radioprotektif (Jagetia 2007).
Selama sepuluh tahun terakhir telah dilakukan penelitian terhadap berbagai tanaman yang memiliki sifat radioprotektif. Melihat toksisitas sebagai kendala utama dalam penggunaan senyawa sintesis, banyak tanaman telah diteliti kemampuan radioprotektif terhadap efek radiasi ionisasi. Tanaman yang memiliki kemampuan radioprotektif harus memenuhi persyaratan sebagai radioprotektor. Syarat radioprotektor yang ideal yaitu efisien, tidak ada atau efek samping minimal, stabil, umur simpan cukup panjang, mudah diperoleh dan ekonomis, onsetnya cepat serta durasinya lambat serta dapat menjangkau semua organ dan mampu mencapai Blood Brain Barrier (Shukla dan Gupta 2010). Tanaman yang telah diteliti dan digunakan sebagai radioprotektor yaitu spirulina (Zhang et al. 2001), ginseng (Lee et al. 2010), dan mint (Baliga dan Rao 2010).
Salah satu tanaman herbal yang mulai dikenal masyarakat adalah rosela (Hibiscus sabdariffa L.). Sebagai sediaan herbal, rosela telah dipergunakan secara luas oleh masyarakat dan oleh peneliti khasiat tanaman obat. Menurut Morton
(1987), kelopak bunga atau kaliks rosela berkhasiat sebagai cholerectic (merangsang keluarnya empedu), diuretic (peluruh air seni), antipiretic (menurunkan demam), hypotensive (menurunkan tekanan darah), dan menurunkan
kekentalan darah serta merangsang gerakan peristaltik usus. Mardiah et al. (2009) menambahkan rosela berkhasiat sebagai anti kanker, anti hipertensi dan anti diabetes.
Tujuan
Tujuan dari penelitian ini yaitu mengetahui potensi radioprotektif ekstrak rosela (Hibiscus sabdariffa L.) terhadap radiasi ionisasi radiodiagnostik pada gambaran histopatologi lambung mencit (Mus musculus).
Hipotesis
Ekstrak rosela (Hibiscus sabdariffa L.) dapat berfungsi sebagai bahan radioprotektor biologi.
Manfaat
Manfaat penelitian ini yaitu memberikan informasi dan gambaran histopatologi organ lambung mencit dan manfaat rosela sebagai bahan radioprotektor terhadap radiasi ionisasi radiodiagnostik.
TINJAUAN PUSTAKA
Sinar-X
Sinar-X merupakan sinar tidak nampak yang menghasilkan radiasi ionisasi. Panjang gelombang sinar-X adalah 10-0.01 nano meter (nm) dengan frekuensi 30.1015 Hertz (Hz) – 30.1018 Hz dan energi 120 elektron volt (eV) sampai 120 kilo elektron volt (keV). Gelombang ini lebih pendek dari panjang gelombang sinar ultra violet atau UV. Sinar-X kini banyak digunakan sebagai sarana radiodiagnostik untuk menghasilkan gambaran medis. Khusus dalam dunia kedokteran hewan, sinar-X ini mulai dimanfaatkan pada tahun 1970-an. Ilmu yang mempelajari berbagai hal yang berkaitan dengan pemanfaatan energi radiasi disebut dengan radiologi. Pemanfaatan energi radiasi ini digunakan sebagai radiodiagnostik penyakit dan sarana radioterapi (Thrall 2002).
Radiasi Ionisasi
Radiasi ionisasi merupakan nama yang tepat untuk semua jenis radiasi yang memiliki sejumlah energi yang dapat mengionisasi suatu molekul. Beberapa sumber radiasi yang termasuk dalam radiasi ionisasi yaitu sinar-α (alpha), sinar -(beta), sinar- (gamma), sinar-X, dan sinar UV dengan panjang gelombang yang rendah. Jumlah energi yang mampu mengionisasi atom dan molekul adalah 10 eV dan beberapa molekul dalam bentuk liquid dan solid memiliki energi ionisasi yang rendah sebesar 6 eV. Hal ini menjelaskan bahwa sinar UV yang memiliki panjang gelombang dibawah 200 nm (6.2 eV) mampu menyebabkan radiasi ionisasi (Henriksen dan Maillie 2003).
pekerja radiasi di Indonesia adalah 20 mSv rata-rata dalam 5 tahun (Ulum dan Noviana 2008).
Proteksi Radiasi
Keselamatan radiasi (radioprotektif) adalah tindakan yang dilakukan untuk melindungi pasien (hewan), pekerja (operator, dokter hewan, dan paramedis), anggota masyarakat dan lingkungan hidup dari bahaya radiasi. Syarat proteksi radiasi dalam pemanfaatan sinar-X sebagai sarana penunjang diagnosa radiodiagnostik harus memperhatikan beberapa hal diantaranya adalah (1) justifikasi pemanfaatan tenaga nuklir, (2) limitasi dosis dan (3) optimisasi proteksi dan keselamatan rabvdiasi. Keselamatan pasien dapat dilakukan dengan meminimalisasi dosis paparan. Tindakan dilakukan dengan cara memperkecil luas permukaan paparan, mempersingkat waktu paparan, menggunakan filter dan menggunakan teknik radiografi dengan memanfaatkan kilo Volt peak (kVp) tinggi (Ulum dan Noviana 2008).
Keselamatan pekerja terhadap paparan radiasi dilakukan dengan melakukan
radiografi dalam jarak sejauh mungkin dari sumber sinar-X, menggunakan sarana proteksi radiasi seperti, apron Plumbum (Pb), sarung tangan Pb, kaca mata Pb, pelindung tiroid Pb, alat ukur radiasi dan mempersingkat waktu radiasi.
Keselamatan lingkungan terhadap bahaya radiasi dilakukan dengan merencanakan desain ruang radiografi yang aman baik bagi pasien, operator dan lingkungan. Ruangan dilapisi dengan Pb dan memperhitungkan beban kerja ruangan terhadap sinar-X yang sesuai dengan perundang-undangan yang berlaku (Ulum dan Noviana 2008).
Obat herbal telah digunakan sejak lama untuk mengobati penyakit. Obat herbal menjadi alternatif terhadap penggunaan obat sintetik dengan pertimbangan tidak ada efek toksik atau efek toksik yang rendah. Sampai saat ini, hampir 70% populasi manusia bergantung pada tanaman untuk mengatasi permasalahan yang berhubungan dengan kesehatan. Berbagai penelitian terus dilakukan untuk menemukan tanaman radioprotektor yang efektif dengan tingkat toksik yang rendah. Banyak tanaman telah berhasil diketahui kemampuannya dalam mengatasi penyakit pada manusia yang diakibatkan oleh radikal bebas seperti rheumatoid arthritis, atherosclerosis, kanker, Alzheimer’s, Parkinson’s, penuaan dan berbagai kondisi lain termasuk peradangan (Das 2002). Tanaman atau bagian dari tanaman dengan kandungan senyawa fitokimia diharapkan dapat melindungi kerusakan langsung akibat radiasi ionisasi maupun akibat radikal bebas yang dihasilkan.
Berbagai tanaman telah diteliti khasiatnya sebagai radioprotektor terhadap efek radiasi ionisasi. Ekstrak tanaman yang berkhasiat sebagai radioprotektor kebanyakan mengandung senyawa antioksidan, immunostimulan, stimulator proliferasi sel, anti inflamasi dan agen anti mikroba, serta kombinasi dari
kandungan yang ada dalam tanaman tersebut. Spesies lain dari tanaman mungkin mengandung senyawa yang berkhasiat untuk perlindungan terhadap kerusakan akibat radiasi ionisasi (Arora et al. 2005).
Rosela (Hibiscus sabdariffa L.)
hari. Kaliks atau kelopak bunga rosela berwarna merah, berdaging renyah dan mengandung banyak air dengan panjang 3.2-5.7 cm serta mengeluarkan bunga hampir sepanjang tahun.
Sistem Taksonomi Rosela (Hibiscus sabdariffa L.) menurut Morton (1987) sebagai berikut:
Divisi : Spermatophyta Subdivisi : Angiospermae Kelas : Dicotiledonae Famili : Malvaceae Genus : Hibiscus
Spesies : Hibiscus sabdariffa Linn.
Rosela memiliki kaliks yang tebal (juicy) yang berkhasiat untuk mencegah penyakit kanker dan radang, mengendalikan tekanan darah, melancarkan peredaran darah dan melancarkan buang air besar. Kaliks tersebut mengandung vitamin C, vitamin A, kalsium, protein dan asam amino. Asam amino yang
diperlukan tubuh, 18 diantaranya terdapat dalam kaliks rosela, termasuk arginin dan lignin yang berperan dalam proses peremajaan sel tubuh (Morton 1987).
Gambar 1 Tanaman rosela (Hibiscus sabdariffa L.). A. Rosela, B. Skema bagian bunga rosela, dan C. Kaliks rosela (Osman 2007).
dikenal dengan asam askorbat pada rosela diketahui 3 kali lebih banyak dari anggur dan 9 kali dari jeruk sitrus (Tsai 1996). Asam askorbat atau vitamin C merupakan salah satu antioksidan yang utama. Rosela mengandung kadar antioksidan yang tinggi. Hasil penelitian mengungkapkan bahwa kandungan antioksidan pada teh rosela sebanyak 1,7 mmol/prolox. Jumlah tersebut lebih tinggi daripada jumlah pada kumis kucing (Widyanto dan Nelista 2009).
Antioksidan merupakan pertahanan pertama untuk melawan radikal bebas. Radikal bebas merupakan molekul bermuatan yang memiliki elektron tidak berpasangan dimana untuk menetralisirnya diperlukan elektron dari zat lain (Sen 2010). Antioksidan merupakan senyawa yang memiliki berat molekul rendah yang dapat bereaksi dengan oksidan. Antioksidan memiliki kemampuan untuk memperlambat, menunda, dan mencegah proses oksidasi sehingga antioksidan memiliki peranan yang sangat penting dalam memerangi radikal bebas. Antioksidan bereaksi dengan memberikan elektron ke molekul oksidan atau radikal bebas tanpa adanya gangguan dan menyebabkan terputusnya reaksi berantai dari radikal bebas tersebut (Percival 1998). Antioksidan terbagi menjadi 2
yaitu antioksidan endogen dan eksogen. Antioksidan endogen dihasilkan sendiri oleh tubuh, contohnya glutathione peroksidase, reduktase, katalase, dan superoksida dismutase (SOD). Antioksidan eksogen contohnya flavonoid, ascorbic acid (vitamin C), beta karoten, tocopherol dan tocophenol (vitamin E)
(Jacob 1995).
konstituen, khususnya antosianin dan asam protokatekuat (protocathechuic acid) memiliki aktifitas antioksidan yang kuat secara in vitro maupun in vivo (Tanaka et al. 1995, Tseng et al. 1997; Wang et al 2000).
Mencit (Mus musculus)
Mencit (Mus musculus) adalah rodensia (Latin = rodere, yang artinya mengerat) anggota famili Muridae (tikus-tikusan) yang berukuran kecil. Mencit termasuk hewan monogastrik, omnivora dan merupakan hewan yang aktif di malam hari atau disebut juga hewan nocturnal. Mencit merupakan salah satu hewan percobaan yang sering digunakan dalam penelitian karena fungsi fisiologis dan genetik yang menyerupai manusia sehingga sering digunakan dalam penelitian biomedis. Selain itu, mencit juga dinilai cukup efisien karena memilki umur yang relatif singkat (2-3 tahun), ekonomis, mudah bereproduksi, praktis, mudah dipelihara dalam ruangan yang relatif kecil, dan dapat digunakan untuk penelitian dalam jumlah yang cukup banyak (Malole dan Pramono 1989).
Klasifikasi ilmiah menurut Meredith dan Redrobe (2002), sebagai berikut:
Kingdom : Animalia Filum : Chordata Subfilum : Vertebrata
Kelas : Mamalia Subkelas : Theria Ordo : Rodensia Subordo : Sciurognathi Famili : Muridae Subfamili : Murinae
Genus : Mus Gambar 2 Mencit (Mus musculus) (Porter 2000). Spesies : Mus musculus
sedangkan umur dewasa 50 hari. Mencit memiliki siklus reproduksi yang cepat dan berkembang biak dalam waktu yang singkat selama 19-21 hari sehingga keturunannya dapat diperoleh dalam jumlah banyak. Mencit jantan dapat dikawinkan pada umur 8 minggu.
Anatomi Lambung Mencit
Menurut Cunningham (2002) sistem pencernaan mamalia terdiri dari saluran pencernaan dan organ aksesorius. Saluran pencernaan meliputi mulut, esophagus, lambung, usus halus (duodenum, jejunum, dan ileum), usus besar (sekum, kolon, rektum), dan anus, serta organ aksesorius meliputi gigi, lidah, kelenjar ludah, hati, dan pankreas. Saluran pencernaan adalah salah satu tempat yang banyak terpapar mikroorganisme patogen dan bahan yang tidak hidup termasuk antigen dan karsinogen.
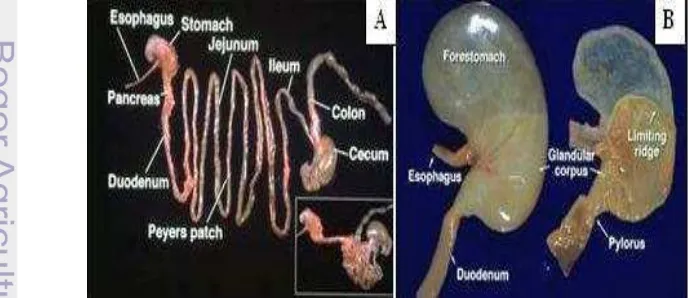
Lambung mencit terletak di sebelah kiri ruang abdomen dan berkontak langsung dengan hati. Lambung mencit terdiri dari dua bagian yang berbeda yaitu bagian lambung non-kelenjar atau fore stomach yang berwarna kelabu dan
berdinding tipis serta sedikit transparan, dan bagian lambung kelenjar atau ventriculus yang berwarna putih dan berdinding tebal (Ghoshal dan Bal 1989). Tepi bagian tengah lambung yang berbentuk cekung disebut dengan curvature minor dan tepi bagian lateral disebut dengan curvature mayor. Secara anatomis
lambung mamalia dibagi atas 4 regio, yaitu cardia, fundus, corpus, dan pylorus (Moore 2000).
Histologi Lambung
Dinding lambung disusun oleh beberapa lapisan yaitu lapisan mukosa, submukosa, muskularis eksterna atau muskularis propria, dan serosa. Bagian lambung kelenjar berhubungan langsung dengan duodenum. Dinding bagian lambung kelenjar merupakan lapisan epitel kolumnar sederhana, terdiri atas sel-sel kelenjar, lamina propria, muskularis mukosa, submukosa, muskularis interna dan eksterna, serta serosa. Mukosa merupakan suatu lapisan tebal yang permukaannya halus dan licin, berwarna coklat kemerahan namun berwarna merah muda di sekitar daerah pilorik. Bagian mukosa lambung non kelenjar berbentuk epitel pipih banyak lapis yang tertutupi oleh lapisan keratin (Frappier 1998). Mukosa lambung tersusun atas lipatan-lipatan longitudinal (rugae) yang terdiri dari lapis muskularis dan sedikit lamina propria yang mengandung kelenjar yang menghasilkan asam dan enzim untuk pencernaan serta gastric pit. Adanya lipatan-lipatan (rugae) ini memungkinkan lambung dapat berdistensi sewaktu di isi makanan (Wilson dan Lester 1994).
Chief cells Parietal cells
Foveolar cells Gastric pit
Muscularis mucosae Submucosa
Tunica muscularis
Serosa
Permukaan laminal lambung dilapisi oleh sel-sel epitel silindris sebaris. Sel-sel epitel silindris melakukan invaginasi ke dalam lamina propria membentuk gastric pit yang berfungsi mensekresikan cairan mukus (mucins) untuk melindungi diri dari asam dan enzim-enzim proteolitik serta mencegah otodigesti mukosa lambung (Swan 2003). Cunningham (2002) menjelaskan bahwa lambung kelenjar terbagi menjadi tiga daerah yaitu kardia mukosa, parietal mukosa, dan pilorus mukosa. Daerah kardia memiliki kelenjar berbentuk tubular pendek, sedangkan pada daerah fundus terdapat susunan kelenjar berbentuk tubular panjang meluas sampai gastric pit. Permukaan epitel lambung secara terus menerus mengalami deskuamasi dan regenerasi pada bagian dasar gastric pit dan bagian leher kelenjar lambung oleh adanya mitosis. Sel baru secara perlahan-lahan terdorong ke atas untuk menggantikan sel-sel yang mati. Bagian fundus terdapat kelenjar yang terdiri atas beberapa tipe sel yaitu stem cell, sel leher mukus, sel parietal, sel chief, dan sel enteroendokrin.
Sel parietal
Menurut Samuelson (2007), sel parietal merupakan sel yang paling besar, memiliki bentuk segitiga dengan inti berbentuk bola dan beberapa diantaranya mengandung dua nuklei. Sitoplasma sel parietal yang banyak terdapat pada bagian
Sel chief
Sel chief atau disebut juga dengan sel zimogen yang memiliki bentuk kuboidal atau piramid. Sitoplasma sel chief bersifat basofilik dengan pewarnaan Hematoksilin Eosin dan memiliki granul-granul sekretori yang berlokasi pada apikal sitoplasma yang mengandung enzim proteolitik inaktif. Sel chief berada pada bagian basal dan jumlahnya lebih banyak dibandingkan dengan sel parietal (Samuelson 2007). Sel chief memiliki lama waktu hidup selama 6 bulan dan membelah sekali dalam sebulan. Sel chief berperan memproduksi enzim terutama enzim pepsin, renin, dan lipase yang berfungsi dalam pencernaan protein dan lemak (Karam 1993).
Gambar 5 Fotografi mikro lambung bagian fundus mencit, sel parietal dan sel chief dengan pewarnaan Hematoksilin Eosin (Conti CJ et al. 2004).
Efek Radiasi
2009). Efek biologis yang terjadi berdasarkan jenis sel yaitu efek genetik dan efek somatik. Efek genetik terjadi pada sel genetik yang akan diturunkan pada keturunan individu yang terpapar, sedangkan efek somatik akan diderita oleh individu yang terpapar radiasi. Efek radiasi ditinjau dari segi dosis radiasi dapat dibedakan berupa efek stokastik dan deterministik. Efek stokastik adalah efek akibat paparan sinar-X yang timbul setelah rentang waktu tertentu tanpa adanya batas ambang dosis sedangkan efek deterministik adalah efek yang langsung terjadi apabila paparan sinar-X melebihi ambang batas dosis dimana tingkat keparahan bergantung pada dosis radiasi yang diterima (Ulum dan Noviana 2008).
Radiasi ionisasi menyebabkan terbentuknya senyawa radikal bebas yang berbahaya bagi tubuh. Sinar-X merupakan salah satu sumber radiasi yang dapat menghasilkan pasangan elektron (ionisasi) pada jaringan. Jaringan tubuh yang umumnya terdiri atas 70% air jika terkena radiasi tersebut menyebabkan terjadinya reaksi ionisasi sehingga terbentuk radikal bebas. Radikal bebas banyak dilaporkan menyebabkan kerusakan pada jaringan. Sinar-X dapat berinteraksi langsung dengan DNA yang dapat menyebabkan beberapa perubahan yang
potensial seperti kerusakan nucleotide, kerusakan rantai DNA, dan hubungan silang antar DNA. Efek kerusakan tersebut dapat menurun dan terjadi pemulihan dengan cepat secara enzimatis atau dapat menyebabkan kematian pada sel (Thrall
2002). Radikal bebas menyebabkan kerusakan hingga kematian sel melalui proses apoptosis atau nekrosis. Keduanya merupakan proses kematian sel yang bersifat irreversible atau tidak dapat kembali pulih menjadi sel aktif yang normal (Haschek dan Rousseaux 1998).
Radiosensitif merupakan istilah untuk kerentanan sel terhadap efek merugikan dari radiasi ionisasi yang dapat diperpanjang ke jaringan, organ-organ dan organisme. Gastrointestinal (GI) adalah salah satu sistem organ yang paling radiosensitif dalam tubuh. Selain pada kripta epitel, paparan radiasi ionisasi juga merusak struktur seperti kelenjar endokrin dari saluran GI. Duodenum merupakan bagian dari sistem GI yang paling radiosensitif, dan selanjutnya yaitu jejunum, ileum, esofagus, lambung, kolon, dan rektum (Hauer-Jensen et al. 2007).
(Alatas dan Lusiyanti 2003). Pemaparan gelombang yang tidak terkendali dari radiasi ionisasi dalam jumlah besar diketahui sebagai penyebab penyakit dan bahkan kematian pada manusia (Swamardika 2009). Efek radiasi dapat mengakibatkan kerusakan pada usus (Grudzinski 2000), leukemia (Alatas dan Lusiyanti 2003; Yoshinaga et al. 2005), kerusakan pada sel darah putih perifer (Rask et al. 2008), dan menyebabkan mutasi, aberasi kromosom, inaktivasi sel serta efek seluler lainnya (Lusiyanti dan Syaifudin 2007). Radiasi akut dosis tunggal sebesar 28.5 Gray (Gy), dapat menyebabkan kematian pada tikus 3 minggu setelah paparan akibat gangguan pada lambung yaitu gastritis erosive dan colitis (Breiter et al. 2009). Radiasi ionisasi juga menyebabkan apoptosis yaitu kematian sel. Proses apoptosis terjadi secara fisiologis akibat proses regenerasi sel, hemostasis jaringan, pertahanan terhadap infeksi virus dan mutasi, dan secara patologis akibat radiasi ionisasi, stres oksidatif, radikal bebas, sinar UV, sitotoksik, dan obat anti-kanker (Kam dan Ferch 2000).
Radiasi ionisasi dapat menyebabkan perubahan pada materi biologis yang terdiri atas tiga fenomena yaitu efek bystander, ketidakstabilan genom, dan respon
radioadaptasi, yang merupakan bagian penting dari respon molekul, sel dan jaringan tubuh terhadap radiasi pengion (Brooks 2005). Respon pada sel yang terpapar oleh radiasi ionisasi secara tidak langsung menunjukkan respon yang
sama dengan sel yang terpapar radiasi ionisasi secara langsung. Efek biologi yang terjadi pada sel yang terpapar radiasi ionisasi secara tidak langsung tetapi berada berdekatan dengan sel yang terkena radiasi ionisasi disebut sebagai efek bystander. Efek tersebut dapat berupa mutasi, kerusakan kromosom, dan transformasi sel pada paparan radiasi dosis rendah (Mothersill dan Seymour 2001; Brooks 2005).
normal menjadi tidak stabil yang merupakan karakteristik dari sel kanker. Ketidakstabilan genom dijumpai pada sel beberapa waktu kemudian setelah paparan radiasi dan termanifestasi pada turunan sel yang terpapar tersebut selama beberapa generasi. Ketidakstabilan dari genom akan menimbulkan berbagai kerusakan seluler meliputi aberasi kromosom, mikronuklei, mutasi, dan amplifikasi gen, transformasi neoplastik, dan kematian reproduktif yang tertunda (Little 1998; Alatas 2005; Brook 2005). Ketidakstabilan genom tersebut memberikan jeda waktu dan kesempatan untuk dapat dilakukan intervensi antara paparan radiasi dan perkembangan ketidakstabilan genom.
Fenomena yang ketiga yaitu perubahan profil ekspresi gen dapat diinduksi oleh paparan radiasi dosis sangat rendah (< 0.5 Gy). Perubahan ini dalam kondisi tertentu, bertujuan untuk melindungi sel terhadap efek yang ditimbulkan oleh paparan radiasi berikutnya dengan dosis yang lebih tinggi. Fenomena proteksi ini dikenal sebagai respon adaptasi atau respon radioadaptasi (Brooks 2005; Coleman 2005). Paparan radiasi dosis rendah diketahui pertama kali dapat memodifikasi tingkat kerusakan dari paparan radiasi berikutnya yang lebih tinggi pada sel
limfosit manusia (Olivieri et al. 1984).
Respon adaptasi atau radioadaptasi merupakan suatu fenomena biologi dimana terjadi resistensi atau ketahanan terhadap radiasi yang diperoleh dengan
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Maret sampai Juli 2011. Proses penggilingan kaliks rosela dilakukan di Pusat Studi Biofarmaka Institut Pertanian
Bogor (IPB) dan proses ekstraksi dilakukan di Balai Penelitian Tanaman Rempah dan Obat (BALITTRO), Cimanggu-Bogor. Proses frezze drying dilakukan di
Laboratorium Bioteknologi, Fakultas Perikanan dan Ilmu Kelautan IPB dan uji fitokimia dilakukan di Laboratorium Pusat Studi Biofarmaka IPB. Kegiatan pemeliharaan hewan coba bertempat di Fasilitas Kandang Hewan Percobaan Bagian Patologi, perlakuan radiasi bertempat di Bagian Bedah dan Radiologi, dan pembuatan preparat histopatologi bertempat di Laboratorium Histopatologi Bagian Patologi, Departemen Klinik, Reproduksi dan Patologi (KRP), Fakultas Kedokteran Hewan (FKH) IPB.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini, yaitu hewan model mencit jantan (Mus musculus) sebanyak 48 ekor strain ddy yang memiliki kisaran umur 6-8 minggu dengan berat badan 18-20 gram. Bahan yang digunakan dalam pemeliharaan mencit pada penelitian ini adalah pakan berupa pelet pakan mencit komersial, air mineral isi ulang untuk minum mencit, obat-obatan pretreatment mencit (anti cacing Prazyquantel® 10 mg/kg BB, antibiotik Clavamox® 25 mg/kg BB dan anti protozoa Metronidazole® 25 mg/kg BB), dan desinfektan sebagai pembersih kandang. Bahan yang digunakan dalam pembuatan ekstrak rosela berupa simplisia kelopak bunga atau kaliks rosela kering lokal (Darmaga-Bogor), etanol 96%, dan akuades. Bahan yang digunakan dalam nekropsi adalah kapas,
alkohol 70%, obat bius Ketamin HCl dan NaCl 0.9%, dan larutan Buffer Neutral Formalin (BNF) 10%. Bahan yang digunakan dalam pembuatan preparat
histopatologi dan pewarnaan Hematoksilin Eosin (HE) adalah sampel lambung mencit, alkohol (70%, 80%, 90%, dan alkohol absolut), xylol, parafin, akuades,
Alat yang dipergunakan selama penelitian ini berlangsung antara lain, yaitu box plastik sebagai kandang dengan ukuran panjang 30 cm, lebar 20 cm, tinggi 15 cm, anyaman jaring kawat penutup kandang, serbuk kayu untuk alas kandang, kain alas, botol minum yang dilengkapi saluran air, tempat pakan, marker, sonde lambung atau stomach tube (1.5 x 80 mm), syringe 1 ml, sarung tangan, masker, sikat, timbangan digital (Precisa 3000 D), kertas label, tissue gulung, gelas ukur 50 ml, dan lemari pendingin. Alat yang digunakan untuk paparan radiasi sinar-X adalah mesin Diagnostic X-Ray (VR-1020, MA Medical Morp, Japan), apron plumbum (Pb), pelindung mata, pelindung tiroid, dan dosimeter pengukur besaran radiasi (MYDOSE miniTM ALOKA CO., LTD Tokyo Japan). Alat nekropsi yang digunakan adalah 1 paket alat bedah (gunting kecil, pinset, dan scalpel), kantung plastik hitam, spidol waterproof permanen untuk penanda, aluminium foil, sterofoam, jarum pentul, dan botol plastik. Pembuatan preparat menggunakan tissue cassete, pensil, Sakura® automatic tissue processor, Paraffin Block Console, mikrotom, pinset anatomis, gelas objek, gelas penutup, dan inkubator. Alat untuk pengamatan yaitu mikroskop cahaya (Olympus® CH-20), Digital Electronic Eyepiece Camera, satu set komputer, perangkat lunak Image Processing and Analysis in Java (Image J®), dan perangkat lunak Statistical Package for Social Sciences (SPSS®)16 for Microsoft® Windows®.
Metode Penelitian
Desain penelitian ini mengacu pada prosedur penelitian yang telah dilakukan oleh Fidan et al. (2008).
Desain penelitian dan hewan coba
Penelitian ini bersifat eksperimental menggunakan hewan coba sebagai model. Hewan coba yang digunakan dalam penelitian ini yaitu 48 ekor mencit jantan yang berumur 6-8 minggu dengan bobot badan 18-20 gram. Mencit berasal dari hasil budidaya laboran di FKH-IPB.
selama 2 minggu. Aklimatisasi mencit dilakukan dengan melalui pemberian anti cacing (Praziquantel®) 10 mg/kg berat badan pada awal aklimatisasi dan di ulang pada hari ke-10, antibiotik (Clavamox®) 25 mg/kg berat badan dan anti protozoa (Metronidazole®) 25 mg/kg berat badan selama lima hari berturut-turut. (Hrapkiewicz dan Medina 2007). Pakan yang diberikan merupakan pakan komersial sebanyak 6 gram/ekor sesuai dengan kebutuhan harian mencit dan air minum diberikan secara ad libitum.
Hewan coba akan dibagi dalam 4 kelompok perlakuan secara acak sebagai berikut:
1. Kelompok Kontrol negatif (K-): Mencit menerima perlakuan peroral 0.2 ml NaCl fisiologis setiap 2 hari sekali tanpa radiasi.
2. Kelompok Kontrol positif (K+): Mencit menerima perlakuan peroral 0.2 ml NaCl fisiologis setiap 2 hari sekali dan paparan radiasi.
3. Kelompok Rosela negatif (R-): Mencit diberi ekstrak rosela dosis 50 mg/kg berat badan secara peroral setiap 2 hari sekali tanpa radiasi.
4. Kelompok Rosela positif (R+): Mencit diberi Ekstrak rosela dosis 50 mg/kg berat badan secara peroral setiap 2 hari sekali dan paparan radiasi.
Tabel 1 Kelompok perlakuan
No Kelompok Perlakuan
Radiasi Ekstrak Rosela NaCl 1 Kontrol negatif (K-) - - + 2 Kontrol positif (K+) + - + 3 Rosela negatif (R-) - + - 4 Rosela positif (R+) + + - Keterangan : - (tanpa), + (dengan)
Radiasi ionisasi dosis rendah pada seluruh tubuh (Total Body Radiation) dilakukan dengan menggunakan mesin Diagnostic X-Ray (VR-1020, MA Medical Morp, Japan) setiap 2 hari sekali dengan dosis radiasi 0.2 mSv. Monitoring dosis paparan dilakukan dengan menggunakan MYDOSE miniTM, ALOKA CO., Ltd
Pembuatan dan Pemberian Ekstrak Rosela
Kaliks rosela yang digunakan berasal dari daerah sekitar kampus IPB Darmaga-Bogor. Kaliks rosela dikeringkan terlebih dahulu menjadi simplisia yang kemudian dihaluskan melalui proses penggilingan yang dilakukan di Pusat Studi Biofarmaka IPB. Proses ekstraksi dilakukan dengan maserasi yaitu dengan perendaman simplisia menggunakan pelarut untuk memperoleh zak aktif dari simplisia tersebut. Sebanyak 200 gram serbuk rosela di ekstrak dengan etanol 96% pada suhu 40°C melalui 2 tahap masing-masing dalam 500 ml pelarut. Proses tersebut dilakukan di Balai Penelitian Tanaman Rempah dan Obat (BALITTRO), Cimanggu-Bogor. Selanjutnya, dilakukan evaporasi dan frezze drying hingga menjadi bentuk kristal yang dilakukan di Laboratorium Bioteknologi, Fakultas Perikanan dan Ilmu Kelautan-IPB. Terakhir, dilakukan uji fitokimia terhadap ekstrak rosela yang dilakukan di laboratorium Pusat Studi Biofarmaka IPB. Sebelum digunakan, ekstrak rosela dilarutkan dalam akuades dengan komposisi 1.5 gram ekstrak dalam 200 ml akuades, sehingga didapatkan konsentrasi 7.5 mg/ml. Dosis yang digunakan adalah 50 mg/kg berat badan
dengan jumlah pemberian ekstrak kaliks rosela pada mencit adalah 0.2 ml (Akindahunsi dan Olelaye 2003; Ali et al. 2005)
Gambar 6 Pencekokkan menggunakan sonde lambung.
Kelompok lainnya yaitu Kontrol negatif (K-) dan Kontrol positif (K+) dilakukan pemberian NaCl fisiologis sebanyak 0.2 ml dengan menggunakan sonde lambung untuk penyeragaman kondisi stress. Pemberian ekstrak rosela dan NaCl fisiologis dilakukan setiap dua hari sebelum diradiasi dengan sinar-X.
Pengambilan lambung mencit
Nekropsi dilakukan pada setiap kelompok secara acak pada minggu ke-4, ke-8 dan ke-12. Mencit sebelumnya dibius dengan ketamin HCl (30 mg/kg BB) secara intra peritoneal(Hrapkiewicz dan Medina 2007). Tahap nekropsi dilakukan dengan menyayat bagian kulit abdomen dan fascia. Rongga abdomen dibuka sampai batas bawah diafragma. Organ yang diambil adalah bagian lambung yang kemudian dilakukan penyayatan di bagian curvatura mayor untuk mengeluarkan isi lambung dan dibilas menggunakan NaCl 0.9%. Lambung mencit kemudian direndam dalam larutan larutan BNF 10% dan disimpan dalam pot plastik selama 2x24 jam untuk dilakukan proses berikutnya.
Gambar 7 Proses nekropsi. A. Prosedur euthanasi mencit, B. Posisi kadaver mencit dorsal rekumbensi dengan fiksasi pada ekstremitas dilakukan menggunakan jarum pentul, C. Sampel organ dalam cawan petri dengan BNF 10%.
Pembuatan preparat histopatologi lambung
Organ lambung yang telah difiksasi kemudian dipotong ukuran 0.5 x 1 cm pada bagian fundus dengan ketebalan 0.5 mm dan dimasukkan ke dalam tissue cassette serta diberi label dengan pensil. Selanjutnya, potongan organ lambung didehidrasi dengan alkohol bertingkat (70 %, 80 %, 90 %, 95 %) masing-masing selama 24 jam dan alkohol absolut (I, II, dan III) masing-masing selama 2 jam. Selanjutnya dilakukan penjernihan (clearing) dalam larutan xylol I, II, III, masing-masing selama 1 jam (Kiernan 1990). Tahap berikutnya adalah infiltrasi parafin
secara otomatis menggunakan mesin Automatic Tissue Processor. Setelah itu dilakukan penanaman jaringan dalam blok parafin (embedding) dengan bantuan Paraffin Block Console (Gambar 8A). Blok jaringan dipotong (sectioning) setebal 5 µm dengan mikrotom. Hasil potongan yang berbentuk pita (ribbon) diletakkan di atas permukaan air hangat (37oC) yang bertujuan untuk menghilangkan lipatan akibat pemotongan. Selanjutnya, potongan tipis jaringan diletakkan pada gelas objek yang telah dilapisi albumin, kemudian diberi label, dan dimasukkan ke dalam inkubator 60oC selama 24 jam (Gambar 8B).
Gambar 8 Proses pembuatan preparat histopatologi lambung. A. Proses penanaman
sampel potongan lambung, B. Ribbon hasil sectioning, C. Proses pewarnaan preparat dengan pewarnaan Hematoksilin-Eosin (HE).
Pewarnaan hematoksilin-eosin (HE)
Proses pewarnaan dilakukan melalui tahapan deparafinasi dan rehidrasi. Deparafinasi dilakukan dengan cara mencelupkan sediaan ke dalam xylol I dan II masing-masing selama 2 menit. Kemudian dilakukan rehidrasi dengan cara mencelupkan ke dalam alkohol absolut II, dan I, alkohol 95 %, 90 %, 80 %, dan
70 % masing-masing selama 2 menit. Selanjutnya sediaan dicuci dengan air kran mengalir dan dikeringkan. Sediaan yang sudah kering ditetesi Mayer’s hematoksilin dan di diamkan selama 8 menit kemudian dibilas dengan air mengalir dan dicuci dengan litium karbonat selama 15-30 detik, dibilas kembali dengan air mengalir dan dilanjutkan dengan pemberian eosin selama 2 menit. Sediaan yang telah terwarnai dimasukan ke dalam alkohol 90 % dan alkohol absolut I masing-masing sebanyak 10 kali celupan, alkohol absolut II selama 2 menit, xylol I selama 1 menit dan xylol II selama 2 menit dan dikeringkan.
Sediaan yang telah kering ditetesi dengan perekat entelan secukupnya kemudian ditutup dengan gelas penutup (cover glass) (Humason 1985; Kiernan 1990).
Pengamatan preparat histopatologi
Pengamatan dilakukan secara kualitatif dan kuantitatifterhadap sel-sel pada organ lambung dengan menggunakan mikroskop cahaya (Gambar 9A). Pengamatan secara kualitatif dilakukan pada preparat lambung secara keseluruhan untuk melihat perubahan secara umum yang terjadi pada organ lambung mulai lapis mukosa sampai serosa menggunakan perbesaran 100x (10x okuler, 10x objektif). Pengamatan secara kuantitatif dilakukan penghitungan terhadap jumlah sel parietal, sel chief dan sel radang pada preparat lambung. Penghitungan sel-sel tersebut dilakukan dengan cara pengambilan foto 10 lapang pandang preparat lambung dengan menggunakan Digital Electronic Eyepiece Camera MD-130® (Gambar 9B) pada perbesaran 400x (10x okuler, 40x objektif), kemudian dilakukan penghitungan sel parietal, sel chief dan sel radang dengan menggunakan perangkat lunak Image Processing and Analysis in Java (Image J®) for Microsoft® Windows® (Gambar 9C).
Gambar 9 Perangkat elektronik untuk pengambilan fotografi mikro lambung mencit. A. Mikroskop dan unit komputer untuk pengambilan foto, B. Digital Electronic
Eyepiece Camera MD-130®, C. Software NIH image J® for Microsoft®
Windows®.
B A
Analisis dan Penyajian Data
HASIL DAN PEMBAHASAN
Uji Fitokimia Ekstrak Rosela (Hibiscus sabdariffa L.)
Analisis fitokimia ekstrak rosela (Hibiscus sabdariffa L.) dilakukan secara kualitatif sesuai dengan prosedur standar di Laboratorium Uji Biofarmaka LPPM-IPB (No. Sertifikat: 008/I3.11.8/LUB-CA/XI/2010). Analisis kualitatif dapat mengetahui kandungan beberapa senyawa fitokimia seperti alkaloid, flavonoid, tannin, saponin, steroid, terpenoid, phenol, dan glikosida. Hasil analisis fitokimia ekstrak rosela dapat dilihat pada Tabel 2.
Tabel 2 Uji fitokimia ekstrak Rosela (Hibiscus sabdariffa L.)
No Parameter Uji Hasil Teknik Analisis
1 Alkaloid Uji Wagner + Kualitatif
Alkaloid Uji Meyer + Kualitatif
Alkaloid Uji Dragendorf + Kualitatif
2 Hidroquinon - Kualitatif
3 Tanin + Kualitatif
4 Flavonoid + Kualitatif
5 Saponin + Kualitatif
6 Steroid - Kualitatif
7 Triterpenoid - Kualitatif
Keterangan: + (ditemukan dan mengandung), - (tidak ditemukan dan tidak mengandung)
Pemeriksaan tanaman yang berkhasiat untuk pengobatan telah dilakukan oleh sejumlah ahli dengan menggunakan analisis awal fitokimia. Analisis fitokimia penting dilakukan untuk mengidentifikasi senyawa yang memiliki nilai
antioksidan yang dapat melawan radikal bebas. Selain sebagai antioksidan, flavonoid juga memiliki khasiat anti-viral, anti peradangan, penanganan hipertensi, diabetes, reumatik, dan demam (Mungole dan Chaturvendi 2011).
Bahan pelarut seperti metanol, etanol, aseton, etil asetat, dan kombinasi antar pelarut tersebut sering digunakan untuk ekstraksi fenol dari tanaman. Pemilihan bahan pelarut mempengaruhi jumlah senyawa polifenol yang terekstraksi. Metanol merupakan bahan pelarut yang lebih tepat digunakan dalam ekstraksi senyawa polifenol yang memiliki bobot molekul rendah. Etanol juga merupakan bahan pelarut yang baik untuk ekstraksi polifenol dan aman dikonsumsi manusia. Proses ekstraksi senyawa antosianin dan phenol dari tanaman umumnya menggunakan bahan pelarut metanol dan etanol. Pelarut tersebut bekerja dengan mendenaturasi membran sel yang secara bersamaan melepas antosianin dan menstabilkannya. Metanol memiliki sifat toksik yang tinggi, sehingga pelarut etanol lebih sering digunakan (Shi et al. 2005).
Total Dosis Radiasi Ionisasi dari Sinar-X
Total dosis radiasi ionisasi didapatkan dengan cara menghitung jumlah akumulasi dosis radiasi dari mesin Sinar-X yang di ukur menggunakan dosimeter selama perlakuan radiasi. Radiasi selama 4 minggu menghasilkan total dosis
radiasi 2.9 mSv, sedangkan radiasi selama 8 minggu menghasilkan total dosis radiasi 5.3 mSv. Masa pemulihan (recovery) merupakan waktu dimana mencit tidak mendapat perlakuan apapun, baik pencekokan maupun paparan radiasi. Masa pemulihan dilakukan selama dua kali yaitu setelah waktu perlakuan radiasi mencapai 4 minggu yang disebut dengan pemulihan I atau 2.9 Recov dan masa pemulihan setelah waktu perlakuan radiasi mencapai 8 minggu yang disebut dengan pemulihan II atau 5.3 Recov.
Gambaran Histopatologi Lambung Mencit
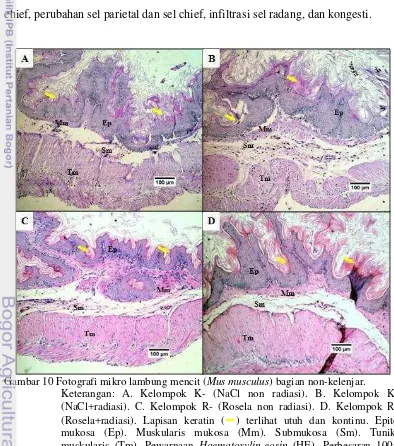
lapisan keratin yang utuh dan kontinu. Lapisan keratin mampu bertahan terhadap paparan radiasi (Gambar 10). Menurut Haschek dan Rousseaux (1998), paparan radiasi pada seluruh tubuh (whole body radiation) akan menimbulkan efek pada sel yang aktif membelah.
Bagian lambung kelenjar secara kualitatif tidak menunjukkan adanya perubahan secara umum mulai dari lapisan paling bawah yaitu serosa, tunika muskularis, submukosa, muskularis mukosa, dan mukosa. Selanjutnya dilakukan pengamatan secara kuantitatif pada lapis mukosa lambung kelenjar. Hasil pengamatan secara kuantitatif pada lapis mukosa lambung kelenjar menunjukkan adanya perubahan. Perubahan yang terjadi yaitu perbedaan jumlah sel parietal dan chief, perubahan sel parietal dan sel chief, infiltrasi sel radang, dan kongesti.
Gambar 10 Fotografi mikro lambung mencit (Mus musculus) bagian non-kelenjar.
Sel parietal
Pengamatan terhadap sel parietal dilakukan dengan menghitung jumlah sel parietal normal, sel parietal degenerasi, dan sel parietal nekrosis. Pengambilan data dilakukan pada dosis 2.9 mSv, 5.3 mSv, dan pada masa pemulihan (Recovery) setelah dosis radiasi 2.9 mSv (Pemulihan I atau 2.9 Recov) dan setelah pemberian dosis radiasi 5.3 mSv (Pemulihan II atau 5.3 Recov).
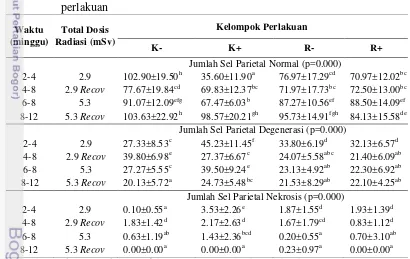
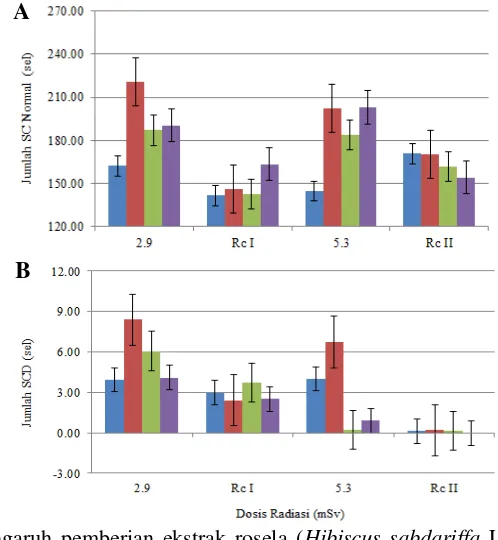
Hasil uji statistik ANOVA dan uji lanjut Duncan terhadap jumlah sel parietal dapat dilihat pada Tabel 3. Hasil uji menunjukkan bahwa terdapat perbedaan yang signifikan dari jumlah sel parietal baik pada sel parietal yang normal, sel degenerasi, dan nekrosis antar kelompok perlakuan dan pemberian dosis radiasi (p<0.05). Jumlah sel parietal normal paling rendah ditunjukkan oleh K+ pada pemberian dosis radiasi 2.9 mSv, sedangkan K- merupakan yang paling tinggi dan R- dan R+ berada pada nilai yang hampir sama. Masa pemulihan I yaitu setelah pemberian dosis radiasi 2.9 mSv, kelompok K+ dan R+ mengalami peningkatan jumlah sel parietal sedangkan kelompok K-, dan R- mengalami penurunan. Pemberian dosis radiasi yang dilanjutkan hingga 5.3 mSv
menyebabkan peningkatan jumlah sel parietal normal dan penurunan jumlah sel parietal degenerasi dan sel parietal nekrosis pada K+ dan R+. Masa pemulihan II yaitu setelah pemberian dosis radiasi 5.3 mSv terjadi peningkatan pada kelompok
K+, sedangkan R+ mengalami penurunan dari jumlah sebelumnya pada dosis 5.3 mSv (Gambar 11A).
degenerasi yang signifikan pada kelompok K+ dan K-, sedangkan R- dan R+ mengalami penurunan yang tidak signifikan (Gambar 11B).
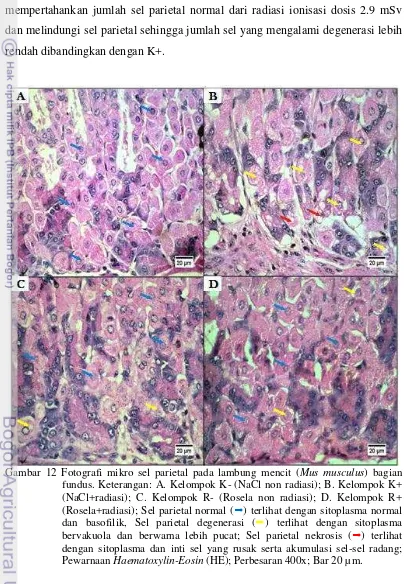
Perubahan lain yang terjadi pada sel parietal yaitu nekrosis. Tabel 2 menunjukkan jumlah sel parietal nekrosis tertinggi pada pemberian dosis radiasi ditunjukkan oleh K+, sedangkan R- dan R+ berada pada kisaran jumlah yang sama. Setelah masa pemulihan I, terjadi penurunan jumlah sel parietal nekrosis pada K+. Paparan radiasi yang dilanjutkan hingga mencapai 5.3 mSv menunjukkan adanya penurunan pada K+, R-, dan R+. Setelah masa pemulihan II yaitu setelah pemberian dosis radiasi 5.3 mSv, jumlah sel parietal nekrosis setiap kelompok menurun kecuali pada R- (Gambar 11C). Perubahan berupa nekrosis pada sel parietal yang ditunjukkan oleh Gambar 12B.
Tabel 3 Pengaruh pemberian ekstrak rosela (Hibiscus sabdariffa L.) selama radiasi ionisasi terhadap jumlah rataan sel parietal pada kelompok perlakuan
Data ditampilkan secara kuantitatif dalam rataan ± standar deviasi dan dengan satuan sel; Huruf superscript yang berbeda menunjukkan adanya perbedaan yang signifikan (p<0.05);
K-=NaCl fisiologis tanpa radiasi ionisasi; K+=NaCl fisiologis dengan radiasi ionisasi; R-=ekstrak rosela tanpa radiasi ionisasi; R+=ekstrak rosela dengan radiasi ionisasi; mSv=dosis radiasi ionisasi dalam mili Sievert; 2.9 Recov=pemulihan I setelah pemberian dosis radisi 2.9 mSv; 5.3
Recov=pemulihan II setelah pemberian dosis radiasi 5.3 mSv.
Waktu (minggu) Total Dosis Radiasi (mSv) Kelompok Perlakuan
K- K+ R- R+
Jumlah Sel Parietal Normal (p=0.000)
2-4 2.9 102.90±19.50h 35.60±11.90a 76.97±17.29cd 70.97±12.02bc 4-8 2.9 Recov 77.67±19.84cd 69.83±12.37bc 71.97±17.73bc 72.50±13.00bc 6-8 5.3 91.07±12.09efg 67.47±6.03b 87.27±10.56ef 88.50±14.09ef 8-12 5.3 Recov 103.63±22.92h 98.57±20.21gh 95.73±14.91fgh 84.13±15.58de
Jumlah Sel Parietal Degenerasi (p=0.000)
2-4 2.9 27.33±8.53c 45.23±11.45f 33.80±6.19d 32.13±6.57d 4-8 2.9 Recov 39.80±6.98e 27.37±6.67c 24.07±5.58abc 21.40±6.09ab 6-8 5.3 27.27±5.55c 39.50±9.24e 23.13±4.92ab 22.30±6.92ab 8-12 5.3 Recov 20.13±5.72a 24.73±5.48bc 21.53±8.29ab 22.10±4.25ab
Jumlah Sel Parietal Nekrosis (p=0.000)
[image:31.595.102.512.354.613.2]Gambar 11 Pengaruh pemberian ekstrak rosela (Hibiscus sabdariffa L.) selama radiasi ionisasi terhadap jumlah rataan sel parietal pada kelompok perlakuan.
Keterangan: A. Sel parietal normal. B. Sel parietal degenerasi. C. Sel parietal nekrosis. K- (NaCl non radiasi); K+ (NaCl+radiasi); R- (Ekstrak rosela non radiasi); R+ (Ekstrak rosela+radiasi); Rc I (recovery atau pemulihan setelah pemberian radiasi 2.9 mSv); Rc II (recovery atau pemulihan setelah pemberian radiasi 5.3 mSv); mSv (mili Sievert).
Pemberian dosis radiasi 2.9 mSv menyebabkan jumlah sel parietal normal yang rendah pada K+ dibandingkan K-. Jumlah tersebut disebabkan oleh banyaknya sel parietal yang mengalami perubahan berupa degenerasi hidropis. Degenerasi hidropis merupakan respon sel terhadap gangguan endogen salah satunya akibat radikal bebas dan eksogen yang dalam hal ini adalah akibat radiasi
ionisasi sinar-X. Menurut Haschek dan Rousseaux (1998), degenerasi hidropis ditandai dengan perubahan pada sel berupa pembengkakan dan perubahan warna sitoplasma menjadi lebih pucat, serta sitoplasma yang bervakuola mulai dari ukuran kecil hingga besar. Perubahan tersebut merupakan tahapan awal dari proses nekrosis yang disebut onkosis (Gambar 12 B,C,D). Faktor lain terjadinya onkosis dapat disebabkan oleh menurunnya jumlah sel darah merah dalam tubuh
A
B
[image:32.595.160.435.77.428.2]yang menyebabkan penurunan asupan oksigen dilanjutkan dengan penurunan oxidative phosphorylation dan penurunan jumlah ATP (Haschek dan Rousseaux 1998). Jumlah sel parietal degenerasi yang tinggi berkorelasi dengan tingginya jumlah sel parietal nekrosis pada K+. Pemberian ekstrak rosela pada R+ mampu mempertahankan jumlah sel parietal normal dari radiasi ionisasi dosis 2.9 mSv dan melindungi sel parietal sehingga jumlah sel yang mengalami degenerasi lebih rendah dibandingkan dengan K+.
Gambar 12 Fotografi mikro sel parietal pada lambung mencit (Mus musculus) bagian fundus. Keterangan: A. Kelompok K- (NaCl non radiasi); B. Kelompok K+ (NaCl+radiasi); C. Kelompok R- (Rosela non radiasi); D. Kelompok R+ (Rosela+radiasi); Sel parietalnormal () terlihat dengan sitoplasma normal dan basofilik, Sel parietal degenerasi () terlihat dengan sitoplasma bervakuola dan berwarna lebih pucat; Sel parietal nekrosis () terlihat dengan sitoplasma dan inti sel yang rusak serta akumulasi sel-sel radang;
[image:33.595.108.512.165.749.2]Pemberian dosis radiasi hingga 5.3 mSv menyebabkan peningkatan sel parietal normal dan penurunan sel parietal degenerasi dan nekrosis pada K+ dan R+. Peningkatan sel parietal normal dan penurunan jumlah sel parietal degenerasi dan nekrosis pada K+ dapat disebabkan oleh adanya respon adaptasi sel terhadap radiasi. Hasil ini memperkuat simpulan Okazaki et al. (2005) dimana paparan radiasi adaptasi dapat merubah efektivitas biologis terhadap paparan radiasi berikutnya dengan dosis yang lebih besar. Peningkatan sel parietal normal dan jumlah sel parietal degenerasi dan sel parietal nekrosis yang lebih rendah pada R+ dibandingkan K+ disebabkan oleh adanya aktivitas antioksidan dalam ekstrak rosela. Antioksidan yang terkandung dalam rosela yaitu flavonoid yang ditunjukkan oleh hasil uji fitokimia yang dilakukan terhadap ekstrak rosela yang digunakan (Tabel 2).
Peningkatan jumlah sel parietal normal dan penurunan jumlah sel parietal degenerasi dan sel parietal nekrosis setelah masa pemulihan I dan II pada K+ disebabkan oleh faktor perlakuan yang dihilangkan. Hal yang sama juga ditunjukan oleh R+ dan juga disebabkan oleh pengaruh pemberian ekstrak rosela
yang mengandung flavonoid.
Sel chief
Pengamatan terhadap sel Chief dilakukan dengan menghitung jumlah sel chief normal dan sel chief degenerasi. Hasil uji statistik ANOVA dan uji lanjut Duncan terhadap jumlah sel chief dan perubahan patologisnya pada mukosa lambung diperoleh hasil perbedaan yang signifikan antar kelompok perlakuan dan pemberian dosis radiasi (p<0.05). Hasil uji statistik ANOVA dan uji Duncan dapat dilihat pada Tabel 4, grafik jumlah sel chief normal dan sel chief degenerasi pada Gambar 13 dan gambaran histopatologi sebaran sel chief dapat di lihat pada Gambar 14.
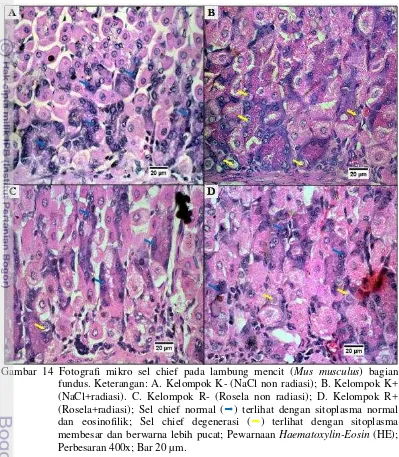
pemberian dosis radiasi 2.9 mSv, terjadi penurunan pada semua kelompok perlakuan dengan jumlah paling rendah ditunjukkan oleh K-. Setelah pemberian radiasi mencapai dosis 5.3 mSv, terjadi peningkatan jumlah sel chief pada kelompok R+, sedangkan penurunan terjadi pada kelompok K+, K-, dan R-. Setelah masa pemulihan II yaitu setelah pemberian dosis radiasi 5.3 mSv, terjadi penurunan jumlah pada kelompok K+, R- dan R+, sedangkan peningkatan terjadi pada K- yang jumlahnya sama dengan K+ (Gambar 13A).
Perubahan patologis yang terjadi pada sel chiefyaitu terjadi degenerasi yang ditunjukkan oleh Gambar 14 B,C,D. Tabel 4 juga menunjukkan adanya perbedaan yang nyata dari jumlah sel chief degenerasi antara semua kelompok perlakuan. Jumlah sel chief degenerasi tertinggi terjadi pada kelompok K+ dengan pemberian dosis radiasi 2.9 mSv, kemudian dilanjutkan secara berurutan ke yang paling rendah mulai dari R-, R+, dan K-. Masa pemulihan I terjadi penurunan jumlah sel chief degenerasi pada semua kelompok perlakuan. Setelah pemberian radiasi dilanjutkan hingga mencapai 5.3 mSv, terjadi penurunan jumlah sel chief degenerasi dari dosis sebelumnya pada K+. Penurunan tersebut juga terjadi pada
kelompok R- dan R+. Setelah masa pemulihan II semua kelompok perlakuan mengalami penurunan jumlah sel chief degenerasi (Gambar 13B).
Tabel 4 Pengaruh pemberian ekstrak rosela (Hibiscus sabdariffa L.) selama radiasi ionisasi terhadap jumlah rataan sel chief pada kelompok perlakuan Waktu (minggu) Total Dosis Radiasi (mSv) Kelompok Perlakuan
K- K+ R- R+
Jumlah Sel Chief normal (p=0.000)
2-4 2.9 162.23±36.40bc 220.63±32.08g 187.10±39.86ef 190.50±33.23ef 4-8 2.9 Recov 141.73±21.77a 146.23±23.26a 142.63±25.09a 163.50±36.62bc 6-8 5.3 143.07±14.00a 201.37±18.07f 183.93±13.44de 202.97±13.06f 8-12 5.3 Recov 170.87±19.90cd 170.20±27.81cd 161.60±21.50bc 154.07±15.92ab
Jumlah Sel Chief Degenerasi (p=0.000)
2-4 2.9 3.93±2.36c 8.40±2.54e 6.07±3.34d 4.10±2.75c 4-8 2.9 Recov 2.97±3.18bc 2.40±2.33b 3.73±2.15c 2.50±2.35b 6-8 5.3 4.00±2.46c 6.73±3.93d 0.23±0.77a 0.90±1.75a 8-12 5.3 Recov 0.13±0.73a 0.20±0.55a 0.13±0.73a 0.00±0.00a Data ditampilkan secara kuantitatif dalam rataan ± standar deviasi dan dengan satuan sel; Huruf superscript yang berbeda menunjukkan adanya perbedaan yang signifikan (p<0.05); K-=NaCl fisiologis tanpa radiasi; K+=NaCl fisiologis dengan radiasi; R-=ekstrak rosela tanpa radiasi; R+=ekstrak rosela dengan radiasi; mSv=dosis radiasi ionisasi dalam mili Sievert; 2.9
Gambar 13 Pengaruh pemberian ekstrak rosela (Hibiscus sabdariffa L.) selama radiasi ionisasi terhadap jumlah rataan sel chief pada kelompok perlakuan.
Keterangan: A. Sel chief normal. B. Sel chief degenerasi. K- (NaCl non radiasi); K+ (NaCl+radiasi); R- (Ekstrak rosela non radiasi); R+ (Ekstrak rosela+radiasi); Rc I (recovery atau pemulihan setelah pemberian radiasi 2.9 mSv); Rc II (recovery atau pemulihan setelah pemberian radiasi 5.3 mSv); mSv (mili Sievert).
Jumlah sel chief normal K+ yang tinggi berbanding terbalik dengan jumlah sel parietal yang rendah pada pemberian dosis radiasi 2.9 mSv. Menurut Jain et al. (2008), jumlah yang rendah dari sel parietal atau mengalami penurunan fungsi menyebabkan penurunan jumlah sel chief, sedangkan hasil yang berbeda ditunjukkan oleh hasil penelitian ini. Menurut Man et al. (1988) radiasi pada lambung mencit menyebabkan penurunan jumlah sekresi histamin oleh enterocromaffin-like cells (sel ECL). Histamin yang menurun tersebut
menyebabkan terjadinya peningkatan jumlah sel chief pada bagian leher hingga bagian basal lambung kelenjar (Bockman et al. 1995). Jumlah sel chief sangat tinggi dan sel parietal yang sangat rendah menyebabkan ketidakseimbangan antara jumlah senyawa yang disekresikan. Jumlah sel chief yang tinggi akan menyebabkan meningkatnya jumlah sekresi pepsin. Ketidakseimbangan ini akan menyebabkan terjadinya gangguan pencernaan pada lambung karena jumlah asam lambung atau HCl yang dihasilkan sedikit. Kelompok R+ pada pemberian dosis
[image:36.595.184.433.84.354.2]radiasi yang sama menunjukkan jumlah sel chief normal yang lebih rendah dibandingkan K+. Hal ini dapat disebabkan oleh pengaruh pemberian ekstrak rosela yang mampu mengontrol jumlah sel chief.
Gambar 14 Fotografi mikro sel chief pada lambung mencit (Mus musculus) bagian fundus. Keterangan: A. Kelompok K- (NaCl non radiasi); B. Kelompok K+ (NaCl+radiasi). C. Kelompok R- (Rosela non radiasi); D. Kelompok R+ (Rosela+radiasi); Sel chief normal () terlihat dengan sitoplasma normal dan eosinofilik; Sel chief degenerasi () terlihat dengan sitoplasma
membesar dan berwarna lebih pucat; Pewarnaan Haematoxylin-Eosin (HE);
Perbesaran 400x; Bar 20 µm.
[image:37.595.112.511.165.622.2]jumlah HCl yang dihasilkan sedikit sehingga aktivitas pencernaan di lambung tidak optimal. Kandungan senyawa antioksidan flavonoid yang terdapat dalam ekstrak rosela mampu mempertahankan jumlah sel parietal tetap terjaga akibat radiasi ionisasi sehingga keasaman lambung dapat terjaga dan pencernaan tetap berjalan optimal. Hal ini dibuktikan dengan adanya perlindungan terhadap jumlah sel parietal pada kelompok mencit yang diberikan ekstrak rosela atau R+ (Tabel 3 dan Gambar 12).
Sel radang
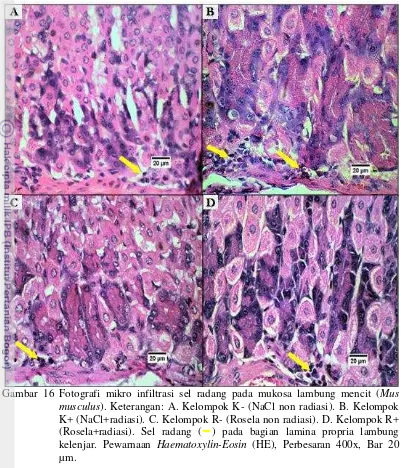
Selain jumlah sel parietal dan sel chief, parameter yang diamati adalah jumlah sel radang pada lapisan mukosa lambung. Hasil uji statistik ANOVA dan uji lanjut Duncan terhadap jumlah sel radang pada mukosa lambung diperoleh hasil perbedaan yang signifikan dari jumlah infiltrasi sel radang antar kelompok perlakuan dan pemberian dosis radiasi (p<0.05). Hasil uji statistik ANOVA dan uji Duncan dapat dilihat pada Tabel 5, grafik infiltrasi sel radang dan kongesti pada Gambar 15 dan gambaran histopatologi sebaran sel radang dapat dilihat pada
Gambar 16.
Tabel 5 Pengaruh pemberian ekstrak rosela (Hibiscus sabdariffa L.) selama pemberian radiasi ionisasi terhadap jumlah rataan sel radang dan kongesti pada kelompok perlakuan
Data ditampilkan secara kuantitatif dalam rataan ± standar deviasi dan dengan satuan sel; Huruf superscript yang berbeda menunjukkan adanya perbedaan yang signifikan (p<0.05);
K-=NaCl fisiologis tanpa radiasi ionisasi; K+=NaCl fisiologis dengan radiasi ionisasi; R-=ekstrak roselatanpa radiasi ionisasi; R+=ekstrak roseladengan radiasi ionisasi; mSv=dosis radiasi ionisasi dalam mili Sievert; 2.9 Recov=pemulihan I setelah pemberian dosis radisi 2.9 mSv; 5.3
Recov=pemulihan II setelah pemberian dosis radiasi 5.3 mSv.
Waktu (minggu)
Total Dosis Radiasi (mSv)
Kelompok Perlakuan
K- K+ R- R+
Jumlah Sel Radang (p=0.000)
2-4 2.9 7.43±8.87a 26.17±12.37c 13.23±7.46b 14.43±6.71b 4-8 2.9 Recov 14.17±6.05b 23.33±11.37c 12.60±6.65b 12.87±9.07b 6-8 5.3 12.80±7.17b 22.63±14.19c 5.93±5.63a 7.30±7.03a 8-12 5.3 Recov 10.07±10.99ab 7.03±5.03a 7.37±6.39a 5.37±6.18a
Jumlah Kongesti (p=0.236)
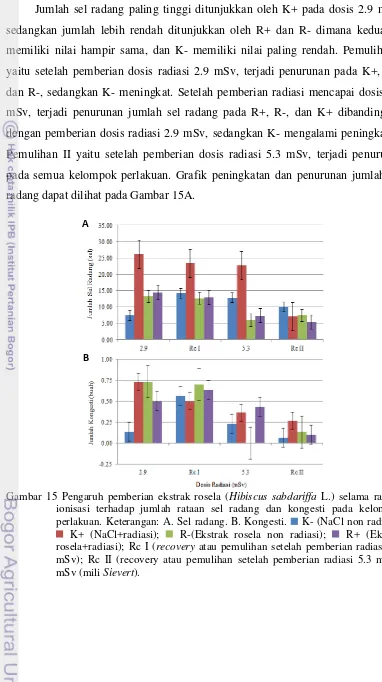
Jumlah sel radang paling tinggi ditunjukkan oleh K+ pada dosis 2.9 mSv, sedangkan jumlah lebih rendah ditunjukkan oleh R+ dan R- dimana keduanya memiliki nilai hampir sama, dan K- memiliki nilai paling rendah. Pemulihan I yaitu setelah pemberian dosis radiasi 2.9 mSv, terjadi penurunan pada K+, R+, dan R-, sedangkan K- meningkat. Setelah pemberian radiasi mencapai dosis 5.3 mSv, terjadi penurunan jumlah sel radang pada R+, R-, dan K+ dibandingkan dengan pemberian dosis radiasi 2.9 mSv, sedangkan K- mengalami peningkatan. Pemulihan II yaitu setelah pemberian dosis radiasi 5.3 mSv, terjadi penurunan pada semua kelompok perlakuan. Grafik peningkatan dan penurunan jumlah sel radang dapat dilihat pada Gambar 15A.
Gambar 15 Pengaruh pemberian ekstrak rosela (Hibiscus sabdariffa L.) selama radiasi ionisasi terhadap jumlah rataan sel radang dan kongesti pada kelompok
perlakuan.Keterangan: A. Sel radang. B. Kongesti. K- (NaCl non radiasi);
K+ (NaCl+radiasi); R-(Ekstrak rosela non radiasi); R+ (Ekstrak rosela+radiasi); Rc I (recovery atau pemulihan setelah pemberian radiasi 2.9 mSv); Rc II (recovery atau pemulihan setelah pemberian radiasi 5.3 mSv); mSv (mili Sievert).
A
[image:39.595.107.489.83.765.2]Gambar 16 Fotografi mikro infiltrasi sel radang pada mukosa lambung mencit (Mus
musculus). Keterangan: A. Kelompok K- (NaCl non radiasi). B. Kelompok
K+ (NaCl+radiasi). C. Kelompok R- (Rosela non radiasi). D. Kelompok R+ (Rosela+radiasi). Sel radang () pada bagian lamina propria lambung kelenjar. Pewarnaan Haematoxylin-Eosin (HE), Perbesaran 400x, Bar 20 µm.
Jumlah sel radang yang tinggi pada K+ disebabkan oleh tingginya jumlah
[image:40.595.111.512.84.552.2]menuju lapisan mukosa akibat sinyal yang dihasilkan oleh sel yang mengalami nekrosis. Kandungan senyawa saponin dan tanin yang umumnya terdapat pada tanaman memiliki sifat anti radang (Lai et al. 2010). Selain itu hasil penelitian ini menyerupai penelitian yang dilakukan oleh Fakaye (2008), dimana ekstrak rosela memiliki efek sebagai immunomodulator.
Kongesti
Berdasarkan hasil pengamatan menunjukkan bahwa terdapat kongesti pada masing-masing kelompok perlakuan dan dosis radiasi. Kongesti terlihat pada bagian lamina propria dari lambung mencit. Tabel 5 menunjukkan bahwa tidak terdapat perbedaan yang nyata (p>0.05) dari jumlah kongesti antar kelompok perlakuan dan pemberian dosis radasi. Pemberian dosis radiasi 2.9 mSv menunjukkan terjadinya kongesti pada K+ lebih tinggi dibandingkan R+, sedangkan setelah masa pemulihan I K+ mengalami penurunan. Pemberian dosis radiasi dilanjutkan hingga mencapai dosis 5.3 mSv menunjukkan masih terjadi kongesti pada K+ dan R+, sedangkan setelah masa pemulihan II keduanya
mengalami penurunan (Gambar 15B).
Kongesti merupakan keadaan dimana terjadi akumulasi butir-butir darah di dalam pembuluh darah pada daerah tertentu. Akumulasi tersebut dapat
Mekanisme Kerusakan Sel oleh Radikal Ionisasi
Faktor yang membedakan terjadinya proses apoptosis atau nekrosis pada sel akibat radikal bebas maupun paparan radiasi ionisasi adalah jumlah radikal bebas yang terbentuk dan lama waktu paparan radiasi. Jumlah radikal bebas dalam level yang rendah atau paparan radiasi ionisasi dalam waktu yang relatif singkat cenderung menimbulkan apoptosis dibandingkan nekrosis, sedangkan radikal bebas dalam level yang tinggi atau paparan radiasi ionisasi dalam waktu yang relatif lama cenderung menimbulkan neksosis (Kass et al. 2000). Perlakuan radiasi yang diberikan pada penelitian ini termasuk dalam paparan radiasi ionisasi dengan jangka waktu yang relatif lama dan cenderung menimbulkan terbentuknya senyawa radikal bebas yang tinggi, sehingga kelainan yang ditimbulkan berupa degenerasi dan nekrosis pada sel parietal dan degenerasi pada sel chief.
Nekrosis merupakan kondisi dimana sel mengalami kematian dan bersifat irreversible atau tidak dapat kembali menjadi sel normal. Umumnya sel mengalami beberapa perubahan sebelum terjadi nekrosis. Tahapan awal nekrosis yaitu terjadi pembengkakan pada sel tersebut dimana sitoplasma menjadi lebih
eosinofilik akibat pengikatan eosin yang berkaitan dengan denaturasi protein. Tahap selanjutnya yaitu kemunculan vakuola atau lubang pada sitoplasma. Ukuran vakuola bervariasi mulai dari yang kecil sampai besar dan begitu juga
dengan jumlahnya. Tahapan tersebut merupakan tahapan awal sebelum sel mengalami kematian atau disebut juga dengan istilah onkosis. Berbeda dengan apoptosis, kejadian nekrosis umumnya disertai dengan infiltrasi sel-sel radang. (Haschek dan Rousseaux 1998).
Gambar 17 Interaksi antara jumlah radikal bebas pada sel (Kass et al. 2000).
Transisi permeabilitas mitokondria dan pelepasan cytochrome c menjadi pembahasan bagaimana radikal bebas dapat menyebabkan kematian sel. Hasil penelitian ini menunjukkan bahwa sel parietal dan sel chiefmengalami perubahan akibat radiasi ionisasi dan menjelaskan bahwa radikal bebas yang terbetuk mengakibatkan terjadinya proses nekrosis. Hal ini memperkuat hasil sebelumnya terkait mekanisme transisi permeabilitas mitokondria yang dapat menyebabkan pembengkakan pada sel yang terjadi dengan cepat dan hebat sehingga sel kehilangan energi secara menyeluruh. Perubahan tersebut cenderung mengarah pada proses nekrosis dibandingkan apoptosis (Kass 1992). Radikal bebas dalam
level yang tinggi pada sel atau akibat stres oksidatif yang menyebabkan nekrosis, tidak menimbulkan proses aktivasi caspase sehingga tidak terjadi apoptosis (Gambar 17). Hasil penelitian ini juga memperkuat hasil tersebut dimana tidak ditemukan sel parietal dan chiefyang mengalami apoptosis.
Radioprotektif Herbal Rosela
glutathione, ascorbic acid, dan α-tokoferol (Halliwell 1995). Antioksidan bekerja pada sel dengan cara melindungi sel dari reactive oxygen species (ROS) atau reactive nitrogen species (RNS) yang secara alami terdapat dalam sistem biologis melalui mekanisme direct scavenging. Antioksidan menunda proses oksidasi biomolekul dengan cara menghambat inisiasi dan propagasi dari rantai oksidasi yang bertentangan dengan proses inisiasi apoptosis (Shimoi et al. 1996).
Antioksidan yang terkandung dalam ekstrak rosela yaitu flavonoid yang mampu mencegah kerusakan yang diakibatkan oleh radiasi ionisasi berupa radikal bebas melalui berbagai cara dan salah satunya dengan direct scavenging. Mekanisme kerja dari antioksidan flavonoid yaitu dengan cara teroksidasi oleh radikal sehingga menghasilkan senyawa radikal yang lebih stabil dan menjadi kurang reaktif. Akibat reaktivitas yang tinggi kelompok hidroksil dari flavonoid,
senyawa radikal bebas dirubah menjadi tidak aktif. (Korkina dan Afanas’ev
1997).
Gambar 18 Mekanisme radioproteksi dari tanaman herbal terhadap radiasi ionisasi (Shimoi et al. 1996).
Meningkatnya produksi ROS dan RNS selama radiasi ionisasi mengakibatkan pemakaian yang tinggi dan dapat menyebabkan pengurangan senyawa antioksidan endogen. Flavonoid yang terkandung dalam ekstrak rosela selain bekerja langsung sebagai direct scavenging juga memiliki kemampuan
ditunjukkan oleh kelompok mencit yang diberikan ekstrak rosela dan radiasi (R+) pada masa pemulihan dimana terjadi penurunan jumlah sel parietal nekrosis dan sel chief degenerasi yang diduga akibat peningkatan antioksidan endogen. Mekanisme kerja antioksidan pada tanaman dapat ditunjukkan oleh Gambar 18.
Penggunaan tanaman dengan memanfaatkan unsur bioaktif seperti aktivitas antioksidan sangat baik untuk meringankan kerusakan akibat radiasi. Antioksidan yang berasal dari tanaman terbukti efektif dalam mengatasi kelainan pada sel parietal dan sel chief selama proses radiasi. Hasil keseluruhan dari penelitian ini menunjukkan bahwa tanaman rosela (Hibiscus sabdariffa L.) merupakan salah satu sumber antioksidan alami yang mengandung komponen fitokimia bermanfaat sebagai radioprotektor terhadap radiasi ionisasi pada tubuh.
STUDI HISTOPATOLOGI POTENSI RADIOPROTEKTIF
EKSTRAK KELOPAK BUNGA ROSELA
(
Hibiscus sabdariffa
L.) DALAM RADIASI IONISASI
RADIODIAGNOSTIK BERULANG PADA
LAMBUNG MENCIT (
Mus musculus
)
ABAS KURNIAWAN
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi Studi Histopatologi Potensi Radioprotektif Ekstrak Kelopak Bunga Rosela (Hibiscus sabdariffa L.) dalam Radiasi Ionisasi Radiodiagnostik Berulang pada Lambung Mencit (Mus musculus) adalah karya saya sendiri dengan arahan dari dosen pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun yang tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, April 2012
ABSTRAK
ABAS KURNIAWAN. Studi Histopatologi Potensi Radioprotektif Ekstrak Kelopak Bunga Rosela (Hibiscus sabdariffa L.) dalam Radiasi Ionisasi Radiodiagnostik Berulang pada Lambung Mencit (Mus musculus). Dibimbing oleh SRI ESTUNINGSIH dan DENI NOVIANA.
Penelitian ini bertujuan untuk mengetahui efek radioprotektif dari ekstrak kelopak bunga Rosela (Hibiscus sabdariffa L.) terhadap radiasi ionisasi radiodiagnostik berulang pada lambung mencit (Mus musculus). Sebanyak 48 ekor mencit jantan dewasa digunakan dalam penelitian ini dan dibagi menjadi 4 kelompok; kontrol (K-), radiasi (K+), rosela tanpa radiasi (R-) dan rosela dengan radiasi (R+). Mencit diberi perlakuan ekstrak rosela peroral dengan dosis 50 mg / kg berat badan setiap dua hari sekali sebelum dilakukan radiasi be