iii
GRIV STIFANA SHATILLA. Radioprotective effect of ethanolic roselle extract (Hibiscus sabdariffa L.) in recurrent radiodiagnostic ionizing radiation: the study of red blood cells peripheral blood in mice (Mus musculus) under supervision: drh. DENI NOVIANA, Ph.D and Dr. drh. SRI ESTUNINGSIH, M.Si, APVet.
The aim of this study was to determine the radioprotective effect of ethanolic roselle extract (Hibiscus sabdariffa L.) in recurrent radiodiagnostic ionizing radiation on peripheral red blood cells of mice (Mus musculus). Fourty eight male mice were used in this study and divided into 4 group; K-(physiological saline without radiation), K+ (physiological saline with radiation), R- (roselle extract without radiation), R+ (roselle extract with radiation). The mice were treated with 50 mg per kg body weight ethanolic roselle extract prior to radiation exposure. Following these treatment, the mice were exposed with ionizing radiation at dose 0.2 mSv every two days for 8 weeks. Bloods sample were collected of each group at week 0 before treatment, 2, 4, 6, and 8 week after treatment. The blood samples were taken also at 4 and 8 week, which previously without radiation exposure for 30 days as recovery phase. The result showed that radiation exposure causes an increasing the number of Mean Corpuscular Volume (MCV), Mean Corpuscular Hemoglobin (MCH), Mean Corpuscular Hemoglobin Concentration (MCHC) and Howell Jolly Bodies in the peripheral blood tissue. However ethanolic roselle extract causes a decreasing number of the parameters. This result indicated that ethanolic roselle extract has radioprotective effect on of red blood cells repair process from ionizing radiation destruction (p<0.05).
ERITROSIT DARAH PERIFER MENCIT (
Mus musculus
)
GRIV STIFANA SHATILLA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ii
Dengan ini saya menyatakan bahwa skripsi dengan judul Efek Radioprotektif
Ekstrak Rosela (Hibiscus sabdariffa L.) terhadap Radiasi Ionisasi Radiodiagnostik Berulang: Studi Gambaran Eritrosit Darah Perifer Mencit (Mus musculus) adalah karya saya dengan arahan dari pembimbing dan belum diajukan dalam bentuk
apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau
dikutip dari karya yang diterbitkan dari penulis lain telah disebutkan dalam teks
dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Bogor, April 2012
Griv Stifana Shatilla
iii
GRIV STIFANA SHATILLA. Radioprotective effect of ethanolic roselle extract (Hibiscus sabdariffa L.) in recurrent radiodiagnostic ionizing radiation: the study of red blood cells peripheral blood in mice (Mus musculus) under supervision: drh. DENI NOVIANA, Ph.D and Dr. drh. SRI ESTUNINGSIH, M.Si, APVet.
The aim of this study was to determine the radioprotective effect of ethanolic roselle extract (Hibiscus sabdariffa L.) in recurrent radiodiagnostic ionizing radiation on peripheral red blood cells of mice (Mus musculus). Fourty eight male mice were used in this study and divided into 4 group; K-(physiological saline without radiation), K+ (physiological saline with radiation), R- (roselle extract without radiation), R+ (roselle extract with radiation). The mice were treated with 50 mg per kg body weight ethanolic roselle extract prior to radiation exposure. Following these treatment, the mice were exposed with ionizing radiation at dose 0.2 mSv every two days for 8 weeks. Bloods sample were collected of each group at week 0 before treatment, 2, 4, 6, and 8 week after treatment. The blood samples were taken also at 4 and 8 week, which previously without radiation exposure for 30 days as recovery phase. The result showed that radiation exposure causes an increasing the number of Mean Corpuscular Volume (MCV), Mean Corpuscular Hemoglobin (MCH), Mean Corpuscular Hemoglobin Concentration (MCHC) and Howell Jolly Bodies in the peripheral blood tissue. However ethanolic roselle extract causes a decreasing number of the parameters. This result indicated that ethanolic roselle extract has radioprotective effect on of red blood cells repair process from ionizing radiation destruction (p<0.05).
iv
© Hak Cipta milik IPB, Tahun 2012
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
v
ERITROSIT DARAH PERIFER MENCIT (
Mus musculus
)
GRIV STIFANA SHATILLA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Kedokteran Hewan pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
BOGOR
2012
vi
Darah Perifer Mencit (Mus musculus). Nama : Griv Stifana Shatilla
NIM : B04070061
Disetujui
Drh. Deni Noviana, PhD Dr. Drh. Sri Estuningsih, M.Si, APVet
Pembimbing I Pembimbing II
Diketahui
Drh. H. Agus Setiyono, MS, Ph.D, APVet
Wakil Dekan Fakultas Kedokteran Hewan
vii
Segala puji dan syukur penulis ucapkan kepada Allah SWT atas segala
rahmat dan hidayah-Nya sehingga skripsi ini berhasil diselesaikan. Judul yang
dipilih dalam penelitian yang dilaksanakan sejak bulan Februari sampai dengan
Juni 2011 adalah Efek Radioprotektif Ekstrak Rosela (Hibiscus sabdariffa L.) terhadap Radiasi Ionisasi Radiodiagnostik Berulang: Studi Gambaran Eritrosit
Darah Perifer Mencit (Mus musculus).
Terima kasih penulis sampaikan sebesar-sebesarnya kepada: drh. Deni
Noviana, Ph.D dan Dr. drh. Sri Estuningsih, M.Si, APVet selaku dosen
pembimbing atas waktu, arahan, kritik dan saran yang mendukung
terselesaikannya skripsi ini dengan baik. Penulis juga ingin mengucapkan
terimakasih kepada drh. M. Fakhrul Ulum, M.Si, atas dukungan, nasehat dan
motivasi dalam penelitian dan penulisan skripsi selama ini, serta teman-teman
satu penelitian (Endah, Bambang, Windy, dan Abas) atas kerjasama dan
kebersamaannya. Terima kasih kepada seluruh staf Bagian Bedah dan Radiologi
serta Bagian Patologi FKH-IPB yang telah banyak membantu penelitian ini.
Ucapan terima kasih juga disampaikan kepada kedua orang tua Efriyon
Rusli dan Yestitin serta adik-adik: Fotji Fazerah Shatilla, Pudja Pilorazo Shatilla,
Grav Demountigiste, Kewa Kazano atas segala doa, kasih sayang dan kesabaran
yang telah diberikan. Ungkapan terima kasih untuk teman-teman GIANUZZI dan
HARMONI atas bantuan dan kebersamaan serta persahabatan selama ini.
Semoga skripsi ini dapat bermanfaat.
Bogor, April 2012
viii
ayah Efriyon Rusli dan ibu Yestitin. Penulis merupakan sulung dari lima
bersaudara.
Penulis menyelesaikan pendidikannya di SMAN 1 Lintau Buo pada tahun
2007. Pada tahun yang sama penulis diterima di IPB melalui jalur Undangan
Seleksi Masuk IPB (USMI) dengan jurusan Kedokteran Hewan. Selama menjadi
mahasiswa, penulis aktif sebagai anggota Himpunan Minat Profesi (HIMPRO)
HKSA FKH IPB (2008-2010).
Tugas akhir dalam perguruan tinggi diselesaikan penulis dengan menulis
skripsi yang berjudul “Efek Radioprotektif Ekstrak Rosela (Hibiscus sabdariffa
L.) terhadap Radiasi Ionisasi Radiodiagnostik Berulang: Studi Gambaran Eritrosit
Darah Perifer Mencit (Mus musculus)” sebagai salah satu syarat untuk mendapatkan gelar sarjana kedokteran hewan Fakultas Kedokteran Hewan,
Institut Pertanian Bogor dibawah bimbingan drh. Deni Noviana, Ph.D dan Dr. drh.
ix
3 BAHAN DAN METODE 3.1 Tempat dan Waktu ... 17
3.2 Bahan dan Alat ... 17
3.2.1 Persiapan dan Pemeliharaan Mencit ... 17
3.2.2 Pembuatan dan Pemberian Ekstrak Rosela ... 17
3.2.3 Paparan Radiasi Sinar-X ... 18
3.2.4 Pengambilan dan Pemeriksaan Darah ... 18
3.2.5 Penghitungan Jumlah Eritrosit ... 18
3.2.6 Pembuatan Preparat Ulas Darah Perifer, Pemeriksaan Hemoglobin dan Hematokrit ... 18
3.3 Metode Penelitian ... 19
3.3.1 Persiapan dan Pemeliharaan Mencit ... 19
3.3.2 Pembuatan Ekstrak Rosela ... 20
3.3.3 Pemberian Ekstrak Rosela ... 21
3.3.4 Paparan Radiasi Sinar-X ... 21
3.3.5Pengambilan dan Pemeriksaan Darah ... 22
3.3.6 Penghitungan Jumlah Eritrosit ... 22
3.3.7 Penghitungan Hemoglobin ... 23
3.3.8 Penghitungan Jumlah Hematokrit (PCV) ... 23
3.3.9Penghitungan Howell Jolly bodies ... 23
3.4 Analisis Data ... 25
4 HASIL DAN PEMBAHASAN ... 26
x
xi
2 Kandungan senyawa kimia dalam kelopak rosela ... 8
3 Nilai normal sel darah merah mencit ... 13
4 Kelompok perlakuan dalam penelitian ... 20
5 Nilai MCV darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang dan setelah pemulihan
selama 30 hari ... 26
6 Nilai MCH darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang dan setelah pemulihan
selama 30 hari ... 29
7 Nilai MCHC darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang dan setelah pemulihan
selama 30 hari ... 32
8 Nilai Howell Jolly bodies perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang dan setelah pemulihan
xii
1 Kemungkinan hasil paparan radiasi terhadap sel normal ... 4
2 Kelopak rosela ... 6
3 Skema hematopoiesis ... 10
4 Sel darah merah normal mencit dilihat secara mikroskopis ... 12
5 Mencit laboratorium yang digunakan sabagai hewan percobaan ... 15
6 Mencit laboratorium di dalam kandang plastik ... 17
7 Pencekokan ekstrak etanol kelopak rosela pada mencit ... 21
8 Pengambilan darah mencit melalui vena sinus retro orbitalis mata ... 22
9 Kamar hitung Neubauer ... 23
10 Counter lens ... 24
11 Persentase MCV darah perifer mencit terhadap radiodiagnostik berulang ... 27
12 Persentase MCH darah perifer mencit terhadap radiodiagnostik berulang ... 30
13 Persentase MCHC darah perifer mencit terhadap radiodiagnostik berulang ... ` 33
14 Persentase Howell Jolly bodies darah perifer mencit terhadap radiodiagnostik berulang ... 36
xiii
1 Perhitungan dosis ekstrak rosela ... 47
2 Perhitungan dosis anticacing ... 47
3 Perhitungan dosis antibiotik ... 47
4 Perhitungan dosis antijamur ... 48
5 Analisis data secara statistik ... 49
PENDAHULUAN
1.1 Latar Belakang
Sekarang ini penggunaan radio ionisasi telah banyak dipakai dalam
radiodiagnostik, radioterapi, industri, dan sektor energi (Jagetia 2007). Radiografi
atau Roentgen atau sinar-X merupakan sarana penunjang diagnostik yang sudah
berkembang pesat baik di dunia kedokteran manusia maupun dalam dunia
kedokteran hewan (Thrall 2002).
Berbagai penyakit dan kelainan organ dapat terdeteksi dengan cepat melalui
radiodiagnosa dan dilakukan terapi dengan radioterapi. Energi yang dihasilkan
oleh sinar-X merupakan energi radiasi ionisasi yang berbahaya bagi kesehatan.
Penggunaan sinar-X yang berlebihan dan tidak memperhatikan kaidah-kaidah
keselamatan dapat menyebabkan kerusakan pada jaringan lain karena adanya efek
radiasi ionisasi (McCurnin dan Bassert 2006).
Sinar-X menghasilkan pasangan elektron (ionisasi) di dalam jaringan.
Kebanyakan jaringan mengandung 70% air, ionisasi molekul air menyebabkan
pembentukan radikal bebas secara aktif. Radikal bebas dapat menyebabkan
kerusakan pada jaringan. Sinar-X berinteraksi secara langsung dengan DNA akan
menghasilkan beberapa perubahan yang berpotensi merusak sel. Jenis jaringan
yang disinari mempunyai dampak atas efek radiasi. Pemaparan berulang atau
pemaparan jangka panjang oleh radiasi dosis rendah dapat menyebabkan
berkurangnya jumlah sel darah merah atau anemia, berkurangnya sel darah putih
atau leukopenia dan berkurangnya trombosit atau trombositopenia (USNRC tanpa
tahun).
Radioprotektor dalam bentuk sediaan yang dapat dikonsumsi dibutuhkan
untuk menangkal radiasi. Radioprotektor yang ideal harus murah, tidak beracun
dalam jangkauan dosis yang luas, penggunaan mudah (secara oral), cepat diserap,
memiliki rentang dosis yang luas, dan dapat bekerja melalui beberapa mekanisme.
Beberapa tanaman dan produk alami memiliki semua sifat yang ideal sebagai
radioprotektor. Produk dari alam biasanya tidak beracun, relatif murah, dapat
digunakan secara oral (Jagetia 2007). Salah satu contoh tanaman dan produk
Tanaman rosela (Hibiscus sabdariffa L.) banyak ditemukan di daerah tropis, termasuk Indonesia. Rosela banyak dimanfaatkan menjadi produk olahan pangan
seperti teh, sirup, selai dan pewarna alami pada makanan (Usman 2010).
Penelitian tentang rosela sebagai tanaman obat tradisional dalam bentuk sediaan
teh merah untuk pengobatan berbagai jenis penyakit sudah dilaporkan oleh
Khosravi et al. (2009) dan penggunaan ekstrak tanaman rosela sebagai obat alternatif untuk berbagai penyakit telah dilaporkan juga oleh Wang et al. (2000), Mardiah dan Rahayu (2009), Odigie et al. (2003) dan Olelaye (2007). Rosela mengandung antioksidan yang tinggi (Mardiah dan Rahayu 2009). Antioksidan
efektif untuk mencegah efek yang ditimbulkan oleh radiasi sinar-X dan pemulihan
sel hematopoietik akibat radiasi (Wambi et al. 2008). Efek radioprotektif ekstrak etanol rosela dalam radiasi ionisasi radiodiagnostik berulang telah dilakukan
terhadap sel darah putih oleh Setiawan (2011) dan sumsum tulang oleh Ulum
(2012). Penelitian ini bermaksud untuk melihat potensi ekstrak etanol rosela
(Hibiscus sabdariffa L.) dalam radiasi ionisasi radiodiagnostik dosis rendah pada sel darah merah mencit.
1.2 Tujuan
Tujuan penelitian ini adalah untuk mengetahui khasiat radioprotektif
tanaman rosela (Hibiscus sabdariffa L.) terhadap radiasi ionisasi radiodiagnostik pada gambaran eritrosit darah perifer mencit (Mus musculus).
1.3 Manfaat
Hasil dari penelitian ini diharapkan dapat memberikan informasi kepada
masyarakat mengenai khasiat ekstrak tanaman rosela (Hibiscus sabdariffa L.) terhadap sel darah merah dalam kaitannya dengan radiasi sinar-X.
1.4 Hipotesis Penelitian
H0 : Pemberian ekstrak rosela tidak melindungi sel darah merah mencit terhadap
paparan radiasi sinar-X berulang.
H1 : Pemberian ekstrak rosela melindungi sel darah merah mencit terhadap
TINJAUAN PUSTAKA
2.1 Radiasi Ionisasi
Radiasi adalah suatu cara perambatan energi dari sumber energi ke
lingkungannya tanpa membutuhkan medium (BATAN 2008; Swamardika 2009).
Sinar-X merupakan gelombang elektromagnetik atau disebut juga dengan foton
sebagai gelombang listrik sekaligus gelombang magnet. Energi sinar-X relatif
besar sehingga memilik daya tembus yang tinggi. Panjang sinar-X sekitar 10-0.01
nanometer (1.0 × 10-9 meter), frekuensi 30 petaherzt-30 exaherzt (30 x 1015 Hz –
30 x 1018 Hz) dan memiliki energi 120 elektron Volt (eV)-120 Kilo elektron Volt
(KeV) (Thrall 2002).
Radiasi pengion adalah jenis radiasi yang dapat menyebabkan proses
ionisasi yaitu terbentuknya ion positif dan ion negatif, apabila berinteraksi dengan
materi. Partikel alpha, partikel beta, sinar gamma, sinar-X dan neutron termasuk
dalam jenis radiasi pengion. Setiap jenis radiasi memiliki karakteristik khusus
(BATAN 2008).
Proses terbentuknya sinar-X diawali dengan adanya pemberian arus pada
kumparan filamen pada tabung sinar-X sehingga akan terbentuk awan elektron.
Pemberian beda tegangan selanjutnya akan menggerakkan awan elektron dari
katoda menumbuk target di anoda sehingga terbentuklah sinar-X karakteristik dan
sinar-X Bremsstrahlung. Sinar-X yang dihasilkan akan keluar dan jika berinteraksi dengan materi dapat menyebabkan beberapa hal diantaranya adalah
efek foto-listrik, efek hamburan Compton dan efek terbentuknya elektron berpasangan. Efek foto-listrik memiliki tingkat radiasi yang lebih rendah
dibandingkan dengan dua efek lainnya. Radiasi ionisasi akan mengakibatkan efek
biologi radiasi, (termasuk efek foto-listrik, hamburan Compton dan terbentuknya elektron berpasangan) yang dapat terjadi secara langsung ataupun secara tidak
langsung (Swamardika 2009).
2.1.1 Efek Radiasi
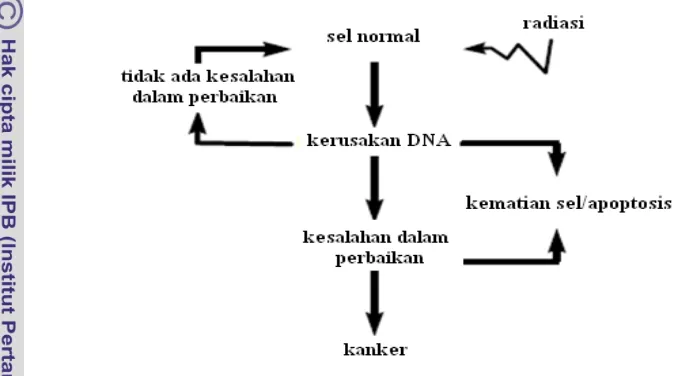
Ketika sel normal terpapar oleh radiasi maka akan terjadi kerusakan DNA.
tersebut, ada beberapa kemungkinan yang dapat terjadi yaitu tidak ada kesalahan
dalam perbaikan, sehingga sel dapat memperbaiki kerusakan kecil dan kembali
menjadi normal. Jika kerusakan cukup parah, akan terjadi kematian sel/apoptosis.
Kemungkinan lain dari paparan radiasi adalah sel tidak mati, namun terjadi mutasi
karena kesalahan dalam perbaikan DNA dan berlanjut menjadi kanker, seperti
yang terlihat pada Gambar 1.
Gambar 1 Kemungkinan hasil paparan radiasi terhadap sel normal (Mitcel 2003).
Apabila ditinjau dari segi dosis radiasi, efek radiasi dapat dibedakan berupa
efek stokastik dan deterministik. Efek stokastik adalah peluang efek akibat
paparan sinar-X yang timbul setelah rentang waktu tertentu tanpa adanya batas
ambang dosis. Efek deterministik merupakan efek yang langsung terjadi apabila
paparan sinar-X melebihi ambang batas dosis dengan tingkat keparahan
bergantung pada dosis radiasi yang diterima. Dosis radiasi bersifat akumulatif
sehingga dosis paparan yang diterima akan bertambah seiring dengan frekuensi
radiasi yang diterima sebelumnya (Ulum dan Noviana 2008). Berbagai kerusakan
yang disebabkan oleh radiasi juga terlihat pada sel darah merah perifer seperti
penghancuran (destruksi) sel darah merah yang berlebihan, terbentuknya Howell Jolly bodies (Hee 1993; Rask et al. 2008), dan menyebabkan leukemia (Yoshinaga et al. 2005).
Menurut USNRC (United State Nuclear Regulatory Commission) (tanpa tahun) dua kategori pengaruh paparan radiasi dosis rendah yaitu efek genetik dan
efek somatik. Efek genetik adalah efek yang diderita oleh keturunan dari individu
yang terkena paparan radiasi. Efek somatik disebut juga dengan efek karsinogenik
karena efek utamanya berupa kanker. Sel pembentuk darah merupakan sel yang
paling sensitif terhadap radiasi ionisasi. Radiasi dengan dosis tinggi akan
memperlihatkan gejala yang akut sedangkan radiasi dosis rendah akan
berlangsung kronis dengan jangka waktu yang lama.
Penggunaan sinar-X yang berlebihan dan paparan sinar gamma dapat
menyebabkan kerusakan pada sumsum tulang. Kerusakan ini kemudian berakibat
pada gangguan pembentukan sel darah merah dan sel darah putih. Gangguan pada
sel darah merah dapat berupa anemia aplasi dan pada sel darah putih berdampak
sebagai leukemia (Lusiyanti dan Syaifudin 2008; USNRC tanpa tahun).
2.1.2 Proteksi Radiasi
Keselamatan radiasi adalah tindakan yang dilakukan untuk melindungi
pasien (hewan), pekerja (operator, dokter hewan dan paramedis), anggota
masyarakat, dan lingkungan hidup dari bahaya radiasi. Syarat proteksi radiasi
dalam pemanfaatan sinar-X sebagai sarana penunjang diagnosa radiodiagnostik
harus memperhatikan bebrapa hal diantaranya justifikasi pemanfaatan tenaga
nuklir, limitasi dosis, dan optimisasi proteksi dan keselamatan radiasi (Thrall
2002; Ulum dan Noviana 2008).
Keselamatan operator, dokter hewan terhadap paparan radiasi dilakukan
dengan melakukan radiografi dalam jarak sejauh mungkin dari sumber sinar-X,
menggunakan sarana proteksi radiasi seperti, apron Pb, sarung tangan Pb, kaca
mata Pb, pelindung tiroid Pb, alat ukur radiasi dan mempersingkat waktu radiasi.
Keselamatan lingkungan terhadap bahaya radiasi dilakukan dengan merencanakan
desain ruang radiografi yang aman baik bagi pasien, operator dan lingkungan.
Ruangan dilapisi dengan Pb dan memperhitungkan beban kerja ruangan terhadap
sinar-X yang sesuai dengan perundang-undangan yang berlaku (Ulum dan
Noviana 2008). Badan Pengawas Tenaga Nuklir (BAPETEN) adalah instansi
yang bertugas melaksanakan pengawasan melalui peraturan, perizinan, dan
inspeksi terhadap segala kegiatan pemanfaatan tenaga nuklir di Indonesia (PP no
2.2. Rosela
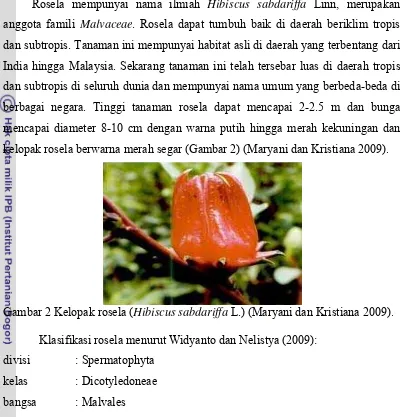
Rosela mempunyai nama ilmiah Hibiscus sabdariffa Linn, merupakan anggota famili Malvaceae. Rosela dapat tumbuh baik di daerah beriklim tropis dan subtropis. Tanaman ini mempunyai habitat asli di daerah yang terbentang dari
India hingga Malaysia. Sekarang tanaman ini telah tersebar luas di daerah tropis
dan subtropis di seluruh dunia dan mempunyai nama umum yang berbeda-beda di
berbagai negara. Tinggi tanaman rosela dapat mencapai 2-2.5 m dan bunga
mencapai diameter 8-10 cm dengan warna putih hingga merah kekuningan dan
kelopak rosela berwarna merah segar (Gambar 2) (Maryani dan Kristiana 2009).
Gambar 2 Kelopak rosela (Hibiscus sabdariffa L.) (Maryani dan Kristiana 2009).
Klasifikasi rosela menurut Widyanto dan Nelistya (2009):
divisi : Spermatophyta
kelas : Dicotyledoneae
bangsa : Malvales
suku : Malvaceae
marga : Hibiscus
jenis : Hibiscus sabdariffa L.
Hibiscus sabdariffa Linn adalah tanaman tahunan yang digunakan sebagai alat pengobatan di beberapa negara seperti Thailand, Mali, Cina dan Mexico.
Kelopak rosela kaya akan senyawa phenolic yang mengandung glukosida, hibiscin, hibiscus antosianin dan hibiscus protocatechuic acid, memiliki efek diuretik dan koleretik, menurunkan viskositas darah, menurunkan tekanan darah
virus, menghambat pertumbuhan kanker, menurunkan asam urat, anti kolesterol,
anti hipertensi, dan mampu menurunkan berat badan (Mardiah dan Rahayu 2009).
Berbagai kandungan yang terdapat dalam tanaman rosela membuatnya
populer sebagai tanaman obat tradisional. Kandungan vitamin dalam rosela cukup
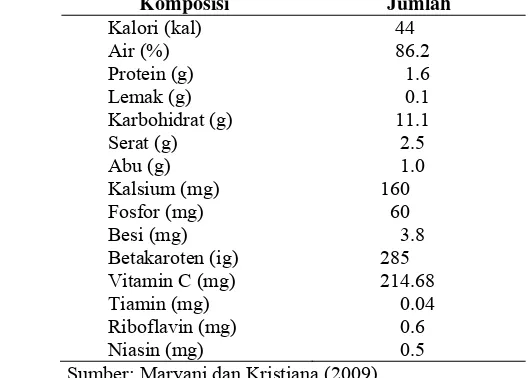
lengkap, yaitu vitamin A, C, D, B1, dan B2 sebagaimana Tabel 1. Kandungan
vitamin C pada rosela yang dikenal dengan asam askorbat diketahui 3 kali lebih
banyak dari anggur hitam, 9 kali dari jeruk sitrus, 10 kali dari buah belimbing, dan
2.5 kali dari jambu biji. Vitamin C merupakan salah satu antioksidan penting.
Hasil penelitian mengungkapkan bahwa kandungan antioksidan pada teh rosela
sebanyak 1.7 mmol/prolox. Jumlah tersebut lebih tinggi daripada jumlah pada
kumis kucing (Widyanto dan Nelistya 2009).
Tabel 1 Komposisi kimia kelopak segar bunga rosela per 100 gram bahan Komposisi Jumlah Sumber: Maryani dan Kristiana (2009).
Kandungan penting yang terdapat pada kelopak bunga rosela adalah pigmen
antosianin yang membentuk flavonoid yang berperan sebagai antioksidan.
Flavonoid rosela terdiri dari flavonols dan pigmen antosianin. Pigmen antosianin
ini yang membentuk warna ungu kemerahan menarik di kelopak bunga maupun
teh hasil seduhan rosela. Antosianin berfungsi sebagai antioksidan yang diyakini
dapat menyembuhkan penyakit degeneratif. Antosianin pada rosela berada dalam
Tabel 2 Kandungan senyawa kimia dalam kelopak rosela.
Nama senyawa Jumlah
Campuran asam sitrat dan asam malat 13%
Anthocyanin yaitu gossipetin (hidroxyflavone) dan hibiscin 2%
Vitamin C 0.004-0.005%
Protein
Berat segar 6.7%
Berat kering 7.9%
Sumber: Maryani dan Kristiana (2009).
Penelitian telah menunjukkan bahwa ekstrak kasar dan beberapa dari
konstituen rosela, khususnya antosianin dan asam protocatechuic memiliki aktivitas antioksidan yang kuat secara in vitro dan in vivo (Tanaka et al. 1994; Tanaka et al. 1995; Tsuda et al. 1996; Tseng et al. 1997; Wang et al. 2000). Aktivitas anti hipertensi minuman yang dibuat dari kelopak kering dari tanaman
rosela telah teruji pada hewan model dan manusia (Fakaye et al. 2008).
Antosianin rosela dapat memberikan kontribusi bermanfaat bagi kesehatan
sebagai sumber antioksidan yang baik. Antosianin adalah turunan dari struktur
kation flavylum dasar, yang memiliki kekurangan elektron inti, mereka umumnya sangat reaktif. Laju kerusakan antosianin tergantung pada banyak faktor seperti
suhu, pH, asam askorbat, dan oksigen. Teknik ekstraksi untuk antosianin rosela
juga memainkan peran utama dalam aktivitas antioksidan ekstrak (Fakaye et al. 2008). Aktifitas ekstrak rosela juga tergantung pada pH yaitu pada pH 2 sampai 7.
Aktifitas berkurang sebagaimana peningkatan pH. Pada pH konstan, penurunan
aktifitas aktioksidan hanya relatif kecil (Sukhapat et al. 2004).
Kelopak rosela mengandung antioksidan yang dapat menghambat
terakumulasinya radikal bebas penyebab penyakit kronis, seperti kerusakan ginjal,
diabetes, jantung koroner dan kanker darah. Antioksidan juga dapat mencegah
penuaan dini. Kadar antioksidan yang terkandung dalam kelopak kering rosela
jauh lebih tinggi dibandingkan dengan tanaman kumis kucing (Mardiah dan
Rahayu 2009). Zat aktif yang paling berperan dalam kelopak bunga rosela
meliputi gossypetin, antosianin, dan glucosidehibiscin. Antosianin merupakan pigmen tumbuhan yang memberikan warna merah pada bunga rosela, bersifat
antioksidan serta berperan mencegah kerusakan sel akibat paparan sinar
ultraviolet berlebih. Salah satu khasiatnya adalah dapat menghambat pertumbuhan
Antioksidan adalah molekul yang berkemampuan memperlambat ataupun
mencegah oksidasi molekul lain. Tubuh memiliki antioksidan yang disebut juga
dengan antioksidan endogen untuk menetralkan radikal bebas, akan tetapi
kandungan antioksidan endogen yang rendah dapat menyebabkan stres oksidatif
sehingga radikal bebas dapat merusak sel-sel tubuh (Fang et al. 2002). Karena itulah efek rosela terhadap berbagai penyakit sebenarnya merupakan efek dari
antioksidannya (Usman 2010).
Antioksidan adalah senyawa dengan struktur molekul yang dapat
memberikan elektronnya kepada molekul radikal bebas tanpa terganggu sama
sekali dan dapat memutus reaksi berantai dari radikal bebas. Radikal bebas adalah
atom atau molekul yang tidak stabil dan sangat reaktif karena mengandung satu
atau lebih elektron tidak berpasangan pada orbital terluarnya. Radikal bebas akan
bereaksi dengan molekul disekitarnya untuk memperoleh pasangan elektron untuk
mencapai kestabilan atom atau molekul (Evans et al. 2004)
Pada umumnya antioksidan mengandung struktur inti sama yang
mengandung cincin benzene tidak jenuh disertai gugusan hidroksi atau gugus
amino. Aktivitas antioksidan terdiri dari beberapa mekanisme diantaranya
mencegah reaksi berantai, mencegah pembentukan peroksida, mencegah
pengambilan atom hidrogen, mereduksi, dan menangkap radikal (Su et al. 2004; Kim 2005).
2.3. Darah
Darah adalah suatu suspensi partikel dalam suatu larutan koloid cair yang
mengandung elektrolit (Baldy 2006). Darah mempunyai fungsi penting dalam
sirkulasi. Secara umum fungsi darah adalah sebagai alat transportasi oksigen,
karbondioksida, zat gizi, dan sisa metabolisme, mempertahankan keseimbangan
asam basa, mengatur cairan jaringan dan cairan ekstra sel, mengatur suhu tubuh,
dan sebagai pertahanan tubuh dengan mengedarkan antibodi dan sel darah putih
(Goorha et al. 2003).
Komponen darah terdiri dari sel-sel darah dan plasma yang merupakan
media cair darah. Sel-sel darah meliputi sel darah merah atau eritrosit, sel darah
Eritrosit atau sel darah merah adalah sel dengan jumlah terbanyak (99%). Platelet atau trombosit jumlah terbanyak setelah sel darah merah (0.6-1.0%). Jumlah
leukosit atau sel darah putih lebih sedikit dari sel darah merah (0.2%).
Perbandingan tipe leukosit tergantung pada spesies (Meyer dan Harvey 2004).
Sel-sel darah mempunyai umur yang terbatas, sehingga diperlukan
pembentukan yang optimal dan konsisten untuk mempertahankan jumlah yang
diperlukan untuk memenuhi kebutuhan jaringan. Pembentukan dan pematangan
darah disebut dengan hematopoiesis. Hematopoiesis terjadi di dalam sumsum
tulang tengkorak, vertebrae, pelvis, sternum, thorax dan epifisis proksimal tulang tulang panjang. Jika kebutuhan darah meningkat seperti keadaan pendarahan dan
penghancuran sel darah meningkat, maka dapat terjadi pembentukan sel darah di
sepanjang tulang panjang (Price dan Wilson 2005).
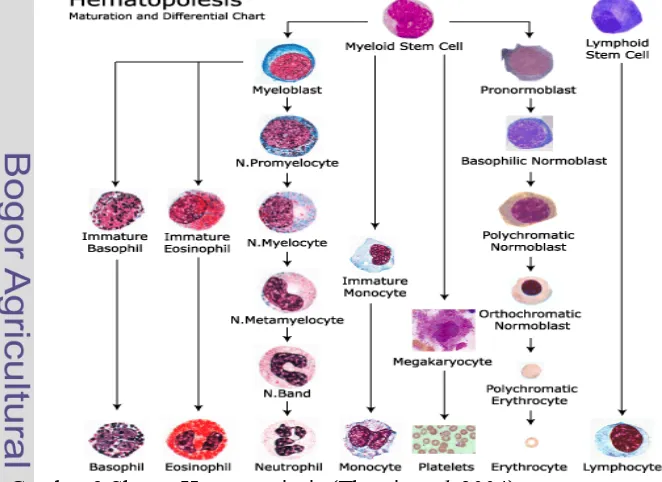
Dua stem sel yang terlibat dalam hematopoiesis yaitu stem sel limfoid dan
mieloid sebagaimana Gambar 3. Stem sel limfoid terkait dengan timus dimana sel
limfosit dihasilkan. Stem sel mieloid jauh lebih kompleks dari stem sel limfoid.
Stem sel mieloid sedikitnya memiliki enam garis keturunan yang berbeda yaitu
garis keturunan eritrosit, trombosit, netrofil, eosonofil, basofil, dan monosit
/makrofag. Sel-sel ini terbentuk sebelum menjadi matur (dewasa) terjadi di
sumsum tulang. Tahap akhir garis keturunan mieloid ini terdapat dalam sel darah
perifer normal (Wellman 2010).
Volume darah mencit dalam sirkulasi sekitar 6.3-8.0 ml/100 gram berat
badan. Pengambilan darah sampai 40% volume darah setelah 24 jam belum tentu
meningkatkan kesakitan atau kematian. Mencit yang masih muda memiliki
volume darah yang lebih banyak dari pada mencit yang sudah tua. (Weiss dan
Wadrop 2010). Pada umumnya volume darah adalah 6-8% dari berat badan
(Kresno 1988). Volume darah di dalam tubuh hewan tergantung pada umur,
keadaan kesehatan, makanan, ukuran tubuh, waktu menyusu, faktor lingkungan
dan derajat aktivitas (Malole dan Pramono 1989). Secara umum, jumlah
maksimum darah yang bisa diambil dalam satu kali pengambilan adalah 1% dari
berat badan (Thrall 2004). Jumlah total darah yang dapat diambil dari mencit
adalah 6%-7% dari berat badan (Meyer dan Harvey 2004).
2.3.1 Sel Darah Merah (Eritrosit)
Morfologi normal sel darah merah (eritrosit) bervariasi tergantung kepada
spesies. Eritrosit mamalia tidak berinti sedangkan eritrosit bangsa camellidae,
reptil, dan aves memiliki inti. Bentuk oval dan bikonkaf dari eritrosit berfungsi
sebagai pertukaran oksigen. Sel darah merah mencit mempunyai ketebalan sel
2.1-2.13 μm dan diameter rata-rata 6.2 μm atau sekitar 5.7-7 μm. Waktu hidup sel
darah mencit adalah sekitar 43 hari. Sel darah merah terdiri sekitar 20% air, 40%,
protein, 35% lemak dan 6% karbohidrat (Weiss dan Wadrop 2010).
Fungsi utama dari sel darah merah adalah untuk mengangkut hemoglobin
yang membawa oksigen ke jaringan. Membran permeabel yang menutupi
komponen sel darah merah terbuat dari lipid, protein, dan karbohidrat. Perubahan
komposisi lipid membran dapat menghasilkan bentuk sel darah merah yang
abnormal. Ketidaknormalan membran protein juga mungkin menghasilkan bentuk
tidak normal dari sel darah merah. Morfologi eritrosit sering digunakan untuk
menegakkan diagnosa mengenai penyebab anemia. Morfologi eritrosit dapat
dilihat pada preparat darah sesuai dengan warna, ukuran bentuk, struktur di dalam
Gambar 4 Sel darah merah normal dilihat secara mikroskopis (Vidinsky 2011).
Evaluasi darah tepi merupakan suatu penunjang diagnosa terhadap kelainan
hematologi. Pengukuran kadar hemoglobin (Hb) dan hematokrit (PCV) digunakan
bersama untuk identifikasi adanya anemia. Hematokrit atau PCV (Packed Cell Volume) adalah volume eritrosit yang dimampatkan dan dinyatakan dalam % (volume sel-sel eritrosit seluruhnya dalam 100 ml darah). Idealnya untuk menilai
anemia selain pengukuran kadar Hb dibutuhkan penilaian terhadap kapasitas
oksigen, tapi pada prakteknya sulit menerapkan pemeriksaan ini dalam
pemeriksaan darah rutin, sehingga pada pemeriksaan darah sering disertai dengan
pengukuran indeks eritrosit yang mengarah pada sifat defek primer anemianya,
pendekatan ini dapat juga menunjukkan kelainan yang mendasari sebelum
terjadinya anemia yang jelas (Kemuning 2010).
Penilaian terhadap indeks eritrosit terdiri dari penghitungan nilai Mean Corpuscular Volume (MCV), Mean Corpuscular Hemoglobin (MCH) dan Mean Corpuscular Hemoglobin Concentration (MCHC). MCV yaitu volume rata-rata sebuah eritrosit dinyatakan dengan femtoliter (10-15 liter). MCV ditentukan paling
akurat dengan pengukuran langsung dengan electronic cell counter. Perhitungan dapat ditentukan secara tidak langsung dengan membagi hematokrit (PCV)
dengan jumlah sel darah merah (dalam 106/µL) dan mengalikan dengan 10. MCV
bervariasi tergantung spesies dan usia. Nilai MCV yang tinggi (macrocytosis) biasanya berhubungan dengan anemia regeneratif karena volume sel darah yang
muda individu terutama dalam keadaan stres, lebih besar dari volume eritrosit
diatas interval referensi yang normal. MCV yang tinggi dapat terjadi pada hewan
dengan gangguan mieloproliferatif (Meyer dan Harvey 2004).
MCH atau disebut juga dengan Hemoglobin Eritrosit Rata-Rata (HER),
yaitu banyaknya hemoglobin per eritrosit dan dinyatakan dalam pikogram (pg).
MCH dihitung dengan membagi nilai hemoglobin (dalam g/dl) dengan sel darah
merah (dalam 106/µL) dan mengalikannya dengan 10. Biasanya MCH berkorelasi
langsung dengan MCV hewan (Meyer dan Harvey 2004).
MCHC atau disebut juga dengan Konsentrasi Hemoglobin Eritrosit
Rata-rata (KHER), yaitu kadar hemoglobin yang didapat per eritrosit, dinyatakan
dengan persen (%) atau gram hemoglobin per dl eritrosit (g/dl). MCHC
merupakan konsentrasi hemoglobin rata-rata dalam eritrosit yang dihitung dengan
membagi nilai hemoglobin (g/dl) dengan PCV dan mengalikannya dengan 100.
MCHC dinyatakan sebagai g/dl eritrosit (Meyer dan Harvey 2004). Nilai normal
sel darah merah mencit dapat dilihat pada Tabel 3.
Tabel 3 Nilai normal sel darah merah mencit
Jenis Jumlah
Jumlah total sel darah merah 6.5-10.1 x 106 sel/µl
PCV 32.8-48.0%
Hemoglobin 10.1-16.1 g/dl
MCV 42.3-55.9 fL
MCH 13.7-18.1 pg
MCHC 29.5-35.1% Sumber : Thrall (2004).
2.3.2 Howell Jolly Bodies
Howell Jolly bodies merupakan sisa inti hasil mitosis yang tidak sempurna berupa fragmen kecil berwarna biru dengan pewarnaan Giemsa dan berdiameter 1
µm di dalam sel darah merah (Thrall 2004). Howell Jolly bodies disebut juga dengan mikronukleus merupakan hasil mutasi dari kromosom utuh yang patah
kemudian tampak sebagai nukleus berukuran kecil di dalam sel (Purwadiwarsa et al. 2000). Howell Jolly bodies biasanya tampak pada sel polychromatic erythrocyte (PCE) yang merupakan sel eritrosit muda dan baru mengalami mitosis dan sintesis DNA (Sumpena et al. 2009). Jumlah sel eritrosit polikromatik bermikronukleus menunjukkan tingkat kerusakan genetik dalam sistem
Radiasi sinar-X pada mencit dapat menyebabkan terbentuknya radikal
bebas. Radikal bebas ini terbentuk dari interaksi radiasi pada elektron atom
dengan molekul air yang ada di dalam tubuh oleh radiasi ionisasi. Radikal bebas
memiliki elektron bebas yang tidak mempunyai pasangan pada lapisan terluarnya
dan dapat menyebabkan kerusakan pada sel tubuh. Kerusakan tersebut dapat
terjadi pada semua sel, namun sel darah adalah sel yang paling sensitif terhadap
terjadinya kerusakan (USNRC tanpa tahun).
Radiasi ionisasi memicu kerusakan kromosom pada tahap anafase
pembelahan sel. Setelah mencapai tahap telofase, elemen sentris menjadi inti sel
anak, sedang fragmen kromosom yang tertinggal tetap berada pada sitoplasma
membentuk inti kecil yang disebut Howell Jolly bodies (Sumpena et al. 2009). Terbentuknya Howell Jolly bodies (mikronukleus) pada sel merupakan indikasi terjadinya aktifitas mutagenik yang merusak kromosom dan memicu
terjadinya kanker. Mikronukleus merupakan hasil mutasi kromosom yang tampak
sebagai nukleus berukuran kecil di dalam sel. Mutasi dapat dipicu oleh adanya
radiasi ionisasi. Jumlah eritrosit bermikronukleus menunjukkan tingkat kerusakan
genetik dalam sistem eritropoietik (Purwadiwarsa et al. 2000).
2.4. Mencit
Hewan coba yang digunakan dalam penelitian ini adalah mencit
laboratorium (Gambar 5). Mencit (Mus musculus) merupakan hewan rodensia yang cepat berbiak, mudah dipelihara dalam jumlah banyak, variasi genetikanya
cukup besar, serta sifat anatomis dan fisiologis terkarakterisasi dengan baik
(Malole dan Pramono 1989). Mencit telah digunakan sebagai subyek penelitian
sejak abad ke-19. Alasan penggunaan mencit sebagai hewan coba yaitu,
berukuran kecil, harganya relatif murah dan mudah dipelihara (Sirois 2005).
Mus musculus sebagaimana pada Gambar 5memiliki ciri ukuran tubuh yang kecil sehingga mudah ditangani dan dikembangbiakkan. Pada bagian ekor mencit
hanya ditutupi oleh rambut-rambut halus. Berbeda dengan tikus dan mamalia lain,
sumsum dari tulang panjangnya selalu aktif seumur hidupnya. Rata-rata umur
dewasa pada umur 6 minggu dan masa bunting selama 19 sampai 21 hari (Sirois
2005).
Gambar 5 Mencit laboratorium yang digunakan sabagai hewan percobaan (Mather dan Lausen 2009).
Sistem taksonomi mencit adalah sebagai berikut (Besselsen 2004):
kingdom : Animalia
filum : Chordata
subfilum : Vertebrata
kelas : Mamalia
subkelas : Theria
ordo : Rodensia
subordo : Sciurognathi
famili : Muridae
subfamili : Murinae
genus : Mus
spesies : Mus musculus
Mencit dapat dikondisikan sesuai dengan kebutuhan penelitian, seperti
kastrasi maupun ovariohisterektomi (steril) untuk penelitian yang berkaitan
dengan hormonal maupun reproduksi, kondisi hiperglikemia untuk penelitian
yang berkaitan dengan glukosa darah, kondisi asam urat untuk penelitian yang
berkaitan dengan asam urat. Kondisi diabetes bawaan (genetik) untuk penelitian
yang berkaitan dengan diabetes melitus dan sinkronisasi birahi untuk penelitian
yang membutuhkan kondisi estrus yang terjadi secara bersamaan untuk
dibutuhkan keseragaman parameter darah agar hasil penelitian dapat
dipertanggung jawabkan (Sirois 2005; Ulum 2010).
Mencit sering digunakan sebagai sarana penelitian biomedis, pengujian dan
pendidikan. Mencit digunakan sebagai model penyakit pada manusia dalam hal
genetika. Hal tersebut karena kelengkapan organ, kebutuhan nutrisi, metabolisme,
dan biokimianya cukup dekat dengan manusia. Beberapa penyakit manusia yang
menggunakan mencit sebagai hewan model adalah toksoplasmosis (Iskandar et al. 2002), jantung coroner (Sukarsa 2004), diabetes (Nugroho 2006), penyakit tifoid
BAHAN DAN METODE
3.1. Tempat dan Waktu
Penelitian ini dilaksanakan di Bagian Bedah dan Radiologi sebagai tempat
pemaparan radiasi dan pengambilan darah serta bagian Fisiologi sebagai tempat
pemeriksaan darah. Pemeliharaan mencit di kandang hewan percobaan Bagian
Patologi Departemen Klinik Reproduksi dan Patologi FKH IPB. Penelitian ini
dilaksanakan dari bulan Februari sampai Juni 2011.
3.2. Bahan dan Alat
3.2.1 Persiapan dan pemeliharaan mencit
Bahan yang diperlukan untuk persiapan dan pemeliharaan mencit adalah 48
ekor mencit jantan yang berumur 6-8 minggu dengan berat badan 20-25 gram
yang diperoleh dari pembiakan di FKH IPB, pakan mencit komersil, serbuk kayu
dan air minum ad libitum. Alat yang digunakan yaitu kandang plastik (35 x 25 x 15 cm) yang dilengkapi dengan tutup kawat, tempat pakan, tempat air minum
mencit dan alat cekok berupa stomach tube.
Gambar 6 Mencit laboratorium di dalam kandang plastik.
3.2.2 Pembuatan dan pemberian ekstrak rosela (Hibiscus sabdariffa L.)
Bahan yang diperlukan untuk pemberian ekstrak rosela adalah kelopak
3.2.3 Paparan radiasi sinar-X
Alat yang digunakan untuk melakukan radiasi sinar-X terhadap mencit
adalah mesin radiodiagnostik portabel sinar-X (VR-1020, Medical corp, Japan),
apron Pb, pelindung mata, pelindung tiriod, dosimeter (MyDose™ ALOKA CO,
LTD Tokyo Japan) dan kandang mencit.
3.2.4 Pengambilan dan pemeriksaan darah perifer mencit
Bahan yang digunakan untuk mengambil darah antara lain kapas, alkohol
70%, EDTA (Ethylene Diamine Tetra Acid) 10%, ketamine, xylazin, dan yohimbin. Alat yang digunakan antara lain syiringe 1 cc, syiringe 3 cc, syiringe 5 cc, mikrokapiler hematokrit, Eppendorf, dan timbangan.
3.2.5 Penghitungan jumlah eritrosit
Sampel darah dan larutan Hayem adalah bahan yang diperlukan untuk menghitung jumlah eritrosit. Alat yang digunakan antara lain hemositometer set
yang terdiri dari kamar hitung Neubauer, pipet leukosit, selang hisap, dan cover glass, serta counter dan kertas tisu.
3.2.6 Pembuatan preparat ulas darah perifer, pemeriksaan hemoglobin dan hematokrit
Pembuatan preparat ulas darah dilakukan terhadap setiap sampel darah yang
diambil. Selain sampel darah, bahan yang diperlukan antara lain larutan giemsa 10%, dan metanol. Alat yang digunakan antara lain object glass, dan timer.
Dalam pemeriksaan hematokrit dibutuhkan sampel darah, mikrohematokrit,
microhematocrit clay, alat sentrifus dan refractometry. Alat dan bahan yang dibutuhkan untuk pemeriksaan hemoglobin adalah hemometer Sahli terdiri dari:
gelas berwarna sebagai warna standar, tabung hemometer, pengaduk dari gelas,
3.3. Metode Penelitian
3.3.1 Persiapan dan Pemeliharaan Mencit
Mencit yang digunakan adalah mencit strain ddy yang diperoleh dari pembiakan di FKH IPB. Desain penelitian merupakan hasil modifikasi prosedur penelitian yang telah dilakukan oleh Fidan et al. (2008).
Semua mencit (48 ekor) diaklimasi untuk menyesuaikan kondisi
laboratorium, selama 2 minggu sebelum penelitian dilaksanakan. Setiap kelompok
mencit (n=12) dibagi menjadi subkelompok (n=6). Setiap subkelompok mencit
ditempatkan di dalam kandang plastik berukuran 35 x 25 x 15 cm. Serbuk kayu
digunakan sebagai litter atau alas kandang. Litter diganti dan kandang dicuci dua kali dalam seminggu. Pakan diberikan sesuai kebutuhan harian mencit dan minum
diberikan secara ad libitum. Sebelum penelitian dimulai, semua mencit diberi anthelmentik (Preziquantel®) diberikan dua kali dengan selang waktu 10 hari
dengan dosis 25 mg/kg peroral; antibiotik (Clavamox®) diberikan selama 5 hari
berturut-turut dengan dosis 50 mg/kg berat badan dan anti fungal (Metronidazole)
dengan dosis 25 mg/kg berat badan diberikan selama lima hari berturut-turut
secara peroral (Hrapkiewicz dan Medina 2007).
Mencit dibagi menjadi 2 grup radiasi, yaitu; (a) grup radiasi rendah (dosis
0.2 mSv dan akumulasi dosis 2.9 mSv) yaitu pemaparan radiasi dilakukan setiap 2
hari sekali selama 4 minggu dan (b) grup radiasi tinggi (dosis 0.2 mSv dan
akumulasi dosis 5.3 mSv) yaitu pemaparan radiasi dilakukan setiap 2 hari selama
8 minggu. Setelah pemaparan radiasi rendah dan tinggi dilakukan recovery (pemulihan) selama 4 minggu tanpa pemberian ekstrak rosela dan tanpa paparan
radiasi.Kelompok perlakuan dalam penelitian dapat dilihat pada Tabel 4. Mencit
dikelompokkan menjadi 4 kelompok perlakuan sebagai berikut:
1. Kelompok kontrol (K-): mencit diberi 0.2 ml NaCl fisiologis peroral setiap 2 hari selama 4 minggu untuk mencit subgrup 1 (n=6) dan selama 8 minggu
untuk mencit subgrup 2 (n=6).
2. Kelompok primer (K+): mencit diberi 0.2 ml NaCl fisiologis peroral dan radiasi berkas sinar utama dengan dosis 0.2 mSv setiap 2 hari selama 4 minggu
untuk mencit subgrup 1 (n=6) dan 8 minggu untuk mencit subgrup 2 (n=6)
3. Kelompok rosela (R-) : mencit diberi ekstrak rosela dengan dosis 50 mg/kg berat badan peroral setiap 2 hari selama 8 minggu untuk mencit subgrup 1
(n=6) dan selama 12 minggu untuk mencit subgrup 2 (n=6).
4. Kelompok rosela primer (R+): mencit diberi ekstrak rosela dengan dosis 50 mg/kg berat badan peroral setiap 2 hari dan radiasi berkas sinar utama dosis 0.2
mSv setiap 2 hari selama 8 minggu untuk mencit subgrup 1 (n=6) dan selama
12 minggu untuk mencit subgrup 2 (n=6) dengan waktu paparan ±1 detik.
Tabel 4 Kelompok perlakuan dalam penelitian
Kelompok n
Radiasi Total 2.9 mSv Radiasi Total 5.3 mSv Ra Minggu
ke-Keterangan: K- (pemberian dengan pemberian NaCl fisiologis 0.9% tanpa paparan radiasi); K+ (pemberian NaCl fisiologis 0.9% dengan paparan radiasi); R- (pemberian ekstrak rosela tanpa paparan radiasi); R+( pemberian ekstrak rosela dengan paparan radiasi); n (Jumlah mencit); Ra (Radiasi); Ro (Pemulihan selama 30 hari setelah perlakuan).
3.3.2 Pembuatan Ekstrak Rosela
Penelitian ini menggunakan kelopak rosela yang diperoleh dari petani rosela
di Dramaga, Bogor, Jawa Barat. Pembuatan ekstrak tanaman rosela meliputi
proses maserasi dan evaporasi. Maserasi adalah proses perendaman simplisia
menggunakan pelarut untuk memperoleh zak aktif dari simplisia tersebut. Proses
maserasi dilakukan menggunakan pelarut etanol 96%. Maserat yang telah
diperoleh dipisahkan kemudian di evaporasi. Evaporasi merupakan proses
pemekatan dengan cara menguapkan pelarut tanpa menjadi kering. Maserasi
dilakukan di Balai Penelitian Tanaman Obat dan Aromatik (Balitro) Cimanggu,
Bogor, dan evaporasi dilakukan di laboratorium Bioteknologi (Biotek) Fakultas
Perikanan IPB. Selanjutnya, dilakukan uji fitokimia yang dilakukan di Pusat Studi
Biofarmaka Bogor. Sebelum digunakan, ekstrak rosela diencerkan dengan
aquadest dengan komposisi 1.5 gram ekstrak dalam 200 ml aquadest, sehingga konsentrasi adalah 7.5 mg/ml. Dosis yang digunakan adalah 50 mg/kg/berat badan
3.3.3 Pemberian Ekstrak Rosela
Mencit yang diterapi dengan ekstrak rosela adalah mencit kelompok R+
(n=12) dan R- (n=12). Sebelum pemberian ekstrak rosela, mencit dipegang
terlebih dahulu secara manual mulai dari belakang telinga sampai dengan dorsal
punggung. Larutan ekstrak rosela diberikan dengan dosis 50 mg/kg berat badan
(Akindahunsi dan Olelaye 2003; Ali et al. 2005) dengan menggunakan sonde lambung. Sonde lambung digunakan secara hati-hati agar larutan ekstrak rosela
tidak masuk ke dalam saluran pernapasan. Pemberian ekstrak rosela dilakukan
setiap dua hari sebelum diradiasi dengan sinar-X seperti Gambar 7.
Gambar 7. Pencekokan NaCl fisiologis dan ekstrak etanol kelopak rosela pada mencit.
3.3.4 Paparan Radiasi Sinar-X
Mencit yang diradiasi sinar-X adalah mencit kelompok K+ dan R+. Setiap
kelompok (n=12) mencit ditempatkan di dalam kandang. Penyinaran dilakukan
dengan dosis 0.2 mSv/2hari dengan pengaturan kVp 80 dan mAs 12 dengan
waktu pemaparan ± 1 detik. Setiap kandang yang berisi mencit dipapari dengan
sinar-X dengan jarak dari berkas sinar utama ke target (dasar kandang mencit)
adalah 100 cm. Paparan sinar-X dilakukan setiap dua hari. Pemaparan dilakukan
di ruang Roentgen pada setiap kelompok K+ dan R+ secara bergantian.
3.3.5 Pengambilan dan Pemeriksaan Darah
Pengambilan darah pada daerah perifer dilakukan secara acak setiap
kelompok dan dilakukan pada minggu ke-0, 2, 4, 6, 8 dan 12 sebanyak 3 ekor
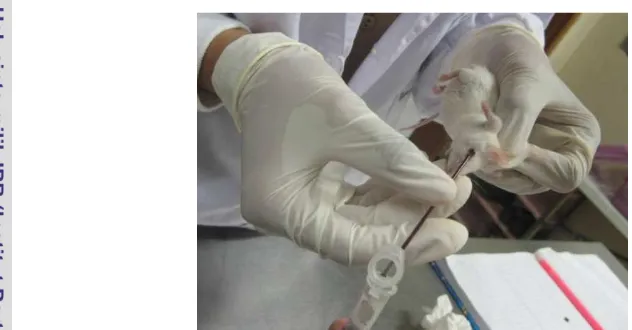
dibius dengan kombinasi ketamine 2 % dan xylazin 2 % dengan dosis masing masing 30 mg/kg berat badan dan 5 mg/kg berat badan secara intraperitoneal. Darah diambil melalui vena pada sinus retro orbitalis dengan menggunakan mikrokapiler hematokrit (Hrapkiewicz dan Medina 2007). Darah ditampung
dengan tabung Eppendorf yang telah ditetesi dengan EDTA sebanyak 0.05 ml seperti Gambar 8. Volume darah yang diambil adalah 0.5 ml. Darah tersebut
disimpan tidak lebih dari 24 jam (Thrall 2004).
Gambar 8 Pengambilan darah mencit melalui vena sinus retro orbitalis mata.
3.3.6 Penghitungan Jumlah Eritrosit
Penghitungan total eritrosit dilakukan dengan menggunakan hemositometer.
Darah dihisap dengan pipet eritrosit sampai batas 0.5 atau lebih. Kelebihannya
dihisap dengan kertas tisu. Bekas darah pada bagian luar pipet di hapus dengan
kertas tisu. larutan Hayem dihisap sampai batas angka 101. Pipet dikocok membentuk angka delapan selama 5-10 menit sampai larutan homogen. Sebanyak
2-3 tetes isi pipet eritrosit dibuang, kemudian ujung pipet ditempelkan pada cover glass pada kamar hitung Neubauer (Gambar 9) sampai semua bagian terisi oleh larutan darah (Thrall 2004). Sel darah merah dilihat dibawah mikroskop kemudian
dihitung dengan menggunakan rumus:
n x 10 x 5 x 200
n = jumlah sel yang terhitung pada ke-5 kotak
10 = tinggi kamar hitung (1/10 mm)
5 = luas kamar hitung (1/5 mm2)
Gambar 9 Kamar hitung neubauer. R adalah daerah untuk menghitung sel darah merah (Wahyura 2010).
3.3.7 Penghitungan Hemoglobin
Tabung hemometer diisi dengan larutan HCl 0.1 N sampai tanda 2. Darah
dihisap dengan pipet Sahli sampai tepat pada tanda 20 µl. Kelebihan darah yang melekat pada ujung luar pipet dihapus dengan kertas tisu secara hati-hati jangan
sampai darah dari dalam pipet berkurang. Darah tersebut dimasukkan ke dalam
tabung yang berisi larutan HCl tanpa menimbulkan gelembung udara kemudian
ditunggu sampai pembentukan asam hematin terjadi. Asam hematin yang
terbentuk diencerkan dengan aquadest setetes demi setetes sambil diaduk dengan pengaduk dari gelas sampai didapat warna yang sama dengan warna standar.
Miniskus dari larutan dibaca dan nilainya dinyatakan dalam g/dl (Thrall 2004).
3.3.8 Penghitungan Jumlah Hematokrit (PCV)
Darah diambil langsung dari vena sinus retro orbitalis mata dengan
menggunakan mikrohematokrit sampai terisi sekitar 2/3 bagian. Salah satu ujung
tabung ditutup dengan dempul (clay). Setelah itu mikrohematokrit disentrifus dengan kecepatan 15.000 rpm selama 5 menit. Tinggi kolom eritrosit pada
mikrohematokrit diukur dengan refractometry dan nilainya dinyatakan dalam persen (%) (Thrall 2004).
3.3.9 Penghitungan Howell Jolly bodies
Howell Jolly bodies dihitung dengan menggunakan sediaan ulas darah yang diwarnai dengan Giemsa. Darah yang keluar dari mikrohematokrit diteteskan pada
ke arah belakang dan dikeringkan di udara. Preparat yang sudah kering difiksasi
dengan metanol selama 3 sampai 5 menit dan dikeringkan di udara. Preparat
selanjutnya diwarnai dengan Giemsa 10% selama 30 menit. Preparat dibersihkan dari sisa Giemsa dengan air mengalir tidak lebih dari 30 detik, lalu dikeringkan di udara (Thrall 2004). Pemeriksaan Howell Jolly bodies dilakukan di bawah mikroskop cahaya dengan perbesaran 100 x lensa objektif dan 10 x lensa okuler
serta menggunakan lensa persegi dengan panjang total sisi 0.225 mm dan luasnya
0.050625mm2. Howell Jolly bodies yang terdapat dalam area ini dihitung pada 10 lapang pandang dengan metode zigzag dengan perhitungan (a/b) x (1/9) x (100%) (Noviana et al. 2004) seperti yang terlihat pada Gambar 10.
Gambar 10 Counter lens; a adalah jumlah semua Howell Jolly bodies yang ada pada kotak besar, b adalah semua sel yang ada pada kotak kecil.
Perhitungan perubahan persentase Howell Jolly bodies darah perifer mencit akibat pemaparan radiasi dan pemberian ekstrak rosela adalah sebagai berikut:
● Persentase Howell Jolly bodies akibat perlakuan = (b-a)/(b+a) x 100%
●Perubahan persentase Howell Jolly bodies setelah pemulihan 30 hari = (d-c)/(d+c) x 100%
Keterangan: a = persentase Howell Jolly bodies sebelum perlakuan b = persentase Howell Jolly bodies pada dosis radiasi tertentu c = persentase Howell Jolly bodies pada dosis x
d = persentase Howell Jolly bodies setelah recovery dosis x x = jumlah dosis paparan radiasi (mSv)
Formula perhitungan seperti di atas juga digunakan untuk perhitungan
persentase MCV, MCH dan MCHC pasca perlakuan dan pasca pemulihan selama
3.4 Analisis Data
Data yang diperoleh dianalisis secara statistik dengan ANOVA® post hoc Duncan Test menggunakan software Statistical Package for Social Sciences (SPSS)® versi 16 untuk Microsoft® Windows® untuk melihat perbedaan nyata
HASIL DAN PEMBAHASAN
4.1 MCV (Mean Corpuscular Volume)
Nilai MCV (Mean Corpuscular Volume) menunjukkan volume rata-rata dan ukuran eritrosit. Nilai normal termasuk ke dalam normositik, nilai di bawah
normal termasuk ke dalam mikrositik dan nilai di atas normal disebut makrositik
(Thrall 2004). Nilai MCV darah mencit berdasarkan kelompok perlakuan dan total
radiasi sebagaimana pada Tabel 5.
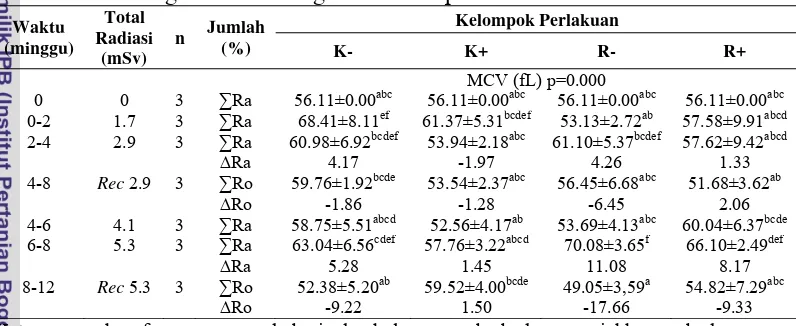
Tabel 5 Nilai MCV darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang dan setelah pemulihan selama 30 hari.
Waktu
Keterangan: huruf yang sama pada baris dan kolom yang berbeda menunjukkan perbedaan yang tidak nyata (p>0.05). K- = pemberian NaCl fisiologis 0.9% tanpa paparan radiasi; K+= pemberian NaCl fisiologis 0.9% dengan paparan radiasi; R-= pemberian ekstrak rosela tanpa paparan radiasi; R+ = pemberian ekstrak rosela dengan paparan radiasi; ∑Ra = nilai parameter setelah perlakuan; ∑Ro = nilai parameter setelah pemulihan; ∆Ro = perubahan setelah pemulihan; ∆Ra = perubahan setelah radiasi; n= jumlah mencit; Rec 2.9= masa pemulihan 2.9 mSv; Rec 5.3= masa pemulihan 5.3 mSv.
Nilai MCV pada semua kelompok perlakuan minggu ke-0 adalah normal,
namun pada kelompok R+ setelah menerima total radiasi 5.3 mSv pada minggu
ke-6 melebihi 61.5 fL sebagai ambang normal MCV (Thrall 2004; Raskin &
Wadrop 2010).
Radiasi total 2.9 mSv pada minggu ke-4 menyebabkan peningkatan nilai
MCV sebesar 53.94 fL pada kelompok K+ dan 57.62 fL pada kelompok R+.
Radiasi yang lebih besar pada minggu ke-8 dengan total radiasi 5.3 mSv
menyebabkan peningkatan 57.76 fL pada kelompok K+ dan 66.10 fL pada
40.00 Dosis Radiasi (mSv)
0 1.7 2.9 4.1 0 5.3 0 Dosis Radiasi (mSv)
2.9 5.3 Dosis Radiasi (mSv)
2‐4 6‐8
2.9 5.3
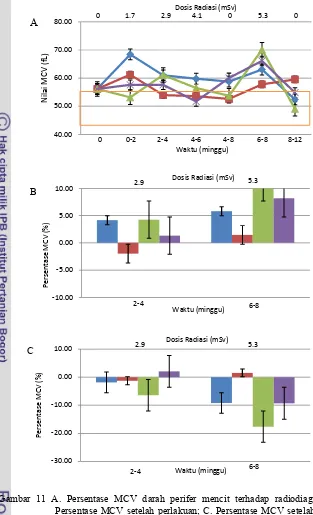
Gambar 11 A. Persentase MCV darah perifer mencit terhadap radiodiagnostik berulang; B. Persentase MCV setelah perlakuan; C. Persentase MCV setelah pemulihan 30 hari.
(K-) = pemberian NaCl fisiologis tanpa paparan radiasi; (K+) = pemberian NaCl fisiologis dengan paparan radiasi; (R-) = pemberian ekstrak rosela tanpa paparan radiasi; (R+) = pemberian ekstrak rosela dengan paparan radiasi; = nilai normal MCV 42.3-55.15 fL (Thrall 2004).
Nilai MCV kelompok R- dengan pemberian ekstrak rosela mengalami
peningkatan sebesar 61.10 fL, sedangkan pada kelompok K- mengalami
peningkatan sebesar 60.98 fL pada minggu ke-4 dibandingkan dengan nilai MCV
sebelum perlakuan. Nilai MCV pada minggu ke-8 mengalami peningkatan pada
A
kelompok R- hingga 66.10 fL, sedangkan pada kelompok K- hanya mengalami
peningkatan sebesar 63.04 fL.
Nilai MCV setelah masa pemulihan dari total radiasi 2.9 mSv menyebabkan
penurunan sebanyak 1.28 % pada kelompok K+ dan peningkatan 2.06 % pada
kelompok R+. Setelah pemulihan total radiasi 5.3 mSv menyebabkan penurunan
nilai MCV sebanyak 1.50 % pada kelompok K+ dan penurunan 9.33 % pada
kelompok R+. Hasil analisa secara statistik menunjukkan nilai MCV terhadap
kelompok perlakuan dan waktu berbeda nyata (p<0.05).
Paparan radiasi dosis total 2.9 mSv menyebabkan nilai MCV K+ menurun
dari sebelum perlakuan, akan tetapi nilai ini masih berada dalam kisaran normal
sedangkan nilai kelompok R+ meningkat dari sebelum perlakuan dan hal ini
melebihi kisaran nilai normal MCV (Gambar 11A). Total radiasi 5.3 mSv nilai
MCV pada kelompok K+ dan R+ mengalami peningkatan, namun nilai MCV
kelompok R+ melebihi kelompok K+, nilai ini melebihi kisaran normal
(42.3-55.15 fL). Setelah pumulihan 30 hari dari radiasi total 5.3 mSv nilai MCV
kelompok R+ dapat kembali normal akan tetapi nilai MCV kelompok K+ masih
berada di atas nilai normal. Hal ini menunjukkan bahwa ekstrak etanol rosela
dapat mengurangi kerusakan akibat radiasi ionisasi sinar-X.
Nilai MCV di atas normal pada kelompok K+ dan R+ disebut juga dengan
anemia makrositik. Hal ini terjadi karena hasil dari penghambatan sintesis DNA
dalam produksi sel darah merah. Ketika sintesis DNA terganggu, maka siklus sel
tidak dapat berkembang dari tahap pertumbuhan (G2) ke tahap mitosis (M)
(Rumsey et al. 2007). Hal ini menyebabkan pertumbuhan sel terus tanpa pembagian dan terlihat sebagai anemia makrositik. Dalam penelitian ini diduga
yang menyebabkan gangguan pada sintesis DNA adalah radiasi ionisasi. Cacat
dalam sintesis DNA sel darah merah paling sering disebabkan oleh
hypovitaminosis, khususnya kekurangan vitamin B12 dan atau asam folat (Aslinia
et al. 2006; Burgess 2012). Pada anemia makrositik biasanya sel darah merah yang belum matang di lepaskan oleh sumsum tulang ke sirkulasi untuk memenuhi
4.2 Mean Corpuscular Hemoglobin (MCH)
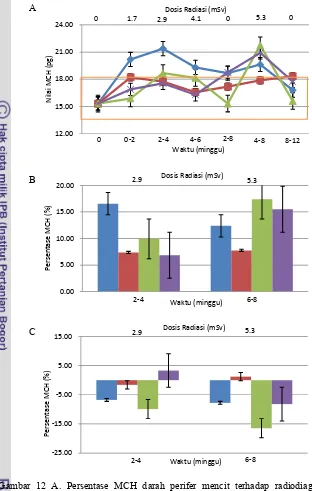
Nilai Mean Corpuscular Hemoglobin (MCH) menggambarkan rata-rata jumlah hemoglobin di dalam eritrosit. Nilai MCH pada semua kelompok pada
waktu pemulihan dan perlakuan radiasi yang berbeda menunjukkan hasil yang
fluktuatif dan masih berada pada rentang nilai normal yaitu 13.7-18.1 pg (Thrall
2004).
Setelah radiasi 2.9 mSv menyebabkan peningkatan sebesar 6.82 % pada
kelompok R+, sedangkan pada kelompok K+ mengalami peningkatan sebesar
7.36 %. Setelah radiasi yang lebih tinggi 5.3 mSv pada minggu ke-8
menyebabkan peningkatan nilai MCH sebanyak 7.75 % pada kelompok K+ dan
15.50 % pada kelompok R+.
Nilai MCH kelompok K+ menurun 1.60 % dan nilai MCH kelompok R+
mengalami peningkatan sebesar 3.30 % setelah masa pemulihan total radiasi 2.9
mSv. Namun setelah masa pemulihan 30 hari total radiasi 5.3 mSv nilai MCH
kelompok K+ meningkat 1.22 mSv sedangkan nilai MCH kelompok R+ terjadi
penurunan 8.21 % sebagaimana Tabel 6 dan Gambar 12.
Tabel 6 Nilai MCH darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang dan setelah pemulihan selama 30 hari.
Waktu
‐25.00 Dosis Radiasi (mSv)
2‐4 6‐8 Dosis Radiasi (mSv)
2‐4 6‐8
2.9 5.3
Gambar 12 A. Persentase MCH darah perifer mencit terhadap radiodiagnostik berulang; B. Persentase MCH setelah perlakuan; C. Persentase MCH setelah pemulihan 30 hari.
(K-) = pemberian NaCl fisiologis tanpa paparan radiasi; (K+) = pemberian NaCl fisiologis dengan paparan radiasi; (R-) = pemberian ekstrak rosela tanpa paparan radiasi; (R+) = pemberian ekstrak rosela dengan paparan radiasi; = nilai normal MCH 13.7-18.1 pg (Thrall 2004).
Setelah minggu ke-4 menyebabkan penurunan nilai MCH sebesar 6.67 %
pada kelompok K- dan 9.91 % pada kelompok R-. Pada minggu ke-8 nilai MCH
kelompok K- mengalami penurunan 7.77 % dan R- mengalami penurunan 16.45
% sebagaimana dalam Tabel 6 dan Gambar 12C. 12.00 Dosis Radiasi (mSv)
0 1.7 2.9 4.1 0 5.3 0
0 0‐2 2‐4 4‐6 2‐8 4‐8 8‐12
B
Nilai MCH berhubungan dengan kosentrasi hemoglobin dan jumlah sel
darah merah. Konsentasi hemoglobin di dalam darah dipengaruhi oleh volume
darah, jika volume berkurang akan menyebabkan berkurangnya hemoglobin.
Selain itu, gangguan penyerapan besi pada sistem pencernaan juga dapat
menyebabkan berkurangnya hemoglobin. Nilai MCH kelompok K+ dan R+
setelah radiasi total 2.9 mSv terlihat hampir sama, namun setelah radiasi total 5.3
mSv nilai MCH kelompok R+ lebih tinggi dari K+. Hal ini disebabkan oleh
kandungan antioksidan ekstrak etanol rosela yang dapat menetralkan kerusakan
akibat radiasi ionisasi. Penelitian yang dilakukan oleh Noviana et al. (2010) menunjukkan radiasi yang lebih rendah yaitu 0.2 mSv dari radiodiagnostik
berulang pada mencit tidak memberikan efek pada parameter sel darah merah.
Dosis mengindikasikan komponen darah mungkin mengalami kerusakan setelah
paparan sinar-X.
4.3 Mean Corpuscular Hemoglobin Concentration (MCHC)
Nilai Mean Corpuscular Hemoglobin Concentration (MCHC) merupakan nilai yang diperoleh dari nilai hemoglobin dan konsentrasi eritrosit. Nilai MCHC
menunjukkan konsentrasi hemoglobin di dalam 100 ml eritrosit. Hemoglobin
berperan dalam memelihara fungsi transpor oksigen dari paru-paru ke jaringan
tubuh. Zat besi merupakan zat yang dibutuhkan dalam pembentukan heme untuk
menyusun hemoglobin. Gangguan dalam penyerapan zat besi mengakibatkan
kurangnya unsur besi dalam peredaran darah sehingga menurunkan jumlah
hemoglobin (Kemuning 2010). Nilai MCHC mencit berdasarkan kelompok
perlakuan terhadap kelompok total radiasi dan fase pemulihan dapat dilihat pada
Tabel 7.
Nilai MCHC terhadap kelompok perlakuan dapat dilihat pada Gambar 13A.
Nilai MCHC setelah perlakuan pada minggu ke 4 yaitu K- 32.29%, K+ 30.91%,
R- 32.09% dan R+ 31.59%. Nilai ini berada dalam kisaran normal (Thrall 2004).
Begitu juga pada minggu ke-8, nilai MCHC pada kelompok K- 32.40 %,
kelompok K+ 30.82 %, kelompok R- 31.73 %, dan R+ 32.48 %.
Radiasi 2.9 mSv pada minggu ke-4 menyebabkan peningkatan nilai MCHC
nilai sebelum perlakuan. Radiasi yang lebih besar pada minggu ke-8 yaitu total
radiasi 5.3 mSv menyebabkan peningkatan nilai MCHC sebesar 6.35% pada
kelompok K+ dan peningkatan 7.45% pada kelompok R+ sebagaimana pada
Tabel 7 dan Gambar 13B.
Tabel 7 Nilai MCHC darah perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang dan setelah pemulihan selama 30 hari.
Waktu
Keterangan: huruf yang sama pada baris dan kolom yang berbeda menunjukkan perbedaan yang tidak nyata (p>0.05). K- = pemberian NaCl fisiologis 0.9% tanpa paparan radiasi; K+ = pemberian NaCl fisiologis 0.9% dengan paparan radiasi; R- = pemberian ekstrak rosela tanpa paparan radiasi; R+ = pemberian ekstrak rosela dengan paparan radiasi; ∑Ra = nilai parameter setelah perlakuan; ∑Ro = nilai parameter setelah pemulihan; ∆Ro = perubahan setelah pemulihan; ∆Ra = perubahan setelah radiasi; n= jumlah mencit; Rec 2.9= masa pemulihan 2.9 mSv; Rec 5.3= masa pemulihan 5.3 mSv.
Nilai MCHC kelompok R- dengan pemberian ekstrak rosela mengalami
peningkatan 5.62% dan pada kelompok K- mengalami peningkatan sebesar
12.16% pada minggu 4 dari nilai sebelum perlakuan. Nilai MCHC minggu
ke-8 mengalami peningkatan 6.64% pada kelompok K- dan pada kelompok R-
mengalami peningkatan 6.41%.
Nilai MCHC setelah masa pemulihan dari radiasi total 2.9 mSv
menyebabkan penurunan sebesar 0.28% pada kelompok K+ dan peningkatan
0.44% pada kelompok R+. Pemulihan setelah radiasi yang lebih tinggi radiasi
total 5.3 mSv menyebabkan penurunan nilai MCHC sebesar 0.26% pada
kelompok K+ dan kenaikan 1.23% pada kelompok R+.
Nilai MCHC setelah minggu ke-4 mengalami penurunan 3.39% pada
kelompok R-, sedangkan pada kelompok K- mengalami penurunan sebesar 4.50%
dari nilai sebelum perlakuan. Setelah pemulihan pada minggu 8 nilai MCHC
24.00 Dosis Radiasi (mSv)
2.9 0 5.3 0 Dosis Radiasi (mSv)
2‐4 6‐8 Dosis Radiasi (mSv)
2‐4 6‐8
2.9 5.3
mengalami peningkatan sebesar 1.14% sebagaimana dalam Tabel 7 dan Gambar
13C. Nilai MCHC terhadap kelompok perlakuan dan waktu berbeda nyata
(p<0.05).
Gambar 13 A. Persentase MCHC darah perifer mencit terhadap radiodiagnostik berulang; B. Persentase MCHC setelah radiasi; C. Persentase MCHC setelah pemulihan 30 hari. (K-) = pemberian NaCl fisiologis tanpa paparan radiasi; (K+) = pemberian NaCl fisiologis dengan paparan radiasi; (R-) = pemberian ekstrak rosela tanpa paparan radiasi; (R+) = pemberian ekstrak rosela dengan paparan radiasi; = nilai normal MCHC 29.5-35.6% (Thrall 2004).
Nilai MCHC selama perlakuan berada dalam kisaran yang normal.
Penurunan nilai MCHC tampak jelas terlihat pada kelompok R- yang diterapi
dengan ekstrak rosela pada minggu ke 8 (Gambar 13A). Penyebab penurunan
A
B
C
jumlah MCHC setelah masa pemulihan belum diketahui secara pasti,
kemungkinan terjadi gangguan penyerapan zat besi pada mencit atau ada zat pada
rosela yang dapat menyebabkan terjadinya gangguan penyerapan sehingga jumlah
MCHC menurun. Penurunan nilai MCHC menunjukkan penurunan konsentrasi
hemoglobin dan di dalam sintesis hemoglobin diperlukan zat besi (Weiss dan
Wardrop 2010). Zat besi nonheme dalam tumbuhan tidak mudah diserap oleh usus
karena tumbuhan mengandung oksalat, fitat, tanin, dan senyawa fenolik lainnya.
Senyawa tersebut akan membentuk kelat atau presipitat dengan besi yang tidak
dapat larut sehingga mencegah proses penyerapan nutrisi. Kandungan tannin pada
rosela dapat mengikat zat besi sehingga penyerapan zat besi terganggu (Besral et al. 2007), namun kandungan vitamin C (asam askorbat) pada rosela dapat meningkatkan jumlah penyerapan zat besi nonheme dari saluran cerna (Kasiyati
2007).
Menurut Macfarlane et al. (2000) efek anemia karena kekurangan hemoglobin akan berakibat pada hipoxia jaringan dan beberapa perubahan pada
sirkulasi, biokimia, dan sumsum tulang. Pada sirkulasi terjadi peningkatan laju
jantung dan dilatasi arteriol. Perubahan secara biokimia terjadi peningkatan 2.3
diphosphoglycerate (DPG) pada sel darah merah, hemoglobin pada sirkulasi perifer berkurang. Pada sumsum tulang terjadi hyperplasia karena terjadi produksi
eritrosit yang meningkat untuk memenuhi kebutuhan jaringan akan sel darah
merah.
4.4 Howell Jolly Bodies
Nilai rata rata persentase Howell Jolly bodies sel darah merah perifer mencit kelompok perlakuan dapat dilihat pada Tabel 8. Total radiasi 2.9 mSv pada
minggu ke-4 menyebabkan munculnya Howell Jolly bodies sebesar 0.10% pada kelompok K+ sedangkan pada kelompok R+ tidak terlihat Howell Jolly bodies yang muncul. Hal ini juga terlihat pada total radiasi 5.3 mSv minggu ke-8 pada
kelompok K+ sebesar 0.13% namun pada kelompok R+ juga tidak terlihat adanya
‐0.07 Dosis Radiasi (mSv)
0 0‐2 2‐4 4‐6 4‐8 6‐8 8‐12
0 1.7 2.9 4.1 0 5.3 0
Tabel 8 Nilai Howell Jolly bodies perifer mencit pada setiap kelompok total radiasi radiodiagnostik berulang dan setelah pemulihan selama 30 hari.
Waktu
Keterangan: huruf yang sama pada baris dan kolom yang berbeda menunjukkan perbedaan yang tidak nyata (p>0.05). K- = pemberian NaCl fisiologis 0.9% tanpa paparan radiasi; K+ = pemberian NaCl fisiologis 0.9% dengan paparan radiasi; R- = pemberian ekstrak rosela tanpa paparan radiasi; R+ = pemberian ekstrak rosela dengan paparan radiasi; ∑Ra = nilai parameter setelah perlakuan; ∑Ro = nilai parameter setelah pemulihan; ∆Ro = perubahan setelah pemulihan; ∆Ra = perubahan setelah radiasi; n= jumlah mencit; Rec 2.9= masa pemulihan 2.9 mSv; Rec 5.3= masa pemulihan 5.3 mSv.
Setelah masa pemulihan dari radiasi 2.9 mSv menyebabkan penurunan
persentase Howell Jolly bodies sebesar 39.60% pada kelompok K+, sedangkan pada kelompok R+ mengalami peningkatan sebesar 100%. Pemulihan setelah
radiasi yang lebih tinggi 5.3 mSv menyebabkan penurunan persentase Howell Jolly bodies sebanyak 15.82% pada kelompok K+ dan peningkatan 100% pada kelompok R+. Persentase Howell Jolly bodies setelah masa pemulihan minggu ke-4 dan minggu ke-8 tidak mengalami peningkatan ataupun penurunan baik pada
kelompok K- dan R- sebagaimana dalam Tabel 8 dan Gambar 14C. Nilai Howell Jolly bodies terhadap kelompok perlakuan dan waktu berbeda nyata (p<0.05).