INHIBISI AKTIVITAS INVERTASE PADA SUKROSA
DENGAN MENGGUNAKAN TEMBAGA SULFAT (CuSO
4)
Oleh
RHENI HAFIDIANA F34102016
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
2
Inhibisi Aktivitas Invertase pada Sukrosa dengan Menggunakan
Tembaga Sulfat (CuSO
4)
Ringkasan
Sukrosa (glucose-1,2 fructose) merupakan pemanis yang banyak dikonsumsi dalam kehidupan manusia. Gula biasanya diartikan sebagai sukrosa untuk penggunaan komersial. Sumber sukrosa umumnya didapatkan dari nira, seperti nira tebu, nira kelapa, nira siwalan maupun dari bit. Kandungan sukrosa dalam masing-masing nira tersebut berbeda, yaitu nira tebu mengandung 14 - 20% sukrosa, nira kelapa mengandung 15 - 20% sukrosa dan nira siwalan mengandung 10 - 15% sukrosa.
Degradasi sukrosa merupakan hal yang harus dihindari pada industri gula karena mempersulit proses kristalisasi. Hal ini disebabkan oleh hidrolisis sukrosa menjadi gula invert, disebut juga gula pereduksi (glukosa dan fruktosa) atau senyawa turunan lainnya pada produk-produk gula seperti sukrosa, merupakan penyebab menurunnya kualitas produk tersebut. Inhibisi aktivitas enzim telah dilakukan dengan mengkombinasikan suhu dan tekanan tinggi, namun mempengaruhi kualitas produk. Aktivitas enzim dipengaruhi oleh suhu, pH, konsentrasi enzim konsentrasi substrat, serta adanya inhibitor. Inhibitor dapat berupa bahan alami, seperti kentang, tomat dan tembakau. Akan tetapi, selain mengandung inhibitor, bahan tersebut masih mengandung bahan lain, sehingga perlu pemurnian. Kation Cu (II) dalam bentuk garam logam CuCl2 talah diteliti
dapat menghambat aktivitas invertase. Terdapat garam Cu (II) lainnya, yaitu CuSO4. Aktivitas invertase dengan penambahan garam logam CuSO4 pada
kondisi konsentrasi, konsentrasi substrat, pH, suhu dan lama pemanasan yang berbeda perlu diteliti, sehingga diketahui kemampuan inhibisi garam logam tersebut. Selain itu, dapat diketahui model kinetika inhibisi yang penting untuk keperluan rekayasa proses.
Tujuan dari penelitian ini adalah untuk menentukan hubungan perubahan pH, konsentrasi substrat, konsentrasi enzim, suhu inkubasi dan lama pemanasan dengan adanya penambahan CuSO4 terhadap degradasi sukrosa. Penelitian ini
juga bertujuan untuk menentukan parameter kinetika laju degradasi (KM dan
Vmaks) sukrosa dengan adanya penambahan CuSO4. Keseluruhan pengujian
menggunakan metode pengukuran gula pereduksi yang dihasilkan akibat hidrolisis sukrosa menggunakan DNS (dinitro salicylic acid). Pengaruh perubahan faktor pada setiap taraf ditentukan dengan menggunakan analisis sidik ragam (Anova) dan uji lanjut Duncan. Model dan parameter kinetika inhibisi yang paling sesuai ditentukan dengan menggunakan software SigmaPlot.
Inhibisi oleh CuSO4 terhadap invertase dipengaruhi oleh perubahan
konsentrasi substrat, konsentrasi enzim, pH, suhu dan lama pemanasan. Pada rasio konsentrasi invertase terhadap sukrosa 1 : 5000 dan pH larutan invertase 4.5, CuSO4 0.75-1.25 mM berperan sebagai aktivator invertase, sedangkan mulai
konsentrasi 2.5 mM berperan sebagai inhibitor. Konsentrasi CuSO4 0.125 mM
pH 3 dan pH 7 ke atas serta turun signifikan hingga 20 detik pemanasan. Inhibisi oleh CuSO4 0.125 mM terjadi pada lama pemanasan 0 – 10 detik.
Kinetika inhibisi laju degradasi sukrosa oleh CuSO4 yang dilakukan pada
pH 7 dengan tiga titik suhu (40°C, 50°C, 60°C) menghasilkan nilai KM dan Vmaks
yang berbeda. Kecepatan reaksi meningkat dengan kenaikan suhu. Model kinetika inhibisi invertase oleh CuSO4 berbeda pada setiap suhu yang diujikan. Model
inhibisi oleh CuSO4 pada suhu 40°C adalah mixed (partial), dengan nilai KM 8.6
g/l, Vmaks 288.4 µM/menit turun menjadi 64.1 µM/menit, Ki 0.5817 mM, α 75.1, β
3.1. Model inhibisi oleh CuSO4 pada suhu 50°C juga mixed (partial) dengan nilai
KM 21.1 g/l, Vmaks 356.6 µM/menit turun menjadi 69.02 µM/menit, Ki 2.873e-9
mM, α 1201.3, β 232.5. Model inhibisi pada suhu 60°C bersifat kompetitif (full), dengan nilai KM 3555e+6 g/l naik menjadi 4.622e+6 g/l, Vmaks 1.732e+7
4
Inhibition on Invertase Activity in Sucrose Using
Copper Sulphate (CuSO
4)
Summary
Sucrose (glucose-1,2 fructose) is the most commonly used as sweetener for human consumption. In commercial usage, the term “sugar” usually refers to sucrose. There are a number of sugar’s sources, such as sugarcane, coconut-palm juice, fan-palm juice and sugar beets which content of sucrose are different. Sugarcane contains 14-20% sucrose, coconut-palm juice contains 15-20% sucrose, while 10-15% in fan-palm juice.
Sucrose is widely used in industry for various purpose, but the degradation of sucrose is easily occured. Sucrose is converted into invert sugar, called reducing sugar or other derived compounds in many sugar products can cause decreasing quality of sugar. Enzyme inhibition is done by combining the temperature and high pressure, but it’s influence the quality of the product. Enzyme activity was influenced by temperature, pH value, enzyme concentration, substrate concentration, and presence of inhibitors. Inhibitors can be found natural sources, such as potato, tomato, and tobacco. Besides containing inhibitor, they still contain other ingredients, therefore purification is needed. Cu (II) cation as CuCl2 metal salt is known as element which can inhibit the activity of invertase.
There are another Cu (II) as metal salt, it is CuSO4. The activity of invertase with
addition of CuSO4 in different enzyme concentration, substrate concentration, pH,
temperature and heat treatment should be learn, in order to recognize the inhibition capability of CuSO4. Besides that, the inhibition kinetic model can be
figured out, which is needed for process engineering.
The objective of this research is to obtain the influence of substrate concentration, enzyme concentration, pH value, incubation temperature and heat treatment with present of CuSO4 concerning to sucrose degradation. Besides that,
it was also to determine the inhibition kinetic parameter (KM and Vmaks) of the rate
of sucrose degradation with addition of CuSO4. The whole research uses the
reducing sugar measurement method, as a result of sucrose hydrolisis using DNS (dinitro salicylic acid). The influence of factor’s changes in each level are determined by using analysis of variance (ANOVA) and Duncan test. The most suitable model and parameter of inhibition kinetic is determined by using SigmaPlot software.
CuSO4 concentration, substrate concentration, enzyme concentration, pH
value, incubation temperature and heat treatment affect inhibition by CuSO4. At
the ratio of invertase to sucrose is 1 : 5000, CuSO4 0.75 - 1.25 mM can be used as
an invertase activator, while as invertase inhibitor with the minimum concentration 2.5 mM. CuSO4 0.125 mM give maximum inhibition (95.1%) at
The kinetic inhibition of of sucrose degradation rate by CuSO4 0.125 mM
done at pH 7 with three temperature treatment (40°C, 50°C, 60°C) make KM and
Vmaks value are vary. The reaction rate of it increases as well as the temperature.
The inhibition kinetics model of invertase is different in each temperature. It is mixed (partial) when the temperature at 40°C. KM 8.6 g/l, Vmaks 288.4 µM/min
decrease to 64.1 µM/min, Ki 0.5817 mM, α 75.1, β 3.1. The inhibition kinetic model when the temperature at 50°C was also mixed (partial). KM 21.1 g/l, Vmaks
356.6 µM/menit decrease to 69.02 µM/menit, Ki 2.873e-9 mM, α 1201.3, β 232.5, while competitive (full) at 60°C with KM 3555e+6 g/l increase to 4.622e+6 g/l,
6
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul “Inhibisi
Aktivitas Invertase pada Sukrosa dengan Menggunakan Tembaga Sulfat (CuSO4)”
adalah hasil karya saya sendiri dengan arahan dosen Pembimbing Akademik,
kecuali yang dengan jelas ditunjukkan rujukannya.
Bogor, 31 Agustus 2006
Yang membuat pernyataan,
INHIBISI AKTIVITAS INVERTASE PADA SUKROSA
DENGAN MENGGUNAKAN TEMBAGA SULFAT (CuSO
4)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen TEKNOLOGI INDUSTRI PERTANIAN
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
RHENI HAFIDIANA F34102016
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
8
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
INHIBISI AKTIVITAS INVERTASE PADA SUKROSA DENGAN MENGGUNAKAN TEMBAGA SULFAT (CuSO4)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen TEKNOLOGI INDUSTRI PERTANIAN
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
RHENI HAFIDIANA F34102016
Dilahirkan pada tanggal 18 Juni 1984
di Boyolali
Tanggal lulus : 24 Agustus 2006
Menyetujui,
Bogor, September 2006
RIWAYAT HIDUP
Penulis dilahirkan di Boyolali pada tanggal 18 Juni
1984. Penulis adalah anak ketiga dari empat bersaudara
dari pasangan Widodo (Alm) dan Muslichah. Pada
tahun 1996, penulis menyelesaikan pendidikan sekolah dasar
di SDN 3 Boyolali. Penulis menyelesaikan pendidikan
sekolah menengah di SLTPN 1 Boyolali pada tahun 1999.
Kemudian penulis melanjutkan pendidikan di SMUN 1 Boyolali dan lulus pada
tahun 2002.
Penulis melanjutkan pendidikan di Perguruan Tinggi Negeri, Institut
Pertanian Bogor tahun 2002 melalui jalur USMI (Undangan Seleksi Masuk IPB)
di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.
Selama kuliah di IPB, penulis pernah menjadi asisten praktikum pada mata kuliah
Laboratorium Lingkungan periode 2005/2006 dan Teknologi Minyak Atsiri dan
Kosmetika periode 2005/2006.
Penulis melaksanakan praktek lapang pada tahun 2005 dengan topik
“Penerapan Aspek Pengawasan Mutu pada Proses Produksi Biskuit Bayi di PT.
Arnott’s Indonesia-Bekasi, Jawa Barat”. Untuk menyelesaikan tugas akhir ini,
penulis melakukan penelitian yang dituangkan dalam skripsi berjudul ”Inhibisi
Aktivitas Invertase pada Sukrosa dengan Menggunakan Tembaga Sulfat
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah
memberikan berkat, rahmat, dan hidayah serta kemudahan sehingga penulis dapat
menyelesaikan skripsi ini. Skripsi ini dibuat sebagai salah satu syarat untuk
memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Teknologi
Industri Pertanian, Fakultas Teknologi Pertanian.
Pada kesempatan ini penulis ingin mengucapkan terimakasih kepada:
1. Prayoga Suryadarma, STP, MT selaku dosen pembimbing akademik yang
telah banyak memberikan arahan dan bimbingan , pada saat penelitian dan
dalam penyusunan skripsi ini.
2. Dr. Ir. Erliza Noor selaku dosen penguji atas masukannya untuk
penyempurnaan skripsi ini.
3. Drs. Purwoko, MSi selaku dosen penguji atas masukannya untuk
penyempurnaan skripsi ini.
4. Ibu, kakak dan saudara kembarku yang selalu memberikan dukungan,
semangat dan doa.
5. Teman sebimbingan (Rian, Annisa, Mba Fitri, dan Pak Ikhsan) atas
bantuan dan kebersamaannya.
6. Teman-teman TIN 39 dan semua pihak yang telah memberikan bantuan
kepada penulis baik selama penelitian maupun semenjak menjadi
mahasiswa TIN yang tidak dapat disebutkan satu per satu.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari
sempurna. Oleh karena itu penulis mengharapkan kritik dan saran yang dapat
membangun dan bermanfaat demi perbaikan skripsi ini. Semoga skripsi ini
memberikan manfaat bagi pembaca.
Bogor, Agustus 2006
INHIBISI AKTIVITAS INVERTASE PADA SUKROSA
DENGAN MENGGUNAKAN TEMBAGA SULFAT (CuSO
4)
Oleh
RHENI HAFIDIANA F34102016
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
2
Inhibisi Aktivitas Invertase pada Sukrosa dengan Menggunakan
Tembaga Sulfat (CuSO
4)
Ringkasan
Sukrosa (glucose-1,2 fructose) merupakan pemanis yang banyak dikonsumsi dalam kehidupan manusia. Gula biasanya diartikan sebagai sukrosa untuk penggunaan komersial. Sumber sukrosa umumnya didapatkan dari nira, seperti nira tebu, nira kelapa, nira siwalan maupun dari bit. Kandungan sukrosa dalam masing-masing nira tersebut berbeda, yaitu nira tebu mengandung 14 - 20% sukrosa, nira kelapa mengandung 15 - 20% sukrosa dan nira siwalan mengandung 10 - 15% sukrosa.
Degradasi sukrosa merupakan hal yang harus dihindari pada industri gula karena mempersulit proses kristalisasi. Hal ini disebabkan oleh hidrolisis sukrosa menjadi gula invert, disebut juga gula pereduksi (glukosa dan fruktosa) atau senyawa turunan lainnya pada produk-produk gula seperti sukrosa, merupakan penyebab menurunnya kualitas produk tersebut. Inhibisi aktivitas enzim telah dilakukan dengan mengkombinasikan suhu dan tekanan tinggi, namun mempengaruhi kualitas produk. Aktivitas enzim dipengaruhi oleh suhu, pH, konsentrasi enzim konsentrasi substrat, serta adanya inhibitor. Inhibitor dapat berupa bahan alami, seperti kentang, tomat dan tembakau. Akan tetapi, selain mengandung inhibitor, bahan tersebut masih mengandung bahan lain, sehingga perlu pemurnian. Kation Cu (II) dalam bentuk garam logam CuCl2 talah diteliti
dapat menghambat aktivitas invertase. Terdapat garam Cu (II) lainnya, yaitu CuSO4. Aktivitas invertase dengan penambahan garam logam CuSO4 pada
kondisi konsentrasi, konsentrasi substrat, pH, suhu dan lama pemanasan yang berbeda perlu diteliti, sehingga diketahui kemampuan inhibisi garam logam tersebut. Selain itu, dapat diketahui model kinetika inhibisi yang penting untuk keperluan rekayasa proses.
Tujuan dari penelitian ini adalah untuk menentukan hubungan perubahan pH, konsentrasi substrat, konsentrasi enzim, suhu inkubasi dan lama pemanasan dengan adanya penambahan CuSO4 terhadap degradasi sukrosa. Penelitian ini
juga bertujuan untuk menentukan parameter kinetika laju degradasi (KM dan
Vmaks) sukrosa dengan adanya penambahan CuSO4. Keseluruhan pengujian
menggunakan metode pengukuran gula pereduksi yang dihasilkan akibat hidrolisis sukrosa menggunakan DNS (dinitro salicylic acid). Pengaruh perubahan faktor pada setiap taraf ditentukan dengan menggunakan analisis sidik ragam (Anova) dan uji lanjut Duncan. Model dan parameter kinetika inhibisi yang paling sesuai ditentukan dengan menggunakan software SigmaPlot.
Inhibisi oleh CuSO4 terhadap invertase dipengaruhi oleh perubahan
konsentrasi substrat, konsentrasi enzim, pH, suhu dan lama pemanasan. Pada rasio konsentrasi invertase terhadap sukrosa 1 : 5000 dan pH larutan invertase 4.5, CuSO4 0.75-1.25 mM berperan sebagai aktivator invertase, sedangkan mulai
konsentrasi 2.5 mM berperan sebagai inhibitor. Konsentrasi CuSO4 0.125 mM
pH 3 dan pH 7 ke atas serta turun signifikan hingga 20 detik pemanasan. Inhibisi oleh CuSO4 0.125 mM terjadi pada lama pemanasan 0 – 10 detik.
Kinetika inhibisi laju degradasi sukrosa oleh CuSO4 yang dilakukan pada
pH 7 dengan tiga titik suhu (40°C, 50°C, 60°C) menghasilkan nilai KM dan Vmaks
yang berbeda. Kecepatan reaksi meningkat dengan kenaikan suhu. Model kinetika inhibisi invertase oleh CuSO4 berbeda pada setiap suhu yang diujikan. Model
inhibisi oleh CuSO4 pada suhu 40°C adalah mixed (partial), dengan nilai KM 8.6
g/l, Vmaks 288.4 µM/menit turun menjadi 64.1 µM/menit, Ki 0.5817 mM, α 75.1, β
3.1. Model inhibisi oleh CuSO4 pada suhu 50°C juga mixed (partial) dengan nilai
KM 21.1 g/l, Vmaks 356.6 µM/menit turun menjadi 69.02 µM/menit, Ki 2.873e-9
mM, α 1201.3, β 232.5. Model inhibisi pada suhu 60°C bersifat kompetitif (full), dengan nilai KM 3555e+6 g/l naik menjadi 4.622e+6 g/l, Vmaks 1.732e+7
4
Inhibition on Invertase Activity in Sucrose Using
Copper Sulphate (CuSO
4)
Summary
Sucrose (glucose-1,2 fructose) is the most commonly used as sweetener for human consumption. In commercial usage, the term “sugar” usually refers to sucrose. There are a number of sugar’s sources, such as sugarcane, coconut-palm juice, fan-palm juice and sugar beets which content of sucrose are different. Sugarcane contains 14-20% sucrose, coconut-palm juice contains 15-20% sucrose, while 10-15% in fan-palm juice.
Sucrose is widely used in industry for various purpose, but the degradation of sucrose is easily occured. Sucrose is converted into invert sugar, called reducing sugar or other derived compounds in many sugar products can cause decreasing quality of sugar. Enzyme inhibition is done by combining the temperature and high pressure, but it’s influence the quality of the product. Enzyme activity was influenced by temperature, pH value, enzyme concentration, substrate concentration, and presence of inhibitors. Inhibitors can be found natural sources, such as potato, tomato, and tobacco. Besides containing inhibitor, they still contain other ingredients, therefore purification is needed. Cu (II) cation as CuCl2 metal salt is known as element which can inhibit the activity of invertase.
There are another Cu (II) as metal salt, it is CuSO4. The activity of invertase with
addition of CuSO4 in different enzyme concentration, substrate concentration, pH,
temperature and heat treatment should be learn, in order to recognize the inhibition capability of CuSO4. Besides that, the inhibition kinetic model can be
figured out, which is needed for process engineering.
The objective of this research is to obtain the influence of substrate concentration, enzyme concentration, pH value, incubation temperature and heat treatment with present of CuSO4 concerning to sucrose degradation. Besides that,
it was also to determine the inhibition kinetic parameter (KM and Vmaks) of the rate
of sucrose degradation with addition of CuSO4. The whole research uses the
reducing sugar measurement method, as a result of sucrose hydrolisis using DNS (dinitro salicylic acid). The influence of factor’s changes in each level are determined by using analysis of variance (ANOVA) and Duncan test. The most suitable model and parameter of inhibition kinetic is determined by using SigmaPlot software.
CuSO4 concentration, substrate concentration, enzyme concentration, pH
value, incubation temperature and heat treatment affect inhibition by CuSO4. At
the ratio of invertase to sucrose is 1 : 5000, CuSO4 0.75 - 1.25 mM can be used as
an invertase activator, while as invertase inhibitor with the minimum concentration 2.5 mM. CuSO4 0.125 mM give maximum inhibition (95.1%) at
The kinetic inhibition of of sucrose degradation rate by CuSO4 0.125 mM
done at pH 7 with three temperature treatment (40°C, 50°C, 60°C) make KM and
Vmaks value are vary. The reaction rate of it increases as well as the temperature.
The inhibition kinetics model of invertase is different in each temperature. It is mixed (partial) when the temperature at 40°C. KM 8.6 g/l, Vmaks 288.4 µM/min
decrease to 64.1 µM/min, Ki 0.5817 mM, α 75.1, β 3.1. The inhibition kinetic model when the temperature at 50°C was also mixed (partial). KM 21.1 g/l, Vmaks
356.6 µM/menit decrease to 69.02 µM/menit, Ki 2.873e-9 mM, α 1201.3, β 232.5, while competitive (full) at 60°C with KM 3555e+6 g/l increase to 4.622e+6 g/l,
6
SURAT PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul “Inhibisi
Aktivitas Invertase pada Sukrosa dengan Menggunakan Tembaga Sulfat (CuSO4)”
adalah hasil karya saya sendiri dengan arahan dosen Pembimbing Akademik,
kecuali yang dengan jelas ditunjukkan rujukannya.
Bogor, 31 Agustus 2006
Yang membuat pernyataan,
INHIBISI AKTIVITAS INVERTASE PADA SUKROSA
DENGAN MENGGUNAKAN TEMBAGA SULFAT (CuSO
4)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen TEKNOLOGI INDUSTRI PERTANIAN
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
RHENI HAFIDIANA F34102016
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
8
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
INHIBISI AKTIVITAS INVERTASE PADA SUKROSA DENGAN MENGGUNAKAN TEMBAGA SULFAT (CuSO4)
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar
SARJANA TEKNOLOGI PERTANIAN
Pada Departemen TEKNOLOGI INDUSTRI PERTANIAN
Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Oleh
RHENI HAFIDIANA F34102016
Dilahirkan pada tanggal 18 Juni 1984
di Boyolali
Tanggal lulus : 24 Agustus 2006
Menyetujui,
Bogor, September 2006
RIWAYAT HIDUP
Penulis dilahirkan di Boyolali pada tanggal 18 Juni
1984. Penulis adalah anak ketiga dari empat bersaudara
dari pasangan Widodo (Alm) dan Muslichah. Pada
tahun 1996, penulis menyelesaikan pendidikan sekolah dasar
di SDN 3 Boyolali. Penulis menyelesaikan pendidikan
sekolah menengah di SLTPN 1 Boyolali pada tahun 1999.
Kemudian penulis melanjutkan pendidikan di SMUN 1 Boyolali dan lulus pada
tahun 2002.
Penulis melanjutkan pendidikan di Perguruan Tinggi Negeri, Institut
Pertanian Bogor tahun 2002 melalui jalur USMI (Undangan Seleksi Masuk IPB)
di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian.
Selama kuliah di IPB, penulis pernah menjadi asisten praktikum pada mata kuliah
Laboratorium Lingkungan periode 2005/2006 dan Teknologi Minyak Atsiri dan
Kosmetika periode 2005/2006.
Penulis melaksanakan praktek lapang pada tahun 2005 dengan topik
“Penerapan Aspek Pengawasan Mutu pada Proses Produksi Biskuit Bayi di PT.
Arnott’s Indonesia-Bekasi, Jawa Barat”. Untuk menyelesaikan tugas akhir ini,
penulis melakukan penelitian yang dituangkan dalam skripsi berjudul ”Inhibisi
Aktivitas Invertase pada Sukrosa dengan Menggunakan Tembaga Sulfat
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah
memberikan berkat, rahmat, dan hidayah serta kemudahan sehingga penulis dapat
menyelesaikan skripsi ini. Skripsi ini dibuat sebagai salah satu syarat untuk
memperoleh gelar Sarjana Teknologi Pertanian pada Departemen Teknologi
Industri Pertanian, Fakultas Teknologi Pertanian.
Pada kesempatan ini penulis ingin mengucapkan terimakasih kepada:
1. Prayoga Suryadarma, STP, MT selaku dosen pembimbing akademik yang
telah banyak memberikan arahan dan bimbingan , pada saat penelitian dan
dalam penyusunan skripsi ini.
2. Dr. Ir. Erliza Noor selaku dosen penguji atas masukannya untuk
penyempurnaan skripsi ini.
3. Drs. Purwoko, MSi selaku dosen penguji atas masukannya untuk
penyempurnaan skripsi ini.
4. Ibu, kakak dan saudara kembarku yang selalu memberikan dukungan,
semangat dan doa.
5. Teman sebimbingan (Rian, Annisa, Mba Fitri, dan Pak Ikhsan) atas
bantuan dan kebersamaannya.
6. Teman-teman TIN 39 dan semua pihak yang telah memberikan bantuan
kepada penulis baik selama penelitian maupun semenjak menjadi
mahasiswa TIN yang tidak dapat disebutkan satu per satu.
Penulis menyadari bahwa dalam penulisan skripsi ini masih jauh dari
sempurna. Oleh karena itu penulis mengharapkan kritik dan saran yang dapat
membangun dan bermanfaat demi perbaikan skripsi ini. Semoga skripsi ini
memberikan manfaat bagi pembaca.
Bogor, Agustus 2006
DAFTAR ISI
Halaman
KATA PENGANTAR... x
DAFTAR ISI... xi
DAFTAR TABEL... xiii
DAFTAR GAMBAR... xiv
DAFTAR LAMPIRAN... xvii
I. PENDAHULUAN... 1
A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
II. TINJAUAN PUSTAKA... 3
A. SUKROSA... 3
B. INVERTASE ... 3
C. AKTIVITAS DAN STABILITAS ENZIM ... 4
D. FAKTOR-FAKTOR YANG MEMPENGARUHI LAJU DEGRADASI SUKROSA ... 5
1. Pengaruh Suhu ... 5
2. Pengaruh pH... 5
3. Pengaruh Konsentrasi Substrat dan Enzim ... 6
4. Pengaruh Perubahan Kondisi Lingkungan ... 7
5. Pengaruh Inhibitor ... 7
E. KINETIKA ENZIMATIK ... 10
III. METODOLOGI ... 15
A. ALAT... 15
B. BAHAN ... 15
C. METODE PENELITIAN ... 15
1. Tahapan Penelitian ... 15
xii
IV. HASIL DAN PEMBAHASAN... 21 A. Aktivitas Invertase... 21
B. Pengaruh Konsentrasi CuSO4... 22
C. Hubungan Pengaruh Perubahan Faktor Terhadap
Degradasi Sukrosa ... 24
1. Pengaruh Konsentrasi Substrat ... 24 2. Pengaruh Konsentrasi Enzim... 27 3. Pengaruh pH... 30 4. Pengaruh Suhu ... 33 5. Pengaruh Lama Pemanasan ... 36
D. Kinetika Inhibisi Reaksi Invertase ... 38
V. KESIMPULAN DAN SARAN... 45 A. KESIMPULAN... 45
B. SARAN ... 45
DAFTAR PUSTAKA... 46
DAFTAR TABEL
Halaman
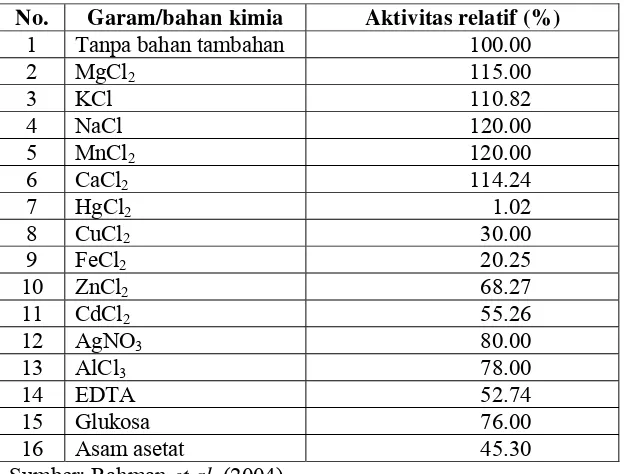
Tabel 1. Pengaruh jenis logam dan bahan kimia pada konsentrasi 0.005 M terhadap aktivitas invertase ... 8
Tabel 2. Parameter kinetika inhibisi invertase pada suhu 40°C... 39
Tabel 3. Parameter kinetika inhibisi invertase pada suhu 50°C... 41
xiv
DAFTAR GAMBAR
Halaman
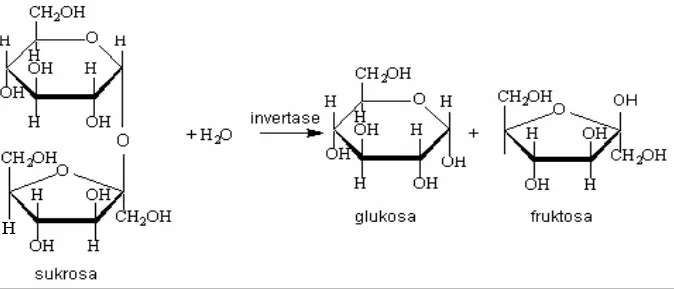
Gambar 1. Reaksi hidrolisis sukrosa oleh invertase ... 3
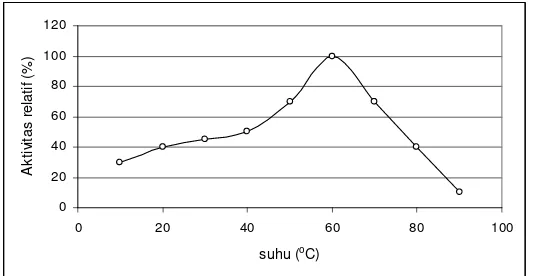
Gambar 2. Pengaruh suhu terhadap aktivitas invertase dari
nira tebu (Rahman et al., 2004) ... 5
Gambar 3. Pengaruh nilai pH terhadap aktivitas invertase dari
nira tebu (Rahman et al., 2004) ... 6
Gambar 4. Ikatan ion logam bivalen (M2+) dan grup sulfhidril ... 9
Gambar 5. Pengaruh konsentrasi substrat terhadap kecepatan awal reaksi enzimatik (Lehninger, 1988)... 10
Gambar 6. Kurva Lineweaver-Burk ... 11
Gambar 7. Mekanisme inhibisi kompetitif ... 12
Gambar 8. Plot Lineweaver-Burk untuk inhibisi kompetitif ... 12
Gambar 9. Mekanisme inhibisi nonkompetitif. ... 13
Gambar 10. Plot Lineweaver-Burk untuk inhibisi nonkompetitif. ... 13
Gambar 11. Mekanisme inhibisi unkompetitif. ... 13
Gambar 12. Plot Lineweaver-Burk untuk inhibisi unkompetitif. ... 14
Gambar 13. Diagram alir tahapan penelitian. ... 16
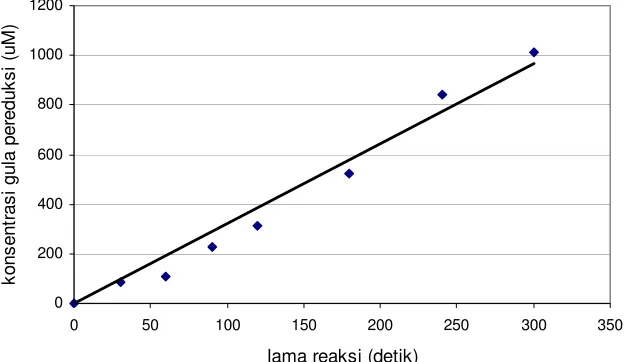
Gambar 14. Kurva aktivitas invertase berdasarkan konsentrasi
gula pereduksi yang dihasilkan, dengan konsentrasi invertase 5 mg/l, konsentrasi sukrosa 25 g/l. Persamaan garis linier
y = 3.2267 x, r2 = 0.9721. ... 21
Gambar 15. Kurva pengaruh konsentrasi CuSO4 terhadap konsentrasi
gula pereduksi yang dihasilkan, dengan konsentrasi sukrosa 25 g/l, konsentrasi invertase 5 mg/l, lama reaksi
5 menit ... 22
Gambar 16. Kurva pengaruh perubahan konsentrasi substrat terhadap konsentrasi gula pereduksi yang dihasilkan, dengan
Gambar 17. Inhibisi aktivitas invertase oleh CuSO4 0.125 mM pada
konsentrasi substrat yang berbeda, dengan konsentrasi
invertase 5 mg/l, lama reaksi 5 menit ... 26
Gambar 18. Kurva pengaruh perubahan konsentrasi enzim terhadap konsentrasi gula pereduksi yang dihasilkan, dengan
konsentrasi sukrosa 25 g/l, pH 7, lama reaksi 5 menit ... 28
Gambar 19. Inhibisi aktivitas invertase oleh CuSO4 0.125 mM pada
konsentrasi enzim yang berbeda, dengan konsentrasi
sukrosa 25 g/l, pH 7, lama reaksi 5 menit... 29
Gambar 20. Kurva pengaruh perubahan nilai pH terhadap konsentrasi gula pereduksi yang dihasilkan dengan konsentrasi invertase 5 mg/l, konsentrasi sukrosa 22.5 g/l,
lama reaksi 5 menit ... 30
Gambar 21. Inhibisi aktivitas invertase oleh CuSO4 0.125 mM pada
nilai pH yang berbeda, dengan konsentrasi invertase 5 mg/l, konsentrasi sukrosa 22.5 g/l, lama reaksi 5 menit ... 33
Gambar 22. Kurva pengaruh perubahan suhu terhadap konsentrasi gula pereduksi yang dihasilkan, dengan konsentrasi invertasi 5 mg/l, konsentrasi sukrosa 12.5 g/l, lama
reaksi 5 menit ... 34
Gambar 23. Inhibisi aktivitas invertase oleh CuSO4 pada suhu
yang berbeda, dengan konsentrasi invertase 5 mg/l,
konsentrasi sukrosa 12.5 g/l, lama reaksi 5 menit... 36
Gambar 24. Kurva pengaruh lama pemanasan terhadap konsentrasi gula pereduksi yang dihasilkan, dengan konsentrasi invertase
5 mg/l, konsentrasi sukrosa 12.5 g/l, lama reaksi 5 menit ... 37
Gambar 25. Inhibisi aktivitas invertase oleh CuSO4 pada
lama pemanasan yang berbeda dengan konsentrasi invertase 5 mg/l, konsentrasi sukrosa 22.5 g/l, lama reaksi 5 menit ... 38
Gambar 26. Kurva Michaelis Menten invertase suhu 40°C. ... 39
Gambar 27. Plot Lineweaver-Burk invertase suhu 40°C... 40
Gambar 28. Kurva Michaelis Menten invertase suhu 50°C. ... 41
Gambar 29. Plot Lineweaver-Burk invertase suhu 50°C... 42
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Prosedur penelitian... 49
Lampiran 2. Data hasil analisis sidik ragam dan uji lanjut Duncan
penentuan konsentrasi CuSO4... 50
Lampiran 3. Data hasil analisis sidik ragam dan uji lanjut Duncan
pengaruh konsentrasi substrat ... 51
Lampiran 4. Data hasil analisis sidik ragam dan uji lanjut Duncan
persen inhibisi pada konsentrasi substrat yang berbeda ... 54
Lampiran 5. Data hasil analisis sidik ragam dan uji lanjut Duncan
pengaruh konsentrasi enzim... 55
Lampiran 6. Data hasil analisis sidik ragam dan uji lanjut Duncan
persen inhibisi pada konsentrasi enzim yang berbeda ... 58
Lampiran 7. Data hasil analisis sidik ragam dan uji lanjut Duncan
pengaruh pH... 59
Lampiran 8. Data hasil analisis sidik ragam dan uji lanjut Duncan
persen inhibisi pada pH yang berbeda ... 62
Lampiran 9. Data hasil analisis sidik ragam dan uji lanjut Duncan
pengaruh suhu ... 64
Lampiran 10. Data hasil analisis sidik ragam dan uji lanjut Duncan
persen inhibisi pada suhu yang berbeda... 67
Lampiran 11. Data hasil analisis sidik ragam dan uji lanjut Duncan
pengaruh lama pemanasan ... 69
Lampiran 12. Data hasil analisis sidik ragam dan uji lanjut Duncan
persen inhibisi pada lama pemanasan yang berbeda... 71
Lampiran 13. Data kinetika inhibisi suhu 40°C ... 73
Lampiran 14. Data kinetika inhibisi suhu 50°C ... 74
I. PENDAHULUAN
A. LATAR BELAKANG
Sukrosa, dengan nama sistematisnya β-D-fructofuranosyl-α -D-glucopyranoside termasuk kelompok disakarida nonpereduksi. Senyawa
organik ini merupakan sejenis karbohidrat yang manis, putih dan termasuk
bahan dasar makanan. Sumber sukrosa umumnya didapatkan dari nira, seperti
nira tebu, nira kelapa, nira siwalan maupun dari bit. Kandungan sukrosa dalam
masing-masing nira tersebut berbeda. Nira tebu mengandung 14 - 20%
sukrosa, nira kelapa mengandung 15 - 20% sukrosa dan nira siwalan
mengandung 10 - 15% sukrosa.
Sukrosa banyak digunakan untuk berbagai keperluan dalam industri,
namun kerusakan sukrosa mudah terjadi. Proses degradasi sukrosa menjadi
gula invert, disebut juga gula pereduksi (glukosa dan fruktosa) sering terjadi
karena lamanya waktu menunggu sebelum nira tebu diproses di industri gula.
Selain degradasi sukrosa, senyawa-senyawa hasil degradasi sukrosa tersebut
dapat mengganggu proses kristalisasi pada industri gula (sukrosa), sehingga
dapat menurunkan rendemen gula sukrosa. Astawan (2001) menyatakan
bahwa pembentukan gula invert juga tidak diharapkan pada pengolahan gula
semut. Jika kadar gula pereduksinya lebih dari 3 persen maka gula yang
dihasilkan akan menjadi lembek dan sangat higroskopis.
Kerusakan gula atau sukrosa dapat disebabkan oleh aktivitas enzim,
mikroorganisme ataupun perlakuan proses (misalnya asam, suhu tinggi, dan
lainnya). Invertase, merupakan salah satu enzim yang dihasilkan pada nira
tebu atau hasil aktivitas ekstraseluler mikroorganisme yang turut memicu
kerusakan sukrosa. Aktivitas invertase pada ekstrak nira tebu adalah
417.6 unit, sedangkan aktivitas spesifiknya 2.86 unit/mg (Rahman, 2004).
Upaya penghambatan perlu dilakukan untuk mengurangi kerusakan sukrosa,
salah satunya dengan menurunkan aktivitas invertase yang mendegradasi
sukrosa.
Upaya penghambatan laju kerusakan sukrosa melalui penurunan
penambahan inhibitor. Cavaille dan Didier (1996) mengkombinasikan
perlakuan tekanan tinggi dengan suhu untuk menginaktivasi invertase,
sedangkan Causette et al. (1998) melakukan inaktivasi enzim dengan
menggunakan gelembung gas inert. Akan tetapi, perlakuan suhu dan tekanan
yang tinggi akan mempengaruhi kualitas produk (sukrosa) akibat terjadinya
reaksi lain yang tidak diinginkan (lateral reaction). Inhibitor invertase juga
ditemukan di dalam umbi kentang (Ewing et al., 1977 dan Pressey, 1966),
tembakau, dan tomat (Pressey ,1994 dan Weil et al., 1994 dalam Greiner et
al., 1998). Inhibitor dari bahan alami tersebut juga memiliki kelemahan, yaitu
masih terdapat bahan lain selain inhibitor, bahkan mengandung invertase.
Jenis inhibitor lain yang dapat menghambat aktivitas invertase adalah
beberapa jenis garam logam, terutama HgCl2, FeCl2, CuCl2, dan CdCl2, yang
dapat menurunkan aktivitas hingga 45-99% (Rahman et al., 2004).
Terdapat garam logam lain, seperti CuSO4 yang juga tersusun dari
kation logam bivalen. Penggunaan garam logam ini memerlukan kondisi
tertentu agar dihasilkan kinerja inhibisi invertase yang optimal. Perubahan
faktor-faktor yang mempengaruhi aktivitas enzim, seperti konsentrasi substrat,
konsentrasi enzim, pH, suhu dan lama pemanasan perlu dilakukan pada saat
garam logam CuSO4 ditambahkan. Perlakuan tersebut diharapkan dapat
menghasilkan profil inhibisi aktivitas invertase dalam mendegradasi sukrosa
serta diperoleh model kinetika inhibisi yang penting untuk keperluan rekayasa
proses.
B. TUJUAN
Adapun tujuan penelitian ini antara lain untuk menentukan:
1. Pengaruh perubahan pH, konsentrasi substrat, konsentrasi enzim, suhu
inkubasi dan lama pemanasan dengan adanya penambahan CuSO4
terhadap degradasi sukrosa
2. Parameter kinetika (KM dan Vmaks) laju degradasi sukrosa dengan adanya
II. TINJAUAN PUSTAKA
A. SUKROSA
Sukrosa (glucose-1,2 fructose) merupakan pemanis yang banyak
dikonsumsi dalam kehidupan manusia. Salah satu sumber sukrosa terpenting
adalah tebu karena mengandung sukrosa hingga 20% (Glazer dan Nikaido,
1995 dalam Filho 1999). Sukrosa, dikenal sebagai gula meja (table sugar),
merupakan disakarida yang terbentuk dari satu molekul α-D-glukosa dan satu molekul β-D-fruktosa yang dihubungkan oleh ikatan α-1,2-glikosidik (Rahman et al., 2004).
Degradasi sukrosa dapat terjadi melalui hidrolisis asam atau secara
enzimatis oleh invertase (Monsan et al., 1984 dalam Filho et al., 1999).
Degradasi secara enzimatis terjadi ketika ikatan α-1,2-glikosidik dihidrolisis oleh enzim invertase (D-fructofuranosidase, EC 3.2.1.26) atau sucrose
synthase (UDP glucose: D-fructose 2-D-glucosyltransferase, EC 2.4.1.13).
Hidrolisis sukrosa menghasilkan campuran glukosa dan fruktosa yang disebut
dengan gula invert (invert sugar) (Rahman et al., 2004). Reaksi hidrolisis
sukrosa oleh invertase (juga disebut sebagai sucrase atau saccharose) dapat
dilihat pada Gambar 1.
Gambar 1. Reaksi hidrolisis sukrosa oleh invertase
B. INVERTASE
Sistem tatanama untuk invertase adalah beta-fructofuranosidase (EC
hidrolisis (Wang, 2002). Invertase terdapat dalam jumlah yang beragam pada
tanaman maupun hewan dengan varietas yang luas. Sumber utama invertase
berasal dari ragi (yeast) dan fungi lainnya. Reed (1966) dalam Pancoast dan
Junk (1980) menyatakan bahwa ragi Saccharomyces cerevisiae dan S.
carlsbergensis merupakan sumber utama penghasil invertase untuk aplikasi
industri. Aspergillus orizae dan A. Niger adalah fungi yang juga merupakan
sumber invertase. Tanaman penghasil enzim ini antara lain tebu (Rahman et
al., 2004), buah mangga (Rahman et al., 2001), buah anggur (Nakanishi et al.,
1990), buah tomat (Konno et al., 1993 dalam Rahman et al., 2001), padi (Isla
et al., 1995) dan umbi kentang (Pressey et al., 1966).
Berbeda dengan sebagian besar enzim, invertase memiliki aktivitas
yang relatif tinggi pada kisaran pH yang luas antara 3.5 sampai 5.5, dengan
aktivitas optimum pada pH 4.5. Aktivitas maksimum dicapai pada suhu 55°C.
Nilai Michaelis-Menten untuk jenis enzim yang berbeda bervariasi, tetapi
kebanyakan enzim memiliki nilai KM antara 2 mM – 5 mM (Wang, 2002).
C. AKTIVITAS DAN STABILITAS ENZIM
Aktivitas enzim didefinisikan sebagai kecepatan pengurangan substrat
atau kecepatan pembentukan produk pada kondisi optimum. Satu unit
aktivitas enzim didefinisikan sebagai satu mikromol (µmol; 10-6 mol) substrat yang bereaksi atau produk yang dikatalisis setiap menit (Rodwell, 1981).
Aktivitas enzim dapat dipengaruhi oleh konsentrasi substrat, pH, dan
suhu. Setiap enzim berfungsi optimal pada suhu, pH dan konsentrasi substrat
tertentu. Konsentrasi substrat yang rendah menyebabkan daerah aktif pada
enzim tidak semuanya terikat pada substrat. Terdapat suhu optimal dimana
reaksi berlangsung sangat cepat. Ketika suhu di atas suhu optimal, kecepatan
reaksi menurun tajam karena enzim sebagai protein akan terdenaturasi,
sedangkan pada suhu terlalu rendah, beberapa enzim tidak dapat bekerja.
Aktivitas enzim juga dipengaruhi oleh pH karena sifat ionik gugus karboksil
dan gugus amino mudah dipengaruhi pH (Pelczar dan Chan, 1986).
Enzim merupakan salah satu jenis protein globular. Stabilitas dan
5 oleh struktur tertier protein. Terdapat empat jenis interaksi yang menstabilkan
struktur tersebut pada suhu, pH dan konsentrasi ion normal, antara lain ikatan
hidrogen, gaya tarik ionik, interaksi hidrofobik dan jembatan kovalen.
(Lehninger, 1988).
D. FAKTOR – FAKTOR YANG MEMPENGARUHI LAJU DEGRADASI
SUKROSA
Laju degradasi sukrosa dipengaruhi oleh beberapa faktor, antara lain
suhu, pH, lama pemanasan, konsentrasi substrat dan konsentrasi enzim. Laju
degradasi sukrosa dapat diperlambat atau bahkan dihambat dengan
penambahan inhibitor.
1. Pengaruh Suhu
Peningkatan suhu pada reaksi enzim memiliki dua pengaruh yang
tidak seimbang. Pengaruh tersebut adalah peningkatan laju reaksi dan di
sisi lain dapat menyebabkan inaktivasi enzim (Stauffer, 1989). Aktivitas
enzim invertase meningkat secara perlahan dengan kenaikan suhu. Suhu
maksimum aktivitas invertase adalah 60°C, peningkatan suhu lebih lanjut
menyebabkan penurunan laju degradasi sukrosa (Rahman et al., 2004).
Pengaruh suhu terhadap aktivitas invertase di dalam tebu dapat dilihat
pada Gambar 2.
Gambar 2. Pengaruh suhu terhadap aktivitas invertase dari nira tebu (Rahman et al., 2004)
2. Pengaruh pH
Invertase memberikan aktivitas maksimum pada pH 7.2. Aktivitas
Observasi ini menunjukkan bahwa enzim relatif stabil pada kisaran pH
asam sampai pH netral (Rahman et al., 2004). Nilai pH optimum invertase
dari benih padi adalah 7.0 (Chungliang et al. dalam Rahman et al., 2004).
Gambar 3 menunjukkan pengaruh pH terhadap aktivitas invertase pada
tebu (Rahman et al., 2004).
Gambar 3. Pengaruh nilai pH terhadap aktivitas invertase dari nira tebu (Rahman et al., 2004)
Stauffer (1989) menyatakan bahwa perubahan pada laju reaksi
enzim oleh pH mungkin dapat disebabkan oleh tiga faktor, yakni:
a. Protonasi sisi aktif rantai asam amino pada kompleks
enzim-substrat (ES) berubah, menghasilkan perubahan kemampuan ES
dalam menghasilkan produk.
b. Perubahan muatan ion pada molekul substrat atau sisi aktif enzim
yang dapat mengubah kecenderungan dari dua molekul tersebut
untuk membentuk kompleks ES.
c. Perubahan pH dari netral dapat melemahkan stabilitas protein,
mempercepat denaturasi enzim yang bersifat irreversible.
3. Pengaruh Konsentrasi Substrat dan Enzim
Invertase dapat mengkatalisis sukrosa pada konsentrasi di atas
59%wt/vol. Peningkatan konsentrasi sukrosa lebih lanjut sampai
80%wt/vol menurunkan aktivitas enzim secara signifikan, mungkin
disebabkan oleh konsentrasi air rendah, inhibisi oleh substrat atau agregasi
substrat (Somiari dan Bielecki, 1995 dalam Filho et al., 1999).
Brown pada tahun 1902 melakukan penelitian tentang invertase,
7 konsentrasi enzim, kecepatan reaksi menjadi tidak tergantung pada
konsentrasi sukrosa (Pancoast, 1980). Aktivitas enzimatik akan menurun
pada konsentrasi substrat yang tinggi dan cenderung membentuk asimtot.
Jenis penghambatan ini akan membentuk kompleks (dead end complex),
satu sisi molekul substrat terikat pada enzim dan molekul substrat lain
terikat pada sisi lain (sekunder) enzim (Suryani dan Mangunwidjaya,
2002).
4. Pengaruh Perubahan Kondisi Lingkungan
Inaktivasi enzim dan mikroorganisme dapat dilakukan dengan
perlakuan suhu yang tinggi. Akan tetapi perlakuan suhu yang tinggi juga
dapat menyebabkan perubahan produk, sehingga kualitasnya menurun.
Metode lain yang dapat digunakan untuk menurunkan aktivitas enzim dan
mikroorganisme tanpa merusak produk yang diinginkan adalah dengan
cara pemberian gelembung gas inert. Pemberian gelembung gas inert
nitrogen mampu menurunkan aktivitas enzim (Causette et al., 1998).
5. Pengaruh Inhibitor
Banyak bahan yang dapat mengubah aktivitas suatu enzim dengan
menggabungkannya dalam suatu jalur yang mempengaruhi ikatan substrat.
Bahan-bahan yang mereduksi aktivitas suatu enzim dengan cara ini
dikenal sebagai inhibitor. Inhibitor terbagi menjadi dua jenis, yakni
inhibitor reversible yang membentuk kompleks dinamik dengan enzim dan
inhibitor irreversible yang dikenal dengan racun pengkatalis (contohnya
beberapa logam berat, seperti merkuri, Hg2+). Inhibitor mengikat molekul enzim dan menurunkan aktivitasnya (Flickinger dan Drew, 1999). Stauffer
(1989) juga membagi inhibitor menjadi 3 golongan berdasarkan
affinitasnya terhadap molekul enzim sebagai berikut:
a. Inhibitor beraffinitas rendah
Molekul inhibitor ini memiliki konstanta affinitas antara 1 M
b. Inhibitor beraffinitas tinggi
Molekul inhibitor ini memiliki konstanta affinitas antara
106 M hingga 1012 M. Inhibitor ini menjadi transisi dari kompleks enzim-substrat menjadi kompleks enzim-produk atau sebagai molekul
yang mengikat kuat pada sisi aktif enzim.
c. Inhibitor irreversible
Molekul inhibitor ini membentuk ikatan kovalen dengan
molekul pada sisi aktif enzim. Ikatan yang dibentuk bersifat stabil.
Reaksi lebih jauh lagi dari enzim dengan inhibitor ini (inhibitor
berlebih) menyebabkan enzim menjadi tidak aktif.
Penambahan garam logam dan senyawa kimia lainnya dapat
menyebabkan peningkatan atau penurunan aktivitas enzim. Peningkatan
dan penurunan aktivitas enzim sangat dipengaruhi oleh jenis garam logam
ataupun senyawa kimia yang ditambahkan. Pengaruh penambahan
beberapa jenis garam logam dan senyawa kimia lainnya terhadap aktivitas
enzim dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh jenis garam logam dan bahan kimia pada konsentrasi 0.005 M terhadap aktivitas invertase
No. Garam/bahan kimia Aktivitas relatif (%)
1 Tanpa bahan tambahan 100.00
9 Hampir semua ion logam selalu berinteraksi dengan kompleks
protein secara cepat. Interaksi kompleks antara ion logam dengan protein
ada dua bentuk:
1. Metaloenzim
Ikatan ini merupakan subkelas dari metaloprotein. Protein
berikatan kuat dengan ion logam sehingga dianggap sebagai ikatan
yang sangat stabil dan lama. Ion logam menjadi bagian dari struktur
protein dan hanya dapat dilepas dalam keadaan tertentu.
2. Metal protein
Sistem ikatan ini memungkinkan ion logam mudah saling
bertukar dengan protein lain (reversible). Laju pertukaran ion logam
dengan kondisi larutan lingkungannya sangat mudah. Ion logam sulit
dalam menempati sisi protein yang tepat karena ion logam ini bersifat
sangat labil.
Kekuatan ikatan ion logam dengan protein tergantung pada muatan kation
yang mengikatnya. Semakin tinggi muatan kation dari logam maka
semakin kuat ikatannya dengan protein, sehingga ikatan tersebut lebih
stabil dan konstan (Darmono, 1995).
Hochster dan Quastel (1963) menyatakan, ikatan ion logam bivalen
dengan grup sulfhidril yang terdapat pada enzim kemungkinan terjadi
sebagai berikut:
E dll
S
E-SH E-S- + H+ E-S -M + M 2+
E-SH E-SH E-S- + H+
Gambar 4. Ikatan ion logam bivalen (M2+) dan grup sulfhidril
Keterangan:
E-SH = enzim yang memiliki grup sulfhidril
E. KINETIKA ENZIMATIK
Enzim merupakan katalisator sejati. Molekul ini dapat meningkatkan
kecepatan reaksi kimia spesifik yang tanpa adanya enzim akan berlangsung
lambat. Kecepatan reaksi yang dikatalisis oleh enzim sangat dipengaruhi oleh
berbagai konsentrasi substrat terhadap kecepatan reaksi awal apabila
konsentrasi enzim dijaga konstan (Lehninger, 1988).
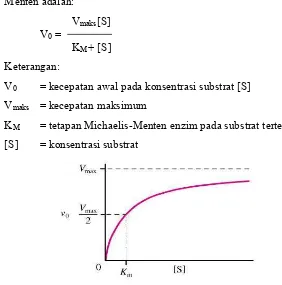
Setiap enzim memiliki sifat yang khas, dinyatakan dalam suatu tetapan
yaitu KM (tetapan Michaelis-Menten). Hampir semua enzim memiliki kurva
kecepatan reaksi dengan bentuk umum yang hampir sama yaitu hiperbola.
Oleh sebab itu, Michaelis-Menten mendefinisikan suatu tetapan untuk
menyatakan hubungan antara konsentrasi substrat dan kecepatan reaksi
enzimatik. KM didefinisikan sebagai konsentrasi substrat tertentu pada saat
enzim mencapai setengah kecepatan maksimumnya. Persamaan
Michaelis-Menten adalah:
Vmaks [S]
V0 =
KM + [S]
Keterangan:
V0 = kecepatan awal pada konsentrasi substrat [S]
Vmaks = kecepatan maksimum
KM = tetapan Michaelis-Menten enzim pada substrat tertentu
[S] = konsentrasi substrat
Gambar 5. Pengaruh konsentrasi substrat terhadap kecepatan awal reaksi enzimatik (Lehninger, 1988)
Nilai KM dan Vmaks sulit untuk ditentukan secara tepat dari grafik
11 tidak dapat diketahui nilai yang sebenarnya. Nilai KM yang lebih tepat dapat
diperoleh dengan memetakan data yang sama dengan cara yang berbeda,
yakni pemetaan kebalikan-ganda, didapat dari transformasi aljabar persamaan
Michaelis-Menten. Hasil transformasi persamaan Michaelis-Menten dikenal
dengan persamaan Lineweaver-Burk.
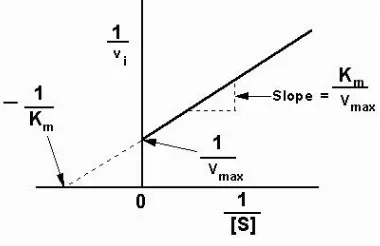
1 KM 1 1
= +
Vo Vmaks [S] Vmaks
Selain dapat menentukan Vmaks secara lebih tepat, persamaan ini bermanfaat
dalam menganalisa penghambatan enzim (Lehninger, 1988). Persamaan
Lineaweaver-Burk menghasilkan kurva yang ditunjukkan pada Gambar 6.
Gambar 6. Kurva Lineweaver-Burk
Kinetika inhibisi enzim menyangkut penentuan fungsi laju reaksi
terhadap konsentrasi substrat dengan inhibitor pada berbagai konsentrasi.
Kurva Lineweaver-Burk memungkinkan untuk menentukan jenis inhibisi
yang bersifat reversible, antara lain sebagai berikut.
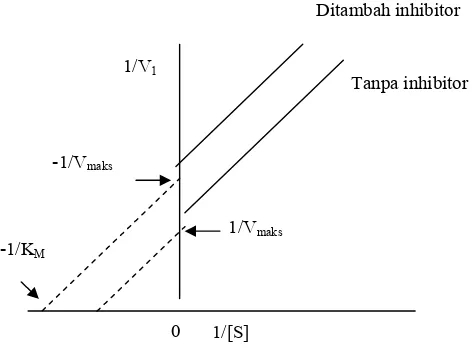
1. Inhibisi Kompetitif
Inhibitor pada model inhibisi ini bersaing dengan substrat untuk
memasuki sisi aktif enzim. Struktur kimia inhibitor umumnya menyerupai
substrat. Oleh sebab itu, inhibitor tersebut dapat berikatan secara
reversible dengan enzim (Rodwell, 2000). Mekanisme inhibisi kompetitif
Gambar 7. Mekanisme inhibisi kompetitif
Penyajian garis lurus pada kurva Lineweaver-Burk memotong
sumbu ordinat pada titik yang sama. Vmaks tidak dipengaruhi oleh inhibitor
(Suryani dan Mangunwidjaja, 2002). Kurva Lineweaver-Burk untuk
model inhibisi kompetitif ditunjukkan pada Gambar 8.
Gambar 8. Plot Lineweaver-Burk untuk inhibisi kompetitif
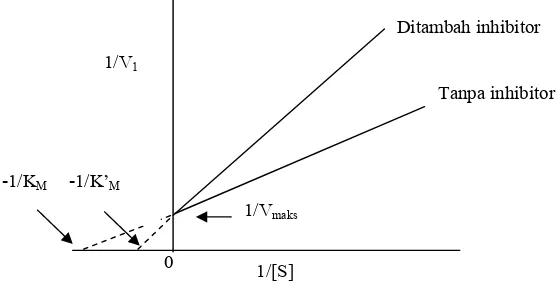
2. Inhibisi Nonkompetitif
Model inhibisi nonkompetitif tidak menunjukkan adanya
persaingan antara inhibitor dengan substrat. Struktur inhibitor biasanya
tidak atau sedikit menyerupai struktur substrat. Inhibitor nonkompetitif
menurunkan kecepatan reaksi maksimal yang diperoleh pada pemberian
sejumlah enzim (Vmaks yang lebih rendah), tetapi biasanya tidak
mempengaruhi nilai KM, ditunjukkan oleh kurva Lineweaver-Burk pada
Gambar 10. Mekanisme reaksi inhibisi nonkompetitif dapat dilihat pada
Gambar 9.
EI (inaktif)
ES (aktif) E + P
E
±I
±S
Ditambah inhibitor
Tanpa inhibitor 1/V1
-1/KM -1/K’M
1/Vmaks
13 Gambar 9. Mekanisme inhibisi nonkompetitif
Gambar 10. Plot Lineweaver-Burk untuk inhibisi nonkompetitif
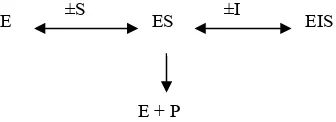
3. Inhibisi Unkompetitif
Inhibisi ini terjadi jika kompleks EI hilang, tetapi kompleks EIS
terbentuk. Inhibitor mengikat langsung pada kompleks enzim-substrat
(ES), bukan enzim bebas (Flickinger dan Drew, 1999). Mekanisme
inhibisi unkompetitif ditunjukkan pada Gambar 11.
Gambar 11. Mekanisme inhibisi unkompetitif ES
E ±S ±I EIS
E + P EI
ES E
±I
±S
E + P
EIS ±S
Ditambah inhibitor
Tanpa inhibitor
1/Vmaks
1/[S] 1/V1
-1/KM
-1/Vmaks
Inhibitor yang bersifat unkompetitif akan mempengaruhi fungsi
enzim, tetapi tidak terhadap ikatannya dengan substrat. Plot
Lineweaver-Burk untuk inhibisi unkompetitif adalah linier dengan kemiringan atau
slope KM/Vmaks seperti pada reaksi tanpa inhibitor, dapat dilihat pada
Gambar 12 (Simanjutak dan Silalahi, 2003).
Gambar 12. Plot Lineweaver-Burk untuk inhibisi unkompetitif 1/[S]
1/V1
-1/KM
-1/Vmaks
0
Ditambah inhibitor
Tanpa inhibitor
III. METODOLOGI
A. ALAT
Peralatan yang digunakan dalam penelitian ini antara lain peralatan
gelas (pipet tetes, corong, tabung reaksi); peralatan ukur (pipet mikro, pipet
volumetri, labu takar, termometer, spektrofotometer, stopwatch dan
timbangan); serta peralatan pendukung (water bath dan vortex).
B. BAHAN
Bahan utama yang digunakan dalam penelitian ini adalah sukrosa,
invertase (Sigma-Aldrich 19253: pH 4.5, 55°C, 355 units/mg solid), dan
larutan CuSO4. Sedangkan bahan yang digunakan untuk analisa adalah NaOH
0.1 N, HCl 0.1 N, indikator PP, glukosa, fruktosa, buffer pH 3-11, pereaksi
DNS (dinitro salicylic acid) dan aquades.
C. METODE PENELITIAN
Metode penelitian ini dibagi menjadi tahapan penelitian dan prosedur
percobaan. Tahapan penelitian menjelaskan tentang langkah-langkah yang
harus dilalui untuk mencapai tujuan penelitian, sedangkan prosedur percobaan
merupakan urutan kegiatan dan tatacara yang secara teknis dikerjakan dalam
setiap tahapan penelitian.
1. Tahapan Penelitian
Penelitian dilakukan dalam empat tahap, yaitu (1) Penentuan
aktivitas invertase, (2) Penentuan pengaruh konsentrasi CuSO4,
(3) Penentuan hubungan perubahan faktor konsentrasi substrat, konsentrasi
enzim, pH, suhu dan lama pemanasan dengan adanya penambahan CuSO4
terhadap degradasi sukrosa, (4) Penentuan parameter kinetika (KM dan
Vmaks) laju degradasi sukrosa dengan adanya penambahan CuSO4.
Gambar 13. Diagram alir tahapan penelitian
a. Penentuan aktivitas invertase
Aktivitas enzim diukur berdasarkan definisi satu unit aktivitas
invertase, yaitu banyaknya invertase yang dapat membebaskan
1 mikromol gula pereduksi dari substrat sukrosa selama 1 menit pada
kondisi percobaan. Kondisi yang digunakan adalah kondisi optimum
invertase, yaitu pada suhu 55°C, di dalam larutan buffer asetat pH 4.5.
Slope yang diperoleh dari gula pereduksi yang dihasilkan pada setiap
konsentrasi yang diujikan merupakan besarnya aktivitas enzim.
b. Penentuan pengaruh konsentrasi CuSO4
CuSO4 dengan konsentrasi yang berbeda diujikan pada reaksi
invertase dengan sukrosa. Nilai gula pereduksi yang lebih rendah dari
kontrol (perlakuan invertase tanpa CuSO4) menunjukkan adanya
inhibisi, sebaliknya jika lebih tinggi dari kontrol menunjukkan aktivasi.
Pengaruh yang berbeda nyata diukur berdasarkan analisis sidik ragam
(ANOVA) dan uji lanjut Duncan.
Mulai
Penentuan aktivitas invertase
Penentuan pengaruh konsentrasi CuSO4
Penentuan pengaruh perubahan faktor dengan adanya penambahan CuSO4 terhadap degradasi sukrosa
Penentuan parameter kinetika (KM dan Vmaks) laju degradasi sukrosa dengan adanya penambahan CuSO4
17
c. Penentuan pengaruh hubungan faktor dengan adanya penambahan CuSO4 terhadap degradasi sukrosa
Uji karakterisasi invertase yang dilakukan antara lain pengaruh
konsentrasi substrat, konsentrasi enzim, pH, suhu dan lama pemanasan
dengan ditambahkan CuSO4. Pengaruh yang diidentifikasi adalah
adanya kenaikan atau penurunan konsentrasi gula pereduksi pada setiap
taraf yang diujikan berdasarkan analisis sidik ragam dan uji lanjut
Duncan. Inhibisi invertase diukur berdasarkan perbandingan dengan
perlakuan tanpa CuSO4, dinyatakan dalam bentuk persen.
d. Penentuan parameter kinetika laju degradasi (KM dan Vmaks) sukrosa dengan adanya penambahan CuSO4
Penentuan parameter kinetika dilakukan pada tiga suhu yang
berbeda dan pH tertentu yang optimum bagi inhibisi invertase. Model
kinetika inhibisi diidentifikasi berdasarkan jenis perubahan nilai
parameter kinetika (KM dan Vmaks) yang diperoleh dari plot
Lineweaver-Burk. Nilai KM diperoleh dari perpotongan garis linier dengan sumbu x,
sedangkan nilai Vmaks diperoleh dari perpotongan garis linier dengan
sumbu y.
2. Prosedur Percobaan
Prosedur percobaan yang dilakukan pada penelitian ini adalah
sebagai berikut.
a. Penentuan aktivitas invertase
Larutan invertase 0.01 g/l dan larutan sukrosa 50 g/l disiapkan
pada tabung reaksi yang terpisah. Masing-masing tabung reaksi
kemudian diinkubasi di dalam water bath suhu 55°C sehingga suhu
tersebut dicapai oleh larutan di dalam tabung reaksi. Selanjutnya
sukrosa dimasukkan ke dalam tabung reaksi berisi invertase dan mulai
diukur waktu reaksi (t = 0). Reaksi dihentikan pada masing-masing
waktu yang diujikan, yaitu 0, 30, 60, 90, 120, 180, 240, dan 300
(detik), dengan memasukkan 2 ml pereaksi DNS. Kemudian tabung
10 menit, tabung reaksi dikeluarkan dan didinginkan untuk diukur
absorbansinya pada panjang gelombang 540 nm.
b. Penentuan konsentrasi inhibitor
Larutan CuSO4 dibuat dalam beberapa konsentrasi, 0 mM-
3.75 mM. Masing-masing larutan CuSO4 dalam berbagai konsentrasi
dimasukkan ke dalam tabung reaksi, kemudian ditambahkan larutan
sukrosa 50 g/l sebanyak 0.5 ml dan divortex. Selanjutnya ditambahkan
1 ml invertase 0.01 g/l pada masing-masing tabung reaksi (t = 0). Pada
saat t = 5 menit, reaksi dihentikan dengan perekasi DNS. Prosedur
untuk menghentikan reaksi mengikuti prosedur sebelumnya pada
penentuan aktivitas.
c. Penentuan pengaruh perubahan faktor
Penentuan pengaruh perubahan faktor dilakukan dengan
maupun tanpa adanya penambahan inhibitor. Prosedur yang dilakukan
pada perlakuan tanpa inhibitor sama halnya dengan pengujian pada
karakterisasi invertase dengan inhibitor, hanya tidak ditambahkan
larutan CuSO4. Total volume larutan dalam tiap tabung reaksi tetap
sama yakni 2 ml, sehingga volume yang ditambah adalah aquades dan
buffer.
1. Pengaruh konsentrasi enzim
Larutan invertase 0.01 g/l disiapkan pada berbagai
konsentrasi sebanyak 0.0 - 0.83 ml dan ditambahkan larutan buffer
pH 7 hingga volumenya 1 ml. Kemudian ditambahkan larutan
CuSO4 2.5 mM sebanyak 0.1 ml pada masing-masing tabung
reaksi. Selanjutnya larutan sukrosa 50 g/l sebanyak 1 ml
dimasukkan pada tiap-tiap tabung tersebut, dan mulai dihitung
waktunya (t = 0 menit). Pada waktu t = 5 menit, dimasukkan 2 ml
pereaksi DNS untuk menghentikan reaksi. Kemudian tabung
tersebut dimasukkan ke dalam water bath pada suhu 95°C selama
10 menit. Setelah 10 menit, tabung reaksi dikeluarkan dan
didinginkan untuk diukur absorbansinya pada panjang gelombang
19 2. Pengaruh konsentrasi substrat
Larutan CuSO4 2.5 mM sebanyak 0.1 ml dimasukkan pada
masing-masing tabung reaksi yang berisi larutan sukrosa 50 g/l
dalam konsentrasi yang berbeda. Kemudian aquades ditambahkan
hingga volume campuran mencapai 2.0 ml. Larutan invertase
0.01 g/l sebanyak 1.0 ml dimasukkan ke masing-masing tabung
reaksi (t = 0 menit). Pengukuran reaksi hidrolisis mengikuti
prosedur sebelumnya.
3. Pengaruh pH
Invertase 0.01g/l sebanyak 1.0 ml dilarutkan dengan
menggunakan buffer pH yang bervariasi (pH 3 - 11) pada tabung
reaksi. Selanjutnya masing-masing tabung reaksi ditambahkan
larutan CuSO4 2.5 mM sebanyak 0.1 ml dan0.9 mllarutan sukrosa
50 g/l (t = 0 menit). Pengukuran reaksi hidrolisis mengikuti
prosedur sebelumnya.
4. Pengaruh suhu
Penangas air mulai suhu 0 - 90oC disiapkan dengan interval suhu 10oC. Pada setiap kelipatan suhu 10oC tersebut, diuji aktivitas invertase. Larutan CuSO4 2.5 mM sebanyak 0.1 ml, 0.4 ml air dan
larutan sukrosa 50 g/l sebanyak 0.5 ml dimasukkan ke dalam setiap
tabung untuk setiap kelipatan suhu 10oC. Tabung reaksi selanjutnya dimasukkan ke dalam penangas air pada rentang suhu
tersebut dan didiamkan selama 5 menit. Kemudian ditambahkan
invertase 0.01 g/l sebanyak 1.0 ml ke dalam masing-masing tabung
reaksi (t = 0 menit) pada suhu inkubasi. Pengukuran reaksi
hidrolisis mengikuti prosedur sebelumnya.
5. Pengaruh lama pemanasan
Larutan invertase 0.01 g/l sebanyak 1.0 ml dimasukkan ke
dalam masing-masing tabung reaksi dan dipanaskan dengan waktu
yang bervariasi dari 0 - 5 (menit). Setelah waktu yang diperlukan
Setelah itu larutan CuSO4 2.5 mM sebanyak 0.1 ml dan larutan
sukrosa 50 g/l sebanyak 0.5 ml dimasukkan ke dalamnya (t =
0 menit). Pengukuran reaksi hidrolisis mengikuti prosedur
sebelumnya.
d. Penentuan parameter kinetika
Kondisi inhibisi invertase oleh CuSO4 yang optimum dipilih
(suhu dan pH) yang kemudian pada selang konsentrasi substrat
tertentu diuji aktivitasnya dalam menghidrolisis sukrosa.. Hasil yang
diperoleh kemudian diplotkan pada kurva kinetika (Lineweaver-Burk),
dan dihitung parameter kinetikanya (KM dan Vmaks) serta dibandingkan
antara perlakuan tanpa CuSO4 dan dengan penambahan CuSO4. Nilai
KM dan Vmaks dapat diperoleh dari persamaan linier plot kurva
Lineweaver-Burk. Slope yang diperoleh merupakan KM/Vmaks,
sedangkan intersep menunjukkan 1/Vmaks. Bentuk kurva
Lineweaver-Burk yang diperoleh menunjukkan model kinetika ihibisi. Penentuan
model kinetika menggunakan alat bantu program SigmaPlot 2004 for
Windows Version 9.01. Program ini menentukan model kinetika
IV. HASIL DAN PEMBAHASAN
Kemampuan hidrolisis sukrosa oleh invertase dilakukan dengan mengukur
aktivitas enzim tersebut, sedangkan kemampuan inhibisi garam logam CuSO4
dilihat pada setiap perubahan faktor yang berpengaruh (konsentrasi substrat,
konsentrasi enzim, pH, suhu dan lama pemanasan) terhadap aktivitas enzim serta
perubahan parameter kinetika (KM dan Vmaks) inhibisi degradasi sukrosa.
A. Aktivitas Invertase
Penentuan aktivitas invertase penting dilakukan untuk mengetahui
seberapa besar perubahan mikromol sukrosa menjadi gula pereduksi setiap
menit reaksi. Slope yang diperoleh dari persamaan garis linier adalah 3.2267,
yang berarti bahwa invertase mampu menghidrolisis sukrosa 3.2267 µM
menjadi glukosa dan fruktosa dalam satu detik atau perubahan 0.3872 µmol
sukrosa menjadi glukosa dan fruktosa dalam satu menit. Aktivitas invertase
digambarkan dalam bentuk kurva pada Gambar 14.
0
B. Pengaruh Konsentrasi CuSO4
Penentuan pengaruh konsentrasi CuSO4 sebagai inhibitor dilakukan
berdasarkan uji daya inhibisi CuSO4 terhadap aktivitas invertase. Adanya
inhibisi invertase ditunjukkan dengan menurunnya gula pereduksi yang
dihasilkan dari hidrolisis sukrosa oleh invertase. Analisis sidik ragam
menunjukkan bahwa konsentrasi yang diujikan memberikan pengaruh yang
nyata terhadap konsentrasi gula pereduksi yang dihasilkan, dapat dilihat pada
Lampiran 2. Konsentrasi gula pereduksi tertinggi diperoleh dari penambahan
larutan CuSO4 1.25 mM sebesar 2064.5 µM, sedangkan konsentrasi gula
pereduksi terkecil ditunjukkan oleh penambahan larutan CuSO4 3.75 mM
sebesar 1052 µM. Kurva pengaruh konsentrasi CuSO4 terhadap aktivitas
invertase dapat dilihat pada Gambar 15.
0
konsentrasi CuSO4 (mM)
k
Gambar 15. Kurva pengaruh konsentrasi CuSO4 terhadap konsentrasi gula
pereduksi yang dihasilkan, dengan konsentrasi sukrosa 25 g/l, konsentrasi invertase 5 mg/l, lama reaksi 5 menit
Hasil uji daya inhibisi menunjukkan bahwa tidak semua konsentrasi
CuSO4 yang diujikan menunjukkan adanya penghambatan aktivitas invertase.
Gula pereduksi meningkat signifikan dengan penambahan larutan CuSO4
0.75 mM. Hal ini menunjukkan bahwa CuSO4 pada konsentrasi yang rendah
tidak memberikan pengaruh inhibisi terhadap aktivitas invertase. CuSO4
23 kecil. Perubahan muatan pada enzim akibat penambahan CuSO4 menyebabkan
enzim mudah dalam mengikat substrat. Hal ini sesuai dengan teori bahwa
logam yang ditambahkan dalam bentuk garam organik memberikan kestabilan
enzim dengan cara menetralkan kelebihan muatan elektrostatik yang
melindungi molekul enzim sehingga konformasi enzim dapat dipertahankan
(Monsan dan Combess, 1984). Kation seperti Cu (II) kemungkinan terlibat
langsung dalam proses katalisis enzim, yaitu dalam pengikatan substrat ke sisi
aktif enzim, dalam menjaga konformasi enzim dan kestabilan substrat
(Whitaker, 1996).
Berdasarkan Gambar 15, besarnya penghambatan setelah aktivitas
invertase mencapai maksimum meningkat sedikit demi sedikit hingga
akhirnya mengalami inhibisi pada konsentrasi CuSO4 2.5 mM. Kemampuan
aktivasi enzim menurun dengan semakin tingginya konsentrasi CuSO4.
Besarnya inhibisi ini berbeda nyata dengan kontrol berdasarkan uji lanjut
Duncan, dapat dilihat pada Lampiran 2. Gula pereduksi yang dihasilkan pada
konsentrasi CuSO4 2.5 mM adalah 1503.25 µM, sedangkan invertase tanpa
CuSO4 (kontrol) menghasilkan gula pereduksi 1669.5 µM, sehingga inhibisi
yang diberikan sebesar 9.96 %.
Inhibisi terhadap aktivitas invertase disebabkan oleh penghambatan
substrat untuk memasuki daerah katalitik enzim dimana kation logam Cu (II)
terikat pada sisi aktif enzim. Inhibisi dapat terjadi pada sisi aktif enzim
maupun sisi sekunder enzim. Jika inhibitor terikat pada sisi aktif enzim,
substrat tidak dapat membentuk kompleks dengan enzim, sehingga produk
tidak akan terbentuk. Inhibisi juga dapat terjadi selain pada sisi aktif enzim,
yaitu pada sisi sekunder enzim. Pengikatan inhibitor pada sisi sekunder enzim
menyebabkan perubahan konformasi enzim, sehingga affinitas enzim pada
substrat berkurang. Inhibisi pada fungsi katalitik enzim dapat terjadi pada
residu asam amino, yang dapat terletak pada sisi aktif enzim. Hal ini sesuai
dengan teori bahwa grup sulfhidril terdapat pada sisi aktif maupun di dekat
sisi aktif invertase yang penting dalam menjalankan fungsi katalitik enzim
Inhibisi terhadap aktivitas invertase juga disebabkan oleh adanya asam
yang terbentuk dari anion SO42- yang berikatan dengan kation H+ dari grup
sulfhidril invertase membentuk senyawa asam H2SO4. Penambahan CuSO4
dengan konsentrasi yang lebih tinggi menyebabkan terbentuknya senyawa
asam sulfat semakin banyak yang mengubah pH larutan menjadi lebih asam.
Hal ini sesuai dengan teori bahwa ion H+ yang berlebihan mempengaruhi keseimbangan muatan pada sisi aktif enzim, sehingga kemampuan enzim
untuk mengikat substrat berkurang (Rodwell, 1981).
Jika konsentrasi CuSO4 dinaikkan maka inhibisi akan semakin besar,
seperti yang ditunjukkan oleh penambahan konsentrasi CuSO4 3.75 mM.
Inaktivasi bahkan dapat terjadi jika konsentrasi tersebut masih dinaikkan,
karena semakin banyak grup sulfhidril invertase yang terikat oleh kation
logam Cu (II) atau semakin banyak senyawa asam yang terbentuk. Hal ini
membuktikan bahwa kation logam Cu (II) bersifat sangat reaktif terhadap
grup sulfhidril pada kondisi konsentrasi yang tinggi. Hasil penelitian ini sesuai
dengan teori bahwa pengaruh inhibisi dari ion-ion logam disebabkan oleh
affinitas (kereaktifan) ion logam. Affinitas enzim terhadap ion logam berbeda
disesuaikan dengan sifat ikatan spesifik grup enzim yang terlibat. Kereaktifan
unsur-unsur atau senyawa untuk melakukan ikatan kompleks ditunjukkan oleh
konstanta pembentukan (log k1) (Klotz, 1954). Konstanta pembentukan kation
logam Cu (II) dengan gugus sulfida adalah 41.5 (Gurd dan Wilcox, 1954).
C. Hubungan Pengaruh Perubahan Faktor Terhadap Degradasi Sukrosa
Aktivitas invertase dalam mendegradasi sukrosa dipengaruhi oleh
beberapa faktor. Faktor-faktor yang mempengaruhi aktivitas enzim antara lain
konsentrasi substrat, konsentrasi enzim, pH, suhu inkubasi dan lama
pemanasan. Perubahan faktor-faktor tersebut dengan penambahan CuSO4
dibahas sebagai berikut.
1. Pengaruh Konsentrasi Substrat
Hasil analisis sidik ragam menunjukkan bahwa perubahan
konsentrasi sukrosa memberikan pengaruh yang nyata terhadap
25 Semakin tinggi konsentrasi sukrosa diberikan, semakin tinggi konsentrasi
gula pereduksi yang dihasilkan. Hasil uji menunjukkan rentang gula
pereduksi dari 0 µM hingga 2157 µM, dengan konsentrasi paling rendah
pada perlakuan tidak diberikan sukrosa dan konsentrasi tertinggi pada
sukrosa 20.75 g/l tanpa penambahan CuSO4. Hasil pengujian pengaruh
perubahan konsentrasi sukrosa terhadap aktivitas invertase dapat dilihat
pada Gambar 16.
0
0 4.25 8.25 12.5 16.75 20.75
konsentrasi sukrosa (g/l)
Perlakuan konsentrasi substrat dengan penambahan CuSO4 0.125 mM Perlakuan konsentrasi substrat tanpa CuSO4
Gambar 16. Kurva pengaruh perubahan konsentrasi substrat terhadap konsentrasi gula pereduksi yang dihasilkan, dengan konsentrasi invertase 5 mg/l, lama reaksi 5 menit
Peningkatan konsentrasi sukrosa meningkatkan gula pereduksi
yang dihasilkan. Peningkatan terjadi dengan curam dari invertase yang
tidak ditambahkan sukrosa (sukrosa 0 g/l) hingga sukrosa 12.5 g/l, baik
pada perlakuan tanpa maupun dengan penambahan CuSO4. Rasio
invertase terhadap sukrosa pada konsentrasi sukrosa 12.5 g/l adalah 1
: 2500. Selanjutnya, peningkatan secara landai terjadi dari konsentrasi
sukrosa 12.5 g/l hingga 16.75 g/l (invertase : sukrosa = 1 : 3350) pada
perlakuan tanpa CuSO4. Hal ini disebabkan oleh enzim yang bekerja
semakin aktif jika substrat yang diberikan semakin banyak, karena
semakin banyak substrat yang berpeluang untuk berikatan dengan sisi aktif