PENGGUNAAN AKAR KAWAO (Millettia sericeasp)
SEBAGAI INHIBITOR AKTIVITAS INVERTASE
Oleh
RIAN WIDIPRATOMO F34102096
2006
DEPARTEMEN TEKNOLOGI INDUSTRI PERTANIAN FAKULTAS TEKNOLOGI PERTANIAN
PENGGUNAAN AKAR KAWAO (Millettia sericeasp)
SEBAGAI INHIBITOR AKTIVITAS INVERTASE
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
RIAN WIDIPRATOMO F34102096
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
PENGGUNAAN AKAR KAWAO (Millettia sericeasp)
SEBAGAI INHIBITOR AKTIVITAS INVERTASE
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN pada Departemen Teknologi Industri Pertanian
Fakultas Teknologi Pertanian Institut Pertanian Bogor
Oleh
RIAN WIDIPRATOMO F34102096
Dilahirkan pada tanggal 15 Juli 1983 di Bogor
Tanggal Lulus : 24 Agustus 2006
Disetujui Dosen Pembimbing, Bogor, Agustus 2006
The Use of Kawao (Millettia sericeasp) root
as Inhibitor on Invertase Activity
Summary
The hydrolysis of sucrose, especially the one that occurred in cane sugar industry, is a process of sugar degradation which needs to be avoided in sugar industry. However, the presence of invert sugar as a result of sucrose hydrolysis in mixtures causes the crystallization process inhibited and leads to decrease of sugar yield. On the other hand, the presence of free hemi acetal group in invert sugar is not only oxidize the structure of invert sugar into carboxylic acid, but also causes the decreasing in pH solution. Decreasing hydrogen ion concentration will, progressively, increase the sucrose degradation. Due to the related state, an effort is needed to avoid or at least to reduce the sucrose degradation, so the yield and the productivity of cane sugar industry can be improved.
The use of natural compound as inhibitor of invertase is needed as being a convenient way than pressure and temperature treatment and the using of heavy metal ions as an inhibitor. In this research, a kawao (Millettia senceasp) root was used as an inhibitor which could influence the invertase activity. The presence of kawao root will inhibit the invertase activity and reduce forming of invert sugar.
The objective of this research were, (i) to determine the correlation between of substrate concentration, enzyme concentration, pH value, incubation temperature and heat treatment with the addition of the kawao root concerning to sucrose degradation; (ii) to determine the inhibition kinetics parameter (KM and Vmax) of the rate of sucrose degradation with the presence of kawao root. The whole research was using reducing sugar measurement methods as a result of sucrose hydrolysis using DNS (dinitrosalicylate). The influence in each of factors were determined by analysis of variance (ANOVA) and Duncan test. The most suitable model and parameter of inhibition kinetic were determined by using SigmaPlot software.
present of kawao root. But for the first 30 seconds the kawao root was still giving a good response of inhibition.
The kinetic inhibition of sucrose degradation rate by kawao that has been conducted at pH 7 and three temperature treatment (30oC, 40oC, 50oC) resulting a different value of inhibition kinetics parameter (KM and Vmax). The sucrose degradation was getting faster due to the increasing temperature, but the presence of kawao root was still giving a good response of inhibition. The inhibition kinetics model of invertase has had no differences in each temperature. The best fit model was uncompetitive (partial) for all the temperature treatment.
Penggunaan Akar Kawao (Millettia sericeasp)
sebagai Inhibitor Aktivitas Invertase
Ringkasan
Hidrolisis sukrosa terutama yang terjadi pada industri gula tebu merupakan suatu proses kerusakan gula yang perlu dihindari pada produksi gula. Pembentukan gula invert hasil hidrolisis akan menghambat proses kristalisasi sukrosa dan mengurangi rendemen gula yang dihasilkan. Selain itu, terdapatnya gugus hemiasetal bebas pada gula pereduksi memicu terjadinya reaksi oksidasi. Reaksi tersebut menyebabkan struktur gula pereduksi teroksidasi menjadi asam karboksilat dan mengakibatkan pH larutan menjadi asam serta semakin memicu kerusakan sukrosa lebih lanjut. Untuk itu diperlukan suatu upaya yang dapat dilakukan agar kerusakan sukrosa semacam ini dapat dihindari atau minimal dapat dihambat sehingga nilai rendemen dan produktivitas industri gula dapat ditingkatkan.
Penggunaan bahan alami dalam reaksi inhibisi invertase perlu dilakukan untuk menutupi kelemahan yang terdapat pada perlakuan tekanan dan suhu serta penggunaan logam berat sebagai inhibitor. Dalam penelitian ini, digunakan akar kawao (Millettia sericeasp) sebagai bahan inhibitor yang mampu mempengaruhi aktivitas invertase. Penambahan akar kawao mampu mencegah terbentuknya gula pereduksi yang sulit untuk dikristalkan, karena dapat menghambat aktivitas invertase dan juga sebagai anti mikroba penghasil invertase.
Tujuan dari penelitian ini adalah untuk mengetahui hubungan perubahan konsentrasi substrat, konsentrasi enzim, pH, suhu inkubasi dan lama pemanasan akibat penambahan ekstrak kawao pada laju degradasi sukrosa. Selain itu juga untuk menentukan parameter kinetika inhibisi laju degradasi (KM dan Vmaks) sukrosa akibat penambahan ekstrak kawao. Pada penelitian ini digunakan metode pengukuran gula pereduksi sebagai hasil dari hidrolisis sukrosa menggunakan DNS. Setiap perubahan faktor dilakukan uji ragam (ANOVA) dan uji lanjut Duncan. Model inhibisi yang paling sesuai dan nilai parameter kinetikanya ditentukan dengan menggunakan perangkat lunak SigmaPlot.
mampu bertahan hingga 10 detik pemanasan, selanjutnya terjadi penurunan akibat mengalami denaturasi, demikian sama halnya dengan penambahan kawao, namun hingga 30 detik pertama masih memberikan respon inhibisi yang cukup baik.
Kinetika inhibisi laju degradasi sukrosa dilakukan pada kondisi lingkungan pH 7, dengan tiga titik suhu pengamatan (30oC, 40°C, 50°C) menghasilkan nilai KM dan Vmaks yang berbeda seiring dengan peningkatan suhu. Kerusakan sukrosa semakin meningkat seiring dengan meningkatnya suhu, namun penambahan kawao memberikan efek inhibisi yang cukup baik. Model inhibisi yang sesuai dengan data yang diperoleh pada suhu 30oC, 40oC dan 50oC ternyata memberikan hasil yang sama yaitu termasuk dalam model inhibisi un-kompetitif (partial).
LEMBAR PERNYATAAN
Saya menyatakan dengan sebenar-benarnya bahwa skripsi dengan judul :
“Penggunaan Akar Kawao (Millettia sericea sp) sebagai Inhibitor Aktivitas Invertase” adalah karya asli saya sendiri, dengan arahan dosen pembimbing akademik, kecuali yang dengan jelas ditunjukkan rujukannya.
Bogor, Agustus 2006
Yang Membuat Pernyataan
BIODATA RINGKAS
Penulis dilahirkan di Bogor pada hari Jumat tanggal 15 Juli 1983. Penulis adalah anak ke-dua dari empat bersaudara, putra dari pasangan Sudarsih dan Sutomo. Pendidikan dasar penulis dimulai sejak tahun 1989 di Sekolah Dasar Negeri Perwira I Bogor, hingga selesai pada tahun 1995. Penulis melanjutkan pendidikan di SLTP Negeri 4 Bogor hingga selesai pada tahun 1998, kemudian melanjutkan pendidikan di Sekolah Menengah Analis Kimia Bogor (SMAKBO) hingga selesai pada tahun 2002.
Pada tahun 2002, Penulis melanjutkan pendidikan tinggi di Departemen Teknologi Industri Pertanian, Fakultas Teknologi Pertanian, Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB). Alhamdulillah, pada tahun 2006 Penulis menyelesaikan pendidikan tinggi strata 1 dan meraih gelar Sarjana Teknologi Pertanian.
Selama menjadi mahasiswa Institut Pertanian Bogor, penulis aktif menjadi pengurus BEM FATETA-IPB sebagai Staf Departemen Politik dan Advokasi (2003-2004), sebagai asisten praktikum untuk mata kuliah Menggambar Teknik (2003), asisten praktikum Penerapan Komputer (2004), dan asisten praktikum Peralatan Industri Pertanian (2005).
KATA PENGANTAR
Alhamdulillah, segala puji hanyalah milik Allah Azza Wa Jalla. Penulis memanjatkan rasa syukur ke hadirat-Nya atas segala rahmat, karunia, dan ridha-Nya sehingga penulis dapat melakukan penelitian serta menyelesaikan skripsi dengan judul “Penggunaan Akar Kawao (Millettia sericea sp) sebagai Inhibitor Aktivitas Invertase”.
Selama pelaksanaan penelitian hingga selesainya penulisan skripsi ini, penulis banyak mendapatkan bimbingan, dukungan, serta semangat dari berbagai pihak. Menyadari hal tersebut, dengan perasaan yang tulus pada kesempatan ini penulis ingin mengucapkan terima kasih kepada:
1. Prayoga Suryadarma, STP, MT., selaku dosen pembimbing yang telah memberikan bimbingan, motivasi, dan arahan selama penulis menjalani kegiatan akademis dan penelitian di Departemen Teknologi Industri Pertanian. 2. Dr. Ir. Dwi Setyaningsih, MSi. dan Dr. Ono Suparno, STP, MT., selaku dosen penguji yang telah mengevaluasi dan memberikan saran serta masukan bagi kesempurnaan penulisan skripsi ini.
3. Keluarga penulis yaitu Ibu, Bapak, serta saudara-saudaraku atas doa restu, semangat dan motivasi yang tiada henti menyertai diri penulis.
4. Rekan-rekan TIN angkatan 39, terutama rekan kerja penelitian (Rheni H., Annisa R., Fitri F., dan M. Ichsan) yang telah banyak memberikan bantuan, dukungan, semangat dan doa.
5. Para laboran di Departemen Industri Pertanian atas segala bantuan yang telah diberikan selama penulis melakukan penelitian.
6. Rekan, sahabat dan orang-orang yang mendukung kesuksesan penulis yang tak dapat penulis sebutkan satu per satu.
Penulis berharap, semoga karya sederhana ini dapat bermanfaat terutama bagi rekan sejawat.
Bogor, Agustus 2006
DAFTAR ISI
Lembar Pengesahan ... iii
Ringkasan ... iv
Lembar Pernyataan ... viii
Daftar Riwayat Hidup ... ix
Kata Pengantar ... x
Daftar Isi ... xi
Daftar Tabel ... xiii
Daftar Gambar ... xiv
Daftar Lampiran ... xvi
I. PENDAHULUAN A. Latar Belakang ... 1
B. Tujuan Kegiatan ... 3
II. TINJAUAN PUSTAKA A. Sukrosa ... 4
B. Akar Kawao ... 5
C. Invertase ... 5
D. Aktivitas dan Stabilitas Enzim ... 6
E. Faktor yang Mempengaruhi Laju Degradasi Sukrosa ... 7
1. Pengaruh konsentrasi substrat dan enzim ... 7
2. Pengaruh suhu dan tekanan ... 8
3. Pengaruh pH ... 9
4. Pengaruh penambahan garam logam ... 10
5. Perubahan kondisi lingkungan ... 11
F. Kinetika Enzimatik ... 11
1. Inhibisi kompetitif ... 14
2. Inhibisi nonkompetitif ... 14
3. Inhibisi unkompetitif ... 15
III. METODOLOGI A. Alat ... 17
B. Bahan ... 17
C. Tempat dan Waktu Penelitian ... 17
D. Metode Penelitian ... 17
1. Tahapan penelitian ... 17
IV. HASIL DAN PEMBAHASAN
A. Aktivitas Invertase ... 24
B. Penentuan Pengaruh Konsentrasi Inhibitor Kawao ... 25
C. Hubungan Pengaruh Perubahan Faktor terhadap Degradasi Sukrosa 27 1. Pengaruh konsentrasi enzim ... 27
2. Pengaruh konsentrasi substrat ... 30
3. Pengaruh pH ... 32
4. Pengaruh suhu ... 35
5. Pengaruh lama pemanasan ... 38
D. Kinetika Inhibisi Invertase ... 41
V. KESIMPULAN DAN SARAN A. Kesimpulan ... 45
B. Saran ... 46
DAFTAR TABEL
Tabel 1. Pengaruh jenis garam logam dan bahan kimia pada konsentrasi 0.005M
terhadap aktivitas invertase ... 10
Tabel 2. Hasil penentuan parameter kinetika ... 44
Tabel 3. Tabulasi data perbandingan volume pengaruh konsentrasi enzim ... 52
Tabel 4. Tabulasi data perbandingan volume pengaruh konsentrasi substrat ... 52
Tabel 5. Tabulasi data perbandingan volume pengaruh pH ... 53
Tabel 6. Tabulasi data perbandingan volume pengaruh suhu inkubasi ... 53
DAFTAR GAMBAR
Gambar 1. Reaksi hidrolisis sukrosa menjadi glukosa dan fruktosa dengan
bantuan invertase ... 4
Gambar 2. Akar kawao (Millettia sericea) ... 5
Gambar 3. Pengaruh suhu terhadap aktivitas invertase dari nira tebu ... 8
Gambar 4. Pengaruh nilai pH terhadap aktivitas invertase dari nira tebu ... 9
Gambar 5. Pengaruh konsentrasi substrat terhadap kecepatan awal reaksi enzimatik 12 Gambar 6. Kurva Lineweaver-Burk ... 12
Gambar 7. Mekanisme inhibisi kompetitif ... 14
Gambar 8. Plot Lineweaver-Burk untuk inhibisi kompetitif ... 14
Gambar 9. Mekanisme inhibisi nonkompetitif ... 15
Gambar 10. Plot Lineweaver-Burk untuk inhibisi nonkompetitif ... 15
Gambar 11. Mekanisme inhibisi unkompetitif ... 16
Gambar 12. Plot Lineweaver-Burk untuk inhibisi unkompetitif ... 16
Gambar 13. Diagram alir tahapan penelitian ... 18
Gambar 14. Kurva aktivitas invertase dengan nilai persamaan y = 3.2267 x dan koefisien regresi r2 = 0.9721 ... 24
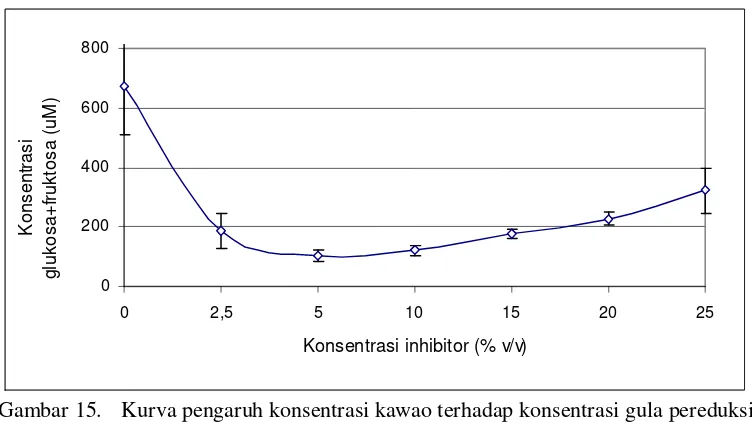
Gambar 15. Kurva pengaruh konsentrasi kawao terhadap konsentrasi gula pereduksi yang dihasilkan ... 26
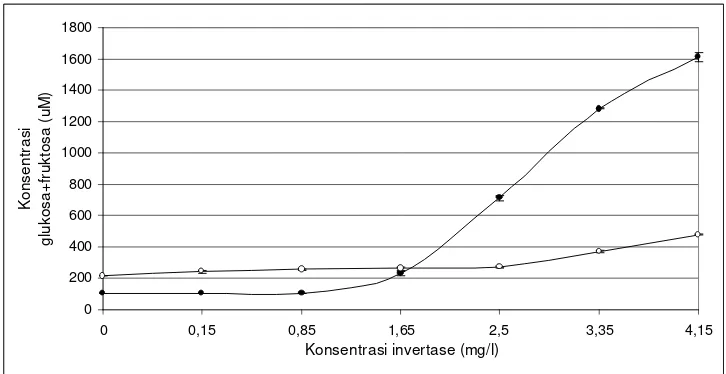
Gambar 16. Kurva pengaruh perubahan konsentrasi enzim terhadap konsentrasi gula pereduksi yang dihasilkan ... 28
Gambar 17. Inhibisi aktivitas invertase oleh kawao pada konsentrasi enzim yang berbeda ... 29
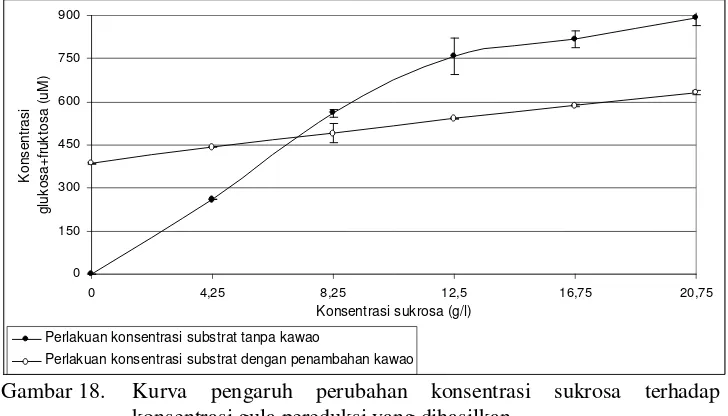
Gambar 18. Kurva pengaruh perubahan konsentrasi sukrosa terhadap konsentrasi gula pereduksi yang dihasilkan ... 30
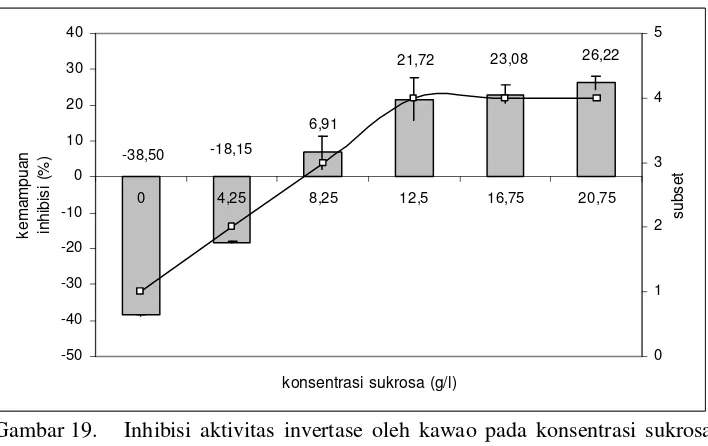
Gambar 19. Inhibisi aktivitas invertase oleh kawao pada konsentrasi sukrosa yang berbeda ... 31
Gambar 20. Kurva pengaruh perubahan pH terhadap konsentrasi gula pereduksi yang dihasilkan ... 33
Gambar 21. Inhibisi aktivitas invertase oleh kawao pada pH yang berbeda ... 35
Gambar 22. Kurva pengaruh perubahan suhu terhadap konsentrasi gula pereduksi yang dihasilkan ... 36
Gambar 23. Inhibisi aktivitas invertase oleh kawao pada suhu yang berbeda ... 37
Gambar 24. Kurva pengaruh lama pemanasan terhadap aktivitas konsentrasi gula pereduksi yang dihasilkan ... 39
Gambar 26. Kurva aktivitas invertase pada suhu 30oC yang ditunjukkan oleh hubungan antara konsentrasi sukrosa dan konsentrasi gula
pereduksi yang dihasilkan ... 41
Gambar 27. Kurva aktivitas invertase pada suhu 40oC yang ditunjukkan oleh hubungan antara konsentrasi sukrosa dan konsentrasi gula
pereduksi yang dihasilkan ... 42
Gambar 28. Kurva aktivitas invertase pada suhu 50oC yang ditunjukkan oleh hubungan antara konsentrasi sukrosa dan konsentrasi gula
pereduksi yang dihasilkan ... 42
Gambar 29. Kurva persamaan kinetika inhibisi invertase oleh kawao pada
masing-masing suhu ... 43
Gambar 30. Kurva standar glukosa+fruktosa, dengan nilai y = 0.0011x - 0.0624
dan r2 = 0.9725 ... 55
Gambar 31. Kurva standar glukosa+fruktosa, dengan nilai y = 0.0005x - 0.0530
dan r2 = 0.9735 ... 57
Gambar 32. Kurva standar glukosa+fruktosa, dengan nilai y = 0.0005x - 0.0545
dan r2 = 0.9841 ... 65
Gambar 33. Kurva standar glukosa+fruktosa, dengan nilai y = 0.0004x - 0.0218
dan r2 = 0.9797 ... 76
Gambar 34. Kurva standar glukosa+fruktosa, dengan nilai y = 0.0004x - 0.0266
DAFTAR LAMPIRAN
Lampiran 1. Prosedur penelitian (tambahan) ... 50
Lampiran 2. Tabulasi data perbandingan volume masing-masing komponen pada pengujian faktor pengaruh aktivitas enzim ... 52
Lampiran 3. Data hasil analisis sidik ragam dan uji lanjut Duncan ... 55
Lampiran 4. Data kinetika inhibisi suhu 30oC ... 76
Lampiran 5. Data kinetika inhibisi suhu 40oC ... 78
Lampiran 6. Data kinetika inhibisi suhu 50oC ... 80
I. PENDAHULUAN
Hampir semua enzim dapat dihambat oleh senyawa kimia tertentu. Senyawa penghambat enzim sangat berguna dalam menjelaskan lintas metabolik di dalam sel. Lebih lanjut, beberapa obat yang bermanfaat di dalam dunia kedokteran nampaknya berfungsi karena senyawa ini dapat menghambat enzim-enzim tertentu yang mengganggu kerja sel. Enzim telah menjadi alat praktis yang penting, bukan hanya dalam dunia kesehatan, tetapi juga dalam industri kimiawi, dalam pengolahan pangan, dan pertanian.
A. Latar Belakang
Sukrosa (glukosa-1,2-fruktosa) yang termasuk dalam golongan disakarida merupakan bahan pemanis yang umum digunakan untuk konsumsi manusia. Salah satu sumber alami sukrosa yang paling utama adalah tebu, yang mengandung hingga 20% sukrosa berdasarkan berat. Sukrosa bukanlah termasuk gula pereduksi, berbeda dengan monosakarida penyusunnya yakni glukosa dan fruktosa yang merupakan gula pereduksi.
Hidrolisis sukrosa terutama yang terjadi pada industri gula tebu merupakan suatu proses kerusakan gula yang perlu dihindari. Pembentukan gula invert hasil hidrolisis akan menghambat proses kristalisasi sukrosa dan mengurangi rendemen gula yang dihasilkan. Faktor inilah yang menjadi salah satu penyebab produktivitas dan efisiensi industri gula menjadi rendah. Adanya kandungan gula pereduksi seperti fruktosa dan glukosa menyebabkan sulitnya proses kristalisasi sukrosa menjadi gula pasir. Selain itu, terdapatnya gugus hemiasetal bebas pada gula pereduksi memicu terjadinya reaksi oksidasi. Reaksi tersebut menyebabkan struktur gula pereduksi teroksidasi menjadi asam aldonat dan mengakibatkan pH larutan menjadi asam serta semakin memicu kerusakan sukrosa lebih lanjut. Untuk itu diperlukan suatu upaya yang dapat dilakukan agar kerusakan sukrosa semacam ini dapat dihindari atau minimal dapat dihambat sehingga nilai rendemen dan produktivitas industri gula dapat ditingkatkan.
invertase, ataupun keberadaan invertase yang memang terdapat dalam nira. Keberadaan invertase terkait erat dengan keberadaan sukrosa, karena hampir di sebagian besar tanaman, sukrosa merupakan bentuk umum senyawaan karbon yang dimetabolisme oleh sel tanaman, dan invertase berperan dalam aktivitas metabolisme sukrosa tersebut. Selain itu perlakuan proses kimia (pengaruh asam, suhu tinggi) juga turut memicu terjadinya hidrolisis sukrosa.
Secara kimiawi, penurunan aktivitas enzim sebagai upaya mengurangi kerusakan gula dapat dilakukan dengan pengendalian perlakuan proses atau penambahan garam logam. Namun, upaya tersebut perlu dikurangi pada proses industri pangan terutama terkait dengan isu kesehatan. Upaya lain adalah menurunkan aktivitas enzim, terutama invertase, baik yang terdapat dalam nira maupun hasil ekstraseluler mikroorganisme dengan cara penambahan bahan alami sebagai inhibitor yang mampu menghambat aktivitas enzim.
Beberapa upaya penghambatan laju kerusakan sukrosa melalui penurunan aktivitas invertase telah dilakukan baik dengan perlakuan suhu, tekanan serta penambahan inhibitor. Causette et al. (1998) melakukan inaktivasi enzim dengan menggunakan gelembung gas inert, menurutnya perlakuan suhu dan tekanan yang tinggi akan mempengaruhi kualitas produk (sukrosa) akibat terjadinya reaksi lain yang tidak diinginkan (lateral reaction). Cavaille dan Didier (1996) mengkombinasikan perlakuan tekanan tinggi dengan suhu untuk menginaktivasi invertase, sedangkan Trojanowicz et al.
(2004) dan Pirvutoiu (2001) melakukan penelitian tentang pengaruh keberadaan kation logam Hg (II) terhadap inhibisi invertase.
(2003) yang mengidentifikasi keberadaaan inhibitor invertase di dalam tembakau dan tomat.
Dalam penelitian ini, digunakan akar kawao (Millettia sericea) sebagai bahan inhibitor yang mampu mempengaruhi aktivitas invertase. Akar kawao digunakan oleh petani gula aren dengan cara menambahkan tumbukan akar kawao seruas jari ke dalam bumbung tempat penyadapan nira. Penambahan akar kawao tersebut mampu mencegah terbentuknya gula pereduksi yang sulit untuk dikristalkan, karena dapat menghambat aktivitas invertase juga sebagai anti mikroba penghasil invertase.
Selain itu, perlunya mengetahui perubahan faktor seperti pengaruh konsentrasi enzim, konsentrasi substrat, pH lingkungan, suhu inkubasi dan lama pemanasan, sehingga dapat diketahui langkah yang tepat dalam upaya mengurangi kerusakan sukrosa.
B. Tujuan
Tujuan penelitian ini antara lain,
1. Menentukan hubungan perubahan konsentrasi substrat, konsentrasi enzim, pH, suhu inkubasi dan lama pemanasan akibat penambahan ekstrak kawao (Millettia sericea) pada laju degradasi sukrosa.
II. TINJAUAN PUSTAKA
A. Sukrosa
Sukrosa, biasanya diketahui sebagai gula meja (table sugar), merupakan disakarida yang tersusun atas sebuah molekul α-D-glukosa dan sebuah molekul β-D-fruktosa yang dihubungkan oleh ikatanα-1,2-glikosidik. Ketika ikatan α-1,2-glikosidik terputus oleh reaksi hidrolisis, akan terbentuk campuran glukosa dan fruktosa. Campuran monosakarida tersebut dikenal sebagai gula invert (invert sugar), yang merupakan turunan dari sukrosa. Sukrosa (glukosa-1,2-fruktosa) merupakan bahan pemanis yang umum dan banyak digunakan dalam konsumsi hidup manusia, dan salah satu sumber penting penghasil sukrosa tersebut adalah gula tebu yang mengandung hingga mencapai 20% (w/w) sukrosa (Glazer dan Nikaido, 1995 dalam Filho et al., 1999). Degradasi sukrosa dapat pula terjadi melalui hidrolisis asam atau secara enzimatis menggunakan invertase (Monsan et al., 1984 dalam Filho et al., 1999). Demikian pula dengan Rahman et al. (2004) yang menyatakan bahwa sukrosa dapat dihidrolisis dengan bantuan enzim yaitu invertase atau sukrase.
Reaksi hidrolisis sukrosa menjadi glukosa dan fruktosa dengan bantuan invertase dapat dilihat pada Gambar 1.
B. Akar Kawao
Kawao (Milletia sericea) merupakan tumbuhan perdu yang memanjat, cegak, panjang 10-30 m, banyak ditemukan di hutan dan tepi sungai mulai dari dataran rendah sampai ±1000 m dpl. Tumbuhan ini mudah tumbuh di tanah berlumpur seperti pinggir air tawar dekat pantai. Warna akarnya coklat kehitam-hitaman, gemangnya sebesar jari tangan, bagian teras berair, sebagian dari akar keluar di atas lumpur, digunakan untuk membius ikan. Orang Jawa memberikan sepotong akar dalam cairan nira yang masih segar agar cairan tersebut tidak menjadi asam (Heyne, 1987). Akar kawao diperlihatkan pada Gambar 2.
Gambar 2. Akar kawao (Millettia sericea)
C. Invertase
Invertase, yang memecah molekul sukrosa menjadi fruktosa dan glukosa merupakan salah satu enzim yang pertama ditemukan. Enzim ini diisolasi pada pertengahan kedua di abad 19, dan nama enzim tersebut ditentukan karena fungsinya yang menghasilkan gula invert, yaitu campuran 1:1 D-glukosa (dextrorotatory) dan D-fruktosa (levorotatory) (Alberto, et al.,
2004).
Sistem tata nama untuk invertase adalah beta-fructofuranosidase (EC 3.2.1.26), dan nomor klasifikasi tersebut menunjukkan bahwa reaksi yang dikatalisasi adalah reaksi hidrolisis. Berbeda dengan enzim lainnya, invertase memiliki aktivitas yang tinggi pada nilai pH 3,5 – 5,5, dengan nilai optimum mendekati nilai pH 4,5. Aktivitas enzim mencapai nilai maksimum pada suhu 55oC. Nilai Michaelis-Menten untuk jenis enzim yang berbeda bervariasi, tetapi kebanyakan enzim memiliki nilai KM antara 2-5 mM (Wang, 2002).
Reed (1966) dalam Pancoast (1980) menyatakan bahwa ragi
sumber utama penghasil invertase untuk aplikasi industri. Aspergillus orizae
danAspergillus niger adalah fungi yang juga merupakan sumber invertase. Invertase sebagian besar digunakan dalam industri makanan di mana fruktosa lebih disukai dibandingkan dengan sukrosa sebab fruktosa lebih manis dan tidak mengkristal dengan mudah. Namun, penggunaan invertase agak terbatas sebab enzim yang lain yakni glukosa isomerase, dapat digunakan untuk mengkonversi glukosa menjadi fruktosa dengan murah, selain itu dengan alasan kesehatan dan pertimbangan rasa, penggunaannya di dalam industri makanan memerlukan invertase yang tinggi tingkat kemurniannya (Wang, 2002).
D. Aktivitas Dan Stabilitas Enzim
Aktivitas enzim didefinisikan sebagai kecepatan pengurangan substrat atau kecepatan pembentukan produk pada kondisi optimum. Satu unit aktivitas enzim didefinisikan sebagai satu mikromol (µmol; 10-6 mol), nanomol (nmol; 10-9 mol), atau pikomol (pmol; 10-12) substrat yang bereaksi atau produk yang dikatalisis setiap menit (Rodwell, 1981).
Stabilitas dan aktivitas enzim ditentukan oleh konformasi tiga dimensinya. Aktivitas enzim pada suhu tinggi terjadi melalui dua mekanisme, yaitu mekanisme intrinsik dan ekstrinsik. Mekanisme intrinsik yaitu struktur enzim secara alamiah mendukung aktivitasnya yang dipengaruhi oleh faktor-faktor interaksi elektrostatik, interaksi hidrofobik, kandungan asam amino alifatik, ikatan disulfida, dan kekompakan struktur. Ikatan hidrofobik akan semakin kuat pada suhu tinggi untuk enzim termostabil, sebaliknya akan semakin lemah untuk enzim termolabil karena terjadi denaturasi. Mekanisme ekstrinsik yaitu terjadinya stabilitas panas akibat adanya interaksi multipoint dengan komponen-komponen lain dan adanya faktor penstabil panas, yaitu pengikatan substrat dengan komponen berberat molekul rendah, kontak antara protein-protein, gugus prostetik, kation logam dan lain-lain (Nam-Soo dan Kim, 1991).
struktur tersebut pada suhu, pH dan konsentrasi ion normal, antara lain ikatan hidrogen, gaya tarik ionik, interaksi hidrofobik dan jembatan kovalen (Lehninger, 1988).
Aktivitas enzim dipengaruhi oleh konsentrasi substrat, pH, dan suhu, selain itu memiliki aktivitas yang optimal pada nilai tertentu untuk setiap parameter tersebut. Konsentrasi substrat yang rendah menyebabkan daerah aktif pada enzim tidak semuanya terikat pada substrat. Terdapat suhu optimal dimana reaksi berlangsung sangat cepat. Ketika suhu di atas suhu optimal, kecepatan reaksi menurun tajam karena enzim sebagai protein akan terdenaturasi, sedangkan pada suhu terlalu rendah beberapa enzim tidak dapat bekerja. Aktivitas enzim juga dipengaruhi oleh pH karena sifat ionik gugus karboksil dan gugus amino mudah dipengaruhi pH (Pelczar dan Chan, 1986). E. Faktor Yang Mempengaruhi Laju Degradasi Sukrosa
Sukrosa mudah mengalami kerusakan atau degradasi. Proses degradasi sukrosa dapat disebabkan oleh reaksi enzimatis maupun kimiawi (Monsan et al., 1984 dalam Filho et al., 1999). Banyak faktor yang mempengaruhi kerusakan sukrosa, salah satunya adalah yang disebabkan oleh reaksi enzimatis (misal invertase).
Reaksi enzimatis dipengaruhi oleh beberapa faktor antara lain suhu dan tekanan, pH, dan penambahan inhibitor (biasanya berupa garam logam atau senyawa kimia lainnya).
1. Pengaruh Konsentrasi Substrat dan Enzim
Invertase dapat mengkatalisis sukrosa pada konsentrasi di atas 59% w/v. Peningkatan konsentrasi sukrosa lebih lanjut sampai 80% w/v menurunkan aktivitas enzim secara signifikan, mungkin disebabkan oleh konsentrasi air rendah, inhibisi oleh substrat atau agregasi substrat (Somiari dan Bielecki, 1995 dalam Filhoet al, 1999).
pada konsentrasi substrat yang tinggi dan cenderung membentuk asimtot. Jenis penghambatan ini akan membentuk kompleks (dead end complex), satu sisi molekul substrat terikat pada enzim dan molekul substrat lain terikat pada sisi lain (sekunder) enzim (Suryani dan Mangunwidjaya, 2002).
2. Pengaruh Suhu dan Tekanan
Suhu merupakan salah satu faktor yang dapat mempengaruhi aktivitas enzim. Peningkatan suhu dapat meningkatkan reaksi, akan tetapi peningkatan suhu yang tinggi akan menyebabkan denaturasi protein, sehingga akan menurunkan aktivitas enzim. Pengaruh suhu terhadap aktivitas invertase dapat dilihat pada Gambar 3 (Rahmanet al., 2004).
0
Gambar 3. Pengaruh suhu terhadap aktivitas invertase dari nira tebu (Rahmanet al., 2004)
Berdasarkan Gambar 3, dapat diketahui bahwa faktor suhu berpengaruh terhadap aktivitas invertase. Semakin tinggi suhu yang diberikan akan meningkatkan aktivitas invertase. Di lain pihak, peningkatan suhu lebih lanjut (di atas 60oC) dapat menyebabkan penurunan aktivitas invertase. Peingkatan suhu di atas 60oC dapat menyebabkan denaturasi protein yang merupakan senyawa penyusun enzim. Selain suhu, tekanan juga merupakan faktor yang berpengaruh terhadap aktivitas enzim.
enzim (Cavaille dan Didier, 1996). Perlakuan suhu dan tekanan yang tinggi dapat menurunkan aktivitas invertase, juga mempengaruhi kualitas produk (sukrosa) akibat terjadinya reaksi lain yang tidak diinginkan (lateral reaction) (Causetteet al., 1998).
3. Pengaruh pH
Nilai pH merupakan faktor yang juga berpengaruh terhadap aktivitas enzim. Kebanyakan dari enzim tidak aktif atau infaktif pada nilai pH yang ekstrim. Hal tersebut dapat disebabkan oleh nilai pH yang ekstrim dapat merusak protein yang merupakan komponen penyusun enzim. Pengaruh faktor nilai pH terhadap aktivitas enzim dapat dilihat pada Gambar 4 (Rahmanet al., 2004).
0
Gambar 4. Pengaruh nilai pH terhadap aktivitas invertase dari nira tebu (Rahmanet al., 2004)
Aktivitas invertase dari nira tebu menurut Gambar 4 tersebut di atas dipengaruhi oleh faktor nilai pH. Peningkatan aktivitas enzim terlihat mulai dari nilai pH 2 sampai dengan pH 7. Namun, peningkatan pH di atas 7 menyebabkan aktivitas invertase menjadi menurun. Setiap enzim akan memberikan profil karakteristik yang spesifik pada rentang pH tertentu, nilai pH optimum diperoleh akibat interaksi struktur maupun kondisi ionik di antara enzim, substrat atau kofaktor yang terlibat.
Stauffer (1989) menyatakan bahwa hubungan perubahan pH dengan laju reaksi enzim dapat disebabkan oleh tiga hal, yakni:
b. Berubahnya muatan ion molekul substrat atau sisi aktif enzim sehingga mempengaruhi kecenderungan pembentukan kompleks ES.
c. Pergeseran nilai pH dari kondisi netral dapat melemahkan stabilitas konformasi protein, menyebabkan terjadinya denaturasi enzim yang bersifatirreversible.
4. Pengaruh Penambahan Garam Logam
Penambahan garam logam dan senyawa kimia lainnya dapat menyebabkan peningkatan atau penurunan aktivitas enzim. Perubahan aktivitas enzim tersebut dipengaruhi oleh jenis garam logam ataupun senyawa kimia yang ditambahkan. Pada Tabel 1 diperlihatkan mengenai pengaruh penambahan beberapa jenis garam logam dan senyawa kimia lainnya terhadap aktivitas enzim.
Tabel 1. Pengaruh jenis garam logam dan bahan kimia pada konsentrasi 0,005 M terhadap aktivitas invertase
No. Garam/bahan kimia Aktivitas relatif (%)
1 Tanpa bahan tambahan 100,00
2 MgCl2 115,00
3 KCl 110,82
4 NaCl 120,00
5 MnCl2 120,00
14 EDTA 52,74
15 Glukosa 76,00
16 Asam asetat 45,30
Sumber: Rahmanet al. (2004)
Berdasarkan Tabel 1 dapat diketahui bahwa aktivitas invertase dapat dipengaruhi oleh keberadaan garam logam. Sebagian ada yang menghambat aktivitas enzim, namun sebagian lagi dapat meningkatkan aktivitas invertase yang berasal dari tanaman tebu.
semakin kuat ikatannya dengan protein, sehingga ikatan tersebut lebih stabil dan konstan (Darmono, 1995).
5. Perubahan Kondisi Lingkungan
Perlakuan suhu yang tinggi dapat menginaktivasi enzim dan mikroorganisme, akan tetapi perlakuan suhu yang tinggi juga dapat menyebabkan perubahan produk, sehingga kualitasnya menurun. Metode lain yang dapat digunakan untuk menurunkan aktivitas enzim dan mikroorganisme tanpa merusak produk yang diinginkan adalah dengan cara pemberian gelembung gas inert. Pemberian gelembung gas inert nitrogen mampu menurunkan aktivitas enzim (Causetteet al., 1998). F. Kinetika Enzimatik
Enzim merupakan katalisator sejati. Molekul ini dapat meningkatkan kecepatan reaksi kimia spesifik yang tanpa adanya enzim akan berlangsung lambat secara nyata. Terdapat dua cara umum dalam meningkatkan kecepatan reaksi kimia. Pertama dengan meningkatkan suhu, yang mempercepat gerak termal molekul. Umumnya kecepatan reaksi kimia meningkat hingga kira-kira 2 kali dengan kenaikan suhu 10oC. Kedua, dengan menambahkan katalisator. Katalisator mampu menurunkan energi aktivasi, sehingga mempercepat reaksi kimia (Lehninger, 1988).
Setiap enzim memiliki sifat yang khas, dinyatakan dalam suatu tetapan yaitu KM (tetapan Michaelis-Menten). Hampir semua enzim memiliki kurva kecepatan reaksi dengan bentuk umum yang hampir sama yaitu hiperbola. Michaelis-Menten mendefinisikan suatu tetapan untuk menyatakan hubungan antara konsentrasi substrat dan kecepatan reaksi enzimatik. KM didefinisikan sebagai konsentrasi substrat tertentu pada saat enzim mencapai setengah kecepatan maksimumnya. Persamaan Michaelis-Menten adalah:
[ ]
KM = tetapan Michaelis-Menten enzim pada substrat tertentu
[S] = konsentrasi substrat
Gambar 5. Pengaruh konsentrasi substrat terhadap kecepatan awal reaksi enzimatik (lehninger, 1988)
Nilai KM dan Vmaks sulit untuk ditentukan secara tepat dari grafik sederhana yang ditunjukkan pada Gambar 5, karena Vmakshanya diduga dan tidak dapat diketahui nilai yang sebenarnya. Nilai KM yang lebih tepat dapat diperoleh dengan memetakan data yang sama dengan cara yang berbeda, yakni pemetaan kebalikan-ganda, didapat dari transformasi aljabar persamaan Michaelis-Menten. Hasil transformasi persamaan Michaelis-Menten dikenal dengan persamaan Lineweaver-Burk.
maks maks
M
o V S V
K V
1 1
1 = +
Selain dapat menentukan Vmaks secara lebih tepat, persamaan ini bermanfaat dalam menganalisa penghambatan enzim (Lehninger, 1988). Persamaan Lineaweaver-Burk menghasilkan kurva yang ditunjukkan pada Gambar 6. Nilai KM menunjukkan tingkat afinitas antara substrat dan enzim. Nilai KM yang rendah menunjukkan nilai afinitas yang tinggi (Lee, 2003).
Kinetika inhibisi enzim menyangkut penentuan fungsi laju reaksi terhadap konsentrasi substrat dengan inhibitor pada berbagai konsentrasi. Kurva Lineweaver-Burk memungkinkan untuk menentukan jenis inhibisi yang bersifatreversible, antara lain sebagai berikut.
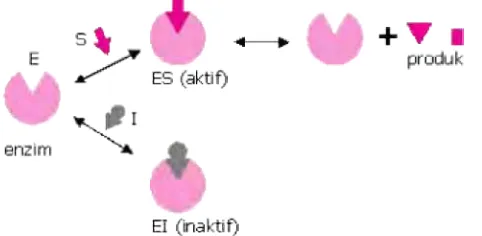
Banyak bahan mengubah aktivitas dari suatu enzim dengan menggabungkannya dalam suatu jalur yang mempengaruhi ikatan substrat. Bahan-bahan yang mereduksi aktivitas suatu enzim dengan cara ini dikenal sebagai inhibitor. Inhibitor berupa bahan yang secara struktural menyerupai substrat enzimnya tetapi salah satunya tidak bereaksi atau bereaksi dengan sangat lambat dibandingkan dengan substrat. Inhibitor-inhibitor seperti ini pada umumnya digunakan untuk menyelidiki sifat kimia dan sifat konformasi alami dari suatu daerah (site) ikatan substrat sebagai bagian dari suatu usaha untuk mengelusidasi mekanisme katalisis enzim tersebut (Simanjuntak dan Silalahi, 2003).
Ada berbagai mekanisme di mana inhibitor enzim dapat bekerja. Menurut (Birch, 2005), inhibitor enzim secara garis besar terbagi menjadi dua jenis:
1) Inhibisi tidak dapat balik (irreversible), yakni yang menyebabkan in-aktivasi tidak dapat balik pada enzim. Biasanya disebabkan oleh modifikasi ikatan kovalen terhadap struktur enzim. Pengaruh kinetika pada inhibitor tidak dapat balik adalah menurunkan konsentrasi enzim aktif, juga menurunkan kemungkinan konsentrasi maksimum kompleks ES (enzim-substrat). Inhibitor tidak dapat balik umumnya merupakan racun dan tidak diperkenankan untuk tujuan pengobatan.
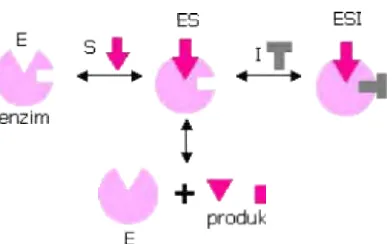
1. Inhibisi Kompetitif
Inhibitor pada model inhibisi ini bersaing dengan substrat untuk memasuki sisi aktif enzim. Struktur kimia inhibitor umumnya menyerupai substrat. Oleh sebab itu, inhibitor tersebut dapat berikatan secara
reversible dengan enzim (Rodwell, 1981). Mekanisme inhibisi kompetitif dapat dilihat pada Gambar 7 .
Gambar 7. Mekanisme inhibisi kompetitif
Penyajian garis lurus pada kurva Lineweaver-Burk memotong sumbu ordinat pada titik yang sama. Vmaks tidak dipengaruhi oleh inhibitor (Suryani dan Mangunwidjaja, 2002). Kurva Lineweaver-Burk untuk model inhibisi kompetitif ditunjukkan pada Gambar 8.
Gambar 8. Plot Lineweaver-Burk untuk inhibisi kompetitif
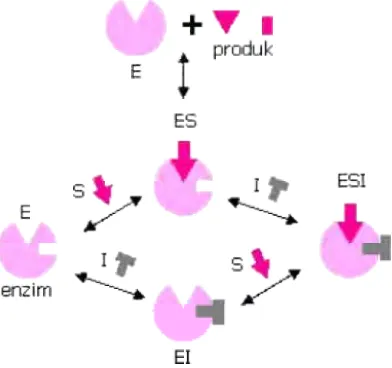
2. Inhibisi Nonkompetitif
mempengaruhi nilai KM, ditunjukkan oleh kurva Lineweaver-Burk pada Gambar 10. Mekanisme reaksi inhibisi nonkompetitif dapat dilihat pada Gambar 9.
Gambar 9. Mekanisme inhibisi nonkompetitif
Gambar 10. Plot Lineweaver-Burk untuk inhibisi nonkompetitif
3. Inhibisi Unkompetitif
Gambar 11. Mekanisme inhibisi unkompetitif
Inhibitor yang bersifat unkompetitif akan mempengaruhi fungsi enzim, tetapi tidak terhadap ikatannya dengan substrat. Plot Lineweaver-Burk untuk inhibisi unkompetitif adalah linier dengan kemiringan atau
slope KM/Vmaks seperti pada reaksi tanpa inhibitor, dapat dilihat pada Gambar 12 (Simanjutak dan Silalahi, 2003).
III. METODOLOGI
A. Alat
Peralatan yang digunakan dalam penelitian ini antara lain peralatan gelas (erlenmeyer, gelas piala, pipet tetes, corong, tabung reaksi); peralatan ukur (labu takar, gelas ukur, pipet volumetri, pipet mikro, termometer, spektrofotometer, stopwatch, buret, neraca); dan peralatan pendukung (penangas air,sentrifuge, mortar, pisau,vortex).
B. Bahan
Bahan utama yang digunakan dalam penelitian ini adalah sukrosa, invertase (Sigma-Aldrich 19253: pH 4.5, 55°C, 355 units/mgsolid), dan akar kawao (Milletia sericea). Akar kawao (Millettia sericea) diperoleh dari perkebunan agropolitan daerah Leuwiliang Bogor. Bahan yang digunakan untuk analisa adalah NaOH 0.1 N dan HCl 0.1 N, indikator PP, glukosa, fruktosa, buffer pH 3-11, pereaksi DNS (dinitro salicylic acid) dan aquades. C. Tempat dan Waktu Penelitian
Penelitian dilakukan di laboratorium bioindustri, Departemen Teknologi Industri Pertanian, Fateta IPB. Pengujian secara spektrofotometri dilakukan di laboratorium genetika, Pusat Antar Universitas (PAU) IPB. Rentang waktu penelitian dimulai pada bulan Januari – Juni tahun 2006. D. Metode Penelitian
Metode penelitian ini meliputi tahapan penelitian dan prosedur percobaan. Tahapan penelitian merupakan tahapan yang dilalui untuk mencapai tujuan penelitian, sedangkan prosedur percobaan merupakan urutan kegiatan dan tatacara yang secara teknis dikerjakan dalam setiap tahapan penelitian.
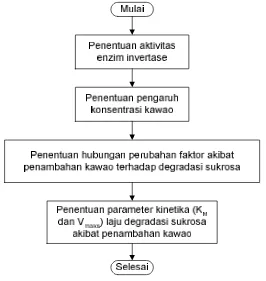
1. Tahapan Penelitian
kawao, (3) Penentuan hubungan perubahan faktor akibat penambahan kawao terhadap degradasi sukrosa, (4) Penentuan parameter kinetika (KM dan Vmaks) laju degradasi sukrosa akibat penambahan kawao. Diagram alir tahapan penelitian dapat dilihat pada Gambar 13.
Gambar 13. Diagram alir tahapan penelitian
a. Penentuan aktivitas invertase
Aktivitas invertase ditentukan untuk mengetahui kondisi awal enzim yang akan digunakan. Aktivitas invertase diperoleh dengan memplotkan kurva hubungan antara waktu reaksi dengan konsentrasi produk yang terbentuk. Nilai slope yang diperoleh menunjukkan aktivitas invertase yang diukur. Aktivitas enzim diukur berdasarkan definisi satu unit aktivitas invertase, yaitu banyaknya invertase yang dapat membebaskan 1 mikromol gula pereduksi dari substrat sukrosa selama 1 menit pada kondisi percobaan. Kondisi yang digunakan yakni pada kondisi optimum invertase, pada suhu 55°C, di dalam larutan
b. Penentuan pengaruh konsentrasi kawao
Konsentrasi inihibitor akar kawao perlu ditentukan dan disesuaikan dengan komposisi campuran subtrat dan enzim yang akan digunakan, sehingga diperoleh batas konsentrasi optimum yang dapat terukur melalui kurva standar. Konsentrasi inhibitor yang diperoleh selanjutnya digunakan untuk karakterisasi invertase dengan penambahan inhibitor. Nilai gula pereduksi yang lebih rendah dari kontrol (perlakuan invertase tanpa inhibitor) menunjukkan terjadinya inhibisi. Pengaruh yang berbeda nyata diukur berdasarkan analisis sidik ragam (ANOVA) dan uji lanjut Duncan.
c. Penentuan hubungan perubahan faktor akibat penambahan kawao terhadap degradasi sukrosa.
Perubahan faktor yang dilakukan pada karakterisasi invertase meliputi pengaruh konsentrasi substrat, konsentrasi enzim, pH, suhu, dan lama pemanasan dengan ditambahkan kawao. Hasil dari tahap ini didapatkan kurva profil pengaruh perubahan faktor akibat penambahan kawao terhadap aktivitas invertase. Pengaruh yang diidentifikasi adalah adanya kenaikan atau penurunan konsentrasi gula pereduksi pada setiap taraf yang diujikan berdasarkan analisis sidik ragam dan uji lanjut Duncan.
d. Penentuan parameter kinetika (KM dan Vmaks) laju degradasi
sukrosa akibat penambahan kawao.
program SigmaPlot 2004 for Windows Version 9.01 dari Systat Software Inc.
2. Prosedur Percobaan
Prosedur percobaan yang dilakukan pada penelitian ini adalah sebagai berikut.
a. Penentuan aktivitas invertase
Larutan kerja invertase 0.01 g/l (yang telah dibuat seperti pada Lampiran 1), disiapkan pada 8 buah tabung reaksi dengan volume masing-masing 1 ml. Secara terpisah, disiapkan pula larutan sukrosa 50 g/l pada 8 buah tabung reaksi berbeda, dengan volume masing-masing 0.5 ml sukrosa dan 0.5 ml air. Seluruh tabung reaksi tersebut yang berjumlah 16 buah, kemudian diinkubasi dalam penangas air yang bersuhu 55°C selama kurang lebih 5 menit. Selanjutnya secara berpasangan, tiap tabung yang berisi sukrosa dimasukkan ke dalam tabung reaksi yang berisi invertase, reaksi berlangsung pada kondisi suhu 55oC. Waktu reaksi (t) mulai diukur pada saat larutan sukrosa kontak dengan invertase. Reaksi dihentikan pada masing-masing waktu yang diujikan, yaitu 30, 60, 90, 120, 180, 240, dan 300 (detik), dengan menambahkan 2 ml pereaksi DNS. Setelah itu dimasukkan ke dalam penangas air pada suhu 95 °C selama 10 menit. Setelah 10 menit, tabung reaksi dikeluarkan dan didinginkan untuk diukur absorbansinya pada panjang gelombang 540 nm.
b. Penentuan konsentrasi inhibitor
0.01 g/l pada masing-masing tabung reaksi (waktu reaksi mulai dihitung, t = 0). Pada saat waktu reaksi 5 menit (t = 5 menit), reaksi dihentikan dengan penambahan pereaksi DNS. Prosedur penghentian reaksi dan pengukuran sesuai dengan prosedur sebelumnya pada penentuan aktivitas invertase.
c. Penentuan pengaruh perubahan faktor
Penentuan pengaruh perubahan faktor dilakukan pada kondisi dengan penambahan inhibitor kawao yang dibandingkan dengan perlakuan kondisi normal (tanpa penambahan inhibitor kawao). Prosedur yang dilakukan pada perlakuan tanpa inhibitor (normal) sama halnya dengan pengujian pada penambahan inhibitor, hanya saja tidak ditambahkan larutan kawao. Untuk setiap pengujian pengaruh perubahan faktor, digunakan ekstrak kawao yang segar dan bukan berasal dari larutan stok ekstrak kawao. Total volume larutan dalam setiap tabung reaksi pada pengujian tetap sama yakni 2 ml, sehingga volume yang ditambah atau dikurangi adalah aquades dan buffer. Secara tabulasi data perbandingan volume masing-masing komponen dapat dilihat pada Lampiran 2.
1. Pengaruh konsentrasi enzim
2. Pengaruh konsentrasi substrat
Larutan invertase 0.01 g/l sebanyak 1.0 ml dimasukkan ke dalam masing-masing tabung reaksi yang sebelumnya telah ditambahkan larutan sukrosa 50 g/l (pada rentang konsentrasi yang berbeda) dan larutan kawao sebanyak 0.1 ml. Kemudian aquades ditambahkan hingga volume campuran mencapai 2.0 ml. Waktu reaksi dihitung saat enzim mulai ditambahkan ke dalam larutan sukrosa, reaksi berlangsung pada suhu ruang (28 ± 2oC) selama 5 menit. Pengukuran reaksi hidrolisis mengikuti prosedur sebelumnya.
3. Pengaruh pH
Larutan invertase 0.01 g/l sebanyak 1.0 ml dilarutkan dengan menggunakan buffer pH yang bervariasi (pH 3 - 11) pada tabung reaksi. Selanjutnya masing-masing tabung reaksi ditambahkan larutan kawao sebanyak 0.1 ml dan 0.9 ml larutan sukrosa 50 g/l. Waktu reaksi dihitung saat sukrosa mulai ditambahkan ke dalam larutan enzim, reaksi berlangsung selama 5 menit pada suhu ruang (28 ± 2 oC). Pengukuran reaksi hidrolisis mengikuti prosedur sebelumnya.
4. Pengaruh suhu
5. Pengaruh lama pemanasan
Larutan invertase 0.01 g/l sebanyak 1.0 ml dimasukkan ke dalam masing-masing tabung reaksi yang telah berisi air 0.4 ml, kemudian dipanaskan dengan waktu yang bervariasi yaitu 0, 10, 20, 30, 40, 50, 60 dan 300 (detik). Setelah waktu yang diperlukan tercapai, tabung reaksi dikeluarkan dari penangas air dan didinginkan. Setelah itu ditambahkan ke dalamnya larutan kawao sebanyak 0.1 ml dan terakhir ditambahkan larutan sukrosa 50 g/l sebanyak 0.5 ml. Waktu reaksi dihitung saat sukrosa mulai ditambahkan ke dalam larutan enzim, reaksi berlangsung selama 5 menit pada suhu ruang (28 ± 2 oC). Pengukuran reaksi hidrolisis mengikuti prosedur sebelumnya.
d. Penentuan parameter kinetika
Penentuan parameter kinetika inhibisi sama halnya dengan penentuan perubahan faktor seperti telah dijelaskan sebelumnya. Analisis yang dilakukan adalah dengan menggunakan metode DNS. Kondisi inhibisi invertase oleh kawao dilakukan pada pH 7 dan pada tiga titik suhu pengamatan (30oC, 40oC, dan 50oC) dengan berdasar pada perubahan konsentrasi substrat.
IV. HASIL DAN PEMBAHASAN
Hasil penelitian dikelompokkan sesuai dengan tahapan penelitian yang dilakukan. Penyajian grafik dalam bentuk garis dan batang, relatif lebih disukai untuk memudahkan dalam interpretasi data. Data-data pendukung lain yang bersifat teknis, dilampirkan pada akhir laporan ini.
A. Aktivitas Invertase
Aktivitas katalitik suatu enzim merupakan suatu karakterisasi yang diukur berdasarkan peningkatan laju reaksi konversi substrat menjadi produk pada suatu reaksi kimia spesifik oleh enzim tersebut. Hal ini merupakan karakterisasi kuantitas enzim secara umum, sedangkan secara khusus adalah penentuan aktivitas katalitik spesifik yang biasanya dilakukan pada pemurnian enzim, di mana aktivitas katalitik dibagi dengan massa protein.
Penentuan aktivitas invertase penting dilakukan untuk mengetahui seberapa besar perubahan penurunan sukrosa (µmol) menjadi gula pereduksi setiap menit reaksi. Selain itu, nilai aktivitas enzim yang diketahui menunjukkan kemampuan enzim dalam mengkatalisis suatu reaksi. Aktivitas invertase terukur, digambarkan dalam bentuk kurva pada Gambar 14.
0
lama reaksi (detik)
k
Gambar 14. Kurva aktivitas invertase dengan nilai persamaan y = 3.2267 x dan koefisien regresi r2 = 0.9721
perubahan 0.3872 µmol sukrosa menjadi glukosa dan fruktosa dalam satu menit pada total volume larutan 2 ml.
Semakin besar nilai aktivitas yang diperoleh menunjukkan bahwa enzim yang dianalisa memiliki aktivitas yang tinggi pula, karena nilai tersebut menunjukkan banyaknya jumlah substrat yang dikatalisis oleh enzim dalam satu satuan waktu (menit). Kecepatan reaksi akan berlangsung lebih cepat, sehingga nilai Vmaks pun cepat tercapai.
Nilai aktivitas yang diperoleh tersebut dapat dikatakan rendah, namun hal tersebut bukan merupakan permasalahan dalam pengujian hubungan pengaruh perubahan faktor terhadap aktivitas enzim akibat penambahan kawao. Respon yang diberikan pada pengaruh perubahan faktor masih dapat diukur, walaupun menggunakan invertase dengan aktivitas yang rendah. B. Penentuan Pengaruh Konsentrasi Inhibitor Kawao
Dalam penentuan pengaruh konsentrasi inhibitor, dilakukan penentuan rentang konsentrasi inhibitor yang mampu memberikan respon inhibisi atau daya hambat terhadap aktivitas invertase. Hal tersebut ditunjukkan dengan menurunnya gula pereduksi (glukosa dan fruktosa) yang dibandingkan dengan kondisi kontrol (tanpa kawao). Analisis sidik ragam pada Lampiran 3 bagian A, menunjukkan bahwa konsentrasi kawao yang diujikan memberikan pengaruh nyata terhadap konsentrasi gula pereduksi yang dihasilkan.
0
Konsentrasi inhibitor (% v/v)
K
Gambar 15. Kurva pengaruh konsentrasi kawao terhadap konsentrasi gula pereduksi yang dihasilkan
Berdasarkan hasil uji daya inhibisi, menunjukkan bahwa akibat penambahan kawao, gula pereduksi cenderung menurun, namun seiring dengan meningkatnya konsentrasi kawao hingga konsentrasi 25% (v/v), terlihat adanya peningkatan jumlah gula pereduksi, namun tidak melebihi nilai kontrol. Terlihat bahwa penambahan kawao mampu memberikan respon inhibisi aktivitas invertase dengan baik.
Gula pereduksi secara signifikan menurun dengan penambahan kawao 2.5% (v/v), selanjutnya penurunan masih terlihat secara landai pada penambahan kawao 5% (v/v). Penambahan kawao lebih dari 5% (v/v) hingga 20% (v/v) meningkatkan gula pereduksi secara tidak signifikan, namun pada penambahan kawao 25% (v/v) terjadi peningkatan secara signifikan. Hasil sidik ragam dan uji lanjut Duncan dapat dilihat pada Lampiran 3 bagian A.
Pada penambahan inhibitor 5% (v/v) diperoleh nilai gula pereduksi terendah, sehingga untuk selanjutnya jumlah inhibitor yang terpilih adalah sebesar 5% (v/v) untuk volume total sampel sebanyak 2 ml. Hasil pengujian kawao menunjukkan bahwa aktivitas invertase mampu dihambat. Inhibisi terhadap aktivitas enzim invertase diduga disebabkan oleh golongan alkaloid yang memberikan aksi penghambatan kepada substrat untuk memasuki daerah katalitik enzim, karena pada ekstrak kawao melalui pengujian fitokimia secara kualitatif mengandung bahan aktif berupa alkaloid. Hasil pengujian fitokimia kawao dapat dilihat pada Lampiran 7.
Trojanowicz et al. (2004) menyatakan bahwa selain ion-ion logam, terdapat bahan lain yang menjadi inhibitor bagi invertase, bahan tersebut antara lain adalah kelompok glikoprotein, polipeptida, dan alkaloid.
C. Hubungan Pengaruh Perubahan Faktor Terhadap Degradasi Sukrosa Telah dieksplorasi bagaimana suatu senyawa kimia yang berbeda yang berikatan dengan enzim dapat mempengaruhi laju reaksi katalisa enzim. Banyak faktor yang dapat mempengaruhi aktivitas katalitik, baik dengan cara mengganggu bentuk enzim, atau secara ionisasi. Berikut merupakan faktor yang turut mempengaruhi aktivitas invertase antara lain konsentrasi substrat, konsentrasi enzim, pH, suhu inkubasi dan lama pemanasan. Jika faktor tersebut berubah, maka aktivitas enzim juga berubah.
1. Pengaruh Konsentrasi Enzim
Kecepatan reaksi enzimatis turut ditentukan oleh konsentrasi enzim yang berperan sebagai katalisator dalam suatu reaksi enzimatis. Peningkatan konsentrasi enzim umumnya akan meningkatkan konsentrasi produk. Hal ini juga terjadi pada pengaruh perubahan konsentrasi invertase terhadap peningkatan konsentrasi glukosa dan fruktosa akibat penambahan kawao.
tanpa kawao (kontrol) maupun akibat penambahan kawao. Hasil perlakuan konsentrasi enzim ditunjukkan pada Gambar 16.
0
Konsentrasi invertase (mg/l)
Ko
Perlakuan konsentrasi enzim tanpa kawao Perlakuan konsentrasi enzim dengan penambahan kawao
Gambar 16. Kurva pengaruh perubahan konsentrasi enzim terhadap
konsentrasi gula pereduksi yang dihasilkan
Pembentukan produk semakin meningkat seiring dengan peningkatan konsentrasi enzim, karena semakin banyak sisi aktif enzim yang berikatan dengan substrat. Reaksi akan berhenti atau menjadi stabil jika semua substrat telah dikatalisis oleh enzim. Namun apabila konsentrasi enzim jauh lebih rendah daripada substrat, maka kondisi tersebut menjadikan substrat sangat berlebih, sehingga dapat membatasi laju reaksi katalisis enzim (Suryani dan Mangunwidjaya, 2002).
Peningkatan aktivitas pada perlakuan kontrol, terjadi pada rentang konsentrasi invertase 0 - 1.65 mg/l. Semakin banyak sisi aktif enzim yang berikatan dengan sukrosa sehingga semakin banyak gula pereduksi yang dihasilkan. Peningkatan masih terjadi hingga taraf konsentrasi enzim tertinggi yaitu 4.15 mg/l, baik pada perlakuan kontrol maupun dengan penambahan kawao.
pengaruh yang berbeda nyata terhadap gula pereduksi yang dihasilkan. Hasil uji statistik tersebut dapat dilihat pada Lampiran 3 bagian B.
79,52
konsentrasi enzim (mg/l)
k
Gambar 17. Inhibisi aktivitas invertase oleh kawao pada konsentrasi enzim yang berbeda
2. Pengaruh konsentrasi substrat
Selain konsentrasi enzim, umumnya konsentrasi substrat juga mempengaruhi aktivitas enzim. Semakin tinggi konsentrasi substrat, maka semakin meningkat pula konsentrasi produk yang dihasilkan. Hal ini juga terjadi pada pengaruh penambahan sukrosa terhadap aktivitas invertase yang ditunjukkan pada Gambar 18.
0
0 4,25 8,25 12,5 16,75 20,75
Konsentrasi sukrosa (g/l)
K
Perlakuan konsentrasi substrat tanpa kawao
Perlakuan konsentrasi substrat dengan penambahan kawao
Gambar 18. Kurva pengaruh perubahan konsentrasi sukrosa terhadap
konsentrasi gula pereduksi yang dihasilkan
-38,50 -18,15
6,91
21,72 23,08 26,22
-50
0 4,25 8,25 12,5 16,75 20,75
konsentrasi sukrosa (g/l)
k
Gambar 19. Inhibisi aktivitas invertase oleh kawao pada konsentrasi sukrosa yang berbeda
Inhibisi terhadap aktivitas invertase secara signifikan meningkat mulai dari konsentrasi 0 – 12.5 g/l, sedangkan inhibisi pada konsentrasi substrat 12.5 – 20.75 g/l tidak berbeda secara nyata, seperti ditunjukkan oleh garis penghubung pada Gambar 19. Garis tersebut menunjukkan perbedaan tingkat signifikan perubahan dua titik konsentrasi yang berdekatan, gradien garis menunjukkan bahwa pada rentang yang diapit tersebut terjadi perubahan secara signifikan baik meningkat maupun menurun, sedangkan apabila mendatar menunjukkan tidak adanya perbedaan secara signifikan pada rentang tersebut. Kemampuan inhibisi (%) yang bernilai negatif menunjukan bahwa gula pereduksi yang dihasilkan lebih tinggi pada perlakuan kontrol dibandingkan dengan penambahan kawao, seperti dapat dilihat pada Gambar 18. Penjelasan untuk kondisi tersebut sama halnya dengan kondisi pada saat konsentrasi enzim rendah. Pada kondisi demikian, efek inhibisi yang terjadi belum optimal, proporsi gula pereduksi dalam larutan didominasi dari ekstrak kawao. Analisis sidik ragam dan uji lanjut Duncan dapat dilihat pada Lampiran 3 bagian C dan Lampiran 3 bagian H.
mengkatalisis sukrosa pada konsentrasi di atas 59% (w/v). Peningkatan konsentrasi sukrosa lebih lanjut sampai 80% (w/v) menurunkan aktivitas enzim secara signifikan, mungkin disebabkan oleh konsentrasi air rendah, inhibisi oleh substrat atau agregasi substrat.
Studi lain menyatakan bahwa pada reaksi hidrolisis sukrosa, fruktosa merupakan inhibitor kompetitif bagi invertase, sedangkan glukosa merupakan inhibitor non kompetitif bagi invertase (Hsiao et al., 2002). Lehninger (1988) menambahkan bahwa seiring dengan meningkatnya konsentrasi substrat, kecepatan reaksi akan meningkat. Namun pada akhirnya akan mencapai titik batas di mana dengan bertambahnya konsentrasi substrat kecepatan reaksi hanya meningkat sedemikian kecil. Pada batas ini disebut dengan kecepatan maksimum (Vmaks), enzim menjadi jenuh oleh substratnya, dan tidak dapat berfungsi lebih cepat. 3. Pengaruh pH
Penentuan pengaruh perubahan pH dilakukan dengan melarutkan invertase pada beberapa buffer pH yang berbeda mulai dari buffer pH 3 hingga pH 11, dengan konsentrasi invertase dan sukrosa sama pada setiap taraf, masing-masing 5 mg/l dan 25 g/l, sehingga masing-masing taraf bereaksi pada pH larutan yang berbeda. Hasil analisis sidik ragam menunjukkan bahwa taraf perlakuan tersebut memberikan pengaruh yang nyata terhadap konsentrasi gula pereduksi yang dihasilkan. Hasil analisis sidik ragam dapat dilihat pada Lampiran 3 bagian D.
Konsentrasi gula pereduksi paling rendah pada perlakuan kontrol diperlihatkan pada 3 nilai pH terakhir yaitu pH 9, 10, dan 11 dan konsentrasi gula pereduksi tertinggi tercapai pada pH 5, sedangkan pada perlakuan akibat penambahan kawao, gula pereduksi terendah terjadi pada pH 9, dan tertinggi pada pH 4.
menurun signifikan seiring dengan penurunan nilai pH hingga pH 8, selanjutnya perubahan nilai pH tidak berpengaruh secara nyata pada pembentukan gula pereduksi.
0
Perlakuan pH tanpa kawao Perlakuan pH dengan penambahan kawao
Gambar 20. Kurva pengaruh perubahan pH terhadap konsentrasi gula
pereduksi yang dihasilkan
Pada perlakuan akibat penambahan kawao, aktivitas invertase meningkat secara signifikan mulai pH 3 hingga mencapai titik optimum di pH 4, kemudian aktivitasnya menurun signifikan hingga pH 6, selanjutnya peningkatan pH larutan tidak memberikan pengaruh yang signifikan. Pergeseran nilai optimum yang diperoleh dibandingkan kontrol dapat disebabkan karena pengaruh perubahan pH terhadap muatan yang terdapat pada gugus fungsional enzim sebagai protein, denaturasi yang terjadi akibat perubahan pH tersebut, serta perubahan konformasi enzim. Aktivitas dan stabilitas invertase terlihat sangat rendah pada pH yang sangat asam (pH 3) dan basa tinggi (pH 8-11). Hal ini menunjukkan bahwa pada pH yang sangat asam, gugus fungsional pada sisi aktif enzim terganggu oleh adanya ion H+ yang berlebihan, sedangkan pada pH basa tinggi aktivitas invertase rendah karena ion OH- yang berlebihan, selain itu mungkin juga telah terjadi denaturasi enzim.
Aktivitas invertase secara umum telah dipelajari, dan memiliki nilai yang bervariasi tergantung sumber perolehannya. Rahman et al.
Rahman et al. (2001) menemukan bahwa aktivitas invertase pada anggur adalah 2.5-8, dengan pH optimum adalah 4.0. Rahman et al. (2004) telah meneliti invertase dalam tebu memberikan aktivitas maksimum pada pH 7,2. Chungliang et al. (1999) dalam Rahman et al. (2004) menyatakan bahwa pH optimum invertase dari benih padi adalah 7,0. Aktivitas dan stabilitas invertase turun perlahan pada pH asam, tetapi turun secara cepat pada pH basa. Observasi ini menunjukkan bahwa enzim relatif stabil pada kisaran pH asam hingga pH netral (Rahmanet al., 2004).
Rodwell (1981) menyatakan bahwa perubahan pH yang tidak begitu besar mempengaruhi keadaan ion enzim dan juga ion substrat. Aktivitas optimum juga dinyatakan antara pH 5.0 hingga 9.0. Akan tetapi, beberapa enzim, misalnya pepsin, aktif pada nilai pH diluar batas tersebut. Chaplin (1990) menyatakan bahwa pada larutan basa (pH > 8), kemungkinan terjadi destruksi parsial (denaturasi), sedangkan pada larutan asam (pH < 4) dapat terjadi hidrolisis ikatan peptida yang labil. Stauffer (1989) menyatakan bahwa enzim terdenaturasi di suhu ruang pada pH tinggi atau rendah, sehingga enzim kehilangan aktivitasnya yang bersifat tidak dapat balik (irreversible).
63,61
-196,23
-234,96 -131,88 -151,89 -156,60
72,84
Gambar 21. Inhibisi aktivitas invertase oleh kawao pada pH yang berbeda
4. Pengaruh suhu
0
Perlakuan suhu tanpa kawao Perlakuan suhu dengan penambahan kawao
Gambar 22. Kurva pengaruh perubahan suhu terhadap konsentrasi gula pereduksi yang dihasilkan
Aktivitas invertase berdasarkan gambar di atas terlihat semakin meningkat seiring dengan kenaikan suhu hingga mencapai titik maksimum. Peningkatan suhu lebih lanjut setelah titik maksimum menyebabkan penurunan aktivitas invertase dalam menghidrolisis sukrosa. Kedua perlakuan terhadap invertase, baik kontrol maupun dengan penambahan kawao menunjukkan pola yang serupa. Webb (1963) menyatakan bahwa suhu pada saat aktivitas enzim maksimum disebut dengan suhu optimum.
Meningkatnya aktivitas invertase pada awal peningkatan suhu terjadi karena peningkatan suhu menyebabkan peningkatan energi kinetik pada molekul enzim dan substrat. Peningkatan energi kinetik memungkinkan terjadinya tumbukan antara molekul tersebut semakin besar, sehingga berpeluang membentuk kompleks enzim-substrat secara optimal. Lehninger (1988) menyatakan bahwa kenaikan suhu akan mempercepat gerak termal molekul, dan laju reaksi akan mengalami peningkatan hingga kira-kira 2 kali setiap kenaikan suhu 10oC. Demikian pula Rodwell (1981) menambahkan, suhu merupakan faktor yang mempengaruhi reaksi kimia, termasuk reaksi katalisis enzim.
pada buah anggur (Nakanishi et al., 1991), sedangkan menurut Wang (2002) aktivitas invertase maksimum dicapai pada saat suhu sekitar 55oC.
Rodwell (1981) menjelaskan bahwa suhu optimum kebanyakan enzim adalah suhu sel atau di atas suhu sel tempat enzim-enzim berada. Kenaikan kecepatan aktivitas enzim di bawah suhu optimum disebabkan oleh kenaikan energi kinetik molekul-molekul yang bereaksi. Akan tetapi apabila suhu tetap dinaikkan, energi kinetik molekul-molekul enzim menjadi demikian besar sehingga melampaui penghalang energi untuk memecahkan ikatan sekunder. Ikatan sekunder tersebut berfungsi untuk mempertahankan enzim dalam keadaan katalitik enzim aktif. Jika ikatan sekunder enzim tersebut pecah, struktur sekunder dan tersier hilang disertai hilangnya aktivitas biologis. Aktivitas invertase pada penelitian ini mengalami penurunan secara siginifikan setelah suhu optimum dan kemudian mengalami inaktivasi pada suhu yang lebih tinggi.
12,44 3,64 8,00 11,92
25,20 40,96
43,96
-3,52 -6,16 -12,72
-20
Gambar 23. Inhibisi aktivitas invertase oleh kawao pada suhu yang berbeda
pada rentang suhu 40 – 50oC secara statistik tidak berbeda nyata, kemudian di atas suhu 50oC terjadi penurunan inhibisi secara signifikan dan melandai pada suhu di atas 70oC. Webb (1963) menyatakan bahwa suhu dapat mempengaruhi perubahan konfigurasi dari sisi aktif enzim. Jika sisi aktif enzim mudah mengalami perubahan struktur, fleksibilitas enzim akan berubah sehingga menyebabkan inhibitor lebih mudah atau lebih sulit untuk mengikat enzim.
Perlakuan perubahan suhu menunjukkan inhibisi meningkat seiring dengan kenaikan suhu hingga mencapai optimum di suhu 50oC. Terlihat pula bahwa suhu optimum aktivitas enzim bergeser, yang semula di suhu 50oC menjadi 60oC. Pergeseran nilai tersebut terkait dengan struktur enzim yang dipengaruhi oleh nilai parameter termodinamika yaitu entropi ( S), yang menunjukkan derajat ketidakaturan suatu molekul, entalpi ( H) dan energi bebas ( G). Nilai-nilai parameter ini berubah seiring dengan berubahnya suhu dan terkait erat dengan stabilitas enzim (Eijsink, et al., 2004). Penambahan kawao diduga memberikan pengaruh terhadap perubahan parameter termodinamika tersebut, yang menyebabkan terjadinya pergeseran nilai suhu optimum.
Inhibisi menurun setelah suhu optimum masing-masing perlakuan terlampaui karena stabilitas invertase baik kontrol maupun dengan penambahan kawao telah mengalami denaturasi akibat pengaruh suhu (thermodenaturation). Hasil tersebut menunjukkan bahwa kawao efektif dalam menghambat aktivitas invertase pada suhu di bawah 60oC, terutama pada suhu optimal enzim (50oC). Hasil uji statistik persentase inhibisi dapat dilihat pada Lampiran 3 bagian J.
Bailey dan Ollis (1988), menyatakan bahwa untuk kebanyakan denaturasi protein, mulai terjadi pada temperatur 45-50oC dan lebih menghebat pada temperatur 55oC. Denaturasi termal dari enzim bisa merupakan proses dapat balik maupun tidak dapat balik.
5. Pengaruh lama pemanasan
berbeda, mulai dari 0 detik hingga 300 detik. Konsentrasi sukrosa dan invertase yang digunakan pada setiap taraf perlakuan sama seperti pada penentuan pengaruh pH dan suhu. Analisis sidik ragam menunjukkan bahwa pemanasan invertase yang dilakukan pada waktu yang berbeda memberikan pengaruh yang nyata terhadap konsentrasi gula pereduksi yang dihasilkan. Hasil uji sidik ragam dapat dilihat pada Lampiran 3 bagian F.
Konsentrasi gula pereduksi tertinggi pada perlakuan kontrol yakni pada saat lama waktu pemanasan 0 detik masih lebih tinggi dibandingkan dengan perlakuan penambahan kawao untuk lama waktu pemanasan yang sama. Hal tersebut menunjukkan bahwa pada kondisi normal, respon inhibisi yang diberikan oleh kawao cukup tinggi. Pengaruh lama pemanasan terhadap aktivitas invertase dapat dilihat pada Gambar 24.
-200
lama pemanasan (detik)
Konsentr
Perlakuan lama pemanasan tanpa kawao Perlakuan lama pemanasan dengan penambahan kawao
Gambar 24. Kurva pengaruh lama pemanasan terhadap aktivitas konsentrasi gula pereduksi yang dihasilkan
tanpa penambahan kawao menunjukkan pola penurunan aktivitas dan stabilitas yang sama.
21,78
71,97 68,98
-14,59 -15,50
-4,54 -13,35 -13,72
-40
lama pemanasan (detik)
k
Gambar 25. Inhibisi aktivitas invertase oleh kawao pada lama pemanasan yang berbeda
D. Kinetika Inhibisi Invertase
Kinetika reaksi invertase pada penelitian ini diujikan pada kondisi suhu optimum inhibisi oleh kawao terjadi. Suhu yang diujikan adalah 30oC, 40°C, dan 50°C dengan tingkat pH yang sama, yakni pH 7, yang dipilih untuk mengetahui respon akibat penambahan kawao pada kondisi pH netral, sedangkan konsentrasi substrat (sukrosa) yang digunakan adalah pada rentang konsentrasi 0 g/l hingga 25 g/l. Pengolahan data kinetika reaksi inhibisi menggunakan alat bantu program SigmaPlot 2004 for Windows Version 9.01
dariSystat Software Inc.
Persamaan Lineweaver-Burk menghasilkan nilai KM dan Vmaks yang berbeda pada berbagai suhu yang diujikan. Model inhibisi yang sesuai untuk tiga titik suhu pengamatan diperoleh hasil yang sama yaitu unkompetitif (parsial). Pada suhu 30oC respon inhibisi oleh kawao baru terlihat pada konsentrasi substrat 6.25 g/l, sedangkan pada suhu 40oC dan 50oC respon inhibisi mulai terlihat pada konsentrasi substrat 2.5 g/l. Kurva yang diperoleh ditunjukkan oleh Gambar 26, Gambar 27 dan Gambar 28. Kurva persamaan Michaelis-Menten dan Lineweaver-Burk yang diperoleh pada masing-masing suhu diperlihatkan pada Gambar 29.
0
Konsentrasi sukrosa (g/l)
Ko
kontrol penambahan kawao
-200
Konsentrasi sukrosa (g/l)
Ko
kontrol penambahan kawao
Gambar 27. Kurva aktivitas invertase pada suhu 40oC yang ditunjukkan oleh hubungan antara konsentrasi sukrosa dan konsentrasi gula pereduksi yang dihasilkan
Konsentrasi sukrosa (g/l)
K
kontrol penambahan kawao
[S] (mg/mL)
tanpa penambahan kawao
dengan penambahan kawao
1/[S] (mg/mL)
tanpa penambahan kawao dengan pe nam bahan kawao
(a) Kurva Michaelis-Menten suhu 30oC (b) Kurva Lineweaver-Burk suhu 30oC
[S] (mg/mL)
dengan penambahan kawao tanpa penambahan kawao
1/[S] (mg/mL)
-0,03 -0,02 -0,01 0,00 0,01 0,02
1/V penambahan kawao
tanpa
penambahan kawao
(c) Kurva Michaelis-Menten suhu 40oC (d) Kurva Lineweaver-Burk suhu 40oC
[S] (mg/mL)
dengan penambahan kawao tanpa penambahan kawao
1/[S] (mg/mL)
-0,010 -0,005 0,000 0,005 0,010 0,015
1/V
tanpa penambahan kawao
(e) Kurva Michaelis-Menten suhu 50oC (f) Kurva Lineweaver-Burk suhu 50oC
Gambar 29. Kurva persamaan kinetika inhibisi invertase oleh kawao pada masing-masing suhu
Tabel 2. Hasil Penentuan Parameter Kinetika
Nilai Parameter kinetika Suhu
(oC)
Model
Inhibisi KM
(g/l)
544.2 10.67 240.2 48.75 0.002 0.993 0.187
40 Un kompetitif-partial
438.8 40.61 445.3 53.74 0.010 0.998 0.031
50 Un kompetitif-partial
2105.3 100.25 1360.4 90.69 0.005 0.993 0.020
Parameter kinetika kondisi normal dilambangkan dengan simbol KM, dan Vmaks, sedangkan parameter kinetika akibat penambahan kawao dilambangkan dengan simbol KM’ , dan Vmaks’ . Seiring dengan meningkatnya nilai suhu, untuk setiap parameter kinetika (KM, KM’ , Vmaks, dan Vmaks’ ) cenderung meningkat, kemudian akibat penambahan kawao, nilai parameter KM’ dan Vmaks’ lebih rendah dibandingkan kondisi normal (KM, Vmaks). Hal tersebut menunjukkan bahwa kecepatan reaksi mampu dihambat dengan penambahan kawao.
Lee (2003) menyatakan bahwa nilai KM menunjukkan tingkat afinitas antara substrat dan enzim. Nilai KM yang rendah menunjukkan nilai afinitas yang tinggi. Artinya semakin rendah nilai KM, tingkat afinitas substrat dan enzim semakin tinggi, Vmaks lebih cepat tercapai pada konsentrasi substrat yang relatif rendah, demikian pula sebaliknya.
V. KESIMPULAN DAN SARAN
A. Kesimpulan
Perubahan faktor konsentrasi inhibitor (kawao), konsentrasi enzim, konsentrasi substrat, pH, suhu dan lama pemanasan berpengaruh nyata terhadap gula pereduksi yang dihasilkan. Akibat penambahan kawao, pada masing-masing perlakuan perubahan faktor yang mempengaruhi aktivitas enzim, diperoleh bahwa nilai konsentrasi gula pereduksi yang dihasilkan lebih rendah dibandingkan kontrol (tanpa penambahan kawao). Hal tersebut menunjukkan bahwa kawao terbukti sebagai inhibitor aktivitas invertase.
Konsentrasi inhibitor (kawao) terpilih adalah pada konsentrasi 5% (v/v) karena memberikan respon pembentukan gula pereduksi yang paling rendah. Inhibisi akibat penambahan kawao pada pengaruh perubahan konsentrasi enzim tercapai mulai konsentrasi enzim 1.65 mg/l. Pada pengaruh perubahan substrat, inhibisi mulai terjadi pada konsentrasi substrat sekitar 7.5 g/l. Pada faktor perubahan nilai pH, akibat penambahan kawao, aktivitas invertase maksimum tercapai pada pH 4, bergeser dari kondisi normal pada pH 5 dan suhu optimumnya bergeser pula dari 50oC menjadi 60oC pada faktor perubahan suhu. Inhibisi terjadi pada rentang pH 4-7 dan mulai suhu 0-60oC. Pada faktor lama pemanasan, inhibisi aktivitas invertase berlangsung pada 30 detik pertama dan memberikan respon inhibisi yang cukup baik.
B. Saran