PROFIL IMUNOHISTOKIMIA ANTIOKSIDAN
Cooper,Zinc-SUPEROXIDE DISMUTASE
(Cu,Zn-SOD)
PADA JARINGAN GINJAL TIKUS
DENGAN PEMBERIAN ISOFLAVON KEDELAI, VITAMIN E
DAN MINERAL Zn
VIAN ARIF PERMANA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRAK
VIAN ARIF PERMANA. Profil Imunohistokimia Antioksidan Cu,Zn SOD pada Jaringan Ginjal Tikus dengan Pemberian Isoflavon Kedelai, Vitamin E dan Mineral Zn. Dibimbing oleh TUTIK WRESDIYATI.
PROFIL IMUNOHISTOKIMIA ANTIOKSIDAN
Cooper,Zinc-SUPEROXIDE DISMUTASE
(Cu,Zn-SOD)
PADA JARINGAN GINJAL TIKUS
DENGAN PEMBERIAN ISOFLAVON KEDELAI, VITAMIN E
DAN MINERAL Zn
VIAN ARIF PERMANA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan Pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul : Profil Imunohistokimia Antioksidan Cu,Zn SOD pada Jaringan Ginjal Tikus dengan Pemberian Isoflavon Kedelai, Vitamin E dan Mineral Zn
Nama Penulis : Vian Arif Permana NRP : B04103065
Telah diperiksa dan disetujui : Pembimbing
Drh. Tutik Wresdiyati Ph.D NIP.131 878 930
Mengetahui,
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
Dr. Drh I Wayan Teguh Wibawan NIP. 131 129 090
RIWAYAT HIDUP
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Alloh SWT atas segala hal yang baik dan indah, berka Alloh yang luar biasa dalam kehidupan sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul ’’Profil Imunohistokimia Antioksidan Cu,Zn SOD pada Jaringan Ginjal Tikus dengan Pemberian Isoflavon Kedelai, Vitamin E dan Mineral Zn’’. Karya ilmiah ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pada kesempatan ini penulis menyampaikan terima kasih yang tulus kepada :
1. drh. Tutik Wresdiyati, Ph.D selaku dosen pembimbing skripsi sekaligus pembimbing akademik yang telah memberikan bimbingan dan pengarahan selama penulis menempuh kuliah di FKH sampai penulisan akhir skripsi ini. 2. drh. I Ketut Mudite Adyane, MSi dan Dr. drh. Adi Winarto serta pak Maman
yang banyak membantu penulis selama melakukan penelitian di laboratorium Histologi.
3. Ir. Sussi Astuti, Msi yang telah banyak membantu dalam penelitian.
4. Ayah dan Ibu tercinta, Mas Andik dan Mbak Nirul atas doa, kasih sayang dan dukungannya sehingga menjadi kekuatan dan kebahagiaan bagi penulis.
5. Irvan sebagai rekan satu penelitian yang telah berbagi kebersamaan dan kerjasama selama penelitian..
6. Teman-teman dari MBV crew (Nandi, Indra, Indah, Silvi, Dewi, Rahma, Puji dan Nisa), OMDA AREMA, dan Gymnolaemata’40.
7. Semua pihak yang tidak dapat disebutkan satu persatu.
Akhirnya, semoga Allah SWT memberikan balasan yang lebih baik atas perhatian yang telah diberikan. Saran dan kritik yang membangun sangat penulis harapkan dan kiranya tulisan yang sederhana ini dapat bermanfaat bagi ilmu pengetahuan.
Bogor, September 2007
DAFTAR ISI
Halaman
DAFTAR ISI ... vii
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Hipotesa ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Organ Ginjal ... 4
Radikal Bebas ... 5
Antioksidan Cu,Zn-SOD ... 7
Isoflavon ... 8
Vitamin E ... 9
Zinc... 11
Imunohistokimia... 11
BAHAN DAN METODE ... 13
Tempat dan Waktu Penelitian ... 13
Materi Penelitian ... 13
Metode Penelitian ... 13
Persiapan Hewan Percobaan ... 13
Pembuatan Preparat dan Pewarnaan ... 14
Parameter dan Analisis Data ... 16
Parameter ... 16
Analisis Data ... 16
HASIL ... 17
Profil Antioksidan Cu,Zn-SOD ... 17
Gambaran Morfologi Ginjal ... 23
PEMBAHASAN ... 25
Profil Antioksidan Cu,Zn-SOD ... 25
Morfologi Ginjal... 28
KESIMPULAN DAN SARAN ... 29
Kesimpulan ... 29
Saran ... 29
DAFTAR PUSTAKA ... 30
DAFTAR TABEL
Halaman
1.
2.
.
.
Distribusi dan Frekuensi Cu,Zn-SOD pada jaringan ginjal tikus kelompok perlakuan ...
Rata-rata jumlah inti sel ginjal yang bereaksi pada berbagai tingkat kandungan Cu,Zn-SOD pada jaringan ginjal tikus perlakuan perlapang pandang pada pembesaran 20X...
18
DAFTAR GAMBAR
Halaman
1.
2.
3.
4.
5.
6.
Prinsip teknik imunohistokimia dengan metode Polymer Peroxidase...
Fotomikrograf jaringan ginjal tikus perlakuan pewarnaan Imunohistokimia terhadap Cu,Zn-SOD...
Persentase jumlah inti sel ginjal yang bereaksi pada berbagai tingkat kandungan Cu,Zn-SOD ...
Fotomikrograf jaringan ginjal tikus perlakuan pewarnaan HE...
Struktur molekul dari isoflavon...
Struktur molekul vitamin E... 18
19
22
24
26
27
DAFTAR LAMPIRAN
Halaman
1.
2.
3.
4.
5.
6.
7.
8.
Proses Preparasi Jaringan...
Proses Pewarnaan Hematoksilin-Eosin (HE)...
Prosedur Pewarnaan Imunohistokimia terhadap Cu,Zn-SOD ...
Komposisi Ransum Standar...
Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif kuat terhadap kandungan Cu,Zn-SOD sel ginjal tikus... Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif sedang terhadap kandungan Cu,Zn-SOD sel ginjal tikus ...
Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif lemah terhadap kandungan Cu,Zn-SOD sel ginjal tikus ...
Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi negatif terhadap kandungan Cu,Zn-SOD sel ginjal tikus ...
33
34
35
36
37
38
39
PROFIL IMUNOHISTOKIMIA ANTIOKSIDAN
Cooper,Zinc-SUPEROXIDE DISMUTASE
(Cu,Zn-SOD)
PADA JARINGAN GINJAL TIKUS
DENGAN PEMBERIAN ISOFLAVON KEDELAI, VITAMIN E
DAN MINERAL Zn
VIAN ARIF PERMANA
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
ABSTRAK
VIAN ARIF PERMANA. Profil Imunohistokimia Antioksidan Cu,Zn SOD pada Jaringan Ginjal Tikus dengan Pemberian Isoflavon Kedelai, Vitamin E dan Mineral Zn. Dibimbing oleh TUTIK WRESDIYATI.
PROFIL IMUNOHISTOKIMIA ANTIOKSIDAN
Cooper,Zinc-SUPEROXIDE DISMUTASE
(Cu,Zn-SOD)
PADA JARINGAN GINJAL TIKUS
DENGAN PEMBERIAN ISOFLAVON KEDELAI, VITAMIN E
DAN MINERAL Zn
VIAN ARIF PERMANA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan Pada
Fakultas Kedokteran Hewan
FAKULTAS KEDOKTERAN HEWAN
INSTITUT PERTANIAN BOGOR
Judul : Profil Imunohistokimia Antioksidan Cu,Zn SOD pada Jaringan Ginjal Tikus dengan Pemberian Isoflavon Kedelai, Vitamin E dan Mineral Zn
Nama Penulis : Vian Arif Permana NRP : B04103065
Telah diperiksa dan disetujui : Pembimbing
Drh. Tutik Wresdiyati Ph.D NIP.131 878 930
Mengetahui,
Wakil Dekan Fakultas Kedokteran Hewan Institut Pertanian Bogor
Dr. Drh I Wayan Teguh Wibawan NIP. 131 129 090
RIWAYAT HIDUP
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Alloh SWT atas segala hal yang baik dan indah, berka Alloh yang luar biasa dalam kehidupan sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul ’’Profil Imunohistokimia Antioksidan Cu,Zn SOD pada Jaringan Ginjal Tikus dengan Pemberian Isoflavon Kedelai, Vitamin E dan Mineral Zn’’. Karya ilmiah ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Kedokteran Hewan pada Fakultas Kedokteran Hewan, Institut Pertanian Bogor. Pada kesempatan ini penulis menyampaikan terima kasih yang tulus kepada :
1. drh. Tutik Wresdiyati, Ph.D selaku dosen pembimbing skripsi sekaligus pembimbing akademik yang telah memberikan bimbingan dan pengarahan selama penulis menempuh kuliah di FKH sampai penulisan akhir skripsi ini. 2. drh. I Ketut Mudite Adyane, MSi dan Dr. drh. Adi Winarto serta pak Maman
yang banyak membantu penulis selama melakukan penelitian di laboratorium Histologi.
3. Ir. Sussi Astuti, Msi yang telah banyak membantu dalam penelitian.
4. Ayah dan Ibu tercinta, Mas Andik dan Mbak Nirul atas doa, kasih sayang dan dukungannya sehingga menjadi kekuatan dan kebahagiaan bagi penulis.
5. Irvan sebagai rekan satu penelitian yang telah berbagi kebersamaan dan kerjasama selama penelitian..
6. Teman-teman dari MBV crew (Nandi, Indra, Indah, Silvi, Dewi, Rahma, Puji dan Nisa), OMDA AREMA, dan Gymnolaemata’40.
7. Semua pihak yang tidak dapat disebutkan satu persatu.
Akhirnya, semoga Allah SWT memberikan balasan yang lebih baik atas perhatian yang telah diberikan. Saran dan kritik yang membangun sangat penulis harapkan dan kiranya tulisan yang sederhana ini dapat bermanfaat bagi ilmu pengetahuan.
Bogor, September 2007
DAFTAR ISI
Halaman
DAFTAR ISI ... vii
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 2
Hipotesa ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Organ Ginjal ... 4
Radikal Bebas ... 5
Antioksidan Cu,Zn-SOD ... 7
Isoflavon ... 8
Vitamin E ... 9
Zinc... 11
Imunohistokimia... 11
BAHAN DAN METODE ... 13
Tempat dan Waktu Penelitian ... 13
Materi Penelitian ... 13
Metode Penelitian ... 13
Persiapan Hewan Percobaan ... 13
Pembuatan Preparat dan Pewarnaan ... 14
Parameter dan Analisis Data ... 16
Parameter ... 16
Analisis Data ... 16
HASIL ... 17
Profil Antioksidan Cu,Zn-SOD ... 17
Gambaran Morfologi Ginjal ... 23
PEMBAHASAN ... 25
Profil Antioksidan Cu,Zn-SOD ... 25
Morfologi Ginjal... 28
KESIMPULAN DAN SARAN ... 29
Kesimpulan ... 29
Saran ... 29
DAFTAR PUSTAKA ... 30
DAFTAR TABEL
Halaman
1.
2.
.
.
Distribusi dan Frekuensi Cu,Zn-SOD pada jaringan ginjal tikus kelompok perlakuan ...
Rata-rata jumlah inti sel ginjal yang bereaksi pada berbagai tingkat kandungan Cu,Zn-SOD pada jaringan ginjal tikus perlakuan perlapang pandang pada pembesaran 20X...
18
DAFTAR GAMBAR
Halaman
1.
2.
3.
4.
5.
6.
Prinsip teknik imunohistokimia dengan metode Polymer Peroxidase...
Fotomikrograf jaringan ginjal tikus perlakuan pewarnaan Imunohistokimia terhadap Cu,Zn-SOD...
Persentase jumlah inti sel ginjal yang bereaksi pada berbagai tingkat kandungan Cu,Zn-SOD ...
Fotomikrograf jaringan ginjal tikus perlakuan pewarnaan HE...
Struktur molekul dari isoflavon...
Struktur molekul vitamin E... 18
19
22
24
26
27
DAFTAR LAMPIRAN
Halaman
1.
2.
3.
4.
5.
6.
7.
8.
Proses Preparasi Jaringan...
Proses Pewarnaan Hematoksilin-Eosin (HE)...
Prosedur Pewarnaan Imunohistokimia terhadap Cu,Zn-SOD ...
Komposisi Ransum Standar...
Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif kuat terhadap kandungan Cu,Zn-SOD sel ginjal tikus... Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif sedang terhadap kandungan Cu,Zn-SOD sel ginjal tikus ...
Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif lemah terhadap kandungan Cu,Zn-SOD sel ginjal tikus ...
Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi negatif terhadap kandungan Cu,Zn-SOD sel ginjal tikus ...
33
34
35
36
37
38
39
PENDAHULUAN
Latar Belakang
Pada era modern permasalahan kesehatan seperti penyakit degeneratif, kanker dan penuaan dini menjadi perhatian yang serius dari masyarakat karena prevalensinya terus meningkat. Masalah kesehatan diatas disebabkan oleh produksi radikal bebas tubuh melebihi ambang normal yang dapat merusak sel tubuh. Produksi radikal bebas yang berlebihan dipengaruhi pola diet yang tidak baik, lingkungan yang tercemar, tingkat stress yang tinggi dan lain-lain. Kondisi ini mendorong para peneliti menggali teori dasar radikal bebas serta mencari bagaimana cara mengendalikan produksi radikal bebas pada tubuh. Penelitian di bidang gizi ortomolekuler pada tingkat sel membuktikan, antioksidan dapat melindungi jaringan tubuh dari efek negatif radikal bebas. Gangguan atau ketidakmampuan sistem antioksidan tubuh inilah yang menyebabkan berbagai macam penyakit degeneratif, kanker dan penuaan dini (Karyadi 2004).
2
perlindungan terhadap serangan radikal bebas, secara alami telah ada dalam tubuh kita. Dari asal terbentuknya, antioksidan ini dibedakan menjadi dua yakni endogen (di dalam sel) dan eksogen (di luar sel) ataupun dari makanan. Dari fungsinya antioksidan tubuh bisa dikelompokkan menjadi 3 yaitu : (1) Antioksidan primer, antioksidan ini bekerja untuk mencegah pembentuk senyawa radikal bebas baru. Ia mengubah radikal bebas yang ada menjadi molekul yang berkurang dampak negatifnya, sebelum radikal bebas ini sempat bereaksi. Contoh antioksidan ini adalah enzim SOD yang berfungsi sebagai pelindung hancurnya sel-sel dalam tubuh serta mencegah proses peradangan karena radikal bebas. Enzim SOD sebenarnya sudah ada dalam tubuh. Namun bekerjanya membutuhkan bantuan zat-zat gizi mineral seperti mangan, zinc dan cuprum. Contoh lain adalah enzim katalase dan glutathione peroksidase yang memerlukan zat gizi mineral selenium (2) Antioksidan sekunder, antioksidan ini berfungsi menangkap senyawa serta mencegah terjadinya reaksi berantai. Contoh antioksidan sekunder: isoflavon, vitamin E, vitamin C, beta karoten, asam bilirubin, dan albumin (Ames et al. 1993). (3) Antioksidan tersier, antioksidan jenis ini memperbaiki kerusakan sel-sel dan jaringan yang disebabkan radikal bebas. Contoh enzim yang memperbaiki DNA pada inti sel adalah metionin sulfoksidan reduktase. Adanya enzim-enzim perbaikan DNA ini berguna untuk mencegah penyakit kanker.
3
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari pengaruh dari pemberian isoflavon, vitamin E dan Zn terhadap profil imunohistokimia antioksidan Cu,Zn-SOD.
Manfaat Penelitian
Dengan adanya penelitian ini diharapkan dapat menjadi informasi ilmiah tentang pengaruh pemberian ketiga antioksidan (isoflavon, vitamin E dan Zn) terhadap profil antioksidan didalam tubuh(Cu, Zn-SOD) secara imunohistokimia.
Hipotesis
TINJAUAN PUSTAKA
Organ Ginjal
Ginjal adalah organ pengatur utama cairan tubuh dan alat ekskresi tubuh. System urinaria tubuh terdiri dari ginjal, ureter, vesika urinaria dan uretra. System urinaria adalah salah satu system organ utama yang berfungsi mengatur homeostasis air dan elektrolit (Banks 1986). Menurut Dellman dan Brown (1992) fungsi utamanya adalah mengatur cairan elektrolit, mengeluarkan limbah metabolisme, memusnahkan zat toksik dan kesetimbangan asam basa serta tekanan darah. Unit fungsional dari ginjal adalah nefron yang terdiri dari glomerulus, tubulus proksimalis, tubulus distalis dan jerat henle. Keempat komponen ini yang memebentuk kemih yang kemudian dialirkan ke unit penyalur dan buluh penampung yang masih terdapat dalam ginjal.
Menurut Maronpot et al. (1999), ginjal tikus mempunyai struktur permukaan yang halus, berwarna kemerah – merahan, terletak berlawanan dengan dorsal dinding tubuh dan beratnya sekitar 0,76 % dari total berat tubuh. Letak ginjal kanan sedikit lebih anterior dari ginjal kiri dan ginjal tikus berbentuk unilobar dengan papilla tunggal. Sepasang ginjal terletak retro peritoneal dengan jaringan lemak yang mengelilinginya. Pada bagian cekung mengarah ke medial sedangkan bagian cembung mengarah ke lateral. Hilus ginjal terletak pada bagian cekung dan berfungsi sebagai tempat masuk keluarnya pembuluh darah dan syaraf.
Unit fungsional terkecil dari ginjal adalah nefron yang terdiri dari glomerulus, bagian kontorti dan rekti tubuli proksimalis, desenden dan asenden dari jerat henle, straight segment, macula densa dan bagian konvulsi dari tubulus distalis (Maronpot et al. 1999). Secara umum gambaran masing – masing unit dijelaskan oleh Banks (1986) sebagai berikut :
5
2. Tubuli proksimalis dilapisi oleh epitel kuboid atau pyramid sebaris dengan inti berbentuk bulat terletak agak basal. Fungsi tubuli proksimalis sangat penting dan bagian yang lebih mudah dipengaruhi oleh proses perjalanan penyakit dan zat toksik. Seluruh bagian dari tubuli kontorti proksimalis terletak di korteks. Pada bagian ini terjadi reabsorbsi isoosmotik sekitar 80% dari filtrate, seluruh glukosa dan 87% Natrium, Clorida dan vitamin C. Setelah dari Tubuli proksimalis akan memasuki jerat henle.
3. Jerat henle terdiri dari dua bagian yaitu desenden (bagian tipis) dan asenden (bagian tebal). Pada cabang desenden filtrat memiliki kelarutan yang rendah. Epitelnya gepeng dan bertindak sebagai selaput dialysis selektif dan meresorbsi air.
4. Tubuli distalis mempunyai ukuran yang tidak seluas tubuli proksimalis tetapi diameter lamina sampai ratio kutikular dinding sel lebih baik dari tubuli proksimalis. Di dalam tubuli distalis pembuatan kemih menjadi lengkap dengan reabsorbsi fakultatif seperti air, ion natrium, klorida, fosfat dan sulfat serta reaksi ion ammonium dan hydrogen.
5. Buluh pengumpul merupakan unit penyalur pasca nefron yang terdiri dari duktus koligentes yang membentuk kengkung dalam korteks dan yang lurus masih dalam radiate dan duktus papillaris(duktus bellini), buluh yang lebih besar dan merupakan pemuaraan dari bagian duktus koligentes yang akhirnya bermuara pada kaliks renalis.
Mekanisme utama nefron adalah menyaring sebagian besar plasma melalui membrane glomerulus ke dalam tubulus nefron kemudian ketika cairan difiltrasi melalui tubulus, zat toksik tidak direabsorbsi kedalam plasma kapiler peritubulus.
Radikal Bebas
6
dalam jumlah yang banyak dan jumlah antioksidan seluler tetap atau kurang maka kelebihan dari radikal bebas tidak dapat dinetralkan dan berakibat kerusakan pada sel (Tejasari 2000). Radikal bebas dapat berasal dari dalam tubuh (radikal bebas endogen) dan dari luar tubuh (radikal bebas eksogen). Radikal bebas endogen terbentuk dari reaksi reduksi oksidasi normal dalam mitokondria, peroksisom, detoksifikasi senyawa xenobiotik, metabolisme obat–obatan dan fagositasi. Radikal bebas eksogen berasal dari asap rokok, radiasi, inflamasi, olahraga yang berlebihan dan polutan lingkungan.
Menurut Halliwell dan Gutterridge (1990), untuk memenuhi keganjilan elektronnya, radikal bebas akan menarik electron makromolekul biologis disekitarnya seperti protein, asam nukleat dan DNA. Makromolekul yang teroksidasi akan terdegradasi dan apabila makromolekul itu bagian dari sel maka akan terjadi kerusakan sel. Senyawa radikal akan membentuk pasangan dengan mengambil electron dari atom atau molekul lain sehingga menghasilkan senyawa radikal baru (Kartikawati 1999). Apabila radikal bebas didalam tubuh tidak terkontrol maka akan terjadi reaksi berantai yang menghasilkan banyak reaksi molekul sejenis.
Beberapa radikal bebas endogen adalah hidroksil (OH¯), superoksida (O2¯), peroksil (RO2¯) dan nitrogen oksida (NO¯). superoksida merupakan salah
satu radikal bebas yang sangat reaktif dan paling berbahaya bagi sel. Superoksida bersifat oksidan dan reduktan serta dapat bereaksi dengan berbagai subtrat biologis. Antioksidan enzimatis yang dapat menghilangkan efek dari superoksida adalah superoksida dismutase (SOD) (Martin et al. 1981).
Adapun reaksi pembentukan radikal bebas adalah
O2¯ + e¯ → O2¯ (anion superoksida)
Reaktivitas O2¯ sangat terbatas karena adanya dismutasi spontan yang
dapat terjadi pada pH fisiologik membentuk H2O2 dan O2. tetapi dengan
terbatasnya reaktifitas O2¯ menyebabkan dapat berdifusi dan bereaksi dengan
7
semua substrat biologis. Karena sifatnya sangat reaktif menyebabkan efek radikalnya berlangsung pada daerah yang dekat dengan terbentuknya dan dalam kondisi fisiologis jumlahnya sedikit. Radikal bebas yang lain dapat ditemukan sebagai derivate oksigen adalah peroksida (H2O2), radikal ini tidak sebahaya
superoksida dan terbentuk akibat dari penambahan satu electron pada superoksida. Derivate oksigen ini bersifat sebagai oksidan kuat tetapi bereaksi lambat dengan substrat organik (Gitawati 1995).
Peran utama O2 adalah dalam proses oksidasi untuk pembentukan energi
(aerob) dan teredusi menjadi air (Muhilal 1991). Sedangkan apabila terekdusi secara parsial akan membentuk oksigen reaktif (ROS). Kondisi dimana terjadi radikal bebas belebih atau kekurangan oksigen disebut sebagai stres oksidatif. Stres oksidatif merupakan efek negatif dari terjadinya radikal bebas yang berlebih dan jumlah antioksidan yang kurang. Akibat kondisi ini menyebabkan gangguan proses fisiologis tubuh sehingga terjadi gangguan metabolisme dan kerusakan sel. Kerusakan sel dapat menyebabkan timbulnya penyakit degeneratif, penuaan dini dan kanker. Stres oksidatif dapat disebakan karena antioksidan seluler lemah, asupan zat kimia sintetis berbahaya, radiasi, diet tinggi asam lemak tak jenuh dan sinar ultra violet (Tejasari 2000).
Antioksidan Cu,Zn SOD
8
jaringan tubuh dan antioksidan nonenzimatik ekstrasel yang berasal dari luar tubuh yang terbagi menjadi antioksidan larut lemak(alfa-tokoferol, karotenid, quinon dan bilirubin) dan antioksidan larut dalam air (vitamin C, asam urat, protein pengikat logam dan pengikat heme).
Pada manusia dan hewan, antioksidan enzimatik SOD merupakan paling banyak ditemukan dalam organ hati dan ginjal. Aktivitas SOD bervariasi pada beberapa organ tubuh, terdapat dalam jumlah tertinggi dalam hati kemudian adrenal, ginjal, darah, limpa, pankreas, otak, paru-paru, lambung, usus dan ovarium (Chow 1988 diacu dalam Kartikawati 1999).
Superoksida dismutase pertamakali diisolasi oleh Mann dan Keillis pada tahun 1938. Enzim ini bekerja mengkatalisis dismutase dari superoksida menjadi hidrogen peroksida dan oksigen. Aktivitas SOD menggunakan oksigen dan melawan kerusakan sel yang diakibatkan oleh oksigen. Pada sel-sel mamalia terdapat tiga tipe SOD yang telah diidentifikasi yaitu, mitokondria manganase (Mn)-SOD, ekstraseluler SOD (EC-SOD) dan sitosilik Cu,Zn-SOD dan Fero (Fe)-SOD. Enzim Cu,Zn-SOD biasanya disusun oleh atom tembaga dan zinc. Studi bbiokimia membuktikan bahwa enzim Cu,Zn-SOD merupakan suatu bentuk protein terlarut yang berasosiasi dengan sitoplasma dan inti. Distribusi enzim Cu,Zn-SOD secara imunositokimia berhasil dilokalisasi pada inti dan sitoplasma sel epitel tubuli proksimalis, ruang ekstraseluler dan kapiler dari glomerulus.
Isoflavon
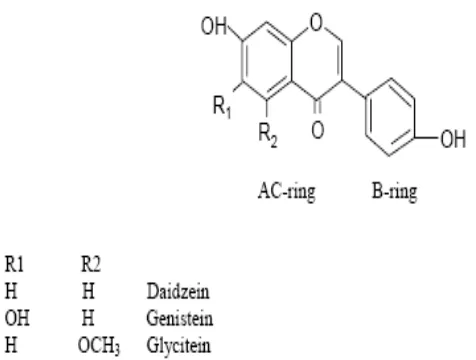
Isoflavon diketahui sebagai golongan flavonoid yang merupakan salah satu dari kelompok fitoestrogen tanaman, tersusun atas daidzein, genistein, dan
glisitein. Isofavon ditemukan dalam kedelai, lentil dan legium tetapi sumber isoflavon terbanyak di dalam makanan manusia adalah kedelai (Kaufman et al.1997). Genistein adalah komponen utama dari isoflavon yang berfungsi sebagai antioksidan. Ada dua pharmacophore dari isoflavon yang mempunyai aktivitas antioksidan yaitu grup 4’hydroxyl pada B-ring dan grup hydroxyl pada AC-ring. Keduanya dapat sebagai donor hidrogen/ elektron (Heijnen et al. 2002).
9
aktivitas seperti estrogen di dalam tubuh, isofavon dapat mengurangi resiko penyakit jantung dengan menurunkan kolesterol darah, secara invitro mampu menghambat enzim tirosinkinase sehingga menghambat perkembangan kanker dan angiogenesis. Isoflavon mampu menurunkan osteoporosis dengan penelitian yang membuktikan bahwa isoflavon dapat mencegah kerapuhan tulang dari tikus, dan isoflavon dapat mencegah gangguan prostat (Sutrisno 2006).
Selain aktivitas diatas isoflavon juga mempunyai sifat antioksidatif. Isoflavon mampu menangkap radikal bebas dan mengubahnya menjadi senyawa yang relatif lebih stabil. Hal ini akan mencegah kerusakan dari komponen – komponen biologis tubuh yang penting seperti asam lemak protein maupun DNA. Isoflavon juga mampu menstimulasi enzim Cu,Zn-SOD, katalase mRNA serta GPx RNA yang dapat melindungi sel dari serangan stres oksidatif. Mekanisme kerja isoflavon sebagai antioksidan ditunjukkan dengan banyak cara, diantaranya yaitu dengan menangkap radikal bebas secara langsung (Nijveldt et al. 2001). Menurut Wei et al.(1995), hasil dari oksidasi test menunjukkan bahwa genistein, apigenin, dan prunektin mampu menghambat generasi O2¯ dari oksidasi xanthin.
Selain itu isofavon menginduksi peningkatan antioksidan mitokondria yaitu enzim Mn SOD dan cytochrome c oksidase (Mahn 2005). Kapasitas dari flavonoid sebagai antioksidan tergantung struktur molekulnya. Posisi rantai hidroksil dan rantai lain di dalam struktur kimia flavonoid sangat penting untuk perannya sebagai antioksidan dan aktivitas scavenger radikal bebas (Cristobal 2000). Dengan adanya aktivitas scavenger radikal bebas ini sistem pertahanan antioksidan normal tubuh akan terpelihara atau mengurangi penggunaan dari enzim antioksidan endogenous (Wu 2003).
Vitamin E
10
dan d-δ-tokotrienol.(Manalu 1999). Vitamin E banyak ditemukan pada minyak sayur, kecambah dan sereal. Pengolahan makanan dan feedstuffs dapat mengurangi kandungan vitamin E dalam makanan. Perlakuan-perlakuan lain yang dapat merusak vitamin E adalah memanaskan pada sinar matahari, menambahkan asam organik, penggilingan dan penyulingan dan irradiasi (Walji 1992). Vitamin E yang masuk tubuh akan diabsorbsi oleh saluran pencernaan sekitar 40% dan sisanya akan dibuang lewat feses. Proses absorbsi vitamin E pada saluran pencernaan dibantu oleh Asam Lemak Tidak Jenuh Ganda atau Poly Unsaturated Fatty Acid (PUFAs) dan masuk peredaran darah melalui pembuluh limfe bersama chylomicron. Vitamin E akan disimpan di jaringan adiposa. Fosfolipid yang ada pada mitokondria, retikulum endoplasma dan plasma membran akan mengikat vitamin E yang kemudian akan menjaga konsentrasi dari fosoflipid (Machlin 1991).
11
Zinc
Zinc merupakan mikromineral essensial yang mempunyai peran penting didalam proses biokimia dan fisiologis tubuh. Zinc banyak ditemukan pada setiap jaringan tubuh. Unsur ini banyak menumpuk pada tulang daripada di hati, yang merupakan organ penyimpanan banyak unsur-unsur mineral. Beberapa enzim juga diketahui mengandung zinc yaitu karbonik anhidrase, karboksi peptidase pankreas, laktat dehidrogenase, alkalis fosfatase, timidin kinase (Manalu 1999), dan superoksida dismutase (Martin et al. 1981).
Unsur zinc paling banyak ditemukan di kapang dan kecambah bijian sereal. Pada lumen usus terdapat zinc-binding faktor yang sama dengan yang disekresikan pankreas untuk absorbsi zinc. Kemudian zinc akan ditransfer ke albumin pada lapis serosa dari mukosa membran sel. Sedangkan zinc disekresikan dari empedu dan dikeluarkan dari tubuh lewat feses (Martin et al. 1981).
Zinc merupakan mineral penting yang berperan dalam berbagai reaksi enzimatis dalam tubuh, mampu mempertahankan sistem imun dan menstimulasi enzim antioksidan tubuh. Salah satu enzim yang sangat dipengaruhi oleh keberadaan zinc adalah Cu,Zn-SOD, yaitu salah satu enzim antioksidan intraseluler yang mampu mengkatalisis reaksi dismutasi radikal anion superoksida. Winarsi (2004) melaporkan bahwa terjadi peningkatan aktivitas enzim antioksidan yaitu SOD, katalase dan glutation peroksidase pada darah wanita premenoupause yang diberi minuman fungsional berbahan dasar susu skimming yang suplementasi dengan isoflavon dan zinc. Zinc yang berikatan dengan enzimnya (Cu,Zn-SOD) mampu menjaga blood barrier brain dari unsur – unsur toksik dan radikal bebas karena enzim tersebut berfungsi sebagai antioksidan (Levy dan Bray 2003).
Imunohistokimia
12
pewarnaan, sedangkan kimia bersangkutan dengan reaksi – reaksi kimia didalam proses pewarnaan.
Tujuan dari teknik imunohistokimia adalah identifikasi dan karakterisasi komponen sel/jaringan. Menurut Kuhlmann (1984), agar kompleks antigen – antibodi dapat divisualisasikan maka kompleks harus dengan cara khusus yaitu substansi yang sesuai untuk melabel kompleks dengan memberikan reaksi warna yang tegas (kromogen). Kromogen yang sering digunakan adalah
Diaminobenzidine (DAB) yang menghasilkan endapan warna coklat (kromoganin).
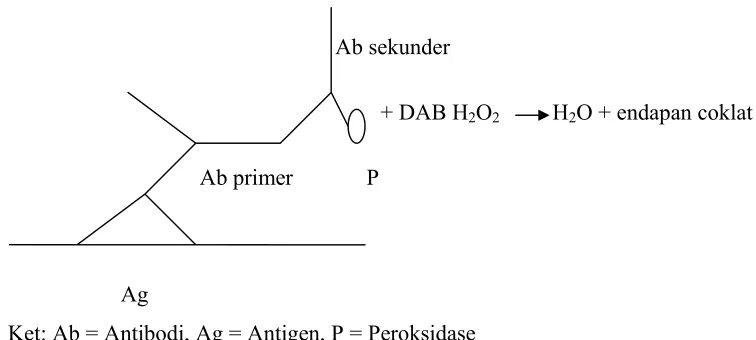
Teknik yang digunakan dalam penelitian ini adalah Polimer Peroxidase. Teknik ini merupakan salah satu teknik terbaru dan dinilai lebih ekonomis, dengan menggunakan dua antibodi yaitu antibodi primer dan antibodi sekunder. Antibodi primer yang digunakan adalah antibodi monoklonal terhadap Cu,Zn-SOD dan antibodi sekunder yang digunakan adalah antibodi yang sudah terkonjugasi dengan peroksidase. Penelitian ini menggunakan Polimer Peroksidase dari produk DAKO. Prinsip pewarnaan imunohistokimia dengan metode Polymer Peroksidase dapat dilihat pada Gambar 1.
Ab sekunder
+ DAB H2O2 H2O + endapan coklat
Ab primer P
Ag
[image:32.612.129.507.427.597.2]Ket: Ab = Antibodi, Ag = Antigen, P = Peroksidase
Gambar 1. Prinsip teknik imunohistokimia dengan metode Polymer Peroxidase (sumber
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Histologi Bagian Anatomi, Histologi dan Embriologi, Departemen Anatomi, Fisiologi dan Farmakologi serta Unit Rehabilitasi Reproduksi (URR) Fakultas Kedokteran Hewan Institut Pertanian Bogor. Adapun pelaksanaannya dimulai pada bulan Juli 2006 sampai dengan bulan Juni 2007.
Materi Penelitian
Hewan yang digunakan adalah tikus putih jantan (Rattus novergicus) galur
Sprague dawley berjumlah 18 ekor dengan umur 21 hari lepas masa sapih dan bobot badan 50 g. Tikus yang berjumlah 18 ekor diadaptasi selama 7 hari kemudian dibagi menjadi 6 kelompok perlakuan yang masing-masing diberi perlakuan dengan penambahan secara kombinasi yang berbeda terhadap vitamin E, isoflavon dan Zn pada ransumnya.
Metode Penelitian
Persiapan Hewan Percobaan
Tikus putih jantan yang berjumlah 30 ekor dibagi menjadi 6 kelompok perlakuan berdasarkan pemberian ransum, yaitu :
1. Kelompok K adalah kelompok kontrol dengan pemberian ransum standar tanpa pemberian Zn, tanpa pemberian vitamin E dan tanpa cekok isoflavon.
2. Kelompok ZE adalah kelompok pemberian ransum dengan fortifikasi Zn 27 mg/kg ransum dan fortifikasi vitamin E 500 mg/ kg ransum tanpa cekok isoflavon
3. Kelompok I adalah kelompok dengan pemberian ransum tanpa fortifikasi Zn, tanpa fortifikasi vitamin E dan dengan cekok isoflavon 3 mg/ekor/hari. 4. Kelompok IZ adalah kelompok pemberian ransum tanpa vitamin E,
14
5. Kelompok IE adalah kelompok pemberian ransum tanpa fortifikasi Zn, dengan fortifikasi vitamin E 500 mg/kg ransum dan dengan cekok isoflavon 3 mg/ekor/hari.
6. Kelompok IZE adalah kelompok pemberian ransum dengan fortifikasi Zn 27 mg/kg ransum, dengan fortifikasi vitamin E 500 mg/kg ransum dan dengan cekok 3 mg/ekor/hari (IZE)
Perlakuan terhadap tikus tersebut dilakukan selama 8 minggu kemudian dilakukan pengambilan sampel organ ginjal dari tikus. Tikus dikorbankan dengan cara dekapitasi. Pada bagian abdomen dibersihkan dengan alkohol 70 % kemudian dibedah untuk diambil organ ginjalnya.
Pembuatan Preparat dan Pewarnaan
Organ ginjal tikus yang diperoleh difiksasi dengan larutan Bouin selama 24 jam. Setelah itu dilakukan proses dehidrasi dengan tingkatan konsentrasi alkohol (70%, 80%, 90%, 95%) masing – masing 24 jam dilanjutkan dengan alkohol absolut I, II, III (masing – masing 1 jam) dan proses clearing xilol I, II, III (masing – masing 1 jam ). Jaringan kemudian diinfiltrasi parafin cair dalam inkubator 65ºC, selanjutnya diembedding dengan parafin. Cetakan dihangatkan terlebih dahulu dan dioles gliserin pada bagian dalam sebelum parafin cair dituangkan kedalamnya. Blok jaringan yang sudah jadi kemudian dipotong dengan mikrotom setebal 4µm.
Pada penelitian ini dilakukan dua teknik pewarnaan, yaitu pewarnaan
haematoxilin-eosin (HE) dan pewarnaan imunohistokimia terhadap antioksidan Cu,Zn-SOD.
1. Pewarnaan HE
15
akuades selama 5 menit, jaringan diwarnai dengan hematoxilin selama ½ - 1 menit kemudian direndam kembali dalamair kran selama 10 menit dan akuades selama 5 menit. Selanjutnya jaringan diwarnai dengan eosin selama 2 menit. Langkah selanjutnya dilakukan dehidrasi jaringan diikuti penjernihan dengan xylol kemudian dimounting dengan entelan. Hasil yang telah diwarnai siap diamati.
2. Pewarnaan Imunohistokimia Cu, Zn SOD
Pewarnaan khusus imunohistokimia terhadap Cu,Zn-SOD dilakukan untuk mengamati perubahan kandungan enzim antioksidan Cu,Zn-SOD pada jaringan ginjal. Langkah awal dilakukan deparafinisasi dengan xylol III – I, waktu untuk xylol III dan xylol II selama 3 menit sedangkan untuk xylol I selama 5 menit. Kemudian dilakukan rehidrasi dengan alkohol absolut III – alkohol 80% masing-masing 3 menit dan terakhir dengan alkohol 70% selama 5 menit. Selanjutnya dimasukkan dalam akuades selama 15 menit. Setelah itu diinkubasi dalam substrat metanol yang ditambahkan H2O2 selama 15 menit untuk menghilangkan
aktivitas peroksidase endogen, selanjutnya dicuci berturut-turut dengan akuades dan Phosphate Buffer Saline (PBS) masing masing 2x10 menit. Setelah itu jaringan dinkubasi dalam serum normal selama 30-60 menit untuk menutupi antigen non spesifik dan berikutnya jaringan dicuci dengan PBS selama 3x 10 menit. Kemudian jaringan dinkubasi dalam antibodi monoklonal Cu,Zn-SOD (1:200) pada suhu 4ºC selama 2 malam. Selanjutnya diinkubasi dalam antibodi sekunder selama 60 menit, Dako Envision Peroxidase (Dako K 1491) dalam ruang gelap dan sebelumnya harus dicuci dengan PBS selama 3x 5 menit. Hasil reaksi antigen dengan antibodi divisualisasikan dengan menggunakan DAB (Diamino Benzidine)
dalam trisbuffer yang ditambahkan H2O2 selama 25 menit (ditutup gelap),
16
Parameter dan Analisis Data Parameter
Hasil pewarnaan HE terhadap jaringan ginjal diamati menggunakan mikroskop cahaya yang diatur sedemikian rupa untuk melihat kondisi morfologi sel. Beberapa tanda histopatologi jaringan ginjal dibandingkan antar kelompok perlakuan. Pengamatan dilakukan dengan melihat morfologi dari inti dan sitoplasma sel tubuli ginjal, glomerulus dan daerah sekitar interstisial.
Pada pewarnaan imunohistokimia dilakukan pengamatan terhadap distribusi dan frekuensi produk reaksi enzim Cu,Zn-SOD pada jaringan ginjal masing-masing kelompok perlakuan. Pengamatan dilakukan secara kualitatif, kuantitatif, dan penghitungan persentase, dengan menggunakan mikroskop cahaya dengan perbesaran 20x. Pengamatan Cu,Zn-SOD secara kualitatif dilakukan pada seluruh bagian ginjal yaitu pada inti dan sitoplasma tubuli renalis, glomerulus dan daerah medulla. Pengamatan kuantitatif kandungan Cu,Zn-SOD dilakukan terhadap produk hasil reaksi pada inti sel tubuli renalis pada berbagai tingkat kandungan dari Cu,Zn-SOD per lapang pandang dengan perbesaran 20x. Ada empat tingkatan hasil reaksi, yaitu : (i) positif kuat (+++), terlihat warna coklat tua, (ii) positif sedang (++), terlihat warna coklat muda, (iii) positif lemah (+/-), terlihat warna coklat kebiru-biruan serta (vi) hasil reaksi negatif (-), terlihat warna biru. Profil kandungan Cu,Zn-SOD juga dilihat dari persentase jumlah inti sel tubuli renalis pada berbagai tingkat kandungan Cu,Zn-SOD.
Analisis Data
HASIL
Profil Antioksidan Cu,Zn-SOD
Pewarnaan imunohistokimia pada jaringan ginjal menunjukkan bahwa sel tubuli renalis yang mengandung antioksidan Cu,Zn-SOD berwarna coklat pada inti dan sitoplasmanya, sedangkan sel tubuli renalis yang bereaksi negatif berwarna biru pada inti dan sitoplasmanya.
Kandungan antioksidan Cu,Zn-SOD dari jaringan ginjal disajikan secara kualitatif, kuantitatif dan persentase jumlah inti sel tubuli renalis pada berbagai tingkat kandungan antioksidan Cu,Z-SOD. Pengamatan secara kualitatif dilakukan dengan cara melihat perbedaan intensitas warna yang terbentuk pada bagian sitoplasma, sedangkan pengamatan kuantitatif dilakukan dengan cara menghitung jumlah inti sel tubuli renalis yang bereaksi pada berbagai tingkat kandungan antioksidan Cu,Zn-SOD. Penghitungan persentase jumlah inti sel tubuli renalis didasarkan pada jumlah rata-rata inti sel pada berbagai tingkat kandungan antioksidan Cu,Zn-SOD.
a). Pengamatan Kualitatif
18
Tabel 1. Distribusi dan frekuensi antioksidan pada jaringan ginjal tikus
Kelompok Distribusi dan frekuensi Cu,Zn SOD
Glomerulus T.Proksimalis T.Distalis
K ZE
I IZ IE IZE
- +/- +/- +/- +/- +
+/- + + +/++ +/++ +++
+/- + + +/++ +/++ +++
Keterangan : (+) = adanya kandungan Cu,Zn-SOD pada jaringan, (/) = kandungan Cu,Zn SOD berada diantara dua nilai, (-) = tidak adanya kandungan Cu,Zn-SOD
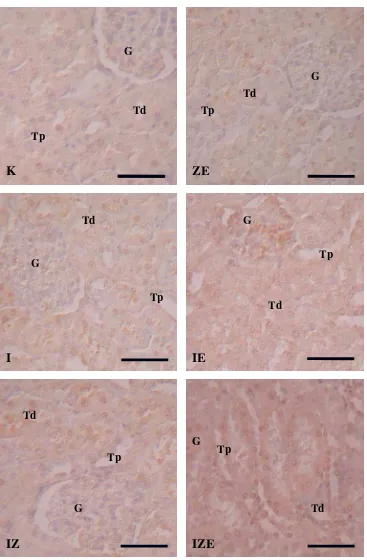
19
Gambar 2. Fotomikrograf jaringan ginjal tikus perlakuan. Pewarnaan Imunohistokimia. G : Glomerulus, Tp : Tubuli Proksimalis, Td : Tubuli distalis. Skala 50 µm.
K
ZE
IZE
IE
I
IZ
G
G
G
G
G G
Tp
Td Tp
Td
Td
Tp
Td
Tp Tp
Td
Tp
20
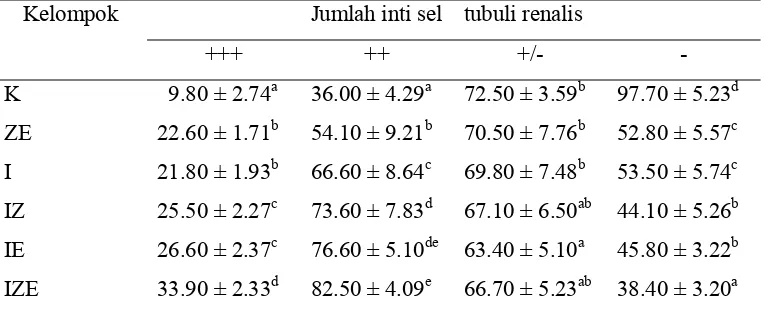
b). Pengamatan Kuantitatif
[image:40.612.131.513.330.485.2]Pengamatan kuantitatif kandungan antioksidan Cu,Zn-SOD pada jaringan ginjal dilakukan dengan menghitung jumlah inti sel tubuli renalis yang bereaksi pada berbagai tingkat kandungan antioksidan Cu,Zn-SOD. Untuk melihat reaksi tersebut dibedakan atas tiga tingkatan intensitas warna untuk reaksi positif dan satu warna untuk reaksi negatif. Reaksi positif terdiri dari positif kuat yang ditunjukkan warna coklat tua (+++), positif sedang yang ditunjukkan warna coklat muda (++), positif lemah ditunjukkan warna coklat campur biru (+/-). Sel yang tidak mengandung kandungan Cu,Zn-SOD atau bereaksi negatif ditunjukkan warna biru (-). Hasil penghitungan jumlah inti sel tubuli renalis pada berbagai tingkat kandungan antioksidan Cu,Zn-SOD tersaji pada tabel 2.
Tabel 2.Rata-rata jumlah sel tubuli renalis pada berbagai tingkat kandungan antioksidan Cu,Zn-SOD pada jaringan ginjal tikus perlakuan perlapang pandang pada perbesaran 20x
Kelompok Jumlah inti sel tubuli renalis
+++ ++ +/- - K ZE I IZ IE IZE
9.80 ± 2.74a 22.60 ± 1.71b 21.80 ± 1.93b 25.50 ± 2.27c 26.60 ± 2.37c 33.90 ± 2.33d
36.00 ± 4.29a 54.10 ± 9.21b 66.60 ± 8.64c 73.60 ± 7.83d 76.60 ± 5.10de 82.50 ± 4.09e
72.50 ± 3.59b 70.50 ± 7.76b 69.80 ± 7.48b 67.10 ± 6.50ab 63.40 ± 5.10a 66.70 ± 5.23ab
97.70 ± 5.23d 52.80 ± 5.57c 53.50 ± 5.74c 44.10 ± 5.26b 45.80 ± 3.22b 38.40 ± 3.20a
Keterangan : (+++) = positif kuat, (++) = positif sedang, (+/-) = positif lemah, (-) = negatif. Angka yang diikuti huruf yang berbeda pada kolom yang sama menunjukkan berbeda nyata pada (p< 0.05)
21
Pada kelompok ZE berdasarkan hasil uji statistik terhadap jumlah inti sel tubuli renalis pada berbagai tingkat kandungan antioksidan Cu,Zn-SOD menunjukkan kandungan antioksidan Cu,Zn-SOD lebih rendah dibandingkan dengan kelompok I. Hal ini ditunjukkan dengan jumlah inti sel yang bereaksi positif sedang lebih rendah secara nyata (p<0.05) pada kelompok ZE dibandingkan dengan kelompok I.
Pada kelompok IZ, berdasarkan uji statistik terhadap jumlah inti sel tubuli renalis pada berbagai tingkat kandungan Cu,Zn-SOD menunjukkan kandungan antioksidan Cu,Zn-SOD lebih tinggi dibandingkan dengan kelompok I. Hal ini terlihat pada jumlah inti sel yang bereaksi positif kuat dan positif sedang lebih tinggi secara nyata (p<0.05) pada kelompok IZ dibandingkan dengan kelompok I. Kandungan antioksidan Cu,Zn-SOD yang lebih tinggi ini juga ditunjukkan dengan jumlah inti sel yang bereaksi negatif lebih rendah secara nyata (p<0.05) pada kelompok IZ dibandingkan dengan kelompok I. Sedangkan pada kelompok IE jumlah inti sel yang bereaksi positif (positif kuat, positif sedang dan positif lemah) dan negatif tidak berbeda secara nyata (p>0.05) dibandingkan dengan kelompok IZ. Namun jumlah inti sel yang bereaksi positif sedang pada kelompok IE tidak berbeda secara nyata (p>0.05) dibandingkan dengan kelompok IZE, sedangkan jumlah inti sel yang bereaksi positif sedang pada kelompok IZE lebih tinggi secara nyata (p<0.05) dibandingkan dengan kelompok IZ. Jadi kelompok IE memiliki kandungan antioksidan Cu,Zn-SOD sedikit lebih tinggi dibandingkan dengan kelompok IZ.
Pada kelompok IZE menunjukkan kandungan antioksidan Cu,Zn-SOD paling tinggi dibandingkan dengan kelompok lain karena jumlah inti sel yang bereaksi positif kuat lebih tinggi secara nyata (p<0.05) dibandingkan dengan kelompok lain. Selain itu kandungan antioksidan Cu,Zn-SOD yang lebih tinggi juga terlihat pada jumlah inti sel yang bereaksi negatif lebih rendah secara nyata (p<0.05) pada kelompok IZE dibandingkan dengan kelompok lain.
22
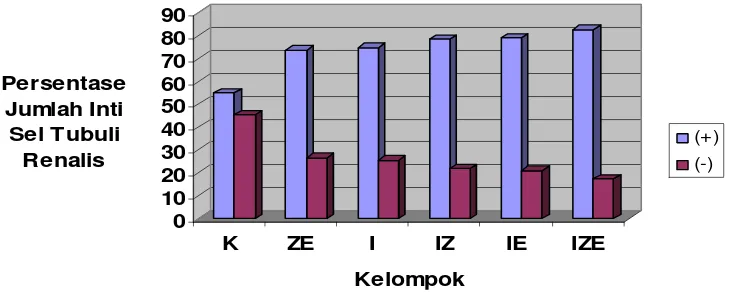
c). Penghitungan Persentase
Profil kandungan antioksidan Cu,Zn-SOD pada ginjal tikus perlakuan juga ditunjukkan dengan penghitungan persentase jumlah rata-rata inti sel tubuli renalis pada berbagai tingkat kandungan antioksidan Cu,Zn-SOD (Gambar 3). 0 10 20 30 40 50 60 70 80 90 Persentase Jumlah Inti Sel Tubuli Renalis
K ZE I IZ IE IZE
Kelompok
[image:42.612.138.503.182.329.2](+) (-)
Gambar 3.Persentase jumlah inti sel tubuli renalis yang memberikanreaksi positif (+) dan reaksi negatif (-) terhadap kandungan antioksidan Cu,Zn-SOD.
Dari hasil penghitungan persentase jumlah inti sel tubuli renalis yang memberikan reaksi positif dan reaksi negatif terhadap kandungan antioksidan Cu,Zn-SOD, diketahui bahwa kandungan antioksidan Cu,Zn-SOD pada kelompok K paling rendah dibandingkan dengan kelompok lain. Hal ini terlihat dari lebih rendahnya persentase jumlah inti sel yang bereaksi positif yaitu 55%. Kandungan antioksidan Cu,Zn-SOD paling rendah juga terlihat pada paling tingginya persentase jumlah inti sel yang bereaksi negatif 45% pada kelompok K dibandingkan dengan kelompok lain.
Pada kelompok ZE, berdasarkan hasil penghitungan persentase jumlah inti sel tubuli renalis memiliki kandungan antioksidan Cu,Zn-SOD sedikit lebih rendah dibandingkan dengan kelompok I. Hal ini ditunjukkan dengan lebih tingginya persentase jumlah sel tubuli yang bereaksi negatif 26% pada kelompok ZE dibandingkan dengan kelompok I yang memiliki persentase jumlah inti sel yang bereaksi negatif 25 %.
23
dibandingkan dengan kelompok IZ dan IE yang memiliki persentase jumlah inti sel yang bereaksi positif 78% dan 79%. Kandungan antioksidan Cu,Zn-SOD lebih rendah juga terlihat pada lebih tingginya persentase jumlah inti sel yang bereaksi negatif 25% pada kelompok I dibandingkan dengan kelompok IZ dan IE yang memiliki persentase jumlah inti sel yang bereaksi negatif 22% dan 21%.
Pada kelompok IZE, berdasarkan hasil penghitungan persentase jumlah inti sel tubuli renalis pada berbagai tingkat kandungan antioksidan Cu,Zn-SOD memiliki kandungan antioksidan Cu,Zn-SOD yang paling tinggi dibandingkan dengan kelompok lain. Hal ini ditunjukkan dengan lebih tingginya persentase jumlah inti sel yang bereaksi positif yaitu 83%. Kandungan antioksidan Cu,Zn-SOD yang paling tinggi juga terlihat dari lebih rendahnya persentase jumlah inti sel yang bereaksi negatif 17% pada kelompok IZE dibandingkan dengan kelompok lain.
Gambaran Morfologi Ginjal
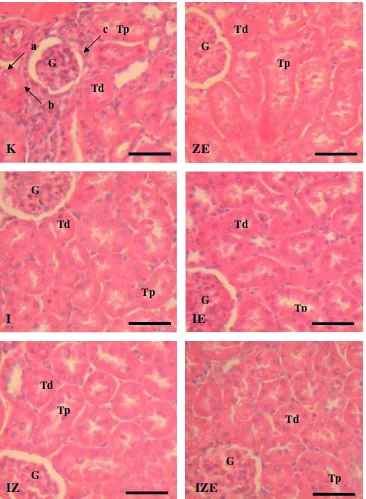
Gambaran morfologi ginjal tikus pada semua kelompok perlakuan dapat terlihat dengan menggunakan pewarnaan Hematoksilin dan Eosin (HE). Secara umum, pada semua kelompok inti sel-sel tubuli renalis berbentuk bulat dan mengambil warna biru. Seperti halnya pada bagian inti, sitoplasma dari sel-sel epitel tubuli renalis mengambil warna merah.
24
Gambar 4. Fotomikrograf jaringan tikus perlakuan. Pewarnaan HE. G : Glomerulus, Tp Tubuli proksimalis, Td : tubuli distalis, a : degenerasi sel, b : nekrosa sel, c : infiltrasi sel radang. Skala 50 µm.
G G
G
G G
G
K ZE
IZ
Tp Td
Td Td
Td
Td
Td Tp
Tp
Tp
Tp
Tp b
a
I IE
c
PEMBAHASAN
Profil Antioksidan Cu,Zn-SOD
Metabolisme merupakan aktivitas yang sangat penting di dalam kehidupan makhluk hidup karena metabolisme menghasilkan energi yang bermanfaat bagi aktivitas hidup. Makhluk hidup tingkat tinggi melakukan sebagian besar proses metabolismenya dalam suasana aerobik (membutuhkan O2). Bahan-bahan
makromolekul dari hasil pencernaan (karbohidrat, protein, lipid) dimetabolisme menjadi molekul yang lebih kecil (hasil akhir berupa energi bebas) dengan cara oksidasi. Proses oksidasi bahan-bahan makromolekul akan menghasilkan produk sampingan berupa radikal bebas (Voet dan Voet 1995). Radikal bebas adalah atom atau molekul yang sifatnya sangat tidak stabil (mempunyai satu elektron atau lebih yang tanpa pasangan pada orbital terluarnya), sehingga untuk memperoleh pasangan elektron senyawa ini sangat reaktif dan merusak sel. Sebenarnya radikal bebas sangat berperan didalam rantai transport elektron proses metabolisme aerobik(reaksi redoks)(Voet dan Voet 1995). Untuk mengatasi sifat radikal bebas yang tidak stabil, reaktif dan cenderung merusak, tubuh akan memberikan respon penggunaan enzim yang bersifat antioksidatif (antioksidan endogen).
Antioksidan superoksida dismutase (SOD) merupakan salah satu enzim yang bertanggung jawab dalam menjaga tubuh dari radikal bebas (Kerksick dan Willoughby 2005) terutama antioksidan Cu,Zn-SOD merupakan lini pertahanan pertama dalam melawan radikal bebas (Desphande et al. 1996). Enzim ini akan bereaksi dengan anion superoksida menjadi hidrogen peroksida (H2O2) yang lebih
stabil atau tidak berbahaya bagi tubuh (Hwang et al. 2005). Selanjutnya H2O2
akan dinetralisir oleh enzim katalase dan glutathion peroksidase.
26
mengatasi radikal bebas, tubuh melakukan perlawanan dengan penggunaan antioksidan seluler sehingga terjadi penurunan kandungan antioksidan tubuh.
Pemberian vitamin E dan zinc pada ransum kelompok ZE dapat memberikan pengaruh yang nyata terhadap tingginya kandungan antioksidan Cu,Zn-SOD. Hal ini disebabkan karena vitamin E mempunyai peran sebagai antioksidan yang melindungi membran bilayer sel dari peroksidasi lipid dengan cara membentuk ikatan dengan radikal bebas ( Noguchi and Niki 1998). Zinc adalah trace mineral esensial yang berperan dalam berbagai reaksi enzimatis dalam tubuh dan sebagai kofaktor beberapa sistem enzim antioksidan : Cu,Zn-SOD (Bunker 1992).
Pada kelompok I dengan pemberian isoflavon memberikan pengaruh yang nyata terhadap tingginya kandungan Cu,Zn-SOD. Isoflavon adalah senyawa golongan flavonoid yang mempunyai peran sebagai antioksidan yang kuat terutama Genistein (Wei et al. 1996). Mekanisme kerja isoflavon sebagai antioksidan ditunjukkan dengan banyak cara, diantaranya yaitu dengan menangkap radikal bebas secara langsung (Nijveldt 2001) dan mempertahankan stabilitas membran terhadap peroksidasi lipid (Wiseman et al. 1993). Kandungan antioksidan Cu,Zn-SOD pada kelompok I lebih tinggi dibandingkan dengan kelompok ZE. Hal ini disebabkan isoflavon secara struktur molekul memiliki dua
[image:46.612.148.386.513.693.2]pharmacophore yang bersifat antioksidatif yaitu grup 4’hydroxyl pada B-ring dan grup hydroxyl AC-ring (Gambar 5). Keduanya dapat sebagai donor hidrogen/elektron (Heijnen et al. 2002).
27
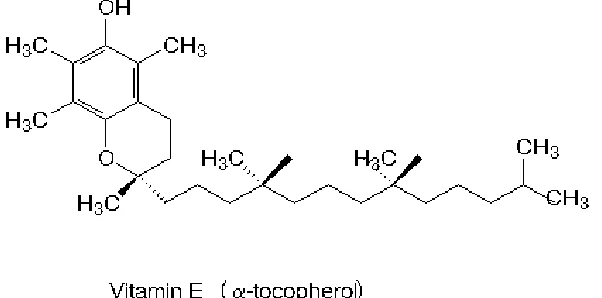
[image:47.612.137.438.245.394.2]Dengan adanya dua pharmacophore tersebut aktivitas sebagai scavanger radikal bebas semakin tinggi (Wu 2005). Berbeda dengan isoflavon, vitamin E hanya mempunyai satu pharmacophore yang berperan sebagai donor hidrogen/elektron (Gambar 6). Sedangkan zinc hanya sebagai kofaktor sistem enzim antioksidan (tidak secara langsung melawan radikal bebas). Sehingga kapasitas isoflavon sebagai antioksidan lebih tinggi dibandingkan dengan kobinasi vitamin E dan zinc.
Gambar 6. struktur molekul vitamin E (sumber Manalu, 1999)
Kandungan antioksidan Cu,Zn-SOD pada kelompok IZ dan IE lebih tinggi secara nyata dibandingkan dengan kelompok I. Hal ini disebabkan adanya kombinasi isoflavon dengan zinc pada kelompok IZ dan kombinasi isoflavon dengan vitamin E pada kelompok IE. Pada kelompok IZ, isoflavon berperan sebagai scavenger radikal bebas (Cristobal, 2000) dan mempertahankan stabilitas membran dari peroksidasi lipid sedangkan zinc berperan sebagai kofaktor sistem enzim antioksidan (Cu,Zn-SOD). Pada kelompok IE, isoflavon dan vitamin E mempunyai fungsi antioksidan yang hampir sama yaitu scavenger radikal bebas dan mempertahankan stabilitas membran dari peroksidasi lipid. Kandungan antioksidan Cu,Zn-SOD pada kelompok IE sedikit lebih tinggi dibandingkan dengan kelompok IZ. Hal ini mungkin disebabkan adanya dua antioksidan yang berperan sebagai scavenger radikal bebas yaitu isoflavon dan vitamin E pada kelompok IE. Sedangkan pada kelompok IZ hanya ada isoflavon sebagai
28
Kelompok IZE memiliki kandungan antioksidan Cu,Zn-SOD paling tinggi dibandingkan dengan kelompok lain. Hal ini menunjukkan penggunaan antioksidan endogen berkurang karena pada kelompok ini dikombinasikan pemberian isoflavon, vitamin E dan zinc. Isoflavon dan vitamin E bersinergi sebagai scavenger radikal bebas dan pelindung membran dari peroksidasi lipid serta dibantu zinc sebagai motor reaksi enzimatis dan kofaktor sistem enzim antioksidan. Sehingga dengan kombinasi dari tiga bahan tersebut membentuk pertahanan yang kuat dari serangan radikal bebas.
Morfologi Ginjal
Ginjal adalah organ pengatur utama cairan tubuh dan alat ekskresi tubuh. Menurut Dellman dan Brown (1992) fungsi utamanya adalah mengatur cairan elektrolit, mengeluarkan limbah metabolisme, memusnahkan zat toksik dan kesetimbangan asam basa serta tekanan darah. Karena mempunyai fungsi sebagai alat ekskresi tubuh, produksi radikal bebas di ginjal akan lebih banyak dibandingkan dengan organ lain. Radikal bebas tersebut merupakan molekul reaktif atau molekul yang tidak stabil, sehingga untuk melengkapi kekurangan tersebut radikal bebas akan berikatan dengan senyawa makromolekul seperti karbohidrat, protein dan lipid yang merupakan komponen pembentuk sel tubuh (Desphande et al. 1996).
Dengan pewarnaan Hematoksilin dan Eosin (HE) hasil penelitian menunjukkan pada kelompok K ditemukan lebih banyak infiltrasi sel radang dan sel yang mengalami degenerasi dan nekrosa dibandingkan dengan kelompok lain. Hal tersebut mungkin disebabkan oleh penyerangan radikal bebas terhadap sel dan lemahnya kemampuan antioksidan endogen mengatasi hal tersebut (terjadi penurunan kandungan antioksidan endogen). Sehingga sel mengalami degenerasi yang menyebabkan terjadinya infiltrasi sel radang.
KESIMPULAN DAN SARAN
Kesimpulan
1. Pemberian isoflavon dapat meningkatkan profil antioksidan Cu,Zn-SOD lebih tinggi dibandingkan dengan pemberian vitamin E dan Zn.
2. Pemberian isoflavon yang dikombinasikan dengan vitamin E dan Zn dapat meningkatkan kandungan antioksidan Cu,Zn-SOD pada jaringan ginjal tikus dibandingkan dengan pemberian isoflavon saja atau vitamin E dan Zn.
3. Pemberian vitamin E yang dikombinasi dengan isoflavon meningkatkan kandungan antioksidan Cu,Zn-SOD pada jaringan ginjal yang lebih tinggi dibandingkan pemberian mineral Zn yang dikombinasikan dengan isoflavon.
4. Pemberian isoflavon, vitamin E dan Zn secara lengkap menunjukkan profil antioksidan Cu,Zn-SOD terbaik pada jaringan ginjal tikus.
Saran
DAFTAR PUSTAKA
Ames BN, Shigenaga MK, Hagen TM. 1993. Oxidant, atioxidant and degenerative disease of aging. Proc Natl Acad Sci 90:15-22.
Bank WJ. 1986. Applied Veterinary Histology. 2thedition. Baltimore.[hal 374-384].
Bunker VW. Free radicals, antioxidants and aging. Medical laboratory sciences, 1992, 49:299–312.
Cristobal M. 2000. Antioxidant activities of flavonoids. lpi.oregonstate.edu/f-w00/flavonoid.html.[9 Februari 2007].
Dellman HD, Brown E. 1992. Buku Teks Histologi Veteriner II. Jakarta: UI Press.[hal 411-433].
Desphande SS, Desphande US, Salunkhe DK. 1996. Food Antioxidant : Nutritional and Health Aspect. Marcel Dekker.USA.[hal 365-387].
Dormandy T.L.1977.Vitamin E and antioxidant activity. Proc.roy.Soc.Med. 70:91-92
Gitawati. 1995. Radikal bebas, sifat dan peranan dalam menimbulkan kerusakan atau kematian sel. Cermin Dunia Kedokteran. 102:33-36.
Halliwell B, Gutteridge JMC. 1990. Role of free radical and catalytic ions in human disease : overview. Meth Ency mol. 86:1-83.
Heijnen C, Haenen GR, Oostveen RM, Stalpers EM, Bast A. 2002. Protection of flavonoids against lipid peroxidation : the structure activity relationship revisited. Free. Radic. Res. 36 : 575-581.
Hwang J, Kleinhenz DJ, Lassègue B, Griendling KK, Dikalov S, Hart CM. 2005. Peroxisome proliferator-activated receptor- ligands regulate endothelial membrane superoxide production. AM J PhysiolCell. 288 : C899-C905.
Hidayati M. 2004. Profil imunohistokimia enzim antioksidan copper,zinc superokside dismutase (Cu,Zn-SOD) pada jaringan ginjal tikus dengan perlakuan stres dan pemberian α-tokoferol.[Skripsi].Bogor:Fakultas Kedokteran Hewan, Institut Pertanian Bogor.
31
Kartikawati. 1999. Study efek proteksi vitamin C dan E terhadap respon imun dan enzim antioksidan mencit yang dipapar paraquat. [Tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Karyadi E. 2004. Antioksidant, resep sehat dan umur panjang. [terhubung berkala]. http//www.indonesiamedia.com/2004/.../kesehatan/ kesehatan
-0704-antioksidan-5k-.html. [4 Januari 2007].
Kerksick C, Willoghby D. 2005. The antioxidant role of gluthation and nacetyl-cystein supplements and exercise-induced oxidative stress. Journal of The International Society and Sport Nutrition.2(2) : 38-44.
Levy MA, Bray TM. 2003. Antioxidant function of dietary zinc and protection against neural disorders. lpi.oregonstate.edu/ss03/zinc.html.[9 Februari 2007].
Martin DW, Mayes PA, Rodwell VW.1981. Harper’s Review of Biochemistry.18thedition. California: Lange Medical Publication. [hal 119 dan 563].
Maclhlin. 1991. Handbook of vitamins. New York : Marcel Dekker Inc.[hal 99-136].
Muhilal. 1991. Teori radikal bebas dalam gizi dan kedokteran. Cermin Dunia Kedokteran. 73:9.
Manalu W.1999. Pengantar Ilmu Nutrisi Hewan. Bogor: Bagian Fisiologi dan Farmakologi, Institut Pertanian Bogor.[Bab VII hal 11-13 dan Bab VIII hal 21].
Maronpot RR, Boorman GA, Gaul BW. 1999. Pathology of Mouse. Viena ; Cache river Press.[hal 208-234].
Mahn K, Borras C, Knock GA, Taylor P, Khan IY, Sugden D, Poston L, Ward JP, Sharpe RM, Vina J, Aaronson PI, Mann GE. 2005.Dietary soy isoflavone-induced increases in antioxidant and eNOS gene expression lead to improved endothelial function and reduced blood pressure in vivo.The FASEB Journal Express Articledoi:10.1096/fj.05-4008fje.[hal 109-130].
Noguchi N, Niki E. 1998. Chemistry of Active Oxygen Species andAntioxidant: In Papas AM (ed) Antioxidant status, diet, nutrition and health. Bucaraton : CRC Press.[hal 3-20].
Nijveldt RJ, Nood E, Hoorn DEC, Boelens PG, Norren K, Leeuwen PA. 2001. Flavonoids: A review of probable mechanism of action an potential application. Am J Clin Nutr. 74 (4) 418-425.
32
Powell SR. 2000. The antioxidant properties of zinc. Journal Nutrition. 130 : 1447S-1454S.
Sutrisno K. 2006. Isoflavon senyawa multi manfaat dalam kedelai.
ebookpangan.com. [1 Januari 2007].
Tejasari. 2000. Efek proteksi komponen bioaktif oleoresin rimpang jahe (Zingiberofficiae Roscoe) terhadap fungsi limfosit secara invitro.[Disertasi]. Bogor :Prgram Pascasarjana, Institut Pertanian Bogor.
Voet D, Voet GJ. 1995. Biochemistry. 2rd Edition. JHON WILEY & SONS,INC. New York.
Winarsi H. 2004. Respon hormonal imunologis wanita premonopause terhadap minuman fungsional berbahan dasar susu skiming disuplementasi dengan isoflavon dan zinc.[Disertasi].Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Walji H. 1992. Vitamin Guide : Essential nutritient for healthly living. Shaftesbury Element.[hal 181-194].
Wei H, Bowen R,Cai Q. 1995. Isoflavones are natural antioxidants. Proc Soc Exp Bio Med. 208(1) :124-130.
Wei H, Cai Q. 1996. Effect of dietary genistein on antioksidant enzime activities in SENCAR mice. Nutritional & Cancer. 25: 1-7.
Wiseman H, Quinn P, Halliwell B. 1993. Tamoxifen and related compounds decrease membrane fludity in liposomes : mechanism for the antioxidant action of tamoxifen and cardioprotective action ?. FEBS Lett. 330 : 53-56.
Wresdiyati T, Astawan M, Nurwati VD. 2006. Level antioksidan superoksida dismutase (SOD) pada ginjal tikus hiperkolesterolemia : suatu kajian imunohistokimia. Jurnal Sain Veteriner. 24(2) : 168-176.
33
Ginjal
Difiksasi dalam Bouin (24 jam)
Stopping point alkohol 70%
Dehidrasi dalam alkohol bertingkat(alkohol 80%-95% dan alkohol absolut I, II, III)
Embedding dalam parafin
Clearing dengan xilol I, II, III
Pemotongan dengan mikrotom Lampiran 1. Proses Preparasi Jaringan
34
Lampiran 2.
Deparafinisasi -rehidrasi( Xilol III-I, alkohol absolut III -I dan alkohol 95% -70%) @ 5 menit
Air mengalir (10 -15 menit)
Akuades (5 -10 menit)
Haematoksilin (1 menit)
Eosin (2 menit) Akuades (5 menit) Air mengalir (5 menit)
Akuades (5 menit)
Mounting
Dehidrasi dan Clearing (alkohol 70% -95%, absolut I -III silol I-III) 3-5 menit
35
Lampiran 3. Proses Pewarnaan Imunohistokimia
Deparafinisasi – Rehidrasi ( 5 menit)
Akuades
Hydrogen Peroksida dalam Metanol
Akuades (10-15 menit)
PBS 2x (@ 5- 10 menit)
Serum Normal 10% 50-60 µm/sediaan 60 menit, 37 oC
PBS 3x (@ 5 menit)
Antibodi SOD (1:200) 50-60 µm/sediaan 2 malam, 4 oC
PBS 3x (@ 5-10 menit)
DAKO Envision Peroxidase System 50-60 µm/sediaan, 37 oC
PBS 3x (@ 5 menit)
DAB + H2O2 (25 menit) cek mikroskop
Counterstain dengan Haematoxylin Mayer
36
Lampiran 4. Komposisi Ransum Standar
Komposisi Ransum Standar Tikus per 100gr
Komposisi bahan Perlakuan
K I IZ IZ IE IZE Kasein (g) 16.64 16.64 16.64 16.64 16.64 16.64 Minyak jagung (g) 7.91 7.91 7.91 7.91 7.91 7.91 Mineral mix (g) 4.35 4.35 4.35 4.35 4.35 4.35 ZnSO4.7H2O - - 2.7 2.7 - 2.7 Vitamin (g)
(multivitaplex) 1 1 1 1 1 1 Asam folat (mg) 30 30 30 30 30 30 Vitamin K (mg) 5 5 5 5 5 5 Vitamin E (mg) - - 50 - 50 50 Selulosa 0.99 0.99 0.99 0.99 0.99 0.99 Air 4.28 4.28 4.28 4.28 4.28 4.28 pati 64.83 64.83 64.83 64.83 64.83 64.83
37
Lampiran 5. Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif kuat terhadap kandungan Cu,Zn-SOD sel tubuli ginjal tikus
Positif Kuat (+++)
Antara- Faktor Subjek
Perlakuan N
K 10
ZE 10
I 10
IZ 10
IE 10
IZE 10
Uji antara-Efek Subjek
Dependent Variable: sel tubuli ginjal tikus yang bereaksi pada positif kuat
Sumber Tipe III jumlah kuadrat Derajat Bebas Kuadrat
tengah F Sig.
Corrected Model 3130.533a 5 626.107 123.664 .000
Intercept 32760.067 1 32760.067 6470.533 .000
Perlakuan 3130.533 5 626.107 123.664 .000
Galat 273.400 54 5.063
Total 36164.000 60
Corrected Total 3403.933 59
a R Squared = .920 (Adjusted R Squared = .912)
Post Hoc Tests
Homogeneous Subsets
Sel tubuli ginjal tikus
Duncan
a,bPerlakuan N Subset
1 2 3 4
K 10 9.8000
I 10 21.8000
ZE 10 22.6000
IZ 10 25.5000
IE 10 26.6000
IZE 10 33.9000
Sig. 1.000 .430 .279 1.000
Means for groups in homogeneous subsets are displayed. Based on Type III Sum of Squares The error term is Mean Square(Error) = 5.063.
38
Lampiran 6. Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif sedang terhadap kandungan Cu,Zn-SOD sel tubuli ginjal tikus
Positif Sedang (++)
Antara- Faktor Subjek
Perlakuan N
K 10
ZE 10
I 10
IZ 10
IE 10
IZE 10
Uji antara-Efek Subjek
Dependent Variable: sel tubuli ginjal tikus yang bereaksi pada positif sedang
Sumber Tipe III jumlah kuadrat Derajat Bebas Kuadrat
tengah F Sig.
Corrected Model 14770.800a 5 2954.160 60.920 .000
Intercept 252720.600 1 252720.600 5211.530 .000
Perlakuan 14770.800 5 2954.160 60.920 .000
Galat 2618.600 54 48.493
Total 270110.000 60
Corrected Total 17389.400 59
a R Squared = .849 (Adjusted R Squared = .835)
Post Hoc Tests
Homogeneous Subsets
Sel tubuli ginjal tikus
Duncan
a,bPerlakuan N Subset
1 2 3 4 5
K 10 36.0000
ZE 10 54.1000
I 10 66.6000
IZ 10 73.6000
IE 10 76.6000 76.6000
IZE 10 82.5000
Sig. 1.000 1.000 1.000 .340 .064
Means for groups in homogeneous subsets are displayed. Based on Type III Sum of Squares The error term is Mean Square(Error) = 48.493.
39
Lampiran 7. Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif lemah terhadap kandungan Cu,Zn-SOD sel tubuli ginjal tikus
Positif Lemah (+/-)
Antara- Faktor Subjek
Perlakuan N
K 10
ZE 10
I 10
IZ 10
IE 10
IZE 10
Uji antara-Efek Subjek
Dependent Variable: sel tubuli ginjal tikus yang bereaksi pada positif lemah
Sumber Tipe III jumlah kuadrat Derajat Bebas Kuadrat
tengah F Sig.
Corrected Model 527.333a 5 105.467 2.814 .025
Intercept 280166.667 1 280166.667 7474.802 .000
Perlakuan 527.333 5 105.467 2.814 .025
Galat 2024.000 54 37.481
Total 282718.000 60
Corrected Total 2551.333 59
a R Squared = .207 (Adjusted R Squared = .133)
Post Hoc Tests
Homogeneous Subsets
Sel tubuli ginjal tikus
Duncan
a,bPerlakuan N Subset
1 2
IE 10 63.4000
IZE 10 66.7000 66.7000
IZ 10 67.1000 67.1000
I 10 69.8000
ZE 10 70.5000
K 10 72.5000
Sig. .208 .062
Means for groups in homogeneous subsets are displayed. Based on Type III Sum of Squares The error term is Mean Square(Error) = 37.481.
40
Lampiran 8. Analisis Sidik Ragam (ANOVA) dengan uji lanjutan Duncan yang memberikan reaksi positif negatif terhadap kandungan Cu,Zn-SOD sel tubuli ginjal tikus
Positif Negatif (-)
Antara- Faktor Subjek
Perlakuan N
K 10
ZE 10
I 10
IZ 10
IE 10
IZE 10
Uji antara-Efek Subjek
Dependent Variable: sel tubuli ginjal tikus yang bereaksi negatif
Sumber Tipe III jumlah kuadrat Derajat Bebas Kuadrat
tengah F Sig.
Corrected Model 23085.083a 5 4617.017 198.329 .000
Intercept 184038.817 1 184038.817 7905.573 .000
Perlakuan 23085.083 5 4617.017 198.329 .000
Galat 1257.100 54 23.280
Total 208381.000 60
Corrected Total 24342.183 59
a R Squared = .948 (Adjusted R Squared = .944)
Post Hoc Tests
Homogeneous Subsets
Sel tubuli ginjal tikus
Duncan
a,bPerlakuan N Subset
1 2 3 4
IZE 10 38.4000
IZ 10 44.1000
IE 10 45.8000
ZE 10 52.8000
I 10 53.5000
K 10 97.7000
Sig. 1.000 .434 .747 1.000
Means for groups in homogeneous subsets are displayed. Based on Type III Sum of Squares The error term is Mean Square(Error) = 23.280.