DAYA INHIBISI EKSTRAK ROSELLA (Hibiscus sabdariffa) TERHADAP ENZIM ALFA-AMILASE, ALFA-GLUKOSIDASE DAN LIPASE
SECARA IN VITRO
ILUL URIFAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
ABSTRACT
ILUL URIFAH. (In Vitro) Inhibition of α-Amylase, α-Glucosidase and Lipase by Roselle (Hibiscus Sabdariffa) Extracts by In Vitro Method. Supervised by
ENDANG PRANGDIMURTI, FRANSISCA R. ZAKARIA.
Obesity is caused as the result of an imbalance between energy intake and expenditure. Moreover, obesity is a strong risk factor for various diseases, such as hypertension, arteriosclerosis, diabetes mellitus. The aim of the present study is to evaluate the ability of roselle aqueous extract (RAE) to inhibit porcine pancreas lipase, S. Cerevisiae α-glucosidase, Bacillus. sp α-amylase and porcine pancreas
α-amylase activity in vitro. Fresh roselle flower was extracted by aquadest at 70, 85 and 100o C for 15 and 30 minutes. We also analyzed total soluble phenolic content of the extract by the Folin-Ciocalteu reagent and total acidity by titratable acidity methods. The results indicated that RAE without pH treatment had more
than 80% inhibitory activity for lipase, α-glucosidase and both α-amylase. Next we treated the pH of RAE similiar to intestinal digestion condition as follow : the pH was reduced to pH 2 for 30 minutes and than increased to pH 6,8. The pH
treated RAE had no effect on α-glucosidase and low inhibition on lipase activity
but it showed the highest inhibition activity against α-amylase. Kinetic studies
revealed uncompetitive inhibition of RAE on α-amylase porcine pancreas. Based
on its strong α-amylase inhibitory RAE seems promising to be an anty obesity agent, although needs further study to proof in vivo efficacy.
RINGKASAN
ILUL URIFAH. Daya Inhibisi Ekstrak Rosella (Hibiscus Sabdariffa) terhadap Enzim Alfa Amilase, Alfa Glukosidase dan Lipase Secara In Vitro. ENDANG PRANGDIMURTI dan FRANSISCA R. ZAKARIA.
Perubahan pola hidup yang menjurus kepada westernisasi dan sedentary berdampak pada peningkatan resiko obesitas. Menurut WHO, obesitas telah menjadi epidemi global dan menjadi problem kesehatan yang harus segera diatasi sebab orang yang mengalami obesitas memiliki resiko tinggi terkena berbagai penyakit kronis seperti penyakit kardiovaskular, hipertensi, diabetes tipe 2 dan kanker.
Pencegahan peningkatan prevalensi obesitas dapat dilakukan dengan pembatasan asupan kalori karbohidrat dan lemak. Hal ini dapat dilakukan dengan meningkatkan konsumsi pangan yang memiliki komponen bioaktif yang dapat
menghambat kerja enzim pemecah karbohidrat (α-amilase, α-glukosidase) dan lemak (lipase). Komponen bioaktif yang mampu menurunkan daya cerna karbohidrat dan lipid dalam tubuh dapat dilakukan dengan cara menghambat kerja
enzim lipase, α-glukosidase dan α-amilase. Tujuan penelitian ini adalah mengamati pengaruh kondisi ekstraksi dan kondisi pH pencernaan secara in vitro
terhadap kemampuan inhibisi enzim α-amilase, α-glukosidase dan lipase dari ekstrak rosella. Tahapan penelitian ini yaitu : penentuan rasio rosella dengan larutan pengekstrak (aquades), pembuatan ekstrak pada berbagai kondisi pemanasan, pengaturan pH simulasi sistem pencernaan dan pengujian kinetika inhibisi dari ekstrak yang memiliki daya inhibisi paling tinggi.
Penentuan rasio bunga rosella dengan larutan pengekstrak (aquades) dilakukan dengan perbandingan 1:1; 1:2; 1:3; 1:4 dan 1:5 (b/v). Hancuran sampel diekstraksi pada suhu 70o C selama 15 menit pada penangas air bergoyang. Ekstrak yang diperoleh dari hasil penyaringan diukur total padatan terlarut (TPT) nya menggunakan refraktometer. Rasio yang menghasilkan TPT terbesar digunakan untuk tahap berikutnya yaitu tahap pembuatan ekstrak pada berbagai kondisi pemanasan. Pada tahap ini sampel diekstraksi dengan aquades pada suhu 70o C, 85o C, 100o C selama 15 dan 30 menit pada penangas air bergoyang. Ekstrak yang dihasilkan (disebut ekstrak awal) kemudian diukur pH, total asam tertitrasi (TAT), total fenol, daya inhibisi enzim α-amilase, α-glukosidase dan lipase.
Pada tahap berikutnya sebagian ekstrak awal diatur pHnya menyerupai sistem pencernaan tubuh yaitu lambung dan usus halus. Mula-mula pH ekstrak diatur menjadi pH 2,0 menggunakan HCl, lalu didiamkan selama 30 menit, kemudian pH dinaikkan ke 6,8 menggunakan NaOH. Selanjutnya ekstrak diukur daya
inhibisi α-amilase, α-glukosidase dan lipase. Pada uji kinetika inhibisi digunakan sederetan konsentrasi ekstrak. Ekstrak dengan konsentrasi terbaik kemudian
Hasil pengamatan menunjukkan bahwa tingkat rasio rosella dan aquades (larutan pengekstrak) 1:3 menggambarkan tingkat warna yang lebih gelap serta memiliki total padatan terlarut (TPT) paling besar (0,6%) dibandingkan tingkat rasio yang lain. Total padatan terlarut pada rasio 1:1, 1:2, 1:4 dan 1:5 berturut-turut adalah 0,1%, 0,3%, 0,2%, 0,2%. Nilai keasaman (pH) ekstrak pada berbagai kondisi ekstraksi berkisar antara 2,78-2,86. Kondisi ekstraksi 100o C selama 30 menit menghasilkan TAT ekstrak rosella tertinggi sebesar 9,06% (0,0906 ml 0,1 N NaOH/100 ml ekstrak rosella). Total fenol tertinggi didapat dari kondisi ekstraksi 100o 30 menit pada taraf signifikansi p = 0,07 sebesar 0,67 mg GAE/g rosella segar (kadar air 81% (bb)).
Pada ekstrak awal, perbedaan interaksi suhu dan waktu ekstraksi tidak
berpengaruh terhadap daya inhibisi α-amilase dan α-glukosidase. Interaksi suhu dan waktu ekstraksi berpengaruh pada daya inhibisi lipase dengan taraf
signifikansi p = 0,1. Kisaran inhibisi ekstrak awal rosella terhadap enzim α
-amilase, α-glukosidase dan lipase secara berurutan adalah 92,93-98,65%; 82,65-93,53% dan 85,78-94,17%.
Dibandingkan dengan ekstrak awal, ekstrak yang diberi perlakuan pH simulasi sistem pencernaan menunjukkan penurunan daya inhibisi untuk ketiga
enzim. Kisaran daya inhibisi enzim α-amilase adalah 8,48-40,39%, sedangkan kisaran daya inhibisi enzim lipase adalah 2,64%-41,15%.
Daya inhibisi α-amilase terbaik pada ekstrak yang mengalami perlakuan pH sistem pencernaan didapat pada hasil ekstraksi 70o C 15 menit sebesar 40,39%. Semua ekstrak rosella yang mengalami perlakuan pH sistem pencernaan
tidak lagi memiliki daya inhibisi α-glukosidase. Daya inhibisi enzim lipase terbaik pada ekstrak yang mengalami perlakuan pH sistem pencernaan didapat dari hasil ekstraksi 100O C sebesar 33,85-41,15%. Kinetika penghambatan ekstrak rosella
PERNYATAAN MENGENAI TESIS DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Daya Inhibisi Ekstrak Rosella (Hibiscus Sabdariffa) Terhadap Enzim Alfa-Amilase, Alfa-Glukosidase Dan Lipase Secara In Vitro adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Oktober 2011
@ Hak Cipta milik Institut Pertanian Bogor Tahun 2011
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulisan ini tanpa mencantumkan atau menyebut sumber
a.Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b.Pengutipan tidak merugikan kepentingan yang wajar IPB
DAYA INHIBISI EKSTRAK ROSELLA (
Hibiscus Sabdariffa
)
TERHADAP ENZIM ALFA-AMILASE,
ALFA-GLUKOSIDASE DAN LIPASE SECARA
IN VITRO
ILUL URIFAH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Daya Inhibisi Ekstrak Rosella (Hibiscus sabdariffa) Terhadap Enzim Alfa-Amilase, Alfa-Glukosidase Dan Lipase Secara In Vitro
Nama : Ilul Urifah NRP : F251090031 Program Studi : Ilmu Pangan
Disetujui,
Komisi Pembimbing
Dr. Ir. Endang Prangdimurti, M.Si Prof. Dr. Ir. Fransisca R. Zakaria, M.Sc
Ketua Anggota
Diketahui,
Ketua Program Studi Dekan Sekolah Pascasarjana Ilmu Pangan
Dr. Ir. Ratih Dewanti-Hariyadi, M.Sc Dr. Ir. Dahrul Syah, M.Sc. Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas Rahmat dan Karunia-NYA sehingga karya ilmiah ini berhasil diselesaikan. Shalawat dan salam untuk Nabi Muhammad SAW, keluarga dan sahabat dan para pengikutnya. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2011 sampai Juli 2011 ini adalah Daya Inhibisi Ekstrak Rosella (Hibiscus Sabdariffa) Terhadap Enzim Alfa-Amilase, Alfa-Glukosidase Dan Lipase Secara In Vitro.
Terima kasih penulis ucapkan kepada:
1. Dr. Ir. Endang Prangdimurti, M.Si dan Prof.Dr. Ir. Fransisca R. Zakaria, M.Sc selaku pembimbing atas bimbingan dan bantuan dana selama pelaksanaan penelitian.
2. Suamiku, Deddy Wahyu Setiadi, atas doa, dorongan, kesetiaan, kesabaran dan kasih sayangnya selama ini.
3. Orang tuaku Bapak Djamari, Ibu Surinah adik-adikku Itom dan Novi atas doa, dukungan kesempatan dan kasih sayangnya.
4. Teman2 seperjuangan IPN 2009 Fenny, Hermawan, Dian, Wanny, Riyanti, Bu Indah, Rizqi, Tina, Imel, bu Wida, Rangga dan pak Supri.
5. Teman2 di Wisma Intan Evi, mba Fita, Nunuz, Ria dan Tia.
6. Seluruh teman yang membantu penulis selama kuliah dan penulisan karya ilmiah ini yang tidak mungkin disebutkan satu-persatu.
Semoga karya ilmiah yang sederhana ini bermanfaat.
Bogor, Oktober 2011
RIWAYAT HIDUP
DAFTAR ISI 2.1.2 Pencernaan dan Penyerapan Lipid (Lemak) ... 2.2 Enzim... 2.2.1 Enzim α-Amilase dan Inhibitornya... 2.2.2 Enzim α-Glukosidase dan Inhibitornya... 2.2.3 Enzim Lipase dan Inhibitornya... 3.3.1 Penentuan Kadar Air dengan Metode Oven... 3.3.2 Penentuan Rasio Pelarut... 3.3.3 Pembuatan Ekstrak pada Berbagai Kondisi Ekstraksi... 3.3.4 Prosedur Analisis Ekstrak... (a) Total Fenol... (b) Total Asam Tertitrasi... (c) Uji Inhibisi Enzim α-amilase Secara In Vitro... 1. Uji Inhibisi Enzim α-amilase Bacillus sp Secara In Vitro... 2.Uji Inhibisi Enzim α-amilase Pankreas Babi Secara In Vitro... (d) Uji Inhibisi enzim α-glukosidase secara In Vitro... (e) Uji Inhibisi enzim lipase secara In Vitro... 3.3.5 Pengaturan pH Simulasi Sistem Pencernaan... 3.3.6 Kinetika Penghambatan Enzim...
4. HASIL DAN PEMBAHASAN... 4.1 Penentuan Rasio Rosella dengan Larutan Pengekstrak (Aquades)...
4.2 Karakterisasi Ekstrak... 4.2.1 Nilai Keasaman (pH)... 4.2.2 Total Asam Tertitrasi... 4.2.3Total Fenol... 4.3 Pengujian Pengaruh pH Sistem Pencernaan Terhadap Daya Inhibisi Enzim... 4.3.1 Inhibisi Enzim α -Amilase Secara In Vitro... a. Inhibisi enzim α-amilase Bacillus sp... b. Inhibisi enzim α-amilase pankreas babi... 4.3.2 Inhibisi Enzim α-Glukosidase secara In Vitro... 4.3.3 Inhibisi Enzim Lipase secara In Vitro... 4.4 Kinetika Inhibisi Enzim α-Amilase Pankreas Babi...
5. KESIMPULAN DAN SARAN... 5.1 Kesimpulan... 5.2 Saran...
34 34 35 37
40 41 41 44 45 47 50
DAFTAR TABEL
1. Enzim-enzim pencernaan utama... 2. Berbagai faktor yang mempengaruhi kecepatan reaksi enzim... 3. Kandungan kimiawi kelopak bunga rosella... 4. Jumlah larutan pada analisis aktivitas inhibisi alfa amilase... 5. Jumlah larutan pada analisis aktivitas inhibisi alfa glukosidase... 6. Jumlah larutan pada analisis aktivitas inhibisi lipase...
DAFTAR GAMBAR
1. Pencernaan dan penyerapan karbohidrat... 2. Pencernaan dan penyerapan lemak... 3. Struktur acarbosa... 4. Reaksi hidrolisis asam lemak... 5. Model umum inhibisi kompetitif... 6. Model umum inhibisi nonkompetitif... 7. Model umum inhibisi unkompetitif... 8. Struktur kimia (-)- asam hidroksi sitrat{(-)-HCA}... 9. Diagram alir penelitian... 10. Nilai total padatan terlarut pada berbagai rasio sampel dan aquades... 11. Nilai pH dan total asam tertitrasi ekstrak rosella... 12. Kadar total fenol ekstrak rosella... 13. Daya inhibisi ekstrak rosella terhadap enzim α-amilase...
14. Daya inhibisi ekstrak rosella terhadap enzim α-glukosidase... 15.Daya inhibisi ekstrak rosella terhadap enzim lipase... 16. Pola kinetika inhibisi ektrak rosella...
DAFTAR LAMPIRAN
1.a Data Kadar Air Kelopak Rosella... 1.b. Data nilai pH ekstrak awal... 2. Uji Anova nilai pH... 3. Data total fenol... 4. Uji Anova total fenol... 5. Data total asam tertitrasi... 6. Uji Anova total asam tertitrasi... 7.a.Data inhibisi ekstrak rosella pH awal terhadap enzim α-amilase
Bacillus sp...
7.b.Data inhibisi ekstrak rosella pH awal terhadap enzim α-amilase
Bacillus sp...
7.c.Data inhibisi acarbosa terhadap kerja enzim α-amilase Bacillus sp...
8. Uji Anova daya inhibisi ekstrak rosella terrhadap enzim α-amilase Bacillus sp...
9. Data inhibisi ekstrak rosella terhadap enzim α-amilase pankreas babi... 10.a.Data inhibisi ekstrak rosella pH awal terhadap enzim α-glukosidase... 10.b.Data inhibisi ekstrak rosella pH awal terhadap enzim α-glukosidase...
10.c.Data inhibisi acarbosa terhadap kerja enzim α-glukosidase...
1. PENDAHULUAN
1.1 Latar Belakang
Perubahan pola hidup yang menjurus ke westernisasi dan sedentary mengakibatkan perubahan pola makan masyarakat yang mengarah pada pola makan tinggi kalori dan tinggi lemak, sehingga berdampak meningkatkan risiko obesitas. Obesitas adalah suatu kondisi dimana lipid tubuh berada dalam jumlah berlebihan yang terjadi akibat ketidakseimbangan masukan energi dan keluaran energi dalam jangka waktu yang lama. Saat ini sekitar 1,6 milyar orang dewasa di seluruh dunia mengalami berat badan berlebih (overweight) dan sekurang-kurangnya 400 juta diantaranya mengalami obesitas. Pada tahun 2015, diperkirakan 2,3 miliar orang dewasa akan mengalami overweight dan 700 juta di antaranya obesitas (WHO. 2003). Menurut RISKESDAS (2008), pada tahun 2007 prevalensi nasional obesitas umum pada penduduk Indonesia berusia > 15 tahun adalah 10,3%. Prevalensi berat badan berlebih pada anak laki-laki usia 6-14 tahun adalah 9,5% dan pada perempuan 6,4%. Angka ini hampir sama dengan estimasi WHO sebesar 10% pada anak usia 5-17 tahun. Menurut WHO (2003), obesitas telah menjadi epidemi global dan menjadi masalah kesehatan yang harus segera diatasi, sebab orang yang mengalami obesitas memiliki resiko tinggi terkena berbagai penyakit kronis seperti penyakit kardiovaskular, hipertensi, diabetes tipe 2, dan kanker.
Pencegahan peningkatan prevalensi obesitas dapat dilakukan dengan mendorong masyarakat mengkonsumsi pangan fungsional yang berfungsi untuk membatasi asupan kalori dengan jalan menghambat kerja enzim pemecah
karbohidrat dan lipid dalam tubuh yang disebut dengan carbohydrate blocker dan lipid blocker.
Carbohydrate blocker adalah substansi yang menurunkan daya cerna atau memperlambat daya cerna pati yang mengakibatkan tingkat penyerapan energi tubuh menjadi lebih rendah (Celeno et al. 2007). Lipid blocker adalah substansi yang mempengaruhi penurunan daya cerna atau memperlambat daya cerna lipid yang mengakibatkan tingkat penyerapan energi tubuh menjadi lebih rendah. Substansi yang dapat menghambat terjadinya pembentukan emulsi lipid dalam tubuh juga dapat disebut sebagai lipid blocker. Substansi yang mampu menurunkan daya cerna karbohidrat dan lipid dalam tubuh diduga dengan cara menghambat kerja enzim α-amilase, α-glukosidase dan lipase. Beberapa hasil penelitian melaporkan kerja enzim α-amilase, α-glukosidase, dan lipase dapat dihambat oleh beberapa ekstrak tanaman, umumnya disebut inhibitor enzim, salah satunya adalah kelopak bunga rosella. Pada penelitian kali ini daya inhibisi ekstrak rosella dilihat pada pH ekstrak awal dan setelah dilakukan simulasi pH sistem pencernaan. Simulasi pH sistem pencernaan bertujuan untuk melihat daya inhibisi ekstrak setelah berada pada sistem pencernaan.
Hansawasdi et al (2000) menyatakan ekstrak metanol rosella kering
mampu menghambat kerja enzim α-amilase sampai 100%. Diduga kemampuan inhibisi ekstrak rosella tersebut karena kandungan asam hibiscus rosella. Sejauh ini kajian terhadap kemampuan inhibisi enzim tersebut hanya menggunakan ekstrak awal, tanpa melihat pengaruhnya setelah ekstrak melalui kondisi pencernaan dan kinetika penghambatannya. Oleh karena itu dalam penelitian ini akan dilihat pula kemampuan inhibisi enzim setelah melalui kondisi pencernaan secara in vitro serta kinetika penghambatannya.
1. 2 Perumusan Masalah
salah satunya adalah dengan memanfaatkan senyawa bioaktif yang terdapat pada berbagai tanaman. Beberapa hasil penelitian melaporkan bahwa senyawa bioaktif pada berbagai tanaman mampu menghambat kerja enzim-enzim pencernaan
seperti α-amilase, α-glukosidase, dan lipase.
Penghambatan kerja enzim pencernaan akan berdampak pada menurunnya absorpsi zat makanan dalam tubuh. Rendahnya absorpsi zat makanan akan mengakibatkan berkurangnya energi yang masuk ke dalam tubuh sehingga diharapkan terjadi keseimbangan energi yang masuk dan energi yang keluar. Adanya keseimbangan energi ini akan mengurangi kelebihan energi yang harus disimpan dalam bentuk triasilgliserida yang akan berdampak pada berkurangnya berat badan.
1.3 Tujuan Penelitian
Penelitian ini bertujuan untuk mengamati pengaruh kondisi ekstraksi dan kondisi pencernaan in vitro terhadap kemampuan inhibisi enzim α-amilase, α -glukosidase, dan lipase dari ekstrak rosella.
1.4 Manfaat Penelitian
Penelitian ini diharapkan dapat memberi informasi bagaimana cara ekstraksi rosella yang dapat berdampak pada inhibisi enzim dan informasi ada atau tidaknya perubahan daya hambat/inhibisi enzim setelah melalui proses pencernaan in vitro.
I.5 Hipotesis
1. Ekstrak rosella memiliki aktivitas penghambatan terhadap enzim
α-amilase, α-glukosidase dan lipase.
2. Kondisi ekstraksi mempengaruhi aktivitas penghambatan enzim.
2. TINJAUAN PUSTAKA
2. 1 Pencernaan dan Penyerapan
Sebelum nutrisi di dalam makanan dapat dimetabolisme oleh tubuh maka makanan tersebut harus dikunyah, dicerna, dan diserap, dimana akan terjadi perubahan dari bentuk makronutrien menjadi mikronutrient dan komponen unit penyusunnya (Berdanier et al. 2006).
Tabel 1. Enzim-enzim pencernaan utama
Sumber Enzim Substrat Fungsi atau Produk Katalitik Kelenjar
Lipase lingual Trigliserida Asam lemak dan 1,2 diasilgliserol
Lambung Pepsin Protein dan
polipeptida Memecah ikatan peptida yang berdekatan dengan asam amino aromatik
Lipase lambung Trigliserida Asam lemak dan gliserol Eksokrin
polipeptida Memecah ikatan peptida di sisi karboksil asam amino aromatik aromatik atau alifatik yang bercabang
Ester kolesteril
hidrolase Ester kolesteril Kolesterol
α-amilase pankreas Pati Sama seperti α-amilase saliva
Ribonuklease RNA Nukleotida
Deoksiribo-nuklease
DNA Nukleotida
Fosfolipase A2 Fosfolipid Asam lemak, fosfolipid
Mukosa usus halus
Enteropeptidase Tripsinogen Tripsin
Aminopeptidase Polipeptida Memecah asam amino terminal dari peptida
Karboksipeptidase Polipeptida Memecah terminal karboksil asam amino dari peptida Endopeptidase Polipeptida Memecah antar gugus residu
di bagian tengah peptida Dipeptidase Dipeptida Dua asam amino
Maltase Maltosa,
maltotriosa,
α- dekstrin
Glukosa
Laktase Laktosa Galaktosa dan glukosa
Sukrase Sukrosa,
nukleat Pentosa, purin, basa pirimidin
Sitoplasma
sel mukosa Berbagai peptidase Di, tri dan tetrapeptida Asam amino Sumber : Ganong et al. 2003
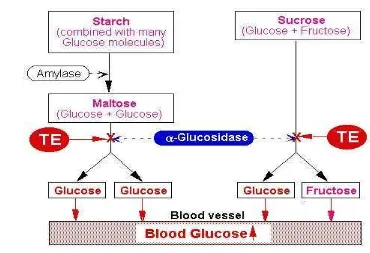
2. 1. 1 Pencernaan dan Penyerapan Karbohidrat
Karbohidrat adalah senyawa yang tersusun atas unsur-unsur C, H dan O. Dalam makanan terdapat 2 kelompok besar karbohidrat yaitu:
1. Karbohidrat yang tersedia (available carbohydrate) termasuk dalam karbohidrat yang dapat dicerna dan diserap sebagai karbohidrat dalam tubuh. Bentuk karbohidrat ini meliputi monosakarida, disakarida, dan oligosakarida dan polisakarida β-glukan.
2. Karbohidrat yang tidak tersedia (unavailable carbohydrate) yaitu karbohidrat yang tidak dapat dihidrolisis sehingga tidak dapat diserap. Bentuk karbohidrat yang termasuk kelompok ini adalah oligosakarida (rafinosa, stakhiosa), selulosa, lignin dan serat (Muchtadi et al. 1993) Karbohidrat mulai dicerna pada mulut secara mekanik dengan pengunyahan dan kimiawi oleh enzim α-amilase saliva yang menghidrolisis karbohidrat kompleks menjadi gula-gula sederhana. Pencernaan lebih lanjut terjadi di usus halus dengan bantuan enzim α-amilase pankreatik, sukrase usus, maltase usus dan laktase usus (Astawan M. 2009). α-amilase pankreatik merupakan enzim yang berperan dalam memotong ikatan α-1,4 glikosida secara acak. Enzim ini akan memotong maltosa menjadi maltosa (90%), maltotriosa, glukosa dan amilopektin menjadi dekstrin, maltosa dan maltotriosa (Balagopalan, 1988).
Pada brush border, yaitu membran mikrovili usus halus, oligosakarida dan disakarida akan dipecah menjadi unit-unit heksosa penyusunnya seperti glukosa, fruktosa dan galaktosa (Murray et al. 1997). Isomaltase atau α-dekstrinase,
terutama berperan dalam hidrolisis ikatan α-1,6, bersama-sama dengan maltase dan sukrase akan memecah maltotriosa dan maltosa. Sukrase akan memecah sukrosa menjadi satu molekul fruktosa dan satu molekul glukosa. Laktase akan menghidrolisis laktosa menjadi glukosa dan galaktosa dan trehalase akan
menghidrolisis trehalosa, suatu dimer ikatan α-1,1 glukosa menjadi 2 molekul glukosa (Ganong et al. 2003).
tertentu dan mengalami proses metabolisme lebih lanjut (Gambar 1). Di dalam hati, monosakarida mengalami proses sintesis menghasilkan glikogen, dioksidasi menjadi CO2 dan H2O atau dilepaskan untuk dibawa oleh aliran darah ke bagian
Gambar 1. Pencernaan dan penyerapan karbohidrat. Sumber: http//:www. google. com
2. 1. 2 Pencernaan dan Penyerapan Lipid (Lemak)
Lipid adalah sekelompok senyawa heterogen, meliputi lemak, minyak, steroid, malam (wax) dan senyawa terkait, yang berkaitan lebih karena sifat fisiknya daripada sifat kimianya. Lipid merupakan senyawa konstituen yang penting dalam makanan karena nilai energi yang dihasilkan tinggi, mengandung vitamin-vitamin larut lemak dan mengandung asam lemak esensial yang terkandung dalam lemak makanan alami (Botham dan Mayes. 2003)
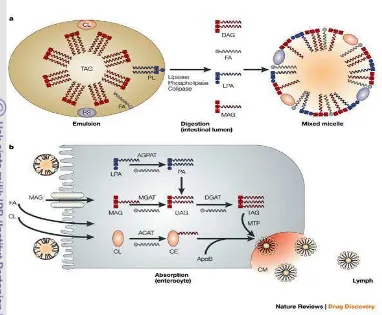
bersatu dengan enzim lipolitik yang bersifat larut dalam air. Misel cenderung membentuk agregat sehingga perlu distabilkan dengan garam empedu dari duodenum. Garam empedu merupakan agen pengemulsi yang kuat dengan 2 sisi (hidrofobik dan hidrofilik). Dalam duodenum droplet-droplet tersebut dilarutkan oleh garam empedu. Trigliserida yang telah teremulsifikasi siap dicerna oleh lipase pankreas menjadi asam lemak dan monogliserida (Astawan M. 2009).
Lipid yang telah dicerna selanjutnya diserap pada membran sel mukosa (Gambar 2). Pada membran sel mukosa misel-misel garam empedu melepaskan diri dan meninggalkan permukaan sel mukosa. Dalam sel mukosa, asam lemak bebas monoasilgliserol disintesis kembali menjadi triasilgliserol yang setelah bergabung dengan albumin, kolesterol, dan lain-lain membentuk kilomikron. Kilomikron akan masuk ke dalam darah, sampai ke hati dan jaringan lain yang memerlukannya. Sebelum masuk ke dalam sel, triasilgliserol dipecah dulu menjadi asam lemak bebas dan gliserol oleh lipoprotein lipase. Asam lemak dapat bersenyawa kembali dengan gliserol membentuk lemak yang kemudian diangkut oleh pembuluh getah bening. Selanjutnya, lemak disimpan di jaringan adiposa (jaringan lemak). Jika dibutuhkan, lemak akan diangkut ke hati dalam bentuk lesitin yang dihidrolisis oleh lipase menjadi asam lemak dan gliserol (Subardi et al. 2008).
Gambar 2. Pencernaan dan penyerapan lemak. Sumber: http//:www. google. com
2.2 Enzim
Pada keseluruhan struktur enzim hanya sebagian kecil yang berfungsi mengadakan interaksi dengan substrat yang disebut sebagai sisi aktif. Sisi aktif pada protein enzim terdiri dari rangkaian beberapa asam amino yang terdapat dalam konfigurasi yang khusus sedemikian rupa, sehingga gugus fungsionalnya dapat berinteraksi dengan substrat secara benar. Asam-asam amino yang lain berperan memberikan bentuk ruang tertentu pada sisi aktif, sehingga hanya substrat dengan konfigurasi yang tepat yang dapat masuk ke dalam sisi aktif tersebut. Reaksi kimia yang terjadi pada gugus fungsional dan substrat meliputi pelepasan dan pengikatan elektron atau atom-atom hidrogen, oksigen, phospat, sulfur, pembentukan dan pergeseran ikatan ganda atau penguraian ikatan kovalen.
Sebelum membentuk produk (P), enzim (E) berikatan dengan substrat (S) pada sisi aktifnya membentuk kompleks ES. Molekul enzim sangat selektif walaupun spesifitasnya beragam (Suhartono. 1989). Faktor-faktor yang mempengaruhi enzim dan aktivitas enzim antara lain:
1. Temperatur atau suhu: umumnya enzim bekerja pada suhu yang optimum. Apabila suhu turun, maka aktivitas akan terhenti tetapi enzim tidak rusak. Sebaliknya, pada suhu tinggi aktivitas menurun dan enzim menjadi rusak.
2. Air : Air berperan dalam memulai kegiatan enzim, contoh pada waktu biji dalam keadaan kering kegiatan enzim tidak kelihatan. Baru setelah ada air, melalui imbibisi mulailah biji berkecambah.
3. pH : Perubahan pH dapat membalikkan kegiatan enzim, yaitu mengubah hasil akhir kembali menjadi substrat.
4. Hasil akhir : Kecepatan reaksi dalam suatu proses kimia tidak selalu konstan. Misal, kegiatan pada awal reaksi tidak sama dengan kegiatan pada pertengahan atau akhir reaksi. Apabila hasil akhir (banyak), maka akan menghambat aktivitas enzim.
6. Zat-zat penghambat : Zat-zat penghambat adalah zat-zat kimia yang menghambat aktivitas kerja enzim. Contoh, garam-garam dari logam berat (Subardi et al. 2008).
2. 2. 1 Enzim α-Amilase dan Inhibitornya
Salah satu enzim yang termasuk dalam hidrolase adalah amilase. Termasuk ke dalam golongan enzim amilase adalah α-amilase, β-amilase, glukoamilase dan pullulanase. α -amilase mempunyai spesifitas memotong ikatan
α-1,4-glikosida pada pati secara acak dan tidak akan memotong cabang yang memiliki ikatan α-1,6 glikosida. Hasil akhir pencernaan α-amilase adalah maltodextrin linear yang pendek, yang dapat berupa glukosa, maltosa, maltotriosa,
maltotetraosa, maltopentosa, maltoheksosa dan α-dekstrin (Nigam & Singh. 1995). Cara kerja α-amilase pada molekul amilosa terjadi
melalui dua tahap: pertama, degradasi yang sangat cepat amilosa menjadi maltosa dan maltotriosa yang terjadi secara acak. Yang kedua pembentukan glukosa dan maltosa dari amilosa sebagai hasil akhir dan caranya tidak secara acak. Kerja α -amilase pada molekul amilopektin akan menghasilkan glukosa, maltosa dan berbagai α-limit dextrin yaitu oligosakarida yang terdiri dari 4 atau lebih residu gula yang semuanya mengandung ikatan α-1,6. Aktifitas α-amilase ditentukan
dengan mengukur hasil degradasi pati atau dari kadar dekstrinnya (Winarno. 1995)
Reaksi enzim α-amilase tidak dihambat oleh ikatan α-1,6 glikosidik walaupun ikatan tersebut tidak dipotong oleh α-amilase. Hampir semua enzim α -amilase termasuk metaloenzim kalsium yaitu mempunyai ion Ca 2+ dalam strukturnya untuk meningkatkan stabilitas enzim (Crueger & Crueger. 1984).
Bhandari et al. 2008; Fred-Jaiyesimi et al. 2008; Thalapaneni et al. 2008; Loizzo et al. 2008; Shobana et al. 2009; Shai et al. 2009; Chethan et al. 2008; Zega Y. 2009; Lee et al. 2010 ). Diduga komponen bioaktif yang mampu menghambat enzim α-amilase adalah: asam hibiscus pada ekstrak rosella dan komponen polifenol seperti asam gallat, asam vanillic, kuercetin dan trans-sinamat pada jewawut (Hansawasdi et al. 2000; Chethan et al. 2008).
Pada umumnya interaksi molekular flavonoid dengan protein terbagi menjadi dua tipe yaitu interaksi Van der Waals, dimana cincin aromatik nonpolar dapat berinteraksi dispersi dengan residu asam amino, dan interaksi elektrostatis. Fenol umumnya berinteraksi dengan protein secara elektrostatik. Ikatan hidrogen merupakan interaksi yang paling penting. Grup OH dapat bertindak sebagai donor hidrogen juga akseptor hidrogen terhadap residu asam amino dan ikatan peptida (Dangles & Dufour. 2005).
Obat yang termasuk dalam golongan inhibitor α-amilase dan α-glukosidase adalah acarbosa (Robyt. 2005). Acarbosa bekerja secara reversibel kompetitif
terhadap enzim hidrolase α-amilase pankreatik dan enzim-enzim pencernaan di usus halus seperti isomaltase, sukrase dan maltase. Acarbosa merupakan serbuk berwarna putih dengan berat molekul 645,6 dan bersifat larut dalam air. Rumus empirik acarbosa adalah C25H43NO18 dan struktur kimianya dapat dilihat pada
Gambar 3 (Slagle. 2002; Bayer. 2004)
2. 2. 2 Enzim α-Glukosidase dan Inhibitornya
Enzim α-glukosidase (EC 3.2.1.20) adalah enzim yang mengkatalisasi pemecahan ikatan α-1,6 glikosida. Enzim ini berfungsi untuk melanjutkan kerja α -amilase, yaitu menghidrolisis lanjut α-limit dextrin menjadi glukosa (Berdanier et al. 2006). Alfa-glukosidase pada pencernaan mamalia berada pada permukaan membran brush border sel usus halus dan merupakan enzim yang mengkatalisis proses akhir pencernaan karbohidrat pada proses pencernaan (Lebovitz. 1997).
Beberapa hasil penelitian melaporkan kerja enzim α-glukosidase mampu dihambat oleh ekstrak tanaman: kayu devil (Alstonia scholaris), Adhatoda vasica Nees., Ecklonia cava, Monarda punctata. kayu secang ( Jong-Anurakkun et al. 2007; Gao et al. 2007; Lee et al. 2010, Diana. 2010). Diduga komponen bioaktif pada ekstrak kayu devil (Alstonia scholaris) yang mampu menghambat kerja enzim α-glukosidase adalah: kuercetin 3-O-β-D-xylopyranosyl (1”-2”)-β -D-galactopiranosid dan (-)-lioniresinol 3-O-β-D-glucopiranosid (Jong-Anurakkun et al. 2007). Mayur et al (2010) menyatakan keseluruhan campuran flavonoid dari ekstrak tanaman Carpesium abrotanoides menunjukkan penghambatan non kompetitif terhadap kerja enzim α-glukosidase yang berasal dari kapang.
Acarbosa diketahui sebagai produk fermentasi dari beberapa spesies Actinoplanes. Acarbosa efektif menghambat beberapa enzim pemecah karbohidrat yaitu : α-glucosidase (Schmidt et al. 1982 diacu dalam Robyt 2005), glukoamilase (Aleshin et al. 1994 diacu dalam Robyt 2005), siklomaltodextrin glukaniltransferase (CGTase) (Strokopytov et al. 1995 diacu dalam Robyt. 2005),
2. 2. 3 Enzim Lipase dan Inhibitornya
Lipase ( Triasilgliserol asilhidolase, EC 3.2.1.20) adalah enzim yang dapat larut dalam air dan bekerja dengan mengkatalisis hidrolisis ikatan ester dalam substrat lipid yang tidak larut dalam air seperti trigliserida berantai panjang(Winarno. 1995). Lipase berfungsi mengkatalisis trigliserida menjadi gliserol dan asam lemak seperti pada Gambar. 4
Kerja enzim lipase dapat dihambat oleh ekstrak: monarda punctata, blueberry, lingonberry, cloudberry, strawberry dan raspberry, actinidia arguta, flavangenol (McDougall et al. 2008; Jang et al. 2008; Shimada et al. 2009; Yamada et al. 2010). McDougall et al (2008) menyatakan komponen bioaktif pada tanaman berri yang mampu menghambat kerja enzim lipase diduga tanin beserta turunannya seperti ellagitannin, proantosianidin. Ikatan hidrogen antara grup karbon dari ikatan peptida protein dan grup hidroksil dari golongan fenol yang termasuk dalam tanin, yang diketahui sebagai interaksi hidrofobik, merupakan mekanisme utama dalam interaksi kompleks tanin-protein (Haslan. 1974)
Gambar 4. Reaksi hidrolisis asam lemak
Sumber : http://www. biologypedia.wordpress.com
2.3 Kinetika Inhibisi Enzim
enzim dicapai pada tingkat konsentrasi substrat yang sudah mampu mengubah seluruh enzim menjadi kompleks ES. Pada konsentrasi substrat dibawah konsentrasi tersebut reaksi enzim bergantung pada konsentrasi substrat yang ditambahkan, sedangkan pada konsentrasi substrat diatas konsentrasi tersebut, kecepatan reaksi tidak tergantung pada konsentrasi substrat. Dengan kata lain, reaksinya menjadi bersifat ordo ke nol. Pada Tabel 2, dapat dilihat beberapa faktor yang mempengaruhi kecepatan reaksi dan informasi yang dapat diperoleh dengan mengubah-ubah faktor tersebut.
Tabel 2. Berbagai faktor yang mempengaruhi kecepatan reaksi enzim Faktor yang mempengaruhi Keterangan yang dapat Diperoleh
Jenis Faktor
Konsentrasi Konsentrasi enzim, Substrat, Produk inhibitor, Aktivator
Mekanisme reaksi, Parameter kinetika (Km, V, Ki) perubahannya yang penting dalam pengikatan substrat
Jenis ikatan dan muatan protein enzim
Faktor dalam Struktur substrat dan produk
enzim, sedangkan inhibitor berikatan dengan enzim dan menyebabkan penurunan kecepatan reaksi enzim. Umumnya inhibitor menghambat kerja enzim dengan tiga jenis penghambatan, yakni penghambatan kompetitif, non kompetitif dan unkompetitif (Suhartono. 1989).
2. 3.1 Penghambatan Kompetitif
Suatu bahan yang berkompetisi secara langsung dengan suatu substrat normal untuk suatu daerah (site) ikatan enzim dikenal dengan suatu inhibitor kompetitif. Inhibitor seperti ini biasanya menyerupai substrat dimana secara spesifik mengikat daerah aktif enzim. Reaksi akan terjadi dan produk akan dihasilkan, walaupun enzim bereaksi dengan inhibitor. Produk yang dihasilkan dari inhibitor akan berbeda jenisnya dengan produk yang dihasilkan oleh substrat (Voet&Voet. 2001).
Pada penghambatan kompetitif inhibitor menyebabkan berubahnya harga KM (menjadi lebih besar dari KM semula), tanpa mengubah tingkat kecepatan
maksimum Vmaks enzim. Jadi, enzim masih mampu mencapai kecepatan
maksimum normalnya, walaupun dalam jangka waktu yang lebih lama, jika pada lingkungan tersebut terdapat senyawa inhibitor. Akan tetapi, adanya inhibitor menyebabkan enzim membutuhkan konsentrasi substrat yang lebih besar, untuk mencapai harga Vmaks-nya. Penghambatan oleh inhibitor kompetitif dapat diatasi
atau dikurangi dengan menambahkan konsentrasi substrat yang memperbesar peluang bagi substrat untuk berikatan dengan sisi aktif pada enzim (Suhartono. 1989). Model umum untuk inhibisi kompetitif diberikan pada Gambar 5. di bawah ini :
2. 3. 2 Penghambatan Nonkompetitif
Pada jenis inhibisi non-kompetitif antara substrat dan inhibitor tidak memiliki kesamaan struktur. Efek penghambatan akan terjadi karena inhibitor berikatan dengan sisi allosterik enzim, dan akan mengubah sisi aktifnya. Akibat dari jenis inhibisi ini adalah terjadinya penurunan Vmaks tanpa mengubah nilai KM
-nya. Pada inhibisi non-kompetitif, inhibitor dapat membentuk ikatan dengan enzim dalam keadaan bebas, disamping dapat membentuk ikatan dengan komplek substrat (Gambar 6). Ikatan inhibitor terhadap enzim bebas dan substrat dapat menyebabkan terbentuknya kompleks inhibitor atau enzim-substrat-inhibitor yang bersifat tidak produktif karena tidak dapat membentuk produk. Produk hanya akan terbentuk jika ikatan inhibitor lepas dari kompleks enzim-substrat-inhibitor. Reaksi sampingan yang sangat merugikan akibat pengaruh inhibitor pada jenis penghambatan ini adalah besarnya peluang sisi aktif enzim untuk berubah secara permanen dari keadaan alami jika kompleks enzim-inhibitor memiliki ikatan yang sangat kuat. Hal ini akan menyebabkan enzim kehilangan reaktifitasnya secara permanen (Voet&Voet. 2001).
2. 3. 3 Penghambatan Unkompetitif
Suatu penghambatan jenis unkompetitif merupakan senyawa yang berikatan secara reversibel pada molekul kompleks enzim substrat, membentuk kompleks Enzim Substrat Inhibitor (ESI) yang bersifat inaktif sehingga tidak dapat menghasilkan produk. Inhibitor tidak berikatan dengan molekul enzim bebas (E) (Suhartono. 1989). Umumnya, inhibisi unkompetitif terjadi akibat adanya akumulasi produk dari reaksi enzim itu sendiri dan sangat jarang dijumpai pada reaksi enzim yang melibatkan hanya satu substrat dan satu produk. Pola kinetika yang terbentuk akibat adanya inhibitor pada jenis inhibisi unkompetitif ini adalah terjadinya penurunan nilai KM dan Vmaks dari keadaan normalnya (Voet &Voet.
2001). Model umum untuk inhibisi unkompetitif diberikan pada Gambar 7 di bawah ini :
Gambar 7. Model umum inhibisi unkompetitif
2. 4Rosella
Rosella berkhasiat diuretik (melancarkan air seni), antiseptik, menurunkan panas, meluruhkan dahak, antiradang, antihipertensi, antibakteri dan memperlancar buang air besar (menstimulasi gerak peristaltik usus). Kelopak bunga rosella dapat mengatasi panas dalam, sariawan, kolesterol tinggi, gangguan jantung, sembelit, mengurangi resiko osteoporosis dan mencegah kanker darah. Senyawa asam amino yang terdapat pada bunga rosella yaitu arginin yang berperan dalam proses peremajaan sel tubuh. Sebagai obat tradisional bunga rosella berkhasiat sebagai antiseptik, aprodisiak, diuretik, dan lain-lain (Rostinawati. 2009). Secara umum, komposisi kimia kelopak bunga rosella basah dapat dilihat pada Tabel 3.
Tabel 3. Kandungan kimiawi kelopak bunga rosella
100 g rosella basah 100g rosella kering
Kalori 44 kal b) -
Air 86,20g b) 4-10 g d,f)
Protein 16 g b) 5,4-9.45 g a)
Lemak 0,1 g b) -
Karbohidrat 11, 1 g b) 16 g e)
Serat 2, 5 g b) 11,7 g c)
Abu 1, 0 g b) 7-11 g a)
Kalsium 160 mg b) 486 mg e)
Fosfor 60 mg b) 0,36 g c)
Besi 3, 8 g b) -
Beta-karoten 285 mg b) -
Asam askorbat 14 mg b) 21-89,4 mg a)
Tiamin 0, 4 mg b) -
Riboflavin 0,5 mg b) -
Niacin 14 mg b) -
Sumber: a) Ibrahium et al (1971); b) Duke (2008); c) Kijparkon et al (2009);
d) Wikipedia (2011); e) Obtrando (2011); f) Winarti et al (2011)
Keterangan : ( - ) : data belum tersedia
tumbuhan. Pigmen ini memberikan warna pada bunga, buah, dan daun. Antosianin merupakan sub-tipe senyawa organik dari keluarga flavonoid, dan merupakan anggota kelompok senyawa yang lebih besar yaitu polifenol (Kevin et al. 2008). Selain kandungan antosianin yang tinggi, komponen bioaktif rosella antara lain terdiri dari anisaldehida, asam sitrat, β-sitosterol, senyawa flavonoid seperti quercetin dan tanin, levo asam askorbat, beta karoten, protocaterchuic acid delphinidin, galaktosa, glossypentin, hibiscetin, mukopolisakarida, pectin, asam stearat, dan lilin (wax) (Tseng et al. 1997; Tsai et al. 2001; Bokura et al. 2003; Prenesti et al. 2005; Hirunpanich et al. 2005; Qi et al. 2005; Christian et al. 2006; Lin et al. 2007; Agoreyo et al. 2008; Kao et al. 2009; Khosravi et al. 2009; Khosravi2 et al. 2009).
Hansawasdi et al (2000) menyatakan asam hibiscus pada ekstrak rosella menghambat pemecahan pati dengan cara menghambat kerja enzim α-amilase. Griebel (1939) dan Bachtez (1948) menyatakan kadar asam hibiscus (HCA) pada rosella adalah 13,6-15.3%. Asam hibiscus (Gambar 8) yang terdapat dalam ekstrak rosella dapat menghambat produksi lemak dari karbohidrat pada percobaan yang dilakukan terhadap tikus (Tee et al. 2002). Ekstrak kelopak bunga rosella mengandung asam hibiscus, atau asam (+)-hydroxycitric {(+)-HCA}. Isomernya yaitu asam (-)-hydroxycitric {(-)-HCA}, merupakan bahan aktif utama yang terdapat pada buah Garcinia indica dan Garcinia cambogia, yang merupakan suatu inhibitor dari citrate lyase. Oleh karena itu, (-)-HCA tersebut diusulkan sebagai suatu agen antiobesitas. Asam hibiscus atau (+)-HCA mengalami proses racemization dengan bantuan enzim yang dikeluarkan flora normal usus untuk berubah menjadi (-)-HCA (Carvajal-Zarrabal et al. 2005).
3. METODOLOGI PENELITIAN
3.1 Tempat dan Waktu
Penelitian ini dilaksanakan pada bulan Februari sampai Juli 2011 di Laboratorium Biokimia Pangan dan Kimia Pangan Departemen Ilmu Teknologi Pangan, Institut Pertanian Bogor.
3. 2 Bahan dan Alat Bahan
Sampel yang digunakan dalam penelitian ini adalah bunga rosella segar berumur 3 minggu dari daerah Darmaga. Bahan-bahan kimia yang digunakan adalah lipase pankreas babi tipe II (Sigma L3126), enzim α-glukosidase dari Saccharomyces cerevisiae (Sigma G-5003), α-amilase dari Bacillus sp (Tipe II A) (Sigma A-6380), α-amilase dari pankreas babi (Sigma A-3176) , p-nitrofenil laurat (pNP laurat) (Sigma 61716), p-nitrofenil-α-D-glukofiranosa (Sigma N- 1377), pati kentang terlarut (Merck), acarbosa (Glucobay), bufer Tris, asam 3.5- dinitrosalisilat (DNS), sodium asetat, bufer fosfat, natrium karbonat, NaH2PO4,
NaCl, CaCl2, NaOH, Na-K-tartarat, bromtimolblue, pereaksi folin, metanol 95%,
aquades.
Alat
Alat-alat yang digunakan dalam penelitian ini antara lain gelas piala, gelas ukur, labu takar, tabung reaksi, pipet volumetrik, pipet tetes, mikropipet, bulb, neraca analitik, refraktometer, sentrifus, spektrofotometer UV-vis, penangas air,penangas air bergoyang, vortex dan hot plate.
3. 3 Metode Penelitian
Tahap awal penelitian ini dilakukan untuk mendapatkan hasil ekstraksi rosella optimum berdasarkan nilai total padatan terlarut yang diperoleh. Selanjutnya hasil ekstraksi dengan total padatan tertinggi tertinggi digunakan
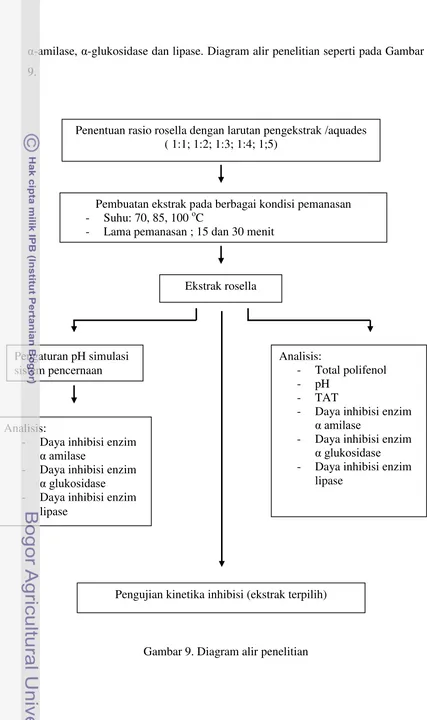
α-amilase, α-glukosidase dan lipase. Diagram alir penelitian seperti pada Gambar 9.
Gambar 9. Diagram alir penelitian
Penentuan rasio rosella dengan larutan pengekstrak /aquades ( 1:1; 1:2; 1:3; 1:4; 1;5)
Pembuatan ekstrak pada berbagai kondisi pemanasan - Suhu: 70, 85, 100 oC
- Lama pemanasan ; 15 dan 30 menit
Ekstrak rosella
Pengaturan pH simulasi sistem pencernaan
Analisis:
- Total polifenol - pH
- TAT
- Daya inhibisi enzim
α amilase
- Daya inhibisi enzim
α glukosidase
- Daya inhibisi enzim lipase
Analisis:
- Daya inhibisi enzim
α amilase
- Daya inhibisi enzim
α glukosidase
- Daya inhibisi enzim lipase
3.3.1 Penentuan Kadar Air dengan Metode Oven (Apriyantono et al. 1989)
Prinsip metode ini adalah sampel dikeringkan dalam oven 100- 102 o C sampai diperoleh berat yang tetap.
Cawan dikeringkan dalam oven, didinginkan dalam desikator dan ditimbang. Sampel dimasukkan dalam cawan dan dioven selama 6 jam pada suhu 100- 102 o C. Didinginkan dalam desikator dan ditimbang sampai berat tetap.
Perhitungan
Kadar air (%) = Kehilangan berat (g) x 100 (wet basis) Sampel sebelum kering (g)
3.3.2 Penentuan Rasio Pelarut
Ekstraksi pada berbagai rasio dilakukan untuk menentukan ekstrak yang memiliki nilai total padatan terlarut tertinggi untuk digunakan pada tahap selanjutnya. Bunga rosella seberat 50 gram ditambah aquades dengan perbandingan 1:1; 1:2; 1:3; 1:4 dan 1:5 kemudian dihancurkan menggunakan blender selama 3 - 4 menit. Hancuran sampel diekstraksi pada suhu 70o C selama 15 menit pada penangas air bergoyang. Hasil ekstraksi kemudian disaring menggunakan delapan lapis kain saring sampai ekstrak tidak mengandung padatan yang terlihat. Penyaringan dilakukan secara manual, diperas menggunakan tangan, dan dihentikan apabila busa mulai keluar. Ekstrak diukur total padatan terlarutnya menggunakan refraktometer.
3.3.3 Pembuatan Ekstrak pada Berbagai Kondisi Ekstraksi
tertitrasi (TAT), total fenol, daya inhibisi enzim α-amilase, α-glukosidase dan lipase.
3.3.4 Prosedur Analisis Ekstrak
(a) Total fenol (Strycharz dan Shetty. 2002)
Larutan standar asam galat dibuat dengan berbagai konsentrasi yaitu 50, 100, 150, 200 dan 250 ppm. Larutan standar atau sampel sebanyak 0,5 ml dilarutkan dalam 2,5 ml aquades, 0,5 ml etanol 95%, 2,5 ml folin ciocalteau 50% kemudian divortex. Setelah itu larutan didiamkan selama 5 menit dalam ruang gelap kemudian ditambahkan 0,5 ml Na2CO3 5%dan divortex kembali. Larutan
didiamkan dalam ruang gelap selama 1 jam, berikutnya larutan diukur absorbansinya pada λ 725 nm.
(b) Total asam tertitrasi (Fardiaz. 1989 )
Sampel 10 gram dimasukkan ke dalam labu takar 100 ml dan diencerkan sampai tanda tera dengan air destilasi. Sampel yang sudah diencerkan sebanyak 10 ml dipindahkan kedalam erlenmeyer dan ditambahkan 2 tetes bromtimol blue. Titrasi dilakukan dengan menggunakan larutan NaOH 0,08 N sampai timbul warna biru.
Total asam tertitrasi = ml 0,1 NaOH x N NaOH x Faktor Pengenceran x 100% gram ekstrak
(c) Uji inhibisi enzim α-amilase
Uji inhibisi α-amilase dilakukan mengggunakan dua sumber enzim yang berbeda yaitu dari Bacillus sp dan pankreas babi. Uji inhibisi terhadap enzim α -amilase pankreas babi hanya dilakukan pada ekstrak yang mempunyai daya hambat paling tinggi karena hanya digunakan sebagai pembanding saja.
- Uji inhibisi enzim α-amilase Bacillus sp secara in vitro ( Cengiz et al. 2010)
Persiapan reagen:
yang berisi sodium klorida 6,7mM. Pereaksi DNS dibuat dengan mencampurkan 20 ml larutan Na-K-tartarat, 50 ml DNS dan aquades hingga diperoleh volume akhir 100 ml. Larutan tartarat diperoleh dengan melarutkan 30 g Na-K-tartarat dalam 20 ml NaOH 2M diatas plat pemanas (jangan sampai mendidih). Larutan DNS diperoleh dengan melarutkan 1094,88 mg asam 3,5 dinitrosalisilat dalam 50 ml air suling pada suhu 45-50o C. Kontrol positif yang digunakan pada penelitian ini adalah acarbosa 0,5 mg/ml yang diperoleh dari pelarutan 1 tablet glukobay (50 mg acarbosa) dalam 100 ml HCl 2 N.
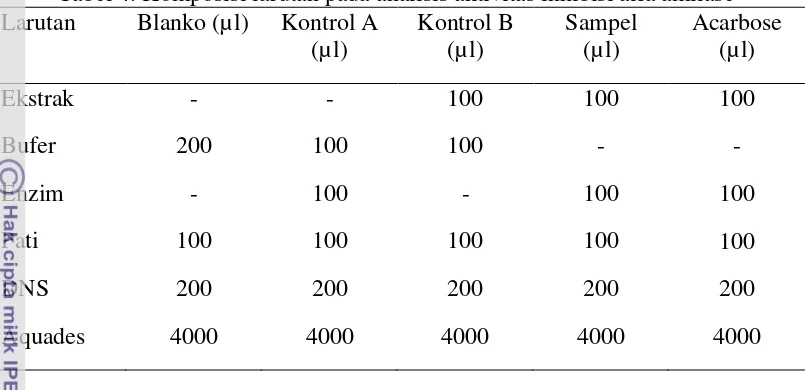
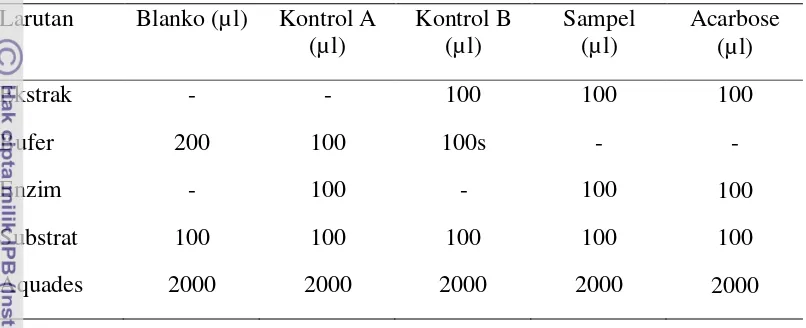
Prosedur Analisis:
Tabel 4. Komposisi larutan pada analisis aktivitas inhibisi alfa amilase Larutan Blanko (µl) Kontrol A
(µl)
Kontrol B (µl)
Sampel (µl)
Acarbose (µl)
Ekstrak - - 100 100 100
Bufer 200 100 100 - -
Enzim - 100 - 100 100
Pati 100 100 100 100 100
DNS 200 200 200 200 200
Aquades 4000 4000 4000 4000 4000
Aktivitas inhibisi sampel dihitung menggunakan rumus sebagai berikut:
Keterangan : A1 = Absorbansi kontrol A – Absorbansi blanko A2 = Absorbansi sampel – Absorbansi kontrol B
- Uji inhibisi enzim α-amilase pankreas babi secara in vitro (Thalapaneni-
et al. 2008)
Persiapan reagen:
aquades dingin. Pereaksi DNS dibuat seperti pada uji inhibisi enzim α-amilase Bacillus sp.
Prosedur Analisis:
Uji inhibisi α-amilase pankreas babi sama dengan uji inhibisi terhadap
α-amilase Bacillus sp.
(d) Uji Inhibisi enzim α-glukosidase secara in vitro (Mayur et al. 2010 dengan modifikasi)
Persiapan reagen:
Uji inhibisi enzim α-glukosidase (Saccharomyces cerevisiae tipe I) secara in vitro dilakukan dengan menggunakan model penghambatan pemecahan substrat p-nitrofenil-α-D-glukofiranosa menjadi p-nitrofenil (berwarna kuning) dan glukosa oleh enzim α-glukosidase. Aktivitas inhibisi enzim diukur berdasarkan warna hasil reaksi menggunakan spektrofotometer pada λ 410nm.
Enzim α-glukosidase berasal dari Saccharomyces cerevisiae tipe I dengan aktivitas 0,2 unit/ml. Aktivitas inhibisi enzim α-glukosidase dideteksi dengan menggunakan substrat p-nitrofenil-α-D-glukofiranosa 0,5mM. Bufer yang digunakan adalah bufer kalium fosfat 0,1 M dengan pH 7,0. Kontrol positif yang digunakan pada penelitian ini adalah acarbosa 0,5 mg/ml yang diperoleh dari pelarutan 1 tablet glukobay (50 mg acarbosa) dalam 100 ml HCl 2 N.
Prosedur Analisis:
Campuran reaksi terdiri dari blanko, kontrol A, kontrol B, dan sampel. Tabel 5 menunjukkan kombinasi jumlah ekstrak, bufer fosfat, dan enzim yang diberikan pada blanko, kontrol A, kontrol B, sampel serta acarbose sebagai kontrol positif. Keterangan blanko, kontrol A, kontrol B, sampel sama dengan uji
Setelah itu aquades ditambahkan dan diukur absorbansinya pada spektrofotometer
λ 410nm.
Tabel 5. Komposisi larutan pada analisis aktivitas inhibisi alfa glukosidase Larutan Blanko (µl) Kontrol A
(µl) Kontrol B (µl) Sampel (µl) Acarbose (µl)
Ekstrak - - 100 100 100
Bufer 200 100 100s - -
Enzim - 100 - 100 100
Substrat 100 100 100 100 100
Aquades 2000 2000 2000 2000 2000
Aktivitas inhibisi sampel dihitung menggunakan rumus sebagai berikut:
Keterangan : A1 = Absorbansi kontrol A – Absorbansi blanko A2 = Absorbansi sampel – Absorbansi kontrol B
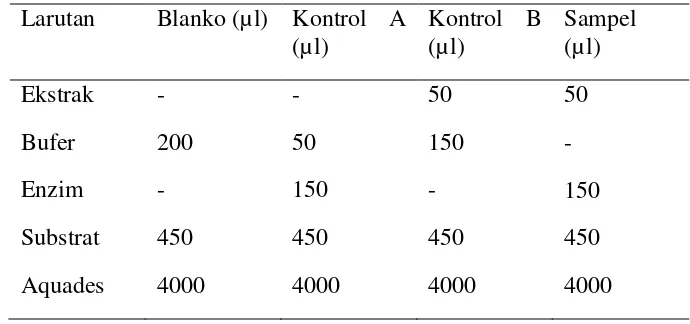
(e) Uji Inhibisi enzim lipase secara in vitro (Mc Dougall GJ et al. 2008)
Persiapan reagen:
Lipase pankreas babi tipe II (Sigma L3126) dilarutkan dalam aquades (10mg/ml). Untuk penentuan aktivitas secara in vitro digunakan Tris bufer pH 8,2 100 mM dan p-nitrofenil laurat (pNP laurat) digunakan sebagai substratnya. Stok substrat 0,08% berat/volume pNP laurat dilarutkan dalam 5mM sodium asetat (pH 5,0) yang mengandung 1% triton X-100 kemudian dipanaskan pada air mendidih selama 1 menit agar didapatkan larutan yang sempurna kemudian didinginkan pada suhu ruang.
Prosedur Analisis:
kontrol A, kontrol B, sampel sama dengan uji inhibisi α-amilase. Masing-masing campuran reaksi diinkubasi pada 37o C selama 2 jam. Reaksi enzim dihentikan dengan memasukkan campuran reaksi ke dalam penangas air suhu 100o C selama 5 menit. Selanjutnya aquades ditambahkan pada campuran reaksi. Campuran reaksi kemudian disentrifugasi pada 4000 rpm selama 15 menit dan dibaca menggunakan spektrofotometer pada λ 410 nm.
Tabel 6. Komposisi larutan pada analisis aktivitas inhibisi lipase Larutan Blanko (µl) Kontrol A
(µl) Kontrol B (µl) Sampel (µl)
Ekstrak - - 50 50
Bufer 200 50 150 -
Enzim - 150 - 150
Substrat 450 450 450 450
Aquades 4000 4000 4000 4000
Aktivitas inhibisi sampel dihitung menggunakan rumus sebagai berikut:
Keterangan : A1 = Absorbansi kontrol A – Absorbansi blanko A2 = Absorbansi sampel – Absorbansi kontrol B
3.3.5 Pengaturan pH Simulasi Sistem Pencernaan
Sebagian ekstrak diatur pHnya menyerupai sistem pencernaan tubuh yaitu lambung dan usus halus. Mula-mula pH ekstrak diatur menjadi pH 2,0 menggunakan HCl, lalu didiamkan selama 30 menit, kemudian pH dinaikkan ke
3.3.6 Kinetika Penghambatan Enzim
Prosedur uji kinetika inhibisi mirip dengan penentuan daya inhibisi, namun pada uji kinetika, konsentrasi substrat divariasikan (1%; 1,25%; 1,5%; 1,75%; 2,0%; 2,25%; 2,5%). Sebelum uji ini dilakukan perlu diketahui dahulu pada konsentrasi berapa ekstrak rosella memberikan hambatan maksimumnya. Untuk itu sederetan konsentrasi ekstrak (25%; 50%; 75%; 100%) akan diujikan. Ekstrak dengan konsentrasi terbaik kemudian dijadikan kandidat bagi pelaksanaan uji kinetika inhibisi.
4. HASIL DAN PEMBAHASAN
4.1 Penentuan Rasio Rosella dengan Larutan Pengekstrak (Aquades)
Ekstraksi adalah proses pemisahan satu atau lebih komponen dari suatu campuran homogen menggunakan pelarut cair (solvent) sebagai agen pemisah. Salah satu tujuan ekstraksi pada tanaman obat adalah untuk memperoleh komponen bioaktif yang berkhasiat sebagai pangan fungsional. Komponen bioaktif dari suatu bahan pangan memegang peranan penting dalam memberikan efek kesehatan. Komponen aktif yang terdapat pada bahan tanaman dikenal dengan istilah fitokimia. Pengertian fitokimia adalah suatu bahan dari tanaman (phytos = tanaman), yang dapat memberikan fungsi-fungsi fisiologis untuk pencegahan penyakit. Bahan yang dimaksud adalah senyawa kimia berupa komponen bioaktif yang dapat digunakan untuk pencegahan atau pengobatan penyakit (Ardiansyah. 2006). Menurut Hansawasdi et al (2000), Jong-Anurakkun et al (2007), Chethan et al (2008) dan McDougall et al (2008) komponen bioaktif yang berperan sebagai inhibitor enzim α-amilase, α-glukosidase dan lipase termasuk dalam golongan polifenol dan asam hibiscus yang mudah larut dalam air. Menurut Suradikusuma (1989), senyawa fenol yang berikatan dengan protein maupun gula glikosida cenderung mudah larut pada pelarut aquades dibandingkan dengan senyawa yang lain.
Air merupakan pelarut polar yang mampu melarutkan zat kimia tertentu,zat terlarut (solute), yang bersifat polar. Senyawa polar memiliki momen dipol, sehingga selalu punya muatan, antar sesama senyawa polar akan saling larut karena muatan-muatan didalamnya akan saling berikatan. Senyawa non polar akan lebih sulit larut dalam air yang bersifat polar karena tidak mempunyai momen dipol, sehingga tidak memiliki muatan untuk berikatan dengan senyawa polar (Bloch. 2006). Perbandingan antara sampel dan pelarut yang tepat akan menghasilkan ekstrak dengan total padatan terlarut tertinggi yang diharapkan dapat sebagai sumber senyawa bioaktif yang optimum.
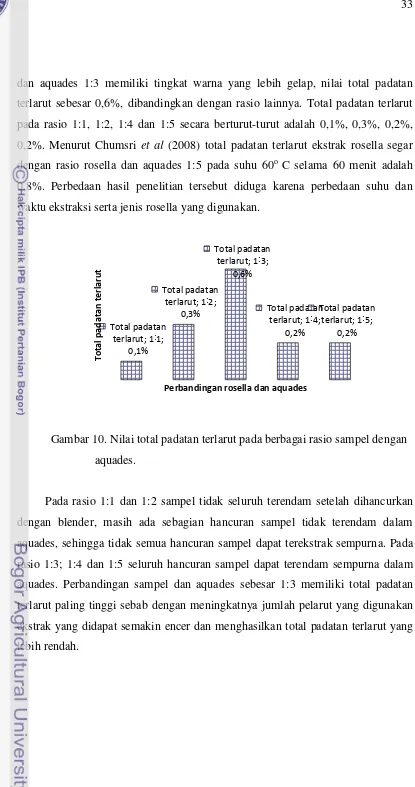
dan aquades 1:3 memiliki tingkat warna yang lebih gelap, nilai total padatan terlarut sebesar 0,6%, dibandingkan dengan rasio lainnya. Total padatan terlarut pada rasio 1:1, 1:2, 1:4 dan 1:5 secara berturut-turut adalah 0,1%, 0,3%, 0,2%, 0,2%. Menurut Chumsri et al (2008) total padatan terlarut ekstrak rosella segar dengan rasio rosella dan aquades 1:5 pada suhu 60o C selama 60 menit adalah 0,8%. Perbedaan hasil penelitian tersebut diduga karena perbedaan suhu dan waktu ekstraksi serta jenis rosella yang digunakan.
Gambar 10. Nilai total padatan terlarut pada berbagai rasio sampel dengan aquades.
4.2 Karakterisasi Ekstrak
Proses ekstraksi dilakukan pada penangas air bergoyang dengan 3 variasi suhu 70o C, 85o C, 100o C dan 2 variasi waktu 15 dan 30 menit. Ekstrak yang telah dihasilkan kemudian ditepatkan kembali pada volume 230 ml (setiap 1ml ekstrak mengandung 0,21 gram kelopak rosella basah) dan diukur pH masing-masing ekstrak setelah ditepatkan. Berdasarkan hasil penelitian diketahui bahwa semakin tinggi dan lama waktu ekstraksi maka volume ekstrak semakin tinggi. Diduga pada suhu yang semakin tinggi kemampuan sampel menahan air dan komponen- komponen larut air semakin rendah sehingga semakin banyak komponen larut air yang terbebaskan dan bercampur dengan aquades. Hal tersebut menyebabkan volume ekstrak akhir sama atau lebih besar dari volume awal. Peningkatan suhu akan menurunkan kemampuan bahan pangan menahan air yang mungkin disebabkan oleh perubahan-perubahan akibat pemanasan yang tidak dapat kembali (Purnomo. 1995). Menurut Duke (2008) rosella segar memiliki kadar air sebesar 80%.
Karakterisasi ekstrak dilakukan dengan melihat pH, total fenol dan total asam tertitrasi. Analisis pH, total fenol dan total asam tertitrasi dilakukan untuk mengetahui karakter dari ekstrak yang digunakan dalam analisis inhibisi enzim, sehingga dapat diamati hubungan antara karakter ekstrak dengan kemampuan farmakologi ekstrak.
4. 2. 1 Nilai Keasaman (pH)
Skala pH bersifat logaritmik, yang berarti perbedaan 1 unit pH dari 2 buah larutan menunjukkan bahwa larutan yang satu mempunyai konsentrasi H+ 10 kali konsentrasi H+ pada larutan yang lain. Istilah pH ditentukan oleh persamaan berikut :
pH = log 1 = - log [H+] [H+]
Perlakuan suhu dan lama pemanasan pada saat ekstraksi tidak berpengaruh pada pH ekstrak. Nilai keasaman (pH) awal ekstrak rosella relatif seragam yaitu antara 2,78-2,86 (Gambar 11, Lampiran 1), sedangkan pH minuman rosella komersial pada umumnya antara pH 3-4. Rosella mengandung asam-asam organik seperti asam sitrat, asam askorbat dan asam hibiscus yang akan menyebabkan ekstrak rosella menjadi bersifat asam. Hart et al (2003) menyatakan total asam pada sampel akan berkorelasi dengan nilai pH sampel. Pada umumnya semakin tinggi asam pada sampel maka nilai pH akan semakin rendah, akan tetapi hal tersebut tidak berlaku pada beberapa kondisi. Hasil uji analisis sidik ragam menunjukkan nilai pH tidak berbeda pada berbagai kondisi ekstraksi (Lampiran 2).
Gambar 11. Nilai pH dan total asam tertitrasi ekstrak rosella
4. 2. 2 Total Asam Tertitrasi
Total asam tertitrasi adalah penentuan total asam yang terdapat pada sampel. pH merupakan kekuatan asam pada sampel, sedangkan total asam tertitrasi adalah jumlah asam yang terdapat pada sampel (Hart et al. 2003). Penentuan total asam tertitrasi dapat dilakukan menggunakan titrasi asam basa. Prinsip titrasi asam basa melibatkan reaksi antara asam dengan basa, sehingga akan terjadi perubahan pH larutan yang dititrasi. Dalam prosedur ini sejumlah volume tertentu dari asam
dititrasi oleh larutan basa, biasanya sodium hidroksida (NaOH) yang mempunyai konsentrasi yang diketahui dengan tepat. NaOH ditambahkan perlahan-lahan sampai titik netralisasi asam tercapai (pH 7). Dengan mengetahui volume dan konsentrasi NaOH yang ditambahkan, konsentrasi asam di dalam larutan dapat dihitung. Pemetaan pH larutan terhadap jumlah NaOH yang ditambahkan sampai titik netralisasi disebut kurva titrasi (Lehninger. 1994).
Data hasil penelitian nilai total asam tertitrasi menunjukkan perlakuan ekstraksi menghasilkan TAT yang berbeda pada ekstrak rosella, sedangkan pH tidak. Hal tersebut diduga karena jenis asam yang terekstrak berbeda pada berbagai kondisi ekstraksi, sehingga total asam tertitrasi tidak berkorelasi negatif terhadap pH ekstrak. Al-Shoosh (1997) menyatakan jenis asam organik pada rosella terdiri atas asam hibiscus ((-)-Hydroxycitricacid/ HCA), asam malat, asam askorbat, asam sitrat dan asam oksalat. Data hasil penelitian nilai total asam tertitrasi ekstrak rosella terlampir pada Lampiran 5.
Kandungan total asam tertitrasi pada kondisi ekstraksi 100o C 30 menit lebih tinggi daripada pada kondisi ekstraksi 100o C 15 menit. Hal tersebut sesuai dengan penelitian Permawati (2008) yang menyatakan semakin lama waktu ekstraksi pada simpilisia gandarusa maka zat kimia yang terekstrak semakin banyak. Total asam tertitrasi yang dihasilkan pada kondisi ekstraksi 100o C 30- menit menghasilkan total asam tertitrasi paling tinggi dibandingkan dengan kondisi ekstraksi lainnya. Diduga pada suhu yang lebih tinggi asam-asam organik yang bersifat tahan panas semakin banyak yang terekstrak. Beberapa asam organik yang bersifat tahan panas antara lain asam hibiscus (HCA), asam sitrat, asam malat dan asam oksalat. Asam-asam tersebut akan terurai jika dipanaskan pada suhu diatas 100o C. Secara berturut-turut titik didih HCA, asam sitrat, asam malat dan asam oksalat adalah 182o C, 175o C, 135o C dan 100o C ( Jena et al. 2002; Wikipedia. 2011).
4. 2. 3 Total Fenol
Karakter dari komponen fenolik adalah memiliki cincin aromatik dengan satu atau lebih yang berikatan dengan gugus hidroksil. Terdapat lebih dari 8000 struktur fenolik tersebar pada kingdom tanaman yang telah dilaporkan (Strack. 1997). Bentuk komponen fenolik tersebar mulai dari bentuk paling sederhana, bentuk dengan berat molekul ringan, cincin aromatik tunggal hingga kompleks tanin serta turunan polifenol. Klasifikasi komponen fenolik terbagi dalam dua grup yaitu flavonoid dan non flavonoid (Crozier et al. 2006).
100, 150, 200, dan 250 ppm. Asam gallat merupakan asam organik yang memiliki kestabilan yang lebih baik daripada asam tanat. Pada asam gallat gugus OH pada karboksil belum melepaskan hidrogen, sedangkan pada asam tanat hidrogen telah dilepaskan (Crozier et al. 2006) .
Data hasil perhitungan total fenol dapat dilihat pada Gambar 12.
Persamaan linier asam gallat yang diperoleh berdasarkan percobaan adalah y = -0.0044x + 0.1021, dimana y adalah nilai absorbansi dan x adalah konsentrasi
(ppm). Persamaan yang diperoleh dari kurva standar (Lampiran 3) tersebut akan digunakan untuk menentukan kadar fenol pada sampel.
Pada umumnya flavonoid tanaman berada dalam bentuk glikosida. Kelarutan flavonoid bergantung pada gugus hidroksil dan gulanya. Gugus hidroksil dan gula akan meningkatkan kelarutan flavonoid pada air, sedangkan gugus metil dan turunan isopentil akan menyebabkan flavonoid bersifat hidrofobik (tidak larut air). Antosianin merupakan komponen fenolik dalam bentuk glikosida, antosianin berikatan dengan gula pada posisi C ke-3 dan kadang-kadang pada posisi C yang lain (Taiz & Zeiger. 2002). Beberapa flavonoid lain seperti mirisetin, kuercetin, isorhamnetin dan kaempferol juga banyak ditemui dalam bentuk glikosidanya. Umumnya konjugasi dengan glikosida terjadi pada cincin atom C nomor 3, tetapi dapat juga terjadi pada cincin atom C 5, 7, 4, 3 (Crozier et al. 2006). Marete et al (2009) menyatakan beberapa komponen fenolik di alam membentuk kompleks dengan protein.
Gambar 12. Kadar total fenol ekstrak rosella
Suhu ekstraksi sangat mempengaruhi terlepasnya komponen fenol dari rosella. Diduga semakin tinggi suhu ekstraksi akan meningkatkan jumlah membran yang pecah akibat pemanasan dan komponen fenol dapat terekstrak. Pada kondisi ekstraksi 70-85o C diduga komponen fenol yang terekstrak sebagian besar adalah komponen fenol dalam bentuk glikosida, sedangkan fenol yang berikatan dengan protein atau fenol murni jumlahnya lebih sedikit. Dengan semakin meningkatnya suhu maka jumlah fenol dalam bentuk glikosida diduga akan semakin menurun. Menurut Taiz & Zeiger (2002) gugus hidroksil dan gula akan meningkatkan kelarutan flavonoid pada air. Marete et al (2009) menyatakan pada suhu ekstraksi di atas 70o C protein dan enzim pengoksidasi telah terdenaturasi sehingga jumlah protein pada ekstrak tanaman feverfew (Tanacetum parthenium) sangat rendah. Diketahui dengan semakin meningkatnya suhu ekstraksi feverfew maka senyawa hasil oksidasi komponen fenol yang berikatan dengan protein semakin kecil. Xu et al (2006) menyatakan dengan semakin meningkatnya suhu ekstraksi pada huyou (Citrus paradisi Changshanhuyou) jumlah komponen fenolik dalam bentuk glikosida akan semakin menurun. Sebagian besar komponen fenol yang terekstrak pada kondisi ekstraksi 100o C diduga adalah tanin. Ekstraksi pada suhu 100o C dapat menyebabkan gula dan beberapa komponen organik pada tanaman pecah dan menghasilkan ekstrak dengan warna yang gelap. Tanin adalah golongan polifenol yang tahan terhadap pemanasan (Pansera et al. 2004; Winarno. 1997).
Total fenol ekstrak berkisar antara 0,49-0,67 mg GAE/g rosella basah (kadar air 81% (bb)). Data kadar air dapat dilihat pada Lampiran 1. Hasil penelitian menunjukkan bahwa interaksi suhu dan waktu ekstraksi pada 70-85o C (15 dan 30 menit) tidak berpengaruh terhadap total fenol ekstrak rosella kecuali pada suhu 100o C (15 dan 30 menit). Pada suhu ekstraksi 70-85o C diduga PPO masih aktif sehingga interaksi suhu dan waktu ekstraksi tidak banyak berpengaruh terhadap total fenol ekstrak. Enzim PPO akan memungkinkan sejumlah komponen fenolik teroksidasi menjadi bentuk quinon. Suhu diatas 50o C akan menstimulasi kerja enzim yang bersifat panas sedang seperti PPO yang menyebabkan perubahan yang signifikan pada polifenol. Aktivitas optimum enzim berbeda pada setiap tanaman, PPO memiliki aktivitas pada suhu optimum 30-90o C (Capecka et al. 2005; Crozier et al. 2006; Diwakar & Mishra. 2011). Flavonoid pada teh hitam, katekin dan gallokatekin, akan teroksidasi oleh PPO menjadi bentuk quinon yaitu katekin quinon dan gallokatekin quinon (Wan et al. 2008). Diduga pada suhu 100o C PPO sudah tidak aktif lagi sehingga semakin lama interaksi suhu dan waktu ekstraksi, total fenol ekstrak akan semakin meningkat.
Menurut Ayerdi et al (2007), 1 gram rosella kering, dengan kadar air 5% akan setara dengan 18 g rosella basah, yang diekstraksi menggunakan campuran air, metanol dan aseton pada suhu ruang selama 60 menit mengandung total fenol sebesar 0,02 mg GAE/g. Perbedaan hasil penelitian dengan literatur disebabkan oleh beberapa hal yaitu suhu dan waktu ekstraksi, jenis pelarut, berat sampel dan jenis rosella yang digunakan.
4.3 Pengujian Pengaruh pH Sistem Pencernaan terhadap Daya Inhibisi Enzim
pada kisaran pH 1-2,5. Kisaran keaktifan enzim dapat mencapai pH 5-9, atau pada konsentrasi ion Hidrogen 10-9 - 10-5 M (Suhartono . 1989). Bahan makanan yang masuk ke dalam tubuh mulai dicerna di mulut dan dilanjutkan pada organ-organ pencernaan seperti lambung yang memiliki kisaran pH 1-2 dan usus halus dengan kisaran pH 6.8-7.00. Pengujian daya inhibisi enzim dilakukan pada dua nilai pH yang berbeda, yakni pH ekstrak awal dan pada pH 6,8-7 setelah didiamkan selama 30 menit pada pH 2 sebagai simulasi kondisi pH pada pencernaan
4. 3. 1 Inhibisi enzim α-Amilase secara In Vitro
Aktivitas inhibisi enzim α-amilase dilakukan menggunakan 2 enzim dari sumber yang berbeda yaitu α-amilase dari Bacillus sp dan α-amilase yang berasal dari pankreas babi. Babi merupakan hewan mamalia yang merupakan sumber enzim yang murah. Alfa-amilase dari Bacillus sp lebih sulit dihambat daripada aktivitas enzim yang lain. Inhibisi enzim α-amilase menggunakan ekstrak amadumbe (Colocasia esculenta) terhadap berbagai sumber enzim yaitu air liur manusia, barley, kentang, Bacillus sp, Aspergillus sp dan pankreas babi menunjukkan α-amilase dari Aspergillus sp paling tidak bisa dihambat diikuti dengan α-amilase dari kentang dan Bacillus sp (McEwan et al. 2010). Hasil penelitian Marshall et al (1975) menunjukkan inhibitor α-amilase dari kacang jogo (Phaseolus vulgaris) tidak mampu menghambat kerja enzim α-amilase dari Bacillus subtilis, Bacillus licheniformis, rye dan gandum barley. Inhibitor kacang jogo mampu menghambat kerja enzim α-amilase dari pankreas babi sebesar 97%.
a. Inhibisi enzim α-amilase Bacillus sp.
Enzim α-amilase terdapat pada tanaman, jaringan mamalia dan tersebar luas pada berbagai mikroba. Bacillus merupakan sumber enzim α-amilase jenis thermofil. Genus bacilli penghasil enzim α-amilase antara lain B. acidocaldarius, B. amyloliquifaciens, B. caldolyticus, B. coagulans, B. licheniformis, B. sterothermophillus dan B. subtillis (Suhartono. 1989).