LAMPIRAN
Lampiran 1. Bagan alur penelitian
Analisis Tanah (mencakup DHL, pH tanah, kandungan N, P, K, Ca, Mg, Na,
Cl, Al, dan KTK)
Penanaman Benih F4
Aplikasi antioksidan
Isolasi daun pada akhir vegetatif
Analisis aktivitas SOD, POD dan kadar protein
Analisis data pengamatan
Interpretasi hasil Analisis Klorofil
Lampiran 2. Alur Penelitian mendapatkan progeni F4
Dilakukan persilangan genotipe beradaptasi salin tersebut dengan varietas anjasmoro sebagai varietas bereproduksi tinggi untuk perbaikan
varietas
F3 (keragaman tanaman yang berproduksi tinggi)
F4 (pemberian beberapa jenis antioksidan terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai
Lampiran 3. Tahapan Analisis Klorofil Daun
Metode yang digunakan adalah metode Wintermans and de Mots (1965). Klorofil diekstraksi dengan menggerus daun menggunakan Etanol 95%. Kemudian dibiarkan selama semalam. Disaring dengan kertas saring bernomor 42. Dan kemudian dibaca dengan menggunakan spektrofotometer. Dihitung klorofil a, b dan total dengan menggunakan rumus:
Klorofil a = {(13,7 x A665 – 5,76 x A649)} (mg/l) Klorofil b = {(25,8 x A649 – 7,60 x A665)} (mg/l) Total Klorofil = {(20,0 x A649 + 6,10 x A665)} (mg/l)
A649 : Absorbansi ekstrak klorofil pada 649 nm A665 : Absorbansi ekstrak klorofil pada 665 nm
Lampiran 4. Tahapan Analisis Enzim Superoksida Dismutase
Aktivitas SOD dianalisis berdasarkan metode Beuchamp dan Fridovich (1971) yang dimodifikasi. Daun sebanyak 0,1 g digerus di
steril sebanyak 350 µl, lalu diaduk sampai merata. Kemudian dibaca dengan spektrofotometer dengan adsorbansi 560 nm.
Lampiran 5. Tahapan Analisis Kandungan Protein Terlarut Daun
Kandungan protein terlarut dianalisis berdasarkan metode Bradford (1976). Daun sebanyak 0,1 g digerus di dalam mortar dengan menambahkan
nitrogen cair dan PVP. Setelah halus sampel dimasukkan ke dalam tube yang berisi 1 ml buffer ekstrak (BE), lalu disentrifus pada kecepatan 10.000 rpm pada suhu 4°C selama 20 menit dan disimpan di dalam kulkas.
Sebelum menganalisis kandungan protein daun, maka kita harus membuat kurva standart terlebih dahulu. Disipakan larutan standar protein terlarut dengan konsentrasi BSA (Bovine Serum Albumin) 0, 10, 20, 30, 40, 50, 60, 70, 80, 90, dan 100 ppm. 0 ppm adalah campuran BSA 0 ml dan BE 1 ml, 10 ppm adalah campuran BSA 0,1ml dan BE 0,9 ml, dan seterusnya. Masing-masing ditambahakan reagen Bradford sebanyak 2,5 ml (dilakukan dalam kondisi gelap). Kemudian dibaca dengan menggunakan spektrofotometer dengan adsorbansi 595nm. Kemudian dibuat kurva dan fungsi kurva.
Lampiran 6. Tahapan Analisis Enzim Peroksidase
Daun sebanyak 0,1 g digerus di dalam mortar dengan menambahkan nitrogen cair dan PVP. Setelah halus sampel dimasukkan ke dalam tube yang berisi 1 ml CaCl2, lalu disentrifus pada kecepatan 10.000 rpm pada suhu 4°C selama 10 menit, disimpan di dalam kulkas. Sebelum melakukan pengukuran POD kita terlebih dahulu mengoptimalkan pH analisis terbaik yaitu pada kondisi asam digunakan larutan buffer MES 0,02 M (dengan pH 5,5; 6,0; 6,5) sedangkan kondisi netral digunakan larutan buffer HEPES 0,02 M (dengan pH 7,0; 7,5; 8,0) dengan menambahkan NaOH 1M. kemudian diuji aktivitas POD masing-masing larutan, aktivitas yang terbesar yang akan digunakan untuk membuat larutan B. Larutan MES pH 5,5 merupakan pH optimal dengan aktivitas peroksidase 0,79.
Larutan A dibuat dengan mencampurkan Fenol sebanyak 1,458 g, 4-aminoantipirin sebanyak 0,045 g dalam akuades sebanyak 90 ml. Larutan B dibuat
dengan dengan mencampurkan larutan H2O2 30% sebanyak 1,5 ml, MES (pH 5,5) 0,02 M dengan konsentrasi akhir 0,01 M.
Disiapkan tabung reaksi sebanyak sampel ditambah dua tabung untuk larutan standar dan blanko. Kemudian dimasukkan larutan A sebanyak 1,4 ml ke dalam tabung reaksi, lalu larutan B sebanyak 1,5 ml. Dimasukkan sampel sebanyak 200 µL. Dibaca oleh spektrofotometer pada panjang gelombang dengan adsorbansi 510 nm selama dua menit. Hasil pembacaan spektrometer pada menit kedua dikurang menit awal adalah satu aktivitas POD.
Lampiran 7. Pembuatan larutan stok dan buffer
Larutan Methionine 13 mM (200 sampel) : Ditimbang Methionin (C5H11NO2S, Mr=149,21) sebanyak 19,3973 mg dan dilarutkan ke dalam 100 ml akuades.
Larutan EDTA 0,1 mM (200 sampel): Ditimbang EDTA (C10H14N2Na2O8 2H2O, Mr = 372,24) sebanyak 1,11672 mg dan dilarutkan ke dalam 30 ml akuades.
Larutan Riboflavin 2µM (200 sampel): Ditimbang Ribolfavin (C17H20N4O6, Mr=376,36) sebanyak 0,0075272 mg dan dilarutkan ke dalam 10 ml akuades.
BSA : Ditimbang 0,01 g BSA (Bovine Serum Albumin) dan dilarutkan ke dalam 10 ml H2O. Larutan ini merupak stok BSA dengan konsentrasi 1000 ppm. Diencerkan BSA dengan mengambil 0,5 ml stok BSA dan ditambahkan 4,5 ml H2O steril sehingga diperoleh konsentrasi 100 ppm.
Reagen Bradford : Ditimbang 0,01 g coomasie brilian blue (CBB) G-250. Kemudian dilarutkan 10 ml etanol 95% dan 20 ml asam fosfor 85%. Diaduk sampai homogen dalam kondisi gelap. Kemudian disaring menggunakan kertas saring sampai seluruhnya tersaring. Larutan dicampur dengan 150 ml akuades. Larutan yang telah dicampurkan dengan akuades tidak dapat disimpan (harus digunakan pada saat itu juga).
CaCl2 0,5 M : Ditimbang CaCl2 sebanyak 5,55 g dan dilarutkan ke dalam 100 ml akuades. Disimpan di lemari pendingin.
Larutan A (60 sampel) : Ditimbang Fenol sebanyak 1,458 g dan 4-aminoantipirin sebanyak 0,045 g. Kemudian bahan di atas dilarutkan ke dalam
akuades sebanyak 90 ml.
Larutan Buffer MES 0,02 M : Ditimbang MES sebanyak 0,293 g dan dilarutkan ke dalam 75ml akuades. Larutan dibagi tiga bagian, masing-masing 25ml. Dioptimal pH pada kondisi asam masing-masing larutan menjadi 5,5; 6,0; 6,5 dengan menggunakan NaOH 1M.
Larutan Buffer HEPES 0,02 M : Ditimbang MES sebanyak 0,357 g dan dilarutkan ke dalam 75ml akuades. Larutan dibagi tiga bagian, masing-masing 25 ml. Dioptimal pH pada kondisi netral masing-masing larutan menjadi 7,0; 7,5; 8,0 dengan menggunakan NaOH 1 M.
Lampiran 8. Deskripsi Kedelai Varietas Grobogan Nama Varietas : Grobogan
SK : 238/Kpts/SR.120/3/2008
Tahun : 2008
Tetua : Pemurnian populasi Lokal Malabar Grobogan Rataan hasil : 3,40 ton/ha
Potensi hasil : 3,77 ton/ha
Karakter khusus : polong masak tidak mudah pecah, dan pada saat panen daun luruh 95–100% saat panen >95% daunnya telah luruh
Pemulia : Suhartina, M. Muclish Adie, T. Adisarwanto, Sumarsono, Sunardi, Tjandramukti, Ali Muchtar, Sihono, SB. Purwanto, Siti
Khawariyah, Murbantoro, Alrodi, Tino Vihara, Farid Mufhti, dan Suharno
Tipe pertumbuhan : Determinate Warna hipokotil : Ungu
Daerah sebaran : Beradaptasi baik pada beberapa kondisi
lingkungan tumbuh yang berbeda cukup besar, pada musim hujan dan daerah beririgasi baik Pengusul : Pemerintah Daerah Kabupaten Grobogan,
Lampiran 9. Deskripsi Kedelai Varietas Anjasmoro Nama Varietas : Anjasmoro
SK : 537/Kpts/TP.240/10/2001
Tahun : 2011
Tetua : Seleksi massa dari populasi galur murni Mansuria
Daya hasil : 2,03-2,25 ton/ha
Pemulia : Takashi Sanbuichi, Nagaaki Sekiya,
Jamaluddin M., Susanto, Darman M.A., dan M. Muchlish Adie Warna polong masak : Cokelat muda Warrna hilum biji : Kuning Kecoklatan
Bentuk daun : Oval Jumlah buku batang utama : 12,9-14,8
Bobot biji : 14,8-15,3 g
X
X
X
X
Lampiran 10. Bagan Penanaman Pada Petak
X : Polibag tanaman di tanah salin 10 cm
30 cm 10 cm
10 cm
Lampiran 12. Hasil analisis tanah
Parameter Satuan Hasil Analisis
N % 0,31
C organik % 3,32
KTK C mol/Kg 26,23
Ca-tukar C mol/Kg 6,79
Mg-tukar C mol/Kg 14,04
K tukar C mol/Kg 1,33
Na-tukar C mol/Kg 8,90
Al-tukar C mol/Kg 0,54
H-tukar C mol/Kg 0,21
pH H2O - 4,36
Lampiran 13. Data Pengamatan Klorofil a
Perlakuan Blok Jumlah Rataan
Lampiran 14. Data Pengamatan Klorofil b
Perlakuan Blok Total Rataan
Lampiran 15. Data Pengamatan Klorofil b Setelah ditranformasi √X+0,5
Perlakuan Blok Total Rataan
Lampiran 16. Data Pengamatan Klorofil total
Perlakuan Blok Total Rataan
Lampiran 17. Data Pengamatan Klorofil total Setelah ditranformasi √X+0,5
Perlakuan Blok Total Rataan
Lampiran 18. Data Pengamatan SOD
Perlakuan Blok Total Rataan
Lampiran 19. Data Pengamatan SOD Setelah ditransformasi √X+0,5
Perlakuan Blok Total Rataan
Lampiran 20. Data Pengamatan POD
Perlakuan Blok Total Rataan
Lampiran 21. Data Pengamatan POD Setelah ditranformasi √X+0,5
Perlakuan Blok Total Rataan
Lampiran 22. Data Pengamatan Protein Daun
Perlakuan Blok Total Rataan
I II
A0 0,300 0,271 0,571 0,285
A1 0,375 0,207 0,581 0,291
A2 0,315 0,270 0,585 0,292
A3 0,330 0,332 0,662 0,331
A4 0,137 0,119 0,256 0,128
A5 0,352 0,306 0,658 0,329
A6 0,401 0,311 0,713 0,356
A7 0,384 0,303 0,688 0,344
A8 0,346 0,266 0,611 0,306
A9 0,297 0,145 0,443 0,221
Lampiran 23. Data Pengamatan Bobot Biji per Tanaman
Perlakuan Blok Total Rataan
Lampiran 24. Data Pengamatan Bobot Biji per Tanaman Setelah ditranformasi √X+0,5
Perlakuan Blok Total Rataan
Lampiran 25. Gambar Tanaman
Persiapan Media Tanam Pengukuran DHL tanah
Perlakuan Kontrol Perlakuan Asam Askorbat 250 ppm
Perlakuan Asam Salisilat 250 ppm Perlakuan Asam Salisilat 500 ppm
Aplikasi Asam Askorbat Aplikasi Asam Salisilat
DAFTAR PUSTAKA
Afzal, I., S.M.A. Basra, N. Ahmad, and M. Farooq. 2005. Optimization of hormonal priming techniques for alleviation of salinity stress in wheat (Triticum aestivum L.). Cardeno de Pesquisa Sėr. Bio., Santa Cruz do sul. 17(1):95-109.
Ahmad. P., G. Nabi and M. Ashraf. 2011. Cadmium-induced oxidative damage in mustard (Brassica juncea L. Czern. &Coss.) plants can be alleviated by salicylic acid. South Afr J Bot 77:36–44.
Andrianto, T. T., dan N. Indarto, 2004. Budidaya dan Analisis Usaha Tani Kedelai, Kacang Hijau dan Kacang Panjang. Absolut, Yogyakarta.
Aroca R, Irigoyen JJ, Diaz MS. 2001 Photosynthetic characteristics and protective mechanisms against oxidative stress during chilling and subsequent recovery in two maize varieties differing in chilling sensitivity. Plant Science 161 : 719– 726.
Ashlock, L. and L. Purcell. 2010. Growth and Development Soybean. University of Arkansas, Monticello.
Azevedo-Neto, D., Prisco, J., Eneas, J., De Abreu, C. and Gomes, E. 2006. Effect of salt stress on antioxidative enzymes and lipid peroxidation in leaves and roots of salt-tolerant and saltsensitive maize varieties. Environment and Experimental Botany, 56 : 87 - 94.
(Bappenas) Badan Perencanaan Pembangunan Nasional. 2014. Rencana pembangunan jangka menengah nasional (RPJMN) bidang pangan dan pertanian 2015-2019. Direktorat Pangan dan Pertanian, Bappenas. (Internet). 413 hlm; (diunduh 2016 Maret 9).
Beauchamp, C. And I. Fridovich. 1971. Superoxide Dismutase. Analytical Biochemistry 44:276:287.
Belfield, S. C. Brown, and R. Martin. 2011. Soybean. ACIAR, Canberra.
Bosch, M. and L. Alegre. 2002. The function of tocopherols and tocotrienols in plants. Crit. Rev. Plant Sci. 21 31–57.
Bradford, M.M. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72: 1976.
Christian, B. 2016. Seleksi Kedelai Generasi F3 di Tanah Salin dengan Metode Pedigree. Skripsi FP USU, Medan.
Dumet D. and Benson E.E. 2000. The use of physical and biochemical studies to elucidate and reduce cryopreservation-induced damage in hydrated/ desiccated plant germplasm. In Engelmann, F. and H. Takagi (Eds.). Cryopreservation of Tropical Plant Germplasm: Current Research Progress and Application. IPGRI. Rome-Italy p.43-56.
El-Hendawy, S.E. 2004. Salinity tolerance in Egyptian springwheat genotypes. Desertasi. University Munich-Weihenstephan. Jerman. 116 p.
El-Tayeb. M. A. 2005. Response of barley grains to the interactive effect of salinity and salicylic acid. Plant Growth Regul 45:215–224.
Evelin, H., R. Kapoor and B. Giri. 2009. Arbuscular mycorrhial fungi in alleviation of salt stress : a review. Annals of Botany 104:1263-1280.
Farouk, S. 2011. Ascorbic acid and α-tocopherol minimize salt-induced wheat leaf senescence. J. of Stress Physiology & Biochemistry 7(3).
Gunes. A., A. Inal., M. Alpaslan., F. Eraslan., E. G. Bagci and N. Cicek. 2007. Salicylic acid induced changes on some physiological parameters symptomatic for oxidative stress and mineral nutrition inmaize ( Zea mays L.) grown under salinity. J. Plant Physiol 164:728–736.
Horvath. E., G. Szalai and T. Janda. 2007. Induction of abiotic stress tolerance by salicylic acid signaling. J Plant Growth Regul 26:290–300.
Jalali-e-Emam, S.M.S., B. Alizadeh, M. Zaefizadeh, R.A. Zakarya, and M. Khayatnezhad. 2011. Superoxide Dismutase (SOD) Activity in Nacl Stress in Salt-Sensitive and Salt-Tolerance Genotypes of Colza (Brassica napus L.). Middle-East Journal of Scientific Research 7(1):07-11.
Jiang, M. and Zhang, J. 2002. Water stress-induced abscissic acid accumulation triggers the increased generation of reactive oxygen species and up-regulates the activities of antioxidant enzymes in maize-leaves. Journal of Experimental Botany, 53 : 2401 – 2410.
Kader, DZA. 2001. Drought and Gibberellic Acid-dependent Oxidative Stress: Effect on Antioxidant Defense System in Two Lettuce Cultivars. Pakistan Journal of Biological Sciences 4(9):1138-1143,
Kao, W.Y., Tsai, T.T., Tsai, H.C. and Shih, C. N. 2006. Response of three Glycine
species to salt stress. Environmental and Experimental Botany 56: 120 – 125.
Khan, A., Ahmad, M.S.A., Athar, H.U. and Ashraf, M. 2006. Interactive Effect of foliarly applied ascorbic acid and salt stess on wheat (Triticum aestivum L) at the seedling stage. Pakistan Journal of Botany, 38 (5) : 1407 - 1414.
Kusmiyati, F., Purbajanti, E.D. dan Kristanto, B.A. 2009. Karakter Fisiologis, Pertumbuhan dan Produksi Legum Pakan pada Kondisi Salin. Seminar Nasional Kebangkitan Peternakan. Semarang.
Kumalaningsih S. 2006. Antioksidan Alami. Penangkal Radikal Bebas. Trubus Agrisarana, Surabaya.
Lauchi, A. and S.R. Grattan. 2007. Plant Growth and Development under Salinity Stress. Springer.
Munns, R. and Tester M. 2008. Mechanism of salinity tolerance. Annu Rev Plant Biol. 59: 651-681
R.A. James, A. Lauchi. 2006. Approaches to Increasing the Salt Tolerance of Wheat and other Cereals. J. Experimental Botany, 57(5):1025-1043.
Nazar. R., N. Iqbal., S. Syeed and N.A. Khan. 2011. Salicylic acid alleviates decreases in photosynthesis under salt stress by enhancing nitrogen and sulfur assimilation and antioxidant metabolism differentially in two mungbean cultivars. J. Plant Physiol 168:807–815.
Noreen, S. M. Ashraf, M. Hussain, and A. Jamil. 2009. Exogenous Application of
Salicylic Acid Enhances Antioxidative Capacity In Salt Stressed Sunflower (Helianthus Annuus L.) Plants. Pak.J.Bot,41(1):473-479.
Orabi, S.A., B.B. Mekki, and F.A. Sharara. 2013. A lleviation of Adverse Effects of Salt Stress on Faba Bean (Vicia faba L.) Plants by Exogenous Application of Salicylic Acid. J. World Applied Sciences, 27(4):418-427
Pessarakli, M. 2011. Handbook of Plant and Crop Stress. CRC Press, New York. Phang, T.H., G. Shao and H.M. Lam. 2008. Salt tolerance in Soybean. Journal of
Integrative Plant Biology 50 (10) : 1196-1212.
Prihatman, 2000. Kedelai (Glycine max L.)
Quiambao, P.R dan N.R. Rojah. 2000. Peroksidase presentation.
Rachman,A., IGM. Subiksa, dan Wahyunto. 2007. Perluasan areal tanaman kedelai ke lahan suboptimal. Kedelai: Teknik produksi dan pengembangan, p. 185-226. Puslitbangtan, Bogor.
Rehman, R.U., M. Zia, B.H. Abbasi, G. Lu and M.F. Chaudhary. 2014. Ascorbic Acid
and Salicylic Acid Mitigate NaCl Stress in Caralluma tuberculata Calli. Springer, New York.
Rubatzky, V. E., dan M. Yamaguchi. 1998. Sayuran Dunia, Prinsip, Produksi, dan Gizi. Edisi Kedua. Penerjemah C. Herison. ITB Press, Bandung.
Sajid, Z.A., M. Safdar, and S. A.Khilji. 2016. Amelioration of Salinity Stress Tolerance in Pea (Pisum sativum L.) by Exogenous Application of Salicylic Acid. J.Biologia,62(1):69-78.
Sairam, R.K and A. Tyagi. 2004. Physiology and molecular biology of salinity stress tolerance in plants. J. Current Sciance 8(3):410
Salama, Z.A., E.A.A.A. El-Nour, M.M. El Fouly, and A.A. Gaafar. 2014. Ascorbic Acid Foliiar Spray Counteracting Effect of Salinity on Growth, Nutrients Concentrations, Photosynthesis, Antioxidant Activities and Lipid Peroxidation of Bean (Phaseulus vulgaris L.) Cultivars. American Journal of Agricultural and Biological Sciences 9(3):384-393.
Scandalios, J.G. 1993. Oxygen and Superoxide Dismutases. Plant Physiol 101:7-12.
. 2005. Oxidative stress: molecular perception and transduction of signals triggering antioxidant gene defenses. Brazilian Journal of Medical and Biological Research 38: 995-1014.
Sgherri CLM. and Navari-Izzo F. 1995. Sunflower seedling subjected to increasing water deficit stress. Oxidative stress and defence mechanism. Physiol. Plant. 93:25-30
Sheng, M., Tang, M., Chan, H., Yang, B., Zhang, F. and Huang, Y. 2008. Influence of arbuscular mycorrhizae on photosynthesis and water status of maize plants under salt stress. Mycorrhiza 18: 287–296.
Sitinjak, E.N. 2012. Respons Pertumbuhan dan Produksi Kedelai (Glycine max (L.) Merril) Varietas Grobogan dengan Pemberian Asam
Smirnoff, N. 1993. The Role of active oxygen in the response of plants to water deficit and dessication. New Phytol 125:27-58.
. 1996. The Function and Metabolism of Ascorbic Acid in Plants. University Exeter, Hatherly.
(SOP) Standart Operating Procedures. 1994. Plant Peroxides Activity Determination. SERAS.
Steenis, V.C.G.G.C. 2005. Flora. Pradnya Paramitha, Jakarta.
Steel, R.G.D dan J.H. Torrie. 1995. Prinsip dan Prosedur Statistik. Gramedia Pustaka Utama, Jakarta. 772 hal.
Sumarno dan A. G. Manshuri. 2007.Persyaratan Tumbuh dan Wilayah Produksi Kedelai di Indonesia. Pusat Penelitian dan Pengembangan Tanaman Pangan, Bogor.
Weisany, W., Y. Sohrabi, G. Heidari, A. Siosemardeh, K. Ghassemi-Golezani. 2011. Physiological responses of soybean (Glycine max L.) to zinc application under salinity stress. Australian Journal of Crop Science 5(11):1441—1447.
Wibowo, F. 2016. Keragaan Morfologi, Fisiologi, dan Biokimia Hasil Persilangan F2 Tanaman Kedelai (Glycine max L. Merril) pada Cekaman Salinitas. Tesis Pasca Sarjana Fakultas Pertanian Universitas Sumatera Utara, Medan.
Winarno, F.G. 1992. Kimia Pangan dan Gizi. Gramedia Pustaka Utama, Jakarta.
Wintermans J.F., De Mots, A. 1965. Spectrophotometric characteristics of chlorophylls a and b and their pheophytins in ethanol. Biochim Biophys Acta 109: 448-453
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di dua tempat, untuk penelitian penanaman turunan F4 kedelai dilaksanakan di Rumah Plastik Fakultas Pertanian Universitas Sumatera Utara dengan ketinggian tempat ± 32 meter di atas permukaan laut. Analisis Fisiologi dan Biokimia dilaksanakan di Laboratorium Kultur Jaringan, Balai Penelitian Sungei Putih, dan Laboratorium Sentral Fakultas Pertanian Universitas Sumatera Utara dimulai pada bulan Februari sampai dengan Agustus 2016.
Bahan dan Alat
Bahan yang digunakan dalam penelitian ini adalah benih turunan F4 kedelai hasil persilangan Varietas Anjasmoro (tetua betina) dengan Grobogan beradaptasi salin (tetua betina) sebagai objek penelitian (Lampiran 2), tanah salin (5-6 DHL) dari penelitian sebelumnya yang diambil dari kecamatan Percut Sei Tuan, polibag 10 kg, plastik bening 15 kg, pupuk Urea, TSP dan KCl, label, fugisida, insektisida, air, selang sebagai bahan perlengkap penanaman, Nitrogen cair, Hidrogen Peroksida (H2O2) 30%, Metanol, NBT (Nitro Blue Tetrazolium), KH2PO4 (Monopotassium phosphate), EDTA (Ethylenediaminetetra Asetic Acid), PVP (Polivinil Pirolidon), K2HPO4 (Dipotassium phosphate), Riboflavin, L-Metionin, CaCl2 (Calsium Clorida), BSA (Bovine Serum Albumin), Etanol 95%, CBB G-250 (Coomasie Brillian Blue G-250),
Fenol, MES (M 2-(N-Morpholino)ethanesulfonic Acid), NaOH (Natrium Hidroksida), HEPES (M N-(2-Hydroxyethyl)piperazine-N’-(2-ethanesulfonic Acid),
Alat yang digunakan meliputi alat pegukur kadar garam (Electro Conductivity Meter) untuk mengukur DHL tanah salin, gembor, handsprayer, meteran,
spektofotometer, centrifius, shaker, pH meter, mortal dan alu, wadah es, timbangan
analitik, tabung reaksi, mikro pipet, serta alat pendukung penelitian ini.
Metode Penelitian
Penelitian menggunakan rancangan acak kelompok (RAK) satu faktor yaitu faktor antioksidan yaitu:
A0 = Kontrol
A1 = Asam Askorbat 250 ppm A2 = Asam Askorbat 500 ppm A3 = Asam Askorbat 750 ppm A4 = Asam Salisilat 250 ppm A5 = Asam Salisilat 500 ppm A6 = Asam Salisilat 750 ppm A7 = α- Tokoferol 250 ppm A8 = α- Tokoferol 500 ppm A9 = α- Tokoferol 750 ppm
Jumlah ulangan : 2 ulangan
Jarak antar polibag : 10 x 10 cm
Jarak antar blok : 50 cm
Jarak antar petak : 20 cm
Data hasil pengamatan dianalisis dengan menggunakan sidik ragam berdasarkan model linear sebagai berikut :
Yij = µ + ρi + δj + εij
i = 1, 2 j = 1, 2, 3, 4, 5, 6, 7, 8, 9,10 Keterangan :
Yij : Data hasil pengamatan dari unit percobaan blok ke-i dengan varietas ke-j µ : Rataan umum
ρi : Pengaruh blok ke-i
δj : Pengaruh perlakuan antioksidan ke-j
εij : Pengaruh error pada blok ke-i dan perlakuan antioksidan ke-j
Jika dari hasil analisis sidik ragam menunjukkan pengaruh yang nyata, maka
dilanjutkan dengan uji beda rataan berdasarkan kontras ortogonal (Steel and Torrie, 1995).
Pelaksanaan Penelitian Seleksi benih
Benih yang digunakan adalah turunan F4 kedelai (hasil persilangan Anjasmoro dan Grobogan hasil adaptasi di tanah salin). Benih yang digunakan adalah yang memiliki bentuk dan ukuran yang baik serta bebas dari bibit penyakit.
Persiapan lahan
Pembuatan rumah plastik
Rumah plastik dibuat di dalam rumah kasa dengan ukuran 12m x 8m dengan rapi dan kokoh. Plastik yang digunakan yang bening agar cahaya mudah masuk.
Persiapan wadah tanam
Wadah tanam yang digunakan pada penelitian ini adalah polibag ukuran 10 kg yang dilapis plastik bening ukuran 15 kg.
Persiapan media tanam
Media tanam yang digunakan dalam penelitian ini adalah tanah salin yang digunakan pada penelitian sebelumnya yang diambil dari kecamatan Percut Sei Tuan dengan melakukan survei awal untuk melihat tanah salin yang memiliki 5-6 4dS/m. Kemudian dipasangkan selang.
Analisis tanah
Analisa tanah mencakup DHL, pH tanah, kandungan N, P total, P tersedia, K, C organik, Ca, Mg, Na, Cl, Al dan KTK pada tanah yang telah dikompositkan.
Penanaman
Penanaman dilakukan dengan membuat lubang tanam pada polibag dengan kedalaman ± 2 cm, kemudian dimasukkan satu benih per polibag dan kemudian ditutup kembali dengan tanah. Benih yang ditanam telah direndam selama 15 menit dengan fungisida berbahan aktif Mankozeb 80% dengan dosis 0,5 ml/liter air.
Pemupukan
Aplikasi antioksidan
Asam askorbat diaplikasikan mulai 2 minggu setelah tanam sampai panen sesuai perlakuan dengan interval waktu aplikasi 1 minggu. Metode aplikasi adalah metode kalibrasi yang dilakukan satu hari sebelum aplikasi. Aplikasi antioksidan
dilakukan dengan menyemprotan di daun tanaman pada pagi hari (pukul 07.00-08.00 WIB).
Pemeliharaan Penyiraman
Penyiraman dilakukan setiap hari pada pagi atau sore hari dan disesuaikan dengan kondisi media tanam di lapangan. Penyiraman dilakukan melalui selang yang dimasukkan ke dalam tanah bertujuan agar air di dalam dan di permukaan polibag seimbang.
Penyiangan
Penyiangan gulma dilakukan secara manual dengan mencabut gulma yang ada di dalam polibag untuk menghindari persaingan dalam mendapatkan unsur hara dari dalam tanah. Penyiangan juga dilakukan di sekeliling lahan dan polibag.
Pengajiran
Pengajiran dilakukan pada seluruh tanaman untuk menjaga tanaman agar tumbuh tegak dan kokoh.
Pengendalian Hama dan Penyakit
Pengendalian hama dilakukan secara manual dengan menangkap dan membunuh hama yang terlihat di sekitar tanaman. Di lapangan dilakukan
unit SOD µg protein Pemanenan
Panen dilakukan dengan cara memetik polong satu persatu dengan menggunakan tangan. Pemanenan dilakukan pada saat tanaman berumur 100-107 hari. Kriteria panen kedelai ditandai dengan kulit polong sudah berwarna kuning kecoklatan sebanyak 95% dan daun sudah berguguran tetapi bukan karena adanya serangan hama dan penyakit.
Peubah Amatan
Kandungan klorofil daun (g/ml)
Analisis aktivitas enzim peroksidase dilakukan di Laboratorium Kultur Jaringan Fakultas Pertanian dan Laboratorium Sentral Universitas Sumatera Utara. Metode yang digunakan dalam menghitung jumlah klorofil a, b dan total adalah metode Wintermans and de Mots (1965). Analisis klorofil dilakukan pada akhir fase vegetatif (Lampiran 3).
Aktivitas enzim superoksida dismutase (unit/µg protein)
Aktivitas SOD dianalisis berdasarkan metode yang dikembangkan oleh Beauchamp and Fridovich (1971) (Lampiran 4). Aktivitas SOD diperoleh dengan membagi unit SOD dengan kadar protein ditentukan sesuai dengan metode Bradford (1976) (Lampiran 5) sebagaimana terlihat dalam rumus:
Aktivitas SOD =
Aktivitas enzim peroksidase (unit/µg protein)
Unit POD Protein terlarut (µg)
akhir masa vegetatif (Lampiran 6). Selanjutnya dihitung sesuai dengan mengikuti rumus:
Unit POD = Af - Ai Af : Pembacaan peroksidase akhir (final)
Ai : Pembacaan peroksidase awal (initial)
Aktivitas POD =
(SOP, 1994)
Bobot biji per tanaman (g)
HASIL DAN PEMBAHASAN
Hasil
Hasil penelitian menunjukkan bahwa perlakuan antioksidan tidak berpengaruh nyata terhadap klorofil daun, aktivitas enzim SOD, POD, dan bobot biji per tanaman. Klorofil daun (g/ml)
Tabel 1. Rataan Klorofil a, b dan total
Perlakuan Klorofil a Klorofil b Klorofil total
A0 2,375 4,930 7,294
Hasil pengamatan klorofil a, b dan total (Tabel 1) diketahui perlakuan antioksidan tidak memberikan pengaruh yang nyata terhadap klrofil a, b dan total. Aktivitas enzim superoksida dismutase (SOD) (unit/ µg protein)
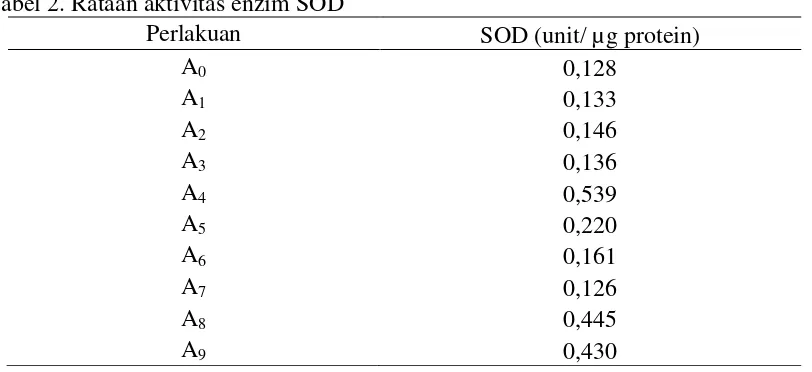
Tabel 2. Rataan aktivitas enzim SOD
Perlakuan SOD (unit/ µg protein)
Hasil pengamatan aktivitas enzim SOD (Tabel 2) diketahui perlakuan antioksidan tidak memberikan pengaruh yang nyata terhadap enzim SOD.
Aktivitas enzim peroksidase (POD) (unit/ µg protein) Tabel 3. Rataan aktivitas enzim POD
Perlakuan POD (unit/ µg protein)
A0 0,33088
Hasil pengamatan aktivitas enzim POD (Tabel 3) diketahui perlakuan antioksidan tidak memberikan pengaruh yang nyata terhadap enzim POD.
Bobot Biji per tanaman (g)
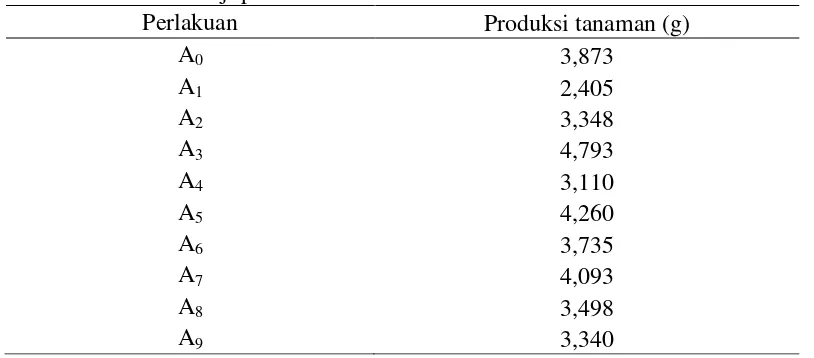
Tabel 4. Rataan bobot biji per tanaman
Perlakuan Produksi tanaman (g)
A0 3,873
Hasil pengamatan bobot biji per tanaman (Tabel 4) diketahui perlakuan antioksidan tidak memberikan pengaruh yang nyata terhadap bobot biji per tanaman.
Pembahasan
Hasil penelitian menunjukkan bahwa perlakuan antioksidan tidak berpengaruh nyata terhadap kandungan klorofil a, b, dan total daun. Aplikasi antioksidan seperti asam askorbat akan meningkatkan kandungan klorofil a, b, dan total pada kedelai di lahan salin (Sitinjak, 2012). Namun, hasil penelitian menunjukkan tidak berpengaruh nyata, ini disebabkan oleh penyerapan antioksidan yang kurang baik oleh stomata daun dan mobilitas ion magnesium di daun. Kondisi cekaman salinitas akan menyebabkan stomata daun tertutup (Kao et al., 2006). Selanjutnya klorofil daun sangat dipengaruhi oleh ion Magnesium (Mg2+). Cekaman salinitas akan mempengaruhi penyerapan ion Magnesium dari tanah karena bersaing dengan ion Natrium (Na+) dan Kalium (K+), didukung oleh penelitian Kamel and El-Tayeb (2004) menunjukkan bahwa semakin tinggi rasio K/Na maka semakin rendah kandungan
magnesium pada daun kacang babi (Vicia faba L.) kondisi salintas dan penelitian Sheng et al., (2008) menunjukkan bahwa pengurangan penyerapan mineral (seperti
Mg) yang diperlukan untuk biosintesis klorofil juga mengurangi konsentrasi klorofil dalam daun.
tercekam salinitas akan tertutup (Pessarakli, 2011) sedangkan cuaca pada saat penelitian menunjukan cuaca yang panas dan menyebabkan banyak antioksidan yang diaplikasikan menguap. Stomata pada tanaman ynag tercekam salinitas akan cenderung tertutup karena ion Kalium (K+) di stomata terbatas. Proses terbukanya stomata sangat dipengaruhi oleh ion Kalium (K+). Jumlah Kalium (K+) yang tertimbun di vakuola sel penjaga selama pembukaan stomata cukup besar untuk mendorong pembukaan, karena K+ bergabung dengan anion lain yang cocok untuk mempertahankan kenetralan muatan listrik (Salisbury and Ross, 1995)
Hasil penelitian menunjukkan bahwa perlakuan antioksidan tidak berpengaruh nyata terhadap aktivitas enzim POD. Penelitian ini didukung oleh Sajid et al. (2016) yang menunjukkan bahwa aplikasi asam salisilat pada tanaman P. sativum L. di tanah salin tidak memberikan pengaruh yang nyata terhadap aktivitas enzim POD. Hal ini disebabkan oleh hidrogen peroksida (H2O2) yang dihasilkan oleh tanaman bukan hanya dipecah oleh enzim peroksidase (POD) tetapi juga enzim katalase (CAT) dan askorbat peroksidase (APX). Kerja enzim POD juga dipengaruhi oleh adanya substrat yang akan dioksidasi dengan H2O2 (Scandalios, 2005) dan POD hanya diproduksi di mitokondria dan sitosol (Scandalios, 1993).
fotosintesis (Kao et al., 2006). Keadaan stomata tertutup ini yang menyebabkan antioksidan yang diaplikasikan di daun tidak dapat diserap dengan baik oleh tanaman. Selain itu, cekaman salinitas akan menyebabkan tanaman sulit menyerap ion K+ dari larutan tanah karena bersaing dengan ion Na+. Ion K+ berfungsi dalam proses fotosintesis (Salisbury and Ross, 1995)
Tanaman yang tercekam salinitas akan memproduksi molekul reaktif seperti singlet oksigen (O2), hidrogen peroksida (H2O2), superoksida (O2-) dan radikal hidroksil (OH) yang dapat merusak sel dan kerja enzim. Salah satu cara tanaman untuk melindungi sel dari efek cekaman ini adalah dengan memproduksi enzim antioksidan yaitu enzim SOD dan POD. Semakin tinggi nilai enzim SOD dan POD maka tanaman akan semakin tahan pada cekaman salintas. Hal ini didukung oleh penelitian Jalali-e-Emam et al (2011) pada tanaman Colza menunjukkan bahwa aktivitas SOD tanaman yang toleran salinitas lebih tinggi daripada tanaman yang sensitif salinitas. Penelitian Salama et al. (2014) menunjukkan bahwa aktivitas enzim POD tanaman yang toleran salinitas lebih tinggi daripada yang sensitif pada tanaman kacang hijau.
Aplikasi antioksidan pada tanaman yang mengalami cekaman salinitas akan berpotensi menghilangkan bahaya ROS. Tanaman dengan konsentrasi enzim antioksidan tinggi telah dilaporkan memiliki ketahanan yang lebih besar terhadap kerusakan oksidatif (Jiang and Zhang, 2002), nilai enzim SOD meningkat pada tanaman Caramulla tuberculata Calli yang diaplikasikan asam salisilat pada kondisi salinitas (Rehman, et al., 2014). Enzim POD meningkat setelah diaplikasikan
KESIMPULAN DAN SARAN
Kesimpulan
1. Aplikasi beberapa jenis antioksidan tidak memberikan pengaruh yang nyata dibandingkan dengan kontrol terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai berdasarkan aktivitas enzim Peroksidase (POD) dan Superoksida Dismutase (SOD).
2. Aplikasi beberapa jenis dan dosis antioksidan tidak memberikan pengaruh yang nyata terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai berdasarkan aktivitas enzim Peroksidase (POD) dan Superoksida Dismutase (SOD).
3. Secara deskriptif perlakuan asam askorbat 750 ppm memberikan rataan tertinggi terhadap klorofil daun dan bobot biji per tanaman, perlakuan asam salisilat 250 tertinggi pada enzim SOD dan perlakuan asam salisilat 500 ppm tertinggi pada enzim POD.
Saran
TINJAUAN PUSTAKA
Botani Tanaman
Klasifikasi tanaman kedelai adalah sebagai berikut : Kingdom : Plantae, Divisio : Spermatophyta, Sub Divisio : Angiospermae, Class : Dicotyledonae, Ordo :
Leguminales, Famili : Leguminoseae, Genus: Glycine, Species : Glycine max L. Merill. (Stennis, 2005).
Kedelai memiliki akar tunggang bercabang dan berserat yang baik. Sistem akar lateral cukup luas, mencapai 45 cm dalam 4-5 minggu. Kondisi tanah yang kering akar dapat tumbuh lebih dalam untuk menyerap air dan unsur hara. Tanaman kedelai juga memiliki hubungan simbiosis dengan bakteri pengikat nitogen pada akar kedelai yaitu Bradyrhizobium spp. (Belfield, et al., 2011)
Kedelai adalah tanaman setahun yang tumbuh tegak (70-150 cm), menyemak, berbulu halus (pubescens), dengan sistem perakaran luas. Tipe pertumbuhan batang dapat dibedakan menjadi terbatas (determinate), tidak terbatas (indeterminate), dan setengah terbatas (semi-indeterminate). Daun tanaman kedelai merupakan daun majemuk trifolia yaitu berdaun tiga (Rubatzky dan Yamaguchi, 1998; Andrianto dan Indarto, 2004).
hijau transparan (tembus cahaya). Ada pula biji yang berwarna gelap kecoklat-coklatan sampai hitam atau berbintik-bintik (Rubatzky dan Yamaguchi, 1998; Andrianto dan Indarto, 2004).
Syarat Tumbuh Iklim
Suhu optimal untuk pertumbuhan kedelai adalah 20- 30°C. Optimal suhu tanah untuk perkecambahan dan awal pertumbuhan bibit adalah 25- 30°C. Pada suhu yang lebih tinggi dari 30°C, fotorespirasi cenderung mengurangi hasil fotosintesis. Tanaman ini pada umumnya dapat beradaptasi terhadap berbagai jenis tanah dan menyukai tanah yang bertekstur ringan hingga sedang, dan berdrainase baik. Tanaman ini peka terhadap kondisi salin (Belfield, et al., 2011;Rubatzky dan Yamaguchi, 1998).
Suhu, panjang hari dan varietas dapat menjadi penting dalam menentukan awal berbunga dan perkembangan tahap reproduksi selanjutnya. Suhu rendah menghambat dan suhu tinggi meningkatkan reproduksi. Hari yang panjang (malam pendek)
menghambat dan hari pendek mempercepat awal tahap reproduksi (Ashlock and Purcell, 2010).
Tanah
Kedelai dapat tumbuh baik pada berbagai jenis tanah asal drainase dan aerase tanah cukup baik. Tanah-tanah yang cocok yaitu alluvial, regosol, grumosol, latosol dan andosol. Pada tanah-tanah podsolik merah kuning dan tanah yang mengandung banyak pasir kwarsa, pertumbuhan kedelai kurang bagus. Kecuali kalau diberi
Kedelai termasuk tanaman yang mampu beradaptasi terhadap berbagai agroklimat, menghendaki tanah yang cukup gembur, tekstur lempung berpasir dan liat. Toleransi pH yang baik sebagai syarat tumbuh yaitu antara 5,8-7 namun pada tanah dengan pH 4,5 pun kedelai masih dapat tumbuh baik (Sumarno dan Manshuri, 2007; Prihatman, 2000).
Pengaruh Salinitas terhadap Tanaman
Lahan salin adalah lahan pasang surut yang secara temporer atau permanen memiliki salinitas tinggi, dengan nilai ESP (Exchangeable Sodium Percentage) < 15%atau nilai EC (Electrical Conductivity) > 4 dS/m. Terdapat dua macam bentuk salinitas tanah, yaitu salinitas primer dan sekunder. Salinitas primer terbentuk akibat akumulasi garam terlarut dalam tanah atau air tanah melalui proses alami yang berlangsung dalam jangka waktu lama. Salinitas sekunder terbentuk akibat aktivitas manusia yang mengubah keseimbangan tata air tanah, antara air yang digunakan (air irigasi atau air hujan) dengan air yang digunakan oleh tanaman dan penguapan. Penyebab utama salinitas sekunder adalah pembukaan lahan dan penggantian vegetasi tahunan dengan tanaman semusim, pengairan menggunakan air berkadar garam tinggi atau keterbatasan air irigasi (El-Hendawy, 2004).
Penurunan produksi pertanian pada tanah salin yang sangat besar dipengaruhi oleh gangguan pertumbuhan dan perkembangan tanaman. Pengaruh salinitas secara langsung terhadap pertumbuhan tanaman meliputi :
− Pengurangan potensial osmotik pada larutan tanah yang akan mengurangi jumlah air yang tersedia bagi tanaman yang menyebabkan kering fisiologis, untuk mengatasi masalah ini tanaman harus menjaga potensial osmotik internal untuk mencegah air keluar dari akar ke tanah di sekitar tanaman.
− Toksisitas akibat berlimpahknya ion Na+ dan Cl- di dalam sel, pengaruh keracunan meliputi terganggunya struktur enzim dan makromolekul lain, kerusakan organel sel dan membran plasma, gangguan fotosintesis, respirasi dan sintesis protein.
− Ketidakseimbangan hara pada tanaman menyebabkan terganggunya penyerapan dan atau transport hara ke tajuk menyebabkan defisiensi hara.
(Evelin et al., 2009).
Tingginya konsentrasi garam menyebabkan gangguan pada seluruh siklus hidup kedelai. Tingkat toleransi kedelai pada berbagai varietas kedelai bervariasi menurut tingkat pertumbuhan. Perkecambahan biji kedelai akan terhambat pada konsentrasi garam rendah. Konsentrasi garam yang lebih tinggi secara nyata akan menurunkan persentase perkecambahan. Pengaruh garam pada tahap awal dan penurunan persentase perkecambahan lebih menonjol pada varietas yang sensitif dibandingkan varietas toleran. Sifat-sifat agronomi kedelai sangat dipengaruhi oleh salinitas yang tinggi, diantaranya :
2. Penurunan kualitas biji
3. Penurunan kandungan protein biji
4. Menurunkan kandungan minyak pada biji kedelai 5. Nodulasi kedelai
6. Mengurangi efisiensi fiksasi nitrogen 7. Menurunkan jumlah dan bobot bintil akar (Phang et al., 2008).
Cekaman Oksidatif
Reactive Oxygen Species (ROS) merupakan radikal bebas yang sangat
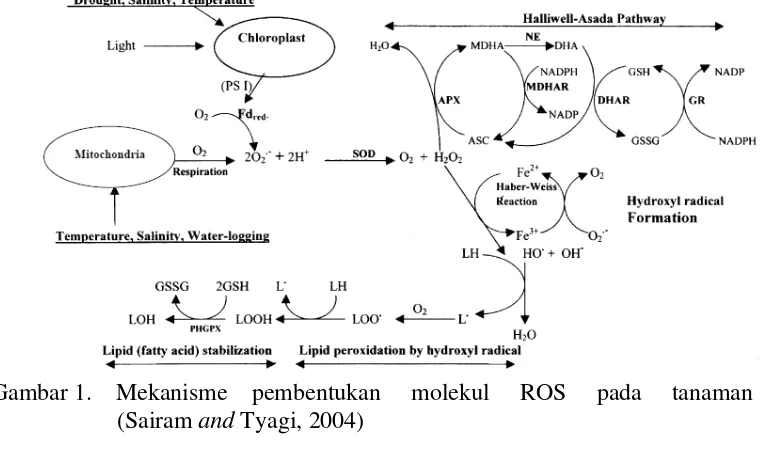
berbahaya bagi makhluk hidup. Pada tanaman ROS terbentuk dalam sel melalui beberapa cara yaitu : 1) Produksi fotokimia di atmosfer akibat pencemaran udara, 2) Penyumbangan elektron langsung ke oksigen ketika terjadi fotosintesis terutama pada kondisi cahaya yang tinggi dan konsentrasi CO2 pada kloroplas yang rendah, 3) Respon terhadap kondisi cekaman seperti kekeringan, suhu tinggi, salinitas, ozon dan serangan mikroba (Pritchard et al. 2000).
Gambar 1. Mekanisme pembentukan molekul ROS pada tanaman (Sairam and Tyagi, 2004)
Terbentuknya H2O2 di kloroplas terjadi karena terhambatnya proses fotosintesis menyebabkan tanaman kelebihan energi elektron yang ditangkap oleh pusat reaksi tidak dapat dilepas atau dipantulkan secara aman sehingga merusak perangkat Fotosistem II pada kloroplas dan membran lipid (Kader, 2001).
Sistem antioksidan di dalam sel tumbuhan menyediakan perlindungan melawan pengaruh racun dari oksigen spesies yang aktif. Komponen penting dari sistem pelindungan itu adalah pertahanan secara enzimatis, seperti SOD dan katalase yang dapat menghindari O2 - dan H2O2 selain metabolit seperti askorbat, glutation dan tokoperol yang berfungsi untuk mengatur tingkat keaktifan oksigen pada jaringan tanaman (Bosch and Alegre, 2002).
Enzim Peroksidase
peroksida dan selanjutnya terurai menjadi senyawa produk oksidasi sekunder yang toksik (Dumet and Benson, 2000).
Gambar 2. Beberapa enzim antioksidan yang diproduksi tanaman untuk menghindari dampak ROS (Pessarakli, 2011)
Molekul-molekul toksik tersebut dibatasi jumlahnya di dalam sel oleh sejumlah enzim. Superoksida dipecahkan oleh SOD dimana dalam proses tersebut dihasilkan hidrogen peroksida (H2O2) yang kemudian diuraikan oleh peroksidase. Peroksidase memecahkan H2O2 menjadi air ketika mengoksidasi sejumlah substrat. Dengan demikian peroksidase adalah enzim golongan oksidoreduktase yang menggunakan H2O2 sebagai akseptor elektron untuk mengkatalis berbagai reaksi oksidatif. Peroksidase tanaman tersebar dalam jaringan tanaman dan terutama ditemukan pada peroksisom. Enzim peroksidase berkaitan erat dengan sejumlah proses fisiologi yang meliputi lignifikasi penyembuhan luka, oksidasi fenol, dan pertahanan terhadap patogen (Quiambao and Rojah, 2000).
Enzim Superoksida Dismutase
paling banyak dan ditemukan di sitosol, peroksisom, kloroplas dan apoplas. Fe-SOD banyak terdapat di plastida, Mn-SOD terdapat di matriks mitokondria dan peroksisom (Pessarakli, 2011).
Pada tanaman tahunan diketahui terdapat 3 bentuk SOD. Ketiga bentuk SOD ini berbeda dalam ko-faktor logam dan letaknya pada sub seluler. SOD yang terletak pada sitosol dan kloroplas yaitu CuZn- SOD, pada mitokondria yaitu Mn-SOD dan pada kloroplas yaitu Fe-SOD (Aroca et al., 2001).
Antioksidan Asam askorbat
Asam askorbat atau vitamin C merupakan salah satu bentuk antioksidan yang secara alami terdapat pada tumbuhan. Askorbat merupakan senyawa metabolit utama pada tumbuhan yang memiliki fungsi sebagai antioksidan, yang melindungi tanaman dari kerusakan oksidatif yang dihasilkan dari metabolisme aerobik, fotosintesis dan berbagai polutan (Smirnoff, 1996).
Aktivitas antioksidan asam askorbat dikaitkan dengan ketahanan tanaman terhadap stres oksidatif. Kemudian tingkat endogen asam askorbat menjadi sangat penting dalam regulasi perkembangan penuaan. Dapat disimpulkan bahwa tanaman yang disemprotkan asam askorbat dapat menunda penuaan daun dengan sistem peroksida atau fenolik atau askorbat yang terlibat dalam pengurangan ROS yang dihasilkan selama penuaan daun (Farouk, 2011).
mengatasi dampak buruk dari stres garam dikaitkan dengan stabilisasi dan perlindungan terhadap pigmen fotosintetik dan organ fotosintesis dari kerusakan oksidatif (Khan et al., 2006 ).
Asam salisilat
Asam salisilat (SA) merupakan hormon tanaman yang umum menghasilkan senyawa fenolik dan hormon tanaman endogen potensial yang memainkan peran penting dalam pertumbuhan dan perkembangan tanaman. Peran SA secara intensif dipelajari dalam respon tanaman terhadap cekaman biotik. Beberapa tahun terakhir keterlibatan SA dalam penanggulangan cekaman abiotik telah banyak diteliti (El Tayeb, 2005; Ahmad et al. 2011). Namun peran yang sebenarnya dari SA pada cekaman abiotik tetap belum terpecahkan. Beberapa metode aplikasi (merendam benih sebelum tanam, menambah solusi hidroponik, irigasi, atau penyemprotan dengan larutan SA) telah dilakukan untuk melindungi berbagai spesies tanaman terhadap stres abiotik dengan menginduksi berbagai proses yang terlibat dalam mekanisme toleransi stres (Horvath et al. 2007).
α- Tokoferol
Tokoferol dikenal sebagai vitamin E. Golongan senyawa ini mempunyai peranan penting terutama dikaitkan dengan sifatnya sebagai antioksidan (Winarno, 1992). Dalam proses melumpuhkan radikal bebas, tokoferol menjadi pelopor, diikuti oleh asam askorbat (Kumalaningsih, 2006).
Tokoferol biasanya terdapat dalam bentuk α-tokoferol, γ-tokoferol, dan
PENDAHULUAN
Latar Belakang
Kebutuhan kedelai dari tahun ke tahun terus meningkat. Permintaan kedelai meningkat pesat seiring dengan laju pertambahan penduduk dan meningkatnya kesadaran pentingnya nilai gizi bagi kesehatan. Tahun 2012-2014, rata-rata kebutuhan kedelai nasional sebesar 2.59 juta ton per tahun sedangkan rata-rata produksi dan produktivitas nasional per tahun, berturut-turut hanya sebesar 800.00 ton/ha dan 1.5 juta ton/ha (Bappenas, 2014). Hal ini menunjukkan bahwa terdapat kesenjangan antara produksi dengan kebutuhan. Kondisi tersebut mendorong pemerintah untuk meningkatkan produksi kedelai dalam negeri melalui strategi peningkatan produktivitas dan perluasan areal tanam terutama melalui pemanfaatan lahan-lahan marginal.
Lahan marginal dapat diartikan sebagai lahan yang memiliki mutu rendah karena memiliki beberapa faktor pembatas jika digunakan untuk suatu keperluan tertentu. Sebenarnya faktor pembatas tersebut dapat diatasi dengan penambahan biaya. Tanpa penambahan biaya yang berarti budidaya pertanian di lahan marginal tidak akan memberikan keuntungan (Yuwono, 2009).
Pengaruh salinitas pada tanaman sangat kompleks. Salinitas akan
menyebabkan stres ion, stres osmotik dan stres sekunder (Kusmiyati et al., 2009; Munns et al., 2006). Penelitian Christian (2016) pada F3
menunjukkan hasil bahwa tanaman dapat beradaptasi di tanah salin dan berproduksi di atas 12 biji per tanaman.
Cekaman salinitas juga menginduksi kerusakan oksidatif pada sel-sel tumbuhan dikatalisis oleh reaktif oksigen spesies (ROS). Salah satu upaya melindungi sel-sel tanaman dari efek kondisi stres adalah sistem antioksidan kompleks yang dibagi menjadi tiga kelompok yaitu 1) antioksidan larut lipid terasosiasi membran
(misalnya α-tokoferol dan ß-karoten), 2) reduktan larut air (misal glutation dan
askorbat), dan 3) enzim antioksidan (misal superoksida dismutase (SOD), katalase (CAT), peroksidase (POD) serta enzim-enzim siklus askorbat-glutation (Smirnoff, 1993). Wibowo (2016) melakukan analisis biokimia hasil persilangan F2 tanaman kedelai (Grobogan dengan Grobogan adaptasi salin) pada cekaman salinitas, hasilnya menunjukkan bahwa terjadi respon tanaman yang fluktuatif terhadap aktivitas enzim peroksidase dan superoksida dismutase.
memberikan respon penurunan fotosintesis dan meminimalkan kandungan Na+, Cl-, dan H2O2 di daun.
Oleh karena itu, peneliti tertarik melakukan penelitian pemberian beberapa jenis antioksidan terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai
berdasarkan aktivitas enzim peroksidase (POD) dan Superoksida Dismutase (SOD).
Tujuan Penelitian
Untuk mendapatkan dosis antioksidan yang terbaik terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai berdasarkan aktivitas enzim Peroksidase (POD) dan Superoksida Dismutase (SOD).
Hipotesis Penelitian
Hipotesis penelitian ini adalah
1. Ada pengaruh yang nyata antara aplikasi antioksidan dan kontrol terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai berdasarkan aktivitas enzim Peroksidase (POD) dan Superoksida Dismutase (SOD).
2. Ada pengaruh yang nyata aplikasi beberapa antioksidan terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai berdasarkan aktivitas enzim Peroksidase (POD) dan Superoksida Dismutase (SOD).
Kegunaan Penelitian
ABSTRAK
Lailasari Hutabarat, Pemberian Beberapa Jenis Antioksidan terhadap Peningkatan Ketahanan Salinitas pada Turunan F4 Kedelai Berdasarkan Aktivitas
Enzin Peroksidase (POD) dan Superoksida Dismutase (SOD). Dibimbing oleh Dr. Diana Sofia Hanfiah, SP., MP. dan Prof. Dr. Ir. Rosmayati, MS.
Peningkatan produksi kedelai dapat dilakukan dengan memanfaatan lahan marginal seperti lahan salin melalui pemanfaatan genotipe hasil persilangan antara toleran salin dengan berproduksi tinggi dan pemberian beberapa antioksidan yaitu asam askorbat, asam salisilat, dan α-tokoferol untuk melindungi sel-sel tanaman dari efek kondisi stres garam. Penelitian dilaksanakan di rumah plastik di lahan percobaan Fakultas Pertanian Universitas Sumatera Utara, analisis karakter fisiologi dan biokimia tanaman di Laboratorium Kultur Jaringan Tanaman USU, Balai Penelitian Sungei Putih, Laboratorium Sentral USU bulan Februari sampai Agustus 2016. Penelitian menggunakan Rancangan Acak Kelompok Satu Faktor yaitu perlakuan antioksidan dan perlakuan diulang dua kali.
Hasil analisis data menunjukkan bahwa perlakuan antioksidan tidak memberikan pengaruh yang nyata terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai. Secara deskriptif perlakuan asam askorbat 750 ppm memberikan rataan tertinggi terhadap klorofil daun dan bobot biji per tanaman, perlakuan asam salisilat 250 tertinggi pada enzim SOD, dan perlakuan asam salisilat 500 ppm tertinggi pada enzim POD.
ABSTRACT
Lailasari Hutabarat, Giving various type of antioxidant to Increase Resilience Salinity on Enzyme Activity Based F4 Soybean peroxidase (POD) and superoxide
dismutase (SOD). Supervisied by Dr. Diana Sofia Hanfiah, SP., MP. and Prof. Dr. Ir. Rosmayati, MS.
The production of soybean can be increased through a marginal land use such as saline land, using genotype as the result of crossing the high-production tolerant saline and giving various of antioxidant, such as ascorbic acid, salicylic acid, and alpha-tocopherol to protect the plant cells from the effect salt-stress. This research carried out in the plastic house in experimental field of Faculty of Agriculture University of North Sumatera, physiology and biochemistry analysis in Plant Tissue Culture Laboratory University of North Sumatera, Sungei Putih Research Center and Central Laboratory of University of North Sumatera on February – August 2016. And used factorial Randomized Block Design with one factor were antioxidant and two replications.
The results showed that antioxidants not significantly effect to the increase of tolerance salinity in the F4 generation of soybean. Descriptively, 750 ppm of ascorbic acid treatment has given the highest average to chlorophyll analysis and weight of seeds per sample, the highest treatment of 250 ppm of salicylic acid was to SOD enzyme, and the highest treatment of 500 ppm of salicylic acid was to POD enzyme.
PEMBERIAN BEBERAPA JENIS ANTIOKSIDAN TERHADAP PENINGKATAN KETAHANAN SALINITAS PADA TURUNAN F4 KEDELAI BERDASARKAN
AKTIVITAS ENZIM PEROKSIDASE (POD) DAN SUPEROKSIDA DISMUTASE (SOD)
SKRIPSI
OLEH:
LAILASARI HUTABARAT 120301217
PEMULIAAN TANAMAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
PEMBERIAN BEBERAPA JENIS ANTIOKSIDAN TERHADAP PENINGKATAN KETAHANAN SALINITAS PADA TURUNAN F4 KEDELAI BERDASARKAN
AKTIVITAS ENZIM PEROKSIDASE (POD) DAN SUPEROKSIDA DISMUTASE (SOD)
SKRIPSI
OLEH:
LAILASARI HUTABARAT 120301217
PEMULIAAN TANAMAN
Skripsi sebagai Salah Satu Syarat untuk Mendapatkan Gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara, Medan
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul Penelitian : Pemberian Beberapa Jenis Antioksidan terhadap Peningkatan Ketahanan Salinitas pada Turunan F4 Kedelai berdasarkan Aktivitas Enzim Peroksidase (POD) dan Superoksida Dismutase (SOD)
Nama : Lailasari Hutabarat
NIM : 120301217
Program Studi : Agroekoteknologi Minat : Pemuliaan Tanaman
Komisi Pembimbing
(Dr. Diana Sofia Hanafiah, SP., MP. ) (
Ketua Anggota
Prof. Dr. Ir. Rosmayati, MS.)
Mengetahui:
(Prof. Dr. Ir. T. Sabrina, MSc. Ketua Program Studi Agroekoteknologi
)
ABSTRAK
Lailasari Hutabarat, Pemberian Beberapa Jenis Antioksidan terhadap Peningkatan Ketahanan Salinitas pada Turunan F4 Kedelai Berdasarkan Aktivitas
Enzin Peroksidase (POD) dan Superoksida Dismutase (SOD). Dibimbing oleh Dr. Diana Sofia Hanfiah, SP., MP. dan Prof. Dr. Ir. Rosmayati, MS.
Peningkatan produksi kedelai dapat dilakukan dengan memanfaatan lahan marginal seperti lahan salin melalui pemanfaatan genotipe hasil persilangan antara toleran salin dengan berproduksi tinggi dan pemberian beberapa antioksidan yaitu asam askorbat, asam salisilat, dan α-tokoferol untuk melindungi sel-sel tanaman dari efek kondisi stres garam. Penelitian dilaksanakan di rumah plastik di lahan percobaan Fakultas Pertanian Universitas Sumatera Utara, analisis karakter fisiologi dan biokimia tanaman di Laboratorium Kultur Jaringan Tanaman USU, Balai Penelitian Sungei Putih, Laboratorium Sentral USU bulan Februari sampai Agustus 2016. Penelitian menggunakan Rancangan Acak Kelompok Satu Faktor yaitu perlakuan antioksidan dan perlakuan diulang dua kali.
Hasil analisis data menunjukkan bahwa perlakuan antioksidan tidak memberikan pengaruh yang nyata terhadap peningkatan ketahanan salinitas pada turunan F4 kedelai. Secara deskriptif perlakuan asam askorbat 750 ppm memberikan rataan tertinggi terhadap klorofil daun dan bobot biji per tanaman, perlakuan asam salisilat 250 tertinggi pada enzim SOD, dan perlakuan asam salisilat 500 ppm tertinggi pada enzim POD.
ABSTRACT
Lailasari Hutabarat, Giving various type of antioxidant to Increase Resilience Salinity on Enzyme Activity Based F4 Soybean peroxidase (POD) and superoxide
dismutase (SOD). Supervisied by Dr. Diana Sofia Hanfiah, SP., MP. and Prof. Dr. Ir. Rosmayati, MS.
The production of soybean can be increased through a marginal land use such as saline land, using genotype as the result of crossing the high-production tolerant saline and giving various of antioxidant, such as ascorbic acid, salicylic acid, and alpha-tocopherol to protect the plant cells from the effect salt-stress. This research carried out in the plastic house in experimental field of Faculty of Agriculture University of North Sumatera, physiology and biochemistry analysis in Plant Tissue Culture Laboratory University of North Sumatera, Sungei Putih Research Center and Central Laboratory of University of North Sumatera on February – August 2016. And used factorial Randomized Block Design with one factor were antioxidant and two replications.
The results showed that antioxidants not significantly effect to the increase of tolerance salinity in the F4 generation of soybean. Descriptively, 750 ppm of ascorbic acid treatment has given the highest average to chlorophyll analysis and weight of seeds per sample, the highest treatment of 250 ppm of salicylic acid was to SOD enzyme, and the highest treatment of 500 ppm of salicylic acid was to POD enzyme.
RIWAYAT HIDUP
Lailasari Hutabarat, lahir di Mela, 30 Mei 1994, anak dari U. Hutabarat (Alm) dan H. Panggabean merupakan anak ketujuh dari tujuh bersaudara.
Tahun 2012 penulis lulus dari SMA Negeri 1 Sibolga dan pada tahun yang sama diterima di Program Studi Agroekoteknologi Fakulas Pertanian USU melalui jalur Ujian Masuk Bersama (UMB) Reguler dan memilih minat Pemuliaan Tanaman.
Selama menjadi mahasiwa, penulis aktif sebagai pengurus Himpunan Mahasiswa Islam (HMI) Komisariat Fakultas Pertanian sebagai Sekretaris Umum periode 2015-2016, menjadi anggota Bidang Penelitian dan Pengembangan Himpunan Mahasiswa Agroekoteknologi (Himagrotek) periode 2014-2015, sebagai asisten praktikum di Laboratorium Biologi.
KATA PENGANTAR
Puji dan syukur penulis ucapkan kehadirat Allah SWT, atas Rahmat dan Hidayah-Nya sehingga penulis dapat menyelesaikan skripsi ini dengan baik dan tepat pada waktunya. Judul dari skripsi ini adalah “Pemberian Beberapa Jenis Antioksidan terhadap Peningkatan Ketahanan Salinitas pada Turunan F4 Kedelai Berdasarkan Aktivitas Enzin Peroksidase (POD) dan Superoksida Dismutase (SOD)”.
Pada kesempatan ini, penulis mengucapkan terima kasih kepada kedua orang tua penulis yang telah merawat dan mendidik penulis selama ini. Penulis juga mengucapkan terima kasih kepada Ibu Dr. Diana Sofia Hanafiah, SP., MP. selaku ketua komisi pembimbing dan Prof. Dr. Ir. Rosmayati, MS., selaku anggota komisi pembimbing yang telah membimbing dan memberikan kritik dan saran dalam penyelesaian skripsi ini.
Akhir kata penulis mengucapkan terima kasih. Semoga Skripsi ini dapat menjadi bahan informasi yang bermanfaat bagi pihak yang membutuhkan.
Medan, Oktober 2016
DAFTAR ISI
Pengaruh Salinitas terhadap Tanaman ... 7
Cekaman Oksidatif ... 9
Enzim Peroksidase ... 10
Enzim Superoksida Dismutase ... 11
Antioksidan ... 11
Asam Askorbat ... 12
Asam Salisilat ... 13
α- Tokoferol ... 14
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian ... 15
Bahan dan Alat ... 15
Metode Penelitian ... 16
Pelaksanaan Penelitian ... 17
Seleksi benih ... 17
Persiapan lahan ... 17
Persiapan media tanam ... 18
Analisis tanah ... 18
Penanaman ... 18
Pemupukan ... 18
Aplikasi antioksidan ... 19
Pemeliharaan ... 19
Penyiraman ... 19
Penyiangan ... 19
Pengajiran ... 19
Pengendalian hama dan penyakit ... 19
Pemanenan ... 20
Peubah Amatan ... 20
Kandungan klorofil daun (g/ml) ... 20
Aktivitas enzim superoksida dismutase (unit/µg protein) ... 20
Aktivitas enzim peroksidase (unit/µg protein) ... 20
Bobot biji per tanaman (g) ... 21
HASIL DAN PEMBAHASAN Hasil ... 22
Kandungan klorofil daun ... 22
Aktivitas enzim superoksida dismutase ... 23
Aktivitas enzim peroksidase ... 23
Bobot biji per tanaman... 23
DAFTAR GAMBAR
No. Hal.
DAFTAR TABEL
No. Hal.
1. Rataan kandungan klorofil daun ... 22
2. Rataan Enzim SOD ... 22
3. Rataan Enzim POD ... 23
DAFTAR LAMPIRAN
No. Hal.
1. Bagan Alur Penelitian ... 33
2. Alur Penelitian Mendapatkan Progeni F4 ... 34
3. Tahapan Analisis Klorofil Daun ... 35
4. Tahapan Analisis Enzim Superoksida Dismutase ... 35
5. Tahapan Analisis Kandungan Protein Terlarut Daun ... 36
6. Tahapan Analisis Enzim Peroksidase ... 37
7. Pembuatan Larutan Stok dan Buffer ... 37
8. Deskripsi Kedelai Varietas Grobogan ... 39
9. Deskripsi Kedelai Varietas Anjasmoro ... 40
10. Bagan Penanaman pada Petak ... 41
11. Bagan Petak Penelitian ... 42
12. Analisis Tanah I ... 43
13. Data Pengamatan Klorofil a ... 44
14. Data Pengamatan Klorofil b ... 45
15. Data Pengamatan Klorofil b setelah Ditransformasi √X+0,5 ... 46
16. Data Pengamatan Klorofil Total ... 47
17. Data Pengamatan Klorofil Total setelah Ditransformasi √X+0,5 ... 48
18. Data Pengamatan Enzim SOD ... 49
19. Data Pengamatan Enzim SOD setelah Ditransformasi √X+0,5 ... 50
20. Data Pengamatan Enzim POD ... 51
22. Data Pengamatan Protein ... 53 23. Data Pengamatan Bobot Biji per Tanaman ... 54 24. Data Pengamatan Bobot Biji per Tanaman setelah