PENINGKATAN KERAGAMAN GENETIK KOPI ARABIKA
DAN DETEKSI DINI KERAGAMAN SOMAKLONAL
MENGGUNAKAN SSR
MEYNARTI SARI DEWI IBRAHIM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa disertasi berjudul Pengembangan Metode Embriogenesis Somatik, Peningkatan Keragaman Genetik Kopi Arabika dan Deteksi Dini Keragaman Somaklonal Menggunakan SSR adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka pada setiap bagian disertasi ini.
Dengam ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Meynarti Sari Dewi Ibrahim
MEYNARTI SARI DEWI IBRAHIM. Pengembangan Metode Embriogenesis Somatik, Peningkatan Keragaman Genetik Kopi Arabika dan Deteksi Dini Keragaman Somaklonal Menggunakan SSR. Dibawah bimbingan SUDARSONO sebagai ketua, AGUS PURWITO dan RUBIYO sebagai anggota.
Tanaman kopi (Coffea ssp.) merupakan salah satu bahan minuman penyegar yang paling banyak diminati dan dikomsumsi di dunia. Diantara 103 species kopi, kopi Arabika memiliki kualitas cita rasa yang lebih baik, sehingga dalam dunia perdagangan harganya selalu lebih tinggi. Salah satu kendala dalam tata niaga kopi Arabika adalah produktivitas masih rendah jika dibandingkan dengan negara Brasil dan Vietnam. Beberapa kendala yang dihadapi dalam peningkatan produktivitas tanaman kopi adalah penggunaan bibit asalan, rendahnya kesadaran penggunaan benih unggul, sebagian besar tanaman masih dalam kondisi tua dan rusak, budidaya tanaman yang belum sesuai standar teknis, dan perakitan bibit unggul baru yang lama.
Penggunaan bibit asalan pada petani dapat terjadi karena keterbatasan dalam penyediaan bibit unggul. Perbanyakan klon kopi Arabika terkendala dalam ketersediaan tunas autotrof sebagai sumber bahan tanaman yang akan diperbanyak, sementara perakitan genotipe terkendala oleh keragaman genetik yang rendah dan waktu program pemuliaan yang lama.
Penggunaaan metode embriogenesis somatik untuk tujuan perbanyakan klonal dengan biaya produksi yang lebih rendah memerlukan penelitian tersendiri, karena keberhasilannya masih tergantung genotipe dan jenis media yang digunakan. Selain untuk perbanyakan tanaman, metode embriogenesis somatik juga dapat digunakan untuk mempercepat perakitan genotipe unggul, salah satunya adalah dengan meningkatkan keragaman genetik melalui mutasi. Selain untuk meningkatkan keragaman genetik (melengkapi plasma nutfah yang sudah ada), mutasi juga dapat digunakan untuk mendapatkan sifat tertentu yang sebelumnya belum ada.
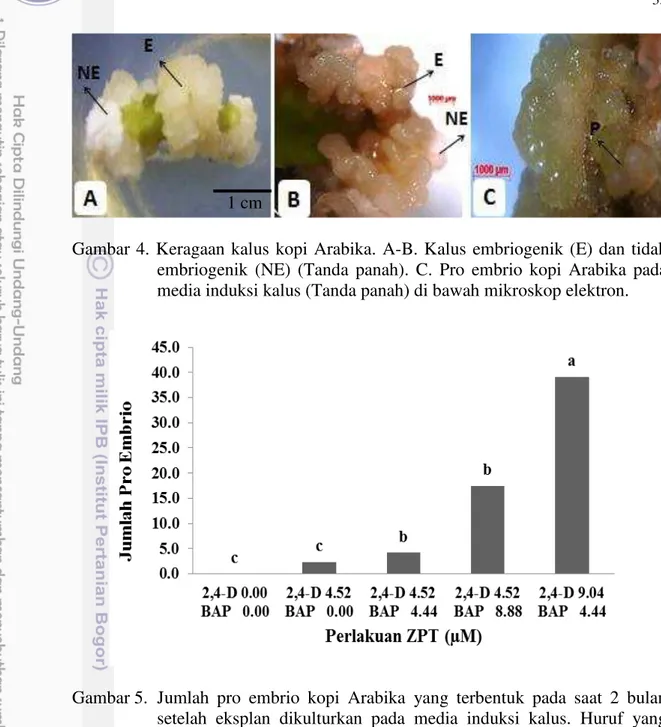
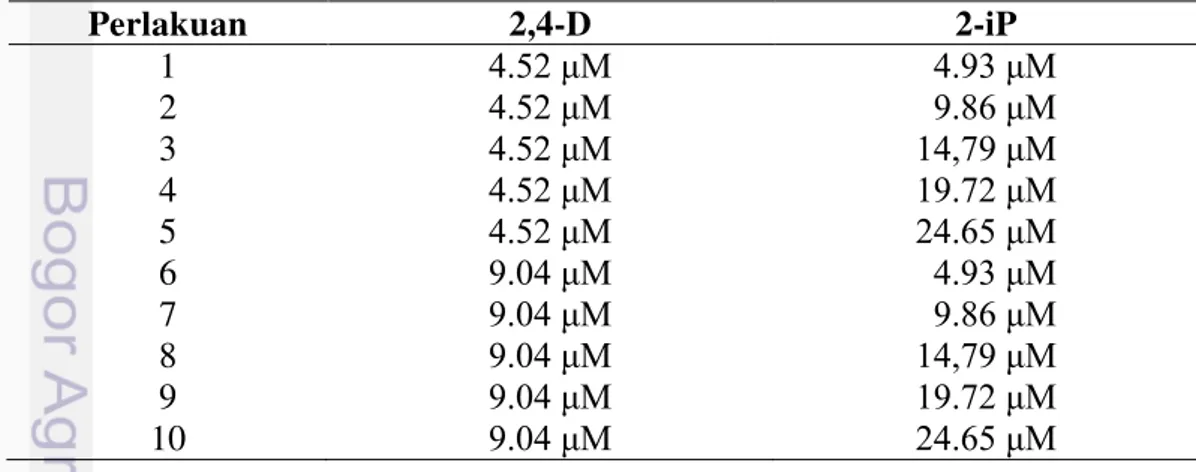
2,4-D 8.88 µM dan BAP 4.44 µM. Studi awal menunjukkan bahwa kalus yang mampu beregenerasi hanya berasal dari media kombinasi 2,4-D 4.52 µM dan BAP 8.88 µM dengan persentase yang masih rendah (16,67 %).
Penelitian lanjutan menggunakan 2,4-D yang dikombinasikan dengan Thidiazuron menunjukkan bahwa 2,4-D 2.26 µM + Thidiazuron 4.54 µM dan 9.08 µM menghasilkan embriogenesis langsung, sementara 2,4-D 4.52 µM + Thidiazuron 9.08 µM dan 2,4-D 9.04 µM + Thidiazuron 9.08 µM menghasilkan embriogenesis tidak langsung. Persentase eksplan berkalus, berat basah kalus, jumlah embrio globular dan torpedo terbanyak pada kombinasi 2,4-D 9.04 µM + Thidiazuron 9.08 µM.
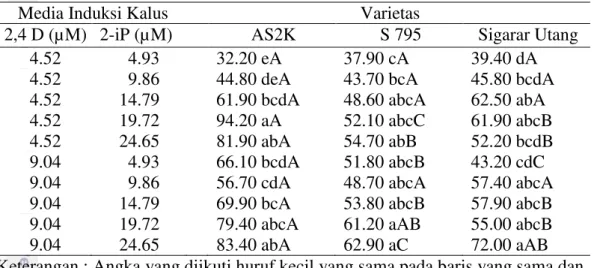
Penelitian yang mengarah pada embriogenesis tidak langsung untuk mendapatkan embrio somatik sekunder diperluas dengan meningkatkan selang konsentrasi Thidiazuron pada beberapa genotipe kopi Arabika. Hasilnya menunjukkan bahwa genotipe dan perlakuan zat pengatur tumbuh memberikan pengaruh yang nyata terhadap bobot basah, jumlah embrio torpedo dan planlet yang dihasilkan, namun tidak berpengaruh nyata terhadap persentase pembentukan kalus. Media induksi kalus terbaik yang dapat digunakan untuk perbanyakan tanaman tergantung genotipe yang digunakan. Persentase dan jumlah embrio somatik sekunder terbanyak dihasilkan dari perlakuan thidiazuron 9.08 µM. Morphogenesis dan histologi dari embriogenesis somatik kopi Arabika dengan perlakuan 2,4-D dan Thidiazuron terlihat normal dimana embrio globular, torpedo, dan kecambah sesuai dengan perkembangan embriogenesis somatik kopi. Mahalnya harga thidiazuron menjadi suatu alasan untuk mengganti Thidiazuron dengan 2-iP. Sejalan dengan perlakuan 2,4-D dan Thidiazuron di bab sebelumnya, pemberian2,4-D dan 2-iP juga memperlihatkan bahwa media induksi embriogenesis somatik tergantung pada genotipe. Kombinasi media 2,4-D 4.52 µM dan 2-iP 19.72 µM merupakan media terbaik untuk genotipe AS2K, sementara genotipe S-795 dan Sigarar Utang memiliki media terbaik pada 2,4-D 4.52 µM dan 2-iP 14.79 µM. Penambahan BAP 17.76 µM menghasilkan persentase tertinggi jumlah embrio somatik sekunder. Aklimatisasi dilakukan menggunakan beberapa kombinasi komposisi media tanam, dimana hasil terbaik ditemukan pada media tanam yang terdiri dari arang sekam, pupuk kandang dan pasir. Analisis SSR yang dilakukan pada sampel DNA yang berasal dari planlet genotipe AS2K menunjukkan variasi somaklonal tidak ditemukan.
Penelitian yang mengkaji kemungkinan penggunaan gula pasir dan agar komersial dalam embiogenesis somatik kopi Arabika, mengindikasikan bahwa dalam pendewasaaan embriogenesis somatik penggunaan sukrosa dan phytagel tidak dapat digantikan gula pasir dan agar komersial. Gula pasir hanya dapat diaplikasikan untuk media perkecambahan dimana hasilnya tidak berbeda dengan sukrosa.
Lethal concentration 20 kalus kopi Arabika yang mampu bergenerasi berada pada konsentrasi 0.38%, dan LC 50 pada konsentrasi 0.65%. Pemberian mutagen kimia EMS pada media mempengaruhi proses embriogenesis somatik kopi Arabika, yang berarti bahwa EMS dapat menghasilkan mutan pada kopi Arabika. Ini terlihat pada perubahan pola pita DNA pada ssr CMA 198, ssr M312 dan satu primer EST CS.
MEYNARTI SARI DEWI IBRAHIM. The Development of Somatic Embryogenesis Method, Improvement of Genetic Diversity and Early Detection of Somaclonal Variation of Coffea arabica L Using SSR Marker. Supervised by SUDARSONO as chairman, AGUS PURWITO and RUBIYO as members of advisory committee.
Coffee (Coffea spp.) is one of the most demanded ingredients for beverage and consumed around the world. Among 103 species of coffee, Arabica coffee has a better taste quality, hence having better price in the world market. One of the problems in the market system of Arabica coffee in Indonesia is its lower productivity than to that in Brazil and Vietnam. Constraint to increase its productivity is the use of low quality of seedling as planting material, lack of awareness to use superior genotype, most plants in the field are old and damaged, inappropriate cultivation technology and required long term to assembly new superior genotypes.
The use of low quality of seedling by farmers caused by limited good quality seeds. Clonal propagation of Arabica coffee also hindered by the limited availability of autotroph shoots as a source of planting material and type of planting media use in propagation. On the other hand, genotype assembly has a problem related to low genetic diversity and lengthy breeding program.
The use of somatic embryogenesis methods for clonal propagation with low production costs required a specific study since its success still depends on genotype and planting media. However, somatic embryogenesis method can accelerate the assembly of superior genotype to increase genetic diversity through mutation. Furthermore, mutation can be used to obtain new specific desired characters.
The main objectives of this study were to obtain seedling multiplication method of Arabica coffee using somatic embryogenesis and to improve genetic diversity of Arabica coffee through somaclonal variation induction by Ethyl Methane Sulfonate. Thus, a series of studies consisted of 5 activities have been conducted: (1) Embryogenic Callus Induction and Regeneration of Arabica Coffee, (2) Induction of Direct and Indirect Somatic Embryogenesis Using 2,4-D and Thidiazuron on Some Genotypes of Arabica Coffee, (3) The Usage of Alternative Plant Growth Regulator on Callus Induction Media to Support the Development of Primary and Secondary Somatic Embryogenesis of Arabica Coffee. (4) The Effeciency of Sucrose and Phytagel Application and the Possibility to Utilize Temporary Immersion System on Arabica Coffee Propagation and (5) Genetic variability improvement of Arabica coffee with Ethyl Methane Sulfonate (EMS).
The results showed that the embryogenic calli was successfully induced from leaf explants of Arabica coffee. All 2,4-D treatments combined with BA could form callus. The highest callus weight, percentage of embryogenic callus, and proembryo number was at 8.88 μM 2,4-D and BAP 4.44 μM treatments.
2,4-D 2.26 µM + Thidiazuron 4.54 µM and 9.08 µM generated direct embryogenesis, whereas 2,4-D 4.52 µM + Thidiazuron 9.08 µM and 2,4-D 9.04 µM + Thidiazuron 9.08 µM produced indirect embryogenesis. The highest callused-explant, callus fresh weight and the number of globular and torpedo embryos were produced by 2,4-D 9.04 µM + Thidiazuron 9.08 µM.
Further research to get secondary somatic embryo from indirect embryogenesis was performed by extending the range of Thidiazuron concentration on some genotypes of Arabica coffee. The result showed that genotypes and plant growth regulator concentration gave significant effect to fresh weight, number of torpedo embryos and planlets. However, it had no significant effect to the percentage of callus formation. The best callus induction media for plant propagation depended on the genotypes. The highest percentage and number of secondary somatic embryos were generated from Thidiazuron 9.08 µM treatment. Morphogenesis and histology of somatic embryogenesis of Arabica coffee treated with 2,4-D and Thidiazuron presented normal indicated by development process of globular embryo, torpedo, and planlets commonly occurred on somatic embryogenesis of coffee.
The expensive price of Thidiazuron can be anticipate by applying 2-iP as subsitute. The similar result was shown by 2,4-D and 2-iP application that induction media for somatic embryogenesis depended on genotype. The 2,4-D 4.52 µM and 2-iP 19.72 µM media was the best media for AS2K genotype. However, the best media for S-795 and Sigarar Utang was 4.52 µM 2,4-D and 14.79 µM 2-iP. The addition of BAP 17.76 μM resulted in the highest percentage of the secondary somatic embryos. The best media for acclimatization was the combination of charcoal, manure and sand. SSR analysis on DNA sample from AS2K genotype plantlets indicated no somaclonal variation.
The study to test the possibility to use sugar and commercial gel in somatic embryogenesis of Arabica coffee indicated that sugar and commercial gel could not substitute sucrose and phytagel in maturity phase of somatic embryo. However, sugar can be applied in germination media since the results showed no differences with sucrose.
The Lethal Concentration 20 (LC 20) of Arabica coffee callus capable to regenerate was on EMS 0.38%, while LC 50 was 0.65% EMS, soaking for 3 hours. The application of chemical mutagen EMS affected the process of somatic embryogenesis on Arabica coffee. This suggested EMS can generate mutants in Arabica coffee, shown by changes in DNA pattern at ssr CMA 198, ssr M312 and one primary of CS EST.
Hak Cipta milik IPB, tahun 2015
Hak Cipta dilindungi oleh Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PENINGKATAN KERAGAMAN GENETIK KOPI ARABIKA
DAN DETEKSI DINI KERAGAMAN SOMAKLONAL
MENGGUNAKAN SSR
MEYNARTI SARI DEWI IBRAHIM
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor
pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : - Dr Ir Diny Dinarti MSi
- Dr Ir Ali Husni MSi
Penguji pada Sidang Promosi : - Dr Ir Diny Dinarti MSi
Syukur Alhamdulillah penulis panjatkan ke hadirat Allah SWT atas segala petunjuk dan karunia-Nya sehingga disertasi ini dapat diselesaikan. Disertasi ini mengangkat topik mengenai Pengembangan Metode Embriogenesis Somatik, Peningkatan Keragaman Genetik Kopi Arabika dan Deteksi Dini Keragaman Somaklonal Menggunakan SSR.
Ucapan terima kasih dan penghargaan yang setinggi-tingginya penulis sampaikan kepada Prof.Dr. Ir. Sudarsono MSc, Dr Ir. Agus Purwito MSc.Agr., dan Dr.Ir. Rubiyo MSi sebagai komisi pembimbing yang telah mencurahkan waktu dan ilmunya selama penulisan proposal sampai disertasi ini dapat terselesaikan. Kepada penguji luar komisi, Dr.Ir. Diny Dinarti MSi dan Dr. Ir. Ade Wahyar MS (pada ujian Prakualifikasi Doktor), Dr.Ir. Diny Dinarti MSi dan Dr. Ir Ali Husni MSi (pada Ujian Tertutup) serta Dr.Ir. Diny Dinarti MSi dan Prof(R) Dr.Ir. Risfaheri MS (pada Ujian Terbuka) juga penulis sampaikan terima kasih.
Ucapan terima kasih juga penulis sampaikan kepada Dr.Ir.Rr. Sri Hartati MP, Dr. Reflinur, SP. MSi, Prof (R) Dr.Ir. Supriadi MSc, Dr. Ir. Dono Waluyo MSc, dan Prof (R) Dr.Ir Ika Mariska yang telah memberikan dukungan dan pemahaman semasa penelitian. Penulis juga mengucapkan terima kasih kepada Badan Litbang Pertanian yang telah memberikan kesempatan untuk mendapatkan beasiswa pendidikan program doktor dan atas dukungan dana penelitian melalui dana APBN Pusat Penelitian dan Pengembangan Tanaman perkebunan.
Terima kasih juga ditujukan kepada teman-teman sejawat di Balai Penelitian Tanaman Industri dan penyegar, Pusat Penelitian dan Pengembangan Tanaman Perkebunan, Laboratorium Unit Pengembangan Benih Unggul Pertanian (Badan Litbang Pertanian), Laboratorium Biologi Melekular (BB-BIOGEN), Laboratorium Biologi Molekuler Tanaman (IPB), dan Laboratorium Anatomi dan Histologi (LIPI). Kepada teman-teman seperjuangan mahasiswa pascasarjana IPB program studi PBT 2010 (Ismail Maskromo, MSi, Sri Suhesti, MP, Dr. Mia Kosmiatin, Laela Sari, MSi, Nur Ajijah, MSi, Azri Kusuma Dewi, MSi, Dr. Roberdi MSi, Dyah Retno W, MSi, Dr. Arvitta Netty S, MP, Redy Gaswanto, MP, Dr. Parli H Sinaga, MP, Jollanda Effendi, MSc. Kawan-kawan AGH 2010 (Dr. Muhammad Thamrin, Dr. Siti Maryam H, Aris Akhsarah, MP, Odit Ferry, MSi dan Dewi Erika MP. Serta ITB 2010 (Dr. Pepi Nur Susilawati), teman-teman Pascasarjana PS AGH, PBT, ITB (2011 dan 2012) terima kasih atas semangat kebersamaan, pertemanan dan saling berbagi demi kemajuan studi. Semoga persahabatan yang terjalin selama menempuh pendidikan di Sekolah Pascasarjana IPB tetap terjalin dengan baik sampai masa datang.
penulis ucapkan terima kasih, Insyaallah Allah Subhanahu wa Ta’ala membalas
semua kebaikan yang telah diberikan. Penulis berharap semoga karya ini bermanfaat bagi perkembangan ilmu pengetahuan, Amin.
Bogor, Agustus 2015
Halaman
DAFTAR TABEL ..……… xix
DAFTAR GAMBAR ………... xxi
DAFTAR LAMPIRAN ………... xxiii
1. PENDAHULUAN………... 1
Latar Belakang ………... 1
Perumusan Masalah ... 2
Tujuan Penelitian ………... 3
Manfaat Penelitian ………... 4
Hipotesis Penelitian ... 4
Kebaruan (Novelty)... 4
Ruang Lingkup Penelitian... 5
Daftar Pustaka ... 7
2. TINJAUAN PUSTAKA.………... 9
Tanaman Kopi Arabika (Coffea arabica) ……….. 9
Kultur In Vitro Tanaman Kopi... 11
Embriogenesis dan Faktor yang Mempengaruhinya ....……... 13
Aplikasi Penggunaan Mutagenesis Secara In vitro ……….... 14
Induksi Mutasi menggunakan EMS (Ethyl Methane Sulfonate) ……. 15
Penggunaan Single Sequence Repeats (SSR) dalam Identifikasi Varian 17 Daftar Pustaka... 19
3. INDUKSI KALUS EMBRIOGENIK DAN DAYA REGENERASI KOPI ARABIKA ... 27 Abstrak ………... 27
Pendahuluan ………... 29
Bahan dan Metoda ……….. 30
Hasil dan Pembahasan ……… 31
Simpulan ………. 35
Daftar Pustaka ... 36
4. INDUKSI EMBRIOGENESIS SOMATIK LANGSUNG DAN TIDAK LANGSUNG MENGGUNAKAN 2,4-D DAN THIDIAZURON PADA BEBERAPA GENOTIPE KOPI ARABIKA... 39 Abstrak……….... 39
Pendahuluan……… 41
Bahan dan Metode……….. 42
Hasil dan Pembahasan………. 45
Simpulan……….. 58
5. PENGGUNAAN ZAT PENGATUR TUMBUH ALTERNATIF PADA
MEDIA INDUKSI KALUS UNTUK MENDUKUNG
PERKEMBANGAN EMBRIOGENESIS SOMATIK PRIMER DAN SEKUNDER KOPI ARABIKA...
61
Abstrak………. 61
Pendahuluan………. 63
Bahan dan Metode………... 64
Hasil dan Pembahasan………. 67
Simpulan……….. 80
Daftar Pustaka... 80
6. EFISIENSI PENGGUNAAN SUKROSA DAN PHYTAGEL SERTA PELUANG PENGGUNAAN TEMPORARY IMMERSION SYSTEM PADA PERBANYAKAN KOPI ARABIKA... 83 Abstrak……… 83
Pendahuluan……… 85
Bahan dan Metode……….. 86
Hasil dan Pembahasan………. 87
Simpulan……….. 96
Daftar Pustaka... 97
7. PENINGKATAN KERAGAMAN GENETIK KOPI ARABIKA DENGAN ETHYL METHANE SULFONATE ………... 99 Abstrak……… 99
Pendahuluan……….... 101
Bahan dan Metode……….. 102
Hasil dan Pembahasan……… 105
Simpulan………. 112
Daftar Pustaka... 112
8. PEMBAHASAN UMUM... 115
Daftar Pustaka... 119
9. SIMPULAN UMUM DAN SARAN... 121
Halaman 1 Kombinasi zat pengatur tumbuh 2,4-D dan Thidiazuron... 44 2 Respon empat varietas kopi Arabika dalam membentuk kalus dan
bobot basah kalus di media induksi kalus lanjutan pada 3 BSK... 51 3 Respon perlakuan media induksi kalus dalam membentuk kalus dan
bobot basah kalus kopi Arabika di media induksi kalus lanjutan pada 3 BSK...
51
4. Respon interaksi empat varietas kopi Arabika dan media induksi kalus dalam menghasilkan jumlah torpedo di media regenerasi pada 8 BSK...
54
5. Respon interaksi empat varietas kopi Arabika dan media induksi kalus dalam menghasilkan jumlah kecambah di media regenerasi pada 10 BSK...
54
6 Persentase pembentukan embrio somatik sekunder kopi Arabika
pada media padat dan semi padat... 57 7 Rataan jumlah embrio somatik sekunder kopi Arabika yang
dihasilkan pada media padat dan semi padat dengan perlakuan sitokinin...
57
8 Kombinasi perlakuan sel pengatur tumbuh 2,4-D dan 2-iP... 65 9 Respon perlakuan media induksi kalus dalam membentuk kalus dan
bobot basah kalus kopi Arabika di media induksi kalus lanjutan pada 3 BSK...
68
10 Respon perlakuan media induksi kalus dalam membentuk kalus dan bobot basah kultur kopi Arabika di media induksi kalus lanjutan pada 4 BSK...
68
11 Respon interaksi tiga varietas kopi Arabika pada media induksi kalus dalam menghasilkan jumlah torpedo di media regenerasi pada 8 BSK...
69
12 Respon interaksi tiga varietas kopi Arabika dan media induksi kalus dalam menghasilkan jumlah kecambah di media regenerasi pada 10 BSK...
69
13 Pengaruh perlakuan media induksi dalam membentuk embrio somatik sekunder (ESS) kopi Arabika 2 bulan setelah kultur... 73 14 Pengaruh perlakuan media induksi dalam membentuk embrio somatik
sekunder (ESS) kopi Arabika 4 bulan setelah kultur... 74 15 Persentase keberhasilan aklimatisasi planlet kopi Arabika 6 minggu
setelah aklimatisasi... 75 16 Rataan pertambahan tinggi tanaman kopi Arabika 3 bulan setelah
aklimatisasi... 76 17 Rataan pertambahan jumlah daun kopi Arabika 3 bulan setelah
aklimatisasi... 76 18 Rataan pertambahan jumlah buku kopi Arabika 3 bulan setelah
aklimatisasi... 76 19 Daftar primer SSR yang digunakan dalam mendeteksi variasi
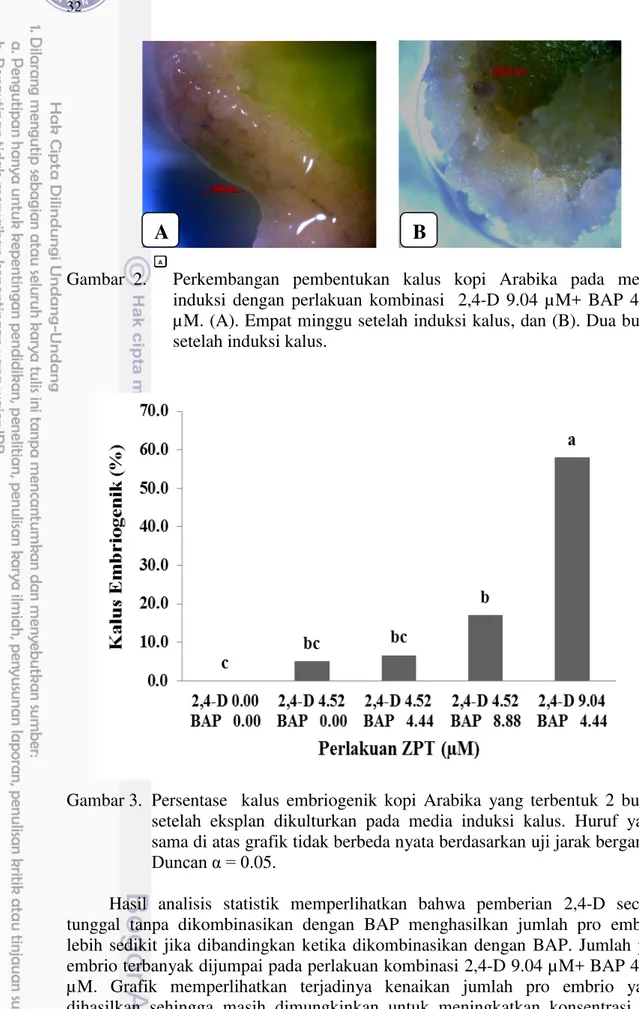
Halaman 1 Diagram alir penelitian... 6 2 Perkembangan pembentukan kalus kopi Arabika pada media induksi
dengan perlakuan kombinasi 2,4-D 9.04 µM+ BAP 4.44 µM. ... 32 3 Persentasi kalus embriogenik kopi Arabika yang terbentuk 2 bulan
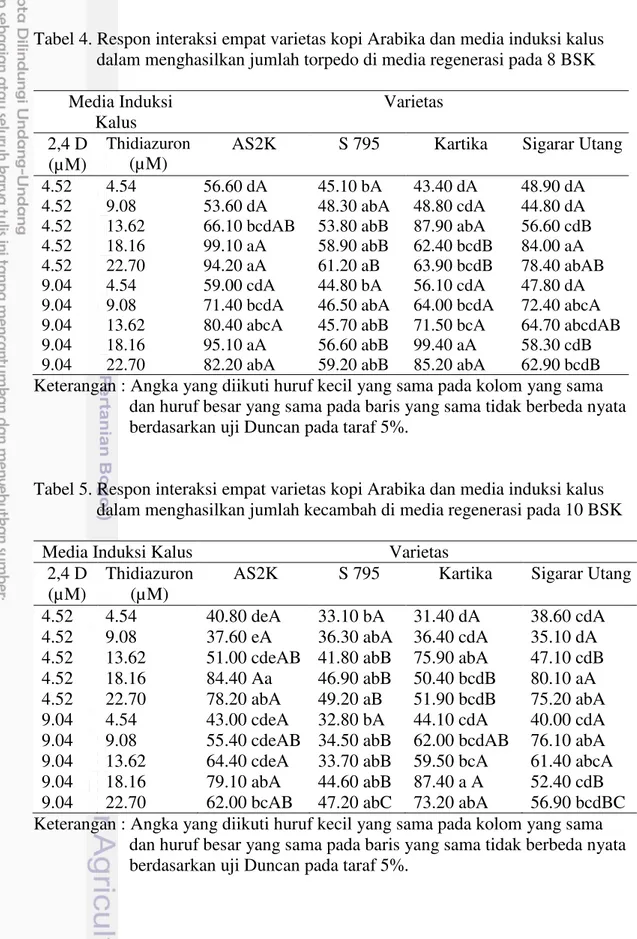
setelah eksplan dikulturkan pada media induksi kalus... 32 4 Keragaan kalus embriogenik, tidak embriogenik dan pro embrio kopi
Arabika pada media induksi kalus di bawah mikroskop ... 33 5 Rataan jumlah pro embrio kopi Arabika yang terbentuk pada saat 2
bulan setelah eksplan dikulturkan pada media induksi kalus... 33 6 Bobot basah kalus kopi Arabika yang terbentuk pada saat 2 bulan
setelah eksplan dikulturkan pada media induksi kalus... 34 7 Keragaan kecambah kopi Arabika yang terbentuk melalui proses
embriogenesis somatik... 35 8 Jumlah kecambah kopi Arabika yang terbentuk pada saat 10 bulan di
media regenerasi...…... 35 9 Keragaan kalus Kopi Arabika pada media induksi kalus lanjutan... 45 10 Rataan pertambahan bobot basah eksplan kopi Arabika setelah
dikulturkan selama 1 bulan di dalam media induksi kalus awal... 46 11 Rataan persentase eksplan kopi Arabika membentuk kalus dalam
media induksi kalus lanjutan 4 bulan setelah kultur... 47 12 Keragaan perkembangan embriogenesis tidak langsung kopi
Arabika... 48 13 Keragaan perkembangan embriogenesis somatik langsung kopi
Arabika. ... 48 14 Rataan jumlah embrio globular dan torpedo kopi Arabika melalui jalur
embriogenesis tidak langsung ... 48 15 Rataan jumlah kecambah kopi Arabika melalui jalur embriogenesis
tidak langsung setelah 4 bulan dalam media regenerasi... 49 16 Rataan jumlah embrio globular dan torpedo kopi Arabika melalui
jalur embriogenesis langsung setelah 3 bulan dalam media regenerasi... 49 17 Rataan jumlah torpedo, kecambah dan planlet kopi Arabika melalui
jalur embriogenesis langsung... 50 18 Keragaan morphologi kecambah kopi Arabika dari berbagai perlakuan
2,4-D dan Thidiazuron... 53 19 Perkembangan embriogenesis tidak langung kopi arabika
varietasAS2K pada media perlakuan 2,4-D dan Thidiazuron. (A). Embrio globular dan awal hati, (B). Hati, (C) Embrio memanjang (elongated embryo). (D).Torpedo, (E) Awal kotiledonari dan (F) planlet...
56
20 Keragaan embrio somatik sekunder kopi Arabika. A. Fase Globolar. B.Fase torpedo. C. Fase Kotiledonari...
57 21 Keragaan jumlah kecambah kopi Arabika dari berbagai perlakuan
2,4-D dan 2-iP... 70 22 Tahapan morphogenesis embriogenesis tidak langsung kopi Arabika
varietas AS2K pada media 2,4-D dan 2-iP dari eksplan daun sampai terbentuknya planlet kopi arabika...
Arabika... 24 Histologi perkembangan embriogenesis kopi Arabika…... 72 25 Keragaan Embriogenesis Somatik Sekunder kopi Arabika. ... 74 26 Tahapan aklimatisasi kopi Arabika hasil embriogenesis somatik ... 77 27 Hasil amplifikasi DNA kopi arabiaka hasil embriogenesis somatik
pada 10 primer yang diuji. ... 79 28 Rataan berat kalus kopi Arabika dalam media regenerasi 3 bulan
setelah kultur... 88 29 Rataan jumlah torpedo kopi Arabika dalam media regenerasi 6 bulan
setelah kultur... 88 30 Rataan jumlah torpedo, kecambah dan planlet kopi Arabika 4 bulan
setelah kultur... 89 31 Rataan karakter agronomi tinggi (cm), panjang akar (cm), jumlah
daun, jumlah buku, dan jumlah akar planlet kopi Arabika 4 bulan setelah kultur...
90
32 Rataan tinggi (cm), panjang akar (cm), jumlah daun, jumlah buku, dan jumlah akar planlet kopi Arabika 6 bulan setelah kultur...
91 33 Keragaan planlet kopi Arabika 6 bulan setelah perlakuan.
menggunakan sukrosa dan phytagel, menggunakan sukrosa dan phytagel (semi solid), gula pasir dan phytagel dan gula biasa agar swallow...
92
34 Jumlah planlet yang dihasilkan pada Alat RITA 3 bulan setelah kultur.. 93 35 Keragaan rataan karakter agronomi kopi Arabika 3 bulan di RITA... 94 36 Keragaan rataan karakter agronomi kopi Arabika 5 bulan di RITA... 95 37 Keragaan perkecambahan embriogenesis somatik kopi Arabika
memakai RITA... 96 38 Persentase penurunan jumlah kalus kopi Arabika yang hidup setelah
perlakuan EMS... 105 39 Rataan bobot basah kalus kopi Arabika yang hidup setelah diberi
perlakuan EMS... 106 40 Rataan jumlah torpedo kopi Arabika setelah diberi perlakuan EMS... 106 41 Grafik persentase kalus kopi Arabika yang mampu beregenerasi pada
beberapa konsentrasi EMS dengan lama perendaman 3 jam... 107 42 Keragaan jumlah torpedo kopi Arabika setelah diberi perlakuan
EMS... 107 43 Rataan jumlah kecambah kopi Arabika setelah diberi perlakuan
EMS... 118 44 Rataan jumlah planlet kopi Arabika setelah perlakuan EMS... 108 45 Keragaan planlet kopi Arabika hasil mutasi dengan EMS 3 jam. A.
Kontrol [Tampa EMS]. B. EMS 0.2%. C. EMS 0.4%. D. EMS 0.6%. E. EMS 0.8%...
109
46 Hasil amplifikasi DNA kopi Arabika hasil mutasi dengan EMS yang menunjukkan pola pita yang berbeda...
1. PENDAHULUAN
Latar Belakang
Tanaman kopi (Coffea spp.) merupakan salah satu tanaman perkebunan yang mempunyai peranan penting dalam perekonomian nasional. Kontribusi komoditas kopi terhadap ekonomi nasional antara lain ; sebagai sumber devisa negara, pencipta lapangan kerja, pembangunan wilayah, pendorong agribisnis dan agroindustri, dan pendukung konservasi lingkungan (Aryani 2013).
Sebagai salah satu bahan minuman penyegar yang paling banyak diminati dan dikomsumsi di dunia, pasar kopi menjadi sangat dinamis. Ekspor kopi Indonesia pada tahun 2013 tercatat sebanyak 448,6 ribu ton dengan nilai US$ 1.249,5 juta. Angka tersebut menempatkan Indonesia menjadi eksportir ketiga terbesar setelah Brasil dan Vietnam (Aryani 2013 ; Wijayadi 2013).
Kopi mempunyai 103 species, akan tetapi yang banyak dibudidayakan hanya dua yaitu; kopi Arabika (Coffea arabica) dan kopi Robusta (Coffea canephora) (Priyono, 2013). Kopi Arabika memiliki kualitas cita rasa yang lebih baik dibandingkan kopi Robusta, sehingga dalam dunia perdagangan harganya selalu lebih tinggi. Bertolak belakang dengan kebutuhan dunia, ekspor kopi Indonesia justru didominasi oleh kopi Robusta (80-90%) dan hanya sebagian kecil kopi Arabika (10-20 %) (AEKI 2015).
Perbanyakan kopi Arabika umumnya dilakukan secara generatif menggunakan biji, atau secara vegetatif menggunakan stek dan sambung pucuk. Perbanyakan dengan kedua cara tersebut masih mempunyai kendala dalam penyediaan benih. Perbanyakan menggunakan biji tidak menjamin benih yang dihasilkan akan sama dengan induknya, karena meskipun penyerbukan kopi Arabika bersifat menyerbuk sendiri, masih mempunyai peluang terjadinya penyerbukan silang dengan angka yang bervariasi. Perbanyakan vegetatif terbatas karena keterbatasan tunas autotrof sebagai sumber bahan tanaman untuk perbanyakan, dan benih yang dihasilkan tidak mempunyai akar tunggang.
Perbanyakan kopi Arabika menggunakan teknik kultur in vitro diharapkan dapat mengatasi kendala tersebut, sehingga tanaman klonal dalam jumlah besar dapat disediakan dalam waktu relatif singkat. Kultur in vitro tanaman kopi memakai stek buku, tunas aksilar dan apikal untuk tujuan perbanyakan tanaman memiliki efisiensi rendah karena sterilisasi eksplan yang sulit, kandungan fenol tinggi, adanya dominasi apikal dan tingkat multiplikasi tunas yang rendah (Raghuramulu et al. 1989 ; Ribeiro & Carneiro 1989). Embriogenesis somatik merupakan teknik perbanyakan yang lebih sesuai untuk kopi karena memungkinkan perbanyakan klonal skala besar dengan biaya produksi yang relatif lebih rendah (Etienne 2005; Kumar et al. 2006).
Teknik perbanyakan dan perbaikan bahan tanaman untuk mendapatkan varietas baru kopi menggunakan embriogenesis somatik telah diterapkan di berbagai negara maju. Hasil penelitian terdahulu memperlihatkan bahwa setiap varietas kopi Arabika memiliki tanggap yang bervariasi terhadap perlakuan zat pengatur tumbuh (ZPT) dan komposisi media tumbuh yang digunakan, sehingga jika ingin menggunakan genotipe yang berbeda diperlukan penelitian baru.
Aplikasi perlakuan menggunakan mutagen untuk perbaikan tanaman secara in vitro merupakan salah satu cara untuk meningkatkan peluang mendapatkan keragaman genetik yang tinggi tanpa harus melakukan persilangan. Mutasi pada tanaman dapat diinduksi secara fisik menggunakan radiasi atau dengan cara kimiawi menggunakan senyawa yang bersifat mutagen. Mutasi fisik dapat dilakukan dengan menggunakan sinar UV, sinar X dan sinar sementara secara kimiawi dengan menggunakan senyawa mutagen colchicine, Dietil sulfate (DES), Ethylimine (EI), Nitroso Etil Urea (NEU), Nitroso Metil Urea (NMU), serta Ethyl Methane Sulfonate (EMS). Ethyl Methane Sulfonate merupakan mutagen yang paling banyak digunakan karena mudah dibeli, setelah dihidrolisis tidak bersifat mutagenik, dan terbukti merupakan mutagen yang efektif untuk berbagai jenis tanaman (van Harten 1998).
Penggunaan EMS pada tanaman yang ditumbuhkan secara in vitro mampu menghasilkan berbagai varian (Ahloowalia 1986). EMS umumnya menyebabkan terjadinya mutasi titik, namun dapat juga menyebabkan kehilangan sedikit segmen kromosom (delesi) (Okagaki et al. 1991). Berdasarkan penelitian terdahulu senyawa EMS telah berhasil digunakan untuk menginduksi pembentukan mutan pada tanaman tembakau (Gichner 2003), kubis-kubisan (Sakamoto et al. 2002; Spasibionek 2006), pisang (Roux 2004), kenaf (Arumingtyas & Indriyani 2005), apokat (Yenisbar 2005) dan abaka (Purwati 2007).
Keragaman somaklonal dapat terinduksi dalam kultur in vitro. Keragaman somaklonal dapat dideteksi lebih awal dengan menggunakan marka molekuler. Kecambah atau planlet dapat digunakan sebagai sampel, tidak bersifat merusak karena hanya membutuhkan sedikit sampel serta tidak bias oleh faktor lingkungan. Salah satu marka molekuler yang telah digunakan secara luas adalah Simple Sequence Repeat (SSR) yang biasa dikenal dengan mikrosatelit. Marka ini telah digunakan pada berbagai studi, diantaranya keragaman genetik atau identifikasi varietas tanaman kopi hasil persilangan (Teressa et al. 2010).
Perumusan Masalah
Teknik perbanyakan kultur in vitro dapat dilakukan melalui proliferasi tunas pucuk, regenerasi tunas adventif dan embriogenesis somatik. Di antara ketiga teknik tersebut, regenerasi embriogenesis somatik merupakan teknik yang paling efisien dan paling besar peluangnya untuk menghasilkan bibit kopi Arabika dalam jumlah yang banyak dengan waktu yang relatif lebih singkat. Kendala keberhasilan menggunakan teknik ini antara lain masih tergantung pada genotipe dan komposisi media kultur jaringan yang digunakan, sehingga dalam mengembangkan varietas tertentu diperlukan penelitian untuk mendapatkan media yang tepat.
Peningkatan keragaman genetik pada tanaman yang menyerbuk sendiri seperti kopi Arabika diperlukan untuk mendapatkan varian baru. Salah satu teknik non kovensional yang dapat digunakan adalah dengan memanfaatkan metoda variasi somaklonal. Variasi somaklonal yang dihasikan dalam suatu proses kultur jaringan umumnya tidak tinggi. Frekuensi variasi somaklonal tanaman dapat ditingkatkan dengan memberikan mutagen pada kultur. Ethyl Methane Sulfonate (EMS) merupakan salah satu mutagen kimia yang dapat menimbulkan efek mutasi pada tanaman. Pengaplikasian EMS pada kalus embriogenik kopi Arabika diharapkan dapat menghasilkan planlet mutan putatif yang dapat dievaluasi keragaman genetiknya.
Identifikasi ada tidaknya varian pada tanaman kopi hasil perbanyakan melalui teknik embriogenesis somatik dan hasil induksi mutasi dengan EMS perlu dilakukan. Hasil identifikasi akan dapat merekomendasikan pengembangan tehnik embriogenesis somatik yang lebih efisien sehingga dapat diterapkan untuk perbanyakan kopi Arabika. Identifikasi mutan putatif hasil induksi mutasi dengan EMS juga diperlukan untuk dapat memastikan planlet mana yang merupakan mutan baru, dan menjadi sumber plasma nutfah. Mutan baru ini nantinya dapat digunakan sebagai tetua atau langsung diseleksi untuk mendapatkan sifat tertentu.
Identifikasi dapat dilakukan dengan menggunakan marka molekuler dapat dilakukan pada kecambah atau planlet, dengan tidak bersifat merusak karena hanya membutuhkan sedikit sampel serta tidak bias oleh faktor lingkungan. Salah satu marka molekuler yang telah digunakan secara luas adalah Simple Sequence Repeat (SSR). Marka SSR bersifat kodominan dan dapat mendeteksi variasi alel yang tinggi sehingga dapat digunakan untuk mendeteksi tanaman yang berkerabat dekat lebih baik dibandingkan dengan marka melekular lainnya. Marka ini telah digunakan pada berbagai studi, diantaranya studi keragaman genetik hasil persilangan kopi dan membedakan antara tanaman diploid dan tetraploid antara beberapa species kopi.
Tujuan Penelitian
Tujuan umum penelitian ini adalah untuk :
(1) Mendapatkan metoda perbanyakan benih melalui jalur embriogenesis somatik kopi Arabika
Sementara tujuan khusus dari masing-masing tahapan penelitian adalah sebagai berikut :
(1) Mempelajari pembentukan kalus, embrio somatik dan regenerasi eksplan daun kopi Arabika,
(2) Mendapatkan media terbaik untuk induksi embriogenesis somatik langsung dan tidak langsung kopi Arabika,
(3) Mendapatkan kombinasi zat pengatur tumbuh yang optimum untuk perbanyakan kopi Arabika melalui embriogenesis somatik tidak langsung,
(4) Mendapatkan konsentrasi optimum zat pengatur tumbuh alternatif pada media induksi kalus untuk mendukung perkembangan embryogenesis somatik primer dan sekunder kopiArabika,
(5) Mendapatkan media yang lebih efisien dalam menginduksi embriogenesis somatik dengan menggunakan gula pasir dan agar komersial,
(6) Mendapatkan varian mutan putatif kopi Arabika hasil kombinasi variasi somaklonal dengan mutagen EMS.
Manfaat Penelitian
Permasalahan kopi Arabika di Indonesia antar lain adalah masih rendahnya produktivitas tanaman karena tidak menggunakan bibit unggul. Terbatasnya jumlah bibit unggul varietas kopi Arabika yang dihasilkan mengakibatkan penyaluran bibit ke petani kopi menjadi sangat lambat. Dengan diperolehnya metoda perbanyakan kopi Arabika melalui embriogenesis somatik, diharapkan ketersediaan bibit varietas unggul kopi Arabika yang berproduksi tinggi dan kualitas baik dapat teratasi. Ketersediaan bibit unggul diharapkan dapat meningkatkan luas areal pengembangan kopi Arabika di Indonesia. Hal ini akan berdampak positif terhadap peningkatan produktivitas kopi Arabika di tingkat petani maupun secara nasional. Disamping metode perbanyakan, peningkatan keragaman genetik kopi Arabika untuk mendapatkan sifat tertentu melalui induksi mutasi menggunakan embriogenesis somatik diharapkan dapat membantu mempercepat program pemuliaan kopi Arabika.
Hipotesis Penelitian
(1) Eksplan daun dapat digunakan untuk menghasilkan benih embrio somatik kopi Arabika,
(2) Keberhasilan dalam menginduksi embriogenesis somatik langsung dan tidak langsung dipengaruhi oleh komposisi media yang digunakan,
(3) Keberhasilan embriogenesis somatik kopi Arabika dipengaruhi oleh genotipe dan zat pengatur tumbuh yang digunakan,
(4) Penggunaan zat pengatur tumbuh tanaman 2-iP pada media induksi kalus mampu menggantikan Thidiazuron dalam menginduksi embriogenesis somatik kopi Arabika,
(5) Media menggunakan gula pasir dan agar komersial dapat digunakan untuk menginduksi embriogenesis somatik kopi Arabika
Kebaruan (Novelty)
Teknik perbanyakan bahan tanaman kopi Arabika menggunakan embriogenesis somatik telah banyak dilaporkan, kendalanya keberhasilan masih tergantung pada genotipe dan media yang digunakan. Adapun kebaruan yang didapatkan dalam penelitian ini adalah :
1.
Diperolehnya metode embriogenesis somatik kopi Arabika pada varietas AS2K, S 795, Sigarar Utang dan Kartika, dengan menggunakan beberapa kombinasi zat pengatur tumbuh, komposisi vitamin, asam amino2.
Penggunaan agar dan gula komersial dalam embriogenesis somatik untuk efisiensi biaya dalam menghasilkan bibit kopi Arabika3.
Penggunaan teknik mutasi dengan mutagen EMS dalam menginduksi keragaman kopi Arabika menggunakan jalur embriogenesis somatik4.
Dihasilkannya mutan baru dari penelitian ini akan menghasilkan genotipe baru kopi Arabika.Ruang Lingkup Penelitian
Daftar Pustaka
[AEKI] Asosiasi Eksportir dan Industri Kopi Indonesia. 2015. Eksport kopi Indonesia Perjenis Kopi. Asosiasi Eksportir dan Industri Kopi Indonesia. http://www.aeki-aice.org. Diakses 6 juni 2015.
Ahloowalia BS. 1986. Limitation to the use of somaclonal variation in crop improvement. Di dalam: Semal J, editor. Somaclonal Variation and Crop Improvement. New York (US): Martinus Nijhoff Pub.hlm 14-27
Arumingtyas EL, Indriyani S. 2005. Induksi variabilitas genetik percabangan tanaman kenaf (Hibiscus cannabinus L.) dengan mutagen kimia Ethyl Methane Sulfonate (EMS). Natural Jurnal 8. (2): 24-28
Aryani N. 2013. Peningkatan Produksi, Produksivitas, dan Mutu Kopi yang Berkelanjutan. Di dalam Rubiyo, Harni R, Wardana E, Towaha J, editor. Prosiding Seminar Nasional Inovasi Teknologi Kopi, Peran Inovasi tekonogi Kopi Menuju Green Economy Nasional. Bogor. 28 Agustus 2013. Badan Penelitian dan pengembangan Pertanian. Jakarta (ID). IAARD Press. hlm 1-10.
Etienne H. 2005. Somatic Embryogenesis Protocol: Coffee (Coffea Arabica L. and Canephora P.) In Jain SM, Gupta PK. (eds). 2005. Protocol for Somatic Embryogenesis in Woody Plants. Printed in the Netherlands (NL). Springer. hlm 167 - 179.
Geleta M, Herrera I, Monzon A, Bryngelsson T. 2012. Genetic Diversity of Arabica Coffee (Coffea arabica L.) in Nicaragua as Estimated by Simple Sequence Repeat Markers. The Scientific World Journal. 1-11.
Gichner T. 2003. Differential genotoxicity of ethyl methanesulphonate, N-ethyl- N-nitrosourea and maleic hydrazide in tobacco seedlings based on data of the Comet assay and two recombination assay. Mutation Research 538: 171- 179.
Kumar V, Madhava N, Ravishankar GA. 2006. Developments in coffee biotechnology-in vitro plant propagation and crop improvement. Plant Cell Tiss. Org. Cult. 87: 49-65.
Okagaki RJ, Neuffert MG, Wessler SR. 1991. A Deletion Common to Two Independently Derived waxy Mutations of Maize. Genetics Society of America. 128: 425-431.
Priyono. 2013. The Relationships and Genetic Diversity Among Species In The Genus Coffea. Review Penelitian Kopi dan Kakao. 1 (1) : 1-11.
Purwati RD, Harran S, Sudarsono. 2007. In Vitro Selection of Abaca for Resistance to Fusarium oxysporum f.sp. cubense. HAYATI Journal of Biosciences, 14(2) :65-70. ISSN: 1978-3019
Raghuramulu Y, Sreenath HL, Ramaiah PK. 1989. Regeneration of coffee plantlets through tissue culture techniques in India. Journal of Coffee Research. 19: 30-38.
Roux NS. 2004. Mutation induction in Musa-review. Di dalam: Jain SM, Swennen R, editor. Banana Improvement: Cellular, Molecular Biology, and Induced Mutations. Enfield: Sci Pub, Inc. hlm. 21-29.
Sakamoto W, Tamura T, Hanba-Tomita Y, Sodmergen, Murata M. 2002. The VAR1 locus of Arabidopsis encodes a chloroplastic FtsH and is responsible for leaf variegation in mutant alleles. Genes to Cell 7:769-780. Spasibionek S. 2006. New mutants of winter rapeseed (Brasica napus L.) with
changed fatty acid composition. Plant Breeding 125(3): 259-267.
Teressa A, Crouzillat D, Petiard V, Brouhan P. 2010. Genetic diversity of Arabica coffee (Coffea arabica L.) Collections. EJAST. 1 (1): 63-79.
van Harten AM. 1998. Mutation Breeding: theory and practical application. Cambridge (GB): Cambridge University Press
Wijayadi. 2013. Peningkatan daya Saing kopi Indonesia di Pasar Internasional. Di dalam Rubiyo, Harni R, Wardana E, Towaha J, editor. Prosiding Seminar Nasional Inovasi Teknologi Kopi, Peran Inovasi tekonogi Kopi Menuju Green Economy Nasional. Bogor. 28 Agustus 2013. Badan Penelitian dan pengembangan Pertanian. Jakarta (ID):IAARD Press. hlm 11-18.
2. TINJAUAN PUSTAKA
Tanaman Kopi Arabika (Coffea arabica L.)
Hampir semua tanaman perkebunan di Indonesia, termasuk kopi bukan tanaman asli Indonesia. Tanaman kopi dalam sejarah perkembangannya merupakan salah satu tanaman eksotik paling tua yang berhasil dikembangkan di Indonesia. Kopi Arabika berasal dari Benua Afrika, tepatnya dari daerah pegunungan di Ethopia Selatan (Abessinia). Di Negara asalnya ini kopi Arabika tumbuh di daerah hutan tropis di bawah pohon-pohon besar pada ketinggian 1500-2000 m dpl (Spillane 1990; Yahmadi 1500-2000).
Tanaman kopi dibawa bangsa arab dari Ethophia ke negerinya untuk dikembangkan dan diperdagangkan. Pada abad ke tiga belas kopi telah menyebar ke daerah laut merah, Persia dan India.Tanaman ini masuk ke Indonesia pertama kali tahun 1696, dan sejarah mencatat pada tahun 1712 telah ada pelelangan kopi asal Jawa di Amsterdam. Sejak saat itu kopi asal Indonesia mulai dikenal dipasaran eropa dengan sebutan Java coffee (Spillane 1990; Yahmadi 2000).
Tanaman kopi (Coffea spp.) secara taksonomi termasuk dalam Kindom : Plantae, Divisio : Spermatophita, Sub-divisio : Angeospermae, Kelas : Dikotiledonea, Ordo : Rubiales, Famili : Rubiaceae, Genus : Coffea, dan Species : Coffea spp. Famili Rubiaceae mempunyai sekitar 500 jenis dengan tidak kurang dari 600 species. Genus Coffea merupakan salah satu genus penting dengan 103 species. Diantara sejumlah species yang ada, paling banyak diusahakan secara komersial adalah Coffea arabika dan Coffea canephora (Siswoputranto 1993; Priyono 2013).
Pertumbuhan dan produksi tanaman kopi Arabika sangat dipengaruhi oleh iklim. Selain kelembaban udara, angin, dan lama penyinaran faktor yang paling penting diperhatikan adalah curah hujan dan suhu udara. Menurut Hulupi (1999), persyaratan kondisi iklim dan tanah untuk kopi Arabika adalah sebagai berikut: tinggi tempat > 700 m dpl, suhu harian 15 - 240C, curah hujan rata-rata 2.000 - 4.000 mm/thn (Curah hujan optimum 2000 - 3000 mm/tahun), jumlah hari hujan kering 1-3 bulan/tahun, pH tanah 5.3 - 6.0, kandungan bahan organik minimal 2%, kedalaman tanah efektif > 100 cm, dan kemiringan tanah maksimum 40% (Siswoputranto 1993).
Kopi Arabika akan tumbuh lebih baik di dataran tinggi 1000 - 2000 m dpl. Pada lahan yang tinggi tersebut aroma kopi Arabika lebih baik dibandingkan apabila ditanam dilahan yang lebih rendah (Prastowo 2010). Batas elevasi tertinggi kopi Arabika dibatasi oleh ancaman frost yang sering terjadi pada ketinggian lebih dari 2000 m dpl, sedangkan batas elevasi terendah dibatasi oleh adanya serangan penyakit karat daun yang serangannya makin parah pada suhu yang lebih tinggi, yaitu di lokasi yang elevasinya lebih rendah (Pujiyanto 1998).
Terbentuknya tanaman kopi Arabika yang allotetraploid merupakan hasil dari persilangan antara Coffea eugeniodes yang diploid dengan Coffea canephora yang juga diploid. Hibrida interspsifik ini sangat steril sehingga dalam prosesnya dibentuk gamet-gamet tanpa mengalami reduksi kromosom yang menghasilkan Coffea arabica (Geleta et al. 2012) .
Tanaman kopi tidak tahan gangguan angin kencang karena dapat merusak cabang tanaman dan merontokkan bunga sehingga menurunkan produksi. Tanaman kopi tumbuh tegak, bercabang dan tinggi yang dapat mencapai 12 m. Secara umum daun kopi bentuk bulat telur dengan ujung meruncing. Daun tumbuh berhadapan pada batang, cabang dan ranting. Sepasang daun terletak dibidang yang sama dicabang dan ranting yang tumbuh mendatar meruncing (Panggabean 2011).
Bentuk fisik daun kopi bervariasi tergantung jenisnya, sehingga salah satu pedoman untuk membedakan jenis kopi adalah dengan memperhatikan bentuk dan fisik daun. Warna pucuk daun kopi dikelompokkan dalam 2 besar yaitu berwarna coklat tembaga yang merupakan ciri utama kelompok Typica dan yang berwarna hijau muda menjadi penciri kelompok Bourbon (Tran 2005).
Sistem percabangan tanaman kopi agak berbeda dengan tanaman lain. Pertanaman kopi dikenal adanya cabang orthotrop dan plagiotrop. Cabang orthotrop disebut juga cabang reproduksi, cabang ini tumbuh tegak dan lurus dan sifatnya hampir sama dengan batang utama, sementara plagiotrop atau cabang primer merupakan cabang yang tumbuh pada batang utama atau cabang reproduksi dan berasal dari tunas primer. Cabang ini tumbuh kesamping dengan arah pertumbuhan mendatar, lemah dan berfungsi sebagai penghasil bunga. Selain tipe percabangan tersebut dikenal juga adanya cabang sekunder, cabang kipas, cabang pecut, cabang balik dan cabang air (Najiyati & Danarti 2007; Panggabean 2011).
Kopi termasuk tanaman berkeping dua (dikotil) yang memiliki akar tunggang, sehingga tidak mudah rebah. Akar tunggang hanya dimiliki oleh tanaman kopi yang berasal dari bibit semai dari perbanyakan generatif. Tanaman kopi berasal dari stek, cangkok, atau okulasi tidak memiliki akar tunggang, sehingga mudah rebah dan akan lebih mudah mengalami kekeringan pada musim kemarau (Najiyati & Danarti 2007 ; Panggabean 2011).
Pada umumnya, tanaman kopi akan berbunga setelah berumur dua tahun. Bunga keluar dari ketiak daun, ketiak daun yang sudah menghasilkan bunga tidak akan menghasilkan bunga lagi. Akan tetapi cabang primer dapat tumbuh terus memanjang membentuk daun baru, sehingga masih dapat menghasilkan bunga baru. Bunga tersusun dalam kelompok, masing-masing 4 - 6 kuntum bunga. Pada setiap ketiak daun dapat menghasilkan 2 - 3 kelompok bunga sehingga setiap ketiak daun dapat menghasilkan 8 - 18 kuntum bunga (Najiyati & Danarti 2007 ; Panggabean 2011).
Kuncup bunga akan mekar atau yang dengan florasi (flush) jika curah hujan minimal 3-4 mm. Bunga mekar umumnya sebelum matahari terbit dan penyerbukan akan terjadi jika cuaca cerah sekitar jam 10 pagi. Masa reseptik bunga kopi hanya satu hari. Penyerbukan terutama melalui perantara angin. Polen (serbuk sari) kopi dapat diterbangkan angin sampai jarak 100 m dari pohon asal, dengan jarak penyerbukan efektif 35 m (Siswoputranto 1993).
Waktu yang diperlukan bunga untuk menjadi buah matang sekitar 9-12 bulan tergantung jenis dan faktor lingkungan. Kopi Arabika membutuhkan sekitar 9-10 bulan, robusta 10-11 bulan, sedangkan Kopi Liberika 10-12 bulan. Ukuran buah kopi sangat bervariasi, sangat tergantung jenis dan varietasnya. Buah kopi terdiri atas beberapa bagian yaitu; lapisan kulit luar atau kulit buah (eksokarp), lapisan daging buah (mesokarp) berwarna putih, berair dan agak manis, lapisan kulit tanduk (endokarp) biji kopi yang keras, kulit ari yang tipis membungkus biji kopi. Buah kopi umumnya mengandung dua butir biji, tetapi ada juga yang hanya mengandung satu atau tiga butir, bahkan tidak berbiji sama sekali. Kriteria biji kopi Arabika yang baik adalah bentuk biji normal dengan jumlah biji 2 butir. Biji kopi mempunyai lembaga. Lembaga atau sering disebut endosperma merupakan bagian yang bisa dimanfaatkan sebagai bahan untuk membuat minuman kopi (Najiyati & Danarti 2007 ; Panggabean 2011).
Umumnya buah kopi mentah berwarna hijau muda setelah itu berubah menjadi hijau tua, kuning dan pada saat matang berwarna merah atau merah tua. Namun ada juga buah kopi yang saat matangnya berwarna kuning. Salah satu yang sangat populer adalah kopi Arabika kultivar Bourbon. Kultivar ini diduga muncul dari mutasi alami pada kultivar Bourbon berbuah merah atau merupakan rekombinan dari hasil persilangan kutivar Caturra Amerello. Selain kultivar Bourbon di Barsil ada juga kultivar Caturra Amarello yang berwana kuning (Carvallho et al. 1957 ; Sera et al. 2003).
Kultur In Vitro pada Tanaman Kopi
Kultur in vitro adalah suatu metode mengisolasi bagian tanaman seperti protoplas, sel, jaringan atau organ, serta menumbuhkannya dalam kondisi aseptik, sehingga bagian-bagian tanaman tersebut dapat tumbuh dan memperbanyak diri serta beregenerasi menjadi tanaman lengkap (Gunawan 1992). Kelebihan menggunakan teknik kultur in vitro antara lain; tanaman dapat diperbanyak setiap saat tanpa tergantung musim, daya multipikasinya tinggi, tanaman yang dihasilkan lebih seragam, dan bebas penyakit (bakteri, cendawan, dan virus), memproduksi senyawa metabolit sekunder, perbaikan tanaman dan konservasi plasma nutfah tanaman (pemuliaan tanaman) (Wattimena et al. 1992).
Pemilihan media yang akan digunakan dalam kultur in vitro sangat tergantung pada jenis tanaman yang dikulturkan dan bentuk pertumbuhan dari deferensiasi yang diinginkan (Pierik 1987). Modifikasi media MS dilakukan dengan meningkatkan dan menurunkan kandungan garam mineral yang ada dalam media, baik pada elemen makro (khususnya NH4 dan NO3), mikro, vitamin maupun asam animo (Samson et al. 2006 ; Etienne 2005).
Media kultur in vitro pada dasarnya harus menyediakan unsur-unsur hara makro seperti ; nitrogen (N), fosfor (P), kalium (K), kalsium (Ca), magnesium (Mg) dan sulfur (S), dan mikro yang antara lain; natirum (Na), besi (Fe), mangan (Mn), boron (B), kuprum (Cu), Klor (Cl), dan molybdenum (Mo). Karbohidrat berupa sukrosa untuk menggantikan karbon yang umumnya dapat berasal dari atmosfir melalui fotosintesis, vitamin, asam amino, dan zat pengatur tumbuh. Pada kasus tertentu seperti pada tanaman tahunan yang umumnya mengandung banyak fenol, ditambahkan anti oksidan seperti Polivynil pyrolidon (PVP) atau arang aktif (Gunawan 1992 ; Wattimena et al. 1992 ; George et al. 2008).
Zat pengatur tumbuh mempunyai peranan penting dalam menginduksi kalus, baik untuk tujuan organogenesis maupun embriogenesis somatik. Setiap genotipe atau jaringan mempunyai respon yang berbeda dalam penyerapan zat pengatur tumbuh. Penelitian terdahulu pada tanaman kopi memperlihatkan bahwa kombinasi zat pengatur tumbuh memperlihatkan respon yang beragam antara kopi Robusta dan Arabika. Setiap varietas kopi Robusta memperlihatkan tanggap yang berbeda terhadap perlakuan zat pengatur tumbuh yang diberikan. Tanggapan terhadap jenis dan konsentrasi ZPT yang berbeda juga ditemukan pada tanaman kopi Arabika (Ramos et al. 1993; Bieysse et al. 1993).
Perbanyakan benih kopi Arabika bebas penyakit dalam jumlah banyak dimungkinkan melalui teknik kultur in vitro. Penggunaan teknik kultur in vitro diharapkan dapat mengatasi penyediaan bahan tanam klonal dalam jumlah besar dengan waktu yang relatif singkat. Ketersediaan teknik perbanyakan emriogenesis somatik tanaman kopi Arabika juga sangat diperlukan dalam program pemuliaan untuk mendapatkan bibit unggul dengan sifat-sifat tertentu yang diinginkan, seperti produksi tinggi sekaligus tahan hama atau penyakit (Priyono 1993; Sumaryono & Tahardi 1993; Suryowinoto 1996; Oktavia et al. 2003; Oktavia 2004).
Kultur in vitro tanaman kopi pertama kali dilaporkan oleh Staritsky (1970) yang mengkulturkan tunas ourtotrop tiga species Coffea spp yaitu ; Coffea liberica, C. arabica dan C. canephora pada media Linsmaier dan Skoog 1965. Hasil penelitiannya memperlihatkan bahwa pembentukan embrio somatik hanya dijumpai pada sebagian kecil jaringan C. canephora sedangkan pada Coffea liberica, C. arabica hanya terbentuk kalus. Pada penelitian tersebut juga digunakan kepala sari, tangkai daun, daun perisperma dan endosperma sebagai bahan tanaman. Hasilnya, dari semua jenis eksplan yang digunakan tersebut, kalus hanya dapat terbentuk dari eksplan yang berasal dari daun (Staritsky 1970).
Penelitian selanjutnya pada tanaman kopi khususnya jenis Robusta yang menggunakan eksplan daun muda juga dilakukan oleh Sondahl et al. (1981), Warga-Dalem (1985), dan Hatanaka et al. (1991). Proses pembentukan embrio somatik melalui dua tahap juga dilaporkan oleh Pierson et al. (1983), sementara Yasuda et al. (1985) melakukan induksi embrio somatik tidak langsung dari daun kopi Arabika yang menghasilkan kalus embriogenik, dan membutuhkan periode kultur yang relatif lama (lebih dari dua tahun baru bisa tumbuh dan berkembang membentuk embrio somatik).
Penelitian terdahulu memperlihatkan bahwa setiap varietas kopi Robusta memiliki tanggap yang bervariasi terhadap perlakuan zat pengatur tumbuh (ZPT) yang diberikan dalam media kultur. Perbedaan ini juga ditemukan pada kutur jaringan kopi Arabika, hasil penelitian Priyono (2004) dan Samson et al. (2006) memperlihatkan perbedaan yang nyata dalam pembentukan embrio somatik diantara 4 species dan 4 varietas kopi Arabika yang digunakan.
Embriogenesis Somatik dan Faktor yang Mempengaruhinya
Regenerasi tanaman dalam kultur in vitro dapat dilakukan melalui jalur organogenesis dan embriogenesis somatik. Produksi bibit melalui benih somatik dari embrio somatik dapat menghasilkan bibit yang jauh lebih banyak dari pada hasil regenerasi melalui organogenesis. Perbaikan tanaman melalui kultur in vitro melalui jalur embriogenesis somatik juga lebih disukai karena dapat berasal dari satu sel somatik sehingga kepastian hasil perbaikan sifat genetik lebih tinggi.
Embriogenesis somatik merupakan proses pembentukan embrio dari sel somatik. Menurut Von Arnorld et al. (2002) Embriogenesis somatik merupakan suatu proses dimana struktur bipolar yang menyerupai embrio zigotik berkembang dari satu sel non-zigotik tanpa adanya hubungan pembuluh dengan jaringan asalnya. Proses embriogenesis somatik terjadi melalui serangkaian tahapan sebagaimana pada embriogenesis zigotik. Zimmerman (1993) menggambarkan kesamaan tahapan somatik embriogenesis dan zigotik embriogenesis. Beberapa penelitian terdahulu memperlihatkan perbanyakan tanaman melalui proses embriogenesis somatik menghasilkan klon yang identik dengan induknya (Evans & Sharp 1986; Jimenez 2001), meskipun beberapa perbedaan akan ditemukan tergantung dari jenis tanamannya.
Diferensiasi sel-sel embriogenik dapat terjadi secara langsung dari eksplan tanpa didahului fase pembentukan kalus dan secara tidak langsung dengan melalui pembentukan kalus terlebih dahulu (Toonen & de Vries 1996; Jimenez 2001; von Arnold et al. 2002. Hussein et al. 2006). Embriogenesis langsung memerlukan waktu relatif lebih singkat untuk menghasilkan planlet dan kemungkinan terjadinya penyimpangan akibat keragaman somaklonal lebih kecil dibandingkan dengan embriogenesis tidak langsung (Ramos et al. 1993).
Keberhasilan menginduksi embriogenesis somatik dipengaruhi oleh banyak faktor antara lain ; sumber eksplan, jenis tanaman, genotipe tanaman, kondisi fisiologis sel, zat pengatur tumbuh, komposisi media tumbuh, dan lingkungan tumbuh (Terzi & Loschiavo 1990; Ehsanpour 2002 ; Bieysse et al. 1993). Pemilihan material jaringan eksplan yang tepat sangat mempengaruhi kesuksesan kultur in vitro, terutama dalam menginduksi embrio somatik. Perbedaan umur, ukuran, organ yang digunakan dan cara mengkulturkan dapat mempengaruhi pertumbuhan dan perkembangan jaringan tanaman (George & Sherington 1984).
Zat pengatur tumbuh 2,4-D merupakan auksin yang paling umum digunakan untuk menginduksi embriogenesis somatik. Selain auksin, pemberian zat pengatur tumbuh sitokinin juga berpengaruh terhadap diferensiasi sel dalam proses embriogenesis somatik (Jain & Ishii 1998 ; Raghavan 1986; Wattimena 1987). Beberapa jenis sitokinin yang biasa dikombinasikan dengan auksin dalam menginduksi embrio somatik kopi diantaranya adalah BA dan Kinetin (Riyadi & Tirtoboma 2004; Oktavia 2004; Oktavia et al. 2003; Sondahl et al. 1981 ; Priyono 1993), 1-phenyl-3-(1,2,3,-thiadiazol-5-yl)urea (Thidiazuron) (Giridhar et al. 2004), 6-(y,y-dimethylallylamino) purine (2-iP) (Arimarsetiowati 2011; Samson et al. 2006 ; Oktavia et al. 2003; Berthouly & Maxchaux-Ferriere 1996), dan Berthouly dan Etienne (2000) mengkombinasikan BA dan 2-iP dengan IBA.
Aplikasi Penggunaan Mutagenesis Secara In vitro
Tanaman kopi Arabika merupakan tanaman tahunan yang menyerbuk sendiri sehingga mempunyai keragaman genetik yang tergolong rendah. Salah satu metode pemuliaan tanaman untuk meningkatkan keragaman genetik sehingga didapatkan varietas unggul adalah dengan mengkombinasikan pemuliaan mutasi dan kultur in vitro. Kombinasi tersebut telah terbukti dapat meningkatkan keragaman genetik sehingga seleksi mutan akan lebih efektif dan efisien (Maluszynski et al. 1995; Ahloowalia 1995).
Penggunaan teknik mutasi secara in vitro memiliki keunggulan antara lain mampu melibatkan sejumlah besar bahan tanaman dan waktu yang dibutuhkan untuk mendapatkan mutan baru relatif lebih cepat dibandingkan dilapangan (Ahloowalia 1995). Kelebihan lain menurut Chahal dan Gosal (2006) yaitu : mutasi dapat dilakukan pada tingkat sel sehingga peluang untuk terjadinya khimera lebih kecil karena mutan yang dihasilkan berasal dari satu sel, laju mutasi lebih tinggi karena masing-masing sel mengalami kontak langsung dengan mutagen, dan pada beberapa kasus tertentu dapat dilanjutkan dengan seleksi in vitro sehingga seleksi terhadap mutan menjadi lebih efisien dan efektif.
Teknik kultur in vitro, seperti kalus, suspensi sel, embrio somatik atau protoplas, dapat dikombinasikan dengan teknik induksi mutasi baik dengan menggunakan mutagen fisik atau kimiawi akan menghasilkan mutan stabil. Mutan solid dapat diperoleh secara langsung, jika bagian yang dimutasi adalah kalus, suspensi sel, embrio somatik atau protoplas, akan tetapi kelemahannya memiliki daya regenerasi yang rendah (van Harten 1998).
panjang sehingga tidak selalu tergantung pada ketersediaan sumber eksplan. Mutasi pada embrio somatik tidak mengakibatkan khimera, karena embrio somatik berasal dari sel tunggal, maka apabila dilakukan induksi mutasi pada tahap ini frekuensi terbentuknya varian relatif besar dan diharapkan terjadi mutasi yang solid (Maluszynski et al. 1995 ; van Harten 1998).
Mutagenesis merupakan keseluruhan proses yang menyebabkan timbulnya berbagai macam mutasi yang spontan atau yang diinduksi dengan agen mutagenik. Mutagenesis in vitro adalah mutagenesis yang menggunakan metode in vitro. Mutagenesis in vitro dimanfaat dalam pemuliaan mutasi, yaitu pemuliaan tanaman yang dilakukan dengan melalui proses mutasi.
Mutasi buatan dilakukan untuk dapat menginduksi keragaman genetik, yang akan tercermin dari mutan-mutan yang dihasilkannya. Mutan-mutan diseleksi dan diperbanyak secara vegetative, atau diserbuki sendiri untuk menstabilkan karakter mutan tersebut (Poelman & Sleper 2006).
Keragaman genetika tanaman kopi Arabika dapat ditingkatkan melalui aplikasi perlakuan mutagenesis dan perbanyakan tanaman secara in vitro, sebagaimana yang dilakukan pada tanaman tembakau (Gichner 2003), kubis-kubisan (Sakamoto et al. 2002; Spasibionek 2006), pisang (Roux 2004), dan kenaf (Arumingtyas & Indriyani, 2005); alphokat (Yenisbar 2005), abaka (Purwati 2007). Penggunaan teknik kultur in vitro sangat penting dalam menginduksi mutan, keragaman somaklonal yang terjadi melalui kultur kalus dan perlakuan mutasi sangat tepat untuk meningkatkan frekuensi terbentuknya varian yang relatif besar yang sangat berguna bagi program pemuliaan.
Peluang keberhasilan mutagenesis in vitro tergantung pada jumlah, umur, bagian dan fase pertumbuhan tanaman. Perbedaan konsentrasi dan lamanya perlakuan mutagen sangat mempengaruhi peluang terjadinya mutasi. Frekuensi mutasi pada penelitian kacang tanah terjadi pada perlakuan EMS dengan konsentrasi 0.25 – 0.5% (Gowda et al. 1996). Pada tanaman barley EMS menimbulkan laju mutasi hingga 4-5 kali lebih tinggi dibandingkan dengan radiasi sinar-x, terutama untuk mutasi klorofil (van Harten 1998). Perlakuan EMS 0.3% 0.5% atau 0.6% pada kalus embriogen abaka klon Tangongon menurunkan rataan jumlah tunas sebesar 80% -93% (Purwati 2007), sementra pada embriogenesis apokat, pertambahan massa pro embrio terhambat pertumbuhannya sebesar 50% ketika diberikan EMS 0,6% selama 30 menit (Yenisbar 2005).
Induksi Mutasi Menggunakan EMS (Ethyl Methane Sulfonate)
Mutasi dapat diartikan sebagai perubahan genetik gen tunggal, sejumlah gen atau susunan kromosom yang terjadi pada bagian tanaman terutama bagian yang aktif melakukan pembelahan sel (Micke & Donini 1993). Mutasi mempunyai peran penting dalam proses evolusi, dan sebagai akibat dari mutasi adalah terjadi peningkatkan keragaman genetik tanaman yang sangat diperlukan sebagai bahan baku dalam pemuliaan tanaman.
Menurut van Harten (1998), peningkatan keragaman genetik yang terjadi secara alami di alam dengan frekuensi sangat rendah, yaitu 10-6 per pembelahan sel. Sementara mutasi buatan merupakan mutasi yang sengaja dilakukan sebagai salah satu cara untuk menimbulkan keragaman genetik.
Untuk tujuan tertentu frekuensi mutasi dapat ditingkatkan dengan menggunakan teknik induksi mutasi. Induksi mutasi adalah salah satu cara untuk meningkatkan keragaman genetik untuk melengkapi pemuliaan tanaman (Odeigah et al. 1998). Penggunaan induksi mutasi telah banyak digunakan untuk memperbaiki beberapa karakter agronomi penting, ketahanan terhadap hama dan penyakit yang disebabkan oleh faktor abiotik dan biotik.
Mutasi buatan telah memberikan kontribusi nyata terhadap perbaikan tanaman di dunia (Maluszynski et al. 1995). Mutasi ini dapat meningkatkan laju mutasi yang lebih tinggi dibandingkan dengan mutasi alami. Menurut Poespodarsono (1988), induksi mutasi terjadi karena adanya mutagen. Secara umum mutagen dikelompokkan menjadi tiga yaitu (1) mutagen kimia seperti; colchicine, Di Etil Sulfate (DES), Ethylimine (EI), Nitroso Etil Urea (NEU), Nitroso Metil Urea (NMU), dan Ethyl Methane Sulfonate (EMS) (2) mutagen fisik seperti radiasi sinar X, sinar α, sinar dan sinar (γ) mutagen fisik non radiasi seperti sinar UV.
Kerusakan atau perubahan pada sejumlah segmen kromosom akibat proses mutasi sering menimbulkan pengaruh negatif, seperti berkurangnya fertilitas tanaman (van Harten 1998). Kenyataan ini mengharuskan kita untuk mempertimbangkan beberapa hal yang perlu diperhatikan dalam memilih mutagen yang akan digunakan, diantaranya seberapa besar pengaruh mutagen yang kita inginkan, apakah perubahan tersebut sampai tingkat genom, kromosom, atau hanya pada tingkat gen.
Berdasarkan tipe, mutasi dibagi menjadi mutasi titik (mutasi gen), mutasi genom, abrasi kromosom dan ekstranuklear. Terjadinya perubahan susunan pasang basa pada struktur DNA meliputi microlession dan macrolession. Microlession sebenarnya adalah mutasi titik dimana terjadi subsitusi, transversi, transisi, serta penyisipan pasangan basa. Macrolession merupakan penghapusan, duplikasi ataupun penyusunan kembali pasangan basa.
Ethyl Methane Sulfonate termasuk senyawa alkil yang dapat bereaksi dengan basa-basa DNA, kemudian merubah transisi dua arah. Gugus alkil bereaksi pada DNA dengan cara mengalkilasi basa purin dan pirimidin. Alkilasi dapat terjadi pada atom O-6 dari basa guanin sehingga yang seharusnya berpasangan dengan sitosin menjadi berpasangan dengan timin. Hal ini mengakibatkan perubahan kode genetik dari GC menjadi AT pada generasi sel berikutnya (Sega 1984; Jusuf 2001). Penelitian Greene et al (2003) pada tanaman Arabidopsis menunjukkan 99% mutasi yang terjadi akibat EMS (20-40 mM selama 10-20 jam) dan perubahannya dari GC menjadi AT dengan 53% perubahan G dan 47% perubahan pada C.
Penggunaan EMS untuk meningkatkan keragaman genetik secara in vitro telah banyak dilaporkan, diantaranya adalah untuk menghasilkan mutan pada tanaman kedelai (Grabau et al. 1995), memperoleh tanaman pisang yang tahan bunchy top nano virus (Imelda et al. 2000), menghasilkan tanaman gandum yang cepat berbunga dan masaknya buah (Vismanathan & Reddy 1996), dan memperoleh tanaman cabai tahan ChiVMV (Manzila et al. 2010).
Penggunaan Single Sequence Repeats (SSR) dalam Identifikasi Varian
Secara umum penanda atau marka dalam mengidentifikasi dan mengevaluasi variasi genetik dapat dikelompokkan dalam 3 kelompok besar yaitu; (1) marka yang berdasarkan sifat visual dapat dilihat yang disebut marka morfologi, (2) marka yang berdasarkan produk gen yang disebut sebagai marka biokimia, dan (3) marka yang berdasarkan pengujian DNA disebut marka molekuler. Secara visual marka Morfologi merupakan penampilan fenotipe tanaman seperti warna bunga dan bentuk buah. Marka biokimia seperti isoezym membedakan enzim yang dideteksi menggunakan elektroforesis dan penanda spesifik. Marka isozim digunakan untuk menganalisis keragaman genetik karena relatif cepat, mudah digunakan, dan biayanya murah, namun masih memiliki kelemahan, yaitu tingkat polimorfik yang terbatas (Meunier 1992) dan dipengaruhi oleh fase perkembangan tanaman (Brar 2002). Sementara marka molekuler selain jumlahnya tidak terbatas, tidak dipengaruhi oleh faktor lingkungan dan perkembangan tanaman (Tanksley & MoCouch 1997; Moritz & Hillis 1996).
Keragaman somaklonal dapat dideteksi menggunakan teknik molekuler. Pemilihan tekhnik ini karena karakterisasi menggunakan marka molekuler dapat dilakukan pada stadium awal, bahkan dapat dilakukan pada benih dan planlet dengan tidak bersifat merusak karena hanya membutuhkan sedikit sampel serta tidak bias oleh faktor lingkungan. Karakterisasi secara molekuler juga dapat digunakan bersama dan saling melengkapi dengan karakterisasi berdasarkan ciri-ciri morfologi.
Salah satu marka molekuler yang telah digunakan secara luas adalah Simple Sequence Repeat (SSR) atau yang biasa dikenal dengan mikrosatelit. Beberapa keungulan pemakaian SSR yaitu: (1) melimpah, (2) terdistribusi dengan seragam, (3) sangat polimorfis, (4) kodominan, (5) dihasilkan dengan cepat melalui PCR, (6) relatif sederhana untuk ditafsirkan, dan (7) mudah diakses oleh laboratorium lain melalui publikasi sekuen primer (Saghai-Maroof et al. 1994). Powell et al. (1996) membuktikan bahwa dari empat marka molekuler yang diuji (RFLP, RAPD, AFLP dan SSR) marka SSR memiliki kandungan informasi (kemampuan untuk membedakan genotipe) yang paling tinggi untuk mengevaluasi plasma nutfah kedelai.
Marka SSR telah digunakan pada berbagai studi, diantaranya studi keragaman genetik atau identifikasi varietas tanaman. Simple Sequence Repeat merupakan tandem arrays dari 2-5 pasangan basa nukleotida berulang yang ditemukan secara luas pada organisme Eukariota. Marka ini bersifat kodominan dan dapat mendeteksi variasi alel yang tinggi dan dapat membedakan antara tanaman diploid dan tetrapoid (Moncada & McCouch 2004; Chakravarthi & Naravaneni 2006; Ruas et al. 2003; Bhat et al. 2005), sehingga dapat digunakan untuk mendeteksi aksesi tanaman yang berkerabat dekat secara lebih baik dibandingkan dengan marka molekuler yang lain.
Single Sequence Repeats adalah bentuk pengulangan sekuen DNA sederhana pada genom individu. Pengulangan berupa unit 1-6 pasang basa DNA dengan variasi yang tinggi (Gupta et al. 1994). Jumlah pengulangan nukleotida SSR biasanya kurang dari 100. Primer SSR dibentuk berdasarkan pada daerah pengapit konservatif (Conserved flaking regian) untuk satu lokus daerah yang diapit (Akkaya et al. 1992). Hasil produk PCR dapat dielektroforesis yang dibedakan menurut jumlah unit pengulangan DNA dalam alel-alel SSR yang muncul dan menghasilkan polimorfisme yang tinggi antar species dan yang lebih penting adalah antar individu-individu didalam species dan populasi (Gupta et al. 1994).
Prosedur umum yang digunakan untuk menemukan lokus SSR adalah dengan mengkontruksi dan skrining pustaka genom DNA yang diperkaya sekuen SSR dan diikuti dengan pengurutan (sequencing). Menggunakan metode ini umumnya membutuhkan waktu dan harga yang relatif sangat mahal. Cara lain yang dapat ditempuh adalah menggunakan data yang telah tersedia di Gen bank. Penggunaan metode ini lebih efisien karena hanya berdasarkan bantuan komputer (Edwars et al. 1996; Robinson et al. 2004). Penelusuran aksesi tanaman dapat dilakukan secara on line seperti menggunakan situs NCBI http://www.ncbi.nlm.nih.gov. dari Amerika, EMBL-EBI http://www.ebi.ac.uk dari Eropa, dan DPBJ http://www.dddbj.nig.ac.ip dari jepang.
Daftar Pustaka
Ahloowalia BS. 1995. In vitro techniques and mutagenesisi for the improvement of vegetatively propagated plants. In. Jain M, Brar DS., Ahloowalia BS. (ed) Somaclonal Variation and Induced Mutations in Crop Improvement. London (GB): Kluwer Acad. hlm 293-309.