Oleh:
Tika Widayanti
G34102021
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
TIKA WIDAYANTI. Isolasi dan Karakterisasi Bacillus sp. Indigenus Penghasil Asam Indol Asetat Asal Tanah Rizosfer. Dibimbing oleh ARIS TRI WAHYUDI dan NISA RACHMANIA MUBARIK.
Genus Bacillus yang dikelompokkan sebagai plant growth-promoting bacteria (PGPB) diisolasi dari tanah rizosfer yang berasal dari sebelas daerah di Pulau Jawa. Hasil karakterisasi parsial menunjukkan sel Bacillus berbentuk batang, bersifat Gram positif, memiliki struktur endospora, dan katalase positif, kecuali isolat HI-9, SI-2 dan PI-8 bersifat katalase negatif. Isolat-isolat tersebut dianalisis kemampuannya dalam memproduksi asam indol asetat (AIA) berdasarkan metode kolorimetri menggunakan reagen Salkowski. Hasil analisis AIA menunjukkan dari 63 isolat yang berhasil diisolasi, sebanyak 61 isolat mampu mensintesis AIA dengan konsentrasi tertinggi dihasilkan isolat HI-2 dan TG-1 sebesar 67.2 ppm pada media dengan penambahan L-triptofan 0.5 mM. Pada media tanpa penambahan L-L-triptofan sebesar 47.6 ppm dan 38.9 ppm, masing-masing untuk isolat HI-2 dan TG-1. Kurva pertumbuhan dan penentuan sintesis AIA dibuat dengan menggunakan isolat HI-2 sebagai model. Dari kurva tersebut dapat diketahui bahwa produksi AIA sejalan dengan pertumbuhan sel bakteri. Konsentrasi AIA pada media yang ditambahkan L-triptofan lebih tinggi dibandingkan konsentrasi AIA pada media tanpa penambahan L-triptofan. AIA mulai dihasilkan pada jam ke-8, yaitu pada akhir fase logaritma dan terus meningkat pada fase stasioner. Hal ini mengindikasikan bahwa AIA termasuk senyawa metabolit sekunder pada bakteri. Dua belas isolat yang menghasilkan AIA tertinggi diuji kemampuannya dalam melarutkan fosfat anorganik dengan cara menumbuhkannya pada media Pikovskaya. Kemampuan melarutkan P terbesar dihasilkan oleh isolat DM-4 dengan indeks pelarutan P sebesar 55.6. Isolat HI-2 dan BY-1 diuji kemampuannya dalam memacu pertumbuhan kecambah biji kedelai. Hasil uji pemacuan perkecambahan biji memperlihatkan bahwa pengaruh perlakuan bakteri tidak berbeda nyata terhadap pemanjangan batang kecambah, tetapi memberikan pengaruh nyata terhadap pemanjangan akar primer dan percabangan akar lateral. Jumlah cabang akar lateral kecambah yang diberi perlakuan lebih banyak dibanding kontrol. Sebaliknya, inokulasi bakteri menghambat pemanjangan akar primer.
ABSTRACT
TIKA WIDAYANTI. Isolation and Characterization of Bacillus sp. Indigenous Producing Indole Acetic Acid from Rhizosphere Soils. Supervised by ARIS TRI WAHYUDI and NISA RACHMANIA MUBARIK.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Tika Widayanti
G34102021
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Isolasi dan Karakterisasi
Bacillus
sp. Indigenus Penghasil Asam
Indol Asetat Asal Tanah Rizosfer
Nama
: Tika Widayanti
NIM
: G34102021
Menyetujui
Pembimbing I,
Pembimbing II,
Dr. Aris Tri Wahyudi, M.Si.
Dr. Nisa Rachmania Mubarik, M.Si.
NIP 131 957 319
NIP 132 045 531
Mengetahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Prof. Dr. Ir. Yonny Koesmaryono, MS.
NIP 131 473 999
ilmiah ini berhasil diselesaikan. Tema yang dipilih adalah mikrob penghasil hormon tumbuhan, dengan judul Isolasi dan Karakterisasi Bacillus sp. Indigenus Penghasil Asam Indol Asetat Asal Tanah Rizosfer. Penelitian ini dilaksanakan di Laboratorium Mikrobiologi, Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Penulis menghaturkan terima kasih kepada Dr. Aris Tri Wahyudi, M.Si. dan Dr. Nisa Rachmania Mubarik, M.Si. selaku pembimbing atas ilmu pengetahuan dan saran yang telah diberikan. Ucapan terima kasih kepada Dr. Ir. H. Ibnul Qayim sebagai dosen penguji dan wakil komisi pendidikan atas saran dan diskusi yang diberikan. Penelitian ini dibiayai oleh The Second Kennedy Round (SKR) JICA Jepang Tahun 2006 melalui kerjasama Departemen Pertanian dengan Institut Pertanian Bogor yang berjudul ”Perbaikan dan Pemanfaatan Bahan Organik dan Mikrob Tanah Potensial untuk Meningkatkan Produksi Tanaman di Jawa Tengah dan Jawa Barat” untuk itu penulis juga menyampaikan terimakasih. Terima kasih penulis ucapkan kepada Ary sebagai teman seperjuangan, Vitria, Dewi, Tika T, Mia, Dhilah, Achie, Nirli, Ade, Wida, Disa, Eci, Ninda, Ela, Ina, Adisty, Adit, Bian serta seluruh teman-teman Biologi Angkatan 39 atas persahabatan, dukungan moral, dan perhatiannya. Ucapan terima kasih juga dihaturkan kepada Pa Djoni, Mba Heni, Mba Rika, Bu It, Mba Rina dan staf laboratorium lainnya atas bantuannya. Terima kasih juga penulis sampaikan kepada mama, papa, Rizki, serta seluruh keluarga atas segala doa dan kasih sayang yang senantiasa diberikan. Semoga karya ilmiah ini dapat bermanfaat.
Bogor, Januari 2007
RIWAYAT HIDUP
Penulis dilahirkan di kota Karawang pada tanggal 1 Februari 1985. Penulis merupakan anak pertama dari dua bersaudara, dari ayah Karyono dan ibu Titin Handayani. Tahun 2002 penulis lulus dari SMU Negeri 1 Cikampek dan pada tahun yang sama masuk Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Ujian Seleksi Masuk IPB (USMI).
DAFTAR TABEL... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN Latar Belakang ... 1
Waktu dan Tempat Penelitian ... 2
BAHAN DAN METODE Bahan ... 2
Metode ... 2
Isolasi Bacillus sp. dari Rizosfer... 2
Karakterisasi Fisiologi Secara Parsial... 2
Analisis Produksi Asam Indol Asetat (AIA) ... 2
Kurva Pertumbuhan dan Penentuan Sintesis AIA ... 2
Uji Pelarutan Fosfat ... 3
Uji Perkecambahan Biji Kedelai ... 3
HASIL DAN PEMBAHASAN Hasil ... 3
Isolasi Bacillus sp. dari Rizosfer... 3
Karakterisasi Fisiologi Secara Parsial... 3
Analisis Produksi Asam Indol Asetat (AIA) ... 3
Kurva Pertumbuhan dan Penentuan Sintesis AIA ... 5
Uji Pelarutan Fosfat ... 5
Uji Perkecambahan Biji Kedelai ... 5
Pembahasan... 6
SIMPULAN DAN SARAN Simpulan ... 8
Saran ... 8
DAFTAR PUSTAKA ... 9
DAFTAR TABEL
Halaman
1 Produksi asam indol asetat (AIA) dari isolat-isolat Bacillus sp. yang berhasil
diisolasi... 4 2 Hasil pengujian pelarutan fosfat dari 12 isolat Bacillus sp ... 5 3 Pengaruh inokulasi Bacillus sp. penghasil AIA terhadap perkecambahan biji kedelai... 6
DAFTAR GAMBAR
Halaman
1 Hasil pewarnaan Gram menunjukan bakteri Gram positif berbentuk batang dengan perbesaran 2000x (A), dan endospora dengan perbesaran 1000x, ditunjukkan dengan
tanda panah (B)... 3 2 Pengukuran konsentrasi AIA pada isolat TG-1, (A) media kosong (kontrol 1),
(B) kultur pada media tanpa L-trp, (C) kultur pada media dengan L-trp, (D) media
kosong yang ditambah L-trp (kontrol 2) ... 5
3 Kurva pertumbuhan dan sintesis AIA dari isolat HI-2 yang diproduksi pada media LB.... 5 4 Zona bening yang terbentuk pada media Pikovskaya menandakan trikalsium fosfat
yang telah terlarut (ditunjukkan dengan tanda panah) ... 5 5 Hasil perkecambahan kedelai, (a) kontrol, (B) kecambah yang diinokulasi dengan
isolat BY-1, (C) kecambah yang diinokulasi dengan isolat HI-2 ... 6
DAFTAR LAMPIRAN
Halaman
1 Karakteristik koloni Bacillus sp. yang berhasil diisolasi dari 11 lokasi pengambilan
PENDAHULUAN
Latar Belakang
Penggunaan senyawa kimia sebagai pupuk dan pestisida di bidang pertanian semakin meningkat seiring dengan berkembangnya pertanian modern. Hal ini telah menyebabkan dampak negatif terhadap lingkungan, terutama meningkatnya pencemaran lingkungan. Masyarakat saat ini juga cenderung lebih memilih pangan yang bebas pestisida dan bahan kimia lainnya. Kesadaran akan lingkungan yang sehat dan perkembangan di bidang bioteknologi telah mendorong berkembangnya penelitian tentang penggunaan mikroorganisme, khususnya bakteri dan cendawan, sebagai agen pupuk hayati dan pestisida alami yang ramah lingkungan. Penemuan ini diduga akan menjadi trend baru dalam pertanian modern.
Bakteri yang hidup di rizosfer yang memberikan pengaruh positif bagi pertumbuhan tanaman dikelompokkan sebagai plant growth-promoting rhizobacteria (PGPR). Istilah ini ditujukan untuk bakteri yang secara agresif mengkolonisasi rizosfer dan permukaan akar. PGPR juga dapat masuk ke dalam struktur akar dan membentuk populasi endofitik, misalnya Azospirillum sp. dan Azotobacter sp. (Kloepper et al. 1999; Gray & Smith 2005). Sedangkan untuk bakteri pemacu pertumbuhan yang berasosiasi dengan spesies tanaman dan umumnya terdapat di berbagai habitat disebut plant growth-promoting bacteria (PGPB) (Bashan & Holguin 1998). PGPB memberikan keuntungan melalui berbagai mekanisme yang berbeda, misalnya produksi metabolit sekunder seperti antibiotik, kitinase, β -1,3-glukanase, sianida, substansi hormon, sebagai pengendali biologi melalui kompetisi, induksi sistem pertahanan terhadap patogen, produksi siderofor, pelarutan fosfat dan fiksasi N2 (Glick 1995;
Husen 2003).
Mikroorganisme mampu menghasilkan hormon tumbuhan seperti auksin, sitokinin, dan giberelin (Leveau & Lindow 2005). Bakteri yang dapat menghasilkan auksin antara lain Pseudomonas sp. Azospirillum sp., Azotobacter sp., Bacillus sp., Lactobacillus sp., Paenibacillus polymyxa, Enterobacter sp., Serratia marcescens, Klebsiella sp., Alcaligenes faecalis dan
sianobakteria (Torres-Rubio et al. 2000; Leveau & Lindow 2005).
Asam indol asetat (AIA) merupakan hormon auksin utama pada tumbuhan yang mengendalikan berbagai proses fisiologi penting meliputi pembelahan dan perkembangan sel, diferensiasi jaringan, serta respon terhadap cahaya dan gravitasi (Salisbury & Ross 1992). Tumbuhan mungkin tidak mensintesis AIA dalam jumlah yang cukup untuk pertumbuhan yang optimal. Oleh karena itu diperlukan tambahan hormon pemacu pertumbuhan dari luar, meskipun berdasarkan penelitian-penelitian yang telah dilakukan, respon tanaman terhadap AIA yang dihasilkan mikrob berbeda-beda tergantung spesies tanaman dan konsentrasi AIA yang dilepaskan (Patten & Glick 2002). Biosintesis AIA oleh mikrob di tanah meningkat dengan adanya L-triptofan yang berasal dari eksudat akar atau sel-sel organisme yang rusak, karena L-triptofan merupakan prekursor pada lintasan biosintesis AIA (Benizri et al. 1998).
Mekanisme PGPB dalam memacu pertumbuhan tanaman, selain menghasilkan AIA diantaranya dengan melarutkan senyawa fosfat dalam tanah. Bakteri pelarut fosfat berpotensi meningkatkan ketersediaan fosfat terlarut bagi tanaman, terutama pada tanah yang banyak mengandung endapan fosfor. Bakteri pelarut fosfat melepaskan ikatan fosfat anorganik yang sukar larut dengan mensekresikan sejumlah asam organik. Mekanisme tersebut bukan satu-satunya cara untuk melarutkan fosfat. Beberapa bakteri seperti B. amyloliquefaciens, B. subtilis, Klebsiella terrigena, Pseudomonas spp. dan Enterobacter sp. dilaporkan mempunyai aktivitas fitase, suatu enzim golongan fosfomonoesterase yang mampu menghidrolisis polifosfat organik tak larut (fitat) menjadi rangkaian ester fosfat berbobot molekul rendah dari myo-inositol dan fosfat yang penting untuk prokariot dan eukariot (Idriss et al. 2002).
membuatnya memiliki eksistensi yang tinggi di alam karena spora tersebut tahan terhadap cekaman lingkungan. Hal ini menjadikannya sebagai PGPB yang dapat diformulasikan menjadi produk yang relatif stabil bila digunakan dalam skala industri dan aplikasi di lapangan (Emmert & Handelsman 1999).
Penelitian ini bertujuan mengisolasi dan mengkarakterisasi Bacillus sp. indigenus penghasil asam indol asetat asal tanah rizosfer.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Juni sampai November 2006, di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan
Bahan yang digunakan ialah isolat Bacillus yang berasal dari 11 lokasi pengambilan sampel tanah rizosfer yang diambil dari Demak, Kebumen, Rembang, Boyolali, dan Tegal, Jawa Tengah, serta Karawang, dan Indramayu, Jawa Barat (Lampiran 1), serta biji kedelai Tanggamus koleksi Dr. Ir Muhammad Jusuf (Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, IPB).
Metode
Isolasi Bacillus sp. dari Rizosfer.
Isolasi Bacillus sp. dilakukan dengan memasukkan 1 gram sampel tanah rizosfer ke dalam tabung berisi 10 ml larutan garam fisiologis (NaCl 0.85%), dikocok kuat, dan dipanaskan di dalam penangas air pada suhu 80 °C selama 20 menit, kemudian dilakukan pengenceran secara serial. Pengenceran 10-5, 10-6, dan 10-7 disebar sebanyak 100 µl pada media agar-agar nutrien (NA), dan diinkubasi selama 24 jam pada suhu ruang. Koloni bakteri yang tumbuh diamati serta dimurnikan pada media Luria Bertani Agar (LA) yang mengandung NaCl 10 g, tripton 10 g, ekstrak khamir 5 g, dan agar-agar 20 g untuk 1 L media.
Karakterisasi Fisiologi Secara Parsial.
Pewarnaan Gram, pewarnaan spora, uji katalase dan preparat lekapan basah dilakukan berdasarkan metode standar (Lay 1994). Masing-masing bakteri yang digunakan untuk pewarnaan Gram dan spora berumur 12 dan 48 jam, dan uji katalase
menggunakan bakteri berumur 24 jam pada media LA.
Analisis Produksi Asam Indol Asetat (AIA). Produksi asam indol asetat diukur berdasarkan metode kolorimetri menggunakan reagen Salkowski (Gordon & Weber 1951; Patten & Glick 2002) yang mengandung 150 ml H2SO4 pekat, 250 ml
akuades, dan 7.5 ml FeCl3 0.5 M. Isolat
bakteri yang diperoleh diinokulasikan sebanyak satu lup ke dalam dua media, yaitu media LB yang ditambah dengan L-triptofan (L-trp) 0.5 mM dan media LB tanpa penambahan L-trp. Kultur tersebut kemudian dikocok dengan kecepatan 100 rpm selama 48 jam pada suhu ruang. Selanjutnya kultur disentrifugasi pada kecepatan 9000 g selama 30 menit. Supernatan diambil sebanyak 2 ml dan dimasukkan ke dalam tabung reaksi steril, kemudian ditambahkan 2 ml reagen Salkowski dan dikocok dengan vortex. Sebagai kontrol, digunakan media kosong tanpa triptofan dan media yang ditambah triptofan. Selanjutnya dibiarkan pada suhu ruang dalam keadaan gelap selama satu jam sebelum diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 510 nm. Konsentrasi AIA yang terdapat dalam kultur ditentukan berdasarkan kurva standar AIA (Lampiran 2). Isolat-isolat yang menghasilkan AIA dalam jumlah cukup besar diseleksi untuk pengujian pelarutan fosfat.
HASIL DAN PEMBAHASAN
mengukur turbiditas dari pengenceran 1:1,1:2, 1:4, 1:8, 1:16, sedangkan hitungan cawan dengan menyebar inokulum pada pengenceran 10-6, 10-8, 10-9, 10-10.
Hasil
Isolasi Bacillus sp. dari Rizosfer. Hasil isolasi Bacillus sp. dari 11 lokasi pengambilan sampel tanah diperoleh sebanyak 63 isolat yang berpotensi sebagai penghasil AIA (Tabel 1). Pemanasan sampel tanah bertujuan sebagai seleksi awal isolasi. Bacillus sp. akan tahan terhadap pemanasan karena memiliki struktur endospora, sedangkan bakteri lain akan mati. Isolat-isolat tersebut kemudian diamati karakter koloninya secara visual.
Uji Pelarutan Fosfat. Dua belas isolat bakteri terpilih diuji kemampuannya dalam melarutkan fosfat. Isolat-isolat tersebut ditumbuhkan dengan cara ditotol pada media agar yang mengandung trikalsium fosfat, yang merupakan modifikasi dari media Pikovskaya (Rao & Sinha 1962) dengan komposisi glukosa 10 g, Ca3HO13P3 5 g,
(NH4)2SO4 0.5 g, KCl 0.2 g, MgSO4·7H2O
0.1 g, ekstrak khamir 0.5 g, MnSO4 25 mg,
dan FeSO4 25 mg, serta agar-agar 15 g
dalam 1 L akuades. Setelah inkubasi selama 7 hari, zona bening yang terdapat di sekeliling koloni diamati dan diukur indeks pelarutan fosfatnya berdasarkan rumus:
Karakterisasi Fisiologi Secara Parsial.
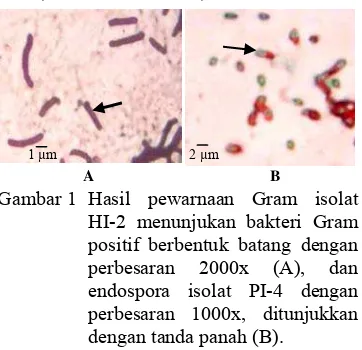
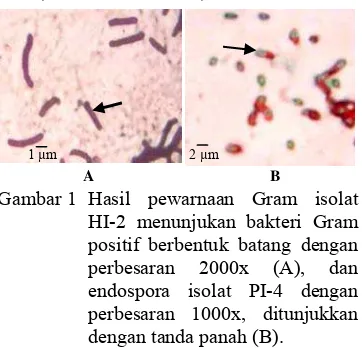
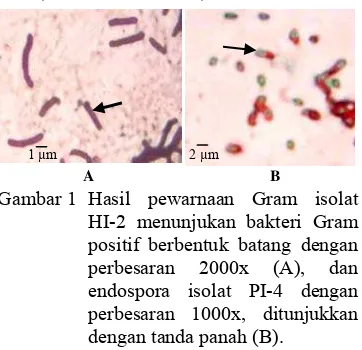
Hasil pewarnaan Gram dan spora menunjukkan sel bakteri bersifat Gram positif, berbentuk batang dengan ukuran dan penataan yang berbeda-beda, dan memiliki endospora dengan bentuk dan letak yang bervariasi (Gambar 1). Uji katalase memperlihatkan hasil positif untuk seluruh isolat, kecuali isolat HI-9, SI-2 dan PI-8. Indeks pelarutan fosfat =
koloni diameter koloni diameter bening zona diameter −
Uji Perkecambahan Biji Kedelai.
Perkecambahan biji dilakukan untuk melihat respon AIA yang disintesis bakteri terhadap pertumbuhan kecambah biji. Uji perkecambahan biji menggunakan kedelai varietas Tanggamus sebagai model. Biji kedelai Tanggamus disterilisasi permukaannya dengan cara direndam dalam etanol 95% selama 10 detik, kemudian direndam dalam H2O2 5% selama 5 menit
dan dibilas dengan akuades steril sebanyak 7 kali untuk menghilangkan residu peroksida.
1 µm 2 µm
Gambar 1 Hasil pewarnaan Gram isolat HI-2 menunjukan bakteri Gram positif berbentuk batang dengan perbesaran 2000x (A), dan endospora isolat PI-4 dengan perbesaran 1000x, ditunjukkan dengan tanda panah (B).
A B
Biji yang telah steril diletakkan pada cawan yang dialasi kertas saring yang telah dibasahi dengan akuades steril, kemudian diletakkan di ruang gelap. Setelah 24 jam, setiap biji yang telah mulai berkecambah ditetesi dengan 100 μl kultur bakteri (± 8x109 sel/ml). Isolat yang digunakan ialah HI-2, mewakili isolat yang menghasilkan AIA dengan konsentrasi tinggi, dan BY-1 mewakili isolat yang menghasilkan AIA dengan konsentrasi rendah, serta media kosong sebagai kontrol. Cawan tersebut diinkubasi selama 7 hari pada suhu ruang dalam kondisi gelap. Kemudian dilakukan pengukuran panjang batang, panjang akar primer, dan jumlah akar lateral. Setiap perlakuan dilakukan sebanyak dua kali ulangan dan setiap ulangan menggunakan sepuluh biji kedelai. Hasil pengukuran dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) menggunakan program SPSS.
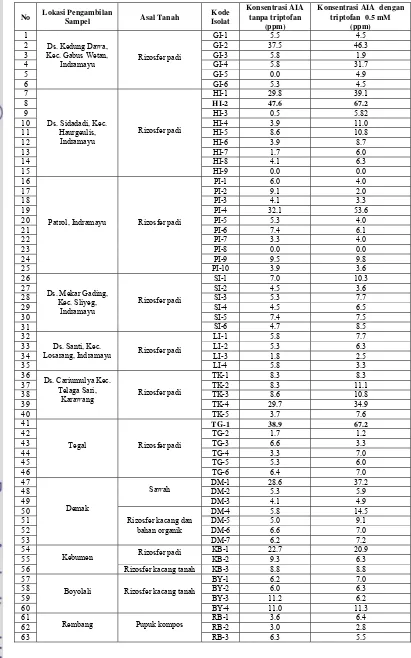
Tabel 1 Produksi asam indol asetat (AIA) dari isolat-isolat Bacillus sp. yang berhasil diisolasi
No Lokasi Pengambilan
Sampel Asal Tanah
Kode Isolat
Konsentrasi AIA tanpa triptofan
(ppm)
Konsentrasi AIA dengan triptofan 0.5 mM
(ppm)
1 GI-1 5.5 4.5
2 GI-2 37.5 46.3
3 GI-3 5.8 1.9
4 GI-4 5.8 31.7
5 GI-5 0.0 4.9
6
Ds. Kedung Dawa, Kec. Gabus Wetan,
Indramayu Rizosfer padi
GI-6 5.3 4.5
7 HI-1 29.8 39.1
8 HI-2 47.6 67.2
9 HI-3 0.5 5.82
10 HI-4 3.9 11.0
11 HI-5 8.6 10.8
12 HI-6 3.9 8.7
13 HI-7 1.7 6.0
14 HI-8 4.1 6.3
15
Ds. Sidadadi, Kec. Haurgeulis,
Indramayu
Rizosfer padi
HI-9 0.0 0.0
16 PI-1 6.0 4.0
17 PI-2 9.1 2.0
18 PI-3 4.1 3.3
19 PI-4 32.1 53.6
20 PI-5 5.3 4.0
21 PI-6 7.4 6.1
22 PI-7 3.3 4.0
23 PI-8 0.0 0.0
24 PI-9 9.5 9.8
25
Patrol, Indramayu Rizosfer padi
PI-10 3.9 3.6
26 SI-1 7.0 10.3
27 SI-2 4.5 3.6
28 SI-3 5.3 7.7
29 SI-4 4.5 6.5
30 SI-5 7.4 7.5
31
Ds. Mekar Gading, Kec. Sliyeg,
Indramayu
Rizosfer padi
SI-6 4.7 8.5
32 LI-1 5.8 7.7
33 LI-2 5.3 6.3
34 LI-3 1.8 2.5
35
Ds. Santi, Kec.
Losarang, Indramayu Rizosfer padi
LI-4 5.8 3.3
36 TK-1 8.3 8.3
37 TK-2 8.3 11.1
38 TK-3 8.6 10.8
39 TK-4 29.7 34.9
40
Ds. Cariumulya Kec. Telaga Sari,
Karawang Rizosfer padi
TK-5 3.7 7.6
41 TG-1 38.9 67.2
42 TG-2 1.7 1.2
43 TG-3 6.6 3.3
44 TG-4 3.3 7.0
45 TG-5 5.3 6.0
46
Tegal Rizosfer padi
TG-6 6.4 7.0
47 DM-1 28.6 37.2
48 DM-2 5.3 5.9
49
Sawah
DM-3 4.1 4.9
50 DM-4 5.8 14.5
51 DM-5 5.0 9.1
52 DM-6 6.6 7.0
53
Demak
Rizosfer kacang dan bahan organik
DM-7 6.2 7.2
54 KB-1 22.7 20.9
55 Rizosfer padi KB-2 9.3 6.3
56
Kebumen
Rizosfer kacang tanah KB-3 8.8 8.8
57 BY-1 6.2 7.0
58 BY-2 6.0 6.3
59 BY-3 11.2 6.2
60
Boyolali Rizosfer kacang tanah
BY-4 11.0 11.3
61 RB-1 3.6 6.4
62 RB-2 3.0 2.8
63
Rembang Pupuk kompos
5.9 6 6.1 6.2 6.3 6.4 6.5 6.6 6.7 6.8 6.9
0 4 8 12 16 20 24 28 32 36 40 44 48 52
Waktu (jam) Log sel
-5 5 15 25 35 45 55 65
Konsentrasi AIA (ppm)
Pertumbuhan HI-2 dalam media dengan penambahan triptofan Pertumbuhan HI-2 dalam media tanpa penambahan triptofan Produksi AIA dengan penambahan triptofan
Produksi AIA tanpa penambahan triptofan
Gambar 2 Pengukuran konsentrasi AIA pada isolat TG-1, (A) media kosong (kontrol 1), (B) kultur pada media tanpa L-trp, (C) kultur pada media dengan L-trp, (D) media kosong yang ditambah L-trp (kontrol 2).
Kurva Pertumbuhan dan Penentuan Sintesis AIA. Pertumbuhan isolat HI-2 cenderung tidak dipengaruhi oleh penambahan triptofan (Gambar 3). Isolat HI-2 mulai memproduksi AIA pada jam ke-8, baik pada media dengan penambahan L-trp maupun media tanpa L-trp. Konsentrasi AIA pada media dengan L-trp terus meningkat dan mencapai konsentrasi tertinggi pada jam ke-31, yaitu 61.2 ppm dengan jumlah sel 8.3x109 sel/ml. Pada media tanpa L-trp, konsentrasi AIA mencapai puncak pada jam ke-43, yaitu sebesar 53.9 ppm dengan jumlah sel 8.3x109 sel/ml.
Gambar 3 Kurva pertumbuhan dan sintesis AIA dari isolat HI-2 yang diproduksi pada media LB.
Uji Pengecambahan Biji Kedelai.
Pemberian inokulasi bakteri penghasil AIA tidak memberikan pengaruh berbeda nyata terhadap pemanjangan batang, tetapi memberikan pengaruh terhadap perkembangan akar primer dan akar lateral kecambah kedelai (Tabel 3). Akar primer kecambah yang diinokulasi dengan Bacillus sp. penghasil AIA lebih pendek dibandingkan dengan kontrol (Gambar 5). Tetapi jumlah akar lateral kecambah yang diberi perlakuan bakteri cenderung lebih
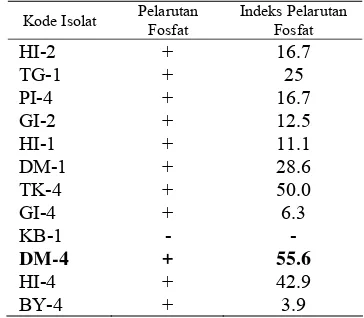
Uji Pelarutan Fosfat. Uji pelarutan fosfat dilakukan terhadap 12 isolat yang menghasilkan AIA tertinggi. Dari 12 isolat yang diuji, diperoleh 11 isolat yang
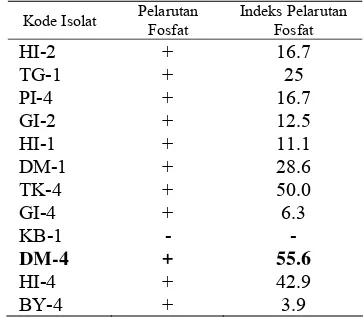
menunjukkan kemampuan melarutkan fosfat. Aktivitas pelarutan fosfat ditandai dengan terbentuknya zona bening di sekitar koloni bakteri (Gambar 4). Berdasarkan hasil uji pelarutan P, indeks pelarutan P terbesar dihasilkan oleh isolat DM-4 yaitu 55.6, kemudian disusul isolat TK-4 (50) dan HI-4 (42.9) (Tabel 2). Isolat HI-2 dan TG-1 yang menghasilkan AIA tertinggi memiliki indeks pelarutan P masing-masing sebesar 16.7 dan 25. Sedangkan pada isolat KB-1 tidak menunjukkan adanya pelarutan fosfat. A B C D
Gambar 4 Zona bening yang terbentuk pada media Pikovskaya menandakan trikalsium fosfat yang telah terlarut (ditunjukkan dengan tanda panah).
Tabel 2 Hasil pengujian pelarutan fosfat dari 12 isolat Bacillus sp.
Kode Isolat Pelarutan Fosfat
Indeks Pelarutan Fosfat
HI-2 + 16.7 TG-1 + 25 PI-4 + 16.7 GI-2 + 12.5 HI-1 + 11.1 DM-1 + 28.6 TK-4 + 50.0 GI-4 + 6.3 KB-1 - -
DM-4 + 55.6
banyak dibandingkan dengan kontrol. Isolat BY-1 yang menghasilkan AIA rendah menginduksi pertumbuhan akar lateral lebih banyak daripada isolat HI-2 yang menghasilkan konsentrasi AIA tinggi.
Tabel 3 Pengaruh inokulasi Bacillus sp. penghasil AIA terhadap perkecambahan biji kedelai
Perlakuan
Panjang batang
(cm)
Panjang akar primer
(cm)
Jumlah akar lateral Kontrol 4.4a 3.7a 35.9a BY-1 4.0a 0.9b 41.7b
HI-2 3.9a 1.3b 36.9ab
Angka yang diikuti huruf yang sama dalam satu kolom tidak berbeda nyata pada taraf 5% menurut uji Duncan
Gambar 5 Hasil perkecambahan kedelai, (a) kontrol, (B) kecambah yang diinokulasi dengan isolat BY-1, (C) kecambah yang diinokulasi dengan isolat HI-2.
Pembahasan
Asam indol asetat (AIA) adalah jenis auksin yang penting bagi pertumbuhan tanaman. AIA terlibat dalam berbagai proses fisiologi tumbuhan seperti inisiasi akar, pemanjangan sel, diferensiasi jaringan pembuluh, dan proses pembungaan (Husen & Saraswati 2003). Sebanyak 63 isolat Bacillus berhasil diisolasi dari 11 lokasi pengambilan sampel. Hasil karakterisasi fisiologis menunjukkan sel Bacillus berbentuk batang, bersifat Gram positif, memiliki endospora, dan pada umumnya bersifat katalase positif, kecuali untuk isolat HI-9, SI-2, dan PI-8 bersifat katalase negatif. Dari 63 isolat yang diuji, diperoleh sebanyak 61 isolat yang dapat mensintesis AIA. Dua isolat yang menghasilkan AIA dengan konsentrasi tertinggi adalah isolat HI-2 dan TG-1. Namun pada media tanpa penambahan L-trp, isolat TG-1 menghasilkan AIA lebih rendah dibandingkan dengan isolat HI-2. Isolat HI-2
memiliki karakter koloni bundar dengan tepian rata, berwarna krem kecoklatan, berlendir, dan elevasinya cembung. Sedangkan isolat TG-1 memiliki karakter koloni bundar dengan tepian rata, warna putih krem, berlendir dan elevasinya cembung (Lampiran 3). Beberapa spesies Bacillus yang telah diketahui berperan sebagai PGPB adalah B. subtilis, B. pumilus, B. cereus, B. brevis, B. polymyxa, B. pasteurii, B. amyloliquifaciens (Ryu et al. 2004; Shishido et al. 1996)
Reagen Salkowski yang digunakan dalam pengukuran AIA dapat bereaksi dengan asam indol piruvat yang terakumulasi dalam filtrat yang diuji sehingga menyebabkan terbentuknya warna merah. Asam indol piruvat merupakan produk dari katalisis triptofan yang dilakukan triptofan transaminase. Katalisis oleh enzim ini merupakan langkah awal dalam lintasan biosintesis AIA (Patten & Glick 2002). Glickmann dan Dessaux (1995) juga melaporkan bahwa Salkowski dapat mendeteksi keberadaan senyawa-senyawa antara dalam sintesis AIA, seperti triptofan, indol etanolamin (triptamin), indol etanol (triptofol), asam indol piruvat, asam indol laktat (ILA) dan indol asetamida (IAM). A B C
Hasil pengukuran AIA dari isolat Bacillus yang diperoleh memperlihatkan bahwa sebagian besar isolat yang ditumbuhkan pada media yang ditambah dengan triptofan menunjukkan konsentrasi AIA yang lebih tinggi dibandingkan konsentrasi AIA pada media tanpa penambahan triptofan. Hal ini terjadi karena L-triptofan (L-trp) merupakan prekursor pada biosintesis AIA. Biosintesis AIA baik pada tumbuhan maupun pada bakteri dapat terjadi melalui lintasan yang bergantung L-trp (tryptophan-dependent pathway) atau tidak bergantung L-trp (tryptophan-independent pathway). Lintasan yang tidak bergantung L-trp menggunakan indol sebagai prekursor dalam sintesis auksin. Pada bakteri patogen tanaman, seperti Agrobacterium tumefaciens dan Pseudomonas syringae, AIA dihasilkan dari L-trp melalui lintasan indol asetamida yang memiliki keterlibatan dalam menginduksi tumor tanaman. Sedangkan pada bakteri nonpatogen, seperti PGPB, sintesis AIA umumnya terjadi melalui lintasan asam indol piruvat yang tergantung L-trp (Patten & Glick 2002).
L-trp, sehingga dapat diindikasikan bahwa Bacillus mampu mensintesis AIA tanpa keberadaan L-trp. Bacillus sp. juga diketahui dapat membentuk L-trp di dalam selnya. Regulasi gen yang terlibat dalam biosintesis L-trp telah dipelajari secara ekstensif pada B. subtilis, B. pumilus, B. halodurans, dan B. stearothermophilus. B. subtilis memiliki operon trpEDCFBA yang mengandung 6 dari 7 gen yang diperlukan dalam biosintesis triptofan dari asam khorismat (prekursor kelompok asam amino) (Szigeti et al. 2004). Sedangkan beberapa kelompok bakteri seperti Azospirillum sp. tidak dapat mensintesis AIA tanpa keberadaan L-trp dalam media tumbuhnya. Di tanah, bakteri rizosfer memperoleh L-trp untuk mensintesis AIA dari eksudat akar atau sel-sel organisme yang rusak.
Pola produksi AIA sejalan dengan pertumbuhan sel bakteri. Dari kurva pertumbuhan dan penentuan sintesis AIA dapat dilihat bahwa AIA mulai disintesis pada awal fase log meskipun dalam jumlah yang sedikit. AIA diproduksi secara signifikan pada akhir fase logaritma, yaitu pada jam ke-8. Pada media dengan penambahan L-trp, saat sel mulai memasuki fase stasioner, yaitu pada jam ke-10, produksi AIA meningkat dengan pesat (27.1 ppm), kemudian terus meningkat hingga mencapai puncak pada jam ke-31 (61.2 ppm). Sedangkan dalam media tanpa penambahan L-trp, konsentrasi AIA mencapai puncak pada jam ke-43 (53.7 ppm). Memasuki fase kematian, produksi AIA sedikit demi sedikit mengalami penurunan.
Produksi AIA pada isolat HI-2 yang ditumbuhkan dalam media tanpa L-trp lebih rendah dibanding produksi AIA oleh isolat HI-2 dalam media yang ditambah L-trp. Konsentrasi AIA yang dihasilkan tergantung aktivitas dan jumlah sel, ketersediaan nutrisi dalam media dan substrat L-trp. Gambar 3 menunjukkan bahwa penambahan L-trp sangat berpengaruh terhadap produksi AIA, tetapi cenderung tidak mempengaruhi pertumbuhan sel isolat HI-2. Dari hasil tersebut dapat diduga bahwa AIA yang disintesis bakteri merupakan senyawa metabolit sekunder, namun perlu analisis lebih lanjut fase pertumbuhan dihasilkannya enzim-enzim yang terlibat dalam biosintesis AIA. Metabolit sekunder biasanya dihasilkan saat sel kekurangan nutrisi atau dalam kondisi pertumbuhan suboptimal, adanya biosintesis atau penambahan induser,
atau penurunan rata-rata pertumbuhan sel bakteri (Somers et al. 2005).
Bacillus termasuk kelompok bakteri pelarut fosfat yang sudah banyak dipelajari. Spesies Bacillus yang dilaporkan dapat melarutkan fosfat antara lain B. brevis, B. cereus, B. circulans, B. firmus, B. licheniformis, B. megaterium, B. mesentricus, B. mycoides, B. polymyxa, B. pumilis, B. pulvifaciens dan B. subtilis (Tilak et al. 2005). Uji pelarutan fosfat menunjukkan bahwa isolat DM-4 memiliki indeks zona bening pelarutan fosfat yang paling tinggi, yaitu sebesar 55.6. Indeks zona bening berkorelasi dengan kemampuan melarutkan fosfat.
Peranan mikrob dalam melarutkan senyawa fosfat terkait dengan asam organik yang dihasilkan dari aktivitas mikrob (Premono 1998). Asam alifatik dengan β -hidroksil dan α-hidroksil seperti sitrat dan oksalat sangat efektif dalam melarutkan batuan fosfat. Premono (1998) mengungkapkan beberapa teori yang berhubungan erat dengan pelarutan P karena aktivitas mikrob, diantaranya (i) pelepasan ortofosfat dari ikatan logam-P melalui pembentukan kompleks logam-organik, (ii) persaingan anion organik dan ortofosfat pada tapak jerapan koloid tanah yang bermuatan positif, (iii) perubahan muatan tapak jerapan oleh ligan organik. Berdasarkan Idriss et al. (2002), pelarutan fosfat oleh bakteri, misalnya pada B. subtilis dan B. amyloliquifaciens, juga terjadi karena aktivitas fosfatase dan fitase (enzim yang menghidrolisis fosfat organik sukar larut/fitat).
AIA yang disekresikan bakteri meningkatkan pertumbuhan akar tanaman secara langsung dengan menstimulasi pemanjangan atau pembelahan sel. Kemampuan produksi AIA dari dua isolat bakteri, yaitu isolat BY-1 dan HI-2 dikaji potensinya dalam meningkatkan pertumbuhan kecambah kacang kedelai. Kedelai kultivar Tanggamus digunakan sebagai model tanaman dalam rangka mengembangkan potensi galur-galur kedelai tahan asam yang dapat diaplikasikan pada lahan asam. Kedelai Tanggamus memiliki kandungan protein paling tinggi, yaitu sebesar 44.5% namun produktivitasnya relatif rendah dan ukuran bijinya kecil (Yulianti 2006).
pengaruh yang berbeda terhadap pemanjangan akar primer dan perkembangan akar lateral kecambah biji. Akar primer kecambah yang diinokulasi dengan Bacillus sp. penghasil AIA lebih pendek dan memiliki percabangan akar lateral yang lebih banyak dibandingkan dengan kontrol, terutama isolat BY-1. Patten & Glick (2002) menyebutkan bahwa konsentrasi AIA yang rendah, yaitu sekitar 10-9–10-12 M, akan menstimulasi pemanjangan akar lateral, sedangkan konsentrasi AIA yang tinggi yang dihasilkan oleh inokulum dengan kepadatan tinggi menstimulasi pembentukan akar lateral dan adventif. Tetapi pada penelitian ini, inokulasi kecambah baik menggunakan isolat HI-2 maupun BY-1 menunjukkan adanya penghambatan pemanjangan akar primer. Hal ini dapat disebabkan konsentrasi AIA pada kultur yang diinokulasikan masih tergolong taraf yang tinggi (± 10-5-10-3 M). Nilai tersebut diperkirakan dari jumlah bakteri pada kultur sel. Aryantha et al. (2004) menyatakan kecambah kacang hijau yang ditumbuhkan secara hidroponik dengan produk cair dari aktinomiset galur LC (36.4 µg AIA/ml media) dan Bacillus galur D3 (52.5 µg AIA/ml media) mampu meningkatkan jumlah akar lateral dan panjang kecambah pada pengenceran 20 kali. Sedangkan kultur aktinomiset galur LC pada pengenceran 40 dan 60 kali telah memberikan efek peningkatan panjang kecambah yang optimum. Hasil tersebut sesuai dengan sifat hormon tumbuh yang efektif dalam jumlah yang sangat rendah (Aryantha et al. 2004).
Glick (1995) melaporkan mekanisme terjadinya penghambatan pertumbuhan tanaman akibat produksi AIA yang berlebihan. AIA eksogenus dalam jumlah yang tinggi akan meningkatkan transkripsi dan aktivitas aminosiklopropana-1-karboksilat (ACC) sintase. Enzim ini akan mengkatalisis produksi ACC di tanaman. Senyawa ACC merupakan prekursor dari hormon tumbuhan etilen, sehingga konsentrasi etilen di tanaman meningkat. Etilen berperan sebagai modulator fitohormon lain dan mencegah terjadinya pertumbuhan yang berlebihan (overgrowth). Etilen juga berfungsi menghambat elongasi akar pada proses perkecambahan. Beberapa PGPB menstimulasi elongasi akar secara tidak langsung dengan menghasilkan aktivitas ACC deaminase yang dapat
menginaktivasi ACC di tanaman (Patten & Glick 2002).
Produksi AIA sebagai hormon tanaman oleh bakteri tidak berfungsi sebagai hormon pada sel bakteri itu sendiri, namun lebih mengarah kepada perkembangan hubungan interaksi antara bakteri dengan tanaman. Keuntungannya bagi bakteri yang berasosiasi dengan akar yaitu meningkatnya suplai nutrisi berupa produk metabolit hasil fiksasi karbon yang dilakukan tanaman. Produk metabolit tersebut dilepaskan ke rizosfer melalui akar sebagai eksudat, lisat dan getah (Patten & Glick 2002). Pada Azospirillum brasilense, biosintesis AIA dari L-trp diduga bertujuan untuk mereduksi tingkat toksisitas L-trp (Bar & Okon 1992). Sedangkan Dosselaere et al. (1997) menyebutkan bahwa AIA memiliki peranan fisiologi tertentu di dalam bakteri, dan bukan hanya merupakan produk akhir dari proses detoksifikasi. Hal ini karena gen ipdC yang diklon dari A. brasilense dinduksi oleh AIA, bukan oleh L-trp. Gen ipdC merupakan salah satu dari dua gen yang terlibat dalam keseluruhan sintesis AIA.
SIMPULAN DAN SARAN
Simpulan
Sejumlah 61 isolat Bacillus sp. yang diperoleh dari 11 lokasi pengambilan sampel tanah rizosfer diketahui dapat mensintesis AIA. Isolat HI-2 dan TG-1 menghasilkan konsentrasi AIA tertinggi, yaitu sebesar 67.2 ppm pada media dengan penambahan triptofan, sedangkan pada media tanpa penambahan triptofan sebesar 47.6 ppm dan 38.9 ppm masing-masing untuk isolat HI-2 dan TG-1. AIA mulai disintesis oleh isolat HI-2 pada jam ke-8 dan mencapai puncak pada fase stasioner. Pada uji pelarutan P, isolat DM-4 memiliki indeks pelarutan P tertinggi yaitu 55.6. Inokulasi dengan Bacillus penghasil AIA dapat meningkatkan jumlah akar lateral kecambah kedelai.
Saran
DAFTAR PUSTAKA
Aryantha INP, Lestari DP, Pengesti NPD. 2004. Potensi isolat bakteri penghasil IAA dalam peningkatan pertumbuhan kecambah kacang hijau pada kondisi hidroponik. J Mikrobiol Indones 9:43-46.
Bar T, Okon Y. 1992. Induction of indole-3-acetic acid synthesis and possible toxicity of tryptophan in Azospirillum brasilense Sp7. Symbiosis 13:191-198. Bashan Y, Holguin G. 1998. Proposal for
the division of plant growth-promoting rhizobacteria into two classifications: biocontrol-PGPB (plant growth-promoting bacteria) and PGPB. Soil Biol Biochem 30:1225–1228.
Benizri E, Courtade A, Picard C, Gucker A. 1998. Role of maize root exudates in the production of auxins by Pseudomonas fluorescens M.3.1. Soil Biol Biochem 30:1481-1484.
Compant S, Duffy B, Nowak J, Clement C, Barka EA. 2005. Minireview: Use of of plant growth-promoting bacteria for biocontrol of plant diseases: principles, mechanisms of action, and future prospects. Appl Environ Microbiol 71:4951-4959.
Dosselaere F et al. 1997. Indole-3-acetic biosynthesis in Azospirillum brasilense. Di dalam: Proceedings of the Fourth International Workshop on Plant Growth-Promoting Rhizobacteria; Sapporo, 5-10 Okt 1997. Hlm 306-309. Emmert EAB, Handelsman J. 1999.
Biocontrol of plant disease : a (Gram-) positive perspective. FEMS Microbiol Lett 171:1-9.
Glick BR. 1995. The enhancement of plant growth by free-living bacteria. Can J Microbiol 41:109–117.
Glickmann E, Dessaux Y. 1995. A critical examination of the specificity of the Salkowski reagen for indolic compounds produced by phytopathogenic bacteria. Appl Environ Microbiol 61:793-796.
Gordon SA, Weber RP. 1951. Colorimetric estimation of indoleacetic acid. Plant physiol 26:192-197.
Gray EJ, Smith DL. 2005. Intracellular and extracellular PGPR: commonalities and distinctions in the plant-bacterium signaling processes. Soil Biol Biochem 37:395–412.
Husen E. 2003. Screening of soil bacteria for plant growth promotion activities in vitro. [komunikasi singkat]. Indones J Agric Sci 4:27-31.
Husen E, Saraswati R. 2003. Effect of IAA-producing bacteria on the growth of hot pepper. J Mikrobiol Indones 8:22-26. Idriss EE et al. 2002. Extracellular phytase
aktivity of Bacillus amyloliquefaciens FZB45 contributes to its plant-growth-promoting effect. Microbiology 148:2097-2109.
Kloepper JW et al. 1999. Plant root-bacterial interactions in biological control of soilborne diseases and potential extension to systemic and foliar diseases. Austral Plant Pathol 28:21– 26.
Lay BW. 1994. Analisis Mikroba di Laboratorium. Jakarta: PT Raja Grafindo Persada.
Leveau JHJ, Lindow SE. 2005. Utilization of the plant hormone indole-3-acetic acid for growth by Pseudomonas putida strain 1290. Appl Environ Microbiol 71:2365-2371.
Patten CL, Glick BR. 2002. Role of Pseudomonas putida indoleacetic acid in development of the host plant root system. Appl Environ Microbiol 68:3795-3801.
Premono ME. 1998. Mikrob pelarut fosfat untuk mengefisiensikan pupuk fosfat dan prospeknya di Indonesia. Hayati 5:85-94.
Rao SWCB, Sinha MK. 1962. Phosphate dissolving microorganism in the soil and rhizosphere. Indian J Sci 23:272-278.
Ryu CM et al. 2004. Bacterial volatiles induce systemic resistance in Arabidopsis. Plant Physiol 134:1017– 1026.
Salisbury FB, Ross CW. 1992. Plant Physiology. Ed ke-4. California: Worth Publishing, Inc.
Shishido M, Massicotte HB, Chanway CP. 1996. Effect of plant growth promoting Bacillus strains on pine and spruce seedling growth and mycorrhizal infection. Ann Bot 77:433-441.
Szigeti R, Milescu M, Gollnick P. 2004. Regulation of the tryptophan biosynthetic genes in Bacillus halodurans: common elements but different strategies than those used by Bacillus subtilis. J Bacteriol 186:818-828.
Tilak KVBR et al. 2005. Diversity of plant growth and soil health supporting bacteria. Curr Sci 89:136-150.
Torres-Rubio MG, Valencia-Plata SA, Bernal-Castillo J, Martinez-Nieto P. 2000. Isolation of Enterobacteria,
Azospirillum sp. and Pseudomonas sp., producers of indol-3-acetic acid and siderofor, from Colombian rice rizosfer. Rev Latinoamericana de Microbiol 42:171-176.
Lampiran 1 Karakteristik koloni Bacillus sp. yang berhasil diisolasi dari 11 lokasi pengambilan sampel
Karakteristik koloni bakteri
Lokasi Sampel Kode isolat Bentuk Permukaan Warna Tepian Elevasi
GI-1 Tidak
beraturan Kering Krem
Berlekuk-lekuk Datar
GI-2 Bundar Berlendir Krem Rata Cembung
GI-3 Bundar Berlendir Krem Rata Cembung
GI-4 Bundar Berlendir Putih Rata Cembung
GI-5 Bundar Kering Putih keruh Rata Cembung
Ds. Kedung Dawa, Kec. Gabus Wetan,
Indramayu (6 isolat)
GI-6 Bundar Berlendir Coklat Rata Cembung
HI-1 Bundar Berlendir Krem Rata Timbul
HI-2 Bundar Berlendir Krem
kecoklatan Rata Cembung
HI-3 Bundar Berlendir Putih Rata Cembung
HI-4 Bundar Berlendir Krem Rata Cembung
HI-5 Tidak
beraturan Berlendir Putih keruh
Berlekuk-lekuk Datar
HI-6 Bundar Seperti berpati Putih Rata Cembung
HI-7 Tidak
beraturan Kering Putih keruh
Berlekuk-lekuk Timbul
HI-8 Bundar Seperti berpati Putih Rata Cembung
Ds. Sidadadi, Kec. Haurgeulis,
Indramayu (9 isolat)
HI-9 Bundar Agak kering, keriput Krem Rata Timbul
PI-1 Tidak
beraturan Berlendir Putih keruh
Berlekuk-lekuk Datar
PI-2 Bundar Berlendir Krem Rata Cembung
PI-3 Bundar Berlendir Putih keruh Rata Cembung
PI-4 Bundar Berlendir Krem Rata Cembung
PI-5 Tidak
beraturan Kering Krem
Berlekuk-lekuk Datar
PI-6 Bundar Berlendir Krem Rata Cembung
PI-7 Bundar Berlendir Krem Rata Cembung
PI-8 Bundar Berlendir Kuning Rata Cembung
PI-9 Tidak
beraturan Berlendir Krem Berombak Datar
Patrol, Indramayu (10 isolat)
PI-10 Bundar Kering, seperti berpati Putih keruh Rata Timbul
SI-1 beraturan Tidak Kering Putih keruh Berlekuk-lekuk Timbul
SI-2 Bundar Berlendir Putih Rata Cembung
SI-3 Bundar Kering Putih keruh Rata Cembung
SI-4 Bundar Berlendir Krem Rata Cembung
SI-5 Bundar Berlendir Krem Rata Timbul
Ds. Mekar Gading, Kec. Sliyeg,
Indramayu (6 isolat)
SI-6 Bundar Agak kering, keriput Krem Rata Timbul
LI-1 Bundar,
menyebar Berlendir Putih Bergerigi Cembung
LI-2 Bundar Berlendir Krem Rata Cembung
LI-3 Bundar Berlendir Kuning Rata Cembung
Ds. Santi Kec. Losarang, Indramayu (4 isolat) LI-4 Tidak beraturan, menyebar
Kering Krem
Berlekuk-lekuk Timbul
TK-1 Bundar Berlendir Kuning Rata Cembung
TK-2 Tidak beraturan, seperti jari tangan Seperti berpati (starchy)
Krem kekuningan
Bercabang
-cabang Timbul
TK-3 Bundar Keriput dan berlendir Putih agak
transparan Rata Timbul
TK-4 Bundar Berlendir Putih keruh Rata Cembung
Ds. Cariumulya Kec. Telaga Sari,
Karawang
(5 isolat)
TK-5 Tidak
beraturan Kering Krem
Berlekuk-lekuk Datar
TG-1 Bundar Berlendir Putih krem Rata Cembung
TG-2 Seperti bintang Berlendir Krem Berlekuk-lekuk Timbul
TG-3 Bundar Berlendir Agak
transparan Rata Timbul
TG-4 Bundar Kering, keriput Krem Rata Timbul
TG -5 Bundar Berlendir Putih keruh Rata Cembung
Tegal (6 isolat)
TG-6 Tidak
Karakteristik koloni bakteri Lokasi Sampel Kode
isolat Bentuk Permukaan Warna Tepian Elevasi
DM-1 Bundar Seperti berpati Putih Rata Cembung
DM-2 Bundar Agak kering, keriput Krem Rata Timbul
DM-3 Bundar Tidak berlendir Krem Rata Timbul
DM-4 Bundar Berlendir Putih Rata
Cembung, seperti tombol
DM-5 Tidak
beraturan Berlendir Putih
Berlekuk-lekuk Timbul
DM-6 Bundar Berlendir Krem Rata Cembung
Demak (7 isolat)
DM-7 Bundar Berlendir Krem Rata Cembung
RB-1 Bundar Berlendir Putih Rata Seperti
kawah
RB-2
Tidak beraturan, menyebar
Berlendir Krem
Berlekuk-lekuk Timbul Rembang
(3 isolat)
RB-3 Bundar Berlendir Coklat Rata Timbul
KB-1 Bundar Berlendir Coklat Rata Timbul
KB-2 Tidak
beraturan Kering Krem
Berlekuk-lekuk Datar Kebumen
(3 isolat)
KB-3
Tidak beraturan, menyebar
Berlendir Krem
Berlekuk-lekuk Timbul
BY-1 Bundar Berlendir Krem Seperti
kerang Timbul
BY-2 Seperti bintang Berlendir Putih keruh
Berlekuk-lekuk Timbul
BY-3 Bundar Berlendir Krem
Berlekuk-lekuk Datar Boyolali I
(4 isolat)
BY-4 Tidak
Lampiran 2 Kurva standar pengukuran AIA
y = 0.0144x + 0.0157 R2 = 0.9921
0 0.1 0.2 0.3 0.4 0.5
0 10 20 30 4
Konsentrasi AIA (ppm)
A
b
so
rb
a
n
si
5
1
0
n
m
0
Lampiran 3 Kurva standar pertumbuhan isolat HI-2
y = 0.1938x + 0.1062 R2 = 0.9558
0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9
0 1 2 3 4 5
Jumlah sel/ml (x109)
A
bs
or
bans
Oleh:
Tika Widayanti
G34102021
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
MUBARIK.
Genus Bacillus yang dikelompokkan sebagai plant growth-promoting bacteria (PGPB) diisolasi dari tanah rizosfer yang berasal dari sebelas daerah di Pulau Jawa. Hasil karakterisasi parsial menunjukkan sel Bacillus berbentuk batang, bersifat Gram positif, memiliki struktur endospora, dan katalase positif, kecuali isolat HI-9, SI-2 dan PI-8 bersifat katalase negatif. Isolat-isolat tersebut dianalisis kemampuannya dalam memproduksi asam indol asetat (AIA) berdasarkan metode kolorimetri menggunakan reagen Salkowski. Hasil analisis AIA menunjukkan dari 63 isolat yang berhasil diisolasi, sebanyak 61 isolat mampu mensintesis AIA dengan konsentrasi tertinggi dihasilkan isolat HI-2 dan TG-1 sebesar 67.2 ppm pada media dengan penambahan L-triptofan 0.5 mM. Pada media tanpa penambahan L-L-triptofan sebesar 47.6 ppm dan 38.9 ppm, masing-masing untuk isolat HI-2 dan TG-1. Kurva pertumbuhan dan penentuan sintesis AIA dibuat dengan menggunakan isolat HI-2 sebagai model. Dari kurva tersebut dapat diketahui bahwa produksi AIA sejalan dengan pertumbuhan sel bakteri. Konsentrasi AIA pada media yang ditambahkan L-triptofan lebih tinggi dibandingkan konsentrasi AIA pada media tanpa penambahan L-triptofan. AIA mulai dihasilkan pada jam ke-8, yaitu pada akhir fase logaritma dan terus meningkat pada fase stasioner. Hal ini mengindikasikan bahwa AIA termasuk senyawa metabolit sekunder pada bakteri. Dua belas isolat yang menghasilkan AIA tertinggi diuji kemampuannya dalam melarutkan fosfat anorganik dengan cara menumbuhkannya pada media Pikovskaya. Kemampuan melarutkan P terbesar dihasilkan oleh isolat DM-4 dengan indeks pelarutan P sebesar 55.6. Isolat HI-2 dan BY-1 diuji kemampuannya dalam memacu pertumbuhan kecambah biji kedelai. Hasil uji pemacuan perkecambahan biji memperlihatkan bahwa pengaruh perlakuan bakteri tidak berbeda nyata terhadap pemanjangan batang kecambah, tetapi memberikan pengaruh nyata terhadap pemanjangan akar primer dan percabangan akar lateral. Jumlah cabang akar lateral kecambah yang diberi perlakuan lebih banyak dibanding kontrol. Sebaliknya, inokulasi bakteri menghambat pemanjangan akar primer.
ABSTRACT
TIKA WIDAYANTI. Isolation and Characterization of Bacillus sp. Indigenous Producing Indole Acetic Acid from Rhizosphere Soils. Supervised by ARIS TRI WAHYUDI and NISA RACHMANIA MUBARIK.
PENDAHULUAN
Latar Belakang
Penggunaan senyawa kimia sebagai pupuk dan pestisida di bidang pertanian semakin meningkat seiring dengan berkembangnya pertanian modern. Hal ini telah menyebabkan dampak negatif terhadap lingkungan, terutama meningkatnya pencemaran lingkungan. Masyarakat saat ini juga cenderung lebih memilih pangan yang bebas pestisida dan bahan kimia lainnya. Kesadaran akan lingkungan yang sehat dan perkembangan di bidang bioteknologi telah mendorong berkembangnya penelitian tentang penggunaan mikroorganisme, khususnya bakteri dan cendawan, sebagai agen pupuk hayati dan pestisida alami yang ramah lingkungan. Penemuan ini diduga akan menjadi trend baru dalam pertanian modern.
Bakteri yang hidup di rizosfer yang memberikan pengaruh positif bagi pertumbuhan tanaman dikelompokkan sebagai plant growth-promoting rhizobacteria (PGPR). Istilah ini ditujukan untuk bakteri yang secara agresif mengkolonisasi rizosfer dan permukaan akar. PGPR juga dapat masuk ke dalam struktur akar dan membentuk populasi endofitik, misalnya Azospirillum sp. dan Azotobacter sp. (Kloepper et al. 1999; Gray & Smith 2005). Sedangkan untuk bakteri pemacu pertumbuhan yang berasosiasi dengan spesies tanaman dan umumnya terdapat di berbagai habitat disebut plant growth-promoting bacteria (PGPB) (Bashan & Holguin 1998). PGPB memberikan keuntungan melalui berbagai mekanisme yang berbeda, misalnya produksi metabolit sekunder seperti antibiotik, kitinase, β -1,3-glukanase, sianida, substansi hormon, sebagai pengendali biologi melalui kompetisi, induksi sistem pertahanan terhadap patogen, produksi siderofor, pelarutan fosfat dan fiksasi N2 (Glick 1995;
Husen 2003).
Mikroorganisme mampu menghasilkan hormon tumbuhan seperti auksin, sitokinin, dan giberelin (Leveau & Lindow 2005). Bakteri yang dapat menghasilkan auksin antara lain Pseudomonas sp. Azospirillum sp., Azotobacter sp., Bacillus sp., Lactobacillus sp., Paenibacillus polymyxa, Enterobacter sp., Serratia marcescens, Klebsiella sp., Alcaligenes faecalis dan
sianobakteria (Torres-Rubio et al. 2000; Leveau & Lindow 2005).
Asam indol asetat (AIA) merupakan hormon auksin utama pada tumbuhan yang mengendalikan berbagai proses fisiologi penting meliputi pembelahan dan perkembangan sel, diferensiasi jaringan, serta respon terhadap cahaya dan gravitasi (Salisbury & Ross 1992). Tumbuhan mungkin tidak mensintesis AIA dalam jumlah yang cukup untuk pertumbuhan yang optimal. Oleh karena itu diperlukan tambahan hormon pemacu pertumbuhan dari luar, meskipun berdasarkan penelitian-penelitian yang telah dilakukan, respon tanaman terhadap AIA yang dihasilkan mikrob berbeda-beda tergantung spesies tanaman dan konsentrasi AIA yang dilepaskan (Patten & Glick 2002). Biosintesis AIA oleh mikrob di tanah meningkat dengan adanya L-triptofan yang berasal dari eksudat akar atau sel-sel organisme yang rusak, karena L-triptofan merupakan prekursor pada lintasan biosintesis AIA (Benizri et al. 1998).
Mekanisme PGPB dalam memacu pertumbuhan tanaman, selain menghasilkan AIA diantaranya dengan melarutkan senyawa fosfat dalam tanah. Bakteri pelarut fosfat berpotensi meningkatkan ketersediaan fosfat terlarut bagi tanaman, terutama pada tanah yang banyak mengandung endapan fosfor. Bakteri pelarut fosfat melepaskan ikatan fosfat anorganik yang sukar larut dengan mensekresikan sejumlah asam organik. Mekanisme tersebut bukan satu-satunya cara untuk melarutkan fosfat. Beberapa bakteri seperti B. amyloliquefaciens, B. subtilis, Klebsiella terrigena, Pseudomonas spp. dan Enterobacter sp. dilaporkan mempunyai aktivitas fitase, suatu enzim golongan fosfomonoesterase yang mampu menghidrolisis polifosfat organik tak larut (fitat) menjadi rangkaian ester fosfat berbobot molekul rendah dari myo-inositol dan fosfat yang penting untuk prokariot dan eukariot (Idriss et al. 2002).
membuatnya memiliki eksistensi yang tinggi di alam karena spora tersebut tahan terhadap cekaman lingkungan. Hal ini menjadikannya sebagai PGPB yang dapat diformulasikan menjadi produk yang relatif stabil bila digunakan dalam skala industri dan aplikasi di lapangan (Emmert & Handelsman 1999).
Penelitian ini bertujuan mengisolasi dan mengkarakterisasi Bacillus sp. indigenus penghasil asam indol asetat asal tanah rizosfer.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Juni sampai November 2006, di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan
Bahan yang digunakan ialah isolat Bacillus yang berasal dari 11 lokasi pengambilan sampel tanah rizosfer yang diambil dari Demak, Kebumen, Rembang, Boyolali, dan Tegal, Jawa Tengah, serta Karawang, dan Indramayu, Jawa Barat (Lampiran 1), serta biji kedelai Tanggamus koleksi Dr. Ir Muhammad Jusuf (Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, IPB).
Metode
Isolasi Bacillus sp. dari Rizosfer.
Isolasi Bacillus sp. dilakukan dengan memasukkan 1 gram sampel tanah rizosfer ke dalam tabung berisi 10 ml larutan garam fisiologis (NaCl 0.85%), dikocok kuat, dan dipanaskan di dalam penangas air pada suhu 80 °C selama 20 menit, kemudian dilakukan pengenceran secara serial. Pengenceran 10-5, 10-6, dan 10-7 disebar sebanyak 100 µl pada media agar-agar nutrien (NA), dan diinkubasi selama 24 jam pada suhu ruang. Koloni bakteri yang tumbuh diamati serta dimurnikan pada media Luria Bertani Agar (LA) yang mengandung NaCl 10 g, tripton 10 g, ekstrak khamir 5 g, dan agar-agar 20 g untuk 1 L media.
Karakterisasi Fisiologi Secara Parsial.
Pewarnaan Gram, pewarnaan spora, uji katalase dan preparat lekapan basah dilakukan berdasarkan metode standar (Lay 1994). Masing-masing bakteri yang digunakan untuk pewarnaan Gram dan spora berumur 12 dan 48 jam, dan uji katalase
menggunakan bakteri berumur 24 jam pada media LA.
Analisis Produksi Asam Indol Asetat (AIA). Produksi asam indol asetat diukur berdasarkan metode kolorimetri menggunakan reagen Salkowski (Gordon & Weber 1951; Patten & Glick 2002) yang mengandung 150 ml H2SO4 pekat, 250 ml
akuades, dan 7.5 ml FeCl3 0.5 M. Isolat
bakteri yang diperoleh diinokulasikan sebanyak satu lup ke dalam dua media, yaitu media LB yang ditambah dengan L-triptofan (L-trp) 0.5 mM dan media LB tanpa penambahan L-trp. Kultur tersebut kemudian dikocok dengan kecepatan 100 rpm selama 48 jam pada suhu ruang. Selanjutnya kultur disentrifugasi pada kecepatan 9000 g selama 30 menit. Supernatan diambil sebanyak 2 ml dan dimasukkan ke dalam tabung reaksi steril, kemudian ditambahkan 2 ml reagen Salkowski dan dikocok dengan vortex. Sebagai kontrol, digunakan media kosong tanpa triptofan dan media yang ditambah triptofan. Selanjutnya dibiarkan pada suhu ruang dalam keadaan gelap selama satu jam sebelum diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 510 nm. Konsentrasi AIA yang terdapat dalam kultur ditentukan berdasarkan kurva standar AIA (Lampiran 2). Isolat-isolat yang menghasilkan AIA dalam jumlah cukup besar diseleksi untuk pengujian pelarutan fosfat.
membuatnya memiliki eksistensi yang tinggi di alam karena spora tersebut tahan terhadap cekaman lingkungan. Hal ini menjadikannya sebagai PGPB yang dapat diformulasikan menjadi produk yang relatif stabil bila digunakan dalam skala industri dan aplikasi di lapangan (Emmert & Handelsman 1999).
Penelitian ini bertujuan mengisolasi dan mengkarakterisasi Bacillus sp. indigenus penghasil asam indol asetat asal tanah rizosfer.
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan Juni sampai November 2006, di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA, IPB.
BAHAN DAN METODE
Bahan
Bahan yang digunakan ialah isolat Bacillus yang berasal dari 11 lokasi pengambilan sampel tanah rizosfer yang diambil dari Demak, Kebumen, Rembang, Boyolali, dan Tegal, Jawa Tengah, serta Karawang, dan Indramayu, Jawa Barat (Lampiran 1), serta biji kedelai Tanggamus koleksi Dr. Ir Muhammad Jusuf (Pusat Penelitian Sumber Daya Hayati dan Bioteknologi, IPB).
Metode
Isolasi Bacillus sp. dari Rizosfer.
Isolasi Bacillus sp. dilakukan dengan memasukkan 1 gram sampel tanah rizosfer ke dalam tabung berisi 10 ml larutan garam fisiologis (NaCl 0.85%), dikocok kuat, dan dipanaskan di dalam penangas air pada suhu 80 °C selama 20 menit, kemudian dilakukan pengenceran secara serial. Pengenceran 10-5, 10-6, dan 10-7 disebar sebanyak 100 µl pada media agar-agar nutrien (NA), dan diinkubasi selama 24 jam pada suhu ruang. Koloni bakteri yang tumbuh diamati serta dimurnikan pada media Luria Bertani Agar (LA) yang mengandung NaCl 10 g, tripton 10 g, ekstrak khamir 5 g, dan agar-agar 20 g untuk 1 L media.
Karakterisasi Fisiologi Secara Parsial.
Pewarnaan Gram, pewarnaan spora, uji katalase dan preparat lekapan basah dilakukan berdasarkan metode standar (Lay 1994). Masing-masing bakteri yang digunakan untuk pewarnaan Gram dan spora berumur 12 dan 48 jam, dan uji katalase
menggunakan bakteri berumur 24 jam pada media LA.
Analisis Produksi Asam Indol Asetat (AIA). Produksi asam indol asetat diukur berdasarkan metode kolorimetri menggunakan reagen Salkowski (Gordon & Weber 1951; Patten & Glick 2002) yang mengandung 150 ml H2SO4 pekat, 250 ml
akuades, dan 7.5 ml FeCl3 0.5 M. Isolat
bakteri yang diperoleh diinokulasikan sebanyak satu lup ke dalam dua media, yaitu media LB yang ditambah dengan L-triptofan (L-trp) 0.5 mM dan media LB tanpa penambahan L-trp. Kultur tersebut kemudian dikocok dengan kecepatan 100 rpm selama 48 jam pada suhu ruang. Selanjutnya kultur disentrifugasi pada kecepatan 9000 g selama 30 menit. Supernatan diambil sebanyak 2 ml dan dimasukkan ke dalam tabung reaksi steril, kemudian ditambahkan 2 ml reagen Salkowski dan dikocok dengan vortex. Sebagai kontrol, digunakan media kosong tanpa triptofan dan media yang ditambah triptofan. Selanjutnya dibiarkan pada suhu ruang dalam keadaan gelap selama satu jam sebelum diukur absorbansinya menggunakan spektrofotometer pada panjang gelombang 510 nm. Konsentrasi AIA yang terdapat dalam kultur ditentukan berdasarkan kurva standar AIA (Lampiran 2). Isolat-isolat yang menghasilkan AIA dalam jumlah cukup besar diseleksi untuk pengujian pelarutan fosfat.
HASIL DAN PEMBAHASAN
mengukur turbiditas dari pengenceran 1:1,1:2, 1:4, 1:8, 1:16, sedangkan hitungan cawan dengan menyebar inokulum pada pengenceran 10-6, 10-8, 10-9, 10-10.
Hasil
Isolasi Bacillus sp. dari Rizosfer. Hasil isolasi Bacillus sp. dari 11 lokasi pengambilan sampel tanah diperoleh sebanyak 63 isolat yang berpotensi sebagai penghasil AIA (Tabel 1). Pemanasan sampel tanah bertujuan sebagai seleksi awal isolasi. Bacillus sp. akan tahan terhadap pemanasan karena memiliki struktur endospora, sedangkan bakteri lain akan mati. Isolat-isolat tersebut kemudian diamati karakter koloninya secara visual.
Uji Pelarutan Fosfat. Dua belas isolat bakteri terpilih diuji kemampuannya dalam melarutkan fosfat. Isolat-isolat tersebut ditumbuhkan dengan cara ditotol pada media agar yang mengandung trikalsium fosfat, yang merupakan modifikasi dari media Pikovskaya (Rao & Sinha 1962) dengan komposisi glukosa 10 g, Ca3HO13P3 5 g,
(NH4)2SO4 0.5 g, KCl 0.2 g, MgSO4·7H2O
0.1 g, ekstrak khamir 0.5 g, MnSO4 25 mg,
dan FeSO4 25 mg, serta agar-agar 15 g
dalam 1 L akuades. Setelah inkubasi selama 7 hari, zona bening yang terdapat di sekeliling koloni diamati dan diukur indeks pelarutan fosfatnya berdasarkan rumus:
Karakterisasi Fisiologi Secara Parsial.
Hasil pewarnaan Gram dan spora menunjukkan sel bakteri bersifat Gram positif, berbentuk batang dengan ukuran dan penataan yang berbeda-beda, dan memiliki endospora dengan bentuk dan letak yang bervariasi (Gambar 1). Uji katalase memperlihatkan hasil positif untuk seluruh isolat, kecuali isolat HI-9, SI-2 dan PI-8. Indeks pelarutan fosfat =
koloni diameter koloni diameter bening zona diameter −
Uji Perkecambahan Biji Kedelai.
Perkecambahan biji dilakukan untuk melihat respon AIA yang disintesis bakteri terhadap pertumbuhan kecambah biji. Uji perkecambahan biji menggunakan kedelai varietas Tanggamus sebagai model. Biji kedelai Tanggamus disterilisasi permukaannya dengan cara direndam dalam etanol 95% selama 10 detik, kemudian direndam dalam H2O2 5% selama 5 menit
dan dibilas dengan akuades steril sebanyak 7 kali untuk menghilangkan residu peroksida.
1 µm 2 µm
Gambar 1 Hasil pewarnaan Gram isolat HI-2 menunjukan bakteri Gram positif berbentuk batang dengan perbesaran 2000x (A), dan endospora isolat PI-4 dengan perbesaran 1000x, ditunjukkan dengan tanda panah (B).
A B
Biji yang telah steril diletakkan pada cawan yang dialasi kertas saring yang telah dibasahi dengan akuades steril, kemudian diletakkan di ruang gelap. Setelah 24 jam, setiap biji yang telah mulai berkecambah ditetesi dengan 100 μl kultur bakteri (± 8x109 sel/ml). Isolat yang digunakan ialah HI-2, mewakili isolat yang menghasilkan AIA dengan konsentrasi tinggi, dan BY-1 mewakili isolat yang menghasilkan AIA dengan konsentrasi rendah, serta media kosong sebagai kontrol. Cawan tersebut diinkubasi selama 7 hari pada suhu ruang dalam kondisi gelap. Kemudian dilakukan pengukuran panjang batang, panjang akar primer, dan jumlah akar lateral. Setiap perlakuan dilakukan sebanyak dua kali ulangan dan setiap ulangan menggunakan sepuluh biji kedelai. Hasil pengukuran dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) menggunakan program SPSS.
HASIL DAN PEMBAHASAN
mengukur turbiditas dari pengenceran 1:1,1:2, 1:4, 1:8, 1:16, sedangkan hitungan cawan dengan menyebar inokulum pada pengenceran 10-6, 10-8, 10-9, 10-10.
Hasil
Isolasi Bacillus sp. dari Rizosfer. Hasil isolasi Bacillus sp. dari 11 lokasi pengambilan sampel tanah diperoleh sebanyak 63 isolat yang berpotensi sebagai penghasil AIA (Tabel 1). Pemanasan sampel tanah bertujuan sebagai seleksi awal isolasi. Bacillus sp. akan tahan terhadap pemanasan karena memiliki struktur endospora, sedangkan bakteri lain akan mati. Isolat-isolat tersebut kemudian diamati karakter koloninya secara visual.
Uji Pelarutan Fosfat. Dua belas isolat bakteri terpilih diuji kemampuannya dalam melarutkan fosfat. Isolat-isolat tersebut ditumbuhkan dengan cara ditotol pada media agar yang mengandung trikalsium fosfat, yang merupakan modifikasi dari media Pikovskaya (Rao & Sinha 1962) dengan komposisi glukosa 10 g, Ca3HO13P3 5 g,
(NH4)2SO4 0.5 g, KCl 0.2 g, MgSO4·7H2O
0.1 g, ekstrak khamir 0.5 g, MnSO4 25 mg,
dan FeSO4 25 mg, serta agar-agar 15 g
dalam 1 L akuades. Setelah inkubasi selama 7 hari, zona bening yang terdapat di sekeliling koloni diamati dan diukur indeks pelarutan fosfatnya berdasarkan rumus:
Karakterisasi Fisiologi Secara Parsial.
Hasil pewarnaan Gram dan spora menunjukkan sel bakteri bersifat Gram positif, berbentuk batang dengan ukuran dan penataan yang berbeda-beda, dan memiliki endospora dengan bentuk dan letak yang bervariasi (Gambar 1). Uji katalase memperlihatkan hasil positif untuk seluruh isolat, kecuali isolat HI-9, SI-2 dan PI-8. Indeks pelarutan fosfat =
koloni diameter koloni diameter bening zona diameter −
Uji Perkecambahan Biji Kedelai.
Perkecambahan biji dilakukan untuk melihat respon AIA yang disintesis bakteri terhadap pertumbuhan kecambah biji. Uji perkecambahan biji menggunakan kedelai varietas Tanggamus sebagai model. Biji kedelai Tanggamus disterilisasi permukaannya dengan cara direndam dalam etanol 95% selama 10 detik, kemudian direndam dalam H2O2 5% selama 5 menit
dan dibilas dengan akuades steril sebanyak 7 kali untuk menghilangkan residu peroksida.
1 µm 2 µm
Gambar 1 Hasil pewarnaan Gram isolat HI-2 menunjukan bakteri Gram positif berbentuk batang dengan perbesaran 2000x (A), dan endospora isolat PI-4 dengan perbesaran 1000x, ditunjukkan dengan tanda panah (B).
A B
Biji yang telah steril diletakkan pada cawan yang dialasi kertas saring yang telah dibasahi dengan akuades steril, kemudian diletakkan di ruang gelap. Setelah 24 jam, setiap biji yang telah mulai berkecambah ditetesi dengan 100 μl kultur bakteri (± 8x109 sel/ml). Isolat yang digunakan ialah HI-2, mewakili isolat yang menghasilkan AIA dengan konsentrasi tinggi, dan BY-1 mewakili isolat yang menghasilkan AIA dengan konsentrasi rendah, serta media kosong sebagai kontrol. Cawan tersebut diinkubasi selama 7 hari pada suhu ruang dalam kondisi gelap. Kemudian dilakukan pengukuran panjang batang, panjang akar primer, dan jumlah akar lateral. Setiap perlakuan dilakukan sebanyak dua kali ulangan dan setiap ulangan menggunakan sepuluh biji kedelai. Hasil pengukuran dianalisis secara statistik dengan one-way Analysis of Variance (ANOVA) menggunakan program SPSS.
Tabel 1 Produksi asam indol asetat (AIA) dari isolat-isolat Bacillus sp. yang berhasil diisolasi
No Lokasi Pengambilan
Sampel Asal Tanah
Kode Isolat
Konsentrasi AIA tanpa triptofan
(ppm)
Konsentrasi AIA dengan triptofan 0.5 mM
(ppm)
1 GI-1 5.5 4.5
2 GI-2 37.5 46.3
3 GI-3 5.8 1.9
4 GI-4 5.8 31.7
5 GI-5 0.0 4.9
6
Ds. Kedung Dawa, Kec. Gabus Wetan,
Indramayu Rizosfer padi
GI-6 5.3 4.5
7 HI-1 29.8 39.1
8 HI-2 47.6 67.2
9 HI-3 0.5 5.82
10 HI-4 3.9 11.0
11 HI-5 8.6 10.8
12 HI-6 3.9 8.7
13 HI-7 1.7 6.0
14 HI-8 4.1 6.3
15
Ds. Sidadadi, Kec. Haurgeulis,
Indramayu
Rizosfer padi
HI-9 0.0 0.0
16 PI-1 6.0 4.0
17 PI-2 9.1 2.0
18 PI-3 4.1 3.3
19 PI-4 32.1 53.6
20 PI-5 5.3 4.0
21 PI-6 7.4 6.1
22 PI-7 3.3 4.0
23 PI-8 0.0 0.0
24 PI-9 9.5 9.8
25
Patrol, Indramayu Rizosfer padi
PI-10 3.9 3.6
26 SI-1 7.0 10.3
27 SI-2 4.5 3.6
28 SI-3 5.3 7.7
29 SI-4 4.5 6.5
30 SI-5 7.4 7.5
31
Ds. Mekar Gading, Kec. Sliyeg,
Indramayu
Rizosfer padi
SI-6 4.7 8.5
32 LI-1 5.8 7.7
33 LI-2 5.3 6.3
34 LI-3 1.8 2.5
35
Ds. Santi, Kec.
Losarang, Indramayu Rizosfer padi
LI-4 5.8 3.3
36 TK-1 8.3 8.3
37 TK-2 8.3 11.1
38 TK-3 8.6 10.8
39 TK-4 29.7 34.9
40
Ds. Cariumulya Kec. Telaga Sari,
Karawang Rizosfer padi
TK-5 3.7 7.6
41 TG-1 38.9 67.2
42 TG-2 1.7 1.2
43 TG-3 6.6 3.3
44 TG-4 3.3 7.0
45 TG-5 5.3 6.0
46
Tegal Rizosfer padi
TG-6 6.4 7.0
47 DM-1 28.6 37.2
48 DM-2 5.3 5.9
49
Sawah
DM-3 4.1 4.9
50 DM-4 5.8 14.5
51 DM-5 5.0 9.1
52 DM-6 6.6 7.0
53
Demak
Rizosfer kacang dan bahan organik
DM-7 6.2 7.2
54 KB-1 22.7 20.9
55 Rizosfer padi KB-2 9.3 6.3
56
Kebumen
Rizosfer kacang tanah KB-3 8.8 8.8
57 BY-1 6.2 7.0
58 BY-2 6.0 6.3
59 BY-3 11.2 6.2
60
Boyolali Rizosfer kacang tanah
BY-4 11.0 11.3
61 RB-1 3.6 6.4
62 RB-2 3.0 2.8
63
Rembang Pupuk kompos
5.9 6 6.1 6.2 6.3 6.4 6.5 6.6 6.7 6.8 6.9
0 4 8 12 16 20 24 28 32 36 40 44 48 52
Waktu (jam) Log sel
-5 5 15 25 35 45 55 65
Konsentrasi AIA (ppm)
Pertumbuhan HI-2 dalam media dengan penambahan triptofan Pertumbuhan HI-2 dalam media tanpa penambahan triptofan Produksi AIA dengan penambahan triptofan
Produksi AIA tanpa penambahan triptofan
Gambar 2 Pengukuran konsentrasi AIA pada isolat TG-1, (A) media kosong (kontrol 1), (B) kultur pada media tanpa L-trp, (C) kultur pada media dengan L-trp, (D) media kosong yang ditambah L-trp (kontrol 2).
Kurva Pertumbuhan dan Penentuan Sintesis AIA. Pertumbuhan isolat HI-2 cenderung tidak dipengaruhi oleh penambahan triptofan (Gambar 3). Isolat HI-2 mulai memproduksi AIA pada jam ke-8, baik pada media dengan penambahan L-trp maupun media tanpa L-trp. Konsentrasi AIA pada media dengan L-trp terus meningkat dan mencapai konsentrasi tertinggi pada jam ke-31, yaitu 61.2 ppm dengan jumlah sel 8.3x109 sel/ml. Pada media tanpa L-trp, konsentrasi AIA mencapai puncak pada jam ke-43, yaitu sebesar 53.9 ppm dengan jumlah sel 8.3x109 sel/ml.
Gambar 3 Kurva pertumbuhan dan sintesis AIA dari isolat HI-2 yang diproduksi pada media LB.
Uji Pengecambahan Biji Kedelai.
Pemberian inokulasi bakteri penghasil AIA tidak memberikan pengaruh berbeda nyata terhadap pemanjangan batang, tetapi memberikan pengaruh terhadap perkembangan akar primer dan akar lateral kecambah kedelai (Tabel 3). Akar primer kecambah yang diinokulasi dengan Bacillus sp. penghasil AIA lebih pendek dibandingkan dengan kontrol (Gambar 5). Tetapi jumlah akar lateral kecambah yang diberi perlakuan bakteri cenderung lebih
Uji Pelarutan Fosfat. Uji pelarutan fosfat dilakukan terhadap 12 isolat yang menghasilkan AIA tertinggi. Dari 12 isolat yang diuji, diperoleh 11 isolat yang
[image:31.595.117.297.80.264.2]menunjukkan kemampuan melarutkan fosfat. Aktivitas pelarutan fosfat ditandai dengan terbentuknya zona bening di sekitar koloni bakteri (Gambar 4). Berdasarkan hasil uji pelarutan P, indeks pelarutan P terbesar dihasilkan oleh isolat DM-4 yaitu 55.6, kemudian disusul isolat TK-4 (50) dan HI-4 (42.9) (Tabel 2). Isolat HI-2 dan TG-1 yang menghasilkan AIA tertinggi memiliki indeks pelarutan P masing-masing sebesar 16.7 dan 25. Sedangkan pada isolat KB-1 tidak menunjukkan adanya pelarutan fosfat. A B C D
Gambar 4 Zona bening yang terbentuk pada media Pikovskaya menandakan trikalsium fosfat yang telah terlarut (ditunjukkan dengan tanda panah).
Tabel 2 Hasil pengujian pelarutan fosfat dari 12 isolat Bacillus sp.
Kode Isolat Pelarutan Fosfat
Indeks Pelarutan Fosfat
HI-2 + 16.7 TG-1 + 25 PI-4 + 16.7 GI-2 + 12.5 HI-1 + 11.1 DM-1 + 28.6 TK-4 + 50.0 GI-4 + 6.3 KB-1 - -
DM-4 + 55.6
[image:31.595.328.507.227.399.2] [image:31.595.334.516.441.600.2]banyak dibandingkan dengan kontrol. Isolat BY-1 yang menghasilkan AIA rendah menginduksi pertumbuhan akar lateral lebih banyak daripada isolat HI-2 yang menghasilkan konsentrasi AIA tinggi.
Tabel 3 Pengaruh inokulasi Bacillus sp. penghasil AIA terhadap perkecambahan biji kedelai
Perlakuan
Panjang batang
(cm)
Panjang akar primer
(cm)
Jumlah akar lateral Kontrol 4.4a 3.7a 35.9a BY-1 4.0a 0.9b 41.7b
HI-2 3.9a 1.3b 36.9ab
Angka yang diikuti huruf yang sama dalam satu kolom tidak berbeda nyata pada taraf 5% menurut uji Duncan
Gambar 5 Hasil perkecambahan kedelai, (a) kontrol, (B) kecambah yang diinokulasi dengan isolat BY-1, (C) kecambah yang diinokulasi dengan isolat HI-2.
Pembahasan
Asam indol asetat (AIA) adalah jenis auksin yang penting bagi pertumbuhan tanaman. AIA terlibat dalam berbagai proses fisiologi tumbuhan seperti inisiasi akar, pemanjangan sel, diferensiasi jaringan pembuluh, dan proses pembungaan (Husen & Saraswati 2003). Sebanyak 63 isolat Bacillus berhasil diisolasi dari 11 lokasi pengambilan sampel. Hasil karakterisasi fisiologis menunjukkan sel Bacillus berbentuk batang, bersifat Gram positif, memiliki endospora, dan pada umumnya bersifat katalase positif, kecuali untuk isolat HI-9, SI-2, dan PI-8 bersifat katalase negatif. Dari 63 isolat yang diuji, diperoleh sebanyak