PENGARUH PENGGUNAAN ZEOLIT BAYAH SEBAGAI MATRIKS IMOBILISASI PADA AKTIVITAS ANTIOKSIDAN SUPEROKSIDA
DISMUTASE Deinococcus radiodurans
AHMAD ROYHAN
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
3
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Pengaruh Penggunaan Zeolit Bayahsebagai Matriks Imobilisasi pada Aktivitas Antioksidan Superoksida Dismutase Deinococcus radiodurans adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
5
ABSTRAK
AHMAD ROYHAN Pengaruh Penggunaan Zeolit Bayah sebagai Matriks
Imobilisasi pada Aktivitas Antioksidan Superoksida Dismutase Deinococcus
radiodurans. Dibimbing oleh DYAH ISWANTINI PRADONO, TRIVADILA dan NOVIK NURHIDAYAT.
Imobilisasi superoksida dismutase (SOD) dengan matriks zeolit Bayah dari
ekstrak Deinococcus radiodurans telah dipelajari selama beberapa tahun
terakhir. D. radiodurans adalah bakteri yang menghasilkan enzim Mn-SOD.
Kondisi optimum aktivitas antioksidan SOD dari ekstrak D. radiodurans adalah
suhu 30 °C, pH 9, dan zeolit Bayah 137.5 mg dengan konsentrasi ekstrak SOD yang digunakan 1.500 g/L. Dari penentuan kinetika reaksi berdasarkan metode
Lineweaver-Burk dan Eadie-Hoofstee diperoleh nilai KM app SOD dari ekstrak D.
radiodurans yang diimobilisasi pada zeolit lebih besar dibandingkan tanpa
diimobilisasi sedangkan nilai IM app dari ekstrak D. radiodurans yang
diimobilisasi sangat besar mencapai 7.0373 μA. Stabilitas elektrode yang diimobilisasi adalah 57.70% setelah 8 jam dibandingkan tanpa imobilisasi yang sudah turun sampai 45.04% setelah 2 jam.
Kata kunci: antioksidan, Deinococcusradiodurans, superoksida dismutase, zeolit
ABSTRACT
AHMAD ROYHAN Effect of Zeolite Bayah as Matrix Immobilization to Superoxide Dismutase Antioxidant Activity of Deinococcus radiodurans. Supervised by DYAH ISWANTINI PRADONO, TRIVADILA and NOVIK NURHIDAYAT.
Immobilization of superoxide dismutase (SOD) from extract of D. radiodurans has been studied over past years. D. radiodurans is a bacteria that produces enzyme Mn-SOD. The optimum condition of SOD antioxidant activity of D. Radiodurans extract is at 30 °C, pH 9, 137.5 mg of zeolite Bayah and 1500 g/L extract of D. radiodurans concentrate. The determination of kinetics reaction is based on the method of Lineweaver-Burk and Eadie-Hoofstee, which resulted KM app SOD value of immobilized extract D. radiodurans on zeolite is higher than
without immobilized extract D. radiodurans. Furthermore, the value of IM app of
immobilized extract D. radiodurans is really massive, 7.0373 μA. The electrode
stability of immobilized extract D. radiodurans still 57.70% after 8 hours, compared to without immobilized extract D. radiodurans that dropped to 45.04% after 2 hours.
PENGARUH PENGGUNAAN ZEOLIT BAYAH SEBAGAI MATRIKS IMOBILISASI PADA AKTIVITAS ANTIOKSIDAN SUPEROKSIDA
DISMUTASE Deinococcus radiodurans
AHMAD ROYHAN
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengaruh Penggunaan Zeolit Bayah sebagai Matriks Imobilisasi pada Aktivitas Antioksidan Superoksida Dismutase Deinococcus radiodurans
Nama : Ahmad Royhan
NIM : G44070082
Disetujui oleh
Novik Nurhidayat, Phd Pembimbing II
Trivadila, SSi, MSi Pembimbing III
Diketahui oleh
Prof Dr Purwatiningsih Sugita, MS Ketua Departemen
Tanggal Lulus:
11
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah yang berjudul “Pengaruh Penggunaan Zeolit Bayah sebagai Matriks
Imobilisasi pada Aktivitas Antioksidan Superoksida Dismutase Deinococcus
radiodurans”. Karya ilmiah ini disusun berdasarkan penelitian yang dilaksanakan pada bulan Juni 2013 hingga Februari 2014 di Laboratorium Fisik dan Laboratorium Bersama, Departemen Kimia, Institut Pertanian Bogor dan Laboratorium Mikrobiologi, Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia Cibinong.
Ucapan terima kasih penulis sampaikan kepada Ibu Prof. Dr. Dyah Iswantini Pradono, MSc, Agr, Ibu Trivadila, SSi, MSi, dan Bapak Novik Nurhidayat, PhD selaku pembimbing yang senantiasa memberikan arahan, dorongan semangat, dan doa kepada penulis selama melaksanakan penelitian. Penulis juga mengucapkan terima kasih kepada seluruh staf Laboratorium Fisik, Laboratorium Bersama dan Laboratorium Mikrobiologi atas bantuan serta masukan selama penelitian berlangsung. Terima kasih tak terhingga penulis ucapkan kepada keluarga, khususnya Ibunda atas doa, kasih sayang, motivasi, serta segala dukungan yang telah diberikan kepada penulis. Terima kasih juga penulis ucapkan kepada teman seperjuangan di Laboratorium Fisik, teman-teman Wisma Al-Afkar dan Wisma Cemara, serta keluarga besar Kimia.
Atas segala khilaf dan kekurangan, semoga dapat dibukakan pintu maaf yang sebesar-besarnya. Penulis berharap karya ilmiah ini dapat bermanfaat.
Juni 2014
DAFTAR ISI
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan ... 3
METODE ... 4
Bahan dan Alat ... 4
Prosedur Penelitian ... 4
Penumbuhan Sel D. radiodurans dan Ekstraksi SOD ... 4
Pembuatan Elektrode Pasta Karbon Termodifikasi Ferosena ... 5
Aktivasi Zeolit ... 5
Imobilisasi Ekstrak D. radiodurans ... 5
Pengukuran Elektrokimia ... 5
Aktivitas Ekstrak Protein SOD D. radiodurans ... 6
Stabilitas Elektrode ... 6
Keterulangan ... 6
HASIL DAN PEMBAHASAN ... 7
Penumbuhan Sel dan Ekstraksi Protein Sitoplasma D. radiodurans ... 7
Imobilisasi dan Optimasi Ekstrak Protein D. radiodurans ... 8
Aktivitas Antioksidan Ekstrak SOD D. radiodurans ... 8
Stabilitas dan Keterulangan Biosensor Antioksidan Berbasis SOD dari Ekstrak D. radiodurans ... 12
SIMPULAN ... 13
DAFTAR TABEL
1 Nilai parameter kinetika enzim ekstrak D. radiodurans 12
DAFTAR GAMBAR
1 Struktur Mn-SOD 7
2 Voltamogram Siklik kondisi optimum 9
3 Hubungan antara konsentrasi xantina dan aktivitas ekstrak D. radiodurans 10
4 Linieritas antara konsentrasi xantina dan aktivitas ekstrak D. radiodurans 11
5 Plot Lineweaver-Burk dan Eddie-Hoofstee 11
6 Grafik stabilitas biosensor antioksidan 13
DAFTAR LAMPIRAN
1 Bagan alir penelitian 18
2 Analisis kinetika SOD ekstrak D.radiodurans diimobilisasi pada zeolit 19
3 Analisis kinetika SOD ekstrak D. radiodurans tanpa zeolit 19
4 Stabilitas biosensor antioksidan berbasis SOD ekstrak D. radiodurans 19
1
P
ENDAHULUANLatar Belakang
Radikal bebas atau spesi oksigen reaktif (ROS) termasuk di dalamnya superoksida (O2.-), H2O2, radikal hidroksil dan oksigen singlet tak terhindarkan terbentuk dari proses biologi, seperti pernapasan (Asada 2006), metabolisme
makanan (Antolovich et al. 2002), pembakaran kalori, degradasi lipid, akibat
stress, dan proses inflamasi (Wang et al. 2008), dan oleh paparan polutan serta iradiasi dari luar tubuh (Chevion et al. 2000). Radikal bebas dalam jumlah normal bermanfaat melindungi tubuh dari serangan penyakit dengan membantu sel darah
putih menghasilkan H2O2 untuk membunuh bakteri dan parasit, mengatur
pertumbuhan sel dan sebagai substrat pembuatan hormon tiroid. Di saat kondisi tekanan oksidatif tinggi, di mana jumlah radikal bebas meningkat, radikal bebas akan sulit untuk dikendalikan dan sifatnya yang reaktif dan bereaksi secara tak spesifik akan membahayakan tubuh. Sistem biologis tubuh manusia memiliki
mekanisme antioksidan secara enzimatik (Ozyurt et al. 2006). Di saat jumlah
radikal bebas dalam tubuh sudah melebihi batas maka proses yang membahayakan tubuhakan muncul. Radikal bebas mengoksidasi dinding sel darah,berperan dalam pembentukan peroksida dari lipid dalam makanan yang bersifat racun, menyerang ikatan tak-jenuh pada membran lipid, merusak DNA yang mengatur pertumbuhan suatu sel dan mengubahnya menjadi sel kanker, dan menyebabkan timbulnya berbagai penyakit pada manusia, seperti penuaan dini
(Yashin 2011), kanker, aterosklerosis (Moskovitz et al. 2002), dementia (Mao
2013), asma, alzheimer (Biskup 2013), parkinson (Koutsilieri 2002), dan diabetes (Abou-Seif dan Youssef 2004). Untuk mencegahnya, radikal bebas yang berlebih dalam tubuh harus diimbangi dengan asupan antioksidan dari luar.
Aktivitas antioksidan banyak ditemukan pada tanaman, di antaranya
minyak zaitun (Coban 2008), anggur merah dan anggur putih (Campanella et al.
2004), beri (Balogh 2010), dan teh (Gil 2011). Untuk mengetahui besarnya kapasitas antioksidan dibutuhkan suatu metode penentuan aktivitas antioksidan yang murah, tepat, cepat, dan sensitif. Metode yang umum digunakan untuk mengukur kapasitas antioksidan, di antaranya spektrofotometri (Kolotkova 2013), kimiluminometri (Bratu 2012), fotokimiluminometri (Balogh 2010), fluoresensi, dan kromatografi gas atau cair (Budnikov dan Ziyatdinova 2004).
Pengukuran kapasitas antioksidan menggunakan biosensor antioksidan
dilakukan oleh Campanella et al. (2004) dengan kelebihan dari metode-metode
lain di antaranya cepat, murah, reaksi yang dihitung adalah reaksi pada detik itu juga, akurasi dan reprodusibilitas terjamin, SD kurang dari 0.5% dan RSD kurang dari 5%, limit deteksi rendah pada level nanogram, reaksi yang diukur adalah reaksi langsung (Yashin 2011). Dalam perkembangannya, ada dua tipe biosensor elektrokimia yang digunakan dalam pengukuran antioksidan, yaitu biosensor amperometri untuk mengukur mono dan poliefenol berbasis enzim tirosinase (Busch et al. 2006), lakase (Royet al. 2005) dan peroksidase, serta biosensor antioksidan berdasarkan aktivitas penangkapan radikal bebas berbasis SOD
(Campanella et al. 2005), sitokrom c (Cortina-Puig et al. 2007), dan DNA
2
biosensor antioksidan berbasis SOD lebih baik daripada biosensor antioksidan berbasis sitokrom c karena enzim SOD lebih spesifik bereaksi dengan superoksida (Di et al. 2004).
Biosensor antioksidan berbasis SOD sudah terbukti dapat mengukur kapasitas antioksidan berbagai jenis contoh, seperti teh dan produk herbal (Campanella et al. 2003a), anggur merah dan putih (Campanella et al. 2004), dan
alga (Campanella et al. 2005), mengukur kapasitas antioksidan pada minyak
zaitun (Coban 2008), dan teh (Gil 2011). Pada pengukuran kapasitas antioksidan anggur merah dan putih diketahui biosensor antioksidan menggunakan SOD murni mampu mendapatkan kapasitas antioksidan lebih besar daripada metode spektrofotometri dan flourometri. Hal ini menunjukkan bahwa biosensor antioksidan berbasis SOD lebih spesifik. Tingginya harga enzim SOD murni menjadi kendala dalam pengembangan biosensor antioksidan berbasis SOD. Keberadaan mikrob yang dapat menghasilkan enzim SOD dan ketersediaannya di alam melimpah mulai dimanfaatkan. Penggunaan mikrob sebagai penghasil enzim telah dilakukan,seperti Bacillus subtilis (Anwar 2009), Escherichia coli
(Iswantini et al2011) dan biosensor asam urat menggunakan Lactobacillus
plantarum (Mardiah2010). Untuk biosensor antioksidan menggunakan D. radiodurans belum banyak dilakukan. Ningrum (2011), Trivadila (2011) dan
Weniarti (2011) telah memanfaatkan mikroba D. radiodurans sebagai sumber
SOD dan terbukti memiliki potensial menggantikan SOD murni komersial dan menghasilkan aktivitas antioksidan lebih baik daripada enzim SOD dari E. Coli untuk biosensor antioksidan.
Enzim SOD, seperti enzim pada umumnya memiliki kesulitan tersendiri dalam penggunaannya. Beberapa masalah yang muncul di antaranya pemulihan enzim, stabilitas enzim, selektivitas enzim, dan reduksi inhibisi oleh produk. Permasalahan tersebut dapat diatasi dengan mengimobilisasikan enzim pada material yang memiliki pori (Mateo et al. 2007). Keuntungan dari imobilisasi enzim adalah produktivitas tinggi, praktis, pengolahan berkelanjutan, reaksi terkontrol, pemulihan produk mudah dan enzim tidak tercampur dengan produk akhir (Anwar 2009), dan meningkatkan aktivitas katalitik (Gustafsson 2012). Kelemahan dari proses imobilisasi terkadang menyebabkan perubahan struktur, mempersulit substrat menemukan sisi aktif enzim sehingga reaksinya lambat (Bello-Gil 2014). Trivadila (2011) membuat biosensor antioksidan berbasis SOD
dari ekstrak D. radiodurans dan diperoleh afinitas enzim substrat dan
kespesifikan yang lebih tinggi dibanding SOD murni namun stabilitas yang diperoleh rendah sehingga perlu dilakukan imobilisasi enzim pada suatu matriks agar aktivitas dan stabilitasnya meningkat.
Esumi et al. (2003) membuat biosensor antioksidan dari nanopartikel emas dengan kitosan dan menunjukkan stablitas yang baik. Shumyantseva et al. (2005) juga menggunakan nanopartikel emas dan terbukti meningkatkan sensitivitas dari
biosensor kolesterol dengan sitokrom P450scc. Mello et al. (2005) mengukur
3
Salah satu bahan yang berpotensi sebagai matriks imobilisasi SOD adalah zeolit. Pemilihan zeolit sebagai material penyangga didasari hasil penelitian
sebelumnya yang dilakukan oleh Valdes et al. (2006) yang menyatakan bahwa
penggunaan zeolit dalam imobilisasi enzim dapat meningkatkan puncak arus,
keseragaman struktur porinya dapat meningkatkan selektivitas dan
reprodusibilitas, resisten terhadap pelarut organik, stabil pada suhu tinggi dan sifatnya yang keras membuatnya tahan terhadap tekanan mekanik dan membuat enzim yang terjerab lebih stabil. Penelitian oleh Weniarti (2011) menemukan bahwa enzim SOD yang diimobilisasi pada permukaanzeolit alam dapat meningkatkan respon arus dan mempercepat laju reaksi dan Hayati (2011) menyatakan bahwa zeolit alam dapat meningkatkan akivitas antioksidan.
Enzim SOD adalah suatu metaloenzim yang mengatalisis secara baik dismutasi dari radikal superoksida melalui mekanisme transfer elektron reaksi
oksidasi–reduksi.. Enzim SOD pada D. radiodurans adalah jenis Mn-SOD, jenis
yang sama yang terdapat di Spirogyra (Kanematsu 2012) dengan dua bentuk
kristal (Dennis et al. 2006). Mn-SOD terbukti mampu melindungi sel mamalia
dari serangan tumor necrosis (Luz 2013). Skema reaksi yang melibatkan Mn-SOD (Abreu 2010).
Enzim SOD dari D. radiodurans yang diimobilisasi pada permukaan
elektrode pasta karbon memiliki kondisi optimum aktivitas enzim pada pH 9 dan
suhu 30 ºC (Weniarti 2011) atau pH 11 dan suhu 20 oC untuk SOD murni yang
berasal dari eritrosit sapi. Enzim SOD dari D. radiodurans memiliki nilai KM app
dan IM app sebesar 0,1930 mM dan 0,1089 µA (metode Lineweaver-Burk); 3,9385
mM dan 0,4759 µA (metode Eadie-Hofstee) (Trivadila 2011). Modifikasi biosensor antioksidan menggunakan zeolit Bayah, zeolit berjenis kristal klinoptilolit (Iswantini 2010) yang ketersediaannya melimpah sebagai matriks imobilisasi diharapkan bisa meningkatkan arus yang dihasilkan dan stabilitas elektode pasta karbon yang baik.
Penelitian ini merupakan lanjutan dari penelitian yang dilakukan oleh Trivadila (2011) dan Weniarti (2011) yang mengembangkan biosensor
elektrokimia menggunakan enzim SOD yang dihasilkan dari D. radiodurans
dengan zeolit alam sebagai matriks imobilisasi. Pemanfaatan zeolit Bayah diharapkan dapat memberikan hasil dan informasi yang lebih baik.
Tujuan
Penelitian ini bertujuan mengetahui pengaruh penggunaan matriks imobilisasi zeolit Bayah terhadap aktivitas antioksidan dan stabilitas elektode serta penentuan parameter kinetikanya.
4
METODE
Bahan dan Alat
Alat-alat yang digunakan antara lain pipet mikro, pinset, batang gelas, sel elektrokimia, neraca analitik, pH meter, oven, tanur, potensiostat-galvanostat eDAQ yang dilengkapi dengan perangkat lunak Echem v2.1.0, laminar air flow, inkubator, High Speed Refrigerated Centrifuge KUBOTA 6500, Centrifuge 5415
R, autoklaf, Ultrasonic Homogenizer UH-150, spektrofotometer ultraviolet
tampak (berkas ganda), dan alat-alat gelas lainnya.
Bahan-bahan yang digunakan adalah media LB untuk pertumbuhan D.
radiodurans, sel D. radiodurans, grafit, ferosena, parafin cair, zeolite alam Bayah, xantina oksidase (XO), xantina, dimetilsulfoksida (DMSO), buffer fosfat,
HCl 3M, AgNO3, membran dialisis, jaring nilon, dan parafilm.
Prosedur Penelitian
Prosedur penelitian dilakukan mengikuti diagram alir pada lampiran 1. Tahapannya meliputi pembuatan elektrode pasta karbon, penumbuhan bakteri D. radiodurans, imobilisasi ekstrak protein superoksida dismutase (SOD) pada zeolit, pengukuran elektrokimia, optimasi aktivitas ekstrak protein SOD serta penentuan stabilitas elektrode.
Penumbuhan Sel D. radiodurans dan Ekstraksi SOD
Sel bakteri D. radiodurans ditumbuhkan pada media heterotrof Luria
Bertani (LB) starter yang mengandung tripton 1%, NaCl 0,5%, yeast extract
0,5%, dan etanol 8%. Sel bakteri yang telah ditanam, kemudian diinkubasi pada suhu 30ºC selama dua hari, lalu dipindahkan ke dalam media heterotrof LB
produksi yang mengandung tripton 1%, NaCl 0,5%, yeast extract 0,5%, dan
etanol 8%, lalu diinkubasi pada suhu 30ºC selama dua hari kemudian dilakukan pengukuran nilai optical density pada panjang gelombang 600 nm tiap interval waktu 24 jam untuk mengukur pertumbuhan sel bakteri D. radiodurans. Bakteri dipanen setelah pertumbuhan bakteri mencapai fase logaritma akhir, dengan bantuan sentrifugasi bergaya 7000 G, pada suhu 4 ºC selama 10 menit dengan tujuan memisahkan pelet biomassa sel bakteri dan medianya. Selanjutnya pelet biomassa sel bakteri diresuspensikan ke dalam bufer fosfat pH 7,0 danpelet biomassa sel bakteri disentrifugasi kembali dengan gaya 7000 G, pada suhu 4 ºC selama 10 menit.
5
dan fraksi ekstrak sitoplasma lalu ekstrak sitoplasma dianalisis dengan menggunakan spektrofotometer UV tampak. Konsentrasi protein yang mengandung enzim SOD dari ekstrak sitoplasma hasil dialisis dapat diketahui dengan nilai absorbansnya pada panjang gelombang 260 dan 280 nm..
Pembuatan Elektrode Pasta Karbon Termodifikasi Ferosena
Elektrode dibuat dengan cara melarutkan 3 mg ferosena dalam 1 mL DMSO dan ke dalam larutan tersebut ditambahkan 100 mg grafit. Campuran didiamkan selama 2 jam kemudian pelarut diuapkan menggunakan pengering vakum dan diperoleh grafit termodifikasi mediator ferosena. Grafit kemudian dicampur dengan 35 μL parafin cair hingga membentuk pasta. Pasta karbon kemudian dimasukkan ke dalam badan elektrode hingga padat sampai permukaan. Permukaan elektrode dihaluskan dan dibersihkan dengan amplas dan kertas minyak (Trivadila 2011).
Aktivasi Zeolit
Sebanyak 50 gram zeolit Bayah dicuci dengan akuades sampai pH 7, kemudian disaring dengan ukuran 50 mesh dan dikeringkan dalam oven pada 105 °C selama 3 jam. Zeolit yang telah kering diaktivasi dengan menambahkan 250 mL HCl 3 M ke dalam gelas piala dan diaduk selama 1 jam. Zeolit yang telah diaktivasi disaring, kemudian dicuci menggunakan akuades sampai pH netral. Larutan hasil saringan diuji kandungan klorin dengan AgNO3 dan dicuci kembali dengan akuades sampai tidak mengandung klorin. Setelah pH netral dan bebas klorin, zeolit dikeringkan pada suhu 300 °C selama 3 jam. Zeolit kemudian dihaluskan dan diayak dengan ayakan 100 mesh
Imobilisasi Ekstrak D. radiodurans
Sebanyak 30 mg zeolit Bayah dicampur dengan 10 mL akuades dengan alat
vorteks sehingga membentuk suspensi 3 mg/mL. sebanyak 20 µL ekstrak D.
radiodurans dalam bufer fosfat pH 7.5 dicampur dengan 10 µL suspensi zeolit dan didiamkan selama 10 menit lalu diteteskan sebanyak 10 µL pada permukaan elektrode, didiamkan hingga pelarutnya menguap, dilapisi dengan membran dialisis, ditutup dengan jaring nilon, dan diikat dengan parafilm. Elektrode dapat
langsung digunakan untuk pengukuran aktivitas antioksidan ekstrak D.
radiodurans dengan metode voltametri siklik. Elektrode direndam dalam bufer fosfat pH 7.5 pada suhu 4 °C ketika tidak digunakan untuk memberikan keadaan yang sama dengan lingkungan sebenarnya (Dai et al. 2004, Iswantini et al. 1998).
Pengukuran Elektrokimia
Pengukuran elektrokimia dilakukan dengan metode voltametri siklik
dengan menggunakan eDAQ potensiostat–Galvanostat yang dilengkapi perangkat
lunak Echem v2.1.0. Elektrode yang digunakan adalah elektrode Ag/AgCl sebagai elektrode rujukan, platina sebagai elektrode bantu dan elektrode pasta
6
karbon dan zeolit sebagai elektrode kerja. Parameter pengukuran dibuat sebagai berikut:
Radikal superoksida dihasilkan melalui reaksi enzimatis xantina-xantina oksidase (XO).
Larutan bufer fosfat sebanyak 1.9 mL, 100 μL ferosena dan 100 μL larutan XO 0,1 U/mL ditambahkan ke dalam sel pengukuran dan puncak arus anoda yang terbentuk diamati sebagai blanko. Selanjutnya ditambahkan 1 mL larutan xantina 2,1 mM dan diukur kembali perubahan atau kenaikkan puncak arus anoda yang terjadi.
Aktivitas Ekstrak Protein SOD D. radiodurans
Aktivitas ekstrak protein diukur pada variasi konsentrasi substrat xantina 0.1-1.0 mM dengan interval 0.1 kemudian dibuat kurva hubungan antara
konsentrasi substrat xantina dengan aktivitas ekstrak protein SOD D.
radiodurans. Sebagai parameter adanya hubungan linier digunakan koefisien korelasi r pada analisis regresi linier y = a + bx.
Stabilitas Elektrode
Elektrode yang dibuat sebelumnya dengan imobilisasi ekstrak protein SOD D. radiodurans pada permukaannya, diukur aktivitasnya secara langsung. Nilai aktivitas yang diperoleh pada pengukuran ini dianggap aktivitas 100%. Aktivitas diukur kembali setiap kurun waktu tertentu, dan aktivitas yang tersisa diukur.
Keterulangan
7
HASIL DAN PEMBAHASAN
Penumbuhan Sel dan Ekstraksi Protein Sitoplasma D. radiodurans
Penggunaan bakteri D. radiodurans sebagai sumber penghasil enzim SOD
yang ekonomis. Penumbuhan sel bakteri D. radiodurans menggunakan media
heterotrof LB yang terbuat dari ekstrak ragi, tripton dan NaCl, ketiganya adalah nutrisi yang dibutuhkan oleh bakteri untuk tumbuh dan etanol 8%. Penambahan etanol 8% untuk menciptakan kondisi lingkungan yang mendukung pertumbuhan bakteri D. radiodurans yang bersifat fenolik. Seluruh proses penumbuhan bakteri D. radiodurans mulai dari penanaman bakteri dalam media heterotrof LB starter
sampai dimulainya proses ektraksi dilakukan dalam keadaan steril. Bakteri D.
radiodurans dikembangkan dalam media heterotrof LB starter kemudian
dipindahkan ke dalam media heterotrof LB produksi. Sel bakteri D. radiodurans
diekstraksi untuk mendapatkan ekstrak protein yang mengandung enzim SOD.
Enzim SOD adalah metaloenzim dan penelitian Dennis et al. (2006)
menunjukkan bahwa enzim SOD pada bakteri D. radiodurans terdapat dalam
bentuk Mn-SOD (Gambar 1).
Enzim Mn-SOD D. radiodurans terdapat di dalam protein sitoplasma yang dilindungi oleh dinding sel yang tebal dan kuat. Untuk mengekstraksi protein dari
bakteri D. radiodurans, sel bakteri harus dipecah terlebih dulu dengan cara
disonifikasi menggunakan Ultrasonic Homogenizer sebanyak dua kali kemudian
dipisahkan dari bagian lain sel dengan cara disentrifugasi. Sel D. radiodurans memiliki bentuk geometri tetrad dan berukuran besar, dinding selnya mengandung petidoglikan yang tebal dan memiliki membran yang menutupi seluruh permukaan luar dinding sel sehingga sangat sulit untuk dipecah. Oleh
karena itu, proses sonifikasi dengan Ultrasonic Homogenizer menjadi tahapan
paling penting dalam proses ekstraksi protein dari sel bakteri D. radiodurans.
Gambar 1 Struktur Mn-SOD
Rendemen ekstrak protein yang diperoleh dari ekstraksi D. radiodurans
8
selanjutnya diimobilisasi ke atas permukaan elektrode pasta karbon termodifikasi grafit. Modifikasi grafit ini bermanfaat karena memiliki sifat elektrokimia yang baik, mudah penanganan, murah dan daerah pertukaran yang lebar dapat meningkatkan respon analat (Ash 2012).
Imobilisasi dan Optimasi Ekstrak Protein D. radiodurans
Imobilisasi suatu enzim pada permukaan material penyangga dapat meningkatkan kerja katalitiknya. Pemilihan metode imobilisasi dan material penyangga yang tepat dapat meningkatkan aktivitas, stabilitas dan selektivitas enzim. Imobilisasi dilakukan menggunakan metode imobilisasi yang dilakukan
oleh Iswantini et al. (1998) dan material penyangga yang digunakan adalah
komposit zeolit alam Bayah. Pemilihan zeolit sebagai material penyangga didasari hasil penelitian sebelumnyayang menyatakan bahwa penggunaan zeolit dalam imobilisasi enzim dapat meningkatkan puncak arus, struktur porinya yang seragam meningkatkan selektivitas dan reprodusibilitas, resisten terhadap pelarut organik, stabil pada suhu tinggi dan sifatnya yang keras membuatnya tahan terhadap tekanan mekanik dan membuat enzim yang terjerab lebih stabil. Weniarti (2011) menyatakan bahwa enzim SOD yang diimobilisasi pada permukaan zeolit alam dapat meningkatkan respon arus dan mempercepat laju reaksi. Penggunaan komposit zeolit yang lebih spesifik dilakukan oleh Hayati (2011) yang menyatakan bahwa enzim SOD yang diimobilisasi pada permukaan zeolit Bayah dapat meningkatkan aktivitas antioksidan yang terukur.
Enzim SOD seperti enzim pada umumnya dapat bekerja dengan baik pada kondisi optimumnya. Parameter katalitik suatu enzim bekerja dengan baik diindikasikan dengan aktivitas, stabilitas, sensitivitas dan selektivitas yang tinggi. Suhu dan pH lingkungan yang tidak sesuai dapat menurunkan kerja enzim SOD karena itu harus diketahui terlebih dulu kondisi optimum untuk enzim SOD sebelum mengukur aktivitasnya menggunakan voltametri siklik. Weniarti (2011) menemukan bahwa enzim SOD murni dan ekstrak protein yang berasal dari
bakteri D. radiodurans bekerja optimum pada suhu 30 ºC dan pH 9. Faktor
ekonomi mendorong pemanfaatan enzim SOD dari D. radiodurans sebagai
alternatif enzim SOD murni. Meski demikian pemanfaatan enzim Mn-SOD dari
bakteri D. radiodurans juga memiliki kekurangan. Ekstrak protein dari D.
radiodurans terdapat protein-protein lain selain protein enzim Mn-SOD sehingga perlu pemurnian lebih lanjut. Tanpa melakukan pemurnian Weniarti (2011) menemukan enzim Mn-SOD dapat bekerja optimum pada konsentrasi ekstrak protein 1.500 g/L.
Aktivitas Antioksidan Ekstrak SOD D. radiodurans
9
Tomaskova (2013) pada berbagai produk olahan minyak bumi menggunakan elektrode kerja emas. Prinsip dari teknik voltametri siklik dengan memberikan potensial pada analat akan menghasilkan arus sebagai fungsi dari aliran potensial. Pengukuran dilakukan dengan mengukur bufer fosfat pH 9, lalu ditambahkan mediator ferosena, xantina oksidase (XO) (hasil pengukuran sebagai blanko), dan substrat xantina pada suhu 30 ºC. Fungsi penambahan ferosena dikarenakan transfer elektron langsung dari enzim ke elektrode sulit terjadi, keberadaan mediator akan mempermudah perpindahan elektron tersebut (Ahammad 2013).
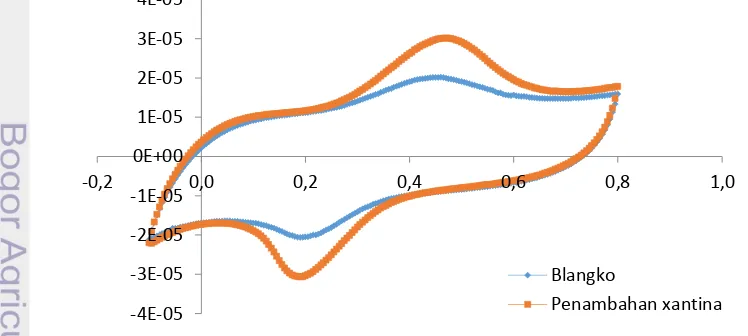
Perubahan arus yang diperoleh dari nilai kuat arus blangko dan setelah penambahan substrat xantina setara dengan besarnya aktivitas antioksidan. Idealnya besar kuat arus pada pengukuran blanko adalah 0 A. Voltamogram pada Gambar 2 menunjukkan adanya puncak oksidasi pada potensial 435 mV dengan kuat arus 20 µA untuk pengukuran blanko. Hal ini terjadi diduga karena adanya oksigen terlarut pada bufer fosfat dan xantina oksidase yang dapat mengalami reaksi redoks sehingga menghasilkan puncak oksidasi. Penambahan ferosena juga menyebabkan puncak oksidasi dan reduksi meningkat. Ini terjadi karena ferosena menghasilkan puncak oksidasi dan reduksi (Trivadila 2011). Larutan bufer fosfat berfungsi mengatur serta menjaga pH lingkungan agar sesuai dengan pH optimum enzim SOD sedangkan ferosena berfungsi sebagai mediator elektron. Reaksi enzimatis berlangsung setelah penambahan XO dan xantina yang menghasilkan radikal bebas superoksida. Radikal superoksida yang dihasilkan akan bereaksi dengan enzim SOD yang diimobilisasi pada zeolit di permukaan elektrode pasta karbon. Reaksi yang terjadi sebagai berikut:
xantina + H
Reaksi melibatkan pertukaran elektron menghasilkan arus oksidasi dan reduksi. Arus yang dihasilkan dari reaksi enzimatis radikal superoksida dengan enzim SOD dikurangi dengan arus blanko dan terhitung sebagai aktivitas antioksidan.
Gambar 2 Voltamogram Siklik pada kondisi optimum; suhu 30 °C. bufer fosfat
.pH 9, zeolit 137.5 mg, dan konsentrasi ekstrak protein1.500 g/L
Pengaruh substrat xantina pada aktivitas antioksidan ekstrak protein D. radiodurans dilakukan pada rentang konsentrasi substrat 0.1-1.0 mM pada suhu
10
30 ºC, pH 9, zeolit 137.5 mg, dan konsentrasi ekstrak D. radiodurans 1.500 g/L
dengan dua perlakuan: dengan imobilisasi ekstrak SOD pada zeolit Bayah dan tanpa imobilisasi. Perbedaan perlakuan dengan dan tanpa zeolit untuk melihat pengaruh penggunaan komposit zeolit Bayah pada aktivitas antioksidan.
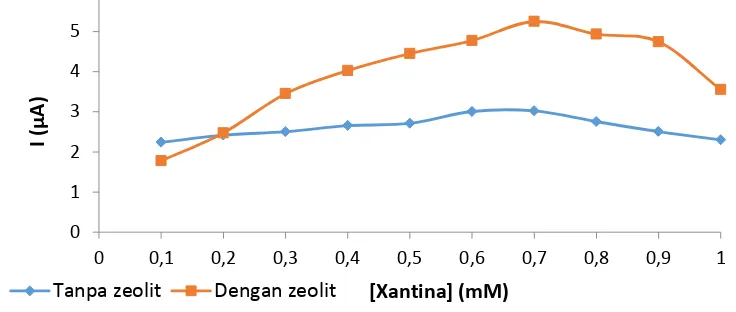
Arulpriya (2010) menemukan bahwa kenaikan konsentrasi ekstrak Samanea saman berbanding lurus dengan aktivitas antioksidannya. Gambar 3
menunjukkan hubungan antara konsentrasi substrat dan aktivitas ekstrak D.
radiodurans. Besarnya kuat arus, I berbanding lurus dengan konsentrasi substrat mengikuti orde reaksi satunamun setelah penambahan substrat dengan konsentrasi 0.8 mM dan lebih besar dari itu, arus yang diperoleh menurun untuk kedua perlakuan. Hal ini terjadi karena pada konsentrasi substrat kecil, tapak aktif pada enzim masih belum seluruhnya terikat dan akan terikat secara sempurna pada penambahan substrat dengan konsentrasi 0.7 mM. Penambahan substrat dengan konsentrasi di atas 0.7 mM tidak menghasilkan peningkatan aktivitas enzim SOD dan bahkan penambahan substrat dengan konsentrasi yang lebih besar akan membuat jenuh dan menyebabkan aktivitas enzim menurun.
Gambar 3 Hubungan antara konsentrasi xantina dan aktivitas ekstrak D.
..radiodurans
Gambar 4 menunjukkan aktivitas ekstrak D. radiodurans dengan
penambahan zeolit lebih besar dibandingkan tanpa penambahan zeolit, yaitu 5.25 µA berbanding 3.02 µA pada konsentrasi substrat 0.7 mM. Hal ini menunjukkan bahwa penggunaan zeolit sebagai matriks imobilisasi dapat meningkatkan arus puncak oksidasi. Regresi linier yang dihasilkan oleh ekstrak D. radiodurans yang
diimobilisasi pada zeolit adalah 0.9673 dan lebih besar dibandingkan ekstrak D.
radiodurans tanpa penambahan zeolit sebesar 0.9661. Hal ini menunjukkan
pengukuran aktivitas ekstrak D. radiodurans dengan imobilisasi zeolit
memberikan hasil lebih akurat dibanding tanpa imobilisasi zeolit. Regresi linier yang didapat lebih baik dari hasil yang didapat Weniarti (2011) sebesar 0.9130 untuk ekstrak D. radiodurans dan 0.9310 untuk enzim SOD murni.
11
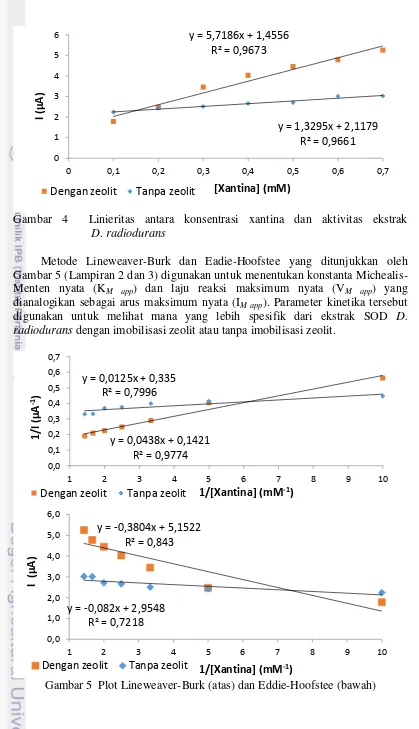
Gambar 4 Linieritas antara konsentrasi xantina dan aktivitas ekstrak D..radiodurans
Metode Lineweaver-Burk dan Eadie-Hoofstee yang ditunjukkan oleh Gambar 5 (Lampiran 2 dan 3) digunakan untuk menentukan konstanta
Michealis-Menten nyata (KM app) dan laju reaksi maksimum nyata (VM app) yang
dianalogikan sebagai arus maksimum nyata (IM app). Parameter kinetika tersebut
digunakan untuk melihat mana yang lebih spesifik dari ekstrak SOD D.
radiodurans dengan imobilisasi zeolit atau tanpa imobilisasi zeolit.
Gambar 5 Plot Lineweaver-Burk (atas) dan Eddie-Hoofstee (bawah)
12
Berdasarkan Tabel 1, nilai KM app ekstrak D. radiodurans dengan
imobilisasi zeolit lebih besar dibandingkan KM app ekstrak D. radiodurans tanpa
imobilisasi zeolit. Ini menunjukkan bahwa afinitas SOD pada ekstrak D.
radiodurans yang diimobilisasi pada zeolit terhadap radikal superoksida lebih
kecil dibandingkan SOD pada ekstrak D. radiodurans tanpa penambahan zeolit.
Afinitas menunjukkan kekuatan enzim untuk mengikat substrat. Semakin kecil
afinitas, maka semakin kuat enzim untuk mengikat substrat. Nilai IM app ekstrak D.
radiodurans dengan imobilisasi zeolit lebih besar dibandingkan IM app ekstrak D.
radiodurans tanpa imobilisasi zeolit. Ini menunjukkan bahwa imobilisasi enzim SOD pada permukaan zeolit dapat meningkatkan laju reaksi dan aktivitas
antiosidan enzim SOD. Weniarti pada ekstrak SOD D. radiodurans (2011)
mendapatkan nilai KM app 0.3400 dengan nilai KM app lebih besar artinya kekuatan
enzim mengikat substrat lebih kuat dan Weniarti (2011) memperoleh nilai IM app
0.1256 µA dengan nilai IM app lebih kecil artinya aktivitas antioksidan lebih kecil.
Tabel 1 Nilai parameter kinetika enzim ekstrak D. radiodurans
Metode
Penambahan zeolit Tanpa penambahan
zeolit
Eaddie-Hoofstee 5.1522 0.3804 2.9548 0.0820
Stabilitas dan Keterulangan Biosensor Antioksidan Berbasis SOD dari Ekstrak D. radiodurans
Kestabilan dan ketahanan enzim merupakan kriteria yang penting dalam
biosensor. Stabilitas biosensor antioksidan berbasis ekstrak D. radiodurans
dengan imobilisasi zeolit dan tanpa imobilisasi zeolit ditentukan dari pengukuran aktivitas antioksidan pada kondisi optimum dan dilakukan selama 10 jam dengan interval 2 jam. Stabilitas biosensor antioksidan digambarkan sebagai hubungan antara waktu (jam) dan aktivitas antioksidan (µA).
13
Gambar 6 Stabilitas biosensor antioksidan berbasis SOD dari ekstrak D.
..radioduran
Keterulangan dilakukan sebanyak 3 elektrode yang diukur di hari yang berlainan. Keterulangan dihitung untuk melihat keakuratan metode yang digunakan. Data perhitungan yang terdapat di Lampiran 5, simpangan baku (SD) dan simpangan baku relatif (%RSD). Menurut Yashin (2011) metode voltametri memiliki keunggulan pada SD kurang dari 0.5% dan RSD kurang dari 5%.Data pada lampiran 5, SD yang diperoleh dari pengukuran aktivitas ekstrak SOD dengan imobilisasi zeolit adalah 0.3548 dan %RSD 11.76% lebih kecil dari SD dan %RSD yang didapat tanpa imobilisasi zeolit 0.5472 dan 24.44%. Nilai yang diperoleh masih jauh dari angka yang diberikan Yashin (2011) meski demikian dapat dilihat keterulangan imobilisasi ekstrak menggunakan zeolit masih lebih baik daripada tanpa zeolit.
SIMPULAN
Proses sonifikasi yang lebih baik akan menghasilkan ekstrak SOD D.
radiodurans yang lebih banyak. Imobilisasi enzim SOD D. radiodurans pada permukaan zeolit Bayah mampu meningkatkan aktivitas antioksidan. Afinitas SOD pada ekstrak D. radiodurans yang diimobilisasi pada zeolit terhadap radikal
superoksida lebih besar dibandingkan SOD pada ekstrak D. radiodurans tanpa
penambahan zeolit. Penggunaan zeolit sebagai matriks imobilisasi dapat meningkatkan puncak arus oksidasi, laju reaksi, dan stabilitas dari biosensor yang lebih baik.
DAFTAR PUSTAKA
Abou-Seif MA, dan Youssef A. 2004. Evaluation of some biochemical changes in diabetic patients. Clinica Chimica Acta346:161-170.
14
Abreu IA. dan Cabelli DE. 2010. Superoxide dismutases-a review of the metal-associated mechanistic variations.Biochim Biophys Acta 1804(2): 263-274 Ahammad AJS. 2013. Hydrogen Peroxide Biosensors Based on Horseradish
Peroxidase and Hemoglobin. J Biosens BioelectronS:9.
Antolovich M, Prenzler PD, Patsalides E, Mcdonald S, Robards K. 2002. Methods for testing antioxidant activity. The Analyst 127:183-198.
Anwar A, Qader SAU, Raiz A, Iqbal S, Azhar A. 2009. Calcium Alginate: A Support Material for Immobilization of Proteases from Newly Isolated Strain
of Bacillus subtilis KIBGE-HAS. World Applied Sciences Journal 7
(10):1281-1286.
Arulpriya P, Lalitha P, Hemalatha S. 2010. Cyclic voltammetric assessment of the antioxidant activity of petroleum ether extract of Samanea saman (Jacq.)Merr. Adv in App Sci Research 1(3):24-35.
Asada, K.(2006) Production and scavenging of reactive oxygen species in chloroplasts and their functions. Plant Physiol141:391-396.
Ash PA, Vincent KA. 2012. Spectroscopic analysis of immobilised redox
enzymes under direct electrochemical control. Chem Commun 48:1400–
1409.
Balogh E. 2010. Characterization Of The Antioxidant Capacity And Determination Of Some Antioxidant Compounds In Berry Fruits. [Tesis]. Budapest (HU): Faculty of Food Science, Corvinus University of Budapest. Bello-Gil D et al. 2014. Specific and Reversible Immobilization of Proteins
Tagged to the Affinity Polypeptide C-LytA on Functionalized Graphite Electrodes. PLOS ONE. Vol 9.
Biskup I, Golonka I, Gamian A, Sroka Z. 2013. Antioxidant activity of selected phenols estimated by ABTS and FRAP methods. Postepy Hig Med Dosw 67: 958-963.
Bratu MM, Doroftei E, Negreanu-Pirjol T, Hostina C, Porta S. 2012. Determination of Antioxidant Activity and Toxicity of Sambucus nigra Fruit
Extract Using Alternative Methods. Food Tech Biotech 50(2):177–182
Busch JHC, Hrncirik K, Bulukin E, Boucon C, Mascinis. 2006. Biosensor Measurements of Polar Phenolics for the Assessment of the Bitterness and Pungency of Virgin Olive Oil. J Agri Food Chem 54:4371-4377.
Budnikov GK, dan Ziyatdinova GK. 2004. Antioxidants As Analytes in Analytical Chemistry. J Anal Chem 60:600-613.
Campanella L, Bonanni A, Bellantoni D, Favero G, Tomassetti M. 2004. Comparison of fluorimetric, voltametric and biosensor methods for the determination of total antioxidant capacity of drug products containing acetylsalicylic acid. J Pharm Biomed Anal 36:91-99.
Campanella L, Bonanni A, Bellantoni D, Tomassetti M. 2004. Biosensor for
determination of total antioxidant capacity of phytotherapeutic
integrators:comparison with other spectrophotometric, fluorimetric and
voltametric methods. J Pharm Anal 35:303–320.
Campanella L, Bonanni A, Favero G, Tomassetti M. 2003. Determination of antioxidant properties of aromatic herbs, olivesand fresh fruit using an
enzymatic sensor. Anal Bioanal Chem 375:1011–1016.
15
wines: comparison with other spectrophotometic and fluorimetric
methods.Biosens Bielect 19:641–651.
Campanella L, Bonanni A, Tomassetti M. 2003. Determination of antioxidant capacity of samples of different types of tea, or of beverages based on tea or
other herbal product, using a superoxide dismutase biosensor. J Pharm
Biomed Anal 32:725–736.
Campanella L, Martini E, Tomassetti M. 2005. Antioxidant capacity of the algae
using a biosensor method. Talanta 66:902–911.
Chevion S, Robert MA, Chevion M. 2000. The use of cyclic voltammetry for the evaluation antioxidant capacity. Free Rad Biol Med 28(6):860-870.
Cortina-Puig M & Camp M. 2007. Electrochemical biosensors as a tool for antioxidant capacity assessment. J Sens Actua 129:459-466.
Daly MJ, et al. 1994. In vivo damage and recA-dependent repair of plasmid and
chromosomal DNA in the radiation-resistant bacterium D. radiodurans. J
Bacteriol 176(12):3508-3517.
Dai Z, Liu S, Ju H. 2004. Direct electron transfer of cytochrome c immobilized on a NaY zeolite matrix and its application in biosensing. Electro Acta 49:2139-2144.
Dennis RJ et al.2006. Structure of the manganese superoxide dismutase from D.
radiodurans in two crystal forms. Act cryst62:325-329.
Di J, Bi S, Zhang M. 2004. Thrid-Generation superoxide anion sensor based on superoxide dismutase directly immobilized by sol-gel thin film on gold electrode. J Biosen Bioelect 19:1479-1486.
Esumi K, Takei N & Yoshimura T. 2003. Antioxidant-potentiality of gold– chitosan nanocomposites. Col & Surf: Biointerfaces. 32(2):117–125.
Gil DM de Albuquerque. 2011. Biosensor evaluation of the antioxidant activity of wines and teas, interference studies and comparison with other methods. [Tesis]. Lisbon (PT): Chemical, Biochemical Department, Lisbon University.
Gustafsson H. 2012. Enzyme Immobilization in Mesoporous Silica. [Tesis]. Departement of Chemical and Biological Engeenering, Chalmer University of Technology.
Hayati T. 2011. Aktivitas antioksidan beberapa tanaman obat menggunakan zeolit alam sebagai bahan penopang. [Tesis]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Ikeda et al.. 1998. Electrochemical monitoring of in vivo reconstitution of glucose
dehydrogenase in Escherichia coli cells with externally added
pyrroloquinoline quinoline. J Electroanal Chem 449:219–224.
Iswantini D. 2010. Indonesian natural zeolit and its nanocomposit as supporting material for antioxidant and antimicrobial herbal medicine. Laporan kerjasama hibah internasional.
Iswantini D, Darusman LK, Rahminiwati M, Iskandar HR. 2004. Formula ekstrak gabungan Apium graveolens dan Sida rhombifolia L. sebagai fitofarmaka untukpenyakit gout: inhibitor xantin oksidase. Scientific Journal of Bogor Agricultural University.
Iswantini D, Kato K, Kano K, Ikeda T. 1998. Electrochemical measurement of glucose dehydrogenase activity exhibited by Escherichia coli cells; effects of
16
the addition of pyrroloquinoline, magnesium or calcium ions and ethylenediaminetetraacetic acid. Bioelect Bioen 46:249-254.
Iswantini D, Nurhidayat N, Trivadila. 2011. Glucose biosensor selected Indonesia bacteria. Microbiology Indonesia 5(1):9-14.
Kamel AY, Moreira FTC, Delerue-Matos C, Sales MGF. 2008. Electrochemical determination of antioxidant capacities in flavored waters by guanine and
adenine biosensors. Biosens and Bioelect24:591–599.
Kanematsu S, Okayasu M, Kurogi D. 2012. Occurrence of two types of Mn-superoxide dismutase in the green alga Spirogyra: cDNA cloning and
characterization of genomic genes and recombinant proteins. Bull
Minamikyushu Univ 42A:1-13.
Kolotkova et al. 2013. Study of Total Antioxidant Activity of Human Serum
Blood in the Pathology of Alcoholism. Molecules 18:1811-1818.
Koutsilieri E., Scheller C., Grünblatt E., Nara K., Li J., Riederer P. 2002. Free radicals in Parkinson’s disease. J Neurol249(2): 1101-1105
Mao P. 2013. Oxidative stress and its clinical applications in dementia. J
Neurodegenerative Dis319898.
Mardiah E. 2011. Aktivitas urikase yang dihasilkan dari berbagai sel Lactobacillus plantarum dan parameter kinetikanya. [Skripsi]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Mateo et al. 2007. Improvement of enzyme activity, stability and selectivity via
immobilization techniques. Enzyme and Microbial Technology
40:1451-1463.
Moskovitz J, Yim MB, dan Chock PB. 2002. Free Radicals and Disease. Biochem and Biophysic397:354-359.
Ningrum LG. 2011. Aktivitas ekstrak protein Mn-superoksida dismutase Deinococcusradiodurans yang diimobilisasi pada permukaan pasta karbon sebagai biosensor antioksidan. [skripsi]. Bogor (ID): Departemen Kimia, Institut Pertanian Bogor.
Ozyurt D, Demirata B, Apak R. 2006. Determination of total antioxidant capacity by a new spectrophotometric method based on Ce(IV) reducing capacity measurement. Talanta 24: 273-282.
Roy JJ, Abrahama TE,Abhijith KS, KumarPVB , Thakur MS. 2005. Biosensor for the determination of phenols based on Cross-Linked Enzyme Crystals (CLEC) of laccase. J Biosen Bioelect 21:206-211.
Shumyantseva et al.. 2005. Direct electron transfer between cytochrome P450scc
and gold nanoparticles on screen-printed rhodium–graphite electrodes.
Biosensors and Bioelectronics. (21):217–22.
Trivadila. 2011. Biosensor antioksidan menggunakan superoksida dismutase D.
radiodurans yang diimobilisasi pada permukaan elektrode pasta karbon dan parameter kinetikanya. [Tesis]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Tomaskova M, Chylkova J, Machalicky O, Selesovska R, Navratil T. 2013. Voltammetric Determination of Different Antioxidants in Petroleum Products by Working Gold Electrode. Int J Electrochem Sci 8:1664-1677. Valdes MG, Perez-Cordoves AI, Diaz-Garcia ME. 2006. Zeolites and zeolite
17
Wang D, Wang L-J, Zhu F-X, Zhu J-Y, Chen XD, Zou L, Saito M, Li L. 2008. In vitro and in vivo studies on the antioxidant activities of the aqueous extracts of Douchi (a traditional Chinese salt-fermented soybean food). Food Chem 107:1421-8.
Weniarti. 2011. Biosensor antioksidan menggunakan superoksida dismutase D. radiodurans yang diimobilisasi pada nanokomposit zeolit alam Indonesia. [Tesis]. Bogor (ID): Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Yashin A, Yashin Y, Nemzer B. 2011. Determination of Antioxidant Activity in Tea Extracts, and Their Total Antioxidant Content. Am J Biomed Sci 3(4), 322-335.
18
Lampiran 1Bagan alir penelitian
Ekstraksi Protein Sitoplasma D. radiodurans
Imobilisasi ekstrak D.Radiodurans pada zeolit
Aktivasi zeolit
Zeolit teraktivasi
Zeolit terimobilisasi ekstrak D. radiodurans diteteskan pada elektrode
Pengukuran dengan metode voltametri siklik
Penentuan linearitas, stabilitas dan keterulanganelektrode
Pembuatan elektrode pasta karbon termodifikasi ferosena
Ekstrak protein
19
Lampiran 2 Analisis kinetika SOD ekstrak D.radiodurans terimobilisasi zeolit [xantina]
Lampiran 3 Analisis kinetika SOD ekstrak D. radiodurans tanpa zeolit [xantina]
Lampiran 4Stabilitas biosensor antioksidan berbasis SOD dari ekstrak D..radiodurans pada suhu 30°C
Waktu Dengan zeolit Tanpa zeolit
20
Lampiran 5 Keterulangan arus puncak oksidasi dari 3 elektrode
Hari Dengan zeolit Tanpa zeolit
aktivitas Aktivitas
1 2.6200 2.8060
2 3.3040 2.1960
3 3.1260 1.7140
Rerata 3.0167 2.2387
SD 0.3549 0.5472
%RSD 11.76 24.44
Contoh perhitungan dengan zeolit:
√∑ ⃓ ⃓
√∑ ⃓ ⃓
SD = 0.354865233
%RSD =
%RSD =