BIOSORPSI TEMBAGA (Cu) DAN MERKURI (Hg) OLEH
Omphalina
sp. MENGGUNAKAN METODE
ROTARY,
BIOTRAY, PACK BED FLOW
, DAN
BATCH
DESI PURWANINGSIH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Biosorpsi Tembaga (Cu) dan Merkuri (Hg) oleh Omphalina sp. Menggunakan Metode Rotary, Biotray, Pack Bed Flow, dan Batch adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Pusat Penelitian Bioteknologi dan Bioindustri Indonesia.
Bogor, Agustus 2015
Desi Purwaningsih
RINGKASAN
DESI PURWANINGSIH. Biosorpsi Tembaga (Cu) dan Merkuri (Hg) oleh
Omphalina sp. menggunakan Metode Rotary, Biotray, Pack Bed Flow, dan Batch. Dibimbing oleh I MADE ARTIKA dan TRI PANJI.
Limbah logam berat merupakan salah satu limbah berbahaya. Toksisitas dapat ditimbulkan akibat jumlah limbah logam yang banyak, sedangkan dalam jumlah sedikit dapat masuk kedalam siklus rantai makanan yang lama-kelamaan akan terakumulasi di dalam tubuh mahluk hidup dan dapat menimbulkan berbagai macam penyakit. Limbah logam berat banyak berasal dari kegiatan-kegiatan industri, pertambangan baik pertambangan skala besar maupun pertambangan – pertambangan milik rakyat. Selain berasal dari limbah industri dan pertambangan, logam berat juga terdapat secara alami di lingkungan.
Banyak metode yang dapat digunakan untuk mengolah limbah logam berat, baik secara fisika, kimia, maupun biologi. Tetapi, cara-cara tersebut memiliki beberapa efek samping seperti: sludge yang berbahaya, kurang efektif pada konsentrasi tinggi, biaya yang mahal, dan menimbulkan efek samping yang berbahaya. Oleh karena itu, biosorpsi logam berat menggunakan mikroorganisme merupakan salah satu metode yang aman, efektif, dan efisien untuk digunakan dalam pengolahan limbah logam berat. Omphalina sp. mrupakan salah satu mikroorganisme yang memiliki kemampuan untuk mendegradasi lignin dan mampu menyerap logam berat. Penelitian ini bertujuan untuk mengetahui kemampuan Omphalina dalam menyerap ion logam berat. Biomassa yang masih hidup dapat menyerap logam lebih banyak dari pada biomassa yang sudah mati, sehingga perlu dilakukan optimalisasi penggunaan biomassa dengan membandingkan metode batch, rotary, pack bed flow, dan biotray.
Penelitian dilakukan pada larutan Cu 100 dan 200 ppm, dan Hg 3 dan 5 ppm. Biosorpsi logam tersebut dilakukan menggunakan kultur padat Omphalina sp. pada media serbuk gergaji yang ditempatkan di dalam kerangka kawat. Serapan logam diatur dengan sistem rotary, biotray, pack bed flow, dan batch. Variasi waktu kontak 1, 3, 5, 7, dan 24 jam, masing-masing sampel diukur kandungan logamnya dengan menggunakan spektrofotometri serapan atom. Hasil penelitian menunjukkan bahwa Hg dengan konsentrasi awal 3 ppm dapat berkurang hingga 91.38 % pada metode rotary, 83.98% biotray, 87.14% pack bed flow, 32.94% batch, sedangkan pada Cu dengan konsentrasi awal 100 ppm dapat berkurang hingga 23.58% pada metode rotary, 22.66% biotray, 10.53% pack bed flow, dan 10.17% pada batch. Penyerapan optimal Hg dan Cu terjadi pada 1 jam pertama dan kapasitas serapan logam paling tinggi pada metode rotary, dan pada metode rotary
memiliki viabilitas yang lebih tinggi, terbukti dengan adanya biomassa Omphalina
sp. yang paling banyak setelah dilakukan perlakuan selama 24 jam. Hal tersebut membuktikan pada metode rotary memungkinkan penggunaan ulang Omphalina
untuk menyerap logam. Pada penyerapan logam campuran Hg dan Cu masih terjadi penyerapan sampai jam ke-5. Metode rotary yang digunakan pada biosorpsi logam campuran dapat digunakan kembali sampai dua kali penggunaan.
SUMMARY
DESI PURWANINGSIH. Biosorption Copper (Cu) and Mercury (Hg) by
Omphalina sp. using Batch, Rotary, Biotray, and Pack Bed Flow Methods. Supervised by I MADE ARTIKA and TRI PANJI.
Heavy metal waste is one of the hazardous waste. Toxicity is caused by the high concentration of hazardous waste, while in small amounts ghe heavy metals can enter the food chain cycle, and time by time will accumulate in the living body and cause various diseases. Heavy metal waste comes from industry and mining activities of both large and small scales. In addition, it is also found naturally in the environment.
Many methods can be used to treat heavy metal waste such as physics, chemistry, and biology. However, these methods have some side effects such as: hazardous sludge, less effective at high concentrations, costly, and cause harmful side effects. Therefore, heavy metal biosorbtion using microorganisms is one method which is safe, effective, and efficient to use in the treatment of heavy metal waste. Omphalina sp. is one of microorganisms that have the ability to degrade lignin and is able to absorb heavy metals. This study was aimed to analyze the ability of Omphalina sp. to absorb heavy metal ions. Live biomass can absorb metal more than the death biomass, and therefore, it is important to optimize the use of biomass by comparing the batch, rotary, packbed flow, and biotray methods.
The research was using solution with Cu concentration of 100 and 200 ppm and Hg concentration of 3 and 5 ppm. Biosorption of the metals was carried out by solid culture of Omphalina sp. on sawdust is placed on a wire frame. Biosorption of the metals was set on rotary, biotray, pack bed flow, and batch system. with variation in the contact time of 1, 3, 5, 7, and 24 hours. The metal content of each sample was measured using atomic absorption spectrophotometry. The results showed that percent reduction of Hg with an initial concentration of 3 ppm was 91.38% in rotary, 83.98% in biotray, 87.14% in pack bed flow, and 32.94% in batch methods. The precent reduction of Cu with an initial concentration of 100 ppm was 23:58% in the rotary, 22.66% in biotray, 10:53% in pack bed flow, and 10:17% in the batch methods. Optimal absorption of Hg and Cu occurs in the first 1 hour with the highest metal uptake by the rotary method. In addition, the rotary method has a higher cell viability than the other methods, as is evidenced by the presence of highest biomass of Omphalina sp. after treatment for 24 hours. Result proves that the rotary method allows the reuse of Omphalina sp. to absorb metal. On absorption of Hg and Cu alloys, absorption still occurs until the 5th use. Rotary method used in alloy biosorption can be reused up to twice.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan PPBBI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
BIOSORPSI TEMBAGA (Cu) DAN MERKURI (Hg) OLEH
Omphalina
sp. MENGGUNAKAN METODE
ROTARY
,
BIOTRAY
,
PACK BED FLOW
, DAN
BATCH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Biosorpsi Tembaga (Cu) dan Merkuri (Hg) oleh Omphalina sp. Menggunakan Metode Rotary, Biotray, Pack Bed Flow, dan Batch
Nama : Desi Purwaningsih NIM : G851130191
Disetujui oleh Komisi Pembimbing
Dr Ir I Made Artika, M App Sc Ketua
Dr Tri Panji, MS APU Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis haturkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Judul karya ilmiah dalam penelitian yang dilaksanakan sejak September 2014 ini ialah Biosorpsi Tembaga (Cu) dan Merkuri (Hg) oleh Omphalina sp. Menggunakan Metode Rotary, Biotray, Pack Bed Flow, dan Batch.
Ucapan terima kasih kepada Dr. Ir. I Made Artika M. App. Sc dan Dr Tri Panji MS. APU selaku pembimbing atas ilmu, saran dan kesabaran yang telah diberikan. Terima kasih juga kepada keluarga besar Biokimia (Dosen, Karyawan, Laboran dan teman-teman Biokimia 2013) yang telah memberikan motivasi dan membantu penulis dalam menyelesaikan karya ilmiah ini. Penulis juga mengucapkan terima kasih kepada Direktorat Jenderal Pendidikan Tinggi (DIKTI) sebagai sponsor Beasiswa Pendidikan Pascasarjana Dalam Negeri 2013. Ucapan spesial kepada ayah, ibu, dan adik-adik yang selalu memberikan do’a dan dukungannya serta kepada teman-teman penelitian di Laboratorium Bioproses Pusat Penelitian Bioteknologi dan Bioindustri Indonesia (PPBBI) terima kasih atas persaudaraan yang telah diberikan kepada penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 3
2 METODE 4
Waktu dan Tempat Penelitian 4
Alat 4
Bahan 4
Prosedur Penelitian 4
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Perbedaan media tanam 7
Pengaruh Waktu terhadap Biosorpsi oleh Omphalina sp. 7
Penyerapan Ion Logam Campuran Cu dan Hg 9
Pengaruh Konsentrasi terhadap Biosorpsi oleh Omphalina sp. 9
Kondisi Biomassa Omphalina sp. 10
Penggunaan Ulang Jamur (Reuse) 11
Penentuan Serapan Maksimum 12
Pembahasan 13
Perbedaan Media Tanam 13
Pengaruh Waktu terhadap Biosorpsi oleh Omphalina sp. 13
Penyerapan Ion Logam Campuran Cu dan Hg 17
Pengaruh Konsentrasi terhadap Biosorpsi oleh Omphalina sp. 17
Kondisi Biomassa Omphalina sp. 18
Penggunaan Ulang Jamur (Reuse) 18
Penentuan Serapan Maksimum 19
4 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 21
LAMPIRAN 24
DAFTAR TABEL
1. Perhitungan qMax 12
2. Optimasi Metode 13
DAFTAR GAMBAR
1. Media serbuk gergaji dengan campuran yang berbeda 7
2. Persentase penyerapan Omphalina sp 8
3. Perpanjangan waktu kontak 9
4. Persentase penyerapan larutan ion logam campuran 9
5. Konsentrasi penyerapan Omphalina sp 10
6. Kondisi biomassa setelah terjadi proses biosorpsi pada berbagai metode 11
7. Persentase penyerapan reuse Omphalina sp 11
8. Mekanisme penyarapan logam oleh mikroorganisme 14
9. Proses pengikatan kitin dengan logam 14
10. Polisakarida dinding sel jamur yang berperan dalam biosorpsi 15
11. Mekanisme pertukaran ion pada jamur 16
12. Skema mekanisme seluler penyerapan logam 16
DAFTAR LAMPIRAN
1. Bagan Alir Penelitian 24
2. Kurva Standar AAS 25
3. Perhitungan Langmuir 26
4. Grafik Linear Langmuir 29
5. Hasil Uji Analisis Statistik 33
1
PENDAHULUAN
Latar Belakang
Seiring dengan perkembangan jaman, permintaan konsumen akan barang-barang industri semakin meningkat. Namun peningkatan tidak diimbangi dengan pengolahan limbah hasil industri. Limbah-limbah hasil industri masih mengandung logam berat dan dibuang begitu saja kelingkungan. Jumlah limbah yang banyak mengandung logam berat berbahaya bagi lingkungan dan kesehatan. Selain itu meskipun jumlahnya sedikit limbah logam berat dapat masuk dan terakumulasi dalam rantai makanan. Salah satu logam berat yang sering dijumpai dalam limbah dan memiliki nilai ekonomi adalah merkuri dan tembaga.
Merkuri (Hg) merupakan salah satu logam yang dalam konsentrasi kecil dapat bersifat toksik. Beberapa industri terutama dalam bidang pertambangan banyak manghasikan limbah merkuri. Merkuri tidak hanya berasal dari limbah industri, namun secara alami sudah terdapat dalam lingkungan. Bahan pencemaran merkuri yang terdapat di lingkungan secara alamiyah dapat berasal dari kegiatan gunung berapi atau rembesan air tanah yang melewati deposit merkuri (Lestarisa. 2010). Salah satu industri yang menghasilkan limbah merkuri adalah penambangan emas tradisional yang dilakukan oleh masyarakat, setelah semua proses industri selesai dilakukan limbah merkuri dibuang begitu saja ke lingkungan tanpa melalui proses lebih lanjut (Trisnawati et al. 2013). Hal tersebut menyebabkan kandungan merkuri disekitar penambang emas rakyat sebesar 239.38 ppm di tanah, dan 21.645 ppm diperairan (Hidayati et al. 2006), hal itu menunjukkan kandungan yang tinggi dan berbahaya bagi mahluk hidup. Merkuri ini sangat berbahaya karena dapat masuk kedalam saluran plasenta sehingga dapat berakibat fatal bagi janin, menyebabkan kerusakan otak karena merkuri menghambat penyaluran darah menuju otak. Merkuri yang berikatan dengan sulfur dalam protein dan enzim dapat membuat enzim menjadi inaktif sehingga menghambat proses metabolisme dalam tubuh (Herman. 2006).
Tembaga (Cu) merupakan salah satu contoh logam berat yang berbahanya jika terdapat dalam jumlah yang besar, karena dapat menyebabkan gangguan kesehatan seperti, kerusakan otak berupa tremor, sakit kepala, mengalami kerusakan ginjal, mengalami anemia karena pecahnya sel darah merah (Warianto. 2011). Tembaga dalam jumlah yang sesuai merupakan mikronutrien yang dibutuhkan mahluk hidup. Tembaga biasanya ditemukan dalam bentuk ion bivalen Cu (II) sebagai hasil dari proses hidrolitik yang sering terjadi pada industri miyak, kertas, pewarnaan, dan pelapisan logam, dan banyak terdapat dari limbah industri perak. Pencelupan dengan menggunakan HCl pada industri perak dapat menghasilkan limbah tembaga (Cu2+). Limbah hasil pencucian ini dibuang begitu saja keperairan bebas dalam bentuk CuCl2 sehingga dapat menimbulkan pencemaran (Andaka. 2008).
2
koagulasi, proses elektrokimia, pertukaran ion, presipitasi kimia dan ekstraksi. Penggunaan zat kimia dalam reaksi tersebut dapat memberikan efek samping yang sama bahayanya dengan limbah logam, dan juga biaya yang dibutuhkan cukup mahal. Proses presipitasi tidak efektif diterapkan pada larutan dengan konsentrasi logam antara 1-1000 mg/l, menggunakan banyak bahan kimia dan menghasilkan
sludge dalam jumlah besar (Soeprijanto et al. 2007). Mengatasi hal tersebut maka digunakan mikroorganisme untuk menyerap logam berat yang terdapat pada limbah. Mikroorganisme dipilih karena memiliki beberapa kelebihan, diantaranya adalah (1) biaya operasional yang rendah. (2) efisien dan kapasitas pengikatan logam cukup tinggi. (3) meminimalkan sludge. (4) memungkinan untuk recovery logam, (5) biosorben dapat diregenerasi, (6) bahan baku mudah didapat, (7) dapat menggunakan mikroba yang sudah mati dan tidak memerlukan tambahan nutrisi (Sud et al. 2008).
Mikroorganisme yang sering digunakan salah satunya adalah jamur
Aspergillus sp., Rhizopus sp., Agaricus sp., Trichaptum sp., Scaccharomyces sp., Candida sp. (Abbas et al. 2014), Trichoderma viride (Khumar et al. 2011). Akantetapi sebagian dari mikroorganisme tersebut bersifat patogen yang dapat membahayakan. Omphalina sp. merupakan salah satu mikroorganisme yang bersifat tidak patogen sehingga labih aman digunakan.
Omphalina sp. dapat digunakan sebagai biosorben baik dalam kondisi hidup ataupun mati. Biomassa yang masih hidup dapat meningkatkan konsentrasi penyerapan logam, oleh karena itu perlu digunakan metode yang dapat menunjang kehidupan biosorben ketika digunakan. Metode yeng memungkinkan adanya aerasi untuk dapat menunjang kehidupan biomassa, seperti: rotary (Diessel dan Cristov. 2001), biotray, pack bed flow (Kumar et al. 2011), batch (Chen et al. 2010).
Perumusan Masalah
Jamur merupakan organisme aerob yang telah terbukti dapat digunakan sebagai bahan biosorben logam berat. Untuk lebih meningkatkan efektifitas penggunaan jamur sebagai bahan biosorben maka perlu digunakan metode yang dapat menunjang kehidupan jamur, sehingga jamur masih tetap dapat hidup, bertambah banyak, dan dapat meningkatkan kapasitas serapan jamur.
Tujuan Penelitian
Penelitian ini bertujuan menguji kemampuan biosorpsi Omphalina sp. pada metode rotary, biotray, pack bed flow, dan batch. Serta mengetahui pengaruh waktu, larutan logam campuran dan efektifitas peggunaan ulang Omphalina sp. dalam menyerap ion logam.
Manfaat Penelitian
3
Ruang Lingkup Penelitian
Lingkup kegiatan penelitian ini meliputi penanaman jamur pada media PDA, beras, serbuk gergaji, dan kultur permukaan. Dilanjutkan dengan proses biosorpsi logam oleh jamur Omphalina sp. dengan menggunakan metode rotary, biotray,
4
2 METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan dari bulan September 2014 sampai bulan Mei 2015. Penelitian dilakukan di Laboratorium Bioproses Pusat Penelitian Bioteknologi dan Bioindustri Indonesia (PPBBI), Laboratorium Bersama Kimia Departemen Kimia, dan Laboratorium Ilmu Nutrisi Ternak Perah (INTP) Departemen Ilmu Nutrisi Ternak Perah Institut Pertanian Bogor (IPB) .
Alat
Alat yang digunakan dalam penelitian ini adalah: tabung 500 ml, cawan petri, gelas ukur, botol jam, gelas beker, seperangkat alat rotary, batch ,pack bed flow, biotray, Atomic Absorption Spectrophotometry (AAS), kompor, autoklaf, plastik tahan panas.
Bahan
Bahan yang digunakan adalah Omphalina sp. yang berasal dari koleksi Laboratorim Mikroba dan Bioproses PPBBI, kentang, agar, aquades, glukosa, CuSO4.5H2O, HgCl2, HNO3, SnCl2, pepton, beras, air, serbuk gergaji (sisa pengolahan kayu di daerah Kedung Halang dan Yasmin), dedak, aquades steril, perklorat, alkohol 70%.
Prosedur Penelitian Persiapan Isolat Omphalina sp. pada PDA
Media potato dextrose agar (PDA) dibuat dari campuran 250 ml air sari rebusan kentang yang ditambahkan dengan 5 g agar dan 5 g gula pasir dan disterilkan pada suhu 121 °C selama 15 menit. PDA dituangkan pada 10 cawan petri. Omphalina yang digunakan merupakan isolat dari koleksi PPBBI dipotong 1 cm2 diinokulasi pada media PDA sampai tumbuh merata pada media selama 7 hari.
Persiapan Isolat Omphalina sp. pada Media Beras (Ihsan dan Octriana. 2009)
Satu liter beras dicuci lalu dipanaskan dengan sedikit air, kemudian dimasak sambil diaduk hingga airnya habis, ditambahkan 1 sendok makan minyak goreng agar beras tidak menggumpal. 100 gram beras dipindahkan ke dalam botol jam, sterilisasi pada suhu 121 °C, 1 atm selama 15 menit, setelah dingin media beras diaduk supaya tidak ada lagi yang menggumpal lalu dicampur dengan setengah petri isolat Omphalina sp. yang berasal dari PDA, diaduk dan diinkubasi pada suhu ruang sampai tumbuh merata pada media selama 14 hari.
Persiapan Isolat Omphalina sp. pada Serbuk Gergaji (Saputra. 2014)
5
dipindahkan kedalam plastik tahan panas, disterilisasi pada suhu 121 0C selama 15 menit didinginkan dan ditiriskan, setelah dingin disterilisasi ulang. Ditiriskan sampai airnya hilang dan dingin, setelah dingin diaduk-aduk supaya seluruh bagian mendapat udara lalu ditambahkan 18 gram isolat Omphalina sp. dari media beras, diaduk lalu diinkubasi sampai tumbuh merata selama 60 hari.
Kultur Permukaan
Box disterilisasi menggunakan alkohol 70 %, didiamkan hingga kering. Aquades steril digunakan untuk membilas. Setelah box steril, dipindahkan 1 kantung isolat Omphalina yang telah ditanam dalam serbuk gergaji kedalam box yang sudah steril. Box ditutup rapat untuk menjaga kelembaban udara di dalam box dan diinkubasi selama 7 hari.
Amobilisasi Omphalina sp. (Modifikasi Suharyanto et al. 2014)
Ijuk dipotong-potong ukuran 5-7 cm, direndam dalam air selama satu minggu dengan penggantian air setiap harinya untuk menghilangkan kotoran yang terdapat pada ijuk, kemudian ditiriskan hingga kering. Ijuk disterilisasi pada suhu 121 0C, selama 15 menit. Setelah dingin, sebanyak 5 gram ijuk digunakan untuk melapisi formula (campuran serbuk gergaji, dedak, dan biomassa jamur).
Penentuan Kemampuan Serapan Logam (Modifikasi Azizah. 2008)
Biosorpsi Cu dan Hg dilakukan di dalam sistem batch, biotray, pack bed flow dan rotary dengan variasi konsentrasi Cu (100 ppm dan 200 ppm), Hg (3 ppm dan 5 ppm) dalam 5 liter larutan logam dan variasi waktu penyerapan (1, 3, 5, 7, dan 24 jam). Perlakuan dilakukan di dalam bak berukuran 20 cm x 30 cm x 10 cm, dengan laju alir 0,173 liter/detik.
Metode Rotary.Dilakukan dengan cara merendam 40-50 % formula kedalam media. Cairan limbah logam dipompa sehingga menyebabkan rotary berputar dan cairan limbah logam melewati formula yang berisi Omphalina sp. mengakibatkan terjadi penyerapan logam. Pompa yang terendam dalam larutan digunakan untuk menyerap larutan sehingga larutan dapat memutar rotary secara terus-menerus. Perputaran dari formula menyebabkan adanya aerasi pada formula tersebut dan memperluas bidang penyerapan.
Metode Batch. Dilakukan dengan cara merendam 50% formula Omphalina
sp. pada air yang berisi larutan logam sehingga terjadi penyerapan logam secara terus-menerus dan Omphalina sp. di bagian atas masih tetap dapat hidup, namun kontak dengan air larutan logam sangat sedikit, karena hanya dibagian bawah yang terjadi kontak dengan larutan logam dan dapat menyebabkan biomassa yang terdapat pada bagian bawah lebih cepat mati.
Metode Pack bed flow. Dilakukan dengan cara mengalirkan larutan logam secara terus-menerus kedalam reaktor yang berisi formula. Larutan logam akan mengalir terus-menerus melalui permukaan atas reaktor yang telah berisi formula yang telah diamobilisasi, sehingga konsentrasi logam dalam larutan akan berkurang. Aliran air memungkinkan adanya aerasi .
6
Konsentrasi ion logam berat yang diinginkan dibuat dengan melarutkan Cu yang berasal dari CuSO4.5H2O, untuk Hg mengencerkan larutan stok HgCl2, pH diatur menjadi 4. Pengambilan sampel dilakukan setiap 1, 3, 5, 7, dan 24 jam, dan diukur menggunakan AAS untuk mengetahui kandungan logam setelah perlakuan.
Pengukuran Kadar Logam (Suharyanto et al. 2014)
Preparasi sampel dilakukan sebelum pengukuran menggunakan AAS (Atomic Absorption Spectrophotometry). Dua ml larutan sampel ditambahkan dengan 5 ml asam nitrat pekat dan 1 ml perklorat, dipanaskan dalam digester blok hingga volumenya menjadi 3 ml (larutan berwarna bening dan asap mengumpul di dalam tabung digester blok). Setelah dingin, dipindahkan kedalam labu 50 ml dan volumenya ditetapkan hingga 50 ml dengan menambahkan aquades. Cu dengan konsentrasi 200 ppm diencerkan lagi 5 kali, sedangkan Hg diencerka lagi 25 kali. Cu siap diperiksa dengan AAS pada panjang gelombang 324.7 nm. SnCl2 10 % ditambahkan pada larutan Hg yang akan diukur, larutan Hg siap diukur menggunakan AAS pada panjang gelombang 253.6 nm.
Penentuan Serapan Maksimum (Wang et al. 2006)
Hasil pengukuran menggunakan AAS diperoleh konsentrasi logam untuk dimasukkan kedalam persamaan:
q = [(C0 – C) x V] / M
q = jumlah logam yang terserap dalam biomassa (mg/g)
C0 = konsentrasi logam di dalam larutan sebelum absorpsi (ppm) C = konsentrasi logam di dalam larutan sesudah absorpsi (ppm) V = pada volume cairan (Liter)
M = jumlah biomassa (gram)
Penurunan kandungan logam dihitung dengan rumus sebagai berikut : αs = (1- Cs / Co ) x 100%
αs = presentase penurunan logam (%) Cs = konsentrasi akhir logam (ppm) Co = konsentrasi awal logam (ppm) M = massa biosorben (gram)
Serapan maksimum logam dihitung berdasarkan model persamaan Langmuir, sebagai berikut :
1 � =
1 �� �
1 �� +
1 �� �
Keterangan :
q = konsentrasi adsorbat yang terjadi (massa adsorbat/ massa biosorben)
qmax = jumlah maksimum logam yang dapat diserap biosorben (mg/g) Cf = konsentrasi akhir logam dalam larutan
B = konstanta langmuir
7
3 HASIL DAN PEMBAHASAN
Hasil Perbedaan Media Tanam
Media merupakan tempat tumbuh dan berkembang mahluk hidup, sehingga perlu dilakukan percobaan pendahuluan untuk menentukan media yang paling efektif. Pada percobaan pendahuluan digunakan dua media tanam yang berbeda, yaitu campuran serbuk gergaji dengan pepton (Gambar 1a) dan campuran serbuk gergaji dengan dedak (Gambar 1b). Warna putih menunjukkan hifa dari jamur
Omphalina sp. sehingga semakin banyak warna putih, membuktikan bahwa semakin banyak biomassa yang tumbuh dalam media tersebut.
a b
Gambar 1 Media serbuk gergaji dengan campuran yang berbeda, yaitu : a. serbuk gergaji dengan pepton, b. serbuk gergaji dengan dedak
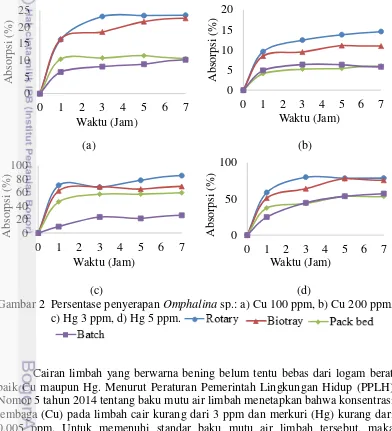
Pengaruh Waktu terhadap Biosorpsi oleh Omphalina sp.
Penentuan pengaruh waktu, seberapa lama biomassa tersebut akan mengalami kejenuhan dapat dilihat dari selisih presentase penyerapan logam pada jam ke 1, 3, 5, 7, dan 24. Presentase penyerapan dihitung dengan menganggap konsentrasi awal logam adalah 100 %. Konsentrasi ion logam yang terserap merupakan selisih dari konsentrasi sebelum dan setelah kontak dengan biomassa.
8
Biosorpsi Hg maksimal juga terjadi pada satu jam pertama, pada satu jam pertama dalam larutan Hg 3 ppm metode rotary berhasil menyerap logam sebanyak 70.63%, metode biotray 62.36 %, pack bed flow 46.11 %, dan metode batch sebesar 9.50 %. Biomassa Omphalina sp. masih dapat menyerapa logam sampai jam ke 24 tetapi jumlahnya sangat sedikit, hal itu dikarenakan biomassa sudah mulai jenuh sehingga persentase penyerapan sudah mulai konstan. Hal yang sama terjadi pada Hg dengan konsentrasi 5 ppm, penyerapan tertinggi terjadi pada satu jam pertama (Gambar 2c dan 2d).
(a) (b)
(c) (d)
Gambar 2 Persentase penyerapan Omphalina sp.: a) Cu 100 ppm, b) Cu 200 ppm, c) Hg 3 ppm, d) Hg 5 ppm.
Cairan limbah yang berwarna bening belum tentu bebas dari logam berat baik Cu maupun Hg. Menurut Peraturan Pemerintah Lingkungan Hidup (PPLH) Nomor 5 tahun 2014 tentang baku mutu air limbah menetapkan bahwa konsentrasi tembaga (Cu) pada limbah cair kurang dari 3 ppm dan merkuri (Hg) kurang dari 0.005 ppm. Untuk memenuhi standar baku mutu air limbah tersebut, maka dilakukan pengulangan perlakuan. Dua kali pengulangan perlakuan pada Hg membuat konsentrasi Hg turun menjadi 0.259 ppm, dan pada Cu dilakukan 3 kali pengulangan perlakuan konsentrasi akhir menjadi 8.51 ppm (Gambar 3). Perlu dilakukan beberapa kali pengulangan untuk memenuhi standar baku mutu air limbah. 0 5 10 15 20
0 1 2 3 4 5 6 7
Absor psi (% ) Waktu (Jam) 0 5 10 15 20 25
0 1 2 3 4 5 6 7
Absor psi (% ) Waktu (Jam) 0 20 40 60 80 100
0 1 2 3 4 5 6 7
Absor psi (% ) Waktu (Jam) 0 50 100
0 1 2 3 4 5 6 7
Absor
psi (%
)
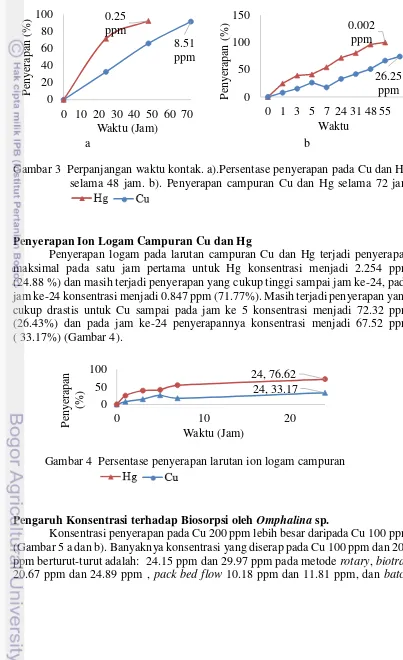
9
Setelah dilakukan pengulangan selama 48 jam konsentrasi Hg pada larutan menjadi 0.25 ppm (92.39%) dan pada larutan campuran Hg dan Cu konsentrasi Hg setelah 55 jam menjadi 0.002 ppm (99.99 %). Konsentrasi Cu menjadi 8.51 ppm (91.57 %) setelah dilakukan penyerapan selama 72 jam, dan pada larutan campuran konsentrasi Cu menjadi 26.25 ppm (74.02%) (Gambar 3 a dan b).
a b
Gambar 3 Perpanjangan waktu kontak. a).Persentase penyerapan pada Cu dan Hg selama 48 jam. b). Penyerapan campuran Cu dan Hg selama 72 jam
Penyerapan Ion Logam Campuran Cu dan Hg
Penyerapan logam pada larutan campuran Cu dan Hg terjadi penyerapan maksimal pada satu jam pertama untuk Hg konsentrasi menjadi 2.254 ppm (24.88 %) dan masih terjadi penyerapan yang cukup tinggi sampai jam ke-24, pada jam ke-24 konsentrasi menjadi 0.847 ppm (71.77%). Masih terjadi penyerapan yang cukup drastis untuk Cu sampai pada jam ke 5 konsentrasi menjadi 72.32 ppm (26.43%) dan pada jam ke-24 penyerapannya konsentrasi menjadi 67.52 ppm ( 33.17%) (Gambar 4).
Gambar 4 Persentase penyerapan larutan ion logam campuran
Pengaruh Konsentrasi terhadap Biosorpsi oleh Omphalina sp.
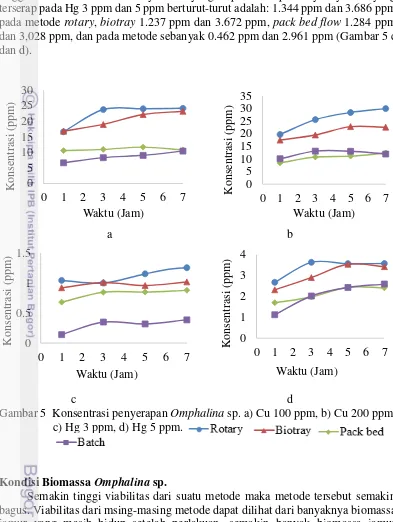
Konsentrasi penyerapan pada Cu 200 ppm lebih besar daripada Cu 100 ppm (Gambar 5 a dan b). Banyaknya konsentrasi yang diserap pada Cu 100 ppm dan 200 ppm berturut-turut adalah: 24.15 ppm dan 29.97 ppm pada metode rotary, biotray
20.67 ppm dan 24.89 ppm , pack bed flow 10.18 ppm dan 11.81 ppm, dan batch
8.51 ppm 0.25 ppm 0 20 40 60 80 100
0 10 20 30 40 50 60 70
P eny era pa n (% ) Waktu (Jam) 0.002 ppm 26.25 ppm 0 50 100 150
0 1 3 5 7 24 31 48 55
P eny era pa n (%) Waktu 24, 33.17 24, 76.62 0 50 100
0 10 20
10
sebanyak 10.41 ppm dan 11.94 ppm. Pada Hg juga terjadi hal yang sama, semakin tinggi konsentrasi semain banyak ion yang dapat diserap. Banyaknya ion yang terserap pada Hg 3 ppm dan 5 ppm berturut-turut adalah: 1.344 ppm dan 3.686 ppm pada metode rotary, biotray 1.237 ppm dan 3.672 ppm, pack bed flow 1.284 ppm dan 3,028 ppm, dan pada metode sebanyak 0.462 ppm dan 2.961 ppm (Gambar 5 c dan d).
a b
c d
Gambar 5 Konsentrasi penyerapan Omphalina sp. a) Cu 100 ppm, b) Cu 200 ppm, c) Hg 3 ppm, d) Hg 5 ppm.
Kondisi Biomassa Omphalina sp.
Semakin tinggi viabilitas dari suatu metode maka metode tersebut semakin bagus. Viabilitas dari msing-masing metode dapat dilihat dari banyaknya biomassa jamur yang masih hidup setelah perlakuan, semakin banyak biomassa jamur
Omphalina(yang ditandai dengan banyaknya hifa Omphalina yang berwarna putih) yang hidup maka viabilitas semakin tinggi. Omphalina sp. masih dapat hidup setalah dilakukan perlakuan selama 24 jam dengan menggunakan metode batch,
pack bed flow, rotary, maupun biotray. Tetapi dari keempat metode tersebut penggunaan metode rotary memungkinkan biomassa yang hidup lebih banyak dari metode yang lain (Gambar 6). Hal itu menunjukkan bahwa metode rotary memiliki viabilitas yang lebih bagus dari metode yang lain.
0 5 10 15 20 25 30
0 1 2 3 4 5 6 7
Konse ntra si (ppm) Waktu (Jam) 0 5 10 15 20 25 30 35
0 1 2 3 4 5 6 7
Konse ntra si (ppm) Waktu (Jam) 0 0.5 1 1.5
0 1 2 3 4 5 6 7
Konse ntra si (ppm) Waktu (Jam) 0 1 2 3 4
0 1 2 3 4 5 6 7
Konse
ntra
si
(ppm)
11
(a) (b)
(c) (d)
Gambar 6 Kondisi biomassa setelah terjadi proses biosorpsi pada berbagai metode. (a) batch, (b) pack bed flow, (c) rotary, (d) biotray
Penggunaan Ulang Jamur (Reuse)
Biomassa yang masih hidup setelah dilakukan perlakuan memungkinkan masih dapat digunakan kembali formula tersebut dengan larutan limbah yang baru. Baik pada Cu maupun Hg masing-masing masih dapat digunakan sebanyak dua kali perlakuan, pada perlakuan ketiga penyerapan yang terjadi sangat sedikit, yaitu 9.38 % (0.28 ppm) untuk Hg dan 1.39 % (1.46 ppm) untuk Cu (Gambar 7).
a b
Gambar 7 Persentase penyerapan reuse Omphalina sp. sebanyak tiga kali penggunaan, yaitu : reuse 1 ( R ), reuse 2 (R2), reuse 3 (R3). (a) persentase penyerapan pada Hg, (b) persentase penyerapan pada Cu.
24, 33.12
24, 22.96 5, 1.461
0 10 20 30 40
0 10 20 30
Konse
ntra
si
(ppm)
Waktu 24, 2.15
24, 2.29
3, 0.28 0
1 2 3
0 20 40
Konse
ntra
si
(ppm)
12
Penentuan Serapan Maksimum
Masing-masing biosorben memiliki kapasitas maksimum penyerapan yang berbeda-beda, tergantung dari banyaknya biomassa, dan besarnya konsentrasi larutan yang digunakan. Nilai serapan maksimum (qmax) dapat diketahui menggunakan persamaan Langmuir, dengan mula-mula menentukan persamaan linear Langmuir. Persamaan linear Langmuir diperoleh dengan membuat grafik antara 1/q pada sumbu X dan 1/cf pada sumbu Y, yang nantinya akan diperoleh nilai dari koefisien determinasi, serapan maksimum, dan konstanta Langmuir.
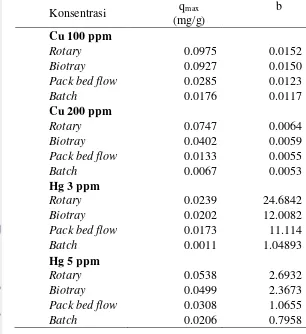
Metode rotary yang digunakan memiliki serapan maksimum tertinggi dari metode lain, pada konsentrasi Cu 100 ppm dan 200 ppm, maupun pada Hg dengan konsentrasi 3 ppm dan 5 ppm, berturut-turut nilainya adalah : 0.0975 mg/g, 0.0747 mg/g, 0.0239 mg/g, 0.0538 mg/g. lalu metode biotray berturut-turut adalah: 0.0927 mg/g, 0.0402 mg/g, 0.0202 mg/g, 0.0499 mg/g. Metode peck bed flow yaitu: 0.0285 mg/g, 0.0133 mg/g, 0.0173 mg/g, 0.0308 mg/g, dan metode yang memiliki serapan maksimum terendah adalah metode batch, yaitu sebesar: 0.0176 mg/g, 0.0067 mg/g, 0.0011 mg/g, dan 0.0206 mg/g (Tabel 1).
Tabel 1 Perhitungan qMax (serapan maksimum), b (konstanta)
Konsentrasi qmax
(mg/g)
b
Cu 100 ppm
Rotary 0.0975 0.0152
Biotray 0.0927 0.0150
Pack bed flow 0.0285 0.0123
Batch 0.0176 0.0117
Cu 200 ppm
Rotary 0.0747 0.0064
Biotray 0.0402 0.0059
Pack bed flow 0.0133 0.0055
Batch 0.0067 0.0053
Hg 3 ppm
Rotary 0.0239 24.6842
Biotray 0.0202 12.0082
Pack bed flow 0.0173 11.114
Batch 0.0011 1.04893
Hg 5 ppm
Rotary 0.0538 2.6932
Biotray 0.0499 2.3673
Pack bed flow 0.0308 1.0655
13
Nilai serapan maksimum setelah 24 jam pada konsentrasi Cu 100 ppm tidak ada perbedaan yang nyata antara rotary dengan biotray, dan antara pack bed flow
dengan batch (Tabel 2). Pada konsentrasi Cu 200 ppm terdapat perbedaan yang nyata antara metode rotary, dan biotray, tetapi tidak berbeda nyata dengan metode
pack bed flow dan batch. Terdapat perbedaan yang nyata untuk semua metode pada Hg dengan konsentrasi awal 3 ppm dan 5 ppm.
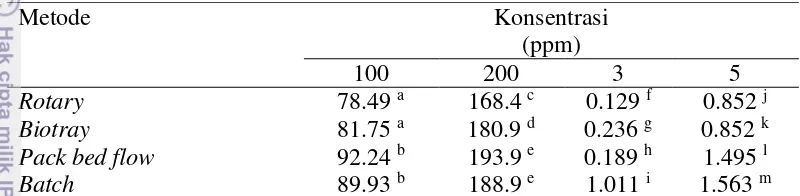
Tabel 2 Optimasi metode
Metode Konsentrasi
(ppm)
100 200 3 5
Rotary 78.49 a 168.4 c 0.129 f 0.852 j
Biotray 81.75 a 180.9 d 0.236 g 0.852 k
Pack bed flow 92.24 b 193.9 e 0.189 h 1.495 l
Batch 89.93 b 188.9 e 1.011 i 1.563 m
Keterangan: Huruf superscrift (a,b,c,d,e,f,g,h,i,j,k,l,m) pada tabel menunjukkan hasil yang berbeda
nyata (p<0.05)
.
Pembahasan Perbedaan Media Tanam
Perbedaan penggunaan media tanam menyebabkan perbedaan banyaknya biomassa dalam media tersebut. Media dengan tambahan dedak menghasilkan lebih banyak biomassa jamur dari pada media dengan tambahan pepton. Untuk memenuhi kebutuhan metabolismenya, jamur membutuhkan media tumbuh dengan sedikit nitrogen, karbohidrat lebih tinggi, dan pada pH optimum (Suprihatin. 2009). Pepton merupakan hasil dari reaksi hidrolisis protein oleh enzim protease dan digunakan sebagai sumber nitrogen pada media tanam mikroba (Sinuhaji. 2012), sedangkan dedak selain mengandung karbohidrat juga terdapat kandungan serat yang cukup tinggi (Murni et al. 2008). Omphalina merupakan jamur pelapuk putih dan tumbuh dengan cepat pada media dengan kandungan lignoselulosa tinggai (Suharyanto et al. 2014). Sehingga penggunaan dedak yang banyak mengandung lignin lebih membantu pertumbuhan Omphalina.
Pengaruh Waktu terhadap Biosorpsi oleh Omphalina sp.
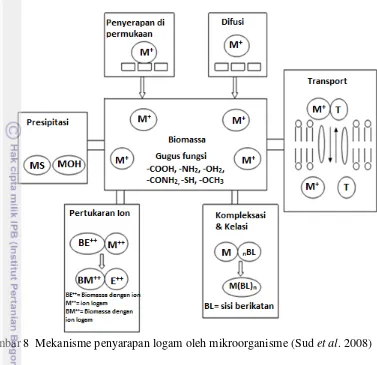
Mekanisme biosorpsi logam oleh mikroorganisme, merupakan proses yang kompleks dan melibatakan banyak proses yang berbeda, seperti: kompleksasi, pertukaran ion, kelasi, adsorpsi, difusi (Sud et al. 2008). Proses biosorpsi terjadi pada dua tahap, tahap petama merupakan penyerapan pasif, tidak tergantung pada proses metabolisme dan penyerapan cepat oleh benyak mekanisme pengikatan seperti : kompleksasi, pertukaran ion, adsorpsi fisik. Ion logam akan berikatan dengan permukaan, agen pengkelat. Pada tahap kedua terjadi penyerapan secara aktif, ion logam menembus membran sel dan masuk kedalam sel (Das et al. 2008). Proses biosorpsi dapat terjadi melalui proses pertukaran ion dan dapat juga melalui proses pembentukan ikatan kompleks antara gugus fungsi pada dinding sel
14
Gambar 8 Mekanisme penyarapan logam oleh mikroorganisme (Sud et al. 2008)
Serapan maksimum logam oleh jamur terjadi pada satu jam pertama, dan diikuti penyerapan dengan periode yang lebih lama sampai jamur benar-benar jenuh oleh ion-ion logam. Hal itu dikarenakan, serapan logam terjadi pada dua tahap, yaitu tahap penyerapan logam yang sangat cepat dan diikuti penyerapan logam yang lambat dengan periode yang lebih lama sampai terjadi keseimbangan (Mitic-stojanovic et al. 2011). Sesuai dengan pendapat Javaid et al. 2011, bahwa serapan cepat oleh permukaan jamur, lalu dilanjutkan penyerapan lambat karena transportasi ion logam ke dalam sitoplasma sel atau lambatnya difusi intraseluler. Hasil tersebut juga sesuai dengan penelitian yang dilakukan Akar et al. 2006, menggunakan Aspergillus flavus untuk biosorpsi Cu memiliki waktu optimum 15-120 menit, dan Javaid et al. 2001 menggunakan Pleurotus ostreatus untuk menyerap Cu terjadi penurunan konsentrasi logam yang sangat tajam pada 15-120 menit pertama.
Gambar 9 Proses pengikatan kitin dengan logam. Logam (M) ( Bellion et al. 2005)
15
Penyerapan awal yang cepat terjadi karena adanya ikatan ion logam yang dipengaruhi kelompok-kelompok fungsional yang berada di permukaan jamur, mula-mula dengan cepat ion logam akan berikatan dengan sisi negatif dari dinding sel jamur (Say et al. 2007). Kualitas dan kuantitas penyerapan logam oleh permukaan biomassa sangat ditentukan oleh gugus fungsional yang terdapat dalam permukaan dinding sel jamur. Dinding sel jamur pada umumya terdiri dari kitin, glukan, kitosan, selulosa (Feofilova. 2010) (Gambar 10), dengan gugus-gugus seperti karbonil, amino, tiol, hidroksil, dan fosfat, dengan sisi aktif bermuatan negatif sehingga mudah mengikat ion logam yang bermuatan positif (Suharyanto et al. 2014). Proses pengikatan kitin dengan logam dapat dilihat pada Gambar 9.
Ganbar 10 Polisakarida dinding sel jamur yang berperan dalam biosorpsi (Siegel et al. 1990)
Pertukaran ion juga merupakan salah satu cara yang digunakan oleh jamur untuk dapat menyerap logam, sehingga terjadi penyerapan yang cepat pada periode pertama. Proses ini terjadi karena adanya pertukaran ion-ion mono ataupun divalen pada dinding sel jamur seperti Na, Mg, dan Ca, digantikan oleh ion-ion logam berat (Suharyanto et al. 2014). Mekanisme pertukaran ion dapat dilihat pada Gambar 11.
Selulosa
Glikan
Kitosan
Poliuronidin
Kitin
Glikan
(6-56 termasuk
16
Gambar 11 Mekanisme pertukaran ion pada jamur. Ion logam (Me). (Mitic-stojanovic et al. 2011)
[image:30.595.70.470.59.842.2]Penyerapan yang cepat pada permukaan dinding sel, lalu dilanjutkan dengan penyerapan yang mulai melambat dengan difusi intraselluler. Pada awalnya penyerapan cepat oleh dinding sel terjadi pada 30 menit-1 jam pertama, lalu dilanjutkan dengan difusi intraselluler lambat (2-3 jam) dan lama-kelamaan akan mencapai keseimbangan (Baldrian. 2003). Proses difusi intraselluler yang terjadi cukup lama mengakibatkan perpindahan ion-ion logam dari dinding sel kedalam sitoplasma terjadi cukup lambat. Hal itu menyebabkan ion-ion logam akan memenuhi dinding sel jamur dalam waktu yang cukup lama, sehingga penyerapan mulai melambat sampai jamur telah benar-benar jenuh oleh logam (Gambar 12).
17
Perpanjangan waktu kontak dengan penggantian biomassa jamur setiap 24 jam dapat mengurangi konsentrasi ion logam berat secara konsisten baik dalam larutan tunggal ataupun larutan campuran. Hal itu memungkinkan serapan yang tinggi tiap awal pergantian. Salah satu faktor yang mempengaruhi biosorpsi adalah banyaknyan biomassa (Das et al. 2008; Tukey et al. 2006). Penggantian biomassa tiap 24 jam menyebabkan jumlah biomassa yang digunakan lebih banyak sehingga konsentrasi logam dalam larutan akan semakin berkurang. Bertambahnya waktu interaksi sebanding dengan meningkatnya proses absorbsi (Buhani et al. 2006; Akar dan Tunali. 2005).
Penyerapan Ion Logam Campuran Cu dan Hg
Terjadi serapan yang cukup tinggi sampai jam ke-5, baik pada Cu maupun Hg pada larutan logam campuran. Pada larutan yang terdiri lebih dari satu ion logam menyebabkan persaingan dalam pengikat sisi aktif yang terdapat pada dinding sel jamur (Manzoo et al. 2012). Penyerapan pada logam campuran dipengaruhi oleh beberapa faktor, yaitu: efek gabungan dari dua atau lebih ion logam, dan juga banyaknya jenis ion logam yang bersaing untuk mengikat sisi aktif dari jamur, serta konsentrasi masing-masing jenis ion logam dalam larutan (Sheng et al. 2007).
Persentase penyerapan Cu pada larutan campuran tidak sebanyak serapan Cu pada larutan logam tunggal. Satu jam pertama pada larutan tunggal terjadi penurunan sampai 16.25 % namun pada larutan dengan campuran Cu dan Hg pada 1 jam pertama penyerapannya hanya 7.95 %. Hal itu dikarenakan, ketika terdapat dua macam logam dalam satu larutan maka kedua logam tersebut akan berkompetisi untuk dapat berikatan dengan sisi aktif dari dinding sel jamur (Manzoo et al. 2012). Persentase penyerapan Hg pada larutan campuran Cu dan Hg lebih kecil dari pada persentase penyerapan Hg pada larutan tunggal Hg. Namun, persentase penyerapan Hg lebih tinggi dari pada persentase penyerapan Cu. Hal itu dikarenakan konsentrasi awal untuk Hg dan Cu tidak sama. Konsentrasi awal untuk Cu adalah 100 ppm, sedangkan untuk Hg adalah 3 ppm. Konsentrasi Hg yang lebih sedikit mengakibatkan jumlah ion Hg pada larutan campuran lebih sedikit dari pada jumlah ion Cu, sehingga persentase penyerapan Hg lebih tinggi dari pada Cu. Adanya ion logam lain dalam suatu sistem penyerapan akan menurunkan kapasitas serapan untuk logam lainnya (Tsekova et al. 2007; Sheng et al. 2007).
Pengaruh Konsentrasi terhadap Biosorpsi oleh Omphalina sp.
Semakin besar konsentrasi logam maka semakin besar pula massa ion logam yang terserap. Hal ini sesuai dengan teori bahwa semakin besar konsentrasi larutan, maka semakin banyak jumlah zat terlarut yang dapat diserap hingga mencapai keseimbangan tertentu (Handayani dan Sulistiyono. 2009). Biosorpsi merupakan perpindahan massa ion logam dari fase cair ke fase padat. Konsentrasi awal ion logam memiliki peran yang peting sebagai pendorong untuk mengatasi hambatan perpindahan massa dari fase cair ke fase padat (Dang et al. 2009), sehingga semakin tinggi konsentrasi maka semakin banyak massa yang dapat diserap.
Keempat metode dapat digunakan dalam biosorpsi Cu dan Hg oleh
18
lancar sehingga Omphalina masih dapat hidup dan diharapkan biomassa bertambah banyak. Semakin banyak biomassa maka serapan logam semakin banyak (Victor et al. 2012).
Kondisi Biomassa Omphalina sp.
Metode rotary memungkinkan biomassa yang hidup lebih banyak dari pada metode biotray, pack bed flow, ataupun batch. Hal itu dikarenakan dengan penggunaan metode rotary memungkinkan terjadinya aerasi yang merata pada seluruh permukaan jamur sehingga seluruh jamur mendapatkan oksigen yang cukup untuk bertahan hidup. Tetapi, pada metode pack bed flow dan biotray aerasi yang terjadi tidak merata pada seluruh tubuh jamur, sehingga jumlah biomassa tidak sebanyak pada metode rotary. Sedangkan pada metode batch tidak terjadi aerasi sehingga jamur yang terrendam terus-menerus lama-kelamaan akan membusuk. Jamur merupakan organisme aerob (Suharyanto et al. 2014), sehingga aktivitas biologisnya juga dipengaruhi oleh adanya oksigen dalam lingkungan. Omphalina
dapat tumbuh pada kondisi-kondisi optimum misalnya, pada pH rendah (berkisar antara 4-9), media yang tinggi karbohidrat dan selulosa, pada suhu optimum 39 ◦C, dan kelembaban udara yang cukup (Suprihatin 2009, Soeprijanto et al).
Selain faktor lingkungan, kemampuan tumbuh jamur untuk bertahan hidup juga memiliki peranan yang penting. Omphalina mampu bertahan hidup pada lingkungan yang tercemar oleh limbah, pada konsentrasi Cu 300 ppm dan Hg 5 ppm (Suharyanto et a.l 2014). Hal itu menandakan pada konsentrasi Cu 300 ppm dan Hg 5 ppm, logam berat belum mempengaruhi metabolisme dari Omphalina tersebut (Yulianto et al. 2006).
Jamur memiliki mekanisme pertahanan terhadap logam, salah satunya menggunakan senyawa pengkelat baik ekstraseluler maupun intraseluler. Secara intraseluler, kelasi logam berat dilakukan oleh molekul peptida yang terdiri dari senyawa phytochelatins atau metallothioneins. Kelasi secara ekstraseluler pada jamur pelapuk putih adalah dengan produksi asam oksalat. Produksi asam oksalat oleh jamur dapat mengamobilisasi ion logam larut, atau sebagai larutan oksalat tembaga, sehingga meningkatkan toleransi terhadap toksisitas logam (Baldrian P. 2003). Terdapat juga ligan dari hasil metabolisme yang dapat digunakan sebagai pengikatan logam seperti: D-glukosamin, L-lisin, L-asparagin, sitrat dan asam ketoglutarik yang aktif terhadap logam Cu, Zn, Cd, Hg (Seagel et al. 1990). Selain itu melanin juga memiliki peranan dalam pertahanan terhadap logam berat. Melanin digunakan sebagai akumulasi logam berat pada miselium. Menurut Rizzo et al. 1992, melanin yang dihasilkan dapat meningkat seiring dengan meningkatnya logam yang diserap.
Penggunaan Ulang Jamur (Reuse)
Biosorben harus dapat digunakan berkali-kali untuk mengurangi biaya (Say
19
biomassa yang sudah matipun dapat digunakan untuk meyerap ion-ion logam dalam larutan (Javaid et al. 2011).
Jamur yang digunakan pada penelitian kali ini hanya dapat digunakan sebanyak tiga kali siklus. Hasil ini tidak sebanyak yang dilakukan oleh Khumar et al. 2011, menggunakan Trichoderma viride yang dapat digunakan sebanyak lima kali siklus. Dikarenakan, sebelum digunakan Trichoderma viride dicuci terlebih dahulu dengan 0.1 N HCl untuk menghilangkan ion-ion logam yang terdapat di dalam biomassa Trichoderma viride, sehingga biomassa yang digunakan tidak memiliki kandungan logam yang tinggi. Hal itu membuktikan bahwa, penggunaan
Omphalina sp. lebih efektif dan efisien, karena dapat digunakan berulang tanpa dilakukan pretreatmen menggunakan HCl terlebih dahulu, dan dapat digunakan modifikasi pada sistem kontinyu dengan gabungan beberapa metode, sehingga penyerapan logam lebih maksimal
Penentuan Serapan Maksimum
Serapan maksimum merupakan banyaknya ion logam yang terserap (mg) tiap satuan berat biomassa jamur (g). Metode rotary memiliki nilai serapan maksimum paling tinggi pada berbagai konsentrasi dan berbagai jenis ion logam, lalu diikuti oleh metode biotray, pack bed flow, dan batch (Tabel 1). Hal itu dikarenakan pada metode rotary memiliki sistem aerasi yang baik dan luas permukaan biosorben yang berinteraksi dengan ion logam lebih banyak dari pada metode biotray, pack bed flow, ataupun batch (Handayani dan Sulistiyono. 2009).
Serapan maksimum tertinggi adalah pada Cu 100 ppm yaitu sebesar 0.0975 mg/g dan pada Cu 200 ppm sebesar 0.0747 mg/g. Hasil ini jauh berbeda dengan Suprijanto et al. 2007 yang menggunakan Phanerochaete chrysosporium sebagai biosorben Cu dengan konsentrasi awal 200 ppm, dan mendapatkan serapan maksimum sebesar 3.99 mg/g. Hal itu dikarenakan Phanerochaete chrysosporium
yang digunakan merupakan biomassa murni yang dalam pembuatannya memerlukan waktu dan biaya yang cukup mahal. Selain itu sebelum digunakan biomassa tersebut diberi perlakuan dengan NaOH 0.5 N selama 5 menit untuk menghilangkan kotoran-kotoran yang ada dipermukaan. Namun meskipun
Omphalina sp. memiliki serapan maksimum yang jauh lebih kecil dari
Phanerochaete chrysosporium, tetapi besarnya konsentrasi penurunan Cu tidak jauh berbeda. Omphalina sp. mampu menurunkan konsentrasi menjadi 168.43 ppm dan pada Phanerochaete chrysosporiumi menjadi 170 ppm.
Konsentrasi akhir yang jauh berbeda dengan metode-metode yang lain, membuat metode rotary berbeda nyata dengan metode-metode yang lain. Tetapi pada konsentrasi Cu 100 ppm penggunaan metode rotary tidak berbeda nyata dengan metode biotray, hal itu dikarenakan konsentrasi ion logam yang terserap pada kedua metode tidak jauh berbeda.
20
4 SIMPULAN DAN SARAN
Simpulan
Omphalina sp. dapat digunakan sebagai biosorben untuk menyerap Cu dan Hg pada metode rotary, biotray, pack bed flow, maupun batch. Pada semua metode dan semua konsentrasi, terjadi serapan maksimum disatu jam pertama. Penyerapan loga pada larutan campuran dapat menurunkan konsentrasi ion logam yang terserap oleh biomassa. Biosorpsi logam dengan menggunakan metode rotary memiliki nilai serapan maksimum lebih tinggi dari metode lain, pada konsentrasi Cu 100 ppm dan 200 ppm, maupun pada Hg dengan konsentrasi 3 ppm dan 5 ppm, berturut-turut nilainya adalah : 0.0975 mg/g, 0.0747 mg/g, 0.0239 mg/g, 0.0538 mg/g. Pada metode rotary biomassa yang masih hidup setelah perlakuan 24 jam lebih banyak dari metode yang lain dan dapat dilakukan penggunaan ulang biomassa sebanyak dua kali penggunaan, dan hasil analisis statistik menunjukkan adanya perbedaan yang nyata antara metode rotary dengan metode yang lain. Sehingga dapat disimpulkan bahwa, metode rotary lebih baik dari metode yang lain pada proses biosorpsi logam berat dalam larutan.
Saran
Perlu dilakukan penelitian lebih lanjut tengtang biosorbsi logam berat oleh
21
DAFTAR PUSTAKA
Abbas SH, Ismail IM, Mostafa TM, Sulaymon AH. 2014. Biosorption of heavy metals [Review]. Journal of Chemical Science and Technology. 3(4): 74-102. Akar T, Tunali S. 2005. Biosorption characteristics of Aspergillus flavus biomass
for removal of Pb(II) and Cu (II) ions from an aqueous solution. Bioresource Technology. 97:1780-1787. Doi: 10.1016/j.biortech.2005.09.009.
Andaka G. 2008. Penurunan kadar tembaga pada limbah cair industry kerajinan perak dengan presipitasi menggunakan natrium hidroksida. J. teknologi.1(2):127-134.
Azizah RN. 2008. Deodorisasi limbah lateks pekat dan dekolorisasi pewarna tekstil secara enzimatis dengan formula Omphalina sp. [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Baldrian P. 2003. Interaction of heavy metals with white-rot fungi. Enzyme and Microbial Technology. 32: 78-79. Doi: 10.1016/S0141-0229902000245-4. Bellion M, Courbot M, Jacob C, Blaudez D, Chalot M. 2005. Extracellular and
cellular mechanisms sustaining metal tolerance in ectomycorrhizal fungi [Review]. FEMS Microbial Lett. 254:173-181. Doi: 10.1111/j.1574-6968.2005.00044.x.
Buhani, Suharso, Sembiring Z. 2006. Biosorption of metal ions Pb (II), Cu (II), and Cd (II) on Sargassum duplicatum immobilized silica gel matrix. Indo. J. Chem. 6(3):245-250.
Chen B, Wang Y, Hu D. 2010. Biosorption and biodegradation of polycyclic aromatic hydrocarbons in aqueous solution by a consortium of white-rot fungi. Journal of Hazardous Materials. 179: 845-851. Doi: 10.1016/j.jhazmat.2010.03.082.
Das N, Vimala R, Karthika P. 2008. Biosorption of heavy metals. Indian J Biotechnology. 7 : 159-169
Driessel BV, Cristov L. 2001. Decolorization of bleach plant effluent by Mucoraleanand white-rot fungi in a rotating biological contactor reactor. J. Biosci.Bioeng (92):271-276
Feofilova EP. 2010. The fungal cell wall: modern concepts of its composition and biological function [Review]. Mikrobiologiya. 79(6): 723-733. Doi: 10.1134/S0026261710060019.
Ganeva S, Denheva V, Todorova D, Tsekova K. 2009. Biosorption of copper (II) and cadmium (II) from aqueous solutions by free and immobilized biomass of
Aspergillus niger. Bioresource Technology. 101(2010):1727-1731.doi:10.1016/j.biotech.2009.10.012.
Handayani M, Sulistiyono E. 2009. Uji persamaan Langmuir dan freundlich pada penyerapan limbah chrom (VI) oleh zeolite. Bandung (ID): Prosiding Seminar Nasional sains dan Teknologi Nuklir.
Herman DZ. 2006.Tinjauan terhadap tailing mengandung unsur pencemaran Arsen (As), Merkuri (Hg), Timbal (Pb), dan Kadmium (Cd) dari sisa pengolahan bijih logam.J Geologi Indonesia. 1(1):31-36.
22
Hidayati N, Syarif F, Juhaeti T. 2006. Potensi Cebtrocema pubescence,
Calopogonium mucunoides, dan Micana cordata dalam membersihkan logam kontaminan pada limbah penambangan emas. Biodiversitas. 7(1): 4-6. Doi: 10.13057/biodiv/d070102. ISSN: 1412-033x.
Ihsan F dan Octariana L. 2009. Teknik pengujian efektivitas jamur entomopatogen
Beauveria bassiana pada media pembawa substrat beras dan jagung untuk mengendalikan lalat buah semilapang. Buletin Teknik Pertanian. 14(2):62-64. Javaid A, Bajwa R, Shafique U, Anwar J. 2011. Removal of heavy metals by adsorption on pleurotus ostreatus. Biomass and Bioenergy. 35:1675-1682. Doi: 10.1016/jbiombioe.2010.12.035.
Kumar R, Bhatia D, singh R, Rani S, Bishnoi NR. 2011. Sorption of heavy metals from electroplating effluent using immobilized biomass Trihcoderma viride
in a continuous packed-bed column. International Biodeterioration dan Biodegradation. 65(8): 1133-1139. Doi: 10.1016/j.ibiod.2011.09.003. Lestari T.2010. Faktor-faktor yang berhubungan dengan keracunan Merkuri (Hg)
pada penambangan emas tanpa ijin (PETI) di kecamatan kurun, kabupaten Gunung Mas, Kalimantan Tengah [Tesis]. Semarang (ID): Universitas Diponegoro.
Manzoor MT, Shoaib A, Bajwa R. 2012. Mycoremediation of Cu (II) and Ni (II).
African Journal of Microbiology Research. 6(2):236-244. Doi: 10.5897/AJMR11.948. ISSN 1996-0808.
McIntyre M, Berry DR, McNeil B. 2000. Role of proteases in autolysis of Penicillium chrysogenum chemostat cultures in response to nutrient depletion.
Appl Microbiol Biotechnol 53:235–242.
Mitic-stojanovic D, zarubica A, Purenovic M, Bojic D, Andjelkovic T, Bojic ALj. 2011. Biosorptive removal of Pb2+, Cd2+, and Zn2+ ions from water by
Lagenaria vulgaris shell. AJOL. 37(30): 303-312. ISSN 0378-4738. Doi.org/10.4314/wsa.v37i3.68481.
Murni R, Suparjo, Akmal. Ginting BL. 2008. Buku Ajar Teknologi Pemanfaatan Limbah Untuk Pakan. Jambi: Universitas Jambi.
Nur A. 2007. Immobilisasi limbah fermentasi pabrik alkohol terhadap adsorpsi logam berat cadmium. Ekuilibrium 6(1):27-31.
Said NI. 2010. Metode penghilangan logam merkuri di dalam air limbah industri.
JAI. 6(1):11-23.
Saputra K. 2014. Produksi jamur tiram putih (Pleurotus ostreatus) pada media serbuk gergaji dengan penambahan beberapa konsentrasi ampas sagu (Metroxylon sp) [Skripsi]. Riau (ID): UIN SUSKA RIAU.
Say R, Lmaz NY, Denizli A. 2007. Biosorption of cadmium, lead, mercury, and arsenic ions by the fungus Penicillium purpurogenum. Separation Science and Technology. 38(9): 2039-2058. Doi: 10.1081/ss-120020133.
Sheng PX, Ting YP, Chen JP. 2007. Biosorption of heavy metal ions (Pb, Cu, and Cd) from aqueous solution by the marine alga Sargassum sp. in single- and multiple metal systems. Ind. Eng. Chem. Res. 46:2438-2444. Doi: 10.1021/ie0615786.
Siegel SM, Galun M, Siegel BZ. 1990. Filamentous fungi as metal biosorbents.
Water, Air, and Soil Pollution (53) : 335-334.
23
Sud D, Mahajan G, Kaur MP. 2008. Agricultural waste material as potential adsorbent for sequestering heavy metal ions from aqueous solution [review].
Bioresource Technology. 99:6017-6027. 10.1016/j.biortech.2007.11.064. Suharyanto, Tri P, Richana N, Zainudin A. 2014. Amobilisasi jamur pelapuk putih
dengan tandan kosong kelapa sawit untuk bio-konsentrasi tembaga dan merkuri terlarut dalam limbah tailing pertambangan [Laporan Hasil Kegiatan]. Bogor (ID): PPBBI.
Suprihatin EA. 2009. Biosorpsi logam Cu (II) dan Cr (VI) pada limbah electroplating dengan menggunakan biomassa Phanerochaete crysoporium. Jurnal Teknik Kimia. 4(1): 1-8.
Soeprijanto, Aryanto B, Fabella R. 2007. Biosorpsi ion logam berat Cu (II) dalam larutan menggunakan biomassa Phanerochaete chrysoporium [Artikel Ilmiah]. Surabaya (ID): ITS.
Trisnawaty FN, Emiyarti, Afu LOA. 2013. Hubungan kadar logam berta merkuri (Hg) pada sedimen dengan struktur komunitas makrozoobenthos di perairan sungai Tahi Ite kecamatan Rarowatu kabupaten Bombana. Mina Laut Indonesia. 03(12): 68-80
Trivedi BD, Patel KC. 2007. Biosorption of hexavalent chromium from aqueous solution by a tropical basidiomycete BDT -14 (DSM 15396). Microbiology and Biotechnology 23(5):683-689.
Tsekova K, ianis M, Dencheva V, Ganeva S. 2009. Biosorption of binary mixtures of cooper and cobalt by Penicillium brevicompactum. Z Naturforsch C. 62:261-264.
Victor M, Juan F, Maria ET, Ismail AR. 2012. Biosorption of mercury (II) from aqueous solutionsonto fungal biomass. Bioinorganic Chemistry and Applications. 1-5. Doi: 10.1155/2012/156190.
Vieira RHSF, Volesky B. 2000. Biosorption : a solution to pollution . Internatl Microbiol. 3:17:24.
Varshney R, Bhadauria S, Gaur MS. 2011. Biosorption of copper (II) from electroplating wastewasters by Aspergillus terreus and its kinetics studies. Water 2:142-151.
Wang J, Chen C. 2006. Biosorption of heavy metals by Saccharomyces cerevisiae
[review]. Biotechnology advances.24:427-451.
Widaningrum, Miskiyah, Suismono. 2007. Bahaya kontaminasi logam berat dalam sayuran dan alternative pencegahan cemaran. Buletin Teknologi Pascapanen Pertanian. 3:16-27.
Widiastuti H, Suharyanto, Wulaningtyas A, Sutamihardja. 2008. Activity of ligninolytic enzymes during growth and fruiting body development of white rot fungi Omphalina sp and Pleurotus ostreatus. Hayati Journal of Biosciences 15(4):140-144 ISSN:1978-3019.
24
Lampiran 1 Bagan Alir Penelitian
Inokulasi pada PDA
Inokulasi pada media beras
Inokulasi pada media serbuk gergaji
Kultur permukaan
Pembuatan formula Pembuatan larutan limbah
Batch Pack bed flow
Biotray Rotary
Pengukuran AAS
Ion logam campuran
25
Lampiran 2 Kurva Standar AAS
y = 0.0239x + 0.0741 R² = 0.9987
0 0.2 0.4 0.6 0.8 1 1.2 1.4
0 10 20 30 40 50 60
K
o
n
sen
tr
asi
(
p
p
m
)
Absorbansi
Series1
26
Lampiran 3 Perhitungan Langmuir
Metode Waktu
(Jam)
Konsentrasi (ppm)
q 1/Cf 1/q Penyerapan
(%)
r2
Hg 3 ppm
Rotary 0 1.473135 0 0.8278
1 0.43266 0.026012 2.311284 38.44398 70.629983
3 0.4756095 0.024938 2.102565 40.09923 67.71446609
5 0.3229569 0.028754 3.096389 34.77722 78.07690062
7 0.2204472 0.031317 4.536234 31.93134 85.03550591
24 0.1288069 0.033608 7.763562 29.75464 91.25627658
Biotray 0 0 0.9373
1 0.554549 0.022965 1.803267 43.54519 62.35586352
3 0.4647745 0.025209 2.151581 39.66835 68.44997234
5 0.516384 0.023919 1.936544 41.80816 64.94659688
7 0.4559561 0.025429 2.193194 39.32445 69.04859025
24 0.236071 0.030927 4.236015 32.33462 83.97492762
Pack Bed Flow
0
1.473135 0
0.7936
1 0.7927911 0.017009 1.261366 58.79379 46.18340817
3 0.6271203 0.02115 1.594591 47.2805 57.42954651
5 0.6256747 0.021187 1.598275 47.19985 57.52767737
7 0.5960673 0.021927 1.677663 45.60651 59.53749656
24 0.1894757 0.032091 5.277723 31.16092 87.13793033
Batch 0 1.473135 0 0.8626
1 1.3336064 0.003488 0.749846 286.6796 9.471541984
3 1.1234098 0.008743 0.890147 114.3755 23.74020032
5 1.1550694 0.007952 0.865749 125.7602 21.59106939
7 1.0875579 0.009639 0.919491 103.7406 26.17391821
24 1.0112279 0.011548 0.988897 86.59749 31.35538494
Hg 5 ppm
Rotary 0 4.538551 0 0.9772
1 1.871627 0.066673 0.534295 14.99855 58.76157831
3 0.910033 0.090713 1.098861 11.02378 79.94882508
5 0.974605 0.089099 1.026057 11.22351 78.52608685
7 0.966895 0.089291 1.034239 11.19929 78.69595935
24 0.852207 0.092159 1.173424 10.85086 81.22292666
Biotray 0 4.523516 0 0.8803
1 2.212799 0.057768 0.451916 17.31064 51.08232623
3 1.624904 0.072465 0.615421 13.79971 64.07874649
5 0.989591 0.088348 1.010518 11.31886 78.12340224
7 1.103267 0.085506 0.906399 11.69506 75.61040682
27
Metode Waktu
(Jam)
Konsentrasi (ppm)
q 1/Cf 1/q Penyerapan
(%)
r2
Hg 5 ppm
Pack BF 0 4.523516 0 0.8567
1 2.830089 0.0423 0.353346 23.62074 37.43608622
3 2.555416 0.0492 0.391326 20.32417 43.50818368
5 2.091606 0.0608 0.478102 16.44797 53.76150654
7 2.117145 0.0602 0.472334 16.62254 53.19690811
24 1.495037 0.0757 0.66888 13.20795 66.94967808
Batch 0 4.523516 0 0.773
1 3.405937 0.0279 0.293605 35.79165 24.70598534
3 2.507469 0.0504 0.398808 19.84081 44.56813682
5 2.101484 0.0605 0.475854 16.51506 53.54312442
7 1.937165 0.0647 0.516218 15.4658 57.17569033
24 1.562605 0.0740 0.639957 13.50936 65.4559639
Cu 100
ppm
Rotary 0 102.411 0 0.99
1 85.76625 0.4161 0.01166 2.40316 16.25289276
3 78.6486 0.594 0.012715 1.683332 23.20297624
5 78.3894 0.601 0.012757 1.665168 23.45607405
7 78.26185 0.6037 0.012778 1.656373 23.58062122
24 78.48905 0.5981 0.012741 1.672104 23.35877005
Biotray 0 102.411 0 0.99
1 85.59765 0.4203 0.011683 2.379062 16.41752351
3 83.42305 0.4747 0.011987 2.106599 18.54092822
5 80.2547 0.5539 0.01246 1.805356 21.63468768
7 79.2043 0.5802 0.012626 1.72364 22.66035875
24 81.745 0.517 0.012233 1.935546 20.17947291
Pack bed flow
0
102.411 0
0.99
1 91.8236 0.2647 0.01089 3.778076 10.33814727
3 91.44835 0.2741 0.010935 3.648753 10.70456299
5 90.72075 0.2923 0.011023 3.421655 11.41503354
7 91.6277 0.2696 0.010914 3.70944 10.52943531
24 92.23485 0.2544 0.010842 3.93076 9.936579078
Batch 0 102.411 0 0.99
1 95.76075 0.1663 0.010443 6.014811 6.493687202
3 94.0909 0.208 0.010628 4.807635 8.124224937
5 93.34965 0.2265 0.010712 4.414353 8.848024138
7 91.99835 0.2603 0.01087 3.841481 10.1675113
28
Metode Waktu
(Jam)
Konsentrasi (ppm)
q 1/Cf 1/q Penyerapan
(%)
r2
Cu 200 ppm
Rotary 0 205.7713 0 0.92
1 186.079 0.492308 0.005374 2.031251 9.569993483
3 180.1735 0.639945 0.00555 1.562634 12.43992724
5 177.3675 0.710095 0.005638 1.408262 13.80357708
7 175.8145 0.74892 0.005688 1.335256 14.55829846
24 168.4315 0.933495 0.005937 1.071243 18.14626238
Biotray 0 205.7713 0 0.99
1 188.311 0.436508 0.00531 2.290911 8.485294111
3 186.287 0.487108 0.005368 2.052935 9.468910387
5 182.963 0.570208 0.005466 1.753748 11.08429601
7 183.1895 0.564545 0.005459 1.771338 10.97422235
24 180.88 0.622283 0.005529 1.606987 12.0965849
Pack BF 0 205.7713 0 0.94
1 197.34 0.210783 0.005067 4.744227 4.097413002
3 195.017 0.268858 0.005128 3.719442 5.226336229
5 194.6595 0.277795 0.005137 3.599777 5.400072799
7 193.4275 0.308595 0.00517 3.240493 5.99879575
24 193.9645 0.29517 0.005156 3.387878 5.737826412
Batch 0 205.7713 0 0.98
1 195.7045 0.25167 0.00511 3.973457 4.892227439
3 192.6725 0.32747 0.00519 3.053715 6.365707949
5 192.736 0.325883 0.005188 3.068591 6.334848446
7 193.833 0.298458 0.005159 3.350561 5.801732312
29
Lampiran 4 Grafik Linear Langmuir
y = -1.6891x + 41.694 R² = 0.8278
0 5 10 15 20 25 30 35 40 45
0 2 4 6 8 10
1
/q
1/Cf
Rotary Hg 3 ppm
Rotary
Linear (Rotary)
y = -4.1215x + 49.492 R² = 0.9373
0 10 20 30 40 50
0 1 2 3 4 5
1
/q
1/Cf
Biotray Hg 3 ppm
Biotray
Linear (Biotray)
y = -5.2092x + 57.895 R² = 0.7936
0 10 20 30 40 50 60 70
0 1 2 3 4 5 6
1
/q
1/Cf
Pack bed flow Hg 3 ppm
Pack BF
y = -863.49x + 905.74 R² = 0.8622 0 50 100 150 200 250 300 350
0 0.5 1 1.5
1
/q
1/Cf
Batch Hg 3 ppm
Batch
30
y = -6.8956x + 18.571 R² = 0.9772
0 2 4 6 8 10 12 14 16
0 0.5 1 1.5
1
/q
1/Cf
Rotary Hg 5 ppm
Rotary
Linear (Rotary) y = -8.4683x + 20.047
R² = 0.8803
0 2 4 6 8 10 12 14 16 18 20
0 0.5 1 1.5
1
/q
1/Cf
Biotray Hg 5 ppm
Biotray
Linear (Biotray)
y = -30.446x + 32.44 R² = 0.8567
0 5 10 15 20 25
0 0.2 0.4 0.6 0.8
1
/q
1/Cf
Pack Bed Flow Hg 5 ppm
Pack Bf
Linear
(Pack Bf) y = -61.119x + 48.638
R² = 0.7738
0 5 10 15 20 25 30 35 40
0 0.2 0.4 0.6 0.8
1
/q
1/Cf
Batch Hg 5 ppm
Batch
31
y = -1593.5x + 21.448 R² = 0.9991
0 0.5 1 1.5 2 2.5 3 3.5 4
0.0112 0.0114 0.0116 0.0118 0.012
1
/q
1/cf
Rotary Cu 100 ppm
Rotary
Linear (Rotary)
y = -7374.6x + 85.94 R² = 0.9847
0 2 4 6 8 10
0.0104 0.0106 0.0108 0.011 0.0112 0.0114
1
/q
1/cf
Biotray Cu 100 ppm
Biotray
Linear (Biotray )
y = -6675.1x + 78.769 R² = 0.9925
0 1 2 3 4 5 6 7 8 9 10
0.0104 0.0106 0.0108 0.011 0.0112 0.0114 0.0116
1
/q
1/Cf
Pack Bed Flow Cu 100 ppm
Pack BF
Linear
(Pack BF) y = -3769.6x + 45.882
R² = 0.9973 3.8 3.9 4 4.1 4.2 4.3 4.4 4.5 4.6 4.7 4.8
0.0109 0.01095 0.011 0.01105 0.0111 0.01115
1
/q
1/Cf
Batch Cu 100 ppm
Batch
32
y = -2593.4x + 16.757 R² = 0.8054 0 0.5 1 1.5 2 2.5 3 3.5 4
0.005 0.0055 0.006 0.0065
1
/q
1/Cf
Rotary Cu 200 ppm
Rotary
Linear (Rotary)
y = -24753x + 134.6 R² = 0.9651
0 1 2 3 4 5 6 7 8 9
0.0051 0.00515 0.0052 0.00525 0.0053 0.00535
1
/q
1/Cf
Biotray Cu 200 ppm
Biotray
Linear (Biotray)
y = -106672x + 556.08 R² = 0.9405 0
5 10 15 20
0.00505 0.0051 0.00515 0.0052
1
/q
1/Cf
Pack Bed Flow Cu 200 ppm
Pack BF
Linear
(Pack BF) y = -22220x + 121.42
R² = 0.8224 0 2 4 6 8 10
0.005 0.0051 0.0052 0.0053 0.0054
1
/q
1/Cf
Batch Cu 200 ppm
Batch
33
Lampiran 5 Hasil Uji Analisis Statistik
ANOVA
Hg 3 ppm Sumber
Keragaman
Jumlah Ku