MIFTAHUL JANAH. Viabilitas Polen Bunga Jantan dan Identifikasi Isozim Penciri Jarak Pagar ( ) Monoecious dan Andromonoecious. Dibimbing oleh TRIADIATI dan RITA MEGIA.
Jarak pagar ( ) umumnya adalah tanaman monoecious. Saat ini, diketahui terdapat tanaman jarak pagar yang menghasilkan bunga hermaprodit, namun jumlahnya sangat terbatas. Tanaman jarak pagar hermaprodit, termasuk tipe andromonoecious dan berpeluang menjadi tanaman yang menyerbuk sendiri. Informasi mengenai viabilitas polen diperlukan untuk mengetahui kemampuan polen dalam proses penyerbukan, sedangkan ciri tanaman monoecious atau andromonoecious ditentukan salah satunya oleh enzim sehingga dapat dianalisis perbedaannya dengan analisis isozim. Penelitian ini bertujuan untuk mengetahui viabilitas polen bunga jantan, serta mengidentifikasi isozim sebagai penciri yang membedakan tanaman
andromonoecious dan monoecious pada tanaman jarak pagar. Jarak pagar mempunyai polen berbentuk bulat dengan ukuran yang bervariasi. Diameter polen jarak pagar berkisar 5010 3m dengan rataan diameter sebesar 7,6 3m. Tingkat viabilitas polen pada bunga jantan jarak pagar monoecious dan andromonoecious tinggi saat keadaan bunga jantan kuncup dan akan menurun ketika bunga jantan sudah mekar sampai layu. Perbedaan ciri isozim jarak pagar monoecious dan andromonoecious dapat terlihat dengan isozim esterase pada sampel daun sebelum periode berbunga (SPB) yang menghasilkan dua pita untuk tanaman andromonoecious dan satu pita untuk tanaman monoecious.
Kata kunci: monoecious, andromonoecious, isozim, viabilitas polen.
Miftahul Janah. Viability of The Male Flower Pollen and Isozyme Identification of Monoecieous and Andromonoecious Physic Nut . Advised by TRIADIATI and RITA MEGIA.
# $ % & "'
Pada umumnya jarak pagar (
) merupakan tanaman berumah satu (monoeciou ) dengan bunga jantan dan betina pada satu tanaman yang sama, tetapi pada bunga yang berbeda (Hartati 2009). Saat ini diketahui terdapat tanaman jarak pagar yang menghasilkan bunga hermaprodit, namun jumlahnya sangat terbatas. Tanaman jarak pagar hermaprodit, termasuk tipe andromonoecious (hanya menghasilkan bunga hermaprodit dan bunga jantan, tanpa bunga betina). Pada satu karangan bunga, jumlah bunga jantan lebih banyak dibandingkan bunga hermaprodit, dan ukuran bunga hermaprodit lebih besar dari bunga jantan (Delita 2008). Tanaman jarak pagar hermaprodit lebih berpeluang berkembang menjadi tanaman yang menyerbuk sendiri karena putik dan benang sari terletak pada satu bunga. Tanaman yang menyerbuk sendiri umumnya akan menghasilkan generasi berikutnya yang lebih homogen, sedangkan tanaman menyerbuk silang umumnya lebih heterogen. Oleh karena itu, benih yang berasal dari satu tanaman hermaprodit yang sama diduga akan mewarisi sifat hermaprodit dari induknya. Pada jarak pagar monoecious dalam satu karangan bunga terdapat 105 bunga betina yang dikelilingi oleh 25093 bunga jantan. Bunga jantan mekar terlebih dahulu sedangkan bunga betina mekar 2 sampai 6 hari setelah bunga jantan mekar (Raju & Ezradanam 2002). Rendahnya jumlah bunga betina merupakan salah satu faktor penyebab rendahnya produksi buah yang dihasilkan (Hartati 2009).
Sifat bunga yang dihasilkan pada tanaman jarak pagar monoecious atau andromonoecious ditentukan salah satunya oleh enzim sehingga perbedaannya dapat dianalisis dengan isozim. Isozim adalah kumpulan berbagai molekul enzim yang memiliki fungsi sama dan hampir tidak dipengaruhi oleh lingkungan. Molekul0 molekul isozim pada elektrogram akan tampak dalam bentuk pita0pita. Secara genetik telah diketahui bahwa satu gen berhubungan dengan satu rantai polipeptida. Ini berarti satu molekul isozim atau protein dapat dikendalikan oleh satu atau beberapa gen (Syukriani & Kusumawati 2008). Esterase (EST), oksaloasetat glutamat transaminase (GOT), dan peroksidase (PER) merupakan beberapa
isozim yang digunakan sebagai marker isozim untuk sidik jari genotipe tertentu seperti kelamin bunga (Culley 1999 ; Syukriani & Kusumawati 2008).
Untuk mempelajari sifat hermaprodit pada tanaman jarak pagar, perlu dilakukan penelitian mengenai ciri biokimia yang membedakan antara tanaman monoecious dengan andromonoecious, seperti analisis isozim. Uji viabilitas polen juga diperlukan untuk mengetahui kemampuan polen bunga jantan dalam proses penyerbukan. Viabilitas polen merupakan kemampuan berkecambah polen yang menunjukkan bahwa peluang polen menyerbuki sel telur tinggi, serta menghasilkan buah bermutu baik dan benih berviabilitas tinggi (Widiastuti & Palupi 2008).
()( "
Penelitian ini bertujuan untuk mengetahui viabilitas polen bunga jantan, dan mengidentifikasi isozim sebagai penciri yang membedakan tanaman andromonoecious dan monoecious pada tanaman jarak pagar (
).
&#( * " %!+ #
Penelitian ini dilaksanakan pada bulan Februari 2011 – Juni 2011 di lahan pertanian Cibeureum, Laboratorium Mikroteknik dan Laboratorium Terpadu Departemen Biologi, FMIPA, serta Laboratorium Biologi Tumbuhan, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) – Lembaga Penelitian dan Pemberdayaan Masyarakat (LPPM) Institut Pertanian Bogor.
, " * " #
Bahan yang digunakan adalah daun dan bunga pada tanaman jarak pagar monoecieous dan andromonoecious larutan buffer Tris, serta pewarna esterase (EST), malat dehidrogenase (MDH), asam phospatase (ACP), peroksidase (PER), dan
pewarna I2KI 0,2 %.
# $ % & "'
Pada umumnya jarak pagar (
) merupakan tanaman berumah satu (monoeciou ) dengan bunga jantan dan betina pada satu tanaman yang sama, tetapi pada bunga yang berbeda (Hartati 2009). Saat ini diketahui terdapat tanaman jarak pagar yang menghasilkan bunga hermaprodit, namun jumlahnya sangat terbatas. Tanaman jarak pagar hermaprodit, termasuk tipe andromonoecious (hanya menghasilkan bunga hermaprodit dan bunga jantan, tanpa bunga betina). Pada satu karangan bunga, jumlah bunga jantan lebih banyak dibandingkan bunga hermaprodit, dan ukuran bunga hermaprodit lebih besar dari bunga jantan (Delita 2008). Tanaman jarak pagar hermaprodit lebih berpeluang berkembang menjadi tanaman yang menyerbuk sendiri karena putik dan benang sari terletak pada satu bunga. Tanaman yang menyerbuk sendiri umumnya akan menghasilkan generasi berikutnya yang lebih homogen, sedangkan tanaman menyerbuk silang umumnya lebih heterogen. Oleh karena itu, benih yang berasal dari satu tanaman hermaprodit yang sama diduga akan mewarisi sifat hermaprodit dari induknya. Pada jarak pagar monoecious dalam satu karangan bunga terdapat 105 bunga betina yang dikelilingi oleh 25093 bunga jantan. Bunga jantan mekar terlebih dahulu sedangkan bunga betina mekar 2 sampai 6 hari setelah bunga jantan mekar (Raju & Ezradanam 2002). Rendahnya jumlah bunga betina merupakan salah satu faktor penyebab rendahnya produksi buah yang dihasilkan (Hartati 2009).
Sifat bunga yang dihasilkan pada tanaman jarak pagar monoecious atau andromonoecious ditentukan salah satunya oleh enzim sehingga perbedaannya dapat dianalisis dengan isozim. Isozim adalah kumpulan berbagai molekul enzim yang memiliki fungsi sama dan hampir tidak dipengaruhi oleh lingkungan. Molekul0 molekul isozim pada elektrogram akan tampak dalam bentuk pita0pita. Secara genetik telah diketahui bahwa satu gen berhubungan dengan satu rantai polipeptida. Ini berarti satu molekul isozim atau protein dapat dikendalikan oleh satu atau beberapa gen (Syukriani & Kusumawati 2008). Esterase (EST), oksaloasetat glutamat transaminase (GOT), dan peroksidase (PER) merupakan beberapa
isozim yang digunakan sebagai marker isozim untuk sidik jari genotipe tertentu seperti kelamin bunga (Culley 1999 ; Syukriani & Kusumawati 2008).
Untuk mempelajari sifat hermaprodit pada tanaman jarak pagar, perlu dilakukan penelitian mengenai ciri biokimia yang membedakan antara tanaman monoecious dengan andromonoecious, seperti analisis isozim. Uji viabilitas polen juga diperlukan untuk mengetahui kemampuan polen bunga jantan dalam proses penyerbukan. Viabilitas polen merupakan kemampuan berkecambah polen yang menunjukkan bahwa peluang polen menyerbuki sel telur tinggi, serta menghasilkan buah bermutu baik dan benih berviabilitas tinggi (Widiastuti & Palupi 2008).
()( "
Penelitian ini bertujuan untuk mengetahui viabilitas polen bunga jantan, dan mengidentifikasi isozim sebagai penciri yang membedakan tanaman andromonoecious dan monoecious pada tanaman jarak pagar (
).
&#( * " %!+ #
Penelitian ini dilaksanakan pada bulan Februari 2011 – Juni 2011 di lahan pertanian Cibeureum, Laboratorium Mikroteknik dan Laboratorium Terpadu Departemen Biologi, FMIPA, serta Laboratorium Biologi Tumbuhan, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) – Lembaga Penelitian dan Pemberdayaan Masyarakat (LPPM) Institut Pertanian Bogor.
, " * " #
Bahan yang digunakan adalah daun dan bunga pada tanaman jarak pagar monoecieous dan andromonoecious larutan buffer Tris, serta pewarna esterase (EST), malat dehidrogenase (MDH), asam phospatase (ACP), peroksidase (PER), dan
pewarna I2KI 0,2 %.
%#-*% !+%
Sampel polen untuk uji viabilitas polen bunga jantan diambil dari 17 bunga jantan dari 3 tanaman jarak pagar andromonoecious
(H1, H5, H6) dan 17 bunga jantan dari 2 tanaman jarak pagar monoecious. Pengambilan bunga jantan dilakukan pada pukul 09.00010.00 WIB. Sampel yang digunakan untuk analisis isozim adalah daun saat periode berbunga (PB), bunga jantan, dan bunga betina pada tanaman jarak pagar induk monoecious dan daun saat periode berbunga (PB), bunga jantan, dan bunga hermaprodit dari 3 tanaman induk jarak pagar andromonoecious yaitu H1, H5, dan H6, serta daun sebelum periode berbunga (SPB) dari 4 tanaman jarak pagar hasil kecambah induk jarak pagar monoecious, H1, H5, dan H6. Letak sampel yang dianalisis dari tanaman jarak pagar terletak pada Lampiran 1.
$ &#%$ !-$.- -'/ 0("' * " ()/ 1/ 0/ /# 2 +- %"
Bunga jantan, bunga betina, dan bunga hermaprodit segar difoto dengan mikroskop stereo untuk diamati morfologinya. Pada uji viabilitas polen, polen dari bunga jantan ditetesi dengan pewarna I2KI 0,2% selama beberapa menit dan diamati di bawah mikroskop dengan perbesaran 100X (Johansen 1940). Pada setiap sampel dilakukan 305 ulangan dengan jumlah minimum 50 butir polen untuk masing0 masing ulangan. Butir polen yang terwarnai hitam adalah polen yang dianggap viabel dan dinyatakan dalam hitungan persen.
" /2/2 /2-3/!
Metode analisis isozim yang digunakan merupakan modifikasi dari teknik Wendel dan Weeden (1989). Tahapan kegiatan analisis enzim terdiri atas penyimpanan bahan, pembuatan bufer, pembuatan gel pati, ekstraksi enzim, elektroforesis, pewarnaan, pencucian, serta dokumentasi.
%!0( # " (.%$
Bufer gel dibuat dari L0Histidin monohidrat 1,048 g yang dilarutkan dengan aquades sampai volume 1 liter dan diatur hingga pH 6,0 dengan menambahkan Tris 0,2 g. Bufer elektroda dibuat dengan melarutkan 10,5507 g asam sitrat monohidrat dan 18,1650 g Tris hidroksimetil aminometan ke dalam aquades hingga volume 1liter dengan pH 6,0.
Bufer ekstrak sebanyak 40 ml dibuat dengan melarutkan L0asam askorbat 0,07045 g, L0sistein
0,1939 g, Triton0X0100 0,12 ml, PVP040 0,02 g, dan 0,54 g Na2HPO4.2H2O pH diatur sampai 7.
Bufer ekstrak berfungsi untuk membantu menghancurkan sel tanpa menimbulkan panas pada ekstrak dan perubahan warna terhadap daun yang di ekstrak.
%!0( # " % #/
Gel dibuat dari pati kentang dengan kadar 13%. Pati kentang dan bufer gel dimasukkan ke dalam labu didih, lalu dikocok merata, dan dimasak dalam penangas air pada suhu 100°C, sambil diputar agar larutan pati masak merata. Gelembung udara yang ada dalam larutan dibuang dengan menggunakan pompa vakum. Larutan selanjutnya dituangkan ke cetakan gel yang sudah dilapisi parafin. Gel kemudian didinginkan, ditutup plastik film, dan dibiarkan selama satu malam.
&2#$ &2/ "3/!
Sampel tanaman sebanyak 2 g, bufer ekstrak 0,5 ml, dan pasir kuarsa digiling dengan mortar yang dialasi nampan berisi es. Untuk pemindahan sampel ke dalam cetakan gel dila0 kukan dengan cara menyerap ekstrak sampel dengan kertas saring, kemudian dimasukkan ke dalam gel. Pada salah satu lubang yang paling pinggir disisipkan kertas saring yang telah diberi
cairan sebagai indikator
mobilitas elektroforesis. %&$-.-$%2/2
Gel yang telah siap kemudian dibuat lubang/sumur sebagai tempat sampel. Kertas saring yang mengandung sampel disisipkan ke dalam sumur. Cetakan gel lalu dimasukkan ke dalam sistem reservoar elektroforesis yang berisi bufer elektroda. Elektroforesis dilakukan dalam ruang pendingin. Waktu yang dibutuhkan untuk elektroforesis adalah 30 menit dengan tegangan awal 100 volt, dan di elektroforesis tetap pada 200 volt selama 304 jam.
%4 $" "
%"5(5/ " * " *-&(!%"# 2/
Setelah pewarnaan selesai, gel dicuci dengan air mengalir sampai bersih. Gel dipindahkan ke plastik transparan, diletakkan diatas lampu pengamatan, kemudian pola pita yang tampak digambar pada plastik transparan, dan difoto.
"#%$+$%# 2/ +- +/# /2-3/!
Pita0pita yang tampak pada plastik transparan diukur jarak pergerakan pita dari titik awal. Selanjutnya dihitung nilai Rf (
) untuk membuat pola pita pada tiap isozim. Nilai Rf dihitung dengan rumus:
Rf = Jarak pergerakan pita dari tempat awal Jarak pergerakan warna pelacak dari awal
$ &#%$ !-$.- -'/ 0("'
menghasilkan bunga majemuk
tak terbatas ( ) yang
terbentuk di terminal cabang. Bunga majemuk menghasilkan bunga betina atau bunga hermaprodit yang dikelilingi oleh sekelompok bunga jantan. Tanaman jarak pagar menghasilkan bunga jantan dengan jumlah yang lebih banyak bila dibandingkan dengan bunga betina (tanaman monoecious) ataupun bunga hermaprodit (tanaman andromonoecious). Bunga jantan, bunga betina, dan bunga hermaprodit masing0 masing memiliki lima sepal dan lima petal dengan rambut0rambut halus dan berwarna hijau (Gambar 1). Jumlah benang sari pada bunga jantan dan bunga hermaprodit adalah 10 buah. Benang sari pada bunga jantan tersusun dalam dua lingkaran yaitu lingkaran luar dan lingkaran dalam dengan masing0 masing lingkaran terdapat lima buah benang sari dan berdekatan satu sama lain (Gambar 1A dan 1B). Letak kepala sari dan kepala putik pada bunga hermaprodit saling berdekatan, bahkan terkadang saling menempel (Gambar 1E dan 1F). Kepala putik pada bunga betina (Gambar 1C dan 1D) maupun bunga hermaprodit (Gambar 1E dan 1F) memiliki tiga lobus dan dikelilingi oleh lima kelenjar nektar.
Bunga betina berukuran relatif lebih besar dari bunga jantan. Bunga hermaprodit memiliki struktur mirip bunga betina namun ukurannya lebih besar dari bunga betina dan memiliki 10 stamen yang yang tersusun melingkar (Gambar 1). Waktu mekar bunga hermaprodit dalam 1 infloresen bervariasi. Pada andromonocious umumnya
bunga jantan mekar lebih dahulu dari bunga hermaprodit. Hal yang serupa juga terlihat pada monoecious. merupakan anggota famili Euphorbiaceae yang mempunyai bentuk polen yang bulat dengan ukuran yang bervariasi. Polen memiliki diameter berkisar 5010 3m dengan rataan diameter sebesar 7,63 3m. Uji pewarnaan I2KI
mewarnai pati yang terdapat pada polen. Intensitas warna yang dihasilkan masing0 masing butir polen berbeda bergantung jumlah pati yang dikandungnya. Dari hasil pengamatan terdapat empat perbedaan intensitas warna yaitu hitam, abu0abu, coklat, dan tidak berwarna/putih. Butir polen yang hitam dan bulat utuh merupakan butir polen yang viabel, sedangkan yang berwana abu0 abu, coklat, dan tidak berwarna/putih dengan bentuk polen bulat utuh maupun tidak adalah butir polen yang tidak viabel (Gambar 2).
Gambar 2 Bentuk, warna, dan variasi ukuran polen perbesaran 400X. (a) polen viabel, (b) polen aviabel.
%"5(5/ " * " *-&(!%"# 2/
Setelah pewarnaan selesai, gel dicuci dengan air mengalir sampai bersih. Gel dipindahkan ke plastik transparan, diletakkan diatas lampu pengamatan, kemudian pola pita yang tampak digambar pada plastik transparan, dan difoto.
"#%$+$%# 2/ +- +/# /2-3/!
Pita0pita yang tampak pada plastik transparan diukur jarak pergerakan pita dari titik awal. Selanjutnya dihitung nilai Rf (
) untuk membuat pola pita pada tiap isozim. Nilai Rf dihitung dengan rumus:
Rf = Jarak pergerakan pita dari tempat awal Jarak pergerakan warna pelacak dari awal
$ &#%$ !-$.- -'/ 0("'
menghasilkan bunga majemuk
tak terbatas ( ) yang
terbentuk di terminal cabang. Bunga majemuk menghasilkan bunga betina atau bunga hermaprodit yang dikelilingi oleh sekelompok bunga jantan. Tanaman jarak pagar menghasilkan bunga jantan dengan jumlah yang lebih banyak bila dibandingkan dengan bunga betina (tanaman monoecious) ataupun bunga hermaprodit (tanaman andromonoecious). Bunga jantan, bunga betina, dan bunga hermaprodit masing0 masing memiliki lima sepal dan lima petal dengan rambut0rambut halus dan berwarna hijau (Gambar 1). Jumlah benang sari pada bunga jantan dan bunga hermaprodit adalah 10 buah. Benang sari pada bunga jantan tersusun dalam dua lingkaran yaitu lingkaran luar dan lingkaran dalam dengan masing0 masing lingkaran terdapat lima buah benang sari dan berdekatan satu sama lain (Gambar 1A dan 1B). Letak kepala sari dan kepala putik pada bunga hermaprodit saling berdekatan, bahkan terkadang saling menempel (Gambar 1E dan 1F). Kepala putik pada bunga betina (Gambar 1C dan 1D) maupun bunga hermaprodit (Gambar 1E dan 1F) memiliki tiga lobus dan dikelilingi oleh lima kelenjar nektar.
Bunga betina berukuran relatif lebih besar dari bunga jantan. Bunga hermaprodit memiliki struktur mirip bunga betina namun ukurannya lebih besar dari bunga betina dan memiliki 10 stamen yang yang tersusun melingkar (Gambar 1). Waktu mekar bunga hermaprodit dalam 1 infloresen bervariasi. Pada andromonocious umumnya
bunga jantan mekar lebih dahulu dari bunga hermaprodit. Hal yang serupa juga terlihat pada monoecious. merupakan anggota famili Euphorbiaceae yang mempunyai bentuk polen yang bulat dengan ukuran yang bervariasi. Polen memiliki diameter berkisar 5010 3m dengan rataan diameter sebesar 7,63 3m. Uji pewarnaan I2KI
mewarnai pati yang terdapat pada polen. Intensitas warna yang dihasilkan masing0 masing butir polen berbeda bergantung jumlah pati yang dikandungnya. Dari hasil pengamatan terdapat empat perbedaan intensitas warna yaitu hitam, abu0abu, coklat, dan tidak berwarna/putih. Butir polen yang hitam dan bulat utuh merupakan butir polen yang viabel, sedangkan yang berwana abu0 abu, coklat, dan tidak berwarna/putih dengan bentuk polen bulat utuh maupun tidak adalah butir polen yang tidak viabel (Gambar 2).
Gambar 2 Bentuk, warna, dan variasi ukuran polen perbesaran 400X. (a) polen viabel, (b) polen aviabel.
Pada Tabel 1 dapat terlihat bahwa viabilitas polen bunga jantan
monoecious tertinggi saat bunga dalam keadaan kuncup (94,13%) dan semakin menurun saat bunga sudah mekar dan layu. Penurunan viabilitas polen bunga jantan mekar juga terjadi pada bunga jantan
andromonoecious. Polen dalam jumlah banyak dapat ditemukan pada kondisi bunga jantan kuncup dan mekar pada hari ke0
22 sejak inisiasi bunga. Perbedaannya, saat kuncup polen belum keluar dari tabung polen, sedangkan pada bunga jantan yang mekar pada hari ke022 polen sudah keluar dari tabung polen dan siap menyerbuki stigma (Gambar 3B dan 3G). Selain jumlah polen yang melimpah, jumlah polen yang viabel pada kondisi tersebut juga memiliki viabilitas yang tinggi yaitu >90% baik pada
monoecious maupun andromonoecious.
Gambar 3 Karakter bunga/warna kepala sari bunga jantan andromonoecious (A0E) dan monoecious (F0J) dengan perbesaran 10X. (A) dan (F) hari ke021, (B) dan (G) hari ke022, (C) dan
(H) hari ke023, (D) dan (I) hari ke024, (E) dan (J) hari ke025.
Tabel 1 Viabilitas polen bunga jantan pada tanaman andromonoecious dan monoecieous Karakter bunga / warna
kepala sari
Umur bunga (hari ke0)
Viabilitas polen bunga jantan (%) Andromonoecious Monoecious
Kuncup 20021 95,74 ± 2,03 94,13 ± 2,45
kuning cerah 22 91,16 ± 1,56 91,85 ± 2,08
Kuning0putih 23 89,54 ± 1,07 83,01 ± 1,37
Putih0coklat 24 84,51 ± 2,09 60,26 ± 5,19
Coklat0hitam 25 76,82 ± 3,71 50,10 ± 5,33
Data menunjukkan nilai rataan ± standar deviasi (SD) ; umur bunga terhitung sejak inisiasi bunga. " /2/2 2-3/!
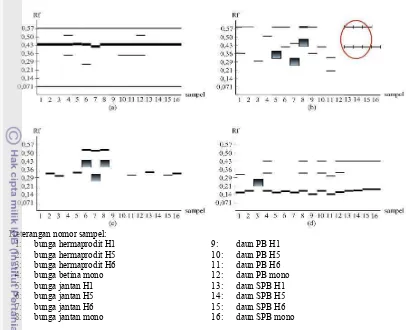
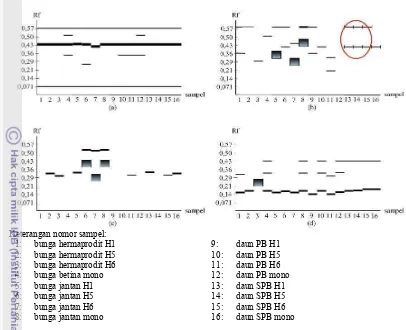
Pada zimogram dapat terlihat bahwa isozim PER, EST, ACP, dan MDH masing0 masing menunjukkan adanya perbedaan jumlah pita. Pada isozim ACP jumlah pita yang dihasilkan sedikit dan pada beberapa sampel tidak menghasilkan pita0pita. Tidak munculnya pita juga ditemukan pada isozim EST, namun jumlah sampel yang tidak menghasilkan pita lebih sedikit yaitu hanya pada sumur 12 yang berisi ekstrak daun jarak pagar monoecious saat periode berbunga (PB) (Gambar 4).
Dari empat isozim yaitu PER, EST, ACP, dan MDH, perbedaan jarak pagar monoecious dan andromonoecious dapat
terlihat dengan menggunakan isozim EST. Perbedaan ini terlihat pada sumur 13016. Sumur 13015 adalah sumur yang berisi ekstrak daun jarak pagar andromonoecious H1, H5, dan H6 sebelum periode berbunga (SPB) yang masing0masing menghasilkan 2 pita, sedangkan sumur 16 adalah sumur yang berisi ekstrak daun jarak pagar monoecious sebelum periode berbunga (SPB) yang menghasilkan 1 pita. Sampel lain yang diuji dengan isozim PER, EST, ACP, dan MDH menunjukkan adanya variasi pola pita. Semua pita pada zimogram PER, EST, MDH, dan ACP terlihat ada yang tebal dan tipis (Gambar 4).
B
A C D E
Keterangan nomor sampel:
1: bunga hermaprodit H1 9: daun PB H1
2: bunga hermaprodit H5 10: daun PB H5
3: bunga hermaprodit H6 11: daun PB H6
4: bunga betina mono 12: daun PB mono
5: bunga jantan H1 13: daun SPB H1
6: bunga jantan H5 14: daun SPB H5
7: bunga jantan H6 15: daun SPB H6
8: bunga jantan mono 16: daun SPB mono
Gambar 4 Zimogram pola pita empat isozim dari 16 sampel (a) PER, (b) EST, (c) ACP, (d) MDH
Jarak pagar merupakan anggota famili Euphorbiaceae dengan jumlah bunga jantan yang lebih banyak daripada bunga betina (monoecious) dan bunga hermaprodit (andromonoecious). Hal ini didukung oleh penelitian sebelumnya yaitu perbandingan bunga jantan dan bunga hermaprodit pada
andromonoecious adalah 14,4:1 (Asbani & Winarno 2009), sedangkan perbandingan bunga jantan dan bunga betina pada monoecious sebesar 29:1 (Raju & Ezradanam 2002) dan 20:1 (Dhillon 2006). Perbedaan rasio yang dihasilkan antara bunga jantan dengan bunga betina ini dapat dipengaruhi oleh iklim serta kondisi unsur hara pada populasi yang diamati (Chang0Wei 2007).
Berdasarkan pengamatan di lapang, bunga jantan umumnya mekar lebih dahulu dari bunga betina ataupun bunga hermaprodit. Hai ini sesuai dengan hasil penelitian Raju dan Ezradanam (2002) yaitu pada monoecious, bunga betina mekar 206 hari setelah bunga jantan mekar yaitu pukul 05.50 dan 06.30, sedangkan
Dhillon (2006) melaporkan bahwa bunga jantan mekar pukul 07.30 dan 08.30. Perbedaan waktu mekar tersebut dapat dipengaruhi oleh intensitas cahaya matahari. Apabila sinar matahari kurang karena kondisi cuaca yang mendung, maka bunga akan mekar lebih lambat (Asbani & Winarno 2009).
Polen monoecious dan
andromonoecious memiliki bentuk bulat. Hal yang sama dilaporkan oleh Erdtman (1972) bahwa polen anggota Euphorbiaceae berbentuk bulat dan merupakan golongan atau tidak memiliki lubang pori, serta pada permukaannya terdapat tonjolon0 tonjolan. Pada uji pewarnaan, I2KI mewarnai
pati yang terdapat di dalam polen. Pati pada setiap butir polen tersebut akan digunakan sebagai sumber energi untuk berkecambah. Intensitas warna yang dihasilkan masing0 masing polen berbeda bergantung jumlah pati yang dikandungnya, sehingga diasumsikan semakin tinggi kandungan pati dalam polen, semakin tinggi viabilitas polen tersebut (Pardales 1980).
Pada Tabel 1 terlihat bahwa viabilitas
polen bunga jantan baik
saat bunga dalam keadaan kuncup dan mekar (H022) yaitu >90%. Hasil penelitian ini sama dengan penelitian yang dilakukan oleh Dhillon (2006) yang mengamati viabilitas polen monoecious yaitu sebesar 98% pada bunga umur hari ke022. Perbedaan viabilitas polen tersebut dapat disebabkan oleh waktu pengambilan sampel yang berbeda. Setelah bunga mekar sempurna (hari ke022), viabilitas polen semakin menurun hingga bunga jantan layu (hari ke0 25).
Viabilitas polen yang menurun menunjukkan bahwa jumlah polen yang viabel juga menurun. Hal ini dapat disebabkan oleh umur bunga yang semakin tua dan adanya degenerasi kandungan pati pada polen. Perbedaan viabilitas polen bunga jantan yang cukup tinggi terlihat pada umur bunga hari ke024 dan hari ke025. Pada waktu tersebut viabilitas polen bunga jantan
andromonoecious lebih tinggi. Hal ini dapat dikarenakan bunga jantan
monoecious polennya sangat berperan untuk menyerbuki bunga betina, sedangkan pada
andromonoecious polen dapat diperoleh dari bunga hermaprodit. Selain itu, degenerasi kandungan pati yang terjadi pada polen kemungkinan dapat disebabkan oleh adanya kegiatan respirasi seluler dalam polen.
Uji viabilitas polen bunga jantan yang dilakukan (Tabel 1) pada penelitian ini dapat menambah informasi mengenai keadaan yang tepat untuk melakukan penyerbukan dengan menggunakan polen dari bunga jantan yaitu hari ke021 dan hari ke022 sejak inisiasi bunga jantan. Bunga jantan pada hari ke021 dan hari ke022 merupakan hari ketika bunga jantan dalam keadaan memiliki kandungan pati dan jumlah polen viabel yang tinggi sehingga mempunyai peluang berkecambah yang besar. Hal itu diperkuat dengan adanya percobaan perkecambahan polen yaitu polen yang diambil pada periode reseptif (bunga mekar sempurna) memiliki kemampuan berkecambah yang lebih besar daripada polen yang diambil di luar periode reseptif (Utomo 2008).
Pada Gambar 4 terlihat bahwa dari empat isozim yang diuji yaitu isozim PER, EST, ACP, dan MDH hanya isozim EST yang menunjukkan perbedaan jelas antara tanaman monoecious dan andromonoecious yaitu pada sampel daun sebelum periode berbunga (SPB) yang menghasilkan dua pita untuk tanaman andromonoecious dan satu pita untuk tanaman monoecious, sedangkan
isozim PER, ACP, dan MDH pola pita yang dihasilkan bervariasi. Variasi pola pita juga ditunjukkan oleh isozim PER, EST, ACP, dan MDH pada sampel lainnya. Variasi pola pita pada tiap isozim ini dapat disebabkan oleh adanya perbedaan umur tanaman, kualitas contoh, jenis bufer ekstrak, dan bufer elektroda yang digunakan yang erat kaitannya dengan denaturasi enzim yang dianalisis (Wendel & Weeden 1989). Isozim ACP pada sampel tanaman jarak pagar yang diuji sifatnya kurang aktif. Hal tersebut diakibatkan pada isozim ACP pita yang dihasilkannya sedikit dan pada beberapa sampel tidak menghasilkan pita0pita (Gambar 4). Tidak munculnya pita juga ditemukan pada isozim EST, namun jumlah sampel yang tidak menghasilkan pita jumlahnya lebih sedikit. Menurut Wendel dan Weeden (1989) tidak adanya aktivitas enzim (tidak muncul pita) dapat dipengaruhi oleh bufer ekstrak yang digunakan. Selain itu, pola pita sendiri dianggap sebagai susunan genetik dari dari suatu jaringan atau individu karena enzim adalah produk langsung dari gen sehingga tidak setiap enzim cocok untuk suatu tanaman atau jaringan.
Sifat morfologi yang membedakan antara monoecious dan andromonoecious seperti bunga dan buah memerlukan waktu cukup lama sampai bisa diamati serta sulit digunakan untuk pemeriksaan pada tingkat benih atau bibit. Pada Gambar 4 dapat terlihat bahwa isozim EST dapat digunakan sebagai penanda
monoecious dan andromonoecious ketika tanaman masih dalam keadaan bibit dengan menggunakan sampel daun.
Isozim EST, PER, dan ACP juga digunakan oleh Syukriani dan Kusumawati (2008) sebagai sidik jari genotipe tanaman gambir. Pita0pita yang terlihat pada zimogram terdapat beberapa yang tebal. Pita yang tebal ini diduga terjadi karena pemisahan yang kurang sempurna dari hasil elektroforesis dengan larutan penyangga, atau terbentuknya beberapa pita yang letaknya berdekatan sehingga terlihat seperti satu buah pita yang tebal.
mempunyai bentuk polen yang bulat dengan ukuran yang bervariasi. Polen
memiliki diameter berkisar 5010 3m dengan rataan diameter sebesar 7,63 3m. Tingkat viabilitas polen pada bunga jantan
saat bunga dalam keadaan kuncup dan mekar (H022) yaitu >90%. Hasil penelitian ini sama dengan penelitian yang dilakukan oleh Dhillon (2006) yang mengamati viabilitas polen monoecious yaitu sebesar 98% pada bunga umur hari ke022. Perbedaan viabilitas polen tersebut dapat disebabkan oleh waktu pengambilan sampel yang berbeda. Setelah bunga mekar sempurna (hari ke022), viabilitas polen semakin menurun hingga bunga jantan layu (hari ke0 25).
Viabilitas polen yang menurun menunjukkan bahwa jumlah polen yang viabel juga menurun. Hal ini dapat disebabkan oleh umur bunga yang semakin tua dan adanya degenerasi kandungan pati pada polen. Perbedaan viabilitas polen bunga jantan yang cukup tinggi terlihat pada umur bunga hari ke024 dan hari ke025. Pada waktu tersebut viabilitas polen bunga jantan
andromonoecious lebih tinggi. Hal ini dapat dikarenakan bunga jantan
monoecious polennya sangat berperan untuk menyerbuki bunga betina, sedangkan pada
andromonoecious polen dapat diperoleh dari bunga hermaprodit. Selain itu, degenerasi kandungan pati yang terjadi pada polen kemungkinan dapat disebabkan oleh adanya kegiatan respirasi seluler dalam polen.
Uji viabilitas polen bunga jantan yang dilakukan (Tabel 1) pada penelitian ini dapat menambah informasi mengenai keadaan yang tepat untuk melakukan penyerbukan dengan menggunakan polen dari bunga jantan yaitu hari ke021 dan hari ke022 sejak inisiasi bunga jantan. Bunga jantan pada hari ke021 dan hari ke022 merupakan hari ketika bunga jantan dalam keadaan memiliki kandungan pati dan jumlah polen viabel yang tinggi sehingga mempunyai peluang berkecambah yang besar. Hal itu diperkuat dengan adanya percobaan perkecambahan polen yaitu polen yang diambil pada periode reseptif (bunga mekar sempurna) memiliki kemampuan berkecambah yang lebih besar daripada polen yang diambil di luar periode reseptif (Utomo 2008).
Pada Gambar 4 terlihat bahwa dari empat isozim yang diuji yaitu isozim PER, EST, ACP, dan MDH hanya isozim EST yang menunjukkan perbedaan jelas antara tanaman monoecious dan andromonoecious yaitu pada sampel daun sebelum periode berbunga (SPB) yang menghasilkan dua pita untuk tanaman andromonoecious dan satu pita untuk tanaman monoecious, sedangkan
isozim PER, ACP, dan MDH pola pita yang dihasilkan bervariasi. Variasi pola pita juga ditunjukkan oleh isozim PER, EST, ACP, dan MDH pada sampel lainnya. Variasi pola pita pada tiap isozim ini dapat disebabkan oleh adanya perbedaan umur tanaman, kualitas contoh, jenis bufer ekstrak, dan bufer elektroda yang digunakan yang erat kaitannya dengan denaturasi enzim yang dianalisis (Wendel & Weeden 1989). Isozim ACP pada sampel tanaman jarak pagar yang diuji sifatnya kurang aktif. Hal tersebut diakibatkan pada isozim ACP pita yang dihasilkannya sedikit dan pada beberapa sampel tidak menghasilkan pita0pita (Gambar 4). Tidak munculnya pita juga ditemukan pada isozim EST, namun jumlah sampel yang tidak menghasilkan pita jumlahnya lebih sedikit. Menurut Wendel dan Weeden (1989) tidak adanya aktivitas enzim (tidak muncul pita) dapat dipengaruhi oleh bufer ekstrak yang digunakan. Selain itu, pola pita sendiri dianggap sebagai susunan genetik dari dari suatu jaringan atau individu karena enzim adalah produk langsung dari gen sehingga tidak setiap enzim cocok untuk suatu tanaman atau jaringan.
Sifat morfologi yang membedakan antara monoecious dan andromonoecious seperti bunga dan buah memerlukan waktu cukup lama sampai bisa diamati serta sulit digunakan untuk pemeriksaan pada tingkat benih atau bibit. Pada Gambar 4 dapat terlihat bahwa isozim EST dapat digunakan sebagai penanda
monoecious dan andromonoecious ketika tanaman masih dalam keadaan bibit dengan menggunakan sampel daun.
Isozim EST, PER, dan ACP juga digunakan oleh Syukriani dan Kusumawati (2008) sebagai sidik jari genotipe tanaman gambir. Pita0pita yang terlihat pada zimogram terdapat beberapa yang tebal. Pita yang tebal ini diduga terjadi karena pemisahan yang kurang sempurna dari hasil elektroforesis dengan larutan penyangga, atau terbentuknya beberapa pita yang letaknya berdekatan sehingga terlihat seperti satu buah pita yang tebal.
mempunyai bentuk polen yang bulat dengan ukuran yang bervariasi. Polen
memiliki diameter berkisar 5010 3m dengan rataan diameter sebesar 7,63 3m. Tingkat viabilitas polen pada bunga jantan
bunga jantan layu (hari ke025). Perbedaan jarak pagar monoecious dan andromonocious dapat terlihat dengan menggunakan isozim EST pada sampel daun sebelum periode berbunga (SPB).
Perlu dilakukan penelitian lebih lanjut untuk memastikan jumlah pita pada pita yang tebal dan mencoba penggunaan isozim yang lebih bervariasi serta penggunaan komposisi bufer yang lebih sesuai untuk tanaman jarak pagar.
Asbani N, Winarno D. 2009. Bioekologi Penyerbukan dan Pembuahan pada Jarak Pagar Andromonoecious. 31 Selfing Rates in A Self0Compatible, Hermaphroditic Species,
(Caryophllaceae).
" 86 (7): 9800 987.
Delita K, Mareza E, Kalsum U. 2008. Korelasi Aktivitas Enzim Nitrat Reduktase dan Pertumbuhan Beberapa Genotipe Tanaman Jarak Pagar
( Linn.) yang
Diperlakukan dengan Zat Pengatur Tumbuh 2,4 D. # 11: 80086. Dhillon RS, Hooda MS, Handa AK, Ahlawat
KS, Kumar Y, Subhash, Singh N. 2006. Clonal Propagation and Reproductive
biology of L. !
8: 18027. Erdtman G. 1972. $
$ % & ' (
! $ !). New
York: Hafner Publishing Company.
Hartati S. 2009. Info Tek Perkebunan Media
Pardales JR. 1980. Factors Limiting Fruit and Seed Set in Taro.
% + 2: 1650171.
Raju S, Ezradanam V. 2002. Pollination ecology and fruiting behaviour in a
monoecious spesies, L.
(Euphorbiaceae). 83
(11): 139501398.
Sriprasertsak P, Burikam S, Attathom S, Piriyasuwarong S. 1988. Determination of Cultivar and Sex of Papaya Tissues Derived from Tissue Culture. ,
22: 24029.
Syukriani L, Kusumawati A. 2008. Analisis Isoenzim sebagai Penanda Biokimia untuk Mengkarakterisasi Tanaman
Gambir (- (Hunter Roxb).
2 (1).
Utomo BP. 2008. Fenologi Pembungaan dan Pembuahan Jarak Pagar (
) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor. Wendel JF, Weeden NF. 1989. Visualization
and Interpretation of Plant Isozymes. In Soltis, D.E. and P.S. Soltis (Eds.). Isozymes in Plant Biology. Dioscorides Press, Oregon. p:5045.
Widiastuti A, Palupi ER. 2008. Viabilitas Serbuk Sari dan Pengaruhnya terhadap Keberhasilan Pembentukan Buah Kelapa
Sawit (. Jacq.)
bunga jantan layu (hari ke025). Perbedaan jarak pagar monoecious dan andromonocious dapat terlihat dengan menggunakan isozim EST pada sampel daun sebelum periode berbunga (SPB).
Perlu dilakukan penelitian lebih lanjut untuk memastikan jumlah pita pada pita yang tebal dan mencoba penggunaan isozim yang lebih bervariasi serta penggunaan komposisi bufer yang lebih sesuai untuk tanaman jarak pagar.
Asbani N, Winarno D. 2009. Bioekologi Penyerbukan dan Pembuahan pada Jarak Pagar Andromonoecious. 31 Selfing Rates in A Self0Compatible, Hermaphroditic Species,
(Caryophllaceae).
" 86 (7): 9800 987.
Delita K, Mareza E, Kalsum U. 2008. Korelasi Aktivitas Enzim Nitrat Reduktase dan Pertumbuhan Beberapa Genotipe Tanaman Jarak Pagar
( Linn.) yang
Diperlakukan dengan Zat Pengatur Tumbuh 2,4 D. # 11: 80086. Dhillon RS, Hooda MS, Handa AK, Ahlawat
KS, Kumar Y, Subhash, Singh N. 2006. Clonal Propagation and Reproductive
biology of L. !
8: 18027. Erdtman G. 1972. $
$ % & ' (
! $ !). New
York: Hafner Publishing Company.
Hartati S. 2009. Info Tek Perkebunan Media
Pardales JR. 1980. Factors Limiting Fruit and Seed Set in Taro.
% + 2: 1650171.
Raju S, Ezradanam V. 2002. Pollination ecology and fruiting behaviour in a
monoecious spesies, L.
(Euphorbiaceae). 83
(11): 139501398.
Sriprasertsak P, Burikam S, Attathom S, Piriyasuwarong S. 1988. Determination of Cultivar and Sex of Papaya Tissues Derived from Tissue Culture. ,
22: 24029.
Syukriani L, Kusumawati A. 2008. Analisis Isoenzim sebagai Penanda Biokimia untuk Mengkarakterisasi Tanaman
Gambir (- (Hunter Roxb).
2 (1).
Utomo BP. 2008. Fenologi Pembungaan dan Pembuahan Jarak Pagar (
) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor. Wendel JF, Weeden NF. 1989. Visualization
and Interpretation of Plant Isozymes. In Soltis, D.E. and P.S. Soltis (Eds.). Isozymes in Plant Biology. Dioscorides Press, Oregon. p:5045.
Widiastuti A, Palupi ER. 2008. Viabilitas Serbuk Sari dan Pengaruhnya terhadap Keberhasilan Pembentukan Buah Kelapa
Sawit (. Jacq.)
MIFTAHUL JANAH. Viabilitas Polen Bunga Jantan dan Identifikasi Isozim Penciri Jarak Pagar ( ) Monoecious dan Andromonoecious. Dibimbing oleh TRIADIATI dan RITA MEGIA.
Jarak pagar ( ) umumnya adalah tanaman monoecious. Saat ini, diketahui terdapat tanaman jarak pagar yang menghasilkan bunga hermaprodit, namun jumlahnya sangat terbatas. Tanaman jarak pagar hermaprodit, termasuk tipe andromonoecious dan berpeluang menjadi tanaman yang menyerbuk sendiri. Informasi mengenai viabilitas polen diperlukan untuk mengetahui kemampuan polen dalam proses penyerbukan, sedangkan ciri tanaman monoecious atau andromonoecious ditentukan salah satunya oleh enzim sehingga dapat dianalisis perbedaannya dengan analisis isozim. Penelitian ini bertujuan untuk mengetahui viabilitas polen bunga jantan, serta mengidentifikasi isozim sebagai penciri yang membedakan tanaman
andromonoecious dan monoecious pada tanaman jarak pagar. Jarak pagar mempunyai polen berbentuk bulat dengan ukuran yang bervariasi. Diameter polen jarak pagar berkisar 5010 3m dengan rataan diameter sebesar 7,6 3m. Tingkat viabilitas polen pada bunga jantan jarak pagar monoecious dan andromonoecious tinggi saat keadaan bunga jantan kuncup dan akan menurun ketika bunga jantan sudah mekar sampai layu. Perbedaan ciri isozim jarak pagar monoecious dan andromonoecious dapat terlihat dengan isozim esterase pada sampel daun sebelum periode berbunga (SPB) yang menghasilkan dua pita untuk tanaman andromonoecious dan satu pita untuk tanaman monoecious.
Kata kunci: monoecious, andromonoecious, isozim, viabilitas polen.
Miftahul Janah. Viability of The Male Flower Pollen and Isozyme Identification of Monoecieous and Andromonoecious Physic Nut . Advised by TRIADIATI and RITA MEGIA.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Judul
: Viabilitas Polen Bunga Jantan dan Identifikasi Isozim Penciri Jarak
Pagar (
) Monoecious dan Andromonoecious
Nama
: Miftahul Janah
NRP
: G34070096
Disetujui
Pembimbing I,
Pembimbing II,
Dr. Triadiati, M. Si
Dr. Rita Megia, DEA
NIP 19600224 198603 2 001 NIP 19550214 198103 2 001
Diketahui
Ketua Departemen Biologi
Fakultas Matematika dan Ilmu Pengetahuan Alam
Dr. Ir. Ence Darmo Jaya Supena, M.Si
NIP 19641002 198903 1 002
Puji syukur kehadirat Allah SWT atas berkat, rahmat, dan karunia0Nya sehingga penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini dilaksanakan sejak bulan Februari 2011 sampai Juni 2011 dengan judul Viabilitas Polen Bunga Jantan dan Identifikasi Isozim Penciri Jarak Pagar ( ) Monoecious dan Andromonoecious.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu penyelesaian karya ilmiah ini antara lain Ibu Dr. Triadiati, M.Si. dan Ibu Dr. Rita Megia, DEA atas bimbingan, masukan, dan arahan yang diberikan sehingga penulis dapat menyelesaikan penelitian dan penulisan karya ilmiah ini. Terima kasih penulis ucapkan kepada Bapak Ir. Tri Heru W, M.Sc. selaku dosen penguji atas masukan dan arahannya dan ucapan terima kasih juga penulis tujukan kepada Bapak Dr. Alex Hartana selaku kepala Lab. Biologi Tumbuhan Pusat Penelitian Sumber daya Hayati dan Bioteknologi (PPSHB) – Lembaga Penelitian dan Pemberdayaan Masyarakat (LPPM) IPB dan Ibu Dr. Ir. Dorly, M.Si. yang telah banyak membantu selama penelitian berlangsung. Penghargaan penulis berikan kepada Bapak Pras, Bu Retno, Bapak Edi, Bapak Jalal yang telah membantu penulis selama di lapangan dan laboratorium. Tidak lupa kepada rekan0rekan Biologi teruma Biologi 44 atas kebersamaannya dan sahabat0sahabat di Pondok Shinta Rana yang selalu membantu dan menerima keluh kesah saya selama ini. Terima kasih yang tak terungkapkan penulis ucapkan kepada orang tua saya Lilik Pranoto dan Siti Isnaini atas kasih sayang, doa, dorongan, dan pengorbanannya selama ini, untuk adikku tersayang Nurul dan teman terdekatku Sumaryanto atas dukungan dan bantuannya.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna, namun penulis berharap semoga karya ilmiah ini dapat bermanfaat bagi ilmu pengetahuan selanjutnya.
Bogor, September 2011
Penulis dilahirkan di Tangerang pada tanggal 16 Agustus 1989 dari bapak Lilik Pranoto dan ibu Siti Isnaini. Penulis merupakan putri pertama dari dua bersaudara. Tahun 2007 penulis lulus dari MA Negeri 10 Joglo, Jakarta Barat dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur SPMB. Penulis memilih mayor Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam dengan minor Gizi Masyarakat, Fakultas Ekologi dan Manusia.
! "
DAFTAR TABEL ... viii
DAFTAR GAMBAR ... viii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 1
Waktu dan Tempat ... 1
BAHAN DAN METODE Bahan dan Alat ... 1
Metode ... 2
Sampel ... 2
Karakter morfologi bunga dan uji viabilitas polen ... 2
Analisis isozim ... 2
Pembuatan Bufer ... 2
Pembuatan Gel Pati ... 2
Elekroforesis ... 2
Pewarnaan ... 2
Pencucian dan dokumentasi... 3
Interpretasi pola pita isozim ... 3
HASIL Karakter morfologi bunga ... 3
Bentuk, ukuran, dan viabilitas polen ... 3
Analisis Isozim ... 4
PEMBAHASAN ... 5
SIMPULAN DAN SARAN ... 6
DAFTAR PUSTAKA ... 7
! "
1 Viabilitas polen bunga jantan pada tanaman jarak pagar andromonoecious dan
monoecious……….. 4
! "
1 Morfologi bunga ………... 3
2 Bentuk dan variasi ukuran polen ………. 3
3 Karakter bunga/warna kepala sari bunga jantan andromonoecious (A0E) dan monoecious (F0J) dengan perbesaran 10X………... 4 4 Zimogram pola pita empat isozim dari 16 sampel ……….. 5
! "
1 Posisi pengambilan sampel daun SPB dan daun PB monoecious dan
andromonoecious………. 9
# $ % & "'
Pada umumnya jarak pagar (
) merupakan tanaman berumah satu (monoeciou ) dengan bunga jantan dan betina pada satu tanaman yang sama, tetapi pada bunga yang berbeda (Hartati 2009). Saat ini diketahui terdapat tanaman jarak pagar yang menghasilkan bunga hermaprodit, namun jumlahnya sangat terbatas. Tanaman jarak pagar hermaprodit, termasuk tipe andromonoecious (hanya menghasilkan bunga hermaprodit dan bunga jantan, tanpa bunga betina). Pada satu karangan bunga, jumlah bunga jantan lebih banyak dibandingkan bunga hermaprodit, dan ukuran bunga hermaprodit lebih besar dari bunga jantan (Delita 2008). Tanaman jarak pagar hermaprodit lebih berpeluang berkembang menjadi tanaman yang menyerbuk sendiri karena putik dan benang sari terletak pada satu bunga. Tanaman yang menyerbuk sendiri umumnya akan menghasilkan generasi berikutnya yang lebih homogen, sedangkan tanaman menyerbuk silang umumnya lebih heterogen. Oleh karena itu, benih yang berasal dari satu tanaman hermaprodit yang sama diduga akan mewarisi sifat hermaprodit dari induknya. Pada jarak pagar monoecious dalam satu karangan bunga terdapat 105 bunga betina yang dikelilingi oleh 25093 bunga jantan. Bunga jantan mekar terlebih dahulu sedangkan bunga betina mekar 2 sampai 6 hari setelah bunga jantan mekar (Raju & Ezradanam 2002). Rendahnya jumlah bunga betina merupakan salah satu faktor penyebab rendahnya produksi buah yang dihasilkan (Hartati 2009).
Sifat bunga yang dihasilkan pada tanaman jarak pagar monoecious atau andromonoecious ditentukan salah satunya oleh enzim sehingga perbedaannya dapat dianalisis dengan isozim. Isozim adalah kumpulan berbagai molekul enzim yang memiliki fungsi sama dan hampir tidak dipengaruhi oleh lingkungan. Molekul0 molekul isozim pada elektrogram akan tampak dalam bentuk pita0pita. Secara genetik telah diketahui bahwa satu gen berhubungan dengan satu rantai polipeptida. Ini berarti satu molekul isozim atau protein dapat dikendalikan oleh satu atau beberapa gen (Syukriani & Kusumawati 2008). Esterase (EST), oksaloasetat glutamat transaminase (GOT), dan peroksidase (PER) merupakan beberapa
isozim yang digunakan sebagai marker isozim untuk sidik jari genotipe tertentu seperti kelamin bunga (Culley 1999 ; Syukriani & Kusumawati 2008).
Untuk mempelajari sifat hermaprodit pada tanaman jarak pagar, perlu dilakukan penelitian mengenai ciri biokimia yang membedakan antara tanaman monoecious dengan andromonoecious, seperti analisis isozim. Uji viabilitas polen juga diperlukan untuk mengetahui kemampuan polen bunga jantan dalam proses penyerbukan. Viabilitas polen merupakan kemampuan berkecambah polen yang menunjukkan bahwa peluang polen menyerbuki sel telur tinggi, serta menghasilkan buah bermutu baik dan benih berviabilitas tinggi (Widiastuti & Palupi 2008).
()( "
Penelitian ini bertujuan untuk mengetahui viabilitas polen bunga jantan, dan mengidentifikasi isozim sebagai penciri yang membedakan tanaman andromonoecious dan monoecious pada tanaman jarak pagar (
).
&#( * " %!+ #
Penelitian ini dilaksanakan pada bulan Februari 2011 – Juni 2011 di lahan pertanian Cibeureum, Laboratorium Mikroteknik dan Laboratorium Terpadu Departemen Biologi, FMIPA, serta Laboratorium Biologi Tumbuhan, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) – Lembaga Penelitian dan Pemberdayaan Masyarakat (LPPM) Institut Pertanian Bogor.
, " * " #
Bahan yang digunakan adalah daun dan bunga pada tanaman jarak pagar monoecieous dan andromonoecious larutan buffer Tris, serta pewarna esterase (EST), malat dehidrogenase (MDH), asam phospatase (ACP), peroksidase (PER), dan
pewarna I2KI 0,2 %.
%#-*% !+%
Sampel polen untuk uji viabilitas polen bunga jantan diambil dari 17 bunga jantan dari 3 tanaman jarak pagar andromonoecious
(H1, H5, H6) dan 17 bunga jantan dari 2 tanaman jarak pagar monoecious. Pengambilan bunga jantan dilakukan pada pukul 09.00010.00 WIB. Sampel yang digunakan untuk analisis isozim adalah daun saat periode berbunga (PB), bunga jantan, dan bunga betina pada tanaman jarak pagar induk monoecious dan daun saat periode berbunga (PB), bunga jantan, dan bunga hermaprodit dari 3 tanaman induk jarak pagar andromonoecious yaitu H1, H5, dan H6, serta daun sebelum periode berbunga (SPB) dari 4 tanaman jarak pagar hasil kecambah induk jarak pagar monoecious, H1, H5, dan H6. Letak sampel yang dianalisis dari tanaman jarak pagar terletak pada Lampiran 1.
$ &#%$ !-$.- -'/ 0("' * " ()/ 1/ 0/ /# 2 +- %"
Bunga jantan, bunga betina, dan bunga hermaprodit segar difoto dengan mikroskop stereo untuk diamati morfologinya. Pada uji viabilitas polen, polen dari bunga jantan ditetesi dengan pewarna I2KI 0,2% selama beberapa menit dan diamati di bawah mikroskop dengan perbesaran 100X (Johansen 1940). Pada setiap sampel dilakukan 305 ulangan dengan jumlah minimum 50 butir polen untuk masing0 masing ulangan. Butir polen yang terwarnai hitam adalah polen yang dianggap viabel dan dinyatakan dalam hitungan persen.
" /2/2 /2-3/!
Metode analisis isozim yang digunakan merupakan modifikasi dari teknik Wendel dan Weeden (1989). Tahapan kegiatan analisis enzim terdiri atas penyimpanan bahan, pembuatan bufer, pembuatan gel pati, ekstraksi enzim, elektroforesis, pewarnaan, pencucian, serta dokumentasi.
%!0( # " (.%$
Bufer gel dibuat dari L0Histidin monohidrat 1,048 g yang dilarutkan dengan aquades sampai volume 1 liter dan diatur hingga pH 6,0 dengan menambahkan Tris 0,2 g. Bufer elektroda dibuat dengan melarutkan 10,5507 g asam sitrat monohidrat dan 18,1650 g Tris hidroksimetil aminometan ke dalam aquades hingga volume 1liter dengan pH 6,0.
Bufer ekstrak sebanyak 40 ml dibuat dengan melarutkan L0asam askorbat 0,07045 g, L0sistein
0,1939 g, Triton0X0100 0,12 ml, PVP040 0,02 g, dan 0,54 g Na2HPO4.2H2O pH diatur sampai 7.
Bufer ekstrak berfungsi untuk membantu menghancurkan sel tanpa menimbulkan panas pada ekstrak dan perubahan warna terhadap daun yang di ekstrak.
%!0( # " % #/
Gel dibuat dari pati kentang dengan kadar 13%. Pati kentang dan bufer gel dimasukkan ke dalam labu didih, lalu dikocok merata, dan dimasak dalam penangas air pada suhu 100°C, sambil diputar agar larutan pati masak merata. Gelembung udara yang ada dalam larutan dibuang dengan menggunakan pompa vakum. Larutan selanjutnya dituangkan ke cetakan gel yang sudah dilapisi parafin. Gel kemudian didinginkan, ditutup plastik film, dan dibiarkan selama satu malam.
&2#$ &2/ "3/!
Sampel tanaman sebanyak 2 g, bufer ekstrak 0,5 ml, dan pasir kuarsa digiling dengan mortar yang dialasi nampan berisi es. Untuk pemindahan sampel ke dalam cetakan gel dila0 kukan dengan cara menyerap ekstrak sampel dengan kertas saring, kemudian dimasukkan ke dalam gel. Pada salah satu lubang yang paling pinggir disisipkan kertas saring yang telah diberi
cairan sebagai indikator
mobilitas elektroforesis. %&$-.-$%2/2
Gel yang telah siap kemudian dibuat lubang/sumur sebagai tempat sampel. Kertas saring yang mengandung sampel disisipkan ke dalam sumur. Cetakan gel lalu dimasukkan ke dalam sistem reservoar elektroforesis yang berisi bufer elektroda. Elektroforesis dilakukan dalam ruang pendingin. Waktu yang dibutuhkan untuk elektroforesis adalah 30 menit dengan tegangan awal 100 volt, dan di elektroforesis tetap pada 200 volt selama 304 jam.
%4 $" "
%"5(5/ " * " *-&(!%"# 2/
Setelah pewarnaan selesai, gel dicuci dengan air mengalir sampai bersih. Gel dipindahkan ke plastik transparan, diletakkan diatas lampu pengamatan, kemudian pola pita yang tampak digambar pada plastik transparan, dan difoto.
"#%$+$%# 2/ +- +/# /2-3/!
Pita0pita yang tampak pada plastik transparan diukur jarak pergerakan pita dari titik awal. Selanjutnya dihitung nilai Rf (
) untuk membuat pola pita pada tiap isozim. Nilai Rf dihitung dengan rumus:
Rf = Jarak pergerakan pita dari tempat awal Jarak pergerakan warna pelacak dari awal
$ &#%$ !-$.- -'/ 0("'
menghasilkan bunga majemuk
tak terbatas ( ) yang
terbentuk di terminal cabang. Bunga majemuk menghasilkan bunga betina atau bunga hermaprodit yang dikelilingi oleh sekelompok bunga jantan. Tanaman jarak pagar menghasilkan bunga jantan dengan jumlah yang lebih banyak bila dibandingkan dengan bunga betina (tanaman monoecious) ataupun bunga hermaprodit (tanaman andromonoecious). Bunga jantan, bunga betina, dan bunga hermaprodit masing0 masing memiliki lima sepal dan lima petal dengan rambut0rambut halus dan berwarna hijau (Gambar 1). Jumlah benang sari pada bunga jantan dan bunga hermaprodit adalah 10 buah. Benang sari pada bunga jantan tersusun dalam dua lingkaran yaitu lingkaran luar dan lingkaran dalam dengan masing0 masing lingkaran terdapat lima buah benang sari dan berdekatan satu sama lain (Gambar 1A dan 1B). Letak kepala sari dan kepala putik pada bunga hermaprodit saling berdekatan, bahkan terkadang saling menempel (Gambar 1E dan 1F). Kepala putik pada bunga betina (Gambar 1C dan 1D) maupun bunga hermaprodit (Gambar 1E dan 1F) memiliki tiga lobus dan dikelilingi oleh lima kelenjar nektar.
Bunga betina berukuran relatif lebih besar dari bunga jantan. Bunga hermaprodit memiliki struktur mirip bunga betina namun ukurannya lebih besar dari bunga betina dan memiliki 10 stamen yang yang tersusun melingkar (Gambar 1). Waktu mekar bunga hermaprodit dalam 1 infloresen bervariasi. Pada andromonocious umumnya
bunga jantan mekar lebih dahulu dari bunga hermaprodit. Hal yang serupa juga terlihat pada monoecious. merupakan anggota famili Euphorbiaceae yang mempunyai bentuk polen yang bulat dengan ukuran yang bervariasi. Polen memiliki diameter berkisar 5010 3m dengan rataan diameter sebesar 7,63 3m. Uji pewarnaan I2KI
mewarnai pati yang terdapat pada polen. Intensitas warna yang dihasilkan masing0 masing butir polen berbeda bergantung jumlah pati yang dikandungnya. Dari hasil pengamatan terdapat empat perbedaan intensitas warna yaitu hitam, abu0abu, coklat, dan tidak berwarna/putih. Butir polen yang hitam dan bulat utuh merupakan butir polen yang viabel, sedangkan yang berwana abu0 abu, coklat, dan tidak berwarna/putih dengan bentuk polen bulat utuh maupun tidak adalah butir polen yang tidak viabel (Gambar 2).
Gambar 2 Bentuk, warna, dan variasi ukuran polen perbesaran 400X. (a) polen viabel, (b) polen aviabel.
Pada Tabel 1 dapat terlihat bahwa viabilitas polen bunga jantan
monoecious tertinggi saat bunga dalam keadaan kuncup (94,13%) dan semakin menurun saat bunga sudah mekar dan layu. Penurunan viabilitas polen bunga jantan mekar juga terjadi pada bunga jantan
andromonoecious. Polen dalam jumlah banyak dapat ditemukan pada kondisi bunga jantan kuncup dan mekar pada hari ke0
22 sejak inisiasi bunga. Perbedaannya, saat kuncup polen belum keluar dari tabung polen, sedangkan pada bunga jantan yang mekar pada hari ke022 polen sudah keluar dari tabung polen dan siap menyerbuki stigma (Gambar 3B dan 3G). Selain jumlah polen yang melimpah, jumlah polen yang viabel pada kondisi tersebut juga memiliki viabilitas yang tinggi yaitu >90% baik pada
monoecious maupun andromonoecious.
Gambar 3 Karakter bunga/warna kepala sari bunga jantan andromonoecious (A0E) dan monoecious (F0J) dengan perbesaran 10X. (A) dan (F) hari ke021, (B) dan (G) hari ke022, (C) dan
(H) hari ke023, (D) dan (I) hari ke024, (E) dan (J) hari ke025.
Tabel 1 Viabilitas polen bunga jantan pada tanaman andromonoecious dan monoecieous Karakter bunga / warna
kepala sari
Umur bunga (hari ke0)
Viabilitas polen bunga jantan (%) Andromonoecious Monoecious
Kuncup 20021 95,74 ± 2,03 94,13 ± 2,45
kuning cerah 22 91,16 ± 1,56 91,85 ± 2,08
Kuning0putih 23 89,54 ± 1,07 83,01 ± 1,37
Putih0coklat 24 84,51 ± 2,09 60,26 ± 5,19
Coklat0hitam 25 76,82 ± 3,71 50,10 ± 5,33
Data menunjukkan nilai rataan ± standar deviasi (SD) ; umur bunga terhitung sejak inisiasi bunga. " /2/2 2-3/!
Pada zimogram dapat terlihat bahwa isozim PER, EST, ACP, dan MDH masing0 masing menunjukkan adanya perbedaan jumlah pita. Pada isozim ACP jumlah pita yang dihasilkan sedikit dan pada beberapa sampel tidak menghasilkan pita0pita. Tidak munculnya pita juga ditemukan pada isozim EST, namun jumlah sampel yang tidak menghasilkan pita lebih sedikit yaitu hanya pada sumur 12 yang berisi ekstrak daun jarak pagar monoecious saat periode berbunga (PB) (Gambar 4).
Dari empat isozim yaitu PER, EST, ACP, dan MDH, perbedaan jarak pagar monoecious dan andromonoecious dapat
terlihat dengan menggunakan isozim EST. Perbedaan ini terlihat pada sumur 13016. Sumur 13015 adalah sumur yang berisi ekstrak daun jarak pagar andromonoecious H1, H5, dan H6 sebelum periode berbunga (SPB) yang masing0masing menghasilkan 2 pita, sedangkan sumur 16 adalah sumur yang berisi ekstrak daun jarak pagar monoecious sebelum periode berbunga (SPB) yang menghasilkan 1 pita. Sampel lain yang diuji dengan isozim PER, EST, ACP, dan MDH menunjukkan adanya variasi pola pita. Semua pita pada zimogram PER, EST, MDH, dan ACP terlihat ada yang tebal dan tipis (Gambar 4).
B
A C D E
Keterangan nomor sampel:
1: bunga hermaprodit H1 9: daun PB H1
2: bunga hermaprodit H5 10: daun PB H5
3: bunga hermaprodit H6 11: daun PB H6
4: bunga betina mono 12: daun PB mono
5: bunga jantan H1 13: daun SPB H1
6: bunga jantan H5 14: daun SPB H5
7: bunga jantan H6 15: daun SPB H6
8: bunga jantan mono 16: daun SPB mono
Gambar 4 Zimogram pola pita empat isozim dari 16 sampel (a) PER, (b) EST, (c) ACP, (d) MDH
Jarak pagar merupakan anggota famili Euphorbiaceae dengan jumlah bunga jantan yang lebih banyak daripada bunga betina (monoecious) dan bunga hermaprodit (andromonoecious). Hal ini didukung oleh penelitian sebelumnya yaitu perbandingan bunga jantan dan bunga hermaprodit pada
andromonoecious adalah 14,4:1 (Asbani & Winarno 2009), sedangkan perbandingan bunga jantan dan bunga betina pada monoecious sebesar 29:1 (Raju & Ezradanam 2002) dan 20:1 (Dhillon 2006). Perbedaan rasio yang dihasilkan antara bunga jantan dengan bunga betina ini dapat dipengaruhi oleh iklim serta kondisi unsur hara pada populasi yang diamati (Chang0Wei 2007).
Berdasarkan pengamatan di lapang, bunga jantan umumnya mekar lebih dahulu dari bunga betina ataupun bunga hermaprodit. Hai ini sesuai dengan hasil penelitian Raju dan Ezradanam (2002) yaitu pada monoecious, bunga betina mekar 206 hari setelah bunga jantan mekar yaitu pukul 05.50 dan 06.30, sedangkan
Dhillon (2006) melaporkan bahwa bunga jantan mekar pukul 07.30 dan 08.30. Perbedaan waktu mekar tersebut dapat dipengaruhi oleh intensitas cahaya matahari. Apabila sinar matahari kurang karena kondisi cuaca yang mendung, maka bunga akan mekar lebih lambat (Asbani & Winarno 2009).
Polen monoecious dan
andromonoecious memiliki bentuk bulat. Hal yang sama dilaporkan oleh Erdtman (1972) bahwa polen anggota Euphorbiaceae berbentuk bulat dan merupakan golongan atau tidak memiliki lubang pori, serta pada permukaannya terdapat tonjolon0 tonjolan. Pada uji pewarnaan, I2KI mewarnai
pati yang terdapat di dalam polen. Pati pada setiap butir polen tersebut akan digunakan sebagai sumber energi untuk berkecambah. Intensitas warna yang dihasilkan masing0 masing polen berbeda bergantung jumlah pati yang dikandungnya, sehingga diasumsikan semakin tinggi kandungan pati dalam polen, semakin tinggi viabilitas polen tersebut (Pardales 1980).
Pada Tabel 1 terlihat bahwa viabilitas
polen bunga jantan baik
saat bunga dalam keadaan kuncup dan mekar (H022) yaitu >90%. Hasil penelitian ini sama dengan penelitian yang dilakukan oleh Dhillon (2006) yang mengamati viabilitas polen monoecious yaitu sebesar 98% pada bunga umur hari ke022. Perbedaan viabilitas polen tersebut dapat disebabkan oleh waktu pengambilan sampel yang berbeda. Setelah bunga mekar sempurna (hari ke022), viabilitas polen semakin menurun hingga bunga jantan layu (hari ke0 25).
Viabilitas polen yang menurun menunjukkan bahwa jumlah polen yang viabel juga menurun. Hal ini dapat disebabkan oleh umur bunga yang semakin tua dan adanya degenerasi kandungan pati pada polen. Perbedaan viabilitas polen bunga jantan yang cukup tinggi terlihat pada umur bunga hari ke024 dan hari ke025. Pada waktu tersebut viabilitas polen bunga jantan
andromonoecious lebih tinggi. Hal ini dapat dikarenakan bunga jantan
monoecious polennya sangat berperan untuk menyerbuki bunga betina, sedangkan pada
andromonoecious polen dapat diperoleh dari bunga hermaprodit. Selain itu, degenerasi kandungan pati yang terjadi pada polen kemungkinan dapat disebabkan oleh adanya kegiatan respirasi seluler dalam polen.
Uji viabilitas polen bunga jantan yang dilakukan (Tabel 1) pada penelitian ini dapat menambah informasi mengenai keadaan yang tepat untuk melakukan penyerbukan dengan menggunakan polen dari bunga jantan yaitu hari ke021 dan hari ke022 sejak inisiasi bunga jantan. Bunga jantan pada hari ke021 dan hari ke022 merupakan hari ketika bunga jantan dalam keadaan memiliki kandungan pati dan jumlah polen viabel yang tinggi sehingga mempunyai peluang berkecambah yang besar. Hal itu diperkuat dengan adanya percobaan perkecambahan polen yaitu polen yang diambil pada periode reseptif (bunga mekar sempurna) memiliki kemampuan berkecambah yang lebih besar daripada polen yang diambil di luar periode reseptif (Utomo 2008).
Pada Gambar 4 terlihat bahwa dari empat isozim yang diuji yaitu isozim PER, EST, ACP, dan MDH hanya isozim EST yang menunjukkan perbedaan jelas antara tanaman monoecious dan andromonoecious yaitu pada sampel daun sebelum periode berbunga (SPB) yang menghasilkan dua pita untuk tanaman andromonoecious dan satu pita untuk tanaman monoecious, sedangkan
isozim PER, ACP, dan MDH pola pita yang dihasilkan bervariasi. Variasi pola pita juga ditunjukkan oleh isozim PER, EST, ACP, dan MDH pada sampel lainnya. Variasi pola pita pada tiap isozim ini dapat disebabkan oleh adanya perbedaan umur tanaman, kualitas contoh, jenis bufer ekstrak, dan bufer elektroda yang digunakan yang erat kaitannya dengan denaturasi enzim yang dianalisis (Wendel & Weeden 1989). Isozim ACP pada sampel tanaman jarak pagar yang diuji sifatnya kurang aktif. Hal tersebut diakibatkan pada isozim ACP pita yang dihasilkannya sedikit dan pada beberapa sampel tidak menghasilkan pita0pita (Gambar 4). Tidak munculnya pita juga ditemukan pada isozim EST, namun jumlah sampel yang tidak menghasilkan pita jumlahnya lebih sedikit. Menurut Wendel dan Weeden (1989) tidak adanya aktivitas enzim (tidak muncul pita) dapat dipengaruhi oleh bufer ekstrak yang digunakan. Selain itu, pola pita sendiri dianggap sebagai susunan genetik dari dari suatu jaringan atau individu karena enzim adalah produk langsung dari gen sehingga tidak setiap enzim cocok untuk suatu tanaman atau jaringan.
Sifat morfologi yang membedakan antara monoecious dan andromonoecious seperti bunga dan buah memerlukan waktu cukup lama sampai bisa diamati serta sulit digunakan untuk pemeriksaan pada tingkat benih atau bibit. Pada Gambar 4 dapat terlihat bahwa isozim EST dapat digunakan sebagai penanda
monoecious dan andromonoecious ketika tanaman masih dalam keadaan bibit dengan menggunakan sampel daun.
Isozim EST, PER, dan ACP juga digunakan oleh Syukriani dan Kusumawati (2008) sebagai sidik jari genotipe tanaman gambir. Pita0pita yang terlihat pada zimogram terdapat beberapa yang tebal. Pita yang tebal ini diduga terjadi karena pemisahan yang kurang sempurna dari hasil elektroforesis dengan larutan penyangga, atau terbentuknya beberapa pita yang letaknya berdekatan sehingga terlihat seperti satu buah pita yang tebal.
mempunyai bentuk polen yang bulat dengan ukuran yang bervariasi. Polen
memiliki diameter berkisar 5010 3m dengan rataan diameter sebesar 7,63 3m. Tingkat viabilitas polen pada bunga jantan
bunga jantan layu (hari ke025). Perbedaan jarak pagar monoecious dan andromonocious dapat terlihat dengan menggunakan isozim EST pada sampel daun sebelum periode berbunga (SPB).
Perlu dilakukan penelitian lebih lanjut untuk memastikan jumlah pita pada pita yang tebal dan mencoba penggunaan isozim yang lebih bervariasi serta penggunaan komposisi bufer yang lebih sesuai untuk tanaman jarak pagar.
Asbani N, Winarno D. 2009. Bioekologi Penyerbukan dan Pembuahan pada Jarak Pagar Andromonoecious. 31 Selfing Rates in A Self0Compatible, Hermaphroditic Species,
(Caryophllaceae).
" 86 (7): 9800 987.
Delita K, Mareza E, Kalsum U. 2008. Korelasi Aktivitas Enzim Nitrat Reduktase dan Pertumbuhan Beberapa Genotipe Tanaman Jarak Pagar
( Linn.) yang
Diperlakukan dengan Zat Pengatur Tumbuh 2,4 D. # 11: 80086. Dhillon RS, Hooda MS, Handa AK, Ahlawat
KS, Kumar Y, Subhash, Singh N. 2006. Clonal Propagation and Reproductive
biology of L. !
8: 18027. Erdtman G. 1972. $
$ % & ' (
! $ !). New
York: Hafner Publishing Company.
Hartati S. 2009. Info Tek Perkebunan Media
Pardales JR. 1980. Factors Limiting Fruit and Seed Set in Taro.
% + 2: 1650171.
Raju S, Ezradanam V. 2002. Pollination ecology and fruiting behaviour in a
monoecious spesies, L.
(Euphorbiaceae). 83
(11): 139501398.
Sriprasertsak P, Burikam S, Attathom S, Piriyasuwarong S. 1988. Determination of Cultivar and Sex of Papaya Tissues Derived from Tissue Culture. ,
22: 24029.
Syukriani L, Kusumawati A. 2008. Analisis Isoenzim sebagai Penanda Biokimia untuk Mengkarakterisasi Tanaman
Gambir (- (Hunter Roxb).
2 (1).
Utomo BP. 2008. Fenologi Pembungaan dan Pembuahan Jarak Pagar (
) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor. Wendel JF, Weeden NF. 1989. Visualization
and Interpretation of Plant Isozymes. In Soltis, D.E. and P.S. Soltis (Eds.). Isozymes in Plant Biology. Dioscorides Press, Oregon. p:5045.
Widiastuti A, Palupi ER. 2008. Viabilitas Serbuk Sari dan Pengaruhnya terhadap Keberhasilan Pembentukan Buah Kelapa
Sawit (. Jacq.)
Lampiran 1 Posisi pengambilan sampel daun SPB dan daun PB pada monoecious (a) dan andromonoecious (b)
1. Daun SPB diambil pada percabangan ke02 dari atas.
(a) (b)
2. Daun PB diambil pada 1 cabang yang sama dengan sampel bunga yang diambil.
Lampiran 2 Komposisi larutan pewarna isozim EST, PER, ACP, dan MDH (Wendel & Weeden 1989).
1. Pewarna Esterase (EST)
0 Sodium fosfat pH 7.0 100 ml
0 10Naftil asetat 50 mg
0 20Naftil asetat 50 mg
0 Aseton 5 ml
0 Fast blue RR salt 50 mg
2. Pewarna Peroksidase (PER)
0 Natrium asetat pH 5.0 100 ml
0 CaCl2 60 mg
0 30amino09 etilkarbasol 60 mg
0 Aseton/N,N0Dimethylformamid 5 ml
0 H2O2 3% 0,5 ml
3. Pewarna Acid phospatase (ACP)
0 Na0acetate buffer pH 5.0 50 ml 0 Na0ά0napthyl acid phospatase+aseton 50 mg
0 MgCl2 50 mg
0 Fast garnet GBG salt 50 mg
4. Pewarna Malat dehidogenase (MDH)
0 Tris HCl pH 8.5 50 ml
0 NAD 10 mg
0 Malic acid 150 mg
0 NBT/MTT 10 mg
Lampiran 1 Posisi pengambilan sampel daun SPB dan daun PB pada monoecious (a) dan andromonoecious (b)
1. Daun SPB diambil pada percabangan ke02 dari atas.
(a) (b)
2. Daun PB diambil pada 1 cabang yang sama dengan sampel bunga yang diambil.