TUTIK HARMIYATI
KISARAN INANG DAN PENULARAN
Papaya ringspot virus
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Kisaran Inang dan Penularan Papaya ringspot virus adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, April 2015
Tutik Harmiyati
RINGKASAN
TUTIK HARMIYATI. Kisaran Inang dan Penularan Papaya ringspot virus. Dibimbing oleh SRI HENDRASTUTI HIDAYAT DAN ABDUL MUIN ADNAN.
Pepaya (Carica papaya L.) merupakan salah satu komoditas pertanian yang banyak dikonsumsi oleh masyarakat Indonesia. Produktivitas pepaya sangat dipengaruhi oleh faktor alam, termasuk gangguan hama dan penyakit tanaman.
Papaya ringspot virus (PRSV) merupakan penyebab penyakit bercak cincin dan dilaporkan mengakibatkan kehilangan hasil pada tanaman pepaya dan beberapa jenis Cucurbitaceae, sehingga menimbulkan kerugian bagi petani. Berdasarkan Permentan 93/2011, PRSV masih tergolong Organisme Pengganggu Tumbuhan Karantina A1, yang artinya organisme tersebut belum ditemukan di wilayah Negara Indonesia. Namun telah ditemukan laporan yang menyatakan bahwa PRSV telah menginfeksi tanaman pepaya di daerah Aceh dan Medan dengan insidensi penyakit mencapai 100%.
Berdasarkan kisaran inangnya, PRSV terdiri atas 2 strain, yaitu PRSV strain P (PRSV-P) dan PRSV strain W (PRSV-W). PRSV-P menginfeksi tanaman pepaya dan Cucurbitaceae, sedangkan PRSV-W hanya menginfeksi Cucurbitaceae. Infeksi PRSV menyebabkan gejala mosaik, pemucatan tulang daun (vein clearing), penebalan tulang daun (vein banding), mosaik bergaris pada petiol, bercak hijau pada pucuk batang, daun berbentuk seperti tali (shoestring), penebalan lamina daun (rugose), dan kerdil. Virus ini dapat ditularkan ke tanaman sehat secara mekanis dan melalui vektor, namun tidak tular benih.
Penelitian dilakukan untuk mengetahui kisaran inang beberapa isolat PRSV melalui pengujian penularan secara mekanis pada 10 jenis tanaman dari 2 famili (Caricaceae dan Cucurbitaceae), efisiensi penularan PRSV melalui 2 spesies kutudaun yaitu Aphis gossypii dan Myzus persicae (Ordo: Hemiptera, Famili: Aphididae), dan membuktikan bahwa PRSV tidak dapat ditularkan melalui biji.
Pengamatan dan pengambilan sampel bergejala PRSV dilakukan di Medan (Desa Namo Belin) dan Bogor (Ciomas). Sampel tanaman bergejala PRSV asal Aceh dan Bogor, diperoleh dari koleksi Laboratorium Virologi Tumbuhan (IPB), sedangkan sampel tanaman bergejala PRSV isolat Bali merupakan koleksi dari Balai Karantina Pertanian (BKP) Kelas I Denpasar. Isolat-isolat PRSV kemudian
diperbanyak pada tanaman pepaya var. ‘California’ melalui inokulasi secara mekanis.
dengan PRSV isolat Thailand (95.9-98.3 %) dan terendah dengan PRSV isolat Taiwan (91.3-96.1%).
Uji kisaran inang dilakukan pada 5 varietas pepaya (‘California’,
‘Callina’,‘Lokal’, ‘Bangkok’, dan ‘Red Lady’) dan 5 jenis tanaman Cucurbitaceae (mentimun, mentimun jepang, kabocha, semangka, dan melon), menggunakan PRSV isolat Medan, Aceh, dan Bogor (Situgede). Inokulasi pada uji kisaran inang dilakukan secara mekanis. Tanaman pepaya yang diinokulasi secara mekanis dengan PRSV menunjukkan gejala yang khas dan jelas, yaitu mosaik, pemucatan tulang daun, penebalan tulang daun, penebalan lamina daun, daun berbentuk seperti tali, bercak hijau seperti berminyak pada batang dan tanaman menjadi kerdil. Tanaman Cucurbitaceae menunjukkan gejala yang lebih ringan. Hasil uji kisaran inang menunjukkan bahwa semua varietas pepaya dapat diinfeksi oleh PRSV isolat Medan, Aceh, dan Bogor. PRSV isolat Medan dan Aceh mampu menginfeksi tanaman mentimun, mentimun jepang, semangka, dan melon, sedangkan PRSV isolat Bogor hanya berhasil menginfeksi mentimun, mentimun jepang, dan melon. Tanaman kabocha merupakan satu-satunya tanaman yang tidak terinfeksi saat diinokulasi dengan PRSV isolat Medan, Aceh, dan Bogor; sedangkan dengan tanaman semangka tidak dapat diinfeksi oleh PRSV isolat Bogor. Periode inkubasi PRSV pada tanaman pepaya dan Cucurbitaceae, berturut-turut berkisar, 5-14 hari setelah inokulasi (HSI) dan 16-26 HSI. Insidensi penyakit pada tanaman pepaya dan Cucurbitaceae berturut-turut mencapai 100% dan 40-100%, dengan keparahan penyakit berturut-turut berkisar 33.82-77.33% dan 4.55-17.78%. Respons tanaman pepaya berkisar antara sangat rentan hingga agak rentan, sedangkan Cucurbitaceae bersifat tahan dan imun. PRSV dari Medan, Aceh, dan Bogor mampu menginfeksi baik tanaman pepaya maupun dari famili cucurbitaceae, sehingga dapat digolongkan ke dalam PRSV-P.
Hasil uji penularan menggunakan kutudaun, menunjukkan bahwa semakin banyak serangga yang digunakan, semakin tinggi insidensi penyakitnya. Insidensi penyakit tanaman pepaya yang diinokulasi menggunakan 5 dan 10 individu serangga A. gossypii berturut-turut sebesar 13.33% dan 60%, dan yang diinokulasi dengan 10 individu serangga M. persicae sebesar33.33% untuk tanaman pepaya.
Periode inkubasi pada tanaman pepaya var. ‘California’ yang diinokulasi virus menggunakan A.gossypii dengan jumlah serangga 1, 5, dan 10 individu seangga berturut-turut adalah 0, 10-11, dan 6-11 HSI, sedangkan dengan M. persicae
berturut-turut sebesar 0, 0, dan 5-18 HSI.
Bibit pepaya yang ditanam dari biji yang berasal dari buah bergejala PRSV (asal Medan dan Bogor), tidak menimbulkan gejala penyakit dan menunjukkan hasil negatif saat dideteksi menggunakan metode RT-PCR.
SUMMARY
TUTIK HARMIYATI. Host range and transmission of Papaya ringspot virus. Supervised by SRI HENDRASTUTI HIDAYAT and ABDUL MUIN ADNAN.
Papaya (Carica papaya L.) is an important agricultural commodity and it consumes daily by people in Indonesia. Productivity of papaya is very dependent on many factors, among others is pests and diseases. Papaya ringspot virus
(PRSV) is the agent causing ringspot disease and it was reported to cause yield loss on papaya and many Cucurbitaceae plants. According to Decree of Ministry of Agriculture No. 93 of 2011 concerning List of Plant Quarantine Pests, PRSV is still considered as A1 pathogen, which means the pathogen has not been found in any region in Indonesia. However, it has been reported recently that this virus has infected papaya plants in Aceh and Medan with disease incidence up to 100%.
PRSV consists of 2 strains, based on its host range, i.e. PRSV strain P (PRSV-P) and PRSV strain W (PRSV-W). PRSV-P infects papaya and Cucurbitaceae plants, while PRSV-W only infects Cucurbitaceae plants. Symptoms of PRSV infections involves mosaic, vein clearing, vein banding, striped mosaic on the petiole, green spots on the top of the stem, shoestring, rugose, and stunting. This virus can be transmitted to healthy plants mechanically and by insect vectors, but not seed transmitted.
Research was conducted to determine the host range of PRSV through mechanical inoculation on 10 species from 2 families (Caricaceae and Cucurbitaceae), the efficiency of transmission of PRSV through 2 species of aphids i.e Aphis gossypii and Myzus persicae (Order: Hemiptera, Family: Aphididae), and to prove whether PRSV is seed transmissible.
Field observations and samples collection was conducted in Medan (Namo Belin) and Bogor (Ciomas). Sample of PRSV isolates Aceh and Bogor was obtained from the collection of Plant Virology Laboratory (IPB), and PRSV isolate Bali was from collection of Denpasar Agricultural Quarantine (BKP Kelas I Denpasar). All of the isolates was then propagated on papaya var. 'California' by mechanical inoculation to obtain virus inoculum for further experiments.
trunk and stunting. Cucurbitaceae plants showed less severe symptoms than Caricaceae. The host range study indicated that all varieties of papaya was susceptible to all PRSV isolates. PRSV isolates Medan and Aceh was able to infect cucumber, Japanese cucumber, watermelon, and melon; while PRSV isolates Bogor was only able to infect cucumber, Japanese cucumber, and melon. Kabocha is the only plants that can’t be infected by all PRSV isolates, whereas watermelon can’t be infected by PRSV isolates Bogor. The incubation period of PRSV in papaya and Cucurbitaceae was 5-14 days after inoculation (DAI) and 16-26 DAI, respectively. Disease incidence on papaya and Cucurbitaceae reached 100% and 40-100%, respectively with disease severity of 33.82-77.33% and 4.55-17.78%, respectively. Papaya was considered very susceptible to moderately susceptible to PRSV infection, while Cucurbitaceae are resistant and immune. Based on this host range study PRSV from Medan, Aceh, and Bogor is classified into PRSV-P due to its ability to infect both papaya plants and Cucurbitaceae plants.
Transmission study using 2 species of aphids indicated that disease incidence is correlated with the number of insects. The more insects used for transmission, the higher disease incidence achieved and the shortest incubation period occurred. Transmission was occurred when using at least 5 adults of
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Entomologi/Fitopatologi
TUTIK HARMIYATI
KISARAN INANG DAN PENULARAN
Papaya ringspot virus
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Alhamdulillahirrobbil’alamin, puji dan syukur penulis panjatkan kepada
Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Penelitian dengan judul Kisaran Inang dan Penularan
Papaya ringspot virus telah dilaksanakan sejak bulan Juli hingga Desember 2014. Terima kasih penulis ucapkan kepada Prof Dr Ir Sri Hendrastuti Hidayat, MSc selaku ketua program studi sekaligus dosen pembimbing bersama Dr Ir Abdul Muin Adnan, MS, dan Dr Ir Eliza S Rusli, MSi selaku penguji. Ungkapan terima kasih juga penulis sampaikan kepada suami, anak, orangtua, serta seluruh keluarga atas limpahan dukungan, perhatian, semangat dan kasih sayangnya.
Ungkapan terimakasih juga penulis sampaikan kepada Badan Karantina Pertanian (Barantan), Kementerian Pertanian yang telah memberikan beasiswa S2 Karantina sehingga penulis berkesempatan untuk melanjutkan pendidikan di Program Pascasarjana IPB, Ibu Iyar, SP selaku penanggung jawab wilayah kerja Kantor Pos Bogor (BBKP Tanjung Priok) atas bantuan peralatannya, Dr Ir Antarjo Dikin, MSc; Dr Ir Arifin Tasrif, MSi; Dr Ir Eliza S Rusli, MSi; Dr Suryanti, SP, MP; dan Dr Ir Nugroho Susetyo Putra, MSi; yang telah memberikan rekomendasi untuk melanjutkan studi S2 di IPB, Bp Edi Supardi dan Mba Sari Nurulita yang telah banyak membantu pelaksanaan penelitian di laboratorium Virologi, ibu Aisyah di laboratorium Taksonomi Serangga yang telah membantu dalam pelaksanaan identifikasi serangga vektor.
Terimakasih juga penulis ucapkan kepada rekan-rekan di laboratorium Virologi Tumbuhan IPB dan teman-teman 3rd Quarantine SPs yang tidak bisa saya sebutkan satu persatu, terimakasih untuk bantuan, persahabatan dan kekompakannya selama ini.
Semoga karya ilmiah ini bermanfaat.
Bogor, April 2015
DAFTAR ISI
Penyiapan Sampel Tanaman Pepaya Terinfeksi PRSV 9
Analisis susunan Nukleotida 10
Perbanyakan Sumber Inokulum PRSV 11
Identifikasi dan Perbanyakan Kutudaun 11
Uji Kisaran Inang PRSV 12
Deteksi PRSV dengan metode Dot blot Immunobinding Assay
(DIBA) 14
Efisiensi penularan PRSV dengan serangga vektor 15
Uji PRSV Tular Benih 15
Deteksi PRSV dengan metode Double Antibody Sandwich-Enzim
Linked Immunosorbent Assay (DAS-ELISA) 16
Ujian Tular Benih 31
SIMPULAN DAN SARAN 32
Simpulan 32
Saran 33
DAFTAR PUSTAKA 33
LAMPIRAN 38
DAFTAR TABEL
1. Famili, spesies tanaman, dan umur tanaman yang digunakan
dalam pengujian kisaran inang 12
2. Kriteria gejala Papaya ringspot virus untuk menentukan
keparahan penyakit (Pacheco et al. 2003) 13
3. Pengelompokkan ketahanan tanaman terhadap infeksi Papaya
ringspot virus berdasarkan keparahan penyakit 14 4. Tingkat homologi sikuen nukleotida gen CP PRSV isolat
Medan, Aceh, dan Bogor dengan isolat dari daerah dan negara
lain 19
5. Periode inkubasi (PI) dan jenis gejala pada beberapa tanaman
hasil inokulasi Papaya ringspot virus (PRSV) secara mekanis 23 6. Insidensi penyakit (IP), keparahan penyakit (KP), dan respons
tanaman (RT) dari famili Caricaceae dan Cucurbitaceae yang
diinokulasi Papaya ringspot virus (PRSV) secara mekanis 24 7. Pengaruh infeksi PRSV isolat Medan, Aceh, dan Bogor terhadap
prosentase tingkat hambatan relatif (THR) tinggi tanaman pada
famili Caricaceae 27
8. Pengaruh infeksi PRSV isolat Medan, Aceh, dan Bogor terhadap prosentase tingkat hambatan relatif (THR) tinggi tanaman pada
famili Cucurbitaceae 28
9. Periode inkubasi (PI), insidensi penyakit (IP), dan tipe gejala tanaman pepaya California yang diinokulasi Papaya ringspot
virus melalui vektor Aphis gossypii dan Myzus persicae 30
DAFTAR GAMBAR
10. Gejala infeksi PRSV pada tanaman pepaya; (A) gejala pada tajuk, (B) gejala pada buah, (C) gejala pada batang, (D) gejala pada petiol, dan (E) gejala pada daun (Sumber: Gonsalves et al.
2004; Gonsalves et al. 2010; www.hawaiplantdisease.net) 4 11. Gejala infeksi PRSVpada tanaman cucurbit; (A) gejala pada
daun dan (B) gejala pada buah. (Sumber: Gonsalves et al. 2010) 5 12. Partikel PRSV di bawah mikroskop elektron (A) (Sumber:
CABI 2014), dan (B) partikel Potyvirus tunggal (Natsuaki et al.
1994) 5
13. Gejala PRSV pada tanaman pepaya ‘Orange lady’ di Medan (Desa Namo Belin), (A) gejala pada tajuk, (B) gejala pada petiol
(atas) dan batang (bawah), dan (C) gejala pada buah. 17 14. Tanaman pepaya di Bogor (Desa Ciomas), (A) Petiol dan batang
15. Hasil amplifikasi DNA Papaya ringspot virus (PRSV) dengan teknik RT-PCR menggunakan primer spesifik gen CP PRSV 326/PRSV 800. Sampel DNA berasal dari daun pepaya yang diinokulasi secara mekanis dengan: (A) isolat PRSV asal Aceh, dan (B) Bogor (Desa Situgede), serta sampel tanaman bergejala dari lapangan di (C) Medan, (D) Bogor (Desa Ciomas), dan (E) Bali. Penanda DNA (M), (K+) kontrol positif, dan (K-) kontrol
negatif. 18
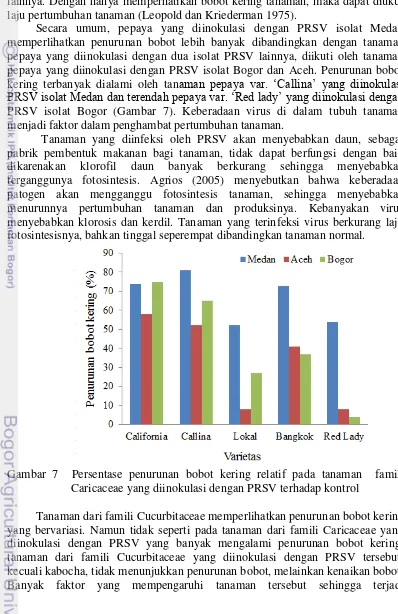
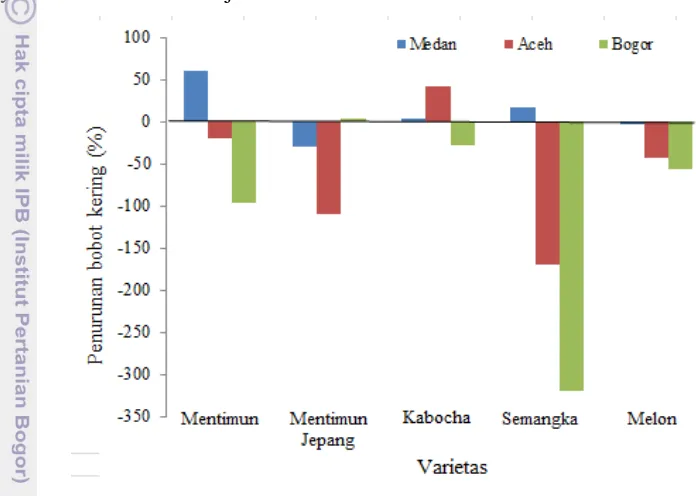
16. Persentase penurunan bobot kering relatif pada tanaman famili
Caricaceae yang diinokulasi dengan PRSV terhadap kontrol 25 17. Persentase penurunan bobot kering relatif pada tanaman famili
Cucurbitaceae yang diinokulasi dengan PRSV terhadap kontrol 26 18. Ciri morfologi A. gossypii (A) imago (aptera), (B) proses
terminal(40x10), (C) sifunkuli (10x10), dan (D) antena tuberkel
(10x10). 29
19. Ciri morfologi M. persicae, (A) imago (aptera), (B) proses terminal(40x10), (C) sifunkuli (10x10), dan (D) antena tuberkel
(10x10). 29
20. Hasil amplifikasi DNA Papaya ringspot virus (PRSV) dengan RT-PCR menggunakan primer PRSV 326/ PRSV 800. Sampel DNA brasal dari daun tanaman pepaya asal biji pepaya
bergejala PRSV dari Medan (M1-5) dan Bogor (B1-5). 31
DAFTAR LAMPIRAN
21. Runutan basa nukleotida gen CP PRSV asal Medan, Aceh, dan
Bogor, dan Bali serta beberapa isolat PRSV asal luar negeri 38 22. Gejala pada pepaya var. ‘California’ yang diinokulasi dengan
PRSV isolat (A dan B) Medan, (C dan D) Aceh, (E dan F)
Bogor, dan (G) kontrol negatif 41
23. Gejala pada pepaya var. ‘Callina’ yang diinokulasi dengan PRSV isolat (A dan B) Medan, (C dan D) Aceh, (E dan F)
Bogor, dan (G) kontrol negatif 41
24. Gejala pada pepaya var. ‘Lokal’ yang diinokulasi dengan PRSV isolat (A dan B) Medan, (C dan D) Aceh, (E dan F) Bogor, dan
27. Hasil deteksi sampel daun famili Caricaceae yang diinokulasi secara mekanis dengan PRSV dengan metode DIBA, warna ungu pada kertas nitroselulose menunjukkan positif, PRSV asal
28. Gejala pada mentimun yang diinokulasi dengan PRSV isolat (A dan B) Medan, (C dan D) Aceh, (E dan F) Bogor, dan (G)
kontrol negatif 45
29. Gejala pada mentimun jepang yang diinokulasi dengan PRSV isolat (A dan B) Medan, (C dan D) Aceh, (E dan F) Bogor, dan
(G) kontrol negatif 45
30. Tanaman kabocha yang diinokulasi dengan PRSV isolat (A dan B) Medan, (C dan D) Aceh, (E dan F) Bogor tidak menunjukkan
adanya gejala PRSV sebagaimana pada (G) kontrol negatif 46 31. Gejala pada semangka yang diinokulasi dengan PRSV isolat (A
dan B) Medan, (C dan D) Aceh, sedangkan yang diinokulasi dengan PRSV Bogor tidak menunjukkan gejala infeksi PRSV (E
dan F), dan (G) kontrol negatif 46
32. Gejala pada melon yang diinokulasi dengan PRSV isolat (A dan B) Medan, (C dan D) Aceh, (E dan F) Bogor, dan (G) kontrol
negatif 47
33. Hasil deteksi sampel daun famili Cucurbitaceae yang diinokulasi secara mekanis dengan PRSV menggunakan metode DIBA, warna ungu pada kertas nitroselulose menunjukkan positif,
PRSV asal Medan (A), Aceh (B), dan Bogor (C), 48 34. Hasil amplifikasi sampel daun bergejala PRSV dengan metode
RT-PCR menggunakan primer spesifik CP DNA PRSV, PRSV
35. Variasi gejala PRSV yang diinokulasi dengan menggunakan vektor M. persicae. (A-C) daun bergejala PRSV, (D) batang
bergejala PRSV, dan (E) daun pepaya sehat 49
36. Variasi gejala PRSV yang diinokulasi dengan menggunakan vektor A. gossyypii. (A-H) daun bergejala PRSV, (I) batang
PENDAHULUAN
Latar Belakang
Pepaya (Carica papaya L., Famili: Caricaceae) merupakan tanaman penting yang banyak ditanam di negara-negara tropik dan subtropik di
seluruh dunia, termasuk Indonesia (Usharani et al. 2013). Indonesia merupakan penghasil pepaya ketiga di dunia pada tahun 2009-2012, setelah India dan Brazil
(FAOSTAT 2014). Tanaman pepaya mudah ditumbuhkan dari biji, buahnya dapat dipanen 9 bulan setelah tanam, dan menghasilkan buah secara terus menerus sepanjang tahun (Manshardt 1992). Pepaya banyak dikonsumsi sebagai buah segar karena dapat memperlancar sistem pencernaan dan kandungan gizinya tinggi. Buah ini mengandung antioksidan (karoten, vitamin C, dan flavonoid), vitamin B (folat dan pantotenat), mineral, dan serat. Pepaya juga menghasilkan enzim papain yang banyak digunakan dalam kebutuhan industri untuk bahan pelunak daging, farmasi, produk kecantikan, kosmetik serta berperan sebagai stabilizer pada pembuatan minuman bir (UF 2012).
Berdasarkan data dari Direktorat Jenderal Hortikultura, produktivitas papaya di Indonesia, dari tahun 2009 sampai 2013, berturut-turut sebesar 80.75, 73.26, 86.68, 77.45, dan 80.44 ton/ha (Kementan 2015).
Banyak faktor yang menjadi pembatas dalam produksi pepaya, satu di antaranya adalah gangguan penyakit tanaman. Beberapa patogen penting yang menginfeksi tanaman pepaya ialah Papaya lethal yellowing virus, Papaya meleira virus, Papaya apical necrosis virus, Papaya ringspot virus, Phytophthora palmivora (penyebab busuk akar), Collectotrichum gloesporiodes (penyebab antraknose pada buah), Pythium sp. (penyebab busuk pangkal batang), Oidium caricae (penyebab embun tepung pepaya), Botryodiplodia theobromae (penyebab kanker batang pepaya) (da Silva et al. 2007), dan Erwinia papayae (Kementan 2006).
Penyakit bercak cincin merupakan penyakit baru pada tanaman pepaya di Indonesia dan banyak mengakibatkan kerugian secara ekonomi. Tennant et al.
(2007) menyatakan bahwa Papaya ringspot virus (PRSV), penyebab penyakit bercak cincin, merupakan salah satu virus yang paling merusak pada tanaman pepaya dan Cucurbitaceae. Tanaman pepaya yang terinfeksi PRSV menunjukkan gejala yang khas, yaitu mosaik menonjol pada daun, klorosis pada lamina daun, garis-garis seperti berminyak pada petiol, dan jika serangan parah daun akan berbentuk seperti tali sepatu (shoestrings). Gonsalves et al. (2010) menambahkan bahwa buah dari tanaman terinfeksi PRSV menunjukkan benjolan mirip dengan buah pada tanaman yang kekurangan Boron dan sering menunjukkan gejala bercak cincin.
2
Infeksi PRSV-P pada tanaman pepaya pertama dilaporkan di Hawai pada tahun 1949 (Jensen 1949). Strain PRSV yang sama kemudian dilaporkan di Thailand pada tahun 1975 (Yeh et al. 1988), bagian tenggara Queensland Australia (1991), Saipan, Kepulauan Mariana Utara dan Guam pada tahun 1994 (Kiritani dan Su 1999), Polinesia pada tahun 2005 (Davis et al. 2005), dan Afrika Utara (Diallo et al. 2007), dengan kehilangan hasil mencapai 100% (Tennant et al. 2007). Strain PRSV yang menginfeksi tanaman dari famili Cucurbitaceae (PRSV-W) dilaporkan di Australia pada tahun 1991 dan Sudan pada tahun 2012 (Gonsalves et al. 2010; Mohammed et al. 2012). Di Indonesia, PRSV telah dilaporkan menginfeksi tanaman pepaya di daerah Aceh dan Medan pada tahun 2012, dengan insidensi penyakit mencapai 100% (Hidayat et al. 2012).
PRSV dapat ditularkan secara mekanis dan melalui banyak spesies kutudaun secara non persisten (Wang et al. 1998; Tripathi et al. 2008), sehingga hanya membutuhkan waktu detik hingga menit untuk dapat ditularkan ke tanaman inang lainnya dan virus tidak bereplikasi di dalam tubuh vektor. Menurut (Kalleshwaraswamy et al. 2005), Aphis gossypii merupakan vektor utama PRSV, diikuti A. craccivora dan Myzus persicae. Penelitian mengenai efisiensi penularan melalui vektor perlu dilakukan untuk mengetahui jumlah individu kutudaun yang sudah mampu menularkan PRSV. Penelitian yang dilakukan oleh Kalleshwaraswamy dan Kumar (2008) menunjukkan bahwa penularan PRSV
pada tanaman pepaya hibrida ‘Surya’ dengan satu individu kutudaun yang dipuasakan 2 jam dengan periode makan akuisisi dan inokulasi masing-masing selama 5 menit, M. persicae, A. gossypii, dan A. craccivora sudah mampu menularkan PRSV berturut-turut sebesar 56%, 48%, dan 30%.
Peraturan Menteri Pertanian Nomor 93/Permentan/OT.140/12/2011 tentang Jenis Organisme Pengganggu Tumbuhan Karantina menggolongkan PRSV sebagai organisme pengganggu tumbuhan karantina (OPTK) kategori A1, yaitu kategori OPT yang belum dilaporkan keberadaannya di wilayah Negara Indonesia (Kementan 2011). Namun, telah ada laporan bahwa PRSV telah ditemukan menginfeksi pertanaman pepaya di beberapa daerah di Indonesia. Hidayat et al. (2012) melaporkan insidensi penyakit PRSV di Aceh dan berdasarkan hasil analisis sikuen nukleotida menunjukkan bahwa PRSV isolat Aceh mempunyai kemiripan yang sangat tinggi (92.7% sampai 94.7%) dengan PRSV asal Filipina dan Thailand. Sebelumnya, peneliti dari Universitas Gadjah Mada, Yogyakarta juga melaporkan bahwa PRSV telah menginfeksi pertanaman pepaya di daerah Sleman, Bantul, Gunung Kidul, dan Kulon Progo, di Daerah Istimewa Yogyakarta (data tidak dipublikasikan). Daerah sebar PRSV di wilayah Negara Indonesia perlu dipastikan, demikian pula dengan sifat-sifat pentingnya seperti kisaran inang dan cara penyebarannya di lapangan.
Perumusan Masalah
1. Apakah isolat PRSV yang berasal dari beberapa daerah di Indonesia memiliki virulensi yang berbeda ?
2. Apakah isolat PRSV yang berasal dari beberapa daerah di Indonesia dapat menginfeksi tanaman dari famili Cucurbitaceae ?
3
4. Apakah ada hubungan antara jumlah kutudaun dengan efisiensi penularan penyakit?
5. Apakah PRSV merupakan patogen tular benih?
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kisaran inang beberapa isolat PRSV melalui pengujian penularan secara mekanis pada 10 jenis tanaman dari 2 famili (Caricaceae dan Cucurbitaceae), efisiensi penularan PRSV melalui 2 spesies kutudaun yaitu A. gossypii dan M. persicae (Ordo: Hemiptera, Famili: Aphididae), dan membuktikan bahwa PRSV tidak dapat ditularkan melalui biji.
Manfaat
Penelitian diharapkan dapat memberikan pengetahuan mengenai sifat-sifat penting PRSV seperti kisaran inang dan penyebarannya di lapangan, sehingga dapat digunakan sebagai dasar untuk menentukan strategi pengendalian.
Hipotesis
1. Isolat PRSV yang berasal dari beberapa daerah di Indonesia dapat menginfeksi tanaman yang termasuk ke dalam famili Caricaceae dan Cucurbitaceae.
2. PRSV isolat Medan bersifat paling virulen dibandingkan dengan PRSV isolat Aceh dan Bogor.
3. Kutudaun M. persicae merupakan vektor yang lebih efektif dalam melakukan penularan PRSV dibandingkan dengan A. gossypii.
4. Semakin banyak jumlah kutudaun yang digunakan untuk penularan, maka semakin tinggi pula insidensi penyakit yang muncul.
5. PRSV tidak dapat ditularkan melalui benih.
TINJAUAN PUSTAKA
Papaya ringspot virus (PRSV) merupakan patogen yang sangat merusak pada tanaman pepaya. Istilah PRSV pertama kali dikenalkan oleh Jensen di Hawai pada tahun 1949. Awalnya penyakit ini dikenal sebagai mosaik pepaya (disebabkan oleh Papaya mosaic virus) dan mosaik semangka (disebabkan oleh
4
Gejala Infeksi PRSV
Gejala pada tanaman pepaya
Semua stadia tanaman pepaya rentan terhadap infeksi PRSV dan pada umumnya gejala akan muncul 2 sampai 3 minggu setelah inokulasi. Tanaman muda yang terinfeksi tidak akan pernah menghasilkan buah namun jarang sekali yang ditemukan mati karena penyakit ini. Beberapa isolat PRSV di Taiwan dapat menyebabkan layu dan kadang-kadang menyebabkan kematian pada tanaman muda (Gonsalves 1993).
Tanaman pepaya yang terinfeksi PRSV menunjukkan gejala yang khas, yaitu mosaik menonjol pada daun, klorosis pada lamina daun, dan garis-garis seperti berminyak pada tangkai daun (Gambar 1). Tanaman yang terinfeksi parah menunjukkan adanya perubahan bentuk daun seperti tali (shoestrings) serta menyerupai kerusakan akibat serangan tungau. Tanaman yang terinfeksi ketika masih muda menjadi kerdil dan tidak akan menghasilkan buah. Buah dari tanaman terinfeksi PRSV menunjukkan benjolan mirip dengan buah pada tanaman yang kekurangan unsur hara Boron dan sering menunjukkan 'bercak cincin'. PRSV isolat Taiwan memperlihatkan gejala nekrosis sistemik dan layu bersamaan dengan mosaik dan klorosis pada tanaman pepaya (Gonsalves et al. 2010).
Gambar 1 Gejala infeksi PRSV pada tanaman pepaya; (A) gejala pada tajuk, (B) gejala pada buah, (C) gejala pada batang, (D) gejala pada petiol, dan (E) gejala pada daun (Sumber: Gonsalves et al. 2004; Gonsalves et al.
2010; www.hawaiplantdisease.net) Gejala pada tanaman Cucurbitaceae
5
berkembang. Tanaman tua yang terinfeksi akan menghasilkan buah, namun buahnya akan mengalami malformasi (salah bentuk) dan perubahan warna pada kulitnya (Gambar 2).
Gambar 2
Gejala infeksi PRSVpada tanaman cucurbit; (A) gejala pada daun dan (B) gejala pada buah. (Sumber: Gonsalves et al. 2010)
Sifat Biologi dan Ekologi PRSV
Sifat PRSV
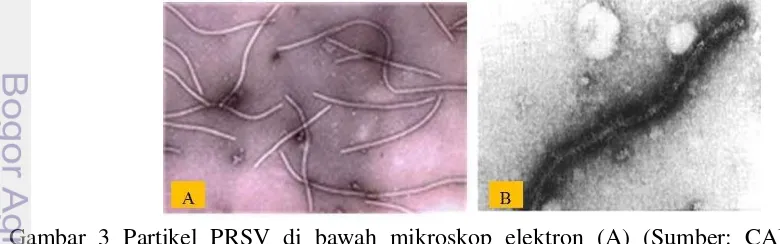
PRSV digolongkan ke dalam genus Potyvirus (Famili: Potyviridae), memiliki sinonim papaya distortion mosaic virus, papaya distortion ringspot virus, papaya leaf distortion virus, dan papaya ringspot potyvirus (CABI 2014). Kelompok Potyvirus merupakan kelompok virus tanaman terbesar dan berperan penting dalam menimbulkan kerugian. Semua anggota dari genus tersebut memiliki virion berbentuk filamen dan fleksibel (Gibbs et al. 2008). Natsuaki et al. (1994) melaporkan bahwa partikel Potyvirus berbentuk seperti benang, memanjang (filamentous) dan lentur (flexuous) (Gambar 3b), dan Siregar (2013) melaporkan bahwa partikel tersebut berukuran 760-800x12 nm dengan genom monopartit beruntai tunggal RNA positif. CABI (2014) menyebutkan bahwa partikel virus mengandung 94.5% protein dan 5.5% asan nukleat, serta tidak mempunyai protein amplop (non-enveloped).
Gambar 3 Partikel PRSV di bawah mikroskop elektron (A) (Sumber: CABI 2014), dan (B) partikel Potyvirus tunggal (Natsuaki et al. 1994)
Kisaran Inang PRSV
PRSV merupakan salah satu spesies dari genus Potyvirus yang tersebar luas di seluruh dunia dan dibedakan menjadi 2 strain berdasarkan kisaran inangnya
6
yaitu PRSV strain P (PRSV-P) yang mampu menginfeksi tanaman pepaya dan Cucurbitaceae, dan PRSV strain W (PRSV-W) yang hanya dapat menginfeksi Cucurbitaceae. Infeksi kedua strain tersebut dapat mengurangi hasil dan kualitas buah (Bateson et al. 1994).
Penularan PRSV
PRSV dapat ditularkan secara mekanis maupun melalui serangga vektor, namun tidak dapat ditularkan melalui benih.
Penularan secara mekanis. PRSV dapat ditularkan antar tanaman melalui kegiatan mekanis seperti perompesan (pruning) Wikipedia 2014). Green dan Kim (1994) melaporkan bahwa pada banyak kasus, efisiensi penularan cairan perasan tanaman berkisar antara 60-80%. Kelaniyangoda dan Madhubashini (2008) juga melaporkan bahwa cairan perasan tanaman yang ditularkan ke bibit pepaya menunjukkan keberhasilan sebesar 80% karena dari 20 bibit terdapat 16 bibit yang bereaksi positif saat dilakukan deteksi menggunakan metode Indirect-ELISA. Penelitiannya menunjukkan bahwa gejala akan muncul 3 minggu setelah inokulasi.
Penularan oleh vektor kutudaun. Sebagaimana Potyvirus lainnya, PRSV ditularkan oleh kutudaun secara non persisten (Jensen 1949), virus diperoleh dan ditularkan oleh vektor dalam jangka waktu yang singkat, hanya dalam ukuran detik hingga menit dan tidak bereplikasi di dalam tubuh vektor. Protein
amorphous inclusion (AI), protein komponen pembantu yang merupakan produk dari gen HC-Pro, diperlukan untuk keberhasilan penularan virus ini (Gonsalves et al. 2010). PRSV terbawa stilet dan ditularkan oleh banyak spesies kutu daun, terutama M. persicae dan A. gossypii. Akuisisi dan penularan partikel PRSV terjadi dalam waktu yang singkat (Maia et al. 1996). Beberapa spesies kutudaun seperti A. nerii Boyer de Fonscolombe, A. gossypii Glover, A.spiraecola Patch, M. persicae Sulzer, Toxoptera aurantii Boyer de Fonscolombe, A. craccivora Koch, dan Rhopalosiphum maidis Fitch dilaporkan dapat menularkan PRSV. Kutudaun yang banyak ditemui pada tanaman pepaya adalah A. gossypii, A.craccivora dan
M. persicae (Kalleshwaraswamy dan Kumar 2008).
Keberhasilan penularan sangat ditentukan oleh rentang waktu dari periode makan akuisisi sampai dengan waktu penularan. Kemampuan A. gossypii, A.craccivora, dan M. persicae setelah 5 menit dari periode makan akuisisi masih mampu menularkan PRSV berturut-turut, 17.5%, 12.5%, dan 22.5%. M. persicae
masih dapat menularkan PRSV setelah 30 menit dari periode makan akuisi, namun efisiensi penularannya berkurang dan hanya mampu menularkan PRSV sebesar 5% (Kalleshwaraswamy dan Kumar 2008).
7
kauda kehitaman (Blackman dan Eastop 2000). Kutudaun ini tersebar di seluruh dunia, dengan warna tubuhnya bervariasi seperti hijau kehitaman atau kuning kecokelatan (Kalshoven 1981), hijau pucat, kuning kehitaman, dan sering berwarna hijau terang (Cottier 1953). Bagian posterior abdomen berwarna kuning atau lebih gelap dari bagian lainnya, kadang-kadang seluruh abdomen berwarna kekuningan atau kehitaman. Pelat anal berwarna sama dengan kauda, tetapi pelat genitalnya berwarna kehitaman, lebih terang dibandingkan pelat anal. Femur tungkai belakang berwarna kehitaman, sedangkan femur tungkai tengah dan depan tidak terlalu kehitaman.
Kepala berwarna hijau kekuningan agak pucat sampai dengan hijau kehitaman, dan kadang-kadang hijau tua. Mata berwarna merah gelap sampai hampir hitam. Rostrum bagian tengah berwarna kekuningan sampai hijau kekuningan. Antena ruas pertama dan kedua tidak berwarna, sering kali berwarna cokelat terang sama seperti warna kepala, ruas ke tiga hampir berwarna, sering virus tanaman secara non persisten pada buncis, kacang polong, kubis-kubisan, seledri, kacang tunggak, mentimun, dahlia, selada, bawang, pepaya, cabai, kedelai, stroberi, kentang, tembakau dan tulip. Selain itu kutu daun ini dapat menularkan virus tanaman secara persisten terhadap Cotton anthocyanosis virus, Lyli rosette virus, dan Pea enation mosaic virus.
M. persicae memiliki nama umum green peach aphid (CABI 2014). Kutudaun ini berbadan lunak, berbentuk seperti pir yang kadang-kadang tidak bersayap dan memiliki panjang kira-kira 0.16 cm. Betina tidak bersayap berwarna kuning kehijauan pucat. Individu yang memiliki sayap memiliki abdomen berwarna hijau kekuningan dengan bercak berwarna hitam. Kedua bentuk tersebut memiliki sepasang tailpipe seperti appendages yang disebut dengan kornikel.
Nimfa lebih kecil dibanding dengan dewasa namun memiliki bentuk yang sama, berwarna hijau kekuningan dan pucat dengan 3 garis berwarna gelap pada abdomennya. Semua stadia dapat dikenali dari bentuk tuberkel bagian depan (di dalam bagian depan kepala, pada bagian bawah antena) (Anonim 2014).
Kutudaun ini merupakan hama yang sangat merusak dan memiliki kisaran inang yang luas. Banyak laporan bahwa kutudaun ini dapat menjadi vektor lebih dari 100 virus tanaman dan dikenal sebagai vektor yang paling efisien dalam menularkan virus di antara spesies serangga lainnya. Beberapa virus yang sering ditularkan adalah Cucumber and celery mosaic virus, Potato leaf roll virus,
Potato virus Y, Beet western yellowsvirus (dan Beet yellow viruses lainnya),
8
Penularan melalui benih. Sejumlah penelitian gagal membuktikan bahwa PRSV dapat ditularkan melalui benih pepaya maupun Cucurbitaceae (Purcifull et al. 1984). Namun demikian, penelitian yang dilakukan oleh Bayot et al. (1990) menunjukkan bahwa 2 dari 1355 bibit pepaya dari buah yang terinfeksi PRSV menunjukkan adanya infeksi PRSV; sedangkan Laney et al. (2012) melaporkan bahwa insidensi penyakit mencapai 50% melalui biji Black locust (Robinia pseudoacacia L.). Dengan demikian, penularan PRSV melalui benih dianggap tidak berpengaruh nyata terhadap penyebaran PRSV (Gonsalves 1998).
Kerugian Akibat Infeksi PRSV
Keberadaan PRSV-P sangat merugikan terutama untuk negara-negara penghasil pepaya. PRSV dapat menyebabkan kehilangan hasil antara 40-90% tergantung pada waktu infeksi dan umur tanaman (Awasthi et al. 2011). Bahkan Tennant et al. (2007) menyatakan bahwa PRSV dapat menyebabkan kehilangan hasil sampai dengan 100% di beberapa negara penghasil pepaya.
Infeksi PRSV-P di Taiwan pertama kali tercatat pada tahun 1975 dan dalam waktu 4 tahun, virus telah menghancurkan sebagian besar pertanaman pepaya di sepanjang pantai barat pulau Taiwan. Total hasil pepaya turun dari 41 595 ton tahun 1974 menjadi 18 950 ton pada tahun 1977 (Yeh et al. 1988). Daerah Tagalog bagian selatan, Filipina, tempat virus itu pertama kali terdeteksi pada tahun 1982, produksi pepaya berkurang drastis dari 36 000 ton pada tahun 1981 menjadi 10 000 ton pada tahun 1987 (Bayot et al. 1990). Di Brazil, penyakit yang disebabkan oleh PRSV-P menyebabkan hampir semua tanaman pepaya di negara bagian Sao Paulo (Brazil) mati. Daerah pertanaman pepaya di negara bagian tersebut pada tahun 1977 mencapai 7 188 ha, namun pada tahun 1980 menurun hingga menjadi 4 374 ha, tahun 1986 menjadi 906 dan pada tahun 1989 tinggal 234 ha.
Deteksi Virus
Deteksi virus penyebab penyakit pada tanaman, benih, atau bahan vegetatif sangat diperlukan dalam strategi pengendalian penyakit. Pengamatan gejala merupakan langkah awal dalam diagnosis penyebab penyakit oleh virus. Namun, pengamatan gejala saja tidak cukup akurat untuk menentukan virus penyebab suatu penyakit karena gejala yang diduga disebabkan oleh virus bisa saja disebabkan oleh patogen lain, toksisitas serangga, maupun pengaruh faktor abiotik misalnya kekurangan dan kelebihan unsur hara, stres lingkungan dan sebagainya (Agrios 2005).
9
(Sreenivasulu dan Gopal 2010). Ruiz-Castro dan Silva-Rosales (1997) melaporkan bahwa Reverse Transcription and Polymerase Chain Reaction (RT-PCR) menunjukkan hasil yang dapat diandalkan untuk mendeteksi PRSV dalam sampel pepaya. Dot immune binding assay (DIBA) berguna untuk pengindeksan virus, karena metode ini sederhana dan murah untuk deteksi virus skala besar (Smith dan Banttari 1987). RT-PCR diidentifikasi sebagai metode diagnosis yang penting dan cepat bagi PRSV. Berdasarkan beberapa hal di atas, maka dapat disimpulkan bahwa keberadaan PRSV dapat dikonfirmasi dengan beberapa metode diagnosis molekuler seperti ELISA, Immuno-capture RT-PCR, RT-PCR, dan DIBA. Pemilihan metode deteksi disesuaikan dengan kebutuhan.
BAHAN DAN METODE
Tempat dan Waktu
Penelitian dilaksanakan dari bulan Juli sampai Desember 2014. Perbanyakan sumber inokulum virus dan serangga vektor, uji kisaran inang, uji efisiensi penularan oleh serangga vektor, dan uji virus tular benih dilaksanakan di Rumah Kaca Cikabayan, IPB; deteksi virus dilakukan di Laboratorium Virologi Tumbuhan, IPB; identifikasi serangga vektor dilakukan di Laboratorium Taksonomi Serangga, IPB; dan pengeringan tanaman dilakukan di Laboratorium Toksikologi Serangga, IPB dan Wilayah Kerja Kantor Pos Bogor, BBKP Tanjung Priok.
Metode Penelitian
Penyiapan Sampel Tanaman Pepaya Terinfeksi PRSV
Pengamatan dan pengambilan sampel tanaman yang bergejala dilakukan di lahan pepaya milik petani di Medan (Desa Namo Belin) dan lahan percobaan Pusat Kajian Hortikultura Tropika (PKHT)-Bogor (Desa Ciomas). Daun pepaya asal Desa Namo Belin yang dikumpulkan sebagai sampel adalah daun yang menunjukkan gejala mosaik, malformasi daun, dan didukung dengan mosaik hijau bergaris pada petiolnya, sedangkan sampel dari Desa Ciomas adalah buah yang menunjukkan gejala bercak cincin. Sampel daun bergejala PRSV juga diperoleh dari koleksi Laboratorium Virologi Tumbuhan, IPB, yaitu PRSV isolat Aceh (Desa Lambaro) dan Bogor (Desa Situgede), dan BKP Kelas II Denpasar (PRSV isolat Bali). Sebagian sampel daun disimpan pada suhu -80⁰C dan sebagian lagi digunakan sebagai sumber inokulum untuk perbanyakan inokulum virus (PRSV isolat Medan, Aceh, dan Bogor).
Deteksi PRSV dengan metode Reverse-Transcription Polymerase Chain Reaction (RT-PCR). Sampel daun dan buah bergejala dari lapangan digunakan untuk dekteksi PRSV secara molekuler dengan RT-PCR yang terdiri atas empat tahapan, yaitu ekstraksi RNA total, sintesis DNA komplemen (cDNA), amplifikasi DNA target, dan visualisasi hasil amplifikasi.
10
Doyle 1987). Sebanyak 0.1 g daun tanaman bergejala digerus menggunakan nitrogen cair dan ditambah dengan 500 µL bufer ekstraksi yang mengandung 1% 2-β-mercaptoethanol yang sebelumnya telah diinkubasikan pada suhu 65ºC selama 10 menit. Hasil gerusan dimasukkan ke dalam tabung mikro 1.5 mL dan diinkubasi dalam penangas air pada suhu 65ºC selama 30 menit, dan dibolak– balik setiap 10 menit sekali untuk membantu proses lisis. Setelah diinkubasi, tabung diangkat dan didiamkan selama 2 menit pada suhu ruang, kemudian ditambahkan dengan 500 µL campuran Chloroform:Isoamilalcohol (24:1). Tabung dibolak-balik selama 5 menit dan disentrifugasi dengan kecepatan 13 000 rpm selama 10 menit. Supernatan diambil dan ditempatkan ke dalam tabung mikro yang baru, dan ditambah Isopropanol dengan volume yang sama dengan supernatan yang diperoleh. Tabung dibolak balik kemudian disentrifugasi dengan kecepatan 13 000 rpm selama 5 menit. Supernatan dibuang dan ditambahkan 500µL etanol 70% pada pelet RNA, selanjutnya disentrifugasi dengan kecepatan 13 000 rpm selama 5 menit. Etanol dibuang, pelet RNA dikeringkan dengan meletakkan tabung pada posisi terbalik. Pelet RNA yang diperoleh dilarutkan dalam 50 µL bufer TE 1x(10 mM Tris-HCl pH 8.0 mM EDTA) dan siap digunakan sebagai templet dalam reaksi transkipsi balik.
Sintesis cDNA. RNA hasil ekstraksi digunakan sebagai templet dalam reaksi transkripsi balik untuk menghasilkan cDNA. Setiap 10 µL reaksi transkripsi balik terdiri atas 2 µL bufer RT, 0.50 µL dNTP 10 mM, 0.35 µL DTT 50 mM, 0.35 µL RNAse Inhibitor (Thermo Scientific, US), 0.35 µL M-MuLV protein selubung PRSV yaitu PRSV326(‘5 TCGTGCCACTCAATCACAAT-3’) sebagai primer F dan PRSV800(5’-GTTACTGACACTGCCGTCCA-3’) sebagai primer R, dengan target amplikon berukuran ±475 pb. Amplifikasi cDNA dimulai dengan tahapan predenaturasi pada suhu 94 ºC selama 5 menit sebanyak 1 siklus. Tahapan selanjutnya sebanyak 35 siklus yang terdiri atas denaturasi pada 94 ºC selama 30 detik, penempelan pada 50 ºC selama 1 menit, ekstensi pada 72 ºC selama 1 menit, ekstensi final pada 72 ºC selama 7 menit.
Visualisasi DNA. DNA hasil amplifikasi dianalisis pada gel agarosa 1% yang dilarutkan dalam bufer 0.5xTris-Borate EDTA (TBE). Elektroforesis dilakukan dengan tegangan 50 volt selama 50 menit, selanjutnya direndam dalam larutan Etidium bromida 1% selama 15 menit. Visualisasi DNA dilakukan di bawah UV transluminator dan didokumentasikan dengan kamera digital. Sampel dikatakan positif, saat muncul pita DNA.
Analisis susunan Nukleotida
11
Informatio (www.ncbi.nlm.nih.gov). Hasil sikuen nukleotida tersebut dibandingkan dengan sikuen nukleotida virus asal negara lain yang terdaftar di
GenBank. Tingkat homologi nukleotida diperoleh dengan program ClustalW multiple alignment dan Sequences Identity Matrix menggunakan perangkat lunak BioEdit7.05.
Perbanyakan Sumber Inokulum PRSV
Perbanyakan sumber inokulum virus dilakukan untuk 4 isolat PRSV, yaitu Medan, Aceh, Bogor (Situgede), dan Bali pada tanaman pepaya var. ‘California’ yang berumur 3-4 minggu dengan metode inokulasi secara mekanis. Sebanyak 2 daun pertama dari tanaman pepaya sehat ditaburi karborondum 600 mesh dan diolesi dengan sap tanaman terinfeksi PRSV. Pengolesan dilakukan menggunakan jari telunjuk, karena jari telunjuk ini sangat sensitif sehingga penekanan ke permukaan daun dapat diperkirakan dan tidak menyebabkan luka yang terlalu dalam di permukaan daun (Dijkstra dan De Jager 1998). Sap tanaman diperoleh dengan cara menggerus daun tanaman sakit dalam bufer fosfat yang mengandung 1% β-mercaptoethanol dengan perbandingan 1:5 (b/v). Setelah inokulasi, daun dibilas dengan air mengalir. Tanaman yang telah diinokulasi dipelihara selama beberapa hari sampai muncul gejala.
Identifikasi dan Perbanyakan Kutudaun
Kutudaun yang digunakan dalam penelitian ini adalah A. gossypii dan
M.persicae (Ordo: Hemiptera, Famili: Apididae). A. gossypii diperoleh dari tanaman cabai dan M. persicae diperoleh dari tanaman kubis di daerah Bogor.
12
kuteks untuk menjaga agar gelas penutup tidak bergeser. Setelah itu, diamati di bawah mikroskop kompon.
Perbanyakan Kutudaun. A. gossypii diperbanyak pada tanaman cabai dan
M. persicae diperbanyak pada tanaman brokoli. Tanaman tersebut ditanam pada polibag berukuran 35x35 cm dengan media tumbuh terdiri atas campuran tanah steril dan pupuk kandang steril dengan perbandingan 2:1 dan dimasukkan ke dalam kurungan pemeliharaan serangga.
Imago kutudaun yang akan dibiakkan, terlebih dahulu dibebasviruskan pada daun talas (tanaman bukan inang) yang sehat. Daun talas dicuci, kemudian tangkai daun dibalut dengan kapas basah dan diletakkan ke dalam cawan petri, satu cawan berisi satu kutudaun. Kutudaun diposisikan di bawah permukaan daun talas dengan menggunakan kuas yang telah dibasahi. Setelah itu, cawan ditutup dan dibiarkan hingga kutudaun menghasilkan nimfa. Nimfa yang baru lahir tersebut dipindahkan ke daun tanaman inang sehat dan dibiarkan berkembangbiak. Kutudaun inilah yang kemudian digunakan untuk pengujian selanjutnya. Kutudaun yang baru lahir selalu bebas dari virus (Dijkstra dan De Jager 1998). Uji Kisaran Inang PRSV
Uji kisaran inang dilakukan pada 5 varietas pepaya, yaitu ‘California’,
‘Callina’, ‘Lokal’, ‘Bangkok’, dan ‘Red Lady’; serta 5 jenis tanaman dari famili Cucurbitaceae, yaitu timun (Cucumis sativus), timun jepang var. ‘Roberto’, kabocha (Cucurbita pepo) var. ‘Golden Mama’, semangka (Citrulus lunatus) var.
‘Gadjah’, dan melon (Cucumis melo) var. ‘reticulatus’. Tanaman tersebut Caricaceae Pepaya (Carica papayaL.) var.‘California’ 26
Pepaya var. ‘Callina’ 26
Pepaya var. ‘Lokal’ 26
Pepaya var. ‘Bangkok’ 26
Pepaya var. ‘Red lady’ 26
Cucurbitaceae Timun (Cucumis sativus) 10
Timun Jepang var. ‘Roberto’ 10
13
Inokulasi dilakukan secara mekanis yaitu dengan menggunakan sari air perasan (sap) tanaman sakit seperti yang diuraikan sebelumnya. Jumlah tanaman yang diinokulasi sebanyak 5 tanaman untuk setiap spesies tanaman. Kontrol negatif merupakan tanaman sehat. Deteksi PRSV dilakukan 2 minggu dan 4 minggu setelah inokulasi dengan metode DIBA menggunakan antiserum PRSV (Agdia, Inc).
Pengamatan. Pengamatan dilakukan terhadap periode inkubasi, jenis gejala yang muncul, insidensi penyakit, keparahan penyakit, tinggi tanaman, dan bobot kering tanaman. Periode inkubasi ditentukan pada saat pertama gejala muncul. Insidensi penyakit dihitung menggunakan rumus:
IP = n ×100% N
IP : insidensi penyakit
N : jumlah tanaman yang sakit
N : jumlah seluruh tanaman yang diinokulasi
Jumlah tanaman yang sakit didasarkan pada hasil deteksi PRSV menggunakan metode DIBA yang merujuk pada metode Mahmood et al. (1997). Keparahan penyakit dihitung dengan rumus:
N : jumlah sampel untuk setiap kategori serangan V : nilai skor untuk setiap kategori serangan N : jumlah sampel yang diamati
Z : nilai skor tertinggi dalam kategori serangan
Keparahan penyakit diukur dengan skoring (Tabel 2). Pengelompokan repons varietas tanaman dilakukan menggunakan kriteria ketahanan (Tabel 3).
Tabel 2 Kriteria gejala Papaya ringspot virus untuk menentukan keparahan
3 Mosaik parah/sebagian besar lamina daun menguning, penebalan tulang daun 4 Daun berbentuk tali dan tanaman kerdil
14
Tabel 3 Pengelompokkan ketahanan tanaman terhadap infeksi Papaya ringspot virus berdasarkan keparahan penyakit
Respons Gejala Keparahan Penyakit (KP)
Imun Tidak bergejala KP = 0%
Tahan Ringan 1% < KP ≤ 25
Agak rentan Sedang 26% < KP ≤ 50%
Rentan Berat 51% < KP ≤ 75%
Sangat rentan Sangat berat KP ≥ 75%
Tingkat hambatan relatif infeksi PRSV terhadap tinggi tanaman. Persentase hambatan relatif (THR) infeksi PRSV terhadap tinggi tanaman perlakuan terhadap kontrol dihitung dengan rumus:
THR = K-P X 100% K
THR : tingkat hambatan tinggi tanaman relatif K : tinggi tanaman kontrol
P : tinggi tanaman perlakuan
Penurunan Bobot Kering Tanaman. Tanaman yang digunakan pada uji kisaran inang dipanen setelah 4 minggu pengamatan. Bobot segar ditimbang sebelum dilakukan pengeringan menggunakan oven. Tanaman dimasukkan ke dalam amplop kertas dan dikeringkan dengan oven pada suhu 70⁰C selama 72 jam (sampai tanaman benar-benar kering). Tanaman yang sudah kering ditimbang kembali untuk mengetahui bobot kering. Persentase penurunan relatif bobot kering tanaman perlakuan terhadap kontrol dihitung:
Deteksi PRSV dengan metode Dot blot Immunobinding Assay (DIBA)
15
digoyang dengan kecepatan 50 rpm selama 180 menit atau sampai dengan membran bersih dari sap tanaman. Membran dicuci sebanyak 5 kali dengan 0.05% Tween 20 dalam TBS (TBST). Membran direndam dalam TBS yang mengandung 1st antibodi PRSV ditambah susu bebas lemak dengan konsentrasi akhir 2% dan diinkubasikan selama semalam sambil digoyang dengan kecepatan 50 rpm. Membran nitroselulosa dicuci dengan TBST sebanyak 5 kali dan direndam kembali dalam 5 mL TBS yang mengandung 5 µ L GAR (goat anti rabbit) ditambah dengan susu bebas lemak dengan konsentrasi akhir 2%, diinkubasi selama 60 menit sambil digoyang dengan kecepatan 50 rpm. Membran dicuci kembali dengan TBST sebanyak 5 kali dan direndam selama 5 menit (ditunggu sampai tetesan sap pada membran berubah warna menjadi ungu) dalam 10 mL bufer substrat (Tris-HCl 0.1 M, NaCl 0.1 M, dan MgCl2 5 mM) yang
mengandung 45 µL nitro blue tetrazolium (NBT) dan 35 µL bromo chloro indolil phosphate (BCIP). Perendaman dihentikan saat membran nitroselulosa yang ditetesi dengan sap tanaman berubah warna menjadi ungu. Reaksi perubahan warna dapat dihentikan dengan merendam membran dalam dH2O.
Efisiensi penularan PRSV dengan serangga vektor
Uji efisiensi penularan PRSV dengan serangga vektor dilakukan pada
pepaya var. ‘California’ dan digunakan PRSV isolat Medan. Imago kutudaun A. gossypii dan M. persicae digunakan sebagai vektor penularan PRSV secara non persisten.
Sejumlah imago kutudaun dipindahkan ke dalam cawan petri dengan menggunakan kuas gambar yang dibasahi air dan dipuasakan selama 1 jam, kemudian kutudaun dipindahkan ke tanaman bergejala PRSV selama 10 menit guna memperoleh periode makan akuisisi. Ciri kutudaun yang telah menusukkan stiletnya ke dalam jaringan tanaman adalah antenanya mengarah ke belakang dan labium menempel pada tanaman. Pada saat tersebut, kutudaun telah melakukan pengambilan makanan dan periode makan akuisisi sudah dapat mulai dihitung. Kutudaun kemudian dipindahkan ke tanaman sehat berumur 3-4 minggu setelah semai (MSS). Kutudaun yang digunakan sebanyak 1, 5, dan 10 imago per tanaman uji. Setiap perlakuan diulang sebanyak 5 kali, setiap ulangan terdiri atas 3 tanaman, dengan satu kontrol. Perlakuan pada tanaman kontrol sama dengan tanaman uji lainnya, hanya saja periode makan akuisisi dilakukan pada tanaman sehat. Kutudaun dibiarkan pada tanaman uji tersebut selama 10 menit (periode makan inokulasi), setelah itu kutudaun dimatikan secara mekanis.
Pengamatan. Pengamatan dilakukan setiap hari sejak hari pertama sampai satu bulan setelah inokulasi. Pengamatan dilakukan terhadap gejala yang muncul, waktu inkubasi, dan insidensi penyakit. Waktu inkubasi dihitung sejak tanaman tersebut diinokulasi virus melalui serangga vektor sampai dengan memunculkan gejala. Insidensi penyakit dihitung dengan cara menghitung jumlah tanaman yang menunjukkan gejala dibagi dengan total tanaman yang diamati dan dikalikan 100%.
Uji PRSV Tular Benih
16
penelitian ini berupa biji pepaya (C. papaya L.) yang dihasilkan dari buah yang bergejala PRSV. Buah pepaya bergejala diambil dari lahan petani di Medan (Desa Namo Belin) dan Bogor (Desa Situgede), kemudian biji diambil dan dijemur agar tidak mudah busuk. Biji pepaya kering, masing-masing diambil 50 biji, direndam pada air hangat (suam-suam kuku) selama semalam, lalu dikecambahkan di dalam kotak persemaian selama ± 15 hari. Biji pepaya yang sudah berkecambah dipindah ke tray penyemaian yang berisi campuran tanah dan kompos (1:2). Saat bibit pepaya sudah muncul dua atau tiga daun, dipindah tanam ke dalam polibag ukuran 25 x 25 cm yang telah diisi dengan campuran tanah dan kompos (2:1). Bibit pepaya dalam polibag disiram setiap dua hari sekali.
Pengamatan. Pengamatan dilakukan terhadap gejala yang muncul pada bibit pepaya selama 1 bulan dan untuk memastikan keberadaan virus di dalam tanaman tersebut, daun tanaman uji dideteksi dengan metode DAS-ELISA dan dikonfirmasi dengan metode RT-PCR (metode seperti yang diuraikan sebelumnya).
Deteksi PRSV dengan metode Double Antibody Sandwich-Enzim Linked Immunosorbent Assay (DAS-ELISA)
DAS-ELISA dilakukan sebagai uji konfirmasi terhadap keberadaan PRSV pada tanaman uji yang digunakan pada uji tular benih. Sampel uji merupakan sampel komposit dari 10 tanaman uji. Deteksi serologi dengan teknik langsung DAS-ELISA dilakukan sesuai dengan prosedur dari produsen antiserum (Agdia Inc.).
Sebanyak 0.5 µL antisera PRSV dicampur ke dalam 100 µL coating buffer
(0.1 g magnesium klorida, 0.2 g sodium azida, dan 97 mL dietanolamini
dilarutkan dalam1000 mL dengan pH akhir 9.8) dan dimasukkan ke plat mikrotiter sebanyak 100 µL tiap sumuran plat kemudian diinkubasikan pada suhu 37 ⁰C selama 2 jam atau -4 ⁰C selama semalam. Selanjutnya plat mikrotiter dicuci sebanyak 6 kali dengan bufer PBST (8 g sodium klorid, 1.15 g tween-20 yang dilarutkan dalam 1 L air dengan pH 7.4), sebanyak 0.1 g jaringan daun pepaya bergejala digerus dalam 1 mL general extract buffer (1.3 g sodium sulfite, 20 g
HASIL DAN PEMBAHASAN
Gejala Infeksi PRSV di Lapangan
Survei dilakukan di lahan pepaya milik petani seluas ± 400 m2 di Medan (Desa Namo Belin) dan pada 114 pohon pepaya di kebun percobaan PKHT-Bogor (Desa Ciomas). Semua tanaman pepaya di Desa Namo Belin menunjukkan gejala berat infeksi PRSV, sedangkan gejala PRSV pada tanaman pepaya di Desa Ciomas. Tanaman pepaya yang terinfeksi PRSV Medan menunjukkan gejala mosaik, klorosis, mosaik memanjang pada petiol, bercak hijau pada batang, dan bercak cincin pada buah (Gambar 4), sedangkan di Desa Ciomas, gejala terlihat pada buah, namun daun, petiol, dan batang tidak menunjukkan adanya gejala sebagaimana pada pepaya yang terinfeksi PRSV di Medan. Tanaman pepaya yang terinfeksi PRSV Medan (Gambar 5).
Gambar 4 Gejala PRSV pada tanaman pepaya ‘Orange lady’ di Medan (Desa Namo Belin), (A) gejala pada tajuk, (B) gejala pada petiol (atas) dan batang (bawah), dan (C) gejala pada buah.
Gambar 5 Tanaman pepaya di Bogor (Desa Ciomas), (A) Petiol dan batang tidak menunjukkan gejala PRSV, (B) bercak cincin pada buah.
18
Deteksi PRSV dengan metode RT-PCR
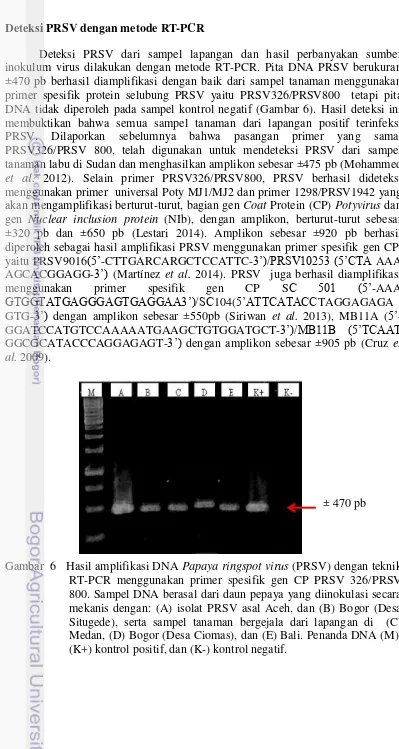
Deteksi PRSV dari sampel lapangan dan hasil perbanyakan sumber inokulum virus dilakukan dengan metode RT-PCR. Pita DNA PRSV berukuran ±470 pb berhasil diamplifikasi dengan baik dari sampel tanaman menggunakan primer spesifik protein selubung PRSV yaitu PRSV326/PRSV800 tetapi pita DNA tidak diperoleh pada sampel kontrol negatif (Gambar 6). Hasil deteksi ini membuktikan bahwa semua sampel tanaman dari lapangan positif terinfeksi PRSV. Dilaporkan sebelumnya bahwa pasangan primer yang sama, PRSV326/PRSV 800, telah digunakan untuk mendeteksi PRSV dari sampel tanaman labu di Sudan dan menghasilkan amplikon sebesar ±475 pb (Mohammed
et al. 2012). Selain primer PRSV326/PRSV800, PRSV berhasil dideteksi menggunakan primer universal Poty MJ1/MJ2 dan primer 1298/PRSV1942 yang akan mengamplifikasi berturut-turut, bagian gen Coat Protein (CP) Potyvirus dan gen Nuclear inclusion protein (NIb), dengan amplikon, berturut-turut sebesar ±320 pb dan ±650 pb (Lestari 2014). Amplikon sebesar ±920 pb berhasil diperoleh sebagai hasil amplifikasi PRSV menggunakan primer spesifik gen CP, yaitu PRSV9016(5’-CTTGARCARGCTCCATTC-3’)/PRSV10253 (5’CTA AAA AGCACGGAGG-3’) (Martínez et al. 2014). PRSV juga berhasil diamplifikasi menggunakan primer spesifik gen CP SC 501 (5’-AAA
GTGGTATGAGGGAGTGAGGAA3’)/SC104(5’ATTCATACCTAGGAGAGA
GTG-3’) dengan amplikon sebesar ±550pb (Siriwan et al. 2013), MB11A (5’ -GGATCCATGTCCAAAAATGAAGCTGTGGATGCT-3’)/MB11B (5’TCAAT GGCGCATACCCAGGAGAGT-3’) dengan amplikon sebesar ±905 pb (Cruz et al. 2009).
Gambar 6 Hasil amplifikasi DNA Papaya ringspot virus (PRSV) dengan teknik RT-PCR menggunakan primer spesifik gen CP PRSV 326/PRSV 800. Sampel DNA berasal dari daun pepaya yang diinokulasi secara mekanis dengan: (A) isolat PRSV asal Aceh, dan (B) Bogor (Desa Situgede), serta sampel tanaman bergejala dari lapangan di (C) Medan, (D) Bogor (Desa Ciomas), dan (E) Bali. Penanda DNA (M), (K+) kontrol positif, dan (K-) kontrol negatif.
19
Perunutan DNA PRSV
Perunutan DNA PRSV hasil amplifikasi memberikan sikuen sepanjang 470pb, 471pb, 470pb, 510pb, dan 472pb, berturut-turut untuk isolat Medan (Desa Namo Belin), Aceh (Desa Lambaro), Bogor (Desa Situgede), Bogor (Desa Ciomas), dan Bali.
Berdasarkan analisis sikuen nukleotida diketahui bahwa PRSV isolat Bali, Aceh, Bogor (Desa Situgede), Medan (Desa Namo Belin), dan Bogor (Desa Ciomas) memiliki homologi yang sangat tinggi satu dengan lainnya (96.5-99.3%). Kemiripan sikuen nukleotida PRSV isolat Bali, Medan, Aceh, dan Bogor (Situgede dan Ciomas) tersebut juga memiliki homologi yang tinggi dengan sikuen nukleotida PRSV dari beberapa negara, seperti Thailand, Australia, Tiongkok, Jepang, Vietnam, dan Taiwan. Homologi tertinggi dan terendah berturut-turut dengan PRSV asal Thailand (95.9-98.3 %) dan PRSV asal Taiwan (91.3-96.1%) (Tabel 4).
Dilaporkan oleh Martínez et al. (2014) bahwa beberapa isolat PRSV dari Brazil memiliki kemiripan yang tinggi (91-100%), demikian pula dengan beberapa isolat PRSV dari Cuba (92-99%). Tingkat homologi yang tinggi menunjukkan kemiripan sikuen gen selubung protein (CP) PRSV dan rendahnya keragaman genetik PRSV di beberapa daerah tersebut. Tingkat kesamaan sikuen nukleotida kelompok Potyvirus berkisar antara 83-99% untuk strain virus yang sama dan 39-53% untuk strain virus yang berbeda (Frenkel et al. 1989). Lebih lanjut Jain et al. (2004) menyatakan bahwa keragaman asam amino dan asam nukleat tertinggi untuk PRSV adalah di antara PRSV isolat Asia. Oleh karena itu, PRSV yang ditemukan menginfeksi tanaman papaya di Aceh, Bogor, Medan, dan Bali merupakan strain PRSV yang sama.
Tabel 4 Tingkat homologi sikuen nukleotida gen CP PRSV isolat Medan, Aceh, dan Bogor dengan isolat dari daerah dan negara lain
No. Asal Isolat Homologi (%)
aTingkat kemiripan urutan basa nukleotida PRSV dihitung menggunakan program Bioedit versi 6.05. b
gen CP PRSV isolat Thailand (AF374862.1), cgen CP PRSV isolat Australia (AF506898.1),
dgen CP PRSV isolat Tiongkok (JN559382.1), egen CP PRSV isolat Jepang (AB583225.1), f PRSV Isolat Vietnam (FN822239.1), dan
20
Kisaran Inang PRSV
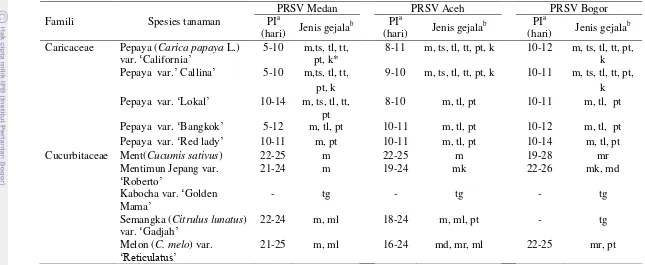
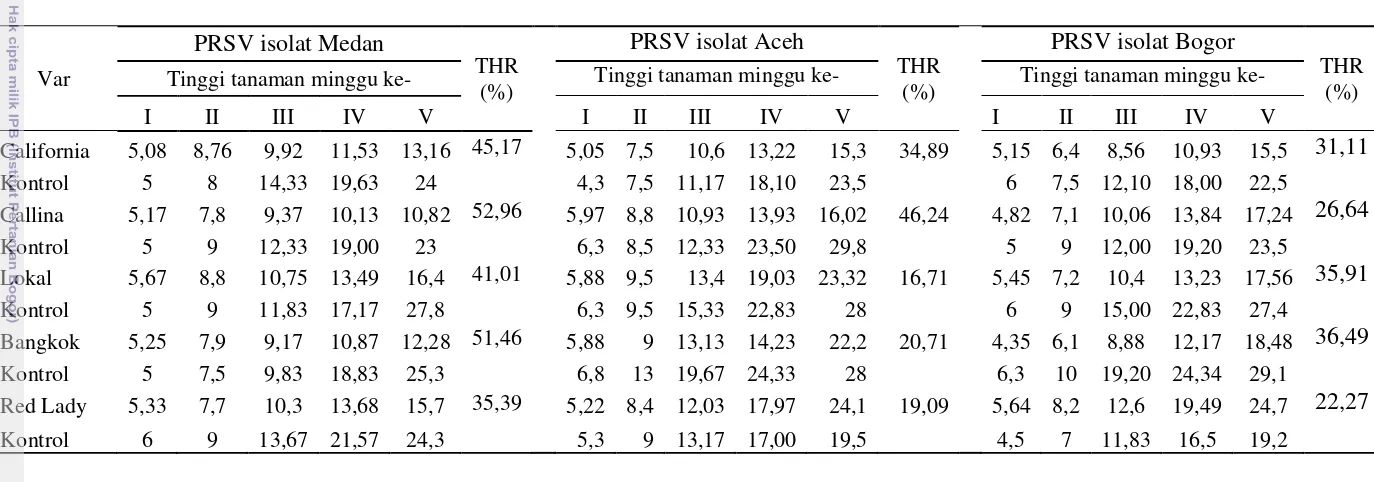
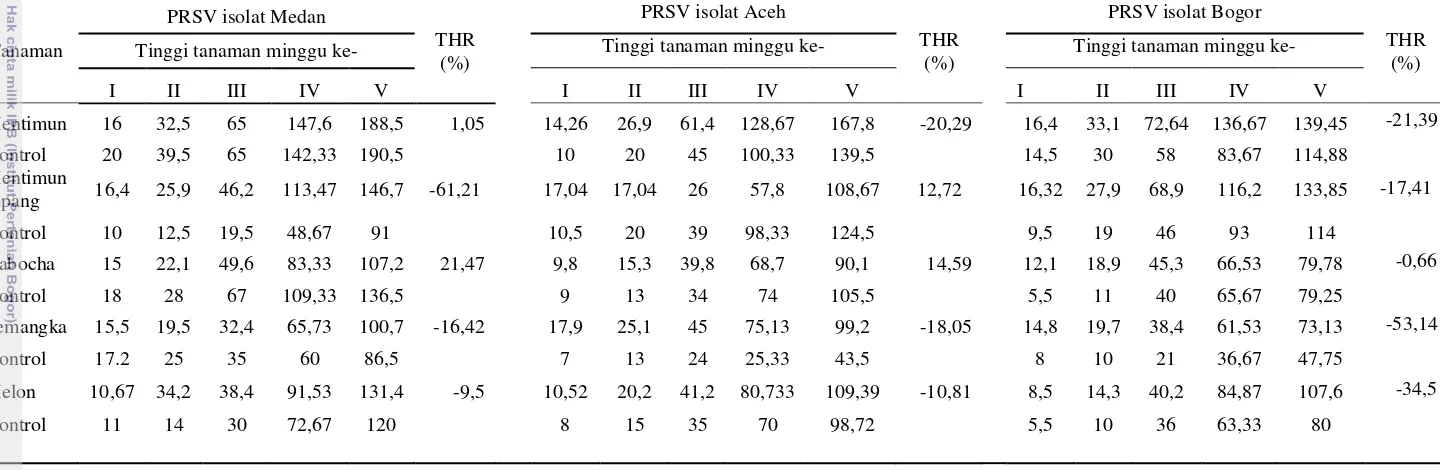
Hasil penularan virus secara mekanis pada 10 jenis tanaman dari famili Caricaceae dan Cucurbitaceae menunjukkan periode inkubasi dan tipe gejala yang berbeda-beda (Tabel 5).
Periode inkubasi PRSV pada famili Caricaceae lebih cepat dibandingkan dengan pada famili Cucurbitaceae. Hari ke-5 setelah inokulasi, tanaman pepaya telah menunjukkan gejala pemucatan tulang daun dan mosaik ringan. Agrios (2005) mengungkapkan bahwa sebagian besar virus membutuhkan 2 sampai 5 hari atau lebih untuk mengekspresikan gejala setelah inokulasi. Sekali virus masuk ke dalam floem, maka akan cepat masuk ke daerah pertumbuhan, meristem dan apikal, atau bagian tanaman penting lainnya. Virus menyebar masuk ke seluruh tanaman secara sistemik di dalam floem, dan masuk ke sel parenkim yang berbatasan dengan floem melalui plasmodesmata. Begitu juga dengan Maule et al.
(2007), mengungkapkan bahwa virus yang memiliki daya virulensi yang tinggi mampu dengan cepat menginfeksi tanaman.
Gejala yang muncul pada tanaman belum cukup untuk menyatakan bahwa tanaman tersebut terinfeksi oleh PRSV. Untuk itu, guna memastikan keberadaan virus tersebut perlu dilakukan deteksi lebih lanjut di laboratorium. Sebagaimana yang dinyatakan oleh Azad et al. (2014) bahwa diagnosis awal PRSV dapat dinilai dari gejala, diagnosis secara visual yang cepat, namun tidak akurat. Gejala PRSV mirip dengan kekurangan nutrisi mikro di dalam tanah dan bervariasinya kondisi lingkungan/cuaca, sehingga perlu dilakukan deteksi secara molekuler.
Secara umum, infeksi PRSV pada tanaman pepaya menunjukkan gejala yang relatif sama untuk semua varietas, namun sebaliknya dengan gejala yang muncul pada tanaman dari famili Cucurbitaceae. Gejala PRSV pada tanaman dari famili Caricaceae menunjukkan gejala khas, sedangkan pada famili Cucurbitaceae menunjukkan gejala yang ringan. Hal tersebut sesuai dengan penelitian Silva-Rosales et al. (2000) bahwa gejala khas PRSV hanya ditemukan pada tanaman pepaya.
Semua tanaman pepaya yang diinokulasi dengan PRSV menunjukkan gejala awal yang hampir sama, yaitu mosaik ringan dan pemucatan tulang daun. Infeksi PRSV pada tanaman pepaya semakin menunjukkan variasi gejala dengan semakin
bertambahnya waktu. Tanaman pepaya varietas ‘California’ dan ‘Callina’
menunjukkan gejala yang sama untuk semua isolat, yaitu mosaik, penebalan lamina daun (rugose), tulang daun menjadi lebih hijau dibandingkan dengan bagian daun lainnya (vein banding), vein clearing,daun berbentuk seperti tali sepatu(shoestring), mosaik bergaris pada petiol, dan tanaman menjadi kerdil. Tanaman pepaya var. ‘Lokal’ yang diinokulasi dengan PRSV isolat Medan menunjukkan gejala mosaik, rugose, vein clearing dan vein banding, sedangkan
var. ‘Lokal’ yang diinokulasi dengan PRSV Aceh dan Bogor tidak menunjukkan
gejala vein banding sebagaimana yang diinokulasi dengan PRSV isolat Medan.
Varietas ‘Bangkok’ dan ‘Red Lady’ juga menunjukkan gejala yang sama untuk
semua isolat PRSV, yaitu mosaik, rugose, dan vein clearing (Tabel 5).
21
yang diinokulasi dengan PRSV isolat Medan. Hal tersebut berbeda dengan hasil penelitian Martínez et al. (2014) yang menyatakan bahwa daun tanaman kabocha yang diinfeksi dengan PRSV-P akan menunjukkan gejala bercak klorotik pada semua permukaan daun dan vein clearing, dengan spot klorotik yang lebih luas. Omar et al. (2011), juga melaporkan bahwa tanaman kabocha yang diinfeksi dengan PRSV akan memperlihatkan gejala mosaik hijau yang dibarengi dengan malformasi pada daun, blister, puckering, distorsi daun, dan helaian daun menjadi menciut, serta malformasi dan munculnya bercak cincin pada buah.
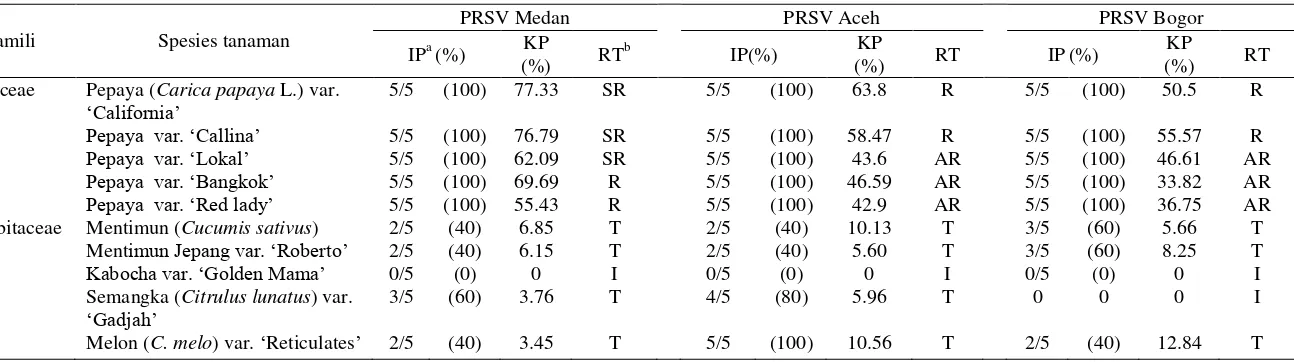
Berdasarkan ekspresi gejala yang muncul dan hasil konfirmasi dengan metode DIBA, dapat ditarik kesimpulan bahwa semua varietas pepaya yang diujikan merupakan inang dari PRSV asal Medan, Aceh dan Bogor, sedangkan untuk Famili Cucurbitaceae, ada sedikit perbedaan kisaran inang. PRSV asal Medan dan Aceh dapat menginfeksi tanaman mentimun, mentimun jepang, semangka, dan melon; PRSV asal Bogor hanya dapat menginfeksi tanaman mentimun, mentimun jepang dan melon. PRSV isolat Medan, Aceh, dan Bogor dapat menginfeksi baik tanaman Caricaceae maupun Cucurbitaceae, sehingga dapat disimpulkan bahwa PRSV yang berasal dari beberapa daerah di Indonesia tersebut termasuk dalam strain yang sama,yaitu PRSV-P. Namun demikian, Fatmawati (2003) telah melaporkan bahwa tanaman kabocha bergejala mosaik kuning asal Cipanas terdeteksi terinfeksi oleh PRSV-W.
Insidensi penyakit pada semua varietas tanaman pepaya yang diinokulasi secara mekanis dengan PRSV mencapai 100%, walaupun berdasarkan hasil DIBA diketahui bahwa sinyal yang muncul pada membran nitroselulosa berbeda-beda yang menandakan bahwa titer virus pada tanaman tersebut juga berbeda-beda (Lampiran 7). Tanaman dari famili Cucurbitaceae menunjukkan periode inkubasi yang sangat bervariasi, yaitu 0-100%. Demikian pula dengan hasil DIBA menunjukkan perubahan warna ungu yang tidak jelas, yang menandakan titer virus pada tanaman cucurbitaceae rendah. Sinyal virus pada membran nitroselulosa sangat tipis (Lampiran 13), sehingga perlu dilakukan uji konfirmasi dengan metode RT-PCR (Lampiran 14). Maule et al. (2007) menyatakan bahwa
lemahnya sinyal pada membran nitroselulosa menunjukkan bahwa tanaman yang diinokulasi virus memiliki tingkat ketahanan
yang tinggi sehingga dapat menghambat laju replikasi dan translokasi virus di dalam tanaman. Hasil penelitian menunjukkan bahwa tanaman mentimun, timun jepang, dan melon yang diinokulasi dengan PRSV Medan memiliki insidensi yang sama, yaitu 40%; sedangkan tanaman semangka yang diinokulasi dengan isolat PRSV yang sama menunjukkan insidensi penyakit 60%. PRSV isolat Aceh yang diinokulasikan ke mentimun dan mentimun jepang, semangka, dan melon, menunjukkan insidensi penyakit berturut-turut, 40, 80, dan 100%; sedangkan mentimun dan timun jepang, serta melon yang diinokulasi dengan PRSV isolat Bogor memperlihatkan insidensi penyakit sebesar 60 serta 40%. Insidensi penyakit pada tanaman kabocha 0% untuk semua isolat PRSV, hal ini menunjukkan bahwa tanaman kabocha bukan merupakan inang PRSV isolat Medan, Aceh, dan Bogor.
22
cucurbitaceae. Pepaya var. ‘California’, ‘Callina’, dan ‘Lokal’ menunjukkan
respons yang sangat rentan terhadap infeksi PRSV isolat Medan. Pepaya var.
‘Bangkok’ dan ‘Red lady’ memperlihatkan respons rentan terhadap infeksi PRSV
isolat Medan. Pepaya varietas ‘California’ dan ‘Callina’ juga menunjukkan
respons rentan terhadap infeksi PRSV isolat Aceh dan Bogor, sedangkan pepaya
var. ‘Lokal’, ‘Bangkok’ dan ‘Red lady’ agak rentan terhadap infeksi kedua isolat
PRSV tersebut. Tanaman Cucurbitaceae menunjukkan respons imun dan tahan terhadap infeksi semua isolat PRSV. Walaupun demikian, keberadaan cucurbitaceae, terutama mentimun, mentimun jepang, semangka, dan melon, tetap harus diperhatikan karena dapat menjadi inang alternatif jika tanaman pepaya tidak ditemukan.
23
Tabel 5 Periode inkubasi (PI) dan jenis gejala pada beberapa tanaman hasil inokulasi Papaya ringspot virus (PRSV) secara mekanis
Famili Spesies tanaman Caricaceae Pepaya (Carica papaya L.)