EKSPRESI GEN SINTETIK PENYANDI PARASPORIN-2
YANG DIKLON PADA PLASMID
pJExpress
DALAM
SEL INANG
Escherichia coli
Top 10 F
FITRI HANDAYANI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
FITRI HANDAYANI. Ekspresi Gen Sintetik Penyandi Parasporin-2 yang Diklon
pada Plasmid
pJExpress
dalam Sel Inang
Escherichia coli
Top 10 F. Dibimbing
oleh EDY DJAUHARI P dan EDDY JUSUF.
Protein parasporin secara alami adalah protein kristal yang dihasilkan oleh
galur-galur tertentu
Bacillus thuringiensis.
Parasporin-2 merupakan salah satu
jenis protein parasporin yang memiliki kemampuan membunuh sel kanker
tertinggi dibandingkan jenis parasporin lainnya. Akan tetapi, penggunaan galur
alami untuk menghasilkan parasporin-2 ini membutuhkan waktu yang lama dan
biaya operasional yang cukup mahal. Sehingga, gen sintetik penyandi
parasporin-2 terpotong disintesis, kemudian diklon pada plasmid
pJExpress
dalam sel inang
Escherichia coli
10 F
.
Penelitian ini bertujuan mendapatkan kondisi optimum
terekspresinya gen sintetik penyandi parasporin-2 terpotong yang diklon pada
plasmid
pJExpress
dalam sel inang
Escherichia coli
Top 10 F. Tingkat ekspresi
protein rekombinan
pJExpress
dilakukan dengan membandingkan optimasi
ekspresi protein yang dihasilkan pada induksi IPTG 100 mM dan 200 mM, serta
pengukuran nilai OD
600pada 0.4 dan 0.6. Hasil penelitian menunjukan ekspresi
gen sintetik penyandi parasporin-2 paling tinggi didapatkan pada nilai OD
600pada
0.4 dengan induksi IPTG 100 mM.
ABSTRACT
FITRI HANDAYANI. Expression of Synthetic Gene Encoding Parasporin-2
Cloned on
pJExpress
Plasmid in
Escherichia coli
host cell Top 10 F. Under
direction of EDY DJAUHARI P and EDDY JUSUF.
Parasporin protein was produced by strains of
Bacillus thuringiensis.
Parasporin-2 is one of some types of parasporin protein which has the highest
ability to kill cancer cells compared than the other types of parasporin. However,
the natural strains of producing parasporin-2 requires a lot of time and also the
operational cost was quite expensive. So, the synthetic gene encoder parasporin-2
should be created and cloned on
pJExpress
plasmid in
Escherichia coli
10 F. The
purpose of this research was to determine the best value of
Escherichia coli
10 F
optical density in order to get the optimal expression of recombinant protein of
parasporin-2. Expression of protein recombinant was comparing the optimization
of protein ekspression between IPTG 100 mM and 200 mM in induction and also
the measurement of OD
600value in 0.4 and 0.6. The best result of the expression
parasporin-2 sintetic gene was from OD
6000.4 with IPTG 100 mM.
EKSPRESI GEN SINTETIK PENYANDI PARASPORIN-2
TERPOTONG YANG DIKLON PADA PLASMID
pJExpress
DALAM SEL INANG
Escherichia coli
Top 10 F
FITRI HANDAYANI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biokimia
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Ekspresi Gen Sintetik Penyandi Parasporin-2 yang Diklon pada
Plasmid
pJExpress
dalam Sel Inang
Escherichia coli
Top 10 F.
Nama
: Fitri Handayani
NIM
: G84080013
Disetujui
Komisi Pembimbing
Drs. Edy Djauhari PK, M.Si.
Drs. Eddy Jusuf, DES
Ketua
Anggota
Diketahui
Dr.Ir. I Made Artika, M.App.Sc.
Ketua Departemen Biokimia
PRAKATA
Assalamu’alaikum W
arahmatullahi Wabarakatu
Puji dan syukur penulis panjatkan kehadiran Allah SWT atas segala rahmat
dan karunia-Nya sehingga penulis dapat menyelesaikan penyusunan skripsi ini.
Skripsi yang berjudul Ekspresi Gen Sintetik Penyandi Parasporin-2 yang Diklon
pada Plasmid
pJExpress
dalam Sel Inang
Escherichia coli
Top 10 F.
Penulis mengucapkan terimakasih kepada Drs. Edy Djauhari PK, M.Si
selaku pembimbing utama, Drs. Eddy Jusuf, DES selaku pembimbing anggota
dan Ibu Rere, Bapak Ogi, Bapak Ridwan selaku staf di Laboratorium
Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia, yang telah banyak
memberikan bimbingan, bantuan, kritik dan saran selama penelitian. Penulis juga
mengucapkan terimakasih kepada kedua orang tua dan keluarga, Bhekti, Lega,
Amania, Lela, Niken, Nurina, Nia, Rahmi, Sari, serta teman-teman Biokimia
angkatan 45 atas doa dan dukungannya.
Penulis menyadari masih banyak kekurangan dan kesalahan yang harus
diperbaiki, namun penulis berharap semoga skripsi ini dapat memberikan manfaat
bagi yang membacanya.
Bogor, Februari 2013
RIWAYAT HIDUP
Penulis dilahirkan di Palembang pada tanggal 12 April 1991 dari pasangan
Yoyot Suryatna dan Iliarti. Penulis merupakan anak pertama dari 3 bersaudara.
Tahun 2008 penulis lulus SMU Negeri 1 Banjarsari kab. Ciamis dan pada
tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk
IPB (USMI). Penulis memilih program Biokimia, Departemen Biokimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... ix
PENDAHULUAN ... 1
TINJAUAN PUSTAKA ... 1
Parasporin ... 1
Susunan Asam Amino Parasporin-2 ... 2
Vektor ekspresi
pJEkspress
... 3
Ekspresi Gen ... 4
Sodium dedocylsulfate-polyacrilamide gelelectrophoresis
(SDS-PAGE) . 5
BAHAN DAN METODE ... 6
Alat dan Bahan ... 6
Metode Penelitian... 6
HASIL DAN PEMBAHASAN ... 8
Kultur
E.coli
Top 10 F ... 8
Pita Ekspresi Protein Parasporin-2 ... 9
Konsentrasi Protein Parasporin-2 ... 9
Pita Ekspresi Protein Parasporin-2 Hasil Pemurnian ... 10
SIMPULAN DAN SARAN ... 11
Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
DAFTAR TABEL
Halaman
1 Pengukuran Nilai OD dan Penambahan IPTG
...
6
2 Konsentrasi Protein Parasporin-2
...
10
DAFTAR GAMBAR
Halaman
1 Sekuen Asam Amino Protein Parasporin-2
...
3
2 Plasmid Vektor
pJEkspress
...
3
3 Struktur Operon
lac
...
4
4 Ekspresi Operon
lac
pada
Escherichia coli
...
5
5 Kultur
E.coli
Top 10 F
...
8
6 Elektroforegram Ekspresi Protein Parasporin-2
...
9
7 Elektroforegram Ekspresi Protein Parasporin-2 Hasil pemurnian
...
10
DAFTAR LAMPIRAN
Halaman
1 Diagram Alir Penelitian
...
14
2 Komposisi
Running
dan
Stacking
Gel pada Elektroforesis
...
15
3 Komposisi Larutan dan Buffer
...
16
4 Sekuen Nukleotida Gen Penyandi Protein PS2Aa1 ... 17
5 Hasil Ekspresi Sekuen yang Diharapkan
...
17
6 Hasil Elektroforegram menggunakan photo-capMw
...
18
7 Marka Protein
Bio-Rad ... ...
...
20
PENDAHULUAN
Bacillus thuringiensis merupakan bakteri yang memiliki sifat morfologi maupun fisiologinya mirip dengan Bacillus aureus,
yang membedakannya adalah adanya kristal protein yang bersifat toksin terhadap serangga (Bernhard & Urtz1993). Protein protoksin ini pertama kali dikenal sebagai parasporal crystalline inclusion selanjutnya disebut
sebagai δ-endotoksin atau Insecticidal Crystalline Protein (ICP) yang dibagi dalam dua katogori protein, yaitu protein Cry dan protein Cyt (Jusuf 2009).
Awal abad 21, telah diketahui juga bahwa beberapa tipe protein yang disintesis oleh
B.thuringiensis memiliki kemamapuan
menghambat tumbuh sel-sel kanker pada manusia. Yokohama et al. (1988) pertama kali melaporkan bahwa protein 25 kDa yang diisolasi dari galur B.thuringiensis subs. israelensis ONR-60A dapat menghambat petumbuhan kultur sel leukemia tikus. Protein Cry anti kanker manusia dari galur
B.thuringiensis ini kemudian diperkenalkan pertama kali oleh Mizuki et al. (2000) sebagai parasporin. Istilah parasporin didefinisikan sebagai protein-protein δ-endotoksin yang non-hemolitik tetapi memiliki kemampuan preferensial membunuh sel kanker, sehingga pada dasarnya parasporin merupakan protein Cry, PS-1 adalah Cry 31, PS-2 adalah Cry 46, PS-3 adalah Cry 41, dan PS-4 adalah Cry 45 (Ohba et al. 2009).
Sampai saat ini yang dikenal sebagai parasporin terdiri atas 4 kelompok, masing-masing adalah parasporin-1 (PS-1), parasporin-2 (PS-2), parasporin-3 (PS-3) dan parasporin-4 (PS-4). Semuanya berjumlah 13 jenis, 8 jenis didapatkan di Jepang, 4 jenis di Vietnam dan satu jenis di Kanada (Amano et al. 2005).
Menurut Ohba et al. (2009) dari keempat kelompok parasporin tersebut yang memiliki aktivitas sitosidal paling besar dan sel kanker sasaran yang lebih banyak adalah PS-2. Sel kanker sasaran PS-2 tersebut diantaranya: Sawano (Endometrial adenocarcinoma), MOLT-4 (human leukemia T cell), HL-60 (human uterus cervix cancer cells), Jurkat, HepG2 (Hepatocellular carcinoma), juga terhadap sel limfosit T normal dan UtSMC (uterine smooth muscle cells) dengan aktivitas lebih rendah. PS-2 adalah protein Cry46Aa atau disebut juga sebagai Mtx-like protein
dengan bentuk tidak beraturan, yang ditunjukkan oleh protein PS2Aa1. Saat ini ada 2 jenis protein ini yaitu PS2Aa1 yang
diperoleh dari galur A1547 asal tanah di Fukuoka dan PS2Ab1 dari galur TK-E6 dari tanah di Ehime (Japan).
Protein parasporin tersebut hanya dihasilkan dari beberapa isolat
B.thuringiensis. Menurut Jusuf (2009), dari berbagai nomor B. thuringiensis yang telah diisolasi dan dikarakterisasi diperoleh 100 nomor isolat yang menunjukan adanya protein Cry. Akan tetapi, baru teridentifikasi 11 nomor dari sejumlah nomor isolat tersebut yang menghasilkan parasporin (Jusuf, tidak dipublikasi). Bakteri B. thuringiensis mampu memproduksi protein parasporin tersebut setidaknya dalam waktu 3 hari. Protein tersebut masih bercampur dengan spora serta sulit dipisahkan dan dimurnikan. Selain itu, protein tersebut baru memiliki aktivitas sitosidal setelah perlakuan dengan enzim-enzim proteolisis.
Hambatan tersebut yang menyebabkan besarnya biaya operasional dan lamanya waktu produksi protein parasporin yang akan digunakan sebagai protein farmaseutika terhadap terapi penyakit kanker. Oleh karena itu, salah satu solusinya adalah membuat gen sintetik yang mampu menyandi protein parasporin-2 aktif siap pakai setelah pemotongan oleh enzim protease (truncated fragment), sehingga produksi protein tersebut tidak memerlukan waktu yang lama (maksimum 24 jam).
Penelitian ini bertujuan mendapatkan kondisi optimum terekspresinya gen sintetik penyandi parasporin-2 yang diklon pada plasmid pJExpress dalam sel inang
Escherichia coli Top 10 F dengan cara kuantitatif dan kualitatif. Penelitian ini juga diharapkan dapat memberikan informasi ilmiah mengenai kondisi optimum terekspresinya gen sintetik penyandi parasporin-2 yang diklon pada plasmid
pJExpress dalam sel inang Escherichia coli
Top 10 F, sehingga penelitian selanjutnya dapat dillakukan hingga memperoleh protein rekombinan yang berpotensi menghambat tumbuh sel kanker. Hipotesis penelitian ini adalah gen sintetik penyandi parasporin-2 yang diklon pada plasmid pJExpress dalam sel inang Escherichia coli Top 10 F tersebut dapat terekspresi.
TINJAUAN PUSTAKA
Parasporin
parasporin terhadap sel kanker hanya terjadi bila protein tersebut telah didegradasi oleh enzim-enzim protease menjadi satu molekul protein kecil (Jusuf 2009). Sampai saat ini telah dikenal empat kelompok parasporin, yaitu PS-1, PS-2, PS-3 dan PS-4 semuanya berjumlah 13 jenis (Amano et.al 2005).
PS-1 merupakan protein Cry31Aa/b/c berbentuk speherical dengan struktur 3 domain seperti umumnya protein Cry. Saat ini telah diidentifikasi 8 jenis parasporin-1 (Ohba
et.al 2009) yaitu PS1Aa1 didapat pada galur A1190 yang diisolasi dari tanah Hiroshima, PS1Aa2 pada galur M15 yang diisolasi dari bangkai tungau di Kanada, PS1Aa3 dari galur B0195 dari tanah di Fukuoka (Jepang), PS1Aa4 (dari galur 79-25) dan PS1Aa5 (dari galur 92-10) keduanya dari tanah di Hanoi. PS1Ab1 atau Cry31Ab1 didapat pada galur B0195 diisolasi dari tanah dik Fukuoka, PS1Ab2 (dari galur 31-5) dan PS1Ac1 (dari galur 87-29), keduanya berasal dari tanah di Hanoi. Mizuki et.al 2000 mengisolasi protein berukuran ± 81,045 kDa yang tersusun dari 723 asam amino dari B. thuringiensis nomor isolate 84-HS-1-11 (selanjutnya disebut sebagai galur A1190). Protein tersebut berasal dari Hirosima yang disandi oleh satu gen berukuran 2169 bp yang diidentifikasi sebagai
Cry31Aa1 atau disebut sebagai PS1Aa1. Sekuen asam amino protein ini terdiri dari 5
conserved block seperti biasanya protein Cry, tetapi homologinya dengan protein Cry
maupun Cyt sangat rendah (<25%).
Aktivitas sitosidal terjadi apabila protein telah didegradasi oleh protease menjadi molekul yang kecil berukuran 40-60 kDa. Tripsin dan proteinase K mengaktifkan parasporin, tetapi chymotrypsin tidak dapat mengaktifkan parasporin tersebut. Aktivitas sitosidal sangat kuat terhadap MOLT-4 (human leukemia T cell) dan HeLa (human uterus cervix cancer cells), tetapi tidak terhadap sel T normal (Yamagiwa et al.
(2002).
PS-2 adalah protein Cry46Aa atau disebut juga sebagai Mtx-like protein dengan bentuk tidak beraturan, yang ditunjukan oleh protein PS2Aa1. Saat ini ada 2 jenis protein ini yaitu PS2Aa1 yang diperoleh dari galur A1547 asal tanah di Fukuoka dan PS2Ab1 dari galur TK-E6 dari tanah di Ehime Japan (Kitada et.al
2005). Protein kristal yang tergolong PS-2 adalah polipeptida dengan 304 asam amino dan berat molekul diprediksi sekitar 33.107 kDa (Hayakawa et al. 2007).
Protein kristal PS-3 atau Cry41Aa/b yang dikenal ada 2 jenis yaitu PS3Aa1 atau
Cry41Aa1 dan PS3Ab1 atau Cry41Ab1, keduanya diperoleh dari galur A1462 asal tanah dari Tokyo. Protein berbentuk bipiramid berukuran 88 kDa dengan struktur tiga domain, setelah pemecahan oleh protease menjadi aktif toksik pada ukuran 64 kDa. Ohba et.al 2009 menyebutkan hanya ada satu protein PS-4 yaitu PS4Aa1 atau Cry45Aa1 yang disebut epsilon toxin like yang ada pada
Clostridium perferingens, merupakan toksin pembentuk pori dengan struktur tiga domain. Berukuran 31 kDa dan bentuk aktif pada ukuran 27 kDa.
Menurut Ohba et al. 2009, diantara keempat kelompok protein parasporin tersebut yang memiliki aktifitas sitosidal paling besar dan memiliki sasaran sel kanker yang lebih banyak adalah parasporin-2 (PS-2). Sasaran sel kanker tersebut diantaranya; MOLT-4 (human leukemia T cell), HL-60 (human uterus cervix cancer cells), Jurkat, HepG2 (hepatocellular carcinoma), A549 (lung adenocarcinoma), juga terhadap sel limfosit T normal dan UtSMC (uterine smooth muscle cells ) dengan aktivitas yang lebih rendah.
Mekanisme penghambatan tumbuh sel kanker pada protein PS-2 terjadi dengan meningkatkan permebilitas dari sel sasaran, tetapi tidak membentuk pori-pori pada membrane mitokondria ataupun retikulum endoplasmik. Pada kasus sel HepG2,
cytoplasmic lactate hydrogenase membuat bocor dinding sehingga propidium iodida ekstrasel masuk ke dalam sitoplasma dari sel yang di-treatment dengan PS2Aa1 (Kitada et al. 2006).
Susunan Asam Amino Parasporin-2
Susunan asam amino dari parasporin-2 yang belum aktif berukuran 37 kDa terdiri dari 338 asam amino (Ito et.al 2006) seperti terlihat pada gambar 1. Setelah aktivasi dengan Proteinase-K maka asam amino N-terminal pertama methionin sampai dengan threonin pada posisi 51 dipotong, sehingga N-terminal dari bentuk parasporin-2 teraktivasi dimulai dari asam aspartat-valin-isoleusin-arginin-asamglutamat-tyrosin yang menjadi penentu aktivitas protein tersebut, seperti terlihat pada Gambar 1, tersisa 287 asam amino dengan C-terminal pada asparagin. Sekuen nukleotida penyandi susunan asam-asam amino tersebut didapatkan dari hasil studi bioinformatika tersusun atas 1017 pasangan basa (Lampiran 4).
Sehingga susunan dan sekuen asam amino yang diharapkan dari hasil penelitian ini dapat terlihat pada Lampiran 5.
Gambar 1 Sekuen asam amino protein parasporin-2 (Ito et al. 2006).
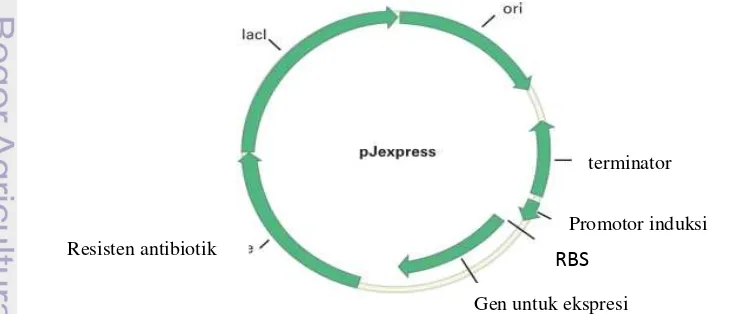
Vektor Ekspresi pJExpress
Vektor ekspresi merupakan mediator yang digunakan untuk mengekspresikan gen asing sehingga dapat dikenali oleh sel inang. Pengenalan sinyal gen asing oleh sel inang (Escherichia coli) dapat memberi informasi adanya gen insert dalam vektor ekspresi, contohnya plasmid. Plasmid adalah molekul DNA yang dapat membawa gen asing yang apabila ditransformasikan ke dalam sel inang dapat bereplikasi (Campbell et al. 2002). Plasmid terletak di luar kromosom, berbentuk sirkular, terdapat pada mikroorganisme (khususnya bakteri), mempunyai ukuran kira-kira 1-200 Kb dan dapat bereplikasi otonom (Jenkins 1990). Plasmid tidak berhubungan dengan DNA kromosom, namun plasmid dapat bereplikasi dan berpindah ketika terjadi pembelahan sel bakteri (Wolfe 1995).
Penggunaan plasmid pada teknik rekombinan didasarkan pada beberapa alasan, yaitu ukurannya kecil, tingkat replikasi plasmid tinggi dalam host selnya, resisten terhadap antibiotik, memiliki beberapa situs
restriksi yang unik (Paolella 1998). Salah satu jenis plasmid yang digunakan dalam vektor ekspresi yaitu pJExpress.
Vektor pJExpress tidak memiliki situs restriksi yang dapat memotong fragmen gen. Sehingga perlu desain sekuen gen pada situs tertentu terhadap enzim restriksi untuk mengisolasi gen dari plamidnya. Promotor T5 telah dimodifikasi untuk memberikan tingkat ekspresi protein lebih tinggi, karena promotor ini bersifat repressible dan aktif pada berbagai strain E.coli.
Vektor pJExpress-404 memiliki inducible
promotor T-5, antibiotic resistence Amp dan pUC origin (Gambar 2). Selain itu vektor ekspresi ini juga dilengkapi dengan His-Tags. Vektor pJExpress bakteria dengan T5 promotor dapat diinduksi oleh IPTG pada sel inang E.coli dalam bentuk galur apapun. Vektor pJExpress juga mengandung sekuen nukleotida pendek yang disebut ribosome binding site (RBS), yang dilokasikan antara
inducible promotor dan fragmen yang akan diekspresikan (Sadler et al. 1983).
Gambar 2 Plasmid vektor pJExpress (Sadler et al. 1983).
3
Resisten antibiotik
Gen untuk ekspresi
RBS
Ekspresi Gen
Ekspresi gen merupakan proses pengendalian atau regulasi gen dari organisasi genom makhluk hidup. Ekspresi gen pada prokariot dikenal dengan istilah sistem operon. Pada sistem operon terdapat sekelompok gen struktural yang ekspresinya dikendalikan oleh satu promoter yang sama. Salah satu organisme prokariot yang memiliki sistem operon yaitu bakteri Escerichia coli. Escherichia coli merupakan organisme prokariot yang paling banyak digunakan sebagai sel inang dalam penelitian ekspresi.
E.coli memiliki karakteristik ideal sebagai sel inang yaitu dapat memperbanyak diri dalam waktu singkat dan stabil, memiliki tingkat ekspresi yang tinggi, bersifat non-patogen dan dapat diintroduksi berbagai gen asing yang mengkode protein target (Brock et al. 1994 & Stratagene 2001). Bakteri E.coli berbentuk batang dengan ukuran genom sebesar 4.5 Kb, dapat tumbuh cepat dalam medium pengayaan dan memiliki banyak strain yang telah dikarakterisasi (Promega 2009).
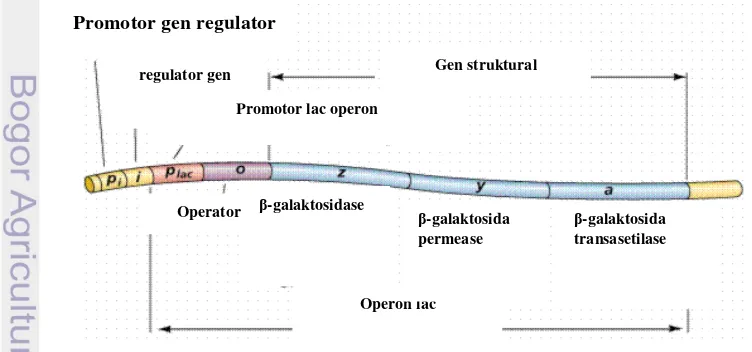
E.coli mampu melakukan metabolisme laktosa karena memiliki sistem operon yang disebut operon lac (Robert 2006). Operon lac
terdiri dari satu gen regulator (gen lacl) dan tiga gen struktural yaitu gen lacZ, lacY, dan lacA. Struktur operon lac dapat dilihat pada Gambar 3. Gen lacZ mengkode β -galaktosidase yang berfungsi menghidrolisis laktosa menjadi monosakarida yaitu galaktosa dan glukosa. Gen lacY mengkode enzim permease yang berfungsi meningkatkan permebilitas sel sehingga laktosa dapat diangkut dari luar sel kedalam sel, dan gen
lacA mengkode trans-asetilase (King 1996).
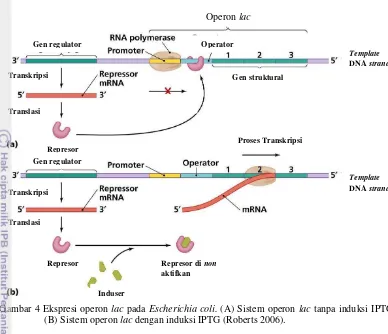
Sistem operon dapat dikendalikan secara positif maupun negatif. Produk ekspresi gen regulator pada sistem operon lac E.coli
berperan menetukan terjadinya pengandalian positif dan pengendalian negatif dari sistem operon tersebut (Yuwono 2002). Pengendalian negatif dilakukan oleh protein repressor yang dikode oleh gen regulator (lacl). Apabila tidak terdapat laktosa sebagai induser, protein repressor akan terus menempel pada bagian operator. Penempelan tersebut menyebabkan RNA polymerase tidak dapat melakukan transkripsi gen-gen structural (gen lacZ, lacy,
dan lacA). Ketika bakteri E.coli
memanfaatkan laktosa sebagai sumber makannanya, laktosa diubah menjadi allolaktosa dan enzim n-galaktosidase. Allolaktosa berperan sebagai induser yang akan berikatan dengan protein repressor sehingga daerah operator yang dilalui oleh RNA polymerase dan proses transkripsi dapat berjalan (Yuwono 2002). Ekspresi operon lac
pada Escherichia coli dapat dilihat pada gambar 4.
Pengendalian positif terjadi karena adanya aktivator berupa protein regulator yang dikenal dengan sebutan catabolite activator protein (CAP) dan suatu molekul efektor yaitu cAMP. Cap kemudian membentuk kompleks CAP-cAMP dan berikatan dengan promotor. Pengikatan tersebut menyebabkan RNA polymerase juga dapat berikatan dengan promoter sehingga membentuk kompleks promotor tertutup. Selanjutnya kompleks promoter tertutup akan menjadi kompleks promoter terbuka dan proses transkripsi dapat berjalan (King 1996 & Yuwono 2002).
Gambar 3 Struktur operon lac (Farabee 2007).
regulator gen
Promotor lac operon
Gen struktural
Operon lac
Operator β-galaktosidase β-galaktosida
permease
β-galaktosida transasetilase Promotor gen regulator
Gambar 4 Ekspresi operon lac pada Escherichia coli. (A) Sistem operon lac tanpa induksi IPTG. (B) Sistem operon lac dengan induksi IPTG (Roberts 2006).
Sodium dedocyl sulfate-polyacrylamide gel electrophoresis (SDS-PAGE). Elektroforesis merupakan pemisahan senyawa yang dilakukan berdasarkan perpindahan molekul bermuatan karena pengaruh medan listrik. Elektroforesis pada umumnya digunakan untuk menentukan berat molekul (BM), mendeteksi kemurnian dan kerusakan protein atau asam nukleat, menetapkan titik isolistrik, serta memisahkan spesies-spesies yang berbeda secara kualitatif dan kuantitatif (Bintang 2010).
SDS-PAGE merupakan salah satu jenis elektroforesis yang digunakan untuk memisahkan dan menganalisis protein. Prinsip dari SDS-PAGE adalah protein yang berukuran kecil akan bermigrasi lebih cepat dibanding protein berukuran besar dalam gel yang dialiri muatan listrik (Lodish 2004).
Sodium dodecylsulfate yang digunakan dalam metode SDS-PAGE adalah sejenis detergen bermuatan negatif yang dapat mengikat protein sehingga protein tersebut dapat bermigrasi ke ujung muatan listrik positif pada gel (Frank 2011). Konstruksi SDS-PAGE dapat diliihat pada gambar 5.
Ada dua jenis gel yang digunakan dalam SDS-PAGE yaitu resolving gel dan stacking gel. Stacking gel berfungsi membentuk well
atau sumur yang menjadi tempat loading
sampel, sedangkan resolving gel berfungsi sebagai tempat migrasi protein (Shaw 2011). Kedua gel tersebut berada pada dua lempeng kaca dan mengalami polimerasi karena terjadi ikatan antara poliakrilamid dengan cross-linking solution (APS dan TEMED) sehingga gel menjadi matriks semisolid. Pori-pori gel yang digunakan dapat berbeda-beda, tergantung dari konsentrasi poliakrilamid dan
cross-linking solution tersebut. Konsentrasi pori-pori gel dan kekuatan arus listrik yang digunakan dapat mempengaruhi kecepatan migrasi protein (Lodish 2004).
Komponen gel yang digunakan juga memiliki fungsi masing-masing yaitu akrilamid, akan membentuk poliakrilamid yaitu polimer pembentuk matriks yang berfungsi sebagai tempat untuk protein berpindah dan memisahkan protein tersebut berdasarkan berat molekulnya (Frank 2011).
Ammonium persulfate (APS) yang bersifat tidak stabil, apabila terjadi kerusakan, akan menghasilkan ion SO4- yang akan bereaksi
dengan molekul akrilamid dan menginisiasi terjadinya polimerasasi keduanya.. TEMED berfungsi sebagai katalis yang dapat mempercepat kerusakan APS. Penggunaan 0.5 M Tris pH 6.8 dan 1.5 M Tris pH 8.8 berfungsi sebagai larutan penyangga atau buffer. Semua bahan kimia yang digunakan
Gen regulator Transkripsi Translasi Represor Represor Translasi Gen struktural Gen regulator Transkripsi Template
DNA strand
Operator
Template
DNA strand
Proses Transkripsi
Induser
Represor di non
aktifkan
5
dalam pembuatan gel dapat disimpan pada suhu ruang selama beberapa bulan kecuali APS. APS yang digunakan sebaiknya dibuat setiap minggu dan disimpan pada suhu 40C agar menjadi stabil. Jika gel yang telah dibuat tidak mengalami polimerisasi maka hal tersebut dikarenakan APS yang digunakan dalam kondisi tidak baik (Shaw 2011).
SDS-PAGE sendiri dinilai lebih menguntungkan dibandingkan elektroforesis kertas dan pati. Hal ini disebabkan karena besarnya pori medium penyangga, serta perbandingan konsentrasi akrilamida dan bis-akrilamida. Gel ini pun tidak menimbulkan konveksi dan bersifat transparan (Bintang 2010).
BAHAN DAN METODE
Alat dan Bahan
Bahan-bahan yang digunakan dalam penelitian ini adalah pJExpress Cry Top 10
glicerol stock, ampisilin 100 mg/ml, IPTG (Isopropyl β-D-thiogalactoside) 100 dan 200 mM, tripton, bacto agar, ekstrak yeast, akuades, NaCl, tris, HCl, alkohol absolut,
30% acrylamide (29:1), EDTA
(etilendiamintetraasetat), Triton X-100, SDS (sodiumdedosilsulfat) 10%, ammonium persulfat 10%, protein standards-Dual color
[Bio-Rad], coomasie blue, gliserol, glisin, methanol, bromophenol blue, Tween-20,asam glasial dan TEMED (tetraetilmetildiamin).
Alat-alat yang digunakan diantaranya laminar air flow, labu Erlenmeyer, tabung reaksi, rak tabung reaksi, gelas ukur, pipet Mohr, pipet volumetrik, pipet Pasteur, labu takar, microtube, sentrifugator, mixer, inkubator, spektrofotometer UV-VIS, tabung vial (Eppendorf), pipet mikro, bulp, sudip, kertas aluminium, sonikator, tip plastik, kain kasa, alumunium foil, bunsen, korek api, termometer, neraca analitik, kertas tisu, labu ukur, gelas piala, botol kaca kecil, kuvet, alat vortex, magnetic strirer, mikroskop, pH meter, lemari pendingin 40C, autoklaf, masker, sarung tangan, elektroforesis SDS-PAGE dan label penanda.
Metode
Refresh Kultur E.coli Top 10 F.
Escherichia coli Top 10 F yang mengandung pJExpress dalam glicerol stock
ditumbuhkan pada media Luria bertani (LB) padat agar yang mengandung ampisilin (100 µg/µl) kemudian diinkubasi semalaman pada suhu 37o C. Koloni tunggal yang terbentuk ditumbuhkan pada 5 ml media LB cair yang ditambahkan 5 µl ampisilin (100 µg/µl). Kemudian kultur tersebut diinkubasi pada suhu 37oC dengan pengocokan 150 rpm selama semalaman (±16 jam).
Pengecekan Optical Density Escherichia coli
Top 10 F dan Induksi IPTG.
Sebanyak 1 ml kultur Escherichia coli Top 10 ± 16 jam dimasukan ke dalam 4 tabung media LB cair 50 ml yang telah ditambahkan 50 µl ampisilin (100 mg/µl).Kemudian kultur diinkubasi dalam shaker incubator pada suhu 370C dengan kecepatan 150 rpm ± 1 jam. Selanjutnya dilakukan pengecekan optical density (OD) setiap 20-30 menit untuk mendapatkan nilai OD yang menjadi variable dalam penelitian ini.
Nilai OD yang didapatkan yaitu tabung 1 dan 2 (OD 0.4), tabung 3 dan 4 (OD 0.6). Pengukuran nilai OD tersebut dilakukan pada panjang gelombang 600 nm dengan menggunakan spektrofotometri. Sebanyak 1 ml medium LB cair diukur sebagai blanko. Selanjutnya sebanyak 1 ml kultur sel E.coli
dari kultur sel E.coli 50 ml diukur sebagai larutan sampel dengan penambahan IPTG sesuai pada tabel 2.
Pemanenan Kultur SelEscherichia coli Top
10 F.
Kultur sel hasil pengukuran OD dan induksi IPTG kemudian di panen dan diinkubasi selama 1 jam di dalam shaker incubator dengan kecepatan 150 rpm pada suhu 370C. setelah diinkubasi kultur sel dipindahkan ke dalam tabung sentrifus. Kultur kemudian disentrifus dengan kecepatan 6000 rpm pada suhu 40C selama 10 menit. Supernatant dibuang, kemudian pelet disimpan pada suhu -200C.
Tabel 1 Pengukuran nilai OD dan penambahan IPTG
Tabung ke- Pengecekan nilai OD Induksi IPTG (mM)
1 0.4 100
2 0.4 200
3 0.6 100
4 0.6 200
Pemecahan sel Escherichia coli Top 10 F.
Pemecahan sel dilakukan dengan dua metode yaitu metode freeze & thaw dan sonikasi. Proses pemecahan sel mengikuti metode dari Margawati & Ridwan (2009) dengan modifikasi.
Metode freeze & thaw. Pelet yang telah
disimpan dalam box freezer -20 dikeluarkan. Selanjutnya pellet di thawing pada suhu (28--300C) selama 10 menit (hingga pellet mencair). Setelah itu pelet dimasukan kembali ke dalam freezer -200C selama 15 menit sampai dengan pelet membeku. Freeze &
thaw tersebut diulang sebanyak 3 kali pengulangan. selanjutnya pelet tersebut ditambahkan 5 ml bufer B. campuran divorteks, kemudian dipindahkan ke dalam tabung falcon.
Metode sonikasi. Suspensi sel selanjutnya
disonikasi selama 15 detik dengan interval waktu 1 menit. Perlakuan tersebut diulang sebanyak 3 kali. Setelah itu, suspense dipindahkan kembali ke dalam tabung sentrifus. Suspensi sel disentrifus dengan kecepatan 10.000 rpm pada suhu 40C selama 15 menit. Sonikasi dilakukan dalam kondisi dingin.
Kuantifikasi konsentrasi protein.
Sebanyak 1 ml sampel absorbansi nya diukur dengan spektrofotometer pada panjang gelombang 260 dan 280. Kemudian konsentrasi protein diukur dengan menggunakan rumus berdasarkan Caprette 1995, yaitu:
Pemurnian protein rekombinan pJExpress.
Proses pemurnian protein dilakukan dengan mengikuti metode dari Amersham Bioscience (2002). Supernatan hasil sosnikasi ditambahkan resin sebanyak 50 µl dan ditambahkan 500 µl buffer B. Sampel protein telah dirotator pada kondisi dingin selama 3 jam, kemudian disentrifius dengan kecepatan 3000 rpm pada suhu 40C selama 7 menit. Selanjutnya sebanyak 1 ml supernatan diambil, kemudian dimasukan ke dalam tabung eppendorf. Supernatan tersebut disebut
inner volume (IV). Sisa supernatant dibuang, kemudian IV disimpan pada suhu -200C. Selanjutnya pelet ditambahkan buffer B 1 ml, kemudian digoyangkan perlahan hingga tercampur merata. Suspensi kemudian disentrifius dengan kecepatan 3000 rpm pada suhu 40C selama 5 menit. Sebanyak 1 ml supernatan diambil, kemudian dimasukan kedalam tabung eppendorf. Supernatant tersebut disebut washing (W).
Tahapan berikutnya pelet ditambahkan elution buffer sebanyak 50 µl. Protein di-rotator
(batch capture) pada suhu 40C selama 17 jam (overnight). Setelah itu protein disentrifius dengan kecepatan 3000 rpm pada suhu 40C selam 1 menit. Sebanyak 100 µl supernatant diambil. Supernatan tersebut disebut elution 1 (E1). Selanjutnya pelet kembali ditambahkan
elution buffer sebanyak 100 µl. selanjutnya protein di-rotator (batch capture) pada suhu 40C selama 3 jam. setelah itu, protein disentrifius dengan kecepatan 3000 rpm pada suhu 40C selama 1 menit. Supernatant tersebut disebut elution 2 (E2). Pelet yang tersisa diberi label R. R dan E2 kemudian disimpan pada suhu -200C.
Identifikasi Protein sampel dengan
SDS-PAGE (Lodish 2004).
Pembuatan gel. Gel yang digunakan
terdiri atas dua bagian, yaitu gel atas (stacking gel) dan gel bawah (running gel). Proses pembuatan running gel dilakukan dengn cara mencampurkan akuades, tris HCl 1.5 M pH 8.8, SDS 10% dan. Kemudian ditambahkan APS 10% dan TEMED sambil digoyang perlahan (Lampiran 2). Running gel yang masih cair tersebut dimasukan ke dalam kaca cetakan setinggi batas atas, kemudian ditambahkan akuades sampai batas ujung kaca untuk meratakan permukaan gel, lalu dibiarkan sampai membeku.
Setelah gel membeku, akuades dibuang dari cetakan dan dikeringkan dengan menggunakan kertas saring. Selanjutnya, bagian atas kaca cetakan yang kosong diisi dengan stacking gel dilakukan dengan cara mencampurkan akuades, tris HCl 0.5 M pH 6.8, SDS 10% dan bis-akrilamida. Setelah tercampur rata, ditambahkan APS 10% dan TEMED (Lampiran 2). Kemudian sisiran pembuat sumur dimasukan ke dalam cetakan. Gel dibiarkan sampai membeku. Setelah sisiran diangkat, tercetak sumur-sumur sesuai dengan jumlah gerigi pada sisiran sebagai tempat sampel, yang selanjutnya dipasang pada alat elektroforesis. Casting gel dipasang, alat elektroforesis dirangkai dan buffer elektroforesis dimasukan. Komposisi buffer elektroforesis yang digunakan yaitu glisin 192 mM, SDS 0.1% dan tris basa 25.0 mM.
hal ini digunakan protein ladder dual color. Komposisi sampel buffer yang digunakan yaitu SDS 1 gram, gliserol 50% sebanyak 2 ml, bromphenol blue 0.1% 2 mL, Tris-HCl 1 M 1.25 mL, dan akuades sebanyak 10 mL. Volume sampel yang dimasukan ke dalam sumur sebanyak 20 µl.
Elektroforesis dijalankan pada tegangan 100 volt selama kurang lebih 2 jam hingga
bromophenol blue mencapai 1 cm dibawah gel. Setelah proses pemisahan berakhir, gel dilepas dari plate gel menggunakan spatula secara perlahan-lahan dan ujung kiri atas running gel dipotong sebagai tanda urutan sumur.
Pewarnaan (Staining) dan pencucian
(Destaining). Pewarnaan gel dilakukan
dengan peredaman gel pada larutan staining.
Larutan tersebut terdiri atas, methanol 100 ml, akuades 100 mL, acetic acid 20 mL, dan
Coomassie blue R-250 200 mg, lalu dicampurkan dan disaring. Gel diwarnai selama 24 jam sambil digoyang konstan, lalu dicuci dengan destain coomasie blue sambil digoyangkan kembali. Pencucian tersebut dilakukan sebanyak 3 kali pengulangan.
Interprestasi Data. Gel yang telah dicuci
kemudian diberi akuades. Selanjutnya sebanyak 1 ml gliserol ditambahkan agar gel tidak mudah patah. Gel diletakan di dalam plastik mika, kemudian didokumentasikan dengan scanner dan kamera digital. Hasil visualisasi protein parasporin-2 rekombinan dengan SDS-PAGE diolah menggunakan teknologi bioinformatika (Photo-CaptMw).
HASIL DAN PEMBAHASAN
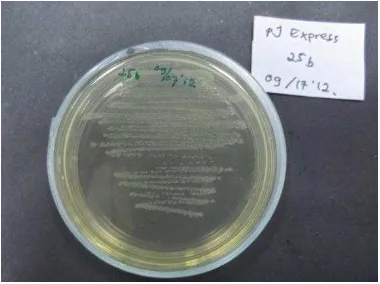
Kultur E.coli Top 10 F.
Kultur dilakukan penyegaran selama semalaman untuk mengetahui masih baik atau tidaknya kondisi kultur yang telah ditransformasi dan disimpan dalam stok gliserol pada suhu -800C. Hasil penelitian menunjukan bahwa bakteri E.coli hasil transformasi tersebut masih dapat tumbuh baik pada media LB agar yang telah ditambahkan dengan ampisilin 100 µg/µl (Gambar 6). Penambahan ampisilin bertujuan untuk mengetahui keberhasilan transformasi
pJExpress dalam E.coli sebelumnya. Apabila sel E.coli telah mengandung plamid
pJExpress maka sel E.coli tersebut akan memiliki sifat resisten terhadap ampisilin (Zhiming Tu 2005). Koloni tunggal hasil
refresh kutur kemudian ditumbuhkan pada media LB cair 5 ml yang telah ditambahkan ampisilin, sebelum pemanenan pada media
LB cair 50 ml yang telah ditambahkan ampisilin 100 µg/µl juga. Hal ini bertujuan untuk menghasilkan pemanenan kultur yang optimum. Pemanenan kultur dilakukan pada saat nilai OD sebesar 1. Hal ini dilakukan karena pada nilai OD sebesar 1 kultur telah memasuki fase stasioner (Roberts 2006). Pemanenan kultur dilakukan dengan metode sentrifugasi (Bintang 2010). Sentrifugasi akan memisahkan sel (pelet) dengan medianya (supernatan). Pelet yang telah dikoleksi selanjutnyaakan memasuki tahap pemecahan sel untuk mengeluarkan protein parasporin-2 yang terdapat didalam sel.
Gambar 5 Hasil kultur sel E.coli Top 10 F transforman.
Pemecahan sel dilakukan sebanyak dua kali yang pertama menggunakan teknik pengering bekuan (freeze & thawing) dan sonikasi. Teknik pengering bekuan pada sel
E.coli menyebabkan pembekuan yang cepat pada cairan intraseluler dan ekstraselular, sehingga akan membentuk kristal es pada intraselular dan ekstraselular yang akan menyebabkan kerusakan terhadap sel (Scawen & Meling 1985). Setelah tahap pengeringbekuan, disonikasi terhadap sel tersebut dengan tujuan semua sel tersebut dapat dipecah dan dikoleksi proteinnya.
hidrofobik dari protein yang terikat pada membran sel dapat terdisosiasi.
Pita Ekspresi Protein Parasporin-2.
Analisis elektroforegram ekspresi protein parasporin-2 ini dilakukan dengan menggunakan program bioinformatika photo-capMw. Photo-capMw merupakan program yang dapat digunakan untuk mengkuantifikasi gel hasil elektroforesis dan imuno elektrofokusing (Gibas & Jambeck 2001). Selain itu program ini juga dapat mengkuantifikasi jumlah dan luas koloni hasil dari perobaan-percobaan mikrobiologi.
Elektroforegram ekspresi parasporin-2 ditunjukan pada Gambar 7, kemudian hasil elektroforegram dianalisis menggunakan photo-capMw (Lampiran 6a). Lajur 5 (L5) sebagai marker, lajur 6 (L6) sebagai lajur sampel dengan pengukuran OD 0.4 yang diinduksi IPTG 100 mM. Lajur 7 (L7) sebagai lajur sampel dengan pengukuran OD 0.4 yang diinduksi IPTG 200 mM. Lajur 8 (L8) sebagai lajur sampel dengan pengukuran OD 0.6 yang diinduksi IPTG 100 mM. Lajur 7 (L7) sebagai lajur sampel dengan pengukuran OD 0.4 yang diinduksi IPTG 200 mM. Hasil analisis photo-capMw menunjukan bahwa adanya pita protein target yang muncul pada lajur 6 (L6), lajur 7 (L7), lajur 8 (L8) dan lajur 9 (L9). Pita protein tersebut terletak dibawah marka protein dengan ukuran 37 kDa (± 30 kDa). Akan tetapi, pita protein tersebut masih belum cukup tebal untuk menunjukan adanya protein target, sehingga dari hasil elektroforegram tersebut belum dapat diketahui kepadatan sel yang tepat untuk memperoleh kondisi optimum terekspresinya protein parasporin-2 tersebut. Oleh karena itu, selanjutnya dilakukan kuantifikasi protein parasporin-2 untuk mengetahui konsentrasi protein, serta purifikasi untuk memperoleh protein parasporin-2 yang lebih murni.
Pita protein yang muncul masih belum terlihat begitu jelas dan tebal. Hal tersebut kemungkinan disebabkan karena masih banyaknya protein pengikut lainnya selain protein target. Bahan-bahan kimia yang digunakan sudah kurang baik, sehingga pita protein tidak mampu terpisah dengan baik. Pengikatan protein dengan SDS akan menyebabkan dua hal, pertama yaitu terputusnya ikatan disulfida yang menentukan protein folding dengan kata lain struktur sekunder protein rusak. Hal kedua yaitu akan menyebabkan bagian luar molekul protein terselubungi oleh muatan negatif dari SDS sehingga molekul protein akan terseparasi
semata-mata berdasarkan berat molekulnya saja bukan berdasarkan besar dan jenis muatannya karena semua molekul protein sekarang bermuatan negatif (Fatchiyah 2012). Oleh karena itu, penggunaan SDS yang rusak akan mempengaruhi laju protein dan sifat protein itu sendiri. Selain itu juga konsentrasi gel akan mempengaruhi kerapatan gel dan laju dari protein. Semakin besar konsentrasi gel maka pori-pori gel akan semakin rapat. Sehingga konsentrasi gel yang tepat diperlukan untuk menghasilkan kerapatan gel sesuai dengan bobot molekul target (Bintang 2010). Selanjutnya pengukuran kuantitatif dan pengukuran diperlukan untuk mencari kondisi optimum terekspresinya gen sintetik tersebut.
Gambar 6 Elektroforegram ekspresi parasporin-2.
Konsentrasi Protein Parasporin-2.
Analisis kuantitatif protein rekombinan
pJExpress dilakukan untuk mengetahui nilai konsentrasi protein parasporin-2. Penentuan konsentrasi protein dilakukan dengan metode berdasarkan Caprrette (1995). Konsentrasi protein di ukur pada panjang gelombang 260 dan 280, kemudian dihitung dengan rumus (Lampiran 8).
Hasil kuantifikasi yang menunjukan bahwa rata-rata total konsentrasi protein hasil kultur sel E.coli dengan nilai OD 0.4 induksi IPTG 100 mM; 0.4 induksi IPTG 200 mM; 0.6 induksi IPTG 100 mM dan 0.6 induksi IPTG 200 mM masing-masing berturut-turut mempunyai nilai 0.705 mg/ml; 0.629 mg/ml; 0.702 mg/ml dan 0.661 mg/ml (Tabel 2).
Tabel 2 Hasil penentuan konsentrasi protein protein parasporin-2.
Keterangan: a= OD 0.4 induksi IPTG 100 mM, b= OD 0.4 induksi IPTG 200 mM c= OD 0.6 induksi IPTG 100 mM, d= OD 0.6 induksi IPTG 200mM
Pita Ekspresi Protein Parasporin-2 Hasil Pemurnian.
Hasil analisis elektroforegram dan penentuan konsentrasi protein parasporin-2 maksimal ditunjukan pada induksi IPTG 100 mM dengan nilai OD 0.4. Oleh karena itu, selanjutnya dilakukan purifikasi protein rekombinan pJExspress yang diinduksi IPTG 100 mM dengan nilai OD 0.4 untuk mendapatkan protein rekombinan pJExpress
yang murni. Gambar 8 menunjukan hasil elektroforegram protein parasporin-2 pada tahap purifikasi diambil dari sampel inner volume (IV), washing 1 (W1), elusi 1 (E1) dan
elusi 2 (E2). Viasualisasi pada tahap purifikasi ini hanya dilakukan pada protein rekombinan
pJExpress dengan kepadatan sel 0.4 yang di induksi IPTG 100 mM. Hal tersebut karena
visualisasi protein rekombinan sebelumnya tervisualisasi baik pada kepadatan dan induksi IPTG tersebut.
Purifikasi protein pJExpress dilakukan menggunakan resin Ni-NTA Agarose. Resin Ni-NTA memiliki sistem chelating dan menangkap hanya protein target yang memiliki fusi His. Sehingga pada saat purifikasi diharapkan hanya protein target yang tertangkap sedangkan protein lain terbuang pada saat pencucian. Ni-NTA mengikat protein 100-1000 kali lebih erat dari Ni-ida. Selain itu, Ni-NTA dapat digunakan untuk memurnikan hampir semua protein, bahkan protein yang tidak mampu terdenaturasi ataupun protein yang membentuk inclusion body (Crowe 1995).
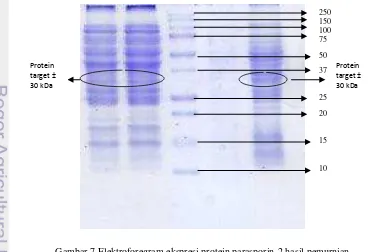
Gambar 7 Elektroforegram ekspresi protein parasporin-2 hasil pemurnian.
Pengulangan
Konsentrasi protein (mg/ml)
a b c d
260 280 Total 260 280 Total 260 280 Total 260 280 Total
1 0.512 0.707 0.707 0.265 0.507 0.584 0.408 0.609 0.634 0.533 0.739 0.740 2 0.479 0.696 0.715 0.318 0.529 0.578 0.485 0.711 0.733 0.535 0.769 0.785 3 0.469 0.703 0.733 0.402 0.576 0.587 0.514 0.674 0.654 0.401 0.580 0.594 4 0.454 0.653 0.667 0.559 0.768 0.766 0.505 0.754 0.785 0.43 0.548 0.523 Rata-Rata 0.479 0.690 0.705 0.386 0.595 0.629 0.478 0.687 0.702 0.475 0.659 0.661
250 150 100 75 50 37
25 20
15
10
Protein target ± 30 kDa
Protein target ± 30 kDa
Analisis protein rekombinan pada tahap purifikasi selanjutnya diambil dari hasil elusi 1 (E1) dan elusi 2 (E2). Sampel tersebut dimasukan pada pada lajur 1 dan 5 (Gambar 8 & Lampiran 6b). Resin yang ditambahkan pada tahap elusi berfungsi untuk melepaskan ikatan antara protein parasporin-2 (protein target) dengan ligan, sehingga akan didapatkan protein parsporin-2 yang murni (pET system 2006). Akan tetapi, hasil elektroforegram dan hasil analisis photo-capMw dari sampel elusi, baik pada visualisasi elusi 1 ataupun elusi 2 masih menunjukan banyak pita protein yang muncul. Hal tersebut kemungkinan terjadi akibat ikatan yang terbentuk antara protein parasporin-2 dengan molekul-molekul lain yang tidak diharapkan belum terlepas. Faktor yang mempengaruhi pemurnian protein rekombinan adalah kondisi pH, buffer elusi,
degradasi protein, konsentrasi immidazole yang terkandung dalam buffer elusi, dan sebagainya (Bioscience 2002). Oleh karena itu perlu dilakukan penelitian lebih lanjut mengenai kondisi optimal pemurnian protein rekombinan pJExpress.
SIMPULAN DAN SARAN
Simpulan
Hasil elektroforegram dan kuantifikasi menunjukan bahwa nilai kepadatan sel 0.4 dengan induksi IPTG 100 mM menghasilkan kondisi optimum terekspresinya protein parasporin-2.
Saran
Hasil elektroforegram protein parasporin-2 masih belum menunjukan hasil yang jelas. Sehingga perlu dilakukan western blotting
untuk mendapatkan visualisasi ekspresi protein rekombinan yang lebih jelas. Selain itu, kuantifikasi hasil purifikasi protein rekombinanpun masih perlu dilakukan.
DAFTAR PUSTAKA
Amano et al. 2005. A novel 29-kDa crystal protein from Bacillus thuringiensis
induces caspase activation and cell death of Jurkat T cells. Biosci Biotechnol Biochem 69: 2063-2072.
Bernhard K & Urtz R. 1993. Production of Bacillus thuringiensis forExperiment and
Commercial Use in Bacillus
thuringiensis, an Environmental
Biopesticide: Theory and Practice.
Bristol: John Walley & Sons.
Bintang. 2010. Teknik Penelitian Biokimia. Jakarta: Erlangga.
Bioscience. 2002. Purification of (His)6
-tagged protein using HisTrap chelating HP columns charged with different metal ions. Terhubung berkalawww.wattson. hoji.ac.ll/purification/PDF/Tag_protein_p urification/Ni-NTA/AMERSHAM_appli cationNote.pdf. [30 November 2012].
Bo-Rad. 2004. Standards for electrophoresis and blotting. United state: Bio-Rad laboratories Inc.
Brock TD et al. 1994. Biology of Microorganism. New Jersey: Prentice Hall Inc.
Campbell NA, Recee JB & Mitchell LG. 2002. Biologi ed ke-5. Lestari R dkk,
penerjemah. Jakarta: Erlangga. Terjemahan dari: Biology 5th ed.
Caprette DR. 1995. Absorbance assay (280). Terhubungberkalawww.ruf.rice.edu/~bios labs/methods/protein/abs280.html. [13 Juni 2012].
Cempaka R. 2011. Pengaruh berbagai konsentrasi Isopropyl-β-D thiogalacto pyranoside (IPTG) terhadap ekspresi protein rekombinan Jembrana Superficial Unit (JSU)pGEX-6PI [Skripsi]. Jakarta: Fakultas Matematika dan Ilmu pengetahuan alam, UI.
Crowe J, Masone BS & ribbe J. 1995. One step purification of recombinant protein with the 6 x His tag and Ni-NTA resin.
Molecular Biotechnology 4:247-257. Farabee MJ. 2007. Control of gene
expression.
Terhubungberkalawww.emc.maricopa.ed u/faculty/farabee/biobk/biobookgenctrl.ht ml. [17 November 2012].
Fatchiyah. 2012. Teknik Analisis Biologi
Molekuler. Malang: Universitas
Brawijaya.
Frank C. 2011. SDS-PAGE (poliacrylamide gel elektrophoresis). Terhubung berkala www.science.smith.edu/departements/Bio chem/Biochem_353/sdspage.html. [14 September 2012].
Gibas C & jambeck P. 2001. Bioinformatics Computer Skills. United States of
America: O’Reilly & Associates, Inc.
Hayakawa T et al. 2007. Parasporin 2Ab a Newly Isolated Cytotoxic Crystal Protein from Bacillus thuringiensis. Jurnal Microbiol 55: 78-83.
Ito A et al. 2006. A Bacillus thuringiensis
crystal protein with selective cytocidal action to human cells. J Biol Chem 279:
21282-21286.
Jenkins JB. 1990. Human Genetics 2nd ed. New York: Harper Collins Publisher, Inc. Jusuf E. 2009. Exploration of Bacillus
thuringiensis δ-endotoxin protein distributed around Jabodetabek region. Microbiology Indonesia 3(2):51-55. King MW. 2011. Control of gene expression.
Terhubungberkalawww.themedicalbioche mistrypage.org/gene-regulation.html. [ 7 November 2012].
Kitada S et al. 2005. Molecular Identification and Cytocidal Action of Parasporin a Protein Group of Novel Crystal Toxins Targetting Human Cancer Cells. Conferense on the Biotechnology of
Bacillus thuringiensis and its
Enviromental Impact 23-27.
Kitada S et al. 2006. Cytocidal actions of parasporin-2, an antitumor crystal toxin from Bacillus thuringiensis. J Biol Chem
281: 26350-26360.
Lodish HF. 2004. Molecular Cell Biology 5th ed. NewYork: WH Freeman and Company.
Manfred Schwab. 2008. Encyclopedia of Cancer (4 Volume Set). Berlin: Springer.
Margawati ET & Ridwan M. 2009. Expression and charachterization of recombinant protein of J-SU pGEX either by single or double cell lysis. Biota 14 (3): 166-171.
Mizuki E et al. 2000. Parasporin, a human leukemic cell-recognizing parasporal protein of Bacillus thuringiensis. Clin Diagn Lab Immunol7: 625-634.
Ohba M, Mizuki E & Uemori A. 2009. Parasporin, a new anticancer protein group from Bacillus thuringiensis.
Anticancer Res. 29 (1) : 427-433.
Paolella P. 1998. Introdustion to Molecular
Biology. Boston: McGraw-Hill
Companies, Inc.
Promega. 2009. E.coli competent cells. New York: Promega corporation.
Robert KJ. 2006. Regulation. Terhubung berkalawww.academic.pgcc.edu/~kroober ts/Lecture/Chapter%207/regulation.html. [4 November 2012].
Sadler et al. 1983. Proc Natl Acad Sci USA. 80:6785.
Scawen MD & Melling J. 1985. Handbook of Enzyme Biotechnology. Alan W, editor. West Sussea: Ellis Horword Lid.
Shaw G. 2011. SDS-PAGE. Terhubung berkalawww.encorbio.com/protocols/SD S-PAGE.htm [14 September 2012]. Stratagene. 2001. BL21(DE3) competent cells,
BL21 (DE3) pLysS component cells, and BL21 competent cells. California: Stratagene.
Vanz et al. 2008. Human granulocyte colony stimulating factor (hg-CSF): Cloning, overeexpression, purification, and characterization. Microbial Cell Factories
7:13.
Widdel F. 2007. Theory and Measurement of Bacterial Growth. Universitas Bremen: Grundpraktikum Microbiologie.
Wolfe SL. 1995. Introduction to Cell and Molecular Biology. Bellmont: Wadsworth Publishing Company.
Yamagiwa M et al. 2002. Cytotoxicity of
Bacillus thuringiensis crystal protein againts mamalian. J Biol Chem 36: 61-66. Yokohama Y et al. 1988 Potentiation of the
cytotoxic activity of anti-cncer drugs againts cultured L1210 cells by Bacillus thuringiensis subsp. isrelensis toxin.
Chem. Pharm. Bull 36 (11) : 4499 – 4504.
Yuwono T. 2002. Biologi Molecular.
Jakarta:Erlangga.
Zhiming T et al. 2005. An improved system for competent cell preparation and high efficiency plasmid transformation using different Escherichia coli strains.
Biotechnology 8(1): 114-120.
13
14
Refresh
kultur
E.coli
Top 10 F
Pengecekan OD & Induksi
IPTG
Pemanenan Kultur
Pemecahan Sel
Kuantifikasi
Purifikasi
Lampiran 2 Komposisi running dan stacking Gel pada Elektroforesis
Komposisi
Running Gel
12%
Poliakrilamida
Stacking Gel
4%
Poliakrilamida
Larutan stok akrilamida 30%
4.15
0.65
1.5 M Buffer tris HCl pH 8.8
2.50
-
0.5 M Buffer tris HCl pH 6.8
-
1.25
Akuades
3.20
3.05
10% (b/v) SDS
0.1
0.05
10% (b/v) Amonium per sulfat
0.05
0.025
TEMED
0.015
0.005
Sumber: Lodish (2004).
16
Lampiran 3 Komposisi larutan dan buffer
Larutan/bufer
Cara Pembuatan
Buffer B (400 ml)
Sebanyak 40 ml Tris-HCl 10 mM; 359 ml NaCl 100
mM; 1 ml Tween-20 ditambahkan ddH
2O hingga
mencapai volume 400 ml.
10% SDS
Sebanyak 5 g SDS ditambahkan ddH
2O hingga
volume 50 ml. larutan diaduk perlahan dengan
magnetic stirrer
hingga larut dan berwarna bening
larutan disimpan pada suhu ruang.
5x SDS
running
pH 8.3
Sebanyak 9 g Tris; glisine 43.2 g; SDS 3 g
ditambahkan ddH
2O hingga mencapai volume 600
ml. Larutan diaduk, kemudian disimpan didalam suhu
4
0C.
Coomasie blue stain for
proteins
Sebanyak 0.25 g
coomasie brilliant blue
; 125 ml
methanol; 50 ml
glacial acetic acid
ditambahkan
ddH
2O hingga mencapai volume 500 ml.
Destain coomasie blue
Sebanyak 100 ml
glacial acetic acid
; 400 ml
methanol ditambahkan ddH
2O hingga volume 1000
ml. larutan diaduk dan disimpan pada suhu ruang.
0.5 M Tris pH 6.8
Sebanyak 6.057 g Tris ditambahkan ddH
2O hingga
100 ml. Larutan diaduk, kemudian ukur pH meter dan
disimpan dalam suhu 4
0C.
1.5 M Tris pH 8.8
Sebanyak 18.171 g Tris ditambahkan ddH
2O hingga
100 ml. Larutan diaduk. Kemudian ukur pH dengan
menggunakan pH meter dan disimpan pada suhu 4
0C.
17
Lampiran 4 Sekuen nukleotida gen penyandi protein PS2Aa1 (Ohba
et.al
2009)
18
Lampiran 6
Hasil analisis elektroforegram menggunakan Photo-CapMw.
a.
Sebelum Purifikasi
L5 = Marker
19
b. Setelah purifikasi
L1 = Elusi 1 (E1) L2 = inner volume (IV) L3 = Marker
20
Lampiran 7 Marka protein Bio-Rad
Marka protein
Bio-Rad
(
Dual color
) yang digunakan dalam penelitian
[sumber: Bio-Rad 2004].
Lampiran 8 Perhitungan konsentrasi protein rekombinan pJExpress.
Rumus
Konsentrasi protein (mg/ml)= (1.55 x A
280)
–
(0.76 x A
260)
Perhitungan
Pengulangan 1 bagian a (OD 0.4: induksi IPTG 100 mM)
A
280= 0.707 ; A
260= 0.512
Konsentrasi protein = (1.55 x 0.707)
–
(0.76 x 0.512)
= 1.096
–
0.389
= 0.707 mg/ml