LAMPIRAN A
DATA PERCOBAAN
LA.1 DATA HASIL EKSTRAKSI MENGGUNAKAN PELARUT
HEKSANA
Dengan menggunakan metode kristalisasi antisolvent menggunakan pelarut heksana, diperoleh data sebagai berikut :
Tabel A.1 Data Hasil Ekstraksi Menggunakan Pelarut Heksana
Jenis
Anti-Solvent (ml)
Perbandingan Jumlah Umpan terhadap Pelarut (F/S,v/v)
1:2 1:2,5 1:3 1:3,5 1:4 1:4,5
Jumlah Likopen Terekstrak (mg/110 mg sampel)
Metanol 0,127 0,130 0,138 0,153 0,250 0,580
Etanol 0,020 0,087 0,093 0,105 0,110 0,470
LA.2 DATA HASIL EKSTRAKSI MENGGUNAKAN PELARUT ETIL
ASETAT
Dengan menggunakan metode kristalisasi antisolvent menggunakan pelarut etil asetat, diperoleh data sebagai berikut :
Tabel A.2 Data Hasil Ekstraksi Menggunakan Pelarut Etil Asetat
Jenis
Anti-Solvent (ml)
Perbandingan Jumlah Umpan terhadap Pelarut (F/S,v/v)
1:2 1:2,5 1:3 1:3,5 1:4 1:4,5
Jumlah Likopen Terekstrak (mg/110 mg sampel)
Metanol 0,210 0,220 0,250 0,340 0,420 0,610
LAMPIRAN B
CONTOH PERHITUNGAN
LB.1 PEMBUATAN LARUTAN UMPAN DALAM CAMPURAN UMPAN DAN PELARUT HEKSANA
a. Membuat larutan perbandingan Umpan terhadap Solvent (1:2) Vsampel = 150 ml
Vsolvent = Vheksana = 2 x 150 ml = 300 ml
b. Membuat larutan perbandingan Umpan terhadap Solvent (1:2,5) Vsampel = 150 ml
Vsolvent = Vheksana = 2,5 x 150 ml = 325 ml
c. Membuat larutan perbandingan Umpan terhadap Solvent (1:3) Vsampel = 150 ml
Vsolvent = Vheksana = 3 x 150 ml = 450 ml
d. Membuat larutan perbandingan Umpan terhadap Solvent (1:3,5) Vsampel = 150 ml
Vsolvent = Vheksana = 3,5 x 150 ml = 525 ml
e. Membuat larutan perbandingan Umpan terhadap Solvent (1:4) Vsampel = 150 ml
Vsolvent = Vheksana = 4 x 150 ml = 600 ml
f. Membuat larutan perbandingan Umpan terhadap Solvent (1:4,5) Vsampel = 150 ml
Vsolvent = Vheksana = 4 x 150 ml = 675 ml
LB.2 PEMBUATAN LARUTAN UMPAN DALAM CAMPURAN
UMPAN DAN PELARUT ETIL ASETAT
a. Membuat larutan perbandingan Umpan terhadap Solvent (1:2) Vsampel = 150 ml
Vsolvent = Vetil asetat = 2 x 150 ml = 300 ml
b. Membuat larutan perbandingan Umpan terhadap Solvent (1:2,5) Vsampel = 150 ml
c. Membuat larutan perbandingan Umpan terhadap Solvent (1:3) Vsampel = 150 ml
Vsolvent = Vetil asetat = 3 x 150 ml = 450 ml
d. Membuat larutan perbandingan Umpan terhadap Solvent (1:3,5) Vsampel = 150 ml
Vsolvent = Vetil asetat = 3,5 x 150 ml = 525 ml
e. Membuat larutan perbandingan Umpan terhadap Solvent (1:4) Vsampel = 150 ml
Vsolvent = Vetil asetat = 4 x 150 ml = 600 ml
f. Membuat larutan perbandingan Umpan terhadap Solvent (1:4,5) Vsampel = 150 ml
Vsolvent = Vetil asetat = 4 x 150 ml = 675 ml
LB.3 PERHITUNGAN RENDEMEN LIKOPEN YANG TEREKSTRAK
(mg/110gr) DENGAN EKSTAKSI MENGGUNAKAN PELARUT
HEKSANA
Rendemen dihitung dalam persen yang menyatakan jumlah pasta yang terdapat di dalam bahan berdasarkan berat basah. Rendemen likopen yang terekstrak pada proses ekstraksi dihitung menggunakan persamaan :
%
- Pada perbandingan 1 : 4,5
LB.4 PERHITUNGAN RENDEMEN LIKOPEN YANG TEREKSTRAK
(mg/110 g) DENGAN EKSTAKSI MENGGUNAKAN PELARUT
ETIL ASETAT
Rendemen dihitung dalam persen yang menyatakan jumlah pasta yang terdapat di dalam bahan berdasarkan berat basah. Rendemen likopen yang terekstrak pada proses ekstraksi dihitung menggunakan persamaan :
%
- Pada perbandingan 1 : 3
LAMPIRAN C
DOKUMENTASI PENELITIAN
LC.1 RANGKAIAN ALAT EKSTRAKSI
Gambar C.1 Rangkaian Alat Ekstraksi
LC.2 EKSTRAK YANG DIPEROLEH SEBELUM PENAMBAHAN
ANTISOLVENT
LC.3 PROSES PENCUCIAN DAN PEMISAHAN EKSTRAK
MENGGUNAKAN AQUADEST
Gambar C.3 Proses Pencucian dan Pemisahan Ekstrak Menggunakan Aquadest
LC.4 HASIL EKSTRAK YANG DIPEROLEH SETELAH
PENAMBAHAN ANTISOLVENT
LC.5 PROSES PENGKRISTALAN YANG TERJADI SETELAH
PENAMBAHAN ANTISOLVENT
Gambar C.5 Proses Pengkristalan yang Terjadi Setelah Penambahan Antisolvent
LC.6 PENYARINGAN KRISTAL YANG DIPEROLEH
(a)
(b)
Gambar C.6 (a) dan (b) Penyaringan Kristal yang Diperoleh
LC.7 KRISTAL LIKOPEN YANG DIPEROLEH
DAFTAR PUSTAKA
[1] Upendra M. Sainju, Ramdane Dris dan Bharat Singh, “Mineral Nutrition of Tomato,” Agricultural Research Station, Fort Valley State University, 2003.
[2] Victor R. Preedy dan Ronald R. Watson, “Tomatoes and Tomato Products,” Science Publishers, Enfield, NH: USA, 2008.
[3] Ita Setiani Rahmawati, Endah Dwi Hastuti, dan Sri Darmanti, “Pengaruh Perlakuan Konsentrasi Kalsium Klorida (CaCl2) dan Lama Penyimpanan
terhadap Kadar Asam Askorbat Buah Tomat (Lycopersicum esculentum Mill.),” Buletin Anatomi dan Fisiologi, 19(1) 2011: hal. 62-70.
[4] Agus Purwadi, Widdi Usada, dan Isyuniarto, “Pengaruh Lama Waktu Ozonisasi Terhadap Umur Simpan Buah Tomat (Lycopersicum esculentum Mill),” Prosiding PPI – PDIPTN. Pusat Teknologi Akselerator dan Proses
Bahan – BATAN, 2007, hal: 234-242.
[5] K.M.S. Weerasinghe1, A.H.K. Balasooriya, S.L. Ransinghe, G.D. Krishantha, R.S. Brahakmanage dan L.C. Wijethilka, 2014. “Effects of Macro and Micro Nutrients on Growth and Yield Performances of Tomato (Lycopersicon Esculentum Mill.),” Proceedings of the Peradeniya Univ. International Research Sessions, Sri Lanka, 18(4) 2014 : hal.556.
[6] BPS (2012), “Produksi Sayuran di Indonesia, 1997-2013,” Badan Pusat Statitistik Republik Indonesia. http://bps.go.id. Diakses pada tanggal 10 Mei 2014.
[7] A. Radzevicius, R. Karkleliene, P. Viskelis, C. Bobinas, R. Bobinaite dan S. Sakalauskiene, “Tomato (Lycopersicon esculentum Mill.) Fruit Quality and Physiological Parameters at Different Ripening Stages of Lithuanian Cultivars,” Agronomy Research. 7(1) 2009 : hal. 712-718.
[8] Aghel N, Ramezani Z, dan Amirfakhrian S, “Isolation and Quantification of Lycopene from Tomato Cultivated in Dezfoul, Iran,” Jundishapur Journal of Natural Pharmaceutical Products, 6(1) 2011 : hal: 9-15.
Evaluation of Analytic Data,” J. Am. Diet. Assoc., 93(1) 1993 : hal.284– 296.
[10] Lihong Liu, Jia Wei, Min Zhang, Liping Zhang, Chuanyou Li dan Qiaomei Wang, “Ethylene Independent Induction of Lycopene Biosynthesis in Tomato Fruits by Jasmonates,” Journal of Experimental Botany, 2012 : hal. 1-14.
[11] Yvon Dumas, Mario Dadomo, Giuseppe Di Lucca dan Pascal Groiler, “Effects of Environmental Factors and Agricultural Techniques on Antioxidant Content of Tomatoes,” Journal of the Science of Food and Agriculture, 83(1) 2003 : hal. 369-382.
[12] Preeti Singh dan G.K. Goyal, “Dietary Lycopene: Its Properties and Anticarcinogenic Effects,” Comprehensive Reviews in Food Science and Food Safety, 7(1) 2008 : hal. 255-270.
[13] G. Sadler, J. Davis dan D. Dezman, “Rapid Extraction of Lycopene and β -Carotene from Reconstitued Tomato Paste and Pink Grapefruit Homogenates,” Journal of Food Science, 55(5) 1990 : hal. 1460-1461. [14] Giuseppe Vasapollo, Luigia Longo, Leonardo Rescio dan Loredana
Ciurlia, “Innovative Supercritical CO2 Extraction of Lycopene from
Tomato in the Presence of Vegetable Oil as Co-Solvent,” Journal of Supercritical Fluids, 29(1) 2003 : hal. 87–96.
[15] Sari H. Hakala dan Heinonen I. Marina, “Chromatographic Purification Of Natural Lycopene,” Journal of Agricultural and Food Chemistry. 42(1) 1994: hal.1314-1316.
[16] F. Miguel, A. Martin, T. Gamse, dan M. J. Cocero, “Supercritical Anti Solvent Precipitation of Lycopene Effect of The Operating Parameters,” Journal of Supercritical Fluids, 36(1) 2006 : hal. 225-235.
[17] Myong-Kyun Roh,, Min-Hee Jeon, Jin-Nam Moon, Woi-Sook Moon, Sun-Mee Park, dan Jae-Suk Choi, “A Simple Method For The Isolation Of Lycopene From Lycopersicon Esculentum,” Botanical Sciences, 91(2) 2013: hal. 187-192.
Solvents,” Journal of Food Composition and Analysis, 15(1) 2002 : hal. 309-317.
[19] A.V. Rao dan S. Agarwal, “Role of Lycopene as Antioxidant Carotenoid in The Prevention of Chronic Diseases: A Review,” Nutrition Research, 19(2) 1998 : hal. 305-323.
[20] Renata Galhardo Borguini dan Elizabeth A. Ferraz Da Silva Torres, “Tomatoes and Tomato Products as Dietary Sources of Antioxidants,” Food Reviews International, 25(1) 2009 : hal. 313-325.
[21] Cassia A. Tavares dan Delia B. Rodriguez-Amaya, “Carotenoid Composition of Brazilian Tomatoes and Tomato Products,” Lebensm-Wiss Technology. 27(1) 1993 : hal. 219-224.
[22] Septiva Asih Pratiwi, “Pengaruh Pemberian Jus Buah Tomat (Lycopersicon Esculentum Mill.) terhadap Perubahan Warna Gigi pada Proses Pemutihan Gigi Secara In Vitro,” Fakultas Kedokteran, Universitas Diponegoro: Semarang, 2009.
[23] Martha Petro-Turza, “Flavor of Tomato and Tomato Products. Food Revies International,” 2(3) 2009 : hal: 309-351.
[24] Santi R. Bhowmik dan Jung C. Pan, “Shelf Life of Mature Green Tomatoes Stored in Controlled Atmosphere and High Humidity,” Journal of Food Science, 57(4) 1992 : hal: 948-953.
[25] Francisco Artes, Francisco Garcia, Jose Marquina, Antonio Cano, dan J. Pablo Fernandez Trujillo, 1998. “Physiological Responses of Tomato Fruit to Cyclic Intermittent Temperature Regimes,” Postharvest Biology and Technology. 14(1) : hal. 283-296.
[26] Nutrient Data Laboratory, ARS, USDA National Food and Nutrient Analysis Program Wave, Beltsville MD, 2001.
[27] F.X Cunningham dan E. Gantt, “Genes And Enzymes of Carotenoid Biosynthesis in Plants,” Annual Reviews. 49(1) 1998 : hal. 557-583.
[29] Joseph R. Cronin, “The Biochemistry of Alternative Medicine Lycopene The Powerful Antioxidant That Makes Tomatoes Red,” Alternative & Complimentary Therapies, 2000, : hal. 92-94.
[30] Thomas W. M. Boileau, Amy C. Boileau dan John W. Erdman, “Bioavailability of all-trans and cis-Isomers of Lycopene,” Experimental Biology and Medicine, 2002 : hal: 914-919.
[31] Peter M. Bramley, “Regulation of Carotenoid Formation During Tomato Fruit Ripening and Development,” Journal of Experimental Botany, 53(377) 2002 : hal. 2107.
[32] Maria Gomez Romero, David Arraez-Roman, Antonio Segura-Carretero, Alberto Fernandez-Gutierrez, “Analytical Determination of Antioxidants in Tomato: Typical Components of the Mediterranean Diet,” Journal of Science. 30(1) 2007 : hal.452-461.
[33] John Shi dan Marc Le Maguer, “Lycopene in Tomatoes: Chemical and Physical Properties Affected by Food Processing,” Critical Reviews in Food Science and Nutrition. 40(1) 2010 : hal. 1-42.
[34] T. Anguelova dan J. Warthsen, “Lycopene Stability in Tomato Powders,” Journal of Food Science, 65(1) 2000 : hal: 67-70.
[35] Nguyen, Minhthy L. dan Steven J. Schwartz, “Lycopene Stability During Food Processing,” Experimental Biology and Medicine, 1999 : hal. 101-105.
[36] Wilhelm Stahl dan Helmut Sies, “Lycopene: A Biologically Important Carotenoid for Humans?” Archives of Biochemistry and Biophysics. 336(1) 1996 : hal. 1-9.
[37] C.J. Geankoplis, “Transport Processes and Separation Process Principles,” Edisi Keempat, Pearson Education Inc : New Jersey, 2003.
[38] Robert E. Treybal, “Mass-Transfer Operations,” Edisi Ketiga, McGraw-Hill, 1981.
[39] Wahyudi Budi Sediawan, “Berbagai Teknologi Pemisahan,” Prosiding Presentasi Ilmiah Daur Bahan Bakar Nuklir V P2TBDU dan
P2BGN-BATAN, Jurusan Teknik Kimia, Fakultas Teknik, UGM: Yogyakarta,
[40] Constantine D. Stalikas, “Extraction, Separation, and Detection Methods for Phenolic Acids and Flavonoids,” Journal of Science, 30(1) 2007: hal. 3268-3295.
[41] A.H. Azizah, N.M. Nik Ruslawati, T. Swee Tee, “Extraction and Characterization of Antioxidant from Cocoa by-Products,” Food Chemistry, 64(1) 1999 : hal. 199-202.
[42] E.M. Silva, H. Rogez, dan Y. Larondelle, “Optimization of Extraction of Phenolics from Inga edulis Leaves Using Response Surface Methodology,” Separation and Purification Technology, 55(1) 2007 : hal. 381-387.
[43] Manuel Pinelo, Monica Rubilar, Maria Jerez, Jorge Sineiro dan Maria Jose Nunez, "Effect of Solvent, Temperature, and Solvent-to-Solid Ratio on the Total Phenolic Content and Antiradical Activity of Extracts from Different Components of Grape Pomace,” Journal of Agricultural and Food Chemistry. 53(1) 2005 : hal. 2111-2117.
[44] Thomas W. Pratt, “Liquid-Liquid Extraction,” Journal of The American Oil Chemists Society, 30(11) 1953 : hal. 497-505.
[45] Danu Ariono, Dwiwahju Sasongko dan Priyono Kusumo, “Dinamika Tetes dalam Kolom Isian,” Program Studi Teknik Kimia, Institut Teknologi Bandung: Bandung, 2012.
[46] Jannat M. Roldan-Gutierrez dan Maria Dolores Luque de Castro, “Lycopene: The Need for Better Methods for Characterization and Determination,” Trends in Analytical Chemistry.,26(2) 2007 : hal. 163-170.
[47] Frederick Khachik, Mudlagiri B. Goli, Gary R. Beecher, Joanne Holden, William R. Lusby, Maria D. Tenorio dan Marcedes R. Barrera, 1992. “Effect of Food Preparation on Qualitative and Quantitative Distribution of Major Carotenoid Constituents of Tomatoes and Several Green Vegetables,” Journal of Agricultural and Food Chemistry, 40(1) 1992 : hal. 390-398.
Increasing Total Antioxidant Activity,” Journal of Agricultural and Food Chemistry. 50(1) 2002 : hal. 3010-3014.
[49] Hussain Al-Wandawi, Maha Abdul-Rahman dan Kaib Al-Shaikhly, “Tomato Processing Wastes as Essential Raw Materials Source,” Journal of Agricultural and Food Chemistry, 33(1) 1995 : hal. 804-807.
[50] C.H. Lin dan B.H. Chen, “Determination of Carotenoids in Tomato Juice by Liquid Chromatography,” Journal of Chromatography, 1012(1) 2003 : hal. 103-109.
[51] H Van Den Berg, R. Faulks, H. Fernando Granado, J. Hirschberg, B. Olmedilla, G. Sandmann, S. Southon dan W. Stahl, “The Potential for The Improvement of Carotenoid Levels in Foods and The Likely Systemic Effects,” Journal of the Science of Food and Agriculture, 80(1) 2000 : hal. 880-912.
[52] Anocha Kajadphai Taungbodhitam, Gwyn P. Jones, Mark L.Wahlqvist dan David R. Briggs, “Evaluation of Extraction Method for The Analysis of Carotenoids in Fruits and Vegetables,” Food Chemistry, 63(4) 1998 : hal. 577-584.
[53] ATSDR (1999) “Chemical and Physical Information,” Toxicological Profiles, Agency for Toxic Substances and Disease Registry, http://www.atsdr.cdc.gov. Diakses pada 30 Maret 2015.
[54] Nugraha Thariq Majid dan Nurkholis, “Pembuatan Teh Rendah Kafein Melalui Proses Ekstraksi dengan Pelarut Etil Asetat,” Universitas Diponogoro: Semarang, 2010.
[55] Bibliotek (2002), “Crystallization,” http://sundoc.bibliothek.uni-halle.de. Diakses pada tanggal 16 Mei 2014.
[56] Giulietti dan Bernardo,“Crystallization by Antisolvent Addition and Cooling,” Chemical Engineering Department Federal University of São Carlos UFSCar Brasil. 2001 : hal. 379.
[58] D.L. Pavia, G.M. Lampman, dan Kriz, G.S., “Introduction To Spectroscopy : A Guide for Students of Organic Chemistry,” (Singapore: Thomson Learning, 2001).
[59] Nurul Fauziah Haq, “Isolasi, Purifikasi, dan Karakterisasi Likopen dari Hasil Fermentasi Rhodotorula Mucilaginosa Uicc Y-169,” Skripsi, Program Sarjana Fakultas Matematika dan Ilmu Pengetahuan Alam UI, Depok, 2012, hal 25.
[60] SR Kumar, Sundar SS, Afandi A dan Rahman S, “Optimization of Lycopene From Malaysian All Sesason Coloured Fleshy Fruits,” International Journal of Biology, Pharmacy an Allied Sciences (IJBPAS),
2(7) 2013 : hal. 1455-1467.
[61] Seda Ersus Bilek, “The Effects of Time, Temperature, Solvent: Solid Ratio And Solvent Composition on Extraction of Total Phenolic Compound from Dried Olive (Olea Europaea L.) Leaves,” GIDA, 35(6) 2010 : hal. 411-416.
[62] Sudipta Das dan Debabrata Bera, “Mathematical Model Study on Solvent Extraction Of Carotene from Carrot,” International Journal of Research in Engineering and Technology (IJRET), 2(9) 2009 : hal. 343-349.
[63] M.A. Al-Farsi dan Chang Y.L, “Optimization of Phenolics and Dietary Fibre Extraction from Date Seeds,” Food Chemistry, 108(3) 2007 : hal. 977-985.
[64] P.W.Tan, C.P.Tan dan Ho,C. W, “Antioxidant Properties: Effect of Solid-to-Solvent Ratio on Antioxidant Compounds and Capacities of Pegaga (Centella Asiatica),” International Food Research Journal, 18(1) 2011 : hal. 553-558.
[65] S.Q.Zhang, H.M.Bi dan C.J. Liu, “Extraction of Bio-Active Components from Rhodiola Sachalinensis under Ultrahigh Hydrostatic Pressure,” Separation and Purification Technology, 57(1) 2007 : hal. 277-282.
[67] Reverchon E, “Supercritical Antisolvent Precipitation of Nanoparticles of a Zinc Oxide Precursor,” Powder Technology, 102(1) 1999 : hal.127–134. [68] Tu LS, Dehghani F dan Foster NR, “Micronisation and
Microencapsulation of Pharmaceuticals Using a Carbon Dioxide Antisolvent,” Powder Technology, 126(1) 2002 : hal.134–149.
[69] Pornsak Sriamornsak dan Kanokporn Burapapadh, “Characterization of Recrystallized Itraconazole Prepared by Cooling and Anti-Solvent Crystallization,” Asian Journal of Pharmaceutical Sciences, 2015 : hal. 1-9.
[70] Y. Wu, D. Lin dan T. Chau, “Ultrasound-Assisted Extraction of Ginseng Saponins from Ginseng Roots and Cultured Ginseng Cells,” 8(1) 2001 : hal.347-352.
[71] S Mussatto, L. Ballesteros, S. Martins dan J. Teixeira, “Extraction of Antioxidant Phenolic Compounds from Spent Coffee Grounds,” Separation and Purification Technology, 83(1) 2011 : hal.173-179.
[72] J. Xi, “Caffeine Extraction from Green Tea Leaves Assisted by High Pressure Processing,” Journal of Food Engineering, 94(1) 2009 : hal.105-109.
[73] W. Peschel, Sanchez-Rabaneda F., Dn W. Plescher A., Gartzia I., Jimenez D., Lamuela-Raventos R., Buxaderas S., Condina C,“An Industrial Approach in the Search of Natural Antioxidants from Vegetable and Fruit Wastes,” Food Chem, 97(1) 2006 : hal.137-150.
[74] Saima Haroon, “Extraction of Lycopene from Tomato Paste and its Immobilization for Controlled Release,” The University of Waikato, 2014.
[75] Hadi Salari, Hanie Rohani, Mohammad Reza Elahifard, Mohammad Hosseini dan Mohammad Reza Gholami, “Solvents Design on the Basis of Molecular-Microscopic Properties of Binary Mixtures for Lycopene Extraction,” American Journal of Chemistry. 2(2) 2012 : hal. 94-98.
Bioavailability,” European Journal of Pharmaceutical Sciences, 40(1) 2010 : hal. 325-334.
[77] M. W. Park dan S. D. Yeo, “Antisolvent Crystallization of Carbamazepine From Organic Solutions,” Chemical Engineering Research and Design, 90(1) 2012 : hal. 2202-2208.
BAB III
METODOLOGI PENELITIAN
3.1 LOKASI DAN WAKTU PENELITIAN
Penelitian dilakukan di Laboratorium Proses Industri Kimia dan Laboratorium Penelitian, Departemen Teknik Kimia, Fakultas Teknik, dan Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara, Medan. Penelitian ini dilakukan selama lebih kurang 6 bulan.
3.2 BAHAN
Pada penelitian ini bahan yang digunakan antara lain: 1. Jus tomat matang
2. Etanol 3. Metanol 4. Heksana 5. Etil asetat
3.3 PERALATAN PENELITIAN 1. Pisau
2. Chiller
3. Beaker glass
4. Gelas ukur 5. Pipet tetes 6. Labu leher tiga 7. Refluks kondensor 8. Statif dan klem 9. Termometer 10. Neraca analitik 11. Labu Leher Tiga 12. Gabus
15. Hot Plate
16. Magnetic Stirrer
17. Fourier Transform Infrared Spectroscopy (FTIR)
3.4 PROSEDUR PERCOBAAN
3.4.1 Persiapan Bahan Baku
Buah tomat dicuci dengan air keran beberapa kali hingga bersih. Kemudian buah tomat dipotong - potong lalu dihaluskan menggunakan blender. Buah tomat yang telah dihaluskan kemudian disimpan di dalam chiller hingga digunakan.
3.4.2 Ekstraksi
Diukur 150 ml sampel kemudian sampel diekstraksi selama 3 jam dengan pelarut heksana dengan perbandingan umpan:pelarut (1:2) pada temperatur 65 oC. Ekstrak dan rafinat yang diperoleh dicuci dengan aquadest kemudian dimasukkan ke dalam corong pemisah untuk memisahkan ekstrak dan rafinat. Ekstrak dicuci dengan aquadest sambil diguncang untuk memisahkan ekstrak dengan pengotor-pengotornya. Setelah terbentuk 2 lapisan, ambil semua lapisan atas (nonpolar) kemudian tampung ke dalam beaker glass.
3.4.3 Kristalisasi dengan Antisolvent
3.5 FLOWCHART PERCOBAAN
3.5.1 Flowchart Persiapan Bahan Baku
Gambar 3.1 Flowchart Persiapan Bahan Baku Mulai
Buah tomat dicuci dengan air keran beberapa kali
Buah tomat dipotong-potong
Dilakukan penghalusan menggunakan blender
Disimpan pada chiller hingga digunakan
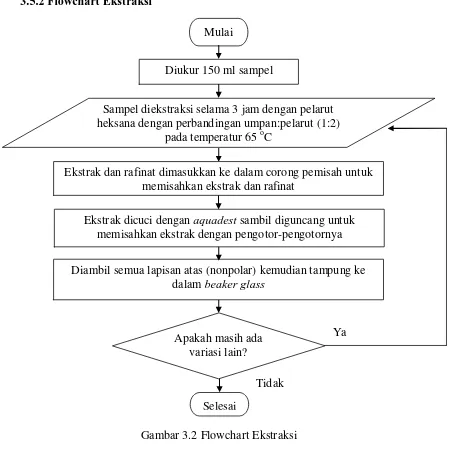
3.5.2 Flowchart Ekstraksi
Gambar 3.2 Flowchart Ekstraksi Tidak
Ya Mulai
Selesai
Diukur 150 ml sampel
Sampel diekstraksi selama 3 jam dengan pelarut heksana dengan perbandingan umpan:pelarut (1:2)
pada temperatur 65 oC
Apakah masih ada variasi lain?
Ekstrak dan rafinat dimasukkan ke dalam corong pemisah untuk memisahkan ekstrak dan rafinat
Ekstrak dicuci dengan aquadest sambil diguncang untuk memisahkan ekstrak dengan pengotor-pengotornya
3.5.3 Flowchart Kristalisasi dengan Antisolvent
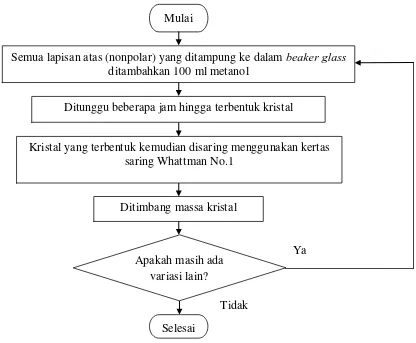
Gambar 3.3 Flowchart Kristalisasi dengan Antisolvent Mulai
Ditimbang massa kristal
Selesai
Ditunggu beberapa jam hingga terbentuk kristal
Kristal yang terbentuk kemudian disaring menggunakan kertas saring Whattman No.1
Semua lapisan atas (nonpolar) yang ditampung ke dalam beaker glass ditambahkan 100 ml metanol
Apakah masih ada variasi lain?
Ya
BAB IV
HASIL DAN PEMBAHASAN
4.1 KARAKTERISASI FTIR (FOURIER TRANSFORM INFRA RED)
HASIL EKSTRAKSI LIKOPEN DARI BUAH TOMAT DENGAN
PENAMBAHAN ANTISOLVENT
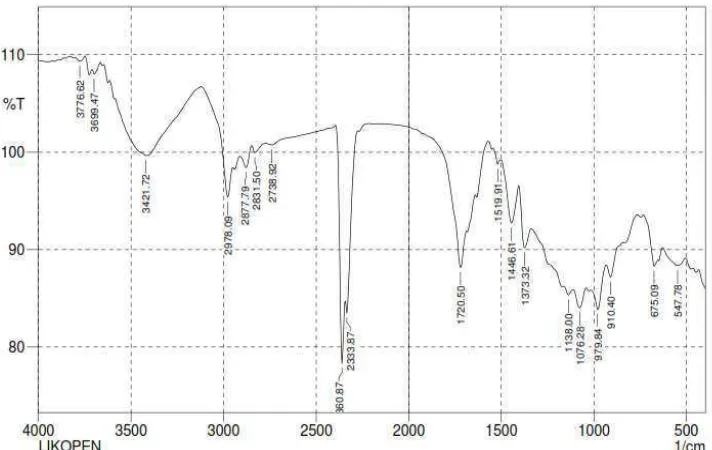
Karakterisasi FTIR (Fourier Transform Infra Red) hasil ekstraksi likopen dari buah tomat dengan penambahan antisolvent dilakukan untuk mengidentifikasi gugus fungsi dari senyawa likopen. Karakteristik FTIR dari hasil ekstraksi likopen dari buah tomat dengan penambahan antisolvent dapat dilihat pada Gambar 4.1 di bawah ini.
Gambar 4.1 Karakterisasi FTIR (Fourier Transform Infra Red) Hasil Ekstraksi Likopen dari Buah Tomat dengan Penambahan Antisolvent
Keterangan analisa gugus fungsi [58]:
- 910,40 cm-1 : ikatan pada alkena (R-CH=CH-R) - 979,84 cm-1 : ikatan pada alkena (R-CH=CH-R) - 1373,32 cm-1 : ikatan dari metil (CH
3) - 1446,61 cm-1 : ikatan dari etil (CH2) - 1720,50 cm-1 : ikatan alkena (C=C)
- 2877,79 cm-1 : gugus karbon-hidrogen (C–H) - 2978,09 cm-1 : gugus karbon-hidrogen (C–H)
- 3421,72 cm-1 : gugus alkohol yang berikatan dengan hidrogen (H-OH)
gelombang sebagai berikut : 956,72 cm-1; 1.373,36 cm-1; 1.456,30 cm-1; 1.647,26 cm-1; 1.743,71 cm-1; 2.879,82 cm-1; 2.910,68 cm-1; 3.392,90 cm-1. Spektrum dianalisis dengan mencermati puncak serapan gelombang yang diperlihatkan data spektrum puncak serapan pada bilangan gelombang sebagai berikut : bilangan gelombang 956,72 cm-1 menunjukkan gugus R-CH=CH-R pada rantai likopen. Bilangan gelombang 1.373,36 cm-1 menunjukkan gugus -CH3- pada rantai
likopen. Bilangan gelombang 1.456,30 cm-1 menunjukkan vibrasi bending dari -CH2- pada rantai likopen. Bilangan gelombang 1.647,26 cm-1 dan 1.743,71 cm-1
menunjukkan adanya ikatan C=C pada rantai likopen. Bilangan gelombang 2.879,82 cm-1 dan 2.910,68 cm-1 menunjukkan gugus C-H pada rantai likopen. Bilangan gelombang 3.392,90 cm-1 kemungkinan gugus O-H dari uap air yang terikat pada likopen [59].
Maka dari hasil analisa FTIR ini dapat disimpulkan bahwa likopen yang dihasilkan memiliki gugus-gugus yang diharapkan.
4.2 PENGARUH PERBANDINGAN UMPAN DAN PELARUT (F/S)
HEKSANA DAN JENIS ANTISOLVENT TERHADAP EKSTRAKSI
LIKOPEN
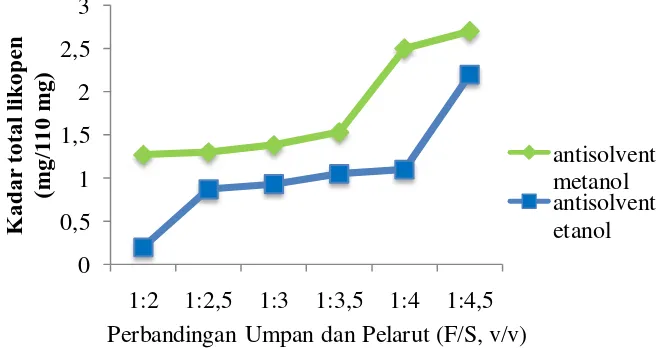
Berdasarkan hasil penelitian, pengaruh perbandingan umpan dan pelarut (F/S) heksana dan jenis antisolvent terhadap ekstraksi likopen dapat dilihat pada gambar 4.2.
Gambar 4.2 Pengaruh Perbandingan Umpan dan Pelarut (F/S) Heksana dan Jenis Antisolvent terhadap Ekstraksi Likopen
0
Perbandingan Umpan dan Pelarut (F/S, v/v)
Dari Gambar 4.2 dapat dilihat bahwa semakin besar perbandingan umpan dan pelarut (F/S) heksana yang digunakan maka kadar total likopen yang diperoleh semakin meningkat pula. Pada perbandingan umpan dan pelarut 1:4,5 diperoleh kadar total likopen paling tinggi baik pada antisolvent metanol maupun pada etanol yaitu 2,7 mg/150 ml dan 2,2 mg/150 ml. Hal ini sesuai dengan teori bahwa jumlah likopen semakin meningkat dengan semakin besarnya volume pelarut [60].
Berdasarkan grafik di atas dapat dilihat bahwa pada perbandingan Umpan:Pelarut (F/S) 1:2, jumlah likopen yang terekstrak sebesar 1,27 mg/150 ml sampel untuk antisolvent metanol dan 0,2 mg/150 ml sampel untuk antisolvent etanol. Hal ini menandakan bahwa rendemen likopen yang terekstrak pada tomat
masih sedikit, dimana kandungan likopen dalam buah tomat adalah 3.041 μg/100
gram buah tomat [26]. Massa 150 ml jus tomat yang digunakan adalah 110 gram
sehingga dalam umpan jus tomat 150 ml, terdapat likopen sebesar 3.345,1 μg/110
gram jus tomat. Masih rendahnya rendemen likopen ini dikarenakan oleh pelarut yang digunakan untuk mengekstraksi masih dalam jumlah kecil. Ikatan hidrogen yang kuat dan tingkat kebasaan yang besar dapat menyebabkan pembengkakan pada jaringan tomat, yang menyebabkan solvent berpenetrasi dengan mudah.
Peningkatan terus terjadi pada perbandingan Umpan:Pelarut (F/S) 1:4, jumlah likopen yang terekstrak yaitu sebesar 2,5 mg/150 ml sampel untuk antisolvent metanol dan 1,1 mg/150 ml sampel untuk antisolvent etanol. Semakin banyak pelarut yang digunakan yaitu pada perbandingan Umpan:Pelarut (F/S) 1:4,5, jumlah likopen yang terekstrak meningkat kembali yaitu sebesar 2,7 mg/150 ml sampel untuk antisolvent metanol dan 2,2 mg/150 ml sampel untuk antisolvent etanol.
Bila perbandingan umpan dan pelarut makin besar, maka makin besar pula jumlah likopen yang terekstraksi dan juga semakin tinggi yield ekstraksi yang diperoleh [62]. Rasio umpan dan pelarut yang tinggi menghasilkan ekstrak dalam jumlah besar, hal ini sesuai dengan prinsip perpindahan massa dimana driving force untuk perpindahan massa adalah gradien konsentrasi antara umpan dengan
pelarut. Rasio umpan dan pelarut yang tinggi dapat mendukung peningkatan gradien konsentrasi, yang menghasilkan kenaikan laju difusi yang menyebabkan ekstraksi lebih optimal oleh pelarut [63,64]. Hal ini sejalan dengan Zhang et al. [65] yang menyatakan bahwa kesempatan komponen bio-aktif untuk melakukan kontak dengan solvent pengekstraksi semakin meningkat seiring dengan meningkatnya jumlah solvent pengekstrasi dan tidak akan berlanjut hingga tercapainya kesetimbangan [64].
Gambar 4.3 Hasil Analisa HPLC Ekstraksi Likopen dari Buah Tomat Menggunakan Pelarut (A) Heksana dan (B) Etil Asetat [17]
Dari Gambar 4.3 dapat dilihat bahwa nilai absorbansi likopen hasil ekstraksi likopen menggunakan pelarut heksana lebih rendah bila dibandingkan dengan ekstraksi menggunakan pelarut etil asetat. Maka dari penelitian yang telah dilakukan, dapat disimpulkan bahwa hasil penelitian telah sesuai dengan teori.
Kristalisasi dari larutan dapat dianggap sebagai proses dua langkah. Langkah pertama adalah pemisahan fasa (pembentukan) dari kristal baru. Yang kedua adalah pertumbuhan kristal ini menjadi ukuran yang lebih besar. Kedua proses dikenal sebagai nukleasi dan pertumbuhan kristal. Analisis proses kristalisasi industri membutuhkan pengetahuan baik nukleasi maupun pertumbuhan kristal. Pembentukan kristal baru, yang disebut nukleasi, mengacu pada awal proses pemisahan fasa. Molekul-molekul zat terlarut telah membentuk partikel berukuran sekecil mungkin pada kondisi saat ini. Tahap selanjutnya dari proses kristalisasi ialah inti tumbuh lebih besar dengan penambahan molekul zat terlarut dari larutan yang sangat jenuh. Bagian dari proses kristalisasi ini dikenal sebagai pertumbuhan kristal. Pertumbuhan kristal, bersama dengan nukleasi, mengontrol distribusi ukuran partikel akhir yang diperoleh pada sistem. Selain itu, kondisi dan laju pertumbuhan kristal memiliki dampak yang signifikan terhadap kemurnian produk dan sifat kristal [55].
yang mempengaruhi bentuk dan sifat kristal. Kelarutan terjadi maksimum dengan penggunaan metanol sebagai antisolvent dan semakin berkurang dengan bertambahnya rantai pada alkohol. Efek ini mengindikasikan bahwa kemampuan pelarut untuk membentuk ikatan hidrogen dengan hetero-atom pada molekul merupakan faktor penting yang mempengaruhi kelarutan pada alkohol. Semakin panjang rantai alkil pada alkohol, kemampuannya untuk membentuk ikatan hidrogen dengan molekul semakin menurun, terutama pada alkohol dengan cabang dari gugus metil, kelarutan akan menurun. Dengan penambahan alkohol, semakin tinggi tingkat kepolaran maka kristal akan semakin berlapis-lapis dibandingkan dengan alkohol dengan tingkat kepolaran rendah. Dengan penambahan metanol, kristal yang terbentuk akan berbentuk seperti plat, sedangkan dengan penambahan alkohol lain, kristal akan seperti jarum dengan serpihan-serpihan. Metanol dan etanol menghasilkan pembentukan kristal yang cepat [69].
Gambar 4.4 Morfologi Kristal dengan Penambahan Antisolvent (a) Metanol dan (b) Etanol [69]
Metanol sebagai antisolvent memiliki koefisien partisi yang lebih tinggi daripada etanol dimana koefisien partisi berhubungan dengan daya pelarutan karetenoid dan trigliserida [17]. Maka dari penelitian yang telah dilakukan, dapat disimpulkan bahwa hasil penelitian telah sesuai dengan teori.
4.3 PENGARUH PERBANDINGAN UMPAN DAN PELARUT (F/S)
ETIL ASETAT DAN JENIS ANTISOLVENT TERHADAP
EKSTRAKSI LIKOPEN
Berdasarkan hasil penelitian, pengaruh perbandingan umpan dan pelarut (F/S) etil asetat dan jenis antisolvent terhadap ekstraksi dapat dilihat pada gambar 4.5.
Gambar 4.5 Pengaruh Perbandingan Umpan dan Pelarut (F/S) Etil Asetat dan Jenis Antisolvent terhadap Ekstraksi Likopen
Dari Gambar 4.5 dapat dilihat bahwa semakin besar perbandingan umpan dan pelarut (F/S) etil asetat yang digunakan maka kadar total likopen yang diperoleh semakin meningkat. Pada perbandingan umpan dan pelarut 1:4,5 diperoleh kadar total likopen paling tinggi baik pada antisolvent metanol maupun pada etanol yaitu 3,2 mg/150 ml dan 2,8 mg/150 ml. Hal ini sesuai dengan teori bahwa jumlah likopen semakin meningkat dengan semakin besarnya volume pelarut [60].
Berdasarkan grafik di atas dapat dilihat bahwa pada perbandingan Umpan:Pelarut (F/S) 1:2, maka jumlah likopen yang terekstrak sebesar 1,5 mg/150 ml sampel untuk antisolvent metanol dan 0,8 mg/150 ml sampel untuk antisolvent etanol. Hal ini menandakan bahwa rendemen likopen yang terekstrak pada tomat masih sedikit, dimana kandungan likopen dalam buah tomat adalah
Perbandingan Umpan dan Pelarut (F/S, v/v)
3.041 μg/100 gram buah tomat [26]. Massa 150 ml jus tomat yang digunakan adalah 110 gram sehingga dalam umpan jus tomat 150 ml, terdapat likopen
sebesar 3.345,1 μg/110 gram jus tomat. Berdasarkan Wu et.al., [70] dan Mussatto
et.al., [71] metode tradisional ekstraksi dengan pelarut didasarkan pada pemilihan
pelarut dan konsentrasinya, perbandingan umpan dan pelarut, waktu kontak dan penggunaan panas dan atau pengadukan untuk meningkatkan kelarutan material dan laju perpindahan massa. Masih rendahnya rendemen likopen yang diperoleh dikarenakan perpindahan massa belum terjadi sempurna akibat masih rendahnya gradien konsentrasi yang merupakan driving force perpindahan massa. Demikian juga pada perbandingan Umpan:Pelarut (F/S) 1:2,5, jumlah likopen yang terekstrak masih rendah yaitu sebesar 1,9 mg/150 ml sampel untuk antisolvent metanol dan 1,4 mg/150 ml sampel untuk antisolvent etanol. Selanjutnya pada perbandingan Umpan:Pelarut (F/S) 1:3, jumlah likopen yang terekstrak masih rendah, namun mengalami peningkatan dari perbandingan Umpan:Pelarut (F/S) sebelumnya yaitu sebesar 2,3 mg/150 ml sampel untuk antisolvent metanol dan 1,6 mg/150 ml sampel untuk antisolvent etanol. Sementara itu pada perbandingan Umpan:Pelarut (F/S) 1:3,5, jumlah likopen yang terekstrak lebih meningkat lagi yaitu sebesar 2,7 mg/150 ml sampel untuk antisolvent metanol dan 2,1 mg/150 ml sampel untuk antisolvent etanol. Peningkatan terus terjadi pada perbandingan Umpan:Pelarut (F/S) 1:4, jumlah likopen yang terekstrak yaitu sebesar 2,9 mg/150 ml sampel untuk antisolvent metanol dan 2,4 mg/150 ml sampel untuk antisolvent etanol. Semakin banyak pelarut yang digunakan yaitu pada perbandingan Umpan:Pelarut (F/S) 1:4,5, jumlah likopen yang terekstrak meningkat kembali yaitu sebesar 3,2 mg/150 ml sampel untuk antisolvent metanol dan 2,8 mg/150 ml sampel untuk antisolvent etanol.
Kelarutan antioksidan dan laju perpindahan massa bervariasi tergantung dengan polaritas pelarut dan jumlah zat organik yang digunakan . Kelarutan komponen bioaktif kedalam pelarut adalah proses fisis, kesempatan komponen bioaktif untuk berkontak dengan pelarut meningkat jika perbandingan umpan dan pelarut semakin besar yang akan menyebabkan laju ekstraksi semakin besar [72].
berbeda-beda dari berbagai sifat kimia dan kepolaran yang berbeda yang dapat atau tidak dapat larut pada pelarut tertentu. Etil asetat sebagai pelarut yang bersifat polar sangat efektif untuk mengekstraksi antioksidan [73].
Setelah dilakukan percobaan dengan pelarut yang berbeda, etil asetat memiliki efisiensi ekstraksi yang terbaik. Hasil HPLC menunjukkan bahwa terdapat peak tajam untuk likopen, yang mengindikasikan bahwa tidak ada komponen atau kontaminan lain yang terdapat pada ekstrak. Dimana pelarut organik lain juga mengekstrak komponen lain selain likopen. Etil asetat juga lebih disukai karena harganya yang murah, tingkat toksisitasnya yang rendah dan baunya yang tidak menusuk [74] karena dalam pertimbangan pemilihan pelarut, terdapat dua hal yang penting yaitu efisiensi ekstraksi dan efek yang minimum untuk kesehatan manusia [75]. Maka dari penelitian yang telah dilakukan, dapat disimpulkan bahwa hasil penelitian telah sesuai dengan teori.
Kristalisasi antisolvent adalah metode pemisahan dan pemurnian yang merupakan cara yang efektif untuk menghasilkan partikel berukuran nano [76]. Teknik ini menghasilkan kristal dari larutan dan mengontrol sifat kristal seperti ukuran partikel dan morfologinya [77]. Penggunaan antisolvent pada proses kristalisasi mengurangi kelarutan zat terlarut pada larutan dan menyebabkan terjadinya kristalisasi secara cepat. Sifat fisika dan kimia antisolvent dapat mempengaruhi pencampurannya dengan larutan sehingga mempengaruhi laju nukleasi dan pertumbuhan kristal. Paremeter kristalisasi sangat mempengaruhi mekanisme pembentukan partikel, ukuran kristal, dan distribusinya [78].
BAB V
KESIMPULAN DAN SARAN
5.1 KESIMPULAN
Adapun kesimpulan yang diperoleh dari penelitian ini adalah semakin besar perbandingan umpan dan pelarut maka yield likopen yang diperoleh akan semakin besar karena jumlah likopen akan semakin meningkat dengan semakin bertambah besarnya volume pelarut. Rasio umpan dan pelarut yang tinggi dapat mendukung peningkatan gradien konsentrasi, yang menghasilkan kenaikan laju difusi yang menyebabkan ekstraksi lebih optimal oleh pelarut. Dengan penggunaan antisolvent metanol, yield likopen yang diperoleh semakin besar dibandingkan dengan penggunaan etanol sebagai antisolvent karena metanol sebagai antisolvent memiliki koefisien partisi yang lebih tinggi daripada etanol dimana koefisien partisi berhubungan dengan daya pelarutan karetenoid dan trigliserida. Dan dengan penggunaan pelarut etil asetat, yield likopen yang diperoleh semakin besar dibandingkan dengan penggunaan heksana sebagai pelarut.
5.2 SARAN
Saran yang dapat diberikan untuk penelitian selanjutnya adalah :
1. Sebaiknya hasil ekstraksi dianalisa terlebih dahulu sebelum dilakukan penambahan antisolvent sehingga dapat dianalisa kadar recovery likopen dengan penambahan antisolvent.
2. Sebaiknya range perbandingan Umpan dan Pelarut (F/S) dibuat lebih besar agar dapat dilihat perbandingan dimana larutan sudah jenuh sehingga hasil ekstraksi berkurang, akibat ekstraksi tidak terjadi secara optimal lagi. 3. Sebaiknya dilakukan analisa lain untuk menganalisa likopen yang
BAB II
TINJAUAN PUSTAKA
2.1 TOMAT (Lycopersicum esculentum)
Tomat (Lycopersicum esculentum) merupakan salah satu sayuran yang paling banyak dikonsumsi, dan telah menjadi tanaman sayuran yang paling penting kedua di seluruh dunia. Tomat merupakan sumber utama antioksidan. Pada kenyataannya, studi epidemiologi telah menunjukkan bahwa konsumsi tomat mentah dan produk berbasis tomat dikaitkan dengan penurunan risiko kanker dan penyakit kardiovaskular [19]. Antioksidan tomat termasuk karotenoid seperti β -karoten, prekursor vitamin A, dan terutama likopen, yang sebagian besar bertanggung jawab untuk warna merah dari buah, vitamin seperti asam askorbat dan tokoferol, dan senyawa fenolik seperti flavonoid dan turunan asam hydroxycinnamik [20,21]. Tomat dan produk tomat kaya sumber vitamin C dan A, likopen, β - karoten, lutein, lektin, dan berbagai senyawa fenolik seperti flavonoid dan asam fenolat. Mereka kaya folat, kalium, serat, dan protein, tetapi rendah lemak dan kalori, serta bebas kolesterol [2].
Secara taksonomi tomat termasuk dalam klasifikasi sebagai berikut : [22]
Kingdom : Plantae
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotylodenae
Ordo : Tubiflorae
Sub ordo : Myrtales
Famili : Solanaceae
Genus : Lycopersium
Spesies : Lycopersicon esculentum Mill. sinonim Lycopersium
licopersium.
amino, pigmen dan lebih dari 400 senyawa aroma berkontribusi terhadap rasa, aroma dan aroma profil volatil tomat [23]. Pematangan tomat ditandai oleh pelunakan buah, degradasi klorofil dan peningkatan laju respirasi, produksi etilen, serta sintesis asam, gula dan likopen [24,25].
Tabel 2.1 Kandungan Nutrisi Buah Tomat dalam 100 gram Buah Tomat [26]
Nutrisi Satuan Kadar per 100 gram tomat
Vitamin C mg 22,8
Vitamin B-6 mg 0,079
Folat μg 13
Vitamin A IU 489
Likopen μg 3.041
β-karoten μg 293
Lutein μg 94
Vitamin E mg 0,56
Vitamin K μg 2,8
2.2 LIKOPEN
Karotenoid merupakan komponen penting dalam fotosintesis organisme [27] Karotenoid juga menyediakan warna pada bunga dan buah-buahan. Misalnya, likopen memberikan warna merah pada tomat dan buah-buahan lainnya. Karotenoid terbagi menjadi karoten (misalnya likopen) dan xanthophylls (misalnya lutein) tergantung pada apakah terdapat oksigen dalam struktur molekul mereka [28].
Likopen adalah karotenoid dengan rumus C40H56 dan memiliki berat
molekul 536,85 g / mol. Rumus strukturnya adalah:
Gambar 2.1 Rumus Struktur Likopen [8]
Likopen adalah hidrokarbon tak jenuh yang mengandung 11 ikatan rangkap terkonjugasi dan dua ikatan rangkap tak terkonjugasi seperti yang diilustrasikan pada Gambar 2.2 [31,32]. Degradasi yang tidak diinginkan dari likopen tidak hanya mempengaruhi kualitas sensorik dari produk akhir, tetapi juga manfaat kesehatan dari makanan berbasis tomat bagi tubuh manusia. Likopen dalam buah tomat segar terjadi pada dasarnya dalam konfigurasi all-trans. Penyebab utama degradasi likopen tomat selama pemrosesan adalah isomerisasi dan oksidasi. Isomerisasi mengkonversi isomer all-trans ke cis-isomer karena masukan energi tambahan dan hasilnya tidak stabil. Pengolahan termal (bleaching, retort, dan proses pembekuan) umumnya menyebabkan hilangnya likopen dalam makanan berbasis tomat. Panas menginduksi isomerisasi all- trans ke bentuk cis. Cis-isomer meningkat dengan suhu dan waktu proses. Secara umum, tomat yang didehidrasi atau menjadi bubuk memiliki stabilitas likopen yang buruk kecuali dengan hati-hati segera diproses, serta disimpan dalam lingkungan tertutup rapat dan inert untuk penyimpanan. Peningkatan yang signifikan pada cis-isomer terjadi dengan penurunan simultan all-trans [8].
Sintesis pigmen pada tomat berhubungan dengan proses pematangan, dan warna merah pada buah merupakan hasil dari akumulasi likopen. Tingkat likopen buah tomat ditentukan dari potensi genetik jenisnya dan kondisi lingkungan, terutama suhu dan cahaya. Selama periode pematangan, komposisi likopen pada buah meningkat tajam [11].
Struktur terkonjugasi membuat likopen antioksidan yang sangat efektif dan mungkin juga bertanggung jawab untuk perannya dalam pencegahan kanker jenis tertentu [34]. Namun, struktur terkonjugasi ini juga membuat likopen rentan terhadap degradasi oksidatif, dan seperti karotenoid lain, sensitif terhadap faktor-faktor seperti oksigen, paparan cahaya, dan pH ekstrim [35].
Aktivitas antioksidan likopen yang dianggap mekanisme utama aksi in vivo. Likopen memiliki aktivitas antioksidan tinggi dibandingkan dengan
karotenoid lain. Likopen dapat menyerap energi dari oksigen tunggal, mengkonversi likopen ke keadaan triplet nya. Energi ini kemudian tersebar ke media sekitarnya melalui gerakan rotasi dan vibrasi [36].
2.3 EKSTRAKSI
Untuk memisahkan satu atau lebih komponen pada campuran, campuran dikontakkan dengan fasa lain. Dua pasangan fasa dapat berupa gas-cair, uap-cair, cair-cair, atau cair-padat.
Pada distilasi, cairan secara parsial diuapkan untuk membuat fasa lain, yaitu uap. Pemisahan dari komponen-komponennya tergantung dari tekanan uap parsial substansi tersebut. Fasa uap dan cair sama secara kimia. Pada ekstraksi cair-cair, kedua fasa secara kimia cukup berbeda, yang menuntun kepada pemisahan komponen-komponennya berdasarkan sifat fisik dan kimia.
Ekstraksi pelarut dapat digunakan sebagai alternatif dari pemisahan secara distilasi maupun evaporasi [37].
2.3.1 Ekstraksi Padat Cair (Leaching)
dilanjutkan dengan berdifusi keluar permukaan partikel padatan dan bergerak ke lapisan film sekitar padatan, untuk selanjutnya ke badan cairan [38].
Misalnya ada campuran fasa padat A dan C yang akan diambil C-nya, maka ditambahkan solven B cair yang bisa melarutkan C tetapi tidak melarutkan A. Diperoleh ekstrak berupa larutan C dalam B. Selanjutnya B dipisahkan dari C, biasanya dengan penguapan, dan dipakai lagi untuk leaching. Proses ini juga bisa dipakai untuk pengambilan minyak atsiri dari hasil-hasil tanaman Indonesia. Industri rakyat umumnya masih belum bisa memanfaatkan teknologi ini karena kelayakan proses ini sangat ditentukan oleh keberhasilan pengambilan kembali (recovery) solven, yang membutuhkan peralatan yang relatif baik.
Harga solven ini biasanya relatif mahal, sehingga kehilangan solven akan sangat merugikan. Kelemahan lain proses ini adalah adanya sedikit solven yang tertinggal dalam produk. Untuk produk-produk tertentu, terutama bahan makanan, adanya sedikit solven tersisa tersebut perlu dihindari.
Proses leaching umumnya memerlukan suhu agak tinggi karena daya larut akan naik dengan naiknya suhu. Suhu agak tinggi ini sering menimbulkan kerusakan bahan, sehingga kualitas produk turun. Masalah lain yang timbul adalah bahwa solven pada umumnya tidak sempurna selektivitasnya sehingga ada zat-zat lain yang ikut terambil dalam ekstrak. Setelah solven diuapkan, masih diperoleh campuran sejumlah zat yang perlu dimurnikan lebih lanjut. Misalnya pada ekstraksi minyak atsiri dari bunga-bungaan, diperoleh produk yang disebut concrete, yang masih perlu dimurnikan [39].
Efisiensi ekstraksi umumnya fungsi dari proses kondisi. Ekstraksi kuantitatif konstituen aktif merupakan langkah penting sebelum analisis. Kuantitas
produk alami memastikan bahwa setiap materi atau sistem pelarut menunjukkan perilaku yang berbeda, yang tidak dapat diprediksi [43].
2.3.2 Ekstraksi Cair-Cair
Ekstraksi cair-cair atau sering disebut ekstraksi saja, sudah lama dikenal dan dipakai dalam industri. Pada proses ini, campuran cair A dan C diambil C-nya dengan penambahan cairan B yang tidak/sedikit saling melarutkan dengan A tetapi bisa melarutkan C. Terbentuk dua fasa cair immiscible, yang pertama kaya A, yang lain kaya B, sedangkan C terdistribusi pada kedua fasa tersebut. Diperoleh ekstrak berupa larutan C dalam B dan rafinat berupa larutan C dalam A. Studi yang banyak dilakukan adalah mencari persamaan-persamaan fundamental proses ekstraksi untuk mendukung perancangan alat ekstraksi yang lebih efisien/optimal. Konsep dasar yang terlibat adalah kesetimbangan fasa cair-cair dan perpindahan massa cair-cair-cair-cair. Ada kecenderungan baru untuk mencoba menggunakan ekstraksi reaktif. Solven yang dipakai mengandung zat yang bisa berikatan kimia atau membentuk senyawa kompleks dengan zat yang diserap sehingga kemampuan solven mengekstraksi meningkat [39].
Ekstraksi cair-cair adalah aplikasi dari kelarutan parsial untuk pemisahan campuran cair dari dua atau lebih komponen. Proses ekstraksi cair-cair diterapkan, secara umum untuk pemisahan campuran yang tidak dapat dilakukan oleh distilasi untuk satu atau lebih alasan:
a) Suhu distilasi yang terlalu tinggi
b) Volatilitas relatif terlalu kecil atau adanya azeotrop c) Pemisahan berdasarkan volatilitas tidak memuaskan
Setiap campuran apapun dapat dipisahkan dengan ekstraksi jika komponennya memiliki perbedaan berat molekul satu sama lain atau tipe molekul yang berbeda. Hal ini hanya diperlukan untuk menemukan pelarut dengan campuran yang larut sebagian dan di salah satu komponen atau satu jenis yang lebih larut dari yang lain [44].
ke dalam larutan asal yang didispersikan kedalam pelarut. Dengan demikian dalam proses ekstraksi cair-cair dikenal dua fasa saling kontak yaitu fasa dispersi yang merupakan cairan yang didispersikan dan fasa yang merupakan cairan yang bertindak sebagai medium dispersi [45].
2.4 PELARUT YANG DIGUNAKAN UNTUK MENGEKSTRAKSI
LIKOPEN
Ada banyak variasi campuran ekstraksi yang digunakan untuk mengekstrak likopen. Tujuan dari ekstraksi adalah memisahkan likopen dari komponen larut air dari likopen yang berisi bahan makanan [46].
Karena karotenoid tomat larut dalam lemak, mereka biasanya diekstrak dengan pelarut organik seperti kloroform, heksana, aseton, petroleum eter, dan lain-lain [47, 48, 49,50]. Karena sampel dapat berisi sejumlah besar air, pelarut organik yang larut dalam air seperti etanol, aseton, dan lain-lain juga digunakan. Campuran berbagai pelarut biasanya digunakan dalam ekstraksi karotenoid. Etanol mendidih telah diusulkan untuk ekstraksi likopen dari tomat.
Laju ekstraksi likopen adalah fungsi dari bahan pelarut termasuk dalam campuran ekstraksi. Likopen larut dalam lemak, sehingga lebih sering diekstraksi dengan pelarut organik seperti etanol, aseton, petroleum eter, heksana, benzena, kloroform, dan lain-lain sebelum analisis kimia untuk penentuan kuantitatif.
2.4.1 Sifat Fisika dan Kimia N-Hekasna
2.4.1.1 Sifat Fisika N-Heksana
Berat Molekul : 86,18 g/mol
Warna : Tidak berwarna
Bentuk fisik : Cairan
Titik leleh : -95 oC
Titik didih : 69 oC
Densitas : 0,6603 g/cm3
2.4.1.2 Sifat Kimia N-Heksana
Larut dalam alkohol, kloroform, dan eter [53].
2.4.2 Sifat Fisika dan Kimia Etil Asetat
2.4.2.1 Sifat Fisika Etil Asetat
Nama lain : Ethyl ethanoate, Ethyl ester, Acetic ester, Ester of
ethanol Rumus molekul : C4H8O2 Berat molekul : 88,105 g/mol
Wujud : Cairan tidak berwarna
Densitas : 0,897 g/cm³
Titik beku : -83,6 °C; 190 K; -118 °F
Titik didih : 77,1 °C; 350 K; 171 °F
Kelarutan dalam air : 8,3 g/100 mL (20 °C)
Viskositas : 0,426 cp (25 °C)
Momen dipole : 1,78 D
2.4.2.2 Sifat Kimia Etil Asetat
Etil asetat dapat terhidrolisa oleh NaOH membentuk natrium asetat dan etanol, berdasarkan reaksi [54].
2.5 METODE KRISTALISASI
Kristalisasi adalah teknik pemisahan dan pemurnian digunakan untuk menghasilkan berbagai macam bahan. Kristalisasi dapat didefinisikan sebagai perubahan fasa di mana produk kristal diperoleh dari larutan. Sebuah larutan adalah campuran dari dua atau lebih spesies yang membentuk satu fasa homogen. Larutan biasanya diasumsikan dalam cairan, meskipun larutan dapat termasuk padatan tersuspensi. Sebuah larutan untuk dapat dikristalisasi harus berada pada kondisi sangat jenuh. Sebuah larutan di mana konsentrasi zat terlarut melebihi keseimbangan (jenuh), konsentrasi zat terlarut pada temperatur tertentu dikenal sebagai larutan jenuh. Ada empat metode utama untuk menghasilkan larutan sangat jenuh adalah sebagai berikut :
Perubahan suhu (terutama pendinginan)
Penguapan pelarut
Reaksi kimia, dan
Mengubah komposisi pelarut (misalnya dengan penggaraman)
Kristalisasi dari larutan dapat dianggap sebagai proses dua langkah. Langkah pertama adalah pemisahan fasa (pembentukan) dari kristal baru. Yang kedua adalah pertumbuhan kristal ini menjadi ukuran yang lebih besar. Kedua proses dikenal sebagai nukleasi dan pertumbuhan kristal. Analisis proses kristalisasi industri membutuhkan pengetahuan baik nukleasi maupun pertumbuhan kristal.
2.5.1 Kristalisasi Antisolvent
Kristalisasi merupakan proses pemisahan terpenting kedua pada industri kimia setelah distilasi. Konsentrasi larutan harus lebih tinggi dari pada konsentrasi kesetimbangan pada suhu kelarutannya agar terjadi nukleasi dan pertumbuhan kristal terjadi. Perbedaan antara konsentrasi sebenarnya dan konsentrasi kesetimbangan disebut lewat jenuh (supersaturated) yang merupakan gaya pendorong (driving force) kristalisasi. Lewat jenuh dapat ditimbulkan pada sistem dengan pendinginan, evaporasi pelarut, atau perubahan media – penambahan antisolvent yang mengurangi kelarutan zat terlarut pada sistem resultan, atau pengubahan zat terlarut melalui reaksi kimia menghasilkan senyawa lain dengan kelarutan yang jauh lebih rendah. Lewat jenuh dapat terbentuk dengan mengubah kelarutan dari sistem tersebut dengan penambahan antisolvent. Keuntungan dari kristalisasi antisolvent adalah prosesnya dapat berlangsung pada temperatur yang mendekati temperatur lingkungan. Metode ini lebih sesuai untuk senyawa yang sensitif terhadap panas. Juga, proses membutuhkan energi yang lebih kecil dari proses evaporasi pelarut. Bagaimanapun, campuran pelarut-antisolvent harus dipisahkan untuk memulihkan dan mendaur ulang (recycle) satu atau kedua pelarut. Keuntungan lain dari kristalisasi antisolvent adalah bahwa perubahan dalam komposisi pelarut dapat mendukung satu struktur kristal dalam kasus-kasus di mana zat terlarut dapat mengkristal dalam dua atau lebih fase kristal (yang disebut polimorfisme), dan hanya satu dari mereka yang diinginkan untuk aplikasi produk. Karena karakteristik ini, kristalisasi antisolvent telah banyak digunakan untuk mengkristalkan produk farmasi, yang secara umum sensitif oleh degradasi akibat pemanasan [56].
2.6 ALAT ANALISA LIKOPEN
membutuhkan manipulasi yang sensitif dan kompleks dan menghabiskan banyak waktu [17].
2.6.1 Fourier Transform Infrared Spectroscopy (FTIR)
Spektroskopi inframerah telah menjadi teknik terpenting untuk analisis bahan di laboratorium selama lebih dari tujuh puluh tahun. Spektrum inframerah menampilkan identitas dari sampel dengan puncak serapan yang sesuai dengan frekuensi getaran antara ikatan atom yang membentuk materi. Karena setiap bahan yang berbeda adalah kombinasi unik dari atom-atom, tidak ada dua senyawa menghasilkan spektrum inframerah yang tetap sama. Oleh karena itu, spektroskopi inframerah dapat menghasilkan identifikasi positif (analisis kualitatif) dari setiap jenis materi yang berbeda. Selain itu, ukuran puncak dalam spektrum merupakan indikasi langsung dari jumlah yang hadir dalam suatu material. Dengan algoritma perangkat lunak modern, inframerah adalah alat yang sangat baik untuk analisis kuantitatif [57].
2.7 ANALISA BIAYA
Analisa biaya dilakukan untuk mengetahui apakah produk yang dihasilkan melalui penelitian ini bersifat ekonomis. Bahan-bahan yang digunakan dibagi menjadi dua bagian, yaitu bahan untuk ekstraksi dan bahan baku untuk kristalisasi.
Berikut ini adalah tabel jumlah bahan baku yang digunakan untuk mengekstraksi likopen dari buah tomat :
Tabel 2.2 Keterangan Jumlah Bahan Baku untuk Mengekstraksi Likopen dari Buah Tomat Menggunakan Pelarut Etil Asetat Teknis
Bahan Kuantitas Harga/satuan (Rp) Harga (Rp) Etil Asetat Teknis 675 ml 20.000,00/L 13.500,00
Tomat 110 kg 2.000,00/kg 220.000,00
Total Rp 233.500,00
Bahan baku untuk proses kristalisasi adalah antisolvent berupa metanol teknis atau etanol teknis sebanyak 100 ml. Rendemen kristal likopen yang diperoleh lebih besar jika digunakan penggunaan antisolvent metanol teknis, maka untuk perhitungan analisa biaya ini dilakukan perhitungan dengan menggunakan antisolvent metanol teknis.
Berikut ini adalah tabel jumlah bahan baku yang digunakan untuk proses kristalisasi likopen dari ekstrak buah tomat :
Tabel 2.3 Keterangan Jumlah Bahan Baku untuk Proses Kristalisasi Likopen dari Ekstrak Buah Tomat Menggunakan Antisolvent Metanol Teknis Bahan Kuantitas Harga/satuan (Rp) Harga (Rp)
Metanol Teknis 100 ml 15.000,00/liter 1.500,00
Total Rp 1.500,00
Dari Tabel 2.2 dan 2.3 diperoleh total biaya bahan baku untuk ekstraksi dan kristalisasi likopen dari buah tomat adalah Rp 233.500,00 + Rp 1.500,00 = Rp 235.000,00. Diasumsikan bahwa dari 110 kg tomat menghasilkan 3,2 gram likopen maka harga 1 gram likopen = Rp 235.000,00/3,2gram = Rp 73.500/gram = Rp 73.500.000,00/kg.
BAB I
PENDAHULUAN
1.1 LATAR BELAKANG
Tomat merupakan salah satu sayuran yang populer dan paling banyak dikonsumsi di dunia. Hal ini disebabkan karena tomat lezat, mudah dicerna dan warna cerahnya merangsang nafsu makan [1]. Tomat dan produk tomat kaya sumber vitamin C dan A, likopen, β - karoten, lutein, lektin, dan berbagai senyawa fenolik seperti flavonoid dan asam fenolat. Tomat kaya akan folat, kalium, serat, dan protein, tetapi rendah lemak dan kalori, serta bebas kolesterol [2].
Masalah utama tomat setelah dipanen adalah sifatnya yang mudah rusak oleh pengaruh mekanis serta kandungan air yang tinggi, sehingga memungkinkan adanya aktivitas enzim dan mikroorganisme pembusuk. Kulit buah tomat sangat mudah mengalami kerusakan karena goresan atau gesekan sehingga diperlukan penanganan pasca panen yang benar, agar sesampainya di tangan konsumen buah tomat tetap dalam keadaan matang segar dengan warna yang menarik serta mempunyai nilai gizi yang cukup tinggi [3]. Buah tomat setelah matang sempurna akan cepat menjadi rusak/busuk yakni setelah 3-4 hari penyimpanan pada suhu kamar sehingga tanpa adanya penanganan khusus umur simpan buah tomat relatif singkat/pendek [4].
Tomat (Lycopersicum esculentum) merupakan tanaman hortikultura utama dengan perkiraan produksi global lebih dari 120 juta metrik ton [5], sedangkan produksi tomat di Indonesia yaitu 893.504 ton pada tahun 2012 [6]. Tomat biasanya dikonsumsi pada kualitas organoleptik maksimumnya, yang terjadi ketika telah tercapai warna merah seluruhnya tetapi sebelum pelunakan berlebihan [7]. Karena produksi yang melimpah dan laju pembusukan yang besar, maka banyak buah tomat yang terbuang dengan begitu saja karena tidak dapat dimanfaatkan lebih lanjut ketika telah terjadi pembusukan.
jantung koroner dan penyakit kronis lainnya [8]. Tomat dan makanan berbasis tomat adalah sumber utama likopen dan dianggap sebagai kontributor penting karotenoid untuk makanan. Sumber-sumber likopen lain adalah semangka, jambu biji, pepaya, dan jeruk [9].
Salah satu karakteristik utama dari pematangan buah tomat adalah akumulasi secara besar-besaran karotenoid (terutama likopen) [10]. Sintesis pigmen pada tomat berkaitan dengan proses pematangan, dan warna merah pada buah merupakan hasil dari akumulasi likopen. Tingkat likopen buah tomat ditentukan dari potensi genetik jenisnya dan kondisi lingkungan, terutama suhu dan cahaya. Selama periode pematangan, komposisi likopen pada buah meningkat tajam [11].
Berikut adalah daftar penelitian sebelumnya tentang ekstraksi likopen dari buah tomat. Tabel 1.1 Daftar Penelitian Sebelumnya Tentang Ekstraksi Likopen dari Buah Tomat
No. Peneliti Judul Bahan Baku dan
Pelarut
Metode Hasil Penelitian
1. Maulida dan Naufal, terbaik pada suhu 70 ºC.
Waktu ekstraksi yang paling optimum adalah 90 menit dengan likopen yang terekstrak sebesar 40,15%.
2. Myong-Kyun Roh, Min-Hee Jeon, Jin-Nam Moon, Woi-Sook Moon,
Sun-Mee Park dan Jae-Suk Choi (2013)
A Simple Method For The Isolation of
Lycopene From
Hasil yield ekstraksi:
Dari penelitian sebelumnya, dapat disimpulkan bahwa ekstraksi likopen dari buah tomat (Lycopersicum esculentum) menggunakan metode kristalisasi antisolvent menghasilkan rendemen (yield) likopen yang lebih tinggi dibandingkan dengan metode ekstraksi cair-cair ataupun dengan metode lain. Selain dari pada itu, di Indonesia masih jarang digunakan metode kristalisasi antisolvent untuk mengekstraksi likopen dari buah tomat untuk menghasilkan yield ekstrak yang lebih tinggi dan juga masih kurangnya penggunaan buah tomat yang telah matang dan hampir membusuk. Oleh sebab itu digunakan buah tomat yang telah matang dan hampir membusuk dalam penelitian ini dengan metode kristalisasi antisolvent untuk memperoleh kandungan ekstrak likopen yang tinggi.
1.2 PERUMUSAN MASALAH
Adapun yang menjadi rumusan masalah dari penelitian ini adalah :
1. Bagaimana pengaruh perbandingan Umpan dan Pelarut (F/S) serta jenis pelarut terhadap ekstraksi likopen dari buah tomat (Lycopersicum esculentum) terhadap rendemen likopen yang terekstrak.
2. Bagaimana pengaruh penambahan metanol dan etanol sebagai antisolvent pada tahap kristalisasi likopen, terhadap rendemen likopen yang terekstrak.
1.3 TUJUAN PENELITIAN
Tujuan dilakukan penelitian ini adalah untuk mengetahui pengaruh perbandingan Umpan dan Pelarut (F/S), jenis antisolvent, serta jenis pelarut terhadap ekstraksi likopen dari buah tomat (Lycopersicum esculentum) menggunakan pelarut heksana dan etil asetat dengan metode kristalisasi.
1.4 MANFAAT PENELITIAN
1. Meningkatkan nilai ekonomis buah tomat (Lycopersicum esculentum) sebagai sumber likopen.
2. Meningkatkan yield dari ekstraksi likopen dengan menggunakan metode kristalisasi antisolvent.
1.5 RUANG LINGKUP PENELITIAN
Penelitian ini dilakukan di Laboratorium Proses Industri Kimia, Laboratorium Penelitian, Fakultas Teknik, Departemen Teknik Kimia, Universitas Sumatera Utara dan Laboratorium Penelitian, Fakultas Farmasi, Universitas Sumatera Utara, Medan.
Penelitian ini memiliki ruang lingkup dan batasan sebagai berikut: 1. Sampel yang digunakan adalah jus buah tomat yang lewat matang.
2. Proses yang digunakan dalam penelitian ini adalah ekstraksi cair-cair dilanjutkan dengan kristalisasi antisolvent.
3. Variabel penelitian adalah perbandingan Umpan dan Pelarut (F/S) dan variasi antisolvent adalah sebagai berikut:
Variabel tetap : Temperatur = 65 oC Volume Sampel = 150 ml Volume Antisolvent = 100 ml Kecepatan pengadukan = 7 rpm Variabel berubah tahap ekstraksi :
Jenis pelarut tunggal : heksana dan etil asetat
Perbandingan Umpan dan Pelarut (F/S) 1:2; 1:2,5; 1:3; 1:3,5; 1:4; 1:4,5 Variabel berubah tahap kristalisasi :
Jenis antisolvent : Metanol dan Etanol
4. Parameter pengujian adalah :
ABSTRAK
Tujuan dilakukan penelitian ini adalah untuk mengetahui pengaruh perbandingan umpan dan pelarut (f/s), jenis antisolvent dan jenis pelarut terhadap ekstraksi likopen dari buah tomat (Lycopersicum esculentum) menggunakan pelarut tunggal dengan metode kristalisasi antisolvent. Pelarut yang digunakan adalah heksana dan etil asetat serta digunakan metanol dan etanol sebagai antisolvent. Variabel-variabel yang diamati antara lain perbandingan umpan dan pelarut (f/s) dengan menggunakan pelarut heksana dan etil asetat pada proses ekstraksi juga menggunakan metanol dan etanol sebagai antisolvent pada proses kristalisasi. Dilakukan penghalusan buah tomat kemudian diekstraksi. Kemudian ekstrak yang diperoleh ditambahkan antisolvent. Hasil penelitian menunjukkan bahwa semakin besar perbandingan umpan dan pelarut maka kadar likopen yang diperoleh akan semakin besar. Pada perbandingan umpan dan pelarut 1:4,5 dengan pelarut heksana diperoleh kadar total likopen paling tinggi yaitu 2,7 mg/150 ml dan 2,2 mg/150 ml. Sedangkan pada perbandingan umpan dan pelarut 1:4,5 dengan pelarut etil asetat diperoleh kadar total likopen paling tinggi yaitu 3,2 mg/150 ml dan 2,8 mg/150 ml. Dengan penggunaan metanol sebagai antisolvent kadar likopen yang diperoleh lebih besar. Dengan penggunaan pelarut etil asetat kadar likopen yang diperoleh lebih besar.
ABSTRACT
This research was aimed to study the effect of feed and solvent ratio (f/s), antisolvent variety and solvent variety to the extraction of lycopene from tomato (Lycopersicum esculentum) by using single solvent and antisolvent crystalization method. The solvent that used was hexane and ethyl acetate and also methanol and ethanol as the antisolvent. Observed variables was feed and solvent ratio (f/s) by using hexane and ethyl acetate as the solvent in extraction process and also using methanol and ethanol as the antisolvent in crystalization process. Tomatoes was milled and then extracted. Antisolvent then added to the extract which was obtained. The results show that the more feed and solvent ratio (f/s) the more lycopene obtained. At the ratio of 1:4,5 with hexane as the solvent obtained the highest lycopene yield were 2,7 mg/150 ml and 2,2 mg/150 ml. Whereas at the ratio of 1:4,5 with ethyl acetate as the solvent obtained the highest lycopene yield were 3,2 mg/150 ml dan 2,8 mg/150 ml. By using methanol as an antisolvent, much lycopene would be obtained. By using ethyl acetate as a solvent, much lycopene would be obtained.
EKSTRAKSI LIKOPEN DARI BUAH TOMAT
(Lycopersicum Esculentum) MENGGUNAKAN
PELARUT TUNGGAL DENGAN METODE
KRISTALISASI ANTISOLVENT
SKRIPSI
Oleh
SOLA FIDE GAVRA TARIGAN
110405073
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
EKSTRAKSI LIKOPEN DARI BUAH TOMAT
(Lycopersicum Esculentum) MENGGUNAKAN
PELARUT TUNGGAL DENGAN METODE
KRISTALISASI ANTISOLVENT
SKRIPSI
Oleh
SOLA FIDE GAVRA TARIGAN
110405073
SKRIPSI INI DIAJUKAN UNTUK MELENGKAPI SEBAGIAN
PERSYARATAN MENJADI SARJANA TEKNIK
DEPARTEMEN TEKNIK KIMIA
FAKULTAS TEKNIK
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas berkat dan karunia-Nya sehingga skripsi ini dapat diselesaikan. Tulisan ini merupakan Skripsi dengan judul “Ekstraksi Likopen dari Buah Tomat (Lycopersicum Esculentum) Menggunakan Pelarut Tunggal dengan Metode Kristalisasi Antisolvent”, berdasarkan hasil penelitian yang penulis lakukan di Departemen Teknik Kimia Fakultas Teknik Universitas Sumatera Utara. Skripsi ini merupakan salah satu syarat untuk mendapatkan gelar sarjana teknik.
Hasil penelitian ini ditujukan untuk memanfaatkan buah tomat yang telah lewat matang yang sering dianggap sebagai limbah pada kehidupan sehari-hari karena terdapat kandungan likopen yang sangat tinggi, dimana likopen berfungsi sebagai antioksidan. Berbagai penelitian tentang ekstraksi buah tomat telah dilakukan untuk mengekstraksi likopen, namun masih rendahnya yield yang diperoleh dan masih terdapatnya zat toksik akibat pelarut yang tersisa menjadi pokok permasalahan yang amat penting. Oleh karena itu, penulis berpikir untuk melakukan suatu penelitian ekstraksi tomat dengan penambahan antisolvent untuk mencapai yield perolehan likopen yang lebih besar dan untuk mengurangi kemungkinan masih terdapatnya pelarut yang terdapat pada likopen yang diperoleh. Dengan menggunakan bahan baku tomat yang telah lewat matang sebagai bahan baku, diharapkan limbah tomat yang telah lewat matang dapat dikurangi di lingkungan masyarakat.
Selama melakukan penelitian sampai penulisan skripsi ini penulis banyak mendapatkan bantuan dari berbagai pihak, untuk itu penulis mengucapkan terima kasih dan penghargaan sebesar-besarnya kepada:
1. Dr. Zuhrina Masyithah, ST, M.Sc selaku dosen pembimbing. 2. Ir. Renita Manurung, M.Sc. selalu koordinator skripsi.




![Gambar 4.3 Hasil Analisa HPLC Ekstraksi Likopen dari Buah Tomat Menggunakan Pelarut (A) Heksana dan (B) Etil Asetat [17]](https://thumb-ap.123doks.com/thumbv2/123dok/1049672.635061/30.595.123.489.85.212/gambar-analisa-ekstraksi-likopen-menggunakan-pelarut-heksana-asetat.webp)
![Gambar 4.4 Morfologi Kristal dengan Penambahan Antisolvent (a) Metanol dan (b) Etanol [69]](https://thumb-ap.123doks.com/thumbv2/123dok/1049672.635061/31.595.130.493.376.540/gambar-morfologi-kristal-dengan-penambahan-antisolvent-metanol-etanol.webp)