PENENTUAN pH DAN SUHU OPTIMUM UNTUK AKTIVITAS
EKSTRAK KASAR ENZIM LIPASE DARI KECAMBAH BIJI
JARAK KEPYAR (Ricinus communis L) TERHADAP
HIDROLISIS MINYAK WIJEN
SKRIPSI
NORA ANGGIANI SIREGAR
060802040
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PENENTUAN pH DAN SUHU OPTIMUM UNTUK AKTIVITAS EKSTRAK KASAR ENZIM LIPASE DARI KECAMBAH BIJI JARAK KEPYAR
(Ricinus communis L) TERHADAP HIDROLISIS MINYAK WIJEN
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
NORA ANGGIANI SIREGAR 060802040
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENENTUAN pH DAN SUHU OPTIMUM UNTUK AKTIVITAS EKSTRAK KASAR ENZIM LIPASE DARI KECAMBAH BIJI JARAK KEPYAR (Ricinus communis L) TERHADAP HIDROLISIS MINYAK WIJEN
Pembimbing 2 Pembimbing 1
Prof. Dr. R.A. Harlinah S.P.W., M.Sc. Drs. Firman Sebayang, MS NIP. 130175778 NIP. 195607261985031001
Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENENTUAN pH DAN SUHU OPTIMUM UNTUK AKTIVITAS EKSTRAK KASAR ENZIM LIPASE DARI KECAMBAH BIJI JARAK KEPYAR
(Ricinus communis L) TERHADAP HIDROLISIS MINYAK WIJEN
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dari ringkasan yang masing-masing disebutkan sumbernya.
Medan, Mei 2011
PENGHARGAAN
Alhamdulillah,,Puji dan Syukur Penulis ucapkan atas kehadirat ALLAH SWT yang telah memberikan Rahmat dan Hidayah yang sangat besar sehingga Penulis dapat menyelesaikan skripsi ini yang diberi judul “ PENENTUAN pH DAN SUHU OPTIMUM UNTUK AKTIVITAS CRUDE ENZIM LIPASE DARI KECAMBAH BIJI JARAK KEPYAR (Ricinus communis L) TERHADAP HIDROLISIS MINYAK WIJEN “.
Pada kesempatan ini, Penulis ingin berterima kasih kepada :
1. Ayahanda NIRWAN EFENDI SIREGAR dan Ibunda NURSATIUR
NIARI HUTASUHUT yang telah membesarkan dan menyayangi serta banyak berkorban untuk Penulis,,
Abang-abang Penulis : NAHAPAL SIREGAR dan FAHRIZAL SIREGAR, Kakak dan Abang ipar : NIRMALA SIREGAR dan SONI ARFAN, yang selalu memberikan semangat dan dukungan, baik secara moril dan materil kepada Penulis,, serta tidak lupa untuk sepupu tersayang DICKY RHAMADHAN HUTASUHUT.
2. Bapak Drs.Firman Sebayang,MS selaku Dosen Pembimbing I dan Ibu Prof.Dr.RA.Harlinah SPW,MSc selaku Dosen pembimbing II Penulis yang telah dengan sabar membantu dan membimbing Penulis dalam mengerjakan penelitian dan menyelesaikan skripsi ini.
3. Ketua Departemen dan Sekretaris Departemen Kimia S-1 Ibu Dr. Hj. Rumondang Bulan Nst, MS dan Bapak Drs. Albert Pasaribu, MSc.
4. Ibu Juliati Tarigan,MSi selaku dosen wali Penulis dan seluruh staf Dosen pengajar Jurusan Kimia FMIPA USU Medan, khususnya Bapak dan Ibu Dosen bidang Biokimia, Prof.Dr. RA. Harlinah SPW,MSc ; Dr.Ribu Surbakti,MS ; Dr.Hj.Rumondang Bulan Nasution,MS ; Drs.Firman Sebayang ,MS ; Dr.Hj.Yuniarti Yusak,MS ; Dra.Hj.Emma Zaidar Nst,MSi atas semua ilmu yang telah diberikan.
5. Para Guru staf pengajar di SMA Negeri 8 Medan yang telah mengantarkan Penulis menjadi mahasiswa di Universitas Sumatera Utara Medan.
6. Seluruh anggota ‘keluarga kedua’ di Laboratorium Biokimia FMIPA USU: kak Fia dan kak Fika (yang banyak membantu), Agung, Ardi, Egy, Eko dan Nurmala”Meeniq”(sahabat seperjuangan ‘06 yang saling mendukung), serta adik-adik ‘07 dan ‘08 : Decy, Erpina, Oki, Feri, Arini, Annisa, Dian, dan Zoraya, yang selalu menghibur Penulis.
8. Sahabat - Sahabat di Kimia USU : Fitri, Rani, Nelvi, Nurmala”Meeniq” dan angkatan ’06 lainnya yang tidak bisa disebutkan satu per satu.
Akhirnya Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu Penulis mengharapkan saran dan masukan yang bersifat membangun dari semua pihak demi terciptanya kesempurnaan dari skripsi ini, semoga ALLAH SWT membalas semua kebaikan kita dan memberikan kebahagian bagi kita semua. Amin Ya Rabbal Alamin.
Medan, Mei 2011
ABSTRAK
Telah dilakukan penentuan pH dan suhu optimum untuk aktivitas crude enzim lipase dari kecambah biji jarak kepyar (Ricinus communis L). Kecambah biji jarak kepyar dibuat melalui proses perendaman, pemisahan biji dari larutan perendaman dan perkecambahan biji dilakukan pada suhu 28 – 30oC selama 4 hari. Crude enzim lipase diperoleh dengan dua kali sentrifugasi selama 30 menit dengan kecepatan putaran 5000 rpm dan 3400 rpm dengan penambahan aseton dan pengeringan dengan freeze
drier. Serbuk crude enzim lipase yang dihasilkan diambil sebanyak 0,5 gram dan
DETERMINATION OF OPTIMUM pH AND TEMPERATURE FOR CRUDE LIPASE ENZYME ACTIVITY FROM CASTOR BEAN
(Ricinus communis L) SEED GERMINATION TO HYDROLYSIS SESAME OIL
ABSTRACT
DAFTAR ISI
BAB II TINJAUAN PUSTAKA 6
2.1. Tanaman Jarak Kepyar (Ricinus communis L) 6
2.1.1. Komposisi Kimia Biji Jarak Kepyar 7
2.2. Perkecambahan Biji 7
2.3. Enzim 9
2.3.1. Sifat – sifat Enzim 10
2.3.2. Faktor – faktor yang Mempengaruhi Aktivitas Enzim 11
2.3.3. Klasifikasi Enzim 12
2.4. Enzim Lipase 14
2.4.1. Sifat – sifat Enzim Lipase 15
2.4.2. Sumber – sumber Enzim Lipase 15
2.4.3. Aktivitas Enzim Lipase 16
2.5. Minyak Wijen Sebagai Substrat 17
2.6. Modifikasi Minyak dan Lemak yang di Katalisis Oleh Lipase 18
2.6.1. Transesterifikasi 19
2.6.2. Asidolisis 21
2.6.3. Gliserolisis / Esterifikasi 22
BAB III BAHAN DAN METODE PENELITIAN 24
3.1. Alat – alat 24
3.2. Bahan – bahan 25
3.3. Prosedur Penelitian 25
3.3.1. Pembuatan Larutan Pereaksi 25
3.3.2. Pembuatan Buffer Fosfat 0,05 M 26
3.3.3. Pembuatan Kecambah Dari Biji Jarak Kepyar 26 3.3.4. Penyediaan Crude Enzim Lipase Dari Kecambah Biji
Jarak kepyar 26
3.3.5. Penentuan Suhu Optimum Untuk Aktivitas Crude Enzim Lipase Dalam Supernatan Pada Hidrolisis Minyak Wijen 27 3.3.6. Penentuan pH Optimum Untuk Aktivitas Crude Enzim
Lipase Dalam Supernatan Pada Hidrolisis Minyak Wijen 27
BAB IV HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian 32 4.1.1. Penentuan Suhu dan pH Optimum Untuk Aktivitas
DAFTAR TABEL
Tabel 2.1. Komposisi biji jarak kepyar 7
Tabel 2.2. Komposisi asam lemak pada minyak wijen 17 Tabel 2.3. Asam lemak dan posisi spesifik dari lipase yang dipilih
untuk digunakan didalam modifikasi nutrisi lemak dan minyak 19 Tabel 3.1. Pembuatan Larutan Buffer Fosfat pH 6,0 – 8,0 26 Tabel 4.1. Hasil Perhitungan aktivitas crude enzim lipase
pada suhu 30 – 50oC 32
Tabel 4.2. Hasil Perhitungan aktivitas crude enzim lipase
pada pH 6,0 – 8,0 33
DAFTAR GAMBAR
Gambar 2.1. Reaksi hidrolisis trigliserida oleh enzim lipase 15 Gambar 2.2. TAG diturunkan dari 1,3 reaksi transesterifikasi
yang dikatalisis oleh lipase diantara sebuah TAG
rantai menengah (A) atau metil ester (B) dan TAG rantai panjang 20 Gambar 2.3. TAG yang potensial diturunkan dari 1,3 reaksi asidolisis
yang dikatalisis oleh lipase diantara sebuah TAG
rantai panjang dan sebuah asam lemak rantai menengah 21 Gambar 2.4.TAG yang potensial dari esterifikasi nonspesifik
yang dikatalisis oleh lipase(A) dan gliserolisis (B) reaksi antara gliserol dan sebuah sam lemak tidak jenuh
dan sebuah asam lemak tidak jenuh-etil ester, secara bersamaan 23 Grafik 4.1. Penentuan suhu optimum untuk aktivitas
crude enzim lipase terhadap hidrolisis minyak wijen 35 Grafik 4.2. Penentuan pH optimum untuk aktivitas crude enzim lipase
terhadap hidrolisis minyak wijen 36
DAFTAR LAMPIRAN
Lampiran 1. Perhitungan pembuatan buffer fosfat 0,05 M 35 Lampiran 2. Perhitungan Kadar ALB (Asam Lemak Bebas) 36
Hasil hidrolisis minyak wijen oleh Crude Enzim Lipase
Lampiran 3. Perhitungan aktivitas crude enzim lipase 36
ABSTRAK
Telah dilakukan penentuan pH dan suhu optimum untuk aktivitas crude enzim lipase dari kecambah biji jarak kepyar (Ricinus communis L). Kecambah biji jarak kepyar dibuat melalui proses perendaman, pemisahan biji dari larutan perendaman dan perkecambahan biji dilakukan pada suhu 28 – 30oC selama 4 hari. Crude enzim lipase diperoleh dengan dua kali sentrifugasi selama 30 menit dengan kecepatan putaran 5000 rpm dan 3400 rpm dengan penambahan aseton dan pengeringan dengan freeze
drier. Serbuk crude enzim lipase yang dihasilkan diambil sebanyak 0,5 gram dan
DETERMINATION OF OPTIMUM pH AND TEMPERATURE FOR CRUDE LIPASE ENZYME ACTIVITY FROM CASTOR BEAN
(Ricinus communis L) SEED GERMINATION TO HYDROLYSIS SESAME OIL
ABSTRACT
BAB I
PENDAHULUAN
1.1. Latar Belakang
Perkecambahan atau germinasi secara teknis adalah permulaan munculnya
pertumbuhan aktif yang menghasilkan pecahnya kulit biji dan munculnya semai
(Gardner, 1991). Menurut J. Derek Bewley dan Michael Black, serta G.Ray Noggle
dan George J.Fritz, ternyata didalam biji - bijian berkecambah terdapat beberapa
enzim, salah satu diantaranya adalah enzim lipase (Bonner, 1976).
Salah satu enzim yang mempunyai peranan penting dan tidak ada
bandingannya dalam pertumbuhan bioteknologi adalah lipase. Enzim lipase atau
lengkapnya triasilgliserol lipase adalah enzim yang menghidrolisis ester karboksilat.
Enzim ini memiliki sifat khusus dapat memecahkan ikatan ester pada lemak dan
gliserol. Selain itu lipase memiliki kemampuan mengkatalisis reaksi organik baik
dalam media berair maupun dalam media non-air.
Beberapa reaksi yang dapat dikatalisis oleh lipase adalah reaksi hidrolisis,
gliserolisis, asidolisis, dan transesterifikasi. Enzim ini digunakan untuk menghasilkan
asam lemak bebas, gliserol, berbagai ester, sebagian gliserida dan lemak yang
dimodifikasi atau di esterifikasi dari substrat yang digunakan (Moentamaria, 2009).
Pada penelitian ini digunakan substrat minyak wijen, karena wijen merupakan
komoditas pertanian yang sangat potensial sebagai penghasil minyak nabati yang
dibutuhkan dalam industri kosmetik, farmasi, makanan, dan lain – lain. Wijen
memiliki julukan The Queen of Oil Seeds Crops, yang mencerminkan bahwa biji
wijen memiliki kandungan gizi yang tinggi dan berdampak positif bagi konsumennya
Di bidang industri lemak dan minyak, enzim ini juga sangat penting karena
peranannya dalam mengendalikan proses produksi minyak dan lemak; misalnya pada
minyak goreng dan margarin dalam proses menyingkirkan cita rasa dan bau – bauan
yang tidak dikehendaki atau sebaliknya dengan enzim tersebut beberapa cita rasa yang
dikehendaki dapat diatur untuk ditampilkan. Pencampuran dari minyak juga telah
dikatalisa dengan lipase, penggunaan biokatalis ini karena keselektifan dari lipase
yang mana memberikan kontrol terhadap produk (Gandhi, 1997).
Tetapi, tingginya harga lipase menjadi salah satu pertimbangan apabila
menggunakannya sebagai katalis. Untuk menekan tingginya biaya tersebut, maka
lipase bisa didapatkan dari mikroba lokal seperti Pseudomonas, Aspergillus niger,
Mucor miehei, Candida rugosa, dan lain – lain (Moentamaria, 2009), dan juga dapat
diisolasi kecambah biji – bijian, seperti kecambah biji wijen (Sesamun Indicum),
kecambah biji jarak pagar (Jatropha curcas L) (Abigor, 2002), jarak kepyar (Ricinus
communis L) (Winarno, 1983) dan lainnya.
Penelitian – penelitian terdahulu telah dilakukan terhadap isolasi dan uji
aktivitas enzim lipase, diantaranya yaitu Abigor dkk (2002) mengisolasi enzim lipase
dari kecambah biji jarak pagar (Jatropha curcas L) dan menggunakan banyak jenis
minyak sebagai substratnya dan menunjukkan hasil bahwa enzim lipase lebih baik
menghidrolisis minyak kelapa sawit pada pH 7,5 dan suhu inkubasi 37oC.
Suhendra L Tranggono dan Hidayat C mengisolasi enzim lipase dari
kecambah biji wijen (Sesamun indicum L) dan pengujian aktivitasnya diperoleh
6µ mol FFA/menit dengan lama perendaman 150 menit dalam perendaman pH 4,2 dan
dikecambahkan selama 63 jam.
Pada penelitian ini perkecambahan biji jarak kepyar dilakukan hingga hari ke
4. Aktivitas lipolitik pada kecambah biji jarak kepyar meningkat pada hari ke 4
didalam pertumbuhan semaian biji, serentak dengan penurunan total lipid (Lin, 1983).
Kandungan triasilgliserol menurun, kandungan monoasilgliserol dan asam lemak
bebas meningkat dan diasilgliserol tidak banyak berubah. Hal ini menunjukkan
dengan pernyataan Kylen, Rolland (1975) dan Kruger (1991) dalam Sri Satyanti
(2001) bahwa selama perkecambahan terjadi penurunan kandungan lemak dan terjadi
peningkatan jumlah enzim lipase (Senanayake, 2000).
Berdasarkan uraian diatas, peneliti ingin mengisolasi crude enzim lipase dari
kecambah biji jarak kepyar (Ricinus communis L) dan mengetahui pH dan suhu
optimum untuk aktivitasnya dalam menghidrolisis minyak wijen.
1.2. Permasalahan
1. Bagaimanakah cara mengisolasi crude enzim lipase dari kecambah biji jarak
kepyar ?
2. Bagaimanakah pengaruh suhu dan pH optimum terhadap aktivitas crude enzim
lipase dari kecambah biji jarak kepyar (Ricinus communis L) dalam menghidrolisis
minyak wijen ?
1.3. Pembatasan Masalah
Dalam penelitian ini masalah dibatasi sebagai berikut:
1. Biji jarak kepyar (Ricinus communis L) yang digunakan diperoleh dari daerah
disekitar PAM Sunggal Medan.
2. Crude enzim lipase diambil dari kecambah yang telah berumur 4 hari.
3. Substrat yang digunakan adalah minyak wijen.
4. Buffer yang digunakan adalah buffer fosfat dengan variasi pH 6,0; 6,5; 7,0; 7,5
dan 8,0.
5. Waktu inkubasi yang digunakan adalah 30 menit.
1.4. Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah :
1. Untuk mengisolasi crude enzim lipase dari kecambah biji jarak kepyar (Ricinus
communis L)
2. Untuk mengetahui suhu dan pH optimum hidrolisis minyak wijen oleh crude
enzim lipase.
1.5. Manfaat Penelitian
Adapun manfaat dari penelitian ini adalah untuk dapat memberikan informasi
mengenai aktivitas crude enzim lipase dari kecambah biji jarak kepyar dan sebagai
bahan informasi bagi penelitian selanjutnya.
1.6.Metodologi Percobaan
Penelitian ini adalah eksperimen yang dilakukan di laboratorium. Sampel yang
digunakan adalah biji jarak kepyar (Ricinus communis L) yang diperoleh di daerah
PAM Sunggal Medan. Sebanyak 75 gram biji jarak kepyar dijemur kemudian dikupas
cangkangnya, biji bagian dalam sebanyak 47 gram dikecambahkan pada suhu 28-30oC
selama 4 hari. Kemudian ditimbang 65 gram kecambah dan ditambahkan 150 mL
buffer fosfat pH 7,0 dan diblender selama 1 menit dan disaring, kemudian filtrat
disentrifugasi pada 5000 rpm selama 30 menit, supernatan yang dihasilkan
ditambahkan dengan 60 mL aseton dan didiamkan selama 1 malam kemudian
disentrifugasi pada 3400 rpm selama 30 menit, pellet dikeringkan dengan freeze drier.
Serbuk crude enzim lipase yang diperoleh diambil sebanyak 0,5 gram dan dilarutkan
dengan 50 mL buffer fosfat pH 7,0. Kemudian dilakukan uji aktivitas untuk crude
enzim lipase dalam menghidrolisis minyak wijen pada pH dan suhu yang berbeda.
Dalam penelitian ini yang dilakukan pada suhu 30oC; 35oC; 40oC; 45oC; 50oC dan pH
1.7. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia / Kimia Bahan Makanan
FMIPA-USU Medan, Laboratorium Pusat Penelitian FMIPA-FMIPA-USU Medan, dan Laboratorium
BAB II
TINJAUAN PUSTAKA
2.1. Tanaman Jarak Kepyar (Ricinus communis L)
Menurut taksonomi tumbuh- tumbuhan, tanaman jarak kepyar (Ricinus communis L)
diklasifikasikan sebagai berikut :
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledonae
Sub Kelas : Rosidae
Ordo : Euphorbiales
Famili : Euphorbiaceae
Genus : Ricinus
Spesies : Ricinus communis L
Nama Umum Dagang : Jarak Kepyar
Tanaman jarak kepyar merupakan tanaman tahunan yang hidup di daerah
tropik maupun subtropik, dan dapat tumbuh pada ketinggian 0 – 800 meter di atas
permukaan laut.
Penanaman jarak kepyar dilakukan dengan cara memasukkan 2-3 biji pada
setiap lubang sedalam kira – kira 3 cm pada tanah yang telah di gemburkan dan
diratakan. Waktu tanam perlu disesuaikan dengan keadaan iklim setempat serta jenis
jarak yang akan ditanam. Sebaiknya penanaman dilakukan pada akhir musim hujan,
untuk menjaga supaya pada saat pembungaan tidak terkena hujan yang dapat
pertumbuhan biji secara serentak, sebelum ditanam biji direndam selama 24 jam.
Pemeliharaan tanaman berumur kurang lebih 3 minggu.
Panen jarak kepyar dimulai pada saat buah jarak kepyar sudah mulai tua, yang
ditandai dengan kulit buah yang mulai kering. Waktu panen harus tepat sebab
keterlambatan akan mengakibatkan pecahnya kulit biji dan biji akan terlempar keluar.
Buah yang masih berkulit kemudian dijemur selama 3 hari dan kulit buah akan
pecah dengan sendirinya. Biji – biji yang diperoleh dijemur kembali sampai kering
kemudian disimpan. Setiap hektar tanaman jarak kepyar dapat menghasilkan 6 – 8
kwintal biji kering, dan tanaman jarak kepyar umumnya produktif sampai umur 6 – 9
bulan.
2.1.1. Komposisi Kimia Biji Jarak Kepyar
Biji jarak kepyar terdiri dari 75 % kernel ( daging biji ) dan 25 % kulit dengan
komposisi sebagai berikut:
Tabel 2.1. Komposisi biji jarak kepyar
(Ketaren, 1986).
2.2. Perkecambahan Biji
Definisi perkecambahan atau germinasi secara teknis adalah permulaan munculnya
Perkecambahan meliputi peristiwa-peristiwa fisiologis dan morfologis berikut:
imbibisi dan absorbsi air, hidrasi jaringan, absorbsi oksigen, pengaktifan enzim,
transfor molekul yang terhidrolisis ke sumbu embrio, peningkatan respirasi dan
asimilasi, inisiasi pembelahan dan pembesaran sel serta munculnya embrio.
Ontogeni perkecambahan meliputi dua fase metabolik yang berbeda, yaitu :
hidrolisis secara enzimatik terhadap cadangan makanan yang disimpan dan disintesis
jaringan baru dari senyawa yang dihidrolisis (yaitu dari gula, asam amino, asam
lemak, dan mineral yang dibebaskan) (Gardner, 1991).
Menurut J. Derek Bewley dan Michael Black, serta G.Ray Noggle dan George
J.Fritz, ternyata didalam bijian berkecambah terdapat beberapa enzim antara lain; α
-amilase, lipase, peptida hidrolase, amilolitik, protease, isositrat liase, β-manase, α
-galaktosidase, aminoliase, dan nitrat reduktase.
Perkecambahan suatu biji yang telah mengalami kematangan baru akan
berlangsung setelah masa dormasi terlewati, yaitu suatu keadaan pertumbuhan yang
tertunda atau istirahat, merupakan kondisi yang berlangsung selama suatu periode
yang tidak terbatas walaupun berada dalam keadaan yang menguntungkan untuk
perkecambahan. Perkecambahan tidak terlepas pula dari faktor – faktor lingkungan.
Syarat – syarat lingkungan perkecambahan :
a. Air
Imbibisi air merupakan awal proses perkecambahan. Biji yang hidup dan mati,
keduanya melakukan imbibisi air dan membengkak. Banyaknya imbibisi air
tergantung pada komposisi kimia biji. Protein, getah dan pektin lebih bersifat
koloid dan hidrofilik serta lebih banyak mengalami imbibisi air daripada zat
tepung. Kandungan air yang kurang dari batas optimum biasanya menghasilkan
imbibisi sebagian dan memperlambat atau menahan perkecambahan.
b. Temperatur
Proses perkecambahan juga meliputi sejumlah proses katabolisme dan anabolisme
Temperatur kardinal (maksimum, optimum dan minimum) untuk perkecambahan
pada kebanyakan biji tanaman pada dasarnya merupakan temperatur kardinal untuk
pertumbuhan vegetatif yang normal. Temperatur optimim adalah temperatur yang
menberikan persentase perkecambahan yang paling tinggi dalam periode waktu
yang paling pendek.
c. Cahaya
Biji membutuhkan cahaya untuk perkecambahan. Dalam hal ini cahaya merupakan
faktor pemasak lanjut, suatu mekanisme pemicu dalam mematahkan macam
dormansi tertentu. Kuantitas (tingkat energi), kualitas (warna atau panjang
gelombang) dan lamanya penyinaran (fotoperiode) dalam daur harian atau
musiman mempunyai pengaruh yang nyata terhadap perkecambahan.
d. Gas
Perkecambahan memerlukan tingkat oksigen yang tinggi kecuali bila repirasi yang
berhubungan dengan hal ini terjadi karena fermentasi. Kebanyakan spesies
memberikan respon yang baik terhadap komposisi udara normal; 20% O2, 0,03%
CO2 dan 80% N. Penurunan kandungan oksigen dibawah 20% biasanya
menurunkan kegiatan perkecambahan. Perkecambahan biji pada kebanyakan
spesies berlangsung baik pada kandungan O2 udara atau konsentrasi O2 udara yang
lebih tinggi.
e. Senyawa kimia eksogen
Sejumlah senyawa kimia dalam medium dapat menggalakkan perkecambahan.
Senyawa kimia dapat dianggap sebagai perangsang dan bukanlah persyaratan
perkecambahan. Senyawa kimia tertentu seperti gibrelin, Kalium Nitrat (KNO3),
Tiourea atau CS(NH2)2, dapat mempertinggi atau menggantikan persyaratan
pencahayaan atau persyaratan suhu dingin untuk masak lanjutan (Bonner, 1976).
2.3. Enzim
Kata enzim berasal dari “en-zyme” yang berarti dalam ragi (yeast), mulai dipakai
(T.Schwan,1836), emulsion (J.V.Liebig dan F.Wohler,1837), masing – masing adalah
senyawa organik yang dapat menghidrolisis pati, protein dan glikosida.
Enzim adalah suatu biokatalisator yang dapat bertindak menguraikan molekul
yang rantainya panjang menjadi lebih sederhana, serta dapat juga membantu
mekanisme reaksi yang mana tergantung pada enzimnya. Walaupun enzim ikut serta
dalam reaksi dan mengalami perubahan fisik selama reaksi, enzim akan kembali
kepada keadaan semula bila reaksi telah selesai.
Enzim mempunyai tenaga katalitik yang luar biasa dan biasanya jauh lebih
besar dari katalisator sintetik. Spesifitas enzim sangat tinggi terhadap substratnya.
Enzim mempercepat reaksi kimia secara spesifik tanpa pembentukan produk samping.
Enzim merupakan unit fungsional untuk metabolisme dalam sel, bekerja menurut
urutan yang teratur. Sistem enzim terkoordinasi dengan baik menghasilkan suatu
hubungan yang harmonis diantara sejumlah aktivitas metabolik yang berbeda.
Kebanyakan enzim diberi nama dengan penambahan akhiran –ase pada kata
yang menunjukkan senyawa asal yang diubah oleh enzim atau pada nama jenis reaksi
kimia yang dikatalisis enzim.
2.3.1. Sifat – Sifat Enzim
1. Spesifitas
Aktivitas enzim sangat spesifik. Pada umumnya enzim tertentu hanya dapat
mengkatalisis satu reaksi. Sebagai contoh, laktase menghidrolisis gula laktosa
tetapi tidak berpengaruh terhadap disakarida yang lain. Hanya molekul laktosa
saja yang akan sesuai dalam sisi aktif molekul.
2. Pengaruh suhu
Aktivitas enzim sangat dipengaruhi oleh suhu. Suhu optimalnya adalah antara
35oC dan 40oC, yaitu suhu tubuh. Pada suhu diatas dan dibawah optimalnya,
3. Pengaruh pH
Masing – masing reaksi yang dikatalisis oleh enzim paling cepat terjadi pada pH
yang tertentu. Untuk kebanyakan enzim pH optimal adalah sekitar pH 7 (netral)
dan jika medium menjadi sangat asam atau sangat alkalis enzim mengalami
inaktivasi.
4. Ko-enzim dan aktivator
Enzim sering kali memerlukan bantuan substansi lain agar berfungsi secara
efektif. Ko-enzim adalah substansi bukan protein yang mengaktifkan enzim
(Gaman, 1992).
2.3.2. Faktor – Faktor yang Mempengaruhi Aktivitas Enzim
1. Suhu enzim
Enzim tidak aktif pada suhu kurang dari pada 0oC. Aktivitas enzim meningkat dua
kali lipat bagi setiap kenaikan suhu 10oC. Aktivitas enzim paling optimum pada
suhu 37oC.
2. Nilai pH
Setiap enzim paling bagus pada nilai pH tertentu yang disebut sebagai pH
optimum. pH optimum bagi kebanyakan enzim adalah pH 7. Terdapat beberapa
pengecualian, misalnya enzim pepsin di dalam perut bereaksi paling bagus pada pH
2, sementara enzim tripsin di dalam usus kecil bereaksi paling bagus pada pH 8.
3. Kepekatan substrat
Apabila kepekatan substrat bertambah, maka molekul enzim dapat bereaksi dengan
molekul substrat. Sedangkan apabila kepekatan substrat rendah, bilangan molekul
enzim melebihi bilangan molekul substrat. Oleh karena itu, hanya sejumlah kecil
molekul enzim yang bereaksi dengan molekul substrat.
4. Kepekatan enzim
Apabila kepekatan enzim bertambah, maka molekul substrat dapat bereaksi dengan
rendah, bilangan molekul substrat melebihi bilangan molekul enzim. Oleh karena
itu, hanya sejumlah kecil molekul substrat bereaksi dengan molekul enzim
(http:/ms.wikipedia.org/wiki/Enzim).
Semua enzim yang dikenal dapat mengkatalisis reaksi hidrolisis ikatan kovalen
dikenal dengan akhiran –ase pada nama substansi atau substrat yang dihidrolisisnya.
Jadi, lipase menghidrolisis lemak atau lipid, amilase menghidrolisis pati atau amilum,
dan protease menghidrolisis protein.
2.3.3. Klasifikasi Enzim
Pada tahun 1956, The International Union of Biochemistry membentuk suatu panitia
untuk menyusun konsep dan mengusulkan klasifikasi dan nomenklatur enzim. Baru
tahun 1961 usul tersebut diterima secara resmi.
Prinsip penamaan tersebut ternyata berdasarkan tipe reaksi yang dikatalisis dan
enzim yang dibagi menjadi enam kelompok utama, yaitu :
1. Oksidoreduktase
Enzim oksidoreduktase adalah enzim yang dapat mengkatalisis reaksi oksidasi atau
reduksi suatu bahan. Dalam golongan ini terdapat 2 jenis enzim yang paling utama
yaitu oksidase dan dehidrogenase.
Oksidase adalah enzim yang mengkatalisis reaksi antara substrat dengan
molekul oksigen. Yang termasuk enzim oksidase adalah katalase, peroksidase,
tirosinase, dan asam askorbat oksidase.
Dehidrogenase adalah enzim yang aktif dalam pengambilan atom hidrogen
dari substrat. Contohnya yaitu suksinat dehidrogenase, glutamat dehidrogenase, dan
2. Transferase
Enzim transferase adalah enzim yang ikut serta dalam reaksi pemindahan (transfer)
suatu radikal atau gugus. Enzim yang termasuk dalam golongan ini adalah
transglikosidase, transfosforilase, transaminase, dan transasetilase.
3. Hidrolase
Enzim hidrolase merupakan enzim yang sangat penting dalam pengolahan pangan,
yaitu enzim yang mengkatalisis reaksi hidrolisis suatu substrat atau pemecahan
substrat dengan pertolongan molekul air. Enzim yang termasuk kedalam golongan ini
adalah lipase yang menghidrolisis ikatan ester pada lemak alami menjadi gliserol dan
asam lemak, glikosidase menghidrolisis ikatan glikosida dan sebagainya. Disamping
itu masih banyak lagi yang termasuk enzim hidrolase, diantaranya karboksil esterase,
pektin metal esterase, selulase, β-amilase, α-amilase dan invertase.
4. Liase
Enzim liase adalah enzim yang aktif dalam pemecahan ikatan C-C dan ikatan C-O
dengan tidak menggunakan melekul air. Yang termasuk dalam golongan enzim ini
adalah enzim dekarboksilase.
5. Isomerase
Enzim isomerase adalah enzim yang mengkatalisis reaksi perubahan konfigurasi
molekul substrat, sehingga dihasilkan molekul baru yang merupakan isomer dari
substrat, atau dengan perubahan isomer posisi. Yang termasuk dalam golongan ini
6. Ligase
Enzim ligase adalah enzim yang mengakatlisis pembentukan ikatan - ikatan tertentu,
misalnya pembentukan ikatan C-O, C-C, dan C-S dalam biosintesis ko-enzim A serta
pembentukan ikatan C-N dalam sintesis glutamin (Winarno, 1983).
2.4. Enzim Lipase
Lipase (E.C.3.1.1.3) adalah enzim yang terutama untuk hidrolisa dari asil gliserida.
Bagaimanapun jumlah berat molekul dari ester baik tinggi maupun rendah tiol ester,
amida, poliol dan lain – lain, dapat diterima sebagai substrat oleh kelompok enzim
lipase ini. Pencampuran dari minyak juga telah dikatalisa dengan lipase, penggunaan
biokatalis ini karena keselektifan dari lipase yang mana memberikan kontrol terhadap
produk (Gandhi, 1997).
Enzim – enzim yang bekerja dalam hidrolisis lemak dan minyak dapat
dikelompokkan menjadi dua kelompok besar yaitu enzim lipase dan enzim esterase.
Keduanya terlihat baik dalam proses metabolisme lemak maupun penguraian dan
kerusakan lemak. Enzim lipase dan enzim esterase sukar dibedakan karena daya
kerjanya yang sangat mirip, yaitu mengkatalisis hidrolisis ester karbohidrat. Pada
preparat murni enzim diekstraksi dari bahan alami sering terkandung enzim lipase
maupun esterase.
Secara fisiologik, enzim ini penting artinya karena dengan menghidrolisis
lemak dihasilkan asam lemak bebas dan gliserol yang penting peranannya dalam
metabolisme dalam tubuh.
Di bidang industri lemak dan minyak, enzim – enzim ini juga sangat penting
karena peranannya dalam mengendalikan proses produksi minyak dan lemak;
misalnya pada minyak goreng dan margarin dalam proses menyingkirkan cita rasa dan
bau – bauan yang tidak dikehendaki atau sebaliknya dengan enzim tersebut beberapa
Berdasarkan nomenklatur dari International Union of Biochemistry, enzim
lipase berfungsi mengkatalisis trigliserida menjadi gliserol dan asam lemak bebas.
Gambar 2.1. Reaksi hidrolisis trigliserida oleh enzim lipase
2.4.1. Sifat – Sifat Enzim Lipase
Tergantung dari asal dan substratnya, keaktifan optimum lipase sangat tergantung
pada pH dan suhu. Enzim lipase pada pankreas misalnya mempunyai pH optimal
antara 8 dan 9, tetapi dapat menurun menjadi antara 6 – 7 bila substratnya berbeda.
Keaktifan optimal enzim lipase tegantung juga dari senyawa pengemulsi yang
digunakan dan ada tidaknya garam dalam substrat. Enzim lipase yang berasal dari
susu mempunyai pH optimal sekitar 9.
Suhu optimum enzim lipase pada umumnya berkisar antara 30o – 40oC.
Meskipun telah ditemukan adanya lipase yang masih aktif pada suhu -29oC, terutama
pada ikan dan udang yang dibekukan.
2.4.2. Sumber – Sumber Enzim Lipase
Enzim lipase dapat diperoleh atau diisolasi dari pankreas, susu, serta bahan lain seperti
misalnya dari biji – bijian, mikroba, dan kacang – kacangan seperti gandum, biji
kapas, dan jarak. Enzim lipase yang bersifat asam banyak terdapat dalam biji jarak
Kerusakan biji – bijian biasanya disebabkan beberapa hal di antaranya oleh
enzim lipase; semakin tinggi kadar air semakin aktif enzim lipase yang ada
didalamnya. Sebagai contoh, enzim lipase pada biji gandum mempunyai keaktifan 5
kali pada kadar air 15 % daripada pada kadar air 8,8 %.
Enzim lipase dari biji Vernonia anthelmintica mempunyai daya aktif spesifik
yang unik, yaitu pada posisi kedua atau tengah dari trigliserida.
Berbagai mikroba dapat memproduksi lipase misalnya Candida dan
Torulopsis. Demikian juga kapang Rhizopus, Penicillium, Aspergillus, Pseudomonas,
Achromobakter, dan Staphylococcus (Winarno, 1983).
2.4.3. Aktifitas Enzim Lipase
Keaktifan enzim dapat ditentukan secara kualitatif dengan reaksi kimia yaitu dengan
substrat yang dapat dihidrolisis oleh enzim tersebut, dan secara kuantitatif ditentukan
dengan mengukur laju reaksi tersebut. Aktivitas enzim lipase mempunyai satuan unit
(U). Satu unit aktivitas enzim lipase setara dengan 1µ mol asam lemak bebas yang
dihasilkan dari hidrolisis substrat yang dikatalisis oleh enzim lipase tiap satuan menit
(Handayani, 2005).
Untuk menentukan aktivitas optimum pada kondisi optimum dari enzim lipase
maka dilakukan pengukuran aktivitas enzimatik pada variasi suhu dan pH. Sehingga
akan diketahui berapa aktifitas lipase di setiap rentang suhu dan pH yang ditentukan.
Pada umumnya, semakin tinggi suhu, maka semakin naik laju reaksi kimia,
baik yang dikatalisis oleh enzim. Tetapi perlu diingat bahwa enzim adalah protein,
jadi semakin tinggi suhu proses, maka inaktifasi enzim juga akan meningkat.
Pengaruh suhu sangat kompleks, misalnya suhu yang terlalu tinggi dapat
mempercepat kerusakan enzim. Pada suhu terlalu rendah, laju reaksi akan kecil,
sedangkan pada suhu terlalu besar maka laju inaktifasi enzim akan semakin cepat dan
menyebabkan reaksi praktis berhenti sama sekali. Oleh karena itu enzim mempunyai
enzim akan berjalan begitu lambat sehingga laju inaktivasi enzim bisa diabaikan
(Ilistyawati, 1996).
Selain itu enzim mempunyai pH optimum yang khas, yaitu pH yang
menyebabkan aktivitas enzim maksimal. pH optimum enzim tidak perlu sama dengan
pH lingkungan normalnya, dengan pH yang mungkin sedikit di atas atau dibawah pH
optimum (Lehninger, 1990).
2.5. Minyak Wijen Sebagai Substrat
Minyak wijen kurang lebih 0,3 – 0,5 persen sesameoline, fenol berikatan 1-4
yang dikenal sebagai sesamol, dan sesamin sekitar 0,5 – 0,1 persen. Sesamol
dihasilkan dari hidrolisa sesamoline dan merupakan suatu antioksidan. Minyak wijen
juga mengandung asam – asam lemak yaitu oleat dan linoleat, palmitat dan stearat dan
jumlahnya dapat dilihat pada tabel dibawah ini:
Tabel 2.2. Komposisi asam lemak didalam minyak wijen
Asam lemak Rumus Persen
Minyak wijen bersifat larut dalam alkohol dan dapat bercampur dengan eter,
chloroform, petroleum benzene dan CS2, tetapi tidak larut dalam eter.
Minyak wijen bersifat synergist terhadap phrethrum yang merupakan sifat
unsur non gliserida dalam minyak lebih positif putaran optiknya, dibandingkan
dengan asam – asam lemak maupun gliserida.
Minyak wijen mempunyai nilai gizi yang baik karena kandungan proteinnya
cukup tinggi yaitu sebesar 19,3 persen, juga mengandung asam lemak essensial yang
dibutuhkan oleh tubuh seperti oleat dan linoleat, sehingga wijen merupakan salah satu
sumber nabati yang baik. Minyak wijen menghasilkan kalori yang tinggi yaitu sekitar
902 kalori/100 gram (Ketaren,1986).
2.6. Modifikasi Minyak dan Lemak yang di Katalisis Oleh Lipase
Secara tradisional, interesterifikasi kimia telah menjadi industri pertama yang sangat
berarti dalam menghasilkan lemak dan minyak yang termodifikasi. Hal ini merupakan
reaksi yang secara teori memproduksi gugus asil dalam triasilgiserol (TAG) secara
acak. Interesterifikasi kimia digunakan dalam industri shortening trans yang rendah,
margarin, dan meluas hingga mengubah bentuk penyusunnya, memodifikasi keadaan
melebur dan meningkatkan stabilitas. Interesterifikasi kimia memiliki potensi untuk
mengubah nutrisi dari lemak dan minyak, terutama untuk menghasilkan proporsi dari
asam lemak spesifik dalam posisi bagian belakang gliserol untuk mengubah
bioavailabilitynya. Interesterifikasi kimia bukan merupakan metode yang efektif
untuk menghasilkan konsentrasi yang tinggi dari asam lemak rantai menengah
(MCFA), struktur lipid yang diacak posisi spesifiknya atau asam lemak yang melekat
secara selektif dalam metode ini. Interesterifikasi yang di katalisis oleh lipase adalah
hal yang paling besar untuk interesterifikasi kimia, ketika distribusi dari posisi spesifik
diperlukan untuk posisi yang melekat dan asam lemak yang memiliki spesifitas oleh
lipase. Lipase mengkatalisis hidrolisis triasilgliserol, diasilgliserol, dan
monoasilgliserol, dalam keadaan kelebihan air tetapi dibawah kondisi air yang
terbatas, reaksi sebaliknya, sintesis ester, dapat tercapai. Interesterifikasi yang
dikatalisis lipase dan hidrolisis mengikuti reaksi yang Ping Pong Bi Bi untuk reaksi
multisubstrat.
Didalam istilah aplikasi lipase untuk modifikasi nutrisi dari lemak dan minyak,
mana tidak memiliki kemampuan spesifik untuk memproduksi posisi yang sama yang
didistribusi sebagai interesterifikasi kimia dengan biaya yang lebih besar dan
memakan waktu, membuat hal ini tidak cocok digunakan sebagai aplikasi. Posisi
spesifik terhadap posisi 1 dan 3 dari triasilgliserol merupakan keadaan akhir dari
ketidakmampuan lipase untuk beraksi pada posisi sn-2 karena hambatan mencegah
akses sterik dari asam lemak didalam posisi sn-2 ke sisi aktif. Asam lemak yang
spesifik, didalam istilah terhadap spesifitas keaduanya dan perbedaan asam lemak
yang bekerja didalam perpindahan atau konsentrasi asam lemak ini. Posisi spesifik
asam lemak dari perbedaan lipase telah digunakan dalam reaksi katalisis oleh lipase,
termasuk transesterifikasi, asidolisis, gliserolisis, dan digunakan untuk mengubah
kualitas nutrisi dari lemak dan minyak. Lipase juga digunakan dalam modifikasi
lemak dan minyak untuk tujuan modifikasi secara fisik, untuk menggunakan substitusi
mentega dari coklat dan mengubah properti yang mencair.
Tabel 2.3. Asam lemak dan posisi spesifik dari lipase yang dipilih untuk
digunakan didalam modifikasi nutrisi lemak dan minyak
Sumber lipase Spesifitas Referensi
Aspergillus niger
Aspergillus delemar
Terhadap asam lemak rantai menengah
dan pendek
Desnuelle (1972);
Stamatis et al.(1993)
Geotrichum candidum Terhadap asam lemak rantai panjang
dengan ikatan rangkap di cis-9
Macrae (1985)
Aspergillus niger
Mucor miehei
Rhizopus arrhizus
Rhizopus delemar
Terhadap posisi sn-1 dan sn-3 Macrae (1983)
Candida parapsilosis Terhadap posisi sn-2 Riaublanc et al.(1993)
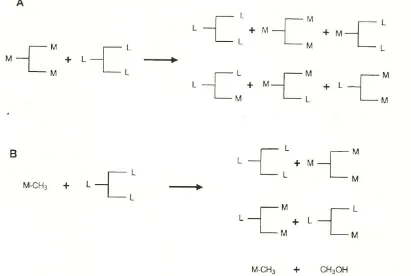
2.6.1. Transesterifikasi
Transesterifikasi yang dikatalisis oleh lipase dikenal sebagai pergantiaan dari gugus
asil diantara 2 ester, dinamakan dua triasilgliserol (TAG), meskipun ini juga dapat
digunakan sebagai metode transfer asam lemak tidak jenuh dari minyak ikan menjadi
minyak sayur untuk EPA (Eicosapentaenoic acid) dan DHA (Docosahexaenoic acid)
yang relatif memiliki konsentrasi rendah didalam minyak ikan yangmana terkadang
tidak lebih dari 25%. Ini menjadi hal yang paling sering digunakan untuk
menghasilkan struktur lipid melalui reaksi diantara sebuah rantai menengah
triasilgliserol dan sebuah minyak sayur atau minyak ikan yang mengandung
konsentrasi tinggi dari asam lemak jenuh rantai panjang dan asam lemak tidak jenuh.
Hal ini merupakan metode ideal yang tidak penting untuk produksi struktur lipid
karena adanya pengacakan asam lemak jenuh dan tidak jenuh menengah didalam
semua tiga posisi dari triasilgliserol. Struktur lipid akan berisi asam lemak rantai
sedang dalam posisi sn-1 dan sn-3 untuk hidrolisis didalam dan absorpsi produksi
energi, dan asam lemak jenuh berantai panjang dan asam lemak tidak jenuh dalam
posisi sn-2 untuk mengubah absorpsinya. Konsentrasi yang lebih tinggi dari struktur
lipid lebih mudah diperoleh dengan menggunakan reaksi asidolisis.
Gambar 2.2. TAG diturunkan dari 1,3 reaksi transesterifikasi yang dikatalisis
oleh lipase diantara sebuah TAG rantai menengah (A) atau metil ester (B) dan
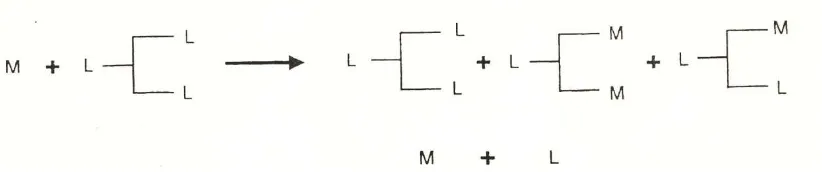
2.6.2. Asidolisis
Asidolisis ditemukan sebagai transfer sebuah gugus asil diantara sebuah asam dan
sebuah ester, dan digunakan terutama untuk menggabungkan asam lemak bebas
kedalam trisasilgliserol (Gambar 2.3.). Asidolisis diantara sebuah fraksi yang banyak
mengandung asam lemak tidak jenuh dan minyak ikan merupakan jalan yang baik
untuk mendapatkan konsentrasi asam lemak tidak jenuh didalam minyak ikan, sejak
minyak ikan cenderung memiliki asam lemak tidak jenuh didalam posisi sn-2, lebih
memungkinkan untuk menggabungkannya didalam posisi sn-1 dan sn-3.
Minyak ikan yang diperkaya asam lemak tidak jenuh telah digunakan didalam
bentuk enkapsulasi untk mengurangi resiko penyakit kardiovaskuler pada dewasa.
Minyak ini tidak cocok digunakan untuk bayi pada konsentrasi EPA yang tinggi
yangmana dapat bersaing dengan AA (arachidonic acid) dan mempengaruhi
pertumbuhan. Minyak sayur yang diperkaya asam lemak tidak jenuh telah digunakan
dalam pencegahan penyakit kardiovaskuler pada dewasa. Manfaat asidolisis dibawah
transesterifikasi untuk menghasilkan lipid yang terstruktur merupakan penggabungan
yang lebih besar. Bagaimanapun, hal ini masih sulit dalam menempatkan asam lemak
tidak jenuh pada posisi sn-2 dan asam lemak rantai menengah pada posisi 1 dan 3.
Gambar 2.3. TAG yang potensial diturunkan dari 1,3 reaksi asidolisis yang
dikatalisis oleh lipase diantara sebuah TAG rantai panjang dan sebuah asam
lemak rantai menengah.
Ada kerugian paling besar yang berkaitan dengan penggunaan asidolisis yang
berarti mengubah kualitas nutrisi dari lemak dan minyak. Memperoleh asam lemak
yang berkonsentrasi tinggi dengan konsentrasi DHA atau EPA yang tinggi
atau destilasi molekuler. Sejak asam lemak dari TAG murni dirilis selama
pembelajaran asidolisis, asam lemak plus penetapan dari substrat asli dapat
dipindahkan dari lipid. Akhir dari kelabilan panas asam lemak tidak jenuh, secara
tradisional artinya adalah asam lemak yang berpindah tersebut sebagai destilasi
molekuler telah ditempatkan sebagai metode titrasi dengan garam untuk
mengendapkan asam lemak.
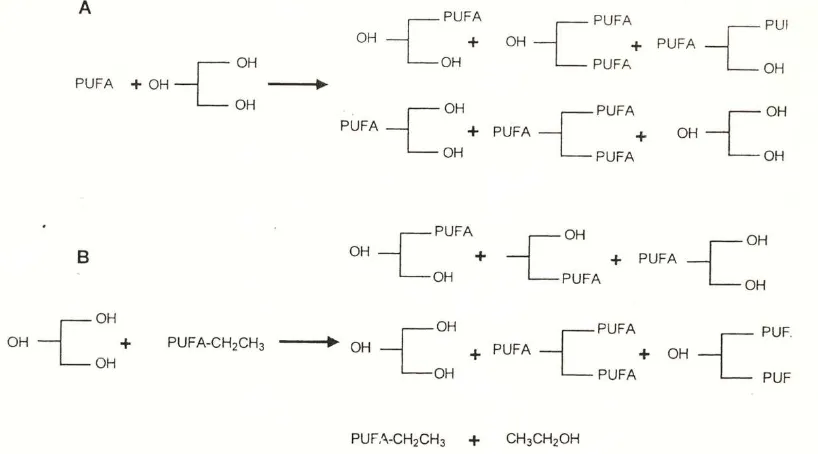
2.6.3. Gliserolisis / Esterifikasi
Gliserolisis adalah reaksi antara TAG dan gliserol, dimana esterifikasi adalah reaksi
antara gliserol (atau gugus alkohol yaitu gliserida sebagian) dan sebuah asam lemak
bebas (Gambar 2.3). Aplikasi yang penting dari esterifikasi yaitu dalam produksi TAG
yang mengandung semua rantai panjang asam lemak tidak jenuh untuk digunakan
sebagai suplemen dewasa atau semua asam lemak rantai menengah untuk nutrisi
oarng lanjut usia, dimana gliserolisis telah digunakan untuk memproduksi asam lemak
tidak jenuh yang mengandung monoasilgliserol. Manfaat dari gliserolisis dan
esterifikasi merupakan pemurnian yang tinggi dari TAG yang mengandung hanya 1
macam asam lemak yang dapat dihasilkan, meskipun kemurnian TAG cenderung
menjadi rendah. Kerugian dari esterifikasi adalah bahwa substrat asam lemak yang
tetap akan dipisahkan. Sebaliknya, esterifikasi menggunakan etil ester tetap layak
secara ekonomi untuk biaya produksi yang tinggi dalam memproduksi EPA dan DHA
yang berkonsentrasi.
2.6.4. Hidrolisis / Pengayaan yang Selektif
Seperti ynag telah disebutkan sebelumnya, beberapa lipase spesifik terhadap asam
lemak tertentu, sebuah properti yangmana dapat digunakan untuk asam lemak
berkonsentrasi selama hidrolisis dan transesterifikasi. Lipase dengan spesifitas
menurun terhadap DHA telah sering digunakan untuk menaikkan konsentrasi DHA
dalam minyak ikan. Aktivitas yang lebih rendah dari beberapa lipase terhadap DHA
disebabkan oleh bukti bahwa ikatan rangkap karbon yang paling dekat dengan gugus
karbonil adalah satu karbon yang lebih dekat dengan dekat didalam DHA
masuk ke sisi aktif. Ketika pengayaan selektif ini digunakan secara efektif dalam
modifikasi nutrisi lemak dan minyak, kepedulian harus diambil untuk mengakui
spesifitas lipase ini ketika metode modifikasi lain lipase untuk mencegah tingkat
rendah dari nggabungan beberapa asam lemak. Secara keseluruhan, pengayaan
selektif merupakan metode yang menjanjikan untuk konsentrasi asam lemak dalam
minyak, secara spesifik minyak ikan, sejak ini tidak memerlukan asam lemak tidak
jenuh yang berkonsentrasi yangmana sulit dan mahal untuk manufaktur.
Gambar 2.4. TAG yang potensial dari esterifikasi nonspesifik yang dikatalisis
oleh lipase(A) dan gliserolisis (B) reaksi antara gliserol dan sebuah sam lemak
tidak jenuh dan sebuah asam lemak tidak jenuh-etil ester, secara bersamaan.
BAB III
BAHAN DAN METODE PENELITIAN
3.1. Alat-Alat
- Gelas Ukur Pyrex
- Gelas Beaker Pyrex
- Gelas Erlenmeyer Pyrex
- Labu Takar Pyrex
- Buret Pyrex
- Neraca Analitis Mettler Toledo
- Sentrifugasi 5000 rpm Gemmy Corp KCE
- Sentrifugasi 3400 rpm Fisher Scientific
- Freeze drier Edwards
- Blender National
- Inkubator Gallenkamp
- Pipet Tetes
- Kapas
- Statif dan Klem
- Botol Akuades
- pH meter Walklab
- Hot Plate Thermolyne
- Pipet Serologi Pyrex
- Pipet Volumetri Pyrex
- Etanol Teknis (Bratachem)
- NaH2PO4.H2O p.a.(E.Merck)
- Na2HPO4 p.a.(E.Merck)
- Indikator Phenolphtalein p.a.(E.Merck)
- KOH(s) p.a.(E.Merck)
- Asam oksalat(s) p.a.(E.Merck)
- Akuades
- Biji jarak kepyar (Ricinus communis L)
- Minyak wijen
3.3. Prosedur Penelitian
3.3.1. Pembuatan Larutan Pereaksi
3.3.1.1. Indikator Phenolphtalein 1%
Ditimbang 1 g indikator Phenolphtalein dan dilarutkan dengan etanol dalam labu takar
100 mL sampai garis tanda.
3.3.1.2. Pembuatan Larutan KOH 0,087 N
a. Pembuatan larutan KOH 0,087 N
Ditimbang 5,61 g KOH dan dimasukkan kedalam labu takar 1000 mL, kemudian
dilarutkan dengan akuades hingga garis tanda, setelah itu dihomogenkan.
b. Standarisasi Larutan KOH 0,087 N dengan asam oksalat
Ditimbang dengan teliti 0,1 g asam oksalat (BM = 126), kemudian dilarutkan kedalam
50 mL akuades dan ditambahkan 3 tetes indikator Phenolphtalein kemudian dititrasi
dengan larutan KOH yang akan distandarisasi hingga warna merah lembayung. Hal
Perhitungan N Larutan KOH = (Sudarmadji, 1997)
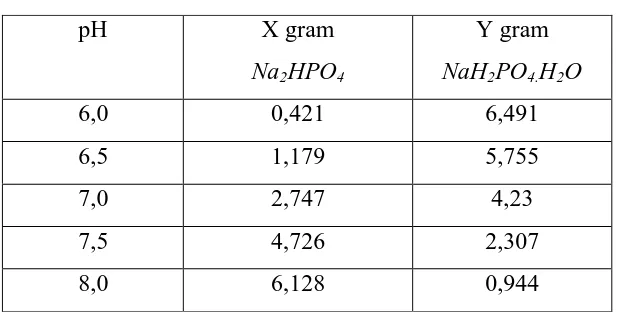
3.3.2. Pembuatan Buffer Fosfat 0,05 M
A = X gram Na2HPO4
B = Y gram NaH2PO4.H2O
A + B dimasukkan kedalam labu takar 1000 mL dan diencerkan sampai garis tanda.
Tabel 3.1. Pembuatan Larutan Buffer Phosfat pH 6,0 – 8,0
Perhitungan pembuatan buffer fosfat 0,05 M dapat dilihat pada lampiran 1.
3.3.3. Pembuatan Kecambah Dari Biji Jarak Kepyar
Dijemur 75 gram biji jarak kepyar selama ± 1 hari, kemudian dipisahkan antara
cangkang dan biji bagian dalamnya. Direndam biji bagian dalam di dalam air selama ±
3 jam, setelah itu dikecambahkan dengan cara ditaburkan diatas kapas yang lembab
pada suhu 28 – 30oC selama 4 hari.
3.3.4. Penyediaan Crude Enzim Lipase Dari Kecambah Biji Jarak Kepyar
Ditimbang kecambah sebanyak 65 gram, ditambahkan dengan buffer fosfat pH 7,0
sebanyak 150 mL dan diblender selama ± 1 menit, kemudian disaring. Filtrat
disentrifugasi pada 5000 rpm selama 30 menit. Didekantasi supernatan sebanyak 120
mL dan ditambahkan 60 mL aseton kemudian didiamkan selama 1 malam pada suhu
4oC. Suspensi yang terbentuk disentrifugasi pada 3400 rpm selama 30 menit dan pellet
yang terbentuk dikeringkan dengan freeze drier. Sebanyak 0,5 gram serbuk crude
enzim lipase dilarutkan dengan 50 mL buffer fosfat pH 7,0 dan diuji aktivitasnya
dalam menghidrolisis minyak wijen.
3.3.5. Penentuan Suhu Optimum Untuk Aktivitas Crude Enzim Lipase Pada
Hidrolisis Minyak Wijen
Ditimbang minyak wijen sebanyak 2,5 gram dan masing – masing dimasukkan
kedalam 5 gelas Erlenmeyer, ditambahkan 10 mL etanol dan ditambahkan 5 mL
buffer fosfat pH 7,0 ; ditambahkan 1 mL crude enzim lipase dan diinkubasi gelas
Erlenmeyer dengan variasi suhu 30oC; 35oC; 40oC; 45oC; dan 50oC selama 30 menit,
setelah itu ditambahkan 3 tetes indikator Phenolphtalein dan dititrasi dengan KOH
0,087 N sampai terjadi perubahan warna menjadi merah lembayung, dicatat volume
KOH 0,087 N yang terpakai, dihitung % ALB dan aktivitasnya
3.3.6. Penentuan pH Optimum Untuk Aktivitas Crude Enzim Lipase Pada
Hidrolisis Minyak Wijen
Ditimbang minyak wijen sebanyak 2,5 gram dan masing – masing dimasukkan
kedalam 5 gelas Erlenmeyer, ditambahkan 10 mL etanol dan ditambahkan 5 mL
buffer fosfat dengan variasi pH 6,0; 6,5; 7,0; 7,5; dan 8,0 dan ditambahkan 1 mL
crude enzim lipase dan diinkubasi gelas Erlenmeyer pada suhu 35oC selama 30 menit,
setelah itu ditambahkan 3 tetes indikator Phenolphtalein dan dititrasi dengan KOH
0,087 N sampai terjadi perubahan warna menjadi merah lembayung, dicatat volume
3.4. Bagan Penelitian
3.4.1. Pembuatan Kecambah Dari Biji Jarak Kepyar
Dijemur selama ± 1 hari
Dikupas 75 g biji jarak kepyar
biji bagian dalam ( 47 g) cangkang
Direndam dalam air selama ± 3 jam
Dikecambahkan pada suhu 28 – 30oC selama 4 hari
3.4.2. Penyediaan Crude Enzim Lipase dari Kecambah Biji Jarak Kepyar
Ditambahkan 60 mL aseton
Didiamkan selama 1 malam pada suhu 4oC
suspensi
Disentrifugasi pada 3400 rpm selama 30 menit
pelet supernatan
Dikeringkan dengan freeze drier
serbuk crude enzim lipase (1,1 g)
Diambil sebanyak 0,5 gram dan dilarutkan dengan buffer fosfat pH 7,0 pada labu takar 50 mL
crude enzim lipase
residu 65 g kecambah biji jarak kepyar
Ditambahkan 150 mL buffer fosfat pH 7,0
Diblender selama ± 1 menit
Disaring
filtrat
Disentrifugasi pada 5000 rpm selama 30 menit
3.4.3. Penentuan Suhu Optimum Untuk Aktivitas Crude Enzim Lipase Pada
Hidrolisis Minyak Wijen
2,5 g minyak wijen
Dimasukkan masing – masing kedalam 5 gelas Erlenmeyer 125 mL
Ditambahkan 10 mL etanol
Ditambahkan 5 mL buffer fosfat pH 7,0
Ditambahkan 1 mL crude enzim lipase
Diinkubasi gelas Erlenmeyer dengan variasi suhu 30oC; 35oC; 40oC; 45oC dan 50oC selama 30 menit
Ditambahkan 3 tetes indikator Phenolphtalein kedalam gelas Erlenmeyer
Dititrasi dengan KOH 0,087 N sampai terjadi perubahan warna menjadi merah lembayung
Dicatat volume KOH 0,087 N yang terpakai
Dihitung % ALB nya
Dihitung aktivitasnya
3.4.4. Penentuan pH Optimum Untuk Aktivitas Crude Enzim Lipase Pada
Hidrolisis Minyak Wijen
2,5 g minyak wijen
Dimasukkan masing – masing kedalam 5 gelas Erlenmeyer 125 mL
Ditambahkan 10 mL etanol
Ditambahkan 5 mL buffer fosfat dengan variasi pH 6,0; 6,5; 7,0; 7,5 dan 8,0
Ditambahkan 1 mL crude enzim lipase
Diinkubasi gelas Erlenmeyer pada suhu 35oC selama 30 menit
Ditambahkan 3 tetes indikator Phenolphtalein kedalam gelas Erlenmeyer
Dititrasi dengan KOH 0,087 N sampai terjadi perubahan warna menjadi merah lembayung
Dicatat volume KOH 0,087 N yang terpakai
Dihitung % ALB nya
Dihitung aktivitasnya
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Penentuan Suhu dan pH Optimum Untuk Aktivitas Crude Enzim Lipase
Dari Kecambah Biji Jarak Kepyar Terhadap Hidrolisis Minyak Wijen
Data hasil perhitungan Aktivitas Crude Enzim Lipase dalam menghidrolisis minyak
wijen pada pH 6,0 – 8,0 dapat dilihat pada tabel di bawah ini :
Tabel 4.2. Hasil Perhitungan aktivitas crude enzim lipase pada pH 6,0 – 8,0
Berat
Pengolahan data untuk perhitungan kadar ALB (asam lemak bebas) dapat dilihat pada
lampiran 2.
Pengolahan data untuk perhitungan aktivitas crude enzim lipase dapat dilihat pada
lampiran 3.
4.2. Pembahasan Hasil Penelitian
4.2.1. Isolasi Crude Enzim Lipase dari Kecambah Biji Jarak Kepyar
Crude enzim lipase diperoleh dari kecambah biji jarak kepyar (Ricinus communis L)
yang telah berumur 4 hari. Kemudian isolasi dilakukan dengan penambahan aseton
sebagai pelarut pada suhu 4oC untuk mengendapkan protein dan memisahkan enzim
dari partikel non-enzim. Aseton mempengaruhi aktivitas air dengan cara mereduksi
kelarutan protein, sehingga terjadi agregasi dan pengendapan. Struktur air di sekeliling
area hidrofobik pada permukaan protein dapat ditempati oleh molekul pelarut organik,
sehingga agregasi terjadi akibat interaksi antara muatan berlawanan pada permukaan
protein.
4.2.2. Penentuan Suhu Optimum Untuk Aktivitas Crude Enzim Lipase dari
Kecambah Biji Jarak Kepyar (Ricinus communis L) Terhadap Hidrolisis
Minyak Wijen
Berdasarkan nomenklatur dari International Union of Biochemistry, enzim lipase
berfungsi mengkatalisis trigliserida menjadi gliserol dan asam lemak bebas.
Jika reaksi hidrolisis dikatalisis oleh enzim lipase, maka asam lemak bebas yang
terbentuk akan semakin banyak, karena reaksi akan berjalan lebih cepat dengan
adanya katalis lipase. Katalis lipase ini akan menurunkan energi aktivasi dari reaksi
Untuk menentukan aktivitas crude enzim lipase dapat dilakukan dengan
metode titrimetri. Metode titrimetri tersebut menggunakan titran KOH 0,087 N, yang
bertujuan untuk mendeteksi kandungan asam lemak bebas (ALB) dalam minyak wijen
yang telah dikatalisis oleh crude enzim lipase. Asam lemak bebas yang terbentuk dari
reaksi hidrolisis tersebut kemudian ditentukan jumlah mol asam lemak bebas yang
berhasil dikatalisis oleh lipase. Dengan adanya imdikator phenolphtalein, maka dapat
diamati perubahan warna pada saat terjadi kesetimbangan jumlah mol antara asam
lemak bebas dan titran KOH. Jadi volume titran KOH identik dengan jumlah mol
asam lemak bebas yang berhasil dikatalisis oleh lipase. Dengan begitu besarnya
aktivitas crude enzim lipase (µmol/ mL/ menit) dapat diukur.
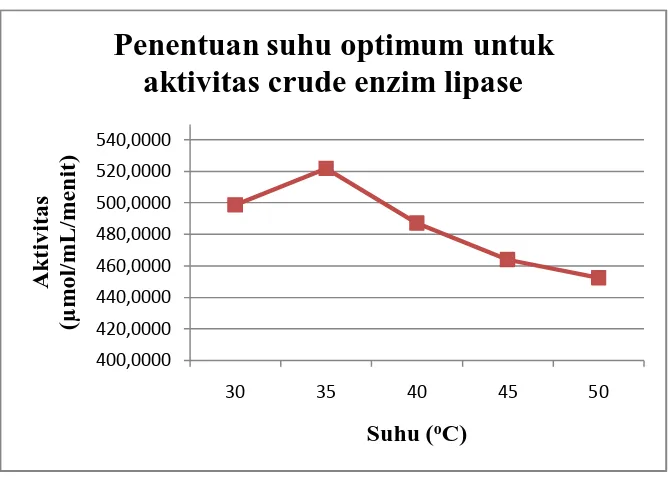
Penentuan suhu optimum untuk aktivitas crude enzim lipase dapat dilihat pada grafik
dibawah ini :
Grafik 4.1. Penentuan suhu optimum untuk aktivitas crude enzim lipase
terhadap hidrolisis minyak wijen
Pada umumnya semakin tinggi suhu, maka semakin naik laju reaksi kimia, baik yang
dikatalisis maupun yang tidak dikatalisis oleh enzim. Tetapi perlu diingat bahwa
enzim adalah protein, jadi semakin tinggi suhu proses, maka inaktivasi enzim juga
dapat mempercepat perusakan enzim. Pada suhu terlalu rendah, laju reaksi akan kecil,
sedangkan pada suhu terlalu tinggi maka laju inaktivasi akan semakin cepat dan
menyebabkan reaksi praktis berhenti sama sekali. Oleh karena itu enzim mempunyai
suhu yang optimum dimana laju reaksi akan berjalan cepat. Dari grafik dapat
diketahui bahwa suhu optimum untuk aktivitas crude enzim lipase dalam
menghidrolisis minyak wijen adalah 35oC. Pada suhu diatas 35 oC, yaitu 40 – 50oC
aktivitas crude enzim lipase menurun karena crude enzim lipase terdenaturasi
sehingga laju inaktivasi enzim akan berjalan begitu lambat dan laju inaktivasi enzim
bisa diabaikan.
4.2.3. Penentuan pH Optimum Untuk Aktivitas Crude Enzim Lipase dari
Kecambah Biji Jarak Kepyar (Ricinus communis L) Terhadap Hidrolisis
Minyak Wijen
Penentuan pH optimum untuk aktivitas crude enzim lipase dapat dilihat pada gambar
dibawah ini :
Grafik 4.2. Penentuan pH optimum untuk aktivitas crude enzim lipase
terhadap hidrolisis minyak wijen
Pada grafik dapat diketahui bahwa pH optimum untuk aktivitas crude enzim lipase
enzim lipase bertambah dengan naiknya pH. Dimana pH berhubungan dengan struktur
enzim yang terdiri dari asam-asam amino. Perubahan pH dalam suatu larutan
menunjukkan perubahan jumlah ion H+ yang ada didalam larutan. Jumlah ion yang
ada akan mempengaruhi ionisasi dari gugus-gugus fungsi pada asam amino dan juga
mempengaruhi ikatan hidrogen yang ada pada enzim sehingga dapat menyebabkan
terjadinya perubahan konformasi dari enzim tersebut.
Terjadinya perubahan konformasi enzim menyebabkan turunnya aktivitas
enzim tersebut. Hal ini disebabkan karena konformasi enzim tidak sama dengan
konformasi substrat sehingga reaksi antara enzim dengan substrat tidak dapat
berlangsung dengan baik. Pada pH optimumnya, jumlah ion H+ tidak mempengaruhi
konformasi enzim sehingga pada pH ini konformasi enzim sama dengan konformasi
substrat ( lock and key ). Hal ini menyebabkan interaksi enzim dengan substrat
meningkat, sehingga pada pH ini aktivitas enzim paling tinggi.
4.2.4. Penentuan waktu inkubasi pada keadaan optimum yaitu suhu 35oC dan
pH 7,0.
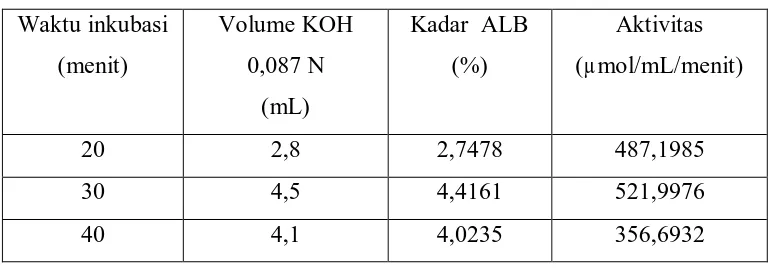
Penentuan waktu inkubasi dapat dilihat pada tabel dibawah ini :
Tabel 4.3. Penentuan waktu inkubasi pasa duhu 35oC dan pH 7,0
Waktu inkubasi
memiliki aktivitas yang paling optimum dalam menghidrolisis minyak wijen adalah
30 menit. Sehingga waktu inkubasi yang digunakan adalah 30 menit.
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian dapat disimpulkan :
1. Isolasi crude enzim lipase dilakukan dengan penambahan aseton pada suhu 4oC
untuk mengendapkan protein dan memisahkan enzim dari partikel non-enzim.
2. suhu dan pH optimum untuk aktivitas tertinggi crude enzim lipase hasil isolasi
kecambah biji jarak kepyar (Ricinus communis L) terhadap substrat minyak wijen
adalah 35oC dan 7,0 ; dimana ditandai dengan kadar asam lemak bebas sebesar
4,4161 % dan aktivitas tertingginya yaitu 521,9976 µmol/ mL/ menit.
5.2. Saran
Sebaiknya dilakukan penelitian lebih lanjut yaitu dengan memurnikan dan
DAFTAR PUSTAKA
Abigor,R.D. 2002. Partial Purification and Properties of Lipase from Germinating
Seeds of Jatropha Curcas L. J. Am Oil. Soc, 79: hal. 1123-1126.
Bonner,J., and Varne, J. 1976. Plant Biochemistry. Third Edition. Academic Press. New York.
Gaman,P.M and Sherington,B. 1992. Pengantar Ilmu Pangan Nutrisi & Mikrobiologi. Edisi Kedua. Gadjah Mada University Press. Yogyakarta.
Gandhi,N.N. 1997. Application of Lipase. JAOCS, AOCS Press.vol 74.
Gardner,F.P., and Pearce, R.B. 1991. Fisiologi Tanaman Budidaya. Universitas Indonesia Press. Jakarta.
Handajani, S. 2006. Potensi Agribisnis Komoditas Wijen. Penerbit Andi. Yogyakarta.
Handayani,R. 2005. Transesterifikasi Ester Asam Lemak Melalui Pemanfaatan
Teknologi Lipase. LIPI. Bogor.
http://ms.wikipedia. Org/wiki/Enzim. Diakses tanggal 2 Februari 2011.
Ilistyawati,D.A. 1996. Amobilisasi Enzim Amylase Dari Aspergillus niger Dengan
Carrier Alginate Untuk Konversi Amilum Menjadi Glukosa. FMIPA.
Universitas Brawijaya.
Ketaren,S. 1986. Pengantar Teknologi Minyak dan Lemak Pangan. Edisi I. UI Press. Jakarta.
Lehninger,A.L. 1998. Dasar – Dasar Biokimia. Erlangga. Jakarta.
Lin, Y.H., and A.H.C Huang. 1983. Lipase in the Lipid Bodies of the Cotyledons of
Rape and Mustard Seedlings. Biology Department. University of South
Carolina. Columbia.
Moentamaria,D. 2009. Kajian Awal Pembuatan Biokatalisator Lipase Teramobil Dari
Mucor Miehei Untuk Pengolahan Minyak Randu Menjadi Biodiesel. Jurusan
Teknik Kimia Politeknik Negeri Malang. Malang.
Senanayake, S.P.J.N. dan F. Shahidi. 2000. Lipid Component of Borage (Borago
officinalis L) Seed and Their Change During Germination. J Am. Oil. Chem.
Suhendra,L. Tranggono, dan Hidayat, C. Aktifitas Hidrolisis dan Esterifikasi Lipase
Ekstrak Kecambah Biji Wijen (Sesamun Indicum). Universitas Gadjah Mada.
Yogyakarta. hal 1-2.
Willis,W.M., and Marangoni, A.G. 1999. Biotechnological Strategies for the
Modification of Food Lipids. Department of Food Science. University of
Guelph. Canada.
Lampiran 1. Perhitungan Pembuatan Buffer Fosfat 0,05 M
Dipakai Rumus :
pH = pKa + log
Untuk pH = 6,0
6,0 = 7,2 + log
log = - 1,2
=
% = x 100%
= x 100%
= 5,93 %
% = x 100%
= x 100%
= 94,07 %
g = % x M x BM
= 0,0593 x 0,05 x 142
= 0,421 g/L
g = % x M x BM
= 0,9407 x 0,05 x 138
Lampiran 2. Perhitungan Kadar ALB (Asam Lemak Bebas) Hasil hidrolisis
Minyak Wijen Oleh Crude Enzim Lipase
Untuk volume KOH 0,087 N adalah 4,5 mL maka % ALB nya adalah
=
= 4,4161 %
Lampiran 3. Perhitungan aktivitas crude enzim lipase
Aktivitas crude enzim lipase dapat dihitung dengan mengkonversikan % ALB ke
Dimana: % ALB = kadar asam lemak bebas yang dihidrolisis dalam minyak wijen
oleh crude enzim lipase
BM = berat molekul asam lemak bebas (oleat 282)
t = waktu inkubasi (30 menit)
Pada suhu 35oC diperoleh % ALB = 4,4161, maka aktivitasnya dapat dihitung :
Aktivitas = 4,4161 / 282 30
X 106 µmol/ mL/ menit
Lampiran 4. Gambar Penelitian
Gambar pohon jarak kepyar Gambar biji jarak kepyar dengan cangkang