PEMANFAATAN NATA PATI KACANG MERAH (Vignea sinensis ) HASIL ISOLASI SEBAGAI MATRIKS TEOFILIN
Diajukan Untuk Melengkapi Salah Satu Syarat Untuk Mencapai Gelar Sarjana Farmasi Pada
Fakultas Farmasi Universitas Sumatera Utara
SKRIPSI
Oleh:
AUDREY MARSELINA ZEBUA NIM 060824025
PROGRAM EKSTENSI SARJANA FARMASI FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
Pengesahan Skripsi Judul:
PEMANFAATAN NATA PATI KACANG MERAH (Vignea sinensis ) HASIL ISOLASI SEBAGAI MATRIKS TEOFILIN
Oleh:
Audrey Marselina Zebua Nim 0600824025
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas farmasi Universitas Sumatera Utara
Pada tanggal: Maret 2009
Pembimbing I Panitia Penguji I:
(Drs. Kasmirul Ramlan Sinaga, M.S.,Apt.) (Prof. Dr. Hakim Bangun, Ph.D., Apt)
Nip: 131 283 722 Nip: 130 872 286
Pembimbing II (Drs. Kasmirul Ramlan Sinaga, M.S.,Apt.)
Nip: 131 283 722
(Dra. Marline Nainggolan, M.S., Apt) (Dra Azizah Nasution, M.Sc.,Apt)
Nip: 131 485 243 Nip: 131 283 721
(Dra.Hj. Aswita Hafni, M.Si.,Apt)
Nip: 131 270 667
Dekan,
KATA PENGANTAR
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Esa atas segala limpahan karunia dan rahmat yang tidak terhingga sehingga penulis dapat menyelesaikan penelitian serta penyusunan skripsi ini. Skripsi ini diajukan untuk memenuhi persyaratan dalam mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara.
Penulis mengucapkan terimakasih yang tak terhingga kepada ayahanda O. Zebua (alm), Ibunda Yulimas Zebua tercinta, Mama Junita tercinta, Suami Emanuel Daeli, ST terkasih, anak-anak tersayang Adriel dan Selma, Adinda Mira/suami yang telah memberikan dorongan moril maupun materil serta doa kepada penulis. Penulis juga mengucapkan terimakasih yang sebesar-besarnya kepada pihak-pihak yang telah membantu sehingga skripsi ini dapat di selesaikan. Dengan rasa hormat dan kerendahan hati penulis ucapkan terimakasih kepada:
1. Bapak Dekan dan para Pembantu Dekan Fakultas Farmasi Universitas Sumatera Utara.
2. Bapak Drs. Kasmirul Ramlan Sinaga, M.S., Apt dan Ibu Dra. Marline Nainggolan, M.S., Apt. sebagai dosen pembimbing atas segala arahan, ilmu serta nasehat selama proses penelitian dan penyusunan skripsi ini. 3. Ibu Dra.Djendakita Purba.M.Si.,Apt sebagai dosen penasehat akademik
dan seluruh staf pengajar atas nasehat dan bimbingannya selama proses perkuliahan.
5. Sahabat-sahabat penulis: Vitha, Nia, Mimi, Nike, Kak Cut, Vika, Ayu, Bang Harry dan rekan-rekan mahasiswa farmasi ekstensi stambuk 2006 serta seluruh pihak yang telah memberikan kasih sayang, bantuan, motivasi, dan inspirasi bagi penulis selama masa perkuliahan sampai penyusunan skripsi ini.
6. Kepada Kepala Laboratorium Fitokimia dan Laboratorium Steril dan seluruh staf atas seluruh fasilitas yang diberikan selama proses penelitian . Semoga Tuhan Yang maha Kuasa memberikan balasan yang berlipatganda atas jasa besar mereka.
Penulis menyadari bahwa tulisan ini masih jauh dari kesempurnaan sehingga membutuhkan banyak masukan dan kritikan. Namun demikian, penulis berharap semoga skripsi ini dapat menjadi sumbangan berarti bagi ilmu pengetahuan khususnya di bidang farmasi.
Medan, Maret 2009
Penulis
ABSTRAK
Telah diteliti pengaruh konsentrasi pati kacang merah hasil isolasi pembuatan nata dan pengaruh pH terhadap kecepatan pelarutan teofilin dari sediaan matriks dan bentuk kapsul. Teofilin dibungkus dalam membran nata yang telah dibentuk mirip kapsul dan matriks nata yang direndam dalam larutan teofilin selam 24 jam.
Uji kecepatan pelarutan dilakukan dengan metode dayung menurut Farmakope Indonesia dalam medium pH 1,2 dan 6 pada suhu 37± 0,50C dengan kecepatan putaran 100 rpm.
ABSTRACT
The concentration effect of red nut extract as isolation result of nata processing and pH on teofilin solubility speed from matrix availability and capsule form, has been observed. The teofilin was wrapped in capsule-shaped nata membrane and nata matrix soaked in teofilin solution for 24 hours.
The solubility speed test has been made by paddle method according to Indonesia pharmacope in medium of pH 1,2 and 6 at 37 ± 0,50 C by rotation speed of 100 rpm.
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN... ii
ABSTRAK ... iii
ABSTRACT ... iv
DAFTAR ISI... v
DAFTAR LAMPIRAN ... vii
DAFTAR GAMBAR... ix
BAB I. PENDAHULUAN 1.1. Latar belakang... 1
1.2. Perumusan masalah ... 3
1.3. Hipotesa... 3
2.1.3 Faktor-faktor yang mempengaruhi nata decoco... 6
2.2. Acetobakter xylinum...6
2.2.1 Cara bakteri Acetobakter xylinum membentuk nata decoco ... 8
2.3. Kacang merah ... 9
2.3.1.Morfologi ... 9
2.3.2. Sinonim ... 9
2.3.3. Klasifikasi ... 9
2.3.4. Kandungan kimia ... 10
2.3.5. Khasiat ... 10
2.4. Teofilin... 10
2.5. Disolusi ... 11
2.5.1Metode disolusi ... 11
2.7.1. Kebaikan dan keburukan sediaan pelepasan terkontrol...14
BAB II. METODOLOGI 3.1. Alat-alat dan Bahan-bahan... 16
3.1.1. Alat-alat yang digunakan ... 16
3.1.2. Bahan-bahan ... 16
3.2. Prosedur ... 16
3.2.1. Medium cairan lambung buatan (pH 1,2) ... 16
3.2.2. Medium cairan usus buatan (pH 6) ... 17
3.3. Pembuatan kurva serapan dan kurva kalibrasi teofilin dalam medium cairan lambung (pH 1,2) ... 17
3.3.1. Pembuatan larutan induk baku medium lambung (pH 1,2) ... 17
3.3.2. Pembuatan kurva serapan teofilin medium lambung (pH 1,2) .... 17
3.3.3. Pembuatan kurva kalibrasi teofilin medium lambung (pH 1,2) ... 17
3.4. Pembuatan kurva serapan dan kurva kalibrasi teofilin dalam medium cairan usus (pH 6) ... 17
3.4.1. Pembuatan larutan induk baku medium usus (pH 6) ... 18
3.4.2. Pembuatan kurva serapan teofilin medium usus ( pH 6) ... 18
3.4.3. Pembuatan kurva kalibrasi teofilin medium usus (pH 6)... 18
3.4.4. Pembuatan bibit (starter) ... 18
3.4.5. Penyiapan biji kacang merah...19
3.4.6. Isolasi Pati Kacang merah ... 19
3.4.7.Pembuatan nata kacang merah 1%... 19
3.4.8. Pembuatan nata kacang merah 2.5%... 20
3.4.9. Pembuatan nata kacang merah sebagai sediaan mirip kapsul ... 20
3.5. Uji disolusi ... 21
BAB IV. HASIL PERCOBAAN DAN PEMBAHASAN ... 23
4.1. Hasil isolasi pati kacang merah ... 23
4.2. Hasil pembuatan nata kacang merah ... 23
4.3. Uji disolusi teofilin... 24
4.3.1. Disolusi matriks nata pada medium lambung buatan(pH 1,2)... 24
4.3.3. Disolusi Nata mirip kapsul pada medium lambung buatan
(pH 1,2) ... 28
4.3.4. Disolusi nata mirip kapsul pada medium ususbuatan (pH 6)... 15
BAB V. KESIMPULAN DAN SARAN ... 39
5.1. Kesimpulan ... 39
5.2. Saran... 39
DAFTAR LAMPIRAN
Lampiran 1a. Data pengukuran kurva serapan Teofilin dalam berbagai panjang
gelombang pada medium pH 1,2 ... 42
Lampiran 1b. Data Pengukuran kurva kalibrasi Larutan Teofilin dengan berbagai konsentrasi pada panjang gelombang 271 nm dalam medium pH 1,2... 43
Lampiran 2a. Data pengukuran kurva serapan teofilin dalam berbagai panjang gelombang pada medium usus (pH 6)... 44
Lampiran 2b. Data pengukuran kurva kalibrasi teofilin dengan berbagai konsentrasi pada panjang gelombang 271 nm dalam medium usus ( pH 6) ... 45
Lampiran 3.%Kumulatif teofilin berbagai formula dalam medium lambung buatan pH 1,2 dan medium usus buatan pH 6... 48
Lampiran 4. Uji SPSS(Anova) Pada medium pH 1,2 Pada formula 1,2,dan 3... 54
Lampiran 5 : Uji SPSS(Anova) Pada medium pH 6 Pada formula 1,2,dan 3... 58
Lampiran 6 : Uji SPSS (Anova) Pada Medium pH 1,2 Pada formula 4,5,6 ... 63
Lampiran 7: Uji SPSS (Anova) Pada Medium pH 6 Pada Formula 4,5,6 ... 67
Lampiran 8: Uji SPSS (Anova) Pada Medium Lambung Buatan pH 1,2 Pada Formula 1,2,3,4,5,dan 6 ... 72
Lampiran 9 Uji SPSS (Anova) Pada Medium pH 6 Pada Formula 1,2,3,4,5,dan 6... 78
Lampiran 10Contoh perhitungan jumlah teofilin yang terperangkap kedalam matriks nata ... 84
Lampiran 11. Jumlah Teofilin yang Terperangkap dalam medium I ( pH 1,2) ... 84
Lampiran 12. Jumlah Teofilin yang Terperangkap dalam medium II ( pH 6 )... 85
Lampiran 13. Contoh perhitungan kadar teofilin yang terlepas... 85
Lampiran 14. Contoh perhitungan t50%... 88
Lampiran 15 Diagram alir proses pembuatan lembaran nata kacang merah secara bertahap ... 89
Lampiran 16 Pembuatan sediaan teofilin dalam nata kacang merah dengan berbagai konsentrasi pati sediaan mirip kapsul... 90
Lampiran 18. Potongan Nata 10 mm x 10 mm ... 92 Lampiran 19 Gambar nata... 92 Lampiran 20 Nata mirip kapsul
Lampiran 20. Nata mirip kapsu l
Lampiran 21. Gambar Pati dalam nata kacang merah (pati 1%) Lampiran 22. Gambar Pati dalam nata kacang merah (pati 2.5%) Lampiran 23. Gambar alat disolusi
DAFTAR GAMBAR
Gambar 1 : Uji disolusi Teofilin dalam Medium Lambung pH 1,2... 12
Gambar 2 : Uji disolusi Teofilin dalam Medium Usus pH 6 ... 13
Gambar 3 : Uji disolusi Teofilin dalam Medium lambung pH 1,2 ... 14
Gambar 4 : Uji Disolusi Teofilin dalam Medium Usus pH 6 ... 15
Gambar 5 : Uji Disolusi Teofilin dalam Medium p Lambung pH 1,2... 17
Gambar 6 : Uji Disolusi Teofilin dalam Medium Usus pH 6 ... 19
Gambar 7. Histogram Pelepasan 50 % Teofilin dalam Medium I ( pH 1,2 )... 20
Gambar 8 .Histogram Pelepasan 50 % Teofilin Matriks Mirip Kapsul Nata dalam Medium Lambung ( pH 1,2 ) ... 20
Gambar 9. Histogram Pelepasan 50 % Teofilin dalam Medium Usus ( pH 6 )... 21
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN... ii
ABSTRAK ... iii
ABSTRACT ... iv
DAFTAR ISI... v
DAFTAR LAMPIRAN ... vii
DAFTAR GAMBAR... ix
BAB I. PENDAHULUAN 1.1. Latar belakang... 1
1.2. Perumusan masalah ... 3
1.3. Hipotesa... 3
2.1.3 Faktor-faktor yang mempengaruhi nata decoco... 6
2.2. Acetobakter xylinum...6
2.2.1 Cara bakteri Acetobakter xylinum membentuk nata decoco ... 8
2.3. Kacang merah ... 9
2.3.1.Morfologi ... 9
2.3.2. Sinonim ... 9
2.3.3. Klasifikasi ... 9
2.3.4. Kandungan kimia ... 10
2.3.5. Khasiat ... 10
2.4. Teofilin... 10
2.6. Aspek teori pelepasan membran...12
2.7. Sediaan pelepasan terkontrol... 14
2.7.1. Kebaikan dan keburukan sediaan pelepasan terkontrol...14
BAB II. METODOLOGI 3.1. Alat-alat dan Bahan-bahan... 16
3.1.1. Alat-alat yang digunakan ... 16
3.1.2. Bahan-bahan ... 16
3.2. Prosedur ... 16
3.2.1. Medium cairan lambung buatan (pH 1,2) ... 16
3.2.2. Medium cairan usus buatan (pH 6) ... 17
3.3. Pembuatan kurva serapan dan kurva kalibrasi teofilin dalam medium cairan lambung (pH 1,2) ... 17
3.3.1. Pembuatan larutan induk baku medium lambung (pH 1,2) ... 17
3.3.2. Pembuatan kurva serapan teofilin medium lambung (pH 1,2) .... 17
3.3.3. Pembuatan kurva kalibrasi teofilin medium lambung (pH 1,2) ... 17
3.4. Pembuatan kurva serapan dan kurva kalibrasi teofilin dalam medium cairan usus (pH 6) ... 17
3.4.1. Pembuatan larutan induk baku medium usus (pH 6) ... 18
3.4.2. Pembuatan kurva serapan teofilin medium usus ( pH 6) ... 18
3.4.3. Pembuatan kurva kalibrasi teofilin medium usus (pH 6)... 18
3.4.4. Pembuatan bibit (starter) ... 18
3.4.5. Penyiapan biji kacang merah...19
3.4.6. Isolasi Pati Kacang merah ... 19
3.4.7.Pembuatan nata kacang merah 1%... 19
3.4.8. Pembuatan nata kacang merah 2.5%... 20
3.4.9. Pembuatan nata kacang merah sebagai sediaan mirip kapsul ... 20
3.5. Uji disolusi ... 21
BAB IV. HASIL PERCOBAAN DAN PEMBAHASAN ... 23
4.1. Hasil isolasi pati kacang merah ... 23
4.2. Hasil pembuatan nata kacang merah ... 23
4.3.1. Disolusi matriks nata pada medium lambung buatan(pH 1,2)... 24
4.3.2. Disolusi matriks nata pada medium usus buatan (pH 6)... 26
4.3.3. Disolusi Nata mirip kapsul pada medium lambung buatan (pH 1,2) ... 28
4.3.4. Disolusi nata mirip kapsul pada medium ususbuatan (pH 6)... 15
BAB V. KESIMPULAN DAN SARAN ... 39
5.1. Kesimpulan ... 39
5.2. Saran... 39
DAFTAR LAMPIRAN
Lampiran 1a. Data pengukuran kurva serapan Teofilin dalam berbagai panjang
gelombang pada medium pH 1,2 ... 42
Lampiran 1b. Data Pengukuran kurva kalibrasi Larutan Teofilin dengan berbagai konsentrasi pada panjang gelombang 271 nm dalam medium pH 1,2... 43
Lampiran 2a. Data pengukuran kurva serapan teofilin dalam berbagai panjang gelombang pada medium usus (pH 6)... 44
Lampiran 2b. Data pengukuran kurva kalibrasi teofilin dengan berbagai konsentrasi pada panjang gelombang 271 nm dalam medium usus ( pH 6) ... 45
Lampiran 3.%Kumulatif teofilin berbagai formula dalam medium lambung buatan pH 1,2 dan medium usus buatan pH 6... 48
Lampiran 4. Uji SPSS(Anova) Pada medium pH 1,2 Pada formula 1,2,dan 3... 54
Lampiran 5 : Uji SPSS(Anova) Pada medium pH 6 Pada formula 1,2,dan 3... 58
Lampiran 6 : Uji SPSS (Anova) Pada Medium pH 1,2 Pada formula 4,5,6 ... 63
Lampiran 7: Uji SPSS (Anova) Pada Medium pH 6 Pada Formula 4,5,6 ... 67
Lampiran 8: Uji SPSS (Anova) Pada Medium Lambung Buatan pH 1,2 Pada Formula 1,2,3,4,5,dan 6 ... 72
Lampiran 9 Uji SPSS (Anova) Pada Medium pH 6 Pada Formula 1,2,3,4,5,dan 6... 78
Lampiran 10Contoh perhitungan jumlah teofilin yang terperangkap kedalam matriks nata ... 84
Lampiran 11. Jumlah Teofilin yang Terperangkap dalam medium I ( pH 1,2) ... 84
Lampiran 12. Jumlah Teofilin yang Terperangkap dalam medium II ( pH 6 )... 85
Lampiran 13. Contoh perhitungan kadar teofilin yang terlepas... 85
Lampiran 14. Contoh perhitungan t50%... 88
Lampiran 15 Diagram alir proses pembuatan lembaran nata kacang merah secara bertahap ... 89
Lampiran 17 Pembuatan sediaan teofilin dalam matriks nata kacang merah dengan berbagai konsentrasi pati... 91 Lampiran 18. Potongan Nata 10 mm x 10 mm ... 92 Lampiran 19 Gambar nata... 92 Lampiran 20 Nata mirip kapsul
Lampiran 20. Nata mirip kapsu l
Lampiran 21. Gambar Pati dalam nata kacang merah (pati 1%) Lampiran 22. Gambar Pati dalam nata kacang merah (pati 2.5%) Lampiran 23. Gambar alat disolusi
DAFTAR GAMBAR
Gambar 1 : Uji disolusi Teofilin dalam Medium Lambung pH 1,2... 12
Gambar 2 : Uji disolusi Teofilin dalam Medium Usus pH 6 ... 13
Gambar 3 : Uji disolusi Teofilin dalam Medium lambung pH 1,2 ... 14
Gambar 4 : Uji Disolusi Teofilin dalam Medium Usus pH 6 ... 15
Gambar 5 : Uji Disolusi Teofilin dalam Medium p Lambung pH 1,2... 17
Gambar 6 : Uji Disolusi Teofilin dalam Medium Usus pH 6 ... 19
Gambar 7. Histogram Pelepasan 50 % Teofilin dalam Medium I ( pH 1,2 )... 20
Gambar 8 .Histogram Pelepasan 50 % Teofilin Matriks Mirip Kapsul Nata dalam Medium Lambung ( pH 1,2 ) ... 20
Gambar 9. Histogram Pelepasan 50 % Teofilin dalam Medium Usus ( pH 6 )... 21
BAB I PENDAHULUAN
1.1. Latar Belakang
Nata pertama sekali di kenal adalah nata de coco, dipopulerkan pada awalnya di Philipina untuk produk olahan yang di buat dari air kelapa dengan bantuan Acetobacter xylinum. Secara kimiawi nata de coco merupakan selulosa yang mengandung air sekitar 98%, dengan ciri fisik bertekstur lembut dengan konsistensi tegar serta berwarna putih. Nata de coco tergolong makanan berkalori rendah sehingga cocok untuk keperluan diet, di samping itu juga di gunakan sebagai campuran minuman. Selain nata de coco yang menggunakan substrat air kelapa., dikenal beberapa nata lain yang di buat dari berbagai macam substrat, misalnya nata de tomato yang berasal dari tomat, nata de cashew yang berasal dari jambu mete, nata de pina yang berasal dari nenas dan nata de aloevera yang berasal dari lidah buaya (Anonim, 2006).
Teofilin adalah derivat xantin yang sering sekali di gunakan untuk pengobatan asma bronkial. Menurut Tjay dan Rahardja (2002) teofilin juga sebaiknya di gunakan sebagai sediaan sustained release yang akan memberikan kadar konstan dalam darah yang lebih teratur. Selain itu efek toksik dari teofilin yang mulai terlihat pada kadar 15 mcg/ml dan lebih sering pada kadar 20 mcg/ml juga dapat dihindari efek samping yang berupa mual, muntah dan sakit kepala (Ganiswara, 1995).
Beberapa kesulitan yang dihadapi dalam mendesain sistem pelepasan agar penyerapan dan pencapaian bioavailabilitas lebih baik. Salah satu dari beberapa kesulitan tersebut adalah ketidakmampuan untuk membatasi bentuk pelepasan dosis pada bagian lambung yang diinginkan. Retensi lambung membantu mempersiapkan kemampuan absorbsi yang lebih baik. Retensi lambung yang dapat dikendalikan atas dosis padat dapat dilakukan dengan mekanisme mukoadhesi, sedimentasi, ekspansi, sistem bentuk yang dimodifikasi atau dengan pengaturan secara simultan atas senyawa farmakologis yang menunda pengosongan lambung. Berdasarkan pendekatan tersebut klasifikasi sistem
Floating Drug Delivery System (FDDS) dapat dijadikan sebagai metode yang sangat berguna dalam pengembangan bentuk dosis kefarmasian untuk sediaan pelepasan terkontrol (Arora et all, 2005).
Hal ini memungkinkan penggunaan nata obat diformulasi dalam bentuk sediaan menggunakan nata sebagai matiks, sebagai matriks digunakan nata yang bersifat semipermeabel dan dapat mengambang di dalam cairan lambung sehingga dapat digunakan untuk memperpanjang masa transit obat dan penetrasi cairan ke dalam matriks dapat dihambat dan akhirnya didapat sediaan pelepasan lambat.
1.2. Perumusan Masalah
1. Apakah nata kacang merah dapat dijadikan sebagai matriks dan sediaan mirip kapsul obat teofilin.
2. Apakah ada perbedaan pelepasan teofilin melalui matriks dan nata mirip kapsul dalam nata de coco, nata pati kacang merah 1% dan 2,5% dalam medium lambung buatan (pH 1,2) dan medium usus buatan (pH 6).
1.3. Hipotesa
1. Nata kacang merahdapat dijadikan sebagai matriks untuk sediaan obat teofilin.
1.4. Tujuan Penelitian
Tujuan penelitian ini ialah :
1. Untuk mengetahui apakah nata kacang merah dapat digunakan sebagai matriks untuk sediaan obat teofilin.
BAB II
TINJAUAN PUSTAKA
2.1. Nata De Coco 2.1.1 Asal Nata de coco
Istilah ”nata de coco” diduga berasal dari bahasa Spanyol yang dalam bahasa Inggris berarti cream, sehingga nata de coco kemudian diartikan sebagai krim dari air kelapa. Di Indonesia nata de coco juga sering disebut sari air kelapa atau sari kelapa. Asal usul nata de coco adalah dari Filipina, produk ini pertama kali diperkenalkan di Indonesia pada tahun 1978, namun baru dikenal di pasaran pada tahun 1981.
Nata de coco mula-mula dipopulerkan di Filipina untuk menyebut produk olahan yang dibuat dari air kelapa dengan bantuan Acetobacter xylinum. Air kelapa yang digunakan berasal dari kelapa muda karena memiliki kandungan gula maksimal yaitu 3 gram per 100 ml air kelapa, biasanya tercapai pada bulan keenam umur buah, kemudian menurun dengan semakin tuanya kelapa. Jenis gula yang terkandung adalah glukosa, fruktosa, dan sukrosa (Anonim, 2006).
2.1.2. Definisi Nata de coco
2.1.3. Faktor-faktor yang mempengaruhi pembuatan Nata de coco
Proses pembuatan nata de coco sangat dipengaruhi oleh berbagai faktor. Hal ini berhubungan dengan faktor-faktor yang mempengaruhi Acetobacter xylinum sebagai bakteri untuk proses fermentasi air kelapa. Pertumbuhan
Acetobacter xyilnum tersebut dipengaruhi oleh oksigen, pH, suhu, dan nutrisi. Faktor-faktor inilah yang harus diperhatikan untuk memperoleh nata de coco yang berkualitas baik. Di samping itu, dalam pembuatannya sangat memerlukan ketelitian dan sterilitas alat (Anonim, 2006).
2.2. Acetobacter xylinum
Spesies Acetobacter xylinum yang telah di kenal antara lain A. aceti, A. oelensis, A liquefacients, meskipun ciri-ciri yang dimiliki hampir sama dengan spesies lainnya namun masing-masing memiliki sifat yang unik.
Bakteri Acetobakter merupakan bakteri yang aerob atau mikroaerofil, berbentuk elips, berukuran 0,6-0,8 µm. Selnya ada yang dapat bergerak dan ada yang tidak dapat bergerak, jika bergerak ia menggunakan flagel peritrik atau lateral, tidak membentuk endospora, selnya gram negatif, membentuk asam dari glukosa. Temperatur optimum yang dapat hidup 250C – 300C Sedangkan pH optimum untuk pertumbuhannya adalah 5,4- 6,3. Spesies Acetobakter banyak terdapat pada bunga, buah-buahan, lebah madu, sake, anggur, sari buah apel, bir, jamur untuk membuat bir, asam cuka.
Acetobakter xylinum dapat membentuk suatu lapisan yang mencapai beberapa sentimeter pada permukaan substrat cair tempat hidupnya. Bakteri itu sendiri terperangkap di dalam massa fibril yang di buatnya, untuk dapat menghasilkan massa yang kokoh, kenyal, tebal, putih dan tembus pandang perlu di perhatikan suhu, inkubasi, komposisi, dan pH medium.
Medium yang baik serta pH medium merupakan faktor yang penting untuk mempengaruhi pertumbuhan, aktivitas fisiologi dan kematian mikororganisme. Aktivitas pembentukan nata oleh Acetobakter xylinum hanya tejadi pada pH sekitar 4 ataupun 5 – 5,5 dan suhu ruang fermentasi adalah 280 – 300C. Selama fermentasi Acetobakter xylinum unggul terhadap bakteri pembusuk yang dapat menggangu bakteri pembusuk nata.
Selama pemeraman, Acetobakter xylinum akan mensintesa gula menjadi selulosa atau nata yang diinginkan dan terbentuknya asam asetat akan menurunkan sampai pH 3,0 – 2,5. Berdasarkan kisaran tersebut, bakteri ini tergolong asidofil yaitu kelompok mikroorganisme yang tumbuh baik pada keasaman 2,0 – 5,0.
Bakteri Acetobakter xylinum mudah di temukan pada sari buah yang terfermentasi dan buah-buahan yang berkadar gula tinggi dan telah membusuk. Isolasi bakteri nata dari bahan-bahan tersebut tidak sulit di lakukan yaitu hanya dengan menumbuhkan di atas medim agar yang di tambah gula dan di perkaya nutrisi lain.
vitamin B komplek. Nutrisi-nutrisi tersebut merangsang pertumbuhan Acetobakter xylinum untuk membentuk nata .
Bakteri Acetobakter xylinum ini di peroleh dengan menggunakan larutan induk. Larutan induk di peroleh dari sari buah nenas atau biakan Acetobakter itu sendiri. Komponen media induk biasanya hamper sama dengan mendia fermentasi yang terdiri dari air kelapa sebagai bahan utama biakan bakteri asam cuka dan gula.
Tanda awal pertumbuhan bakteri nata pada media cair yang mengandung gula berupa timbulnya kekeruhan selama 24 jam inkubasi pada suhu kamar. Setelah 36 – 48 jam, suatu lapisan tembus cahaya mulai terbentuk di permukaan media dan secara bertahap akan menebal membentuk lapisan kompak, jika di ganggu lapisan ini akan tenggelam dan lapisan baru akan terbentuk di atas permukaan selama kondisi mendukung.
2.2.1. Cara Bakteri Acetobacter xylinum membentuk Nata de coco
Bakteri Acetobacter xylinum akan dapat membentuk nata de coco jika ditumbuhkan dalam air kelapa yang sudah diperkaya dengan Karbon (C) dan
2.3.Kacang Merah 2.3.1. Morfologi
Kacang merah berupa tanaman semak yang tegak dan ada yang merambat di para - para. Kacang merah dapat mencapai tinggi sekitar 3,5 - 4,5 meter, tumbuhnya memerlukan penyangga. Pengembangbiakan dapat dilakukan dengan biji, juga diperlukan tanah yang baik, Kacang merah akan dapat tumbuh baik di daerah basah atau dingin pada ketinggian 1400-2000 meter dari permukaan laut dan dipanen 6 bulan setelah penanaman. Kacang merah dapat digolongkan menjadi 2 macam, yaitu kacang merah yang tumbuhnya kerdil dan yang tumbuh memanjang dan memerlukan para - para. Warna bijinya merah bertotol - totol merah tua, sesuai dengan namanya. Buahnya (polong ) berwarna kuning, kalau masih muda berwarna hijau dan kadang - kadang berwarna merah. Kalau sudah tua berubah menguning, mengering, dan siap panen. Buahnya yang berbentuk polong memanjang, hanya sedikit lebih panjang bila dibandingkan dengan buncis. Dalam satu polong ada 2 - 3 biji kacang merah. Bentuk kacang merah yang masih utuh sama dengan kacang buncis, baik daun, bunga maupun bentuk polongnya.
2.3.2. Sinonim
Sinonim dari biji kacang merah (Vigna sinensis) adalah sebagai berikut :
Phaseolus bipunctatus Jacq, Vigna angularis (Willd).
2.3.3. Klasifikasi
Sistematika kacang merah adalah sebagai berikut: Kingdom : Plantae ( tumbuhan )
Subkingdom : Tracheobionta (berpembuluh) Superdivisio : Spermatophyta ( menghasilkan biji ) Divisio : Magnoliophyta ( berbunga )
Sub kelas : Rosidae Ordo : Fabales Familia : Fabaceae
Genus : Vigna Spesies : Vigna Sinensis 2.3.4. Kandungan Kimia
Daun, batang, akar dan biji Vigna Sinensis mengandung saponin, di samping itu daun, akar dan batangnya juga mengandung polifenol, akarnya mengandung flavonoida.
2.3.5. Khasiat
Biji kering tanaman ini di gunakan untuk membuat tepung kacang protein tinggi untuk memperkaya roti atau mie. Biji dan daun bernilai tinggi karena kualitasnya sebagai bahan diet untuk pengobatan asia tradisional. Setelah kacang ini di panen, batang kadang-kadang untuk makanan ternak.
2.4. Teofilin
Teofilin adalah alkaloid turunan xantin dengan rumus bangun :
Mempunyai nama lain : Anhydrous Theophylline; 1,3-Dimethylxanthine; Teofilina; 3,7-Dihydro-1,3-dimethylpurine-2,6(1H)-dione. Rumus molekul C7H8N4O2 dan berat molekulnya 180,2. Titik leburnya 270º-274ºC (Clarke,
Teofilin berupa serbuk hablur, tidak berbau, rasa pahit dan stabil di udara. Senyawa ini sukar larut dalam air, tetapi lebih mudah larut dalam air panas, mudah larut dalam larutan alkali hidroksida dan dalam amonium hidroksida, agak sukar larut dalam etanol, dalam kloroform dan dalam eter. Dosis lazim teofilin satu kali pemakaian 200 mg dan satu hari 500 mg, dosis maksimum satu kali pemakaian 500 mg dan satu hari 1000 mg (Depkes RI, 1979).
2.5. Disolusi
2.5.1. Metode disolusi
Disolusi adalah proses larutnya zat aktif dari sediaan dalam medium atau pelarut. Saat sekarang ini disolusi di pandang sebagai salah satu uji pengawasan mutu yang paling penting di lakukan pada sediaan farmasi.
Gambar 1. Pelepasan obat dengan metode disolusi.
Alat uji disolusi yang paling banyak digunakan dewasa ini adalah alat yang tertera dalam Farmakope Indonesia Edisi IV, 1994 yaitu :
a. Metode keranjang berputar
b. Metode dayung berputar
Metode dayung berputar terdiri atas suatu dayung yang dilapisi khusus, yang berfungsi memperkecil turbelensi yang disebabkan oleh pengadukan. Dayung diikat secara vertikal ke motor yang berputar dengan suatu kecepatan yang terkendali. Sampel diletakkan dalam labu pelarutan yang beralas bulat yang berfungsi untuk memperkecil turbelensi dari medium disolusi. Alat ditempatkan dalam suatu penangas air yang bersuhu konstan (37±0,5ºC).
2.6. Aspek Teori Pelintasan Membran
Pada kajian umum formulasi dan biofarmasi, istilah membran mempunyai arti yang sangat luas. Membran dapat berupa fase padat, setengah padat atau cair, dengan ukuran tertentu, tidak larut atau tidak tercampurkan dengan lingkungan disekitarnya dan dipisahkan satu dan lainnya umumnya oleh fase cair.
Dalam biofarmasi yaitu pada studi tentang penyerapan, membran padat dapat digunakan sebagai model pendekatan membran biologis. Selain itu membran padat juga digunakan sebagai model untuk mempelajari kompleks atau interaksi antara zat aktif dan bahan tambahan juga mempelajari proses pelepasan atau pelarutan.
Dalam studi biofarmasi mutlak diperlukan tindakan yang berhati-hati dalam pemilihan membran dan model percobaan, karena hal tersebut menentukan cara penilaian data penelitian.
Pengelompokan dan penggunaan membran sintetik
Membran padat tiruan dapat dibedakan atas 3 (tiga) kelompok yaitu : • Membran polimer berpori ( membran heterogen)
• Membran lipida tak berpori
a Membran polimer berpori
Molekul-molekul melintasi pori membran tanpa melarut dalam senyawa penyusun membran. Laju perlintasan membran tergantung pada ukuran pori, sifat molekul, komposisi dan kekentalan larutan di kedua sisi membran. Membran tersebut bertindak sebagai membran dialisis yang digunakan untuk memisahkan molekul kecil yang ukurannya sekitar ukuran pori, sedangkan senyawa makromolekul adalah nol atau hampir nol. Membran dialysis kadang-kadang disebut juga membran penyaring atau membran semipermeabel. Membran padat tiruan terutama terdiri dari satu atau lebih senyawa polimer yang tidak larut.
b. Membran polimer tak berpori
Membran padat tiruan pada umumnya dibuat hanya dari satu polimer. Perlintasan membran polimer tersebut terjadi karena kelarutan dan difusi molekul pada permukaan yang terdekat dengan membran dan karena adanya peresapan. Secara laboratorium, membran berpori maupun membran tak berpori dapat dibuat dengan 2 (dua) cara yaitu :
1. Penguapan perlahan pada permukaan datar (teflon, merkuri). Suatu larutan organik yang mengandung polimer dan bahan tambahan seperti
2. bahan pelicin atau bahan hidrofil yang dengan pelarutan akan membentuk pori membran. Dalam hal ini sifat pelarut dan laju penguapannya sangat berperan.
Karakter permeabilitas kedua membran yang didapat dengan cara berbeda dapat sangat berbeda, walaupun komposisi dan ketebalannya sama.
c. Membran lipida tak berpori
Membran lipida tak berpori terdiri dari bahan mekanik inert yang berfungsi untuk menjaga integritas membran dan kandungan fase lipida atau fosfolipida. Penggunaan lipida ini dimaksudkan untuk meniru sifat membran biologis sehingga memungkinkan terjadinya transport pasif melintasi membran karena keterlarutan bahan dalam bahan penyusun dinding sel.
2.8. Sediaan dengan Pelepasan Terkontrol
Tujuan utama dari suatu produk obat pelepasan terkontrol adalah untuk mencapai suatu efek terapetik yang diperpanjang disamping memperkecil efek samping yang tidak diinginkan yang disebabkan oleh fluktuasi kadar obat dalam plasma (Shargel dan Andrew, 1988).
Istilah pelepasan terkontrol menunjukkan bahwa obat dilepaskan dari sediaan sesuai dengan yang direncanakan dan pelepasannya lebih lambat dari sediaan konvensional sehingga akan memperpanjang kerja obat (Ansel, 1989).
2.8.1. Kebaikan dan Keburukan Sediaan Pelepasan Terkontrol
BAB III METODOLOGI
3.1. Alat-alat dan Bahan-bahan 3.1.1. Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah hot plate, penangas air, neraca listrik (Sartorius), disolution tester (Hanson type SR-8 plus), spektrofotometer UV/Visible (Shimadzu), freeze dryer (Edward), stopwatch, termometer, pH meter (Hanna), Alat sonikasi (Powersonic 140) dan alat-alat gelas.
3.1.2 Bahan-bahan
Teofilin (BPFI BPOM), Kalium dihidrogen phosfat, Natrium hidroksida, Asam klorida, biji kacang merah, air kelapa, gula, urea, asam asetat 25%,
Acetobacter xylinum.
3.2. Pembuatan pereaksi
3.2.1. Natrium hidroksida 0,2 N (Ditjen POM, 1995).
Natrium hidrksida sebanyak 8 gram dilarutkan dalam air bebas karbondioksida secukupnya hingga 1000ml.
3.2.2. Air bebas karbondioksida (Ditjen POM, 1995).
Air suling yang telah dididihkan selama 5 menit atau lebih didiamkan sampai dingin dan tidak boleh menyerap karbondioksida dari udara.
3.2.3. Medium cairan lambung buatan pH 1,2 (Ditjen POM, 1995)
3.2.4. Medium cairan usus buatan pH 6 (Ditjen POM, 1995).
Larutkan 6,8 gram kalium posfat dalam 250 ml air suling, tambahkan190 ml natrium hidroksida 0,2 N dan di tambahkan air suling hingga 1000 ml. Cek pH hingga menunjukkan pH 6
3.3. Pembuatan kurva serapan dan kurva kalibrasi teofilin dalam medium cairan lambung buatan pH 1,2.
3.3.1 Pembuatan larutan induk baku medium lambung buatan pH 1,2.
Ditimbang 50 mg teofilin dan dimasukkan dalam labu ukur 100 ml, dilarutkan dengan cairan lambung buatan pH 1,2 dan dicukupkan sampai batas tanda, lalu dikocok homogen sehingga diperoleh larutan induk baku dengan konsentrasi 500 mcg/ml.
3.3.2 Pembuatan kurva serapan teofilin medium lambung buatan ( pH 1,2)
Dipipet 0,4 ml larutan induk baku dan dimasukkan ke dalam labu ukur 25 ml dan di tambahkan dengan medium cairan lambung buatan pH 1,2 sampai garis tanda. Maka di peroleh larutan dengan konsentrasi 8 mcg/ml. Serapan larutan di ukur pada panjang gelombang 200-400 nm.
3.3.3. Pembuatan kurva kalibrasi teofilin medium lambung buatan (pH 1,2)
Dipipet larutan induk baku sebanyak 0,1ml; 0,2ml; 0,3ml; 0,4ml; 0,5ml; 0,6ml. Dimasukkan ke dalam labu ukur 25 ml kemudian di encerkan dengan medium cairan lambung buatan pH 1,2 sampai garis tanda. Serapan di ukur pada panjang gelombang maksimum dengan cairan lambung buatan pH 1,2 sebagai blanko.
3.4. Pembuatan kurva serapan dan kurva kalibrasi teofilin dalam medium cairan usus buatan ( pH 6)
Ditimbang 50 mg teofilin baku di masukkan dalam labu ukur 100 ml, di larutkan dengan cairan usus buatan pH 6dan di cukupkan sampai garis tanda, lalu di kocok homogen sehingga diperoleh larutan induk baku dengan konsentrasi 500 mcg/ml.
3.4.2Pembuatan kurva serapan teofilin medium usus buatan (pH 6)
Dipipet 0,3 ml larutan induk baku dan dimasukkan ke dalam labu ukur 25 ml dan di tambahkan dengan medium cairan lambung buatan pH 6 sampai garis tanda. Maka di peroleh larutan dengan konsentrasi 6 mcg/ml. Serapan larutan di ukur pada panjang gelombang 200-400 nm.
3.4.3 Pembuatan kurva kalibrasi teofilin medium usus (pH 6)
Dipipet larutan induk baku sebanyak0,1ml; 0,15ml; 0,25ml; 0,3ml; 0,4ml; 0,45ml. Dimasukkan ke dalam labu ukur 25 ml kemudian diencerkan dengan medium usus buatan pH 6 sampai garis tanda. Serapan diukur pada panjang gelombang maksimum dengan cairan usus buatan pH 6 sebagai blanko.
3.4.4. Pembuatan Nata de coco
3.4.5. Penyiapan biji Kacang merah
Biji kacang merah kering diperoleh dari daerah Padang Bulan lokasi di pajak sore. Pengambilan sampel dilakukan secara purposif, tanpa membandingkan dengan tumbuhan dari daerah lain.
3.4.6. Isolasi Pati Kacang Merah
Kacang merah di rendam dengan air secukupnya selama 24 jam, lalu di kupas kulitnya dan di cuci bersih, kemudian di blender, hasilnya di kumpulkan, kemudian di saring dengan kain blacu bersih. Pemerasan dilakukan berulang-ulang hingga perasannya menjadi jernih. Hasil saringan di endapkan selama 24 jam. Patinya akan turun ke bawah dan mengendap, cairan di atasnya di buang. Pencucian terhadap patinya di lakukan beberapa kali sampai cairan di atas endapan menjadi jernih. Endapan pati di keluarkan dari wadah, di keringkan di bawah sinar matahari. Sebelum kacang merah di keringkan dahulu di dalam oven pada suhu 60-65o C Selama 1 jam ( Shipman, 1965).
3.4.7. Pembuatan nata dengan menggunakan kacang merah 1%
Pati kacang merah seberat 10g dilarutkan dalam satu liter air mendidih. Larutan pati dicampur dengan 10% gula, 0,5% urea, dan asam asetat glasial 25% sampai pH 4, lalu didihkan sampai 1000C. Kemudian dimasukkan kedalam wadah yang telah steril,.setelah dingin ditambahkan dengan Acetobakter xylinum 20%. Ditutup wadah dan diinkubasi selama 15 hari pada suhu 280 – 300C.
3.4.8. Pembuatan nata dengan menggunakan kacang merah 2,5%
Pati kacang merah seberat 25 g dilarutkan dalam satu liter air mendidih. Larutan pati dicampur dengan 10% gula, 0,5% urea, dan asam asetat glasial 25% sampai pH 4, lalu didihkan sampai 1000C. Kemudian dimasukkan kedalam wadah yang telah steril,.setelah dingin ditambahkan dengan Acetobakter xylinum 20%. Ditutup wadah dan diinkubasi selama 15 hari pada suhu 280 – 300C.
Kemudian setelah 15 hari natasiap dipanen.
3.4.9. Pembuatan Nata kacang merah sebagai matriks
Lembaran nata yang diperoleh dikeringkan dengan menggunakan freeze dryer ± 3 hari kemudian dipotong-potong dengan ukuran diameter 10 mm x 10 mm dan di timbang beratnya maka diperoleh berat kering. Selanjutnya matriks direndam dalam larutan teofilin dengan konsentrasi 32 mg/ml selama 24 jam kemudian ditimbang maka di peroleh berat basah. Selanjutnya di keringkan lagi dengan menggunakan alat freeze dryer, lalu ditimbang untuk mendapatkan berapa banyaknya teofilin yang terperangkap. Selanjutnya diuji pelepasannya dengan menggunakan disolusi pada medium pH 1,2 dan medium pH 6, kemudian di ukur pelepasan teofilin melalui matriks dengan menggunakan alat spektrofotometer UV.
3.4.10.Pembuatan Nata kacang merah sebagai sediaan mirip kapsul
uji pelepasannya dengan menggunakan disolusi pada medium pH 1,2 dan medium pH 6, dan selanjutnya di ukur pelepasan teofilin melalui membran menggunakan alat spektrofotometer UV.
3.5. Uji Disolusi
Uji disolusi teofilin dilakukan dengan alat disolusi model dayung sesuai dengan yang tertera pada Farmakope Indonesia edisi IV, 1995. Tiap-tiap uji terhadap bentuk sediaan dilakukan sebanyak enam kali. Satu buah sediaan yang telah selesai dibuat dan dimasukkan ke dalam bejana yang berisi 900 ml medium disolusi yang bersuhu 37±0, 5ºC. diputar dengan kecepatan 100 putaran per menit dan interval waktu pengambilan alikout 5, 15, 30, 45, 60, 90, 120, 150, 180, 210, 240, 270, 300, 330, 360, 390, 420, 450, dan 480 menit, setelah pemutaran dipipet 5 ml alikout dan diencerkan dengan medium hingga 25 ml, diukur resapannya pada panjang gelombang maksimum, dengan menggunakan medium yang sama sebagai blanko. Volume medium disolusi diusahakan tetap dengan menambahkan sejumlah volume yang sama dengam volume yang diambil. Jumlah teofilin terdisolusi dihitung dengan persamaan regresi kurva kalibrasi.
3.5.1. Uji disolusi terhadap matriks nata
Pada penelitian ini matriks nata dimasukkan ke dalam alat disolusi. Kemudian pengujian di lakukan dalam medium lambung buatan pH 1,2 dan medium usus buatan pH 6 sebanyak enam kali.
Tabel 1. Bentuk sediaan matriks
Formula Bentuk Sediaan Konsentrasi pati kacang merah
F1 Matriks nata de coco -
F2 Matriks nata 1%
3.5.2. Uji disolusi nata mirip kapsul
Pada penelitian ini nata mirip kapsul dimasukkan ke dalam alat disolusi. Kemudian pengujian di lakukan dalam medium lambung buatan pH 1,2 dan medium usus buatan pH 6 sebanyak enam kali.
Tabel 2. Bentuk sediaan nata mirip kapsul
Formula Bentuk Sediaan Konsentrasi pati kacang merah F1 Nata de coco mirip kapsul -
BAB IV
HASIL DAN PEMBAHASAN 4.1 Hasil isolasi pati kacang merah
Hasil isolasi pati kacang merah sebanyak 5000 gram diperoleh pati sebanyak 578Pati kacang merah yang diperoleh berupa serbuk halus, berwarna putih kekuningan, tidak berbau dan tidak berasa. Butir pati kacang merah
berbentuk bulat atau hampir bulat mempunyai lamela yang jelas dan hilus berada ditengah.
hilus
Gambar 2. Pati kacang merah (perbesaran 10 x 40)
4.2. Hasil Pembuatan nata kacang merah
mengendap di dasar wadah sehingga penelitian hanya dilakukan pada konsentrasi 1% dan 2,5%.
Hasil pembuatan nata kacang merah diperoleh nata memiliki bentuk padat, menyerupai gel, terapung pada bagian permukaan cairan, berwarna putih seperti kolang-kaling, terasa kenyal, dan mengandung air cukup banyak .
4.3.Uji Disolusi Teofilin
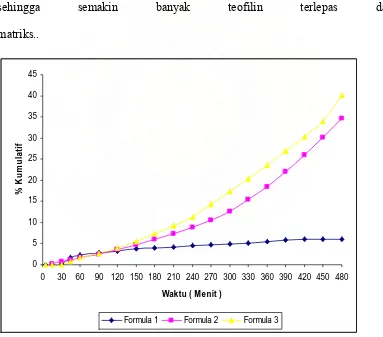
4.3.1. Disolusi matriks nata pada medium lambung buatan pH 1,2
Tabel 3. % Kumulatif matriks nata dalam medium lambung buatan pH 1,2 % Kumulatif
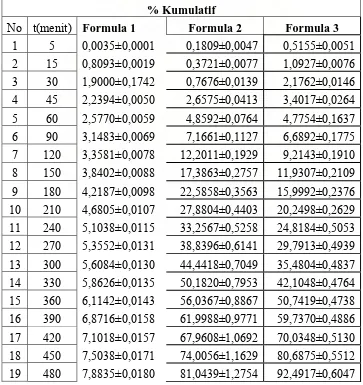
No t(menit) Formula 1 Formula 2 Formula 3
1 5 0,0035±0,0001 0,1570±0,0634 0,2931±0,0041 2 15 0,8093±0,0019 0,6652±0,2691 0,6564±0,0071 3 30 1,9000±0,1742 1,2849±0,5212 1,0204±0,0095 4 45 2,2394±0,0050 1,9005±0,7723 1,8990±0,0159 5 60 2,5770±0,0059 2,5636±1,0423 2,9086±0,0223 6 90 3,1483±0,0069 3,2949±1,3408 4,0239±0,0312 7 120 3,3581±0,0078 4,4229±1,7998 5,4740±0,0446 8 150 3,8402±0,0088 5,5714±2,2670 6,9349±0,0597 9 180 4,2187±0,0098 6,8997±2,8510 8,7351±0,0744 10 210 4,6805±0,0107 8,1846±3,3356 10,6217±0,0916 11 240 5,1038±0,0115 9,5398±3,8864 12,6186±0,1105 12 270 5,3552±0,0131 11,1429±4,5376 15,3375±0,1361 13 300 5,6084±0,0130 12,9835±5,2895 18,0687±0,1633 14 330 5,8626±0,0135 15,3529±6,2553 20,9241±0,1906 15 360 6,1142±0,0143 17,9434±7,3106 23,8134±0,2183 16 390 6,8716±0,0158 21,0442±8,5689 26,7791±0,2458 17 420 7,1018±0,0157 24,3556±9,9169 29,9222±0,2761 18 450 7,5038±0,0171 27,8902±11,3578 33,1332±0,3096 19 480 7,8835±0,0180 31,6437±12,8886 38,4344±0,3586
pada waktu 5 menit pelepasannya hanya mencapai 0,0035% untuk formula 1; 0,1571 % untuk formula 2 dan 0,2931 % untuk formula 3. Pada waktu 4 jam kenaikan laju disolusi teofilin untuk formula 1 sebanyak 5,1038 %,formula 2 sebanyak 9,5398% dan formula 3 sebanyak 12,6186%. Setelah 8 jam disolusi untuk formula 1 adalah 7,8835 % untuk formula 2 adalah 31,6437% dan formula 3 adalah 38,4344%.Hasil di atas menunjukkan pengaruh konsentrasi pati terhadap pelepasan teofilin. Semakin tinggi konsentrasi pati maka pelepasan semakin cepat, karena banyaknya pati membuat rongga-rongga di antara anyaman serat nata sehingga semakin banyak teofilin terlepas dari matriks..
Formula 1 Formula 2 Formula 3
Gambar 3 : Uji disolusi Teofilin dalam Medium Lambung (pH 1,2)
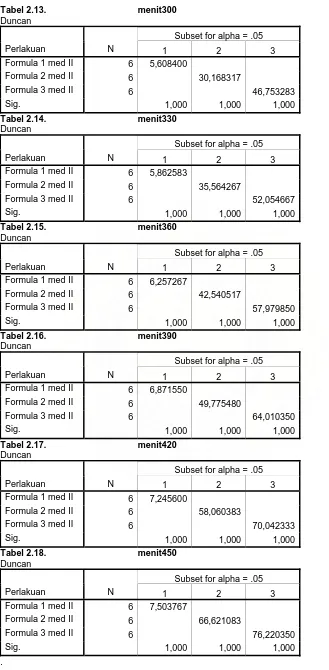
melihat masing-masing perbedaan maka di lakukan uji beda nyata rata-rata duncan yang dapat di lihat pada tabel 1.1 hingga tabel 1.19 (lampiran 4). Berdasarkan hasil analisis statistik uji beda nyata rata-rata duncan pada lampiran 4 tabel 1.1 sampai tabel 1.19 diperolehmenit ke-5 sampai menit ke-480 formula 1 berbeda nyata dengan formula 2 dan 3, formula 2 berbeda nyata dengan formula 1 dan formula 3 yang berarti ada perbedaan % kumulatif disolusi masing-masing formula.
4.3.2. Disolusi Matriks nata pada medium usus buatan pH 6 Tabel 4. % Kumulatif matriks nata dalam medium usus buatan pH 6
% Kumulatif
No t(menit) Formula 1 Formula 2 Formula 3
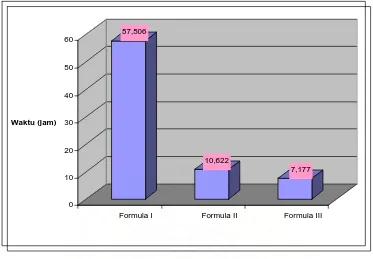
Pelepasan teofiln konsentrasi pati matriks nata dalam medium usus pH 6 dapat dilihat pada gambar 4 yaitu peningkatan konsentrasi pati pada matriks nata mempercepat pelepasan dimana setelah terdisolusi selama 4 jam pelepasan pada formula 1 mencapai 4,6805%, sedangkan pada formula 2 mencapai 33,2567% dan formula 3 mencapai 24,8184%. Pada formula 3 terjadi kenaikan laju disolusi yang cukup besar sampai setelah 8 jam terdisolusi dengan pelepasan 92,4917% sedangkan pada formula 2 terjadi kenaikan laju disolusi dengan pelepasan sebesar 81,0439%. Hasil di atas menunjukkan pengaruh konsentrasi pati terhadap pelepasan teofilin. Semakin tinggi konsentrasi pati maka pelepasan semakin cepat, karena banyaknya pati membuat rongga-rongga di antara anyaman serat nata sehingga semakin banyak teofilin terlepas dari matriks .
0
Formula 1 Formula 2 Formula 3
Pada tabel 2 dapat dilihat uji statistik menunjukkan adanya perbedaan antara formula yaitu F1,F2, dan F3. Dari hasil uji statistik Anova diperoleh pada menit ke-5 diperoleh signifikansi 0,000 sampai menit ke-480 dimana masing-masing signifikansi < 0,005 yang berarti ada perbedaan yang nyata % kumulatif disolusi masing-masing formula. Untuk melihat masing-masing perbedaan maka di lakukan uji beda nyata beda rata-rata duncan yang terlihat pada tabel 2.1 hingga tabel 2.19 (lampiran 5).
Berdasarkan hasil analisa statistik uji beda nyata rata-rata duncan pada tabel 2.1 hingga tabel 2.19 diperoleh padamenit ke-5, menit ke-15, menit ke- 30, menit ke-45, menit ke 60, menit ke 90, menit ke-120, menit ke- 150, menit ke-180, menit 210, menit 240, menit ke 270, menit ke 300, menit 330, menit ke-360, menit ke- 390, menit 420, menit ke-450 dan menit ke-480 formula 1 berbeda nyata dengan formula 2 dan 3, formula 2 berbeda nyata dengan formula 1 dan formula 3 yang berarti ada perbedaan % kumulatif disolusi masing-masing formula, dari sini diperoleh bahwa formula mempengaruhi disolusi (dapat di lihat pada lampiran 5). Semakin tinggi konsentrasi pati maka pelepasan semakin cepat, karena banyaknya pati membuat rongga-rongga di antara anyaman serat nata sehingga semakin banyak teofilin terlepas dari matriks..
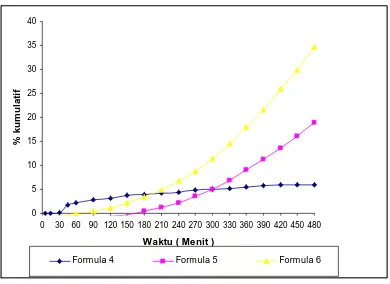
4.3.3. Disolusi nata mirip kapsul pada medium lambung buatan pH 1,2 Tabel 5. % Kumulatif nata mirip kapsul dalam medium lambung buatan pH
1,2
% Kumulatif
No t(menit) Formula 4 Formula 5 Formula 6
4 45 1,7681±0,0002 1,0156±0,0143 0,3114±0,01836 5 60 2,1978±0,0011 1,0631±0,0124 0,042464±0,052315 6 90 2,7458±0,0003 0,9413±0,0131 0,533159±0,054936 7 120 3,1189±0,0003 0,5945±0,0781 1,153604±0,070196 8 150 3,7060±0,0017 0,2560±0,0811 2,198689±0,069167 9 180 3,8635±0,0004 0,4087±0,0800 3,484404±0,053464 10 210 4,1713±0,0003 1,2138±0,0644 4,895151±0,061476 11 240 4,4472±0,0007 2,2356±0,1098 6,692792±0,061471 12 270 4,7829±0,0001 3,5773±0,1086 8,782962±0,068759 13 300 4,9346±0,0007 5,0222±0,1047 11,4464±0,094847 14 330 5,1345±0,00022 6,8635±0,0922 14,53447±0,103332 15 360 5,4853±0,0002 9,0021±0,0981 17,96933±0,057045 16 390 5,7467±0,0002 11,1963±0,0886 21,56933±0,055575 17 420 5,9711±0,0003 13,5557±0,1001 25,86999±0,045712 18 450 5,9895±0,0003 16,1174±0,1199 29,81206±0,045639 19 480 5,9957±0,0075 18,8732±0,1227 34,65295±0,03151
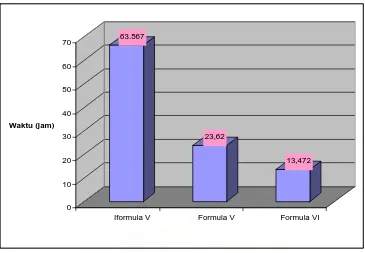
Kecepatan disolusi teofilin dari nata mirip kapsul nata dengan konsentrasi pati nata yang berbeda dalam medium lambung pH 1,2 dapat dilihat pada gambar 8 yang menunjukkan bahwa pada waktu 4 jam kenaikan laju disolusi teofilin untuk formula 1 sebanyak 4,4472 %,formula 2 sebanyak 2,2356 %,dan formula 3 sebanyak 6,6928%,setelah 8 jam disolusi untuk formula 1 adalah 5,9957 % untuk formula 2 adalah 18,8732 % dan formula 3 adalah 34,6529 %.
0
Formula 4 Formula 5 Formula 6
Gambar 5 Uji disolusi Teofilin dalam Medium lambung buatan pH 1,2 Pada tabel 3 dapat dilihat uji statistik menunjukkan adanya perbedaan antara formula yaitu F4,F5, dan F6 secara statistik (dapat di lihat pada lampiran 6).
Berdasarkan hasil analisis statistik uji beda nyata rata-rata duncan pada tabel 3.1 hingga tabel 3.19. diperoleh padamenit ke-90, menit ke 120, menit ke 150, menit ke 180, menit ke 210, menit ke-240, menit ke-270, menit ke-300, menit ke-330, menit ke-360, menit ke 390, menit ke 420, menit ke-450, dan menit ke-480 formula 4 berbeda nyata dengan formula 5 dan 6, formula 6 berbeda nyata dengan formula 4 dan formula5 yang berarti ada perbedaan % kumulatif disolusi masing-masing formula.
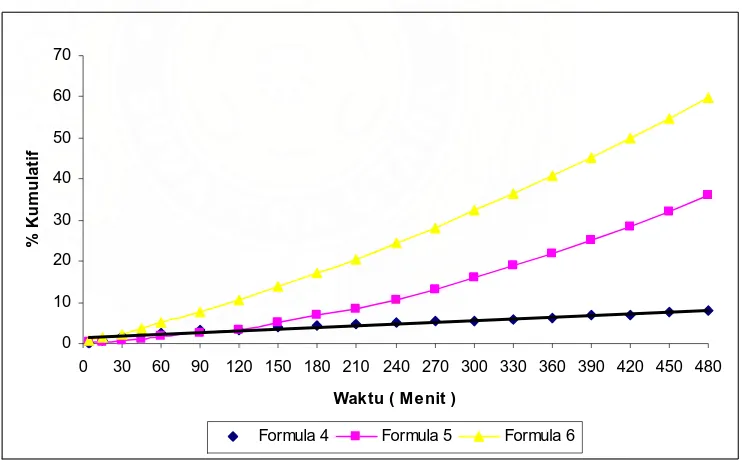
4.3.5.Disolusi nata mirip kapsul pada medium usus buatan pH 6
Tabel 6. % Kumulatif nata mirip kapsul dalam medium lambung buatan pH 6.
% Kumulatif
No t(menit) Formula 4 Formula 5 Formula 6
Pelepasan teofiln dari konsentrasi pati nata mirip kapsul dalam medium usus pH 6 dapat dilihat pada gambar 8 yaitu pada formula 4 mencapai 0% setelah 5 menit. Peningkatan konsentrasi pati pada matriks nata mempercepat pelepasan dimana pada formula 5 setelah 5 menit melepaskan 0,0773% teofilin dan pada formula 6 pelepasan juga lebih cepat dibandingkan dengan formula 4 dan 5 dengan pelepasan sebesar 0,5566% pada jam yang sama.Setelah terdisolusi selama 4 jam pelepasan pada formula 4 mencapai 4,472% ,sedangkan pada formula 5 mencapai 9,3391% dan formula 6 mencapai 24,2709%.Pada formula 6 terjadi kenaikan laju disolusi yang cukup besar sampai setelah 8 jam terdisolusi dengan pelepasan 59,7432% sedangkan pada formula 5 terjadi kenaikan laju disolusi dengan pelepasan sebesar 34,7360% dan formula 4 sebesar 5,9952%
0
Formula 4 Formula 5 Formula 6
Gambar 6 Uji disolusi teofilin dalam medium usus buatan pH 6
Dari hasil uji statistik Anova diperoleh pada menit ke-5 diperoleh signifikansi 0,000, pada menit ke- 15 signifikansi 0,000, sama dengan menit ke- 30, menit 45, menit ke 60, menit ke 90, menit 120, menit 150, menit ke-180, menit ke-210, menit ke-240, menit ke 270, menit ke 300, menit ke-330, menit ke-360, menit ke- 390, menit 420, menit ke-450 dan menit ke-480 dimana masing-masing signifikansi < 0,005 yang berarti ada perbedaan yang nyata % kumulatif disolusi masing-masing formula. Untuk melihat masing-masing perbedaan maka di lakukan uji beda nyata beda rata-rata duncan yang terlihat pada tabel 4.1 hingga tabel 4.19 (lampiran 7).
66,392
13,511 11,376
0 10 20 30 40 50 60 70
Waktu (jam )
Formula 1 Formula 2 Formula 3
Gambar7. Histogram Pelepasan 50 % teofilin dalam medium lambung buatan pH 1,2
63.567
23,62
13,472
0 10 20 30 40 50 60 70
Waktu (jam)
Iformula V Formula V Formula VI
Gambar 8. Histogram pelepasan 50 % teofilin matriks mirip kapsul nata dalam medium lambung buatan ( pH 1,2 )
57,506
10,622
7,177
0 10 20 30 40 50 60
Waktu (jam)
Formula I Formula II Formula III
Gambar 9. Histogram Pelepasan 50 % teofilin dalam medium usus ( pH 6 )
57,506
10,823
7,468
0 10 20 30 40 50 60
Waktu (jam)
Formula I Formula II Formula III
Gambar 10. Histogram pelepasan 50 % Teofilin matriks mirip kapsul nata dalam medium usus ( pH 6).
BAB V
KESIMPULAN DAN SARAN 5.1. Kesimpulan
Dari beberapa formula sediaan pelepasan terkontrol yang diuji, maka dapat diketahui dan disimpulkan bahwa :
1. Nata ternyata dapat digunakan sebagai hal ini terbukti dengan adanya kemampuan dari membran nata untuk memperpanjang waktu transit obat oleh karena adanya sifat membran nata yang mampu mengambang di atas cairan sehingga dapat meminimalkan efek samping dari teofilin yang tidak diinginkan
2. Pelepasan teofilin setelah 8 jam disolusi pada medium lambung pH 1,2 F(1), F(2), F(3), F(4), F(5) dan F(6) berturut-turut 7,8835%; 31,6437 %; 38,4344%; 5,9957%; 18,8732% dan 34,6529 %, pelepasan teofilin setelah 8 jam disolusi pada medium usus (pH 6) F(1), F(2), F(3), F(4), F(5) dan F(6) berturut-turut 7,8835%; 81,0439%; 92,4917%; 5,9957%; 34,7360% dan 59,7432%. Kecepatan pelepasan teofilin lebih besar pada pH 6 dari pada pH 1,2.
5.2. Saran
DAFTAR PUSTAKA
Aditama, T.Y., (1995). Pengobatan Asma dengan Teofilin Lepas Lambat Dosis Sekali. Cermin Dunia Kedokteran. Halaman 101, 21 – 24
Aiache , J.M., (1993). Farmasektika 2 Biofarmasi. Terjemahan : Dr. Widji Soeratri Edisi kedua. Surabaya : Penerbit Airlangga University Press. Halaman 331-367
Anonim. (2006). Proses Pembuatan Nata De Coco. http://www.atmajaya.ac.id.htm.
Ansel, H.C., (1989). Pengantar Bentuk Sediaan Farmasi. Terjemahan : Farida Ibrahim. Edisi 4. Jakarta : Penerbit Universitas Indonesia. Halaman 288-290
Arora S, Ali J, Ahuja A, Khar RK, Baboota S. Floating Drug Delivery System A review. AAPS Pharm Scitech, 2005 : 06 (03): E372-E390.DOI:
10.1208/Pt 060347
Clarke, E.G.C., (1986). Isolation and Identification of Drugs. 2nd ed., London : The Pharmaceutical Press. Halaman : 584
Departemen Kesehatan Republik Indonesia., (1979). Famakope Indonesia Edisi III. Jakarta. Halaman 213
Departemen Kesehatan Republik Indonesia., (1994). Farmakope Indonesia Edisi IV. Jakarta. Halaman 350
Elvy, O., (1993). Formulasi Sediaan System Pelepasan Terkontrol : Pengaruh Sifat Keterbasahan Matriks terhadap Kecepatan Pelarutan Obat Bentuk Pelet. Skripsi mahasiswa S-1 jurusan Farmasi. Halaman 5-12
Lachman, L., Lieberman, H.A., dan Kanig, J.L., (1994). Teori dan Praktek Farmasi Industri. Terjemahan : Siti Suyatni. Edisi ketiga. Jakarta : UI-Press. Halaman 52
Longer, M.A., (1990). Sustained-Release Drug Delivery Systems. In :
Martin, A., Swarbrick, J., and Cammarata, A., (1983). Dasar-dasar Kimia Fisika dalam Ilmu Farmasetika. Dalam : Farmasi Fisik. Terjemahan :
Yoshita. Edisi ketiga, Jakarta : UI-Press. Halaman 1222-1319
Shargel dan Andrew, B.C Yu., (1988). Biofarmasetika dan Farmakokinetika Terapan. Terjemahan : Dr. Fasich., Apt. Edisi kedua. Surabaya : Penerbit Airlangga University Press. Halaman 16, 19-112
Sunaryo., (1995). Farmakologi dan Terapi. Edisi IV. Editor : Sulistia Gan, rianto Setiabudi, Udin Syamsudin dan Sunilda S. Bustami. Jakarta. Halaman 202-207
USP XXII and NF XVII., (1990). The United States Pharmacopedia XII and The national Formulary XVII. Twinbrook Parkway, Rockville : The United States Pharmacopeial Convention, Inc. Halaman 1578-1579 Voigt, R., (1994). Buku Pelajaran Teknologi Farmasi. Terjemahan : Dr.
Lampiran 1a. Data pengukuran kurva serapan Teofilin dalam berbagai panjang gelombang pada medium pH 1,2.
Panjang gelombang Keterangan :* = Panjang gelombang maksimum 271 nm
0
220 240 260 280 300
Lampiran 1b. Data Pengukuran kurva kalibrasi Larutan Teofilin dengan berbagai konsentrasi pada panjang gelombang 271 nm dalam medium pH 1,2
Konsentrasi
(mcg/ml) Absorbansi (nm)
0 0
Lampiran 2a. Data pengukuran kurva serapan Teofilin dalam berbagai panjang gelombang pada medium pH 6.
Panjang gelombang
220 240 260 280 300
Lampiran 2b. Data Pengukuran kurva kalibrasi Larutan Teofilin dengan berbagai konsentrasi pada panjang gelombang 271 nm dalam medium pH 6
Konsentrasi
(mcg/ml) Absorbansi (nm) 0 0
Lampiran 3. % Kumulatif teofilin berbagai formula dalam medium lambung buatan dan medium usus buatan.
% KUMULATIF TEOFIIN FORMULA 1 DALAM MEDIUM LAMBUNG (pH 1,2)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
% KUMULATIF FORMULA 2 MEDIUM LAMBUNG( pH 1,2)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
12 270 11,1998 11,2266 10,9816 11,1018 0,0056 11,0817 11,1429±4,5376
13 300 13,1314 13,0710 12,7918 12,9151 0,0065 12,8889 12,9835±5,2895
14 330 15,5500 15,4447 15,1259 15,2835 0,0077 15,2234 15,3529±6,2553
15 360 18,1614 18,0684 17,6802 17,8493 0,0091 17,7959 17,9434±7,3106
16 390 21,2515 21,1653 20,7115 20,9311 0,0106 20,9140 21,0442±8,5689
17 420 24,5945 24,5247 23,9671 24,1938 0,0123 24,2045 24,3556±9,9169
18 450 28,1592 28,0905 27,4468 27,7032 0,0140 27,7370 27,8902±11,3578
% KUMULATIF FORMULA 3 MEDIUM LAMBUNG( pH 1,2)
18 450 33,1464 33,4721 33,4347 32,8060 33,2099 32,7327 33,1332±0,3096
19 480 38,4539 38,8309 38,7844 38,0519 38,5172 37,9763 38,4344±0,3586
% KUMULATIF TEOFIIN FORMULA 4 DALAM MEDIUM LAMBUNG (pH 1,2) No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
1 5 0 0 0 0 0 0 0
2 15 0 0 0 0 0 0 0
3 30 0,1282 0,1300 0,1292 0,1300 0,1287 0,1289 0,1292±0,0007
4 45 1,7678 1,7681 1,7681 1,7683 1,7681 1,7681 1,7681±0,0002
5 60 2,1973 2,1971 2,1991 2,1967 2,1973 2,1991 2,1978±0,0011
6 90 2,7457 2,7463 2,7459 2,7459 2,7455 2,7457 2,7458±0,0003
7 120 3,1187 3,1183 3,1190 3,1192 3,1190 3,1189 3,1189±0,0003
8 150 3,7062 3,7064 3,7066 3,7026 3,7071 3,7069 3,7060±0,0017
9 180 3,8632 3,8633 3,8633 3,8632 3,8641 3,8641 3,8635±0,0004
10 210 4,1710 4,1713 4,1713 4,1710 4,1713 4,1717 4,1713±0,0003
11 240 4,4465 4,4467 4,4483 4,4469 4,4474 4,4476 4,4472±0,0007
12 270 4,7828 4,7830 4,7830 4,7828 4,7830 4,7830 4,7829±0,0001
13 300 4,9342 4,9343 4,9343 4,9360 4,9343 4,9343 4,9346±0,0007
14 330 5,1343 5,1347 5,1347 5,1343 5,1345 5,1345 5,1345±0,00022
15 360 5,4851 5,4853 5,4855 5,4851 5,4853 5,4853 5,4853±0,0002
16 390 5,7465 5,7467 5,7467 5,7465 5,7469 5,7469 5,7467±0,0002
17 420 5,9708 5,9710 5,9710 5,9710 5,9717 5,9708 5,9711±0,0003
18 450 5,9893 5,9895 5,9897 5,9895 5,9890 5,9900 5,9895±0,0003
% KUMULATIF FORMULA 5 MEDIUM LAMBUNG( pH 1,2)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
1 5 0,441743 0,439679 0,439679 0,443807 0,443807 0,425229 0,4067±0,0070
2 15 0,776147 0,774083 0,76789 0,788532 0,780275 0,749312 0,7411±0,0134
3 30 0,930963 0,937156 0,91445 0,943349 0,933028 0,904128 0,8979±0,0149
4 45 1,044495 1,030046 1,023853 1,056881 1,054817 1,027982 1,0156±0,0143
5 60 1,083716 1,07133 1,056881 1,089908 1,087844 1,075459 1,0631±0,0124
6 90 0,966055 0,976376 0,970183 0,955734 0,945413 0,945413 0,9413±0,0131
7 120 0,687385 0,790596 0,757569 0,71422 0,606881 0,598624 0,5945±0,0781
8 150 0,363303 0,462385 0,441743 0,398394 0,282798 0,266284 0,2560±0,0811
9 180 0,280734 0,173394 0,206422 0,243578 0,363303 0,365367 0,4087±0,0800
10 210 1,102294 1,013532 1,056881 1,069266 1,172477 1,172477 1,2138±0,0644
11 240 2,23555 2,043578 2,338761 2,299541 2,334633 2,252064 2,2356±0,1098
12 270 3,569037 3,377064 3,666055 3,628899 3,668119 3,593807 3,5773±0,1086
13 300 5,030505 4,855046 5,148165 5,094495 5,119266 5,040826 5,0222±0,1047
14 330 6,867661 6,723165 6,983257 6,919266 6,954358 6,865596 6,8635±0,0922
15 360 9,004128 8,845183 9,113532 9,049541 9,107339 9,010321 9,0021±0,0981
16 390 11,19427 11,06422 11,31812 11,22523 11,28303 11,18807 11,1963±0,0886
17 420 13,62385 13,53922 13,81583 13,69197 13,68578 13,56812 13,5557±0,1001
18 450 16,21858 16,16284 16,42294 16,37959 16,24748 16,1195 16,1174±0,1199
19 480 19,00528 18,96399 19,22615 19,16835 19,03624 18,90619 18,8732±0,1227
%KUMULATIF TEOFILIN FORMULA 6 MEDIUM LAMBUNG (pH 1,2)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
1 5 0,33263 0,33971 0,32556 0,32556 0,32084 0,33971 0,33971±0,007954
2 15 0,53788 0,54731 0,52136 0,52136 0,52844 0,55911 0,55911±0,015173
3 30 0,46474 0,50013 0,45767 0,45767 0,46239 0,48598 0,48598±0,017554
4 45 0,28073 0,30197 0,26658 0,26658 0,28781 0,3114 0,3114±0,01836
5 60 0,10616 0,082569 0,169856 0,169856 0,153342 0,042464 0,042464±0,052315
6 90 0,5827 0,537877 0,639318 0,639318 0,658191 0,533159 0,533159±0,054936
7 120 1,236173 1,203145 1,318742 1,318742 1,311664 1,153604 1,153604±0,070196
8 150 2,288336 2,271822 2,370904 2,370904 2,35675 2,198689 2,198689±0,069167
9 180 3,533945 3,482045 3,595282 3,595282 3,583486 3,484404 3,484404±0,053464
10 210 4,932896 4,857405 4,989515 4,989515 5,013106 4,895151 4,895151±0,061476
11 240 6,730537 6,657405 6,789515 6,789515 6,810747 6,692792 6,692792±0,061471
12 270 8,856094 8,863172 8,957536 8,957536 8,924509 8,782962 8,782962±0,068759
13 300 11,54312 11,59974 11,6941 11,6941 11,62097 11,4464 11,4464±0,094847
14 330 14,65478 14,74443 14,80577 14,80577 14,70668 14,53447 14,53447±0,103332
15 360 17,9363 18,01887 18,07785 18,07785 18,02595 17,96933 17,96933±0,057045
16 390 21,56461 21,68493 21,67549 21,67549 21,6118 21,56933 21,56933±0,055575
17 420 25,85583 25,97379 25,94076 25,94076 25,90301 25,86999 25,86999±0,045712
18 450 29,8097 29,92765 29,87811 29,87811 29,84037 29,81206 29,81206±0,045639
% KUMULATIF TEOFIIN FORMULA 1 DALAM MEDIUM USUS (pH 6)
%KUMULATIF TEOFILIN FORMULA 2 MEDIUM USUS (pH 6)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
1 5 0,1850 0,1885 0,1774 0,1797 0,1831 0,1763 0,1809±0,0047
2 15 0,3783 0,3801 0,3657 0,3686 0,3805 0,3636 0,3721±0,0077
3 30 0,7783 0,7790 0,7483 0,7636 0,7786 0,7526 0,7676±0,0139
4 45 2,6884 2,7034 2,5937 2,6513 2,6792 2,6276 2,6575±0,0413
5 60 4,9169 4,9466 4,7400 4,8524 4,8967 4,8085 4,8592±0,0764
6 90 7,2508 7,2959 6,9870 7,1587 7,2190 7,0988 7,1661±0,1127
7 120 12,3434 12,4237 11,8934 12,1887 12,2936 12,0875 12,2011±0,1929
8 150 17,5859 17,7119 16,9473 17,3688 17,5091 17,2242 17,3863±0,2757
9 180 22,8408 23,0052 22,0142 22,5663 22,7442 22,3812 22,5858±0,3563
10 210 28,1970 28,4027 27,1777 27,8485 28,0749 27,6272 27,8804±0,4403
11 240 33,6317 33,8846 32,4199 33,2196 33,4868 32,9513 33,2567±0,5258
12 270 39,2794 39,5737 37,8644 38,7968 39,1055 38,4780 38,8396±0,6141
13 300 44,9487 45,2857 43,3259 44,3863 44,7468 44,0239 44,4418±0,7049
14 330 50,7556 51,1362 48,9219 50,1198 50,5208 49,7156 50,1820±0,7953
15 360 56,6751 57,1002 54,6264 55,9696 56,4110 55,5259 56,0367±0,8867
16 390 62,7062 63,1714 60,4446 62,0318 62,4071 61,4314 61,9988±0,9771
17 420 68,7373 69,2427 66,2628 67,9929 68,4125 67,3369 67,9608±1,0692
18 450 74,8470 75,4056 72,1607 74,0432 74,4919 73,3265 74,0056±1,1629
%KUMULATIF TEOFILIN FORMULA 3 MEDIUM USUS (pH 6)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
1 5 0,5178 0,5249 0,5102 0,5140 0,5127 0,5166 0,5155±0,0051
2 15 1,0977 1,0997 1,0877 1,0834 1,1022 1,0888 1,0927±0,0076
3 30 2,1923 2,1932 2,1570 2,1668 2,1860 2,1776 2,1762±0,0146
4 45 3,4326 3,4334 3,3638 3,3918 3,3988 3,4086 3,4017±0,0264
5 60 5,0792 4,8049 4,7051 4,7368 4,5901 4,7604 4,7754±0,1637
6 90 7,0141 6,7388 6,5932 6,6451 6,4937 6,6750 6,6892±0,1775
7 120 9,5537 9,2975 9,0893 9,1690 9,0113 9,1774 9,2143±0,1910
8 150 12,2948 12,0499 11,7718 11,8744 11,7162 11,8962 11,9307±0,2109
9 180 16,3879 16,1675 15,7956 15,9311 15,7629 15,9699 15,9992±0,2376
10 210 20,6578 20,4663 20,0149 20,1600 19,9876 20,2323 20,2498±0,2629
11 240 25,2501 23,7123 24,5427 24,7091 24,5347 24,8163 24,8184±0,5053
12 270 30,2456 28,7453 29,4647 29,6768 29,4809 29,7994 29,7913±0,4939
13 300 35,9542 34,4969 35,0955 35,3524 35,1548 35,5031 35,4804±0,4837
14 330 42,6117 41,2045 41,6551 41,9575 41,7437 42,1410 42,1048±0,4764
15 360 51,2755 49,9334 50,2067 50,5725 50,3497 50,7987 50,7419±0,4738
16 390 60,3175 59,0434 59,0975 59,3875 59,3026 59,8214 59,7370±0,4886
17 420 70,6619 69,4656 69,2898 69,6553 69,5420 70,1371 70,0348±0,5130
18 450 81,3660 80,2501 79,8364 80,2678 80,1376 80,8146 80,6875±0,5512
19 480 93,2174 92,1907 91,5136 92,0345 91,8845 92,6582 92,4917±0,6047
% KUMULATIF TEOFIIN FORMULA 4 DALAM MEDIUM USUS (pH 6)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
1 5 0 0 0 0 0 0 0
2 15 0 0 0 0 0 0 0
3 30 0,1282 0,1300 0,1292 0,1300 0,1287 0,1289 0,1292±0,0007
4 45 1,7678 1,7681 1,7681 1,7683 1,7681 1,7681 1,7681±0,0002
5 60 2,1973 2,1971 2,1991 2,1967 2,1973 2,1991 2,1978±0,0011
6 90 2,7457 2,7463 2,7459 2,7459 2,7455 2,7457 2,7458±0,0003
7 120 3,1187 3,1183 3,1190 3,1192 3,1190 3,1189 3,1189±0,0003
8 150 3,7062 3,7064 3,7066 3,7026 3,7071 3,7069 3,7060±0,0017
9 180 3,8632 3,8633 3,8633 3,8632 3,8641 3,8641 3,8635±0,0004
10 210 4,1710 4,1713 4,1713 4,1710 4,1713 4,1717 4,1713±0,0003
11 240 4,4465 4,4467 4,4483 4,4469 4,4474 4,4476 4,4472±0,0007
12 270 4,7828 4,7830 4,7830 4,7828 4,7830 4,7830 4,7829±0,0001
13 300 4,9342 4,9343 4,9343 4,9360 4,9343 4,9343 4,9346±0,0007
14 330 5,1343 5,1347 5,1347 5,1343 5,1345 5,1345 5,1345±0,00022
15 360 5,4851 5,4853 5,4855 5,4851 5,4853 5,4853 5,4853±0,0002
16 390 5,7465 5,7467 5,7467 5,7465 5,7469 5,7469 5,7467±0,0002
17 420 5,9708 5,9710 5,9710 5,9710 5,9717 5,9708 5,9711±0,0003
18 450 5,9893 5,9895 5,9897 5,9895 5,9890 5,9900 5,9895±0,0003
% KUMULATIF TEOFIIN FORMULA 5 DALAM MEDIUM USUS (pH 6)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
1 5 0,0767 0,0767 0,0773 0,0804 0,0767 0,0760 0,0773±0,0016
2 15 0,1913 0,1938 0,1926 0,1938 0,1932 0,1895 0,1920±0,0017
3 30 0,3540 0,3584 0,3571 0,3584 0,3559 0,3515 0,3553±0,0027
4 45 0,5410 0,5460 0,5422 0,5198 0,5435 0,5373 0,5379±0,0095
5 60 0,7298 0,7336 0,7311 0,7055 0,7323 0,7242 0,7255±0,0106
6 90 1,0533 1,0583 1,0552 1,0321 1,0571 1,0508 1,0496±0,0097
7 120 1,5214 1,5251 1,5195 1,4990 1,5239 1,5164 1,5158±0,0096 8 150 2,3429 2,3454 2,3410 2,3235 2,3485 2,3391 2,3379±0,0087 9 180 3,8911 3,8942 3,8923 3,8724 3,8973 3,8873 3,8867±0,0088 10 210 6,3960 6,2370 6,5749 6,5524 6,5767 6,5686 6,4814±0,1396 11 240 9,2518 9,0929 9,4357 9,4107 9,4325 9,4294 9,3391±0,1411
12 270 12,2466 12,0852 12,4305 12,4018 12,4317 12,4280 12,3339±0,1427
13 300 15,2626 15,1043 15,4508 15,4680 15,4477 15,4515 15,3530±0,1488
14 330 18,3627 18,1515 18,5522 18,5651 18,5497 18,5541 18,4444±0,1679
15 360 21,5208 21,3064 21,7122 21,7263 21,7084 21,7122 21,6025±0,1698
16 390 24,7201 24,5051 24,9089 24,9255 24,9077 24,9089 24,8005±0,1694
17 420 27,8931 27,6769 28,0770 28,0998 28,0795 28,0820 27,9711±0,1693
18 450 31,2706 30,9403 31,3348 31,3620 31,3380 31,3398 31,2501±0,1617
19 480 34,9099 34,3994 34,7915 34,8211 34,7859 34,7952 34,7360±0,1781
% KUMULATIF TEOFIIN FORMULA 6 DALAM MEDIUM USUS (pH 6)
No t(menit) Uji 1 Uji 2 Uji 3 Uji 4 Uji 5 Uji 6 Rata-rata
1 5 0,5578 0,5566 0,5566 0,5566 0,5566 0,5560 0,5566±0,0006
2 15 1,3301 1,3301 1,3282 1,3294 1,3294 1,3282 1,3288±0,0009
3 30 2,3404 2,3404 2,3410 2,3429 2,3429 2,3429 2,3410±0,0013
4 45 3,5071 3,5084 3,5053 3,5071 3,5096 3,5071 3,5065±0,0015
5 60 5,0248 5,0298 5,0229 5,0254 5,0273 5,0248 5,0211±0,0024
6 90 7,6662 7,6712 7,6581 7,6699 7,6743 7,6712 7,6637±0,0057
7 120 10,5831 10,5875 10,5787 10,5875 10,5912 10,5881 10,5812±0,0044
8 150 13,7767 13,7786 13,7724 13,7842 13,7848 13,7798 13,7742±0,0047
9 180 17,1112 17,1093 17,1069 17,1156 17,1212 17,1112 17,1069±0,0051
10 210 20,7367 20,7355 20,7374 20,7424 20,7536 20,7418 20,5629±0,0067
11 240 24,6141 24,6098 24,6135 24,6141 24,6253 24,6197 24,2709±0,0055
12 270 28,5643 28,5600 28,5613 28,5650 28,5756 28,5663 28,2205±0,0055
13 300 32,6206 32,6225 32,6175 32,6213 32,6319 32,6244 32,2780±0,0049
14 330 36,7410 36,7504 36,7386 36,7448 36,7554 36,7454 36,4009±0,0062
15 360 41,0322 41,0435 41,0248 41,0335 41,0466 41,0366 40,6909±0,0079
16 390 45,4655 45,4837 45,4556 45,4668 45,4762 45,4662 45,2989±0,0097
17 420 50,0310 50,0522 50,0242 50,0348 50,0404 50,0017 49,8643±0,0171
18 450 54,6269 54,6432 54,6114 54,6295 54,6314 54,5341 54,6523±0,0398