PENYAKIT
MOTILE AEROMONADS SEPTICEMIA
MOHAMMAD FAIZAL ULKHAQ
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis berjudul Pemberian Probiotik Bacillus
pada Media Pemeliharaan Ikan Lele Dumbo (Clarias gariepinus) untuk Pencegahan Penyakit Motile Aeromonads Septicemia adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Mohammad Faizal Ulkhaq
Pemeliharaan Ikan Lele Dumbo (Clarias gariepinus) untuk Pencegahan Penyakit
Motile Aeromonads Septicemia. Dibimbing oleh WIDANARNI dan ANGELA MARIANA LUSIASTUTI.
Penyakit merupakan salah satu kendala pada budidaya ikan lele dumbo sistem intensif, diantaranya adalah Motile Aeromonads Septicaemia yang disebabkan oleh infeksi bakteriAeromonas hydrophila.Usaha pengendalian untuk mengatasi penyakit ini, salah satunya dengan penggunaan antibiotika. Namun seringkali dalam penggunaannya tidak tepat dosis, sehingga menimbulkan resistensi patogen dan munculnya residu kimia pada produk perikanan. Oleh karena itu, saat ini usaha pencegahan penyakit ikan pada sistem budidaya sedang diarahkan pada penggunaan probiotik. Penelitian ini bertujuan untuk menguji efektivitas probiotikBacillus dalam menghambat pertumbuhan A. hydrophiladan mencegah serangan penyakit Motile Aeromonads Septicemia pada ikan lele dumbo.
Penelitian dilaksanakan mulai bulan Oktober 2013 sampai dengan Januari 2014 di Laboratorium Kesehatan Ikan, Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor, Jawa Barat. Penelitian ini terdiri dari tiga tahap yaitu: uji in vitro (karakterisasi isolat bakteri dan pemberian penanda resisten antibiotik serta uji kultur bersama), uji Postulat Koch, dan uji in vivo. Parameter uji yang diamati selama penelitian adalah tingkat kelangsungan hidup, laju pertumbuhan harian, total bakteri pada media pemeliharaan, total eritrosit, total leukosit, hemoglobin, hematokrit, diferensial leukosit, histopatologi dan kualitas air. Penelitian terdiri dari lima perlakuan dengan masing-masing tiga ulangan, yaitu budidaya ikan lele dumbo dengan pemberian probiotik Bacillus P4I1 RifR,
Bacillus P4I2 RifR, Bacillus P4I1 RifR + Bacillus P4I2 RifR (Kom), kontrol positif (K+) dan kontrol negatif (K-) (tanpa pemberian probiotik). Ikan lele dumbo (13.35±2.80 g) dipelihara dalam 15 akuarium (volume 40 liter) dengan kepadatan masing-masing 30 ekor tiap akuarium selama 30 hari. Pemberian probiotik (104 CFU/mL) dilakukan setiap pagi hari, sedangkan patogen A. hydrophila RifR (103 CFU/mL) ditambahkan sekali pada awal penelitian pada semua perlakuan kecuali perlakuan kontrol negatif (K-).
Hasil penelitian menunjukkan bahwa konsentrasi terbaik dari probiotik
probiotik (P4I1 RifR, P4I2 RifR, dan Kom), akan tetapi seluruh perlakuan berbeda nyata dengan kontrol. Pengamatan histopatologi menunjukkan bahwa pada perlakuan probiotik, terjadi kerusakan organ hati dan ginjal yang lebih ringan dibandingkan perlakuan kontrol positif (K+). Pemberian probiotik Bacillus P4I1 dengan dosis 104 CFU/mL efektif menekan pertumbuhan A. hydrophila dan mencegah penyakitMotile Aeromonads Septicemiadengan meningkatkan respons imun dan kelangsungan hidup serta laju pertumbuhan harian ikan lele dumbo (Clarias gariepinus).
culture medium of African Catfish (Clarias gariepinus) to Prevent Motile Aeromonads Septicemia disease. Supervised by WIDANARNI and ANGELA MARIANA LUSIASTUTI.
Disease is one constraint at intensive cultivation of African Catfish (Clarias gariepinus), such as Motile Aeromonads Septicemia caused by Aeromonas hydrophila. Control efforts have been made to overcome this disease, one of which was using of antibiotics, but often it was not in appropriate doses, giving rise to the emergence of resistance pathogens and chemical residues in fishery products. Therefore, the current prevention for fish disease which efforts at cultivation systems is being directed at the use of probiotics. The aim of this study was to test the effectiveness of a probiotic Bacillus for the prevention of Motile Aeromonads Septicemia (MAS) disease caused by A. hydrophila on African Catfish (C. gariepinus)
The study was carried out at the Fish Health Laboratory, Research and Development Institute for Freshwater Aquaculture, Bogor, West Java, on October 2013-January 2014. The study consisted in three phases, there were: in vitro test (characterization and transmission of antibiotic resistant marker), co-culture, Postulat Koch, and in vivo test. The parameter were survival rate, specific growth rate, total number of bacteria in culture medium, erytrocyte, leucocyte, hemoglobin, hematocrite, differential leucocyte, histopathology, and water quality. The in vivo test, consisted of five treatment such as the addition of probiotic Bacillus P4I1 RifR, Bacillus P4I2 RifR, Bacillus P4I1 RifR + Bacillus
P4I2 RifR (Kom), positive control (K+) and negative control (K-) (without probiotics addition). African Catfish (13.35±2.80 g) were maintained in 15 aquariums (40 liters volume) with the density of 30 fishes in each aquarium for 30 days. Probiotic bacteria (104CFU/mL) were applied in water once a day, whereas pathogenic bacteriaA. hydrophila RifR (103CFU/mL) were added once in earlier treatment (except for the negative control).
Keywords: Bacillus, Clarias gariepinus, Motile Aeromonads Septicemia,
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PEMBERIAN PROBIOTIK
Bacillus
PADA MEDIA PEMELIHARAAN
IKAN LELE DUMBO (Clarias gariepinus) UNTUK PENCEGAHAN
PENYAKIT
MOTILE AEROMONADS SEPTICEMIA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
2014
Judul Tesis : Pemberian ProbiotikBacilluspada Media Pemeliharaan Ikan Lele Dumbo (Clarias gariepinus) untuk Pencegahan PenyakitMotile Aeromonads Septicemia.
Nama : Mohammad Faizal Ulkhaq NIM : C151120411
Disetujui oleh
Komisi Pembimbing
Dr Ir Widanarni, MSi Ketua
Dr drh Angela Mariana L, MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 22 Juli 2014
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Oktober 2013 ini ialah kesehatan ikan, dengan judul Pemberian Probiotik Bacillus pada Media Pemeliharaan Ikan Lele Dumbo (Clarias gariepinus) untuk Pencegahan Penyakit
Motile Aeromonads Septicemia.
Terima kasih penulis ucapkan kepada Dr Ir Widanarni, MSi dan Dr drh Angela Mariana Lusiastuti, MSi selaku pembimbing serta Dr Munti Yuhana, SPi, MSi dan Dr Ir Mia Setiawati, MSi selaku dosen penguji luar komisi. Penghargaan penulis ditujukan kepada Kepala Balai Penelitian dan Pengembangan Budidaya Air Tawar, yang telah memberikan izin pelaksanaan penelitian, beserta seluruh staf peneliti dan teknisi Laboratorium Kesehatan Ikan (Ibu Tuti Sumiati, Ibu Desi Sugiani, Ibu Uni Purwaningsih, Bapak Ahmad Wahyudi, Bapak Mikdarullah, Bapak Bambang dan Bapak Edi), yang telah membantu selama penelitian ini berjalan.
Ungkapan terima kasih juga disampaikan kepada ayahanda Moch. Choirul Anam, ibunda Ernawati MA, kakanda Erlina Dewi Indahyani, SE dan Hariyanto, keponakan Axell Eriansyah serta seluruh keluarga, atas segala doa dan kasih sayangnya. Terima kasih juga penulis sampaikan kepada seluruh teman-teman AKU 2012, AKU 2011 (Mbak Dewi), AKU 2013 (Hilma dan Putri), bapak dan ibu kos Bata Merah berserta seluruh penghuninya: Ade Dea, Teteh Wida, Mbak Dewi yang telah memberikan motivasi dan semangat sehingga penulis dapat menyelesaikan studinya dengan lancar.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR ISI v
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
1 PENDAHULUAN 2
Latar Belakang 2
Perumusan Masalah 3
Tujuan Penelitian 4
Manfaat Penelitian 4
2 TINJAUAN PUSTAKA 4
ProbiotikBacillus 4
BakteriA. hydrophila 5
PenyakitMotile Aeromonads Septicemia(MAS) 6
3 METODE 6
Waktu dan Tempat Penelitian 6
Prosedur Penelitian 6
UjiIn vitro 7
Uji Kultur Bersama 7
UjiPostulat Koch 8
UjiIn vivo 9
Parameter yang Diukur 9
Prosedur Analisis Data 11
4 HASIL DAN PEMBAHASAN 12
UjiIn vitro 12
Uji Kultur Bersama 14
UjiPostulat Koch 15
UjiIn vivo 16
5 KESIMPULAN DAN SARAN 31
Kesimpulan 31
Saran 31
DAFTAR PUSTAKA 31
LAMPIRAN 40
DAFTAR TABEL
1 Kombinasi perlakuan uji penghambatan bakteri probiotik terhadap A. hydrophilasecarain vitro 8 2 Kombinasi perlakuan uji probiotik Bacillussecarain vivo pada media
pemeliharaan ikan lele dumbo (Clarias gariepinus) 9 3 Hasil karakterisasi isolat bakteri patogen A. hydrophila dan probiotik
Bacillusberdasarkan morfologi koloni dan sifat biokimia 12 4 Penghambatan bakteri probiotik Bacillus terhadap A. hydrophila
secarain vitro 14
5 Kematian ikan lele dumbo pasca infeksi A. hydrophila pada uji
Postulat Koch 15
6 Kisaran nilai kualitas air media pemeliharaan ikan lele dumbo 30
DAFTAR GAMBAR
1 Zona hambat yang terbentuk terhadap antibiotik rifampisin 13 2 BakteriA. hydrophilapada media RS hasil ujiPostulat KochI. 16 3 Kelangsungan hidup ikan lele dumbo (C. gariepinus) pada perlakuan
probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol 17 4 Laju pertumbuhan ikan lele dumbo (C. gariepinus) pada perlakuan
probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol 18 5 Kelimpahan bakteri pada media pemeliharaan ikan lele dumbo pada
perlakuan probiotik Bacillus P4I1 RifR, Bacillus P4I2 RifR, Kom (BacillusP4I1 RifR+BacillusP4I2 RifR) dan kontrol 19 6 Total eritrosit darah ikan lele dumbo pada pada perlakuan probiotik
Bacillus P4I1 RifR, Bacillus P4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol 20 7 Total leukosit darah ikan lele dumbo pada pada perlakuan probiotik
Bacillus P4I1 RifR, Bacillus P4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol 22 8 Kadar hemoglobin darah ikan lele dumbo pada pada perlakuan
probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol 23 9 Kadar hematokrit darah ikan lele dumbo pada pada perlakuan
probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol 24 10 Persentase monosit darah ikan lele dumbo pada pada perlakuan
probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol 25 11 Persentase limfosit darah ikan lele dumbo pada pada perlakuan
DAFTAR GAMBAR (lanjutan)
12 Persentase neutrofil darah ikan lele dumbo pada pada perlakuan probiotik BacillusP4I1 RifR,BacillusP4I2 RifR, Kom (BacillusP4I1 RifR+BacillusP4I2 RifR) dan kontrol 27 13 Histopatologi hati dan ginjal ikan lele dumbo pada perlakuan
probiotik BacillusP4I1 RifR,BacillusP4I2 RifR, Kom (BacillusP4I1 RifR+BacillusP4I2 RifR) dan kontrol (400x, HE) 29
DAFTAR LAMPIRAN
Latar Belakang
Produksi budidaya ikan lele dumbo (Clarias gariepinus) menunjukkan peningkatan setiap tahunnya. Menurut data Statistik Kementerian Kelautan dan Perikanan (KKP), tahun 2007 produksi nasional lele dumbo sebesar 91.735 ton meningkat menjadi 114.370 ton pada tahun 2008 dan 144.755 ton pada tahun 2009. Tahun 2010 meningkat kembali menjadi 242.811 ton dan pada tahun 2011 terus meningkat sampai 337.577 ton. Persentase kenaikan produksi ikan lele mulai tahun 2007-2011 sebesar 39.50% (KKP 2013). Hal ini menunjukkan bahwa ikan lele dumbo merupakan salah satu komoditas yang dapat dibudidayakan dengan intensif karena permintaan pasar yang tinggi. Salah satu kendala pada budidaya sistem intensif dengan padat tebar tinggi adalah penyakit. Kejadian penyakit pada budidaya ikan dapat menyebabkan kematian mulai dari ikan ukuran benih sampai ukuran konsumsi serta menimbulkan kerugian ekonomi yang besar. Penyakit yang banyak menyerang ikan lele dumbo antara lain penyakit yang disebabkan oleh infeksi bakteri, salah satunya adalahAeromonas hydrophila(Asniatihet al. 2011).
Bakteri A. hydrophila merupakan penyebab penyakit Motile Aeromonads Septicemia (MAS) yang sering menyerang ikan lele (Clarias sp.) dan jenis ikan air tawar tropis lainnya yaitu ikan dari famili Siluridae, Ictaluridae, Clariidae, serta Cyprinidae. Tingkat kematian pada ikan lele dapat mencapai 80%, bahkan 100% dalam waktu sekitar satu minggu. Penyebaran penyakit ini sangat luas dan cepat sejalan dengan meluasnya usaha budidaya dan jaringan penyebaran benih dan ikan konsumsi, baik ikan segar maupun ikan hidup (Dini dan Purbomartono 2009). Selain itu, perubahan kondisi lingkungan termasuk kepadatan tinggi, rendahnya oksigen terlarut, pemberian pakan atau pupuk yang berlebih, serta terjadinya blooming alga dan upwelling sering kali dihubungkan dengan terjangkitnya penyakit ini (Angka 2005).
Upaya pengendalian penyakit MAS pada budidaya ikan, sampai saat ini masih menggunakan antibiotik. Antibiotik yang sering digunakan antara lain kloramfenikol dan oksitetrasiklin dengan dosis sebanyak 5-7 gram/100 kg pakan (Igbinosa et al. 2012). Penggunaan bahan antibiotik yang tidak tepat telah diketahui dapat menimbulkan masalah serius berupa resistensi pada bakteri patogen (Balcazar et al. 2006). Selain itu, penggunaan antibiotik ini juga dapat mencemari lingkungan perairan, dan berdampak pada kesehatan manusia dengan adanya residu kimia dari antibiotik pada produk perikanan yang dikonsumsi (Flores 2011). Salah satu alternatif yang dapat dipilih untuk pencegahan penyakit ini adalah dengan aplikasi probiotik.
Probiotik didefinisikan sebagai mikroorganisme yang memiliki kemampuan untuk memodifikasi komposisi bakteri dalam saluran pencernaan, air dan sedimen serta dapat digunakan sebagai agen biokontrol (Flores 2011). Salah satu jenis mikroorganisme yang banyak dimanfaatkan sebagai probiotik dalam akuakultur adalah genus Bacillus (Hong et al. 2004). Sorukulova et al. (2007) menyatakan bahwa probiotik dari golongan Bacillus telah banyak diaplikasikan untuk kepentingan bioteknologi termasuk jenis enzim dan asam amino yang dihasilkan serta produksi antibiotik untuk pengendalian patogen. Aktivitas penghambatan Bacillus terhadap pertumbuhan A. hydrophiladikarenakan bakteri ini menghasilkan produk ekstraseluler, antara lain esterase lipase, leucine arylamidase, acid phosphatase, lipase, Naphthol-AS-BI-phospholidase, subtilin, coagulin, surfactin, iturins dan bacilysin (Murilio dan Villamil 2011, Honget al.
2004). Hasil penelitian Raviet al. (2007) menyebutkan bahwa probiotik dari jenis
Paenibacillus spp., Bacillus cereus dan P. polymyxa yang diaplikasikan pada media pemeliharaan dapat menghambat pertumbuhan Vibrio pada larva udang windu (Penaeus monodon). Hasil penelitian lain juga menyebutkan bahwa empat strain Bacillus yang diisolasi dari saluran pencernaan udang putih sehat dan diaplikasikan melalui media pemeliharaan dengan konsentrasi 105CFU/mL dapat meningkatkan kesehatan larva udang putih (Litopenaeus vannamei) (Luis-Villasenor et al. 2011). Berdasarkan hasil penelitian tersebut, diharapkan dengan pemberian probiotik Bacillus pada media pemeliharaan ikan lele dumbo (C. gariepinus) dapat menekan pertumbuhanA. hydrophila.
Perumusan Masalah
Bakteri A. hydrophila termasuk bakteri patogen oportunistik dan merupakan flora normal dalam perairan. Al-Harbi dan Uddin (2010) menyatakan bahwa A. hydrophila terdapat pada kolam budidaya ikan lele dumbo dengan persentase sebesar 25% dari total bakteri dalam media pemeliharaan. Bakteri oportunistik berperan sebagai biofilter alami dalam proses perombakan bahan organik dalam air serta tidak membahayakan organisme budidaya jika kondisi lingkungan budidaya dalam kisaran normal (Ibrahemet al.2008). Akan tetapi bila kondisi lingkungan budidaya dalam keadaan buruk, seperti adanya fluktuasi suhu yang terlalu tinggi, atau meningkatnya kadar bahan organik dalam perairan, menyebabkan stres ikan meningkat dan sistem imun ikan menurun, akibatnya ikan akan mudah terserang penyakit.
optimal untuk kegiatan budidaya. Salah satu cara untuk mengontrol jenis bakteri dalam perairan yaitu dengan menggunakan probiotik sebagaimana konsep probiotik sebagai agen biokontrol lingkungan (Cruz et al. 2012). Penggunaan probiotik sebagai biokontrol ini diharapkan dapat menurunkan jumlah bakteri patogen dalam perairan terutamaA. hydrophila, sehingga kondisi perairan berada dalam kondisi optimal bagi kepentingan budidaya.
Tujuan Penelitian
Tujuan dari penelitian ini yaitu untuk menguji efektivitas probiotik
Bacillus pada media pemeliharaan ikan lele dumbo (C. gariepinus) dalam menghambat pertumbuhanA. hydrophiladan mencegah serangan penyakit Motile Aeromonads Septicemia.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat diaplikasikan pada budidaya ikan lele dumbo untuk menekan pertumbuhan A. hydrophila dan menjadi alternatif pemecahan masalah penyakitMotile Aeromonads Septicemia pada budidaya ikan lele dumbo secara aman dan ramah lingkungan.
2 TINJAUAN PUSTAKA
ProbiotikBacillus
Probiotik merupakan mikroorganisme hidup yang bila diberikan dalam jumlah yang cukup bermanfaat untuk meningkatkan kesehatan inang (Fyzulet al.
2013). Peningkatan kesehatan inang melalui probiotik dapat dicapai dengan salah satu atau gabungan dari mekanisme berikut: kompetisi dengan bakteri patogen (Zhou et al. 2010), peningkatan penyerapan nutrien dalam pakan (Ayoola et al.
2013), perombakan bahan organik dalam air (Jha 2011), dan peningkatan respons imun terhadap patogen (Khalilet al.2011, Reneshwaryet al.2011).
Mikroorganisme hidup yang dimaksudkan berasal dari golongan bakteri (Gram-positif dan Gram-negatif), bakteriofag, mikroalga, ragi (yeast), dan cendawan (Flores 2011). Salah satu jenis bakteri yang banyak dimanfaatkan sebagai probiotik yaitu dari genus Bacillus. Bacillus termasuk dalam golongan bakteri Gram positif, berbentuk batang, dan dapat diisolasi dari tanah, air maupun makanan (Slepecky dan Hemphill 2006). Lebih lanjut Sorukulova et al. (2007) menyatakan bahwa probiotik dari golongan Bacillus telah banyak diaplikasikan untuk kepentingan bioteknologi termasuk jenis enzim dan asam amino yang dihasilkan serta produksi antibiotik untuk pengendalian patogen. SpesiesBacillus
patogen tertentu (Murillo dan Villamil 2011). Jenis produk ekstraseluler yang dihasilkan oleh Bacillus antara lain: subtilin, coagulin, protease-resistant isocoumarin, aminocoumacin, dan polyfermenticum (Honget al.2004).
Aplikasi probiotik dapat dilakukan dengan beberapa metode antara lain melalui pencampuran pakan dan diaplikasikan langsung dalam kolam budidaya (Tuan et al. 2013). Probiotik yang dicampurkan dalam pakan dapat merangsang sistem imun dalam saluran pencernaan dan keseimbangan mikroba saluran pencernaan (Nayak 2010). Sedangkan aplikasi probiotik secara langsung dalam media pemeliharaan menghasilkan efek yang lebih cepat dibandingkan metode pemberian lain, meskipun kandungan bakteri probiotik didalamnya lebih sedikit (Sahu et al. 2008). Hasil penelitian menyebutkan bahwa empat strain Bacillus
yang diisolasi dari saluran pencernaan udang putih sehat yang diaplikasikan melalui media pemeliharaan pada konsentrasi 105 CFU/mL/hari dapat meningkatkan kesehatan larva udang putih (Litopenaeus vannamei) (Luis-Villasenor et al. 2011). Penggunaan Bacillus coagulans SC8168 pada media pemeliharaan juga dapat meningkatkan kelangsungan hidup, aktivitas enzim pencernaan dan memperbaiki kualitas air pada hatchery larva udang vannamei (Penaeus vannamei) (Zhouet al.2008)
BakteriA. hydrophila
Bakteri A. hydrophila merupakan bakteri anaerobik fakultatif dari famili Aeromonadaceae, bergerak dengan flagela, serta tidak membentuk spora (Erdem
et al. 2011). Koloni A. hydrophila berbentuk bulat, elevasi cembung, tepian rata, berwarna kuning pada mediaRhimler-Shotts(Shotts dan Rimler 1973), putih pada media Blood Agar serta hijau kebiruan pada media Istrati-Meitert (Chirila et al.
2008). Pengamatan secara mikroskopis menunjukkan bahwa bakteriA. hydrophila
berbentuk batang pendek, Gram negatif, serta tidak memiliki kapsul (Chandrakanthiet al. 2000). Hasil uji karakteristik biokimiaA. hydrophilayaitu : indole (+), MR (-), VP (+), citrate (+), katalase (+), urea (-), oksidase (+), hidrolisis gelatin (+), pemanfaatan karbohidrat dari laktosa (+), glucosa (+), trehalosa (+) (Jayavigneshet al.2011).
Genus Aeromonas merupakan bakteri oportunistik yang dapat diisolasi dari lingkungan perairan, termasuk air tanah, air permukaan, air minum dan air limbah. Selain itu, bakteri ini juga dapat ditemukan dalam makanan, keju dan susu (Sharma et al.2009). Janda dan Abbot (2010) telah berhasil mengidentifikasi 21 spesies dari genusAeromonas, akan tetapi spesies yang diketahui sebagai patogen pada ikan yaitu A. salmonicida, A. hydrophila, A. formicans dan A. liquefaciens
(Abdel-Raouf dan Ibraheem 2008).
Aberoum dan Jooyandeh (2010) mengemukakan bahwa Aeromonas
mensekresikan beberapa jenis produk ekstraseluler, antara lain: amilase, chitinase, elastase, aerolysin, nuclease, gelatinase, lecithinase, lipase dan protease. Produk ekstraseluler tersebut yang menyebabkan A. hydrophila dikenal sebagai patogen pada ikan. Lebih lanjut Yousr et al. (2007) telah berhasil mendeteksi adanya gen penyandi aerolysin dan hemolisin yang dihasilkan oleh Aeromonas spp. Hasil penelitian selanjutnya oleh Niamah (2012) juga berhasil mendeteksi gen Aero
PenyakitMotile Aeromonads Septicemia (MAS) disebabkan oleh bakteriA. hydrophiladan dapat menginfeksi ikan melalui luka akibat gesekan antar ikan dan saluran pencernaan bersamaan dengan pakan yang dikonsumsi (Ventura dan Grizzle 1987). Ikan yang terserang menunjukkan gejala klinis yaitu: ikan lemas, nafsu makan menurun, berenang di permukaan, hiperplasia insang, ginjal dan hati mengalami hemoragi dan infiltrasi limfosit (Yardimci dan Aydin 2011). Prakoso (2012) menambahkan tanda-tanda ikan yang terserang MAS yaitu: hemoragi pada permukaan kulit dan insang, abdomen yang membengkak, ulcerasi kulit dan nekrosis pada jaringan. Ikan yang mati menampakkan gejala klinis seperti lesi kecil di permukaan tubuh, hemoragi fokal, hemoragi organ, tukak kulit dalam, exophthalmia dan abses di rongga perut (Thuneet al.1983).
Penyakit MAS pada ikan menjadi wabah terutama di Asia Tenggara sejak tahun 1980, terjadi di Jawa Barat yang menyebabkan kematian 82,2 ton ikan dalam waktu 1 bulan. Tahun 1981 menyebar ke Malaysia dan Thailand, kemudian Filipina (1985), Sri Langka (1987), Bangladesh, India dan Nepal (1988) (Angka 2005). Faktor lingkungan yang mempengaruhi penyebaran penyakit MAS antara lain, salinitas, tingkat pencemaran perairan, pH dan kekeruhan (Hazen et al.
1978).
Ikan lele yang terserang penyakit MAS menunjukkan gejala klinis eksternal berupa bercak merah pada kepala dan mata mengalami exophthalmia. Sedangkan gejala internal yang tampak yaitu hati membengkak dan memucat, serta ginjal mengalami peradangan (Asniatih et al. 2013). Secara histopatologis, ikan lele yang terserang MAS menunjukkan kerusakan berupa nekrosis dan hipertropi pada kulit, hiperplasia dan infiltrasi leukosit pada lamela insang, degenerasi dan peradangan pada ginjal dan hati, degenerasi dan pembengkakan pada otot daging serta hiperplasia pada limpa (Laith dan Najiah 2013).
3 METODE
Waktu dan Tempat Penelitian
Penelitian ini telah dilaksanakan selama empat bulan mulai bulan Oktober 2013 sampai dengan Januari 2014 di Laboratorium Kesehatan Ikan, Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor, Jawa Barat.
Prosedur Penelitian
UjiIn vitro
Karakterisasi Isolat Bakteri dan Pemberian Penanda Resisten Antibiotik
Isolat probiotik yang digunakan merupakan kelompok bakteri Bacillus
yang terdiri dari probiotik Bacillus P4I1 yang diisolasi dari saluran pencernaan ikan nila (Oreochromis niloticus) danBacillusP4I2 yang diisolasi dari lingkungan budidaya ikan lele (Clarias sp.), sedangkan patogen yang digunakan dalam penelitian ini adalah A. hydrophila AH26. Seluruh isolat bakteri merupakan koleksi dari Balai Penelitian dan Pengembangan Budidaya Air Tawar, Bogor. Isolat bakteri dikarakterisasi berdasarkan morfologi, sifat fisiologi dan biokimia, serta diberi penanda resisten rifampisin (RifR) dengan dosis 100 µg/mL. Sebelumnya masing-masing isolat bakteri dikultur pada media Trypticase Soy Broth(TSB) sebanyak 25 mL di dalamwater bath shaker, 160 rpm selama 24 jam pada 29oC. Kultur sel dipanen dan disentrifugasi pada 5000 rpm selama 15 menit. Setelah itu, suspensi bakteri dicuci sebanyak dua kali denganphosfat buffer saline
(PBS; NaCl 0.8 g, KH2PO4 0.2 g, Na2HPO41.5 g, KCl 0.2 g dan akuades 1000
mL). Pengenceran berseri disesuaikan dengan dosis percobaan. Total Plate Count
(TPC) bakteri ditentukan dengan metode cawan sebar (Madiganet al. 2011). Pemberian penanda resisten antibiotik pada isolat bakteri digunakan untuk mengetahui keberadaan bakteri tersebut pada lingkungan pemeliharaan sehingga keberadaannya dapat dimonitor (Widanarni et al. 2004). Pemberian penanda resisten rifampisin (RifR) dilakukan melalui mutasi spontan dengan menumbuhkan kurang lebih 108CFU/mL isolat bakteri tipe liar sensitif rifampisin pada media Trypticase Soy Agar (TSA) yang mengandung rifampisin 100 μ g/mL (TSA+Rif).
Uji Kultur Bersama
Uji kultur bersama dilakukan untuk mengetahui potensi bakteri probiotik
Bacillus P4I1, Bacillus P4I2 dan gabungannya (Bacillus P4I1 + Bacillus P4I2) dalam menghambat pertumbuhan bakteri patogen A. hydrophila. Kombinasi perlakuan pada uji kultur bersama secarain vitrodapat dilihat pada Tabel 1.
Setiap kombinasi bakteri pada perlakuan A, B, C dan D diinokulasikan pada media TSB yang berbeda (Bernardet al.2013) dan diinkubasi selama 24 jam pada suhu 28 °C. Penghitungan bakteri dilakukan dengan metode hitungan cawan (Madigan et al. 2011). Media yang digunakan berupa media Rhimler Shotts medium (media R-S) yang merupakan media selektif untuk A. hydrophila.
Perlakuan E diinokulasikan pada media TSA menggunakan metode dual culture
UjiPostulat Koch
Uji Postulat Koch dilakukan untuk mengetahui sifat patogen dari isolat bakteri (Madiganet al. 2011) dalam hal ini adalah isolat A. hydrophila pada ikan lele dumbo. IsolatA. hydrophilayang digunakan adalah isolat berpenanda resisten rifampisin (tipe mutan) dan isolat liar (wild type). Uji ini dilakukan dengan proses pasase yang diawali dengan mengkultur A. hydrophila pada media TSA+Rif untuk tipe mutan dan media TSA untuk wild type dan diinkubasi selama 24 jam pada suhu 28 °C, kemudian masing-masing isolat bakteri dipindahkan pada media TSB dan diinkubasi kembali selama 24 jam pada suhu 28 °C.
Selanjutnya suspensi sel bakteri dilakukan pengenceran serial menggunakan larutan PBS sampai diperoleh konsentrasi bakteri yang diinginkan yaitu 106 CFU/mL. Kemudian, isolat A. hydrophila tersebut diinjeksikan ke masing-masing ikan uji dengan volume 0.1 mL. Ikan uji yang digunakan adalah ikan lele dumbo berukuran 8-10 cm dengan berat 15-20 gram yang ditebar pada tiga akuarium berukuran 60x70x40 cm3 berisi 40 liter air dengan padat tebar masing-masing 10 ekor untuk setiap perlakuan. Perlakuan yang diberikan yaitu penyuntikan A. hydrophila tipe liar (wild type), penyuntikan A. hydrophila tipe mutan dan kontrol (penyuntikan dengan PBS). Selama pengujian berlangsung, ikan diberi pakan pelet komersial dengan kandungan protein 36% setiap pagi dan sore hari secaraat satiation.
Pengamatan gejala klinis dilakukan setelah penginfeksian ikan dengan A. hydrophila dan dicatat tingkat kelangsungan hidup ikan serta selang waktu kematian pascainfeksi. Gejala klinis yang diamati yaitu adanya bercak merah dan luka pada permukaan tubuh (Angka 2005). Ikan yang telah menunjukkan gejala
Tabel 1 Kombinasi perlakuan uji penghambatan bakteri probiotik terhadapA. hydrophilasecarain vitro
klinis diambil untuk diisolasi bakterinya dengan menggoreskan pada media TSA dan RS yang mengandung antibiotik untuk tipe mutan dan media TSA dan RS untuk wild type dan diinkubasi selama 24 jam pada suhu 28 °C. Goresan berasal dari luka, hati dan ginjal. Koloni bakteri yang tumbuh diidentifikasi berdasarkan morfologi koloni, karakteristik biokimia dan sifat Gram untuk memastikan bahwa bakteri yang menginfeksi ikan uji adalahA. hydrophila. Proses pasase diulang dua kali untuk meningkatkan patogenitas isolatA. hydrophila.
UjiIn vivo
Desain penelitian
Uji in vivo merupakan uji probiotik Bacillus pada media pemeliharaan untuk menekan jumlah A. hydrophila. Ikan uji yang digunakan adalah ikan lele dumbo dengan panjang 12.69±0.9 cm dan berat 13.35±2.8 gram. Percobaan dilakukan pada akuarium berukuran 60x70x40 cm3dengan volume air 40 liter dan kepadatan 30 ekor per akuarium. Pemberian probiotik pada media pemeliharaan dengan dosis 104CFU/mL (berdasarkan hasil uji kultur bersama), dilakukan setiap hari pada pagi hari selama 30 hari. Probiotik yang ditambahkan pada perlakuan P4I1 RifR dan P4I2 RifR sebanyak 4 mL, sedangkan pada perlakuan Kom ditambahkan sebanyak 2 mL untuk masing-masing jenis probiotik (P4I1 RifR dan P4I2 RifR). Bakteri patogen A. hydrophila RifR diberikan pada media pemeliharaan dengan dosis 103 CFU/mL (Al Harbi dan Uddin 2010) sebanyak satu kali pemberian pada awal pemeliharaan (H0). Pakan berupa pelet komersial dengan kadar protein 36% diberikan secara at satiation setiap pagi dan sore hari. Selama masa pemeliharaan (30 hari), akuarium tidak disipon dan tidak dilakukan pergantian air. Pengujian dilakukan sebanyak lima perlakuan dan tiga kali ulangan (Tabel 2).
Parameter yang Diukur
Parameter yang diukur dalam penelitian ini meliputi tingkat kelangsungan hidup (Survival rate), laju pertumbuhan harian (Specific growth rate), total bakteri dalam media pemeliharaan, gambaran darah, histopatologi, dan kualitas air.
Tabel 2 Kombinasi perlakuan uji probiotikBacillussecarain vivopada media pemeliharaan ikan lele dumbo (Clarias gariepinus)
Kelangsungan hidup/survival rate (SR) dihitung mulai awal sampai akhir penelitian berdasarkan Effendi (2002) yaitu:
Keterangan :
SR = Tingkat kelangsungan hidup (%)
Nt = Jumlah ikan yang hidup pada akhir pengamatan (ekor) No = Jumlah ikan yang hidup pada awal pengamatan (ekor)
Laju Pertumbuhan Harian
Laju pertumbuhan harian/specific growth rate (SGR) dihitung mulai awal sampai akhir penelitian berdasarkan Effendi (2002) yaitu:
Keterangan :
SGR = Laju pertumbuhan harian (%)
ln Wt = Log natural bobot ikan pada akhir pengamatan (gram) ln Wo = Log natural bobot ikan pada awal pengamatan (gram) t = Lama waktu pengamatan (hari)
Total bakteri dalam Media Pemeliharaan
Total bakteri dalam media pemeliharaan dihitung menggunakan metode
Total Plate Count (TPC) (Al Harbi dan Uddin 2010) yang dilakukan setiap minggu pada hari ke-0, 7, 14, 21, dan 28. Media yang digunakan adalah media TSA untuk menghitung Total Viable Bacterial Count (TBC), R-S untuk menghitung total bakteri A. hydrophila, dan TSA+Rif untuk menghitung total bakteriA. hydrophila dan probiotikBacillusRifR.
Gambaran Darah
Pengukuran gambaran darah dilakukan setiap minggu pada hari ke-0, 7, 14, 21, dan 28. Sampel darah diambil dari 2 ekor ikan pada masing-masing perlakuan. Gambaran darah yang diamati yaitu:
Hematokrit (He)
Hematokrit diperiksa menurut Anderson dan Siwicki (1993) menggunakan tabung mikro hematokrit kemudian dihitung dengan persamaan:
Keterangan:
a: bagian darah yang mengendap
b: bagian seluruh darah dalam tabung mikrohematokrit
Kadar Hemoglobin (Hb)
Kadar hemoglobin diukur menurut metode Sahli (Collier 1944) dengan menggunakan tabung Sahlinometer. Kadar hemoglobin dinyatakan dalam g% yang berarti banyaknya hemoglobin dalam gram per 100 mL darah.
Total Eritrosit
Jumlah eritrosit dihitung berdasarkan Blaxhall dan Daisley (1973) dan dimasukkan kedalam rumus :
Keterangan:
A = Jumlah sel eritrosit terhitung
N = Jumlah kotak hemositometer yang diamati V = Volume kotak hemositometer yang diamati Fp = Faktor pengenceran
Total Leukosit
Total leukosit dihitung dengan metode Blaxhall dan Daisley (1973) dan dimasukkan kedalam rumus:
Keterangan:
A = Jumlah sel leukosit terhitung
N = Jumlah kotak hemositometer yang diamati V = Volume kotak hemositometer yang diamati Fp = Faktor pengenceran
Diferensial Leukosit
Pengamatan diferensial leukosit menggunakan metode Blaxhall dan Daisley (1973) dengan mengamati preparat ulas darah yang diwarnai dengan pewarna Giemsa di bawah mikroskop. Pengamatan dan penghitungan masing-masing jenis sel (monosit, limfosit dan neutrofil) dilakukan hingga jumlah semua jenis sel mencapai 100, dan hasilnya dinyatakan dalam % .
Histopatologi
Pengamatan histopatologi dilakukan dengan mengambil satu ekor ikan dari masing-masing perlakuan untuk dibuat preparat histopatologi dari organ hati dan ginjal ikan berdasarkan metode yang dijelaskan oleh Hossain et al. (2007). Hasil histopatologi dianalisis secara deskriptif berdasarkan jumlah kerusakan pada organ ikan pada beberapa bagian organ. Jika jumlah kerusakan organ hanya di satu bagian (fokal), di beberapa tempat (multifokal), dan di semua tempat (difus), maka diberi tanda masing-masing +, ++, +++ (Adinataet al.2012)
Kualitas Air
Parameter kualitas air yang diamati pada penelitian ini adalah oksigen terlarut, pH, suhu, dan amonia yang diukur pada hari ke-0, 7, 14, 21, dan 28.
Prosedur Analisis Data
Analisis data dilakukan dengan dua metode yaitu analisis statistik pada selang kepercayaan 95% (alpha=0.05) dan analisis deskriptif. Untuk analisis statistik, rancangan yang digunakan adalah Rancangan Acak Lengkap (RAL)
version16.0. Apabila berbeda nyata dilanjutkan denganDuncan’s Multiple Range
Test (DMRT). Analisis statistik digunakan untuk analisis data tingkat kelangsungan hidup, laju pertumbuhan spesifik dan gambaran darah ikan. Sedangkan analisis deskriptif digunakan untuk data total bakteri pada media pemeliharaan, histopatologi dan kualitas air.
4 HASIL DAN PEMBAHASAN
UjiIn vitro
Karakterisasi Isolat Bakteri
Karakterisasi bakteri merupakan tahap yang penting untuk memastikan isolat bakteri yang digunakan merupakan isolat bakteri yang diinginkan. Karakterisasi bakteri dapat dilakukan dengan mengamati morfologi koloni dan sifat biokimia bakteri, menggunakantestkit, ataupun secara molekuler (Suryani et al. 2010). Hasil karakterisasi bakteri patogen dan probiotik berdasarkan sifat morfologi dan biokimia (Tabel 3) menunjukkan bahwa isolat bakteri yang digunakan merupakan isolat patogen A. hydrophila (SNI 7309: 2009) dan probiotikBacillus(P4I1 dan P4I2) (Cowan 1974).
Pemberian Penanda Resistensi Antibiotik
Pemberian penanda resisten antibiotik pada isolat bakteri digunakan untuk memantau keberadaan bakteri tersebut pada lingkungan pemeliharaan (Widanarni
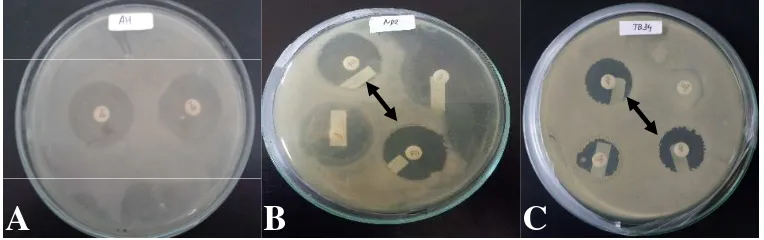
et al. 2004; Bolstridge et al.2009). Antibiotik yang digunakan adalah rifampisin 100μ g/mL. Sebelumnya dilakukan pengukuran zona hambat menggunakan disk rifampisin 5μ g untuk mengetahui sensitivitas masing-masing isolat bakteri terhadap antibiotik rifampisin. Hasil pengukuran zona hambat (Gambar 1) menunjukkan bahwa seluruh isolat bakteri yang digunakan (patogen dan probiotik) sensitif terhadap antibiotik rifampisin dengan diameter zona hambat sebesar 27 mm (A. hydrophila), 25 mm (probiotik Bacillus P4I1) dan 22 mm Tabel 3 Hasil karakterisasi isolat bakteri patogenA. hydrophiladan probiotik
Bacillusberdasarkan morfologi koloni dan sifat biokimia
Media
Morfologi Koloni dan Sifat Biokimia Bentuk
Sel Gram
Jenis Bakteri Warna Elevasi Tepian Motil Katalase Oksidase
TSA Krem Cembung Halus + + + Batang
pendek
Negatif (-)
A. hydrophila
RS Kuning Cembung Halus + + + Batang
pendek
Negatif (-)
TSA Putih Cembung Halus + + - Batang Positif
(+)
Bacillus (P4I1)
TSA Putih Cembung Halus + + - Batang Positif
(+)
(probiotik Bacillus P4I2) (NCCLS 2002). Hasil penelitian Costa dan Cyrino (2006) menyebutkan bahwa bakteri A. hydrophila sensitif terhadap antibiotik chloramphenicol, gentamicin, kanamycin, nitrofurantoin, norfloxacin, rifampicin, streptomycin, trimetoprim+sulphamethoxazole. Sedangkan bakteri Bacillus
sensitif terhadap antibiotik chlorampenicol, novobiocin, rifampicin, tetrasiklin, dan neomycin (Honget al.2004).
Gambar 1 Zona hambat yang terbentuk terhadap antibiotik rifampisin (A. A. hydrophila, B.BacillusP4I1,C.BacillusP4I2)
Resistensi antibiotik merupakan sifat bakteri yang menunjukkan kebal atau tahan terhadap antibiotik tertentu (Byarugaba 2010). Resistensi antibiotik dapat terjadi melalui dua proses yaitu resistensi yang terjadi karena mutasi spontan dalam kromosom serta resistensi yang dikarenakan perpindahan plasmid. Resistensi pada kromosom bersifat lebih stabil dan tidak dapat dipindahkan secara horisontal pada bakteri lain, sedangkan resistensi plasmid bersifat tidak stabil/mudah hilang serta mudah ditransfer pada bakteri lain yang belum memiliki gen tersebut (Cruzet al.2012).
Mekanisme resistensi terhadap rifampisin terjadi karena bakteri mengubah struktur sub unit β-RNA polimerase yang dikode oleh gen rpo B sehingga merusak dan mematikan situs tersebut (Montoya et al. 2007). Bockstael dan Aerschot (2009) menambahkan bahwa sejumlah mekanisme terjadi saat bakteri mengembangkan sifat resistensinya terhadap rifampisin yang akhirnya dapat memodifikasi gugus hidroksil dan mengganggu pengikatan RNA polimerase. Lebih lanjut, Hong et al. (2004), menyatakan bahwa resistensi bakteri terhadap antibiotik rifampisin bersifat stabil sampai 200 generasi. Hal ini juga terjadi pada bakteri A. hydrophila (Janda dan Scoot 2010) dan Bacillus (Nicholson dan Maughan 2002, Tupinet al.2009).
A
Hasil uji penghambatan bakteri probiotik Bacillus RifR terhadap A. hydrophilaRifR dapat dilihat pada Tabel 4. Hasil penelitian menunjukkan bahwa konsentrasi terbaik dari probiotik Bacillus RifR dan gabungan keduanya setelah diuji tantang dengan A. hydrophila RifR secara in vitro adalah pada konsentrasi 104CFU/mL. Hasil tersebut kemudian dijadikan acuan pada pengujian probiotik secarain vivo. Pada hasil pengujian kombinasi isolat probiotik BacillusP4I1 RifR dan Bacillus P4I2 RifR pada media TSA, tidak menunjukkan adanya aktivitas antagonis yang ditunjukkan dengan tidak adanya zona hambat yang dihasilkan. Dengan demikian kedua isolat probiotik dapat digunakan secara bersamaan untuk menghambat pertumbuhanA. hydrophilaRifR.
Hasil uji bakteri probiotik Bacillusterhadap A. hydrophila secara in vitro
menunjukkan bahwa isolat probiotik Bacillus P4I1 RifR, Bacillus P4I2 RifR dengan kepadatan 104CFU/mL dan kombinasi (BacillusP4I1 RifR104CFU/mL+
Bacillus P4I2 RifR 104 CFU/mL) mampu menghambat populasi A. hydrophila
RifR. Jumlah populasi A. hydrophila tanpa pemberian probiotik adalah 1010CFU/mL, sedangkan jumlah populasiA. hydrophilapada perlakuan probiotik berada pada kisaran 104 – 106 CFU/mL. Hal ini diduga disebabkan adanya senyawa ekstraseluler yang dihasilkan oleh Bacillus. Defoirt et al. (2010) menyatakan bahwa Bacillus anthracis, Bacillus cereus, Bacillus subtilis, dan
Bacillus thuringiensis terbukti menghasilkan senyawa N-acylhomoserine lactone
yang dapat mencegah terjadinya quorum sensing dari A. hydrophila, A.
Tabel 4 Penghambatan bakteri probiotikBacillusterhadapA. hydrophilasecara
in vitro
* : kepadatanA.hydrophilayang diinokulasikan
salmonicida, Edwardsiella tarda, dan Vibrio salmonicida. Penelitian lain juga menyebutkan bahwa secara in vitro, probiotik Bacillus dapat menghambat pertumbuhan A. hydrophila. (Sansawat dan Thirabuyanon 2009; Al-Faragi dan Alsapar 2012).
Hasil penelitian menunjukkan bahwa konsentrasi probiotik yang lebih tinggi (106CFU/mL) menghasilkan aktivitas penghambatan yang kurang optimal dibandingkan konsentrasi 104 CFU/mL. Hasil yang sama juga ditunjukkan oleh Widanarniet al.(2010), yaitu penambahan bakteriVibrioSKT-b dengan dosis 106 CFU/mL menunjukkan nilai kelangsungan hidup larva udang windu (Penaeus monodon) yang lebih rendah dibandingkan dosis 104CFU/mL. Nikoskelainen et al. (2001) mengemukakan bahwa penggunaan probiotik dalam dosis tinggi ternyata tidak menjamin perlindungan yang lebih baik terhadap hewan inang. Hal ini diduga karena adanya persaingan nutrisi dan oksigen yang tinggi dalam media sehingga menyebabkan keseimbangan bakteri didalamnya terganggu.
UjiPostulat Koch
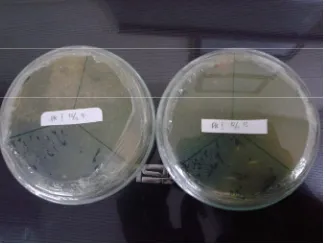
Jumlah kematian ikan setelah diinfeksi dengan patogen A. hydrophila
dapat dilihat pada Tabel 5. Hasil uji Postulat Koch I menunjukkan bahwa terjadi kematian mulai pada jam ke-18 pascainfeksi dan pada jam ke-24 terjadi kematian 100% pada ikan lele dumbo. Hasil isolasi bakteri pada media R-S (Gambar 2) dari ikan yang menunjukkan gejala klinis kemudian disuntikkan kembali pada ikan sehat untuk uji Postulat Koch II. Pada uji Postulat Koch II menghasilkan kematian pada ikan lele dumbo mulai pada jam ke-17 pascainfeksi dan terjadi kematian 100% ikan lele dumbo pada jam ke-22.
Tabel 5 Kematian ikan lele dumbo pasca infeksiA. hydrophilapada ujiPostulat Koch
Postulat
Koch Jumlah ikan yang mati (ekor)
17
dalam sel bakteri menurun bahkan hilang. Selain itu, kandungan nutrien dalam media juga mempengaruhi patogenisitas dan aktivitas bakteri. Hasil penelitian Sarkar dan Rashid (2012) menunjukkan bahwa patogenisitas A. hydrophila
berbeda-beda pada ikan Heteropneustes fossilis, Clarias batrachus, Labeo rohita, Catla catla, Cirrhinus cirrhosus, dan Anabas testudineus serta menunjukkan kematian 60-100% setelah 2-11 hari pascainfeksi. Yulianto et al. (2013) menambahkan bahwa terjadi kerusakan jaringan organ yang semakin parah seiring dengan meningkatnya konsentrasi bakteri A. hydrophila yang disuntikkan pada ikan komet (Carassius auratus).
Gambar 2 BakteriA. hydrophilapada media RS hasil ujiPostulat KochI
UjiIn vivo
Penelitian tahap akhir ini merupakan uji biologis probiotikBacillus untuk menekan pertumbuhan A. hydrophila dan mencegah serangan penyakit Motile Aeromonads Septicemia pada ikan lele dumbo. Parameter yang diamati selama penelitian ini yaitu:
Tingkat Kelangsungan Hidup/Survival Rate(SR)
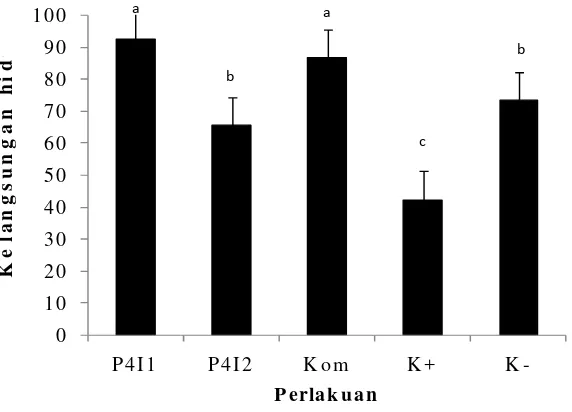
Tingkat kelangsungan hidup ikan lele dumbo dapat dilihat pada Gambar 3. Berdasarkan pengamatan tingkat kelangsungan hidup ikan selama 30 hari perlakuan, diketahui bahwa perlakuan dengan pemberian probiotik Bacillus P4I1 RifRdan perlakuan kombinasi probiotik (BacillusP4I1 RifR+Bacillus P4I2 RifR) menunjukkan tingkat kelangsungan hidup yang signifikan lebih tinggi dibanding perlakuan Bacillus P4I2 RifR, kontrol negatif (K-), dan kontrol positif (K+) (P<0.05). Selain itu, perlakuan pemberian probiotik Bacillus P4I2 RifR juga menunjukkan hasil yang berbeda nyata terhadap kontrol (+) (P<0.05).
(Bacillus P4I1 Rif + Bacillus P4I2 Rif ) semakin menurun sampai akhir penelitian dibandingkan pada perlakuan lain (BacillusP4I2 RifRdan kontrol).
a
Ket: Huruf yang berbeda menunjukkan hasil yang berbeda nyata (p<0.05)
Gambar 3 Kelangsungan hidup ikan lele dumbo (C. gariepinus) pada perlakuan probiotik Bacillus P4I1 RifR,Bacillus P4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol
Penggunaan probiotikBacillusdapat meningkatkan kelangsungan hidup dan pertumbuhanzoeadanmysisudang putih (Litopenaeus vannamei) terutama ketika probiotik ditambahkan dalam media pemeliharaan dibandingkan lewat pakan mikro-alga (Silva et al. 2013). Hasil penelitian Baskar dan Kannan (2009) menyebutkan bahwa probiotik Bacillus sp., dan Bacillus cereus yang diaplikasikan pada media pemeliharaan dapat menghambat pertumbuhan Vibrio
pada media pemeliharaan larva udang windu (Penaeus monodon) serta meningkatkan nilai ketahanan hidup larva udang windu tersebut. Hasil penelitian lain menyebutkan bahwa probiotik Lactobacillus plantarum yang diaplikasikan lewat media pemeliharaan juga efektif untuk meningkatkan kelangsungan hidup, aktivitas enzim dan memperbaiki kualitas air pada budidaya kepiting Portunus pelagicus(Talpuret al.2013).
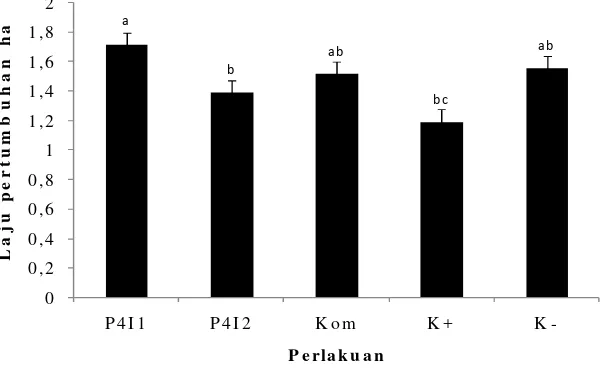
Laju Pertumbuhan Harian
Laju pertumbuhan harian ikan lele dumbo ditampilkan pada Gambar 4. Berdasarkan pengamatan laju pertumbuhan ikan selama 30 hari perlakuan, diketahui bahwa perlakuan pemberian probiotik Bacillus P4I1 RifRmenunjukkan laju pertumbuhan yang signifikan lebih tinggi dibanding perlakuan pemberian probiotik Bacillus P4I2 RifR dan kontrol positif (K+) (P<0.05), akan tetapi tidak berbeda signifikan dengan perlakuan pemberian kombinasi probiotik (Bacillus
hydrophiladalam air setelah pemberian probiotikBacillusP4I1 RifR, maka sistem imun dalam tubuh ikan dapat meningkat yang disertai dengan peningkatan pertumbuhan. Hal ini sesuai dengan hasil penelitian Sun et al. (2010) yang menyebutkan bahwa probiotik jenis Bacillus pumilus dan Bacillus clausii dapat meningkatkan performa pertumbuhan dan respons imun ikan Epinephelus coloides. Ziaei-Nejad et al. (2005) menyatakan bahwa probiotik Bacillus spp. yang diaplikasikan lewat media pemeliharaan dapat meningkatkan pertumbuhan dan tingkat kelangsungan hidup udang putih India (Fenneropenaeus indicus).
a
Ket: Huruf yang berbeda menunjukkan hasil yang berbeda nyata (p<0.05)
Gambar 4 Laju pertumbuhan ikan lele dumbo (C. gariepinus) pada perlakuan probiotikBacillus P4I1 RifR,Bacillus P4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol
Selain itu, peningkatan pertumbuhan diduga juga disebabkan karena penurunan tingkat stres ikan terhadap faktor kualitas air. Sehingga energi dari pakan yang masuk dalam tubuh ikan sebagian besar diarahkan untuk pertumbuhan. Fu et al. (2007) menyebutkan bahwa energi yang masuk dalam tubuh ikan yang berasal dari pakan akan sebagian besar digunakan untuk metabolisme, sebagian lagi digunakan untuk pertumbuhan dan sisanya dibuang dalam bentuk feses. Stres pada ikan menyebabkan penurunan pertumbuhan, tingkah laku yang abnormal, penurunan sistem imun ikan dan resistensi terhadap penyakit (Lupatsch et al. 2010). Faktor penyebab stres pada ikan dapat berasal dari kualitas air (Luzet al. 2008, Brogowskiet al.2005, Mallya 2007), kepadatan (Naserizadehet al. 2013) serta proses penanganan dan pengangkutan yang buruk (Adeyemoet al.2009).
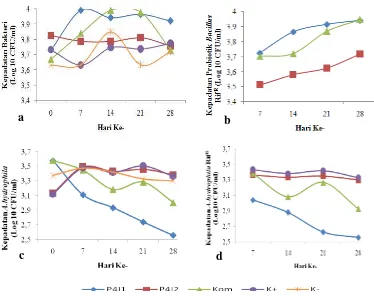
Total Bakteri pada Media Pemeliharaan
5b) mengalami peningkatan seiring dengan lamanya waktu perlakuan. Total
Bacillus RifR tertinggi terdapat pada perlakuan Bacillus P4I1 RifR, kemudian diikuti oleh perlakuan kombinasi probiotik (Bacillus P4I1 RifR + Bacillus P4I2 RifR), dan BacillusP4I2 RifR. Adapun hasil penghitungan populasi A. hydrophila
(wild type dan RifR) pada perlakuan probiotik menunjukkan pola penurunan dari 103 CFU/mL pada awal penelitian menjadi 102 CFU/mL pada akhir penelitian. Sedangkan populasi A. hydrophila pada perlakuan kontrol (+) menunjukkan hasil yang tetap tanpa terjadi penurunan (Gambar 5c dan 5d).
Gambar 5 Kelimpahan bakteri pada media pemeliharaan ikan lele dumbo pada perlakuan probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (BacillusP4I1 RifR+BacillusP4I2 RifR) dan kontrol
Populasi bakteri di media pemeliharaan pada semua perlakuan berfluktuasi selama pengamatan (Gambar 5a). Hal ini diduga karena faktor lingkungan (DO dan pH) serta kandungan nutrien dalam media pemeliharaan yang berfluktuasi. Uddin dan Al-Harbi (2012) menyatakan bahwa jumlah bakteri dalam kolam budidaya bervariasi tergantung suhu, salinitas, oksigen terlarut, pH, dan total padatan terlarut/Total Dissolved Solids(TDS).
Total probiotikBacillusRifR(Gambar 5b) menunjukkan peningkatan pada semua perlakuan probiotik. Hal ini menunjukkan bahwa probiotik Bacillus RifR mampu tumbuh dan berkembang dalam media pemeliharaan. Menurut George et al.(2011) bakteriBacillusdapat ditemukan pada air dan sedimen. Hasil penelitian Al-Harbi dan Uddin (2010) menyatakan bahwa 6.25% dari total bakteri pada media pemeliharaan ikan lele dumbo (Clarias gariepinus) dan 5.44% dari total bakteri pada kolam budidaya polikultur ikan mas (Cyprinus carpio) dan ikan lele
b a
Keberadaan Bacillus dalam air tersebut diduga yang berperan dalam menekan jumlahA. hydrophila.
PopulasiA. hydrophilapada seluruh perlakuan sudah terdeteksi pada awal pengamatan. Hal ini menunjukkan bahwa bakteri A. hydrophila merupakan bakteri oportunistik yang dapat ditemukan pada lingkungan perairan (Sharma et al. 2009). Pada perlakuan probiotik Bacillus P4I1 RifR, penurunan populasi A. hydrophila lebih cepat dibanding perlakuan probiotik Bacillus P4I2 RifR dan kombinasi probiotik (Bacillus P4I1 RifR + Bacillus P4I1 RifR) serta perlakuan kontrol positif (K+). Hal ini menunjukkan kemampuan penghambatan pertumbuhan A. hydrophila oleh probiotik Bacillus P4I1 RifR lebih baik dibandingkan probiotik Bacillus P4I2 RifR dan sejalan dengan hasil uji in vitro
dimana probiotik Bacillus P4I1 RifR menunjukkan kemampuan menghambat A. hydrophila yang lebih baik dibandingkan probiotik Bacillus P4I2 RifR. Hasil penelitian Purivirojkul dan Areechon (2007) menunjukkan bahwa Bacillus yang diisolasi dari saluran pencernaan udang Penaeus monodon dapat menghambat pertumbuhan A. hydrophila, Streptococcus agalactiae dan Vibrio harveyi dalam air. Lebih lanjut Murillo dan Villamil (2011) menambahkan bahwa penghambatan pertumbuhan A. hydrophila oleh Bacillus dikarenakan bakteri ini menghasilkan enzim antara lain esterase lipase, leucine arylamidase, acid phosphatase, lipase, dan Naphthol-AS-BI- phosphohydrolase.
Gambaran Darah Total Eritrosit
Pemeriksaan total eritrosit bertujuan untuk mengetahui kondisi kesehatan ikan dengan cara menghitung total eritrosit dalam darah (Alamanda et al. 2007). Hasil pengamatan terhadap total eritrosit dalam penelitian ini ditampilkan pada Gambar 6.
Ket: Huruf yang berbeda pada pola yang sama menunjukkan berbeda nyata (p<0.05)
Gambar 6 Total eritrosit darah ikan lele dumbo pada pada perlakuan probiotik
Berdasarkan Gambar 6 terlihat bahwa pada awal penelitian (H0), jumlah eritrosit ikan masih sama pada setiap perlakuan yaitu sebesar 1.518±0.00 x106 sel/mL kemudian terjadi penurunan pada hari ke-7 pasca penambahan A. hydrophila dalam air. Namun, pada hari-hari berikutnya terlihat peningkatan jumlah eritrosit sampai akhir penelitian kecuali pada perlakuan kontrol negatif (K-).
Pada hari ke-7 terjadi penurunan eritrosit pada semua perlakuan dengan nilai terendah pada perlakuan kontrol positif (K+) yaitu sebesar 0.955±0.02 x106 sel/mL; disusul oleh perlakuan probiotik Bacillus P4I2 RifR, kombinasi probiotik (Bacillus P4I1 RifR+ Bacillus P4I2 RifR ), BacillusP4I1 RifR dan kontrol negatif (K-) dengan masing-masing 1.259±0.07 x106 sel/mL; 1.412±0.08 x106 sel/mL; 1.445±0.04 x106 sel/mL dan 1.585±0.01 x106 sel/mL. Berdasarkan uji lanjut Duncan diketahui bahwa pada hari ke-7 terdapat beda nyata antaraBacillus P4I1 RifR, kombinasi probiotik (Bacillus P4I1 RifR+Bacillus P4I2 RifR) dan Bacillus
P4I2 RifR dengan kontrol positif (K+). Penurunan nilai eritrosit ini diduga karena adanya produk ekstraseluler yang dihasilkan oleh A. hydrophila antara lain aerolysin dan hemolisin (Yousr et al. 2007). Produk ini berkaitan dengan tingkat virulensi dari bakteri tersebut. Aerolysin dan hemolisin menunjukkan aktivitas hemolisis secara in vitromenggunakan media agar darah (Blood agar) (Chirila et al. 2008). Toksin ini bekerja membunuh sel dengan membentuk struktur heptametrik yang dapat melubangi membran plasma (Iacovache et al. 2006, Knappet al.2010).
Setelah terjadi penurunan eritrosit pada hari ke-7, selanjutnya jumlah eritrosit berangsur-angsur naik sampai akhir penelitian. Kenaikan jumlah eritrosit mencapai nilai tertinggi pada akhir penelitian dan terjadi pada perlakuan probiotik
Bacillus P4I2 RifR yaitu sebesar 2.291±0.03 x106 sel/mL; kemudian disusul dengan perlakuan probiotik Bacillus P4I1 RifR (1.862±0.02 x106 sel/mL); kombinasi probiotik (Bacillus P4I1 RifR+Bacillus P4I2 RifR) (1.819±0.00 x106 sel/mL); K+ (1.513±0.06 x106 sel/mL) dan K- (1.513±0.08 x106 sel/mL). Peningkatan jumlah eritrosit ini diduga karena efek pemberian probiotik. Hasil penelitian Sharma et al. (2013) menyebutkan bahwa pemberian probiotik komersial dapat meningkatkan total eritrosit pada ikanCirrhinus mrigalaHam.
Total Leukosit
Respon imun pada ikan teleostei terdiri dari respon imun non spesifik dan respon imun spesifik. Respon imun tersebut diperankan oleh sel darah putih atau leukosit yang terdiri dari limfosit untuk pertahanan spesifik serta monosit dan granulosit untuk pertahanan non spesifik (Magnadottir 2010). Leukosit membantu membersihkan tubuh dari benda asing, termasuk invasi patogen melalui sistem tanggap kebal. Ikan yang sakit akan menghasilkan banyak leukosit untuk memfagosit bakteri dan mensintesis antibodi (Uribe et al. 2011). Hasil pengukuran nilai total leukosit dapat dilihat pada Gambar 7.
dengan masing-masing nilai untuk probiotik Bacillus P4I2 RifR, kombinasi probiotik (Bacillus P4I1 RifR +Bacillus P4I2 RifR), probiotik Bacillus P4I1 RifR, kontrol positif (K+) serta kontrol negatif (K-) adalah 9.12±0.01 x105 sel/mL; 8.709±0.03 x105 sel/mL; 7.943±0.02 x105 sel/mL; 6.918±0.07 x105 sel/mL; serta 6.309±0.02 x105 sel/mL. Hasil uji Duncan menunjukkan berbeda nyata antara perlakuan probiotik Bacillus P4I2 RifR dan kombinasi probiotik (Bacillus P4I1 RifR+Bacillus P4I2 RifR) dengan kontrol positif (K+). Hal ini menunjukkan bahwa probiotikBacillus P4I2 RifR lebih cepat merangsang sistem imun ikan uji dibandingkan probiotik Bacillus P4I1 RifR. Peningkatan jumlah leukosit pada perlakuan probiotikBacillus P4I2 RifR, kombinasi probiotik (BacillusP4I1 RifR+
BacillusP4I2 RifR) dan BacillusP4I1 RifR diduga karena populasi A. hydrophila
dalam air meningkat sehingga merangsang sistem imun ikan. Picchietti et al.
(2009) menyatakan bahwa sistem imun pada larva Dicentrarchus labrax dapat distimulasi dengan pemberian probiotik Lactobacillus delbrueckii dengan merangsang perpindahan sel T danAcidophilic Granulocytes (AGs) pada lapisan lendir. Selanjutnya Balaji et al. (2012) menyatakan bahwa probiotik L. acidophilusdan B. subtilis dapat meningkatkan total leukosit ikan mas (Cyprinus carpio) setelah diuji tantang denganA. hydrophila.
Ket: Huruf yang berbeda pada pola yang sama menunjukkan berbeda nyata (p<0.05)
Gambar 7 Total leukosit darah ikan lele dumbo pada pada perlakuan probiotik
Bacillus P4I1 RifR, Bacillus P4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol
Nilai leukosit mengalami penurunan mulai hari ke-21 sampai akhir penelitian, namun dari hasil uji Duncan terlihat bahwa perlakuan probiotik
Bacillus P4I2 RifR (7.244±0.02 x105 sel/mL) dan kombinasi probiotik (Bacillus
P4I1 RifR+Bacillus P4I2 RifR) (7.413±0.05 x105 sel/mL) berbeda nyata dengan perlakuan kontrol positif (K+) yaitu sebesar 5.888±0.05 x105 sel/mL. Hal ini menunjukkan bahwa kondisi sistem imun ikan sudah kembali normal karena populasiA. hydrophiladalam media pemeliharaan sudah terkontrol.
Hemoglobin
Bonilla-Rodriguez 2007). Kadar hemoglobin selama penelitian ditampilkan pada Gambar 8.
Nilai hemoglobin pada awal perlakuan menunjukkan nilai yang sama untuk semua perlakuan yaitu sebesar 6.86±0.00 g%. Penurunan nilai hemoglobin pada semua perlakuan terjadi pada hari ke-7. Hasil uji Duncan menunjukkan terdapat beda nyata antara perlakuan probiotik Bacillus P4I2 RifR, probiotik
BacillusP4I1 RifR, kombinasi probiotik (BacillusP4I1 RifR +BacillusP4I2 RifR), kontrol negatif (K-) dan kontrol positif (K+). Nilai masing-masing perlakuan adalah sebesar 6.5±1.3 g%; 5.3±0.8 g%; 5.31±1.5 g%; 6.9±0.7 g%; 5.1±0.9 g%. Penurunan nilai hemoglobin ini diduga disebabkan oleh infeksi A. hydrophila
karena toksin yang dihasilkan. Mohapatra dan Swain (2008) menyebutkan bahwa toksin yang dihasilkan oleh A. hydrophila dapat menyebabkan sel darah merah menjadi lisis dan pendarahan pada kulit serta organ internal ikan. Selanjutnya Saputra et al. (2013) menambahkan bahwa kadar hemoglobin berbanding lurus dengan jumlah eritrosit, semakin tinggi kadar hemoglobin semakin tinggi pula jumlah eritrosit.
Ket: Huruf yang berbeda pada pola yang sama menunjukkan berbeda nyata (p<0.05)
Gambar 8 Kadar hemoglobin darah ikan lele dumbo pada pada perlakuan probiotik Bacillus P4I1 RifR,Bacillus P4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol
oligosaccharide(GOS) danMannan-oligosaccharide(MOS) dapat meningkatkan kadar hemoglobin ikanChanna striatayang diuji tantang denganA. hydrophila.
Hematokrit
Pemeriksaan hematokrit bertujuan untuk mengetahui kondisi kesehatan ikan, yaitu dengan melihat persentase kandungan volume sel eritrosit dalam darah (Alamandaet al.2007). Hasil penghitungan hematokrit ditampilkan pada Gambar 9.
Jumlah hematokrit pada awal penelitian memberikan nilai yang sama pada semua perlakuan yaitu sebesar 24.62±0.0%. Penurunan hematokrit terjadi pada hari ke-7, dan hasil uji Duncan menunjukkan terjadi beda nyata antara perlakuan probiotik Bacillus P4I1 RifR, probiotik Bacillus P4I2 RifR, kombinasi probiotik (Bacillus P4I1 RifR+Bacillus P4I2 RifR), kontrol negatif (K-) dan kontrol positif (K+). Penurunan nilai hematokrit pada hari ke-7 diduga disebabkan karena infeksi
A. hydrophila yang mampu melisiskan sel-sel darah merah. Penurunan ini juga ditunjukkan oleh hasil pengukuran parameter total eritrosit mengingat keduanya saling berkaitan. Alamanda et al. (2007) menyatakan bahwa jumlah eritrosit meningkat seiring dengan meningkatnya nilai hematokrit.
Ket: Huruf yang berbeda pada pola yang sama menunjukkan berbeda nyata (p<0.05)
Gambar 9 Kadar hematokrit darah ikan lele dumbo pada pada perlakuan probiotik
Bacillus P4I1 RifR, Bacillus P4I2 RifR, Kom (Bacillus P4I1 RifR+BacillusP4I2 RifR) dan kontrol
hematokrit menunjukkan kondisi kesehatan ikan, apabila kandungan hematokrit rendah menunjukkan ikan mengalami anemia (Alamanda et al. 2007). Peningkatan nilai hematokrit ini diduga karena efek dari pemberian probiotik. Hal ini sesuai dengan hasil penelitian Mocanu et al. (2010) yang menyatakan bahwa probiotik dari jenis B. licheniformis dan B. subtilis dapat meningkatkan nilai hematokrit ikan Rainbow Trout (Oncorhynchus mykissWalbaum).
Diferensial Leukosit
Parameter diferensial leukosit yang diamati pada penelitian ini meliputi monosit, limfosit, serta neutrofil. Nilai yang diperoleh relatif bervariasi pada setiap perlakuan.
Monosit
Monosit merupakan sel leukosit berbentuk oval dengan inti sel yang berbentuk oval atau seperti jantung. Sel monosit memiliki kemampuan menembus dinding pembuluh darah kapiler dan masuk ke dalam jaringan dan berdiferensiasi menjadi sel makrofag (Uribe et al. 2012). Hasil dari perhitungan monosit ditampilkan pada Gambar 10.
Ket: : Huruf yang berbeda pada pola yang sama menunjukkan berbeda nyata (p<0.05)
Gambar 10 Persentase monosit darah ikan lele dumbo pada pada perlakuan probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (BacillusP4I1 RifR+BacillusP4I2 RifR) dan kontrol
Monosit pada pengambilan sampel awal menunjukkan nilai yang sama pada semua perlakuan yaitu 6.00±0.00% kemudian mengalami peningkatan tertinggi pada hari ke-7, dan menurun secara perlahan sampai akhir penelitian. Berdasarkan hasil uji Duncan, terdapat beda nyata antara perlakuan probiotik
Bacillus P4I1 RifR, probiotik Bacillus P4I2 RifR, kombinasi probiotik (Bacillus
P4I1 RifR+Bacillus P4I2 RifR) dengan kontrol positif (K+) dan kontrol negatif (K-) pada hari ke-7, dan tidak terdapat perbedaan nyata pada akhir penelitian.
memfagositosis sisa–sisa jaringan dan penyebab penyakit (Gomezet al.2013). Penurunan jumlah monosit terjadi mulai hari ke-14 diduga karena sel monosit mulai keluar dari sirkulasi darah, selanjutnya masuk ke jaringan yang terinfeksi dengan berdiferensiasi menjadi makrofag yang berperan dalam memfagosit dan menyajikan antigen kepada sel limfosit. Hal ini sesuai dengan pernyataan Esteban (2012), yaitu pada saat terjadi infeksi oleh benda asing, maka monosit akan bergerak cepat meninggalkan pembuluh darah menuju daerah yang terinfeksi untuk melakukan fagositosis. Hasil penelitian Standen et al. (2013) menyatakan bahwa terjadi peningkatan persentase monosit pada ikan
Oreochromis niloticussetelah pemberian probiotikPediococcus acidilactici.
Limfosit
Limfosit terdiri dari sel limfosit B dan sel limfosit T yang keduanya berperan untuk pertahanan spesifik dengan pembentukan antibodi dan sel memori (Scapigliati 2013). Hasil perhitungan limfosit ditampilkan pada Gambar 11.
Ket: Huruf yang berbeda pada pola yang sama menunjukkan berbeda nyata (p<0.05)
Gambar 11 Persentase limfosit darah ikan lele dumbo pada pada perlakuan probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (BacillusP4I1 RifR+BacillusP4I2 RifR) dan kontrol
Nilai limfosit pada pengamatan awal menunjukkan nilai yang sama pada semua perlakuan yaitu sebesar 77.00±0.00%. Penurunan mulai terjadi pada hari ke-7, hasil uji Duncan menunjukkan beda nyata antara perlakuan probiotik
Bacillus P4I1 RifR, probiotik Bacillus P4I2 RifR, kombinasi probiotik (Bacillus
P4I1 RifR+Bacillus P4I2 RifR), kontrol negatif (K-) dengan kontrol positif (K+). Penurunan limfosit diduga terjadi karena tubuh ikan memberi respon tanggap kebal terhadap adanya infeksi A. hydrophila. Lazado dan Caipang (2014) menyatakan bahwa penurunan jumlah sel limfosit dipengaruhi adanya antigen asing dan infeksi patogen yang menyebabkan jumlah limfosit menurun. Selanjutnya terjadi kenaikan perlahan hingga akhir penelitian dengan nilai masing-masing 77.00±1.82% (kombinasi probiotik Bacillus P4I1 RifR dan
(probiotik Bacillus P4I1 Rif ); 76.50±0.54% (kontrol negatif) dan 71.00±3.13% (kontrol positif).
Limfosit tidak dapat melakukan proses fagositosis, akan tetapi mempunyai fungsi yang sangat penting dalam mekanisme pertahanan tubuh atau imunitas spesifik terhadap benda asing (Zhu et al. 2013). Pernyataan ini merupakan penjelasan dari data pada berbagai perlakuan, bahwa nilai terendah terjadi setelah pemberian A. hydrophiladalam air. Diduga pada kondisi ini yang bekerja secara dominan adalah monosit dan neutrofil sehingga diferensiasi leukosit yang terjadi didominasi oleh monosit dan neutrofil sehingga jumlah limfosit relaitif berkurang. Mulai hari ke-14 sampai akhir penelitian dianggap sebagai tahap pemulihan yang terlihat dengan kenaikan nilai limfosit, karena pada tahap tersebut sel mulai membentuk antibodi. Magnadottir (2010) menyatakan bahwa respon imun spesifik yang diperankan oleh limfosit bekerja lebih lambat dibandingkan respon imun non spesifik yang diperankan oleh makrofag. Hasil penelitian Khalil et al.
(2011) menyatakan bahwa penambahan probiotikSaccharomyces cerevisiaedapat meningkatkan persentase limfosit dari ikan nila (Oreochromis niloticus) setelah diinfeksi olehA. hydrophila.
Neutrofil
Neutrofil merupakan sel fagosit sistem polimorfonuklear yaitu sel yang bekerja cepat dalam melakukan fagosit tetapi tidak mampu bertahan lama. Sel neutrofil berbentuk bulat dengan sitoplasma bergranula halus dan ditengahnya terdapat nukleus (Uribeet al.2011). Hasil pengukuran neutrofil ditampilkan pada Gambar 12.
Ket: Huruf yang berbeda pada pola yang sama menunjukkan berbeda nyata (p<0.05)
Gambar 12 Persentase neutrofil darah ikan lele dumbo pada pada perlakuan probiotikBacillusP4I1 RifR,BacillusP4I2 RifR, Kom (BacillusP4I1 RifR+BacillusP4I2 RifR) dan kontrol
Nilai neutrofil pada awal penelitian menunjukkan nilai yang sama yaitu 17,00±0,00%. Peningkatan nilai neutrofil terjadi pada hari ke-7, dan hasil uji Duncan menunjukkan beda nyata antara perlakuan probiotik Bacillus P4I1 RifR, probiotik Bacillus P4I2 RifR, kombinasi probiotik (Bacillus P4I1 RifR+Bacillus