PENGUJIAN IN VIVO TERHADAP EFIKASI FORMULA
JAMU ANTIDIABETES DAN ANALISIS SIDIK JARI
KROMATOGRAFINYA
HANIFULLAH HABIBIE
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Pengujian In Vivo Terhadap Efikasi Formula Jamu Antidiabetes dan Analisis Sidik Jari Kromatografinya adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
HANIFULLAH HABIBIE. Pengujian In Vivo Terhadap Efikasi Formula Jamu Antidiabetes dan Analisis Sidik Jari Kromatografinya. Dibimbing oleh LATIFAH K DARUSMAN dan RUDI HERYANTO.
Pengujian in vivo khasiat suatu formula jamu penting dilakukan sebelum dikonsumsi oleh manusia. Tujuan penelitian ini adalah membuktikan khasiat antidiabetes dari formula jamu biofarmaka secara in vivo dan menentukan profil sidik jari formula tersebut dengan analisis kromatografi. Uji in vivo menggunakan mencit yang diinduksi diabetes dengan streptozotosin. Efektivitas formula jamu dalam menurunkan kadar gula darah mencit dibandingkan dengan kontrol positif metformin. Berikutnya, metode kromatografi lapis tipis (KLT) dan kromatografi cair kinerja tinggi (KCKT) digunakan untuk menghasilkan profil sidik jari formula jamu. Hasil penelitian menunjukkan bahwa formula jamu biofarmaka dapat menurunkan kadar gula darah mencit diabetes selama perlakuan. Hasil penurunan ini tidak berbeda nyata dengan kontrol positif. Kromatogram KLT formula jamu yang dielusi dengan toluena:aseton:asam asetat menunjukkan 5 pita yang terpisah dengan baik. Adapun analisis KCKT dengan elusi gradien fase terbalik dan fase gerak air:asetonitril dapat menghasilkan pola kromatogram yang dapat berfungsi sebagai sidik jari formula jamu.
Kata kunci: analisis sidik jari, jamu antidiabetes, metformin, streptozotosin
ABSTRACT
HANIFULLAH HABIBIE. In Vivo Anti-diabetic Assay of Jamu Formula and Its Chromatographic Fingerprint Analysis. Supervised by LATIFAH K DARUSMAN and RUDI HERYANTO.
In vivo assay of a jamu formula's efficacy is necessary before it is consumed by human. The aims of this study were proving the efficacy of biopharmaca anti-diabetic jamu formula by in vivo assay and determine the formula fingerprint profiles with chromatographic analysis. In vivo assay was done using mice which were diabetic-induced by streptozotocin. The effectiveness of jamu formulas in reducing the mice blood sugar level was compared with metforminas a positive control. The fingerprint profiles of jamu formula were further generated by thin layer chromatography (TLC) and high performance liquid chromatography (HPLC) methods. The results showed that the formula of biopharmaca jamu could reduce the blood sugar levels during treatment. The result of this reduction was not significantly different to that of the positive control. TLC chromatogram jamu formula eluted using toluene:acetone:acetic acid showed 5 well-separated spots. The HPLC analysis with phase-reversed gradient elution and mobile phase of water:acetonitrile gave the chromatogram patterns which can serve as fingerprints of jamu formulas.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
PENGUJIAN IN VIVO TERHADAP EFIKASI FORMULA
JAMU ANTIDIABETES DAN ANALISIS SIDIK JARI
KROMATOGRAFINYA
HANIFULLAH HABIBIE
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Pengujian In Vivo Terhadap Efikasi Formula Jamu Antidiabetes dan Analisis Sidik Jari Kromatografinya
Nama : Hanifullah Habibie NIM : G44100098
Disetujui oleh
Prof Dr Ir Latifah K Darusman, MS Pembimbing I
Rudi Heryanto, SSi MSi Pembimbing II
Diketahui oleh
Prof Dr Dra Purwantiningsih Sugita, MS Ketua Departemen
PRAKATA
Puji dan syukur kepada Allah SWT atas limpahan rahmat dan nikmat-Nya sehingga penulis dapat menyelesaikan karya ilmiah skripsi dengan judul Pengujian In Vivo Terhadap Efikasi Formula Jamu Antidiabetes dan Analisis Sidik Jari Kromatografinya.
Penulis mengucapkan terima kasih banyak kepada semua pihak yang telah membantu dan memberikan bimbingan kepada penulis selama kegiatan penelitian dan penulisan skripsi. Secara khusus kepada Ibu Prof Dr Ir Latifah K Darusman, MS dan Bapak Rudi Heryanto, SSi MSi selaku pembimbing. Selain itu, penghargaan penulis sampaikan kepada drh Aidell, drh Dian, dan Pak Mulyadi yang telah membantu selama pengujian in vivo; Mas Antonio, Mbak Laela, dan Mas Endi yang membantu teknis saat analisis KLT dan KCKT. Ungkapan terima kasih juga disampaikan kepada Unit Kandang Hewan Percobaan Pusat Studi Biofarmaka IPB (UKHP-PSB IPB) yang memberikan izin bagi penulis untuk menggunakan fasilitas penelitian di sana.
Penulis juga menyampaikan terima kasih kepada orang tua, keluarga dan para sahabat yang telah memberikan dukungan moral dan materil selama kegiatan penelitian tugas akhir. Ucapan terima kasih juga untuk CSR PT Adaro Indonesia yang selama ini memberikan dukungan finansial dan motivasi selama menjalani kegiatan akademik di IPB. Semoga karya ilmiah ini dapat memberikan manfaat sebesar-besarnya.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Ruang Lingkup Penelitian 2
METODE 2
Alat dan Bahan 2
Prosedur Penelitian 3
HASIL DAN PEMBAHASAN 7
Induksi Hiperglikemia Hewan Uji Menggunakan STZ 7
Profil Kadar Gula Darah Mencit Pada Masa Perlakuan 8 Analisis Sidik Jari KLT Ekstrak Jamu Antidiabetes 9 Analisis Sidik Jari KCKT Ekstrak Jamu Antidiabetes 13
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 20
DAFTAR TABEL
1. Rerata kadar gula darah hewan uji praperlakuan dan pada masa
perlakuan 9
2. Jumlah pita dan nilai Rf pita hasil pemisahan komponen ekstrak jamu
antidiabetes menggunakan KLT pada fase gerak terbaik 12
3. Parameter kondisi analisis KCKT terhadap ekstrak jamu antidiabetes 14
DAFTAR GAMBAR
1. Hipotesis struktur komposisi jamu (Pusat Studi Biofarmaka) 1
2. Struktur kimia streptozotocin (Elsner 2000) 7
3. Profil sidik jari KLT ekstrak jamu dan densitogram hasil pengolahan
perangkat lunak ImageJ 11
4. Profil KLT ekstrak jamu antidiabetes yang dielusi menggunakan fase
gerak komposisi 1-4 11
5. Profil KLT ekstrak jamu antidiabetes yang dielusi menggunakan fase
gerak tunggal 12
6. Profil sidik jari KLT ekstrak jamu dan densitogram hasil pengolahan
perangkat lunak ImageJ pada fase gerak tunggal 13
7. Kromatogram KCKT hasil elusi menggunakan kondisi 2 15
DAFTAR LAMPIRAN
1. Bagan alir penelitian (Pengujian in vivo) 20
2. Bagan alir penelitian (lanjutan) 21
3. Kadar gula darah mencit praperlakuan dan selama masa perlakuan 22 4. Uji ANOVA dan uji berganda Duncan terhadap kadar gula darah
mencit praperlakuan 23
5. Kadar gula darah mencit yang digunakan dalam analisis statistika 23 6. Profil rerata kadar gula darah mencit selama masa perlakuan 24 7. Uji berganda Duncan terhadap kadar gula darah mencit setelah masa
perlakuan 24
PENDAHULUAN
Latar Belakang
Diabetes Mellitus (DM) merupakan penyakit yang disebabkan terhambatnya sekresi insulin atau penurunan sensitivitas insulin terhadap jaringan target untuk menurunkan kadar gula darah. Penyakit ini dicirikan oleh gejala hiperglikemia yang muncul akibat defisiensi insulin pada diabetes tipe 1 (T1D) atau resistansi insulin pada diabetes tipe 2 (T2D) (Salek et al. 2007; Ugarte et al. 2012). Menurut laporan WHO (World Health Organization), Indonesia menempati urutan ke-4 sebagai negara dengan penderita diabetes terbesar di dunia setelah India, China, dan Amerika Serikat. Pada tahun 2000, jumlah penderita DM di Indonesia mencapai 8.4 juta orang dan diprediksi akan meningkat menjadi 21.3 juta penderita pada tahun 2030 (Wild et al. 2004). Penyakit diabetes tidak dapat disembuhkan secara total. Penanganan medis yang dilakukan hanya untuk menjaga kadar glukosa darah dapat dipertahankan pada kondisi normal (80-120 mg/dl) (Bailey & Day 2003). Selama ini penanganan diabetes umumnya menggunakan obat-obatan sintetik oral seperti rosiglitazone (nama dagang: Avandia), Metformin (nama dagang: Glucophage), sulfunilurea, glibenklamid, akarbosa (Glucobay), Actos, dan lain-lain. Namun penggunaan obat sintetik ini menimbulkan kekhawatiran akan efek samping yang dapat ditimbulkannya. Misalnya penggunaan rosiglitazone yang diduga ikut berpengaruh pada peningkatan risiko serangan jantung (Nissen & Wolski 2007) dan konsumsi metformin yang berefek samping diare, sakit perut, serta pusing (Rayfield & Valentine 2006). Hal ini mendorong dilakukannya penelitian-penelitian tentang potensi penggunaan obat alami (herbal) sebagai antidiabetes.
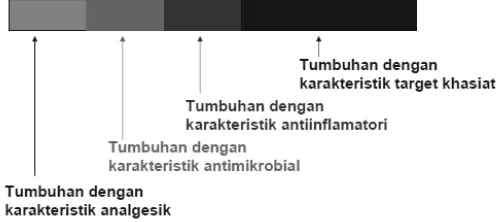
Salah satu metode pengobatan berbasis tanaman herbal adalah jamu. Jamu merupakan jenis pengobatan herbal yang berasal dari budaya Indonesia. Menurut hipotesis Pusat Studi Biofarmaka (2011) dan penelitian Afendi et al. (2010), struktur komposisi jamu terbagi dalam 4 fraksi yang menentukan khasiat atau efikasinya (Gambar 1). Struktur tersebut terdiri atas 1 tanaman utama sebagai penentu khasiat dan 3 tanaman pendukung dengan aktivitas farmakologis antiinflamasi, antimikroba, dan analgesik. Ketiga aktivitas farmakologis tanaman pendukung bersifat tetap sedangkan tanaman utama bersifat spesifik dan dinamis tergantung target khasiatnya. Pola struktur jamu ini didasari oleh penelitian Afendi et al. (2012) yang menggunakan 5310 formula jamu dari 550 jenis tanaman dengan pendekatan statistik-bioinformatika dan dikompilasikan dalam
2
database KNApSAcK. Namun database ini masih dibangun berdasarkan pendekatan teoritis sehingga dibutuhkan pengujian in vitro dan in vivo untuk membuktikan kesahihannya. Beberapa peneliti seperti Rohmawati (2008), Aziza (2012), dan Julianti (2012) telah berupaya mengkaji potensi antidiabetes secara in vivo menggunakan ekstrak tanaman tunggal. Penelitian yang dilakukan oleh Nurishmaya (2014) berupaya lebih jauh mengkaji aktivitas antidiabetes ini berdasarkan hipotesis struktur jamu dan database KNApSAcK. Hasilnya adalah formula jamu yang terdiri atas kombinasi 4 tanaman sebagai penyusun formula jamu antidiabetes dan diujikan pada ikan zebra (Danio rerio) sebagai hewan model. Formula jamu tersebut diprediksi memiliki aktivitas farmakologis hipoglikemik yang dapat menurunkan kadar gula darah ikan zebra.
Pada penelitian ini efek jamu antidiabetes diujikan kepada mencit (Mus musculus) jantan dewasa dan dilakukan analisis sidik jari ekstrak jamu tersebut dengan Kromatografi Lapis Tipis (KLT) serta Kromatografi Cair Kinerja Tinggi (KCKT). Pengujian in vivo menggunakan mencit sebagai hewan uji lebih diakui dalam dunia medis. Hal ini disebabkan mencit mampu merepresentasikan dengan baik model sistematika asupan makanan dan metabolisme nutrisi tubuh manusia (Sutardi 2010). Analisis sidik jari KLT dan KCKT ekstrak jamu dilakukan untuk mendapatkan parameter yang menghasilkan pola sidik jari terbaik sehingga dapat digunakan dalam kendali mutu jamu antidiabetes.
Tujuan Penelitian
Penelitian ini bertujuan membuktikan khasiat antidiabetes dari formula jamu biofarmaka secara in vivo dan menentukan profil sidik jari formula tersebut dengan analisis kromatografi.
Ruang Lingkup Penelitian
3 Reprostar 3, dan seperangkat alat gelas. Bahan-bahan yang digunakan adalah mencit jantan dewasa yang diperoleh dari BPOM RI, streptozotocin (STZ) dari Sigma Aldrich, obat diabetes Glucophage, daun sembung (Blumea balsamifera), batang brotowali (Tinospora crispa), rimpang jahe (Zingiber officinale), daun pare (Momordica charantia), akuades, pakan standar mencit, dan kain blacu.
Prosedur Penelitian
Penelitian akan dilakukan dalam beberapa tahap yaitu preparasi ekstrak jamu, pembuatan pakan jamu dan obat, preparasi hewan uji, pengujian formula jamu terhadap hewan uji, pemantauan kadar gula darah hewan uji, analisis sidik jari ekstrak jamu dengan KLT dan KCKT, dan evaluasi statistik kadar gula darah hewan uji.
Preparasi Ekstrak Jamu Antidiabetes
Jamu antidiabetes dibuat berdasarkan salah satu formula terbaik yang dihasilkan dari penelitian Nurishmaya (2014). Ramuan ini terdiri atas daun pare (Momordica charantia), daun sembung (Blumea balsamifera), rimpang jahe (Zingiber officinale), dan batang brotowali (Tinospora crispa). Tanaman brotowali berperan sebagai tanaman utama yang memiliki aktivitas farmakologis hipoglikemik, sedangkan ketiga tanaman lainnya sebagai tanaman pendukung pada ramuan jamu sebagaimana hipotesis Pusat Studi Biofarmaka (2011).
Simplisia tanaman terpilih diperoleh dari Kebun Percobaan Biofarmaka IPB dan Kebun Balittro Bogor. Sampel dipotong kecil-kecil dan dikeringkan di oven. Setelah itu, sampel digiling hingga berbentuk serbuk halus. Serbuk tanaman tersebut masing-masing ditimbang dan dicampurkan sesuai komposisi jamu sehingga diperoleh bobot total 400 gram. Setelah itu, setiap campuran dimasukkan ke dalam gelas piala lalu ditambahkan akuades 2800 mL dan dididihkan selama 1 jam atau hingga pelarut tinggal setengahnya. Ekstraksi dilakukan dengan teknik penggodokan tanpa refluks. Hal ini dianalogikan seperti proses pembuatan jamu gendong tradisional yang umumnya menggunakan metode perebusan. Selanjutnya jamu disaring menggunakan kain blacu untuk memisahkan filtrat dengan ampas. Ampas diekstraksi kembali hingga 2 kali ulangan. Proses ini diulangi hingga 5 batch ekstraksi. Filtrat jamu dikumpulkan lalu dipekatkan menggunakan vacuum evaporator, sedangkan ampas dibuang. Ekstrak kering akan digunakan untuk pembuatan pakan jamu.
Pemeliharaan dan adaptasi hewan uji (modifikasi Permana 2013)
4
tidak diberi jamu dan obat; (4) (N): mencit yang tidak diinduksi diabetes dan diberikan pakan standar.
Mencit yang dipergunakan untuk perlakuan sebanyak 32 ekor (n=8/kelompok). Kriteria hewan uji yang digunakan adalah mencit jantan ±2 bulan dengan bobot 20-40 g yang ditempatkan di dalam kandang pada lingkungan Unit Kandang Hewan Percobaan Pusat Studi Biofarmaka IPB dengan temperatur dijaga pada kisaran 22-26 °C dan pencahayaan 10:14 jam (terang:gelap). Pemilihan mencit jantan didasarkan pada protokol Wu & Huan (2008) yang menyatakan bahwa mencit betina kurang sensitif terhadap induksi hiperglikemia oleh STZ. Jumlah hewan uji didasari oleh rumus Federer (Federer 1991) yang menyaratkan jumlah hewan uji minimal 6 ekor jika terdapat 4 kelompok perlakuan. Penggunaan hewan uji untuk masing-masing kelompok dilebihkan 2 ekor untuk mengantisipasi kematian atau kondisi di luar kendali selama masa
Induksi hiperglikemia pada mencit menggunakan metode injeksi intraperitoneal dengan dosis rendah berulang STZ (streptozotocin) sebanyak 40 mg/kg bobot tubuh. Sebelum dilakukan induksi dengan streptozotocin (STZ), semua mencit dipuasakan selama minimal 4 jam dan air minum tetap diberikan seperti biasa. Larutan buffer natrium sitrat 50 mM (pH 4.5) disiapkan. Kemudian 10 mg STZ ditimbang dalam tabung Eppendorf 1.5 ml dan ditutup dengan aluminium foil. STZ dilarutkan dengan larutan buffer natrium sitrat 50 mM (pH 4.5) sampai mencapai konsentrasi akhir 10 mg/ml. Larutan STZ harus disiapkan segar untuk setiap injeksi dalam waktu kurang dari 5 menit.
Induksi mencit dengan STZ dilakukan secara intraperitoneal dengan menggunakan syringe 1 ml dan jarum 26-G dosis 40 mg/kg untuk tiap ekor mencit. Buffer sitrat (pH 4.5) disuntikkan dengan volume yang sama secara intraperitoneal untuk kelompok normal. Mencit dikembalikan ke kandang kemudian diberi pakan standar dan larutan sukrosa 10%. Prosedur ini dilakukan selama 5 hari berturut-turut. Setelah hari ke-6, larutan sukrosa yang diberikan diganti menjadi air biasa.
5 ditempelkan pada glucose strip yang akan diserap secara otomatis, kemudian dibaca pada alat ukur GlucoDr meter.
Pembuatan Pakan Jamu dan Pakan Obat
Pakan jamu yang dibuat hanya untuk hewan uji kelompok perlakuan. Nisbah bobot pakan:ekstrak jamu kering adalah 1:0.6 berdasarkan formula penelitian Nurishmaya (2014). Sebanyak 2.5 g pakan kering halus dimasukan ke dalam wadah plastik lalu ditambahkan 1.5 g ekstrak jamu. Keduanya dicampurkan hingga homogen lalu ditambahkan sedikit akuades agar adonan pakan mudah dicetak. Jumlah tersebut digunakan untuk pakan 1 ekor mencit per hari. Pakan jamu dibuat setiap hari pada masa perlakuan untuk menghindari kerusakan akibat mikroorganisme.
Pakan obat diberikan kepada hewan uji kelompok kontrol positif. Sebanyak 1.7329 mg obat Glucophage dari golongan metformin buatan Merck ditambahkan pakan kering yang telah dihaluskan hingga bobotnya 4 g. Hal ini didasari oleh Noffritasari (2006) yang menyatakan dosis penggunaan Glucophage untuk mencit adalah 63 mg/kg BB (asumsi: bobot per mencit 27.5 g). Keduanya diaduk hingga merata lalu ditambahkan sedikit akuades agar adonan mudah dicetak. Jumlah tersebut digunakan untuk pakan 1 ekor mencit per hari. Pakan obat juga dibuat setiap hari pada masa perlakuan. Perlakuan pakan sesuai jenis kelompoknya diberikan mulai hari ke-22 sejak induksi hiperglikemia dan dilakukan selama 20 hari.
Pengukuran Kadar Gula Darah Hewan Uji Selama Masa Perlakuan
Sebelum dilakukan pengukuran kadar gula darah, hewan uji dipuasakan minimal 6 jam dan dihangatkan dengan sinar matahari selama ±5 menit agar aliran darah lancar saat pengukuran. Pengambilan darah dilakukan secara cepat mengunakan penusukan jarum melalui pembuluh darah ekor untuk memperoleh 1-2 tetes darah pada uji glukosa darah. Konsentrasi glukosa darah diukur menggunakan strip GlucoDr blood glucose test meter. Sebanyak satu tetes darah ditempelkan pada glucose strip yang akan diserap secara otomatis, kemudian dibaca pada alat ukur GlucoDr meter. Pengukuran kadar gula darah dilakukan setiap minggu sejak hari pertama perlakuan. Pada hari ke-21 masa perlakuan, dilakukan proses nekropsi, sampling darah, dan sampling organ. Tahapan nekropsi dan prosedur pascanekropsi tidak dituliskan karena berada di luar ruang lingkup penelitian ini.
Analisis Sidik Jari Ekstrak Jamu Dengan KLT Dengan Instrumen CAMAG Linomat 5
Ekstrak kering jamu dilarutkan dengan metanol PA sampai diperoleh larutan ekstrak 10 mg/mL. Larutan ekstrak disaring lalu ditotolkan pada pelat KLT GF254
6
dimasukkan ke dalam bejana kromatografi dan dijenuhkan selama 30 menit. Kemudian pelat KLT dimasukkan ke dalam bejana berisi fase gerak tersebut. Elusi dihentikan ketika fase gerak telah mencapai 0.5 cm dari tepi atas pelat KLT. Setelah elusi selesai maka pelat diangkat, dikeringkan dan dideteksi pada instrumen CAMAG Repsrostar 3 yang terintegrasi perangkat lunak WinCATS. Deteksi dilakukan dengan lampu UV 254 nm dan 366 nm lalu foto citra KLT disimpan dalam format .jpg untuk dianalisis dengan bantuan perangkat lunak ImageJ. Pengujian juga dilakukan terhadap ekstrak jamu menggunakan metode yang sama namun fase gerak yang digunakan diganti fase gerak tunggal etanol, toluena, aseton, diklorometana, etil asetat, kloroform, dan n-heksana.
Komposisi 1 : kloroform:etil asetat (1:1) (Yonanda 2011)
Komposisi 2 : toluena:etil asetat (93:7) (Kemenkes RI 2009 dalam Farmakope Herbal Indonesia)
Komposisi 3 : diklorometana:n-heksana (9:1) (Jagessar et al. 2008)
Komposisi 4 : toluena:aseton:asam asetat 2% (1:1:2 tetes) (Kemenkes RI 2009 dalam Farmakope Herbal Indonesia)
Analisis Digital Terhadap Sidik Jari KLT Ekstrak Jamu dengan Perangkat Lunak ImageJ (Dewi 2013 dan Fitrianti 2011)
Perangkat lunak ImageJ dibuka lalu dipilih menu File-Open. Foto citra KLT dalam format .jpg yang sudah didokumentasikan dengan CAMAG Reprostar 3 dipilih. Pengaturan kontras dengan cara memilih menu Image-Adjust lalu Brigthness serta Contrast diatur hingga didapatkan gambar yang jelas. Menu Rectangular diaktifkan dan area gambar KLT target diblok. Kemudian dipilih menu Analyze-Gels-Select First Lane. Menu Analyze-Gels-Plot Lanes dipilih agar menampilkan kurva densitogram yang sesuai dengan gambar pita pada KLT. Hasil pengolahan gambar dengan menggunakan ImageJ dapat menunjukkan data jumlah pita yang terdapat pada pelat KLT. Kemudian dipilih Edit-Copy to System-Paste untuk memindahkan gambar ke program pengolah kata.
Analisis Sidik Jari Ekstrak Jamu dengan KCKT (Modifikasi Prabandari 2012)
Sebanyak 100 mg ekstrak jamu dilarutkan dengan 10 mL etanol PA dan disaring menggunakan syringe dengan filter WHATMAN berpori 0.45 μm. Selanjutnya sampel diinjeksikan ke dalam KCKT (Shimadzu) dengan volume
injeksi 20 μL pada 4 kondisi optimum ekstrak tunggal tanaman penyusun komponen jamu. Kolom KCKT yang digunakan adalah C18 fase terbalik dan detektor yang digunakan adalah PDA (Photo Diode Array). Setelah itu, standar shogaol, gingerol, dan kuersetin diinjeksikan pula pada kondisi yang menghasilkan sidik jari KCKT terbaik.
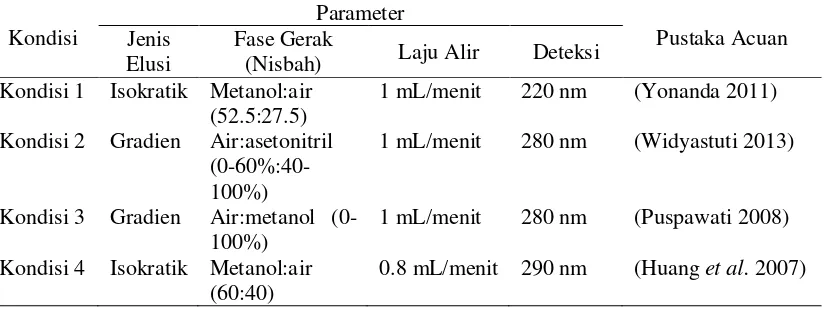
Kondisi 1 : elusi isokratik metanol:air (52.5:27.5), laju alir 1 mL/menit, waktu analisis 50 menit, deteksi pada panjang gelombang 220 nm (Yonanda 2011)
7 Kondisi 3 : elusi gradien air:metanol (0-100%), laju alir 1 mL/menit, waktu
analisis 50 menit, deteksi pada panjang gelombang 280 nm (Puspawati 2008)
Kondisi 4 : elusi isokratik metanol:air (60:40), laju alir 0.8 mL/menit, waktu analisis 50 menit, deteksi pada panjang gelombang 290 nm (Huang et al. 2007)
HASIL DAN PEMBAHASAN
Induksi Hiperglikemia Hewan Uji Menggunakan STZ
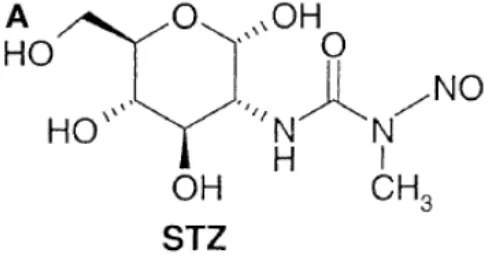
Streptozotocin (STZ) (Gambar 2) merupakan senyawa glukosamina-nitrosourea yang dihasilkan oleh bakteri Streptomyces achromogenes. STZ digunakan sebagai bahan induktor hiperglikemia pada mencit dengan cara merusak DNA sel-β pankreas sehingga mengganggu sekresi insulin. Menurut Zhang et al. (2008), STZ yang diinjeksikan dengan teknik dosis rendah secara berulang dapat menginduksi diabetes tipe 2 (T2D) pada hewan uji. Jenis diabetes T2D ini merupakan jenis yang paling umum diderita oleh manusia. Persentase T2D sudah mencapai 90% dari populasi penderita diabetes untuk kasus di wilayah Amerika Serikat (Julianti 2012). Pada penelitian ini induksi T2D terhadap mencit mengikuti metode induksi diabetes pada hewan model yang ditulis oleh Wu & Huan (2008) dengan dosis 40 mg/kg BB selama 5 hari berturut-turut.
Pemantauan kadar gula darah mencit dilakukan pada hari ke-21 setelah injeksi pertama STZ. Hal ini untuk meyakinkan bahwa telah terjadi hiperglikemia permanen pada mencit akibat injeksi dosis rendah berulang STZ. Menurut Kim (2006) dalam Sutardi (2010), kerusakan sel-β pankreas baru terjadi setelah tiga hari pemberian STZ dan akan meningkat setelah tiga sampai empat minggu. Sehingga pemberian bahan uji dilakukan minimal 21 hari setelah injeksi STZ. Elsner et al. (2002) mengusulkan mekanisme kerja STZ dalam menginisiasi kerusakan DNA dalam sel-sel-β pankreas berdasarkan proses alkilasi DNA. Proses tersebut bersinergi dengan aktivitas senyawa oksigen reaktif yang dihasilkan dari gugus nitrogen oksida (NO) pada STZ sehingga merusak DNA. Kerusakan DNA sel-β pankreas ini mengakibatkan penurunan kuantitas insulin yang dihasilkan dan resistensi insulin yang menimbulkan gejala hiperglikemia.
8
Mencit yang menunjukkan gejala hiperglikemia (kriteria kadar gula darah >150 mg/dL) dibagi secara acak ke dalam tiga kelompok (P, KP, dan KN) dalam jumlah yang sama dan digunakan sebagai hewan uji perlakuan. Jumlah mencit yang berhasil diinduksi hiperglikemia sebanyak 24 ekor sehingga tiap kelompok terdapat 8 ekor mencit. Sebanyak 8 ekor mencit lainnya yang tidak diinjeksi STZ digunakan sebagai hewan uji kelompok normal (N) (Lampiran 3). Uji ANOVA dan berganda Duncan yang dilakukan terhadap kadar gula darah praperlakuan tiap kelompok menunjukkan bahwa kelompok hiperglikemia (terinduksi STZ) yang terdiri atas P, KP, dan KN tidak berbeda nyata satu sama lain. Namun secara signifikan berbeda terhadap kelompok N (tanpa induksi STZ) (Lampiran 4). Hal ini untuk meyakinkan bahwa kondisi awal mencit yang akan digunakan pada perlakuan sudah sesuai rancangan percobaan. Kadar gula darah mencit diabetes praperlakuan kelompok P, KP, dan KN yang lebih tinggi daripada kelompok N akan diamati profil perubahannya selama 3 minggu masa perlakuan.
Profil Kadar Gula Darah Mencit Pada Masa Perlakuan
Pemantauan kadar gula darah mencit setiap minggu menunjukkan fluktuasi yang dinamis pada setiap kelompok hewan uji. Pada kelompok perlakuan yang sama teramati pola kecenderungan perubahan kadar gula darah yang relatif mirip. Pada beberapa individu mencit terjadi perubahan kadar gula darah yang ekstrem sehingga dikategorikan sebagai pencilan (Lampiran 3). Hal ini disebabkan respon individual hewan uji selaku makhluk hidup memiliki preferabilitas atau nafsu makan terhadap pakan yang diberikan tidak sama satu dengan lainnya. Sebab dalam penelitian ini perlakuan terhadap hewan uji dicobakan melalui konsumsi pakan.
Selama masa perlakuan terdapat beberapa hewan uji yang mengalami kematian. Penyebab kematiannya berasal dari beberapa faktor yaitu respon individual, gangguan sistem pencernaan (diketahui dari nekropsi post mortem), dan luka-luka akibat gigitan atau cakaran mencit lainnya. Kematian paling banyak terdapat pada kelompok N yaitu 3 ekor. Berdasarkan pengamatan tingkah laku mencit kelompok N cenderung lebih agresif dan buas terhadap sesamanya dibandingkan mencit dari kelompok-kelompok terinduksi STZ. Sehingga kematian di kelompok lain lebih sedikit daripada kematian di kelompok N. Keberadaan hewan uji yang memiliki pencilan kadar gula darah (berdasarkan uji pencilan menggunakan Minitab) akan mengganggu analisis profil kadar gula darah. Sehingga mencit yang dilibatkan dalam analisis data hanya berjumlah 5 ekor agar dihasilkan data yang kongruen dan representatif terhadap jenis kelompok perlakuan (Lampiran 5).
9 kontrol negatif pada minggu kedua ini. Namun penurunan pada kelompok P relatif lebih landai (tidak drastis seperti kelompok KP yang dapat mengakibatkan hipoglikemia kritis karena penurunan kadar gula dalam jumlah besar terlalu cepat). Setelah minggu ke-3 perlakuan, kelompok P mengalami sedikit kenaikan kadar gula darah namun tidak berbeda nyata terhadap kelompok N dan masih di bawah batas kategori diabetes (150 mg/dL) serta di bawah kelompok KN. Kadar gula darah kelompok KP cenderung tetap setelah minggu ke-3 perlakuan ini. Hal yang menarik salah satunya adalah kecenderungan penurunan kadar gula darah kelompok KN seiring masa perlakuan. Hal ini diduga akibat mekanisme self healing atau regenerasi sel-β pankreas yang sebelumnya mengalami kerusakan oleh STZ (Zhang et al. 2012; Dor et al. 2004). Sebab sejatinya T2D bukan tipe diabetes yang mutlak memerlukan asupan insulin eksternal. Masih terdapat sedikit insulin yang disekresikan meskipun sensitivitasnya berkurang.
Ringkasan hasil uji Duncan rerata kadar gula darah antarkelompok perlakuan disajikan pada Tabel 1 berikut. Kelompok N dijadikan sebagai pembanding kondisi kadar gula normal karena kelompok ini tidak mengalami diabetes. Setelah minggu ke-1 perlakuan, kelompok P menunjukkan penurunan kadar gula darah ke nilai yang tidak berbeda nyata dengan keadaan normal. Namun kelompok KP yang diberi pakan bercampur obat diabetes justru mengalami kenaikan dan berbeda nyata terhadap kelompok N. Kelompok KP baru menunjukkan penurunan setelah minggu ke-2 pemberian obat. Penurunan kadar gula ini terjadi sangat drastis mencapai 100 mg/dL. Kadar gula darah hewan uji kelompok KP dan P mengalami penurunan sehingga tidak berbeda secara signifikan terhadap kelompok normal setelah minggu ke-2 dan ke-3 ekstrak jamu dan obat. Artinya pada minggu ke-2 ekstrak jamu dan obat sebenarnya sudah mulai mampu menurunkan kadar gula darah ke kondisi normal.
Analisis Sidik Jari Kromatografi Lapis Tipis Ekstrak Jamu Antidiabetes dengan Perangkat Lunak ImageJ
Analisis sidik jari merupakan suatu metode untuk menampilkan informasi mengenai senyawa kimia dalam suatu sampel berdasarkan spektrogram, kromatogram, atau grafik lain yang didapatkan dari teknik-teknik analisis. Teknik ini digunakan sebagai metode kendali mutu, metode validasi, dan dapat pula digunakan untuk mengklasifikasikan suatu sampel tanaman. Metode sidik jari digunakan juga untuk mengetahui senyawa penciri dari suatu bahan alam berdasarkan bentuk dan pola kurva atau grafik yang ditunjukkan dari suatu teknik Tabel 1 Rerata kadar gula darah hewan uji praperlakuan dan pada masa perlakuan
Kelompok Kadar gula darah (mg/dL)
Praperlakuan Minggu ke-1 Minggu ke-2 Minggu ke-3 P 224.2±52.6a 195.4±36.6a 95.4±17.7a 147.2±57.9a KP 223.4±27.1a 286.2±49.8b 107.8±26.3a 105.4±20.8a KN 246.4±44.5a 246.8±39.8b 224.0±57.8b 168.2±52.2a
N 133.0±10.0b 156.8±21.4a 133.4±8.4a 108.0±15.4a
Nilai yang disertai dengan huruf superscripts sama tidak berbeda nyata pada α=0.05 (Duncan’s
10
analisis (Shams et al. 2014). Salah satu alat yang paling mudah diaplikasikan untuk analisis sidik jari adalah kromatografi lapis tipis (KLT). Kelebihan metode ini adalah sederhana, selektif, sensitif, cepat, dapat digunakan secara simultan, dan penggunaan pelarut yang relatif sedikit (Liang et al. 2009). Pada penelitiannya, Hess (2007) telah mengembangkan teknik ini menjadi lebih baik untuk menginterpretasikan sidik jari KLT dengan bantuan perangkat lunak digital. Metode yang disebut dengan Digitally Enchanced Thin Layer Chromatography (DE-TLC) ini merupakan perpaduan metode fotografi digital dengan KLT konvensional yang dapat digunakan untuk menganalisis kromatogram secara kuantitatif maupun kualitatif dengan menggunakan bantuan perangkat lunak pengolah gambar misalnya ImageJ. Perangkat lunak ImageJ adalah suatu program pengolah gambar berbasis bahasa pemprograman Java dan dapat diunduh secara legal untuk umum. Program ini dikembangkan oleh Research Service Branch (RSB), Institut Nasional Kesehatan Mental (NIMH), bagian dari Institut Kesehatan Nasional (NH), Batesdha, Maryland, USA (Ferreira & Rasband 2011). Program ini akan mengkonversi pita-pita KLT yang terdeteksi menjadi bentuk densitogram yang sebanding dengan ukuran dan intensitas pita.
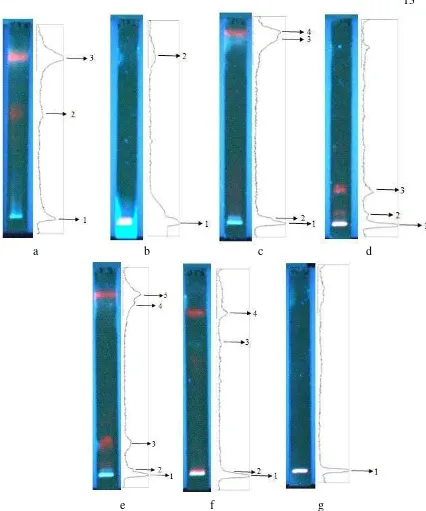
Pada penelitian ini sidik jari ekstrak jamu antidiabetes dianalisis menggunakan 2 pendekatan. Pendekatan pertama berdasarkan komposisi fase gerak optimum pemisahan KLT masing-masing ekstrak tunggal penyusun jamu ini. Sedangkan pendekatan kedua berdasarkan fase gerak tunggal yang memiliki kepolaran beragam. Pada pendekatan pertama, komposisi fase gerak optimum pemisahan ekstrak tanaman brotowali, jahe, sembung, dan pare diperoleh dari literatur sebagaimana komposisi 1-4. Pola pemisahan KLT ekstrak jamu dideteksi pada panjang gelombang 254 dan 366 nm (Gambar 3). Menurut Fernand (2003), penyinaran pada UV 254 nm untuk mendeteksi senyawa golongan alkaloid, flavo- noid, lignan, dan triterpena berdasarkan pemadamannya (quenching). Sedangkan penyinaran pada UV 366 nm untuk mendeteksi senyawa golongan yang sama namun berdasarkan zona pendarnya (fluorescence). Umumnya deteksi menggunakan UV 366 nm menghasilkan pita yang lebih tampak daripada UV 254 nm. Hal ini disebabkan fase diam KLT GF254 yaitu silika gel akan berpendar pada
panjang gelombang ini sehingga pita gelap komponen sampel kurang terlihat. Sebaliknya pada UV 366 nm pita yang berpendar adalah komponen sampel (Oktavia 2011).
11
tinggi puncak kurva densitogram menunjukkan intensitas pendaran yang semakin besar. Pada pita posisi awal penotolan sampel terlihat sangat berpendar karena masih banyak komponen kimia yang belum terpisahkan dan masih menumpuk di posisi ini.
Proses elusi kedua menggunakan pendekatan fase gerak tunggal yang memiliki kepolaran bervariasi. Pemisahan yang dilakukan dengan pelarut tunggal memperlihatkan pita-pita berwarna biru dan merah yang berpendar pada 366 nm. Pita gelap pada pendeteksian menggunakan UV 254 nm lebih sulit untuk diamati karena pendaran fase diam gel silika memudarkan pita komponen sampel (Gambar 5). Pemisahan komponen sampel menunjukkan hasil terbaik untuk pelarut etil asetat. Pada kondisi ini dihasilkan 5 pita yang terpisah cukup baik. Pelarut etil asetat tergolong semipolar dengan indeks kepolaran 4.4 sehingga mampu menarik komponen polar maupun nonpolar yang terdapat dalam sampel. Akibatnya pita pemisahan KLT yang dihasilkan lebih banyak. Penjelasan ini juga
a b
Gambar 3 Profil KLT ekstrak jamu antidiabetes yang dielusi menggunakan fase gerak komposisi 1-4 pada panjang gelombang 254 nm (a) dan 366 nm (b)
a b c d
12
berlaku untuk pelarut aseton dan kloroform yang memiliki indeks kepolaran berturut-turut 5.1 dan 4.1 sehingga menghasilkan pemisahan yang cukup baik (4 pita) (Gambar 6). Pelarut n-heksana memberikan pemisahan yang paling buruk karena hanya menghasilkan satu pita. Hal ini disebabkan sifat n-heksana yang sangat nonpolar (indeks kepolaran 0.1) sehingga komponen-komponen polar pada sampel yang diekstrak dengan pelarut polar air tidak dapat ditarik oleh fase gerak. Pada beberapa pelarut seperti aseton, etil asetat, dan kloroform terlihat bahwa beberapa puncak densitogram masih bertumpang-tindih dan belum terpisah baik satu sama lain. Sehingga sulit untuk diidentifikasi sebagai dua pita kecuali jika pendaran warnanya berbeda pada kromatogram. Perpaduan kromatogram dan densitogram akan mempermudah proses identifikasi pemisahan pita berdasarkan kecocokan antara puncak densitogram dan pendaran pita kromatogram.
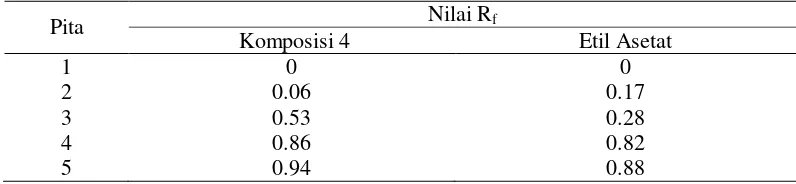
Secara keseluruhan, sidik jari KLT terbaik ekstrak jamu antidiabetes dihasilkan dengan parameter komposisi 4 dengan pendekatan fase gerak optimum dan eluen etil asetat dengan pendekatan fase gerak tunggal. Kedua komposisi ini menghasilkan 5 pita komponen kimia penyusun ekstrak jamu. Fase gerak pada komposisi 4 sedikit lebih unggul karena menghasilkan pita-pita yang lebih terpisah dibandingkan sidik jari jamu yang dielusi menggunakan fase gerak etil asetat. Nilai faktor retensi (Rf) tiap pita yang diperoleh pada kedua kondisi analisis tersebut ditampilkan pada Tabel 2 di bawah ini.
a b c d e f g a b c d e f g
Gambar 5 Profil KLT ekstrak jamu antidiabetes yang dielusi menggunakan fase gerak tunggal etanol (a), toluena (b), aseton (c), diklorometana (d), etil asetat (e), kloroform (f), n-heksana (g) pada panjang gelombang 254 nm dan 366 nm
Tabel 2 Jumlah pita dan nilai Rf pita hasil pemisahan komponen ekstrak jamu antidiabetes menggunakan KLT pada fase gerak terbaik
13
Analisis Sidik Jari Kromatografi Cair Kinerja Tinggi (KCKT) Ekstrak Jamu Antidiabetes
Analisis KCKT dilakukan terhadap ekstrak jamu menggunakan parameter kondisi sebagaimana yang ditampilkan pada Tabel 3. Pemisahan pada kondisi 1, 3, dan 4 menggunakan fase gerak air dan metanol. Sedangkan pada kondisi 2 keberadaan fase gerak metanol digantikan oleh asetonitril. Pemisahan komponen
a b c d
e f g
14
kimia ekstrak jamu pada kondisi 2 dan 4 memberikan hasil yang lebih baik daripada kondisi 1 dan 3 (Lampiran 8). Hal ini ditandai oleh resolusi puncak yang lebih baik karena cukup terpisah satu sama lain. Pola sidik jari KCKT terbaik dari ekstrak jamu antidiabetes terjadi pada kondisi 2 yang mampu menghasilkan puncak relatif lebih banyak dibandingkan kondisi 4. Hasil ini seiring dengan penelitian Badrunanto (2013) yang menyatakan bahwa penggantian metanol dengan asetonitril dapat meningkatkan resolusi dan jumlah puncak pada analisis sidik jari KCKT. Hal ini disebabkan kemampuan asetonitril yang lebih baik dalam berinteraksi dengan komponen-komponen organik yang terkandung dalam sampel. Sehingga fitur-fitur puncak yang dihasilkan menjadi lebih kaya. Selain itu jenis elusi yang digunakan turut berkontribusi pada keterpisahan puncak. Jenis elusi gradien yang digunakan pada kondisi 2 dan 3 lebih baik dibandingkan elusi isokratik kondisi 1 dan 4. Keunggulan ini disebabkan sifat kepolaran fase gerak yang terus berubah seiring waktu sehingga beberapa komponen dengan polaritas berbeda akan lebih terpisahkan satu sama lain. Meskipun pada kondisi 3 kenyataannya terjadi penumpukan puncak di awal proses elusi yang menyebabkan sidik jarinya kurang informatif. Hal ini disebabkan kondisi awal elusi gradien yang menggunakan 100% fase gerak metanol dan 0% air. Akibatnya komponen-komponen kimia yang bersifat polar pada ekstrak jamu akan segera terelusi mencapai detektor pada awal proses pemisahan.
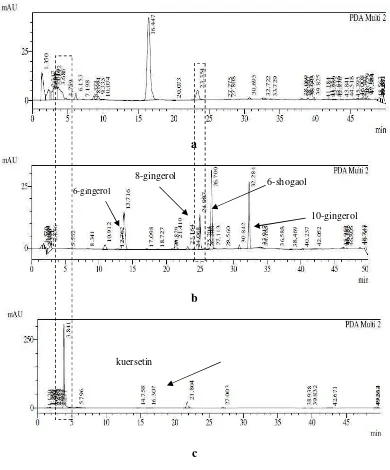
Selanjutnya dilakukan injeksi standar 6,8,10-gingerol, 6-shogaol dan kuersetin pada KCKT dengan kondisi 2 untuk membandingkan waktu retensi komponen ekstrak jamu terhadap waktu retensi senyawa standar. Gingerol dan shogaol merupakan senyawa penanda untuk ekstrak jahe yang menjadi salah satu tanaman penyusun formula jamu antidiabetes ini. Sedangkan kuersetin digunakan sebagai senyawa penanda ekstrak sembung berdasarkan Kemenkes RI (2009) dalam Farmakope Herbal Indonesia. Urutan kepolaran standar meningkat dari 10-gingerol, 6-shogaol, 8-10-gingerol, 6-10-gingerol, dan kuersetin. Komponen yang lebih polar terelusi lebih awal karena jenis elusi yang digunakan adalah fase terbalik. Fase diam pada jenis elusi ini berupa kolom nonpolar dan fase geraknya adalah pelarut polar. Komponen polar kurang berinteraksi dengan fase diam sehingga akan terelusi lebih dahulu. Pada Gambar 7 terlihat bahwa senyawa yang berpotensi sebagai senyawa penciri (marker compound) ekstrak jamu antidiabetes adalah komponen yang memiliki intensitas puncak paling signifikan yaitu dengan
Tabel 3 Parameter kondisi analisis KCKT terhadap ekstrak jamu antidiabetes
Kondisi
15
waktu retensi 16.447 menit. Namun ketika dihubungkan terhadap standar, waktu retensinya cukup jauh terhadap standar gingerol, shogaol, maupun kuersetin. Sehingga senyawa ini dikonfirmasi bukan 6,8,10-gingerol, 6-shogaol, ataupun kuersetin. Keberadaan puncak kromatogram ekstrak jamu yang berdekatan dengan waktu retensi standar terjadi pada posisi 23.354 menit. Senyawa ini dikonfirmasi sebagai 8-gingerol meskipun kurang berpotensi sebagai senyawa penciri karena intensitasnya yang rendah. Pada penelitian sebelumnya, Nurishmaya (2014) memberikan dugaan senyawa yang berperan terhadap aktivitas penurunan kadar gula darah dalam ekstrak jamu antidiabetes ini berasal dari golongan flavonoid yaitu kuersetin dan krisin. Hal itu disebabkan kemampuan flavonoid untuk
a
b
c
Gambar 7 Kromatogram KCKT hasil elusi menggunakan kondisi 2 terhadap ekstrak jamu (a), standar gingerol dan shogaol (b), dan standar kuersetin (c)
6-gingerol
kuersetin
6-shogaol 8-gingerol
16
merangsang sekresi insulin dengan meregenerasi sel-β pankreas yang rusak pada penderita diabetes. Namun keberadaan kuersetin pada sidik jari KCKT kondisi 2 sulit teramati karena bertumpuk dengan puncak-puncak lain yang terelusi dengan waktu retensi yang berdekatan.
SIMPULAN DAN SARAN
Simpulan
Penggunaan larutan STZ mampu menginduksi gejala hiperglikemia pada hewan uji setelah hari ke-21 pascainjeksi pertama dengan teknik dosis rendah berulang. Pemberian ekstrak jamu antidiabetes kepada hewan uji terbukti mampu menurunkan kadar gula darah selama masa perlakuan. Kadar gula darah kelompok jamu secara statistik tidak berbeda nyata dengan kelompok normal yang tidak mengalami diabetes. Bahkan profil penurunan kadar gula darah kelompok jamu lebih aman karena tidak terjadi secara drastis sebagaimana kelompok kontrol positif. Perangkat lunak ImageJ memudahkan interpretasi sidik jari KLT ekstrak jamu berdasarkan densitogram yang dihasilkan dan meningkatkan keakuratan kuantisasi luas pita. Hasil analisis pola sidik jari KLT jamu dengan komposisi 4 menunjukkan keterpisahan yang cukup baik sehingga dapat digunakan sebagai kendali mutu ekstrak jamu antidiabetes. Kondisi fase gerak optimum untuk analisis sidik jari KCKT jamu adalah kondisi 2. Pada kondisi ini dihasilkan puncak paling banyak yang terpisah dengan baik.
Saran
Sebaiknya pendekatan metabolomik diaplikasikan pada penelitian berikutnya sehingga dapat diperoleh gambaran yang lebih komprehensif mengenai khasiat jamu antidiabetes dan komponen yang berperan dalam aktivitas tersebut pada organisme biologis.
DAFTAR PUSTAKA
Afendi FM, Sulistiyani, Aki H, Altaf-Ul-Aamin M, Hiroki T, Kensuke N, Kanaya S. 2010. Modelling ingredient of jamu to predict its efficacy. Forum Statistika dan Komputasi. 15(2):1-9.
Afendi FM, Okada T, Yamazaki M, Hirai-Morita A, Nakamura Y, Nakamura K, Ikeda S, Takahashi H, Altaf-Ul-Aamin M, Darusman LK, Saito K, Kanaya S. 2012. KNApSAcK family database: integrated metabolite-plant species databases for multifaceted plant research. Plant Cell Physiol. 53(2):1-12. Aziza RZ. 2012. Gambaran histomorfologi hati, usus halus, dan limpa pada tikus
17 Badrunanto. 2013. Pengoptimuman fase gerak kromatografi cair kinerja tinggi
untuk analisis sidik jari ekstrak temu putih (Curcuma zedoaria) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Bailey CJ, Day C. 2003. Antidiabetic drugs. Br J Cardiol. 10:128-136.
Dewi R. 2013. Bioaktivitas buah kawista (Limonia acidissima) dan penentuan sidik jarinya menggunakan kromatografi lapis tipis [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Dor Y, Brown J, Martinez OI, Melton DA. 2004. Adult pancreatic beta-cells are formed by self-duplication rather than stem-cell differentiation. Nature. 429: 41–46.
Federer W. 1991. Statistics and society: data collection and interpretation. 2nd ed. New York (US): Marcel Dekker.
Elsner M, Guldbake B, Tiedge M, Munday R, Lenzen S. 2000. Relative importance of transport and alkylation for pancreatic beta-cell toxicity of streptozotocin. Diabetologia. 43:1528-1533.
Fernand VE. 2003. Initial characterization of crude extracts from Phyllanthus amarus Schum, and Thonn, and Quassia amara L. using normal phase thin layer chromatography [tesis]. Lousiana (BR): University of Suriname. Ferreira TA, Rasband W. 2010. The ImageJ User Guide Version 1.45. Canada
(CA): McGill University.
Fitrianti SA. 2011. Diferensiasi temulawak, kunyit, dan bangle berdasarkan interpretasi kromatografi lapis tipis menggunakan ImageJ [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Hess AV. 2007. Digitally enhanced thin-layer chromatography: an inexpensive, new technique for qualitative and quantitative analysis. J Chemical Education. (84):842-847.
Huang YL, Wen YX, Zhao ZG, Zhu TC. 2007. Determination of flavanones and flavanonols in Blumea balsanifera DC by RP-HPLC. Guangxi Sciences. 14(2): 140-142.
Jagessar RC, Mohamed A, Gomes G. 2008. An evaluation of the antibacterial and antifungal activity of leaf extracts of Momordica charantia against Candida albicans, Staphylococcus aureus and Escherichia coli. Nature and Science. 6(1): 1-14.
Julianti ED. 2012. Pengaruh pemberian pati tapioka termodifikasi polifenol teh hijau dan daun jambu biji merah pada tikus normal dan diabetes [tesis]. Bogor (ID): Institut Pertanian Bogor.
[Kemenkes RI] Kementerian Kesehatan Republik Indonesia. 2009. Keputusan Menteri Kesehatan Republik Indonesia Nomor 261/MENKES/SK/IV/2009 Tentang Farmakope Herbal Indonesia Edisi Pertama. Jakarta (ID): KEMENKES RI.
Kim JD, Kang SM, Seo BI, Choi HY, Choi HS, Ku SK. 2006. Anti-diabetic activity of SMK001, a poly herbal formula in streptozotocin induced diabetic rats: therapeutic study. Biol Pharm Bull. 29(3): 477-482.
18
Markham KR. 1988. Cara Mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung (ID): Penerbit ITB. Terjemahan dari: Techniques of Flavonoid Identification.
Nissen SE, Wolski K. 2007. Effect of rosiglitazone on the risk of myocardial infarction and death from cardiovascular causes. The New England journal of medicine. 356(24):2457–2471.
Noffritasari B. 2006. Pengaruh pemberian infusa daun kacapiring (Gardenia augusta, Merr.) terhadap kadar glukosa darah tikus wistar yang diberi beban glukosa [skripsi]. Semarang (ID): Universitas Diponegoro.
Nurishmaya MR. 2014. Pendekatan bioinformatika formulasi jamu baru berkhasiat antidiabetes dengan ikan zebra (Danio rerio) sebagai hewan model [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Oktavia JD. 2011. Pengoptimuman ekstraksi flavonoid daun salam (Syzygium polyanthum) dan analisis sidik jari dengan kromatografi lapis tipis [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Permana RB. 2013. Aktivitas antidiabetes buah ciplukan (Physalis angulata Linn.) pada tikus model diabetes melitus tipe-2 [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Prabandari NLPD. 2012. Aktivitas antijerawat formula campuran temu lawak dan meniran serta penentuan sidik jari kromatografinya [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Puspawati NM. 2008. Isolation and identification momordicin I from leaves extract of Momordica charantia L. Jurnal Kimia. 2(1): 53-56.
Rayfield EJ, Valentine MV. Pathophysiology and clinical management of diabetes and prediabetes. Di dalam: Mechanick JI, Brett EM, editor. Nutritional Strategies for the Diabetic and Prediabetic Patient. Boca Raton (US): CRC Press.
Rohmawati E. 2008. Pengaruh fraksi nonprotein kacang komak (Lablab purpureus (L.) sweet) terhadap kadar glukosa darah, profil lipid, dan peroksidasi lipid tikus diabetes [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Salek RM, Maguire ML, Bentley E, Rubtsov DV, Hough T, Cheeseman M, Nunez D, Sweatman BC, Haselden JN, Cox RD, Connor SC, Griffin JL. 2007. A metabolomic comparison of urinary changes in type 2 diabetes in mouse, rat, and human. Physiol Genomics. 29:99-108.
Shams G, Ismail HF, Chee TL, Ali MA, Majid FAA, Sarmidi MR, Aziz RA. 2014. Development of HPLC fingerprint analysis of traditional diabetes herbal jamu diabetes plant materials. Jurnal Teknologi (Sciences & Engineering). 68(1): 83-88.
Sutardi LN. 2010. Stabilitas dan pengaruh gel rimpang kunyit dalam proses penyembuhan luka mencit hiperglikemik [tesis]. Bogor (ID): Institut Pertanian Bogor.
19 Widyastuti R. 2013. Kendali mutu jahe menggunakan sidik jari kromatografi cair
kinerja tinggi dan analisis multivariat [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Wild S, Roglic G, Green A, Sicree R, King H. 2004. Global prevalence of diabetes - estimates for the year 2000 and projections for 2030. Diabetes Care. 27:1047–1053.
Wu KK, Huan Y. 2008. Streptozotocin-induced diabetic models in mice and rats.
Current Protocols in Pharmacology 5(4): 5.47.1-5.47.14.
Yonanda RJ. 2011. Formulasi ekstrak sambiloto (Andrographis paniculata) dan brotowali (Tinospora crispa) sebagai inhibitor α-glukosidase dan analisis sidik jari menggunakan teknik kromatografi [skripsi]: Bogor (ID): Institut Pertanian Bogor.
Zhang M, Lv XY, Li J, Xu ZG, Chen L. 2008. The characterization of high-fat diet and multiple low-dose streptozotocin induced type 2 diabetes rat model. Experimental Diabetes Research. 2008:704045. DOI: 10.1155/2008/704045. Zhang Y, Zhang Y, Bone RN, Cui W, Peng JB, Siegal GP, Wang H, Wu H. 2012.
20
Pemberian pakan jamu
Evaluasi statistik hasil pemantauan kadar gula darah hewan uji Induksi diabetes dengan larutan STZ
Lampiran 1 Bagan alir penelitian (Pengujian in vivo)
Preparasi ekstrak jamu
Pembuatan pakan mengandung ekstrak
jamu
Perancangan petak kandang hewan uji
Masa adaptasi hewan uji
Pembagian mencit menjadi kelompok N
dan terinduksi STZ
Kelompok perlakuan pakan
jamu (P)
Kelompok normal (N) Kelompok kontrol
negatif (KN)
Kelompok kontrol positif (KP)
22
23 Lampiran 4 Uji ANOVA dan uji berganda Duncan terhadap kadar gula darah
mencit praperlakuan
ANOVA
VAR00002
Sum of Squares df Mean Square F Sig.
Between Groups 94930,594 3 31643,531 9,597 ,000
Within Groups 92326,125 28 3297,362
Total 187256,719 31
H0 : Jenis kelompok tidak berpengaruh terhadap kadar gula darah praperlakuan
H1 : Ada kelompok yang berpengaruh terhadap kadar gula darah praperlakuan
Karena p-value kurang dari α=0.05 maka tolak H0, sehingga dapat dilanjutkan ke uji
Duncan untuk melihat selisih antarrerata kelompok.
Lampiran 5 Kadar gula darah mencit yang digunakan dalam analisis statistika
24
Lampiran 6 Profil rerata kadar gula darah mencit selama masa perlakuan
25
Minggu ke-2 perlakuan
VAR00002
VAR00001 N Subset for alpha = 0.05
1 2
Duncana
P 5 95,4000
KP 5 107,8000
N 5 133,4000
KN 5 224,0000
Sig. ,105 1,000
Minggu ke-3 perlakuan
VAR00002
VAR00001 N Subset for alpha = 0.05
1 2
Duncana
KP 5 105,4000
N 5 108,0000
P 5 147,2000 147,2000
KN 5 168,2000
Sig. ,146 ,431
Lampiran 8 Kromatogram hasil analisis ekstrak jamu antidiabetes dengan KCKT Kondisi 1
26
Kondisi 3
Kondisi 4
27
RIWAYAT HIDUP
Penulis lahir di Kelua, sebuah kecamatan kecil di bagian utara Kalimantan Selatan pada tanggal 24 Juni 1992. Penulis adalah anak pertama dari 2 bersaudara dari pasangan Drs Hartani (Alm) dan Nordinah, SAg. Pada tahun 2010, penulis lulus dari SMAN 2 Tanjung dan diterima untuk melanjutkan studi di Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Beasiswa Utusan Daerah (BUD) atas kerjasama PT Adaro Indonesia dan Pemkab Tabalong.