INDUKSI MUTASI DAN SELEKSI
IN VITRO
PURWOCENG (
Pimpinella pruatjan
Molk.)
UNTUK KETAHANAN TERHADAP SUHU TINGGI
NUR AJIJAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis dengan judul Induksi Mutasi dan
Seleksi In Vitro Purwoceng (Pimpinella pruatjan Molk.) untuk Ketahanan
terhadap Suhu Tinggi adalah karya saya dengan arahan dari komisi pembimbing
dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun.
Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan dari
penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka
pada bagian akhir tesis ini.
Bogor, Januari 2009
Nur Ajijah
ABSTRACT
NUR AJIJAH. Induction of Mutations and In Vitro Selection for High Temperature Resistance in Purwoceng (Pimpinella pruatjan Molk.). Under the direction of YUDIWANTI W.E. KUSUMO and IRENG DARWATI.
Purwoceng (Pimpinella pruatjan Molk., P. alpina KDS.) is one of Indonesian medicinal plants. It is a high altitude endemic species. Planting expansion through the development of low and medium land tolerant variety is needed to optimize the use of purwoceng as a medicinal plant. Those varieties are not available yet. The purpose of this research was to achieve high temperature resistant (insensitive) varians of purwoceng through induction of mutations using ethyl methanesulphonate (EMS) and in vitro selection.
Four hundreds and thirty two somatic embryo explants (size 0.5 x 0.5 x 0.5 cm3) were treated with aquades (control) and 0, 0.1, 0.3, 0.5 and 0.7% (v/v) EMS solutions for 1 or 2 hours. EMS was dissolved in buffer sodium phosphate pH 7 0.M and DMSO (dimethyl sulfo-oxida) 4% (EMS 0%). Afterwards, those explants were selected at three room temperature levels i.e. 17.3 ± 0.5ºC, 23.3 ± 2.1ºC and 32.8 ± 1.7ºC for 3 months. The temperature of 17.3 ± 0.5ºC was used as control. Variables observed were explant fresh weight increment, percentage of explant forming shoot, number of shoot per explant, percentage of survive explant and phenotipic variations in shoots formed.
The result showed that the average of explant fresh weight increment, percentage of explant forming shoot and number of shoot per explant were decreased with increasing of temperature and EMS doses. The growth of purwoceng somatic embryos was inhibited at the temperature of 32.8 ± 1.7ºC and EMS dose 0.7% for 2 hours. The percentage of survive explant was also decreased by the increase of temperature selection. The average of survive explant at the end of selection reached 100 and 75-100% at control temperature and 23.3 ± 2.1ºC respectively, while at 32.8 ± 1.7ºC was only 0 - 25%. The resistant (insensitive) varians at 32.8 ± 1.7ºC were obtained from both EMS treated and untreated explants. The result also showed the increase of phenotipic variation in EMS treated shoots.
Molk.) untuk Ketahanan terhadap Suhu Tinggi. Dibimbing oleh YUDIWANTI W.E. KUSUMO dan IRENG DARWATI.
Purwoceng (Pimpinella pruatjan Molk. atau P. alpina KDS.) merupakan salah satu jenis tanaman obat asli Indonesia endemik dataran tinggi yang keberadaannya telah langka. Tanaman ini memiliki khasiat afrodisiak dan digunakan juga sebagai tonik untuk meningkatkan stamina tubuh. Dengan khasiat yang dimilikinya purwoceng memiliki potensi untuk dikembangkan sebagai tanaman obat pengganti ginseng yang pemakaiannya di Indonesia cukup tinggi. Salah satu upaya yang dapat ditempuh untuk mendukung pengembangan budidaya purwoceng adalah melalui pengembangan varietas purwoceng toleran dataran menengah atau rendah yang antara lain dapat diperoleh melalui pendekatan seleksi ketahanan terhadap suhu tinggi. Seleksi ketahanan terhadap suhu tinggi juga penting berkaitan dengan isu pemanasan global. Penelitian bertujuan mendapatkan varian embrio somatik/tunas purwoceng tahan (tidak sensitif) suhu tinggi melalui induksi mutasi dengan EMS dan seleksi secara in vitro.
Empat ratus tiga puluh dua eksplan embrio somatik berukuran sekitar 0.5 x 0.5 x 0.5 cm3 direndam di dalam 0%, 0.1%, 0.3%, 0.5% dan 0.7% (v/v) larutan EMS selama 1 atau 2 jam. Sebagai pelarut EMS digunakan bufer natrium fosfat pH 7 0.1 M dan DMSO 4% (EMS 0%). Aquades dengan lama perendaman yang sama digunakan sebagai kontrol. Setelah itu eksplan diseleksi pada 3 taraf suhu ruang yaitu rata-rata suhu siang 17.3 ± 0.5ºC, 23.3 ± 2.1ºC dan 32.8 ± 1.7ºC selama 3 bulan. Suhu 17.3 ± 0.5ºC digunakan sebagai kontrol. Penempatan perlakuan EMS pada masing-masing suhu seleksi menggunakan rancangan lingkungan acak kelompok dengan 4 ulangan. Masing-masing ulangan terdiri dari 4 botol kultur dan masing-masing botol kultur terdiri dari 3 eksplan. Kriteria seleksi didasarkan pada kemampuan eksplan bertahan hidup pada kondisi suhu seleksi. Embrio somatik yang mampu bertahan hidup sampai akhir seleksi dan tunas yang terbentuk dan mampu bertahan hidup sampai akhir seleksi dikategorikan sebagai embrio somatik dan tunas yang tahan.
Peubah yang diamati meliputi penambahan bobot segar eksplan, persentase eksplan membentuk tunas, jumlah tunas per eksplan dan persentase eksplan hidup yang diamati pada umur 1, 2 dan 3 bulan serta variasi fenotipe tunas yang diamati pada umur 3 bulan. Analisis ragam dilanjutkan dengan uji Jarak Berganda Duncan pada taraf α 0.05 menggunakan program SAS 9.1 dilakukan untuk mengetahui pengaruh perlakuan EMS terhadap pertumbuhan dan perkembangan eksplan pada masing-masing suhu seleksi.
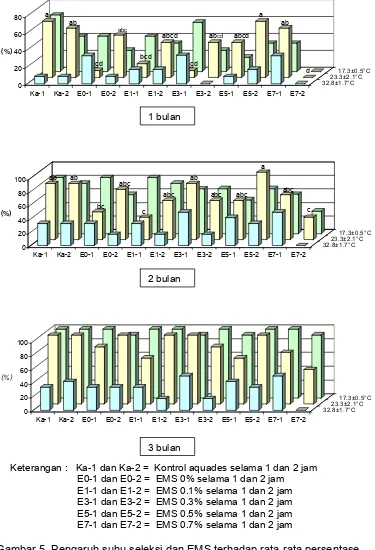
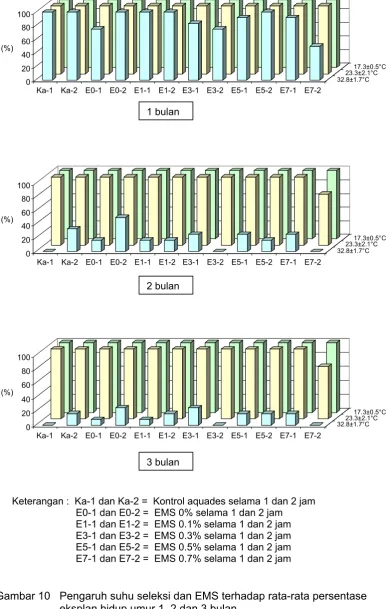
yang nyata terhadap rata-rata persentase eksplan hidup umur 1, 2 dan 3 bulan pada suhu kontrol, 23.3 ± 2.1ºC dan 32.8 ± 1.7ºC.
Rata-rata penambahan bobot segar eksplan, persentase eksplan mem-bentuk tunas, jumlah tunas per eksplan serta persentase eksplan hidup semakin menurun dengan meningkatnya suhu seleksi. Rata-rata penambahan bobot segar eksplan, persentase eksplan membentuk tunas, jumlah tunas per eksplan dan persentase eksplan hidup umur 1, 2 dan 3 bulan paling rendah terdapat pada perlakuan suhu 32.8 ± 1.7ºC. Rata-rata persentase eksplan hidup umur 3 bulan pada suhu kontrol dan 23.3 ± 2.1ºC berturut-turut mencapai 100 dan 75-100%, sementara pada suhu 32.8 ± 1.7ºC hanya 0 - 25%. Suhu 23.3 ± 2.1ºC dengan lama periode seleksi selama 3 bulan tidak dapat digunakan untuk me-nyeleksi ketahanan terhadap suhu tinggi pada eksplan embrio somatik purwoceng karena pada kisaran suhu tersebut varian tahan dan tidak tahan tidak dapat dibedakan. Sebaliknya suhu 32.8 ± 1.7ºC dengan periode seleksi selama 3 bulan dapat digunakan untuk menyeleksi ketahanan terhadap suhu tinggi pada eksplan embrio somatik purwoceng karena telah mencapai heat killing
tempe-rature yaitu suhu tinggi yang menyebabkan kematian eksplan sebesar 50%,
sehingga pada kisaran suhu tersebut varian tahan (tidak sensitif) dan tidak tahan (sensitif) dapat dibedakan.
Eksplan yang bertahan hidup hingga umur 3 bulan pada suhu 32.8 ± 1.7ºC diperoleh baik pada perlakuan EMS maupun EMS 0% dan kontrol aquades yaitu pada perlakuan kontrol aquades selama 2 jam, EMS 0% selama 1 dan 2 jam, EMS 0.1% selama 1 dan 2 jam, EMS 0.3% selama 1 jam, EMS 0.5% selama 1 dan 2 jam serta EMS 0.7% selama 1 jam. Rata-rata persentase eksplan hidup paling tinggi diperoleh pada perlakuan EMS 0% selama 2 jam dan EMS 0.3% selama 1 jam yaitu 25%. Eksplan yang bertahan hidup ini diharapkan meru-pakan bentuk varian yang tahan terhadap suhu tinggi. Varian tahan yang ter-bentuk pada perlakuan kontrol aquades dan EMS 0% diduga merupakan ter-bentuk variasi somaklonal yang terinduksi baik selama penelitian berlangsung maupun sebelumnya. Varian tahan yang terbentuk pada perlakuan EMS diduga meru-pakan hasil mutasi yang terinduksi oleh perlakuan EMS, namun tidak tertutup kemungkinan varian tersebut juga merupakan bentuk variasi somaklonal atau merupakan hasil dari keduanya yaitu variasi somaklonal dan mutasi yang terinduksi oleh perlakuan EMS. Eksplan yang bertahan hidup hingga umur 3 bulan pada suhu 32.8 ± 1.7ºC tidak diperoleh pada perlakuan kontrol aquades selama 1 jam serta EMS 0.3 dan 0.7% selama 2 jam, diduga tidak ada varian tahan yang terinduksi pada ketiga perlakuan tersebut.
Eksplan yang bertahan hidup pada suhu 32.8 ± 1.7ºC umur 3 bulan sebagian besar telah membentuk tunas dan sebagian masih berupa embrio somatik. Sebagian besar tunas yang terbentuk pada suhu 32.8 ± 1.7ºC tidak dapat bertahan hidup sampai akhir seleksi (umur 3 bulan), hanya tunas yang tahan (tidak sensitif) yang dapat bertahan hidup sampai akhir seleksi. Eksplan yang membentuk tunas tahan umur 3 bulan diperoleh pada perlakuan kontrol aquades selama 2 jam, EMS 0% selama 1 dan 2 jam, EMS 0.1% selama 1 dan 2 jam, EMS 0.3% selama 1 jam, EMS 0.5% selama 2 jam serta EMS 0.7% selama 1 jam dengan jumlah tunas tahan berkisar antara 1 – 18 tunas per perlakuan. Jumlah tunas tahan paling banyak diperoleh pada perlakuan EMS 0% selama 2 jam dan EMS 0.3% selama 1 jam yaitu berturut-turut 18 dan 16 tunas.
diisolasi dan di subkultur pada media DKW + IBA 5 mg/l untuk embrio somatik dan DKW tanpa zat pengatur tumbuh untuk tunas dan diinkubasi pada suhu 23.3 ± 2.1ºC untuk perbanyakan. Sifat tahan pada embrio somatik dan tunas ini diharapkan bukan epigenetik melainkan hasil mutasi, baik mutasi yang terinduksi oleh perlakuan EMS maupun variasi somaklonal, sehingga ketahanannya bersifat permanen dan dapat diwariskan.
Hasil penelitian juga menunjukkan adanya peningkatan variasi fenotipe tunas pada perlakuan EMS dibandingkan kontrol aquades dan EMS 0%. Variasi yang ditemukan berupa tangkai daun besar, daun variegata dan albino. Varian tangkai daun besar ditemukan baik pada perlakuan EMS maupun kontrol aquades dan EMS 0%. Varian daun variegata dan albino hanya ditemukan pada perlakuan EMS. Varian tangkai daun besar kemungkinan merupakan bentuk variasi somaklonal, sedangkan varian daun variegata dan albino kemungkinan merupakan tipe variasi yang terinduksi oleh perlakuan EMS. Frekuensi variasi fenotipe tunas paling tinggi diperoleh pada perlakuan EMS 0.5% selama 1 jam yaitu 12% pada suhu kontrol dan 26.7% pada suhu 23.3 ± 2.1ºC yang terdiri dari varian tangkai daun besar, daun variegata dan albino. Adanya peningkatan variasi fenotipe tunas pada perlakuan EMS menunjukkan EMS mampu meng-induksi keragaman yang lebih tinggi dibandingkan kontrol aquades dan EMS 0%.
Variasi fenotipe tunas yang ditemukan pada suhu 32.8 ± 1.7ºC lebih sedikit dibandingkan pada suhu kontrol dan suhu 23.3 ± 2.1ºC. Hal ini disebabkan tunas yang berhasil hidup pada suhu 32.8 ± 1.7ºC hanya tunas yang tahan (tidak sensitif) terhadap suhu tersebut sedangkan sebagian besar varian kemungkinan tidak tahan.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
UNTUK KETAHANAN TERHADAP SUHU TINGGI
NUR AJIJAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Megister Sains pada
Departemen Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama
:
Nur AjijahNIM
:
A151060041Disetujui
Komisi Pembimbing
Dr. Ir. Yudiwanti W.E. Kusumo, MS Dr. Ir. Ireng Darwati
Ketua Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana Agronomi
Dr. Ir. Munif Ghulamahdi, MS Prof. Dr. Ir. Khairil A. Notodiputro, MS
PRAKATA
Alhamdulillah, puji dan syukur penulis panjatkan ke hadirat Allah SWT atas
segala limpahan rahmat dan karuniaNya sehingga penelitian dan karya tulis ini
dapat diselesaikan. Tema yang dipilih dalam penelitian ini adalah seleksi in vitro
untuk ketahanan terhadap suhu tinggi, dengan judul Induksi Mutasi dan Seleksi
In Vitro Purwoceng (Pimpinella pruatjan Molk.) untuk Ketahanan terhadap Suhu
Tinggi.
Penghargaan dan ucapan terima kasih yang sebesar-besarnya penulis
sampaikan kepada Ibu Dr. Ir. Yudiwanti W.E. Kusumo, MS dan Ibu Dr. Ir. Ireng
Darwati yang telah memberikan kesempatan kepada penulis untuk terlibat di
dalam penelitian ini serta telah memberikan dorongan, bimbingan dan arahan
dalam pelaksanaan penelitian dan penulisan karya ilmiah. Ucapan terima kasih
juga penulis sampaikan kepada Ibu Dr. Ir. Nurul Khumaida, MS yang telah
memberikan masukan dan saran yang sangat berarti untuk perbaikan karya tulis.
Penghargaan dan ucapan terima kasih penulis sampaikan kepada Ibu Susi,
Ibu Rohmah serta seluruh staf laboratorium kultur jaringan Kelompok Peneliti
Ekofisiologi Balai Penelitian Tanaman Obat dan Aromatik (Balittro) Bogor yang
telah memberikan dukungan dan bantuan teknis dalam pelaksanaan penelitian,
juga kepada teman-teman pascasarjana angkatan 2006 atas dukungan dan
kerjasamanya selama menyelesaikan studi.
Penulis menyampaikan terima kasih kepada Badan Litbang Pertanian
Departemen Pertanian RI yang telah memberikan kesempatan dan beasiswa
kepada penulis untuk melanjutkan studi pada program Megister di Sekolah
Pascasarjana IPB.
Ucapan terima kasih yang tulus penulis sampaikan kepada suami dan
anak-anakku Habil, Izza dan Maryam atas pengertian serta dukungannya yang
begitu besar selama menyelesaikan studi, juga kepada Umi dan Abi yang
senantiasa berdoa untuk kebaikan putra-putrinya.
Semoga karya tulis ini bermanfaat untuk menambah khasanah ilmu
pengetahuan khususnya dalam menghadapi isu pemanasan global.
Bogor, Januari 2009
Penulis dilahirkan di Majalengka pada tanggal 9 April 1970 dari Ayahanda
H. M. Ridwanullah dan Ibu Hj. Kusyati. Penulis merupakan putri ke tiga dari
enam bersaudara.
Penulis menyelesaikan pendidikan sarjana di program studi Agronomi IPB
pada tahun 1993. Tahun 2006 penulis mendapat beasiswa dari Badan Litbang
Pertanian Departemen Pertanian RI untuk melanjutkan studi pada program
Megister di program studi Agronomi Sekolah Pascasarjana IPB.
Penulis bekerja sebagai peneliti di Balai Penelitian Tanaman Rempah dan
Obat Bogor sejak tahun 1994 – 2006. Mulai tahun 2007 sampai sekarang
penulis bekerja di Balai Penelitian Tanaman Rempah dan Aneka Tanaman
Industri Sukabumi dengan jabatan terakhir sebagai Peneliti Muda. Bidang
penelitian yang menjadi tanggung jawab penulis selama bekerja adalah plasma
DAFTAR ISI
DAFTAR GAMBAR ………...
DAFTAR LAMPIRAN ………...
PENDAHULUAN ………... Latar Belakang ………... Tujuan Penelitian ………... Hipotesis………. Manfaat Penelitian ………
TINJAUAN PUSTAKA ... Purwoceng ………... Mutasi pada Pemuliaan Tanaman ………... Cekaman Suhu Tinggi padaTanaman ………... Seleksi In Vitro untuk Ketahanan terhadap Suhu Tinggi ...
BAHAN DAN METODE ... Waktu dan Tempat ... Bahan Penelitian ... Metode ...
HASIL DAN PEMBAHASAN... Keadaan Umum Penelitian ... Pengaruh Suhu Seleksi dan EMS terhadap Pertumbuhan dan perkembangan Eksplan ... Varian Tahan Suhu 32.8 ± 1.7ºC ………... Keragaman Fenotipe Tunas ………...
SIMPULAN DAN SARAN ………... Simpulan ………... Saran ………...
DAFTAR PUSTAKA ………..
1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16
Kultur in vitro purwoceng yang digunakan sebagai sumber eksplan....
Kalus dan embrio somatik yang diinduksi dari eksplan daun ...
Kultur yang mengalami kontaminasi bakteri pada suhu 32.8 ± 1.7ºC ..
Pengaruh suhu seleksi dan EMS terhadap rata-rata penambahan bobot segar eksplan umur 1, 2 dan 3 bulan...
Pengaruh suhu seleksi dan EMS terhadap rata-rata persentase eksplan membentuk tunas umur 1, 2 dan 3 bulan...
Eksplan membentuk tunas umur 1, 2 dan 3 bulan pada suhu kontrol, 23.3 ± 2.1ºC dan 32.8 ± 1.7ºC ………..
Pengaruh suhu seleksi dan EMS terhadap rata-rata jumlah tunas per eksplan umur 1, 2 dan 3 bulan ...
Perbandingan jumlah tunas umur 3 bulan pada perlakuan kontrol aquades dan EMS 0.7% selama 2 jam pada suhu kontrol dan 23.3 ± 2.1ºC ...
Tunas umur 3 bulan yang telah berakar pada suhu kontrol dan 23.3 ± 2.1ºC …...………....
Pengaruh suhu seleksi dan EMS terhadap rata-rata persentase eksplan hidup umur 1, 2 dan 3 bulan ...
Perkembangan eksplan umur 1, 2 dan 3 bulan pada suhu 32.8±1.7ºC
Tunas tidak tahan (sensitif ) pada suhu 32.8 ± 1.7ºC ...
Tunas dan embrio somatik yang bertahan hidup umur 3 bulan pada suhu 32.8 ± 1.7ºC ...…..
Tunas dan embrio somatik tahan (tidak sensitif) suhu 32.8 ± 1.7ºC 3 bulan setelah perbanyakan pada suhu 23.3 ± 2.1ºC ………..
Variasi fenotipe tunas ………..
Tipe dan frekuensi variasi fenotipe tunas pada masing-masing perlakuan EMS dan suhu seleksi ………
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ..………. 55
2 Tabel komposisi media Murashige dan Skoog (MS) serta Driver,
Kuniyuki dan Walnut (DKW) ... 56
3 Tabel rekapitulasi uji F pengaruh perlakuan EMS terhadap pertumbuhan dan perkembangan eksplan umur 1, 2 dan 3 bulan
pada suhu kontrol ... 57
4 Tabel rekapitulasi uji F pengaruh perlakuan EMS terhadap pertumbuhan dan perkembangan eksplan umur 1, 2 dan 3 bulan
pada suhu 23.3 ± 2.1ºC ……… 58
5 Tabel rekapitulasi uji F pengaruh perlakuan EMS terhadap pertumbuhan dan perkembangan eksplan umur 1, 2 dan 3 bulan
pada suhu 32.8 ± 1.7ºC ……… 59
6 Tabel rata-rata penambahan bobot segar eksplan (g) pada masing-
masing suhu seleksi dan perlakuan EMS umur 1, 2 dan 3 bulan .. 60
7 Tabel rata-rata persentase eksplan membentuk tunas (%) pada masing-masing suhu seleksi dan perlakuan EMS umur 1, 2 dan 3
bulan ... 61
8 Tabel rata-rata jumlah tunas per eksplan umur 1, 2 dan 3 bulan
pada masing-masing suhu seleksi dan perlakuan EMS ... 62
9 Tabel rata-rata persentase eksplan hidup (%) umur 1, 2 dan 3 bulan
pada masing-masing suhu seleksi dan perlakuan EMS ... 63
10 Tabel frekuensi variasi fenotipe tunas (%) pada masing-masing
perlakuan EMS dan suhu seleksi... 64
Latara Belakang
Purwoceng (Pimpinella pruatjan Molk. atau P. alpina KDS.) merupakan
tanaman obat asli Indonesia endemik dataran tinggi. Habitat alami purwoceng
berada pada ketinggian 1 800 – 3 500 m dpl. (Heyne 1987), dan yang dikenal
sebagai daerah pengembangan budidayanya pada saat ini hanya Dataran Tinggi
Dieng dengan luasan terbatas. Di Dataran Tinggi Dieng purwoceng tumbuh
pada ketinggian 1 850 – 2 050 m dpl. dengan suhu antara 15 – 21°C (Rahardjo
et al. 2006).
Purwoceng dikenal memiliki khasiat afrodisiak (meningkatkan kemampuan
sexual) pada pria dan telah lama digunakan di dalam ramuan obat tradisional.
Seduhan purwoceng juga digunakan sebagai tonik untuk meningkatkan stamina
tubuh (Heyne 1987). Dengan khasiat yang dimilikinya, purwoceng memiliki
potensi untuk dikembangkan sebagai tanaman obat pengganti ginseng yang
pemakaiannya di Indonesia cukup tinggi. Impor ginseng Indonesia pada tahun
2005 mencapai 22 515 kg dengan nilai 1 801 599 US $ (BPS 2006).
Purwoceng telah dinyatakan sebagai tanaman obat langka (Rifai 1990).
Oleh karena itu pemerintah telah mengeluarkan larangan penggunaan simplisia
(sediaan bahan obat) purwoceng yang bukan berasal dari tanaman yang
dibudidayakan (DITJEN POM 2000). Salah satu upaya yang dapat ditempuh
untuk mendukung pengembangan budidaya purwoceng adalah melalui
pengembangan varietas purwoceng toleran dataran menengah atau rendah.
Dengan adanya varietas toleran dataran rendah atau menengah ini, alternatif
daerah pengembangan menjadi lebih luas tidak terbatas di dataran tinggi.
Varietas tersebut pada saat ini belum tersedia.
Sifat toleransi terhadap dataran rendah atau menengah antara lain dapat
diperoleh melalui pendekatan seleksi ketahanan terhadap suhu tinggi, karena
dataran menengah atau rendah pada umumnya memiliki suhu yang lebih tinggi
dibandingkan dataran tinggi. Seleksi ketahanan terhadap suhu tinggi juga
penting berkaitan dengan isu pemanasan global. Akibat pemanasan global suhu
di permukaan bumi diperkirakan akan naik sekitar 0.3°C per dekade (Jones et al.
1999 dalam Wahid et al. 2007) atau naik sekitar 1 dan 3°C dari keadaan suhu
2
Peningkatan suhu bumi ini akan mengancam kelangsungan hidup spesies
bahkan pada habitat alaminya sekalipun, termasuk puwoceng.
Induksi mutasi yang dilanjutkan dengan seleksi ketahanan terhadap suhu
tinggi secara in vitro antara lain telah dilakukan pada tanaman kentang dan
bawang putih dan telah berhasil diperoleh mutan toleran suhu tinggi (Das et al.
2000; Gosal et al. 2001; Zhen 2001a). Menurut Svetleva dan Crino (2005),
induksi mutasi yang digabungkan dengan kultur in vitro merupakan metode yang
menguntungkan karena dapat meningkatkan frekuensi terbentuknya variasi baru.
Secara teknis kultur in vitro dapat menghasilkan variasi somaklonal dan variasi
ini dapat ditingkatkan dengan menggunakan mutagen.
Salah satu jenis mutagen kimia yang paling banyak digunakan, paling
efektif serta telah digunakan pada berbagai jenis organisma mulai dari virus
sampai mamalia adalah EMS (ethyl methanesulphonate) (Sega 1984; Medina et
al. 2005). EMS umumnya menghasilkan mutasi titik atau mutasi gen, sedikit
mutasi yang terpaut dan sedikit kerusakan pada kromosom sehingga sangat
menguntungkan bagi kegiatan pemuliaan. Beberapa sifat penting telah berhasil
diperoleh melalui induksi mutasi secara in vitro menggunakan EMS antara lain
toleran salinitas pada krisantemum (Hosain et al. 2006) dan ubi jalar (Luan et al.
2007) serta ketahanan terhadap Fusarium pada abaka (Purwati 2006). EMS
juga telah digunakan secara in vitro untuk menginduksi keragaman pada
tanaman apukat (Yenisbar 2005) dan perbaikan sifat agronomi pada tanaman
anggur (Khawale et al. 2007). Secara in vivo, EMS antara lain telah berhasil
digunakan untuk menginduksi sifat ketahanan terhadap Xanthomonas oryzae pv
oryzae pada padi (Agrawal et al. 2005). Diharapkan EMS dapat menginduksi
sifat ketahanan terhadap suhu tinggi pada purwoceng.
Pada penelitian ini dilakukan induksi mutasi secara in vitro pada embrio
somatik purwoceng menggunakan beberapa taraf dosis EMS dilanjutkan dengan
seleksi in vitro pada beberapa taraf suhu.
Tujuan Penelitian
Penelitian bertujuan mendapatkan varian embrio somatik/tunas purwoceng
Hipotesis
Perlakuan EMS pada dosis tertentu akan menginduksi terbentuknya
varian embrio somatik/tunas purwoceng tahan (tidak sensitif) suhu tinggi.
Manfaat Penelitian
Varian embrio somatik/tunas purwoceng tahan (tidak sensitif) suhu tinggi
diharapkan dapat diregenerasikan menjadi tanaman dan digunakan sebagai
bahan perakitan varietas purwoceng toleran suhu tinggi atau toleran dataran
TINJAUAN PUSTAKA
Purwoceng Botani dan Karakteristik
Purwoceng merupakan tanaman terna setahun, habitus tanaman
membentuk roset dengan tangkai daun berada di atas permukaan tanah. Tajuk
tanaman menutupi permukaan tanah dengan diameter sekitar 37 cm. Tangkai
daun rapat menutupi batang tanaman seolah batang tanaman tidak ada, jumlah
tangkai daun sekitar 46 buah per tanaman. Pangkal tangkai daun umumnya
berwarna merah kecoklatan, hanya sekitar 2% populasi yang memiliki tangkai
daun kehijauan. Rata-rata panjang tangkai daun sekitar 18 cm (Rahardjo et al.
2006).
Klasifikasi botani purwoceng adalah sebagai berikut :
Divisi : Spermatophyta
Anak divisi : Angiospermae
Kelas : Dicotyledoneae
Famili : Apiaceae
Marga : Pimpinella
Jenis : Pimpinella pruatjan Molk. Sinonim P. alpina KDS.
Purwoceng memiliki daun majemuk berpasangan berhadapan. Bentuk
anak daun membulat dengan tepi bergerigi. Warna permukaan atas daun hijau
dan permukaan bawah hijau keputihan. Purwoceng memiliki akar tunggang yang
membesar membentuk struktur seperti umbi pada tanaman ginseng tapi dengan
ukuran yang lebih kecil (Rahardjo et al. 2006).
Purwoceng merupakan tanaman berumah satu namun dapat menyerbuk
silang. Tanaman mulai berbunga pada umur 7 bulan dan mencapai 100%
berbunga pada umur 9 bulan. Bunga purwoceng merupakan bunga majemuk
berbentuk payung. Biji yang telah masak berwarna hitam, berukuran sangat kecil
sekitar 0.52 g per 1 000 butir biji (Rahardjo et al. 2006).
Daerah Asal dan Penyebaran
Purwoceng merupakan tumbuhan obat asli Indonesia endemik dataran
tinggi pada ketinggian 1 800 – 3 500 m dpl. Pada awalnya purwoceng terdapat
di Gunung Pangrango, Papandayan dan Tangkuban Perahu (Jawa Barat),
1935, Heyne 1987). Namun saat ini purwoceng hanya terdapat di Gunung
Gede (Jawa Barat) dan Pegunungan Dieng (Jawa Tengah) dan termasuk ke
dalam dua puluh empat tumbuhan langka di Jawa (Pusat Konservasi Tumbuhan
2007).
Rifai (1990) telah menggolongkan purwoceng sebagai salah satu tumbuhan
obat langka dengan kategori genting (endangered species). Tanaman ini
dikelompokkan sebagai jenis tumbuhan langka dalam kategori genting karena
populasinya di alam menurun lebih dari 50% dalam 10 tahun terakhir, terjadi
penurunan luas wilayah dan kualitas habitat, tingginya tingkat eksploitasi, luas
wilayah keberadaan populasi kurang dari 5 000 m2 karena mengalami fragmen-tasi berat (Mogea et al. 2001 dalam Rostiana et al. 2006). Tumbuhan dalam
kategori ini apabila tidak segera dilakukan perlindungan akan mengalami
kepunahan.
Daerah pengembangan budidaya purwoceng yang dikenal pada saat ini
hanya Dataran Tinggi Dieng, dengan luas areal yang terbatas. Di Dataran Tinggi
Dieng purwoceng hanya ditemukan di Desa Sikunang, yaitu di pekarangan
rumah petani dengan luas areal pertanaman antara 4 - 200 m2 atau rata-rata 37
m2 per petani (Ermiati et al. 2006).
Keberadaan spesies ini di negara lain tidak diketahui. Namun diketahui
spesies kerabat dekatnya yaitu Pimpinella tirupatiensis Bal dan Subr terdapat di
India, yang juga merupakan tanaman obat langka endemik dataran tinggi yang
akarnya digunakan sebagai afrodisiak (Prakash et al. 2001).
Kandungan Bahan Aktif dan Khasiat
Akar purwoceng diketahui mengandung turunan senyawa kumarin, sterol,
alkaloid, saponin (Caropeboka & Lubis 1975, Rostiana et al. 2003), flavonoid,
glikosida dan tanin (Rostiana et al. 2003), kelompok furanokumarin seperti
bergapten, isobargapten dan sphondin (Sidik et al. 1975), turunan kumarin
seperti xanthotoksin, mamersin, 6,8-dimetoksi umbelliferon (Hernani & Rostiana
2004), stigmasterol (Suzery et al 2004, Rahardjo et al. 2006, Rostiana et al.
2007), sitosterol (Rahardjo et al. 2006, Rostiana et al. 2007), dan vitamin E
(Rahardjo et al. 2006). Sementara ternanya mengandung stigmasterol dan
bergapten (Rahardjo et al. 2006, Rostiana et al. 2007), vitamin E (Rahardjo et al.
2006), saponin, alkaloid, glikosida, kumarin dan triterpenoid-steroid (Rostiana et
6
Bahan aktif sitosterol, stigmasterol, bergapten dan saponin dari tanaman
purwoceng telah berhasil diproduksi secara in vitro melalui kultur kalus dan akar
rambut dengan menggunakan skualena dan mevalonat sebagai prekursor
(Darwati 2007).
Turunan senyawa kumarin digunakan dalam industri obat moderen sebagai
analgetika (penghilang rasa sakit ), anti fungi, anti bakteri dan anti kanker (Sidik
et al., 1985 dalam Rostiana et al. 2006). Sedangkan senyawa yang diketahui
memberi efek afrodisiak diantaranya adalah turunan steroid, saponin, alkaloid,
tanin dan senyawa lain yang dapat melancarkan peredaran darah (Anwar 2001).
Hasil uji farmaklogis pada tikus menunjukkan pemberian ekstrak akar
purwoceng meningkatkan motilitas spermatozoa (Juniarto 2004) dan
mening-katkan kadar LH (Luteinizing Hormone) dan testoteron (Taufiqqurrachman &
Wibowo 2006). Peningkatan kadar testoteron ini disebabkan efek stimulasi
ekstrak purwoceng terhadap LH dan konversi fitosterol yang ada pada ekstrak
purwoceng menjadi testoteron pada jaringan hewan uji (Taufiqqurrachman &
Wibowo 2006). Testoteron merupakan hormon utama yang mempengaruhi
perilaku sexual pria. Hasil penelitian menunjukkan beberapa pria menjadi lebih
agresif, sensitif dan mampu untuk ereksi apabila kadar serum testoteronnya
cukup (Beck, 1993, Morales et al. 1997 dan Van Basten et al. 1997 dalam
Taufiqqurrachman & Wibowo 2006). Testoteron dibentuk dari ester kolesterol di
dalam sel Leydig testis, sisanya sekitar 5% dihasilkan oleh kortek adrenal di
mana prekursor seperti sterol dari tanaman akan dikonversi menjadi testoteron
di dalam jaringan pheripheral (Graner 1996 dalam Taufiqqurrachman & Wibowo
2006).
Mutasi pada Pemuliaan Tanaman
Mutasi didefinisikan sebagai perubahan material genetik yang diwariskan
(van Harten 1998; Montelone 1998; Hartl 1994). Sedangkan keseluruhan proses
yang menyebabkan timbulnya berbagai macam mutasi disebut mutagenesis.
Secara teori, seluruh perubahan yang terjadi pada sekuen DNA akan
menimbulkan perubahan kode genetik sehingga disebut mutasi (van Harten
1998; Chahal & Gosal 2006).
Berdasarkan proses terjadinya, mutasi terbagi menjadi dua yaitu mutasi
alami/spontan dan mutasi yang diinduksi. Mutasi spontan adalah mutasi yang
kapan akan terjadi (Hartl 1994). Mutasi spontan terjadi sebagai hasil proses
alami di dalam sel seperti kesalahan pada saat replikasi DNA atau hasil interaksi
dengan mutagen yang terdapat di lingkungan (Montelone 1998). Kesalahan
dalam replikasi DNA mencapai 1 per 102 gen yang berreplikasi. Namun karena
adanya mekanisme perbaikan, laju mutasi akibat kesalahan replikasi DNA
menjadi sekitar 1 per 108 sampai 109 lokus (Micke 1991
dalam van Harten 1998).
Mutasi spontan terjadi dengan laju yang sangat rendah dan bervariasi pada
setiap organisme. Laju mutasi spontan pada E. coli berkisar antara 10-5 - 10-9 (Hartl 1994), sedangkan pada tanaman Arabidopsis berkisar antara 10-7 - 10-8 pasang basa per generasi (Kovalchuk et al. 2000 dalam Greene et al. 2003).
Mutasi induksi adalah mutasi yang diketahui agen penyebabnya. Bukti
pertama yang menunjukkan bahwa agen dari luar dapat meningkatkan laju
mutasi diperlihatkan oleh Hermano Muller pada tahun 1927 dengan
meng-gunakan sinar X pada Drosophila. Setelah itu berbagai jenis agen fisik dan kimia
yang dapat meningkatkan laju terjadinya mutasi ditemukan (Hartl 1994). Mutasi
induksi terjadi dengan laju yang lebih tinggi dibandingkan mutasi spontan.
Mutagen fisik dan kimia diketahui dapat meningkatkan laju mutasi ratusan
sampai ribuan kali dibandingkan mutasi spontan (Broertjes & van Harten 1988;
van Harten 1998). Laju mutasi yang optimal untuk kegiatan pemuliaan adalah
sekitar 1 per 104 lokus (van Harten 1998).
Pada kegiatan pemuliaan tanaman, mutasi induksi digunakan untuk
menginduksi terjadinya mutasi pada lokus yang mengontrol sifat yang penting
secara ekonomi atau mengeliminasi gen-gen yang tidak diinginkan dari
galur-galur elit (Lippert et al. 1964 dalam Jabeen & Mirza 2004). Mutasi induksi dapat
memberikan tambahan keragaman genetik untuk melengkapi pemuliaan
tanaman konvensional (Odeigah et al. 1998). Pemanfaatan mutasi secara
langsung pada pemuliaan tanaman untuk menambahkan satu atau dua karakter
yang mudah diidentifikasi dapat dilakukan tanpa mengubah genotipe dasar dari
kultivar yang sudah adaptif. Hal ini menguntungkan karena tidak diperlukan
backcross yang berulang untuk merekonstruksi genotipe dasar dari kultivar
tersebut (Chahal & Gosal 2006). Menurut Chahal dan Gosal (2006), situasi ideal
untuk melakukan mutasi adalah apabila gen atau alel yang diinginkan tidak
terdapat pada plasma nutfah yang dimiliki atau gen tersebut terpaut dekat
8
dilakukan. Mutasi juga dilakukan untuk menginduksi dan mengintroduksi alel
yang tidak ada di dalam populasi alami.
Mutasi dapat dibedakan berdasarkan beberapa kategori. Yang paling
umum adalah pembagian mutasi berdasarkan besarnya sekuen DNA yang
berubah yaitu pada tingkat genom, kromosom dan gen (Broertjes & van Harten
1988). Mutasi pada tingkat genom berupa perubahan pada tingkat ploidi atau
jumlah kromosom, baik polilpoid maupun aneuploid. Sedangkan mutasi pada
tingkat kromosom berupa perubahan pada struktur kromosom yang disebabkan
oleh adanya delesi, inversi, duplikasi atau translokasi. Mutasi gen atau disebut
juga mutasi titik atau narrow sense mutation atau intragenic mutation adalah
perubahan yang terjadi di dalam gen yang diakibatkan oleh adanya perubahan
pada sekuen DNA di dalam gen tersebut seperti penambahan atau pengurangan
satu atau beberapa pasang basa atau penggantian satu pasang basa oleh yang
lainnya (van Harten 1998).
Pada kegiatan pemuliaan, mutasi yang diinginkan adalah mutasi pada
tingkat gen dan alelnya atau mutasi titik atau perubahan pada sejumlah kecil
segmen kromosom (van Harten 1998), sebab perubahan pada sejumlah besar
segmen kromosom sering menimbulkan pengaruh negatif seperti berkurangnya
fertilitas pada tanaman (Broertjes & van Harten 1988).
Mutasi titik yang diakibatkan oleh penggantian atau substitusi pasangan
basa akan menghasilkan silent mutation (mutasi diam atau mutasi yang tidak
kelihatan) apabila penggantian pasangan basa tidak menimbulkan perubahan
pada asam amino yang dikodekannya. Perubahan pada asam amino ini akan
mengakibatkan perubahan pada struktur dan fungsi protein yang disusunnya.
Substitusi basa juga dapat mengubah kodon penyandi asam amino menjadi stop
kodon atau disebut nonsense mutation, menghasilkan prematurely shortened
protein. Pengaruh dari nonsense mutation bervariasi tergantung seberapa
banyak protein terpotong dan seberapa besar pengaruhnya terhadap fungsi
protein tersebut. Substitusi basa dapat juga terjadi pada promotor atau daerah
regulator dari gen yang mungkin akan mempengaruhi transkripsi dan translasi
yang pada akhirnya akan mempengaruhi ekspresi gen (van Harten 1998;
Montelone 1998). Substitusi pasangan basa dapat terjadi antara purin dengan
purin atau pirimidin dengan pirimidin yang disebut transisi atau antara purin
dengan pirimidin atau sebaliknya yang disebut transversi (Hartl 1994; van Harten
Mutasi titik berupa penambahan dan pengurangan satu atau lebih (tapi
bukan tiga atau kelipatan tiga) nukletida pada daerah pengkode asam amino
akan mengakibatkan perubahan pada reading frame atau disebut dengan
frameshift mutation. Mutasi tipe ini akan menghasilkan protein yang tidak
fungsional atau protein yang berbeda dengan protein semula atau terjadi
pemendekan protein akibat terbentuknya stop kodon yang lebih awal (Montelone
1998).
Perubahan fenotipe yang dihasilkan akibat mutasi bervariasi, mulai dari
perubahan minor yang hanya terdeteksi dengan metode analisis biokimia sampai
perubahan drastis yang terjadi di dalam proses metabolisme yang esensial
sehingga menimbulkan kematian sel atau organsime (Hartl 1994).
Induksi Mutasi Secara In Vitro
Mutasi dapat dilakukan secara in vivo maupun in vitro (van Harten 1998).
Mutasi yang dikombinasikan dengan teknik kultur in vitro disebut in vitro
mutagenesis. Secara teknis, kultur in vitro dapat menghasilkan variasi
soma-klonal, variasi ini dapat ditingkatkan dengan menggunakan mutagen (van Harten
1998; Svetleva & Crino 2005; Chahal & Gosal 2006). Pada mutasi in vitro,
sebuah sel atau agregat sel dapat diberi perlakuan dengan mutagen kimia atau
fisik (Chahal & Gosal 2006).
Terdapat beberapa kelebihan metode induksi mutasi secara in vitro
dibandingkan metode konvensional (in vivo) antara lain 1) mutasi dapat
dilaku-kan pada tingkat sel sehingga peluang untuk terjadinya kimera lebih kecil karena
mutan yang dihasilkan berasal dari satu sel, 2) laju mutasi lebih tinggi karena
masing-masing sel mengalami kontak langsung dengan mutagen, 3) dapat
di-lanjutkan dengan seleksi secara in vitro dimana ribuan sel yang merupakan calon
tanaman dapat diseleksi pada sekala laboratorium sehingga seleksi terhadap
mutan menjadi lebih efesien (Chahal & Gosal 2006). Selain pada kultur sel,
mutasi secara in vitro juga dapat dilakukan pada eksplan multiseluler yang
ber-ukuran kecil terutama untuk menghindari kimera (van Harten 1998).
Induksi mutasi secara in vitro telah dilakukan pada banyak tanaman untuk
mendapatkan berbagai sifat yang diinginkan, baik menggunakan mutagen fisik
maupun kimia serta dilanjutkan dengan seleksi secara in vitro maupun tidak.
Induksi mutasi secara in vitro antara lain telah dilakukan pada tanaman kentang
10
dan Phytophthora infestans (Das et al. 2000; Gosal et al. 2001; Sharabash 2001;
Rashed et al. 2001), tanaman tebu untuk mendapatkan sifat ketahanan terhadap
kadar garam tinggi, penyakit red rot, genangan dan sifat tidak berbunga (Rashed
et al. 2001; Samad et al. 2001), tanaman bawang putih untuk mendapatkan sifat
ketahanan terhadap suhu tinggi (Zhen 2001a), ubi jalar untuk berbagai sifat
morfologi (Zhen 2001b), bitter potato untuk perbaikan sifat agronomis (Murillo &
Mendoza 2004), apokat untuk peningkatan keragaman genetik (Yenisbar 2005),
abaka untuk perbaikan produksi, kualitas serat dan ketahanan terhadap
Fusarium (Purwati 2006) serta anggur untuk perbaikan sifat agronomis dan
kualitas buah (Khawale et al. 2007).
EMS sebagai Mutagen
Mutagen adalah agen alami atau buatan manusia yang dapat mengubah
struktur atau sekuen DNA. Dikenal tiga jenis mutagen yaitu mutagen fisik, kimia
dan biologi. Mutagen kimia mempunyai beberapa kelebihan dibandingkan
mutagen lainnya antara lain 1) sebagian besar mutasi yang terjadi adalah mutasi
titik, 2) kerusakan kromosom lebih kecil, dan 3) mutasi terjadi dengan laju yang
lebih tinggi (meningkatkan laju mutasi 5 – 10 kali lebih tinggi dibandingkan
radiasi) (Broertjes & van Harten 1988; van Harten 1998). Namun demikian
mutagen kimia juga mempunyai beberapa kekurangannya di antaranya 1)
pene-trasi pada jaringan multiseluler seringkali sulit, 2) rendahnya reproducibility dan
3) mutagen kimia perlu penanganan sangat hati-hati karena bersifat karsinogenik
(van Harten 1998). Pada mutagenesis secara in vitro, sulitnya penetrasi
muta-gen kimia pada jaringan multiseluler dapat diatasi dengan menggunakan kultur
sel atau eksplan multiseluler yang berukuran kecil.
EMS (CH3SO2OC2H5) merupakan jenis mutagen kimia yang paling
poten-sial (Chopra 2005), banyak digunakan dan paling efektif (Medina et al. 2005)
serta telah digunakan sebagai mutagen pada berbagai jenis organisma mulai dari
virus sampai mamalia (Sega 1984). Menurut von Arnim (2005), EMS banyak
digunakan sebab toksisitasnya tidak terlalu tinggi (moderate toxicity), memiliki
efektivitas yang tinggi untuk menginduksi banyak mutasi (multiple mutations) per
genom dan biasanya mutasinya berupa substitusi satu basa.
EMS merupakan senyawa pengalkil. Gugus alkil bereaksi dengan DNA
dengan cara mengalkilasi basa purin dan pirimidin. Alkilasi atau etilasi dapat
seharusnya berpasangan dengan sitosin menjadi berpasangan dengan timin
mengakibatkan perubahan kode genetik pada generasi sel berikutnya dari GC
menjadi AT (Sega 1984). Hasil penelitian Greene et al. (2003) pada tanaman
Arabidopsis menunjukkan 99% mutasi yang terjadi akibat EMS (20 – 40 mM
selama 10-20 jam pada biji) adalah perubahan dari GC ke AT dengan 53%
perubahan pada G dan 47% perubahan pada C. Intensitas mutasi cukup tinggi
yaitu terjadi pada 1/300 kilo basa atau 10 mutasi per gen.
Pada tanaman, EMS umumnya menyebabkan terjadinya mutasi titik,
namun dapat juga menyebabkan kehilangan sedikit segmen kromosom atau
delesi (Okagaki et al. 1991 dalam Saba & Mirza 2002). Bhat et al. (2007)
menemukan beberapa ketidaknormalan perilaku kromosom saat meiosis pada
tanaman Vicia faba yang mendapat perlakuan EMS 0.1 – 0.4% (v/v) selama 6
jam pada biji. Menurut Sega (1984), pada organisme tinggkat tinggi, EMS dapat
menimbulkan kerusakan pada kromosom meskipun mekanismenya belum jelas,
kemungkinan disebabkan terjadinya etilasi pada beberapa protein kromosom.
Gaulden (1987) dalam Bhat et al. (2007) menyebutkan bahwa pengaruh
langsung mutagen terhadap protein histon mengakibatkan ketidaksempurnaan
atau kesalahan pada pelipatan DNA. Namun demikian, secara umum EMS
mengakibatkan mutasi titik dan hanya sedikit kerusakan yang ditimbulkan pada
kromosom (Greene et al. 2003). Dengan demikian penggunaan EMS pada
pemuliaan tanaman sangat menguntungkan karena dapat mengubah lokus
tertentu tanpa menginduksi sejumlah besar mutasi yang terpaut dekat dengan
lokus tersebut (Saba & Mirza 2002).
Beberapa sifat penting telah berhasil diperoleh melalui mutasi induksi
menggunakan EMS antara lain pembungaan awal pada springrape (Thurling &
Depittayanan 1992), peningkatan hasil dan kandungan vitamin C pada cabe
(Pillai & Abraham 1996), toleran salinitas pada krisantemum (Hosain et al. 2006)
dan ubi jalar (Luan et al. 2007), toleran herbisida pada tanaman kedelai
(Sebastian et al. 1989) dan ketahanan terhadap Xanthomonas oryzae pv oryzae
pada padi (Agrawal et al. 2005). Penggunaan eksplan embrio somatik fase
globuler dan hati pada mutagenesis in vitro menggunakan EMS antara lain
telah dilakukan Purwati (2006) pada tanaman abaka dan berhasil mendapatkan
12
Cekaman Suhu Tinggi pada Tanaman
Di antara berbagai cekaman lingkungan, cekaman yang diakibatkan oleh
suhu merupakan yang paling banyak dihadapi oleh tanaman (Iba 2002). Suhu
berubah lebih cepat dibandingkan penyebab cekaman lainnya. Suhu juga
ber-variasi secara spasial dan temporal. Setiap jenis tanaman mempunyai suhu
optimum masing-masing untuk tumbuh, dan pola penyebarannya di alam
ditentukan oleh zone suhu di mana ia bisa hidup. Pada masa yang akan datang,
cekaman suhu tinggi akibat pemanasan global akan menjadi ancaman bagi
kehidupan hampir seluruh mahluk hidup di bumi termasuk tanaman.
Menurut Levitt (1980) tidak ada batasan kuantitatif untuk cekaman suhu
tinggi pada tanaman. Setiap jenis tanaman mempunyai batas toleransi yang
spesifik terhadap cekaman suhu. Namun demikian, Levitt (1980) mengemukakan
bahwa suhu 15°C di atas suhu optimum untuk pertumbuhan umumnya telah
mengakibatkan cekaman suhu tinggi pada tanaman yang mempunyai toleransi
paling rendah terhadap suhu tinggi (psychrophiles), pada jenis tanaman lain
cekaman suhu tinggi mungkin terjadi pada suhu kurang dari 15°C di atas suhu
optimum untuk pertumbuhan. Wahid et al. (2007) juga mengemukakan bahwa
cekaman suhu tinggi pada tanaman umumnya terjadi pada suhu 10-15°C di atas
suhu optimum untuk pertumbuhan.
Menurut Wahid et al. (2007), akibat langsung dari cekaman suhu tinggi
pada tanaman adalah terdenaturasinya protein dan peningkatan fluiditas
membran sel. Akibat tidak langsungnya adalah enzim-enzim menjadi tidak aktif,
sintesa protein terhambat dan kehilangan integritas membran. Disintegrasi
membran dapat menyebabkan terjadinya kebocoran ion dan solut (Levitt 1980).
Levitt (1980) juga mengemukakan bahwa pengaruh utama dari cekaman suhu
tinggi adalah berkurangnya kandungan ADP dan ATP. Keadaan ini
meng-akibatkan terjadinya penghambatan pada pertumbuhan atau kematian pada
tanaman. Menurut Wahid et al. (2007) pada tingkat cekaman suhu yang sangat
tinggi kerusakan atau bahkan kematian sel dapat terjadi dalam waktu beberapa
menit, sedangkan pada cekaman suhu yang tidak terlalu tinggi (sedang),
kerusakan atau kematian sel terjadi setelah periode waktu yang cukup lama.
Menurut Zhang et al. (2005), cekaman suhu tinggi dapat mengakibatkan
kerusakan yang tidak dapat balik pada PSII dan Rubisco. Hasil penelitian Zhang
Kloroplas dan fotosintesa yang terekspresi pada tanaman yang toleran,
dibandingkan pada tanaman yang sensitif terhadap suhu tinggi.
Toleransi tanaman terhadap suhu tinggi tampaknya ditentukan oleh tingkat
sensitifitas reaksi fotokimia yang berlangsung pada membran tilakoid. Membran
tilakoid merupakan membran sel yang paling sensitif terhadap cekaman suhu
tinggi. Membran tilakoid lebih sensitif terhadap kerusakan akibat suhu tinggi
dibandingkan membran kloroplas (chloroplast envelope), dan membran kloroplas
lebih sensitif dibandingkan membran plasma (Levitt 1980). Pusat reaksi,
kompleks pigmen antena-protein dan sebagian besar enzim-enzim yang terlibat
di dalam transfer elektron merupakan integral membrane protein yang
terintegrasi pada membran tilakoid (Taiz & Zeiger 2002). Transfer elektron
adalah bagian dari tahapan reaksi terang pada fotosintesis, elektron yang
diperoleh dari hasil pemecahan molekul H2O ini diperlukan untuk mereduksi
NADP+ menjadi NADPH dan mendorong terjadinya fosforilasi ADP menjadi ATP. Kapasitas transfer elektron oleh PSII lebih sensitif terhadap kerusakan akibat
suhu tinggi dibandingkan aktifitas lainnya. Perlakuan suhu tinggi sampai 44°C
tidak mempengaruhi transfer elektron oleh PSI, akan tetapi menurunkan transfer
elektron oleh PSII sebesar 25% (Levitt 1980). Penyebab perbedaan sensitifitas
antara PSI dan PSII terhadap kerusakan akibat suhu tinggi masih belum jelas,
namun diduga berkaitan dengan perbedaan tempat berlangsungnya kedua
reaksi tersebut dan perbedaan komposisi protein penyusun PSI dan PSII. PSI
dan PSII merupakan kompleks multisubunit klorofil-protein yang terintegrasi pada
membran tilakoid. PSII berlangsung di dalam lamela grana, sedangkan PSI
berlangsung di dalam lamela stroma dan pada tepi lamela grana (Taiz & Zeiger
2002). Menurut Dekker dan Boekema (2005) dalam Mullineaux (2005),
kom-posisi protein antara lamela grana dan lamela stroma sangat berbeda.
Menurut Zhang et al. (2005), respon tanaman terhadap suhu tinggi di
antaranya adalah penurunan sintesa protein normal dan percepatan transkripsi
dan translasi heat shock protein (HSP). Respon ini dapat teramati pada level
suhu 5°C di atas suhu optimum untuk pertumbuhan. Hasil penelitian Zhang et
al. (2005) menunjukkan pada saat mendapat cekaman suhu tinggi, tanaman
yang rentan lebih sering mengekspresikan gen-gen yang berhubungan dengan
metabolisme stres seperti gen yang mengontrol sintesa protein yang
14
berusaha bertahan dengan lebih banyak menggunakan metabolit melalui
glikolisis serta perombakan protein dan lipid.
Terdapat perbedaan anatomi dan morfologi antara tanaman Festuca yang
toleran dan yang sensitif terhadap suhu tinggi. Tanaman yang toleran
mem-punyai ukuran sel yang lebih besar, lebih banyak sel skelenkima dan kolenkima
(sel pendukung) di antara jaringan vaskuler dan epidermis dibandingkan varietas
yang rentan atau sensitif (Zhang et al. 2005).
Seleksi In Vitro untuk Ketahanan terhadap Suhu Tinggi
Mutagenesis in vitro yang dilanjutkan dengan seleksi secara in vitro untuk
katahanan terhadap suhu tinggi telah dilakukan antara lain pada tanaman
kentang (Das et al. 2000; Gosal et al. 2001) dan bawang putih (Zhen 2001a).
Penelitian-penelitian ini menunjukkan keberhasilan dalam memperoleh mutan
toleran suhu tinggi. Induksi mutasi secara in vitro untuk mendapatkan mutan
toleran suhu tinggi yang tidak dilanjutkan dengan seleksi secara in vitro
melainkan secara in vivo telah dilakukan pada tanamam nenas (Lokko &
Amoatey 2001). Pada tanaman kentang, induksi mutasi dilakukan pada setek
satu buku. Seleksi ketahanan terhadap suhu tinggi dilakukan pada populasi
M1V3 berdasarkan kemampuan mutan untuk membentuk umbi mikro pada suhu
28ºC, 8ºC lebih tinggi dari suhu optimum untuk pembentukkan umbi mikro yaitu
20ºC. Seleksi juga dilakukan berdasarkan kemampuan daun mempertahankan
persistensi klorofil secara in vitro. Mutan yang mampu membentuk umbi mikro
dan mempertahankan persistensi klorofil kemudian dievaluasi di lapang yang
beriklim panas dan diperoleh beberapa mutan yang toleran. Pada tanamam
bawang putih induksi mutasi dilakukan pada struktur globular kalus embriogenik
dan seleksi dilakukan berdasarkan kemampuan mutan untuk membentuk umbi
(bulb) secara in vitro pada suhu 32ºC. Pada tanaman nenas, induksi mutasi
dilakukan pada tunas pucuk dan diperoleh mutan yang mampu tumbuh pada
suhu 45ºC di lapang. Menurut Lokko dan Amoatey (2001), suhu 10ºC lebih
tinggi dari suhu optimum untuk pertumbuhan telah cukup untuk menginduksi
Waktu dan Tempat
Penelitian dilaksanakan mulai bulan Juli 2007 sampai Juni 2008 di
laboratorium Kultur Jaringan Kelompok Peneliti Ekofisiolagi Balai Penelitian
Tanaman Obat dan Aromatik (Balittro) Bogor.
Bahan Penelitian
Bahan tanaman yang digunakan adalah eksplan daun dari tanaman
purwoceng aseptik yang telah mengalami periode kultur selama 2 tahun dengan
sub kultur setiap 2-3 bulan sekali (Gambar 1)
.
[image:30.595.243.391.322.434.2]Gambar 1 Kultur in vitro purwoceng yang digunakan sebagai sumber eksplan.
Metode
Penelitian diawali dengan persiapan bahan tanaman berupa induksi
embriogenesis somatik dilanjutkan dengan aplikasi EMS dan seleksi in vitro pada
beberapa taraf suhu ruang.
Induksi Embriogenesis Somatik
Induksi embriogeneisis somatik dilakukan menggunakan metode yang dikembangakan oleh Rostika et al. 2005. Induksi embriogenesis somatik diawali
dengan induksi kalus dari eksplan potongan daun purwoceng berukuran sekitar
0.5 – 1 cm x 0.5 – 1 cm. Kalus diinduksi pada media Murashige dan Skoog (MS) dengan penambahan zat pengatur tumbuh 2,4-D 2 mg/l dan pikloram 0.5 mg/l,
gula 30 g/l dan pemadat phytagel 2 g/l dengan pH media 5.8. Setiap botol kultur
16
suhu 16-18ºC dalam kondisi gelap sampai terbentuk kalus. Kalus yang telah
terbentuk kemudian disubkultur pada media embriogenesis somatik yaitu media
Driver, Kuniyuki dan Walnut (DKW) dengan penambahan zat pengatur tumbuh
IBA 5 mg/l, gula 30 g/l dan pemadat phytagel 2 g/l dengan pH media 5.8. Setiap
botol diisi 4 potong kalus berukuran panjang dan lebar sekitar 1 cm x 1 cm.
Kultur kemudian diinkubasi pada suhu 16 - 18ºC dengan pencahayaan 2 buah
lampu TL masing-masing 40 watt selama 16 jam sampai terbentuk embrio
somatik.
Aplikasi EMS
Perlakuan EMS dimaksudkan untuk meningkatkan keragaman genetik
embrio somatik purwoceng. Sekitar 432 potong eksplan embrio somatik
berukuran sekitar 0.5 x 0.5 x 0.5 cm3 yang sebagian besar berada pada fase globular dan hati direndam di dalam larutan EMS 0, 0.1, 0.3, 0.5 dan 0.7% (v/v)
dengan lama perendaman 1 atau 2 jam. Larutan bufer natrium fosfat pH 7 0.1M
dan DMSO (dimethyl sulfo-oxida) 4% dipergunakan sebagai pelarut EMS (EMS
0%). Sebagai kontrol digunakan aquades dengan lama perendaman yang sama.
Masing-masing perlakuan terdiri dari 36 eksplan. Setelah diberi perlakuan EMS,
eksplan dibilas 3 kali dengan aquades steril (kecuali kontrol aquades), kemudian
diletakkan di dalam cawan petri yang telah diberi lapisan kertas saring steril.
Setelah itu eksplan ditanam pada media DKW dengan penambahan zat pengatur
tumbuh IBA 5 mg/l, gula 30 g/l dan pemadat phytagel 2 g/l dengan pH media 5.8
sebanyak 3 eksplan per botol. Dengan demikian setiap perlakuan terdiri dari 12
botol.
Seleksi In Vitro
Seleksi in vitro dilakukan di dalam 3 buah ruangan yang berbeda yaitu
ruang inkubasi kontrol dengan rata-rata suhu siang 17.3 ± 0.5ºC, ruang seleksi I
dengan rata-rata suhu siang 23.3 ± 2.1ºC dan ruang seleksi II dengan rata-rata
suhu siang 32.8 ± 1.7ºC. Suhu 17.3 ± 0.5ºC pada ruang inkubasi kontrol dan
suhu 23.3 ± 2.1ºC pada ruang seleksi I dikontrol dengan menggunakan AC,
sedangkan suhu 32.8 ± 1.7ºC pada ruang seleksi II diperoleh dengan
menggunakan bantuan lampu pijar yang dicat hitam sebagai sumber panas.
Lampu pijar diletakkan pada bagian atas rak kultur bersebelahan dengan lampu
ditanam pada media DKW + IBA 5 mg/l diinkubasi pada masing-masing suhu
seleksi dengan pencahayaan dua buah lampu TL masing-masing 40 watt selama
16 jam. Penempatan perlakuan EMS di dalam masing-masing suhu seleksi
menggunakan rancangan lingkungan acak kelompok dengan 4 ulangan.
Masing-masing ulangan terdiri dari 1 botol kultur dan Masing-masing-Masing-masing botol kultur terdiri
dari 3 eksplan. Seleksi dilakukan selama 3 bulan dengan subkultur setiap bulan.
Subkultur dilakukan pada media yang sama kecuali apabila telah terbentuk tunas
atau kecambah fase kotiledon akhir dan akar subkultur dilakukan pada media
DKW tanpa zat pengatur tumbuh. Untuk mengetahui kondisi suhu seleksi
dilakukan pengukuran suhu harian pada pukul 09.00, 12.00 dan 15.00 WIB.
Pertukaran posisi botol kultur di dalam ulangan dilakukan setiap 2 kali seminggu
untuk lebih memeratakan suhu di antara botol kultur yang diinkubasi pada suhu
32.8 ± 1.7ºC.
Peubah yang diamati meliputi penambahan bobot segar eksplan (diamati
setiap bulan pada umur 1, 2 dan 3 bulan), persentase eksplan membentuk tunas
(diamati setiap bulan pada umur 1, 2 dan 3 bulan), jumlah tunas per eksplan
(diamati setiap bulan pada umur 1, 2 dan 3 bulan) dan persentase eksplan hidup
(diamati setiap bulan pada umur 1, 2 dan 3 bulan). Di samping itu dilakukan juga
pengamatan terhadap tipe dan frekuensi variasi fenotipe tunas umur 3 bulan
pada masing-masing perlakuan EMS dan suhu seleksi. Frekuensi variasi tunas
dihitung dengan cara berikut :
Jumlah tunas dengan tipe variasi fenotipe tertentu
Frekuensi variasi = --- X 100% Jumlah tunas yang diamati
Kriteria seleksi didasarkan pada kemampuan eksplan bertahan hidup
pada kondisi suhu seleksi. Embrio somatik yang mampu bertahan hidup atau
tunas yang terbentuk dan mampu bertahan hidup selama periode seleksi
dikategorikan sebagai embrio somatik dan tunas yang tahan atau tidak sensitif
terhadap suhu seleksi. Sebaliknya embrio somatik atau tunas yang tidak dapat
bertahan hidup atau mati selama periode seleksi dianggap sebagai embrio
somatik atau tunas yang tidak tahan atau sensitif terhadap suhu seleksi.
Analisis ragam dilanjutkan dengan uji Jarak Berganda Duncan pada taraf α 0.05 menggunakan program SAS 9.1 dilakukan untuk mengetahui pengaruh
perlakuan EMS terhadap pertumbuhan dan perkembangan eksplan pada
HASIL DAN PEMBAHASAN
Keadaan Umum Penelitian Induksi Kalus dan Embriogenesis Somatik
Kalus purwoceng berhasil diinduksi dari eksplan daun pada media MS
dengan penambahan zat pengatur tumbuh 2,4-D 2 mg/l + pikloram 0.5 mg/l.
Inisiaisi kalus mulai terbentuk pada umur 1 minggu. Pada umur 4 minggu hampir
seluruh permukaan eksplan telah ditutupi oleh kalus. Kalus yang terbentuk
berwarna krem keputihan atau krem muda dengan struktur yang kompak
(Gambar 2A dan B). Setelah berumur 6 minggu kalus dipindahkan ke dalam
media induksi embriogenesis somatik yaitu media DKW dengan penambahan zat
pengatur tumbuh IBA 5 mg/l. Pada umur 6 minggu mulai terbentuk embrio
somatik fase globuler dan hati berwarna krem kehijauan (Gambar 2C dan D).
Embrio somatik pada fase ini kemudian digunakan sebagai bahan untuk induksi
mutasi dengan EMS dilanjutkan dengan seleksi in vitro pada suhu tinggi.
[image:33.595.185.440.407.662.2]
C D
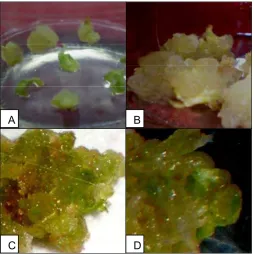
Gambar 2 Kalus yang diinduksi dari eksplan daun pada media MS + 2,4-D 2 mg/l + pikloram 0.5 mg/l umur 4 minggu (A) dan 6 minggu (B) serta embrio somatik fase globuler (C) dan fase hati (D) yang diinduksi pada media DKW + IBA 5 mg/l
A B
Keadaan Suhu Ruang Seleksi
Hasil pengukuran suhu harian pada masing-masing ruang seleksi
menunjukkan rata-rata suhu siang hari di dalam ruang inkubasi kontrol adalah
17.3 ± 0.5ºC, ruang seleksi I 23.3 ± 2.1ºC dan ruang seleksi II 32.8 ± 1.7ºC.
Rata-rata suhu siang pada ruang inkubasi kontrol relatif stabil, sedangkan di
dalam ruang seleksi I dan II berfluktuasi seiring dengan perubahan suhu
ling-kungan. Pada ruang seleksi I rata-rata suhu pukul 12.00 dan 15.00 lebih tinggi
sekitar 0.2ºC dan 1.3ºC dibandingkan rata-rata suhu pukul 09.00. Demikian juga
pada ruang seleksi II, rata-rata suhu pukul 12.00 dan 15.00 lebih tinggi sekitar
0.9ºC dan 1ºC dibandingkan rata-rata suhu pada pukul 09.00 (Tabel 1).
Peng-gunaan AC yang intensif pada ruang inkubasi kontrol menyebabkan suhu pada
ruang tersebut lebih stabil dibandingkan suhu pada ruang seleksi I dan II. Pada
ruang seleksi I AC digunakan secara terbatas, sedangkan pada ruang seleksi II
tidak dipergunakan AC. Suhu pada ruang inkubasi kontrol merupakan suhu
[image:34.595.119.515.417.673.2]yang selama ini digunakan untuk kultur in vitro purwoceng.
Tabel 1 Rata-rata suhu harian pada masing-masing ruang seleksi
Ruang seleksi Waktu pengukuran (WIB)
Rata-rata suhu (ºC)
Kontrol 09.00 17.3 ± 0.5
12.00 17.3 ± 0.5
15.00 17.3 ± 0.6
Rata-rata 17.3 ± 0.5
Ruang I 09.00 22.9 ± 2.0
12.00 23.1 ± 1.7
15.00 24.2 ± 2.2
Rata-rata 23.3 ± 2.1
Ruang II 09.00 32.2 ± 1.4
12.00 33.1 ± 1.6
15.00 33.2 ± 1.8
20
Keadaan Kultur
Sekitar 80% kultur yang diinkubasi pada suhu 32.8 ± 1.7ºC mengalami
kontaminasi. Sebagian besar kontaminan berupa bakteri (Gambar 3), hanya
sekitar 10% kontaminan berupa cendawan. Kontaminasi yang terjadi pada suhu
kontrol dan suhu 23.3 ± 2.1ºC sekitar 10% yang terdiri dari kontaminan bakteri
dan cendawan. Meskipun terkontaminasi, kultur pada suhu 32.8 ± 1.7ºC dapat
dipertahankan dan diamati sampai akhir seleksi karena perkembangan bakteri
[image:35.595.230.384.264.385.2]relatif lambat, dan setiap bulan selalu dilakukan sub kultur ke dalam media baru.
Gambar 3 Kultur yang mengalami kontaminasi bakteri pada suhu 32.8 ± 1.7ºC
Pengaruh Suhu Seleksi dan EMS terhadap Pertumbuhan dan Perkembangan Eksplan
Indikasi pengaruh fisiologis dari mutagen pada mutagenesis secara in vitro,
dapat dilihat berdasarkan pengaruh penghambatannya terhadap pertumbuhan,
kemampuan hidup dan kemampuan regenerasi eksplan setelah aplikasi mutagen
dibandingkan kontrol tanpa perlakuan mutagen (van Harten 1998; Roux 2004).
Hasil penelitian menunjukkan pertumbuhan dan perkembangan eksplan
cen-derung semakin menurun dengan meningkatnya suhu seleksi dan dosis EMS
yang digunakan. Pertumbuhan dan perkembangan eksplan cenderung
terham-bat pada suhu 32.8 ± 1.7ºC dan dosis EMS 0.7% selama 2 jam.
Penambahan Bobot Segar Eksplan
Peubah bobot segar eksplan digunakan untuk mengukur pertumbuhan
tanaman baik secara in vitro maupun in vivo (van Harten 1998; Roux 2004;
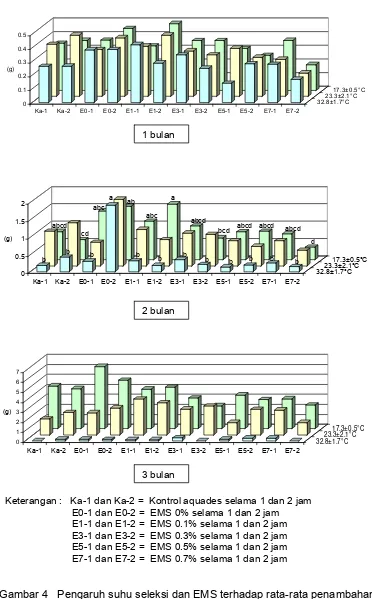
Medina et al. 2005). Rata-rata penambahan bobot segar eksplan semakin
segar eksplan umur 1, 2 dan 3 bulan pada suhu kontrol berturut-turut berkisar
antara 0.1890 - 0.4892 g, 0.3659 - 1.6139 g dan 2.2859 - 6.1972 g. Pada suhu
23.3 ± 2.1ºC berkisar antara 0.1710 - 0.4429 g, 0.4497 - 1.9279 g dan 1.2287 -
3.5572 g dan pada suhu 32.8 ± 1.7 ºC berkisar antara 0.1393 - 0.4223 g, 0.1420
- 1.9263 g dan 0 - 0.3062 g. Suhu 32.8 ± 1.7ºC menunjukkan rata-rata
penam-bahan bobot segar eksplan paling rendah pada umur 1, 2 dan 3 bulan (Gambar
4).
Rata-rata penambahan bobot segar eksplan pada suhu kontrol dan suhu
23.3 ± 2.1ºC cenderung meningkat dengan semakin meningkatnya umur
eksplan, sedangkan rata-rata penambahan bobot segar eksplan pada suhu 32.8
± 1.7ºC cenderung menurun dengan meningkatnya umur eksplan atau
ber-tambah lamanya periode seleksi (Gambar 4). Hal ini menunjukkan suhu 32.8 ±
1.7ºC cenderung memberikan penghambatan terhadap pertumbuhan eksplan,
dan penghambatannya semakin besar dengan bertambah lamanya periode
seleksi. Menurut Sung et al. (2003), besarnya cekaman yang ditimbulkan oleh
suhu berbeda-beda tergantung dari intensitas derajat suhu, laju perubahan suhu
dan lamanya periode cekaman. Hasil penelitian Chalupa dan Durzan (1973)
dalam Chalupa (1987) dan Chalupa (1987) menunjukkan suhu memberikan
pengaruh terhadap pertumbuhan kalus tanaman Picea abies dan Pinus
banksiana. Suhu optimum untuk pertumbuhan kalus diperoleh pada suhu 25°C.
Suhu di bawah dan di atas suhu optimum menghambat pertumbuhan kalus yang
ditandai oleh rata-rata bobot segar dan bobot kering kalus yang lebih rendah
dibandingkan pada suhu 25°C.
Pengaruh EMS terhadap rata-rata penambahan bobot segar eksplan pada
suhu kontrol nyata pada umur 2 bulan. Rata-rata penambahan bobot segar
eksplan cenderung semakin menurun dengan meningkatnya dosis EMS yang
digunakan. Rata-rata penambahan bobot segar eksplan umur 2 bulan paling
tinggi diperoleh pada perlakuan EMS 0.1% selama 2 jam yaitu 1.6139 g, namun
hanya berbeda nyata dengan kontrol aquades selama 2 jam serta EMS 0.3 dan
0.7% selama 2 jam yang berturut-turut menunjukkan penambahan bobot segar
0.5835 g, 0.6383 g dan 0.3659 g. Perlakuan EMS 0.1% selama 2 jam juga
cenderung menunjukkan rata-rata penambahan bobot segar eksplan paling tinggi
pada umur 1 bulan yaitu 0.4892 g, sedangkan rata-rata penambahan bobot segar
eksplan paling tinggi umur 3 bulan ditunjukkan oleh perlakuan EMS 0% selama
22
Keterangan : Ka-1 dan Ka-2 = Kontrol aquades selama 1 dan 2 jam E0-1 dan E0-2 = EMS 0% selama 1 dan 2 jam E1-1 dan E1-2 = EMS 0.1% selama 1 dan 2 jam E3-1 dan E3-2 = EMS 0.3% selama 1 dan 2 jam E5-1 dan E5-2 = EMS 0.5% selama 1 dan 2 jam
[image:37.595.114.486.95.694.2]E7-1 dan E7-2 = EMS 0.7% selama 1 dan 2 jam
Gambar 4 Pengaruh suhu seleksi dan EMS terhadap rata-rata penambahan bobot segar eksplan umur 1, 2 dan 3 bulan. Huruf yang sama pada umur dan suhu seleksi yang sama tidak berbeda nyata berdasarkan uji Jarak Berganda Duncan pada taraf α = 0.05.
0 0.5 1 1.5 2 (g)
Ka-1 Ka-2 E0-1 E0-2 E1-1 E1-2 E3-1 E3-2 E5-1 E5-2 E7-1 E7-2
32.8±1.7°C23.3±2.1°C 17.3±0.5°C abcd cd abc ab abc a abcd
bcd abcd abcd abcd d b
b b a
b
b b b b b b b
0 1 2 3 4 5 6 7 (g)
Ka-1 Ka-2 E0-1 E0-2 E1-1 E1-2 E3-1 E3-2 E5-1 E5-2 E7-1 E7-2
32.8±1.7°C 23.3±2.1°C17.3±0.5°C 3 bulan 0 0.1 0.2 0.3 0.4 0.5 (g)
Ka-1 Ka-2 E0-1 E0-2 E1-1 E1-2 E3-1 E3-2 E5-1 E5-2 E7-1 E7-2
32.8±1.7°C23.3±2.1°C 17.3±0.5°C
1 bulan
statistik tidak nyata. Perlakuan EMS 0.7% selama 2 jam cenderung
menun-jukkan rata-rata penambahan bobot segar eksplan paling rendah pada umur 1, 2
dan 3 bulan, yaitu berturut-turut 0.1890 g, 0.3659 g, dan 2.3751 g (Gambar 4).
Hal ini menunjukkan EMS 0.7% selama 2 jam cenderung memberikan
peng-hambatan terhadap pertumbuhan eksplan yang diinkubasi pada suhu kontrol.
Pada suhu kontrol, pengaruh tekanan dari suhu seleksi dianggap tidak ada,
sehingga pengaruh penghambatan terhadap pertumbuhan eksplan dapat
dianggap sebagai pengaruh penghambatan dari EMS secara tunggal.
Rata-rata penambahan bobot segar eksplan pada suhu 23.3 ± 2.1ºC juga
cenderung semakin menurun dengan meningkatnya dosis EMS, namun demikian
pengaruhnya secara statistik tidak nyata pada umur 1, 2 dan 3 bulan. Perlakuan
kontrol aquades, EMS 0 dan 0.1% selama 2 jam cenderung menunjukkan
rata-rata penambahan bobot segar eksplan umur 1 bulan lebih tinggi dibandingkan
perlakuan lainnya. Demikian juga perlakuan EMS 0% selama 2 jam pada umur
2 bulan dan EMS 0.1% selama 1 dan 2 jam pada umur 3 bulan. Perlakuan EMS
0.7% selama 2 jam cenderung menunjukkan rata-rata penambahan bobot segar
eksplan paling rendah pada umur 1, 2 dan 3 bulan yaitu berturut-turut 0.1710 g,
0.4497 g dan 1.2287 g (Gambar 4).
EMS memberikan pengaruh nyata terhadap rata-rata penambahan bobot
segar eksplan umur 2 bulan pada suhu 32.8 ± 1.7ºC. Rata-rata penambahan
bobot segar eksplan umur 2 bulan paling tinggi ditunjukkan oleh perlakuan EMS
0% selama 2 jam yaitu 1.9263 g, berbeda nyata dengan kontrol aquades dan
perlakuan EMS lainnya yang berkisar antara 0.1420 – 0.4239 g. Tidak terdapat
perbedaan rata-rata penambahan bobot segar yang nyata di antara kontrol
aqudes dan perlakuan EMS lainnya (Gambar 4). Pengaruh perlakuan EMS pada
umur 1 dan 3 bulan secara statistik tidak nyata, namun demikian perlakuan EMS
0.1 dan 0.3% selama 1 jam cenderung menunjukkan rata-rata penambahan
bobot segar eksplan yang lebih tinggi berturut-turut pada umur 1 dan 3 bulan
(Gambar 4).
Adanya pengaruh penghambatan dari EMS terhadap pertumbuhan dan
perkembangan eksplan embrio somatik telah dikemukakan oleh peneliti
sebe-lumnya di antaranya Yenisbar (2005) dan Purwati (2006), sedangkan pengaruh
dorongan EMS pada dosis rendah terhadap pertumbuhan eksplan embrio
somatik apokat antara lain dikemukakan oleh Yenisbar (2005) dan terhadap
24
dosis rendah juga dilaporkan mendorong pertumbuhan kalus tanaman buncis
(Svetleva & Crino 2005). Menurut van Harten (1998) dosis mutagen merupakan
hasil perkalian antara konsentrasi dan lama periode perlakuan. Semakin tinggi
konsentrasi dan lama periode perlakuan maka semakin besar dosis mutagen
yang diterima oleh tanaman. Semakin tinggi dosis mutagen semakin tinggi efek
penghambatannya terhadap pertumbuhan dan perkembangan eksplan. Namun
demikian sensitifitas setiap material tanaman terhadap mutagen berbeda-beda
tergantung faktor genetik, fisiologis dan kondisi lingkungan pada saat dan setelah
aplikasi mutagen. Penghambatan ini diduga disebabkan oleh terjadinya
kerusakan DNA pada sel yang diberi perlakuan mutagen (Gichner 2003 dalam
Purwati 2006). Dorongan EMS pada dosis rendah terhadap pertumbuhan
eksplan diduga berkaitan dengan pengaruh stres yang ditimbulkan akibat
penggunaan EMS (Van et al. 2008). Menurut Pius et al. (1994) dalam Van et al.
(2008), EMS merupakan salah satu elemen stres, dan pengaruh dorongannya
terhadap daya regenerasi pada kultur jaringan somatik telah dilaporkan
sebe-lumnya. Gaj (2002) dalam Van et al. (2008) juga mengemukakan bahwa
pe-ngaruh dorongan EMS pada dosis rendah terhadap pertumbuhan eksplan bukan
disebabkan oleh pengaruh EMS secara langsung, melainkan diakibatkan oleh
pengaruh stres yang ditimbulkan akibat perlakuan EMS.
Penggunaan pelarut bufer natrium fosfat pH 7 0.1M dan DMSO 4% (EMS
0%) cenderung meningkatkan penambahan bobot segar eksplan. Bagaimana
larutan bufer natrium fosfat dapat meningkatkan penambahan bobot segar
eksplan masih belum jelas, apakah disebabkan NaH2PO4 dan Na2HPO4 yang
digunakan sebagai bahan pembuatan bufer menjadi sumber nutrisi tambahan
bagi eksplan, atau ada pengaruh lain. Hasil ini berbeda dengan yang diperoleh
Wang et al. (2007), di mana kontrol bufer fosfat pH 3 0.1M memberikan
penghambatan terhadap kemampuan hidup eksplan kalus jagung. Diduga pH
yang rendah pada penelitian Wang et al. bersifat toksik terhadap eksplan. Bufer
natr