HIDROLISIS PATI UMBI TACCA MENGGUNAKAN
EKSTRAK KASAR
α
-AMILASE DARI
Brevibacterium
sp.
UNTUK MENGHASILKAN OLIGOSAKARIDA
FEBY HERYANI PUTRI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Hidrolisis Pati Umbi Tacca Menggunakan Ekstrak Kasar α-Amilase dari Brevibacterium sp. untuk Menghasilkan Oligosakarida adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
FEBY HERYANI PUTRI. Hidrolisis Pati Umbi Tacca Menggunakan Ekstrak Kasar α-Amilase dari Brevibacterium sp. untuk Menghasilkan Oligosakarida. Dibimbing oleh MEGA SAFITHRI dan NANIK RAHMANI.
Oligosakarida memiliki fungsi penting dalam berbagai bidang seperti kesehatan, industri, pangan dan pakan, termasuk sebagai bahan pangan fungsional (prebiotik). Oligosakarida dapat diproduksi dari umbi Tacca (Tacca leontopetaloides) yang mengandung 66.65% pati. Umbi Tacca yang digunakan berasal Hutan Jati, dan enzim yang digunakan adalah α-amilase dari Brevibacterium sp. yang memiliki aktivitas enzim sebesar 1.78 U mL-1. Tujuan penelitian ini yaitu menentukan kondisi optimum reaksi hidrolisis pati umbi Tacca serta menentukan jenis oligosakaridanya menggunakan Kromatografi Lapis Tipis (KLT) dan Kromatografi Cair Kinerja Tinggi (KCKT). Hasil penelitian menunjukkan reaksi hidrolisis pati umbi Tacca menggunakan α-amilase dari Brevibacterium sp. untuk menghasilkan oligosakarida memiliki kondisi optimum pada konsentrasi substrat 3%, perbandingan enzim dan substrat 1:5 serta waktu hidrolisis selama 6-8 jam. Analisis profil oligosakarida dengan KLT dan KCKT menunjukkan bahwa hidrolisat mengandung oligosakarida jenis maltooligosakarida berupa maltosa, maltotriosa dan maltotetraosa.
Kata kunci: umbi Tacca, Brevibacterium sp., maltooligosakarida, Kromatografi Lapis Tipis (KLT), Kromatografi Cair Kinerja Tinggi (KCKT)
ABSTRACT
FEBY HERYANI PUTRI. Tacca Tuber Starch Hydrolysis Using Crude Extract α -Amylase from Brevibacterium sp. to Produce Oligosaccharides. Supervised by MEGA SAFITHRI and NANIK RAHMANI.
Oligosaccharides have an important function in various sectors such as healthcare, industrial, food and feed, including as functional food ingredients (prebiotics). Oligosaccharides were produced from Tacca tubers (Tacca leontopetaloides) which containing 66.65 % of starch. Tacca tubers were used from Hutan Jati, and enzymes were used α-amylase from Brevibacterium sp. which has enzyme activity of 1.78 U mL-1 . The purposes of this research are to determine the optimum conditions Tacca tuber starch hydrolysis reaction and determine the type of oligosaccharides using Thin Layer Chromatography (TLC) and High Performance Liquid Chromatography (HPLC). Optimal production was achieved at 3 % substrate concentration, enzyme and substrate ratio of 1:5 and hydrolysis time of 6-8 hours. Oligosaccharides profile analysis both using TLC and HPLC showed that the enzimatically hydrolyzed samples contained maltose, maltotriose and maltotetraose.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
HIDROLISIS PATI UMBI TACCA MENGGUNAKAN
EKSTRAK KASAR
α
-AMILASE DARI
Brevibacterium
sp.
UNTUK MENGHASILKAN OLIGOSAKARIDA
FEBY HERYANI PUTRI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
Judul Skripsi : Hidrolisis Pati Umbi Tacca Menggunakan Ekstrak Kasar α-Amilase dari Brevibacterium sp. untuk Menghasilkan Oligosakarida
Nama : Feby Heryani Putri NIM : G84090025
Disetujui oleh
Dr Mega Safithri, SSi MSi Pembimbing I
Nanik Rahmani, MSi Pembimbing II
Diketahui oleh
Dr I Made Artika, MAppSc Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala nikmat dan karunia-Nya sehingga penyusunan karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Februari 2013 hingga bulan Januari 2014 ini berjudul Hidrolisis Pati Umbi Tacca Menggunakan Ekstrak Kasar α -Amilase dari Brevibacterium sp. untuk Menghasilkan Oligosakarida. Penelitian ini didanai oleh DIPA PN Pusat Penelitian Biologi LIPI Tahun 2011-2013.
Terima kasih penulis ucapkan kepada Ibu Dr Mega Safithri dan Ibu Nanik Rahmani, MSi selaku pembimbing yang telah memberi arahan dan bimbingan. Di samping itu, penghargaan penulis sampaikan kepada Dr Yopi, Mbak Rohanah, Mbak Lia dan Mas Dicky dari Laboratorium Biokatalis dan Fermentasi (LBF) Bidang Bioproses, Pusat Penelitian Bioteknologi, LIPI Cibinong. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, keluarga, serta seluruh teman dan sahabat dari Biokimia 46 dan Pondok Asad atas doa dan dukungannya.
Semoga karya ilmiah ini bermanfaat bagi pengembangan ilmu pengetahuan khususnya bidang biokimia.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE PENELITIAN 2
Bahan 2
Alat 2
Lokasi dan Waktu Penelitian 3
Prosedur Percobaan 3
HASIL 5
Amilase Ekstrak Kasar 5
Kondisi Optimum Hidrolisis Enzimatis Pati Umbi Tacca 6
Hidrolisis Pati Umbi Tacca Skala Besar 11
Analisis Oligosakarida Dengan Kromatografi Cair Kinerja Tinggi (KCKT) 13
PEMBAHASAN 15
Amilase Ekstrak Kasar 15
Kondisi Optimum Hidrolisis Enzimatis Pati Umbi Tacca 16
Hidrolisis Pati Umbi Tacca Skala Besar 18
Analisis Oligosakarida dengan Kromatografi Cair Kinerja Tinggi (KCKT) 18
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 20
LAMPIRAN 23
DAFTAR TABEL
1 Derajat polimerisasi hasil hidrolisis pati Umbi Tacca pada berbagai
konsentrasi substrat 8
2 Derajat polimerisasi hasil hidrolisis pati umbi Tacca pada berbagai
perbandingan enzim dan substrat 10
3 Rf spot standar dan oligosakarida hasil analisis KLT 12 4 Waktu retensi standar KCKT dan oligosakarida (segar dan freeze dry) 14
DAFTAR GAMBAR
1 Hasil peremajaan isolat Brevibacterium sp. pada media padat 6 2 Media kultur bakteri sebelum ditanami bakteri (a) dan setelah
ditanami bakteri (kultur hari ke-4) (b) 6
3 Konsentrasi gula pereduksi (µg mL-1) hasil hidrolisis pati umbi
5 Konsentrasi gula total (µg mL-1) hasil hidrolisis pati umbi Tacca pada berbagai perbandingan enzim dan substrat 1:10, 1;5,
1:2, 1:1 9
6 Konsentrasi gula pereduksi (µg mL-1) hasil hidrolisis pati umbi Tacca pada berbagai perbandingan enzim dan substrat 1:10, 1;5,
1:2, 1:1 9
7 Kromatogram KLT pada berbagai perbandingan enzim dan substrat
1:10 (a), 1:5 (b), 1:2 (c) dan 1:1 (d) 10
8 Oligosakarida Tacca segar (a) dan freeze dry (b) hasil hidrolisis skala
besar 11
9 Kromatogram KLT oligosakarida segar (a), freeze dry 1% (b), 2% (c), dan 3% (d) hasil hidrolisis pati umbi Tacca skala besar 12 10 Kromatogram KCKT standar glukosa dan maltosa (a), maltotriosa (b)
serta maltopentosa (c) 13
11 Kromatogram KCKT hasil hidrolisis pati umbi Tacca skala besar oligosakarida segar (a), dan freeze dry (b) 14
DAFTAR LAMPIRAN
1 Kurva standar glukosa untuk penentuan aktivitas amilase 23 2 Perhitungan aktivitas enzim amilase ekstrak kasar 24 3 Kurva standar untuk perhitungan gula pereduksi dan gula total 25 4 Perhitungan konsentrasi gula pereduksi dan gula total hasil hidrolisis
pati umbi Tacca pada berbagai konsentrasi substrat 26 5 Perhitungan konsentrasi gula pereduksi dan gula total hasil hidrolisis
pati umbi Tacca pada berbagai perbandingan enzim dan substrat 28 6 Konsentrasi gula pereduksi, gula total dan derajat polimerisasi hasil
PENDAHULUAN
Indonesia merupakan negara agraris yang kaya akan hasil alam termasuk tanaman pangan. Tanaman pangan ini dimanfaatkan untuk kebutuhan konsumsi makhluk hidup. Pengembangan pertanian saat ini tidak hanya berorientasi pada peningkatan produksi, tetapi juga pada produktivitas dan nilai tambah bahan pangan tersebut. Umbi Tacca (Tacca leontopetaloides) adalah salah satu tanaman pangan sumber karbohidrat alternatif yang banyak ditemui tumbuh liar di seluruh wilayah pesisir Indonesia, misalnya di daerah pesisir Garut Selatan dengan nama lokal jalawure, dan di daerah Kabupaten Kepulauan Talaud khususnya Kecamatan Nanusa, Sulawesi Utara dengan nama lokal anuwun. Umbi Tacca ini tidak dapat langsung dikonsumsi karena pada umbi tersebut terdapat senyawa rasa pahit Taccaline. Selain itu, pengembangan umbi Tacca ini juga masih sangat terbatas. Masyarakat disekitarnya hanya mengonsumsi umbi Tacca sebagai bahan pangan alternatif pengganti beras, dan tepung Tacca digunakan untuk membuat berbagai jenis kue, baik kue kering maupun kue basah (Aatjin 2012).
Umbi Tacca mengandung 66.65% pati yang terdiri dari 22.7% amilosa dan 43.88% amilopektin (Aatjin 2012). Pati yang dikandung oleh umbi Tacca ini berpotensi untuk menghasilkan oligosakarida melalui proses hidrolisis enzimatis. Dengan mengubah terlebih dahulu pati menjadi oligosakarida, nilai jual umbi Tacca akan semakin tinggi.
Oligosakarida memiliki fungsi penting dalam berbagai bidang seperti kesehatan, industri, pangan dan pakan. Di bidang kesehatan oligosakarida memiliki pengaruh yang menguntungkan terhadap proliferasi sel dari dinding mukosa usus, menunjukkan sifat anti radang dan aktivitas antitumor, serta meningkatkan aktivitas motorik usus (Haryati et al. 2010). Selain itu oligosakarida juga berfungsi dalam penurunan kolesterol serta pencegah karies (Nakakuki 2002). Di bidang industri oligosakarida dimanfaatkan pada pembuatan berbagai produk sehari-hari seperti kue, roti, yoghurt, permen, sirup dan minuman ringan lainnya (Nakakuki 2002). Di bidang pangan oligosakarida berperan sebagai bahan pangan fungsional (prebiotik) dan pengawet makanan (Barreteau et al. 2006). Selain untuk manusia, oligosakarida juga dapat digunakan sebagai prebiotik untuk ternak (Haryati et al. 2010) dan zat pemacu pertumbuhan alternatif yang aman sebagai pengganti antibiotik pada unggas (Nurmeiliasari 2008).
2
yang merupakan bakteri laut gram positif, bersifat aerobik serta dapat menghasilkan amilase pada kondisi suhu ruang dan pH 8 (Rahmani et al. 2011a).
Proses hidrolisis enzimatis dipengaruhi oleh beberapa faktor, yaitu enzim, konsentrasi substrat, suhu, pH, waktu hidrolisis, perbandingan enzim dan substrat serta pengadukan (Purba 2009). Oleh karena itu, pada penelitian ini dilakukan optimasi hidrolisis enzimatis pati umbi Tacca menggunakan amilase dari Brevibacterium sp. untuk menghasilkan oligosakarida dengan menggunakan beberapa parameter, yaitu konsentrasi substrat, perbandingan konsentrasi enzim dan konsentrasi substrat, serta waktu hidrolisis. Hasil hidrolisis tersebut selanjutnya dianalisis gula total, gula pereduksi, Kromatografi Lapis Tipis (KLT) dan Kromatografi Cair Kinerja Tinggi (KCKT).
Tujuan penelitian ini yaitu menentukan kondisi optimum reaksi hidrolisis pati umbi Tacca untuk menghasilkan oligosakarida serta menganalisis profil oligosakarida hasil hidrolisis pada kondisi optimum tersebut. Adapun hipotesis dari penelitian ini adalah oligosakarida dapat dihasilkan melalui proses hidrolisis
pati umbi Tacca menggunakan enzim α-amilase dari Brevibacterium sp. pada
kondisi optimum konsentrasi substrat ≤7.5%, perbandingan enzim dan substrat ≤1:10 dan waktu hidrolisis ≤8 jam, serta oligosakarida yang dihasilkan merupakan
jenis maltooligosakarida. Penelitian ini diharapkan dapat memberikan pengetahuan dan nilai guna mengenai manfaat pati umbi Tacca dan produk turunannya berupa oligosakarida yang bernilai jual tinggi dan berfungsi sebagai komponen pangan sehat seperti prebiotik.
METODE PENELITIAN
Bahan
Bahan utama yang digunakan sebagai substrat yaitu pati hasil ekstraksi umbi Tacca asal Hutan Jati berumur 9 bulan yang dikulturkan di Laboratorium Biak Sel dan Jaringan Tanaman, Bidang Biologi Sel dan Jaringan, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong-Bogor. Adapun bahan-bahan yang digunakan dalam pembuatan media peremajaan, pertumbuhan, dan produksi amilase ekstrak kasar yaitu artificial sea water (ASW), yeast extract, pepton, pati komersial, akuades, agar. Isolat Brevibacterium sp. merupakan koleksi bakteri laut di Laboratorium Biokatalis dan Fermentasi, Pusat penelitian Bioteknologi, LIPI Cibinong Bogor. Bahan-bahan lain yang digunakan untuk analisis kimia yaitu aquades, buffer fosfat pH 6.6 (0.02 M), pereaksi DNS (dinitrosalicylic acid), fenol 5% (b/v), H2SO4 pekat, n-butanol, asam asetat, α -difenilamin, aseton, asam fosfat, anilin dan asetonitril.
Alat
Alat-alat yang digunakan untuk pembuatan media peremajaan dan pertumbuhan bakteri yaitu Erlenmeyer, cawan petri steril, magnetic stirrer, jarum ose steril, bunsen, laminar dan plastik wrap. Alat-alat yang digunakan untuk
3 Selain itu alat-alat yang digunakan untuk analisis kimia yaitu tabung reaksi, rak tabung, microtube eppendorf, pipet mikro, sentrifus, stopwatch, waterbath, kuvet, spektrofotometer UV-VIS (Hitachi, U-3900H, Tokyo Japan), autoklaf, Kromatografi Lpis Tipis (KLT) dan Kromatografi Cair Kinerja Tinggi (KCKT) menggunakan Agilent Technology 1290 Infinity, United States.
Lokasi dan Waktu Penelitian
Penelitian dilakukan di Laboratorium Biokatalis dan Fermentasi (LBF) Bidang Bioproses, Pusat Penelitian Bioteknologi, LIPI Cibinong mulai dari Februari 2013 sampai Januari 2014.
Prosedur Percobaan
Produksi Enzim Amilase Ekstrak Kasar dari Brevibacterium sp.
Pembuatan Media Peremajaan dan Kultur Penumbuhan Bakteri (Rahmani et al. 2011a). Pembuatan media diawali dengan menyiapkan bahan penyusun media peremajaan dan kultur bakteri terlebih dahulu yang terdiri dari 2% pati komersial, 1.5% agar, 1 g L-1 yeast extract, 5 g L-1 pepton dan 38 g L-1 artificial sea water (ASW), yaitu campuran garam mineral terlarut, terdiri dari garam-garam anorganik dan ion anorganik seperti natrium klorida, kalium klorida, natrium bromide dan magnesium klorida, yang mensimulasikan air laut serta memungkinkan persiapan media yang tepat untuk organisme laut. Media tersebut disterilisasi pada 121 °C selama 15 menit. Peremajaan bakteri dilakukan pada cawan petri steril, sedangkan kultur pertumbuhan bakteri dilakukan pada media cair. Bahan yang digunakan pada media peremajaan dan kultur pertumbuhan bakteri hampir sama, hanya saja agar tidak ditambahkan pada media kultur pertumbuhan.
Peremajaan dan Proses Kultur Bakteri (Rahmani et al. 2011a). Peremajaan bakteri Brevibacterium sp. dilakukan dengan menggoreskan isolat bakteri menggunakan jarum ose steril pada media padat yang telah disiapkan. Sebelum melakukan penanaman, laminar tempat kerja disinari sinar UV terlebih dahulu selama 15 menit untuk membunuh mikroorganisme yang tidak diinginkan sehingga dapat menurunkan risiko kontaminasi sebelum penanaman. Media yang telah ditanami isolat diinkubasi pada suhu 30 °C selama 3 hari.
Setelah itu dilakukan prekultur dan kultur isolat bakteri pada media cair. Prekultur dilakukan dengan memindahkan sebanyak 1 ose koloni tunggal bakteri ke dalam 20 mL media cair. Tujuan prekultur yaitu sebagai tahap adaptasi bakteri terhadap media pertumbuhan sebelum dilakukan kultur pada volume yang lebih besar yaitu 180 mL media cair. Prekultur diinkubasi pada inkubator goyang 150 rpm, 30°C selama 3 hari. Selanjutnya dilakukan proses kultur pada kondisi yang sama seperti pada prekultur selama 4 hari.
4
Analisis Aktivitas Amilase Ekstrak Kasar (Modifikasi Bernfeld 1995). Reaksi dilakukan dengan menginkubasi sebanyak 0.5 mL enzim ditambah 0.5 mL larutan pati 0.5% (b/v) dalam buffer fosfat pH 6.6 (0.02 M) pada suhu 30 °C selama 30 menit. Reaksi dihentikan dengan diinkubasi pada 100 °C selama 20 menit, dan diinkubasi di dalam es selama 10 menit. Warna yang terbentuk diukur dengan spektrofotometer pada panjang gelombang 540 nm. Satu unit aktivitas enzim didefinisikan sebagai produksi 1 µmol maltooligosakarida per menit pada kondisi diatas.
Penentuan Kondisi Hidrolisis Enzimatis Pati Umbi Tacca (Rohanah 2012) Tahap penentuan kondisi optimum produksi oligosakarida dilakukan dengan menggunakan enzim amilase ekstrak kasar. Terdapat tiga variabel yang harus ditentukan. Penentuan kondisi tersebut dilakukan secara bertahap, yaitu sebagai berikut.
1. Penentuan konsentrasi substrat (b/v) 1.5%, 3%, 4.5%, 6%, dan 7.5%. 2. Penentuan perbandingan enzim dan substrat (v/v) 1:1, 1:2, 1:5 dan 1:10. 3. Penentuan waktu reaksi pada jam ke-1, 2, 4, 6 dan 8.
Dalam penelitian ini konsentrasi substrat ditentukan terlebih dahulu. Setelah dipilih konsentrasi substrat optimum, dilanjutkan dengan penentuan perbandingan enzim dan substrat, serta waktu reaksi.
Adapun proses reaksi hidrolisis enzimatis dilakukan dengan cara membuat larutan substrat terlebih dahulu menggunakan pelarut akuades, lalu dipanaskan pada suhu 80 °C selama 10 menit dan didiamkan hingga suhunya mencapai 30 °C. Selanjutnya dilakukan penambahan amilase ekstrak kasar dan disimpan pada inkubator goyang 150 rpm pada suhu tertentu. Pengambilan sampel dilakukan pada jam ke-1, 2, 4, 6, dan 8. Sampel dipanaskan pada suhu 100 °C selama 15 menit, dan didiamkan hingga suhunya 27 °C, lalu disentrifugasi pada kecepatan 6764 xg selama 15 menit. Supernatan yang dihasilkan selanjutnya dianalisis gula pereduksi, gula total, KLT dan KCKT.
Analisis Kimia
Analisis Gula Pereduksi (Modifikasi Miller 1959). Jumlah gula pereduksi yang terbentuk ditentukan dengan metode DNS yang telah dimodifikasi. Sebanyak 0.5 mL larutan standar glukosa dengan konsentrasi 0, 100, 150, 200, 250 dan 300 µg mL-1 dimasukkan ke dalam tabung reaksi dan ditambah 0.75 mL pereaksi DNS (dinitrosalicylic acid), begitupun sampel hasil hidrolisis. Larutan standar sampel direaksikan pada suhu 100°C selama 20 menit kemudian didiamkan hingga suhunya mendekati suhu ruang. Setelah itu dilakukan pengukuran absorbansi pada panjang gelombang 540 nm.
5 Derajat Polimerisasi (Apriyantono et al. 1989). Derajat polimerisasi (DP) dihitung berdasarkan perbandingan antara gula total dan gula pereduksi dengan rumus sebagai berikut:
Analisis Kromatografi Lapis Tipis (Rahmani et al. 2013). Kromatografi Lapis Tipis (KLT) digunakan secara kuantitatif untuk melihat jenis oligosakarida yang terbentuk. Analisis ini dilakukan pada plat silika gel 60 F254 (Merck art 20-20 cm) sebagai fase diam. Plat tersebut dibuat dengan ukuran 10 cm x 10 cm, garis start 1 cm dari batas bawah dan garis finish 0.5 cm dari batas atas. Sampel diteteskan menggunakan pipa kapiler dengan jarak 1 cm antara sampel. Plat dimasukkan ke dalam bejana pengembang berisi eluen yang telah dijenuhkan selama 1 jam. Eluen tersebut terdiri dari n-butanol:asam asetat:akuades dengan perbandingan 2:1:1 (mL). Elusi dilakukan hingga garis finish. Plat diangkat hingga eluen menguap semua pada suhu kamar lalu disemprotkan dengan
pewarna gula (0.5 gram α-difenilamin, 25 mL aseton, 2.5 mL asam fosfat, 0.5 mL anilin pada Erlenmeyer 300 mL). Plat dikeringkan didalam oven 100 °C selama 15 menit hingga terbentuk spot. Setelah dingin diukur nilai Rf dari masing-masing komponen. Nilai Rf adalah perbandingan tinggi spot pada plat silika gel dengan tinggi larutan pengembang. Rumusnya yaitu:
Analisis Kromatografi Cair Kinerja Tinggi (Kandra et al. 2002; Lee et al. 2003; Eliasson dan Gudmundsson 2006). Oligosakarida hasil hidrolisis enzimatis dianalisis menggunakan Kromatografi Cair Kinerja Tinggi (KCKT). Detektor yang digunakan yaitu refractive index detector (RID) dan kolom Zorbax SIL (silika) dengan dilapisi 3-aminopropilsilen. Fase gerak yang digunakan adalah asetonitril dan akuades dengan perbandingan 75:25 (v/v). Kecepatan alir yang digunakan adalah 1 mL/menit pada suhu 30 °C.
HASIL
Amilase Ekstrak Kasar
6
Kondisi Optimum Hidrolisis Enzimatis Pati Umbi Tacca
Konsentrasi Substrat Optimum
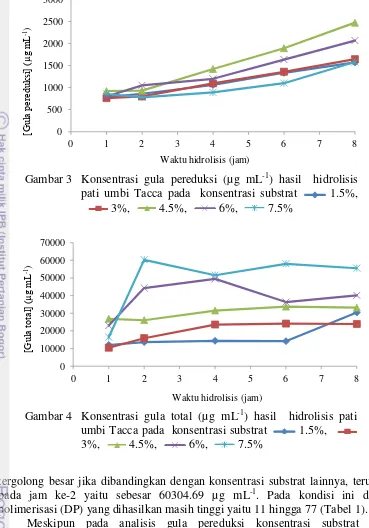
Hasil pengukuran konsentrasi gula pereduksi pada berbagai konsentrasi substrat memperlihatkan bahwa semakin lama waktu inkubasi konsentrasi gula pereduksi relatif semakin bertambah, karena semakin banyak pula substrat yang terhidrolisis oleh enzim membentuk gula pereduksi (Gambar 3). Akan tetapi pertambahan konsentrasi substrat tidak berbanding lurus dengan pertambahan konsentrasi gula pereduksi yang dihasilkan. Konsentrasi substrat 4.5% menghasilkan gula pereduksi lebih besar dibandingkan konsentrasi substrat 7.5%. Gula pereduksi tertinggi yang dihasilkan yaitu pada jam ke-8 dengan konsentrasi substrat 4.5% sebesar 2470.81 µg mL-1, sedangkan konsentrasi gula pereduksi terkecil yaitu pada jam ke-1 dengan konsentrasi substrat 3% sebesar 1760.46 µg mL-1.
Gula total menggambarkan total konsentrasi gula baik gula monosakarida, disakarida, dan oligosakarida. Gula total pada pati dianalisis dengan metode fenol sulfat. Asam sulfat yang bereaksi dengan fenol dan larutan pati menghasilkan perubahan warna larutan menjadi cokelat muda yang diukur absorbansinya pada panjang gelombang 490 nm. Gula total menggambarkan banyaknya gula yang terdapat pada pati dengan konsentrasi yang berbeda-beda. Semakin pekat warna larutan maka gula total yang dihasilkan semakin banyak. Berdasarkan Gambar 4 dapat dilihat bahwa dengan konsentrasi substrat 7.5% gula total yang dihasilkan
(a) (b)
Gambar 2 Media kultur bakteri sebelum ditanami bakteri (a) dan setelah ditanami bakteri (kultur hari ke-4) (b)
7
tergolong besar jika dibandingkan dengan konsentrasi substrat lainnya, terutama pada jam ke-2 yaitu sebesar 60304.69 µg mL-1. Pada kondisi ini derajat polimerisasi (DP) yang dihasilkan masih tinggi yaitu 11 hingga 77 (Tabel 1).
Meskipun pada analisis gula pereduksi konsentrasi substrat 4.5% menghasilkan hidrolisat yang cukup baik, namun setelah dicoba menggunakan KLT sampel terlihat belum terpisah dan gula belum terdegradasi. Kemungkinan diperlukan enzim yang unit aktivitasnya lebih tinggi, sehingga degradasinya lebih optimal. Amilase yang dihasilkan dari Brevibacterium sp. ini memiliki aktivitas yang cukup kecil sehingga kurang cocok untuk memotong-motong substrat dengan konsentrasi 4.5%. Oleh karena itu konsentrasi yang lebih rendah yaitu 3% dipilih sebagai konsentrasi substrat optimum dalam penentuan perbandingan enzim dan substrat.
8
Perbandingan Enzim dan Substrat Optimum
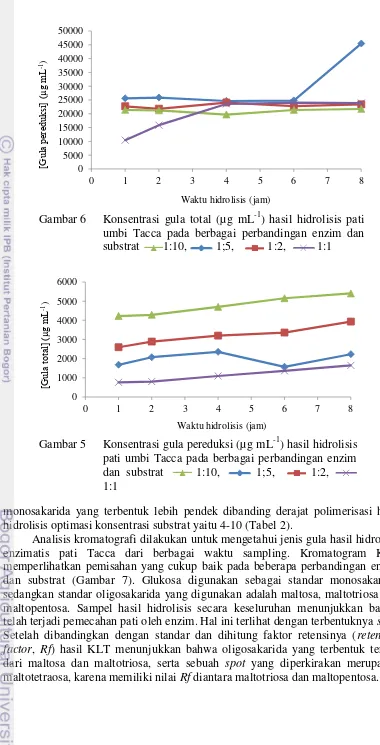
Hasil percobaan menunjukkan bahwa pada semua perbandingan enzim dan substrat konsentrasi gula pereduksi mengalami pertambahan seiring dengan bertambahnya waktu hidrolisis, namun tidak begitu signifikan. Pada jam ke-6 konsentrasi gula pereduksi dengan perbandingan enzim dan substrat 1:5 mengalami penurunan dan kembali bertambah pada jam ke-8 (Gambar 5).
Gambar 6 memperlihatkan bahwa konsentrasi gula total pada perbandingan enzim dan substrat 1:2 dan 1:1 cukup konstan, tidak mengalami penambahan atau pengurangan yang signifikan. Untuk perbandingan enzim dan substrat 1:10 nilai konsentrasi gula total pada jam ke-1 yaitu 10445.32 µg mL-1 lalu naik pada jam ke-2 dan konstan hingga jam ke-8. Sebaliknya, untuk perbandingan enzim dan substrat 1:5, nilai konsentrasi gula total konstan pada mulanya hingga jam ke-6 dan bertambah secara signifikan pada jam ke-8 yaitu dari 24846.35 menjadi 45463.54 µg mL-1. Derajat polimerisasi hasil hidrolisis pati umbi Tacca pada berbagai perbandingan enzim dan substrat menunjukkan jumlah rantai Tabel 1 Derajat polimerisasi hasil hidrolisis pati Umbi Tacca pada berbagai
9
monosakarida yang terbentuk lebih pendek dibanding derajat polimerisasi hasil hidrolisis optimasi konsentrasi substrat yaitu 4-10 (Tabel 2).
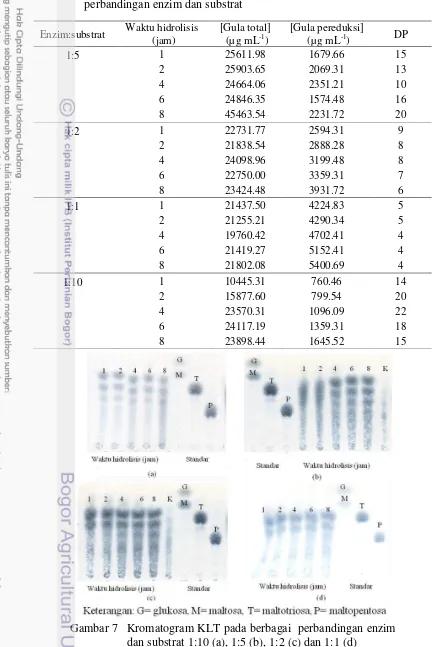
Analisis kromatografi dilakukan untuk mengetahui jenis gula hasil hidrolisis enzimatis pati Tacca dari berbagai waktu sampling. Kromatogram KLT memperlihatkan pemisahan yang cukup baik pada beberapa perbandingan enzim dan substrat (Gambar 7). Glukosa digunakan sebagai standar monosakarida, sedangkan standar oligosakarida yang digunakan adalah maltosa, maltotriosa dan maltopentosa. Sampel hasil hidrolisis secara keseluruhan menunjukkan bahwa telah terjadi pemecahan pati oleh enzim. Hal ini terlihat dengan terbentuknya spot. Setelah dibandingkan dengan standar dan dihitung faktor retensinya (retention factor, Rf) hasil KLT menunjukkan bahwa oligosakarida yang terbentuk terdiri dari maltosa dan maltotriosa, serta sebuah spot yang diperkirakan merupakan maltotetraosa, karena memiliki nilai Rf diantara maltotriosa dan maltopentosa.
Gambar 6 Konsentrasi gula total (µg mL-1) hasil hidrolisis pati
10
Tabel 2 Derajat polimerisasi hasil hidrolisis pati umbi Tacca pada berbagai perbandingan enzim dan substrat
Enzim:substrat Waktu hidrolisis
(jam)
[Gula total] (µg mL-1)
[Gula pereduksi]
(µg mL-1) DP
1:5 1 25611.98 1679.66 15
2 25903.65 2069.31 13
4 24664.06 2351.21 10
6 24846.35 1574.48 16
8 45463.54 2231.72 20
1:2 1 22731.77 2594.31 9
2 21838.54 2888.28 8
4 24098.96 3199.48 8
6 22750.00 3359.31 7
8 23424.48 3931.72 6
1:1 1 21437.50 4224.83 5
2 21255.21 4290.34 5
4 19760.42 4702.41 4
6 21419.27 5152.41 4
8 21802.08 5400.69 4
1:10 1 10445.31 760.46 14
2 15877.60 799.54 20
4 23570.31 1096.09 22
6 24117.19 1359.31 18
8 23898.44 1645.52 15
11 Perbandingan enzim dan substrat 1:2 dan 1:1 menghasilkan pemisahan kurang baik. Sedangkan pada perbandingan konsentrasi enzim dan substrat 1:5 dan 1:10 menujukkan plot terlihat terpisah. Jika dibandingkan diantara keduanya perbandingan 1:5 mencirikan intensitas kromatogram yang lebih kuat daripada 1:10 pada jam ke-6 hingga jam ke-8. Oleh karena itu 1:5 dipilih sebagai perbandingan enzim dan substrat optimum dan waktu hidrolisis optimumnya terjadi pada jam ke-6 hingga jam ke-8.
Hidrolisis Pati Umbi Tacca Skala Besar
Volume total hidrolisis pati umbi Tacca skala besar yang dilakukan yaitu 3.6 L, dengan volume substrat 3 L dan enzim 0.6 mL. Volume total hasil hidrolisis adalah sekitar 3 L. Sebanyak 1 L dari hasil sentrifugasi tersebut disimpan dalam lemari pendingin sebagai oligosakarida segar hasil optimasi hidrolisis skala besar, sedangkan sebanyak 2 L sampel segar tersebut dikeringbekukan (freeze dry) pada tekanan 10 µHg dengan suhu -50 °C. Bobot setelah dikeringbekukan berupa padatan berbentuk bubuk berwarna putih kecokelat-cokelatan adalah sebesar 34.4903 gram (Gambar 8).
(a)
(b)
12
Hasil analisis konsentrasi gula pereduksi untuk oligosakarida segar adalah 6580.46 µg mL-1 dan freeze dry 3317.82 µg mL-1. Besarnya konsentrasi gula total oligosakarida segar sebesar 17793.81 µg mL-1 dan freeze dry sebesar 4240.21 µg mL-1, sehingga derajat polimerisasinya masing-masing yaitu 2.7 untuk oligosakarida segar dan 1.3 untuk oligosakarida freeze dry.
Analisis KLT dilakukan dengan menggunakan standar oligosakarida yang terdiri dari maltosa, maltotetraosa dan maltopentosa yang memiliki nilai Rf berturut-turut 0.486, 0.405, 0.270, 0.203. Hasil kromatografi menunjukkan bahwa sampel segar dan freeze dry menghasilkan nilai Rf yang tidak jauh berbeda serta mengandung oligosakarida yang sama dengan hasil hidrolisis pada saat optimasi, yaitu maltosa, maltotetraosa dan diperkirakan maltotriosa karena memiliki nilai Rf diantara maltosa dan maltotetraosa (Gambar 9 dan Tabel 3). Dari hasil KLT dapat dilihat bahwa yang menghasilkan pemisahan paling baik adalah sampel freeze dry dengan konsentrasi 1%, sehingga yang digunakan untuk analisis profil oligosakarida menggunakan KCKT adalah sampel segar dan freeze dry 1%.
Tabel 3 Rf spot standar dan oligosakarida hasil analisis KLT
Spot Retention factor (Rf)
Glukosa Maltosa X Maltotetraosa Maltopentosa
Standar 0.486 0.405 - 0.270 0.203
Segar - 0.392 0.324 0.243
-Freeze dry 1% - 0.419 0.351 0.270
-Freeze dry 2% - 0.405 0.324 0.257
-Freeze dry 3% - 0.392 0.324 0.270
-Keterangan: X= Spot yang tidak diketahui standar
13 Analisis Oligosakarida Dengan Kromatografi Cair Kinerja Tinggi (KCKT)
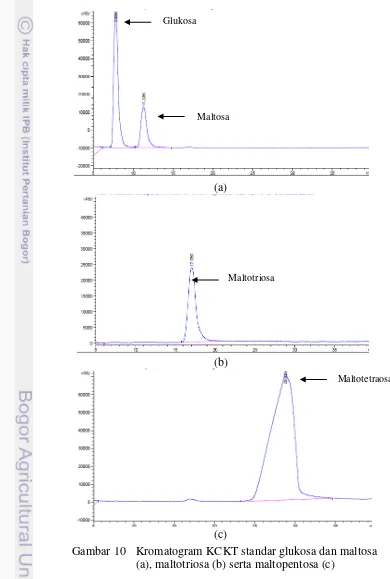
Analisis KCKT dilakukan dengan tujuan untuk mendapatkan informasi mengenai jenis oligosakarida yang terdapat dalam sampel. Standar yang digunakan adalah glukosa+maltosa 5%, maltotriosa 10.000 µg mL-1 dan maltotetraosa 100.000 µg mL-1. Standar tersebut diinjek terlebih dahulu dan menghasilkan waktu retensi (retention time, Rt) yang berbeda-beda (Gambar 10).
(a)
(b)
(c)
Gambar 10 Kromatogram KCKT standar glukosa dan maltosa (a), maltotriosa (b) serta maltopentosa (c)
Glukosa
Maltosa
Maltotriosa
14
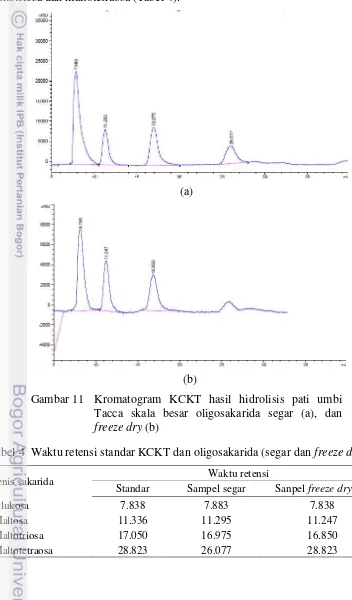
Analisis oligosakarida hasil hidrolisis pati umbi Tacca baik segar maupun freeze dry menghasilkan empat puncak (Gambar 11). Masing-masing puncak memiliki waktu retensi yang tidak jauh berbeda dengan waktu retensi standar. Waktu retensi yang mendekati antara komponen sampel dengan standar menunjukkan komponen yang dikandung sampel sama dengan standar. Setelah dibandingkan dengan standar, puncak pertama dicirikan sebagai monosakarida, yaitu glukosa dan puncak lainnya dicirikan sebagai oligosakarida yaitu maltosa, maltotriosa dan maltotetraosa (Tabel 4).
(a)
(b)
Gambar 11 Kromatogram KCKT hasil hidrolisis pati umbi Tacca skala besar oligosakarida segar (a), dan freeze dry (b)
Tabel 4 Waktu retensi standar KCKT dan oligosakarida (segar dan freeze dry)
Jenis sakarida Waktu retensi
Standar Sampel segar Sanpel freeze dry 1%
Glukosa 7.838 7.883 7.838
Maltosa 11.336 11.295 11.247
Maltotriosa 17.050 16.975 16.850
15
PEMBAHASAN
Amilase Ekstrak Kasar
Setiap bakteri yang akan digunakan harus diremajakan terlebih dahulu dengan tujuan mendapatkan bakteri yang aktif. Hal ini dikarenakan sebelumnya bakteri tersebut disimpan pada keadaan inaktif dalam media di lemari pendingin bersuhu -80 °C. Brevibacterium sp. merupakan bakteri laut, oleh karena itu isolat Brevibacterium sp. diremajakan pada media padat yang mengandung artificial sea water (ASW). Dengan media ASW ini, isolat Brevibacterium sp. dapat tumbuh pada media yang sesuai.
Berdasarkan Gambar 1 terlihat bahwa hasil isolat yang telah diremajakan memiliki kenampakan koloni berwarna putih kekuningan dan permukaan yang licin. Hal ini sesuai dengan yang telah dilaporkan oleh Putranto (2012), yaitu isolat berwarna putih apabila masih muda dan akan berwarna kuning di pinggir koloni jika sudah tua. Diameter koloni berukuran 0.6-1.2 x 1.5-6 μm. Bakteri ini memiliki bentuk sel batang, termasuk ke dalam bakteri gram positif, aerob, tidak mampu bergerak dan termasuk ke dalam katalase positif.
Enzim α-amilase dapat diproduksi dari berbagai sumber seperti tumbuhan,
hewan dan mikroorganisme. Sumber α-amilase yang banyak digunakan berasal dari mikroorganisme, karena mudah ditumbuhkan pada kondisi yang terkontrol dengan baik, serta cepat menghasilkan enzim dengan jumlah yang lebih banyak (Waluyo 2007). Brevibacterium sp. merupakan salah satu mikroorganisme yang
mampu menghasilkan α-amilase secara ekstraseluler. Pati dalam media terhidrolisis oleh enzim amilase yang disekresikan oleh Brevibacterium sp. menjadi senyawa yang lebih sederhana seperti glukosa dan maltosa. Enzim ekstraseluler dapat memecah polimer yang tidak larut seperti pati, kemudian produk dari pemecahan tersebut akan ditranspor ke dalam sel dan digunakan sebagai nutrisi untuk tumbuh (Madigan et al. 2000).
Hasil produksi α-amilase dilanjutkan dengan sentrifugasi untuk memisahkan
media yang mengandung α-amilase dengan sel bakteri sehingga dihasilkan filtrat yang berisi ekstrak kasar enzim dan terpisah dari sel bakteri serta sisa-sisa media yang tidak larut. Sentrifugasi pada suhu dingin bertujuan umtuk meminimalkan kerusakan enzim. Sel bakteri yang berukuran lebih besar dibandingkan dengan enzim ekstraselulernya akan mengalami gaya sentrifugal yang lebih besar pada kecepatan radial dan jarak putar yang sama. Akibatnya sel akan mengendap dan enzim akan tetap berada pada bagian filtrat (Rachmadani 2007).
16
karena pH lingkungan hidup diketahui mempengaruhi sintesis dan sekresi amilase sama seperti stabilitas (Sivaramakrishnan et al. 2006).
Adanya aktivitas enzim dapat digambarkan melalui hilangnya substrat atau terbentuknya produk-produk reaksi. Enzim diinkubasi dengan substrat pada kondisi yang sesuai, sehingga sampel akan terurai pada interval waktu tertentu dan kemudian dianalisis. Aktivitas enzim dinyatakan dalam istilah unit (U). Satu unit adalah sejumlah enzim yang mengkatalisis konversi dari 1 µmol substrat per unit dalam kondisi normal (Bintang 2010). Aktivitas amilase ekstrak kasar yang terukur yaitu sebesar 1.78 U mL-1 yang berarti amilase tersebut dapat menghasilkan 1.78 µmol produk per menit. Nilai ini lebih rendah bila dibandingkan dengan hasil penelitian Rahmani et al. (2011a) yang menemukan bahwa Brevibacterium sp. yang diisolasi dari Teluk Kamal mampu menghasilkan amilase dengan aktivitas 2.85 U mL-1. Perbedaan ini dapat disebabkan karena adanya perbedaan sumber isolat bakteri yang digunakan. Isolat bakteri yang digunakan pada penelitian ini merupakan hasil peremajaan dari bakteri yang dibiakkan sebelumnya, sehingga isolat ini kemungkinan telah mengalami perubahan yang mengakibatkan perbedaan pada aktivitas enzim yang dihasilkan. Semakin tinggi aktivitas enzim amilase maka semakin optimal enzim tersebut memecah pati menjadi gula sederhana seperti oligosakarida.
Kondisi Optimum Hidrolisis Enzimatis Pati Umbi Tacca
Konsentrasi Substrat Optimum
Penentuan kondisi optimum hidrolisis enzimatis pati umbi Tacca untuk menghasilkan oligosakarida menggunakan beberapa parameter, yaitu konsentrasi substrat, perbandingan enzim dan substrat, serta waktu. Menurut Purba (2009) rekasi yang dikatalis oleh enzim dipengaruhi oleh konsentrasi substratnya. Substrat yang akan bereaksi melekat terlebih dahulu pada molekul enzim di daerah yang disebut sisi aktif membentuk kompleks enzim-substrat. Konsentrasi substrat yang rendah mempunyai kesempatan yang kecil untuk diikat oleh enzim dalam menghasilkan produk dan sebaliknya. Namun penambahan konsentrasi substrat pada level tertentu melebihi konsentrasi optimumnya dapat menurunkan laju reaksi. Hal ini terjadi karena substrat akhirnya menginhibisi kerja enzim. Begitu banyak substrat menyebabkan terjadinya persaingan antar substrat untuk menempati sisi aktif enzim sehingga laju reaksi menurun dan produk yang dihasilkan kurang optimal (Husnil 2009).
Substrat yang digunakan adalah pati umbi Tacca yang berasal dari Hutan Jati. Berdasarkan hasil penelitian terdahulu, pati umbi Tacca Hutan Jati memiliki rendemen pati sebesar 28.44% dan daya cerna pati sebesar 97.23% (Rahmani et al. 2011b). Daya cerna pati adalah tingkat kemudahan suatu jenis pati untuk dapat dihidrolisis oleh enzim pemecah pati menjadi unit-unit yang lebih sederhana (Prangdimurti 2009). Dengan tingginya daya cerna tersebut, pati umbi Tacca sangat berpotensi untuk memproduksi oligosakarida.
17 atau keton bebas. Semua monosakarida (glukosa, fruktosa, galaktosa) dan disakarida (laktosa, maltosa), termasuk sebagai gula pereduksi. Semakin tinggi aktivitas enzim maka semakin tinggi pula gula pereduksi yang dihasilkan. Jumlah gula pereduksi yang dihasilkan selama reaksi diukur dengan menggunakan pereaksi DNS pada panjang gelombang 540 nm sama seperti pada pengukuran aktivitas enzim. Semakin tinggi nilai absorbansi yang dihasilkan, semakin banyak pula gula pereduksi yang terkandung (Bintang 2010).
Konsentrasi optimum terpilih adalah 3%. Pada kondisi ini derajat polimerisasi (DP) yang dihasilkan sebesar 15-21. DP nyatakan jumlah unit monomer atau jumlah rata-rata rantai monosakarida dominan dalam suatu molekul. Hal tersebut berarti bahwa hidrolisat pati diperkirakan masih mengandung rantai monosakarida dominan pada rentang nilai tersebut. Oligosakarida sendiri merupakan hasil hidrolisis pati dengan nilai DP 2-10 (Nakakuki 2002). Semakin kecil nilai DP maka semakin banyak pula pati yang terhidrolisis menjadi gugus yang lebih kecil. Pada reaksi hidrolisis kali ini pati belum berhasil terhidrolisis menghasilkan oligosakarida dengan gugus yang kecil.
Perbandingan Enzim dan Substrat Optimum
Perbandingan enzim dan substrat dapat mempengaruhi reaksi hidrolisis. Jika salah satu satu zat pereaksi dibuat berlebih maka keseimbangan dapat bergeser ke sebelah kanan dengan baik. Menurut Yuanita et al. (2010) penambahan enzim akan meningkatkan kecepatan reaksi bila substrat tersedia secara berlebih. Namun peningkatan kecepatan reaksi akan semakin menurun untuk setiap penambahan enzim. Waktu inkubasi juga merupakan salah satu faktor yang mempengaruhi reaksi hidrólisis. Pada reaksi hidrolisis, waktu inkubasi merupakan waktu kontak antara enzim dan substrat sehingga menghasilkan produk. Bertambahnya waktu kontak memungkinkan seluruh enzim berperan untuk merubah substrat menjadi produk. Akan tetapi pada kondisi optimum, enzim akan terjenuhi oleh substrat sehingga tidak terjadi penambahan produk dan memungkinkan reaksi balik terjadinya kompleks substrat menjadi enzim bebas. Peningkatan produk akan mencapai titik batas, setelah titik itu terlampaui maka tidak akan terjadi perubahan nilai produk yang lebih tinggi lagi meskipun konsentrasi enzim ditambahkan dan waktu diperpanjang. Hal ini terjadi karena sisi aktif enzim telah jenuh oleh substrat sehingga tidak ada lagi substrat yang dapat melekat pada sisi aktif. Batas tersebut disebut sebagai kecepatan maksimum, yaitu kecepatan ketika enzim telah jenuh dengan substrat. Pada saat tercapai kecepatan maksimum semua enzim terdapat dalam kompleks enzim substrat.
Secara keseluruhan analisis gula pereduksi pada berbagai perbandingan enzim dan substrat menghasilkan konsentrasi gula pereduksi yang lebih tinggi hingga dua kali lipat dibanding konsentrasi gula pereduksi pada berbagai konsentrasi substrat. Begitupula DP yang dihasilkan menjadi lebih kecil yaitu 4-10. Berdasarkan pengertian oligosakarida menurut Nakakuki (2002) maka dapat dikatakan bahwa hasil hidrólisis tersebut sudah merupakan oligosakarida.
18
menghasilkan oligosakarida dengan DP lebih dari atau sama dengan 2. Perbandingan enzim dan substrat 1:5 dipilih sebagai perbandingan enzim dan substrat optimum pada jam ke-6 hingga jam ke-8 karena pada kondisi tersebut hasil analisis KLT menunjukkan spot yang terlihat terpisah dan intensitas kromatogram yang lebih kuat. Penggunaan dosis enzim yang terlalu tinggi menyebabkan proses hidrolisis menjadi kurang optimal seperti pada hasil hidrolisis dengan perbandingan enzim dan substrat 1:1 dan 1:2 (Gambar 7). Setiap reaksi hidrólisis memiliki kondisi optimum yang berbeda-beda untuk menghasilkan oligosakarida bergantung pada sumber substrat yang digunakan. Seperti halnya pada reaksi hidrólisis pati kentang hitam yang memiliki kondisi optimum pada konsentrasi substrat 2.5%, perbandingan enzim dan substrat 1:5, serta waktu reaksi selama 4 jam (Rohanah 2012).
Hidrolisis Pati Umbi Tacca Skala Besar
Sebelumnya hidrolisis skala kecil dilakukan untuk proses optimasi yaitu mengetahui konsentrasi, perbandingan enzim dan substrat, serta waktu optimum. Adapun hidrolisis pati umbi Tacca skala besar dilakukan dengan tujuan untuk memproduksi oligosakarida dalam pengaplikasiannya terhadap industri. Hidrolisis dilakukanpada kondisi yang telah dioptimasi sebelumnya, yaitu konsentrasi substrat 3%, perbandingan enzim dan substrat 1:5, dan waktu reaksi 6-8 jam dan aktivitas enzim sebesar 1.78 U mL-1. Oligosakarida segar hasil hidrólisis skala besar sebagian dikeringbekukan ( freeze dry) dengan tujuan menguapkan air yang terkandung dalam sampel sehingga konsentrasi sampel menjadi lebih tinggi. Selain itu hasil sampel yang berupa padatan merupakan langkah akhir yang ideal untuk memudahkan proses analisis dan penyimpanan dalam jumlah yang banyak (Zhu et al. 2006).
Analisis gula pereduksi dan DP oligosakarida hasil hidrolisis skala besar menghasilkan nilai yang lebih baik dibandingkan dengan hidrolisis pada saat optimasi. Hal ini dikarenakan proses hidrolisis yang dilakukan sudah dalam keadaan optimum sehingga menghasilkan oligosakarida yang optimum pula yaitu konsentrasi gula pereduksi oligosakarida segar sebanyak 6580.46 µg mL-1 dengan DP 2.7 dan konsentrasi gula pereduksi freeze dry sebanyak 3317.82 µg mL-1 dengan DP 1.3. Hasil analisis KLT menunjukkan bahwa sampel segar dan freeze dry mengandung oligosakarida yang sama dengan hasil hidrolisis pada saat optimasi, yaitu maltosa, maltotetraosa dan diperkirakan maltotriosa karena memiliki nilai Rf diantara maltosa dan maltotetraosa (Gambar 10 dan Tabel 3). Dari hasil KLT dapat dilihat bahwa yang menghasilkan pemisahan paling baik adalah sampel freeze dry dengan konsentrasi 1%, sehingga yang digunakan untuk analisis profil oligosakarida menggunakan KCKT adalah oligosakarida segar dan freeze dry 1%. Adapun oligosakarida freeze dry 2% dan 3% menghasilkan pemisahan spot yang kurang baik karena konsentrasi yang terlalu besar.
Analisis Oligosakarida dengan Kromatografi Cair Kinerja Tinggi (KCKT)
19 Eliasson dan Gudmundsson (2006), pelarut polar yang digunakan dalam menentukan profil oligosakarida yaitu asetonitril:akuades yang telah di-degassing dengan perbandingan 75:25. Tujuan degassing yaitu untuk menghilangkan gas sehingga dapat mengurangi gangguan saat analisis berlangsung. Teknik pemisahan melibatkan kromatografi partisi cair-cair dengan mekanisme retensi diikuti oleh fase normal dengan fase diam berupa senyawa polar dan fase gerak berupa senyawa nonpolar. Polaritas fase gerak meningkat dengan mencampur asetonitril dan air pada perbandingan 75:25. Indeks polaritas pelarut campuran adalah 6.9 lebih nonpolar daripada air yang telah didestilasi (10.2) dan lebih polar daripada asetonitril (5.8).
Jenis gula sederhana hasil analisis menggunakan KCKT hampir sama dengan hasil analisis menggunakan KLT, hanya saja glukosa muncul pada KCKT dan tidak muncul pada KLT. Hal ini dapat disebabkan karena konsentrasi glukosa yang terdapat pada sampel terlalu rendah sehingga hanya muncul ketika analisis menggunakan KCKT dengana tingkat kesensitifan yang tinggi, dan tidak muncul pemisahan spot pada KLT. Adapun oligosakarida yang dihasilkan yaitu berupa maltooligosakarida: maltosa, maltotriosa dan maltotetraosa. Dengan adanya analisis menggunakan KLT dan KCKT yang memunculkan gula-gula baik monosakarida maupun oligosakarida, menunjukkan bahwa pati umbi Tacca telah terdegradasi menjadi gula-gula sederhana dengan menggunakan α-amilase dari Brevibacterium sp.
Enzim α-amylase (EC 3.2.1.1) atau yang biasa disebut 1,4–α-D-glukan
glukanohidrolase merupakan endoenzim yang memutus ikatan α-1,4 amilosa dan amilopektin dengan cepat pada larutan pati kental yang telah mengalami
gelatinisasi. Enzim ini akan menghidrolisis ikatan α-1,4 glikosidik pada polisakarida dengan hasil degradasi di bagian tengah atau di dalam molekul sehingga terbentuk molekul-molekul karbohidrat yang lebih pendek meliputi glukosa, dekstrin dan produk oligosakarida berbagai ukuran dengan konfigurasi alfa (Winarno 2010). α-Amilase mendegradasi G4 (maltotetraosa), G5 (maltopentosa), G6 (maltoheksosa) menjadi G1 (glukosa), G2 (maltosa), G3 (maltotriosa), dan G3 (maltotriosa) yang terbentuk dapat terdegradasi menjadi G1 (glukosa). Hidrolisis yang dilakukan oleh Rohanah (2012) pada pati kentang
hitam menggunakan α-amilase dari Brevibacterium sp. menghasilkan glukosa, maltosa dan maltotriosa.
Beberapa oligosakarida turunan pati memiliki banyak manfaat di bidang pangan, misalnya maltosa banyak digunakan sebagai pemanis, suplemen gula pada intravena. Sirup maltotetraosa dijadikan sebagai pengganti sukrosa yaitu dapat mengurangi manisnya makanan tanpa mempengaruhi rasa dan aroma, serta dapat menjaga kelembaban dalam pangan. Selain itu, oligosakarida juga dapat digunakan sebagai pangan fungsional yang memiliki potensi besar untuk meningkatkan kualitas bahan makanan, modifikasi rasa makanan, dan karakter fisikokimia yang menguntungkan bagi kesehatan (Aiyer 2005).
Hidrolisis pati menggunakan enzim yang berbeda akan menghasilkan berbagai jenis oligosakarida yang berbeda pula. Menurut Nakakuki (2002) berbagai jenis oligosakarida yang dapat diproduksi dari hidrolisis menggunakan pati sebagai bahan bakunya adalah berupa maltooligosakarida (maltosa~maltoheptaosa), isomaltooligosakarida (isomaltosa, panosa,
20
CDs), maltitol, gentiooligosakarida, trehalosa dan nigerosa. Lin et al. (2011) melakukan metode satu langkah menggunakan neopullulanase (NPN) dalam hubungannya dengan saccharifyingα-amilase (SAA) untuk biokonversi pati beras ke isomaltooligosakarida.
SIMPULAN DAN SARAN
Simpulan
Ekstrak kasar α-amilase yang digunakan untuk menghidrolisis pati umbi Tacca berasal dari Brevibacterium sp. yang memiliki aktivitas enzim sebesar 1.78 U mL-1. Hidrolisis pati umbi Tacca asal Hutan Jati untuk menghasilkan oligosakarida memiliki kondisi optimum pada konsentrasi substrat 3 %, perbandingan enzim dan substrat 1:5 serta waktu hidrolisis selama 6-8 jam. Analisis profil oligosakarida dengan KLT dan KCKT menunjukkan hasil yang sama yaitu hidrolisat mengandung oligosakarida berupa maltosa, maltotriosa dan maltotetraosa.
Saran
Identifikasi enzim ekstrak kasar α-amilase dari Brevibacterium sp. menggunakan zimogram atau SDS-PAGE. Penentuan kondisi optimum hidrolisis pati akan lebih efisien jika diiringi dengan penggunaan metode pemodelan dan optimasi seperti Response Surface Methodology (RSM) dan Artificial Neural Network-Genetic Algorithm (ANN-GA). Selain itu, perlu adanya karakterisasi dan analisis lebih lanjut mengenai oligosakarida yang dihasilkan sehubungan dengan pengembangannya sebagai prebiotik maupun bahan tambahan pangan fungsional lainnya.
DAFTAR PUSTAKA
Aatjin AZ. 2012. Pemanfaatan pati Tacca (Tacca leontopetaloides) pada pembuatan biskuit [skripsi]. Manado (ID): Universitas Sam Ratulangi.
Aiyer PV. 2005. Amylases and their applications. J Biotechnol. 4(13):1525-1529. Apriyantono A, Fardiaz, Puspitasari NL, Budiyanto S. 1989. Analisis Pangan.
Bogor: PAU Pangan dan Gizi.
Barreteau H, Delattre C, Michaud P. 2006. Production of oligosaccharides as promising new food additive generation. Food Technol Biotechnol. 44(3):323-333.
Bernfeld P. 1955. Amilase α- and - methodes. J Anzymol. 149-158. Bintang M. 2010. Biokimia Teknik Penelitian. Jakarta (ID): Erlangga.
Chofid A. 2010. Modifikasi tepung sagu menjadi maltodekstrin menggunakan enzim α-amilase [skripsi]. Semarang (ID): Universitas Diponegoro.
21 Eliasson AC, Gudmundsson M. 2006. Starch: phsycochemical and functional aspect. Di dalam: Eliasson AC, editor. Carbohydrates In Food. Ed ke-2. Boca Raton: CRC Pr. hlm 391-469.
Haryati T, Suprijati K, Susana IWR. 2010. Senyawa oligosakarida dari bungkil kedelai dan ubi jalar sebagai prebiotik untuk ternak. Seminar Nasional Teknologi Peternakan dan Veteriner. 511-518.
Husnil YA. 2009. Perlakuan gelombang mikro dan hidrolisis enzimatis pada bamboo untuk produksi bioetanol [tesis]. Depok (ID): Universitas Indonesia.
Kandra L, Gyemant G, Liptak A. β00β. Action pattern of α-amilases on modified maltooligosaccharides. J Biol. 57(11):171-180.
Kolusheva T, Marinova A. 2006. A study of the optimal condition of starch
hidrolisis through thermostable α-amilase. J Univ Chem Technol Metal. 42(1):93-96.
Lee JW, Kwon TO, Moon IS. 2003. Adsorption of monosaccharides, disaccharides, and maltooligisaccharides on activated carbon for separation of maltopentaose. Biotechnol Bioprocess Engineer. 8(1): 47-53. doi: 10.1007/BF 02932898.
Lin Q et al. 2011. Production of isomalto-oligossacharides syrup from rice starch using an one step conversion method. J Biotechnol. 46:1194-1200.
Madigan MT, Martinko JM, Parker J. 2000. Biology of Microorganism. New Jersey: Prentice Hall.
Miller GL. 1959. Use of dinitrosalicylic acid reagent for determination of reducing sugar. J Anal Chem. 31(3):426-428. doi: 10.1021/ac60147a030. Mohapatra BR, Bapuji M, Sree A. 2003. Production of industrian enymes
(amylase, carboxymethylcellulase and protease) by bacteria isolated from marine sedentary organism. Acta Biotechnol. 23:75-84.
Nakakuki T. 2002. Present status and future of functional oligosaccharide development in Japan. Pure Appl Chem. 74(7):1245-1251.
Nurmeiliasari. 2008. Oligosaccharides, an alternative to antibiotics growth promotant: a review. Jurnal S Peter Indonesia. 3(1):15-19.
Patel S, Arum G. 2011. Functional oligosaccharides: production, properties and applications. World J Microbiol Biotechnol. 27(5):1119-1128. doi: 10.1007/s11274-010-0558-5.
Prangdimurti. 2009. Penentuan daya cerna protein in vitro dan pengukuran daya cerna pati secara in vitro [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Purba, Elida. 2009. Hidrolisis pati ubi kayu (Manihot esculenta) dan pati ubi jalar (Impomonea batatas) menjadi glukosa secara cold process dengan acid fungal amilase dan glukoamilase[skripsi]. Lampung (ID): Universitas Lampung. Putranto WT. 2012. Partial purification and characterization of Brevibacterium sp.
amylase [tesis]. Bogor (ID): Institut Pertanian Bogor.
Rachmadani D. 2007. Mempelajari pemurnian enzim kitosanase termostabil dari isolat Bacillus licheniformis MB-2 asal Tampaso, Manado, Sulawesi Utara [skripsi]. Bogor (ID): Institut Pertanian Bogor.
22
Rahmani N, Yopi, Indriani A, Awan. 2011. Karakteristik dan pengembangan karbohidrat dari umbi kentang hitam (Coleus tuberosus benth), ubi kayu (Manihot esculenta) dan umbi Tacca (Tacca leontopetaloides) [laporan teknis]. Bogor (ID): Lembaga Ilmu Pengetahuan Indonesia.
Rahmani N, Rohanah, Sukarno, Andriani A, Yopi. 2013. Production of maltooligosaccharides from Black Potato (Coleus tuberosus) starch by α -amylase from a marine bacterium (Brevibacterium sp.). J Microbiol. 7(3):129-136. doi: 10.5454/mi.7.3.6.
Rohanah. 2012. Peranan enzim amilase dari Brevibacterium sp. dalam menghidrolisis pati kentang hitam [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sari DP, Wuryanti, Anam K. 2013. Isolasi, purifikasi dan karakterisasi α-amilase dari Saccharomyces cerevisiae FNCC 3012. Chem Info. 1(1):337-344.
Sivaramakrishnan S, Gangadharan D, Nampoothiri KM, Soccol CR, Pandey A. 2006. α-Amilase from microbial sources – an overview on recent developments. Food .Technol Biotechnol. 44 (2):173-184.
Waluyo L. 2007. Mikrobiologi Umum. Malang (ID): UMM Pr. Winarno. 2008. Kimia Pangan dan Gizi. Bogor (ID): M-Brio Pr.
Yuanita, Sulistyo T, Apriliastuti, Estiasih T, Wulan SN. 2010. Hidrolisis secara sinergis pati Garut (Marantha arundinaceae L.) oleh enzim α-amilase, glukoamilase, pullulanase untuk produksi sirup glukosa. J Tekno Per. 11(2):78-86.
23
LAMPIRAN
Lampiran 1 Kurva standar glukosa untuk penentuan aktivitas amilase
[Glukosa] (µg mL-1) Absorbansi Rerata
50 0.05
100 0.23
150 0.39
200 0.55
250 0.70
300 0.85
400 1.14
500 1.42
y = 0.003x - 0.0722 R² = 0.9988
0.0 0.2 0.4 0.6 0.8 1.0 1.2 1.4 1.6
0 100 200 300 400 500 600
A
b
so
rb
an
si
24
Lampiran 2 Perhitungan aktivitas enzim amilase ekstrak kasar
Sampel U1 U2 Rerata (R)
Kontrol (K) R-K
Konsentrasi (µg mL-1)
Konsentrasi (mg mL-1)
Aktivitas (U mL-1)
100x 0.498 0.506 0.502 0.430 0.072 48.000 0.048 1.78
Perhitungan:
Persamaan kurva standar:
y = 0.003x-0.0722; y= absorbansi (R-K); x=konsentrasi (µg mL-1)
0.072 = 0.003x-0.0722
= 48.00 µg mL-1
Konsentrasi (µg mL-1) = konsentrasi (mg L-1)
= 48.00 x mg L-1
=
= 0.048 mg mL-1
25 Lampiran 3 Kurva standar untuk perhitungan gula pereduksi dan gula total a. Gula pereduksi
[Glukosa] (µg mL-1) Absorbansi Rerata
0 0.000
[Glukosa] (µg mL-1) Absorbansi Rerata
26
Lampiran 4 Perhitungan konsentrasi gula pereduksi dan gula total hasil hidrolisis pati umbi Tacca pada berbagai konsentrasi substrat
a. Gula pereduksi
1.5% 1 0.011 0.207 0.196 78.57 785.75
2 0.001 0.218 0.217 85.93 859.31
4 0.004 0.279 0.275 105.93 1059.31
6 0.002 0.357 0.355 133.40 1334.02
8 0.026 0.449 0.423 156.97 1569.66
3.0% 1 0.024 0.212 0.188 76.05 760.46
2 0.037 0.237 0.200 79.95 799.54
4 0.048 0.334 0.286 109.61 1096.09
6 0.077 0.439 0.362 135.93 1359.31
8 0.101 0.546 0.445 164.55 1645.52
4.5% 1 0.002 0.237 0.235 92.14 921.38
2 0.011 0.249 0.238 93.06 930.57
4 0.002 0.382 0.380 142.25 1422.53
6 0.002 0.519 0.517 189.26 1892.64
8 0.001 0.685 0.684 247.08 2470.80
6.0% 1 0.004 0.203 0.199 79.72 797.24
2 0.003 0.276 0.273 105.13 1051.26
4 -0.001 0.315 0.316 120.07 1200.69
6 -0.01 0.432 0.442 163.63 1636.32
8 -0.006 0.561 0.567 206.62 2066.21
7.5% 1 -0.001 0.215 0.216 85.70 857.01
2 0.017 0.210 0.193 77.66 776.55
4 0.033 0.259 0.226 89.03 890.34
6 0.049 0.336 0.287 110.07 1100.69
8 0.094 0.520 0.426 158.00 1580.00
Persamaan garis: y= 0.0029x – 0.0322
Keterangan: y= absorbansi; x= konsentrasi gula pereduksi (µg mL-1)
b. Gula total
1.5% 1 0.316 0.318 0.317 34.32 12013.02
2 0.349 0.371 0.360 38.80 13580.73
4 0.384 0.378 0.381 40.99 14346.35
6 0.364 0.387 0.376 40.42 14145.83
27
3.0% 1 0.273 0.275 0.274 29.84 10445.31
2 0.385 0.461 0.423 45.36 15877.60
4 0.626 0.642 0.634 67.34 23570.31
6 0.634 0.664 0.649 68.91 24117.19
8 0.623 0.663 0.643 68.28 23898.44
4.5% 1 0.739 0.710 0.725 76.77 26869.79
2 0.703 0.703 0.703 74.53 26085.94
4 0.825 0.880 0.853 90.10 31536.46
6 0.897 0.928 0.913 96.35 33723.96
8 0.935 0.860 0.898 94.79 33177.08
6.0% 1 0.620 0.616 0.618 65.68 22986.98
2 1.253 1.154 1.204 126.67 44333.33
4 1.301 1.388 1.345 141.35 49473.96
6 0.976 0.992 0.984 103.80 36330.73
8 1.018 1.158 1.088 114.64 40122.40
7.5% 1 0.335 0.340 0.338 36.46 16406.25
2 1.282 1.266 1.274 134.01 60304.69
4 1.002 1.174 1.088 114.64 51585.94
6 1.243 1.207 1.225 128.91 58007.81
8 1.145 1.200 1.173 123.44 55546.88
Persamaan garis: y= 0.0096x – 0.0125
28
Lampiran 5 Perhitungan konsentrasi gula pereduksi dan gula total hasil hidrolisis pati umbi Tacca pada berbagai perbandingan enzim dan substrat
a. Gula pereduksi
1:5 1 0.471 0.471 0.471 167.97 1679.66
2 0.589 0.579 0.584 206.93 2069.31
4 0.670 0.662 0.666 235.12 2351.21
6 0.445 0.436 0.441 157.45 1574.48
8 0.619 0.611 0.615 223.17 2231.72
1:2 1 0.738 0.735 0.736 259.43 2594.31
2 0.818 0.826 0.822 288.83 2888.28
4 0.916 0.908 0.912 319.95 3199.48
6 0.942 0.942 0.942 335.93 3359.31
8 1.108 1.108 1.108 393.17 3931.72
1:1 1 1.195 1.191 1.193 422.48 4224.83
2 1.218 1.206 1.212 429.03 4290.34
4 1.340 1.323 1.332 470.24 4702.41
6 1.459 1.465 1.462 515.24 5152.41
8 1.531 1.537 1.534 540.07 5400.69
1:10 1 0.097 0.092 0.188 76.05 760.46
2 0.095 0.104 0.200 79.95 799.54
4 0.140 0.146 0.286 109.61 1096.09
6 0.185 0.177 0.362 135.93 1359.31
8 0.222 0.223 0.445 164.55 1645.52
Persamaan garis: y= 0.0029x – 0.0322
Keterangan: y= absorbansi; x= konsentrasi gula pereduksi (µg mL-1)
b. Gula total
1:5 1 0.653 0.727 0.690 73.18 25611.98
2 0.672 0.724 0.698 74.01 25903.65
4 0.568 0.760 0.664 70.47 24664.06
6 0.643 0.695 0.669 70.99 24846.35
8 1.404 1.040 1.222 129.90 45463.54
1:2 1 0.702 0.520 0.611 64.95 22731.77
2 0.591 0.582 0.587 62.40 21838.54
4 0.626 0.671 0.649 68.85 24098.96
6 0.564 0.659 0.612 65.00 22750.00
29
1:1 1 0.577 0.574 0.576 61.25 21437.50
2 0.487 0.654 0.571 60.73 21255.21
4 0.544 0.515 0.530 56.46 19760.42
6 0.605 0.545 0.575 61.20 21419.27
8 0.556 0.615 0.586 62.29 21802.08
1:10 1 0.273 0.275 0.274 29.84 10445.31
2 0.385 0.461 0.423 45.36 15877.60
4 0.626 0.642 0.634 67.34 23570.31
6 0.634 0.664 0.649 68.91 24117.19
8 0.623 0.663 0.643 68.28 23898.44
Persamaan garis: y= 0.0096x – 0.0125
30
Lampiran 6 Konsentrasi gula pereduksi, gula total dan derajat polimerisasi hasil hidrolisis pati umbi Tacca skala besar
Sampel [Gula pereduksi]
(µg mL-1)
[Gula total]
(µg mL-1) DP
Segar 6580.46 17793.81 2.70
31
RIWAYAT HIDUP
Penulis dilahirkan di Sumedang pada 11 Februari 1993 sebagai anak sulung dari tujuh bersaudara dengan Ibu Sriyatini dan Ayah H. Dedi Heryana, Ir. Pada tahun 2009 penulis lulus dari SMAN 1 Sumedang. Pada tahun yang sama penulis diterima sebagai mahasiswa baru pada Program Biokimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB.