PENAMBAHAN MINYAK CENGKEH
Syzygium
aromaticum
DALAM PAKAN UNTUK MEMPERBAIKI
KINERJA PERTUMBUHAN IKAN MAS
Cyprinus carpio
TIRA SILVIANTI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Penambahan Minyak Cengkeh Syzygium aromaticum dalam Pakan untuk Memperbaiki Kinerja Pertumbuhan Ikan Mas Cyprinus carpio adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015
RINGKASAN
TIRA SILVIANTI. Penambahan Minyak Cengkeh Syzygium aromaticum dalam Pakan untuk Memperbaiki Kinerja Pertumbuhan Ikan Mas Cyprinus carpio. Dibimbing oleh DEDI JUSADI dan SRI NURYATI.
Ikan mas merupakan jenis ikan air tawar yang dominan dibudidayakan di Jawa Barat. Pengembangan budidaya ikan mas di Jawa Barat masih dihadapkan pada kendala makin menurunnya mutu lingkungan. Oleh karena itu dibutuhkan pakan yang diharapkan dapat meningkatkan respons fisiologis ikan, sehingga pada akhirnya ikan dapat memanfaatkan pakan lebih efisien. Salah satu upaya yang dapat dilakukan yaitu dengan penambahan feed additive berupa minyak cengkeh. Penelitian ini bertujuan untuk mengevaluasi pengaruh penambahan minyak cengkeh dalam pakan terhadap kinerja pertumbuhan ikan mas.
Sebuah percobaan dengan tiga ulangan dilakukan dengan menggunakan ikan mas dengan bobot awal 3,9 ± 1,08 g/ekor. Ikan ditebar ke dalam akuarium berukuran 50x40x35 cm3 dengan volume air 150 L pada kepadatan ikan 25 ekor/akuarium. Setiap akuarium dilengkapi dengan top filter dan thermostat. Selama periode pemeliharaan, ikan diberi makan dengan pakan yang mengandung minyak cengkeh sebanyak 0, 5, 10, 15, dan 100 mg/100 g pakan. Penelitian ini terdiri dari dua tahap percobaan. Percobaan pertama bertujuan untuk mengetahui kinerja pertumbuhan ikan (56 hari), berikutnya percobaan kedua bertujuan untuk menguji kecernaan pakan (10 hari). Ikan diberi pakan tiga kali dalam sehari secara at satiation, yaitu pukul 08.00, 12.00 dan 16.00 WIB.
Hasil penelitian menunjukkan bahwa kinerja pertumbuhan ikan dipengaruhi oleh penambahan minyak cengkeh. Pemberian pakan yang mengandung minyak cengkeh meningkatkan retensi lemak dan tingkat kelangsungan hidup ikan mas. Namun hanya kelompok ikan yang diberi pakan dengan penambahan minyak cengkeh pada dosis 100 mg/100 g pakan menghasilkan bobot akhir, laju pertumbuhan harian, efisiensi pakan, panjang vili usus dan nilai hemoglobin yang paling tinggi dibandingkan dengan perlakuan lainnya. Pemberian pakan yang mengandung minyak cengkeh memberi efek yang sama seperti pada perlakuan kontrol terhadap kecernaan protein, retensi protein, indek hepatosomatik (IHS), nilai rasio panjang usus per panjang tubuh, total eritrosit dan nilai hematokrit. Kelimpahan total bakteri di usus ikan mas tertinggi adalah perlakuan 100 mg minyak cengkeh/100 g pakan, yaitu 3,6 x 107 CFU/g dengan jenis bakteri dominan Acinetobacter, Chromobacterium lividium, Pseudomonas, Bacillus dan Kurthia. Sebagai kesimpulan bahwa penambahan minyak cengkeh dengan dosis 100 mg/100 g pakan dapat meningkatkan kinerja pertumbuhan ikan mas.
SUMMARY
TIRA SILVIANTI. The supplementation of clove oil Syzygium aromaticum in the diet to improve the growth performance of common carp Cyprinus carpio. Supervised by DEDI JUSADI and SRI NURYATI.
Common carp is one of freshwater fish species which dominantly farmed in West Java. The farming activities constrained with the decreasing of environment quality. Hence it is needed diet that expected to increase the fish physiological response, in order that fish can utilize diet more efficiently. One of the efforts is the supplementation of feed additive from clove oil. The aim of this research was to determine the effect of the diet supplemented with clove oil on the growth performance of common carp Cyprinus carpio.
A triplicate experiment was conducted using common carp with an initial body weight of 3.9±1.08 g/fish. Fishes were stocked in 50×40×35 cm3 aquaria with 150 L water volume at density of 25 fishes/aquaria. Each aquarium was equipped with top filter and thermostat. During rearing period, fishes were fed on the diet contained clove oil either of 0, 5, 10, 15, and 100 mg/100 g diet, respectively. The research consisted of two experiments. First experiment aimed to determine fish growth performance (56 days), the second experiment that aimed to tested fish digestibility given treatment diets (10 days). The fishes were fed on the diet three times a day at satiation ie 08.00 am, 12.00 am and 16.00 pm.
Results showed that the fish growth performance were affected by clove oil supplemented diet. The survival rate and lipid retention were increased in the groups of fish fed on the diet supplemented with clove oil. Fish fed on the diet supplemented with clove oil at dose of 100 mg/100 g diet showed highest value of final body weight, daily growth rate, feed efficiency, the length of intestinal villi and hemoglobin compared with other treatments. However, the protein digestibility, protein retention, hepatosomatic index (HSI) and ratio of intestinal length to total body length, total erythrocytes and hematocrit were insignificantly affected by clove oil supplemented diets. The total number of bacteria in the fish intestine was highest in 100 mg clove oil per 100 g diet group with mostly dominant bacteria were Acinetobacter, Chromobacterium lividium, Pseudomonas, Bacillus and Kurthia. It can be conclude that the supplementation of clove oil at dose of 100 mg/100 g diet improve common carp growth performance.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
PENAMBAHAN MINYAK CENGKEH
Syzygium
aromaticum
DALAM PAKAN UNTUK MEMPERBAIKI
KINERJA PERTUMBUHAN IKAN MAS
Cyprinus carpio
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Penambahan Minyak Cengkeh Syzygium aromaticum dalam Pakan untuk Memperbaiki Kinerja Pertumbuhan Ikan Mas Cyprinus carpio
Nama : Tira Silvianti NIM : C151130481
Disetujui oleh Komisi Pembimbing
Dr Ir Dedi Jusadi, MSc Ketua
Dr Sri Nuryati, SPi MSi Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 20 November 2015
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala limpahan rahmat dan karunia-Nya sehingga tesis ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah feed additive, dengan judul Penambahan Minyak Cengkeh Syzygium aromaticum dalam Pakan untuk Memperbaiki Kinerja Pertumbuhan Ikan Mas Cyprinus carpio.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Dedi Jusadi, MSc dan Ibu Dr Ir Sri Nuryati, MSi selaku komisi pembimbing atas waktu dan bimbingannya. Di samping itu, penulis juga menyampaikan rasa terima kasih kepada Bapak Dr Eddy Supriyono, MSc selaku dosen penguji luar komisi dan Ibu Dr Ir Widanarni, MSi sebagai komisi program studi.
Terima kasih disampaikan pada Direktorat Jendral Pendidikan Tinggi (DIKTI) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPPDN) atas dana bantuan pendidikan yang diberikan kepada penulis. Ungkapan terima kasih juga disampaikan kepada ayahanda Salim Akil, ibunda Juairiyah, kakak dan adik atas segala doa dan kasih sayangnya.
Terima kasih kepada pak Wasjan, mbak Retno, pak Ranta, kang Yosi, pak Aam, kang Depi atas bantuannya selama penelitian. Kepada A. Tiara EDP dan Nurina Pratiwi selaku teman seperjuangan yang telah bekerjasama dan membantu penulis selama penelitian hingga proses penulisan tesis, serta teman-teman khususnya M. Rijalul Fikri, Dendi, kak Wiwik, kak Ibha, kak Aisyah, kak Puji, Ika,Yacha, Rudi, kak Ega, Windu, Asep, Fahmi, Didi, Bayu dan teman-teman Ilmu Akuakutur 2013 atas bantuan, semangat dan persahabatannya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Hipotesis 2
2 METODE 3
Rancangan Percobaan 3
Prosedur Penelitian 3
Parameter Uji 6
Analisis Data 6
3 HASIL DAN PEMBAHASAN 7
Hasil 7
Pembahasan 10
4 KESIMPULAN DAN SARAN 14
Kesimpulan 14
Saran 14
DAFTAR PUSTAKA 14
LAMPIRAN 17
DAFTAR TABEL
1 Formulasi pakan uji 4
2 Hasil proksimat pakan perlakuan 4
3 Kinerja pertumbuhan dan kecernaan protein ikan mas pada penambahan
minyak cengkeh dalam pakan dengan dosis berbeda 8
4 Indek hepatosomatik (IHS), rasio panjang usus per panjang tubuh (RPU), panjang vili (PV) ikan mas pada penambahan minyak cengkeh dalam
pakan dengan dosis berbeda 8
5 Kelimpahan total dan jenis bakteri dominan di usus ikan mas pada penambahan minyak cengkeh dalam pakan dengan dosis berbeda 9 6 Parameter gambaran darah ikan mas pada penambahan minyak cengkeh
dalam pakan dengan dosis berbeda 10
7 Karakterisasi jenis bakteri dominan di usus ikan mas pada penambahan
minyak cengkeh dalam pakan dengan dosis berbeda 31
DAFTAR GAMBAR
1 Bobot rata-rata ikan mas yang diberi pakan perlakuan minyak cengkeh
dengan dosis berbeda 7
2 Panjang villi pada histologi melintang usus ikan mas 9
DAFTAR LAMPIRAN
1 Kondisi Gaskromatografi untuk analisis bahan aktif minyak cengkeh 17
2 Prosedur analisis proksimat 17
3 Prosedur uji kecernaan 20
4 Prosedur perhitungan parameter pertumbuhan 20
5 Prosedur perhitungan parameter kecernaan 22
6 Prosedur perhitungan parameter kesehatan 22
7 Hasil uji statistik 24
1 PENDAHULUAN
Latar Belakang
Ikan mas merupakan jenis ikan air tawar yang dominan dibudidayakan di Jawa Barat. Sentra produksi ikan mas Jawa Barat adalah Waduk Cirata dan Waduk Jatiluhur. Adapun jumlah capaian produksi ikan mas pada tahun 2014 yaitu sebesar 484.110 ton (DJPB 2014). Pengembangan budidaya ikan mas Jawa Barat masih dihadapkan pada kendala makin menurunnya mutu lingkungan. Waduk Cirata terkenal dengan kualitas airnya yang buruk, dicirikan dengan sering terjadinya upwelling. Menurut petani ikan pada Tahun 2014, upwelling pada Waduk Cirata terjadi hampir setiap bulan dibandingkan di Waduk Jatiluhur hanya terjadi satu kali dalam setahun yaitu antara bulan Desember hingga Januari. Nilai efisiensi pakan untuk ikan mas di Waduk Cirata juga lebih rendah yaitu kurang dari 60% dibandingkan dengan Waduk Jatiluhur, dimana nilai efisiensi pakannya antara 65-68 %. Oleh karena itu diperlukan upaya untuk meningkatkan efisiensi pakan. Salah satu upaya yang dapat dilakukan yaitu dengan penambahan feed additive berupa minyak cengkeh.
Hasil penelitian Gaber (2000) menunjukkan, penambahan minyak cengkeh pada pakan ikan nila sebanyak 8 mg/100 g pakan dapat meningkatkan bobot tubuh sebesar 261,2 % dibanding yang tidak diberi minyak cengkeh peningkatan bobot tubuhnya hanya 128,2%, menekan feed conversion ratio (FCR) dari 3,6 pada perlakuan kontrol menjadi 2,2, efisiensi pakan yang tidak diberi minyak cengkeh 30,2% sedangkan yang diberi minyak cengkeh adalah 49%. Selain itu, parameter imun non spesifik berupa gambaran darah yaitu total eritrosit, total leukosit, hemoglobin dan hematokrit juga meningkat.
Kelebihan penggunaan minyak cengkeh adalah bahan alami yang mudah tersedia secara massal, sehingga aplikasinya mudah dilakukan. Minyak cengkeh menurut Goni et al. (2009) kandungan terbesarnya terdiri dari 82 % eugenol, 10 % β karyophilene, 2,9 % α humelene, 0,5 % eugenol asetat dan 0,4 % δ-kadinene. Menurut Ogata et al. (2000) tanaman cengkeh mengandung beberapa komponen fenol yaitu eugenol, asetil eugenol, α dan β karyophilene, eugenia, vanillin dan asam galotanin. Senyawa fenol dapat berfungsi sebagai antioksidan karena mampu menghentikan reaksi radikal bebas pada oksidasi lipid. Eugenol dalam minyak cengkeh memiliki aktivitas antioksidan yang efeknya sama dengan α tokoferol dalam menghambat peroksidase lipid.
Hasil penelitian Mu’nisa (2009) memperlihatkan bahwa ekstrak daun cengkeh memiliki peran sebagai senyawa antioksidan dan antihiperkolesterolemia (menekan kadar kolesterol dalam darah yang dapat menyebabkan penumpukan lipid dalam darah) pada kelinci. Minyak cengkeh juga dapat menyebabkan perubahan permeabilitas sel bakteri. Oleh karena itu minyak cengkeh dapat menghambat sejumlah besar bakteri Gram negatif maupun positif dan beberapa jenis kapang (Nunez & Aquino 2012), sehingga penggunaan minyak cengkeh pada dosis tertentu diduga dapat mengganggu aktivitas mikloflora dalam usus ikan dan berpeluang menghambat kecernaan dan pertumbuhan.
2
hari yang dipelihara selama 38 hari tidak memberikan hasil pertumbuhan yang berbeda secara signifikan dengan perlakuan tanpa penambahan minyak cengkeh. Hasil tersebut menunjukkan bahwa penambahan minyak cengkeh dalam pakan hingga dosis 600 mg/kg masih dalam dosis yang aman dan tidak menekan pertumbuhan. Penggunaan minyak cengkeh telah diakui aman oleh The United States Food and Drug Administration (USFDA) bila tidak melebihi dosis 1500 ppm di semua kategori makanan (Gulcin et al. 2012). Berdasarkan uraian di atas, penelitian ini dilakukan untuk mengevaluasi penambahan minyak cengkeh dalam pakan untuk memperbaiki kinerja pertumbuhan ikan mas.
Perumusan Masalah
Efisiensi pemanfaatan pakan dalam budidaya ikan mas cenderung menurun dari waktu ke waktu, diduga akibat menurunnya mutu lingkungan. Oleh karena itu dibutuhkan pakan yang diharapkan dapat meningkatkan respons fisiologis ikan yang pada akhirnya dapat memanfaatkan pakan lebih efisien. Alternatif yang dapat dilakukan yaitu penambahan minyak cengkeh dalam pakan. Selain mudah tersedia secara masal, minyak cengkeh merupakan bahan alami yang memiliki banyak fungsi, diantaranya dapat digunakan sebagai stimulasi untuk pertumbuhan. Penggunaan minyak cengkeh dalam pakan perlu diteliti lebih lanjut untuk memperbaiki kinerja pertumbuhan ikan mas.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi efek penambahan minyak cengkeh dalam pakan terhadap kinerja pertumbuhan ikan mas.
Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah memberikan informasi potensi minyak cengkeh sebagai feed additive dalam pakan untuk memperbaiki efisiensi pemanfaatan pakan dan pertumbuhan ikan mas.
Hipotesis
3
2 METODE
Rancangan Percobaan
Desain perlakuan yang digunakan pada penelitian ini yaitu metode rancangan acak lengkap (RAL) yang terdiri dari 5 perlakuan dan 3 ulangan. Penelitian dibagi dalam dua tahap, yakni pemeliharaan ikan untuk uji pertumbuhan dan pemeliharaan ikan untuk uji kecernaan. Perlakuan yang digunakan adalah penambahan minyak cengkeh ke dalam pakan pada dosis 0, 5, 10, 15, dan 100 mg/100 g pakan.
Prosedur Penelitian
Pakan Uji
Minyak cengkeh yang digunakan diperoleh dari penyedia minyak atsiri di kota Bogor yang diproduksi pada tahun 2014. Minyak cengkeh dianalisis kandungan bahan aktifnya di Balai Penelitian Tanaman Rempah dan Obat (BALITRO), Cimanggu, Bogor dengan Gaskromatografi Agilent N890. Kondisi Gaskromatografi (GC) untuk analisis bahan aktif minyak cengkeh disajikan pada Lampiran 1. Komposisi bahan aktif minyak cengkeh yaitu eugenol 58,27%, ß-carophylen 31,29% dan metil eugenol 0,41%. Penelitian ini terbagi menjadi dua tahap yaitu uji pertumbuhan dan uji kecernaan pakan. Pakan untuk uji kecernaan dan uji pertumbuhan menggunakan formula yang sama, namun pada uji kecernaan pakan ditambahkan kromium (Cr2O3) sebanyak 0,5% sebagai indikator (NRC
1993).
4
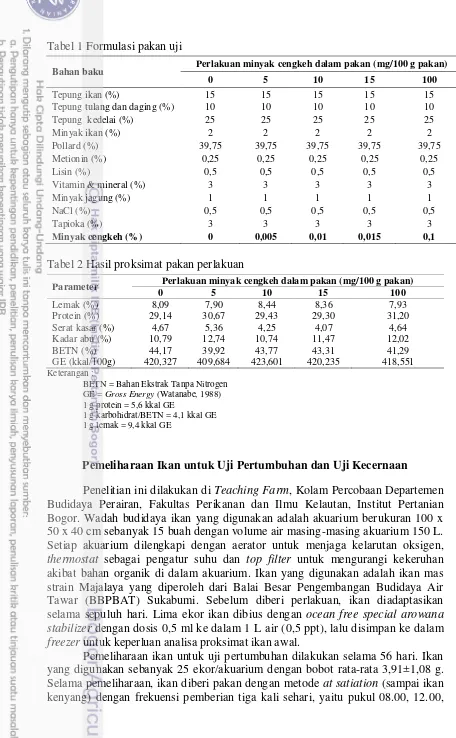
Tabel 1 Formulasi pakan uji
Bahan baku Perlakuan minyak cengkeh dalam pakan (mg/100 g pakan)
0 5 10 15 100
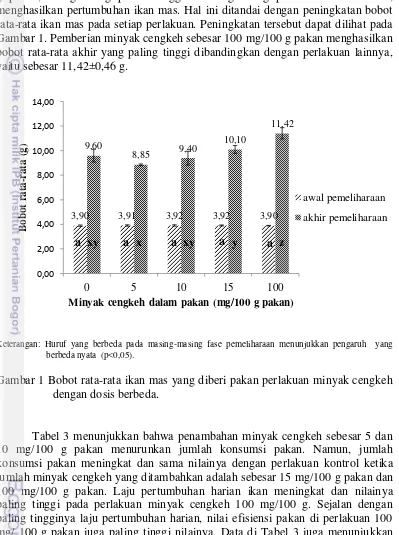
Tabel 2 Hasil proksimat pakan perlakuan
Parameter Perlakuan minyak cengkeh dalam pakan (mg/100 g pakan)
0 5 10 15 100
GE (kkal/100g) 420,327 409,684 423,601 420,235 418,551
Keterangan :
BETN = Bahan Ekstrak Tanpa Nitrogen GE = Gross Energy (Watanabe, 1988) 1g protein = 5,6 kkal GE
1g karbohidrat/BETN = 4,1 kkal GE 1g lemak = 9,4 kkal GE
Pemeliharaan Ikan untuk Uji Pertumbuhan dan Uji Kecernaan
Penelitian ini dilakukan di Teaching Farm, Kolam Percobaan Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Wadah budidaya ikan yang digunakan adalah akuarium berukuran 100 x 50 x 40 cm sebanyak 15 buah dengan volume air masing-masing akuarium 150 L. Setiap akuarium dilengkapi dengan aerator untuk menjaga kelarutan oksigen, thermostat sebagai pengatur suhu dan top filter untuk mengurangi kekeruhan akibat bahan organik di dalam akuarium. Ikan yang digunakan adalah ikan mas strain Majalaya yang diperoleh dari Balai Besar Pengembangan Budidaya Air Tawar (BBPBAT) Sukabumi. Sebelum diberi perlakuan, ikan diadaptasikan selama sepuluh hari. Lima ekor ikan dibius dengan ocean free special arowana stabilizer dengan dosis 0,5 ml ke dalam 1 L air (0,5 ppt), lalu disimpan ke dalam freezer untuk keperluan analisa proksimat ikan awal.
5
dan 16.00 WIB. Penimbangan bobot ikan dilakukan pada hari ke-0 dan hari ke-57. Sebelum ditimbang, ikan dibius dengan ocean free special arowana stabilizer dengan dosis 0,5 ppt. Kondisi kualitas air dijaga dengan penyiponan dan dilakukan pergantian air sebanyak 25% setiap 2-3 hari sekali. Selama masa pemeliharaan, dilakukan pengukuran kualitas air pada awal serta pertengahan masa pemeliharaan ikan (hari ke-25), sedangkan pengukuran suhu air dilakukan setiap hari. Nilai kualitas air yang diperoleh meliputi suhu air berkisar 28-31ºC, pH 7,29-7,55, oksigen terlarut (DO) 4,6-6,2 mg/L, alkalinitas 80-168 mg/L CaCO3 dan total ammonia nitrogen (TAN) 0,08-0,34 mg/L.
Pada akhir masa pemeliharaan, ikan dipuasakan selama 1 hari kemudian ditimbang bobotnya. Tiga ekor ikan dari setiap akuarium diambil dan dijadikan satu untuk dilakukan analisis gambaran darah dan proksimat tubuh. Tiga ekor ikan dari setiap akuarium diambil untuk diukur panjang usus, bobot hati dan dilakukan histologi usus, selanjutnya dua ekor ikan setiap akuarium untuk uji kelimpahan total dan jenis bakteri di usus.
Perlakuan uji kecernaan pakan dimulai pada hari ke-57 hingga hari ke-67. Ikan yang digunakan yaitu sebanyak 13 ekor dengan bobot rata-rata 9,87±0,97 g dari sisa uji pertumbuhan. Ikan diberi pakan mengandung kromium dengan frekuensi pemberian tiga kali sehari yaitu pukul 08.00, 12.00, dan 16.00 WIB. Feses ikan mulai dikumpulkan pada hari ke-60 (ditandai dengan feses berwarna hijau) hingga jumlahnya mencukupi untuk keperluan analisis. Pengumpulan feses dilakukan dua kali sehari (siang dan sore hari) satu jam setelah pemberian pakan. Feses yang terkumpul dimasukkan dalam botol film dan disimpan dalam freezer guna menjaga kesegarannya, untuk kemudian dianalisis kandungan kromiumnya.
Analisis Kimia
6
Parameter Uji
Parameter Pertumbuhan
Parameter pertumbuhan yang diamati yaitu peningkatan bobot rata-rata, jumlah konsumsi pakan, laju pertumbuhan harian (Huisman 1987), retensi protein, retensi lemak dan efisiensi pakan sesuai dengan Takeuchi (1988), serta tingkat kelangsungan hidup. Parameter pendukung pertumbuhan lainnya antara lain indek hepatosomatik (Yang et al. 2002), rasio panjang usus per panjang tubuh (Murtini 2015) dan panjang vili usus (Nasir 2002). Pengamatan panjang vili usus dilakukan dengan melakukan histologi usus terlebih dahulu sesuai prosedur Hossain et al. (2007). Prosedur lengkapnya disajikan pada Lampiran 4.
Parameter Kecernaan
Parameter kecernaan yang diamati yaitu kecernaan protein yang dilakukan sesuai dengan prosedur Takeuchi (1988). Perhitungan parameter kecernaan disajikan pada Lampiran 5.
Parameter Kesehatan
Parameter kesehatan ikan diamati melalui parameter kelimpahan total bakteri mengikuti metode Balaji et al. (2012) dan jenis bakteri di usus disesuaikan dengan identifikasi bakteri gram positif dan negatif pada tabel Cowan (1974). Parameter kesehatan ikan juga diamati berdasarkan profil gambaran darah berupa sel darah merah yang dilakukan sesuai dengan prosedur Blaxhall & Daisley (1973), sel darah putih (Blaxhall & Daisley 1973), hematokrit (Goldenfarb et al. 1971) dan hemoglobin (Collier 1944). Prosedur lengkapnya disajikan pada Lampiran 6.
Analisis Data
7
3 HASIL DAN PEMBAHASAN
Hasil
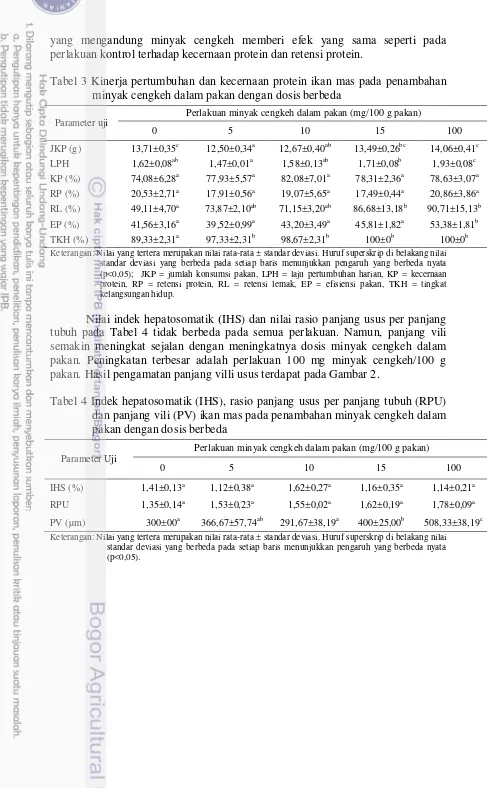
Pemberian pakan yang ditambah minyak cengkeh dengan dosis 0 mg/100 g pakan, 5 mg/100 g pakan hingga 100 mg/100 g pakan selama 56 hari, menghasilkan pertumbuhan ikan mas. Hal ini ditandai dengan peningkatan bobot rata-rata ikan mas pada setiap perlakuan. Peningkatan tersebut dapat dilihat pada Gambar 1. Pemberian minyak cengkeh sebesar 100 mg/100 g pakan menghasilkan bobot rata-rata akhir yang paling tinggi dibandingkan dengan perlakuan lainnya, yaitu sebesar 11,42±0,46 g.
Keterangan: Huruf yang berbeda pada masing-masing fase pemeliharaan menunjukkan pengaruh yang berbeda nyata (p<0,05).
Gambar 1 Bobot rata-rata ikan mas yang diberi pakan perlakuan minyak cengkeh dengan dosis berbeda.
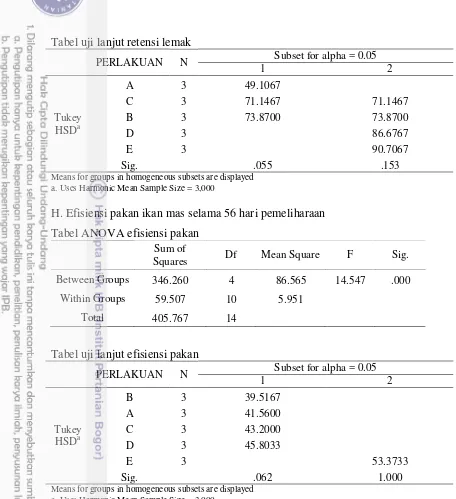
Tabel 3 menunjukkan bahwa penambahan minyak cengkeh sebesar 5 dan 10 mg/100 g pakan menurunkan jumlah konsumsi pakan. Namun, jumlah konsumsi pakan meningkat dan sama nilainya dengan perlakuan kontrol ketika jumlah minyak cengkeh yang ditambahkan adalah sebesar 15 mg/100 g pakan dan 100 mg/100 g pakan. Laju pertumbuhan harian ikan meningkat dan nilainya paling tinggi pada perlakuan minyak cengkeh 100 mg/100 g. Sejalan dengan paling tingginya laju pertumbuhan harian, nilai efisiensi pakan di perlakuan 100 mg/ 100 g pakan juga paling tinggi nilainya. Data di Tabel 3 juga menunjukkan bahwa pemberian pakan yang mengandung minyak cengkeh dapat meningkatkan retensi lemak dan tingkat kelangsungan hidup ikan mas. Namun, pemberian pakan
3,90 3,91 3,92 3,92 3,90
Minyak cengkeh dalam pakan (mg/100 g pakan)
8
yang mengandung minyak cengkeh memberi efek yang sama seperti pada perlakuan kontrol terhadap kecernaan protein dan retensi protein.
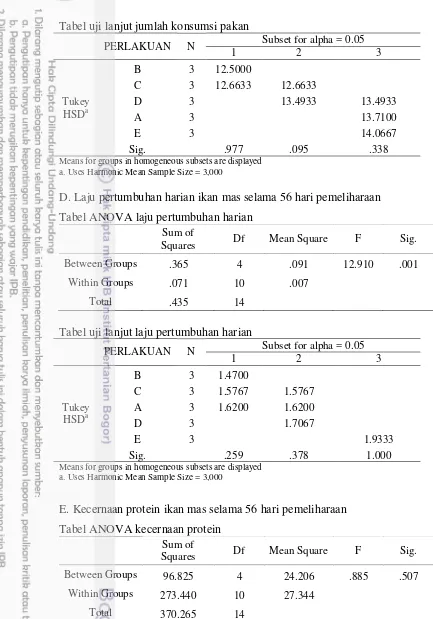
Tabel 3 Kinerja pertumbuhan dan kecernaan protein ikan mas pada penambahan minyak cengkeh dalam pakan dengan dosis berbeda
Parameter uji
Perlakuan minyak cengkeh dalam pakan (mg/100 g pakan)
0 5 10 15 100
JKP (g) 13,71±0,35c 12,50±0,34a 12,67±0,40ab 13,49±0,26bc 14,06±0,41c
LPH 1,62±0,08ab 1,47±0,01a 1,58±0,13ab 1,71±0,08b 1,93±0,08c
KP (%) 74,08±6,28a 77,93±5,57a 82,08±7,01a 78,31±2,36a 78,63±3,07a
RP (%) 20,53±2,71a 17,91±0,56a 19,07±5,65a 17,49±0,44a 20,86±3,86a
RL (%) 49,11±4,70a 73,87±2,10ab 71,15±3,20ab 86,68±13,18b 90,71±15,13b
EP (%) 41,56±3,16a 39,52±0,99a 43,20±3,49a 45,81±1,82a 53,38±1,81b
TKH (%) 89,33±2,31a 97,33±2,31b 98,67±2,31b 100±0b 100±0b
Keterangan: Nilai yang tertera merupakan nilai rata-rata ± standar deviasi. Huruf superskrip di belakang nilai standar deviasi yang berbeda pada setiap baris menunjukkan pengaruh yang berbeda nyata (p<0,05); JKP = jumlah konsumsi pakan, LPH = laju pertumbuhan harian, KP = kecernaan protein, RP = retensi protein, RL = retensi lemak, EP = efisiensi pakan, TKH = tingkat kelangsungan hidup.
Nilai indek hepatosomatik (IHS) dan nilai rasio panjang usus per panjang tubuh pada Tabel 4 tidak berbeda pada semua perlakuan. Namun, panjang vili semakin meningkat sejalan dengan meningkatnya dosis minyak cengkeh dalam pakan. Peningkatan terbesar adalah perlakuan 100 mg minyak cengkeh/100 g pakan. Hasil pengamatan panjang villi usus terdapat pada Gambar 2.
Tabel 4 Indek hepatosomatik (IHS), rasio panjang usus per panjang tubuh (RPU) dan panjang vili (PV) ikan mas pada penambahan minyak cengkeh dalam pakan dengan dosis berbeda
Parameter Uji
Perlakuan minyak cengkeh dalam pakan (mg/100 g pakan)
0 5 10 15 100
IHS (%) 1,41±0,13a 1,12±0,38a 1,62±0,27a 1,16±0,35a 1,14±0,21a
RPU 1,35±0,14a 1,53±0,23a 1,55±0,02a 1,62±0,19a 1,78±0,09a
PV (µm) 300±00a 366,67±57,74ab 291,67±38,19a 400±25,00b 508,33±38,19c
9
Keterangan: pv = panjang vili; a = perlakuan 0 (kontrol), b = perlakuan minyak cengkeh 5 mg/100 g pakan, c = perlakuan 10 mg/100 g, d = perlakuan 15 mg/100 g, dan e = perlakuan 100 mg/100 g; skala perbesaran gambar 100 kali.
Gambar 2 Panjang villi pada histologi melintang usus ikan mas
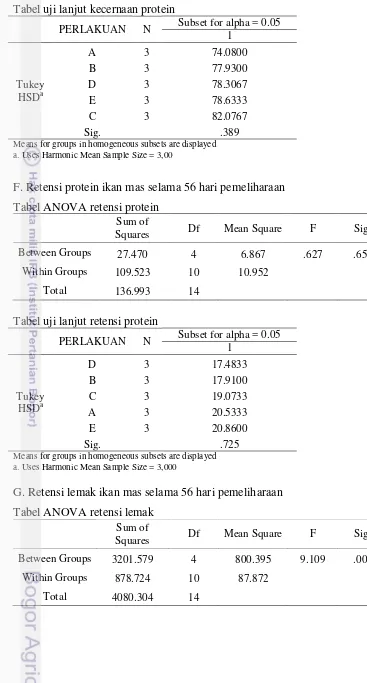
Berdasarkan Tabel 5, terlihat bahwa kelimpahan total bakteri di usus ikan mas yang tertinggi adalah perlakuan minyak cengkeh 100 mg /100 g pakan yaitu sebanyak 3,6 x 107 CFU/g. Selain itu, ditemukan dugaan jenis bakteri dominan pada usus ikan mas yang dianalisis berdasarkan uji biokimia bakteri yang dikelompokkan berdasarkan Tabel Cowan. Pada semua perlakuan ditemukan jenis bakteri Acinetobacter. Jenis bakteri yang paling banyak ditemukan pada perlakuan minyak cengkeh 100 mg/100 g. Hasil pengujian analisis biokimia bakteri secara lengkap disajikan pada Lampiran 8.
Tabel 5 Kelimpahan total dan jenis bakteri dominan di usus ikan mas pada penambahan minyak cengkeh dalam pakan dengan dosis berbeda
Perlakuan (mg/100 g pakan)
Kelimpahan bakteri
(CFU/g) Jenis Bakteri
0 1,46 x 107 Acinetobacter, Bacillus
5 6,4 x 106 Acinetobacter, Bacteroides
10 1,24 x 107 Acinetobacter, Chromobacterium lividium,
Pseudomonas, Micrococcus
15 1,82 x 107 Acinetobacter, Flavobacterium
100 3,6 x 107 Acinetobacter, Chromobacterium lividium,
Pseudomonas, Bacillus, Kurthia
Tabel 6 menunjukkan status kesehatan ikan mas melalui gambaran darah. Penambahan minyak cengkeh hingga dosis 100 mg/100 g pakan tidak menunjukkan perbedaan yang besar pada nilai sel darah merah (SDM), sel darah putih (SDP) dan hematokrit. Namun, nilai sel darah putih ikan perlakuan kontrol lebih tinggi dibandingkan dengan perlakuan lainnya. Selain itu, nilai hematokrit ikan pada semua perlakuan tidak jauh berbeda, namun lebih rendah dari nilai standar. Sedangkan nilai hemoglobin terus meningkat seiring meningkatnya dosis
10
minyak cengkeh. Nilai hemoglobin tertinggi yaitu pada perlakuan minyak cengkeh100 mg/100 g pakan.
Tabel 6 Parameter gambaran darah ikan mas pada penambahan minyak cengkeh dalam pakan dengan dosis berbeda
Parameter Uji
Perlakuan minyak cengkeh dalam pakan (mg/100 g pakan)
0 5 10 15 100 Nilai
(g %) 20-28,95 23,26-27,50 18,42-23,81 20,93-23,68 20,51-24,32 28-40
c
Hemoglobin
(%) 6,8-7 6,2-8,4 7,4-8,8 9-12,6 10,8-13,6 6-10
c
Keterangan: SDM = sel darah merah, SDP = sel darah putih, a = Hibiya & Takashima (1995), b = Moyle dan Cech (1988), c = Svobodova & Vyukusova (1991).
Pembahasan
Penambahan minyak cengkeh dengan dosis yang berbeda pada pakan ikan mas menunjukkan adanya peningkatan kinerja pertumbuhan dengan adanya penambahan bobot tubuh ikan. Berdasarkan hasil yang didapatkan dalam penelitian ini, bobot rata-rata akhir pada perlakuan minyak cengkeh 100 mg/100 g pakan menunjukkan perbedaan yang signifikan dibandingkan dengan perlakuan kontrol dan perlakuan lainnya. Hal ini menunjukkan bahwa semakin besar dosis minyak cengkeh yang ditambahkan maka bobot akhir yang dihasilkan akan semakin besar pula, selama dosis minyak cengkeh masih dalam batas toleransi ikan tersebut.
Peningkatan bobot rata-rata pada penelitian ini diikuti dengan peningkatan laju pertumbuhan harian dan efisiensi pakan. Semakin tinggi dosis minyak cengkeh yang diberikan maka laju pertumbuhan harian dan efisiensi pakan menjadi semakin besar pula. Hasil ini memiliki pengaruh yang sama dengan dengan hasil penelitian Gaber (2000) bahwa penambahan minyak cengkeh dalam pakan dengan dosis 8 mg/100 g pakan dapat meningkatkan bobot tubuh dan efisiensi pakan ikan nila paling baik dibandingkan dengan perlakuan lainnya, sedangkan untuk ikan mas pada penelitian ini hasil terbaik dicapai pada dosis 100 mg/100 g pakan.
11
Mikroba dalam saluran pencernaan berperan dalam meningkatkan kecernaan nutrient pakan melalui enzim pencernaan eksogen yang dieksresikannya yang berperan dalam degradasi molekul kompleks (Aslamyah 2006). Pada semua perlakuan ditemukan jenis bakteri Acinetobacter. Bakteri Acinetobacter merupakan mikroflora normal yang biasa ditemukan pada air dan tanah. Pada kondisi lingkungan yang buruk strain bakteri Acinetobacter baumannii dapat menyebabkan patogen pada ikan channel catfish (Xia et al. 2008). Bakteri Pseudomonas, khususnya strain Pseudomonas putida adalah mikroorganisme yang biasa ditemukan pada ikan, merupakan spesies patogen oportunistik yang menyebabkan penyakit infeksi yang memicu timbulnya lesi dan nekrosis pada kulit hingga timbulnya ulcer pada tubuh ikan rainbow trout (Altinok et al. 2006). Chromobacterium lividium dan Kurthia merupakan flora normal non patogen pada ikan dan organisme lainnya (Cowan 1974). Bakteri Bacillus biasanya digunakan sebagai probiotik yang mempengaruhi aktivitas enzim pencernaan yaitu meningkatkan aktivitas protease, amilase dan lipase sehingga nutrient lebih mudah diserap dan dapat memicu pertumbuhan (Yanbo & Zirong 2006).
Pada perlakuan minyak cengkeh 5 mg/100 g pakan juga ditemukan bakteri Bacteroides, yaitu bakteri yang memiliki efek menguntungkan dalam proses pencernaan hewan air. Pada ikan, dilaporkan bahwa Bacteroides dan Clostridium sp. berkontribusi menyediakan asam lemak dan vitamin (Michael et al. 2014). Pada perlakuan 10 mg/100 g pakan ditemukan bakteri Micrococcus, dimana bakteri Micrococcus sp. menurut Dahiya et al. (2012) merupakan bakteri patogen yang ditemukan pada catfish Clarius batrachus L. Namun pada penelitian El-Rahman et al. (2009) strain bakteri Micrococcus luteus digunakan sebagai probiotik pada ikan nila yang dapat meningkatkan pertumbuhan dan kesehatan ikan. Sedangkan pada perlakuan 15 mg/100 g pakan juga ditemukan bakteri Flavobacterium, strain bakteri Flavobacterium columnare yaitu merupakan patogen yang dapat menyebabkan infeksi akut hingga kronis dan biasanya menyebabkan kerusakan insang, kulit dan sirip ikan budidaya air tawar (Declercq et al. 2013). Jenis dan biomassa mikroflora usus yang bervariasi dipengaruhi oleh faktor pakan dan media pemeliharaan ikan tersebut (Latha & Mohan 2013). Pada penelitian ini diduga bakteri yang ditemukan di usus ikan mas bukan merupakan strain bakteri dari golongan yang patogen, karena masih dalam kelompok genus tertentu dan tidak dilakukan uji patogenitas dengan Postulat Koch. Sehingga pertumbuhan ikan mas masih mengalami peningkatan hingga dosis penambahan minyak cengkeh 100 mg/100 g pakan dengan kelangsungan hidup 100%. Akan tetapi, jumlah kepadatan bakteri yang tinggi dan jenis bakteri yang lebih banyak pada perlakuan 100 mg/100 g tidak mampu meningkatkan kecernaan pakan. Hal ini terlihat dari nilai kecernaan protein yang sama. Diduga walaupun jumlah bakteri di usus ikan pada perlakuan minyak cengkeh 100 mg/100 g pakan lebih tinggi dari perlakuan lainnya, namun memiliki aktivitas enzim yang sama dengan bakteri pada perlakuan lainnya. Sehingga kecernaan protein tidak berbeda pada semua perlakuan.
12
terutama di perlakuan minyak cengkeh 100 mg/100 g pakan diduga menyebabkan meningkatnya nutrient yang diserap, sehingga tubuh memperoleh nutrient dalam jumlah yang berlebih. Hal ini menyebabkan pertumbuhan ikan dan efisiensi pakan di perlakuan minyak cengkeh 100 mg/100 g pakan paling tinggi. Menurut Nasir (2002), semakin panjang vili usus, maka akan meningkatkan efektivitas proses pencernaan pakan karena luas penampang vili lebih besar, sehingga penyerapan nutrient menjadi lebih optimal. Selain itu, Khojasteh (2012) menunjukkan bahwa ikan rainbow trout Oncorhynchus mykiss dan gilt head bream Sparus aurata memiliki usus dengan vili yang panjang dengan fungsi utama sebagai penyerapan nutrient dengan mengoptimalkan permukaan usus.
Status kesehatan ikan dapat diketahui melalui kondisi gambaran darah. Darah bertanggung jawab untuk mengangkut oksigen, karbon dioksida, nutrisi makanan dan hormon, serta terlibat dalam produksi antibodi (Aruldoss et al. 2014). Nilai sel darah merah ikan mas pada semua perlakuan tidak jauh berbeda yaitu 1,25-2,92 x 106 sel/mm3, dimana jumlah sel darah merah ikan pada umumnya adalah sebesar 1-3 x 106 sel/mm3 (Hibiya & Takashima 1995). Nilai sel darah putih (leukosit) pada penambahan minyak cengkeh dalam pakan juga masih dalam batasan normal, kecuali pada perlakuan kontrol. Nilai sel darah putih pada perlakuan kontrol yaitu 15,60-22,5 x 104 sel/mm3, nilai tersebut lebih tinggi dari jumlah leukosit normal. Jumlah leukosit ikan pada umumnya adalah 2-15 x 104 sel/mm3 (Moyle & Cech 2004). Ikan pada perlakuan kontrol diduga mengalami gangguan sistem imun. Akibat dari menurunnya sistem imun pada ikan adalah tingkat kelangsungan hidup ikan pada perlakuan kontrol menjadi lebih rendah dari ikan yang diberi minyak cengkeh dalam pakan. Kematian ikan pada perlakuan kontrol diduga akibat terserang penyakit, ditandai dengan adanya bercak putih seperti kapas di permukaan kulit. Ikan diduga terserang jamur, namun tidak dilakukan identifikasi lebih lanjut mengenai penyakit yang menyerang ikan mas. Menurut Moyle & Cech (2004), leukosit merupakan sel darah yang berperan dalam sistem kekebalan tubuh. Leukosit membantu membersihkan tubuh dari benda asing. Ikan akan menghasilkan banyak leukosit untuk mensintesis antibodi dan memfagosit patogen.
Nilai hematokrit ikan pada semua perlakuan tidak jauh berbeda, namun lebih rendah nilainya dibandingkan dengan hematokrit ikan pada umumnya menurut Svobodova & Vyukusova (1991) yaitu 28-40 g %. Perbedaan nilai hematokrit ini diduga disebabkan oleh jenis ikan dan kondisi lingkungan yang berbeda. Sedangkan nilai hemoglobin terus meningkat seiring meningkatnya dosis minyak cengkeh. Nilai tertinggi adalah pada perlakuan minyak cengkeh 100 mg/100 g pakan yaitu 10,8-13,6 g%. Sedangkan nilai hemoglobin normal pada umumnya menurut Svobodova & Vyukusova (1991) adalah 6-10 g%. Nilai hemoglobin pada perlakuan 100 mg minyak cengkeh/100 g sedikit lebih tinggi dari ikan normal, akan tetapi nilai tersebut masih dalam batas yang dapat ditoleransi ikan mas karena pertumbuhan ikan mas paling tinggi pada dosis tersebut. Hemoglobin berfungsi membawa oksigen dari insang ke jaringan tubuh dalam proses metabolisme untuk menghasilkan energi (Moyle & Cech 2004).
13
dan 100 mg/100 g pakan memberikan hasil lebih tinggi dari perlakuan kontrol. Tingginya nilai retensi lemak disebabkan karena ikan mas lebih dapat memanfaatkan protein dibandingkan dengan lemak sebagai sumber energi. Hal ini dilihat dari nilai retensi lemak yang lebih tinggi dibandingkan dengan nilai retensi protein. Lemak cenderung disimpan dalam jaringan sebagai penyusun struktur membran sel tubuh dibandingkan dimanfaatkan sebagai energi untuk pertumbuhan.
Hati adalah pusat metabolisme nutrient yang berasal dari saluran pencernaan (Bozidar et al. 2011), selain itu hati juga merupakan organ ekskresi yang berfungsi untuk menawarkan racun yang masuk ke dalam tubuh dan menyimpan lemak maupun karbohidrat bila jumlahya dalam tubuh berlebih. Pada penelitian ini nilai IHS ikan pada perlakuan kontrol dan perlakuan minyak cengkeh tidak menunjukkan perbedaan. Hal yang serupa dengan penelitian Cabuk et al. (2006), penambahan campuran minyak esensial (minyak oregano, minyak daun laurel, minyak daun sage, minyak daun myrtle, minyak biji fennel dan minyak kulit jeruk) dengan dosis 24 dan 48 mg/kg pakan tidak mempengaruhi bobot hati ayam broiler.
14
4 KESIMPULAN DAN SARAN
Kesimpulan
Penambahan minyak cengkeh di dalam pakan dengan dosis 100 mg/100 g pakan dapat meningkatkan kinerja pertumbuhan ikan mas terbaik.
Saran
Perlu dilakukan uji Postulat Koch untuk menentukan jenis bakteri patogen yang ditemukan pada usus ikan mas. Pada pemeliharaan ikan mas skala lapang, penggunaan dosis minyak cengkeh dalam pakan yang disarankan untuk meningkatkan kinerja pertumbuhan ikan mas yaitu 100 mg/100 g pakan.
DAFTAR PUSTAKA
Abdel-Magied N. and Ahmed AG. 2011. Efficacy of clove oil as an antioxidant against radiation risk in male rats. J Rad Res Appl Sci. 4 (3): 939-955. Altinok I, Kayis S, Capkin E. 2006. Pseudomonas putida infection in rainbow
trout. Aquacult. 261: 850-855
Aslamyah S. 2006. Penggunaan mikroflora saluran pencernaan sebagai probiotik untuk meningkatkan pertumbuhan dan kelangsungan hidup ikan bandeng (Chanoschanos Forsscal) [tesis]. Bogor (ID): Institut Pertanian Bogor. Aruldoss K, Kannan K, Chandira A. 2014. Effect of Cynodon dactylon on the
heamatological parameters in the blood of Oreochromis mossambicus. Int J Modn Res Revs. 2(5): 171-177.
Balaji N, Rajasekaran KM, Kanipandian N, Vignesh V, Thirumurugan R. 2012. Isolatioan and screening of proteolytic bacteria from freshwater fish Cyprinus carpio. Int Multidiscip Research J. 2(6): 56-59.
Blaxhall PC, Daisley KW. 1973. Routine hematological methods for use with fish blood. J Fish Biol. 5: 577-581.
Bozidar SR, Marko BS, Zoran ZM, Vesna DP. 2011. Histological methods in the assessment of different feed effects on liver and intestine Of fish. J of Agricult Sci. 56(1): 87-100.
Cabuk M, Bozkurt M, Alcicek A, Akbas Y, Kucukyilmaz K. 2006. Effect of a herbal essential oil mixture on growth and internal organ weight of broilers from young and old breeder flocks. South African J of Anim Sci. 36 (2): 135-141.
Collier HB. 1944. The standardization of blood haemoglobin determination. Can Med Assoc J. 50: 550-552.
15 interactions. Veterinary Research. 44: 27.
[DJPB] Direktorat Jenderal Perikanan Budidaya. 2014. Laporan kinerja (LKj) Direktorat Produksi tahun 2014, Direktorat Jenderal Perikanan Budidaya [Internet]. [diunduh 2015 Agu 23]. Tersedia pada: http://www.djpb.kkp.go.id/public/upload/files/laporan-kinerja-dit.-produksi-tahun-2014.pdf.
El-Rahman AMA, Khattab YAE, Shalaby AME. 2009. Micrococcus luteus and Pseudomonas species as probiotics for promoting the growth performance and health of nile tilapia, Oreochromis niloticus. Fish and Shellfish Immunol. 27:175-180.
Gaber MM. 2000. Growth response of nile tilapia fingerlings (Oreochromis niloticus) fed diet containing different levels of clove oil. EgyptJ Aquat Biol and Fish. 4(1): 1-18.
Goldenfarb PB, Bowyer FP, Elmerhall MD, Hall E, Brosious E. 1971. Reproducibility in the Hematology Laboratory: The Microhematokrit Determination. Amer J Clin Path. 56(1): 35-39.
Goni P, Lopez P, Sanchez C, Gomez-Lus R, Becerril R, Nerin C. 2009. Antimicrobial activity in the vapour phase of a combination of cinnamon and clove essential oils. Food Chem. 116: 982-989.
Gulcin I, Elmastas M, Aboul-Einin HY. 2012. Antioxidant activity of clove oil-a powerfull antioxidant source. Arabian J of Chem. 5: 489-49.
Hibiya T and Takashima F. 1995. An Atlas of Fish Histology Normal and Pathological Feature. Second Edition. Takashima F. Kodansha Ltd Tokyo. 195 hlm.
Hossain MK, Hossain MD, Rahman H. 2007. Histopathology of some diseased fishes. J Life Earth Sci. 2(2): 47-50.
Huisman EA. 1987. Principles of Fish Production. Department of Fisheries Wageningen. Agriculture University. Netherland.
Khojasteh B. 2012. The Morphology of the post gastric alimantary canal in teleost fish. Int J Aqu Sci. 3(2): 71-88.
Latha N, Mohan MR. 2013. The bacterial microflora in the fish organs-a public health aspect. Indian J of Advan in Chem Sci. 1 (3): 139-143.
Michael ET, Amos SO, Hussaini LT . 2014. A review on probiotics application in aquaculture. Fish Aquacult J. 5(4): 2150-3508.
Moyle PB, Cech Jr JJ. 2004. Fishes. An Introduction to Ichthyology. 5th Edition. USA: Prentice Hall, Inc.
Mukhtar MA. 2011. The effect of dietary clove oil on broiler performance. Austral J of Bas and Appl Sci. 5(7): 49-51.
16
Mu’nisa A. 2009. Aktivitas antioksidan dan antihiperkolesterolemia ekstrak daun
cengkeh (Eugenia aromatica O.K) pada kelinci [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Nasir M. 2002. Pengaruh kadar selulosa yang berbeda dalam pakan terhadap panjang usus dan aktivitas enzim pencernaan benih ikan gurami (Osphronemus gouramy Lac.) [tesis]. Bogor (ID): Institut Pertanian Bogor. [NRC] National Research Council. 1993. Nutrient requirement of Fish.
Washington DC (US): National Academy Press.
Nunez L, D’ Aquino M. 2012. Microbicide activity of clove essential oil
(Eugenia caryophyllata). Brazilian J Microbiol: 1255-1260.
Ogata M, Hoshi M, Urano S, Endo T. 2000. Antioxidant activity of eugenol and related monomeric and dimeric compounds. Chem Pharm Bull. 48(10):1467-1469.
Svobodova Z, Vykusova B, 1991. Diagnostic prevention and therapy of fish diseases and intoxication. Reseacrh Intitute of Fish Culture and Hydrobiology Vodnany, Czechoslovakia.
Takeuchi T. 1988. Laboratory work-chemical evaluation of dietary nutrients, P 179-233 In: T, Watanabe, editor. Fish Nutrition and Mariculture. Departement of Aquatic Bioscience. Tokyo University of Fisheries.
Watanabe T. 1988. Fish Nutrition and Mariculture. Department of Aquatic Biosience. Tokyo University of Fisheries: JICA.
Xia L, Xiong D, Gu Z, Xu Z, Chen C, Xie J, Xu P. 2008. Recovery of Acinetobacter baumannii from diseased channel catfish (Ictalurus punctatus) in China.Aquacult. 284: 285-288.
Yanbo W, Zirong X. 2006. Effect of probiotics for common carp (Cyprinus carpio) based on growth performance and digestive enzyme activities. Animal Feed Sci and Tech. 127: 283-292.
17
LAMPIRAN
Lampiran 1 Kondisi Gaskromatografi untuk analisis bahan aktif minyak cengkeh Komposisi bahan aktif minyak cengkeh yang dianalisis yaitu eugenol, ß-carophylen dan metil eugenol. Analisis dilakukan dengan Gaskromatografi Agilent N890 dengan tipe kolom Carbowax 20 M. Volume contoh yang digunakan sebanyak 0,1 µl. Kondisi alat yang digunakan yaitu:
Suhu kolom initial : 60 0C Suhu kolom final : 180 0C Suhu injektor : 220 0C Suhu detektor : 250 0C
Detektor : FID
Gas pembawa : N2
Laju alir N2 : 1 ml/menit
Laju alir H2 : 30 ml/menit
Laju alir udara tekan : 40 ml/menit
Lampiran 2 Prosedur analisis proksimat A. Kadar protein
Tahap oksidasi
1. Sampel ditimbang sebanyak 0,5 gram dan dimasukkan ke dalam labu Kjeldahl. 2. Katalis (K2SO4+CuSO4.5H2O) dengan rasio 9:1 ditimbang sebanyak 3 gram
dan dimasukkan ke dalam labu Kjeldahl.
3. 10 ml H2SO4 pekat ditambahkan ke dalam labu Kjeldahl dan kemudian labu
tersebut dipanaskan dalam rak oksidasi/digestion pada suhu 400 oC selama 3-4 jam hingga berwarna hijau bening.
4. Larutan didinginkan lalu ditambahkan air destilasi 100 ml. Kemudian larutan dimasukkan ke dalam labu takar dan diencerkan dengan akuades sampai volume larutan mencapai 100 ml. Larutan sampel siap didestilasi.
Tahap destilasi
1. Beberapa tetes H2SO4 dimsukkan ke dalam labu, sebelumnya labu diisi
setengahnya dengan akuades untuk menghindari kontaminasi oleh ammonia lingkungan. Kemudian didihkan selama 10 menit.
2. Erlenmeyer diisi 10 ml H2SO4 0,05 N dan ditambahkan 2 tetes indicator methyl
red diletakkan di bawah pipa pembuangan kondensor dengan cara dimiringkan sehingga ujung pipa tenggelam dalam cairan.
3. 5 ml larutan sampel dimasukkan ke dalam tabung destilasi melalui corong yang kemudian dibilas dengan akuades dan ditambahkan 10 ml NaOH 30% lalu dimasukkan melalui corong tersebut dan ditutup.
18
5. Labu erlenmeyer diturunkan hingga ujung pipa kondensor berada di leher labu, diatas permukaan larutan. Kondensor dibilas dengan akuades selama 1-2 menit. Tahap titrasi
1. Larutan hasil destilasi ditritasi dengan larutan NaOH 0,05 N. 2. Volume hasil titrasi dicatat.
3. Prosedur yang sama juga dilakukan pada blanko.
Kadar Protein (%) = 0,0007 * x (Vb – Vs) x 6,25 ** x 20 x 100 S
Keterangan :
Vb = Volume hasil titrasi blanko (ml) Vs = Volume hasil titrasi sampel (ml) S = Bobot sampel (gram)
* = Setiap ml 0,05 NaOH ekivalen dengan 0,0007 gram Nitrogen ** = Faktor Nitrogen
B. Kadar lemak
Metode ekstraksi Soxhlet (sampel kering)
1. Labu ekstraksi dipanaskan dalam oven pada suhu 110 oC dalam waktu 1 jam. Kemudian didiinginkan dalam desikator selama 30 menit dan ditimbang bobot labu tersebut (X1)
2. Sampel ditimbang sebanyak 3-5 gram (A), dan dimasukkan ke dalam selongsong tabung filter dan dimasukkan ke dalam soxhlet dan pemberat diletakkan di atasnya.
3. N-hexan 100-150 ml dimasukkan ke dalam soxhlet sampai selongsong terendam dan sisa N-hexan dimasukkan ke dalam labu.
4. Labu yang telah dihubungkan dengan soxhlet dipanaskan di atas water bath sampai cairan yang merendam sampel dalam soxhlet berwarna bening.
5. Labu dilepaskan dan tetap dipanaskan hingga N-hexan menguap.
6. Labu dan lemak yang tersisa dipanakan dalam oven selama 15 menit, kemudian didinginkan dalam desikator selama 15-30 menit dan ditimbang (X2)
Metode Folch (sampel basah)
1. Labu silinder dioven terlebih dahulu pada suhu 110 oC selama 1 jam, didinginkan dalam desikator selama 30 menit kemudian ditimbang (X1). 2. Sampel ditimbang sebanyak 2-3 gram (A) dan dimasukkan ke dalam gelas
homogenize dan ditambahkan larutan kloroform/methanol (20xA), sebagian disisakan untuk membilas pada saat penyaringan.
3. Sampel dihomogenkan selama 5 menit setelah itu disraing dengan vacuum pump.
4. Sampel yang telah disaring tersebut dimasukkan dalamlabu pemisah yang telah diberi larutan MgCl2 0,03 N (0,2xC), kemudian dikocok dengan kuat minimal
selama 1 menit kemudian ditutup dengan aluminium foil dan didiamkan selama 1 malam.
19
terdpat dalam labu diuapkan dengan menggunakan vacuum setelah itu ditimbang (X2)
Kadar Lemak (%) = X2 –X1 x 100 A
C. Kadar air
1. Cawan dipanaskan dalam oven pada suhu 100 oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipanaskan dalam oven pada suhu 110 oC selama 4 jam kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
Kadar Air (%) = (X1+A)-X2 x 100 A
D. Kadar Abu
1. Cawan dipanaskan dalam oven pada suhu 100 oC selama 1 jam dan kemudian dimasukkan dalam desikator selama 30 menit dan ditimbang (X1)
2. Bahan ditimbang 2-3 gram (A)
3. Cawan dan bahan dipansakan dalam tanur pada suhu 600 oC sampai menjadi abu kemudian dimasukkan dalam desikator selam 30 menit dan ditimbang (X2)
Kadar Abu (%) = X2–X1 x 100 A
E. Kadar serat kasar
1. Kertas filter dipanaskan dalam oven selama 1 jam pada suhu 110 oC setelah itu didinginkan dalam desikator selama 15 menit dan ditimbang (X1)
2. Sampel ditimbang sebanyak 0,5 gram (A) dimasukkan kedalam Erlenmeyer 250 ml
3. H2SO4 0,3 N sebanyak 50 ml ditambahkan ke dalam Erlenmeyer kemudian
dipanaskan di atas hotplate selama 30 menit. Setelah itu NaOH 1,5 N sebanyak 25 ml ditambahkan ke dalam Erlenmeyer dan dipanskan kembali selama 30 menit.
4. Larutan dan bahan yang telah dipanaskan kemudian disaring dalam corong Buchner dan dihubungkan pada vacuum pump untuk mempercepat filtrasi. 5. Larutan dan bahan yang ada pada corong Buchner kemudaian dibilas secara
berturut-turut dengan 50 ml air panas, 50 ml H2SO4 0,3 N, 50 ml air panas, dan
25 ml acetone.
6. Kertas saring dan isinya dimasukkan dalam cawan porselin, lalu dipanaskan dalam oven 105-110 oC selama 1 jam kemudian didinginkan dalam desikator 5-15 menit dan ditimbang (X2).
20
Kadar Serat Kasar (%) = (X2 – X1 – X3) x 100 A
Lampiran 3 Prosedur uji kecernaan
1. Sampel ditimbang sebanyak 0,1-0,2 g sampel/bahan, kemudian dimasukkan ke dalam labu Kjehdal.
2. Larutan asam nitrat pekat ditambahkan sebanyak 5 ml ke dalam labu.
3. Setelah itu, sampel dipanaskan dengan hati-hati selama 30 menit sampai volume larutan menjadi sekitar 1 ml.
4. Setelah sampel dingin, ditambahkan 3 ml asam perklorat pekat ke dalam labu kemudian dipanaskan kembali.
5. Setelah asap putih terlihat dan larutan berubah dari hijau menjadi kuning atau orange, campuran dipanaskan selama sekitar 10 menit.
6. Larutan didinginkan, lalu diencerkan sampai volume 100 ml
7. Nilai absorban larutan ditentukan oleh spektrofotometer dengan panjang gelombang 350 nm.
Lampiran 4 Prosedur perhitungan parameter pertumbuhan A. Jumlah konsumsi pakan (JKP)
Pengukuran jumlah konsumsi pakan ditentukan dengan menimbang jumlah pakan yang diberikan dikurangi jumlah pakan yang tidak dimakan selama pemberian pakan uji pertumbuhan:
JKP = Pm-Pt Keterangan :
JKP = Jumlah konsumsi pakan (g) Pm = Jumlah pakan yang diberikan (g) Pt = Jumlah pakan yang tidak dimakan (g) B. Laju pertumbuhan harian (LPH)
Pengukuran laju pertumbuhan harian ikan uji dihitung menggunakan persamaan berikut (Huisman 1987):
21
C. Retensi protein (RP)
Nilai retensi protein dihitung dengan persamaan sebagai berikut (Takeuchi 1988):
RP = [(FP-I)/P] x 100% Keterangan :
RP = Retensi protein (%)
FP = Jumlah protein ditubuh ikan pada akhir pemeliharaan (g) I = Jumlah protein ditubuh ikan pada awal pemeliharaan (g) P = Jumlah protein yang dikonsumsi ikan (g)
D. Retensi lemak (RL)
Nilai retensi lemak dihitung dengan menggunakan persamaan sebagai berikut (Takeuchi 1988):
RL = [(FL-I)/L] x 100% Keterangan :
RL = Retensi lemak (%)
FL = Jumlah lemak pada tubuh ikan pada akhir pemeliharaan (g) I = Jumlah lemak pada tubuh ikan pada awal pemeliharaan (g) L = Jumlah lemak yang dikonsumsi ikan (g)
E. Efisiensi pakan (EP)
Nilai efisiensi pakan dihitung dengan menggunakan persamaan sebagai berikut (Takeuchi 1988):
EP = {[(Wt + D) - Wo] / F} x 100% Keterangan :
EP = Efisiensi pakan (%)
F = Jumlah pakan yang diberikan selama pemeliharaan (g) Wt = Bobot akhir pemeliharaan (g)
Wo = Bobot awal pemeliharaan (g) D = Bobot ikan mati (g)
F. Tingkat kelangsungan hidup (TKH)
Kelangsungan hidup ikan diamati selama 56 hari pemeliharaan ikan. Kelangsungan hidup ikan dapat diketahui dengan persamaan sebagai berikut:
TKH = [Nt / No] x 100% Keterangan :
22
G. Indeks hepatosomatik (IHS)
Indek hepatosomatik (IHS) diukur dengan menimbang bobot hati dibandingkan dengan bobot tubuh ikan mas hasil perlakuan. IHS dihitung berdasarkan persamaan yang dikemukakan oleh Yang et al. (2002) berikut ini:
IHS(%) = [bobot organ hati (g)/bobot tubuh ikan (g)] x 100 H. Rasio panjang usus/panjang tubuh (RPU)
Rasio panjang usus per panjang tubuh diperoleh dengan mengukur panjang usus dibandingkan dengan panjang tubuh ikan mas hasil perlakuan. RPU dihitung berdasarkan persamaan yang dikemukakan oleh Murtini (2015) berikut ini:
RPU = panjang usus (cm)/panjang tubuh ikan (cm) I. Panjang vili usus (PVU)
Pengamatan panjang vili usus dilakukan dengan melakukan histologi usus. Pembuatan preparat histologi melalui 4 tahapan, yaitu fiksasi, parafinasi, pemotongan jaringan dan pewarnaan jaringan dengan hematoxylin dan eosin (Hossain et al. 2007). Panjang vili usus diperoleh dengan mengukur panjang vili di bawah mikroskop dengan perbesaran 100 kali.
Lampiran 5 Prosedur perhitungan paremeter kecernaan Kecernaan protein
Parameter kecernaan yang diukur adalah kecernaan protein pakan uji. Nilai kecernaan bahan dihitung dengan rumus sebagai berikut (Takeuchi 1988):
Kecernaan protein = [1- a/a’ x b’/b] x 100 Keterangan :
a = % Cr2O3 dalam pakan
a’ = % Cr2O3 dalam feses b = % nutrien dalam pakan
b’ = % nutrien dalam feses
Lampiran 6 Prosedur perhitungan parameter kesehatan Kelimpahan total bakteri di usus
23
disebar pada media agar TSA (Tyiptic Soy agar) lalu diinkubasi pada suhu 37 oC selama 24 jam (Balaji et al. 2012). Koloni tunggal yang tumbuh di media tersebut dihitung jumlah totalnya dan dikarakterisasi berdasarkan bentuk, gram, uji O/F, SIM, Oksidase dan Katalase. Karakterisasi bakteri dilakukan menurut metode Cowan (1974). Kelimpahan total bakteri dihitung menggunakan metode hitungan cawan sebar ditentukan dalam Colony Forming Unit (CFU) dengan perhitungan sebagai berikut:
Σ Bakteri= x Keterangan:
Σ Bakteri = banyaknya sel bakteri (CFU/g) N = jumlah koloni bakteri
f = faktor pengenceran
Gambaran darah
A. Sel Darah Merah (Eritrosit)
Darah dihisap menggunakan pipet hemasitometer berbulir merah hingga skala 0,5, lalu diencerkan dengan larutan Hayem sampai skala maksimum 101. Kedua ujung ditutup kemudian digoyangkan membentuk angka delapan selama 3-5 menit. Selanjutnya, larutan pada bagian ujung pipet yang tidak teraduk dibuang sebanyak 1 tetes. Tetesan berikutnya dimasukkan ke dalam hemasitometer yang telah dilengkapi dengan kaca penutup. Perhitungan dilakukan di bawah mikroskop dengan perbesaran 400x dan jumlah eritrosit dihitung pada 5 kotak besar hemasitometer dengan faktor pengenceran 200 kali. Perhitungan total eritrosit digunakan rumus berikut ini (Blaxhall & Daisley 1973):
∑ Eritrosit = rataan ∑ sel terhitung x x faktor pengenceran B. Sel Darah Putih (Leukosit)
Darah dihisap menggunakan pipet hemasitometer hingga skala 0,5 lalu
diencerkan dengan larutan Turk’s sampai skala maksimum 11. Kedua ujung
ditutup kemudian digoyangkan membentuk angka delapan selama 3-5 menit. Selanjutnya, larutan pada bagian ujung pipet yang tidak teraduk dibuang sebanyak 1 tetes. Tetesan berikutnya dimasukkan ke dalam hemasitometer yang telah dilengkapi dengan kaca penutup. Perhitungan dilakukan di bawah mikroskop dengan perbesaran 400x dan jumlah leukosit dihitung pada 5 kotak besar haemasitometer dengan faktor pengenceran 20 kali. Perhitungan total leukosit digunakan rumus berikut ini (Blaxhall & Daisley 1973):
24
C. Hematokrit
Darah dihisap dengan tabung mikrohematokrit sampai mencapai ¾ bagian tabung, lalu ujung tabung ditutup dengan crytoseal sedalam kira-kira 1 mm, sehingga terbentuk sumbat crytoseal. Setelah itu, tabung mikrohematokrit tersebut disentrifuge selama 5 menit pada 5000 rpm dengan posisi tabung yang bervolume sama berhadapan agar putaran sentrifuse seimbang. Panjang bagian darah yang mengendap (a) dan panjang total volume darah yang terdapat di dalam tabung (b) diukur dengan menggunakan penggaris. Perhitungan nilai hematokrit menggunakan rumus berikut ini (Goldenfarb et al. 1971):
Kadar hematokrit = Keterangan:
a = Panjang natan
b = Panjang total volume darah D. Hemoglobin
Pengukuran kadar Haemoglobin (Hb) dilakukan dengan metode Sahli (Collier 1944). Darah dihisap dengan pipet sahli sampai skala 20 mm3 atau pada skala 0,02 mL, kemudian darah dipindahkan ke dalam tabung Hb-meter yang telah diisi HCl 0,1 N sampai skala 10, kemudian diaduk dan dibiarkan selama 3-5 menit. Setelah itu akuades ditambahkan sampai warna darah dan HCl tersebut sama seperti warna larutan standar yang ada dalam Hb-meter tersebut. Skala dibaca dengan melihat permukaan cairan dan dicocokkan dengan skala tabung sahli yang dilihat pada skala jalur g% (kuning) yang berarti banyaknya haemoglobin dalam gram per 100 mL darah.
Lampiran 7 Hasil uji statistik A. Bobot rata-rata awal ikan mas Tabel ANOVA bobot rata-rata awal
Sum of
Squares Df Mean Square F Sig.
Between Groups .001 4 .000 .076 .988
Within Groups .024 10 .002
25
Tabel uji lanjut bobot rata-rata awal
PERLAKUAN N Subset for alpha = 0.05
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
B. Bobot rata-rata akhir ikan mas selama 56 hari pemeliharaan Tabel ANOVA bobot rata-rata akhir
Sum of
Squares Df Mean Square F Sig.
Between Groups 11.331 4 2.833 15.871 .000
Within Groups 1.785 10 .178
Total 13.116 14
Tabel uji lanjut bobot rata-rata akhir
PERLAKUAN N Subset for alpha = 0.05
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
C. Jumlah konsumsi pakan ikan mas selama 56 hari pemeliharaan Tabel ANOVA jumlah konsumsi pakan
Sum of
Squares Df Mean Square F Sig.
Between Groups 5.513 4 1.378 11.028 .001
Within Groups 1.250 10 .125
26
Tabel uji lanjut jumlah konsumsi pakan
PERLAKUAN N Subset for alpha = 0.05
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
D. Laju pertumbuhan harian ikan mas selama 56 hari pemeliharaan Tabel ANOVA laju pertumbuhan harian
Sum of
Squares Df Mean Square F Sig.
Between Groups .365 4 .091 12.910 .001
Within Groups .071 10 .007
Total .435 14
Tabel uji lanjut laju pertumbuhan harian
PERLAKUAN N Subset for alpha = 0.05
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
E. Kecernaan protein ikan mas selama 56 hari pemeliharaan Tabel ANOVA kecernaan protein
Sum of
Squares Df Mean Square F Sig.
Between Groups 96.825 4 24.206 .885 .507
Within Groups 273.440 10 27.344
27
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,00
F. Retensi protein ikan mas selama 56 hari pemeliharaan Tabel ANOVA retensi protein
Sum of
Squares Df Mean Square F Sig.
Between Groups 27.470 4 6.867 .627 .654
Within Groups 109.523 10 10.952
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
G. Retensi lemak ikan mas selama 56 hari pemeliharaan Tabel ANOVA retensi lemak
Sum of
Squares Df Mean Square F Sig.
Between Groups 3201.579 4 800.395 9.109 .002
Within Groups 878.724 10 87.872
28
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
H. Efisiensi pakan ikan mas selama 56 hari pemeliharaan Tabel ANOVA efisiensi pakan
Sum of
Squares Df Mean Square F Sig.
Between Groups 346.260 4 86.565 14.547 .000
Within Groups 59.507 10 5.951
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
I. Tingkat kelangsungan hidup ikan mas selama 56 hari pemeliharaan Tabel ANOVA tingkat kelangsungan hidup
Sum of
Squares Df Mean Square F Sig.
Between Groups 238.933 4 59.733 18.667 .000
Within Groups 32.000 10 3.200
29
Tabel uji lanjut tingkat kelangsungan hidup
PERLAKUAN N Subset for alpha = 0.05
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
J. Indek hepatosomatik ikan mas selama 56 hari pemeliharaan Tabel ANOVA indek hepatosomatik
Sum of
Squares Df Mean Square F Sig.
Between Groups .578 4 .145 1.826 .201
Within Groups .792 10 .079
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
K. Rasio panjang usus per panjang tubuh ikan mas selama 56 hari pemeliharaan Tabel ANOVA rasio panjang usus per panjang tubuh
Sum of
Squares Df Mean Square F Sig.
Between Groups .287 4 .072 2.978 .074
Within Groups .241 10 .024
30
Tabel uji lanjut rasio panjang usus per panjang tubuh
PERLAKUAN N Subset for alpha = 0.05
1 2
Tukey
HSDa
A 3 1.3567
B 3 1.5267 1.5267
C 3 1.5500 1.5500
D 3 1.6200 1.6200
E 3 1.7833
Sig. .300 .322
Means for groups in homogeneous subsets are displayed a. Uses Harmonic Mean Sample Size = 3,000
L. Panjang vili ikan mas selama 56 hari pemeliharaan Tabel ANOVA panjang vili
Sum of
Squares Df Mean Square F Sig.
Between Groups 93083.333 4 23270.833 16.924 .000
Within Groups 13750.000 10 1375.000
Total 106833.333 14
Tabel uji lanjut panjang vili
PERLAKUAN N Subset for alpha = 0.05
1 2 3
Tukey
HSDa
C 3 291.6667
A 3 300.0000
B 3 366.6667 366.6667
D 3 400.0000
E 3 508.3333
Sig. .172 .802 1.000
31
Lampiran 8 Karakterisasi jenis bakteri dominan di usus ikan mas pada penambahan minyak cengkeh dalam pakan dengan dosis berbeda Perlakuan
(mg/100 g pakan)
Uji Karakteristik Biokimia
Jenis Bakteri
Isolat Bentuk Gram O/F SIM Oksidase Katalase
0 1 Batang - O - - + Acinetobacter
2 Batang + O + - + Bacillus
5 1 Batang - O - - + Acinetobacter
2 Batang - - - Bacteroides
10 1 Batang - O + - +
Acinetobacter,
Chromobacterium lividium, Pseudomonas
2 Kokus + - - - + Micrococcus
15 1 Batang - O - - + Acinetobacter
2 Batang - O - + + Flavobacterium
100 1 Batang - O + - +
Acinetobacter,
Chromobacterium lividium, Pseudomonas
32
RIWAYAT HIDUP
Penulis dilahirkan di Pringsewu, 20 Juni 1990 dari Ayah Salim Akil dan Ibu Juairiyah. Penulis merupakan anak keempat dari enam bersaudara. Penulis menyelesaikan pendidikan dasar di SD Negeri 1 Pringsewu, Lampung pada tahun 2002. Tahun 2005 penulis berhasil menyelesaikan pendidikan lanjutan pertama di SLTP Negeri 1 Pringsewu, Lampung. Pada tahun 2008 penulis berhasil menyelesaikan pendidikan di SMA Negeri 1 Prigsewu, Lampung. Pada tahun yang sama, penulis lulus seleksi masuk IPB jalur Undangan Seleksi Masuk IPB (USMI) pada Program Studi Teknologi dan Manajemen Perikanan Budidaya, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, dan lulus pada tahun 2013.
Pada tahun 2013, penulis melanjutkan studinya dengan menempuh Program Magister pada program studi Ilmu Akuakultur, Sekolah Pascasarjana, Institut Pertanian Bogor. Penelitian yang dilakukan oleh penulis untuk
menyelesaikan studi Magister Sains (S2) berjudul “Penambahan Minyak Cengkeh