MEMBRAN POLISTIRENA TERFLUORINASI UNTUK
APLIKASI PADA
MICROBIAL FUEL CELL
MIRANTI DYAH PRAMESTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
MIRANTI DYAH PRAMESTI.
Membran Polistirena Terfluorinasi untuk
Aplikasi pada
Microbial Fuel Cell
. Dibimbing oleh
SRI MULIJANI dan
MUHAMMAD KHOTIB.
Microbial fuel cell
(MFC) merupakan suatu sel bahan bakar yang
memanfaatkan aktivitas mikrob sebagai sumber energinya. Mikrob yang
digunakan berasal dari air perasan rumen sapi. Semakin banyak jumlah mikrob,
maka diasumsikan aktivitasnya juga semakin meningkat. Elektrolit yang
digunakan dalam MFC adalah membran polistirena terfluorinasi (PSf). Sintesis
membran PSf menggunakan trietilamina
trihidroflorida dengan berbagai
komposisi, yaitu 5, 10, dan 15%. Berdasarkan hasil uji
fourier transform infrared
spectroscopy
(FTIR), diketahui bahwa gugus fluorin telah tersubtitusi ke dalam
cincin aromatik polistirena. Uji
scanning electron microscope
(SEM) menyatakan
bahwa membran PSf merupakan membran tidak berpori sehingga baik digunakan
sebagai membran elektrolit pada sel bahan bakar. Pengujian konduktivitas proton
membran menunjukkan membran PSf 5% memiliki konduktivitas proton paling
tinggi. Membran PSf yang dihasilkan dapat diaplikasikan dengan baik dalam
sistem MFC. Hal ini dapat diketahui berdasarkan nilai beda potensial yang
dihasilkan oleh PSf 5, 10, dan 15% berturut-turut sebesar 8, 12, dan18 mV.
Kata kunci: polistirena terfluorinasi,
microbial fuel cell
, air perasan rumen sapi.
ABSTRACT
MIRANTI DYAH PRAMESTI.
Fluorinated Polystyrene Membrane for
Application in
Microbial Fuel Cell
. Supervised by SRI MULIJANI and
MUHAMMAD KHOTIB.
Microbial fuel cell
(MFC) is a fuel cell that utilizes microbial activity as a
source of its energy. The microbe used was from cow’s rumen liquid. The higher
numbers of microbe, the higher the microbial activity . The electrolyte used in the
MFC system was a fluorinated polystyrene membrane (PSf). Synthesis of PSf was
done by using triethylamine trihydrofluoride with various composition, namely 5,
10, and 15%. Based on
Fourier transform infrared spectroscopy
(FTIR) result,
fluorine atoms has been substituted into the aromatic ring of the polystyrene. The
results of
scanning electron microscope
(SEM) states that the PSf membrane is a
nonporous membrane so that is good to be used as an electrolyte in fuel cell.
Proton conductivity test shows that membrane of 5% PSf has the highest proton
conductivity. The PSf membrane can be applied in MFC system well. It known
according to the value of potential difference generated by PSf 5, 10, and 15%,
which are 8, 12, and 15 mV, respectively.
MEMBRAN POLISTIRENA TERFLUORINASI UNTUK
APLIKASI PADA
MICROBIAL FUEL CELL
MIRANTI DYAH PRAMESTI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul
: Membran Polistirena Terfluorinasi untuk Aplikasi pada
Microbial
Fuel Cell
Nama
: Miranti Dyah Pramesti
NIM
: G44080056
Disetujui
Pembimbing I
Pembimbing II
Dr. Sri Mulijani, MS
Muhammad Khotib, SSi, MSi
NIP 19630401 199103 2 001 NIP 19781018 20070 1 002
Diketahui
Ketua Departemen
Prof. Dr. Ir. Tun Tedja Irawadi, MS
NIP 19501227 197603 2 002
PRAKATA
Puji dan syukur kehadirat Allah SWT berkat rahmat dan karunia-Nya sehingga
penulis dapat menyelesaikan karya ilmiah ini. Penelitian ini dilaksanakan dari
bulan Februari sampai Juni 2012 yang bertempat di Laboratorium Kimia Fisik,
Departemen Kimia; Laboratorium Biofisika Membran, Departemen Fsika
Fakultas Matematika dan Ilmu Pengetahuan Alam; Laboratorium Bakteriologi,
Fakultas Kedokteran Hewan; dan Fakultas Peternakan, Institut Pertanian Bogor.
Penulis banyak mengucapkan terima kasih kepada yang terhormat Ibu Dr. Sri
Mulijani, MS selaku pembimbing pertama dan Bapak Muhammad Khotib, SSi,
MSi selaku pembimbing kedua yang telah memberikan bimbingan dan semangat
kepada penulis selama penelitian dan penyusunan karya ilmiah ini. Terima kasih
kepada Bapak Agus Sumatri, Bapak Jajang, Bapak Novri, dan Bapak Akhir yang
telah membantu penulis dalam berdiskusi selama penyusunan karya ilmiah,
pemakaian alat dan bahan di laboratorium, dan kepada Bapak Mail, Bapak Caca,
Bapak Eman, Bapak Sobur, dan Bapak Adi yang telah membantu penulis selama
penelitian dilaksanakan.
Ungkapan terima kasih kepada Bapak, Ibu, adik-adikku dan seluruh
keluarga atas doa, dukungan dan semangatnya. Ucapan terima kasih kepada Fikri,
Rido, Ade Nurbani, Suci, Hani, Sugma, Fadli, Vani, Nur Aida, Dumas, Evan,
Ammar, Gita, Umar, Abo, Dwi Utami, Dian Novitasari, dan Retno yang telah
membantu, memberikan semangat, motivasi dan dorongan dalam menyusun karya
ilmiah ini.
Semoga tulisan ini dapat bermanfaat dan menambah wawasan bagi penulis
maupun bagi pembaca.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Surabaya pada tanggal 24 Februari 1990 dari ayah Agus
Eko Priyono dan ibu Suliestyawati. Penulis merupakan putri pertama dari tiga
bersaudara.
Tahun 2002 penulis menyelesaikan sekolah di SD Negeri Kranggan 3
Mojokerto dan pada tahun 2005 penulis menyelesaikan sekolahnya di SMP
Negeri 4 Mojokerto. Tahun 2008 penulis lulus dari SMA Negeri 1 Puri Mojokerto
dan pada tahun yang sama lulus seleksi masuk IPB melalui jalur Undangan
Seleksi Masuk IPB. Penulis memilih Program Studi Kimia, Departemen Kimia,
Fakultas Matematika dan Ilmu Pengetahuan Alam.
DAFTAR ISI
Halaman
DAFTAR ISI ... ixv
DAFTAR TABEL ... v
DAFTAR GAMBAR ... v
DAFTAR LAMPIRAN... v
PENDAHULUAN ... 1
BAHAN DAN METODE ... 2
Alat dan Bahan ... 2
Metode ... 2
Pembuatan membran polistirena... 2
Penentuan
water uptake
... 3
Pencirian membran ... 3
Pengukuran konduktivitas membran... 3
Pengukuran beda potensial sistem MFC ... 3
Perhitungan total mikrob dalam air perasan rumen sapi... 3
HASIL DAN PEMBAHASAN ... 4
Pembuatan membran polistirena terfluorinasi ... 4
Pembuatan trietilamina trihidroflorida... 4
Sintesis polistirena terfluorinasi ... 4
Pencetakan membran ... 4
Penentuan bobot molekul PS dan PSf... 4
Penentuan
water uptake
... 5
Pencirian membran ... 5
Analisis FTIR ... 5
Analisis SEM... 7
Pengukuran konduktivitas membran ... 7
Beda potensial sistem sel bahan bakar... 8
Perhitungan total mikrob dalam air perasan rumen sapi ... 9
SIMPULAN DAN SARAN ... 9
Simpulan ... 9
Saran ... 10
DAFTAR PUSTAKA ... 10
DAFTAR TABEL
Halaman
1 Hubungan
water uptake
dan konduktivitas proton membran ... 8
2 Total mikroba dalam air perasan rumen sapi ... 9
DAFTAR GAMBAR
Halaman
1 Instrumen LCR meter... 3
2 Padatan PS dan PSf. ... 4
3 Hasil pencetakan membran, membran PSf, danmembran PS. ... 4
4 Hubungan antara konsentrasi PSf dan nilai
water uptake
... 5
5 Spektrum PSf dan PS. ... 6
6 Reaksi antara HF dan TEA... 6
7 Produk reaksi fluorinasi pada polistirena ... 6
8 Penampang melintang permukaan membran PS dan PSf, bagian muka membran
PS dan PSf. ... 7
9 Kurva perbedaan konduktivitas proton sebelum dan setelah diaktivasi. ... 7
10 Sistem
microbial fuel cell
(A) anolit dan (B) katolit. ... 8
11 Kurva hubungan beda potensial dan konsentrasi PSf. ... 8
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian... 13
2 Penentuan bobot molekul polistirena dan polistirena terfluorinasi ... 14
3 Penentuan
water uptake
... 18
4 Penentuan konduktivitas proton dari membran ... 19
PENDAHULUAN
Perkembangan teknologi yang pesat mengakibatkan terjadinya peningkatan kebutuhan energi. Saat ini, Indonesia menghadapi persoalan pasokan energi, baik untuk kepentingan industri maupun rumah tangga (Hendrana 2007). Krisis energi ini dipicu dari pertumbuhan populasi manusia dan berkembangnya teknologi baru yang membutuhkan energi listrik dalam melakukan kinerjanya. Upaya pemenuhan energi yang telah dilakukan, sebagian besar berasal dari konversi bahan bakar fosil yang tidak dapat diperbaharui. Oleh karena itu, diperlukan suatu inovasi energi alternatif yang dapat diperbaharui dan ramah lingkungan (Dewi et al.2008).
Fuel cellatau sel bahan bakar merupakan sebuah alat elektrokimia yang mengonversi energi kimia menjadi energi listrik melalui proses elektrokimia. Macam-macam sel bahan bakar, yaitu alkaline fuel cell (AFC), phosphoric acid fuel cell (PAFC), direct methanol fuel cell (DMFC), solid oxide fuel cell(SOFC), proton exchange membrane fuel cell (PEMFC), dan ada pula sel bahan bakar yang pengaplikasiannya menggunakan bantuan mikroorganisme, yang dikenal microbial fuel cell(MFC), sehingga energinya tidak berasal dari hidrogen murni (Dewi et al. 2008).
Penelitian kali ini bertujuan membuat membran dari polistirena terflorinasi (PSf) yang berperan sebagai membran elektrolit pada sistem microbial fuel cell(MFC). Sistem MFC yang digunakan pada penelitian kali ini memanfaatkan materi organik yang bersumber dari air perasan rumen sapi sebagai sumber energinya (Du et al. 2007). Berdasarkan penelitian Sidharta et al (2007) dengan menggunakan membran nafion, sebanyak 500 mL air perasan rumen sapi mampu menghasilkan beda potensial listrik sebesar 810 mV.
Bagian-bagian yang terdapat pada sel bahan bakar, yaitu anode berperan sebagai tempat terjadinya pemecahan hidrogen menjadi proton dan elektron. Katode sebagai tempat terjadinya reaksi penggabungan proton, elektron, dan oksigen. Elektrolit berupa membran polimer yang berperan sebagai proton exchange membrane (PEM) untuk mengalirkan proton dan memblokir elektron melewati membran (Hendrana et al. 2007).
Syarat-syarat polimer yang digunakan dalam sel bahan bakar, yaitu tipis, memiliki
sifat mekanik yang baik, permeable bagi proton, impermeable bagi gas CO2 dan hidrogen, impermeable terhadap elektron, memiliki konduktivitas proton yang tinggi, memiliki kestabilan kimia, elektrokimia, dan suhu yang baik, serta tahan terhadap asam (Walsby 2001).
Nafion merupakan membran yang biasa digunakan sebagai elektrolit dalam sel bahan bakar, memiliki konduktivitas proton sebesar 0.1 S/cm (Hendrana et al. 2007). Namun, membran ini harganya sangat mahal dan konduktivitas proton dari membran dapat menurun secara signifikan (Oo & Win 2008). Oleh karena itu, saat ini banyak dikembangkan material baru yang dapat menggantikan nafion, misalnya campuran antara poli(aril eter keton), poliimida, poli (benzaimidazol), dan polistirena (Walsby 2001).
Polistirena atau styrofoam banyak digunakan masyarakat Indonesia. Maraknya penggunaan styrofoam dapat menyebabkan dampak buruk bagi kesehatan dan lingkungan. Dari segi kesehatan, bahaya residu PS dalam makanan dapat menyebabkan timbulnya penyakit dan gangguan reproduksi pada manusia. Sedangkan dari segi lingkungan, sifatnya yang tidak dapat di daur ulang dapat menyebabkan masalah terhadap lingkungan (Hendrana et al 2007). Berdasarkan data Deperindag (2007) menyatakan jumlah sampah PS yang dihasilkan per tahun dapat mencapai 1080 styrofoam. Oleh karena itu, perlu adanya penanganan untuk mengurangi limbah gabus PS tersebut dan dapat meningkatkan nilai mutunya.
Polistirena mengalami kendala pada struktrunya yang rapuh pada suhu 100-120 °C dan tingginya permeabilitas terhadap uap air dan oksigen, sehingga diperlukan suatu tehnik untuk memodifikasinya. Salah satu caranya yaitu dengan fluorinasi. Reagen fluorinasi yang digunakan adalah trietilamina trihidroflrida (HF-TEA). Produk dominannya dapat diidentifikasi melalui pengujian menggunakan menggunakan fourier transform infrared spectroscopy (FTIR). Selain itu, FTIR digunakan untuk mendeteksi perubahan gugus fungsi hasil fluorinasi pada membran (Handayani 2008).
digunakan dalam penentuan total bakteri adalah metode total plate count(TPC).
Salah satu karakter membran yang baik untuk sel bahan bakar adalah memiliki konduktivitas proton yang tinggi. Besar kecilnya beda potensial yang dihasilkan air perasan rumen sapi dipengaruhi oleh mikrob yang hidup dan memanfaatkan nutrisi yang terkandung dalam cairan tersebut (Barua & Deka 2010). Penentuan water uptake dilakukan untuk mengetahui kemampuan swellingdari membran (Dhuhita & Arti 2010). Penentuan bobot molekul membran PS dan PSf dilakukan menggunakan metode viskositas (Malcolm 2011).
BAHAN DAN METODE
Alat dan Bahan
Alat-alat yang digunakan adalah peralatan gelas, neraca analitik, oven,fourier transform infra red (FTIR), scanning electrone microscope (SEM), pHmeter, impedance analyzer(LCR meter), rotavapor, seperangkat alat untuk menghitung total bakteri dengan metode TPC (Total Plate Count), pH universal, viskometer Ostwald, mikrometer digital, dan corong pisah.
Bahan-bahan yang digunakan adalah polistirena (PS), Hidrogen florida (HF) 40%, Trietilamina (TEA) 99.7% , diklrometana, kloroform, air perasan rumen sapi, es batu, air deionisasi, elektrode karbon, K3Fe(CN)6, K2HPO4, buffered peptone water(BPW), dan plate count agar(PCA).
Metode
Bagan alir penelitian dapat dilihat pada Lampiran 1.
Pembuatan membran polistirena terfluorinasi
Pembuatan trietilamina trihidroflorida
.
Larutan TEA 99.7% sebanyak 10 mL dicampurkan dengan 15 mL HF 40% ke dalam labu erlenmeyer. Proses pencampuran dilakukan sedikit demi sedikit dan bertahap sambil terus digoyang-goyangkan hingga homogen dan gas yang terbentuk tidak timbul lagi. Saat pengocokkan, labu erlenmeyer ditutup rapat dengan sumbat karet agar gas yang ditimbulkan tidak menyebar. Pembuatan (CH3CH2)3N.3HF ini dilakukan di lemari asam.Sintesis polistirena terfluorinasi. Tahap awal dalam sintesis polistirena adalah memotong polistirena menjadi ukuran yang
lebih kecil. Potongan polistirena ditimbang sebanyak 3 gram, kemudian dimasukkan ke dalam 60 mL kloroform dan diaduk hingga homogen. Larutan polistirena tersebut dicampurkan dengan 24 g (CH3CH2)3N.3HF. Campuran tersebut diaduk hingga homogen, dan direfluks selama 4 jam.
Larutan hasil refluks dinetralkan dengan pencucian menggunakan air deionisasi, kemudian larutan dipekatkan menggunakan rotavapor. Hasil pemekatan berupa padatan yang keras berwarna putih. Padatan yang merupakan polistirena terfluorinasi tersebut dikeluarkan dari labu rotavapor dan dikeringudarakan selama 24 jam. Langkah selanjutnya adalah pencetakkan membran dari polistirena terfluorinasi. Hal yang serupa juga dilakukan untuk blanko, tanpa penambahan (CH3CH2)3N.3HF.
Pencetakkan membran polistirena terfluorinasi (PSf). Padatan polistirena terfluorinasi yang telah dikeringudarakan, dilarutkan ke dalam diklorometana dengan berbagai variasi komposisi (%b/v), yaitu 5%, 10%, dan 15% Psf dalam 30 mL diklorometana. Campuran tersebut diaduk hingga homogen, kemudian dicetak di atas pelat kaca. Bagian pinggir pelat kaca diberi selotip dengan ketebalan tertentu. Larutan cetak polistirena terfluorinasi dituang di atas pelat kaca dan ditarik menggunakan batang pengaduk sehingga membentuk lapisan tipis.
Lapisan ini dibiarkan selama 10 hingga 25 menit untuk terjadinya penguapan parsial pelarutnya kemudian dimasukkan ke dalam bak koagulasi berisi air deionisasi pada suhu ruang dan dibiarkan selama satu malam untuk mendapatkan koagulasi sempurna. Membran tipis yang terbentuk dicuci dengan akuades untuk menghilangkan sisa pelarut kemudian dikeringkan di udara terbuka.
Membran yang telah diperoleh, baik membran polistirena dan polistirena terfluorinasi direbus selama 1 jam dalam air deionisasi, kemudian direbus dengan 3% H2O2 selama 1 jam, direbus dalam H2SO4 0.5 M selama 1 jam. Setelah perebusan, membran-membran tersebut dicuci dengan air deionisasi dan direndam dalam air deionisasi hingga akan digunakan untuk pengukuran.
diambil kurang lebih 20 mL dan dimasukkan ke dalam viskometer Ostwald, kemudian diukur waktu alirnya. Masing-masing membran diukur waktu alirnya sebanyak tiga kali ulangan. Blanko yang digunakan adalah kloroform.
Penentuan water uptake
Membran PS, PSf 5%, 10%, dan 15% dipotong dengan ukuran (1×1)cm2, masing-masing 3 kali ulangan pada lokasi yang acak. Membran-membran tersebut dimasukkan ke dalam oven pada suhu 120 °C selama 24 jam, kemudian ditimbang bobot keringnya. Selanjutnya, membran-mebran tersebut direndam dalam air deionisasi selama 48 jam, dan ditimbang bobot basahnya. Nilai water uptakediperoleh dari persamaan:
Pencirian membran
Analisis gugus fungsi. Pengujian struktur sampel berupa membran polistirena dan polistirena terfluorinasi dilakukan di Laboratorium Biofarmaka, Bogor. Pengujian dilakukan dengan metode spektrofotometri FTIR menggunakan instrumen FTIR Bruker Tensor 27. Analisis ini dilakukan untuk mengetahui spektrum infra merah dari membran polistirena dan polistirena terfluorinasi.
Analisis SEM. Analisis morfologi membran dilakukan dengan menggunakan instrumen SEM Jeol JSM-836ola. Pengukuran dilakukan terhadap polistirena dan polistirena terfluorinasi (PSf) untuk mengetahui pori yang terjadi pada membran. Pemotretan dilakukan pada bagian permukaan dan penampang melintang membran dengan perbesaran 1000 dan 5000 kali.
Pengukuran konduktivitas membran
Pengukuran konduktivitas dilakukan menggunakan alat LCR meter, di Laboratorium Biofisika Membran, Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB. Langkah awal yang dilakukan adalah memotong membran dengan ukuran (6 × 1)cm2. Membran tersebut diapit di antara dua elektrode karbon, kemudian kedua elektrode tersebut dihubungkan dengan kutub positif dan negatif
pada alat, sehingga muncul nilai konduktivitas membrannya.
Gambar 1 Instrumen LCR meter.
Membran yang digunakan saat pengukuran konduktivitas, diukur pula ketebalannya menggunakan mikrometer digital karena tebal membran sebanding dengan jarak antara kedua elektrode karbon (l). Nilai konduktansi (G) yang diperoleh, dikonversi menjadi nilai konduktivitas per satuan jarak yang disebut dengan nilai konduktivitasproton (σ) melalui persamaan :
Keterangan :
σ : konduktivitas proton (S/cm) A : luas permukaan (cm2)
l : jarak antar kedua elektroda G : nilai konduktivitas (S)
Pengukuran beda potensial sistem MFC
Pengukuran konduktivitas sistem sel bahan bakar dilakukan dengan dua sistem bejana. Bejana pertama sebagai tempat anode, dan bejana kedua sebagai tempat katode. Bejana katode (katolit), diisi dengan larutan K3Fe(CN)6 yang dilarutkan dalam akuades hingga 50 mM dan dicampur dengan K2HPO4 yang dilarutkan dalam akuades hingga 100 mM. Bejana anode (anolit) diisi dengan cairan rumen sapi. Bejana anode dan katode masing-masing diisi larutan sebanyak 100 mL.
Kedua bejana tersebut dihubungkan oleh lima lubang yang berdiameter 1 cm. Membran direkatkan di bagian tengah bejana, dan menjadi pembatas antara katolit dan anolit. Elektrode dimasukkan ke dalam kedua larutan tersebut, kemudian dihubungkan dengan kutub positif dan negatif pada LCR meter, sehingga muncul nilai beda potensial yang dihasilkan sistem.
Perhitungan total mikroba dalam air perasan rumen sapi
merupakan larutan dengan Sebanyak 1 mL suspensi dengan 10-1diambil dan dicampurkan BPW, sehingga diperoleh suspens konsentrasi 10-2, dari suspensi dibuat suspensi konsentrasi Dari masing-masing suspensi diambil 1 mL dan dipindahkan cawan petri secara duplo.
Media PCA yang telah dicairkan 45 ± 1 0C sebanyak 15 mL
dalam cawan petri yang pengenceran, kemudian dilakuk membentuk angka delapan aga didiamkan hingga menjadi
tersebut diinkubasi pada temperatur selama 24 hingga 48 jam. Setela jumlah koloni pada pengencerannya. Setelah itu, koloni pada setiap seri pengenc
Semua koloni dalam cawan dengan menggunakan alat penghitun Rata-rata jumlah koloni dikalikan faktor pengencerannya,
dinyatakan sebagai jumlah mililiter. Jika jumlahnya lebih dari 3 maka dinyatakan tidak dapat atau TBUD (ISO 2000).
HASIL DAN PEMBAHASAN
Pembuatan membran poli terfluorinasi Pembuatan trietilamina trihidrof
Warna larutan (CH3CH2 putih dan jika dibiarkan dalam cukup lama akan membentuk seperti pasir. Reagen trihidroflorida ini bersifat higros 2008).
Sintesis polistirena terfluorinasi
Kloroform digunakan sebagai karena PS mudah larut dalam aromatik dan mengandung klorin. larut sempurna dalam klorofor adanya kesamaan sifat nonpolar Pemanasan selama 4 jam pada dilakukan agar campuran homogen dan untuk memperce fluorinasi PS.
Larutan yang telah direflu menggunakan rotavapor untuk pelarut-pelarut yang masih te larutan menjadi lebih pekat. Hasil tersebut berupa gel berwarna
dengan konsentrasi 10-1. dengan konsentrasi dicampurkan dengan 9 mL oleh suspensi dengan spensi konsentrasi 10-2 10-3 hingga 10-8. suspensi pengenceran, dipindahkan ke dalam
telah dicairkan bersuhu 15 mL ditambahkan ke ang berisi suspensi n dilakukan pemutaran lapan agar homogen dan menjadi padat. Padatan pada temperatur 34 °C jam. Setelah itu, dihitung pada setiap seri h itu, dihitung jumlah
encerannya. dalam cawan petri dihitung
alat penghitung koloni. koloni dikalikan dengan ya, dan hasilnya jumlah mikrob per nya lebih dari 300 koloni, dapat untuk dihitung
ASIL DAN PEMBAHASAN
mbran polistirena orinasi
trihidroflorida
2)3N. 3HF adalah dibiarkan dalam waktu yang membentuk endapan putih Reagen trietilamina bersifat higroskopis (TCI
orinasi
akan sebagai pelarut ut dalam hidrokarbon ung klorin. Polistirena dalam kloroform karena nonpolar (Cowd 1999). jam pada suhu 70°C mpuran tersebut lebih mempercepat reaksi
direfluks, dipekatkan untuk menghilangkan masih tersisa dan agar
pekat. Hasil pemekatan berwarna putih yang jika
dikeringudarakan, akan menjadi padata yang keras.
Gambar 2 Padatan PS dan
Pencetakan membran
Padatan PS dan PSf dilarutk komposisi 5%, 10%, dan 15% diklorometana. Padatan PSf mudah secara homogen dalam diklorometa adanya kesamaan sifat nonpolar (Cowd Membran yang telah dicetak,
dikeringudarakan untuk menghilangka pelarut-pelarut dan pengotor yang menguap sehingga membran lebih kering.
Pelepasan membran dari pelat dilakukan dengan merendam bersama pelat kacanya ke dalam air hingga membran terlepas dengan Hal ini dilakukan agar pelepasa dilakukan secara kasar, yang akan pada rusaknya membran.
(a) (b)
Gambar 3 (a) Hasil pencetakan mem membran PSf, dan (c) me
Sebelum membran digunakan bahan bakar, dilakukan proses terlebih dahulu dengan mengguna oksidator kuat. Aktivasi dilakuk mengaktifkan pori yang terdapat membran sehingga saat diaplikasikan sel bahan bakar, membra menghantarkan proton lebih banyak.
Penentuan bobot molekul PS dan
Penentuan bobot molekul dilakukan mengetahui perbedaan bobot molekul dan PSf dan untuk mengetahui reaksi fluorinasi PS terhadap bobot polimer. Penentuannya dilakuka menentukan viskositasnya berdasar alir larutan PS dan PSf. Pelarut digunakan adalah kloroform karena merupakan pelarut yang baik Kloroform dapat berinteraksi dengan
menjadi padatan putih
PS dan PSf.
dilarutkan dengan dan 15% dalam PSf mudah larut diklorometana karena (Cowd 1999). dicetak, kemudian menghilangkan pengotor yang mudah membran lebih cepat
dari pelat kaca merendam membran dalam air deionisasi dengan sendirinya. pelepasannya tidak ang akan berakibat
(c)
kan membran, (b) Sf, dan (c) membran PS.
digunakan pada sel proses aktivasi menggunakan dilakukan untuk terdapat pada diaplikasikan untuk membran dapat oton lebih banyak.
PS dan PSf
dengan cara membuka rantai makromolekul polimer tersebut, sehingga PS mapun PSf mampu larut sempurna dalam kloroform (Azizah 2004).
Lampiran 2 menunjukkan laju alir PS dan PSf. Semakin pekat konsentrasi suatu larutan, maka laju alirnya akan semakin lama (Azizah 2004). Laju alir larutan PSf lebih besar dibandingkan larutan PS. Hal ini membuktikan bahwa larutan PSf lebih kental dan pekat dibandingkan larutan PS. Laju alir kloroform yang diperoleh sebesar 32.81 detik, sedangkan kedua sampel yang digunakan memiliki laju alir yang lebih besar dibandingkan laju alir pelarutnya.
Persamaan garis yang diperoleh untuk hubungan viskositas reduktif dan konsentrasi sampel berupa PS adalah, y = 38.10 + 2301x dan untuk PSf adalah, y = 87.77 – 1706x. Berdasarkan persamaan garis yang diperoleh, dapat diketahui nilai viskositas intrinsik ([η]) yang digunakan untuk dapat menentukan bobot molekul dari suatu polimer menurut persamaan Mark-Houwink (Azizah 2004). Bobot molekul PSf yang diperoleh sebesar 239634.7 g/mol dengan nilai linieritas sebesar 0.953, sedangkan bobot molekul PS diperoleh sebesar 79777.77 g/mol dengan nilai linieritasnya 0.893.
Bobot molekul membran PS mengalami peningkatan setelah mengalami proses fluorinasi. Hal ini menunjukkan bahwa proses fluorinasi PS telah berhasil. Adanya subtitusi gugus fluor ke dalam rantai PS, menyebabkan penambahan bobot molekul dari polistirena.
Penentuan water uptake
Penentuan water uptake membran, dilakukan untuk mengetahui kemampuan membran dalam melakukan proses swelling saat pengaplikasiannya sebagai sel bahan bakar (Chia 2006). Proses swellingbertujuan untuk menghantarkan proton yang dihasilkan di bagian anode, yang terjerap dalam membran dan mengalirkannya menuju ke katode.
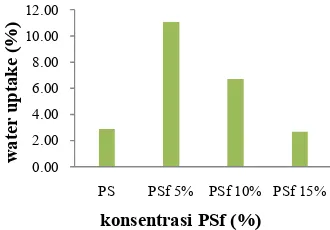
Gambar 4 Hubungan antara konsentrasi PSf dan nilai water uptake.
Berdasarkan Lampiran 2 diketahui bahwa terjadi peningkatan bobot membran setelah perendaman, yang dinyatakan sebagai bobot basah. Hal ini menunjukkan bahwa membran memiliki kemampuan mengikat air bebas, meskipun penambahan bobotnya tidak signifikan. Nilai water uptake membran PS dan PSf tergolong tinggi, artinya semua membran yang akan diaplikasikan sebagai elektrolit dalam sistem MFC memiliki kemampuan swellingyang cukup baik.
Gambar 5 menunjukkan bahwa membran PSf 5% memiliki persentase water uptake yang paling besar, yaitu 11.07%. Membran PSf 5% memiliki kemampuan menyerap air lebih tinggi dibandingkan membran yang lain, sehingga proses swelling untuk menghantarkan proton yang dihasilkan juga akan semakin tinggi. Kemampuan membran dalam menghantarkan proton, sangat berpengaruh terhadap nilai konduktivitas protonnya.
Pencirian membran Analisis FTIR
Pengujian FTIR dilakukan pada membran PS dan PSf untuk mengetahui adanya subtitusi gugus fluor pada polistirena dan produk dominan yang dihasilkan dari sintesis polistirena menggunakan reagen trietilamina trihidroflorida, berdasarkan spektrum infra merahnya. 0.00 2.00 4.00 6.00 8.00 10.00 12.00
PS PSf 5% PSf 10% PSf 15%
w at er u p tak e (%)
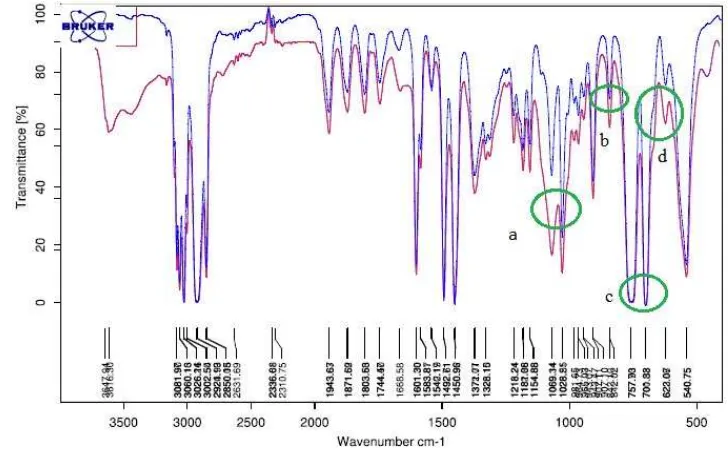
Gambar 5 Spektrum PSf ( ) dan PS ( ).
Spektrum berwarna merah menunjukkan spektrum PSf, sedangkan spektrum berwarna biru merupakan spektrum dari PS. Terdapat perbedaan pita serapan dari kedua spektrum membran. Spektrum senyawa aromatik, ditunjukkan dengan adanya serapan pada bilangan gelombang 1601.30 cm-1. Perbedaan antara kedua spektrum tersebut yaitu pita serapan pada bilangan gelombang 1069.14 hingga 1028.55 cm-1yang diberi simbol huruf ‘a’, hanya terdapat pada spektrum PSf dan tidak terdapat pada spektrum PS. Serapan itu menunjukkan adanya gugus fluor yang terdapat dalam membran PSf (Pavia et al. 2001).
Saat terjadi pencampuran antara HF dan TEA, atom N pada TEA akan terprotonasi sehingga tidak dapat bereaksi lagi.
Gambar 6 Reaksi antara HF dan TEA.
Ion F- yang terbentuk berperan sebagai nukleofilik yang akan menyerang cincin aromatik PS yang sifat elektronegatifitasnya lebih rendah dibandingkan F-. Subtitusi F-ke dalam cincin aromatik melalui tahap pembentukkan intermediet berupa benzuna. Struktur intermediet ini memiliki ikatan rangkap tiga pada salah satu ikatan rangkapnya. Ion F- akan menyerang atom H yang terdapat pada ikatan rangkap tiga pada cincin aromatik, sehingga menghasilkan produk berupa polistirena terfluorinasi pada posisi ‘orto’, ‘meta’, dan ‘para’.
Gambar 7 Produk reaksi fluorinasi pada polistirena
Serapan yang diberi simbol dengan huruf ‘b’, ‘c’, dan ‘d’ menunjukkan adanya trisubtitusi pada cincin aromatik dalam polistirena. Huruf ‘b’ pada pita serapan 842.02 cm-1 menunjukkan adanya subtitusi
PS dan PSf pada 757.93-700.88 cm-1 tidak terdapat perbedaan intensitas. Artinya, subtitusi gugus fluor pada posisi ‘orto’ intensitasnya sangat rendah.
Subtitusi fluor pada posisi ‘meta’ ditunjukkan pada bilangan gelombang 650-700 cm-1, yang diberi simbol huruf ’d’. Intensitas pita serapan pada posisi ‘meta’ sangat besar dibandingkan dengan intensitas pada posisi ‘orto’ dan ‘para’, sehingga dapat diketahui bahwa produk polistirena terfluorinasi dengan subtitusi fluor pada posisi ‘meta’ merupakan produk PSf yang paling dominan.
Analisis SEM
(a) (b)
(c) (d)
Gambar 8 Penampang melintang permukaan membran (a) PS dan (b) PSf, bagian muka membran (c) PS dan (d) PSf.
Penampang melintang membran PS dan PSf ditunjukkan pada Gambar 9a dan 9b. Berdasarkan penampang melintang membran, diketahui bahwa lapisan atas membran, baik PS maupun PSf tidak memiliki pori atau nonporous. Membran yang dihasilkan merupakan membran nonporous yang bersifat selektif, sehingga hanya dapat melewatkan proton (H+). Gas CO2 maupun gas dan material lain tidak dapat melewati membran tersebut, sehingga tidak terjadi difusi gas yang melewati membran.
Lapisan bawah dari membran memiliki pori yang berguna untuk membantu proses swelling sehingga proton yang tertangkap di lapisan atas membran dapat dialirkan menuju katode pada sel bahan bakar. Gambar 9c dan 9d merupakan gambar bagian muka dari membran PS dan PSf. Berdasarkan gambar
tersebut, diketahui bahwa baik membran PS dan PSf tidak memiliki pori.
Pengukuran konduktivitas membran
Nilai konduktivitas membran PS, PSf 5, 10, dan 15% diukur menggunakan LCR meter dengan elektroda karbon. Selain memiliki nilai water uptake yang tinggi dan membrannya tidak berpori, syarat lain membran dapat digunakan sebagai elektrolit pada sel bahan bakar adalah memiliki konduktivitas proton yang tinggi (Hendrana 2007). Konduktivitas proton diukur untuk mengetahui kemampuan membran dalam menghantarkan proton. Semakin besar konduktivitas proton yang dihasilkan, maka membran tersebut semakin baik digunakan dalam sistem sel bahan bakar.
Gambar 9 Kurva perbedaan konduktivitas proton sebelum dan setelah diaktivasi.
Berdasarkan Gambar 10, diketahui terjadi perbedaan antara konduktivitas membran sebelum dan setelah diaktivasi. Membran yang telah diaktivasi menggunakan H2O2dan H2SO4, memiliki nilai konduktivitas proton yang lebih tinggi dibandingkan membran yang belum diaktivasi. Hal ini terjadi karena membran yang telah diaktivasi dengan berbagai oksidator kuat tersebut memiliki gugus penghantar proton yang lebih aktif sehingga konduktivitas protonnya pun akan semakin meningkat.
Membran yang belum diaktivasi menunjukkan penurunan nilai konduktivitas proton seiring dengan peningkatan konsentrasi PSf. Membran PS justru memiliki konduktivitas proton tertinggi yaitu 0.52 µS/cm dan PSf 15% memiliki konduktivitas
proton terendah yaitu 0.30 μS/cm. Namun,
setelah semua membran diaktivasi, terjadi perubahan nilai konduktivitas proton masing-masing membran yang cukup signifikan. Membran PSf 5% justru memiliki
0.2 0.4 0.6 0.8 1
0 5 10 15 20
k o nduk ti v ita s pro to n ( μ S/ c m )
Konsentrasi PSf (%)
sebelum aktivasi
konduktivitas proton tertinggi, yaitu sebesar
0.69 μS/cm(Lampiran 5).
Tabel 1 Hubungan water uptakedan konduktivitas proton membran
Membran Water uptake (%)
σ
(µS/cm)
PS 2.87 0.54
PSf 5% 11.07 0.69
PSf 10% 6.70 0.67
PSf 15% 2.64 0.63
Tingginya nilai konduktivitas proton PSf 5% sebanding dengan nilai water uptakeyang dimiliki membran. Membran PSf 5% memiliki nilai water uptake yang paling tinggi, artinya proses swelling untuk menghantarkan proton juga semakin tinggi. Hal ini terbukti dari nilai konduktivitas proton yang dihasilkan dari membran tersebut. Namun, membran PS yang memiliki nilai water uptakelebih tinggi dibanding PSf 15%, justru memiliki konduktivitas proton yang lebih rendah. Hal ini dapat terjadi akibat proses aktivasi yang kurang optimum.
Beda potensial sistem sel bahan bakar
Penelitian mengenai sistem MFC kali ini menggunakan air perasan rumen sapi sebagai anolit dan larutan potasium ferisianida dalam buffer fosfat sebagai katolit. Sistem ini memanfaatkan aktivitas mikroba sebagai sumber energinya. Mikroba dalam air perasan rumen sapi melakukan metabolisme terhadap medium di anoda dengan mengatalisis penguraian glukosa menjadi energi listrik, dengan mentransfer elektron dari anoda melalui kabel dan menghasilkan arus ke katoda (Liu et al.2010).
Elektroda yang digunakan adalah elektrode karbon. Larutan potasium ferisianida yang menjadi komponen katoda merupakan senyawa kimia dengan rumus molekul K3[Fe(CN)6], bersifat racun, dan dapat berfungsi sebagai agen pengoksidasi. Fe (III) yang terkandung di dalam molekul K3[Fe(CN)6] akan tereduksi menjadi Fe (II) oleh elektron yang dialirkan dari anoda sebagai hasil metabolisme mikroba. Reduksi Fe (III) menjadi Fe(II) ditunjukkan dengan terjadinya perubahan warna menjadi kuning kehijauan pada larutan katode (Sidharta et al. 2007).
Bagian anolit yang berisi air perasan rumen sapi merupakan tempat terjadinya proses oksidasi bahan-bahan organik. Substrat yang berasal dari pakan sapi, misalnya
selulosa, hemiselulosa, dan lignin akan mengalami respirasi anaerob secara fermentatif dengan bantuan mikroorganisme (Suwandi 1997). Hasil metabolisme mikroba tersebut akan mengalami oksidasi di anode.
Tahap awal dari respirasi anaerobik yaitu proses glikolisis menghasilkan piruvat. Piruvat akan mengalami fermentasi dengan bantuan enzim. Zat hasil metabolisme yang dapat digunakan sebagai sumber hidrogen untuk menghasilkan elektron yaitu alkohol, asetat, atau gas metana, dimana asam asetat merupakan hasil fermentasi yang paling dominan (Campbell et al.1999).
Gambar 10 Sistem microbial fuel cell(A) anolit dan (B) katolit.
C6H12O6+ 2H2O 2CH3COOH + 4H2 + 2CO2
CH3COOH CH4+ CO2 Anode : CH3COO
-+ 4H2O 2HCO3
-+ 9H++ 8e-(E°red = -0.279 V) Katode : 8Fe3++ 8e- 8Fe2+ (E°red =
+0.770) (Liu et al2010).
Proton yang dihasilkan dari proses oksidasi di anode akan melewati membran menuju ke katode, sedangkan elektron yang dihasilkan akan bergerak ke sirkuit luar dan menuju ke katode pula, untuk terjadinya proses reduksi (Koesnandar & Mahyudin 2006). Aliran elektron inilah yang menyebabkan adanya beda potensial antara kedua kutub (anode dan katode) yang besarnya diukur menggunakan LCR meter.
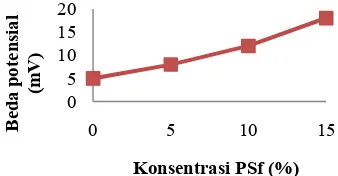
Gambar 11 Kurva hubungan beda potensial dan konsentrasi PSf.
0 5 10 15 20
0 5 10 15
B ed a p o te n si al (m V )
Besar kecilnya beda potensial yang dihasilkan oleh limbah cair organik dipengaruhi oleh konsorsium mikrob yang hidup dan memanfaatkan nutrisi yang terkandung di dalam limbah. Semakin aktif suatu konsorsium mikrob dalam melakukan metabolisme, maka semakin banyak pula elektron bebas yang dihasilkan (Sidharta et al. 2004). Sebanyak 100 mL cairan rumen sapi dapat menghasilkan beda potensial sebesar 18 mV dengan menggunakan membran elektrolit berupa PSf 15%. Semakin tinggi komposisi PSf yang digunakan sebagai membran, semakin besar pula beda potensial yang dihasilkan.
Membran PSf 5% hanya dapat menghasilkan beda potensial sebesar 8 mV. Hal ini dapat terjadi karena adanya penurunan aktivitas mikrob. Mikrob sedang beradaptasi untuk memecah substrat yang lebih kompleks menjadi sederhana. Selain itu, dapat juga disebabkan karena produk fermentasi dari satu jenis mikrob dapat menjadi substrat bagi jenis mikrob yang lain, sehingga produk fermentasi tersebut tidak dapat dioksidasi untuk menghasilkan elektron bebas. (Rabaey et al. 2004).
Faktor lain yang dapat menyebabkan rendahnya beda potensial pada membran PSf 5% stabilitas membrannya. Membran yang memiliki nilai water uptake terlalu tinggi juga kurang baik, karena stabilitas membrannya dapat berubah-ubah sehingga menyebabkan beda potensial yang dihasilkannya pun kurang optimum (Dhuhita & Arti 2010).
Perhitungan total mikrob dalam air perasan rumen sapi
Penentuan total mikrob dilakukan untuk mengetahui jumlah mikrob yang terdapat dalam 1 mL cairan rumen sapi yang digunakan pada sistem MFC. Metode ini dilakukan dengan metode TPC. Banyaknya mikrob dalam air perasan rumen sapi sangat berpengaruh terhadap besarnya beda potensial yang dihasilkan oleh sistem. Semakin banyak mikrob dalam air perasan rumen sapi diasumsikan bahwa aktivitas biologis yang terjadi juga semakin besar. Hal ini menyebabkan banyaknya elektron bebas yang lepas, sehingga dapat menghasilkan beda potensial besar pula (Liu et al. 2010).
Jenis-jenis mikrob yang terdapat dalam air perasan rumen sapi, misalnya bakteri selulolitik (Ruminococcus albus), bakteri proteolitik (Bacteroides ruminocola dan Selenomonas ruminantium), bakteri metanogenik (Methanobacterium formicium),
bakteri amilolitik (Clostridium lochheaddii dan Bacteroides amylophilus), bakteri yang memfermentasikan gula (Eurobacterium ruminantium), beberapa jenis bakteri hemiselulolitik, dan bakteri lipolitik (Suwandi 1997).
Perhitungan total mikrob dilakukan dengan pengenceran bertingkat hingga delapan kali pengenceran. Saat pengenceran pertama hingga ke tujuh, jumlah mikrob melebihi 300, sehingga dinyatakan tidak bisa untuk dihitung (TBUD), hanya pengenceran ke delapan yang tidak TBUD (Lampiran 7).
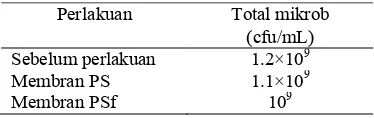
Tabel 2 Total mikroba dalam air perasan rumen sapi
Perlakuan Total mikrob (cfu/mL) Sebelum perlakuan 1.2×109
Membran PS 1.1×109
Membran PSf 109
Berdasarkan Tabel 2, diketahui bahwa total mikrob sebelum digunakan sebagai media dalam MFC sebesar 1.2×109cfu/mL. Berdasarkan penelitian Ogimoto dan Imai pada 1980, menyatakan bahwa terdapat jumlah mikrob sekitar 109 – 1010 cfu/mL cairan rumen (Ogimoto & Imai 1980). Jumlah mikrob yang dihasilkan dalam penelitian kali ini tergolong cukup besar, artinya sebanyak 1.2×109cfu/mL air perasan rumen sapi, beda potensial sistem yang dihasilkan yaitu sebesar 5, 8, 12, dan 18 mV bergantung pada membran yang digunakan. Semakin besar komposisi PSf yang digunakan pada membran, beda potensial terukur juga semakin meningkat.
Jumlah mikrob setelah digunakan sebagai media dalam MFC, terjadi penurunan jumlah yang tidak terlalu signifikan. Penurunan jumlah mikrob dapat dikarenakan adanya mikrob yang mati atau aktivitasnya menurun setelah perlakuan. Kematian mikrob dapat terjadi akibat suhu yang kurang cocok untuk hidup mikrob dan kondisi mikrob yang kurang anaerobik.
SIMPULAN DAN SARAN
Simpulan
Aplikasi PSf sebagai membran elektrolit dalam MFC dengan media air perasan rumen sapi menghasilkan beda potensial yang lebih besar dibandingkan membran PS biasa. Beda potensial terbesar yang dihasilkan dari sistem MFC yaitu sebesar 18 mV menggunakan membran PSf 15%.
Saran
Perlu dilakukan pengujian tidak hanya jumlah total mikrob saja, tetapi juga terhadap aktivitas mikroba yang terjadi pada setiap sampel air perasan rumen yang digunakan, karena aktivitas mikrob dapat berubah setiap saat dan tidak hanya dipengaruhi oleh jumlah mikrob saja. Penentuan jenis mikrob yang berperan paling aktif dalam menghasilkan listrik. Perlu dilakukan pula pengukuran beda potensial dengan variasi waktu, sehingga dapat diketahui hubungan antara aktivitas mikroba terhadap waktu. Penggunaan katalis dalam sistem sel bahan bakar dan penentuan TGA (Thermogravimetric Analysis) terhadap membran, juga sangat diperlukan.
DAFTAR PUSTAKA
Azizah U. 2004. Polimer. Sukarmin, editor. Jakarta: Direktorat Pendidikan Menengah Kejuruan.
Barua PK, Deka D. 2010. Electricity generation from biowaste based microbial fuel cell. International Journal of Energy, Information, and Communications 1(1): 77-92.
Bierley AW, Heat RJ, Scott MJ. 1988. Plastic Materials Properties and Applications. New York: Chapman and Hall Publishing.
Campbell, Neil A, Jane B, Reece, Lawrence GM. 1999. Biology, 5th Edition. Menlo Park: Addison Wesley Longman Inc.
Chia Ee Sunn. 2006. A Chemical Reaction Engineering Perspective of Polymer Electrolyte Membrane Fuel Cells [Disertasi]. Faculty of Princeton University.
Cowd MA. 1999. Kimia Polimer. Firman H, penerjemah; Padmawinata K, editor. London: J Murray. Terjemahan dari: Cowd, Polymer Chemistry.
[DEPERINDAG] Departemen Perindustrian dan Perdagangan. 2007. Kemasan Flexible: 1-15.
Dewi EL. 2007. Mass Transfer Study on Polymer Electrolyte Fuel Cell. Di dalam: Seminar Nasional Teknologi 2007; Yogyakarta, 24 November 2007. Jakarta: BPPT. Hlm 1-8.
Dewi EL, Ismujanto T, Chandrasa GT. 2008. Pengembangan dan aplikasi fuel cell. Di dalam: Tjutjuk Ismujanto, editor. Prosiding Seminar Teknologi; 51-54.
Dhuhita A, Arti DK. 2010. Karakterisasi dan uji kinerja SPEEK, cSMM, dan nafion untuk aplikasi direct methanol fuel cell [Skripsi]. Semarang: Fakultas Teknik, Universitas Diponegoro.
Du, Zhuwei, H Li, T Gu. 2007. A state f the art review on microbial fuel cell; A promising technology for wastewater treatment and bioenergy. Journal of Biotechnology Advance25: 464-482.
Handayani S. 2008. Membran elektrolit berbasis polieter-eter keton tersulfonasi untuk direct methanol fuel cellsuhu tinggi [Disertasi]. Jakarta: Fakultas Teknik, Universitas Indonesia.
Hendrana S, Pujiastuti S, Sudirman, Rahayu I. 2007. Pengaruh suhu dan tekanan proses pembuatan terhadap konduktivitas ionic membran PEMFC berbasis polistirena tersufonasi. Jurnal Sains Materi Indonesia 8(3): 187-191.
Hendrana S. 2007. Pengembangan membran polimer untuk proton exchange membrane fuel cell(PEMFC). Pusat penelitian fisika-LIPI: Bandung.
Hoogers G. 2003. Fuel Cell Technology Handbook. Florida: CRC press LLC.
Indriyati, Hendrana S, Pujiastuti. 2004. Karakterisasi membran polistirena tersulfonasi. Prosiding Pertemuan Ilmiah Ilmu Pengetahuan dan Teknologi Bahan. Serpong,pp: 92-96.
[ISO] International Standard Operation. 2000. Microbiology of Food Animal Feeding Stuffs- Horizontal Method for The Detection and Enumeration of Enterobacteriaceae. 21528-1: 2000.
Koesnandar, Mahyudin AR. 2006. Biohydrogen production: prospects and limitations to practical application. Akta Kimindo1: 73-78.
penerjemah. Jakarta: Erlangga. Terjemahan dari: Principles of Biochemistry.
Li YS, Zhao TS, Yang WW. 2010. Measurement of water uptake and transport properties in anion-exchange membranes. International Journal of Hydrogen Energy35: 5656-5665.
Liu H, Chignell J, Fan Y, Hu H. 2010. Microbial electrolysis: novel technology for hydrogen production from biomass. Biofuels1(1): 129 – 142.
Malcolm SP. 2001. Kimia Polimer. Sopyan I, penerjemah. Jakarta: PT Pradnya Paramita. Terjemahan dari: Polymer Chemistry: An Introduction.
Ogimoto K, Imai S. 1980. Atlas of Rumen Microbiology. Tokyo: Japan Scientific Societies Press.
Oo MM, Win N. 2008. Preparation of Membrane for Proton Exchange Membrane Fuel Cell. WorldAcademy of Science, Engineering, and Technology 48: 135-138.
Pavia DL, Lampman GM, Kriz GS. Introduction to Spectroscopy 2001., third Edition. Washington: Department of Chemistry Western Washington University.
Rabaey K, Lissens G,Verstraete W. 2004. Microbial Fuel Cell: Permormance and Perspective. Belgium: Ghent University.
Sidharta M L, Jamilah, Karamita D, Brianno W, Hamid A. 2007. Pemanfaatan limbah cair sebagai sumber energi listrik pada microbial fuel cell. [Karya Ilmiah]. Bandung: Institut Teknologi Bandung bekerjasama dengan PT. Rekayasa Industri.
Suwandi. 1997. Peranan mikroba rumen pada ternak ruminansia. Lokakarya Fungsional Non Peneliti. Bogor: 13-19.
[
TCI] Tokyo Chemical Industry. 2008. Fluorinating reagents and building blocks for fluorinated biochemical compounds. Tokyo: Tokyo Chemical Industry Co.,Ltd.Wagner H. 2005. It’s Electricity: Cows Show Promise as Powerplants. Columbus: Ohio State University.
Lampiran 1 Diagram alir penelitian
Pembuatan membran polistirena terfluorinasi
(Pembuatan HF-TEA, sintesis PSf, pencetakan membran, aktivasi membran, penentuan bobot molekul, dan penentuan water uptake)
Penentuan koduktivitas proton membran
Penentuan beda potensial sistem MFC
Pencirian membran
- FTIR - SEM
Lampiran 2 Penentuan bobot molekul polistirena dan polistirena terfluorinasi
Volume pelarut yang digunakan (Kloroform) = 25 mL Data laju alir polistirena dan polistirena terfluorinasi
Sampel
ke-Bobot
polistirena Konsentrasi
ulangan
waktu alir (s)
ηrelatif ηspesifik ηreduktif
(g) (g/mL) ti trerata
PSf
1 0.1003 0.00401
1 43.71
43.61 1.329 0.329 82.01
2 43.46
3 43.66
2 0.1505 0.00602
1 47.64
47.77 14.557 0.4557 75.70
2 47.84
3 47.82
3 0.2507 0.01003
1 56.07
56.41 17.192 0.7192 71.72
2 56.96
3 56.21
4 0.3008 0.01203
1 59.43
59.22 18.049 0.8049 66.89
2 59.22
3 59.02
PS
1 0.1502 0.0060
1 43.50
43.43 13.234 0.3234 53.84
2 43.43
3 43.35
2 0.2008 0.0080
1 47.00
47.15 14.368 0.4368 54.38
2 47.31
3 47.13
3 0.2501 0.0100
1 52.83
52.41 15.971 0.5971 59.69
2 52.34
3 52.05
4 0.3026 0.0121
1 59.44
59.66 18.182 0.8182 67.59
2 59.68
3 59.86
kloroform
1 32.52
32.81
2 33.32
3 32.60
Contoh perhitungan
- Penentuan konsentrasi polistirena terfluorinasi ke-1
Bobot PSf yang ditimbang = 0.1003 g
Volume pelarut (kloroform) yang digunakan = 25 mL
Konsentrasi (%b/v) polistirena terfluorinasi ( ) ( )=
.
Lanjutan lampiran 2
- Penentuan nilai ηrelatif PSf ke-1
Waktu alir rerata PSf-1 = 43.61 s
Waktu alir kloroform = 32.81 s
ηrelatif
= .
. = 1.329 - Penentuan nilai ηspesifik PSf ke-1
ηrelatif = 1.329
ηspesifik
ηspesifik = ηrelatif - 1
ηspesifik = 1.329 – 1 = 0.329
- Penentuan nilai ηreduktif PSf ke-1
ηspesifik = 0.329
Konsentrasi polistirena = 0.00401 g/mL
ηreduktif
η
× 100%= . . /= 82.01 mL/g
- Penentuan persamaan garis dan nilai viskositas intrinsik
Persamaan garis ditentukan dengan cara memplotkan nilai ηreduktif sebagai ‘y’ dan
konsentrasi polistirena terfluorinasi sebagai ‘x’, sehingga diperoleh persamaan garis, yaitu
y = 87.77 – 1706x
Berdasarkan persamaan garis di atas dapat ditentukan nilai viskositas intrinsik dari polistirena
terfluorinasi([η]). Persamaan garis di atas setara dengan persamaan berikut
ηspesifik =[η] + kintrinsikC
Sehingga, dapat diperoleh nilai [η] sebesar 87.77
- Penentuan bobot molekul PSf
Diketahui : a = 0.76
k = 0.00716
Ditanya : bobot molekul (BM)
Jawab : [η] = k (BM)a
log [η] = log k + a log BM
log 87.77 = log 0.00716 + 0.76 log BM
log BM = 5.37955
Lanjutan lampiran 2
Hubungan konsentrasi dan ηreduktif polistirena terfluorinasi.
- Penentuan konsentrasi polistirena sampel ke-1
Bobot polistirena yang ditimbang = 0.1502 g
Volume pelarut (kloroform) yang digunakan = 25 mL
Konsentrasi (%b/v) polistirena
( ) ( )
= . = 0.0060 g/mL
- Penentuan nilai ηrelatif PS ke-1
Waktu alir rerata PS-1 = 43.43 s
Waktu alir kloroform = 32.81 s
ηrelatif = = .
. = 1.3234
- Penentuan nilai ηspesifik PS ke-1 ηrelatif = 1.3234
ηspesifik
ηspesifik = ηrelatif - 1
ηspesifik = 1.3234 – 1 = 0.3234
- Penentuan nilai ηreduktif PSfke-1
ηspesifik = 0.3234
Konsentrasi polistirena terflorinasi = 0.0060 g/mL
ηreduktif
× 100%= . . /= 53.85 mL/g
y = -1706,x + 87.77 R² = 0.953
0 10 20 30 40 50 60 70 80 90
0 0.002 0.004 0.006 0.008 0.01 0.012 0.014
ηred
u
k
ti
f
Lanjutan lampiran 2
- Penentuan persamaan garis dan nilai viskositas intrinsik
Persamaan garis ditentukan dengan cara memplotkan nilai ηreduktif sebagai ‘y’ dan
konsentrasi polistirena sebagai ‘x’ sehingga diperoleh persamaan garis, yaitu
y = 38.10 +2301x
Berdasarkan persamaan garis di atas dapat ditentukan nilai viskositas intrinsik dari polistirena
([η]). Persamaan garis di atas setara dengan persamaan berikut ηreduktif =[η] + kintrinsikC
Sehingga, dapat diperoleh nilai [η] sebesar 38.10
- Penentuan bobot molekul polistirena
Diketahui : a = 0.76
k = 0.00716
Ditanya : bobot molekul (BM)
Jawab : [η] = k (BM)a
log [η] = log k + a log BM
log 38.049 = log 0.00716 + 0.76 log BM
log BM = 4.901882
BM = 79777.77 g/mol
Hubungan konsentrasi danηreduktif polistirena. y = 2301,x + 38.10
R² = 0.893
0 10 20 30 40 50 60 70 80
0 0.002 0.004 0.006 0.008 0.01 0.012 0.014
ηred
u
k
ti
f
Lampiran 3 Penentuan water uptake
Penentuan water uptake
Membran ulangan Bobot membran (g) Water uptake
Rerata water uptake
kering Basah (%) (%)
PS 1 0.0033 0.0034 3.03
2.87
2 0.0140 0.0143 2.14
3 0.0029 0.0030 3.45
PSf5% 1 0.0029 0.0030 3.45
11.07
2 0.0014 0.0017 21.43
3 0.0012 0.0013 8.33
PSf10% 1 0.0033 0.0037 12.12
6.70
2 0.0056 0.0059 5.36
3 0.0038 0.0039 2.63
PSf15% 1 0.0062 0.0064 3.23
2.64
2 0.0064 0.0067 4.69
3 0.0028 0.0028 0.00
Contoh Perhitungan
- Penentuan water uptake membran polistirena ulangan-1
( ) ( )
( ) × 100%
. .
Lampiran 4 Penentuan konduktivitas proton dari membran
Konduktivitas membran sebelum aktivasi
Membran G L/A σ
(µ S) (cm-1) (μS/cm)
PS 627.13 0.0008 0.52
PSf5% 553.83 0.0008 0.44
PSf10% 446.30 0.0008 0.36
PSf15% 376.16 0.0008 0.30
Konduktivitas membran setelah aktivasi
Membran G L/A σ
(µS) (cm-1) (μS/cm)
PS 654.49 0.0008 0.54
PSf5% 865.88 0.0008 0.69 PSf10% 814.66 0.0008 0.67 PSf15% 793.60 0.0008 0.63
Contoh perhitungan
- Penentuan konduktivitas proton membran PS setelah aktivasi
Luas permukaan (A) = 6 cm2
Jarak antar dua elektroda (L) = 0.0050 cm
Konduktivitas membran (G) = 654.49 × 10-6 S
=
σ = 654.49 × 10-6 S × . = 0.5238 × 10-6 S/cm = 0.52 µS/cm
- Penentuan rasio L/A
Ketebalan PS (L) = 0.0050 cm
Luas permukaan membran (A) = 6 cm2
Konstanta L/A = . = 8×10-4cm-1
- Penentuan konduktivitas proton membran PSf 5% setelah aktivasi (L/A dianggap konstan)
Rasio L/A = 8×10-4cm-1
Konduktans (G) = 865.88 µS
Lampiran 5 Penentuan beda potensial dan total mikrob sistem microbial fuel cell(MFC)
Data beda potensial sistem MFC
Membran V
(mV)
PS 5
PSf5% 8
PSf10% 12 PSf15% 18
Penentuan jumlah mikrob dalam air perasan rumen sapi
No Konsentrasi
total
(cfu/mL) 10-1 10-2 10-3 10-4 10-5 10-6 10-7 10-8
1 - - - 208 109
- - - 288
2 - - - 288 1.2×109
- - - 296
3 - - - 256 1.1×109
- - - 296
Keterangan :
1 = total mikrob rumen dengan menggunakan membranPSf
2 = total mikrob rumen sebelum digunakan (tanpa perlakuan terhadap sistem) 3 = total mikrob rumen dengan menggunakan membran PS
− = mikroba TBUD (tak dapat untuk dihitung)
Contoh perhitungan
- Penentuan total mikrob rumen (cfu/mL) pada cawan nomor 1
Jumlah = 208 mikrob
288 mikrob
Total mikrob (cfu/mL)
(2.08 × 1010) + (2.88 × 1010) = 4.96 × 1010
. ×
= 2.48 × 1010
. ×