i
RECOVERY
GLUKOSAMIN HIDROKLORIDA DARI
CANGKANG UDANG MELALUI HIDROLISIS KIMIAWI
SEBAGAI BAHAN SEDIAAN SUPLEMEN OSTEOARTRITIS
NORITA AFRIDIANA C34062189
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
ii
RINGKASAN
NORITA AFRIDIANA. Recovery Glukosamin Hidroklorida dari Kulit Udang
melalui Hidrolisis Kimiawi sebagai Bahan Sediaan Suplemen Osteoartritis. Dibimbing oleh BAMBANG RIYANTO dan WINI TRILAKSANI.
Glukosamin hidroklorida (GlcN HCl) merupakan monomer dari kitin dan telah banyak dimanfaatkan dalam bidang kesehatan terutama sebagai suplemen penyakit osteoarthritis. Senyawa ini dapat dihidrolisis dari limbah kulit udang karena kandungan kitinnya cukup tinggi. Beberapa penelitian hidrolisis glukosamin hidroklorida yang telah dilakukan memiliki tingkat permasalahan yang berbeda, diantaranya adalah rendemen yang dihasilkan sangat rendah, proses hidrolisis sulit dan memiliki risiko kegagalan yang relatif tinggi, serta biaya produksi yang cukup tinggi. Tuntutan kebutuhan akan kondisi optimal proses masih sangat diperlukan. Selain itu, produksi glukosamin di Indonesia masih belum ada dan banyak diimpor dari negara lain dengan harga yang tinggi. Penelitian ini bertujuan mengekstraksi glukosamin hidroklorida dari kulit udang melalui hidrolisis kimiawi dan menganalisis tingkat konsentrasinyauntuk sediaan suplemen penyakit osteoarthritis.
Penelitian ini meliputi pretreatment kulit udang, analisis proksimat kulit udang, preparasi kitin, analisis proksimat dan analisis nilai derajat deasetilasi kitin yang dihasilkan, selanjutnya dilakukan hidrolisis kimiawi dan terakhir pengujian analisis karakteristik glukosamin hidroklorida yang dihasilkan. Proses diawali dengan perendaman kitin dalam larutan asam hidroklorida, dengan perlakuan peubah yang diragamkan berupa konsentrasi HCl, yaitu 20%, 25%, 32%, dan 37%, dengan perlakuan yang diseragamkan berupa rasio larutan HCl 9:1 selama 4 jam pada suhu 90o±5oC. Glukosamin hidroklorida yang dihasilkan kemudian dianalisis karakteristiknya yang meliputi uji titik leleh, analisis Fourier Transform Infra Red
(FTIR), tingkat konsentrasi dengan High Performance Liquid Chromatography
(HPLC) dan pengujian toksisitas menggunakan metode Brine Shrimp Lethal Toxicity
(BSLT) (LC50).
iii
RECOVERY
GLUKOSAMIN HIDROKLORIDA DARI
KULIT UDANG MELALUI HIDROLISIS KIMIAWI SEBAGAI
BAHAN SEDIAAN SUPLEMEN OSTEOARTRITIS
NORITA AFRIDIANA C34062189
Sebagai salah satu syarat memperoleh gelar Sarjana Perikanan
pada Fakultas perikanan dan Ilmu kelautan Institut pertanian Bogor
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR
BOGOR
iv
Judul Skripsi : Recovery Glukosamin Hidroklorida dari Cangkang Udang melalui Modifikasi Hidrolisis Kimiawi sebagai Bahan Sediaan Suplemen Osteoartritis
Nama : Norita Afridiana
NRP : C34062189
Menyetujui,
Pembimbing I
Bambang Riyanto, S.Pi, M.Si NIP. 19690631 199802 1 001
Pembimbing II
Ir. Wini Trilaksani, M.Sc NIP. 19610128 198601 2 001
Mengetahui,
Ketua Departemen Teknologi Hasil Perairan
Dr. Ir. Ruddy Suwandi, MS, M.Phil NIP. 19580511 1985 03 1 002
v
RIWAYAT HIDUP
Penulis dilahirkan di Kangean, Jawa Timur pada tanggal 21 September 1988. Penulis merupakan anak tunggal dari pasangan orang tua bernama H. Dg. Musaid dan Hj. Nur Cholisah.
Penulis memulai jenjang pendidikan formal di Sekolah Dasar Negeri 1 Luwuk – Sulawesi Tengah (tahun 1995-1996), kemudian penulis pindah sekolah di Sekolah Dasar Lumpur – Gresik – Jawa Timur (tahun 1996 – 1999), dan pada tahun 1999
– 2001 menamatkan Sekolah Dasar-nya di SDN 1 Kebomas Gresik. Selanjutnya penulis melanjutkan pendidikannya di SLTP N 2 Gresik (tahun 2001 - 2003). Pendidikan menengah atas ditempuh penulis di SMA Muhammadiyah 1 Gresik
(tahun 2003-2006). Pada tahun 2006, penulis diterima di Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) dan pada tahun 2007 penulis diterima di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
vi
KATA PENGANTAR
Ucapan syukur penulis panjatkan kehadirat Tuhan Yang Maha Esa, atas karunia-Nya yang berlimpah sehingga penulis dapat menyelesaikan tugas akhir skripsi yang berjudul ―Recovery Glukosamin Hidroklorida dari Limbah Kulit Udang melalui Hidrolisis Kimiawi sebagai Bahan Sediaan Suplemen Osteoartritis‖.
Penulis mengucapkan terima kasih kepada semua pihak yang telah membantu dalam penulisan skripsi ini, terutama kepada:
1. Bapak Bambang Riyanto S.Pi., M.Si. dan Ibu Ir. Wini Trilaksani, M.Sc selaku dosen pembimbing atas motivasi, nasehat, saran, bimbingan, dan memberikan arahan dalam penulisan dan penyempurnaan skripsi.
2. Ibu Dra. Pipih Suptijah, MBA selaku dosen penguji atas masukan dan saran yang
diberikan dalam penulisan tulisan ini.
3. Bapak Dr. Ir. Agoes M. Jacob, Dipl, Biol. selaku komisi pendidikan.
4. Kedua orang tua tercinta serta keluarga besar penulis, untuk dukungan yang diberikan baik dukungan moral maupun materil yang telah diberikan pada penulis tanpa batas.
5. Bapak Drs. Harsojo APU selaku Kepala Laboratorium Balai Tenaga Atom dan Nuklir Nasional (BATAN) atas semua saran dan kritik yang sangat membangun serta bantuannya selama masa penelitian.
6. Ibu Ariyanti selaku kepala Laboratorium Instrumen serta seluruh staff Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan. (BBRP2HP).
7. Ibu dr.Saptawati Bardosono, dr. Jaka, Ibu Lusi di RSCM, dan dr. Harya atas saran, dukungan, dan informasi yang diberikan dalam penyempurnaan skripsi dari aspek medis.
vii
9. Teman-teman seperjuangan di THP yang bersedia membantu dan selalu memberikan semangatnya, Hilda, Ratna, Anggi, Achi, Era, Rida, Arin, Icha, Tika, Pipit, Minal, Patma, Memey, Wahyu, Yayan, Joha, Ijal, dan Oji
10. Saudara sekaligus sahabat yang selalu memberikan semangat dan doanya di setiap saat, teruntuk Cik ifa, Cik oo, Nurul, dan Cik Ila.
11. Teman seperjuangan selama menimba ilmu di IPB sejak dari tingkat pertama di
asrama sampai tingkat akhir di THP ‘Hilda Dasa Indah‘, terima kasih atas semua
kenangan indah dan momen berharga tak tergantikan yang pernah terukir bersama.
12. Beberapa pihak lain yang telah bersedia memberikan bantuan yang sangat bermanfaat serta semangatnya, Wulan, Isnita, Yoan, Siska, Henry, Syukron, Ayu, Ali, dan Ari.
13. Sahabat-sahabat tercinta ‖Wisma Intan‖ yang selalu setia menemani di saat suka dan duka serta memberikan semangat dan doanya, Hilda, Tika, Anggun, Herna, Ruri, Agnez, Pipit, Mbak Nia, dan Mbak Febri.
14. Teman-teman THP 43, 44, dan 45 atas semangat dan dukungannya selama menempuh studi di bangku THP.
15. Seluruh pihak yang membantu dan tidak dapat disebutkan satu persatu, terima kasih atas segala keikhlasannya.
Penulis menyadari bahwa dalam penulisan skripsi ini masih belum sempurna. Oleh sebab itu kritik dan saran yang bersifat membangun dari semua pihak sangat diharapkan.
Bogor, 9 Agustus 2011
viii
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... x
DAFTAR TABEL ... xi
DAFTAR LAMPIRAN ... xii
1. PENDAHULUAN ... 1
1.1 Latar Belakang. ... 1
1.2 Tujuan ... 4
2. TINJAUAN PUSTAKA . ... 5
2.1 Osteoartritis ... 5
2.2 Glukosamin Hidroklorida (GlcN HCl) ... 6
2.3 Limbah Kulit Udang ... 8
2.4 Kitin ... 9
3. METODOLOGI ... 13
3.1 Waktu dan Tempat... 13
3.2 Alat dan Bahan ... 13
3.3 Prosedur Penelitian ... 13
3.4 Prosedur Pengujian ... 15
3.4.1 Analisis proksimat ... 15
3.4.2 Derajat deasetilasi kitin dengan FTIR (Fourier Transform-Infra Red) (Kasaai 2008 dan Khan et al. 2002) ... 17
3.4.3 Analisis tingkat konsentrasi glukosamin hidroklorida (GlcN HCl) dengan HPLC (High Performance Liquid Chromatography) (Crespo et al. 2006) Termodifikasi ... 18
3.4.4 Analisis FTIR glukosamin hidroklorida (GlcN HCl) (Stuart 2004) ... 19
3.4.5 Uji titik leleh (AOAC 1995) ... 19
ix
4. HASIL DAN PEMBAHASAN ... 21
4.1 Karakteristik Fisik dan Kimia Kulit Udang Putih (Penaeus merguensis) ... 21
4.2 Karakteristik Kimia Kitin Hasil Ekstraksi dari Kulit Udang Putih (Penaeus merguensis) ... 22
4.2.1 Kadar abu kitin23 4.2.2 Kadar nitrogen kitin ... 24
4.2.3 Nilai Derajat deasetilasi (DD) kitin ... 24
4.3 Sintesis Glukosamin Hidroklorida (GlcN HCl) ... 25
4.4 Bentuk Fisik Glukosamin Hidroklorida (GlcN HCl) ... 25
4.5 Titik Leleh Glukosamin Hidroklorida (GlcN HCl) ... 26
4.6 Tingkat Konsentrasi Glukosamin Hidroklorida (GlcN HCl) ... 27
4.7 Spektrum Glukosamin Hidroklorida (GlcN HCl) ... 28
4.8 Tingkat Toksisitas Glukosamin Hidroklorida (GlcN HCl) ... 29
5. SIMPULAN DAN SARAN ... 31
5.1 Simpulan ... 31
5.2 Saran ... 31
DAFTAR PUSTAKA ... 32
x
DAFTAR GAMBAR
Nomor Teks Halaman
1 Struktur kimia glukosamin hidroklorida dan glukosamin sulfat (Mojarrad et al. 2007) ... 6 2 Struktur kimia kitin (Mojarrad et al. 2007) ... 10 3 Diagram alir ekstraksi kitin dari kulit udang putih (Penaeus
merguensis) mengacu pada Aye & Steven (2004) dan No et al. (1989) ... 15
4 Diagram alir hidrolisis glukosamin hidroklorida (GlcN HCl) melalui modifikasi hidrolisis kimiawi yang mengacu pada Mojarrad et al.
(2007) dan Crespo et al. (2006) ... 16 5 Kulit udang yang telah dipretreatment ... 22 6 Padatan glukosamin hidroklorida hasil hidrolisis pada berbagai
vi
DAFTAR TABEL
Nomor
Teks Hala
man
1. Komposisi kimia limbah kulit udang pada berbagai hasil penelitian ... 8 2 Kandungan kitin pada berbagai jenis krustasea ... 9 3 Komposisi proksimat kulit udang setelah pretreatment dibandingkan
dengan hasil penelitian lain ... 21 4 Komposisi kimia kitin hasil ekstraksi sebagai perbandingan antara
kitin komersial, hasil penelitian lainnya dan bahan baku kulit udang
yang digunakan ... 22 5 Perbandingan titik leleh glukosamin hidroklorida hasil penelitian
dengan Mojarrad et al. (2007) ... 26 6 Tingkat konsentrasi glukosamin hidroklorida dan perbandingannya
dengan hasil penelitian lainnya. ... 27 7 Perbandingan serapan FTIR glukosamin hidroklorida pada berbagai
vi
DAFTAR LAMPIRAN
Nomor Halaman
1 Kitin hasil ekstraksi dan komersial ... 38 2 Spektrum kitin hasil ekstraksi dan komersial hasil pengujian FTIR ... 38 3 Kromatogram GlcN HCl hasil hidrolisis dan standar menggunakan
HPLC Refraksi Indeks ... 39 4 Spektrum hasil pengujian FTIR GlcN HCl hasil hidrolisis dan standar... 41 5 Nilai LC50 hasil pengujian BSLT pada GlcN HCl hasil hidrolisis
1.1 Latar Belakang Masalah
Osteoarthritis (OA) merupakan penyakit sendi yang telah dimasukkan dalam empat kondisi penyakit otot dan tulang yang dapat membebani hidup seseorang (WHO 2007). Deteksi radiologis menunjukkan bahwa lebih dari 70% penduduk dunia yang berusia di atas 70 tahun menderita osteoarthritis (EFSA 2009). Laporan National Health Interview Survey (NHIS) dan National Health
and Nutrition Examination Study (NHANES), memperkirakan bahwa sebanyak
12% masyarakat Amerika yang berusia 25-74 tahun memiliki gejala penyakit OA (Felson 2006). Wang et al. (2007) menambahkan bahwa penyakit OA akan semakin meningkat seiring dengan bertambahnya usia dan tingkat obesitas. Boh
and Elliot (2002) menyampaikan bahwa penambahan satu kilogram berat badan pada wanita akan meningkatkan risiko terkena OA sebesar 9-13%. WHO yang diacu American College of Rheumatology (2010) memperkirakan penyakit ini akan menjadi penyebab utama distabilitas masyarakat dunia setelah artritis reumatoid, osteoporosis, dan nyeri punggung bawah, saat Melinium Goal tahun 2020 nanti. Ditambahkan pula bahwa tantangan ini akan semakin besar, terlebih dengan semakin bertambahnya populasi lanjut usia seiring dengan kemajuan ekonomi dan teknologi dunia. Perkumpulan Keluarga Berencana Indonesia (PKBI) pada tahun 2000 telah melaporkan bahwa berdasarkan jumlah lanjut usia yang ada, Indonesia telah menduduki urutan keempat terbanyak sesudah Cina, India, dan Amerika Serikat.
Definisi komprehensif osteoarthritis menurut National Institutes of Health
Conference (2007) sebagai hasil proses mekanis dan biologis yang tidak stabil
terhadap rangkaian proses pembentukan dan penghancuran dari tulang rawan sendi dan tulang subkondral. Berdasarkan NHS (2008), sekalipun dapat dicetuskan oleh banyak faktor, seperti genetik, perkembangan metabolik, trauma dan sebagainya, osteoarthritis dapat meliputi seluruh struktur dari sebuah sendi seperti tulang rawan, tulang dan jaringan sekitar.
Terapi medis pada pasien osteoarthritis difokuskan kepada terapi nyeri sendi,
penggunaan kedua bahan tersebut dinyatakan memiliki efektivitas yang kurang optimal (Felson 2006) dan masih terdapat hal-hal yang dipertanyakan tentang keamanannya (Martha 2006), terutama tentang adanya indikasi peningkatan risiko kardiovaskular (Mukherjee et al. 2001)dan hipertensi (Solomon et al. 2004). Diet suplemen glukosamin dan kondroitin sulfat telah dianjurkan sebagai pilihan yang aman dan efektif untuk pencegahan maupun pengobatan gejala osteoarthritis (Richy et al. 2003; Institute of Medicine Report 2004; EFSA 2009).
Glukosamin merupakan senyawa yang secara alami terdapat pada tubuh, terutama pada jaringan penghubung dan jaringan tulang rawan (Anderson et al.
2004). Kemampuan untuk mensintesis glukosamin pada tubuh akan mengalami penurunan seiring dengan bertambahnya umur. Perubahan ini dipengaruhi oleh penurunan kemampuan proteoglikan dalam memproduksi glukosamin, sehingga
akan menyebabkan terjadinya penyakit osteoarthritis (Santhosh & Mathew 2008). Food and Drug Administration (2004) menggolongkan glukosamin sebagai suplemen yang dapat membantu menurunkan risiko penyakit persendian. Glukosamin terbukti dapat menstimulasi produksi tulang rawan dan menghambat enzim yang menghancurkan tulang rawan. Selain itu, glukosamin juga dapat membantu menghambat terjadinya perubahan metabolisme tulang pada penderita osteoarthritis (Towheed et al. 2005; Clegg et al. 2006). Sepuluh studi menunjukkan bahwa glukosamin sulfat maupun glukosamin hidroklorida mampu mengurangi nyeri sendi pada pasien yang memiliki penyakit osteoarthritis berikut mekanismenya, seperti membantu menghilangkan rasa nyeri pada sendi (Pavelka
et al. 2002; Usha and Naidu 2004; Reginster et al., 2001; Braham et al. 2003), membantu perbaikan sendi, membantu untuk melindungi kerusakan tulang rawan (Cibere et al. 2004; Clegg et al. 2006; Houpt et al. 1999; Leffler et al. 1999;
Qiu et al. 1998, 2005). Hasil penelitian Wang et al. (2007) semakin menegaskan
bahwa terdapat peningkatan yang signifikan terhadap struktur subkondral sendi setelah mendapat pemberian Glukosamin secara oral selama 8 minggu.
White dan Stegemann (2001) menguraikan beberapa alasan mengenai meningkatnya konsumsi glukosamin termasuk biaya, avaibilitas, dan persepsi masyarakat mengenai pemakaian produk alami yang aman. Challener (2003)
tahunnya dan terjadi peningkatan penjualan mencapai 900 juta dolar pada tahun 2004. Sedangkan di Jepang, glukosamin telah dikembangkan menjadi suplemen makanan dan pangan fungsional dengan target produksi mencapai 1500 ton setiap tahunnya (Kralovec et al. 2008). Berdasarkan hal tersebut, Mojarrad (2007) mengemukakan bahwa terjadinya peningkatan permintaan dunia akan glukosamin tersebut, telah menuntut akan adanya tingkat optimasi metode dalam preparasi glukosamin dengan produktivitas dan kualitas yang tinggi.
Produk suplemen glukosamin untuk penderita penyakit arthritis biasanya diformulasikan dalam bentuk garam hidroklorida atau glukosamin sulfat dan sering dikombinasikan dengan kondroitin sulfat (Abdel dan Hammad 2001). Chen dan Chiou (2004) menyampaikan bahwa modifikasi hidrolisis kimia untuk memproduksi glukosamin dengan cepat, produktivitas tinggi serta memiliki
tingkat konsentrasi yang dapat diandalkan menjadi fokus utama dalam beberapa tahun terakhir ini.
Glukosamin (2-amino-2-deoxyglucose, chitosamin) adalah gula amino yang diperoleh dari proses hidrolisis kitin (Shantosh et al. 2007). Teknik ekstraksi kitin yang paling banyak digunakan di bidang industri adalah proses kimiawi, yang meliputi penghilangan komponen organik (demineralisasi), deproteinisasi, dan dekolorisasi (Erika et al. 2006). No et al. (1989) menyampaikan bahwa deproteinisasi optimum telah berhasil dilakukan pada kondisi ekstraksi menggunakan larutan NaOH 3,5% (b/b) selama 2 jam pada 65ºC, dengan pengadukan tetap dan nisbah larutan 1:10 (b/v). Adapun kondisi optimum demineralisasi dapat diperoleh dengan ekstraksi menggunakan HCl 1 N selama 30 menit pada suhu kamar dengan nisbah larutan sebesar 1:5 (b/v).
Rotta Research Laboratorium (1987) melaporkan bahwa glukosamin sulfat telah berhasil dipreparasi dengan perendaman kitin dalam larutan asam sulfat, namun reaksi ini menghasilkan rendemen dalam jumlah yang kecil. Menghindari permasalahan ini, Mojarrad et al. (2007) menyampaikan bahwa dalam preparasi glukosamin sulfat harus diawali dengan pembuatan glukosamin hidroklorida terlebih dahulu kemudian ditambahkan penambahan potasium sulfat atau natrium sulfat dan kristalisasi hasil campuran tersebut. Secara lengkap disampaikan,
formulasi terbaik proses hidrolisis glukosamin hidroklorida, kondisi optimum diperoleh dengan pemberian asam klorida konsentrasi 30 dan 37%, rasio padatan dan larutan 9:1 (v/b), dan waktu reaksi selama 4 jam. Chio dan Chen (1999) berhasil meningkatkan kuantitas glukosamin yang dihasilkan dengan
menggunakan metode ‗one-step hydrolisis’ untuk melepaskan glukosamin dari
kitin, yaitu dengan menambahkan perlakuan berupa vaccum treatment, inkubasi pada suhu 28ºC selama 10 menit, pengisian kembali 3 ml air deionisasi, pembilasan nitrogen, dan perlakuan panas pada suhu 140ºC selama 60 menit.
Beberapa penelitian mengenai hidrolisis glukosamin hidroklorida yang telah dilakukan sebelumnya memiliki tingkat permasalahan yang berbeda, diantaranya adalah rendemen yang dihasilkan masih sangat rendah (Kralovec & Barrow 2008), proses hidrolisis yang sulit dan memiliki risiko kegagalan yang
cukup tinggi, dimana proses yang dilakukan merupakan hidrolisis dari modifikasi mikroorganisme dengan tingkat kemurnian yang dihasilkan ≤ 50% (Berry et al.
2002 Paten US 6,372,457; Deng et al. 2004 Paten WO 2004003175), serta biaya produksi yang cukup tinggi, yaitu untuk skala industri mencapai US$ 200-US$300/kg (Chmielowski et al. 2007). Tuntutan kebutuhan akan metode yang dapat menghasilkan kondisi optimal masih sangat diperlukan, diantaranya adalah bahan baku yang mudah diperoleh, proses hidrolisis yang cukup mudah dengan risiko kegagalan rendah, biaya produksi yang terjangkau serta memilliki tingkat konsentrasi yang cukup tinggi. Selain itu, produksi glukosamin di Indonesia sendiri masih belum ada dan masih banyak diimpor dari negara lain dengan harga yang cukup tinggi (Bardosono 2011). Oleh karena itu, penelitian untuk menghasilkan glukosamin hidroklorida dari kulit udang melalui modifikasi hidrolisis kimiawi sebagai sediaan suplemen penyakit osteoarthritis menjadi sangat penting untuk dilakukan.
1.2 Tujuan
2 TINJAUAN PUSTAKA
2.1 Osteoarthriris
Osteoarthritis pada sendi merupakan penyakit rematik yang bisa mengenai
sendi lutut dan dapat menimbulkan rasa sakit serta ketidakmampuan untuk mencapai fungsinya sebagai penumpu berat badan serta aktifitas lain seperti jongkok, berdiri, dan berjalan. Osteoarthritis dapat mengenai semua usia, biasanya pada orang dengan usia di atas 65 tahun. Secara umum, laki-laki dan wanita dapat sama-sama terkena penyakit ini, meskipun pada umur sebelum 45 tahun. Prevalensi pada laki-laki umumnya lebih sering terjadi, namun setelah umur 45 tahun lebih banyak pada wanita, dengan perbandingan ± 4:1 (NIH 2007). Selain faktor usia dan jenis kelamin, faktor pekerjaan dan kegemaran, ras dan hereditas
bisa berperan dalam manifestasi klinis osteoarthritis (Williams 2004).
Osteoarthritis dimasukkan ke dalam salah satu dari empat kondisi otot dan tulang yang membebani individu, sistem kesehatan maupun sistem perawatan sosial dengan biaya yang cukup besar dan diperkirakan 9,6 % pria dan 18 % wanita di dunia yang berumur diatas usia 60 tahun akan menderita osteoarthritis. Penyakit ini meningkat akibat bertambahnya usia dan obesitas (kegemukan) (WHO 2007). Kerugian yang ditimbulkan oleh OA antara lain berkurangnya kemampuan gerak pasien dan rasa nyeri yang dapat menurunkan produktivitas sehingga secara keseluruhan akan menurunkan kualitas hidup pasien. Oleh karena itu, penatalaksanaan terapi OA memerlukan perhatian khusus terutama dalam penanganan nyeri dengan berbagai jenis analgenetika. Terapi OA mencakup dua macam yaitu, terapi nonfarmakologis dan farmakologis (obat). Terapi nonfarmakologis meliputi pemberian edukasi tentang OA pada pasien, latihan, penggunaan alat bantu, proteksi sendi, dan kebutuhan penurunan berat badan (Aru et al. 2006).
Terapi farmakologis penyakit OA pada umumnya tidak bersifat monoterapi, misalnya pada penanganan nyeri dan inflamasi yang berat. American
Pain Society Guidelines tahun 2002 dan American Pain Society Treatment of
Chronic Pain in OA merekomendasikan penggunaan kombinasi NSAIDs dengan
Banyaknya jumlah dan jenis obat yang dipergunakan pasien meningkatkan risiko munculnya masalah yang berkaitan dengan obat. Pemilihan dan penggunaan obat yang tepat akan menentukan keberhasilan terapi obat (Cipolle et al. 1998).
2.2 Glukosamin Hidroklorida (GlcN-HCl)
Glukosamin pertama kali diidentifikasi oleh Dr. Georg Ledderhose pada tahun 1876, tapi struktur stereokimia tidak sepenuhnya diketahui sampai ditemukan oleh Walter Haworth pada tahun 1939 (Horton, Derek, dan Wander 1980 dalam Wales 2009). Glukosamin merupakan salah satu senyawa gula amino yang ditemukan secara luas pada tulang rawan dan memiliki peranan yang sangat penting untuk kesehatan dan kelenturan sendi (EFSA 2009). Glukosamin ditemukan pada kitin, dimana kitin adalah kopolimer dari N-acetyl-D-glukosamin
dan glukosamin. Secara umum, glukosamin terbagi menjadi tiga bentuk yaitu,
glukosamin hidroklorida, glukosamin sulfat, dan N-asetil glukosamin (Institute of
Medicine 2004). Struktur glukosamin hidroklorida dan glukosamin sulfat dapat
dilihat pada Gambar 1.
Gambar 1 Struktur kimia glukosamin hidroklorida dan glukosamin sulfat
(Mojarrad et al. 2007).
Glukosamin sulfat (2-Amino-2-deoksi-D-glukosa sulfat) merupakan
cairan sinovial sehingga dapat mencegah serta mengobati penyakit OA (Williams 2004).
Berbagai studi klinis telah membuktikan bahwa glukosamin aman untuk dikonsumsi (FDA 2004; EFSA 2009). Sediaan glukosamin oral telah dipergunakan secara luas sebagai pengobatan osteoarthritis (OA), yang berfungsi dengan berbagai mekanisme berdasarkan beberapa hasil penelitian in vitro (Bigge et al. 2006). Glukosamin dapat diperoleh dari suplemen makanan dan umumnya dikombinasikan dengan suplemen lain seperti kondroitin sulfat dan metilsulfonilmetan. Umumnya, glukosamin yang umum dikonsumsi merupakan glukosamin dalam bentuk glukosamin sulfat dan glukosamin hidroklorida. Glukosamin sulfat pada dasarnya dikemukakan dan dipelajari untuk bahan pengobatan penyakit osteoarthritis, seperti kristal glukosamin sulfat, yang secara
kimia mudah ditemukan dalam bentuk substansi murni dan tersedia dalam beberapa negara di dunia (Foot et al. 2005).
Penelitian Hathcock & Andrew (2006) menunjukkan bahwa dosis
glukosamin yang memenuhi batas aman konsumsi oral adalah sebesar 2000 mg/hari. Mekanisme kerja glukosamin yaitu dengan menghambat sintetis
glikosaminoglikan dan mencegah destruksi tulang rawan. Glukosamin dapat merangsang sel-sel tulang rawan untuk pembentukan proteoglikan dan kolagen yang merupakan protein esensial untuk memperbaiki fungsi persendian.
Pengolahan glukosamin hidroklorida dari kitin dilakukan melalui reaksi hidrolisis sederhana. Selama reaksi tersebut, kitin akan melewati proses deasetilasi dan depolimerisasi untuk menjadi glukosamin hidrolorida sebagai hasil dari perendaman didalam larutan asam hidroklorida (Mojarrad et al. 2007). Kamasastri & Prabu (1961) berhasil menghidrolisis glukosamin di bawah kondisi konsentrasi asam hidroklorida yang berbeda. Inouoe (1963) menyatakan bahwa hidrolisis glukosamin dapat diperoleh dari perendaman 594,7 gram kitin dari cangkang udang dalam 2,5 liter asam hidroklorida 20%. Alphan (1929) menggunakan asam hidroklorida 37% pada suhu 100°C dengan perbandingan larutan asam dan kitin sebesar 5:1 (v/b). Ingle et al. (1973) mengaplikasikan tiga bagian proses yaitu pengadukan dalam larutan asam hidroklorida 20% pada
2.3 Limbah Kulit Udang
Badan Pusat Statistik tahun 2008 mencatat bahwa produksi udang Indonesia meningkat sebesar 5% setiap tahunnya. Departemen Kelautan dan Perikanan juga melaporkan bahwa volume ekspor udang pada tahun 2002-2007 meningkat dari 124,763 ton mencapai 157,545 ton, dengan nilai devisa sebesar USD 1,029 juta (DKP 2008). Akan tetapi, terdapat permasalahan utama dalam industri pengolahan udang ini, yaitu menghasilkan limbah dalam jumlah yang sangat besar. Berdasarkan FAO (2011) sebesar 80-90% ekspor udang dunia dilakukan dalam bentuk udang beku tanpa kepala dan kulit (peeled), sehingga dapat diperkirakan bahwa limbah dari pengolahan udang adalah sekitar 35-45% dari bobot udang utuh (Shahidi et al. 1999). No et al. (1989) melaporkan bahwa udang memiliki bagian-bagian seperti kepala yang merupakan bagian terbesar dari
seluruh bobot udang dapat mencapai 36-49%, bagian daging dapat mencapai 24-41%, serta bagian kulit dan ekor dapat mencapai 17-23%.
Hayes et al. (2008) menyatakan bahwa sebagian besar limbah kulit udang masih dimanfaatkan secara tradisional, seperti hidrolisat protein, silase, pasta udang (petis) dimana nilai ekonomisnya masih tergolong rendah, padahal kulit udang mengandung kitin yang cukup tinggi yaitu sekitar 17-40% (Synowiecki & Al-Khateeb 2003; Kurita 2006). Komposisi kimia limbah kulit udang dapat dilihat pada Tabel 1.
Tabel 1 Komposisi kimia limbah kulit udang pada berbagai hasil penelitian
Komposisi
Komposisi kimia limbah kulit udang (%)
No et al. 1989 Aye dan
Steven 2004
Focher et al. 1992
Protein kasar 16,9 54,3 ± 2,4 25 – 40
Lemak 0,6 - -
Abu 63,6 - -
CaCO3 24,8 32,9 ± 0,7 45 – 50
Kitin 23,5 25 ± 1 15 – 20
Sumber: No et al. (1989); Aye dan Steven (2004); Focher et al. (1992)
Recovery process menjadi salah satu teknologi alternatif yang semakin
banyak dikembangkan untuk memanfaatkan limbah terbuang menjadi produk yang bernilai ekonomis (Holanda et.al 2006). Shantosh dan Mathew (2007)
yang dapat disintesis dari kulit udang serta dapat dijadikan sebagai bahan baku pembuatan glukosamin.
2.4 Kitin
Kitin merupakan polisakarida yang paling banyak terdapat di alam setelah selulosa dan keberadaannya di alam terikat dengan protein, mineral, dan berbagai macam mineral (Chang et al. 2001). Kitin umumnya banyak dijumpai pada eksoskeleton krustasea, seperti udang, lobster, dan kepiting. Kitin tidak hanya ditemukan pada hewan, tetapi juga ditemukan pada dinding sel tumbuhan misalnya pada dinding sel jamur dari genus Mucor, Phycomycetes, dan
Saccharomyces (Knorr 1991; No et al. 1999; Knaul et al. 1999). Beberapa jenis krustasea mengandung 15-20% kitin (berat kering). Kandungan kitin pada berbagai organisme krustasea dapat dilihat pada Tabel 2.
Tabel 2 Kandungan kitin pada berbagai jenis krustasea
Jenis Organisme (Limbah Kulit) Kandungan Kitin (% bk)
Kerang 3-6
Kepiting:
Collinectes sapidus Chinoecetes opilio
Sumber: Synowiecki & Al-Khateeb (2003); Kurita (2006)
(Bastaman 1989). Knoor (1984) memyampaikan bahwa kitin berbentuk kristal dengan berat molekul lebih dari 1,2 x 105 dalton
Bentuk fisiknya merupakan padatan amorf yang berwarna putih dengan
kalor spesifik [α]D18+22º pada konsentrasi asam metanosulfat 1,0%. Sebagai
biopolimer kristalin, kitin terdapat dalam tiga bentuk kristal di alam, yaitu α, ,
dan (Muzzarelli 1999). Kitin-α berbentuk kristal ortomorbik dengan setiap unit
selnya mengandung 4 cincin N-asetil-D-glukosamin (GlcNAc) yang ditautkan
dengan β ikatan glikosidik (1-4) dan tertata secara parallel, rapat, dan kompak.
Kitin- berbentuk kristalin monoklin dan setiap unitnya terdiri atas β cincin N-asetil-D-glukosamin (GlcNAc) dan 2 molekul air yang tertata secara paralel.
Sedangkan Kitin- diduga dalam β penataan, yaitu β rantai parallel dan 1 antiparalel (Erika et al. 2006). Struktur bentuk kitin dapat dilihat pada
Gambar 2.
Gambar 2 Struktur kimia kitin (Mojarrad et al. 2007).
Sifat kitin yang dapat terdegradasi secara ilmiah menunjukkan bahwa kitin bersifat ramah lingkungan, dapat didaur ulang menjadi sumber nitrogen dan karbon, dan juga dalam produksinya sangat berguna sebagai pereaksi bahan kimia (Gooday et al. 1992). Kitin tidak dapat larut dalam air dan juga pelarut organik lainnya. Kitin merupakan polimer yang dapat diaplikasikan pada berbagai bidang industri, seperti kromatografi, kertas, tekstil, makanan dan nutrisi, pertanian, farmasi, dan sebagainya (Kurita 2006). Sebuah penelitian membuktikan bahwa senyawa ini tidak mengakibatkan alergi dan tidak beracun, jadi tubuh tidak akan
menolak senyawa ini sebagai material asing yang membahayakan (Rasmussen & Morrissey 2008).
ataupun secara enzimatis menggunakan enzim protease atau mikroorganisme, dan penghilangan pigmen (dekolorisasi) menggunakan etanol atau aseton absolut (Venugopal 2009).
Shadidi dan Synowiecki (1991) mengemukakan bahwa faktor terpenting dalam tahap penghilangan mineral adalah jenis dan jumlah asam yang digunakan. Demineralisasi secara umum dilakukan dengan larutan HCl atau asam lain seperti H2SO4 pada kondisi tertentu (Johnson dan Peniston 1982). Keefektifan HCl dalam melarutkan kalsium 10% lebih tinggi daripada H2SO4 (Knoor 1984). Menurut
No et al. (1989) kondisi optimum demineralisasi dapat diperoleh dengan ekstraksi
menggunakan HCl 1 N selama 30 menit pada suhu kamar dengan nisbah larutan sebesar 1:5 (b/v). Kondisi ini dapat menurunkan kadar abu kitin hingga 99,5%.
Deproteinisasi kitin merupakan reaksi hidrolisis dalam suasana asam atau
basa. Lazimnya, hidrolisis dilakukan dalam suasana basa dengan menggunakan larutan NaOH 2-3% pada suhu 63-65°C selama 1-2 jam (Johnson dan Peniston 1982: Knorr 1984). Menurut No et al. (1989), deproteinisasi optimum dicapai pada kondisi ekstraksi menggunakan larutan NaOH 3,5% (b/b) selama 2 jam pada 65°C dengan pengadukan tetap dan nisbah padatan-pelarut 1:10 (b/v). Kondisi optimum No et al. (1989) dapat menurunkan kadar nitrogen menjadi 6,86% mendekati nilai teoritisnya, yaitu 6,9 dalam kitin murni. Efisiensi deproteinisasi tidak hanya bergantung pada konsentrasi basa dan asam, tetapi juga spesies serta kondisi sumber kitin yang digunakan.
3 METODE
3.1 Waktu dan Tempat
Penelitian ini dilakukan pada bulan September 2010 hingga Mei 2011 bertempat di Laboratorium Biokimia Departemen Biokimia, Laboratorium Kimia Organik Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan, Laboratorium Biokimia Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Laboratorium Biofarmaka, Institut Pertanian Bogor, Laboratorium Terpadu, Universitas Islam Negeri ―Syarif Hidayatullah‖ Jakarta dan Laboratorium Instrumen Balai Besar Riset Pengolahan Produk dan Bioteknologi Kelautan dan Perikanan.
3.2 Alat dan Bahan
Alat yang digunakan dalam penelitian ini adalah hammer mill type YC L132M1, magnetic stirrer, timbangan analitik, kertas saring ukuran 60 mesh,
erlenmeyer ukuran 100 ml, gelas piala ukuran 1 liter, gelas ukur 10 ml dan 100 ml, pipet volumetrik ukuran 10 ml dan 5 ml, oven, hotplate model 4803-02, sentrifuga Beckman J2-21, pemanas listrik untuk titik leleh MelTemp, FT-IR Perkin Elmer spectrumOne, pelat silikat gel Merck 60 GF254, dan HPLC Perkin Elmer Series 200 dengan detektor Refraksi Indeks (RI) Waters 2414.
Bahan yang digunakan adalah kulit udang dari jenis udang putih (Penaeus
merguensis) yang diperoleh dari hasil proses penanganan udang beku di PT Red
Ribbon Indonesia – Muara Baru – Jakarta, akuades, HCl 1N (teknis), NaOH 3,5% (teknis), HCl 37% (p.a), etanol 100% (glacial) (p.a), larutan asam asetat 100%
(glacial) (p.a), dan standar glukosamin hidroklorida yang diperoleh dari PT Otto
Pharmaceutical.
3.3 Prosedur Penelitian
Penelitian meliputiperlakuan pendahuluan kulit udang, analisis proksimat kulit udang, preparasi kitin, analisis proksimat dan analisis nilai derajat deasetilasi kitin yang dihasilkan, selanjutnya dilakukan hidrolisis kimiawi dan terakhir pengujian karakteristik glukosamin hidroklorida yang dihasilkan.
cara mencuci kulit udang menggunakan air hangat (±60ºC), kemudian dilakukan pengeringan di bawah sinar matahari selama 3 hari. Setelah itu dilakukan size
reduction menggunakan hammer mill dengan ukuran partikel 40 mesh. Analisis
proksimat kulit udang yang dilakukan meliputi kadar protein, lemak, air, abu (AOAC 2007) dan karbohidrat (by difference). Selanjutnya dilakukan preparasi kitin, yang mengacu pada kondisi optimum penelitian No et al. (1999), yang terdiri dari tiga tahapan yaitu, demineralisasi menggunakan HCl 1N dengan rasio 15:1 (v/w) selama 30 menit pada suhu ±30ºC, deproteinisasi menggunakan NaOH (3,5%) dengan rasio 10:1 (v/w) selama 120 menit pada suhu 65 ºC, dan selanjutnya dikeringkan dengan menggunakan oven suhu 60 ºC selama 4 jam. Karakteristik kitin hasil hidrolisis dilakukan melalui analisis proksimat yang meliputi kadar protein, lemak, air, abu, (AOAC 2007) dan karbohidrat (by
difference) serta nilai derajat deasetilasi dengan menggunakan Fourier Transform
Infra Red (FTIR) Spektrum (Kassai 2008). Diagram alir perlakuan pendahuluan
dan ekstraksi kitin dapat dilihat pada Gambar 3.
Proses hidrolisis glukosamin hidroklorida dilakukan dengan menggunakan hidrolisis kimiawi yang dimodifikasi dari Mojarrad et al. (2007). Teknik ini diawali dengan perendaman kitin sebanyak 2,5 gram dalam larutan asam hidroklorida dengan perlakuan peubah yang diragamkan berupa konsentrasi HCl, yaitu 20%, 25%, 32%, dan 37%, dan dengan rasio peubah yang diseragamkan dari perlakuan terbaik Mojarrad et al. (2007), yaitu 9:1 selama 4 jam pada suhu 90o±5oC. Hidrolisis dilanjutkan dengan proses sentrifugasi bubur glukosamin hidroklorida dengan kecepatan 10.000 rpm selama 15 menit. Endapan yang diperoleh dicuci dengan etanol 100% (glacial) (p.a), kemudian disentrifugasi kembali dengan kecepatan 10.000 rpm selama 15 menit. Selanjutnya endapan yang diperoleh dikeringkan dalam oven pada suhu 40oC selama ±4 jam, kemudian dihitung rendemennya. Glukosamin hidroklorida yang telah dihasilkan kemudian dianalisis karakteristik fisikanya, yang meliputi uji titik leleh (AOAC 1995) dan analisis Fourier Transform Infra Red (FT-IR) Spektrum (Siverstein et al. 2005). Kemudian ditentukan tingkat konsentrasinya dengan analisis High Performance
Liquid Chromatography (HPLC) (Crespo et al. 2006dimodifikasi), dan pengujian
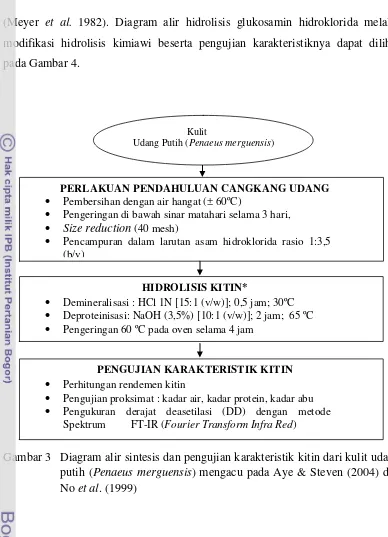
(Meyer et al. 1982). Diagram alir hidrolisis glukosamin hidroklorida melalui modifikasi hidrolisis kimiawi beserta pengujian karakteristiknya dapat dilihat pada Gambar 4.
Gambar 3 Diagram alir sintesis dan pengujian karakteristik kitin dari kulit udang putih (Penaeus merguensis) mengacu pada Aye & Steven (2004) dan No et al. (1999)
PERLAKUAN PENDAHULUAN CANGKANG UDANG
Pembersihan dengan air hangat (± 60ºC)
Pengeringan di bawah sinar matahari selama 3 hari,
Size reduction (40 mesh)
Pencampuran dalam larutan asam hidroklorida rasio 1:3,5 (b/v)
HIDROLISIS KITIN*
Demineralisasi : HCl 1N [15:1 (v/w)]; 0,5 jam; 30ºC Deproteinisasi: NaOH (3,5%) [10:1 (v/w)]; 2 jam; 65 ºC Pengeringan 60 ºC pada oven selama 4 jam
PENGUJIAN KARAKTERISTIK KITIN
Perhitungan rendemen kitin
Pengujian proksimat : kadar air, kadar protein, kadar abu Pengukuran derajat deasetilasi (DD) dengan metode
Spektrum FT-IR (Fourier Transform Infra Red)
Kulit
Gambar 4 Diagram alir hidrolisis glukosamin hidroklorida (GlcN HCl) melalui modifikasi hidrolisis kimiawi yang mengacu pada Mojarrad et al.
(2007) dan Crespo et al. (2006)
3.4 Prosedur Pengujian
3.4.1 Analisis Proksimat
Analisis proksimat merupakan suatu analisis yang dilakukan untuk mengetahui komposisi kimia yang ada pada suatu bahan. Analisis proksimat dilakukan pada sampel kulit udang kering dan kitin yang telah disintesis, yang meliputi: analisis kadar air, abu, dan protein.
1) Analisis kadar air (AOAC 2007)
Tahap pertama yang dilakukan untuk menentukan kadar air adalah mengeringkan cawan porselen dalam oven pada suhu 105 ºC selama 1 jam. Cawan tersebut diletakkan ke dalam desikator (kurang lebih 15 menit) dan dibiarkan sampai dingin kemudian ditimbang. Cawan tersebut ditimbang kembali
Sentrifuse I : 15 menit; 10.000 rpm; T=40C Pencucian dengan etanol glacial (p.a)
Sentrifuse II : 15 menit; 10.000 rpm; T=40C Pengeringan : 60oC; 4 jam
KARAKTERISASI GLUKOSAMIN HIDROKLORIDA Peritungan rendemen glukosamin hidroklorida
Analisis derajat deasetilasi (DD) dengan metode (FT-IR) Spektrum Identifikasi tingkat konsentrasi dengan metode (HPLC)
Pengukuran titik leleh
UJI TOKSISITAS BSLT (LC50)
Penetasan telur Artemia salina Leach
Perlakuan GlcN-HCl dalam 3 konsentrasi (1000 ppm; 100 ppm; 10 ppm) dan kontrol
Perhitungan LC setelah 24 jam Kitin
HIDROLISIS GLUKOSAMIN HIDROKLORIDA*
Perendaman kitin dalam larutan HCl : 20% , 32%, 35% dan 37% Rasio padatan dan larutan : (9:1 v/w)
Waktu : 4 jam
hingga beratnya konstan. Sebanyak 5 gram sampel uji dimasukkan ke dalam cawan, kemudian dikeringkan dalam oven pada suhu 105 ºC selama 5 jam atau sampai beratnya konstan. Setelah selesai, cawan tersebut kemudian dimasukkan ke dalam desikator dan dibiarkan sampai dingin dan selanjutnya dilakukan penimbangan kembali.
Perhitungan kadar air:
2) Analisis kadar protein (AOAC 2007)
Tahap-tahap yang dilakukan dalam analisis protein terdiri dari tiga tahapan, yaitu dekstruksi, destilasi, dan titrasi. Pengukuran kadar protein
dilakukan dengan metode Kjeldahl. Sampel ditimbang sebanyak 0,25 gram kemudian dimasukkan ke dalam labu Kjeldahl 100 ml, lalu ditambahkan 0,25 gram selenium dan 3 ml H2SO4 (p.a) pekat. Sampel didekstruksi pada suhu 410ºC selama kurang lebih 1 jam sampai larutan jernih lalu didinginkan. Setelah dingin, sebanyak 50 ml akuades dan 20 ml NaOH 40% dimasukkan ke dalam labu Kjeldahl, kemudian dilakukan proses destilasi dengan suhu desikator 100ºC. Hasil destilasi ditampung dalam labu erlenmeyer 125 ml yang berisi campuran 10 ml asam borat (H3BO3) 2% dan 2 tetes indikator bromcherosol green-methyl red
yang berwarna merah muda (1:2). Setelah volume destilat mencapai 40 ml dan berwarna hijau kebiruan, maka proses destilasi dihentikan. Kemudian dilakukan titrasi destilat dengan HCl 0,1 N sampai terjadi perubahan warna merah muda dan dicatat volume titrat. Larutan blanko dianalisis seperti sampel.
Perhitungan kadar protein:
*) faktor koreksi alat = 2.5
3) Analisis kadar abu (AOAC 2007)
hingga didapatkan berat yang konstan. Sampel sebanyak 5 gram dimasukkan ke dalam cawan pengabuan dan dipijarkan di atas nyala api hingga tidak berasap lagi. Setelah itu, dimasukkan ke dalam tanur pengabuan dengan suhu 600 ºC selama 1 jam, kemudian ditimbang hingga didapatkan berat yang konstan.
Perhitungan kadar abu:
3.4.2 Derajat deasetilasi kitin dengan FTIR (Fourier Transform-Infra Red)
(Kasaai 2008 dan Khan et al. 2002)
Sampel sebanyak 2 mg dan 200 mg KBr dicampurkan dan dihancurkan dengan mortar. Campuran ini ditempatkan dalam alat pengepresan dan dilakukan pengepresan pada tekanan 800 kg. Kepingan hasil pengepresan diukur absorbansinya pada 1655 dan 3450 cm-1 dengan spektrofotometer Infra Red. Puncak tertinggi dicatat dan diukur dari garis dasar yang dipilih. Nilai absorbans dapat diukur dengan menggunakan rumus:
dengan: A = absorbans
P = transmitans pada puncak minimum Po = transmitans pada garis dasar
Perhitungan derajat deasetilasi (DD) mengacu pada Robert (1997), yaitu dengan membandingkan nilai absorbansi pada bilangan gelombang 1655 cm-1 (serapan pita amida) dengan bilangan gelombang 3450 cm-1 (serapan pita hidroksil). Kitin yang tidak terdeasetilasi menghasilkan nilai perbandingan A1655/A3450 = 1,33. DD dapat dihitung dengan persamaan sebagai berikut:
3.4.3 Analisis tingkat konsentrasi glukosamin hidroklorida (GlcN HCl)
dengan HPLC (High Performance Layer Chromatography)
(Crespo et al. (2006) Termodifikasi)
termodifikasi. Penentuan konsentrasi dengan HPLC dilakukan dengan teknik kromatografi partisi terbalik, yaitu dengan fase diam bersifat nonpolar, sedangkan fase gerak bersifat polar. Proses pemisahan kromatografi fase normal berjalan dengan mengeluarkan komponen-komponen yang nonpolar terlebih dahulu, sementara komponen lainnya yang lebih polar akan tertahan lebih lama dalam kolom. Laju alir fase gerak yang digunakan isokratik, yaitu nisbah volume fase gerak selalu tetap sama selama proses pemisahan. Detektor yang digunakan dalam pengujian HPLC adalah refraksi indeks. Hal ini dikarenakan terdapat beberapa gugus primer dan sekunder pada glukosamin, sehingga perlu dilakukan derivatisasi (Zhu et al. 2005) akan tetapi proses ini memerlukan biaya yang cukup tinggi (Saharty & Bary 2002). Crespo et al. (2006) menyatakan bahwa refraksi indeks merupakan detektor yang dapat mengidentifikasi hampir seluruh
komponen non-ionik yang tidak dapat diserap oleh detektor lainnya seperti UV-Vis dan fluorescence.
Metode ini menggunakan kolom Waters Bondapak NH2 3,9 x 300 mm dengan pompa Waters 1525 Binary Pump. Fase gerak yang digunakan adalah asetonitril (HPLC grade) dan air (HPLC grade) (60:40) dengan sistem eluen isokratik. Laju alir 1 ml/menit dengan volume penyuntikan 50 µl, dan suhu kolom 40oC. Deteksi dilakukan menggunakan detektor Refractive Index (RI) Waters
2414. Konsentrasi glukosamin hidroklorida standar dan hasil hidrolisis yang digunakan sebesar 1000 ppm (1 mg/ml).
3.4.4 Analisis FTIR glukosamin hidroklorida (GlcN HCl) (Stuart 2004)
Analisis FTIR merupakan salah satu teknik spektroskopi inframerah yang dapat mengidentifikasi kandungan gugus kompleks, struktur kimia, pita serapan, serta informasi ikatan polimer pada suatu senyawa dengan spektra infra merah yang terdapat pada range 400-4000 cm-1 (Kauppinen & Partanen 2001). Spektrofotometer inframerah dispersif menggunakan monokromator sebagai pemilah panjang gelombang yang pada FTIR digantikan dengan interferometer. Teknik ini memiliki beberapa keuntungan, yaitu relatif cepat, sampel uji tidak perlu murni, dan tingkat ketelitian tinggi (Stuart 2004).
dengan menggunakan mortar. Campuran ini ditempatkan dalam alat pengepresan dan dilakukan pengepresan pada tekanan 800 kg. kepingan hasil pengepresan diukur absorbansinya menggunakan FTIR. Kisaran scanning yang digunakan antara 450 cm-1 hingga 4000 cm-1.
3.4.5 Uji titik leleh (AOAC 1995)
Padatan glukosamin hidroklorida sintetik dimasukkan dalam tabung kapiler melalui ujung tabung yang terbuka. Agar padatan turun ke dasar tabung, tabung diketuk dengan dasar tertutup di bagian bawah atau dijatuhkan melalui sebuah tabung sempit yang panjang. Cara ini dilakukan berulang kali untuk mendapatkan contoh padat dalam tabung setinggi 1-2 mm. Tabung kapiler dimasukkan ke pemanas listrik untuk penetapan titik leleh. Alat dinyalakan dan suhu dinaikkan perlahan sampai titik leleh tercapai.
3.4.6 Pengujian toksisitas glukosamin hidroklorida (GlcN HCl) dengan
metode brine shrimp lethal toxicity (BSLT) (Meyer et al. (1982).
Brine Shrimp Lethality Test (BSLT) merupakan salah satu metode skrining
yang dapat digunakan sebagai tahapan awal dalam menentukan ketoksikan suatu ekstrak ataupun senyawa Metode BSLT memiliki beberapa keunggulan yaitu, perkembangbiakan hewan uji cepat, harganya murah, metode percobaannya mudah, sampel yang diperlukan sedikit, tidak memerlukan laboratorium yang khusus dan hasilnya dapat dipercaya (Indiastuti et al. 2008).Menurut Meyer et al.
(1982), suatu ekstrak dianggap sangat toksik bila memiliki nilai LC50 di bawah 30 ppm, dianggap toksik bila memiliki nilai LC50 30 -1000 ppm dan dianggap tidak toksik bila nilai LC50 di atas 1000 ppm.
Tahapan awal adalah penetasan telur Artemia salina Leach dalam gelas piala ukuran 1 liter yang telah berisi air laut kemudian diletakkan di bawah lampu
neon 40 watt dan diberi aerasi. Setelah 48 jam telur menetas menjadi naupilus dan siap untuk diujicobakan. Larutan uji dibuat dengan konsentrasi 1000 ppm,
Sebagai kontrol dipakai 4 ml air laut yang berisi 10 -12 ekor larva udang tanpa penambahan larutan uji.
4 HASIL DAN PEMBAHASAN
4.1 Karakteristik Fisik dan Kimia Kulit Udang Putih (Penaeus
merguensis)
Analisis karakteristik fisik dan kimia bahan baku bertujuan untuk mengetahui kandungan spesifik yang terdapat dalam bahan baku kulit udang putih yang akan digunakan, selain untuk mengetahui tingkat keberhasilan dari proses ekstraksi yang akan dilakukan. Komposisi kulit udang yang akan digunakan setelah dilakukan perlakuan pendahuluan dibandingkan dengan kulit udang dari penelitian lainnya dapat dilihat pada Tabel 3.
Tabel 3 Komposisi kimia kulit udang setelah perlakuan pendahuluan dibandingkan dengan hasil penelitian lain
Paramater
Murtihapsari et al. (2008)b
Terdapat dua faktor yang dapat mempengaruhi sintesis kemurnian kitin yaitu kadar protein dan mineral (No et al. 1989). Selain itu Aye & Steven (2004); Erika et al. (2005) menyampaikan bahwa proses sintesis kitin dapat dioptimalkan dengan adanya perlakuan awal pada bahan baku (di perlakuan pendahuluan terlebih dahulu), sehingga mempermudah proses deproteinisasi dan demineralisasi saat ekstraksi kitin. Perlakuan pendahuluan yang dilakukan meliputi pencucian, perendaman dalam air hangat, dan pengecilan ukuran (size reduction). Pencucian
bertujuan untuk membersihkan kulit udang dari pengotor, sedangkan perendaman dalam air hangat dilakukan untuk melepaskan komponen organik yang masih
dimiliki 17,41% dan protein 28,73%. Perbedaan ini diduga dikarenakan dalam
penelitian ini tidak dilakukan perendaman larutan asam selama 6 jam. Aye & Steven (2004) menyatakan bahwa perendaman larutan asam akan
menurunkan protein dan abu lebih banyak dibandingkan tanpa perendaman larutan asam. Selain itu, perbedaan jenis spesies juga akan mempengaruhi kadar proksimat dari bahan baku (Synowiecki et al. 2003). Akan tetapi jika dibandingkan dengan Murtihapsari et al. (2008) yang menggunakan spesies yang sama, hasil yang ditunjukkan masih lebih rendah. Hal ini menunjukkan bahwa proses perlakuan pendahuluan cukup efektif untuk menurunkan kadar abu dan protein, sehingga dapat mempengaruhi kemudahan proses demineralisasi dan deproteinisasi dalam pembuatan kitin.Kulit udang setelah perlakuan pendahuluan dan penghomogenan 60 mesh dapat dilihat pada Gambar 5.
(a) (b)
Gambar 5 (a) kulit udang kering setelah perlakuan pendahuluan (b) kulit udang kering setelah penghomogenan (60 mesh)
4.2 Karakteristik Kimia Kitin Hasil Ekstraksi dari Kulit Udang Putih
(Penaeus merguensis)
Proses ekstraksi kitin dari kulit udang secara kimiawi terdiri dari dua tahapan utama, yaitu demineralisasi dan deproteinisasi (Venugopal 2009).
Tabel 4 Komposisi kimia kitin hasil ekstraksi dengan kitin komersial, hasil penelitian lainnya dan bahan baku kulit udang yang digunakan.
Parameter Kitin
Sumber : a Kitin komersial didapatkan dari PT Dinar, Tangerang b
Erika et al. (2005) c
Suptijah (2004)
4.2.1 Kadar abu kitin
Demineralisasi meruakan suatu proses yang bertujuan untuk menghilangkan atau melarutkan mineral semaksimal mungkin dari substrat, biasanya dilakukan dengan menggunakan larutan asam (Toan et al. 2006). Tahap demineralisasi kitin dalam penelitian ini dilakukan dengan perendaman kulit
udang dalam larutan asam klorida HCl 4N. Mineral-mineral yang terdapat dalam kulit udang adalah kalsium fosfat (Ca3(PO4)2) serta kalsium karbonat CaCO3 yang
merupakan komponen mineral utama pada kulit udang (Cardenas et al. 2004). Selama proses demineralisasi berlangsung, terjadi reaksi pengikatan matriks mineral yang terdapat pada kulit udang oleh HCl (Knoor 1991). Reaksi antara HCl dan CaCO3 akan membentuk CaCl2, CO2, dan H2O (Cardenas et al. 2004). Bentuk reaksi pengikatan tersebut adalah :
CaCO3 + 2HCl CaCl2 + H2CO3
H2CO3 H2O + CO2
CaCO3 + 2HCl CaCl2 + H2O + CO2
Ca3(PO4)2 + 6HCl 3CaCl2 + 2H3PO4
(2004). Secara umum, penurunan kadar abu selama proses demineralisasi memperlihatkan nilai sebesar 96,5%. Perbedaan ini dapat disebabkan beberapa faktor, yaitu perbedaan jenis organisme yang digunakan dan kondisi selama ekstraksi. Untuk menghilangkan HCl sisa dilakukan proses pencucian dengan menggunakan akuades untuk mencegah terjadinya degradasi produk selama proses pengeringan kitin. Adanya sisa HCl dapat memutus rantai atau cincin kitin ketika dipanaskan (Savitri et al. 2010). Menurut Suptijah (2004), HCl pada proses demineralisasi akan bereaksi dengan protein yang mengakibatkan terjadinya degradasi struktur protein, sehingga akan memudahkan terjadinya proses deproteinisasi.
4.2.2 Kadar nitrogen kitin
Deproteinisasi merupakan reaksi hidrolisis dalam suasana basa atau asam
(Johnson & Peniston 1982). Tahap deproteinisasi kitin dalam penelitian ini dilakukan dengan perendaman kulit udang dalam larutan basa NaOH 3.5% selama
2 jam. Menurut Hong et al. (1989) kadar total nitrogen yang tersisa dalam deproteinisasi dapat dijadikan sebagai indikator keberhasilan proses deproteinisasi. Penurunan kadar nitrogen yang semakin tinggi menunjukkan bahwa proses deproteinisasi yang semakin maksimal.
Hasil analisis kadar nitrogen kitin hasil ekstraksi terlihat tidak berbeda nyata dibandingkan dengan kitin komersial, yaitu berturut-turut 5,68 dan 5,08. Perbedaan ini diduga disebabkan oleh beberapa faktor, antara lain konsentrasi NaOH, waktu proses deproteinisasi (Saleh et al. 1994), dan proses pengadukan yang konstan (Benjakula dan Sophanodora 1993). Semakin tinggi konsentrasi NaOH yang digunakan dan semakin lama waktu deproteinisasi yang digunakan maka reaksi antara protein dengan larutan membentuk ester (Na-proteinat) akan semakin sempurna sehingga protein yang dihilangkan akan semakin banyak (Saleh et al. 1994). Kemudian Benjakula dan Sophanodora (1993) mengemukakan bahwa kadar total nitrogen berupa protein yang dapat dihilangkan pada pembuatan kitin sangat dipengaruhi oleh konsentrasi NaOH yang digunakan, waktu ekstraksi dan suhu ekstraksi. Selain itu proses pengadukan yang konstan
4.2.3 Nilai derajat deasetilasi (DD) kitin
Derajat deasetilasi merupakan parameter penting dalam produk kitin. Analisis derajat deasetilasi terhadap produk kitin dilakukan untuk mengetahui presentase gugus asetil yang dapat dihilangkan dari kulit udang sehingga dihasilkan produk kitin. Semakin tinggi nilai DD dalam kitin maka kemurnian produk kitin yang dihasilkan semakin bagus (Subangsihe 1999).
Hasil pengukuran menggunakan FTIR, dapat diketahui bahwa derajat deasetilasi kitin hasil ekstraksi sebesar 49,5%, lebih besar dibandingkan kitin komersial yaitu 43,83%. Hal ini menunjukkan bahwa kitin hasil ekstraksi memiliki tingkat kemurnian yang lebih tinggi dibandingkan kitin komersial. Semakin tinggi derajat deasetilasi kitin menunjukkan semakin banyak gugus asetil yang dilepaskan dan semakin banyak gugus aktif amida bebas (-NH2) sehingga
tingkat kemurniannya semakin tinggi. Tingginya derajat deasetilasi kitin hasil ektraksi diduga dipengaruhi oleh kondisi perlakuan pendahuluan, demineralisasi dan deproteinisasi yang baik. Hal ini sesuai dengan pernyataan Erika et al. (2006) bahwa kondisi perlakuan pendahuluan dan proses ekstraksi yang baik akan meningkatkan derajat deasetilasi kitin yang dihasilkan. Terlepasnya gugus asetil pada kitin dapat disebabkan adanya interaksi antara basa NaOH selama proses deproteinisasi. Molekul NaOH akan teradisi ke molekul kitin dan menyebabkan gugus asetil lepas. Spektrum kitin hasil hidrolisis dan komersial dapat dilihat pada Lampiran 2.
4.3 Sintesis Glukosamin Hidroklorida (GlcN HCl)
Sintesis glukosamin hidroklorida dilakukan dengan menghidrolisis kitin menggunakan dalam larutan HCl pada suhu 90o±5oC selama 4 jam dengan pengadukan konstan. Peubah yang diragamkan adalah faktor konsentrasi HCl sebesar 20%, 25%, 32%, dan 37%. Sedangkan suhu dan lamanya waktu yang digunakan mengacu pada perlakuan terbaik Mojarrad et al. (2007). Proses yang terjadi selama hidrolisis kitin adalah depolimerisasi dan deasetilasi. Proses deasetilasi terjadi karena hilangnya gugus asetil (CH3CO) sehingga molekul dapat larut dalam asam dan menghasilkan gugus amida bebas yaitu NH2 (Rokhati 2006).
glukosamin hidroklorida yang didapatkan kemudian disentrifugasi dengan kecepatan 10.000 rpm pada suhu 4oC selama 15 menit. Hal ini dilakukan untuk memisahkan kristal glukosamin hidroklorida dari filtrat. Padatan glukosamin dicuci menggunakan etanol 100% (p.a) untuk menghilangkan sisa pereaksi berupa Cl- karena dapat sifatnya beracun. Tahap akhir adalah pengeringan dalam oven pada suhu 40o±5o C selama ±4 jam.
4.4 Bentuk Fisik Glukosamin Hidroklorida (GlcN HCl)
Padatan glukosamin hidroklorida yang dihasilkan berbentuk butiran halus berwarna putih kekuningan untuk konsentrasi HCl 37% dan semakin putih seiring dengan menurunnya konsentrasi HCl yang digunakan. Mekanisme perubahan warna tersebut diduga disebabkan oleh terjadi reaksi enolisasi glikosil amino akibat adanya interaksi gula amino dengan asam kuat pada suhu tinggi sehingga
terbentuk komponen furfural yang berwarna coklat (Manuliang 1997). Visualisasi bentuk padatan glukosamin hidroklorida yang diperoleh dapat dilihat pada Gambar 6.
a b c d
Gambar 6 Padatan glukosamin hidroklorida hasil hidrolisis berbagai konsentrasi HCl (a) HCl 20%, (b) HCl 25%, (c) HCl 32%, dan HCl 37%.
4.4 Titik Leleh Glukosamin Hidroklorida (GlcN HCl)
hidroklorida standar (190-192). Hasil pengujian titik leleh selengkapnya dapat dilihat pada Tabel 5.
Tabel 5 Perbandingan titik leleh glukosamin hidroklorida hasil penelitian dengan Mojarrad et al. (2007)
Sampel Uji GlcN HCl Hasil Penelitian Mojarrad et al.
(2007)
Keterangan: a Glukosamin hidroklorida hasil hidrolisis kimiawi b
Glukosamin hidroklorida standar (PT Otto Pharmaceutical)
4.5 Tingkat Konsentrasi Glukosamin Hidroklorida (GlcN HCl)
Tingkat konsentrasi glukosamin hidroklorida (GlcN HCl) dapat diukur dengan metode High Performance Liquid Chromatography (HPLC) atau dikenal dengan kromatografi cair kinerja tinggi (KCKT), yaitu salah satu teknik kromatografi yang menggunakan cairan sebagai fase geraknya (Harvey 2000). Tingkat konsentrasi glukosamin hidroklorida hasil hidrolisis dapat dilihat pada Tabel 6.
Tabel 6 Tingkat konsentrasi glukosamin hidroklorida dan perbandingannya dengan hasil penelitian lainnya.
Sampel GlcN HCl Waktu Retensi
(menit) Konsentrasi (%)
bahwa di dalam padatan hasil hidrolisis terdapat monomer glukosamin hidroklorida. Kromatogram glukosamin hidroklorida hasil hidrolisis dan standar dapat dilihat pada Lampiran 3.
Konsentrasi dihitung dengan membandingkan persentase luas area hasil hidrolisis dan standar. Hasil pengujian dengan HPLC-RI pada Tabel 3 memperlihatkan bahwa konsentrasi glukosamin hidroklorida yang diperoleh mengalami peningkatan seiring dengan semakin tingginya konsentrasi HCl yang digunakan. Hal ini menunjukkan bahwa semakin tinggi konsentrasi HCl yang digunakan akan meningkatkan tingkat konsentrasi glukosamin hidroklorida yang ada. Hal ini sesuai dengan hasil penelitian Mojarrad et al. (2007), yaitu peningkatan konsentrasi HCl akan meningkatkan tingkat konsentrasi glukosamin hidroklorida dari hidrolisis kitin. Teng et al. (2001) juga menyatakan bahwa
tingkat konsentrasi glukosamin yang diperoleh dari hidrolisis kitin akan semakin meningkat seiring dengan meningkatnya suhu, waktu, dan konsentrasi HCl yang digunakan selama proses hidrolisis.
Konsentrasi glukosamin yang dihasilkan lebih tinggi dibandingkan penelitian Teng et al. (2001), hal ini diduga disebabkan oleh suhu, waktu, dan konsentrasi yang digunakan lebih rendah. Akan tetapi, hasil yang diperoleh masih lebih rendah dibandingkan penelitian Mojarrad et al. (2007). Hal ini dapat diduga juga dipengaruhi oleh kondisi dan jenis bahan baku yang digunakan. Pada penelitian ini digunakan kitin dengan nilai DD sebesar 49,50%, dimana gugus asetil (COCH3) yang ada masih terbilang tinggi, sehingga dimungkinkan konsentrasinya masih belum mencapai maksimal.
4.6 Spektrum Glukosamin Hidroklorida (GlcN HCl)
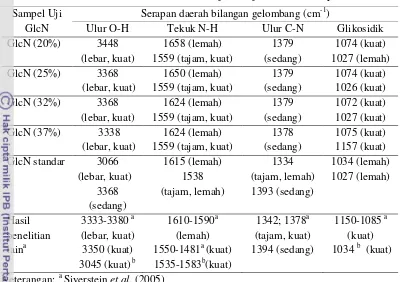
Tabel 7 Perbandingan serapan FTIR glukosamin hidroklorida pada berbagai konsentrasi HCl dan standar terhadap hasil penelitian lainnya
Sampel Uji GlcN
Serapan daerah bilangan gelombang (cm-1)
Ulur O-H Tekuk N-H Ulur C-N Glikosidik
Hasil pengukuran spektrum FTIR menunjukkan bahwa spektrum GlcN-HCl standar memperlihatkan gugus O-H yang dominan dengan garis yang lebar dan kuat pada bilangan gelombang 3066 cm-1, sedangkan pada GlcN-HCl hasil hidrolisis menunjukkan gugus N-H yang dominan yaitu pada 3338 cm-1 dengan konsentrasi HCl 37% (tertinggi) dan 3448 cm-1 untuk konsentrasi 20% (terendah). Spektrum tersebut menunjukkan kemiripan dengan hasil penelitian Mojarrad et al.
pada standar 1334 dan 1394 cm-1. Nilai ini hampir mendekati literatur bahwa
pita serapan C-N ditunjukkan pada 1394 cm-1 (Mojarrad et al. 2007) dan 1384 cm-1 (Silverstein et al. 2005). Pita serapan ikatan glikosidik pada GlcN-HCl
hasil hidrolisis dan standar ditunjukkan pada 1027-1026 cm1. Hal ini menunjukkan bahwa keberadaan ikatan glikosidik pada standar dan hasil hidrolisis sama. Secara keseluruhan pita serapan gugus khas pada GlCN-HCl hasil hidrolisis menunjukkan kemiripan dengan GlcN-HCl standar dan hasil penelitian lainnya. Namun masih terdapat sedikit selisih pada bilangan gelombang yang ditampilkan, hal ini dapat disebabkan karena konsentrasi yang dihasilkan masih terbilang rendah.
4.7 Tingkat Toksisitas Glukosamin Hidroklorida (GlcN HCl)
Uji toksisitas dimaksudkan untuk memaparkan adanya efek toksik dan atau menilai batas keamanan dalam kaitannya dengan penggunaan suatu senyawa (Mc Laughlin 1991). Pengujian BSLT pada glukosamin hidroklorida hasil terbaik adalah pada perlakuan HCl 37% dengan tingkat konsentrasi 45,64 ±1,95%. Berdasarkan hasil pengujian diketahui bahwa nilai LC50 di atas 1000 ppm karena tidak ada hewan uji (Artemia salina Leach) yang mati hingga konsentrasi 1000
ppm selama 24 jam masa inkubasi. Hal ini menunjukkan bahwa glukosamin hidroklorida yang dihasilkan dapat dikatakan tidak toksik.
Berdasarkan hasil tinjauan uji klinis Anderson et al. (2005) dapat
5 SIMPULAN DAN SARAN
5.1 Simpulan
Glukosamin hidroklorida berhasil diekstrak dari kitin melalui metode hidrolisis kimiawi. Glukosamin hidroklorida hasil hidrolisis menunjukkan karakteristik yang hampir sama dengan GlcN standar dan beberapa hasil penelitiannya. Tingkat konsentrasi GlcN HCl cenderung mengalami peningkatan seiring dengan makin meningkatnya konsentrasi HCl yang digunakan, dengan hasil konsentrasi terbaik 45,64 ±1,95% pada konsentrasi HCl 37%. Spektrum FTIR menunjukkan pola pita serapan yang hampir mirip antara GlcN HCl hasil hidrolisis dan standar yang menunjukkan terdapat monomer glukosamin hidroklorida. Adapun pengujian toksisitas dengan metode BSLT menghasilkan
nilai LC50 > 1000 ppm, yang artinya bahwa GlcN HCl yang diperoleh tidak toksik untuk dikonsumsi oleh manusia.
4.2 Saran
DAFTAR PUSTAKA
Abdel FW, Hammad T. 2001. Chondroitin sulfate and glucosamine: A review of their safety profile. Journal American Nutraceutical Association 3: 16-23. ACR [American College of Rheumatology]. 2010. Recommendations for the
Medical Management of Osteoarthrits of the Hip and Knee.
http://www.rheumatology.org/education/index.asp [20 September 2010].
Alphan JV. Preparation of glucosamine hydrochloride. 1929.Chemistry Weekblad 26: 602.
Anderson JW, Nicolosi RJ, Borzelleca JF. 2005. Glucosamine effects in humans: a review of effects on glucose metabolism, side effects, safety considerations and efficacy. Food and Chemical Toxicology 43:187-201. AOAC [Association of Official Analytical and Chemistry]. 2007. Officials
Methods of Analysis. 18th Ed. Marylan: Association of Official Analytical and Chemistry Inc.
AOAC [Association of Official Analytical and Chemistry]. 1995. Officials Methods of Analysis of AOAC Internasional. Arlington, Virginia, USA. Aru WS, Hadi BS, Alwi I, Simadibratak M, Setiati S. 2006. Ilmu Penyakit Dalam.
Jilid 2. Edisi ke-4. Jakarta: Pusat Penerbitan Departemen Ilmu Penyakit Dalam. Fakultas Kedokteran Universitas Indonesia.
Aye KN, Stevens WF. 2004. Technical note improved chitin production by perlakuan pendahuluan of shrimp shells. Journal of Chemistry
Technology Biotechnology 79:421-425.
Bardosono S. 2011. Konsultasi pribadi [3 Mei 2011]. RSCM Jakarta.
Bastaman S. 1989. Studies on degradation and extraction of chitin and chitosan from prawn shella. belfast. Thesis. The Departement of Mechanical Manufacturing Acronautical and Chemical Engineering. The Queens University.
Biggee BA, Blinn CM, McAlindon TE, Nuite M, Silbert JE. 2006. Low levels of human serum glucosamine after ingestion of glucosamine sulphate relative to capability for peripheral effectiveness. Ann Rheum Dis. 65:222-226.Braham R, Dawson B, Goodman C, 2003.The effect of glucosamine supplementation on people experiencing regular knee pain. British Journal
of Sports Medicine 37: 45-49.
Berry A, Burlingame RP, Millis JR. 2002. Process and materials for production of glucosamine. US patent 6,372,457.
Benjakula S, Sophanodora P. 1993. Chitosan production from carapace and shell of black tiger shrimp (Penaeus monodon). Asean Food Journal 8(4): 145-148.