PRIMA LUNA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Optimasi Sintesis Monolaurin Menggunakan Katalis Enzim Lipase Imobil pada Circulated Packed Bed Reaktor adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi dan kutipan dari karya penulis lain, yang diterbitkan maupun yang tidak diterbitkan, telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, April 2011
Circulated Packed Bed Reactor. Supervised by NURI ANDARWULAN and TRI HARYATI
Monolaurin is a special food grade monogliceride, which has a function beside as emulsifier and food preservative, also has an ability to destroy Herpes and HIV-1 virus. It was reported that monolaurin had the greatest antimicrobial activity among monoglycerides. Novozyme® 435 catalyze the esterification of lauric acid and glycerol in organic solvent. The purpose of this research were : 1) to obtain optimum condition to synthesis monolaurin using Novozyme® 435; 2) to analyze the stability of Novozyme®
Continuous circulated packed bed reactor had residence time of 23,57 minute, glycerol/ oil molar ratio of 5:1, solvent/substrate ratio of 8,8:1, and the process produced MAG up to 80%. Optimization of synthesis MAG obtained quadratic equation which was Y= - 61,700 + 6,088 x
435 in continuous system. Continuous Esterification was employed in circulated packed bed reactor. This researchwas using Response Surface Methods (RSM) as experimental design and temperature and time reaction were as variables.
1+3,259 x2 – 0,065 x12 +
0,017 x1x2 – 1,792 x22 with R2 = 0,5408, optimum temperature and time reaction
of 46,92oC and 1,1 hour, respectively. The product yield was 81,09% and contained MAG of 83,15%. The product had acid value of 1,78±0,08 %, peroxide value of 0,49 ± 0,14 meq O2/kg MAG, free glycerol content of 0,26%, and
melting point 53-53,5oC. The enzyme remain stable during 10 reaction cycles and up to 70% produced of MAG at each cycle.
PRIMA LUNA. Optimasi Sintesis Monolaurin Menggunakan Katalis Enzim Lipase Imobil Pada Circulated Packed Bed Reaktor. Dibimbing oleh: NURI ANDARWULAN dan TRI HARYATI
Monoasilgliserol (MAG) adalah salah satu emulsifier yang banyak digunakan sebagai bahan tambahan pangan. MAG secara luas digunakan dalam produk bakeri, margarine, produk susu, dan confectionary karena sifat emulsifikasi, stabilisasi, dan conditioning (Damstrup et al., 2005). Salah satu jenis MAG, yaitu monolaurin, monogliserida dari asam laurat, merupakan salah satu produk turunan dari minyak, yang memiliki keistimewaan. Kegunaan monolaurin adalah sebagai bahan pengawet pangan dan sanitizer. Saat ini monolaurin sudah banyak digunakan dalam industri kosmetik, farmasi dan obat-obatan. Monolaurin dilaporkan memiliki kemampuan menghancurkan virus herpes dan HIV-1 serta menurunkan resiko penularan virus ini pada bayi dari ibu hamil yang terinfeksi HIV, selain itu monolaurin juga efektif menghambat sel vegetative B. Cereus, mengakibatkan kerusakan membran, menyebabkan kebocoran protein intraselular dan asam nukleat sehingga menurunkan aktivitas enzim yang berperan dalam metabolisme pada bakteri gram prositif (Cotton dan Marshall, 1997; Kabara 1993). Tujuan penelitian ini adalah : 1) Mencari kondisi optimum untuk sintesis monolaurin melalui proses esterifikasi enzimatis circulated packed bed reactor; 2) Menguji stabilitas enzim Novozyme®
Metode yang digunakan pada penelitian ini adalah reaksi esterifikasi enzimatis circulated packed bed reactor. Rancangan percobaan optimasi pada penelitian ini menggunakan Central Composite Design dari Response Surface Methods (RSM). Hasil penelitian pendahuluan menghasilkan MAG 77,33 % dengan rendemennya sebesar 82,26% pada proses batch reaksi esterifikasi enzimatis. Kondisi reaksi pada proses reaksi batch tersebut kemudian dikonversi ke esterifikasi menggunakan reaktor packed bed sirkulasi. Kondisi reaksi kontinyu menggunakan rasio asam lemak/gliserol (1:5); volume reaktan 50 ml, rasio substrat/ pelarut (1:8,8), dan residence time 23,57 menit. Hasil optimasi reaksi kontinyu menggunakan respon permukaan tanggap menunjukkan persamaan kuadrat optimasi MAG adalah Y= - 61,700 + 6,088 X
435 dalam reaksi esterifikasi circulated packed bed reactor.
1+3,259 X2 –
0,065 X12 + 0,017 X1X2 – 1,792 X22 . Suhu dan waktu reaksi optimum yaitu
46,92oC dan 1,1 jam. Hasil optimasi diverifikasi sebanyak lima kali menghasilkan MAG 83,19% dan rendemen 81,09. Karakterisasi sifat kimia produk hasil verifikasi memiliki bilangan asam 1,78 ±0,08 %, bilangan peroksida 0,49 ± 0,14 meq O2/kg MAG, kadar gliserol bebas 0,26%, dan memiliki kisaran titik leleh
53-53,5 oC. Berdasarkan jumlah produk MAG yang dihasilkan terlihat bahwa selama 10 kali reaksi terjadi penurunan jumlah produk MAG sekitar 7% dari komposisi MAG awal, sedangkan rendemen produk MAG dan Jumlah MAG selama 10 kali siklus reaksi mengalami penurunan masing-masing sekitar 16% dari rendemen serta jumlah MAG awal.
Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atas seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. Pengutipan tersebut tidak merugikan kepentingan yang wajar IPB 2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya
CIRCULATED PACKED BED REAKTOR
PRIMA LUNA
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
NRP : F251080341
Program Studi : Ilmu Pangan
Disetujui
Komisi Pembimbing
Dr. Ir. Nuri Andarwulan, M.Si
NIP. 19630701 198811 2 001 Anggota
Dr. Ir. Tri Haryati, MS
Ketua
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB
Ilmu Pangan
Dr. Ir. Ratih Dewanti, M.Sc
NIP. 19620920 198603 2 002 NIP. 19650814 199002 1 001 Dr. Ir. Dahrul Syah, MSc. Agr
Alhamdulillah, penulis panjatkan puji dan syukur kehadirat Allah SWT atas
rahmat dan karunia-Nya sehingga penulisan tesis dengan judul ”Optimasi Sintesis Monolaurin Menggunakan Katalis Enzim Lipase Imobil pada Circulated Packed Bed Reaktor” dapat diselesaikan. Tesis ini disusun sebagai salah syarat untuk memperoleh gelar Magister Sains pada Sekolah Pascasarjana, Institut Pertanian
Bogor.
Pada kesempatan ini penulis menyampaikan ucapan terima kasih kepada:
1. Ibu Dr. Ir. Nuri Andarwulan, M.Si dan Ibu Dr. Ir. Tri Haryati, MS selaku
dosen pembimbing yang telah banyak memberikan ilmu, arahan, bimbingan
dan pendanaan sehingga penulis dapat menyelesaikan tesis ini.
2. Prof. Dr. Ir. Purwiyatno Hariyadi, M.Sc selaku dosen penguji atas ilmu, saran
dan masukan bagi sempurnanya karya ilmiah penulis ini.
3. Orang tuaku Papah dan Mamah (Prof. H. Sambas Basuni dan Hj. Nurahmat,
SE. M.Pd) yang selalu menjadi inspirasi bagi penulis, Papa dan Mama
Palembang (H. Sumanto dan Hj. Swati), adik-adik tercinta (de tiara&de utik)
serta keluarga besar atas doa dan semangat yang telah diberikan.
4. Suami dan anak-anak tercinta (Koko Setiawan, Abang Ayyash, dan Dede
Nusaibah) atas doa, pengorbanan, semangat dan kasih sayang yang telah
diberikan sehingga penulis dapat menyelesaikan tesis ini.
5. Sahabat seperjuangan IPN 2008 : Ibu-ibu manis (Teh Elin, Teh Susi, Mba
Titin, Mb Siti, Mb Yeni), Alin, Lia, Ira, Nono, Arief atas segala bantuan dan
motivasinya, serta semua pihak yang tidak dapat penulis sebutkan
satu-persatu.
6. WAMY (World Assembly Moslem Youth) atas bantuan beasiswa sehingga penulis dapat menyelesaikan tesis ini
Ucapan terima kasih yang sebesar-besarnya kepada Indofood Riset Nugraha
2010 atas bantuan dana penelitian yang telah diberikan sehingga penelitian ini
dapat berjalan. Semoga karya ilmiah ini bermanfaat.
Bogor, April 2011
Penulis dilahirkan di Bogor tanggal 08 Juni 1983 dari ayah Prof. Dr. Ir. H. Sambar Basuni, MS dan Ibu Hj. Nurahmat, SE. M.Pd. Penulis merupakan anak pertama dari tiga bersaudara.
Tahun 2001 penulis lulus dari SMUN 1 Bogor dan pada tahun yang sama penulis masuk Institut Pertanian Bogor melalui jalur PMDK. Penulis memilih Departemen Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian (FATETA). Penulis menyelesaikan pendidikan sarjananya pada bulan Juni tahun 2005. Kemudian pada tahun 2008 penulis melanjutkan studi Magister Sains di Program Studi Ilmu Pangan, Sekolah Pascasarjana, Institut Pertanian Bogor.
PENDAHULUAN Latar Belakang
Monoasilgliserol (MAG) adalah salah satu emulsifier yang banyak digunakan sebagai bahan tambahan pangan. MAG secara luas digunakan dalam produk bakeri, margarine, produk susu, dan confectionary karena sifat emulsifikasi, stabilisasi, dan conditioning (Damstrup et al., 2005). Komersial MAG banyak terbuat dari gliserolisis minyak atau lemak. Reaksi gliserolisis dipercepat dengan penggunaan katalis basa inorganik, seperti NaOH atau Ca(OH)2 pada temperatur tinggi (220-260o
Penelitian sintesis monoasilgliserol (MAG) dan diasilgliserol (DAG) secara enzimatis telah banyak dilakukan sebelumnya, antara lain Pujiastuti (1998) dan Nuraeni (2008) telah berhasil memanfaatkan Destilat Asam Lemak Minyak Sawit (DALMS) sebagai bahan baku pembuatan emulsifier mono- dan diasilgliserol (M-DAG), kemudian Kitu (2000) telah berhasil memanfaatkan Destilat Asam Lemak Minyak Kelapa (DALMIK) sebagai bahan baku pembuatan emulsifier mono- dan diasilgliserol (M-DAG) secara enzimatis.
C). Kandungan MAG dalam keseimbangan bervariasi antara 10-60% tergantung pada rasio gliserol dengan minyak dalam campuran reaksi.
Produk monolaurin dapat dibuat dari berbagai macam minyak yang memiliki kandungan asam laurat tinggi seperti Destilat Asam Lemak Minyak Kelapa (DALMIK), minyak kelapa, minyak inti sawit, dan asam laurat komersial itu sendiri. Asam laurat merupakan asam lemak jenuh rantai sedang yang mengandung 12 atom karbon dan tidak memiliki ikatan rangkap. Asam laurat mengandung gugus hidrokarbon non polar pada bagian ekornya dan asam karboksilat yang polar pada bagian kepala. Hal tersebut menyebabkan asam laurat ini dapat berinteraksi baik dengan air maupun minyak.
Pembuatan MAG dan DAG dilakukan secara kimia dan enzimatis. Cara kimia merupakan cara yang paling banyak digunakan dalam industri, namun reaksi kimia seperti ini berlangsung lama, tidak selektif, dan menggunakan energi dalam jumlah besar. Selain itu, cara ini akan menghasilkan produk samping yang tidak dikehendaki seperti warna gelap, rasa terbakar, dan flavor yang menyimpang. Sintesis MAG secara enzimatis menjadi pilihan peneliti beberapa tahun terakhir, karena aktivitas katalitik enzim yang sangat tinggi dan kemampuannya bekerja pada suhu relatif rendah (McNeill et al., 1992). Sintesis enzimatis dapat dilakukan dengan hidrolisis, esterifikasi asam lemak, transesterifikasi ester asam lemak dan gliserolisis minyak atau lemak dengan menggunakan enzim lipase. Berkembangnya teknologi enzim imobil meningkatkan stabilitas enzim (Haryadi, 1996), salah satu enzim imobil yang banyak digunakan adalah Lipozyme dan Novozyme.
laurat secara enzimatis serta dilakukan pula pengujian stabilitas enzim imobil yang digunakan, yaitu Novozyme®
Harga lipase komersial biasanya sangat tinggi karena proses produksinya yang sulit dan memakan waktu. Selain itu, dalam proses reaksi enzimatis, lipase tidak dapat digunakan kembali lagi karena terlarut dalam media reaksi. Hal ini menyebabkan biaya reaksi yang dikatalisis lipase menjadi meningkat. Perlu adanya penelitian tentang teknik penggunaan kembali lipase, salah satunya adalah teknik reaksi immobilisasi dengan bantuan support sebagai media pembantu yang dapat menahan enzim dalam struktur molekulnya.
435.
Recovery dan penggunaan kembali (reuse) enzim dari reaksi esterifikasi dikarenakan alasan biaya (cost). Oleh karena itu stabilitas lipase dalam reaksi adalah parameter penting (Rozendaal,1997). Kehilangan aktivitas selama reaksi inesterifikasi disebabkan oleh dua faktor, yaitu inaktivasi panas lipase dan kontaminasi oleh komponen minor dalam reaktan. Kontaminasi reaktan dapat dicegah dengan cara penyaringan secara hati-hati dari reaktan tersebut, tapi lipase harus tahan pada suhu relatif tinggi yang digunakan dalam reaksi.
Stabilitas enzim imobil diuji dengan cara penggunaan kembali (re-use) enzim pada reaksi esterifikasi dengan cara enzim dipisahkan dari reaksi, kemudian dicuci dengan pelarut dan dikeringkan. Setelah itu digunakan kembali pada proses dan kondisi reaksi yang sama beberapa kali. Hal ini bertujuan untuk melihat seberapa stabil enzim imobil komersial dapat digunakan dengan menganalisis parameter rendemen dan komposisi MAG yang dihasilkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Mencari kondisi optimum untuk sintesis monolaurin melalui proses esterifikasi enzimatis circulated packed bed reactor.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat sebagai berikut:
1. Pengembangan teknologi pembuatan monolaurin dengan metode enzimatis
TINJAUAN PUSTAKA Asam Lemak Laurat
Asam laurat atau asam dodekanoat adalah sedang (middle-chained fatty acid, MCFA) yang tersusun dari 12 atom utama asam lemak ini adal
laurat, sertapalm kernel oil). Sumber lain adalah susu sapi.
Asam laurat memiliki titik lebur 44°C dan titik didih 225°C sehingga pada suhu ruang berwujud padatan berwarna putih, dan mudah mencair jika dipanaskan. Rumus kimia: CH3(CH2)10COOH, berat molekul 200,3 g.mol-1. Asam-asam
lemak rantai pendek memiliki kemampuan kelarutan dalam pelarut air, semakin panjang rantai asam-asam lemak maka kelarutannya dalam air semakin berkurang. Asam kaprilat pada 30 oC mempunyai nilai kelarutan 1, yang artinya 1 gram asam kaprilat dapat larut dalam setiap 100 g air pada suhu 30 oC. Sedangkan asam stearat mempunyai nilai kelarutan sekitar 0,00034 pada suhu 30 o
Sifat fisikokimia asam laurat banyak dimanfaatkan oleh industri yang menghasilkan produk personal care dan farmasi, misalnya pada industri
C (Ketaren, 2005). Sifat kelarutan tersebut digunakan sebagai dasar untuk memisahkan berbagai asam lemak yang tidak jenuh, yaitu dengan proses kristalisasi.
Natrium laurilsulfat adalah turunan yang paling sering dipakai dalam industri sabun dan shampoo, sedangkan pada industri kosmetik, asam laurat ini berfungsi sebagai pengental, pelembab dan pelembut. Asam laurat atau asam lemak berantai menengah berbeda dengan asam lemak berantai panjang yang memiliki molekul lebih besar. Sifat-sifat metabolisme asam lemak rantai menengah jauh lebih mudah dicerna dan diserap usus dan dibawa ke hati untuk diubah menjadi energi. Itu karena asam lemak rantai menengah memiliki molekul ukuran lebih kecil sehingga cepat menghasilkan energi untuk tubuh.
lemak dalam air susu ibu (ASI) (Kabara, 1983; Jensen et al., 1992; Jensen, 1996; Kolezko et al., 1992). Asam lemak jenuh pada minyak kelapa didominasi oleh asam lemak laurat yang memiliki rantai karbon 12, sehingga minyak kelapa sering juga disebut minyak laurat. Asam lemak jenuh rantai menengah inilah yang membuat minyak kelapa murni bermanfaat bagi kesehatan.
Minyak kelapa berdasarkan kandungan asam lemak digolongkan ke dalam minyak asam laurat (Ketaren, 2005), karena kandungan asam lauratnya paling besar jika dibandingkan asam lemak lainnya. Komposisi asam lemak minyak kelapa dapat dilihat pada Tabel 1. Dari Tabel tersebut dapat dilihat bahwa asam lemak jenuh minyak kelapa lebih kurang 90 persen. Minyak kelapa mengandung 84 persen trigliserida dengan tiga molekul asam lemak jenuh, 12 persen trigliserida dengan dua asam lemak jenuh dan 4 persen trigliserida dengan satu asam lemak jenuh.
Tabel 1 Komposisi Asam lemak Minyak Kelapa
Asam Lemak Rumus Kimia Jumlah (%)
Asam lemak jenuh:
Asam kaproat C5 H11 COOH 0,0 – 0,8
Asam kaprilat C7 H17 COOH 5,5 – 9,5
Asam Kaprat C9 H19 COOH 4,5 – 9,5
Asam Laurat C11 H23 COOH 44,0 – 52,0
Asam miristat C13 H27 COOH 13,0 – 19,0
Asam palmitat C15 H31 COOH 7,5 – 10,5
Asam stearat C17 H35 COOH 1,0 – 3,0
Asam arachidat C19 H39 COOH 0,0 – 0,4
Asam lemak tidak jenuh:
Asam palmitoleat C15 H29 COOH 0,0 – 1,3
Asam oleat C17 H33 COOH 5,0 – 8,0
Asam linoleat C17 H31 COOH 1,5 – 2,5
Sumber: Thieme (1968) Di dalam Ketaren (2005)
and Deodorized Palm Oil (RBDPO), RBDPKO, minyak goreng, minyak makan, margarine, shortening dan lain sebagainya.
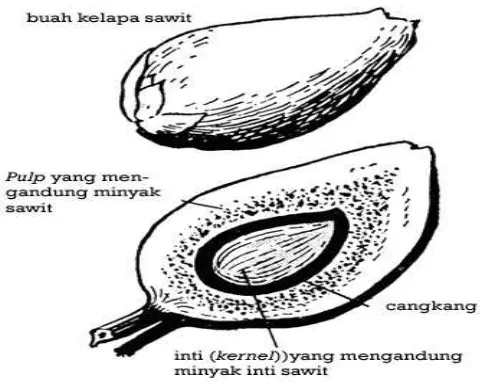
Gambar 1 Bagian-bagian buah kelapa sawit (FAO, 2006)
Tabel 2 Komposisi asam lemak minyak sawit dan minyak inti sawit
Asam Lemak Minyak kelapa sawit (%) Minyak inti sawit (%)
Asam kaprilat - 3 – 4
Asam kaproat - 3 – 7
Asam laurat - 46 – 52
Asam miristat 1.1 – 2.5 14 – 17
Asam palmitat 40 – 46 6.5 – 9
Asam stearat 3.6 – 4.7 1 – 2.5
Asam oleat 39 – 45 13 – 19
Asam linoleat 7 – 11 0.5 – 2
Sumber : Eckey (1995)
Minyak inti sawit memiliki kemiripan sifat dan komposisi asam lemak dengan minyak kelapa, sehingga dalam penggunaannya dapat bersifat sebagai bahan subtitusi. PKO dan minyak kelapa sering digunakan oleh industri oleokimia sebagai bahan baku untuk menghasilkan produk surfaktan dan emulsifier. Kandungan asam laurat yang cukup tinggi pada minyak inti sawit menjadi salah satu kelebihan karena asam lemak ini memiliki khasiat bagi kesehatan tubuh.
Pengolahan minyak dari kelapa sawit ini akan mengalami peningkatan seiring dengan semakin tingginya permintaan pasar dan majunya teknologi rekayasa pengolahan minyak. Teknologi tersebut diharapkan dapat menghasilkan produk yang dapat diaplikasikan di berbagai aspek industri pengolahan serta dapat bersaing dengan produk minyak nabati lainnya di pasar dalam negeri maupun internasional.
Gliserol
Gliserol, disebut juga gliserin, adalah suatu larutan kental yang memiliki rasa manis, tidak berwarna, tidak memiliki bau, dan bersifat higroskopis. Gliserol merupakan gula alkohol dan mempunyai tiga gugus hidroksil yang bersifat hidrofilik sehingga dapat larut dalam air. Oleh karena itu, larutan kental ini banyak digunakan sebagai pelembab pada kosmetik. Rumus kimia gliserol adalah C3H8O3 dengan nama kimia propane-1,2,3-triol. Gliserol memiliki berat molekul
Gambar 2 Struktur molekul gliserol
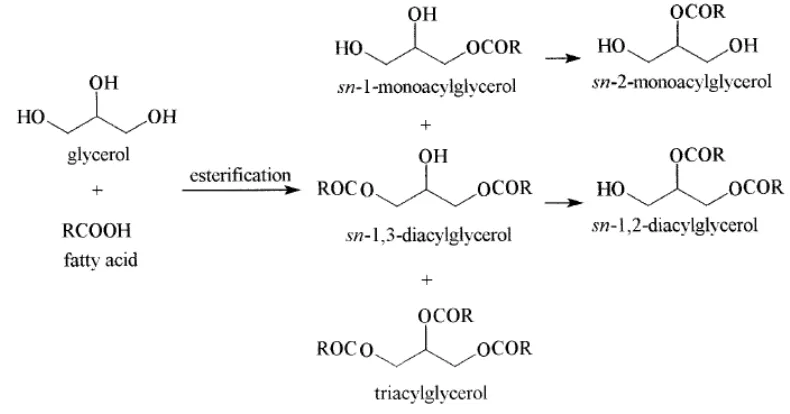
Gliserol dapat digunakan sebagai bahan dasar untuk pembuatan monogliserida, digliserida, dan trigliserida melalui proses reaksi gliserolisis, esterifikasi atau inesterifikasi secara kimia atau enzimatis. Bila suatu radikal asam lemak berkaitan dengan gliserol maka akan terbentuk suatu monogliserida. Reaksi asam lemak dan gliserol dapat dilihat pada Gambar 3. Trigliserida akan terbentuk bila tiga asam lemak beresterifikasi dengan satu molekul gliserol (Winarno, 2002). Penggunaan gliserol akan menyebabkan reaksi keseimbangan menuju ke arah kanan reaksi esterifikasi sehingga menghasilkan produk MAG yang cukup tinggi (Fischer, 1998).
O
H2C-OH O H2C-O-C-R
HC-OH + HO-C-R HC-OH + H 1
2
H
O
2C-OH H2
Gliserol Asam lemak Monoasilgliserol air
C-OH
Gambar 3 Reaksi esterifikasi satu molekul asam lemak dengan satu gliserol
(Winarno, 2002)
Monoasilgliserol
banyak digunakan dalam pangan, farmasi, dan industri kosmetik (Bornscheuer, 1995). MAG dan turunannya sebanyak 75% digunakan sebagai emulsifier pangan di dunia dan di Amerika Serikat sekitar 100 juta kilogram digunakan per tahunnya (Sagalowicz, 2006; Birnbaum, 1981 di dalam Chetpattananondh et al.., 2008). Menurut Li dan Ward (1993) di dalam Bornscheuer (2005), MAG juga bermanfaat untuk kesehatan, misalnya MAG yang mengandung n-3-PUFA seperti
EPA dan DHA positif mencegah kerusakan cardiovascular, dan
monopentadecanoglycerol digunakan sebagai bahan tambahan perawatan rambut. Struktur molekul MAG dapat dilihat pada Gambar 4.
H2
H C OH
C O C R1
H2
Gambar 4 Monoasilgliserol C OH
Pada skala industri, MAG telah banyak diproduksi dengan menggunakan metode gliserolisis kimia minyak/lemak dan gliserol. Reaksi gliserolisis kimia ini dilakukan pada suhu tinggi (220 – 250o C) menggunakan katalis basa inorganik dalam atmosfer gas nitrogen. Penggunaan suhu tinggi memiliki
Gliserolisis kimia komersial biasanya menghasilkan 30-60% MAG, 35-50% DAG, 1-20% TAG, 1-10% asam lemak bebas dan logam garam basa (Damstrup et al., 2006). Menurut WHO dan arahan EU, MAG dan DAG dari asam lemak disyaratkan mengandung kurang lebih 70% MDAG, 30% MAG, dan maksimum gliserol 7% (Damstrup et al., 2006). Untuk menghasilkan produk MAG dengan kemurnian tinggi (90-95%), MAG sering dimurnikan dari campuran kesetimbangan dengan distilasi.
beberapa kelemahan, seperti warna gelap, rasa terbakar, dan mengkonsumsi energi yang banyak.
Gliserolisis dengan katalis enzim lipase lebih banyak digunakan beberapa tahun belakangan, hal ini dikarenakan teknologi yang digunakan lebih baik dengan menggunakan suhu lebih rendah. Suhu yang lebih rendah dibawah 80o C
membuat produksi MAG yang sensitif terhadap panas dengan asam lemak tidak jenuh rantai panjang lebih mudah, dimana jika dilakukan dengan proses kimia sulit dilakukan. MAG dari gliserolisis kimia menjadi bahan atau senyawa potensial bagi industri dengan fungsional yang lebih baik atau profil nutrisi asam lemak yang lebih sehat (Damstrup et al., 2005).
Reaksi gliserolisis enzimatis pada suhu rendah memiliki kelemahan karena mengandung tiga fase, yaitu fase hidrofobik minyak, fase gliserol hidrofilik, dn fase enzim padat. Karena enzim memiliki karakteristik hidrofilik, gliserol sering mengikat partikel enzim dan membuat akses molekul minyak ke partikel enzim menjadi sulit. Hal ini menyebabkan rendemen MAG menjadi relatif rendah dan waktu reaksi tidak praktis dari sudut pandang industri.
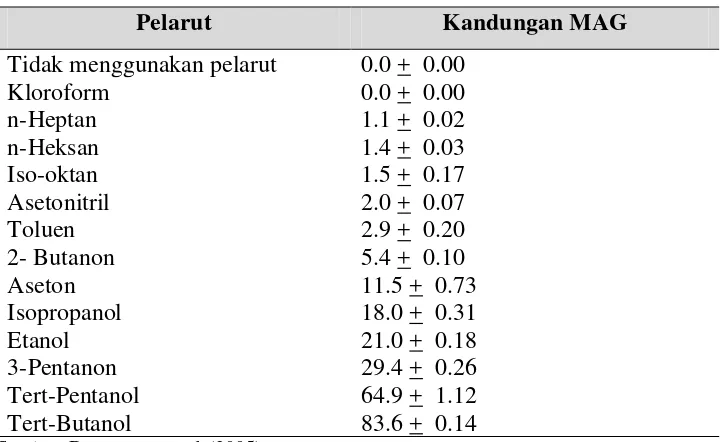
Tabel 3 Kandungan MAG setelah reaksi gliserolisis dalam berbagai pelarut
Pelarut Kandungan MAG
Tidak menggunakan pelarut 0.0 + 0.00
Kloroform 0.0 + 0.00
n-Heptan 1.1 + 0.02
n-Heksan 1.4 + 0.03
Iso-oktan 1.5 + 0.17
Asetonitril 2.0 + 0.07
Toluen 2.9 + 0.20
2- Butanon 5.4 + 0.10
Aseton 11.5 + 0.73
Isopropanol 18.0 + 0.31
Etanol 21.0 + 0.18
3-Pentanon 29.4 + 0.26
Tert-Pentanol 64.9 + 1.12
Tert-Butanol 83.6 + 0.14
Sumber: Damstrup et al. (2005)
gliserol/minyak, 5:1; waktu reaksi 150 menit; suhu 50o
MAG terdiri dari beberapa jenis, salah satu diantaranya adalah gliserol monolaurat atau monolaurin adalah senyawa multifungsi dengan sifat sebagai emulsifier dan antimikroba (Cotton dan Marshall, 1997). Monolaurin terbentuk dari reaksi antara gliserol dan asam laurat. Keistemewaan dari monolaurin lainnya adalah dapat menghambat sel vegetative Bacillus cereus (Cotton et al., 1997). Penelitian-penelitian sebelumnya juga menunjukkan bahwa monolaurin dapat menghambat aktivitas Listeria monocytogenes, B. stearothermophilus dan B. subtilis (Kabara, 1983).
C; pelarut 50 ml/10 g minyak; dosis enzim 30% (w/w minyak).
Transesterifikasi
Pembuatan MAG dapat dilakukan dengan menggunakan beberapa metode seperti esterifikasi langsung, reaksi gliserolisis, serta dapat dilakukan secara enzimatis maupun kimia. Esterifikasi merupakan reaksi antara asam karboksilat dan alkohol untuk membentuk ester. Reaksi esterifikasi kimia sederhana dapat dilakukan pada suhu tinggi tanpa menggunakan katalis dan pada suhu yang lebih rendah dilakukan dengan katalis.
Reaksi esterifikasi langsung terjadi antara ester asam lemak dengan gliserol dan dilakukan pada suhu tinggi dan waktu yang cukup lama dengan bantuan katalis asam. Penggunaan suhu yang terlalu tinggi sangat dihindari karena akan terjadi reaksi sekunder yaitu polimerisasi gliserol, dehidratasi gliserol dengan pembentukan akrolein. Air yang merupakan hasil samping dari reaksi esterifikasi ini harus dijerap dengan menggunakan zat kimia tertentu agar reaksi tidak reversible. Pada metode gliserolisis, lemak/ minyak dalam bentuk trigliserida direaksikan dengan gliserol dan ditambahkan katalis kimia kemudian dipanaskan pada suhu yang tidak terlalu tinggi (± 1200
transesterisfikasi antara gliserol dan minyak atau lemak (reaksi gliserolisis) dapat dilihat pada gambar di bawah ini.
Gambar 5 Reaksi esterisfikasi antara gliserol dan minyak atau lemak (reaksi gliserolisis). (Monteiro et al. 2003)
Reaksi inesterifikasi ini dapat terjadi secara acak maupun terarah. Secara umum reaksi inesterifikasi dapat terjadi secara batch, semi-continously, atau continously. Reaksi ini akan berjalan dengan empat tahapan, yaitu: perlakuan awal minyak, penambahan katalis, terjadi reaksi, dan deaktivasi enzim. Reaksi terjadi secara acak mengikuti hukum keseimbangan hingga menghasilkan komposisi MAG, DAG, dan TAG tertentu.
Penggunaan katalis enzimatis mulai dilirik untuk memperbaiki kekurangan yang terdapat pada penggunaan katalis kimia. Katalis enzimatis memiliki keunggulan antara lain produk yang dihasilkan tidak memiliki keragaman besar. Hal ini dikarenakan penggunaan enzim lipase memiliki kespesifikan tertentu artinya enzim ini akan memotong ikatan antara gliserol dan asam lemak pada titik tertentu (Elizabeth dan Boyle, 1997). Sintesis MAG enzimatis dapat dilakukan dengan hidrolisis, esterifikasi asam lemak, transesterifikasi ester asam lemak dan gliserolisis minyak atau lemak dengan katalis lipase. Kelemahan metode enzimatis ini adalah harga enzim yang relatif mahal dan bersifat labil. Namun, dengan berkembangnya teknologi enzim imobil, enzim dapat digunakan ulang sampai beberapa kali sehingga mengurangi biaya keseluruhan. Sifat labil enzim dapat diatasi dengan berkembangnya teknik enzimologi mikroakueus dimana stabilitas enzim dapat ditingkatkan (Hariyadi, 1996). Mikroakueus adalah kondisi lingkungan reaksi dengan konsentrasi air terbatas, yaitu tidak lebih dari 0.1% v/v. Kondisi ini akan mempermudah reaksi sintesis produk, isolasi produk, dan pemakaian ulang enzim. Kondisi mikroakueus dapat diterapkan dengan menggunakan pelarut organik sebagai pengganti air dalam reaksi. Kehadiran air dalam campuran reaksi dapat membentuk asam lemak bebas yang tidak diinginkan (Damstrup et al., 2005)
dosis enzim, waktu reaksi, rasio substrat gliserol/minyak, dan jumlah pelarut. Parameter yang paling signifikan dalam pengujian untuk menghasilkan MAG adalah dosis enzim dan waktu reaksi. Kondisi optimal yang menghasilkan rendemen MAG tinggi adalah dosis enzim 18 % (w/w minyak); rasio gliserol/minyak 7:1 (mol/mol); jumlah pelarut 500 ml (v/w minyak)dan waktu reaksi 115 menit. Kandungan MAG yang dihasilkan adalah 76%.
Monteiro et al. (2003) melakukan penelitian reaksi esterifikasi enzimatis dengan substrat asam laurat dan gliserol (rasio molar 1:5) dalam sistem homogenus dengan katalis enzim Lipozyme IM. Aktivitas enzim Lipozyme IM adalah 5-6 BAUN/g (Batch Acidolysis Units Novo). Pelarut yang digunakan adalah heksan dan tert-butanol (1:1 v/v). Hasil reaksi pada sistem homogenus n-heksan/tert butanol (1:1 v/v) lebih baik karena produk yang dihasilkan adalah monolaurin dengan sedikit sekali dilaurin. Sedangkan pada reaksi menggunakan pelarut heksan saja, produk yang dihasilkan adalah campuran monolaurin dan dilaurin. Hal ini berarti penggunaan campuran pelarut tert butanol dan heksan (1:1 v/v) dapat meminimalisir terjadinya migrasi asil. Sistem pelarut menjadi lebih polar dari heksan murni menyebabkan pengambilan air dari medium sehingga mencegah terjadinya inaktivasi enzim dan meningkatkan konversi substrat menjadi produk yang diinginkan. Konversi asam laurat menjadi monolaurin dianalisis menggunakan GC dengan waktu retensi 22 menit sebesar 65% selama 8 jam reaksi.
pada suhu 7o
Suhu dan waktu reaksi merupakan faktor penting dalam reaksi esterifikasi. Suhu dan waktu reaksi dijadikan sebagai parameter dalam penelitian ini. Pemilihan suhu reaksi 50
C. Pemisahan endapan yang merupakan produk hasil fraksinasi kemudian dilakukan dengan cara penyaringan.
o
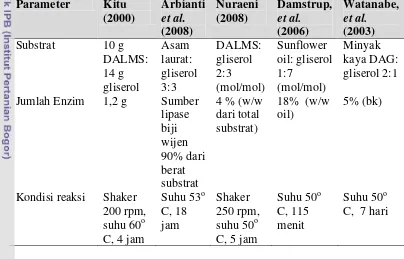
Tabel 4 Perbandingan kondisi reaksi esterifikasi menggunakan enzim lipase C dalam reaksi esterifikasi enzimatis telah banyak dilakukan oleh beberapa peneliti seperti ditunjukkan pada Tabel 4. Sedangkan pemilihan waktu reaksi 55 jam adalah berdasarkan hasil penelitian terdahulu pada sintesis monolaurin (Haryati et al., 2007, tidak dipublikasikan).
Parameter Kitu (2000)
Arbianti et al. (2008) Nuraeni (2008) Damstrup, et al. (2006) Watanabe, et al. (2003)
Substrat 10 g
DALMS: 14 g gliserol Asam laurat: gliserol 3:3 DALMS: gliserol 2:3 (mol/mol) Sunflower oil: gliserol 1:7 (mol/mol) Minyak kaya DAG: gliserol 2:1
Jumlah Enzim 1,2 g Sumber
lipase biji wijen 90% dari berat substrat
4 % (w/w dari total substrat)
18% (w/w oil)
5% (bk)
Kondisi reaksi Shaker 200 rpm, suhu 60o
Suhu 53
C, 4 jam
o
Shaker 250 rpm, suhu 50 C, 18
jam o
Suhu 50
C, 5 jam
o
Suhu 50 C, 115
menit
o
C, 7 hari
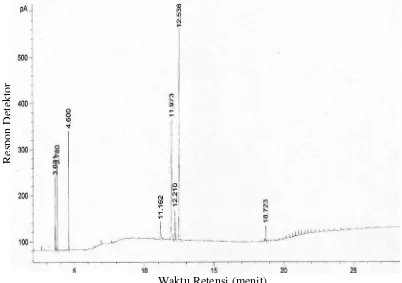
hasil analisis LC-MS terhadap diester yang diperkirakan dilaurin, menghasilkan kromatogram dengan puncak dominan pada waktu retensi 17,8 menit.
Gambar 6 Kromatogram GC untuk sintesis monolaurin dengan reaksi esterifikasi enzimatis secara batch (Haryati et al., 2007, tidak dipublikasikan)
Enzim Lipase
Lipase (triasilgliserol ester hidrolase, EC. 3.1.1.3) adalah enzim yang memilki kemampuan mensintesis minyak atau lemak. Lipase juga mengkatalisis hidrolisis triasilgliserol pada interfase minyak dalam air dan akan membentuk ikatan ester pada lingkungan dengan kondisi sedikit air. Reaksi yang mungkin terjadi pada kondisi lingkungan tersebut adalah esterifikasi, transesterifikasi, polimerisasi, laktonisasi (Divakar dan Manohar, 2007). Lipase sebagai katalis dapat diperoleh dari berbagai organisme seperti tanaman, hewan, dan mikroorganisme. Lipase komersial yang tersedia saat ini terutama diperoleh dari mikroorganisme seperti bakteri, kapang, dan khamir. Pada umumnya lipase dari
Waktu Retensi (menit)
R
es
pon D
et
ekt
hewan dan tumbuhan memiliki stabilitas termal yang lebih rendah daripada lipase mikrobial, sehingga industri lebih banyak menggunakan lipase dari mikroorganisme. Mikroorganisme penghasil lipase dari bakteri antara lain P. Flourescens, S. Carnosus, B. Stearothermophillus, C. Viscocum. Lipase yang berasal dari kapang adalah A. Niger, R. Miehei, R. Delemar. Sedangkan lipase dari khamir dapat diperoleh dari C. Cylindriceae, C. Auriculariae, C. Curvata, dan Hansenula aromala (Borgstrom et al., 1984).
Beberapa jenis lipase yang dapat mengkatalisis reaksi esterifikasi adalah R. Miehei, A. Niger, R. Delemar, G. Candidum, P. Camembertii, R. Arrhizus, C. Antartica, Pseudomonas sp., C. Viscosum. Lipase-lipase tersebut telah diteliti dapat menghasilkan MAG sebagai produk utama pada beberapa jenis substrat (Bornscheuer, 1995). Novozym®
Reaksi yang dikatalisis oleh enzim lipase berlangsung pada sisi aktif enzim. Menurut Brady et al. (1990) di dalam Hariyadi (1995), sisi aktif lipase terdiri dari trio residu asam amino yaitu Ser-Asp-His. Dalam struktur enzim, sisi aktif ini tersembunyi di balik suatu tutup, yaitu polipeptida yang sering disebut lid enzim. Secara fisiologis lid enzim tersebut berfungsi untuk mencegah kerusakan proteolitik asam-asam amino sisi aktif, yang akan berdampak negatif terhadap aktivitas enzim. Lid bersifat fleksibel dan pada waktu membuka menyebabkan substrat dapat mencapai sisi aktif enzim. Lid mengandung residu triptofan (Trp) yang bersifat nonpolar. Pada saat enzim inaktif, sisi aktif lipase masih berada dalam keadaan tertutup karena lid berinteraksi dengan residu hidrofobik di sekitar inti katalitik. Keberadaan lingkungan hidrofobik (nonpolar) di sekitar enzim akan memberikan kesempatan bagi lid untuk membuka, karena adanya interaksi antara area nonpolar lid dengan lingkungan hidrofobik. Perubahan struktur yang
435 yang disuplai oleh Novozymes A/S (Bagsvaerd, Denmark) adalah lipase komersial yang berasal dari C. Antartica yang diproduksi submerged fermentation rekayasa genetik dari mikroorganisme Aspergillus oryzae dan diabsorbsi dalam macroporous resin (Damstrup et al.,
2006). Candida antartica termasuk kedalam kelompok enzim yang
menyebabkan terbukanya sisi aktif ini, menyebabkan substrat mudah untuk berafinitas dengan sisi aktif lipase, sehingga terjadi proses katalisis.
Stabilitas Enzim Lipase Imobil
Stabilitas enzim dapat diartikan sebagai kestabilan aktivitas enzim selama penyimpanan dan penggunaan enzim tersebut,serta kestabilan terhadap senyawa yang bersifat merusak seperti pelarut tertentu (asam,basa) dan oleh pengaruh suhu atau pH ekstrim. Stabilitas merupakan sifat penting yang harus dimiliki oleh enzim dalam aplikasinya sebagai biokatalis. Pasa prinsipnya, ada dua cara yang dapat ditempuh untuk memperoleh enzim yang mempunyai stabilitas tinggi yaitu: (1) menggunakan enzim yang memiliki stabilitas ekstrim alami; (2) mengusahakan peningkatan stabilitas enzim yang secara alami tidak/ kurang stabil. Peningkatan stabilitas dapat ditempuh melalui: (a) imobilisasi enzim; (b) modifikasi kimia; dan (c) protein engineering (Janecek, 1993). Lipase merupakan enzim yang memiliki peran yang penting dalam bioteknologi modern. Banyak industri yang telah mengaplikasikan penggunaan enzim sebagai biokatalis. Lipase terkenal memiliki aktivitas yang tinggi dalam reaksi hidrolisis dan dalam kimia sintesis. Lipase dapat berperan sebagai biokatalis untuk reaksi hidrolisis, esterifikasi, alkoholisis, asidolisis atau aminolisis. Candida dan Rhizopus yang merupakan organisme yang paling sering dipakai sebagai sumber sintesis penghasil lipase (Pandey et al.,1999).
Enzim Lipase akan mengkatalis reaksi pada interfase, dan untuk menghasilkan kecepatan reaksi yang tinggi, maka area interfase antara reaktan dan fase enzim yang lebih hidrofilik dibutuhkan. Hal ini dapat dicapai dengan produksi dispersi lipase yang baik dalam fase organik misalnya dengan menggunakan surfaktan atau dengan mengimobilisasi enzim pada partikel pendukung macroporous. Imobilisasi lipase biasanya dipilih untuk proses inesterifikasi (Rozendaal, 1997). Imobilisasi lipase akan memperbaiki stabilitas, pemisahan produk, dan pemisahan enzim dari reaksi untuk digunakan kembali (Nawani et al., 2006).
daripada dengan katalis kimia. Hanya saja secara ekonomis penggunaan katalis enzim lipase lebih mahal. Untuk mengatasi masalah ini enzim lipase digunakan pada fase imobil sehingga dapat digunakan berulang-ulang dan memungkinkan untuk diaplikasikan pada proses circulated packed bed reactor. Dengan perkembangan teknologi peneliti dari Novozymes A/S, Bagsvaerd, Denmark telah berhasil memproduksi Novozyme®
Enzim lipase imobil menjadi pilihan dalam reaksi untuk mencapai kecepatan reaksi inesterifikasi. Enzim imobil dilakukan dengan cara mengadsorpsi enzim ke dalam partikel macroporous dengan interaksi ionik atau hidrofobik, karena protein tidak dapat larut dalam reaksi campuran. Partikel macroporous harus memiliki area yang cukup pada permukaan dalam untuk mengadsorpsi sejumlah lipase dan area permukaan bahan sekitar 10-100 m
435 yang diklaim sebagai enzim yang harganya terjangkau. Lipase imobil ini kemudian dikomersialisasikan untuk memenuhi kebutuhan produksi komoditas minyak dan lemak.
2
Enzim imobil yang digunakan pada penelitian ini adalah Novozyme
/g yang normal digunakan. Diameter rata-rata pori partikel pendukung > 100 nM banyak dipilih. Kemudian asal bahan kimia permukaan partikel juga penting diperhatikan.
®
435. Novozyme® 435 dibeli dari Novozymes A/S (Bagsvaerd, Denmark) adalah lipase komersial yang berasal dari C. Antartica yang diproduksi rekayasa genetik dengan submerged fermentation dari mikroorganisme Aspergillus oryzae dan diadsorbsi dalam macroporous resin (Damstrup et al., 2006). Novozyme®
Novozyme
435 adalah katalis yang stabil pada suhu tinggi dan pelarut organik. Bisa digunakan pada operasi reaksi batch dan column tapi khususnya cocok digunakan untuk fixed-bed reactor.
®
Stabilitas enzim merupakan parameter penting dalam reaksi, hal ini dikarenakan harga enzim yang mahal. Oleh karena itu recovery dan penggunaan kembali (re-use) dari reaksi sangat dibutuhkan. Kehilangan aktivitas enzim selama reaksi inesterifikasi dikarenakan dua faktor, yaitu inaktivase enzim lipase dan kontaminasi dari komponen minor dalam reaktan. Kontaminasi reaktan dapat dicegah dengan cara penyaringan reaktan secara hati-hati, sedangkan ketahanan enzim pada suhu tinggi adalah syarat mutlak sebagai katalis.
[image:31.595.121.502.351.488.2]Nawani, et al. (2006) telah melakukan penelitian tentang imobilisasi enzim dan stabilitas lipase dari enzim thermofilik yang berasal dari Bacillus sp. Beberapa uji dilakukan untuk melihat stabilitas dari enzim imobil antara lain uji kestabilan enzim pada suhu tinggi. Enzim yang diuji adalah enzim dalam aqueous, diimobilisasi, dan dimobilisasi dengan cross linked pada suhu 0-80o C.
Gambar 7 Pengaruh suhu pada enzim aqueous, imobil, dan imobil cross link
(Nawani et al., 2006)
Tabel 5 Retensi aktivitas lipase dalam penyangga padat pada siklus yang berbeda
No
Padatan penyangga
Sisa Aktivitas Enzim (%)
5 siklus 10 siklus 15 siklus 20 siklus 25 siklus
1 HP 20 100 93 86 79 71
2 Silica 100 89 78 58 46
(Sigurgisladottir et al., 1993)
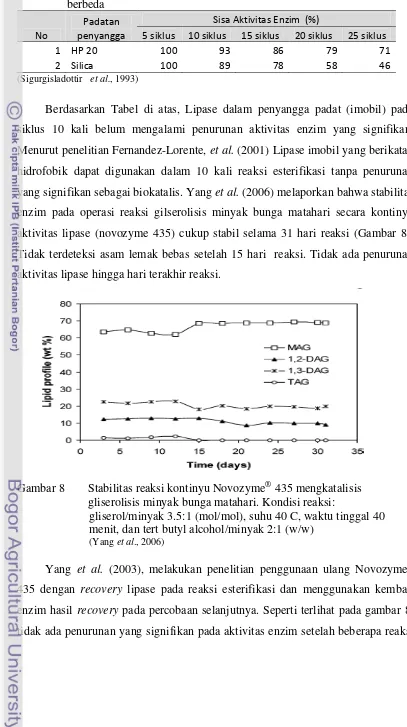
Berdasarkan Tabel di atas, Lipase dalam penyangga padat (imobil) pada siklus 10 kali belum mengalami penurunan aktivitas enzim yang signifikan. Menurut penelitian Fernandez-Lorente, et al. (2001) Lipase imobil yang berikatan hidrofobik dapat digunakan dalam 10 kali reaksi esterifikasi tanpa penurunan yang signifikan sebagai biokatalis. Yang et al. (2006) melaporkan bahwa stabilitas enzim pada operasi reaksi gilserolisis minyak bunga matahari secara kontinyu aktivitas lipase (novozyme 435) cukup stabil selama 31 hari reaksi (Gambar 8). Tidak terdeteksi asam lemak bebas setelah 15 hari reaksi. Tidak ada penurunan aktivitas lipase hingga hari terakhir reaksi.
Gambar 8 Stabilitas reaksi kontinyu Novozyme®
gliserolisis minyak bunga matahari. Kondisi reaksi:
435 mengkatalisis
gliserol/minyak 3.5:1 (mol/mol), suhu 40 C, waktu tinggal 40 menit, dan tert butyl alcohol/minyak 2:1 (w/w)
(Yang et al., 2006)
[image:32.595.68.475.102.829.2]batch. Sekitar 90% dari aktivitas enzim (selama pembentukan MAG) dipertahankan setelah 14 kali reaksi (Gambar 9).
Gambar 9 Kandungan MAG vs jumlah reaksi batch pada penelitian penggunaan kembali Novozyme®
reaksi sama (Yang et al., 2003)
METODOLOGI PENELITIAN Waktu Dan Tempat Penelitian
Penelitian dilaksanakan mulai bulan Juni 2010 sampai dengan Februari 2011 bertempat di Laboratorium Kimia SEAFAST Center IPB dan Laboratorium Kimia Pangan Departemen Ilmu dan Teknologi Pangan (ITP), IPB .
Bahan Dan Alat
Bahan baku untuk sintesis monolaurin adalah asam lemak laurat teknis komersial, gliserol, enzim lipase Novozyme® 435 dari Novozymes A/S (Bagsvaerd, Denmark), standar monolaurin dari Sigma, heksan teknis, dan tert-butanol p.a (Sigma). Bahan kimia yang digunakan (NA2S2O3
Alat-alat yang digunakan dalam penellitian ini adalah rangkaian reaktor packed bed yang dilengkapi dengan tangki stok, pompa peristaltik (BT 100-1 F), waterbath (Stephen Haake, Germany) serta wadah penampung produk, serangkaian peralatan GC (Gas Chromatography) dengan detektor FID (Flame Ionization Detector), GC-MS Pyrolisis, neraca analitik, Aw-meter (Shibaura WA-360), pH meter, kertas saring dan peralatan gelas.
) 0.1N, larutan Wijs, larutan Alkohol 95%, indikator PP dan pati, Larutan NaOH 0.01N, larutan kloroform, Dimetil formamida (DMF), benzena, dan aquades.
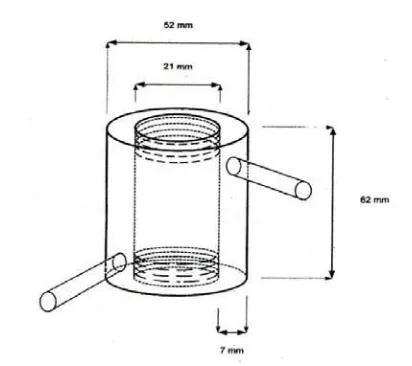
Gambar 10 Desain reaktor
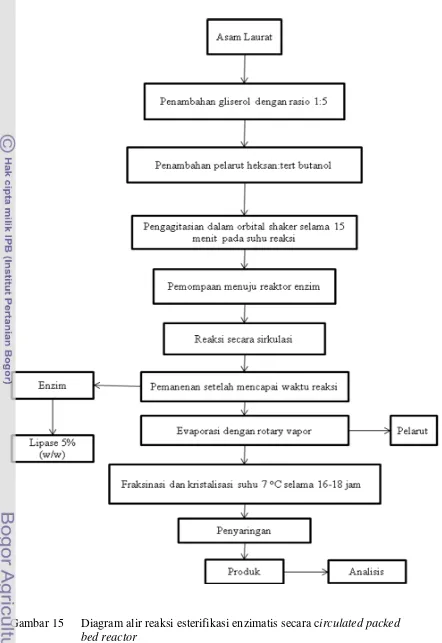
Skema proses produksi MAG secara circulated packed bed reactor dapat dilihat pada Gambar 12. Rangkaian alat esterifikasi enzimatis menggunakan reaktor packed bed dapat dilihat pada Gambar 11 dimana substrat dari wadah reaktan (B) dialirkan dengan laju tertentu ke dalam reaktor packed bed yang berisi enzim lipase (A) menggunakan pompa peristaltik(E). Produk yang dihasilkan ditampung dalam wadah produk (C).
Keterangan : A. Reaktor Enzim B. Wadah Reaktan C.Wadah Produk D. Waterbath
E. Pompa Peristaltik
Gambar 11 Rangkaian alat reaksi esterifikasi menggunakan Reaktor Packed Bed (Soekopitojo, 2003)
[image:35.595.134.472.439.659.2]
Gambar 12 Skema alur reaksi esterifikasi enzimatis circulated packed bed reactor
Metode Penelitian Analisis Sifat Kimia Bahan Baku
Asam laurat dan enzim yang digunakan dalam proses esterifikasi dianalisis terlebih dahulu untuk menentukan kualitas bahan baku. Analisis yang dilakukan meliputi kadar air, asam lemak bebas (ALB), dan bilangan peroksida. Enzim dilakukan karakterisasi terlebih dahulu dengan dilakukan pengukuran pH dan Aw enzim.
Uji Coba Reaksi Sintesis Monolaurin Secara Batch
Uji coba hasil penelitian mengacu pada metode penelitian terdahulu. Proses esterifikasi dilakukan dengan mereaksikan substrat yaitu asam lemak laurat dan gliserol (Gambar 12). Asam lemak laurat dan gliserol direaksikan dalam tabung erlenmeyer sebanyak 1 : 5 (mol/mol substrat), ditambah campuran pelarut organik, kemudian diagitasi menggunakan orbital shaker dengan kecepatan 200 rpm. Reaksi dilakukan pada suhu 50o
Setelah suhu reaksi yang diinginkan dalam rotary shaker tercapai, ditambahkan enzim lipase dengan perbandingan 5% (w/w minyak). Reaksi dibiarkan berjalan hingga 55 jam. Kemudian produk dari enzim dipisahkan dengan cara disaring, kemudian filtrat disentrifuse untuk memisahkan dari pelarut. Setelah itu di fraksinasi 16-18 jam pada suhu 7
C.
o
[image:37.595.80.506.66.718.2]
Optimasi dan Verifikasi Reaksi Esterifikasi untuk Sintesis Monoasilgliserol dalam Circulated Packed Bed Reactor
Konversi Reaksi Esterifikasi Proses Batch ke Circulated Packed Bed Reactor Sebelum dilakukan optimasi reaksi, terlebih dahulu dilakukan konversi dari proses batch ke proses circulated packed bed reactor. Hasil dari proses batch dipilih yang memiliki hasil dengan kadar MAG dan rendemen tertinggi, serta rasio substrat dan pelarut yang efektif untuk dilakukan proses secara circulated packed bed reactor.
Optimasi Reaksi Esterifikasi Circulated Packed Bed Reactor
Pada tahap ini dilakukan penelitian untuk mencari kondisi optimum proses esterifikasi enzimatis secara circulated packed bed reactor yang dapat menghasilkan produk dengan kadar MAG tinggi. Diagram alir tahap optimasi dan proses reaksi esterifikasi dapat dilihat pada Gambar 14 dan 15. Rancangan percobaan yang digunakan pada tahap ini mengikuti rancangan Central Composite Design (CCD) dari Respon Surface Methodology (RSM) dengan dua variabel yaitu waktu dan suhu reaksi esterifikasi.
Gambar 14 Diagram alir proses optimasi sintesis monolaurin dengan metode circulated packed bed reactor
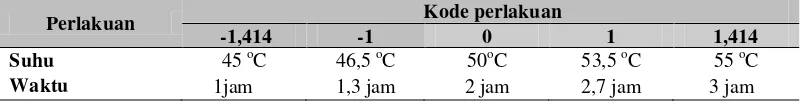
Tabel 6 Perlakuan dan kode perlakuan untuk reaksi esterifikasi
Perlakuan Kode perlakuan
-1,414 -1 0 1 1,414
Suhu 45 oC 46,5 oC 50oC 53,5 oC 55 oC Waktu 1jam 1,3 jam 2 jam 2,7 jam 3 jam
Tabel 7 Rancangan percobaan dengan sistem pengkodean
No Suhu ( C) Waktu Reaksi (jam)
1 -1 -1
2 1 -1
3 -1 1
4 1 1
5 -1,414 0
6 1,414 0
7 0 -1,414
8 0 1,414
9 0 0
10 0 0
11 0 0
12 0 0
13 0 0
Sumber : Cochran dan Cox (1962) Enzim
Enzim
Lauric acid gliserol
Produk
Optimasi Central Composite Design
Waktu reaksi Suhu reaksi
Metode Permukaan Tanggap Esterifikasi
Filtrasi
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah Central Composite Design. Model Respon Surface digunakan untuk melihat pengaruh perlakuan waktu dan suhu reaksi terhadap rendemen produk dan komposisi MAG dalam produk. Titik tengah perancangan penelitian diambil dari suhu dan waktu reaksi pada hasil penelitian pendahuluan.
Model Response Surface Methodology atau RSM adalah kumpulan teknik matematika dan statistik yang digunakan untuk membentuk model dan menganalisis masalah dalam suatu respon yang dipengaruhi oleh beberapa peubah dan bertujuan untuk mengoptimalisasi respon tersebut. RSM digunakan untuk mengetahui hubungan antara faktor percobaan dengan variabel respon. Berdasarkan hubungan tersebut dapat diperoleh nilai faktor percabaan yang akan menghasilkan nilai variabel respon yang dikehendaki. Seluruh perlakuan terdiri dari 13 set percobaan, dimana model umum rancangan percobaan yang digunakan adalah:
k k k -1,k
Y = β
o+
Σ
β
iX
i+
Σ
β
iiX
i 2+
Σ
β
i,jX
ii=1 i=1 i=1,j=2
Xj +
ε
Keterangan:
Y = Respon Pengamatan
β
oβ
i = = Interceptβ
ii = Pengaruh linierβ
ij Pengaruh kuadratikXi = Kode untuk faktor ke-i = Pengaruh interaksi percobaan
Xj = Kode untuk fakyor ke-j k = Jumlah faktor yang dicobakan
Verifikasi Kondisi Optimum Reaksi Esterifikasi Circulated packed bed reactor
Tahap verifikasi merupakan tahap pengujian terhadap kondisi proses optimum. Verifikasi dilakukan dengan maksud untuk memperbaiki tingkat keyakinan bahwa berdasarkan kondisi optimum yang diasumsikan, model yang dikembangkan dapat mewakili sistem yang sebenarnya. Verifikasi dilakukan dengan cara mengaplikasikan kondisi proses tersebut sebanyak lima kali ulangan, Tujuan verifikasi adalah melihat konsistensi produk yang dihasilkan berdasarkan pada nilai CV (Coeficeient Varians). Parameter yang dianalisis pada tahap verifikasi adalah komposisi MAG dan rendemen.
Uji Stabilitas Enzim Novozyme 435 pada Reaksi Esterifikasi Circulated packed bed reactor
Gambar 16 Diagram alir uji stabilitas enzim Novozyme® 435 pada reaksi esterifikasi circulated packed bed reactor
Pengamatan
MAG yang dihasikan. Analisis yang dilakukan meliputi bilangan Peroksida, kadar asam lemak bebas (ALB), Aw Enzim, pH enzim, analisis semi kuantitatif komposisi Gliserida dengan GC, Titik Leleh, dan analisis kuantitatif komposisi Gliserida produk dengan GC-MS Pyrolisis.
Analisis Kadar Air Dalam Minyak (AOAC,1995)
Sejumlah ± 5 g sampel dimasukkan ke dalam cawan yang telah diketahui beratnya. Kemudian cawan dimasukkan ke dalam oven bersuhu 100o
KA =
C hingga diperoleh berat yang konstan. Perhitungan kadar air dilakukan dengan menggunakan rumus :
% 100 ) ( x c b a c− −
dengan: a = berat cawan dan sampel (g) b = berat cawan dan sampel akhir (g) c = berat sampel awal (g)
Analisis Bilangan Peroksida, Metode Titrimetri (AOAC, 1995)
Contoh minyak ditimbang seberat 5 gram dan dimasukkan ke dalam erlenmeyer tertutup dan diisi dengan gas N2. sampel ditambah dengan 55 ml
kloroform dan distirer kemudian ditambah asam asetat glasial sebanyak 20 ml. Larutan KI jenuh ditambahkan sebanyak 0.5 ml kemudian ditutup dengan cepat, digoyang selama 1 menit. Sampel disimpan di tempat yang gelap selama 5 menit pada suhu 15oC sampai 25o
BP =
C. Setelah itu, sampel ditambahkan 30 ml air destilata. Larutan tersebut dititrasi dengan larutan sodium thiosulfat 0.01N dan digoyang dengan kuat. Larutan pati yang digunakan sebagai indikator ditambahkan ketika warna kuning larutan hampir hilang dan titrasi diteruskan hingga warna biru menghilang. Titrasi juga dilakukan terhadap blanko.
1000 ) ( x m xT Vb Vs−
Keterangan : BP = bilangan peroksida (meq O2
Vs = volume sodium thiosulfat untuk titrasi sampel (ml) /kg)
Analisis Kadar Asam Lemak Bebas (ALB) (AOAC, 1995)
Sampel ditimbang sebanyak 5 gram kemudian dilarutkan ke dalam 50 ml etanol (alkohol) 95%. Larutan ini kemudian ditrasi dengan NaOH 0,01N dengan indikator fenoftalein hingga terlihat warna merah muda selama 10 detik. Kadar asam lemak bebas dihitung dengan menggunakan rumus perhitungan :
Kadar Asam =
m x M x T x V 10
Keterangan : V = volume (ml) KOH untuk titrasi
T = normalitas larutan KOH M = berat molekul sampel
m = jumlah sampel yang digunakan
Pengukuran pH Enzim (Hariyadi, 1995)
Sebanyak 0.5 gram enzim disuspensikan dalam 15 ml air destilata. Campuran diaduk menggunakan magnetic stirer selama 2 menit dan diinkubasikan pada suhu kamar (±28 o
Pengukuran A
C) selama 30 menit. Selanjutnya dilakukanpengukuran menggunakan pH meter.
w
Pengukuran aktivitas air (A
enzim (Hariyadi, 1995)
w) enzim dilakukan secara langsung
menggunakan aw-meter Shibaura WA-60. Kalibrasi dilakukan garam NaCl
dengan Aw= 0.7509. Sebanyak 1 gram sampel enzim diletakkan pada tempat
sampel pada Aw-meter Shibaura WA-60. Selanjutnya Aw-meter ditutup dan
ditunggu sampai angka hasil pengukuran pada Aw
Analisa Komposisi Gliserida MAG Dengan Kromatografi Gas (Modifikasi AOAC Official Method 993.18, 1995)
-meter konstan.
Sampel ditimbang teliti kurang lebih 0.2 mg dimasukkan dalam vial kemudian ditambahkan 0.2 ml BSTFA [bis(trimethylsilil)trifluoro acetamide] dan 0.1 ml TMCS (trimethylchlorsilane) dan 0.1 ml larutan standart internal n- tetradecana kemudian dikocok hati-hati dan dipanaskan pada suhu 70o C selama
seperti diatas untuk 0.1 ml larutan referensinya (MAG dan DAG) pada kondisi operasi yang sama, peak yang muncul diidentifikasi dengan membandingkan waktu retensi dari referensi. Larutan referensi dibuat dengan menimbang 0.2 mg referensi dilarutkan dalam piridin menggunakan labu takar 10 ml. Kromatografi gas yang digunakan dilengkapi dengan split injeksi atau kolom injeksi dan FID dengan operasi sebagai berikut: suhu kolom awal 50o C dinaikkan menjadi 180o C dengan kenaikan 15 o C/ menit kemudian dinaikkan lagi menjadi 230 o C dengan kenaikan 7 o C/menit dan dinaikkan lagi menjadi 380 o C, suhu detektor 390 o C, suhu injektor 390 o C, kecepatan gas pembawa 0.7 ml N2
Titik leleh (PORIM Test Method, 1995)
/menit, kecepatan aliran
udara 450 ml/menit dan volume injeksi 1 μl.
Titik leleh didefinisikan sebagai suhu dimana sampel menjadi cair dengan sempurna. Produk mono dan diasilgliserol yang telah disaring dilelehkan dan dimasukkan ke dalam tabung kapiler (3 buah) setinggi 1 cm. Selanjutnya disimpan dalam refrigerator pada suhu 4-100C selama 16 jam. Ikatkan tabung kapiler pada termometer dan masukkan termometer tersebut ke dalam beaker glass (600 ml) berisi air distilasi (sekitar 300 ml). Atur suhu air dalam beaker glass pada suhu 8 – 100C di bawah titik leleh sampel dan suhu air dipanaskan pelan-pelan (dengan kenaikkan 0.50C – 10
Kandungan gliserol bebas (AOCS Official Method Ca 5a-40, 1998)
C/menit) dengan pengadukan (magnetic stirrer). Pemanasan dilanjutkan dan suhu diamati dari saat sampel meleleh sampai sampel naik pada tanda batas atas. Titik leleh dihitung berdasarkan rata-rata suhu dari ketiga sampel yang diamati.
kemudian ditambahkan asam periodat sebanyak 12.5 ml. Labu erlenmeyer dalam keadaan tertutup alumunium foil. Larutan KI 15% ditambahkan ke dalam labu kemudian didiamkan selama kurang lebih 1 menit. Ditambahkan sebanyak 100 ml air destilata ke dalam labu erlenmeyer. Campuran dititrasi dengan menggunakan larutan natrium tiosulfat 0.1 N hingga warna terbentuk warna kuning. Indikator pati ditambahkan sebanyak 2 ml kemudian dititrasi kembali hingga warna kompleks menghilang. Kandungan gliserol bebas dapat dihitung dengan rumus sebagai berikut
((B-S) x N x 2,302)/W
Keterangan : B – volume titrasi blanko (ml) N – konsentrasi sodium tiosulfat (N) S – volume titrasi sampel (ml) W – berat sampel (g)
Analisa Komposisi Gliserida MAG Dengan Kromatografi Gas- MS Pyrolisis (Modifikasi Ralph et al., 1991)
HASIL DAN PEMBAHASAN Sifat Kimia Bahan Baku
Asam laurat yang akan digunakan dalam sintesis monolaurin ini harus memenuhi persyaratan sebagai bahan baku yang meliputi kadar air, kadar asam lemak bebas (ALB), dan bilangan peroksida. Tujuan analisa bahan baku ini adalah untuk melihat mutu asam lemak terhadap karakteristik katalis yang digunakan. Berdasarkan hasil analisis bahan baku, kadar air asam laurat adalah 0,3369 ± 0,017 % (bk). Semakin rendah kadar air yang terkandung dalam bahan baku maka semakin baik, hal ini dikarenakan keberadaan air dalam bahan baku dapat menghidrolisis enzim sehingga mengganggu jalannya reaksi esterifikasi. Kandungan air awal sistem reaksi, jumlah enzim dan rasio mol substrat merupakan faktor-faktor yang sangat penting dalam mempengaruhi hasil esterifikasi (Linko et al., 1995). Kadar asam lemak bebas (ALB) bahan baku adalah 98,9108 ± 0,3389 % , hal ini menunjukkan kandungan asam lemak bebas yang terdapat pada bahan baku 98,9% adalah asam laurat. Bilangan peroksida bahan baku asam laurat adalah 1,226± 0.07 meq O2/kg. Menurut De Greyt et al.
(1997), syarat bilangan peroksida yang terdapat pada bahan baku lebih rendah dari 10 meq O2
Komposisi asam lemak dalam bahan baku asam laurat dapat diketahui kemurniannya dengan gas chromatography (GC). Asam laurat yang digunakan sebagai bahan baku berdasarkan hasil kromatogram GC hanya memiliki satu puncak pada waktu retensi 7,312 (Gambar 29a). Berdasarkan hasil GC kandungan bahan baku adalah 100% asam laurat. Namun, hasil analisis ALB menunjukkan kandungan asam laurat 99%, sedangkan 1% sisanya kemungkinan asam lemak bebas lainnya dikarenakan bahan baku yang digunakan adalah asam lemak teknis. Asam lemak lainnya tidak muncul pada kromatogram GC dikarenakan jumlah yang terlalu kecil sehingga tidak terdeteksi oleh detektor FID.
/kg.
didominasi oleh asam laurat (46-52 %) dan asam miristat (14-17%). Semakin murni bahan baku asam lemak bebas maka reaksi esterifikasi diharapkan dapat berjalan secara optimal, sehingga akan menghasilkan produk MAG yang tinggi.
Selain bahan baku asam laurat, katalis yaitu enzim Novozyme® 435 dianalisis pH dan Aw. Hasil pengukuran pH dan Aw berturut-turut adalah 4,375 ±
0,021 dan 0,62 ± 0,004 pada suhu 29,5oC. Hasil pengukuran Aw enzim tersebut sedikit lebih rendah dari hasil pengukuran penelitian Imelda (1999) dan Pertiwi (1998) yaitu masing-masing 0,672 dan 0,691. Sedangkan pH enzim pada penelitian ini lebih rendah dari pada hasil pengukuran pH enzim penelitian Pertiwi (1998) yaitu 5,4. Berdasarkan info dari Novo Nordisk Bioindustrial Ltd. Novozyme® 435 mempunyai aktivitas inesterifikasi 10000 PLU/g (Propyl Laurate Units/gram). Aktivitas esterifikasi Novozyme® 435 adalah 442,14 mM asam /g.menit (Imelda, 1999). Bentuk granula memiliki ukuran partikel 0,3-0,9 mm dan mempunyai bulk density mendekati 430 kg/m3
Sintesis MAG dengan Reaksi Esterifikasi Secara Batch
. Sedangkan carrier yang digunakan untuk imobilisasi enzim adalah suatu resin acrylic makroporous (Enzymtech, 2011).
Keterangan:
[image:50.595.82.481.77.359.2]A. Jumlah substrat 10 g; B. Jumlah substrat 20 g; C. Jumlah substrat 50 g
Gambar 17 Kadar monoasilgliserol dan rendemen hasil reaksi esterifikasi enzimatis secara batch
Gambar 18 Kromatogram GC-MS pyrolisis produk MAG pada reaksi esterifikasi enzimatis secara batch
[image:51.595.84.518.72.754.2]
Setelah didapatkan formula rasio jumlah substrat dan pelarut terbaik dengan proses batch, kemudian dilakukan konversi proses esterifikasi enzimatis secara circulated packed bed reactor. Reaksi esterifikasi berlangsung secara sirkulasi, dimana reaktor berisi substrat mengalir menuju reaktor enzim yang jumlahnya tetap kemudian kembali ke reaktor substrat sampai waktu dan suhu reaksi tercapai. Reaksi esterifikasi terjadi selama kontak antara enzim dan substrat yang lewat. Waktu dimana molekul melalui reaktor enzim dengan kecepatan alir tertentu disebut residence time (Yang et al., 2005). Levenspiel (1972), menyebutkan bahwa residence/Space time analog dengan waktu reaksi pada sistem batch dan didefinisikan sebagai waktu yang diperlukan untuk mengolah reaktan sebanyak satu volume reaktor pada kondisi tertentu Sedangkan, pada penelitian ini residence time didefinisikan sebagai waktu ketika substrat melewati reaktor enzim sehingga reaksi esterifikasi terjadi ketika substrat kontak dengan enzim. Residence time pada penelitian ini dinyatakan dengan rumus:
untuk menghasilkan MAG yang tinggi. Pada penelitian ini reaksi enzimatis berjalan circulated packed bed reactor dengan sirkulasi hingga tercapai waktu reaksi, kemudian ditampung pada wadah produk.
Reaktor packed bed dibuat berjaket dari bahan gelas dengan volume kerja 15 mililiter kemudian diisi enzim Novozyme®
Pemilihan jenis pelarut merupakan faktor penting dalam reaksi esterifikasi enzimatis, antara lain adalah kelarutan substrat dan produk dalam pelarut, hidrofobisitas pelarut, reaktivitas pelarut, densitas, viskositas, tekanan permukaan, toksisitas, mudah/tidaknya terbakar, masalah pembuangannya ke lingkungan, serta tentunya masalah biaya (Dordick, 1989). Dari berbagai faktor tersebut, yang mendapatkan perhatian sangat besar adalah masalah hidrofobisitas pelarut (Hariyadi, 1995). Jadi, aktivitas katalisis yang tinggi umumnya diamati pada pelarut yang hidrofobik, sementara pelarut yang hidrofilik tidak mendukung munculnya aktivitas katalisis. parameter hidrofobisitas yang dipakai adalah nilai log P dari pelarut yang digunakan. Nilai P diberi batasan sebagai koefisien partisi suatu pelarut pada suatu sistem dua fase yang terdiri dari 1-oktanol dan air (Persamaan 1).
435 sebanyak 4,6 gram. Reaksi esterifikasi enzimatis secara circulated packed bed reactor mula-mula dilakukan berdasarkan hasil konversi proses reaksi esterifikasi secara batch, namun mengalami kesulitan pada saat proses reaksi berlangsung, yaitu ketidaklarutan gliserol. Lipase menunjukkan stabilitas dan aktivitas yang baik pada pelarut hidrofobik dengan 2< log P < 4, seperti n-hexane (Laane et al., 1987), namun pada medium tersebut gliserol tidak larut.
...(1)
...(2)
Nilai log P juga telah diusulkan untuk digunakan sebagai alat untuk menduga posisi baru keseimbangan suatu sistem reaksi dengan menggunakan sistem pelarut yang lain (Hailing, 1990). Pelarut yang digunakan pada penelitian ini adalah heksan dengan nilai log P nya adalah 3,5, sedangkan log P tert butanol adalah 0,4 (Damstrup et al., 2006). Nilai log P dari pelarut yang digunakan pada penelitian ini adalah 1,33. Hal ini berarti pelarut pada penelitian ini cenderung hidrofilik.
Sebelum dimasukkan ke dalam reaktor, substrat dan pelarut direaksikan terlebih dahulu dalam erlenmeyer pada orbital shaker suhu 50o
Campuran reaktan diagitasi selama 15 menit, kemudian dimasukkan ke dalam reaktor reaktan dan dialirkan ke reaktor enzim. Sampling mulai dilakukan pada jam ke-2, karena setelah reaktor beroperasi selama 2 jam mencapai kondisi steady state (Soekopitojo, 2003) dan menurut Yang et al. (2005), komposisi MAG tinggi pada sistem tert butanol sekitar 60-70% diagitasi pada tangki setelah 2 jam reaksi berlangsung. Hasil kadar MAG bisa dilihat pada Gambar 20.
C dan putaran 200 rpm selama ±15 menit, hal ini bertujuan agar asam laurat meleleh dan bereaksi terlebih dahulu dengan gliserol dan pelarutnya sehingga larut sempurna dan telah mencapai suhu reaksi. Namun, selama 55 jam diagitasi dalam orbital shaker gliserol tidak larut. Kemudian uji coba reaksi esterifikasi enzimatis secara circulated packed bed reactor dilakukan dengan kondisi gliserol tidak larut tersebut.
Keterangan:
[image:55.595.125.479.96.314.2](A) Sampling jam ke-2; (B) Sampling jam ke-4; (C) Sampling Hasil Pencucian Reaktor Enzim
Gambar 20 Kromatogram GC reaksi esterifikasi circulated packed bed reactor dengan kondisi gliserol tidak larut
Penumpukan produk pada reaktor enzim karena tertahannya gliserol. Gliserol sering mengikat partikel enzim, sehingga reaksi antara molekul asam laurat dengan enzim menjadi sulit (Yang et al., 2005). Kondisi tersebut akan berdampak pada produk MAG yang tidak konsisten pula. Pada penelitian pendahuluan menggunakan Packed Bed Reactor (PBR) ini bertujuan untuk menentukan kondisi optimum meliputi suhu dan waktu reaksi yang optimum untuk menghasilkan produk MAG yang tertinggi.
yang digunakan lebih banyak sehingga biaya reaksi lebih mahal. Metode II, reaksi dilakukan dengan cara melarutkan gliserol sesuai kondisi reaksi batch yang optimum yaitu dengan meraksikan jumlah substrat 50 gram dan total pelarutnya 440 ml selama 55 jam diagitasi dalam orbital shaker, reaksi ini tetap menunjukkan gilserol yang tidak larut sempurna. Metode III, dilakukan dengan cara mengubah komposisi pelarut saja, sedangkan kondisi reaksi yang lainnya tetap dan dilakukan dengan orbital shaker selama 30 menit. Kelarutan gliserol sempurna diperoleh kurang dari 10 menit dengan metode III.
Percobaan reaksi esterifikasi enzimatis secara circulated packed bed reactor dengan menggunakan komposisi pelarut yang dihasilkan pada metode III, rasio jumlah substrat (1:5 mol/mol) dan pelarut tetap yaitu 1:8,8 sebagai bahan perbandingan dengan reaksi secara circulated packed bed reactor dengan kondisi gliserol yang tidak larut. Hasil uji coba tersebut menunjukkan komposisi MAG pada sampling jam ke-2 dengan 2 siklus (A) sebesar 83,91% dan jam ke-4 dengan 4 siklus (B) sebesar 79,38% (Gambar 21).
Berdasarkan komposisi MAG pada reaksi circulated packed bed reactor baik yang gliserol larut maupun tidak larut memiliki kesamaan yaitu sampling jam ke-2 tinggi sekitar 80%, kemudian reaksi setelah jam ke-4 nya menurun. Oleh karena itu waktu reaksi 2 jam menjadi titik tengah untuk optimasi reaksi, sedangkan suhu 50o
reaksi menunjukkan pada volume reaktan 50 ml menghasilkan komposisi MAG 81,12% dan rendemen 67,17%, sedangkan penggunaan volume reaktan 100 ml menghasilkan komposisi MAG 74,96%, DAG 1,84%, dan rendemen 77,9%. Berdasarkan hasil reaksi esterifikasi, maka tidak ada perbedaan yang nyata dari hasil kromatogram GC. Oleh karena itu untuk efisiensi biaya pelarut maka pada penelitian ini digunakan volume 50 ml.
Keterangan:
A Komposisi Monoasilgliserol pada sampling jam ke-2 B Komposisi Monoasilgliserol pada sampling jam ke-4 C Asam Lemak Bebas pada sampling jam ke-2
[image:57.595.82.513.217.780.2]D Asam Lemak Bebas pada sampling jam ke-4
Optimasi Sintesis MAG dengan Reaksi Esterifikasi Circulated packed bed reactor
Berdasarkan penelitian pendahuluan reaksi esterifikasi circulated packed bed reactor, maka ditentukan kisaran suhu dan waktu untuk memperoleh respon yang optimum dapat dilihat pada Tabel 8. Tahap ini dilakukan dengan mengikuti rancangan Central Composite Design (CCD) dari respon surface methods (RSM) yang memberikan persamaan kuadratik yang dapat menunjukkan pengaruh faktor suhu dan waktu reaksi terhadap respon komposisi MAG, rendemen, jumlah MAG. Seluruh perlakuan terdiri dari 13 unit percobaan dimana setiap perlakuan mengikuti rancangan penelitian yang telah ditentukan sebelumnya pada metode penelitian dan setting perlakuannya dapat dilihat pada Tabel 7.
Tabel 8 Perlakuan dan kode perlakuan untuk menghasilkan respon maksimum
Perlakuan Kode perlakuan
-1,414 -1 0 1 1,414
Suhu 45 oC 46,5 oC 50oC 53,5 oC 55 oC
Waktu 1jam 1,3 jam 2 jam 2,7 jam 3 jam Komposisi 13 unit percobaan dapat dilihat pada Tabel 9. Nilai komposisi MAG, rendemen, dan jumlah MAG yang telah diperoleh dari 13 unit percobaan selanjutnya dianalisis dengan RSM (response surface methods) untuk memperoleh suhu dan waktu reaksi optimum yang menghasilkan komposisi MAG maksimum.
Komposisi MAG merupakan respon yang utama pada penelitian ini. Persamaan model untuk respon MAG sebagai berikut:
Y= - 61,700 + 6,088 X1+3,259 X2 – 0,065 X12 + 0,017 X1X2 – 1,792 X2
Dimana X
2
1 adalah suhu reaksi dan X2 adalah waktu reaksi. Hasil analisis
Tabel 9 Komposisi 13 reaksi esterifikasi pada reaktor Circulated packed bed reactor Kode Suhu Kode Waktu MAG (%) Rendemen
(%) Jumlah MAG
-1 -1 86,75 67,82 1,39
-1 1 79,16 63,04 1,17
1 -1 80,82 60,83 1,16
1 1 73,4 88,79 1,54
-1.414 0 73,94 70,75 1,06
1.414 0 79,04 75 1,39
0 -1.414 79,38 55,65 1,04
0 1.414 77,84 76,78 1,4
0 0 81,72 71,17 1,3
0 0 79,63 73,22 1,34
0 0 79,82 78,64 1,4
0 0 82,9 88,3 1,53
0 0 81,12 67,21 1,69
[image:59.595.114.424.116.355.2]Hasil analisis kanonik menunjukkan bahwa nilai prediksi MAG pada titik stasioner adalah 82,96% (maksimum). Nilai MAG maksimum diperoleh pada suhu 46,92oC dan waktu 1,1 jam.
[image:59.595.87.540.439.717.2]Gambar 22 menunjukkan pengaruh suhu dan waktu reaksi terhadap MAG. Berdasarkan Gambar tersebut tampak kurva pada sumbu Y (waktu reaksi) lebih cembung daripada kurva pada sumbu X (suhu reaksi). Hal ini menunjukkan bahwa pengaruh waktu lebih besar dibanding dengan pengaruh suhu reaksi dalam meningkatkan MAG. Pada sumbu Y tampak MAG akan mencapai maksimum pada waktu reaksi 1,1 jam, namun MAG akan semakin menurun dengan semakin meningkatnya waktu lebih dari 1,1 jam. Pada sumbu X tampak bahwa MAG akan mencapai maksimum pada suhu reaksi 46,92oC, namun akan semakin menurun seiring dengan semakin meningkatnya suhu reaksi yang lebih dari 46,92 o
Gambar 23 adalah kontur dua dimensi MAG. Berdasarkan gambar tersebut tampak titik belok kurva pada sumbu Y (waktu reaksi) lebih tajam dibanding titik belok kurva pada sumbu X (suhu reaksi). Hal ini menunjukkan bahwa pengaruh waktu reaksi lebih besar dalam meningkatkan MAG produk dibanding dengan pengaruh suhu reaksi. Hasil analisis kanonik menunjukkan bahwa MAG pada titik stasioner menunjukkan nilai maksimum yaitu sebesar 82,96%.
C.
Gambar 23 Kontur dua dimensi Optimasi Parameter Komposisi Monoasilgliserol (MAG)
Berdasarkan hasil analisis respon rendemen, persamaan yang dihasilkan adalah sebagai berikut:
Y = 48,859 + 4,639 X1 – 120,524 X2 – 0,104 X12 + 3,340 X1X2 – 9,271 X2
40
42
44
46
48
50
52
54
56
58
60
0
1
2
3
2
Suhu (oC)
Waktu (J
am
Dimana X1 adalah suhu dan X2 adalah waktu reaksi. Hasil analisis ANOVA
menggunakan program SAS menunjukkan bahwa model permukaan tanggap memiliki nilai R2= 0,7137, artinya persamaan ini dapat menjelaskan sekitar 71,37% total variabel bebas yang dipelajari (suhu dan waktu reaksi) terhadap variabel tak bebas (rendemen). Hasil analisis kanonik menunjukkan bahwa nilai prediksi rendemen pada titik stasioner adalah 73,65% (saddle point). Nilai rendemen diperoleh pada suhu 46o
Hasil analisis RSM divisualisasikan dalam bentuk gambar permukaan tiga dimensi dan kontur dua dimensi rendemen seperti tampak pada Gambar 24 dan 25. Gambar 24 menunjukkan pengaruh suhu dan waktu terhadap rendemen. Berdasarkan Gambar 24 terlihat bahwa kurva pada sumbu Y (waktu) lebih cembung dibanding dengan kurva pada sumbu X (suhu). Hal ini berarti pengaruh waktu reaksi lebih besar dari pada suhu reaksi dalam meningkatkan rendemen. Kondisi titik stasioner saddle point menunjukkan karakterisasi dari model permukaan tanggap dimana diduga terdapat dua perlakuan optimum yang dapat menghasilkan rendemen optimum.
[image:61.595.80.533.424.716.2]C dan waktu 1,8 jam.