DI PULAU DERAWAN KALIMANTAN TIMUR
AGUS EKO PRASETYO
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Deteksi dan Identifikasi Fitoplasma yang Berasosiasi dengan Penyakit Layu Kelapa di Pulau Derawan Kalimantan Timur adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Januari 2012
AGUS EKO PRASETYO. Detection and Identification of Phytoplasmas Associated With Coconut Wilt Disease in Derawan Island East Kalimantan. Under direction of KIKIN HAMZAH MUTAQIN and GIYANTO.
Coconut as a main commodity in Derawan Island has two functions, i.e. farmer’s income source and beach plant aesthetics. The occurrence of coconut wilt disease resulted in eradication of about 10% of the palm in 2010. The objectives of this study were: (1) to describe morphological and histopathological symptoms of coconut wilt disease in Derawan island, (2) to detect the presence of phytoplasmas associated with coconut wilt disease in Derawan island using nested-PCR (n-PCR) technique, (3) to identify and classify phytoplasmas associated with coconut wilt disease based on 16S rRNA gene sequences, (4) to detect the presence of phytoplasmas from leafhoppers (Hemiptera: Cicadellidae) and love vein (Cassytha filiformis) (Laurales: Lauraceae),which expected to have ability to transmit the pathogen. The methods in this research included visual and microscopic observation, detection of phytoplasmas with n-PCR method, cloning of the nPCR products, sequencing, analysis of sequencing results using BLAST, construction of phylogenetic tree, and in silico RFLP analysis. The results showed that the suspected phytoplasmas reside in phloem tissues and were detected with both microscopic and molecular techniques. Phytoplasmas associated with coconut wilt disease in Derawan island belong to 16SrII (witches’ broom phytoplasma) and 16SrXI (Ca. Phytoplasma oryzae) groups. The use of nPCR employing R16F2n/R16R2 primer pair with expected amplicon at size of about 1.25 kb are positive not only for particular strain of phytoplasmas but also other bacterial species that mainly belong to Gram Positive group. Phytoplasmas that belong to 16SrII are also detected in some leafhoppers andC. filliformis. Keywords: Coconut wilt disease, phytoplasmas, nested PCR, sequencing,
AGUS EKO PRASETYO. Deteksi dan Identifikasi Fitoplasma yang Berasosiasi dengan Penyakit Layu Kelapa di Pulau Derawan Kalimantan Timur. Dibimbing oleh KIKIN HAMZAH MUTAQIN dan GIYANTO.
Tanaman kelapa di Pulau Derawan bernilai ekonomi sangat tinggi, karena selain sebagai tanaman penghias pantai, juga menjadi satu-satunya tanaman perkebunan yang dibudidayakan. Akhir-akhir ini populasi tanaman kelapa di Pulau Derawan semakin menurun, karena adanya penyakit layu kelapa yang telah mengakibatkan tidak kurang dari 10% tanaman mati. Produktivitas kelapa yang dihasilkan juga sangat menurun. Di Indonesia, penyakit serupa dikenal sebagai layu Kalimantan (Kalimantan wilt) yang disebabkan oleh Candidatus Phytoplasma oryzae dan telah mengakibatkan kerugian yang besar pada pertanaman kelapa di daerah Sampit, Kalimantan Tengah.
Gejala penyakit layu kelapa di Pulau Derawan juga mirip dengan gejala penyakit lethal yellowingyang mematikan dan sangat merugikan tanaman kelapa dan kelapa sawit yang disebabkan oleh Ca. Phytoplasma palmae di daerah Amerika dan Afrika. Ca. Phytoplasma palmae termasuk dalam Organisme Pengganggu Tumbuhan Karantina (OPTK) kelas A1 Badan Karantina Tumbuhan Indonesia. Kekhawatiran bahwa penyebab penyakit tersebut adalah sama dengan penyebab penyakit layu kelapa di Pulau Derawan mendorong penelitian ini dilakukan untuk memastikan identitas patogen penyebabnya. Hal tersebut mempertimbangkan tanaman kelapa dan kelapa sawit yang berpotensi terserang penyakit di Indonesia yang mana luas arealnya menduduki peringkat pertama di dunia.
Metode deteksi dan identifikasi fitoplasma dari penyakit layu kelapa dilakukan melalui dua pendekatan: Pertama, metode konvensional dengan membandingkan morfologi gejala dan histopatologi antara jaringan tanaman yang sakit dengan yang sehat; Kedua, metode deteksi secara molekuler dengan mendasarkan pada gen yang bersifat stabil (conserved) dan paling banyak digunakan sebagai dasar klasifikasi fitoplasma saat ini yakni gen 16S rRNA.
Pembandingan morfologi gejala penyakit dilakukan secara visual terhadap bentuk daun, pelepah, batang, dan buah antara tanaman yang bergejala dengan yang masih sehat, sedangkan studi histopatologi dilakukan dengan membandingkan jaringan pengangkutan terutama floem dari jaringan tanaman yang sakit dan sehat. Studi histopatologi mencakup pewarnaan 4,6-diamino-2-phenylindole (DAPI) pada jaringan floem dan pengamatan mikroskopi fluoresen dan mikroskopi elektron (scanning electron microscope/SEM).
NCBI, analisis filogenetik dengan program PAUP 4.0, dan analisis RFLP in silico menggunakan 17 enzim restriksi yang sering digunakan untuk karakterisasi fitoplasma.
Gejala penyakit layu kelapa di Pulau Derawan adalah daun menguning, pelepah-pelepah maupun daun kelapa yang muncul terlihat lebih pendek daripada yang normal (sehat), daun mengering(klorosis) yang dimulai dari bagian daun yang tua (bawah), pangkal pelepah tua mudahsengkleh(jawa: lunglai pada bagian pangkal pelepah), buah kelapa yang masih muda gugur atau jika masih ada buah kelapa yang tersisa sampai besar dan masak, biasanya hanya 1 atau 2 biji saja. Gejala akhir penyakit ini adalah seluruh pelepah dan daun kelapa mengering, gugur dan terlihat hanya seperti tonggak batang kayu.
Pengamatan pada jaringan pengangkutan batang, akar, dan daun tanaman kelapa bergejala layu dengan pewarnaan DAPI menunjukkan adanya akumulasi fitoplasma pada jaringan pengangkutan floem. Sama halnya pada pengamatan jaringan dengan SEM, sel-sel fitoplasma tampak melekat pada dinding-dinding sel floem, walaupun tidak terlihat menggerombol. Bentuk sel fitoplasma pleomorfik dengan ukuran diameter berkisar antara 0,5–0,9μm.
Hasil PCR dengan primer P1/P7 tidak mampu memperlihatkan fragmen DNA fitoplasma yang berasal dari tanaman kelapa pada gel agarosa, namun hasil nPCR dengan primer R16F2n/R16R2 memperlihatkan adanya fragmen DNA berukuran sekitar 1.25 kb. Semua sampel dari tanaman kelapa bergejala layu ringan dan berat (masing-masing 6 tanaman) dari Pulau Derawan menunjukkan hasil positif dengan nPCR, sedangkan pada tanaman yang belum bergejala hanya 3 dari 6 tanaman yang positif. Setelah dilakukan sequencing dan analisis menggunakan BLAST dari NCBI, diperoleh bahwa 77,78% (dari total 15 tanaman bergejala berat, ringan dan belum bergejala) sekuen DNA produk nPCR sangat mirip dengan beberapa strain fitoplasma dan 23,22% bukan merupakan fitoplasma.
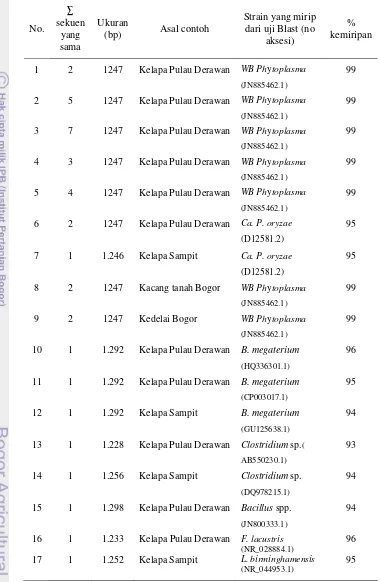
Sebanyak 6 sekuen DNA yang berbeda yang diperoleh dari sequencing, 5 sekuen DNA tergolong ke dalam kelompok witches’ broom phytoplasma (grup 16SrII) dengan nilai homologi 99% terhadap sekuen gen 16S rRNA witches'-broom phytoplasma isolat T4, patogen pada Echinacea purpurea dari Taiwan (JN885462.1), dan satu sekuen tergolong ke dalamCa. Phytoplasma oryzae(grup 16SrXI) dengan nilai homologi 96% terhadap sekuen gen 16S rRNA flower stunt phytoplasma strain BVK, patogen pada Psammotettix cephalotes (HQ589192). Keenam sekuen DNA yang berbeda tersebut mempunyai ukuran yang sama yaitu 1247 bp.
sekuen DNA Kalimantan wilt dari Sampit mempunyai hubungan kekerabatan yang tinggi, tetapi relatif jauh dari witches broom phytoplasma dan Ca. Phytoplasma oryzae. Hasil uji filogenetik ini berbeda dengan hasil BLAST dari NCBI yang menyatakan bahwa Sekuen Derawan 6 dan sekuen Kalimantan wilt dekat denganCa. Phytoplasma oryzae.
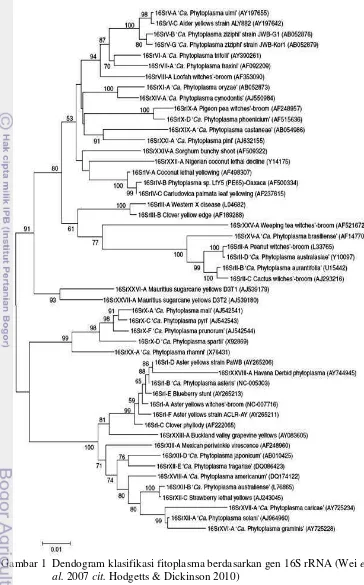
Hasil uji RFLPin silicodari sampel asal Pulau Derawan juga menunjukkan adanya 6 pola potongan fragmen DNA yang berbeda. Bila dibandingkan dengan hasil RFLPin silicoterhadap berbagai grup fitoplasma yang telah dibuat oleh Wei et al. (2007), maka keenam sekuen DNA tersebut mempunyai nilai koefisiensi kesamaan yang tinggi dengan grup 16SrIIA (peanut witches broom phytoplasma) yakni berkisar antara 0,84 – 0,98. Kelompok witches broom phytoplasma yang berasosiasi dengan penyakit layu kelapa ini baru pertama kali dilaporkan.
Hasil deteksi dan identifikasi fitoplasma yang berasosiasi dengan penyakit layu kelapa di Pulau Derawan ini membuktikan bahwa strain fitoplasma yang ditemukan berbeda dengan strain fitoplasma sebagai penyebab penyakit lethal yellowing pada tanaman kelapa dan kelapa sawit. Ini berarti bahwa status Ca. phytoplasma palmae tetap menjadi OPTK A1. Penyakit ini juga diketahui telah mengakibatkan kerugian ekonomis sehingga kewaspadaan akan penyebaran penyakit ke lokasi yang lain perlu menjadi perhatian bagi pemerintah setempat.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
YANG BERASOSIASI DENGAN PENYAKIT LAYU KELAPA
DI PULAU DERAWAN KALIMANTAN TIMUR
AGUS EKO PRASETYO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Kalimantan Timur
Nama : Agus Eko Prasetyo
NIM : A3502090041
Disetujui
Komisi Pembimbing
Dr. Ir. Kikin Hamzah Mutaqin, MSi Ketua
Dr. Ir. Giyanto, MSi Anggota
Diketahui
Ketua Program Studi Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, MSc
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, MScAgr
Puji dan syukur penulis panjatkan kepada Allah Subhanahu Wa Ta’alaatas segala karunia-Nya sehingga penelitian tesis ini berhasil diselesaikan. Judul penelitian yang dilaksanakan pada bulan September 2010 sampai September 2011 ini adalah“Deteksi dan Identifikasi Fitoplasma yang Berasosiasi dengan Penyakit Layu Kelapa di Pulau Derawan Kalimantan Timur”.
Terima kasih penulis ucapkan kepada Dr. Ir. Kikin Hamzah Mutaqin, MSi. dan Dr. Ir. Giyanto, MSi. yang bersedia membimbing penulis dalam melaksanakan penelitian ini serta Dr. Ir. Endang Nurhayati, MS. sebagai Penguji Luar Komisi. Terima kasih penulis ucapkan juga kepada Direktur, Kepala Bidang Penelitian, dan Ketua Kelompok Peneliti Proteksi Tanaman Pusat Penelitian Kelapa Sawit Medan atas ijin melanjutkan studi S2 di IPB beserta segala biaya untuk penelitian tesis. Disamping itu, penghargaan penulis sampaikan kepada Ir. Waimin beserta jajaran Dinas Perkebunan Berau Kalimantan Timur yang telah menemani penulis selama berada di lokasi sampel penelitian, Dr. Sunaryo beserta para peneliti di lingkup Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong yang telah memberikan kesempatan magang dan melakukan penelitian termasuk penggunaan alat penelitian, dan Prof. Naotake Ogasawara beserta staf peneliti dan teknisi di Laboratorium Genomic of Bacterial Cell Function, Nara Institute of Science and Technology (NAIST) Jepang atas segala pemberian fasilitas dana dan bimbingan penelitian melalui program The Japan Society for Promoting Sciences (JSPS). Bagi teman-teman di Laboratorium Bakteriologi, Mikologi, dan Virologi Departemen Proteksi Tanaman IPB atas segala bantuan yang mempermudah jalannya penelitian, penulis juga mengucapkan terima kasih.
Tak lupa, ucapan terima kasih juga disampaikan kepada orang tua, istri, anak, serta seluruh keluarga, atas segala doa dan kasih sayangnya. Bahwa “Keberhasilanku adalah keberhasilan kalian, kelulusanku adalah kelulusan kalian, pencapaianku adalah pencapaian kalian, ijazahku adalah ijazah kalian. Terima kasih atas pengorbanan, dukungan dan cinta yang tiada henti selama ini. Dan maafkan, banyak sekali perasaan dan keinginan kalian yang terabaikan selama 2,5 tahun perjalanan ini, I love you so much”.
Semoga karya tulis ilmiah ini dapat bermanfaat.
Bogor, Januari 2012
Penulis dilahirkan di Magelang pada tanggal 12 Agustus 1982 dari pasangan Hasyim dan Siti Khotimah. Penulis merupakan putra pertama dari lima bersaudara.
Tahun 2000 penulis lulus dari SMA Negeri 1 Muntilan dan pada tahun yang sama lulus seleksi masuk Universitas Gadjah Mada (UGM) pada jurusan Hama dan Penyakit Tumbuhan di Fakultas Pertanian. Gelar Sarjana Pertanian diperoleh pada tahun 2005. Kesempatan untuk melanjutkan ke program magister akhirnya penulis dapatkan dengan lulus seleksi masuk Institut Pertanian Bogor (IPB) pada mayor Fitopatologi, Fakultas Pertanian tahun 2009.
Halaman Ciri Geografis dan Potensi Ekonomis Pulau Derawan ··· 5
Kondisi Pertanaman Kelapa di Indonesia ··· 6
Fitoplasma ··· 7
Gejala Penyakit dan Kisaran Inang ··· 8
Penularan ··· 9
Pengelolaan Penyakit ··· 10
Deteksi dan Identifikasi Fitoplasma ··· 11
Klasifikasi Fitoplasma ··· 12
Klasifikasi Konvensional dan Berdasarkan Gen 16S rRNA dan Gen Lain ··· 12
Kajian Proses Evolusi Fitoplasma ··· 14
AnalisisSequencingdan Filogenetik Fitoplasma ··· 15
BAHAN DAN METODE Tempat dan Waktu ··· 17
Morfologi dan Histopatologi Penyakit Layu Kelapa ··· 17
Pengamatan Morfologi Gejala ··· 17
Pengambilan Contoh Tanaman ··· 17
Pengamatan Jaringan Tanaman dengan Pewarna DAPI ··· 18
Pengamatan Jaringan Pengangkutan Floem dengan SEM ··· 18
Deteksi Fitoplasma denganNested Polymerase Chain Reaction (nPCR) ··· 19
Pengambilan Contoh ··· 19
Ekstraksi DNA dari Tanaman ··· 19
Amplifikasi DNA dengan MetodeNestedPCR ··· 20
Elektroforesis Gel Agarose ··· 20
CloningDNA Fitoplasma ··· 21
Preparasi Sel Bakteri Kompeten ··· 21
Insersi ProdukNestedPCR ke dalam DNA Plasmid ··· 22
Transformasi DNA Plasmid ke Sel Bakteri Kompeten ··· 23
Isolasi Plasmid ··· 24
Sequencingdan Kajian Filogenetik Fitoplasma ··· 26
Analisis HasilSequencing··· 27
Kajian Filogenetik ··· 27
Ekstraksi DNA Fitoplasma dari Tanaman dan Wereng Daun ··· 28
Deteksi dan Identifikasi Fitoplasma ··· 29
HASIL DAN PEMBAHASAN Morfologi dan Histopatologi Penyakit Layu Kelapa ··· 31
Gejala Morfologi Penyakit Layu Kelapa di Pulau Derawan ··· 31
Pengamatan Jaringan Pengangkutan Tanaman dengan Pewarnaan DAPI ··· 33
Pengamatan Jaringan Pengangkutan Floem dengan SEM ··· 35
Deteksi Fitoplasma denganNested Polymerase Chain Reaction (nPCR) ··· 36
Identifikasi dan Karakterisasi Molekuler Fitoplasma dari Kelapa Bergejala Layu di Pulau Derawan ··· 40
SequencingProduk nPCR ··· 40
Analisis Filogenetik ··· 46
Restriction Fragment Length Polymorphisms(RFLP)In Silico ··· 47
Deteksi danSequencingFitoplasma pada Wereng Daun dan TumbuhanCassytha filiformis ··· 50
SIMPULAN DAN SARAN Simpulan ··· 57
Saran ··· 57
DAFTAR PUSTAKA ··· 59
Halaman
1 Komposisi bahan-bahan yang digunakan untuk reaksi insersi
produk nPCR ··· 23
2 Komposisi bahan-bahan yang digunakan untuk PCR koloni ··· 24
3 Komposisi bahan-bahan yang digunakan untuk PCR plasmid ··· 26
4 Komposisi bahan-bahan yang digunakan untuk PCRsequencing ··· 27
5 Data hasilsequencingdan uji BLAST pada NCBI dari produk nPCR contoh tanaman kelapa, kacang tanah, dan kedelai ··· 41
6 Penyakit layu pada tanaman kelapa yang berasosiasi dengan fitoplasma ··· 43
7 Fitoplasma grupwitches broom phytoplasma(16SrII) yang pernah dilaporkan pada beberapa tanaman inang ··· 44
8 Koefisien kesamaan yang diperoleh dari analisis pola RFLPin silicogen 16S rRNA dari 6 sekuen DNA asal Pulau Derawan ··· 49
9 Perbandingan karakteristik spesiesC. filiformisdanCuscutasp. (Nelson 2008)··· 53
Halaman
1 Dendogram klasifikasi fitoplasma berdasarkan gen 16S rRNA (Wei
et al.2007cit.Hodgetts & Dickinson 2010) ··· 16
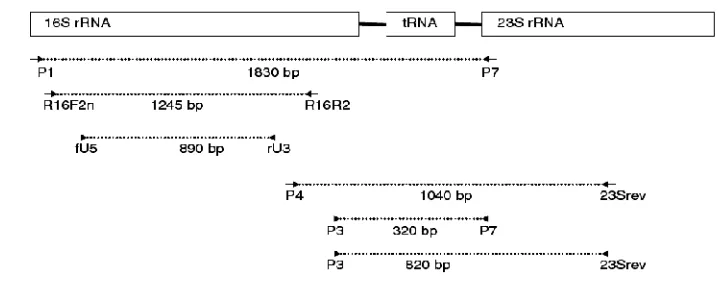
2 Representasi diagram operon 16S–23S rRNA, menunjukkan posisi beberapa primer universal yang telah dikembangkan untuk amplifikasi PCR daerah ini dari fitoplasma ··· 21
3 Gejala penyakit layu kelapa di Pulau Derawan ··· 31
4 Gejala lanjut penyakit layu kelapa di Pulau Derawan ··· 33
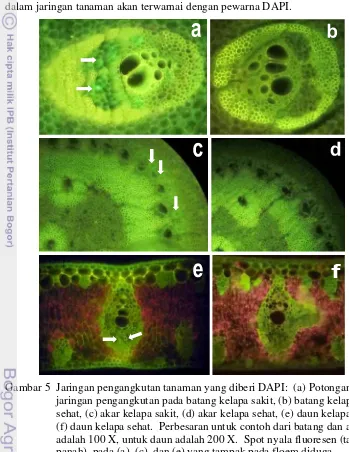
5 Jaringan pengangkutan tanaman yang diberi DAPI ··· 34
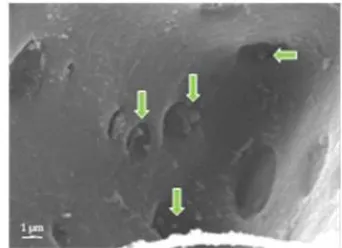
6 Sel floem batang kelapa bergejala layu yang diamati menggunakan SEM ··· 36
7 Fragmen DNA fitoplasma hasil PCR menggunakan primer P1/P7 dari berbagai tanaman ··· 37
8 Fragmen DNA fitoplasma hasil nPCR menggunakan primer R16F2n/R16R2 dari berbagai tanaman ··· 37
9 Pohon filogenetik yang menggambarkan hubungan kekerabatan strain fitoplasma dari contoh yang diuji dengan strain fitoplasma dari setiap grup 16S rRNA yang telah tersimpan di GenBank yang dibuat dengan analisisbootstrap neighbor-joiningprogram PAUP 4.0 ··· 47
10 Ploting hasil analisis RFLPin silicomenggunakan 17 enzim restriksi··· 48
11 Beberapa jenis wereng daun yang ditemukan di sekitar tanaman kelapa bergejala penyakit layu ··· 51
12 Morfologi tanamanCassytha filiformisyang hampir menutupi seluruh permukaan tanaman inang ··· 52
13 TanamanC. filiformispada beberapa tanaman inang ··· 53
Halaman
1 Hasil padanan sekuen gen 16S rRNA dari sampel kelapa Pulau Derawan dan Sampit, kacang tanah dan kedelai menggunakan
program BLAST di NCBI ··· 71
2 Hasil pola fragmentasi grup 16SrII dan 16SrXI fitoplasma dengan 17 enzim restriksi yang dianalisis menggunakan program pDRAW (Wei et al.2007) ··· 82
3 Komposisi larutan-larutan bufer (penyangga) ··· 83
4 Komposisi media pertumbuhan bakteri ··· 85
PENDAHULUAN
Latar BelakangKelapa merupakan komoditi sosial kedua setelah padi di Indonesia dengan luas areal sekitar 3.7 juta ha, setara dengan sepertiga luas penanaman kelapa dunia dan menjadikan Indonesia sebagai negara penanam kelapa terluas di dunia (Deptan 2007). Di Pulau Derawan (Kalimantan Timur), kelapa menjadi satu-satunya tanaman perkebunan yang dibudidayakan. Selain sebagai penambah pendapatan masyarakat, tanaman kelapa di Pulau Derawan juga memiliki fungsi artistik sebagai penambah nilai estetika pantai yang menjadi maskot pariwisata di provinsi tersebut.
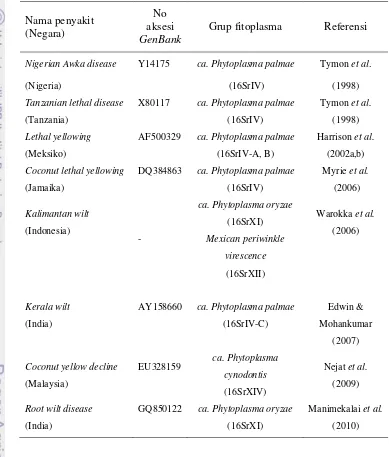
Keberadaan tanaman kelapa di Pulau Derawan mulai berkurang. Faktor utama terjadinya penurunan populasi tanaman ini adalah adanya penyakit layu yang telah mengakibatkan tidak kurang dari 10% tanaman mati (Waimin 9 September 2010, komunikasi pribadi). Selain itu, selama masa inkubasi penyakit, produktivitas tanaman sangat menurun. Di Indonesia, penyakit serupa pada tanaman kelapa dikenal dengan penyakit layu Kalimantan (Kalimantan wilt) yang ditemukan oleh Warokka et al.(2006). Penyakit ini disebabkan oleh fitoplasma dan telah mengakibatkan kerugian yang besar pada pertanaman kelapa di daerah Sampit Kalimantan Tengah.
Menurut Weintraub & Wilson (2010), pada tanaman kelapa, fitoplasma dapat menyebabkan gejala daun menguning sampai klorosis dan berakhir pada kematian tanaman. Tanaman kelapa yang telah menunjukkan gejala penyakit layu akibat fitoplasma umumnya akan mengalami gugur buah muda. Jika satu tanaman telah terinfeksi, maka penyebaran penyakit akan sangat cepat. Sampai saat ini, pengendalian penyakit ini pada tanaman kelapa belum ada yang memuaskan.
daerah Amerika dan Afrika adalahCa. Phytoplasma palmae (Tymon et al.1998, Harrison et al. 2002a, b, Myrie et al. 2006). Strain fitoplasma tersebut terakhir masuk dalam kelas A1 Karantina Tumbuhan karena selain tanaman kelapa, strain ini juga telah diketahui dapat menyerang tanaman kelapa sawit yang saat ini menjadi sumber devisa non migas utama di Indonesia (Utomo & Susanto 2006)
Oleh karena itu, deteksi dan identifikasi fitoplasma sebagai penyebab penyakit layu kelapa di Pulau Derawan sangat penting dilakukan untuk mencegah perluasan penyakit yang dapat menjadi ancaman bagi kebun kelapa dan kelapa sawit. Jika penyebab penyakit telah diketahui, maka penyusunan strategi pengendalian penyakit akan lebih tepat. Pengklasifikasian berdasarkan karakteristik molekuler gen 16S rRNA antar strain fitoplasma yang ditemukan dan kemudian dibandingkan dengan data yang telah didepositkan di GenBank akan membantu menganalisis asal patogen ini dan kemungkinan adanya penularan fitoplasma dari tanaman kelapa ke kelapa sawit. Metode deteksi yang digunakan untuk mengetahui keberadaan fitoplasma pada tanaman kelapa adalah nested polymerase chain reaction (nPCR) menggunakan beberapa pasang primer universal fitoplasma.
Tujuan Penelitian
Penelitian ini bertujuan untuk:
1. Menunjukkan gejala morfologi dan histopatologi penyakit layu kelapa di Pulau Derawan.
2. Menunjukkan asosiasi fitoplasma dengan penyakit layu kelapa di Pulau Derawan menggunakan teknik deteksinestedPCR.
3. Mengidentifikasi dan membuat hubungan kekerabatan fitoplasma yang berhubungan dengan penyakit layu kelapa di Pulau Derawan dengan fitoplasma yang telah tersimpan di GenBank berdasarkan sekuen gen 16S rRNA.
Manfaat Penelitian
TINJAUAN PUSTAKA
Ciri Geografis dan Potensi Ekonomis Pulau Derawan
Pulau Derawan terletak di Kecamatan Pulau Derawan, Kabupaten Berau Kalimantan Timur. Pulau ini memiliki dataran pantai bertopografi datar dengan pantai pasir memiliki kemiringan lereng sekitar 7° - 11° dan lebar 13,5 - 20 meter (Pemrov Kaltim 2011). Secara geografis, pulau ini terletak diantara 116osampai 119oBujur Timur dan 1osampai dengan 2,33oLintang Utara (Disbun Berau 2009).
Pulau Derawan mempunyai potensi laut yang sangat kaya yang dicirikan dengan keindahan taman laut dan keanekaragaman biota laut, serta menjadi daerah konservasi penyu hijau menduduki posisi ke tiga di dunia. Pulau ini telah dicalonkan untuk menjadi Situs Warisan Dunia UNESCO sejak tahun 2005. Sebagai lokasi wisata, pulau ini kini dikelola oleh PT. Bhumi Manimbora Interbuana sejak 1993 dan telah dilengkapi dengan cottages, restoran,speed boat serta perlengkapan selam lainnya, sehingga menjadi salah satu maskot pariwisata perairan Kalimantan Timur (Pemprov Kaltim 2011).
Pulau Derawan memiliki potensi sumber daya alam dan letak yang strategis, yang dapat dikembangkan menjadi suatu kegiatan usaha unggulan. Potensi tersebut terutama pada sektor perkebunan dalam penyediaan bahan baku pengembangan Agroindustri. Tanaman kelapa yang menjadi satu-satunya komoditi perkebunan yang dibudidayakan di Pulau Derawan, selain berfungsi sebagai tanaman penghias bibir pantai, juga sering dimanfaatkan untuk diambil buah muda maupun kopra (Disbun Berau 2009).
Provinsi Kalimantan Timur dan Dinas Perkebunan Kabupaten Berau bekerjasama dengan Puslit Kelapa Manado dan Puslit Kelapa Sawit Medan untuk melakukan sosialisasi mengenai penyakit layu kelapa kepada masyarakat di Kepulauan Derawan pada tahun 2009 (Pemprov Kaltim 2011).
Kondisi Pertanaman Kelapa di Indonesia
Kelapa (Cocos nucifera L.) adalah tanaman monokotil tropis dari Famili Palmae yang sangat dikenal masyarakat Indonesia. Tanaman ini merupakan komoditas strategis yang memiliki peran sosial, budaya, dan ekonomi dalam kehidupan masyarakat Indonesia. Manfaat tanaman kelapa tidak saja terletak pada daging buahnya yang dapat diolah menjadi santan, kopra, dan minyak kelapa, tetapi seluruh bagian tanaman kelapa mempunyai manfaat yang besar. Demikian besar manfaat tanaman kelapa sehingga ada yang menamakannya sebagai "pohon kehidupan" (the tree of life) atau "pohon surga" (a heaven tree) (Deptan 2007).
Menurut Cook, Beccari, dan Herjerdhal, tanaman kelapa berasal dari Amerika Selatan. Namun Berry, Werth, Mearil, Mayurathan, Lepesma, dan Pureseglove menyebutkan bahwa tanaman ini berasal dari Asia atau Indo Pasifik (Suhardiono 1993). Tanaman kelapa yang sering dibudidayakan dibagi menjadi tiga: (1) Kelapa dalam, misalnya varietas Viridis (kelapa hijau), Rubescens (kelapa merah), Marcocorpu (kelapa kelabu), dan Sakarina (kelapa manis), (2) Kelapa genjah, misalnya varietas Eburnea (kelapa gading), Regia (kelapa raja), Pumila (kelapa puyuh), dan Pretiosa (kelapa raja malabar), (3) Kelapa hibrida (Warisno 1998).
Areal penanaman kelapa di Indonesia terdapat di hampir seluruh wilayah negeri, yaitu di Sumatera dengan areal 1,20 juta ha (32,90%), Jawa 0,903 juta ha (24,30%), Sulawesi 0,716 juta ha (19,30%), Bali, NTB, dan NTT 0,305 juta ha (8,20%), Maluku dan Papua 0,289 juta ha (7,80%), dan Kalimantan 0,277 juta ha (7,50%). Kelapa diusahakan petani baik di kebun maupun pekarangan rumah (Deptan 2007).
(16,0%), Sri Langka (3,7%) dan Thailand (3,1%) (Deptan 2007). Menurut Allorerung & Hossang (2003), luas areal perkebunan kelapa sekitar 3,74 juta ha dengan 96,60% pertanaman kelapa dikelola oleh petani dengan rata-rata pemilikan 1 ha/kepala keluarga. Tanaman ini dibudidayakan secara monobiakan, kebun campuran atau sebagai tanaman pekarangan.
Namun demikian, dari segi produksi ternyata Indonesia hanya menduduki posisi kedua setelah Filipina. Ragam produk dan devisa yang dihasilkan Indonesia juga di bawah India dan Sri Lanka. Perolehan devisa dari produk kelapa mencapai US$ 229 juta atau 11% dari ekspor produk kelapa dunia pada tahun 2003 (Deptan 2007).
Rendahnya produktivitas kelapa di Indonesia ini salah satunya disebabkan oleh kurang intensifnya pengelolaan kebun oleh petani. Banyak dari perkebunan kelapa yang ada hanya bersifat usaha sampingan. Pengelolaan kebun yang dimaksud termasuk juga dalam hal manajemen pengendalian hama dan penyakit. Sebagai tanaman tropis, kelapa masih cukup rentan dengan adanya berbagai serangan hama dan penyakit (Deptan 2007).
Fitoplasma
Nama fitoplasma mulai diusulkan oleh Sears & Kirkpatrick (1994) karena sifatnya hanya sebagai patogen yang menyerang tumbuhan. Sebelumnya patogen ini disebut mycoplasma-like organism (MLO) berdasarkan pengamatan menggunakan mikroskop elektron pada jaringan floem tanaman oleh peneliti di Jepang, yaitu Doi et al. pada tahun 1967 yang mirip dengan mikoplasma pada hewan. Bahkan sebelum itu, karena sifat gejala penyakit dan cara penularannya patogen ini dianggap sebagai virus (Kirkpatrick 1989). Fitoplasma merupakan bakteri tanpa dinding sel (Bertaccini 2007, Hogenhoutet al.2008). Bentuk selnya adalah polimorfik dengan distribusi berada pada jaringan floem. Fitoplasma belum bisa dibiakankan pada media buatan serta perkembangbiakannya sangat tergantung pada tanaman inang dan serangga vektor inang. Oleh karena itu, fitoplasma termasuk patogen obligat (Leeet al.2000).
fitoplasma). Sistem klasifikasi fitoplasma baru didasarkan pada karakteristik molekuler yaitu gen 16S rRNA (Zhaoet al.2010) dan gen selain gen 16S rRNA seperti gen Intergenic Spacer Region (ISR) antara gen 16S–23S rRNA, gen Tuf, genRibosomal Protein(rp), genSecY,dan gen SecA(Leeet al.2010, Hodgetts & Dickinson 2010).
Gejala Penyakit dan Kisaran Inang
Fitoplasma telah diketahui menyebabkan penyakit pada ratusan spesies tanaman (Bertaccini 2007, Hogenhout et al. 2008). Secara umum, tipe gejala penyakit yang disebabkan oleh fitoplasma meliputi filodi (perubahan warna bagian tanaman menjadi hijau yang pada umumnya tidak berwarna hijau), virescen (bagian yang seharusnya menjadi bunga, tumbuh menjadi daun), sapu (pertumbuhan tunas yang berlebihan dari satu titik tumbuh), pertambahan abnormal jumlah akar sekunder (akar rambut), penghambatan pembungaan, kerdil dan klorosis (Bertaccini 2007, Hogenhoutet al.2008). Gejala penyakit ini terjadi karena terganggunya sistem fotosintesis terutama transpor fotosintat dan konduktansi stomata, ketidakseimbangan hormon pertumbuhan, metabolisme senyawa sekunder, dan perubahan nutrisi pada berbagai bagian tanaman (Marcone 2010).
Pada tanaman palma, patogen ini telah dilaporkan menyerang lebih dari 30 jenis tanaman palma inang (Alvarez et al. 2005). Daftar genus tanaman palma yang termasuk ke dalam spesies yang rentan terhadap lethal yellowing akibat fitoplasma adalah: Allogoptera, Arenga, Arikuryroba, Borassus, Caryota, Chrysalidocarpus, Cocos, Corypha, Dictyosperma, Gaussia, Hyophorbe, Latania, Livistona, Mascarena, Nannorrops, Phoenix, Pritchardia, Trachycarpus dan Veitchia(Harrison & Elliot, 2006).
et al.2005), Mesir (Ammaret al.2005) dan Tanzania. Di Amerika Utara, patogen ini telah menyerang tanaman kelapa di Semenanjung Yucantan Meksiko (Aguilar et al. 2009), Florida, Miami dan Texas Amerika Serikat serta pulau Key West Kuba. Di Amerika Tengah, penyakit karena fitoplasma ini terjadi di pulau Cayman, Bahamas, Kuba, Republik Dominika, Haiti, Honduras dan Jamaika. Di Asia, beberapa peneliti telah melaporkan keberadaan patogen ini di India (Sharmilaet al.2004), Malaysia (Nejatet al.2009) dan Indonesia (Warokkaet al. 2006).
Kerugian ekonomi yang diakibatkan oleh penyakit ini sangat besar. Triki et al. (2003) melaporkan bahwa di Nefta oasis, persentase kematian tanaman meningkat dari 12% pada tahun 1987 menjadi 50% pada tahun 1994. Survey juga menunjukkan bahwa jumlah tanaman kelapa di Tunisia yang terinfeksi fitoplasma sejumlah 4.700 tanaman pada tahun 1987 meningkat menjadi 36.000 tanaman pada tahun 2002. Penyakit ini juga secara signifikan menurunkan jumlah tanaman kelapa di Florida dan Karibia (Harrison & Elliot 2006).
Pada tanaman kelapa, gejala penyakit karena fitoplasma yang paling khas adalah menguningnya daun-daun dari bawah (yang tua) dan merembet naik ke daun yang lebih muda (Harrison & Elliot 2006). Perkembangan generatif tanaman yang terserang fitoplasma juga menjadi terhambat. Gejala lanjut adalah gugurnya daun dan buah oleh produksi asam absisat dan etilen yang tinggi (Marcone 2010). Tingkat kemunculan gejala sampai kematian tanaman tergantung dari ketahanan tanaman, konsentrasi dan tingkat virulensi patogen.
Penularan
Fitoplasma merupakan patogen sistemik yang hanya ditemukan pada jaringan floem (jaringan vaskuler yang mengangkut sari-sari makanan) pada tanaman dan di dalam tubuh serangga vektor. Di luar tanaman ataupun serangga vektor, patogen ini tidak dapat hidup (Hogenhoutet al.2008).
dan menyebarkan ke tanaman sehat (Hogenhoutet al.2008). Penularan fitoplasma oleh serangga vektor bersifat persisten dan propagatif yaitu selama vektor masih aktif hidup, patogen memperbanyak diri di dalam saluran pencernaan tengah dan saluran peredaran darah serangga hingga menuju kelenjar salivari sebelum ditransfer melalui penghisapan makanan pada tanaman inang yang baru (Fletcher et al.1998).
Serangga vektor yang terlibat dalam penularan fitoplasma adalah wereng (ordo Hemiptera) terutama wereng daun (famili Cicadellidae), wereng batang (famili Fulgoroidea), dan serangga psyllids (famili Psyllidae) (Mitchell 2004, Weintraub & Beanland 2006). Mathen et al. (1990) melaporkan bahwa Stephanitis typica (Distant) dewasa menjadi vektor penting fitoplasma pada tanaman kelapa dengan masa inkubasi 13-18 hari dan 5 hari akses periode akuisisi. Vektor Myndus crudus dewasa menyerang tanaman kelapa (Cocos nucifera) dan tanaman Palma yang lain, sedangkan stadia larva menyerang tanaman rumputan yang tumbuh di sekitar tanaman Palma khususnya rumput St Augustine (Stenotaphrum secundatum) (Howard, 1990). Vektor ini yang menyebabkan perpindahan patogen dari India ke Negri Karibia (Ogle & Harries, 2005).
Pengelolaan Penyakit
Pengendalian penyakit fitoplasma pada tanaman kelapa maupun pada tanaman lain belum ada yang efektif. Metode pengendalian yang paling baik bersifat preventif meliputi penggunaan bahan tanaman yang bebas dari patogen, penggunaan tanaman resisten, dan manajemen serangga vektor. Namun demikian, tanaman kelapa resisten fitoplasma masih sebatas pengujian ketahanan pada varietas kelapa tertentu sedangkan serangga vektor umumnya memiliki kisaran inang yang cukup luas sehingga menyulitkan pengendalian. Penggunaan tanaman resisten terhadap fitoplasma merupakan solusi jangka panjang sedangkan pengendalian serangga vektor dengan aplikasi insektisida juga tidak cukup mengurangi daya sebar penyakit (Weintraub & Wilson 2010).
kimiawi dengan aplikasi antibiotik oxytetracycline HCl melalui injeksi batang ternyata tidak dapat membunuh fitoplasma tetapi hanya mampu mengurangi atau menekan populasi fitoplasma dalam tanaman sampai pada batas yang tidak merusak. Ketika injeksi antibiotik dihentikan, populasi fitoplasma kembali meningkat sehingga gejala penyakit akan berkembang kembali. Tanaman kelapa yang telah terserang sebaiknya dieradikasi, tetapi karena penyebaran penyakit dapat terjadi dengan cepat maka kehilangan hasil produksi bisa mencapai 100% (Harrison & Elliot 2006).
Deteksi dan Identifikasi Fitoplasma
Akhir-akhir ini deteksi dan identifikasi fitoplasma lebih didasarkan pada karakteristik molekuler, khususnya terhadap gen 16S rRNA (Alvarez et al.2005, Zhaoet al.2010). Klasifikasi pendahuluan pada fitoplasma yang belum diketahui dapat dilakukan menggunakan analisis randomly fragment length polymorphism (RFLP) dari hasil amplifikasi fragmen DNA dengannested PCR pada daerah 16S rRNA dan kemudian dibandingkan dengan grup 16S rRNA fitoplasma yang sudah ada (CIAT 2002, 2004, Alvarez et al. 2003, 2004). Fragmen hasil amplifikasi (amplikon) kemudian disekuen dan didepositkan ke GenBank sebagai referensi bagi peneliti yang lain (Sharmillaet al.2004).
Nested PCR menjadi pilihan yang paling tepat untuk mengamplifikasi daerah 16S rRNA dengan menggunakan pasangan primer universal yang kemudian diikuti dengan pasangan primer produk hasil PCR yang pertama. Nested PCR didesain memiliki sensitifitas yang tinggi dan spesifik untuk amplifikasi fitoplasma. Teknik ini digunakan untuk mengantisipasi sedikitnya jumlah patogen yang ditemukan pada jaringan floem (Lee et al.1994, Gundersen & Lee 1996, Ammaret al.2005, Nejatet al.2009).
jaringan merismatik contoh, meliputi petiole daun yang masih sangat muda, daerah di bawah titik tumbuh, ujung akar, bunga jantan dan daun tombak. Konsentrasi paling tinggi ditemukan pada petiole daun yang belum membuka/daun tombak, ujung akar dan daerah di bawah titik tumbuh.
Klasifikasi Fitoplasma
Klasifikasi Konvensional dan Berdasarkan Gen 16S rRNA dan Gen Lain
Klasifikasi fitoplasma berdasarkan metode konvensional, yaitu lebih banyak didasarkan atas sifat-sifat fenotip terutama pada gejala penyakit tanaman yang ditimbulkan, masih belum memuaskan. Suatu fitoplasma dapat menyebabkan perbedaan gejala penyakit pada tanaman yang berbeda atau gejala penyakit yang sama dapat disebabkan oleh fitoplasma yang berbeda (Leeet al. 2000). Metode ini juga dinilai kurang efektif karena fitoplasma termasuk dalam patogen obligat sehingga sangat sulit dibiakan dalam media buatan. Kesulitan ini mengakibatkan proses determinasi status taksonomi dengan serangkaian uji morfologi, fisiologi dan biokimia dalam media buatan seperti halnya pada kelompok bakteri yang lain menjadi rumit (Murray et al. 1990). Oleh karena itu, pendekatan molekuler dibutuhkan untuk menjadi acuan utama dalam studi klasifikasi fitoplasma saat ini. Klasifikasi fitoplasma secara molekuler berdasarkan pada data sekuen genomik dapat dilakukan tanpa membutuhkan biakan bakteri hidup (Leeet al.2010).
Sampai saat ini, klasifikasi dan penamaan spesies fitoplasma utamanya didasarkan pada gen 16S rRNA yang sebagian besar peneliti mengacu pada sistem taksonomi untuk bakteri yang tidak dapat dibiakankan (Murray & Schleifer 1994). Penamaan patogen baru sebatas kandidat fitoplasma (Ca. Phytoplasma). Kini
telah diketahui 28 spesies ‘Ca. Phytoplasma’ yang telah dinamai berdasarkan pada kriteria yang direkomendasikan oleh International Research Program on Comparative Mycoplasmology, Phytoplasma/ Spiroplasma Working Team – Phytoplasma Taxonomy Group(IRPCM 2004).
untuk pembedaan yang tepat antar strain fitoplasma. Hal ini dibuktikan dengan adanya beberapa subgroup dari satu strain yang mempunyai sifat biologi yang berbeda (Zaoet al.2010).
Nilai ambang kesamaan antar sekuen gen 16S rRNA adalah 97.5%. Nilai ini direkomendasikan oleh International Research Program for Comparative Mycoplasmology, Phytoplasma/Spiroplasma Working Team(IRPCM 2004) untuk
memisahkan dua spesies ‘Ca. Phytoplasma’. Namun demikian, nilai ini tidak dapat digunakan secara sembarangan sebagai pedoman untuk menentukan spesies baru. Hal ini karena gen 16S rRNA bersifat sangat stabil sehingga mengecualikan banyak strain fitoplasma yang berbeda secara ekologi dan biologi. Spesifikasi spesies fitoplasma baru juga membutuhkan tambahan properti biologi seperti hubungannya dengan tanaman inang dan vektor (Leeet al.2010).
Penggunaan sistem banyak gen akan memberikan kriteria molekuler untuk klasifikasi fitoplasma sampai tingkat spesies dan strain yang lebih baik. Kelemahan sistem berdasarkan gen 16S rRNA sebagai sistem klasifikasi strain fitoplasma akan tertutupi dengan penambahan marka-marka molekuler lain sebagai parameter baru. Beberapa marka molekuler, selain gen 16S rRNA, telah berhasil diidentifikasi dan menunjukkan hasil yang lebih baik dalam mengklasifikasikan strain ekologis patogen tersebut (Hodgetts & Dickinson 2010).
Beberapa marka molekuler mempunyai potensi lebih besar untuk mendukung gen 16S rRNA sebagai parameter standar filogenetik tambahan, khususnya dalam mengetahui hubungan kekerabatan strain dengan sifat ekologi dan biologi tertentu. Kombinasi gen 16S rRNA dengan satu atau lebih variabel gen atau fragmen DNA, 16S rRNA dan SecY, 16S rRNA dan rp atau 16S rRNA dan SecA, terbukti cukup untuk menjelaskan dengan jelas hubungan kekerabatan antar strain (Leeet al.2004, Martiniet al.2007, Hodgetts et al.2008). Gen 16S rRNA dan ISR juga memberikan pemisahan antar strain yang lebih baik yang tidak didapat apabila hanya menggunakan gen 16S rRNA (Langer & Maixner 2004).
et al. 2008, Tran-Nguyen et al. 2008). Namun demikian, masih banyak proyek sequencinggenom fitoplasma yang sedang dalam proses. Kompilasi dari genom-genom ini akan memberikan kecocokan gen tambahan dari marka molekuler yang akan menjadi pilihan untuk klasifikasi fitoplasma pada tingkatan strain, spesies, genus dan populasi. Oleh karena itu, sistem klasifikasi fitoplasma sampai saat ini kebanyakan masih berdasarkan gen 16S rRNA (Leeet al.2010).
Kajian Proses Evolusi Fitoplasma
Lebih dari 1500 strain fitoplasma telah dikarakterisasi dan diidentifikasi berdasarkan pada sekuen gen 16S rRNA dalam dekade terakhir. Analisis filogenetik berdasarkan ketersediaan gen 16S rRNA dari berbagai strain fitoplasma di GenBank membuktikan bahwa fitoplasma mempunyai nenek moyang sama dengan Acholeplasma spp. dan kemudian menjadi beragam dari spesies ini (Weiet al.2007, 2008, Zhaoet al.2009).
Fitoplasma merupakan patogen yang ditularkan oleh serangga dan mempunyai kemampuan untuk berkembangbiak pada serangga vektor dan tanaman inang (Leeet al.2000). Karenanya strain fitoplasma mudah terpengaruh (spesifik) oleh jenis serangga dan tanaman tertentu. Termasuk strain dalam subgroup 16Sr, selektifitas masing-masing strain fitoplasma telah memudahkan proses evolusi dan atau isolasi populasi atau strain fitoplasma tertentu sepanjang waktu. Bahkan, distribusi spesies tanaman inang dan serangga vektor yang berbeda-beda diduga juga akan mempengaruhi proses isolasi geografis strain fitoplasma (Leeet al.2010).
strain ‘Ca. Phytoplasma asteris’) dapat menyebabkan penyakit yang berbeda dan menginduksi gejala yang berbeda (Leeet al.2004).
AnalisisSequencingdan Filogenetik Fitoplasma
Kemajuan studi filogenetik dan penyempurnaan proyek sequencing sejumlah genom dari bakteri yang dapat dibiakan telah mendeterminasikan keragaman genomik dalam hubungannya dengan kenampakan fenotipik kingdom bakteri. Hasilnya, pandangan taksonomi modern dalam dunia prokariot telah berubah (Woese et al. 1980, Murray et al. 1990, Brown et al. 2007). Terdapat kesepakatan bahwa gen 16S rRNA akan digunakan sebagai parameter filogenetik utama untuk spesifikasi bakteri sehingga menggantikan prosedur konvensional berdasarkan homologi DNA–DNA (http://www.bergeys.org/; Brownet al.2007).
BAHAN DAN METODE
Tempat dan WaktuPengambilan contoh tanaman dilakukan di Pulau Derawan Kab. Berau Kalimantan Timur dan sebagai pembanding digunakan contoh tanaman kelapa dari perkebunan kelapa di daerah Sampit Kalimantan Tengah dan contoh tanaman kedelai dan kacang tanah sakit dari Bogor Jawa Barat. Penelitian mencakup dua tahap, yaitu pengujian histopatologi dan molekuler. Pengujian histopatologi dilaksanakan di Laboratorium Anatomi Tumbuhan Pusat Penelitian Biologi Lembaga Ilmu Pengetahuan Indonesia (LIPI) Cibinong dan Laboratorium Nematologi Departemen Proteksi Tanaman (PTN) - Fakultas Pertanian - Institut Pertanian Bogor (PTN Faperta IPB). Pengujian molekuler dilaksanakan di Laboratorium Bakteriologi Tumbuhan PTN Faperta IPB dan di Laboratorium Genomic of Bacterial Cell Function - Bacterial System Division - Graduate School of Biological Science - Nara Institute of Science and Technology(NAIST) Jepang. Penelitian ini dilaksanakan pada bulan September 2010 sampai bulan September 2011.
Morfologi dan Histopatologi Penyakit Layu Kelapa
Pengamatan Morfologi Gejala
Deskripsi tanaman kelapa yang bergejala dilakukan secara visual dengan melihat morfologi batang, pelepah, daun, bunga, dan buah. Morfologi tanaman sakit dibandingkan dengan tanaman yang masih sehat secara visual. Beberapa tanaman yang sakit juga dipotong untuk mempermudah mendapatkan contoh batang atas, daun, bunga, maupun buah. Gejala penyakit layu kelapa di Pulau Derawan umumnya tampak pada tanaman dengan umur di atas 15 tahun (Waimin 9 September 2010, komunikasi pribadi).
Pengambilan Contoh Tanaman
Batang tanaman diperoleh dengan cara mengebor tanaman menggunakan bor besi yang berlubang sehingga hasilnya seperti pensil kayu berdiameter 0,5 cm. Contoh batang ini kemudian dipotong-potong dengan panjang 0,5 cm dengan memperhatikan letak jaringan pengangkutannya. Contoh akar yang digunakan juga dipotong-potong dengan ukuran 0,5 cm. Sedangkan untuk contoh daun, digunakan daun kelapa muda yang sudah membuka.
Pengamatan Jaringan Tanaman dengan Pewarna DAPI
Studi histopatologi terutama pada jaringan pengangkutan floem dilakukan dengan menggunakan pewarnaan 4,6-diamino-2-phenylindole (DAPI). Jaringan akar, batang, dan daun dipotong sepanjang 0,5 cm kemudian difiksasi dengan larutan glutaraldehid (5% dalam 0,1 M bufer fosfat pH 7) dan disimpan di dalam lemari es suhu 5oC. Selanjutnya jaringan tanaman tersebut dicuci dengan 0,1 M bufer fosfat dan jaringan siap dipotong denganfreezing microtome setebal 10-25 µm. Hasil potongan diletakkan di atas gelas objek kemudian diwarnai dengan cara meneteskan larutan DAPI (0,1 mg DAPI dalam 100 ml bufer fosfat) dan disimpan selama 30 menit pada ruangan gelap. Gelas objek selanjutnya ditutup dengan gelas penutup, pinggirnya diberi cat kuku jernih. Pengamatan jaringan pengangkutannya menggunakan mikroskop fluoresens (Olympus BX51) segera atau kurang dari 48 jam (Schaadet al. 2001).
Pengamatan Jaringan Pengangkutan Floem dengan SEM
Pengamatan morfologi dan keberadaan fitoplasma juga dilakukan dengan menggunakan scanning electron microscope (SEM). Jaringan batang dipotong sepanjang 0,5 – 1 cm kemudian difiksasi dengan 6% larutan glutaraldehid serta 2% OsO4. Selanjutnya potongan batang tersebut diwarnai dengan 2% larutan
absolut beberapa kali dan diletakkan pada pengering bertekanan sampai titik kritis. Contoh tersebut kemudian diinfiltrasi dengan larutan CO2 sampai kering
titik kritis serta dilapisi dengan 5 nm karbon dan 20 –25 nm emas di dalam mesin pengering berputar, kemudian diamati dengan SEM terutama pada sel floem (Musetti & Favali 2004).
Deteksi Fitoplasma denganNested Polymerase Chain Reaction(nPCR)
Pengambilan Contoh
Tanaman yang dijadikan contoh adalah tanaman kelapa yang menunjukkan gejala penyakit layu ringan (daun menguning dan mulai klorosis), gejala penyakit layu berat (daun klorosis, mengering dan tidak memproduksi buah), dan tanaman yang tidak bergejala penyakit. Contoh yang diambil berupa serbuk batang dengan cara mengebor pada ketinggian sekitar 1 meter dari permukaan tanah sedalam 15-20 cm (Oropeza et al. 2002). Serbuk batang yang keluar dari mata bor dikumpulkan dan ditempatkan pada botol sebagai bahan baku ekstraksi DNA. Setiap pengeboran contoh selanjutnya, ujung mata bor disterilisasi dengan alkohol 70% dan aquades steril. Jumlah contoh yang diambil pada setiap jenis tanaman adalah 6 tanaman dan 3 ulangan. Sebagai kontrol positif terhadap primer dan metode amplifikasi, digunakan contoh tanaman kelapa pada penyakit layu Kalimantan di Sampit Kalimantan Tengah dan beberapa contoh tanaman kacang tanah dan kedelai yang terserang penyakit sapu.
Ekstraksi DNA dari Tanaman
kloroform-isoamilalkohol untuk supernatan yang terbentuk. Selanjutnya DNA dipresipitasi dengan isopropanol dingin 0,6 ml kemudian disentrifugasi 10000 g suhu 4 oC selama 7 menit. Supernatan dibuang, sedangkan pelet DNA yang terbentuk dicuci dengan ethanol 70% dingin dua kali. Pelet DNA disuspensi dalam 0,1 ml bufer TE dan disimpan pada suhu -20oC.
Amplifikasi DNA dengan MetodeNestedPCR
DNA hasil ekstraksi diamplifikasi berturut-turut menggunakan dua pasang primer universal fitoplasma,P1 (5’-AAG AGT TTG ATC CTG GCT CAG GAT T-3’) (Deng & Hiruki 1991) / P7 (5’-CGT CCT TCA TCG GCT CTT-3’) dan dilanjutkan dengan pasangan primer R16F2n (5’-GAA ACG ACT GCT AAG ACT GG-3’) / R16R2 (5’-TGA CGG GCG GTG TGT ACA AAC CCC G-3’)
(Gundersen & Lee 1996). Reaksi PCR dilakukan pada volume 10µl yang terdiri dari 1µl template DNA, 1µl 2 mM dNTPs; 0,6µl 25 mM MgSO4; 1µl primer forward (2 pmol); 1 µl primer reverse (2 pmol); 0,1 µl Taq KOD plus Neo (TOYOBO Bio-Technology, CO., LTD.); dan 4,3 µl dH2O. Posisi pasangan
masing-masing primer universal ditunjukkan pada Gambar 2. Pada proses PCR yang pertama dengan pasangan primer P1/P7, siklus pemanasan adalah denaturasi awal 94oC selama 2 menit; denaturasi 94oC selama 15 detik, penempelan primer 54oC selama 30 detik, ekstensi 68oC selama 1 menit 30 detik sebanyak 35 siklus. Sejumlah 1µl hasil PCR pertama ini digunakan sebagaitemplate (cetakan) untuk PCR kedua dengan pasangan primer R16F2n/R16R2. Siklus pemanasan PCR kedua sama dengan PCR pertama, hanya berbeda pada suhu penempelan primer yakni 57oC.
Elektroforesis Gel Agarosa
λ Eco T14I digest. Pita DNA yang terbentuk hasil elektroforesis tersebut diamati di atas transluminator UV dan selanjutnya dipotret dengan kamera digital dan dicetak hitam putih.
Gambar 2 Representasi diagram operon 16S–23S rRNA, menunjukkan posisi beberapa primer universal yang telah dikembangkan untuk amplifikasi PCR daerah ini dari fitoplasma. Nama primer diberikan di bawah tanda panah dan ukuran perkiraan amplikon ditunjukkan diantara garis putus-putus. Tidak digambar pada skala (Hodgetts & Dickinson 2010)
CloningDNA Fitoplasma
Preparasi Sel Bakteri Kompeten
Sel bakteri yang digunakan sebagai sel kompeten pada penelitian ini adalah bakteri Eschericia coli DH5α. Metode preparasi sel bakteri kompeten berdasarkan Sambrook & Russel (2001) yakni metode Inoue “ultra competent” cells. BakteriE. coli DH5αditumbuhkan pada media Luria Bertani (LB) agar dan diinkubasi pada suhu 37 oC selama 16 – 20 jam. Satu koloni tunggal bakteri (diameter 2 – 3 mm) diambil dan dimasukkan pada 25 ml media SOB dalam Erlenmeyer 250 ml kemudian diinkubasikan pada shaker incubatorpada suhu 37
o
C, kecepatan 250–300 rpm, selama 6–8 jam. Sejumlah 10 ml, 4 ml, dan 2 ml suspensi bakteri yang terbentuk diambil dan dimasukkan pada masing-masing 250 ml media SOB dalam tabung erlenmeyer 1 liter, lalu diinkubasikan dalamshaker incubator pada suhu 18 – 22 oC dan kecepatan 150 – 200 rpm. Pengecekan kepadatan sel bakteri dengan OD600pada ketiga biakan dilakukan setiap 45 menit.
Ketika OD600 telah mencapai 0,55 pada salah satu biakan, maka biakan tersebut
suhu 4oC. Setelah supernatan (media) dibuang, tabung diletakkan dalam keadaan miring dengan alas tissue steril sehingga semua cairan hilang atau menggunakan bantuan aspirator. Pelet sel kemudian disuspensikan dengan 80 ml bufer transformasi Inoue dingin dengan menggoyang-goyangkan tabung. Sel bakteri dipanen kembali dengan cara sentrifugasi dengan kecepatan 2500 g selama 10 menit pada suhu 4oC. Supernatan yang terbentuk dibuang, selanjutnya pelet sel disuspensikan kembali dengan 20 ml bufer transformasi Inoue dan ditambahkan 1,5 ml DMSO. Suspensi bakteri dicampurkan dengan menggoyang-goyangkan tabung kemudian diinkubasikan di dalam es selama 10 menit. Dengan kerja cepat, sebanyak masing-masing 100µl suspensi bakteri dimasukkan pada tabung eppendorf 1.5 ml sampai habis. Tabung eppendorf berisi sel bakteri tersebut direndam di dalam nitrogen cair beberapa saat dan kemudian diambil untuk disimpan pada suhu -80 oC. Ketika akan digunakan, sel bakteri dalam tabung dicairkan dengan cara menggenggamnya dan kemudian diletakkan pada es selama 10 menit.
Insersi ProdukNestedPCR ke dalam DNA Plasmid
Plasmid yang digunakan dalam penelitian ini adalah pDONRTM 201 (kit cloning dari Invitrogen). Produk nested PCR (nPCR) yang digunakan adalah amplikon DNA dengan primer R16F2n/R16R2 yang telah ditambahkan dengan adaptorattB1 dan attB2, sehingga susunan sekuen primer menjadi R16F2n-attB1 (5’-GGG GAC AAG TTT GTA CAA AAA AGC AGG CTC GGA AAC GAC TGC TAA GAC TGG-3’) dan R16R2-attB2 (5’-GGG GAC CAC TTT GTA CAA GAA AGC TGG GTC TGA CGG GCG GTG TGT ACA AAC CCC G-3’). Produk nPCR tersebut diencerkan 20 kali dengan dH2O. Produk nPCR tersebut
Tabel 1 Komposisi bahan-bahan yang digunakan untuk reaksi insersi produk nPCR
Stok bahan Volume per reaksi
Plasmid PDONRTM201 (150 ng/µl) 0,5µl
5X buffer BP 1µl
Buffer TE 0,5µl
BPClonase 1µl
Produk nPCR 2µl
Transformasi DNA Plasmid ke Sel Bakteri Kompeten
Transformasi DNA plasmid ke sel bakteri kompeten dilakukan menggunakan metode heat shock (Sambrook & Russell 2001). Sebanyak 5 µl reaksi BP dimasukkan ke dalam 100µl sel bakteri kompeten yang telah dicairkan dan dicampurkan dengan cepat lalu diinkubasikan pada es selama 30 menit, dipindahkan pada suhu 42 oC selama 90 detik dan segera diletakkan pada es kembali selama 1 – 2 menit. Sebanyak 800 µl media SOC ditambahkan pada masing-masing tabung dan segera diinkubasikan pada suhu 37 oC selama 1 – 2 menit. Tempat inkubasi dipindahkan padashaker incubator(200–250 rpm) suhu 37 oC selama 45 menit. Sejumlah 50 µl suspensi bakteri diambil dan ditumbuhkan pada media LB di dalam cawan petri yang telah diberikan antibiotik kanamisin 50 µg/ml dengan bantuan glass beads kemudian diinkubasikan pada suhu 37 oC semalam. Jika terdapat bakteri yang tumbuh pada media, berarti bakteri tersebut telah terinsersi dengan plasmid yang mengandung produk nPCR. Sebagai kontrol digunakan hanya sel bakteri kompeten saja dan sel bakteri kompeten yang telah ditambahkan dengan plasmid pDONRTM 201 yang tidak akan memperlihatkan adanya pertumbuhan bakteri.
Koloni tunggal bakteri yang tumbuh diambil menggunakan ujung pipet tip 10 µl steril dan ditumbuhkan pada media LB + kanamycin 50 µg/ml di dalam cawan petri dengan cara titik kemudian sisa sel bakteri pada ujung pipet tip tersebut dimasukkan ke dalam 30 µl dH2O di dalam tabung PCR dan diberi tanda
dalam cawan petri diinkubasikan di pada suhu 37 oC semalaman. Pengecekan dilakukan terhadap panjang produk nPCR yang diharapkan (sekitar 1,25 kb) menggunakan teknik PCR koloni dengan komposisi sesuai pada Tabel 2. Mesin PCR diatur dengan suhu denaturasi awal 95oC selama 2 menit dan denaturasi 95
o
C selama 15 detik, suhu penempelan primer 58oC selama 30 detik, suhu ekstensi 72oC selama 1 menit 15 detik sebanyak 30 siklus.
Tabel 2 Komposisi bahan-bahan yang digunakan untuk PCR koloni
Stok bahan Volume per reaksi
5X buffer 2G, 1,5 mM Mg 2,00µl
10 mM dNTPs 0,20µl
Primer R16F2n-attB1/ PDONR-F (2 pmol) 2,50µl Primer R16R2-atttB2/ PDONR-R (2 pmol) 2,50µl
DNAtemplate(suspensi bakteri) 1,00µl
Taq polymerase KAPA 2G Robust 0,04µl
dH2O 1,76µl
Pasangan primer yang digunakan adalah R16F2n-attB1/PDONR-R (5’-GTA ACA TCA GAG ATT TTG AGA CAC-3’) atau PDONR-F (5’-TCG CGT TAA CGC TAG CAT GGA TCT C-3’)/R16R2-atttB2
Produk PCR koloni dielektroforesis (2 µl produk PCR koloni + 1µl 10X loading dye) pada 1% gel agarosa dengan tegangan listrik 100 volt selama 20 menit. Jika pita DNA yang tervisualisasi pada gel agarosa berada pada urutan sekitar 1,25 kb maka sel bakteri kompeten yang ditumbuhkan pada media LB di dalam cawan petri selanjutnya plasmid dapat diisolasi.
Isolasi Plasmid
tabung eppendorf 1.5 ml dan disentrifugasi dengan kecepatan 8000 rpm selama 2 menit. Supernatan yang terbentuk dibuang dengan cara dihisap menggunakan aspirator secara hati-hati. Pelet sel disimpan pada suhu -20 oC (jika tidak langsung diperlakukan). Sebanyak 100 µl larutan alkalin lisis I dingin tambahkan pada pelet sel kemudian divortex 4 -5 detik. Sejumlah 200µl larutan alkalin lisis II (dibuat sebelum digunakan) ditambahkan kemudian suspensi bakteri dicampurkan dengan membolak-balikkan tabung selama 5 kali dengan cepat, selanjutnya diinkubasikan pada es selama 5 menit. Sebanyak 150 µl larutan alkalin lisis III ditambahkan, divortex 1 – 2 detik kemudian disimpan pada es selama 3 – 5 menit dan disentrifugasi dengan kecepatan 15000 rpm selama 5 menit pada suhu 4oC. Sebanyak 400µl supernatan dipindahkan ke dalam tabung eppendorf yang baru dan ditambahkan fenol : kloroform : isoamil alkohol (25:24:1 v/v/v) volume setara kemudian dicampurkan dengan vortex 1 – 2 detik dan disentrifugasi dengan kecepatan 15000 rpm selama 2 menit pada suhu 4 oC. Lapisan paling atas (sekitar 350 µl) dipindahkan ke dalam tabung eppendorf baru kemudian asam nukleat (plasmid) dari supernatan dipresipitasi dengan menambahkan 2 kali volume etanol 100% pada suhu ruang selama 2 menit dan disentrifugasi dengan kecepatan 15000 rpm selama 5 menit pada suhu 4 oC. Supernatan dibuang menggunakan aspirator dan tabung eppendorf didirikan di atas tissue steril sampai kering. Sebanyak 1 ml etanol 70% ditambahkan pada pelet DNA plasmid kemudian dibalik beberapa waktu dan disentrifugasi dengan kecepatan 15000 rpm selama 2 menit pada suhu 4 oC. Supernatan dibuang kembali menggunakan aspirator dengan hati-hati karena pelet mudah lepas. Semua cairan di dalam tabung eppendorf dihilangkan dengan pompa vakum selama 5 – 10 menit pada 0,1 Mpa cm Hg. Sebanyak 50µl bufer TE dan 5 µl RNAse-A (Invitrogen) ditambahkan, divortex 2 – 3 detik kemudian disimpan pada suhu -20oC.
Tabel 3 Komposisi bahan-bahan yang digunakan untuk PCR plasmid
Stok bahan Volume per reaksi
5X buffer 2G, 1,5 mM Mg 2,00µl
10 mM dNTPs 0,20µl
Primer PDONR-F (2 pmol) 2,50µl
Primer PDONR-R (2 pmol) 2,50µl
DNAtemplate(plasmid hasil isolasi) 1,00µl
Taq polymerase KAPA 2G Robust 0,04µl
dH2O 1,76µl
Sequencingdan Kajian Filogenetik Fitoplasma
Sebanyak 8 µl produk PCR plasmid ditambahkan 3 µl Exo SAP-IT dan diencerkan 20 kali dengan dH2O kemudian diinkubasikan pada suhu 37oC selama
30 menit dan suhu 81 oC selama 20 menit. Suspensi produk PCR plasmid ini digunakan sebagai template pada PCR sequencing. Reaksi PCR sequencing dilakukan dengan komposisi bahan sesuai dengan Tabel 4. Mesin PCR diatur dengan denaturasi awal 94 oC selama 2 menit dan denaturasi 96 oC selama 10 detik, penempelan primer 50 oC selama 5 detik, ekstensi 60 oC selama 3 menit sebanyak 25 siklus. Sebanyak 5 µl dH2O ditambahkan pada produk PCR sequencing.
Sambil menunggu hasil PCR, serbuk agar Sphadex G-50 dimasukkan pada kolom 45 µl dan diratakan. Multiscreen HV ditempatkan tepat diatas kolom kemudian dibalik bersama-sama sehingga agar tertuang pada Multiscreen HV. Sebanyak 300 µl dH2O ditambahkan pada masing-masing lubang (yang berisi
Analyzer (Applied BiosystemTM) dan dijalankan sesuai dengan petunjuk pada logbookmesin. Data hasilsequencingdisimpan padahard diskkomputer.
Tabel 4 Komposisi bahan-bahan yang digunakan untuk PCR sequencing
Stok bahan Volume per reaksi
5X buffersequencing 1,0µl
Primer PDON-F atau PDON-R (2 pmol) 0,5µl
DNAtemplate(suspensi bakteri) 2,0µl
Big Dye (for applied biosystem) 1,0µl
dH2O 0,5µl
PCRsequencingpada komposisi yang sama juga dilakukan menggunakan primer (5’-ACA TCT CAC GAC ACG AGC TGA CGA C-3’) yangletaknya di tengah fragmen DNA karena panjang fragmen DNA sekitar 1,25 kb sementara kemampuansequencingyang baik hanya sekitar 500 bp.
Analisis HasilSequencing
Hasil sequencing kemudian dirakit (assembly) dengan program Autoassemblyuntuk menentukan primer yang berada di tengah fragmen. Langkah ini dilakukan karena kemampuan mesin sekuenser ABI PRISM 3100 Genetic Analyzer hanya optimal merunut basa sekitar 500 bp, sedangkan ukuran sekuen target dari R16F2n/R16R2 adalah sekitar 1,25 kb. Setelah primer didapatkan (yaitu 5’-ACA TCT CAC GAC ACG AGC TGA CGA C-3’), maka dilakukan proses sequencing kembali pada masing-masing contoh dengan menggunakan primer tersebut. Hasilnya kemudian dirakit kembali bersama-sama dengan hasil sequencing menggunakan primer PDONR-F dan PDONR-R sehingga menghasilkan sekuen DNA yang utuh. Sekuen DNA di luar sekuen primer R16F2n dan R16R2 dihilangkan. Sekuen DNA hasil assembly tersebut dikonfirmasikan ke GenBank melalui program Basic Local Alighment Search Tool (BLAST) untuk melihat kedekatannya dengan sekuen DNA yang telah tersimpan diGenBank.
Kajian Filogenetik
paup.csit.fsu.edu), Bioedit (http://www.mbio.ncsu.edu), Clustal X, Clustal W (http://www.clustal.org) dan TreeView. Analisis filogenetik juga dilakukan terhadap sekuen DNA fitoplasma yang telah tersimpan diGenBank berdasarkan Weiet al.(2007).
Pemotongan Fragmen DNA dengan Enzim Restriksi SecaraIn Silico
Sekuen DNA hasil sequencing kemudian dimasukkan pada program pDRAW32 yang dikembangkan oleh AcaClone Software (http://www.acaclone.com). Masing-masing sekuen DNA kemudian dipotong-potong menggunakan 17 macam enzim restriksi yang sering digunakan untuk analisis RFLP gen 16S rRNA fitoplasma (Weiet al.2007). Enzim-enzim restriksi tersebut adalah AluI, BamHI, BfaI, BstUI (ThaI), DraI, EcoRI, HaeIII, HhaI, HinfI, HpaI, HpaII, KpnI, Sau3AI (MboI), MseI, RsaI, SspI, dan TaqI. Setelah dipotong, pola fragmentasi hasil RFLP in silico tersebut kemudian diplotkan sebagai gambar elektroforesis gel agarosa 3% pada komputer dan simpan pada format PDF.
Deteksi Fitoplasma pada Wereng Daun danCassytha filiformis
Pengambilan Contoh Tanaman dan Serangga
Ekstraksi DNA Fitoplasma dari Tanaman dan Wereng Daun
Metode ekstraksi DNA dari tanaman C. filiformis mengacu pada metode Zang et al. (1998) seperti yang telah dijelaskan di atas. Ekstraksi DNA dari wereng berdasarkan Goodwin et al. (1994). Sejumlah 3 – 4 ekor wereng daun digerus di dalam tabung eppendorf menggunakan mikropistil dan kemudian dicampur dengan 200 µl bufer CTAB. Hasil gerusan divortex beberapa detik, kemudian diinkubasi pada 65oC selama 5 menit. Ke dalam suspensi ditambahkan kloroform:isoamil alkohol (24:1 v/v) dengan volume setara, kemudian diinkubasi pada suhu kamar selama 20 menit. Tabung eppendorf dibolak-balik beberapa kali kemudian disentrifus 12.000 rpm selama 3 menit. Supernatan sebanyak 90 µl dipindahkan ke dalam tabung eppendorf baru, kemudian DNA dipresipitasi dengan 10 µl NaOAc (pH 5.2) dan 250 µl etanol absolut (-20 oC). Tabung ditempatkan dalam freezer selama 30 menit. Selanjutnya suspensi disentrifus 12.000 rpm selama 15 menit. Supernatan dibuang, sedangkan endapan dicuci dua kali dengan 200 µl etanol 70% (-20 oC) dan disentrifus 12.000 rpm selama 2 menit. Etanol dibuang dan endapan dikeringkan menggunakan pompa vakum. DNA diresuspensi dengan aquades steril sebanyak 10 µl.
Deteksi dan Identifikasi Fitoplasma
HASIL DAN PEMBAHASAN
Morfologi dan Histopatologi Penyakit Layu Kelapa
Gejala Morfologi Penyakit Layu Kelapa di Pulau Derawan
Gejala penyakit layu kelapa yang berasal dari Pulau Derawan terlihat umumnya pada tanaman di atas umur 15 tahun. Daun-daun kelapa menguning mulai dari bagian bawah (tua) ke bagian atas (muda). Menguningnya daun juga dimulai pada bagian ujung daun ke bagian yang dekat dengan pelepah. Pelepah-pelepah maupun daun kelapa yang muncul terlihat lebih pendek daripada tanaman kelapa yang sehat. Pemendekan pelepah dan daun kelapa ini mengakibatkan tanaman terlihat kerdil dan sedikit pelepah (Gambar 3).
Gambar 3 Gejala penyakit layu kelapa di Pulau Derawan. Daun tanaman kelapa menguning dan memendek (A); Perbesaran gambar gejala penyakit kelapa (B)
daun dengan gejala penyakit yang berat, beberapa jenis sitokinin tidak terdeteksi. Penurunan jumlah sitokinin ini mengakibatkan perilaku stomata cenderung menutup. Namun demikian, kandungan sitokinin pada akar tanaman yang bergejala penyakit cenderung mengalami kenaikan.
Perubahan fisiologi juga terjadi terutama di dalam daun dan akar yang akan memperlihatkan gejala secara visual seperti yang diteliti oleh Maust et al. (2003). Konduktansi stomata, fotosintesis dan respirasi akar menurun pada stadia perkembangan penyakit. Jumlah pusat-pusat reaksi fotosistem II (PSII) yang aktif akan menurun mulai stadia awal gejala penyakit, namun maksimum penggunaan efisiensi PSII akan sama sampai stadia pertengahan perkembangan penyakit sebelum mengalami penurunan. Konsentrasi gula dan pati pada daun-daun bagian tengah (daun ke-14) dan daun-daun atas (daun ke-4) mengalami peningkatan selama perkembangan penyakit, sedangkan konsentrasi karbohidrat akar mengalami penurunan yang sangat cepat selama masa inkubasi fitoplasma. Meskipun laju fotosintesis dan konsentrasi karbohidrat akar menurun, konsentrasi karbohidrat daun meningkat. Hal ini membuktikan bahwa terjadinya penghambatan transportasi gula di dalam floem yang memicu pada cekaman jaringan pengangkutan dan menyebabkan perkembangan gejala lethal yellowing menjadi tampak secara visual.
Struktur batang tanaman kelapa sakit umumnya lebih licin dibandingkan batang tanaman sehat. Tekstur kulit batang tetap bergelombang karena adanya bekas tumpuan pelepah yang telah terlepas, tetapi ketika dipanjat akan terasa lebih licin. Batang kelapa yang bergejala penyakit ini semakin ke bagian atas, akan terasa semakin licin. Untuk waktu normal, dengan lingkar batang dan ketinggian tanaman yang sama (sekitar 12 meter), seorang pemanen kelapa akan membutuhkan waktu memanjat pada tanaman yang sakit dan bergejala berturut-turut sekitar 1 menit dan 4 menit. Diameter batang tanaman yang sakit juga lebih kecil daripada tanaman yang masih sehat, namun hanya pada bagian atas, pada bagian bawah relatif sama.
tidak dapat diduduki pemanen yang hanya memiliki berat tubuh sekitar 60 kg. Selain karena jumlah buah yang sangat sedikit dengan ketinggian tanaman yang cukup tinggi, kondisi seperti ini mengakibatkan tanaman ini jarang tersentuh.
Gejala penyakit layu kelapa di Pulau Derawan yang sudah lanjut adalah mengeringnya daun (klorosis) yang dimulai dari bagian daun yang tua (bawah) dan bagian ujung daun. Pelepah-pelepah tua mudah sengkleh, terjadinya penguguran buah kelapa yang masih muda atau jika masih ada buah kelapa yang tersisa sampai besar dan masak, biasanya hanya 1 atau 2 biji saja. Gejala akhir penyakit ini adalah mengeringnya seluruh pelepah dan daun kelapa, rontok dan terlihat hanya seperti tonggak batang kayu (Gambar 4).
Gambar 4 Gejala lanjut penyakit layu kelapa di Pulau Derawan. Daun kelapa mengalami nekorsis dari daun bagian bawah (A), daun dan buah berguguran hingga tertinggal hanya tonggak batang (B)
Gejala lanjut penyakit layu kelapa seperti daun yang mengalami klorosis, pelepah sengkleh, gugurnya buah muda mirip dengan tanaman kelapa yang memperlihatkan gejala penyakit lethal yellowing stadia lanjut. Menurut Leon et al. (1996), tanaman yang sakit akan menghasilkan asam absisat dan etilen yang sangat tinggi. Akibatnya tanaman terjadi ketidakseimbangan hormon. Hormon-hormon ini akan memacu penuaan daun dan mengakibatkansengkleh-nya pelepah serta gugurnya buah yang masih muda (Musetti 2010).
Pengamatan Jaringan Pengangkutan Tanaman dengan Pewarnaan DAPI
terhadap jaringan batang, akar, dan daun seperti terlihat seperti pada Gambar 5 menunjukkan bahwa pada jaringan floem dari tanaman sakit (bergejala layu) terdapat spot nyala fluoresensi yang lebih terang dibandingkan dengan floem dari tanaman sehat. Spot nyala fluoresensi pada sel floem yang lebih terang ini diduga merupakan akumulasi DNA fitoplasma. Adanya DNA suatu mikroorganisme di dalam jaringan tanaman akan terwarnai dengan pewarna DAPI.
Gambar 5 Jaringan pengangkutan tanaman yang diberi DAPI: (a) Potongan jaringan pengangkutan pada batang kelapa sakit, (b) batang kelapa sehat, (c) akar kelapa sakit, (d) akar kelapa sehat, (e) daun kelapa sakit, (f) daun kelapa sehat. Perbesaran untuk contoh dari batang dan akar adalah 100 X, untuk daun adalah 200 X. Spot nyala fluoresen (tanda panah) pada (a), (c), dan (e) yang tampak pada floem diduga
merupakan DNA fitoplasma
antara sel mikroorganisme lain atau komponen sel (mitokondria, kloroplas) dari fitoplasma (Schaad et al. 2001). Sebagai contoh, pada kasus tanaman wortel, daerah fluorosen (berpendar) biru dan putih terlihat di bawah lensa pandang mikroskop fluoresen pada sel jaringan pengangkutan tanaman yang bergejala penyakit, tetapi pengamatan dengan transmission electron microscope (TEM) memperlihatkan bahwa yang sebenarnya berpendar tersebut berturut-turut adalah ricketsia-like organisms dan partikel rhabdovirus (Franova et al. 2007). Karena
itu, teknik ini hanya digunakan sebagai alat deteksi awal dari deteksi utama
dengan pendekatanpolymerase chain reaction(PCR) (Arismendiet al.2009).
Sebenarnya jaringan tanaman akan berpendar secara alami (contoh dinding
sel xilem) atau karena akumulasi produksi substansi tertentu (misal senyawa
fenol) sebagai respon terhadap berbagai keadaan yang kurang mendukung seperti
tekanan lingkungan abiotik dan biotik (penyakit). Oleh karena itu, tanpa
pewarnaan tertentu, penglihatan langsung jaringan ini menggunakan mikroskop
cahaya tidak dapat dijadikan sebagai metode deteksi fitoplasma. Pewarnaan 4’ -6-diamidino-2-phenylindole (DAPI) yang mengikat DNA mengakibatkan sel-sel floem menjadi sangat berpendar, lebih berpendar dari nukleus sel parenkim
(Musetti & Favali 2004). Jika terdapat fitoplasma, maka spot-spot pada sel floem
akan sangat berpendar yang akan membedakan dengan ketiadaan fitoplasma pada
jaringan tanaman sehat. Teknik pewarnaan DAPI ini dapat digunakan untuk
contoh tanaman basah maupun kering, dan juga tidak hanya untuk jaringan daun
dan batang, tetapi juga untuk akar, bunga dan petiole.
Pengamatan Jaringan Pengangkutan Floem dengan SEM