SIFAT PENEMPELAN
ASAL DAGING SAPI
PADA PERMUKAAN USUS
SECARA
SKRIPSI
ADITYA PRASETYA
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
RINGKASAN
ADITYA PRASETYA. D14052342. 2011. Sifat Penempelan
Asal Daging Sapi pada Permukaan Usus Secara Skripsi. Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Irma Isnafia Arief. S.Pt., M.Si. Pembimbing Anggota : drh. Adi Winarto Ph.D.
Bakteri asam laktat (BAL) merupakan jenis bakteri yang hidup pada lingkungan yang mengandung karbohidrat sebagai sumber gula. Isolasi BAL dapat dilakukan dari beberapa produk hewani satu diantaranya adalah daging segar. Penelitian ini ditujukan untuk mengkarakterisasikan lima jenis BAL yang sudah diisolasi dari daging sapi segar yang meliputi: pengamatan morfologi bakteri asam laktat asal daging sapi dan mengetahui sifat penempelannya pada permukaan usus. Pemurnian kultur bakteri diperiksa melalui morfologinya yang diamati secara mikroskopik dengan bantuan metode pewarnaan Gram.
Penelitian dimulai dengan melakukan konfirmasi sifat BAL terhadap 5 kultur yang sudah diisolasi. Penelitian kemudian dilanjutkan dengan menguji kemampuan tumbuh pada kondisi lingkungan yang mengandung MRSB suhu 37°C, mengelompokkan BAL reaksi dalam pewarnaan Gram serta melihat kemampuan melekatnya pada permukaan epitel usus. Rancangan yang digunakan adalah Rancangan acak lengkap pola Faktorial 6 x 2 dengan 3 kali ulangan. Sebanyak 5 jenis isolat BAL berbeda sebagai faktor pertama yaitu BAL 1A5, 1A32, 2B2, 2B4,
2C12 dan kontrol digunakan dalam evaluasi pada model usus halus tikus.
Usus halus tikus yang digunakan berukuran (1x1 cm2). Faktor kedua adalah
perlakuan inkubasi suspensi bakteri setelah usus dicuci dengan PBS, dan perlakuan inkubasi langsung dalam suspensi bakteri tanpa pencucian PBS, pengulangan dilakukan 3 kali yang dikelompokkan. Uji daya tumbuh pada suhu 37 °C dilakukan secara kuantitatif.
Hasil yang diperoleh menunjukkan bahwa 5 kultur bakteri tersebut merupakan kelompok bakteri asam laktat yang mempunyai sifat Gram positif dan memiliki suhu optimal pertumbuhan 37 ºC. Perlakuan kontrol, pencucian PBS serta tanpa pencucian PBS dengan media tumbuh MRSA menunjukan peningkatan pertumbuhan BAL. Jenis BAL tidak berpengaruh nyata (P>0,05) terhadap pertumbuhan masing=masing BAL. Tingkat ketahanan penempelan 3 isolat BAL pada sel epitel usus halus berturut=turut adalah isolat 1A5, 2C12, dan 1A32. Kemampuan menempel BAL pada epitel vili=vili usus halus terlihat dari hasil pewarnaan Hematoxylin. Daya menempel pada perlakuan tanpa pencucian PBS memberikan hasil yang tidak nyata (P>0,05). Berdasarkan hasil penelitian dapat disimpulkan bahwa isolat 1A32, 1A5, 2B2, 2B4, dan 2C12 mampu menempel pada permukaan usus.
ABSTRACT
Adhesiveness of Beef Isolated Lactic Acid Bacteria on Intestinal Surface
Prasetya, A., I. I. Arief, and A. Winarto
The gut micro flora is various in number and composition, and its condition strongly effect the health of the host. Probiotic is live microorganism that to believed having potential to control pathogenic bacteria in digestive system. Lactic acid bacteria (LAB) is the one of the most popular bacteria to be used as probiotic. This experimental aims were to investigate the adhesive ability of LAB to the intestinal epithelium, to identify bacterial gram expression and to evaluate the influence of mucus component to the adhesion ability. The finding may provide more various LAB species which highly potential as a probiotic starter. The data were analyzed by ANOVA using the GLM procedure of MINITAB. There were 5 LAB strains and
control evaluated using rat ileum as a model. The ileum sample (1x1 cm2)
were prepared for 2 treatment: group one will be incubated in bacterial suspension
after ( PBS ) flushing and the other group are directly
incubated without flushing at 37oC for 30 minute. Bacterial adhesion will be
evaluated with micro=technique using gram staining. All of LAB showed a normal growth after 24 hours incubated at 37 °C in MRS with agar. The different strains of LAB had no significant on bacterial population of 1A5, 2B2, 2B4, 2C12 and 1A32
isolates. Treatment directly incubated without flushing at 37oC for 30 minute no
significantly increase the growth final population of LAB (P>0,05), especially isolate 1A5, 2C12 and 1A32. Result hematoxylin=eosin expression to indicate LAB population was significant adhesive ability given the highly on treatment directly incubated without flushing than treatment will be incubated in bacterial suspension after PBS flushing. As a conclusion bacteria adhesive ability the influence by cell surface protein mucous on aggregation and adhesiveness membrane cell of LAB to intestinal epithelial.
SIFAT PENEMPELAN
ASAL DAGING SAPI
PADA PERMUKAAN USUS
SECARA
ADITYA PRASETYA D14052342
Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Peternakan pada
Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU PRODUKSI DAN TEKNOLOGI PETERNAKAN FAKULTAS PETERNAKAN
Judul : Sifat Penempelan Asal Daging Sapi
Pada Permukaan Usus Secara .
Nama : Aditya Prasetya
NIM : D14052342
Menyetujui,
Pembimbing Utama, Pembimbing Anggota,
(Irma Isnafia Arief, S.Pt., M.Si) (drh. Adi Winarto, Ph.D)
NIP. 19750304 199903 2 001 NIP. 19680516 198601 1 001
Mengetahui: Ketua Departemen,
Ilmu Produksi dan Teknologi Peternakan,
(Prof. Dr. Ir. Cece Sumantri M. Agr.Sc) NIP. 19591212 198603 1 004
1 RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 19 Januari 1987 di Jakarta. Penulis adalah anak pertama dari dua bersaudara dari pasangan Bapak Ayi Muhamad Yusup dan Ibu Suratini. Riwayat pendidikan penulis dimulai dari pendidikan taman kanak= kanak diselesaikan pada tahun 1992 di TK Aisyah Depok, Pendidikan Sekolah Dasar diselesaikan pada tahun 1999 di SDN Anyelir 1 Depok, Sekolah Lanjutan Tingkat Pertama diselesaikan pada tahun 2002 di SLTPN 2 Depok, dan dilanjutkan ke Sekolah Menengah Atas diselesaikan pada tahun 2005 di SMA Perguruan Rakyat 1 Jakarta. Penulis kemudian melanjutkan pendidikan dan diterima sebagai mahasiswa di Institut Pertanian Bogor pada tahun 2005 melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan penerapan Sistem Mayor Minor oleh IPB pada tahun 2006 membawa penulis pada Departemen Ilmu Produksi dan Teknologi Peternakan (IPTP), Fakultas Peternakan, Institut Pertanian Bogor.
Selama menjadi mahasiswa, penulis aktif sebagai anggota Himpunan Profesi Mahasiswa Produksi Ternak (HIMAPROTER) periode 2006=2007 serta mengikuti beberapa kepanitiaan dalam acara IPB maupun acara Fakultas.
Penulis melakukan penelitian dan penulisan skripsi yang berjudul “Sifat
Penempelan Asal Daging Sapi pada Permukaan Usus Secara
” guna memenuhi salah satu syarat untuk memperoleh gelar sarjana pada
1 KATA PENGANTAR
Assalamu’alaikum warahmatullaahi wabarakaatuhu
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala limpahan nikmat dan Rahmat=Nya hingga akhirnya penulis skripsi ini dapat diselesaikan dengan baik. Shalawat serta salam semoga selalu dilimpahkan kepada Nabi Muhammad SAW dan untuk keselamatan seluruh umat Islam.
Substansi skripsi ini tentang pengkajian lebih dalam mengenai sifat dan karakteristik 5 jenis isolat bakteri asam laktat asal daging sapi terhadap kemampuan masing=masing BAL tersebut untuk menempel pada permukaan usus halus. Penelitian ini dimulai dengan mengkonfirmasi 5 isolat bakteri asam laktat berdasarkan pewarnaan Gram dan morfologi secara mikroskopis sebagai pembuktian bahwa 5 kultur ini merupakan bakteri asam laktat.
Penelitian utama dilakukan untuk mengetahui profil 5 isolat BAL yaitu suhu
pertumbuhan pada suhu 37ºC, melihat kemampuan menempel masing=masing isolat
BAL pada sel epitel usus dengan perlakuan pencucian PBS dan pewarnaan Hematoxylin. Hasil penelitian bertujuan untuk mengetahui potensi masing=masing isolat BAL yang kemudian dijadikan kandidat BAL probiotik.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh sebab itu, Penulis sangat mengharapkan kritik dan saran agar skripsi ini menjadi lebih baik. Penulis juga mengucapkan terima kasih kepada seluruh pihak yang telah membantu hingga skripsi ini selesai. Penulis berharap semoga skripsi ini dapat bermanfaat bagi Penulis khususnya dan bagi pembaca pada umumnya
Bogor, April 2011
1
Sifat Fungsional Produk Bakteri Asam Laktat ... 5
Bakteri Asam Laktat (BAL) Sebagai Probiotik ... 5
Probiotik ... 6
Ketahanan Bakteri Asam Laktat di Saluran Pencernaan ... 8
1
Pemeriksaan Kemurnian BAL ... 25
Pewarnaan Gram ... 26
Morfologi Sel ... 27
Pertumbuhan Bakteri Asam Laktat pada Suhu 37 ºC ... 29
Jumlah Bakteri Asam Laktat dalam Usus Halus Tikus ... 30
Mekanisme Penempelan Isolat BAL terhadap Pencucian PBS ... 36
Pengaruh Keberadaan Isolat BAL Pada Sel Epitel Usus Halus .... 41
KESIMPULAN DAN SARAN ... 44
Kesimpulan ... 44
Saran ... 44
UCAPAN TERIMAKASIH ... 45
DAFTAR PUSTAKA ... 46
1 DAFTAR TABEL
Nomor Halaman
1. Pengelompokkan Bakteri Berdasarkan Kemampuan Hidupnya
dalam Saluran Pencernaan Manusia... 12
2. Karakteristik Lima Isolat Bakteri Asam laktat Berdasarkan
Morfologi dan Pewarnaan Gram... 28
1 DAFTAR GAMBAR
Nomor Halaman
1. Bentuk Morfologis ... 5
2. Struktur Anatomi Usus Halus ... 10
3. Mekanisme Bakteri probiotik dalam Menghambat Infeksi Patogen... ... 14
4. Diagram Alir Penelitian... ... 18
5. Tahapan Proses Pengujian Penempelan BAL pada Permukaan Usus Tikus Secara ... ... 22
6. Tahapan Proses Pembuatan Preparat Histologis Usus Halus... ... 24
7. Kekeruhan pada Uji Petumbuhan BAL pada Suhu 37 ºC ... 29
8. Diagram Jumlah BAL Terhadap Perlakuan Pencucian PBS ... 32
9. Standarisasi Kekeruhan Isolat BAL pada Larutan PBS di Suhu 37 ºC.... 35
10. Hasil Pewarnaan Hematoxylin=Eosin Isolat BAL pada Sel Epitel Usus dengan Menggunakan Mikroskop Cahaya Mikrophot=FX………. 39
1 DAFTAR LAMPIRAN
Nomor Halaman
1. Hasil Uji Asumsi Analisis Keragaman Jumlah 5 Isolat BAL
Terhadap Perlakuan PBS... 53
2. Analisis Ragam Jumlah 5 Isolat BAL Terhadap Perlakuan PBS ... 53
3. Komposisi Media MRSB (de=Man’s Ragosa Sharpe Broth)
OXOID CM 0359 ... 54
4. Komposisi Media PBS (Phosphate Buffer Saline) OXOID
BR00146 ... 55 5. Tahapan Pembuatan Preparat Histologi ... 56
1 PENDAHULUAN
Latar Belakang
Bakteri yang terdapat pada sistem pencernaan manusia jumlahnya berbeda= beda. Seiring dengan pertambahan usia, populasi dari berbagai bakteri mengalami adaptasi sehingga komposisi dari berbagai genus bakteri tersebut mempunyai keseimbangan dan menempati daerah kolonisasi masing=masing. Namun demikian, mempertahankan keseimbangan adalah hal yang tidak mudah disebabkan perubahan gaya hidup seperti pola makan dan konsumsi obat (antibiotik), dapat mengakibatkan perubahan keseimbangan komposisi bakteri dan mengarah pada dominasi bakteri
berbahaya seperti spesies ! " # dan $ Dominasi
bakteri berbahaya dapat berakibat pada gejala klinis yang tidak sehat seperti kanker dan berbagai penyakit pencernaan lain.
Memacu dominasi bakteri menguntungkan dalam sistem pencernaan dengan demikian menjadi sangat penting. Salah satunya dengan cara mengkonsumsi bahan pangan yang membawa bakteri probiotik. Probiotik memiliki peranan positif
terhadap kesehatan diantaranya adalah : menurunkan kasus ,
menurunkan kadar serum kolesterol, menstimulasi sistem imunitas tubuh, mengendalikan infeksi patogen, berperan sebagai antibiotik serta mampu menekan terjadinya tumor dan kanker sistem pencernaan.
merupakan jenis bakteri yang memiliki potensi sebagai probiotik karena bakteri ini mampu bertahan hidup dalam saluran pencernaan terutama pada usus halus dan mampu membentuk kolonisasi pada saluran pencernaan terutama kolon. Jika bakteri probiotik dapat menempel pada usus, terutama pada bagian mukosa usus maka bakteri tersebut dapat meningkatkan sistem imun, berkompetisi dengan patogen, serta mencegah penempelan dan pembentukan koloni oleh patogen. Keberadaan bakteri probiotik dalam saluran pencernaan juga harus didukung oleh zat=zat nutrisi yang dibutuhkan oleh bakteri probiotik. Bakteri asam laktat yang digunakan dalam penelitian ini diharapkan mampu mendukung dalam saluran pencernaan dengan memberikan zat nutrisi berupa peptida bagi perkembangan bakteri tersebut.
1 usus. Produk probiotik sangat penting mengandung sejumlah mikroba yang dapat masuk ke dalam tubuh manusia dan dapat bertahan hidup pada saluran pencernaan. Mempertahankan viabilitas probiotik bukan merupakan hal yang mudah mengingat banyak sekali hambatan seperti : (1) pH lambung yang sangat rendah, (2) keberadaan asam=asam empedu, (3) kompetisi dengan bakteri lain, (4) kondisi anaerob obligat, (5) keberadaan beberapa senyawa toksik. Optimalisasi pertumbuhan dan daya tahan bakteri probiotik dalam saluran pencernaan dapat dicapai dengan pemberian zat nutrisi yang dibutuhkan bagi pertumbuhan bakteri probiotik.
Pengujian efek bakteri asam laktat dalam pakan secara pada
mikroflora saluran pencernaan dilakukan terhadap % & atau tikus putih.
Hewan percobaan ini memiliki beberapa kelebihan diantaranya memiliki jumlah anak yang banyak pada setiap kelahiran serta sifat produksi dan reproduksinya hampir menyerupai mamalia besar. Terdapat dua sifat tikus putih yang membedakan dengan hewan percobaan lain yaitu tikus putih tidak dapat muntah karena struktur anatominya yang tidak lazim di tempat esophagus bermuara ke dalam lambung dan juga tidak memiliki kantong empedu. Kondisi yang demikian sangat menguntungkan karena dapat dipastikan semua pakan yang diberikan akan dikonsumsi. Selain itu tikus putih percobaan secara fisiologi dapat dikatakan memiliki kesamaan fungsi organ dengan manusia sehingga sangat berguna dalam penelitian yang berhubungan dengan kondisi manusia.
Tujuan
Tujuan dari penelitian ini adalah: 1) mengamati morfologi bakteri asam laktat asal daging sapi; 2) mengetahui kemampuan menempel dari bakteri dari isolat 1A5, 2B2, 2C12, 1A32 dan 2B4 pada sel epitel usus.
1 TINJAUAN PUSTAKA
Bakteri Asam Laktat
Bakteri asam laktat (BAL) adalah bakteri yang memproduksi asam laktat, termasuk golongan bakteri Gram positif, tidak membentuk spora, sel berbentuk batang atau bulat, baik tunggal, berpasangan atau berantai, kadang=kadang bentuk
tetrad, tidak memiliki sitokrom, dan bersifat anaerobik tetapi toleran terhadap O2
(Fardiaz, 1992). BAL diklasifikasikan berdasarkan morfologi, cara fermentasi glukosa, suhu pertumbuhan yang berbeda, bentuk produksi asam laktat yang dihasilkan, kemampuannya untuk tumbuh pada konsentrasi garam yang tinggi serta ketahanannya terhadap asam dan alkali yang berbeda=beda. Menurut Ray (1996) salah satu faktor yang mempengaruhi pertumbuhan BAL ialah faktor lingkungan (suhu dan aerasi). Walaupun bakteri asam laktat dapat hidup dengan dan tanpa oksigen, sumber energi terbesarnya untuk tumbuh adalah fermentasi gula. Bakteri ini mempunyai kapasitas respirasi yang sangat terbatas dan oleh karena itu tidak dapat memperoleh ATP dari proses respirasi (Salminen dan Wright 2004).
Bakteri asam laktat terdiri atas beberapa genus. Kelompok genus
(dalam bentuk ! ), " , dan sering
digunakan dalam proses fermentasi bahan pangan hasil ternak, sayur=sayuran, buah= buahan, daging dan produk sereal (Davidson dan Hoover, 1993). Selain itu BAL dapat digunakan sebagai probiotik untuk meningkatkan mikroflora dalam saluran pencernaan (Ouwehand, 1998).
Bakteri asam laktat memproduksi berbagai komponen bermassa molekul rendah termasuk asam, alkohol, karbon dioksida, diasetil, hidrogen peroksida dan metabolit lainnya. Banyak metabolit mempunyai spektrum aktivitas yang luas melawan spesies lain dan produksi tersebut dipengaruhi secara luas oleh matriks
makanan itu sendiri (Helander $, 1997). Efektivitas BAL dalam menghambat
bakteri pembusuk dipengaruhi oleh kepadatan dan strain BAL serta komposisi media. Selain itu, produk substansi penghambat dari BAL dipengaruhi oleh media pertumbuhan, pH dan suhu lingkungan (Shortt, 1999)
Menurut Rahman . (1992), bakteri asam laktat dapat dibedakan menjadi
dua kelompok berdasarkan zat yang dihasilkan yaitu heterofermentatif dan
homofermentatif. Bakteri yang bersifat homofermentatif contohnya ! "
1
dan beberapa spesies . Bakteri heterofermentatif misalnya
dan beberapa spesies . Bakteri heterofermentatif
melakukan fermentasi campuran yaitu selain menghasilkan asam laktat, juga
menghasilkan etanol, asam asetat dan CO2, sedangkan bakteri yang bersifat
homofermentatif hanya menghasilkan asam laktat saja. Bakteri asam laktat memproduksi sistem antimikroba seperti bakteriosin, sehingga BAL digunakan sebagai pengawet makanan yang alami untuk meningkatkan keamanan pangan. Antimikroba ini dapat dimanfaatkan dengan cara penambahan langsung BAL sebagai starter atau melalui metabolit antimikroba seperti asam organik atau bakteriosin yang berasal dari BAL (Earnshaw, 1999).
. merupakan genus terbesar dari kelompok Bakteri Asam
Laktat (BAL) (Axxelson, 1993). Genus bersifat gram positif dan tidak
membentuk spora, bersifat anaerob fakultatif, tumbuh optimum pada kisaran suhu
30=400C tapi dapat tumbuh pada 5=350C. tumbuh optimum pada pH
5.5=5.8, namun secara umum dapat tumbuh pada pH kurang dari 5.
banyak terdapat pada produk makanan fermentasi seperti sosis fermentasi, serta
produk fermentasi sayuran seperti pikel dan sauerkaut (Buckle .,1987)
merupakan bakteri yang tergolong dalam famili
. Bakteri ini berbentuk batang yang panjang, anaerobik fakultatif, dan katalase negatif. Jenis ini dapat dibedakan atas dua kelompok yaitu homofermentatif dan heterofermentatif. Bakteri heterofermentatif memecah gula terutama menjadi asam laktat dan produk=produk lain seperti alkohol, asetat dan karbondioksida. Spesies yang tergolong heterofermentatif tumbuh baik pada suhu 37
0
C atau lebih (Fardiaz, 1992).
1
Gambar 1. .
Sumber: www.usprobiotics.org (2010)
Sifat Fungsional Produk Bakteri Asam Laktat (BAL).
Produk BAL menurut Nakazawa dan Hasono, (1992) memiliki fungsi antara lain: 1.) meningkatkan pertumbuhan dan daya cerna, dibuktikan dengan tikus yang diberi yoghurt menunjukkan bobot lebih besar dibandingkan dengan tikus yang diberi susu. Semakin banyak BAL yang dikonsumsi makin besar pertambahan bobot
badannya; 2.) memberi pengaruh pada gastrointestinal, bakteri patogen seperti #$ "
' dan ! jumlahnya berkurang dan multiplikasinya rendah; 3.)
meningkatkan gerakan usus, !$ dapat meningkatkan gerakan usus
sehingga konstipasi; 4.) BAL sebagai anti kanker, percobaan dengan mencit yang diberi sel tumor dimana grup pertama diberikan yoghurt dan sirup sedangkan grup kedua tidak diberikan yoghurt, terdapat perbedaan multiplikasi sel kanker karena
pemberian yoghurt; 5.) mencegah ; dan 6.) menurunkan
kolesterol darah. Gilliland . (1985) menambahkan bahwa penurunan kolesterol
diduga karena kemampuan BAL dalam mengasimilasi kolesterol dan
mendekonjugasi garam empedu.
Bakteri Asam Laktat (BAL) Sebagai Probiotik
Probiotik merupakan mikroorganisme hidup yang dapat dimanfaatkan untuk meningkatkan keseimbangan populasi mikroba di dalam usus. Probiotik dapat diperoleh dengan cara mengkonsumsi produk olahan susu fermentasi yang
mengandung bakteri dari kelompok dan( (Fuller, 1989).
Beberapa BAL mempunyai sifat sebagai probiotik, dikonsumsi melalui produk fermentasi dan dapat mencapai usus dalam keadaan hidup serta membantu dalam menjaga keseimbangan mikroflora usus sehingga bersifat menguntungkan bagi kesehatan manusia.
1 Fuller (1989) menyatakan prasyarat yang harus dimiliki probiotik yang baik antara lain (1) merupakan flora normal usus yang non patogenik, dapat mempertahankan aktivitasnya pada kondisi lingkungan yang tinggi keasamannya yaitu di lambung dan pada konsentrasi garam yang tinggi di usus halus, (2) dapat tumbuh dan melakukan metabolisme dengan sangat cepat dan terdapat dalam jumlah yang tinggi, (3) mengkolonisasi bagian tertentu saluran pencernaan dengan kemampuan untuk menempel pada epitelium sangat diperlukan, (4) mempunyai sifat antimikroba yang spesifik terhadap bakteri yang membahayakan, (5) mudah untuk diproduksi, bertahan hidup pada skala besar dan dapat mempertahankan viabilitas selama penyimpanan. Salah satu kegunaan probiotik adalah dapat menurunkan jumlah bakteri patogen dan bakteri membahayakan. Mekanisme penurunan jumlah patogen oleh bakteri probiotik seperti dikemukakan oleh Fuller (1989) yaitu dengan cara (1) memproduksi komponen anti bakteri, (2) berkompetisi untuk memperoleh zat nutrisi, dan (3) berkompetisi untuk memperoleh daerah kolonisasi.
Probiotik
Fuller (1992) mengemukakan, bahwa probiotik adalah mikroorganisme hidup yang ketika dikonsumsi oleh ternak atau manusia akan memberikan efek yang menguntungkan bagi kesehatan inangnya dengan cara meningkatkan sifat=sifat dari mikroflora dalam saluran pencernaan. Spesies mikroba yang umum digunakan
sebagai probiotik adalah " ( " # "
! , dan (Gibson, 2000).
Karakteristik probiotik yang diinginkan dari satu strain spesifik mencakup:
(a) mempunyai kapasitas untuk bertahan hidup (survive)" untuk melakukan
kolonisasi (colonize), serta melakukan metabolisme (metabolize) dalam saluran cerna, (b) mampu mempertahankan suatu keseimbangan mikroflora usus yang sehat melalui kompetisi dan inhibisi kuman=kuman patogen, (c) dapat menstimulasi bangkitnya pertahanan imun, (d) bersifat non=patogenik dan non=toksik, serta (e) harus mempunyai karakteristik teknologik yang baik, yaitu mampu bertahan hidup secara optimal dan stabil selama penyimpanan dan penggunaan (storage and use) dalam bentuk preparat makanan yang didinginkan dan dikeringkan, agar dapat disediakan secara massal dalam industri (Lisai, 2005). Tannock (1999)
1 menyimpulkan beberapa manfaat yang diperoleh dari mengkonsumsi probiotik yaitu: (1) meningkatkan sistem kekebalan tubuh, (2) mengurangi gejala diare, (3) menurunkan kadar kolesterol dalam darah, (4) mempunyai aktivitas anti karsinogenik, (5) mengikis sel tumor, dan (6) mengatur tekanan darah.
Prinsip kerja probiotik yaitu 1) mikroorganisme non=endogenus mendesak mikroorganisme patogen endogenous keluar dari ekosistem saluran pencernaan dan menggantikan lokasi mikroorganisme patogen (translokasi) di dalam saluran pencernaan, 2) menyediakan enzim yang mampu mencerna serat kasar, protein, lemak, dan mendetoksifikasi zat racun atau metabolit, dan 3) menghasilkan asam, selain itu beberapa mikroba probiotik dapat menghasilkan bahan antimikroba (bakteriosin). Probiotik dapat diberikan melalui pakan, air minum, dan kapsul. Pemberian melalui pakan merupakan cara yang terbaik untuk memperoleh jumlah dan proporsi yang tepat (Gibson dan Roberford, 1995).
Hasil riset membuktikan, bahwa bakteri probiotik bertahan hidup dalam saluran pencernaan setelah dikonsumsi. Bakteri ini tahan lizozim, asam lambung, dan asam empedu sehingga mampu mencapai usus dalam keadaan hidup. Bakteri probiotik mampu melekat pada sel=sel epithelial dan memproduksi zat metabolit yang berperan dalam menjaga dan mempertahankan mikroflora usus. Kondisi seimbang mikroflora usus memberikan aktivitas menguntungkan dan menghasilkan
efek positif bagi kesehatan (Yukuchi ., 1992).
Bakteri dapat berkolonisasi pada saluran pencernaan memerlukan pelekatan glikokonjugat yang ada pada membran mikrovili. Glikokonjugat merupakan terminal gula pada sisi rantai oligosakarida yang terletak pada membran mikrovili. Glikokonjugat ini dapat berupa glikoprotein atau glikolipid. Spesifik bakteri melekat pada spesifik gula. Bakteri probiotik dapat melakukan pelekatan pada permukaan usus untuk meningkatkan pertahanan saluran pencernaan inang. Probiotik dapat melindungi inang dari kolonisasi bakteri yang bersifat patogen dengan mekanisme yang berbeda=beda, misalnya probiotik juga mempunyai preferensi pada sebuah reseptor karbohidrat. Jika preferensi untuk menempel pada gula spesifik, misalnya
( & dan #$ memiliki preferensi yang sama pada manosa,
maka probiotik dapat melakukan kompetisi dan menghambat kolonisasi #$ .
penempelan probiotik dapat melakukan kompetisi dan menghambat kolonisasi
1
#$ $ Penempelan probiotik tersebut dapat merangsang aktifnya sel=sel epithelial
dan fungsi limfosit sehingga dapat meningkatkan kapasitas perlindungan pada sistem pertahanan mukosa (Walker, 2008).
Terdapat banyak pula kendala dalam penggunaan probiotik, termasuk kemampuan survival, kolonisasi, dan kompetisi nutrien untuk masuk ke dalam suatu lingkungan ekosistem yang sudah mengandung beberapa ratus jenis spesies bakteri lainnya. Lisai, (2005) menambahkan, jika bahan yang mengandung probiotik tidak lagi dimakan, maka bakteri yang ditambahkan itu dengan cepat akan mengalami wash=out (tidak lagi melekat dan dikeluarkan dari saluran pencernaan). Pendekatan lain yang dapat mengatasi keterbatasan pemakaian probiotik adalah dengan
penggunaan prebiotik (Lisai, 2005), yaitu suatu unsur makanan yang & ,
yang mempunyai pengaruh menguntungkan bagi inangnya, yang secara selektif menstimulasi pertumbuhan dan aktivitas metabolik dari satu atau sejumlah terbatas bakteri dalam kolon sehingga memperbaiki kesehatan induk semangnya (Gibson,
2000). Prebiotik yang dapat digunakan misalnya & oligosakarida dan
pati resisten (Gibson, 2000).
Ketahanan Bakteri Asam Laktat di Saluran Pencernaan
Roberfroid (2000), menyatakan bahwa probiotik adalah sel mikroba hidup yang dikonsumsi oleh manusia, merupakan mikroflora yang dapat hidup di saluran pencernaan dan mempunyai efek yang menguntungkan bagi kesehatan manusia. Setelah dapat melewati lambung dan usus halus, bakteri yang termasuk dalam probiotik dapat bertahan hidup di usus halus. Adanya kapasitas fermentasi pada kolon memungkinkan bakteri probiotik berkembang biak, dan hasilnya, sering ditemukan sejumlah probiotik yang terikut dalam feses. Oleh karenanya salah satu syarat bakteri termasuk probiotik adalah mampu bertahan pada kondisi sesuai saluran pencernaan yang meliputi keasaman yang tinggi dan adanya sekresi garam empedu.
Menurut Hoier (1992), beberapa kriteria yang harus diperhatikan untuk menentukan strain mikroba probiotik, yaitu: (1) mampu melakukan aktivitas dalam memfermentasikan susu dalam waktu yang relatif cepat, (2) mampu menggandakan diri, (3) tahan terhadap suasana asam sehingga mampu hidup dan bertahan dalam saluran pencernaan, (4) menghasilkan produk akhir yang dapat diterima konsumen,
1 dan (5) mempunyai stabilitas yang tinggi selama proses fermentasi, penyimpanan, dan distribusi.
Marteau . (1997) melakukan penelitian pada bakteri asam untuk
mengetahui ketahanan hidup serta kondisi saluran pencernaan melalui model dinamis
$ Bakteri asam laktat yang dipakai adalah strain tunggal
" & " ( !
$ Model saluran pencernaan yang dirancang terdiri dari dua kondisi
yang berbeda yaitu simulasi sekresi fisiologis empedu dan sekresi empedu yang rendah. Model tersebut digunakan untuk melihat gerakan peristaltik, perubahan pH, perubahan konsentrasi enzim, dan garam empedu di saluran pencernaan.
Selain sifat ketahanannya terhadap pH rendah dan garam empedu, sifat ketahanan bakteri asam laktat sebagai probiotik di saluran pencernaan juga ditentukan dengan uji penempelan. Berbagai model penempelan secara
dilakukan antara lain penempelan ke epitel usus babi oleh Kos . (2003), Mirsha
dan Prasad (2005) yang melakukan uji penempelan secara
ke sel usus tikus.
Lin . (2006) juga melakukan penelitian pada beberapa produk komersil
yoghurt, produk granul dan bubuk yang beredar di pasaran untuk menguji sifat=sifat probiotik yang telah diklaim mengandung bakteri asam laktat yang probiotik. Sifat= sifat probiotik yang diuji adalah sifat ketahanan hidup pada kondisi pH rendah dan garam empedu serta uji penempelan pada sel epitel usus. Hasil penelitiannya menunjukkan bahwa pada produk komersial yang mengandung BAL terdapat penurunan jumlah populasi bakteri yang mampu bertahan hidup pada pH 2,0.
Populasi BAL pada produk cair sekitar 105 cfu/ml pada pH 2,0 : yang lebih tinggi
dibandingkan dengan produk bubuk yaitu 104 cfu/ml. strain BAL yang mampu
bertahan hidup pada pH 2,0 juga mampu bertahan hidup pada kondisi garam empedu 0,3%.
Zoumpopoulou $ (2008) juga melakukan penelitian untuk menguji
ketahanan bakteri asam laktat pada kondisi yang disimulasikan seperti kondisi pada saluran pencernaan manusia. Ketahanan hidup strain probiotik pada larutan PBS
(Phosphat Buffer Saline) pH 2,5 ditentukan setelah inkubasi pada suhu 37oC selama
0,5: 1: 2 dan 4 jam seperti masa transit makanan di lambung. Toleransi dalam garam
1 empedu ditentukan dengan ketahanan hidup probiotik pada larutan PBS pH 8 yang mengandung 1% dan 2% (w/v) setelah diinkubasi selama 1, 2 dan 4 jam seperti masa transit makanan dalam usus halus.
Usus Halus
Usus halus merupakan bagian dari sistem pencernaan yang berfungsi mencerna dan menyerap zat=zat makanan seperti asam amino, lipid dan monosakarida (Banks, 1993). Fungsi utama usus halus adalah mengabsorpsi mikronutrien, mineral dan vitamin. Beda lokasi usus halus, berbeda pula jenis mikronutrien yang diabsorpsi (Andra, 2007).
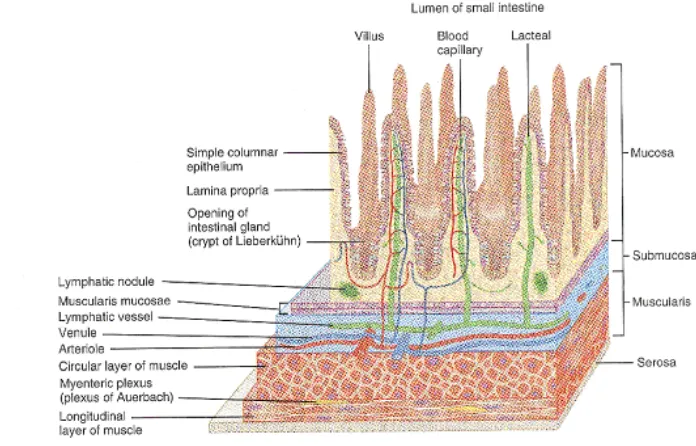
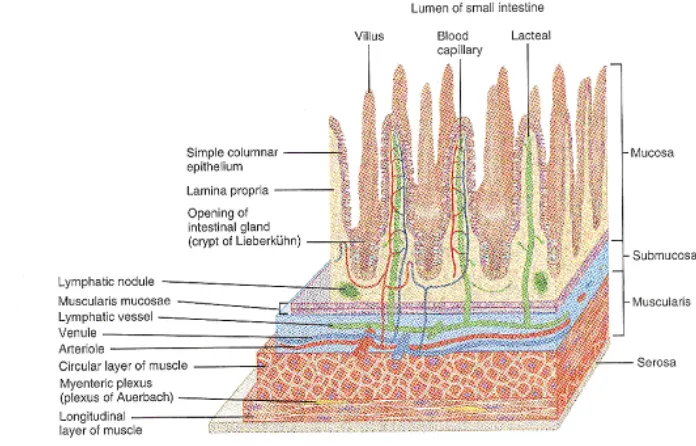
Gambar 2. Struktur Anatomi Usus Halus
Sumber: Bank, 1993
Usus halus, secara histologi terdiri dari lapisan mukosa ( "
" dan ), submukosa, muskularis (
), dan serosa ( ) (Bank, 1993). Rofiq (2003) menyebutkan,
nutrisi bahan pakan diserap melalui permukaan vili usus halus. Morfologi permukaan vili usus halus sangat berperan dalam menyerap bahan pakan, sehingga morfologi usus halus mempunyai struktur yang optimal dalam menyerap nutrisi. Struktur tersebut diamati sebagai performans vili usus halus dipengaruhi oleh beberapa faktor
1 melalui jalur kelahiran. Mikroorganisme tersebut tinggal di saluran pencernaan sampai hewan tersebut mati. Bagian dari saluran pencernaan yang paling banyak dihuni oleh bakteri adalah saluran usus. Bakteri yang menempati saluran usus dinamakan bakteri usus dan bila dianalogkan sebagai tumbuhan maka bakteri tersebut dikenal sebagai mikroflora usus (Nakazawa dan Harsono, 1992).
Mikroflora usus secara alami terdapat dalam saluran pencernaan, yang terdiri dari bermacam=macam mikrobiota yang memiliki fungsi yang penting. Komposisi mikroflora usus berubah seiring meningkatnya umur seseorang. Pada manusia dewasa sehat, mikroflora usus berada dalam keseimbangan walaupun terdapat perbedaan antara individu yang satu dengan individu yang lain (Mizutani, 1992).
Mizutani (1992) melaporkan bahwa pada orang usia lanjut, jumlah
( . akan semakin menurun atau bahkan hilang. Sedangkan
* & , # , ! ., serta
semakin meningkat dengan meningkatnya usia. Secara umum, komposisi mikroflora pada lokasi spesifik ditentukan oleh lingkungan fisik (gerakan usus) dan lingkungan kimia (perubahan pH) (Salminen dan Wright, 2004).
Nakazawa dan Hasono (1992) mendefinisikan mikroflora normal usus berdasarkan sifat=sifat yang dimilikinya yaitu: (1) dapat tumbuh di bawah kondisi anaerob, (2) biasanya terdapat di dalam saluran usus manusia dewasa, (3) dapat mengkolonisasi pada bagian spesifik saluran pencernaan, (4) dapat membangun habitat sendiri selama proses suksesi hewan muda, (5) dapat menjaga populasi pada manusia dewasa normal, dan (6) dapat melekatkan diri pada permukaan epitel usus.
Kolars . (1984) seperti yang dikutip oleh Nakazawa dan Hasono (1992)
menyatakan bahwa dapat mengetahui mikroflora normal dalam usus biasanya digunakan feses yang kemudian dipupukkan pada berbagai media dan metode kultur untuk menentukan mikroflora tersebut. Jumlah mikroba pada saluran pencernaan
1
terdiri atas 100 spesies dan lebih dari 1014 koloni bakteri, baik yang patogen maupun
menguntungkan.
Mikroflora usus pada hewan sangat kompleks dan interaksi diantara mereka saling terkait satu dengan lainnya. Interaksi itu dijadikan sebagai cara untuk menyeleksi probiotik yang akan digunakan. Umumnya mikroflora yang terdapat di dalam usus bersifat anaerobik obligat, lebih dari 200 jenis. Jenis Gram positif,
anaerobik termasuk terdiri dari 30% total yang hidup. Jenis
lainnya Gram negatif, tidak berspora sebanyak 20%. Bakteri yang bersifat Gram
positif dan tidak berspora termasuk tipe # , terdiri dari 16%, sedangkan
bentuk dan berjumlah 10% (Fuller, 1992). Kesimbangan
mikroflora usus akan tercapai apabila perbandingan antara bakteri yang menguntungkan terhadap bakteri yang merugikan sebesar 80% : 20% (Manap, 1999) atau 85% : 15% (Philip, 1993).
Mitsuoka (1989) menyatakan bahwa BAL yang sering dijumpai pada usus dapat mencapai usus dalam keadaan hidup serta dapat digunakan sebagai kultur
starter produk fermentasi adalah dan ( " sedangkan genus
dan tidak dijumpai pada usus. Pengelompokkan BAL
berdasarkan kemampuan hidupnya dalam saluran pencernaan manusia dapat dilihat pada Tabel 1.
Tabel 1. Pengelompokkan Bakteri Berdasarkan Kemampuan Hidupnya dalam Saluran Pencernaan Manusia.
Grup Distribusi dan karakteristik Genus dan contoh Spesiesnya
1
Molin . (1993) menunjukkan bahwa galur . yang
dominan pada mukosa usus manusia sangat berbeda untuk setiap orang, baik pada orang sehat maupun sakit. Pada usus kecil manusia dewasa, jumlah
sekitar 103=104 cfu/g mukosa, dan pada kolon sekitar 104=106 cfu/g mukosa,
sedangkan pada feses sekitar 108 cfu/g feses (Evaldson ., 1982 dan Lidbeck $
., 1988 dikutip oleh Molin $ ., 1993). Jumlah yang ditemukan pada
bagian dan usus besar sebesar 102=105 dan 104=109/ml atau /gram.
( . diantara bakteri yang banyak ditemukan pada usus dua belas
jari (0=104/ml atau/g) dengan jumlah meningkat sepanjang saluran pencernaan hingga
mencapai 108=1011/g pada usus besar. Mitsuoka (1989) mengemukakan lima faktor
yang dapat mempengaruhi komposisi dan metabolit flora usus yaitu makanan, obat,
kontaminasi bakteri, imunitas dan .
Mekanisme Penempelan Bakteri Pada Usus
Sebuah lapisan mukus ditemukan dalam permukaan membran mukosa. Mukus ini selalu diproduksi oleh sel. Terdapat dua jenis mukus yaitu : (1) gel tak terlarut, yang melekat kuat pada sel; (2) lapisan kental yang larut air dan dibungkus gel. Mukus ini terbentuk dari mucin yang merupakan glikoprotein yang menyusun gel tersebut. Glikoprotein inilah yang dapat menyebabkan bakteri melekat baik
secara spesifik maupun secara alami (Bourlioux $" 2003).
Kemampuan bakteri asam laktat untuk menempel pada permukaan mukosa sangat penting bukan hanya untuk menjaga keseimbangan jumlah bakteri dalam saluran pencernaan, tapi juga untuk mencegah asosiasi sel dan invasi bakteri patogen.
(Bernet=Chamard $" 1997). Kemampuan bakteri asam laktat dalam menempel
pada sel usus manusia juga dilaporkan oleh Bernet=Chamard $ (1997), strain
yang digunakan dalam penelitian tersebut dapat menempel pada sel epitel usus manusia, sehingga dapat menghasilkan substansi anti
bakteri selain bakteriosin baik secara maupun .
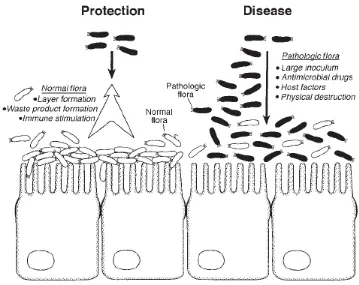
Mekanisme penempelan bakteri pada permukaan epitel usus atau yang sering disebut adhesi terjadi melalui beberapa mekanisme. Mekanisme adhesi yang pertama terjadi dengan ikatan antara struktur bakteri dengan reseptor atau ligan spesifik pada permukaan sel epitel. Mekanisme adhesi yang kedua melibatkan gen
1 , menyebabkan perubahan konsentrasi kalsium intraseluller dan arsitektur sitoskleton di bawah membran mikrovillus. Mekanisme adhesi yang ketiga adalah dengan pola agregasi (Lu dan Walker, 2001).
Gambar 2. Mekanisme Bakteri Probiotik dalam Menghambat Infeksi Patogen Sumber: Lu dan Walker, 2001.
1 MATERI DAN METODE
Lokasi dan Waktu
Penelitian ini dilakukan di Laboratorium Histologi, Departemen Anatomi Fisiologi dan Farmakologi, Fakultas Kedokteran Hewan dan Laboratorium Ilmu Produksi Ternak, Bagian Ruminansia Besar, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan Institut Pertanian Bogor dari bulan Juli 2009 hingga Februari 2010.
.
Bahan
Bahan utama yang digunakan dalam penelitian ini adalah 5 buah isolat
bakteri asam laktat ( . 1A5, 2B2, 2C12, 1A32 dan 2B4) yang telah
diisolasi dari daging sapi segar bangsa Peranakan Ongole di pasar tradisional wilayah
Bogor. Isolat disimpan dalam media MRS dengan gliserol 20% pada suhu 40C
(Arief ., 2005).
Bahan yang digunakan untuk pengujian bakteri asam laktat adalah
* & (PCA), ( . (BPW), ' % & ! (
(MRSB), ' % & ! & (MRSA), ( ! (PBS),
pewarnaan Gram (bahan yang digunakan aquades, larutan kristal violet, larutan iodin, larutan etanol, larutan safranin, larutan alkohol, minyak imersi). Pakan berupa pellet komplit dari Badan Pengawasan Obat dan Makanan (BPOM) Jakarta ,serta
sekam padi sebagai $
Hewan Percobaan. Hewan percobaan yang digunakan dalam penelitian adalah tikus
putih konvensional (% & ) jenis ! & - berumur enam
minggu berjenis kelamin jantan sebanyak 3 ekor dengan kisaran bobot 100=150 gram per ekor yang diperoleh dari BPOM Jakarta.
Alat
Peralatan yang digunakan untuk pemeliharaan dalam penelitian ini antara lain kandang tikus metabolit terbuat dari plastik dilengkapi dengan kawat penutup, kandang diberi alas berupa sekam padi dengan berat 100 gram yang diganti tiap tujuh hari. Tempat pakan berupa mangkuk plastik dan tempat minum berupa botol yang
1 Peralatan yang digunakan untuk pengujian mikroflora antara lain pipet mikro, pipet volumetrik, tabung reaksi, cawan Petri, mortar, pinset, labu Erlenmeyer, labu takar, jarum Ose, gelas objek, jangka sorong, aluminium foil, pemanas Bunsen, inkubator, vortex, ruang aseptik, refrigerator, dan alat bedah. Sterilisasi alat=alat gelas pada oven pengering (150ºC, 2 jam), sedang untuk bahan=bahan lainnya menggunakan autoklaf.
Pengambilan Sampel dan Pembuatan Preparat Histologi
Peralatan yang digunakan untuk bedah tikus dan pembuatan preparat usus
meliputi 0 , gunting, pinset, pisau bedah. Peralatan yang digunakan dalam
pembuatan preparat histologi meliputi , botol sampel, &
, inkubator, refrigerator, pemanas Bunsen" , , gelas
objek, dan & .
Bahan yang digunakan dalam pembuatan preparat histologi meliputi parafin, obat bius Ketamil Injection, larutan Formaldehid 10%, larutan Alkohol 70%, 80%, 90%, 95%, larutan Alkohol Absolut I, II, III, larutan Xylol I, II, III, larutan Parafin cair, larutan Gliserol, Air kran, larutan Hematoxylin=Eosin dan akuades.
Rancangan Percobaan
Perlakuan
Rancangan percobaan yang digunakan pada penelitian ini adalah Rancangan Acak Lengkap pola Faktorial 6 x 2 dengan 3 kali ulangan. Perbedaan isolat BAL sebagai faktor pertama yaitu kontrol, 1A32, 2B2, 2B4, 2C12 dan 1A5. Faktor kedua adalah perlakuan yaitu ileum yang dicuci PBS, ileum tanpa dicuci PBS. Penelitian ini menggunakan 3 ekor tikus, setiap ekor tikus mewakili ulangan. Rancangan ini digunakan untuk mengetahui BAL yang menempel, jumlah bakteri asam laktat dan mengidentifikasi BAL dengan metode pewarnaan Gram.
Model
Model statistik yang digunakan untuk Rancangan Acak Lengkap pola Faktorial. Model ini digunakan untuk menghitung populasi bakteri asam laktat pada permukaan usus halus.
1 Model matematis yang digunakan berdasarkan Steel and Torrie (1995) sebagai berikut :
Yijk = ; + αi + βj + (αβ)ij €ijk
Keterangan untuk model statistik populasi total bakteri, bakteri asam laktat dalam usus halus adalah:
Yijk = Variabel yang akan dianalisis
N = Nilai tengah umum
αi = Pengaruh faktor I pada taraf ke=i; i= Ileum yang dicuci PBS, Ileum tanpa
dicuci PBS.
βj = Pengaruh faktor II pada taraf ke=j; j= BAL 1A32, 2B2, 2B4, 2C12,
1A5 dan kontrol.
(αβ)ij = interaksi antara faktor I pada taraf ke=i dan faktor II pada taraf ke=j
€ijk = Pengaruh galat percobaan.
Peubah
Peubah mikrobiologis yang diamati meliputi jumlah bakteri asam laktat dalam permukaan usus halus akibat perlakuan.
Analisis Data
Data yang diperoleh dianalisis dengan Minitab 14. Data yang memenuhi asumsi akan diuji secara parametrik dengan Analisis Ragam atau
(ANOVA), apabila terdapat hasil yang berbeda nyata maka dilanjutkan dengan uji Tukey (Steel dan Torrie, 1995).
Prosedur
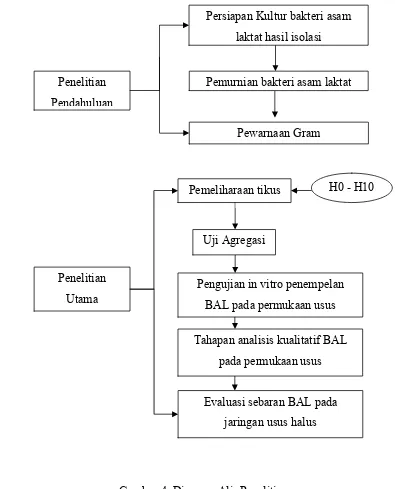
Penelitian ini terdiri dari dua tahap. Tahap pertama merupakan penelitian pendahuluan serta tahap kedua merupakan penelitian utama. Penelitian Pendahuluan meliputi (1) persiapan kultur bakteri asam laktat hasil isolasi dan (2) pemurnian kultur bakteri asam laktat. Penelitian Utama meliputi (1) Pemeliharaan tikus putih di kandang individu dan (2) pengujian penempelan bakteri asam laktat pada sel epitel usus halus. Diagram alir penelitian yang dilakukan secara garis besar dapat dilihat pada Gambar 4.
1 Gambar 4. Diagram Alir Penelitian
Persiapan Kultur bakteri asam laktat hasil isolasi
Pemurnian bakteri asam laktat Penelitian
Pendahuluan
Pewarnaan Gram
Penelitian Utama
Pemeliharaan tikus
Uji Agregasi
Pengujian in vitro penempelan BAL pada permukaan usus
Tahapan analisis kualitatif BAL pada permukaan usus
Evaluasi sebaran BAL pada jaringan usus halus
H0 = H10
1 Penelitian Pendahuluan
Persiapan kultur Bakteri asam laktat hasil isolasi.
Persiapan kultur dilakukan dengan memilih isolat bakteri asam laktat yang berasal dari daging sapi segar di pasar kota Bogor, diantara isolat yang ada spesies 1A32, 2B2, 2B4, 2C12, dan 1A5, merupakan spesies yang berpotensi untuk diuji. Kelimanya merupakan spesies bakteri asam laktat terbaik dari hasil isolasi daging
sapi segar yang telah digunakan pada penelitian sebelumnya (Arief ., 2005).
Pemurnian bakteri asam laktat. Pemurnian kultur bakteri asam laktat dilakukan
dengan memupuk masing=masing isolat sebanyak satu jarum pada media MRSB,
hasil pupukan diamati untuk melihat keseragaman koloni dengan ukuran 2=5 mm,
bentuk konveks dan tidak berpigmen. Koloni yang murni dari MRSB selanjutnya
dipupuk pada MRSA dengan cara yang sama dan diinkubasi selama 24 jam pada suhu sekitar 37ºC. Pertumbuhan koloni pada MRSA kemudian dihitung dengan metode kuadran. Sifat gram dari bakteri dievaluasi dengan menggunakan pewarnaan Gram. Morfologi sel bakteri ditentukan dengan melakukan pengamatan di bawah mikroskop cahaya pada bakteri yang telah diwarnai dengan pewarnaan Gram. Koloni
yang dihasilkan, apabila telah sesuai dengan Holt . (1994) dalam ( &
' , dilakukan pengayaan dengan MRSB dan disimpan pada suhu 4ºC sebagai
kultur Bakteri asam laktat yang siap digunakan untuk pengujian penempelan bakteri asam laktat pada sel epitel usus halus tikus.
Kultur hasil pengayaan terbaik dimurnikan lagi dengan ditumbuhkan pada MRSA yang memadat dalam cawan petri dengan menggunakan masing=masing satu jarum ose diinkubasi selama 24 jam pada suhu 37ºC. Populasi kultur bakteri asam laktat dihitung dengan pemupukan pada MRSA dan diinkubasi selama 24 jam pada
suhu sekitar 37ºC. Jika jumlah populasi telah mencapai kisaran nilai 10⁸ cfu/g,
dilakukan pewarnaan Gram kembali untuk mengecek kualitas bakteri asam laktat yang digunakan. Apabila tidak terkontaminasi oleh kapang ataupun khamir maka kultur tersebut dapat digunakan sebagai kultur bakteri asam laktat.
1 Pewarnaan Gram (Hadioetomo, 1990). Persiapan kultur starter diawali dengan pemeriksaan kultur starter dengan cara pengujian morfologi bakteri. Pengujian
morfologi kultur starter dibantu dengan metode pewarnaan Gram. Sampel bakteri
dari koloni yang homogen dioleskan pada kaca objek kemudian difiksasi dengan panas. Olesan bakteri diteteskan dengan kristal violet selama satu menit, diratakan,
dibilas dengan 1 , dan dikeringudarakan. Olesan bakteri selanjutnya
diteteskan iodium Gram selama dua menit, kemudian dibilas 1 dan ditiriskan.
Preparat dicuci dengan pemucat warna yaitu etanol 95%, tetes demi tetes selama 30
detik, dicuci segera dengan 1 dan ditiriskan. Preparat selanjutnya diteteskan
safranin selama 30 detik, dibilas dengan 1 dan ditiriskan. Setelah kering
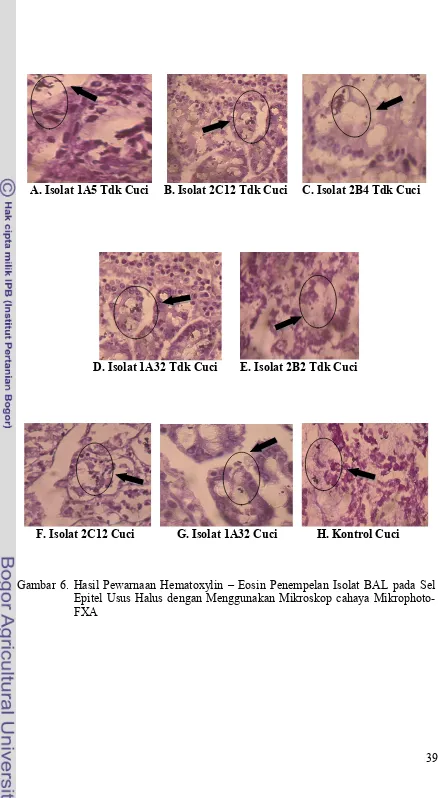
preparat diamati di bawah mikroskop dengan pembesaran 1000 kali. Hasil pewarnaan dengan metode ini terbagi menjadi dua kelompok, yaitu bakteri Gram positif yang mempertahankan zat pewarna kristal violet. Kelompok yang lain yaitu bakteri Gram negatif yang akan kehilangan warna kristal violet bila dicuci dengan alkohol 95 %, dan sewaktu diberi pewarna tandingan dengan warna merah safranin akan tampak berwarna merah. Bakteri yang termasuk dalam kelompok gram positif akan menunjukkan warna biru keunguan sedangkan kelompok bakteri gram negatif adalah berwarna merah safranin. Hasil pengamatan preparat didokumentasikan dalam bentuk fotografik.
Penelitian Utama
Pemeliharaan tikus. Tikus yang digunakan adalah tikus putih konvensional (% & ) jenis ! & yang berumur 6 minggu berjenis kelamin jantan dengan kisaran bobot 100=150 gram per ekor yang diperoleh dari Badan Pengawasan Obat dan Makanan (BPOM) Jakarta. Tikus yang digunakan berjumlah 10 ekor, setiap ekor tikus menjadi ulangan. Setiap tikus dimasukkan ke dalam kandang individu. Tikus diadaptasikan selama 5 hari dengan pemberian ransum standar BPOM yang telah mendapat jaminan sertifikasi. Setelah lima hari kemudian setiap ekor tikus dilakukan tindakan anastesi lalu pembedahan untuk memperoleh organ usus halus sebagai sampel pengujian penempelan bakteri asam laktat.
1 Uji Agregasi (Jankovic 2003). Uji agregasi dilakukan untuk mengetahui kemampuan suatu bakteri untuk membentuk koloni (agregat). Pada uji ini bakteri uji
( 1A32, 2B2, 2B4, 2C12 dan 1A5) ditumbuhkan pada MRSB
(Oxoid, CM 0359) selama 24 jam pada suhu 37°C. Agregasi dinilai positif jika pada MRSB didapatkan agregat yang jelas (partikel seperti pasir) membentuk endapan di dasar tabung dan supernatan akan terlihat jernih. Populasi sebelum diinkubasi dan populasi setelah diinkubasi dihitung untuk melihat adanya pertumbuhan bakteri asam laktat yang diuji.
Pengujian penempelan Bakteri Asam Laktat pada Permukaan usus
halus (Kos ., 2003).
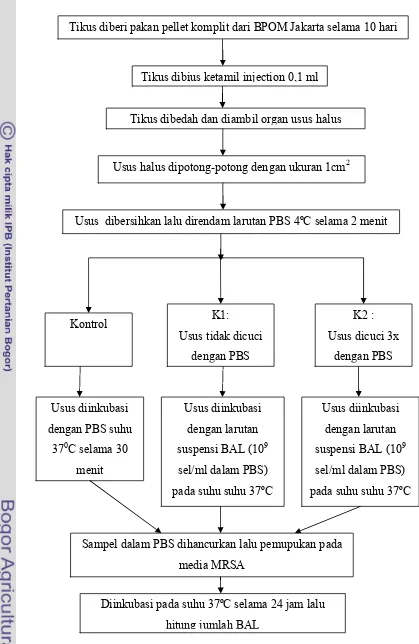
Pengambilan sampel usus pada tikus diawali dengan pembiusan tikus dengan
0 , kemudian dilakukan pembedahan mulai dari bagian dada ke arah
abdomen. Usus halus (Ileum) dipotong=potong dengan ukuran ± 1 cm2. Unit
percobaan pada penelitian ini yaitu usus halus tikus. Sampel usus selanjutnya dibagi menjadi kelompok yang tidak dicuci dan kelompok yang dicuci dengaan PBS.
Sampel yang dicuci dimasukkan ke dalam yang kemudian
direndam dengan larutan PBS pada suhu 4oC selama beberapa menit dan setelah itu
dilakukan pencucian sebanyak tiga kali. Uji penempelan dilakukan dengan menginkubasikan sampel usus ke dalam cawan Petri yang berisi larutan suspensi
bakteri 1,2 x 109 sel ml=1 dalam PBS pada suhu 37oC selama 30 menit kemudian
dibilas dengan PBS. Jumlah bakteri yang menempel dievaluasi dengan melakukan penghitungan bakteri hasil pemupukan pada media MRSA dari suspensi usus pasca
inkubasi dalam larutan suspensi bakteri 1,2 x 109 sel ml=1 dalam PBS. Tahapan proses
pengujian penempelan BAL pada permukaan usus tikus secara dapat dilihat
pada Gambar 5.
1 Gambar 5. Tahapan Proses Pengujian Penempelan BAL pada Usus Tikus
Tikus dibius ketamil injection 0,1 ml
Tikus dibedah dan diambil organ usus halus
Usus halus dipotong=potong dengan ukuran 1cm2
Usus dibersihkan lalu direndam larutan PBS 4ºC selama 2 menit Tikus diberi pakan pellet komplit dari BPOM Jakarta selama 10 hari
Kontrol K1:
Sampel dalam PBS dihancurkan lalu pemupukan pada media MRSA
Diinkubasi pada suhu 37ºC selama 24 jam lalu hitung jumlah BAL
1 Tahapan Analisis Kuantitatif Bakteri Asam Laktat (APHA, 1992) pada
Permukaan Usus Halus.
Sebanyak 1 gram sampel usus halus dimasukan kedalam tabung yang berisi 9
ml larutan ( . (BPW). Campuran dihomogenkan menggunakan
vortex sehingga didapat pengenceran sepersepuluh (P=1). Selanjutnya 1 ml dari
tabung P=1 dilarutkan kedalam larutan pengencer BPW 9 ml untuk memperoleh P=2,
demikian seterusnya dengan cara yang sama hingga mendapatkan P=7. Pemupukan
dilakukan terhadap masing=masing pengenceran yang dikehendaki (P=5 sampai P=7)
media ' % & ! & (MRSA) dengan cara 1 ml inokulan dipipet ke
dalam cawan Petri steril dan selanjutnya medium MRSA yang telah dingin (37o C)
dituang kedalam cawan Petri steril tersebut sebanyak 12=15 ml. Campuran tersebut dihomogenkan dengan cara diputar membentuk angka delapan. Setelah agar
mengeras, cawan Petri diinkubasi dengan posisi terbalik pada suhu 37o C selama 24 =
48 jam. Jumlah bakteri ditentukan dengan metode hitungan cawan dan untuk
melaporkan hasil analisa digunakan ! * (SPC).
Tahapan Proses Pembuatan preparat Histologis Usus (Analisis Histologis)
(Modifikasi Kiernan, 1990)
Kemampuan penempelan BAL pada mukosa usus halus dilakukan dengan
analisa histologis. Semua sampel ileum ukuran 1 cm2 untuk evaluasi histologis
difiksasi dalam Paraformaldehid 4%. Setelah difiksasi sampel kemudian didehidrasi dengan larutan Alkohol 70%, 80%, 90%, 95%, dan Alkohol Absolut I, II, III,
kemudian dijernihkan dengan larutan / I, II, III, selanjutnya sampel diinfiltrasi
dengan parafin I, II, III dan diblok dengan parafin. Proses selanjutnya blok dipotong dengan ketebalan 4=5 Sm menggunakan mikrotom dan diwarnai dengan pewarnaan Hematoxylin=Eosin dan siap dievaluasi. Tahapan proses pembuatan preparat histologis dapat dilihat pada Gambar 6.
1 Gambar 6. Tahapan Proses Pembuatan Preparat Histologis
Masing=masing sampel difiksasi dan dehidrasi
# &dan Parafinasi
Sampel dipotong (5Nm) dengan mikrotom
Sampel direkatkan dengan &
Pewarnaan dengn Hematoxylin dan Eosin
Pengamatan secara mikroskopis dan dokumentasi
Kontrol K1:
Usus tidak dicuci dengan PBS
K2 : Usus dicuci 3x
dengan PBS
1 HASIL DAN PEMBAHASAN
Penelitian Pendahuluan
Penelitian pendahuluan meliputi persiapan kultur bakteri asam laktat (BAL) asal daging sapi, dan persiapan pewarnaan bakteri untuk diidentifikasi. Tujuan dari penelitian pendahuluan adalah untuk memeriksa karakteristik morfologis dan kemurnian isolat bakteri yang digunakan. Isolat bakteri yang digunakan berjumlah 5 isolat yang berasal dari daging sapi. Karakteristik morfologis yang diamati meliputi respon terhadap pewarnaan Gram, bentuk dan susunan sel.
Kelompok genus adalah bakteri Gram positif, katalase negatif,
dan memiliki bentuk batang (Fardiaz, 1992). Isolat 1A32, 2B2, 2B4, 2C12, dan 1A5 tergolong dalam Gram positif yang mempunyai bentuk batang dengan susunan tunggal atau rantai serta uji katalase yang negatif. Berdasarkan hasil uji fermentasi gula menunjukkan 1A32 dan 2B4 merupakan spesies bakteri
dengan tingkat akurasi 96% dan 99% (Hidayati, 2006). Hal ini sesuai dengan penelitian terdahulu yang menyatakan bahwa isolat bakteri tersebut tergolong dalam
kelompok genus $ dan ! $ Perbedaan kemampuan
isolat dalam memfermentasi beberapa gula menunjukkan bahwa isolat=isolat tersebut adalah isolat yang berbeda (Hidayati, 2006).
Kultur asal daging sapi lokal yang digunakan merupakan kelompok BAL. Lima buah isolat BAL yang diisolasi dari daging sapi merupakan Gram positif dengan hasil uji katalase negatif. Hasil tersebut menunjukkan bahwa kultur tidak tercemar dan masih homogen seperti yang diperoleh dari penelitian sebelumnya (Hidayati, 2006).
Pemeriksaan Kemurnian Bakteri Asam laktat
1 masing isolat BAL yang sudah diisolasi sebelumnya dari daging sapi segar yang beredar di Bogor (Hidayati, 2006).
Pewarnaan gram
Pewarnaan gram merupakan metode uji untuk mengetahui makromolekul dinding sel setiap isolate bakteri uji. Komposisi kimia dinding sel mikroba sangat bervariasi, sehingga terdapat perbedaan kemampuan mengadsorpsi (melekat) di antara spesies, galur dan bahkan diantara tipe sel pada organisme yang sama
(Yuniarti ., 2003). Bakteri berdasarkan reaksi pewarnaan gram dibedakan
menjadi bakteri Gram positif dan Gram negatif.
Sebanyak 5 isolat bakteri asam laktat dilakukan pengujian pewarnaan gram. Hasil yang didapatkan ternyata isolat 1A32, 2B2, 2B4, 2C12, 1A5 merupakan bakteri Gram positif. Hasil ini ditunjukkan dengan hasil pewarnaan pada sel bakteri berwarna biru yang dilihat di bawah mikroskop dengan pembesaran 1000 kali. Uji pewarnaan pada kultur ini sesuai dengan hasil yang dilakukan oleh Hidayati (2006) yang menyatakan bahwa 28 kultur ini merupakan bakteri Gram positif. Pato (2003) menegaskan bahwa BAL adalah kelompok bakteri Gram positif. Fardiaz (1992) menjelaskan bahwa pada bakteri Gram positif dinding selnya tersusun oleh
peptidoglikan dan lapisan tipisnya terikat. Yuniarti ., (2003) menegaskan bahwa
dinding sel bakteri Gram positif merupakan struktur yang sangat renggang (porous) dengan komponen utama peptidoglikan yang mengandung gugus asam.
Proses pewarnaan tahap pertama adalah memberi pewarna basa kristal violet yang menyebabkan membran sitoplasma yang terdiri dari protein dan lipid akan menyerap warna. Tahap selanjutnya dalam pewarnaan Gram adalah memberi larutan iodium sehingga akan terbentuk suatu kompleks antara kristal violet dengan iodium. Perlakuan selanjutnya adalah pencucian dengan menggunakan alkohol, proses ini akan mengakibatkan dinding sel akan mengalami dehidrasi yang kemudian pori= porinya mengkerut, permeabilitas menurun sehingga kompleks Kristal violet dan iodium yang sudah terbentuk pada membran sitoplasma tidak bisa keluar dan saat diberi pewarna safranin yang berwarna merah. Pewarna safranin dapat masuk ke dalam membran sitoplasma. Kompleks kristal violet dan iodium tidak terpengaruh, sehingga sel bakteri Gram positif tetap berwarna biru.
1 Morfologi Sel
Konfirmasi bakteri uji yang terakhir diuji adalah morfologi sel. Sebanyak 5 isolat BAL dikarakterisasi berdasarkan morfologi selnya untuk mengetahui bentuk bakteri dari masing=masing isolat dengan menggunakan mikroskop. Fardiaz (1992) menyatakan bahwa berdasarkan bentuk morfologinya bakteri dibagi menjadi 3 golongan yaitu golongan batang (basil), bulat (kokus), dan golongan spiral.
Preparat masing=masing isolat yang sudah dilakukan pewarnaan Gram diamati bentuknya dibawah mikroskop dengan pembesaran 1000 kali. Hasil pengamatan morfologi sel 5 isolat BAL dapat dilihat pada Tabel 2 yang menyatakan bahwa isolat tersebut antara lain: 1A32, 2B2, 2B4, 2C12, 1A5 merupakan bakteri bakteri berbentuk batang (basil) dengan susunan tunggal dan pendek. Isolat ini
merupakan kelompok bakteri asam laktat genus (Fardiaz, 1992).
1 Tabel 2. Karakteristik 5 Isolat Bakteri Asam Laktat Berdasarkan Morfologi dan
1 Pertumbuhan Bakteri Asam Laktat pada Suhu 37 °C
Isolat bakteri asam laktat yang telah dimurnikan sebanyak 5 buah kemudian
diinkolasikan dalam tabung reaksi yang berisi media ' % & ! (
(MRSB) pada masing=masing isolat, kemudian masing=masing tabung reaksi yang sudah diinokulasi kultur diinkubasi pada suhu 37 °C selama 24 jam.
Hasil penelitian menujukkan untuk isolat 1A32, 2B2, 2B4, 2C12 dan 1A5 dapat tumbuh pada suhu 37°C. Isolat=isolat ini mampu tumbuh dengan baik pada suhu 37 °C dan 45 °C terlihat kekeruhannya (+++). Kekeruhan ini merupakan indikator bakteri dapat tumbuh dengan baik atau tidak dalam media MRSB, semakin keruh media MRSB yang sudah diinokulasi bakteri maka bakteri tersebut dapat tumbuh dengan baik. Menurut Fardiaz (1992) bakteri ini termasuk kedalam golongan bakteri mesofil yaitu bakteri yang mampu tumbuh pada suhu minimal 10=20 °C, maksimal pada suhu 45 °C dan pertumbuhan optimal pada suhu 37 °C. Suhu 37 °C merupakan suhu optimum pertumbuhan isolat=isolat ini terlihat dari kekeruhan yang paling keruh pada suhu ini. Hal ini seperti dilihat pada Gambar 3.
Keterangan : Tingkat Kekeruhan a : tidak keruh (=) b : sedikit keruh (+) c : keruh (++)
d : sangat keruh (+++)
Gambar 3. Kekeruhan pada Uji Pertumbuhan BAL pada Suhu 37 ºC
Napitupulu $ (2000) melaporkan bahwa menghasilkan anti
bakteri. Filtrat dapat menghambat pertumbuhan bakteri patogen
! " ! " dan # "bahkan filtrat yang sudah
disimpan selama 6 bulan memiliki kemampuan sama. juga mampu
menghambat pertumbuhan bakteri lain yang merugikan atau patogen (Tagg $"
1976). Goldin dan Gorbach (1992) mengatakan bahwa beberapa substansi
antimikroba yang dihasilkan bakteri probiotik, misalnya $ menghasilkan
1
acidotin, acidophilin, bacteriocin, lactocidin, $ & (bulgarican), $
(lactolin), $ (lactobullin, lactobrevin), dan $ (rauterin).
Beberapa kriteria penting untuk karakter fisiologi yang merupakan seleksi kelayakan bakteri sebagai produk probiotik antara lain uji pertumbuhan/resistensi bakteri probiotik pada pH rendah. Fetlinski dan Stepaniak (1994) menyebutkan bahwa dapat tidaknya suatu bakteri sebagai probiotik tergantung resistensi atau ketahanan probiotik terhadap pH rendah, garam empedu, dan kemampuan untuk hidup dalam sistem pencernaan. Berdasarkan hal di atas dilakukan penelitian ini,
yang bertujuan untuk mendapatkan isolat terseleksi sebagai kandidat
probiotik dengan mengetahui resistensi/ketahanan hidup beberapa isolat bakteri pada pH rendah.
Jumlah Bakteri Asam Laktat dalam Usus Halus Tikus
Bakteri asam laktat dalam saluran pencernaan merupakan bakteri yang bersifat nonpatogen yang sangat penting peranannya dalam menjaga kesehatan saluran pencernaan (Nakazawa dan Hosono, 1992). Jumlah bakteri asam laktat
dalam suspensi 1,2 x 109 cfu/cm² atau 9,07 log10 cfu/cm². Jumlah bakteri asam laktat
dalam usus halus seperti dilihat pada Tabel 3.
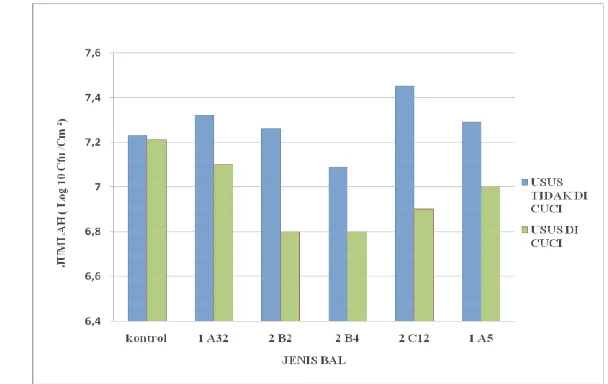
Tabel 3. Rataan Jumlah Bakteri Asam Laktat (BAL) dalam Usus Halus Tikus
Perlakuan Jenis Bakteri Asam Laktat RataD
rata
Kontrol 1A32 2B2 2B4 2C12 1A5
DDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDD ( log 10 cfu/ cm² usus halus ) DDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDDD
Cuci PBS 7,21±0,17 7,10±0,17 6,80±0,20 6,80±0,30 6,90±0,35 7,00±0,005 6,96±0,19
Tanpa
Cuci PBS
7,23±0,48 7,32±0,74 7,26±0,30 7,09±0,32 7,45±1,18 7,29 ±1,31 7,27±0,72
RataDrata 7,22±0,33 7,21±0,45 7,03±0,25 6,94±0,31 7,18±0,77 7,14 ±0,66
1 Berdasarkan hasil penelitian dengan pengujian statistik (Tabel 3), rataan jumlah bakteri asam laktat pada usus halus tidak dipengaruhi oleh perlakuan dan jenis BAL yang digunakan (P>0,05). Usus tikus yang mendapat perlakuan pencucian PBS memiliki rataan populasi bakteri asam laktat dalam usus sekitar 6,96 ± 0,19;
usus tikus kontrol 7,22± 0,33 dan usus tikus tanpa perlakuan pencucian PBS 7,27±
0,72. Jumlah BAL dalam usus halus tanpa pencucian PBS lebih banyak dibandingkan dengan usus pencucian PBS. Hal ini karena BAL pada perlakuan tanpa pencucian PBS lebih banyak menempel pada lendir mukosa usus sedangkan pada perlakuan pencucian PBS BAL menempel terjadi di dalam sel sehingga mampu menginvasi patogen dan dapat dijadikan standar sebagai kandidat probiotik.
Kultur yang digunakan dalam penelitian sifat penempelan pada sel epitel usus
secara adalah kode 1A5, 2B2, 2B4, 2C12 dan 1A32 yang
merupakan hasil isolasi asal daging sapi. Kelima isolat bakteri asam laktat tersebut dapat meningkatkan jumlah bakteri asam laktat dalam saluran pencernaan. termasuk golongan bakteri asam laktat yang sering dijumpai pada makanan fermentasi, produk olahan ikan, daging, susu, dan buah=buahan (Napitupulu
$" 1997). Sejauh ini telah diketahui bahwa keberadaan bakteri ini tidak bersifat patogen dan aman bagi kesehatan sehingga sering digunakan dalam industri pengawetan makanan, minuman dan berpotensi sebagai produk probiotik. Sifat yang
menguntungkan dari bakteri dalam bentuk probiotik adalah dapat
digunakan untuk mendukung peningkatan kesehatan. Bakteri tersebut berperan sebagai flora normal dalam sistem pencernaan. Fungsinya adalah untuk menjaga keseimbangan asam dan basa sehingga pH dalam ileum dan kolon konstan. Bakteri asam laktat yang mampu bertahan dalam saluran pencernaan antara lain,
. 1A5, 2C12 dan 1A32 sedangkan kode 2B2 dan
2B4 jumlahnya lebih rendah sehingga tidak mampu bertahan dalam saluran pencernaan.
Selanjutnya Alcamo (2000) mengatakan bahwa $ dan $
dapat aktif pada pH rendah dan menghasilkan asam laktat dalam jumlah banyak sehingga pada makanan ternak dapat membantu menyimpan energi. Tidak terjadi perubahan jumlah bakteri asam laktat dalam usus halus pada perlakuan pencucian PBS dan tanpa pencucian PBS. Jumlah bakteri asam laktat yang terdapat
1
dalam usus juga relatif rendah yaitu antara 6,90=7,30 log 10 cfu/cm2. Jumlah bakteri
asam laktat dalam usus ini cenderung normal karena masih berada pada kisaran 108=
109 cfu/cm2 atau log10 8=9 (Mitsuoka, 1989). Diagram rataan jumlah bakteri asam
laktat akibat pencucian PBS ditunjukkan dengan Gambar 4.
Gambar 4. Diagram Jumlah Bakteri Asam Laktat terhadap Pencucian PBS
Jumlah bakteri asam laktat pada usus halus tanpa perlakuan pencucian PBS lebih tinggi dibandingkan jumlah bakteri asam laktat pada usus halus yang diberi perlakuan pencucian PBS. Hal ini mengindikasikan bahwa sebagian besar isolat bakteri asam laktat 1A5, 2C12 dan 1A32 lebih mampu bertahan hidup di dalam usus halus tanpa perlakuan pencucian PBS. Diagram jumlah BAL menunjukkan perlakuan pencucian PBS menyebabkan penurunan, ini terjadi karena penanganan pada proses pembersihan vili usus ketika dipotong yang terlalu lama sehingga menyebabkan terjadinya kerusakan pada lapisan mukosa yang terdapat pada vili usus yang menghambat BAL untuk menempel pada lapisan tersebut serta proses inkubasi pada suspensi BAL yang singkat.
Ketidakmampuan kode 2B2 dan 2B4 bertahan dalam
saluran pencernaan berkaitan dengan rendahnya kemampuan menempel
kode 2B2 dan 2B4 pada saluran pencernaan. Battacharya dan Majumdar (1983) menyatakan bahwa kemampuan menempel bakteri dalam saluran pencernaan dipengaruhi beberapa faktor. Faktor=faktor yang mempengaruhi kemampuan menempel dari bakteri tersebut adalah asal bakteri tersebut, polisakarida
1 dan glikoprotein pada permukaan sel bakteri, adanya inhibitor pada permukaan epitel usus halus (saluran pencernaan) serta gerakan usus dalam saluran pencernaan. Mukus merupakan secret jernih dan kental serta melekat, membentuk lapisan tipis, berbentuk gel kontinyu yang menutupi dan beradhesi pada permukaan epitel mukosa. Tebal mukus bervariasi antara 50=450 Nm dengan komposisi sangat bervariasi tergantung spesies dan lokasi, anatomi dan keadaan normal organisme. Secara umum komposisinya terdiri dari air 95 %, glikoprotein dan lemak 0,5=5,0 %, garam=garam mineral 1 % dan protein bebas 0,5=1 %. Komponen utama mukus yang bertanggung jawab pada viskositas serta sifat adhesi dan kohesinya adalah glikoprotein, suatu protein berbobot molekul tinggi yang memiliki unit oligosakharida (rata=rata 8=10 residu monosakharida dari 5 jenis monosakharida, seperti L=fukosa, D=galaktosa, N= asetil=D=glukosamin, N=asetil=D=galaktosamin dan asam sialat
kode 2B2 dan 2B4 tidak dapat menempel pada permukaan saluran pencernaan walaupun diisolasi dari mamalia hal ini tidak sesuai dengan
Battacharya dan Majumdar (1983) menyatakan bahwa jenis yang dapat
menempel pada saluran pencernaan tikus adalah yang berasal dari
mamalia. Jumlah bakteri asam laktat yang sudah maksimal dalam saluran pencernaan dan menempel pada permukaan epitel usus juga menjadi penghambat (inhibitor) bagi kode 2B2 dan 2B4 untuk menempel pada saluran pencernaan.
Gerakan usus saluran pencernaan yang cepat juga mendorong kode
2B2 dan 2B4 keluar dari saluran pencernaan dan tidak menempel pada saluran pencernaan. Gerakan usus yang cepat mengakibatkan bakteri yang sulit menempel pada saluran pencernaan terbawa bersama sisa=sisa makanan yang akan dibuang dalam bentuk feses.
Beberapa cara untuk meningkatkan populasi bakteri nonpatogen dalam saluran pencernaan menurut Lu dan Walker (2001) adalah dengan pemberian nutrisi yang baik, lingkungan yang stabil dan melakukan pemberian sinbiotik yang dapat
berinteraksi dengan mikroflora normal usus. Bourlioux . (2003) menyatakan
bahwa bakteri dalam saluran pencernaan membutuhkan nutrisi dan energi untuk tumbuh dan berkembangbiak. Pertumbuhan dan perkembangan bakteri ini biasanya terjadi di usus halus. Nutrisi yang digunakan oleh bakteri adalah makanan yang tidak terserap, mucin dan sel=sel mati serta metabolit yang dihasilkan oleh bakteri. Hasil