11. Jawaban: C
Reaksi: CrCl3→ Cr3+ + 3Cl–
Mol Cr3+ = mol larutan CrCl
3 = M × V = 1,0 × 1= 1 mol
Massa Cr yang mengendap di katoda = 1 mol × 52 gram/mol = 52 gram
e.i.t W e.F
96.500
Ar 52
e 17,33
Jumlah elektron 3 e.i.t
W
96.500 96.500.W t
i.e
96.500 52 5.018.000
t 48.250 detik
17,33 6 103,98
= =
= = =
=
=
×
= = =
×
12. Jawaban: B
Pada reaksi SO2 → HSO3- bilangan oksidasi S tetap.
• Nilai S pada SO2 S + 2(O) = 0 S + 2(–2) = 0 S – 4 = 0 S = + 4
• Nilai S pada HSO3–
H + S + 3(O) = –1 1 + S + 3(–2) = –1 S – 5 = –1
S = +4
13. Jawaban: D Reaksi:
2 3 2
2 3 2 3
Fe O + 3CO 2Fe + 3CO
11,2
Mol Fe = = 0,2 mol 56
1
Mol Fe O 0,2 0,1 mol 2
Massa Fe O 0,1 160 16 kg
→
= × =
= × =
14. Jawaban: D
Gas SO2 dan NO2 adalah gas hasil dari industri yang dapat menyebabkan hujan asam, karena apabila SO2 dan NO2 bereaksi dengan air akan menghasilkan H2SO4 dan HNO3 yang membuat pH air menjadi asam sekitar 3–4.
15. Jawaban: C
E° reduksi > E° oksidasi E° = Eo reduksi – E° oksidasi
Larutan
BAB 9
Larutan Elektrolit dan Non-Elektrolit
A.
Larutan merupakan campuran homogen antara dua zat atau lebih. Berdasarkan daya hantarnya larutan terbagi 2 yaitu:
1. Larutan Elektrolit
Larutan elektrolit adalah larutan yang dapat menghantarkan listrik, karena di dalam larutan mengalami ionisasi. Larutan yang bersifat seperti ini adalah asam, basa, dan garam seperti NaCl, HCl, NaOH, dll. Berdasarkan kekuatan terionisasinya larutan elektrolit terbagi 2 yaitu elektrolit kuat dan elektrolit lemah. Berikut perbedaan dari elektrolit kuat dan elektrolit lemah:
No Elektrolit Kuat Elektrolit Lemah
1
Dalam air terionisasi sempurna (reaksi berkesudahan).
Dalam air terionisasi sebagian (reaksi setimbang), maka mem-punyai Ka atau Kb.
2 Daya hantar listrik kuat. Daya hantar listrik lemah. 3
Dalam alat uji elektrolit ditandai: Lampu menyala terang.
Gelembung gas banyak.
Dalam alat uji elektrolit ditandai: - Lampu redup/mati.
- Gelembung gas sedikit. 4 Derajat ionisasi (α = 1). Derajat ionisasi ( 0 < α < 1). 5
Contoh:
- Asamida (HCl, HBr, HI).
- Asam oksi (H2SO4, HNO3, HClO4, HClO3). - Basa (NaOH, KOH, Ca(OH)2, Ba(OH)2) - Garam yang terlarut dalam air (sebagian
besar terlarut dalam air): NaCl, K2SO4.
Contoh:
- Sebagian asam, selain yang kuat: CH3COOH, HCN
- Sebagian basa, selain yang kuat: NH4OH, Al(OH)3, Cu(OH)2, dll.
- Sebagian kecil garam, seperti garam rangkap: K2SO4, Al2(SO4)3 .24 H2O (tawas)
2. Larutan Non-Elektrolit,
Larutan Asam dan Basa
B.
Air yang merupakan larutan netral dapat menghantarkan arus listrik apabila diberi tegangan tinggi. Karena saat diberi tegangan tinggi, air akan mengalami ionisasi. Reaksi yang terjadi yaitu:
H2O ↔ H+ + OH–
Reaksi ionisasi mempunyai tetapan kesetimbangan yang dilambangkan dengan Kw (1 × 10–14 pada suhu 25oC) sehingga rumus dari reaksi diatas menjadi:
Kw = [H+] [OH-]
Pada air murni, [H+] = [OH–], sehingga: Kw = [H+] [OH–]
Kw = [H+]2 atau K w = [OH
–]2
Contoh soal:
1. Berapakah konsentrasi ion OH– dalam suatu larutan yang mengandung konsentrasi ion H+ 0,05 M? 2. Pada suhu tertentu harga Kw = 1 × 10–13. Tentukanlah:
a. Konsentrasi ion H+ dalam air murni.
b. Konsentrasi ion OH– jika konsentrasi H+ 0,02 M.
Jawab:
1. Kw = [H+] [OH–]
– w
+ -14
-2
K [OH ]
H
1 10 5 10
=
× =
×
= 2 × 10–13 M
2. a. Kw = [H+]2
+
w 13
12 6 –7
H K
1 10
0,1 10
0,316 10
3,16 10
−
−
− =
= ×
= ×
= ×
= ×
b. Kw = [H+] [OH–]
– w
+
K OH
H
=
13
2 12
1 10
2 10
5 10 M
−
−
− × =
Indikator
C.
Indikator asam basa adalah zat warna yang mempunyai warna yang berbeda dalam larutan asam dan larutan basa. Ciri-ciri dari larutan asam, basa maupun netral yaitu:
No Larutan Asam Larutan Basa Larutan Netral
1 Rasanya asam. Rasanya pahit. Rasanya bervariasi. 2 Merubah lakmus biru menjadi
merah.
Merubah lakmus merah menjadi biru.
Tidak merubah warna kertas lakmus.
3 [H+] > [OH–] [H+] < [OH–] [H+] = [OH–]
4 Terurai menjadi ion H
+ dan ion
negatif sisa asam.
Terurai menjadi ion positif logam dan ion OH–.
Terurai menjadi [H+] dan [OH–].
5 Bersifat korosif. Contoh: cuka, air aki (H2SO4), HCl, HNO3.
Bersifat melarutkan kulit (kaustik). Contoh: air sabun, air kapur, air abu.
Tidak bersifat korosif. Contoh: NaCl, alkohol, urea.
Kertas Lakmus
D.
Terdiri dari kertas lakmus merah dan kertas lakmus biru.
Kertas Lakmus Sifat Larutan
Asam Basa Netral
Merah Merah Biru Merah Biru Merah Biru Biru
Indikator Alami
E.
Berasal dari tumbuhan berwarna seperti kembang sepatu, mawar, bougenville, kulit manggis, bunga terompet, bunga kana, dan kunyit. Berikut beberapa hasil uji larutan dengan ekstrak bunga:
Bunga Air Cuka (Asam) Air Kapur (Basa) Air Suling (Netral)
Terompet Merah Hijau Ungu Kana Jingga Hijau muda Kuning Kembang sepatu Merah Hijau Merah
Kulit manggis Coklat kemerahan Biru kehitaman Ungu Kunyit Kuning cerah Jingga kecoklatan Kuning
Indikator Buatan
F.
Merupakan indikator yang digunakan dalam laboratorium, seperti:
Indikator Asam Basa Netral
Sekilas Info Kimia!
Pada saat titrasi HCl dengan NaOH, titik ekuivalen akan terlihat dengan menggunakan indikator fenolf-talein. Indikator ini mempunyai trayek pH antara 8,3– 10,0 yang akan membentuk warna ketika pH mulai memasuki 8,3. Titik ekuivalen titrasi HCl dan NaOH adalah 7 sehingga tepat pada titik ekuivalen terse-but fenolftalein belum berubah warna. Namun, jika kelebihan 1 tetes pH akan langsung berubah men-jadi 10 dan ini menunjukkan bahwa batas kesalahan masih berada dalam batas yang sangat kecil
sehing-ga indikator fenolftalein dapat digunakan untuk menunjukkan titik ekuivalen pada titrasi asam kuat (HCl) dengan basa kuat (NaOH).
Teori Asam-Basa
G.
1. Lavoiser
Bahwa setiap asam mengandung unsur oksigen.
2. Humphrey Davy
Bahwa hidrogen merupakan unsur dasar dari setiap asam.
3. Gay Lussac
Asam adalah zat yang dapat menetralkan basa (alkali) dan kedua golongan senyawa itu (asam dan basa) hanya dapat dideinisikan dalam kaitan satu dengan yang lain.
4. Arrhenius
Asam adalah zat yang di dalam air dapat melepaskan ion H+ sedangkan basa melepaskan ion OH-. • Asam Arrhenius
Dirumuskan sebagai: HxZ → x H+ + Zx– Contohnya:
HCl → H+ + Cl– H2SO4→ 2H+ + SO
4 2–
Jumlah ion yang dihasilkan oleh satu molekul asam disebut valensi asam dan ion negatifnya disebut sisa asam.
• Basa Arrhenius
Adalah hidroksi logam yang terionisasi menjadi: M(OH)x→ M x+ + x OH–
Contohnya:
NaOH → Na+ + OH–
Titik setara
Volume pada 0,1000 M NaOH, mL
0,0 2,0
5,0 10,0 15,0 20,0 25,0 30,0 35,0 40,0 45,0 50,0 4,0
6,0 8,0 10,0 12,0 14,0
Selang pH, alizarin kuning R Selang pH, fenolftalein Selang pH, feno merah Selang pH, metil merah
Mg(OH)2→ Mg2+ + 2OH–
Jumlah ion OH– yang dihasilkan oleh satu molekul basa disebut valensi basa dan ion positifnya disebut sisa basa.
5. Bronsted-Lowry
Bronsted-Lowry menyusun pengertian asam dan basa yang baru setelah melihat kenyataan bahwa asam dan basa juga terdapat dalam larutan yang pelarutnya bukan air. Asam dan basa juga tidak selalu mengandung ion H+ atau OH–, contohnya adalah pada reaksi antara natrium amida dengan ammonium klorida dalam ammonia cair.
Menurut Bronsted dan Lowry, asam adalah semua zat baik dalam bentuk molekul atau ion yang dapat memberikan proton (donor proton). Sedangkan basa adalah semua zat baik dalam bentuk molekul maupun ion yang dapat menerima proton (akseptor proton).
Proton: H+
Asam → H+ + basa konjugasi Basa + H+→ asam konjugasi Contohnya:
HCl + H2O↔ H3O+ + Cl–, bila diuraikan menjadi:
HCl → H+ + Cl–
Asam Basa
H2O + H+→ H 3O
+
Basa Asam
Jadi, pasangan asam-basa konjugasi adalah: • HCl dan Cl–
• H2Odan H3O+ Keterangan:
a. HCl lebih proton dibanding Cl– sehingga HCl disebut asam konjugasi, sebaliknya Cl– yang
kekurangan proton disebut basa konjugasi dari HCl. b. H2Okekurangan proton dibanding H3O+ sehingga H
2O disebut basa konjugasi dari H3O
+ sebaliknya
H3O+ kelebihan proton dibanding H
2Osehingga disebut asam konjugasi dari H2O.
Larutan Asam
H.
Berdasarkan kekuatan asamnya, larutan asam dibagi menjadi 2 yaitu:
1. Asam Kuat
Yaitu asam yang seluruh molekulnya terurai menjadi ion. Contoh:
H2SO4→ 2 H+ + SO 4
2–
[H+] = x . M
Keterangan:
M = konsentrasi asam x = valensi asam
Contoh soal:
Hitunglah konsentrasi ion H+ dalam 200 ml larutan H
2SO4 0,01 mol. Jawab:
H2SO4→ 2H+ + SO 4
2– M = mol/liter
= 0,01/0,2 = 0,05 M
[H+] = x.M = 2 × 0,05 M = 0,1 M
2. Asam Lemah
Yaitu asam yang hanya sebagian molekulnya terurai menjadi ion. Contoh:
CH3COOH → CH3COO– + H+ HCN → H+ + CN–
a
H+ K .M
=
Rumus lainnya adalah: [H+] = α × M
a
K M
mol zat terurai mol zat mula-mula α
α
=
=
Keterangan:
α = derajat ionisasi Ka = tetapan ionisasi asam M = konsentrasi asam
Contoh soal:
Hitunglah konsentrasi ion H+ larutan CH
3COOH 0,001 M jika diketahui tetapan ionisasi asam 1 × 10–5.
Jawab: +
a
H K M
= ×
+ a
+ -5 3
4
H K M
H (1 10 ) (1 10 )
1 10 8 1 10
−
−
−
= ×
= × × ×
= ×
= ×
Larutan Basa
I.
1. Basa Kuat
Contoh:
NaOH → Na+ + OH– Mg(OH)2→ Mg2++ 2OH–
[OH–] = x . M
Keterangan:
M = konsentrasi basa x = valensi basa
Contoh soal:
Hitunglah konsentrasi ion OH– jika 4 gr NaOH (Mr = 40) dilarutkan dalam 500 ml air. Jawab:
g 1000 M
Mr ml 4 1000
40 500 0,2 M
= ×
= ×
=
[OH–] = x.M
= 1 × 0,2
= 0,2 M
2. Basa Lemah
Contoh:
NH3→ NH4+ + OH–
-b
H K .M
=
Rumus lainnya: [OH–] = α.M
mol zat terurai mol zat mula-mula α=
Keterangan:
Contoh soal
Hitunglah konsentrasi ion OH– dalam larutan NH
3 0,01 M, jika Kb = 1 × 10 –5. Jawab:
(
) (
)
b
5 2
6 4 4
OH K .M
1 10 1 10
0,1 10
0,316 10
3,16 10
−
− −
−
−
− =
= × × ×
= ×
= ×
= ×
Derajat Keasaman (pH)
J.
Yang dimaksud dengan derajat keasaman atau pH adalah konsentrasi ion H+ dalam larutan. Istilah ini diajukan oleh Sorensen, dengan p berasal dari kata ‘potenz’ artinya pangkat dan H menyatakan atom hidrogen.
pH = –log [H+] pOH = –log [OH–] pKw = pH + pOH 14 = pH + pOH pH = 14 – pOH pOH = 14 – pH
Larutan netral pH = pOH = 7 Larutan asam pH < 7
Larutan basa pH > 7
1. Pengukuran pH
Cara menentukan pH suatu larutan dapat dilakukan dengan cara: a. Menggunakan indikator
Indikator mempunyai trayek perubahan warna yang berbeda-beda. Dari uji larutan dengan beberapa indikator diperoleh daerah irisan pH larutan.
b. Menggunakan Indikator universal
Indikator universal merupakan gabungan dari beberapa indikator. Indikator universal yang biasa digunakan adalah metal jingga, metal merah, bromtimol biru dan fenolftalein.
c. Menggunakan pH-meter
Merupakan alat pengukur pH dengan ketelitian yang tinggi. pH-meter dapat menentukan pH larutan sampai 2 angka desimal.
2. pH Larutan Asam
Keterangan:
M = konsentrasi asam x = valensi asam
Contoh soal:
Hitung pH larutan H2SO4 100 ml jika dalam larutan tersebut terdapat 0,01 mol H2SO4! Jawab:
mol M
l 0, 01
0,1 l 0,1 M
=
= =
H2SO4→ 2H+ + SO 4
2– [H+] = x.M
= 2 × 0,1 M = 0,2 M
pH = –log [H+] = –log [2 × 10-1] = 1 – log 2 = 0,7 b. Asam lemah
+ +
a +
pH log[H ]
[H ] K .M
[H ] α.M
= − = = Keterangan:
α = derajat ionisasi Ka = tetapan ionisasi asam M = konsentrasi asam
Contoh soal:
Hitunglah pH larutanCH3COOH0,01 M jika α = 0,1! Jawab:
[OH–] = α.M = 0,1 × 0,01 = 1 × 10–3 M
3. pH Larutan Basa
a. Basa Kuat [OH–] = x.M pOH = –log [OH– pH = 14 – pOH
Keterangan:
M = konsentrasi basa x = valensi basa
Contoh soal:
Hitunglah pH larutan NaOH 0,1 M dalam air? Jawab:
[OH–] = x.M = 1 × 0,1 = 0,1 M
pOH = –log [OH–] = –log [1 × 10–1]
= 1
pH = 14 – pOH = 14 – 1 = 13
b. Basa lemah –
b
OH K M
= ×
[OH–] = α .M pOH = –log [OH–] pH = 14 – pOH
Contoh soal:
Hitung pH larutan NH3 0,1 M jika Kb = 1 × 10–5. Jawab:
(
) (
)
b
-5 -1
-6 -3
OH K M
1 10 1 10
1 10
1 10
−
= ×
= × × ×
= ×
= ×
pH = 14 – pOH = 14 – 3 = 11
Titrasi Asam-Basa
K.
Titrasi asam-basa dapat digunakan untuk menentukan kadar larutan, salah satunya melalui reaksi penetralan. Jika salah satu larutan diketahui molaritasnya maka molaritas larutan yang ditambahkan dapat diketahui dengan rumus pengenceran. Akhir dari titrasi asam-basa jika titik ekivalen sudah tercapai. Tercapainya titik ekivalen saat mol ion H+ sama dengan mol ion OH–. Artinya terjadi perubahan warna yang menandakan bahwa asam dan basa habis bereaksi.
Larutan Penyangga
L.
Merupakan larutan yang berfungsi untuk mempertahankan pH meskipun pH ditambahkan sedikit asam, basa ataupun pengenceran. Larutan penyangga (bufer) terdiri dari:
1. Buffer Asam
Yaitu campuran asam lemah dengan garam (basa konjugasi) yang berasal dari basa kuat.
[
]
[
]
[
]
[
]
+ a
a
asam lemah H K .
garam
asam lemah pH pK log
garam
=
= −
2. Buffer Basa
Yaitu campuran antara basa lemah dengan garam (asam konjugasi) yang berasal dari asam kuat.
[
]
[
]
[
]
[
]
– b
b
basa lemah OH K .
garam
basa lemah pOH pK log
garam
=
= −
Fungsi larutan penyangga yaitu:
a. Di dalam tubuh berfungsi untuk menjaga pH darah agar sesuai dengan karateristik reaksi enzim. b. Dalam kehidupan sehari-hari digunakan untuk menjaga pH dalam makanan kaleng agar tidak mudah
dirusak oleh bakteri.
Hidrolisis Garam
M.
1. Garam dari Asam Kuat + Basa Kuat
a. Tidak terhidrolisis. b. pH = 7
2. Garam dari Asam Kuat + Basa Lemah
a. Terhidrolisis sebagian, pH < 7.
b. Kh = w b
K K
c. [H+] = w
[
]
bK
. garam K
3. Garam dari Asam Lemah + Basa Kuat
a. Terhidrolisis sebagian, pH > 7.
b. Kh = w a
K K
c. [OH–] = w
[
]
aK
. garam K
4. Garam dari Asam Lemah + Basa Lemah
a. Terhidrolisis sempurna.
b. Kh = w a b
K K .K
c. [H+] = w
[ ]
a bK . K
K atau [OH
–] = w
[ ]
b aK . K K
Rumus pH pada berbagai campuran ditampilkan dalam tabel berikut:
Campuran Mol
Habis Bereaksi Sisa Asam Sisa Basa
Asam kuat + basa kuat
Garam tidak terhidrolisis Larutan bersifat netral. pH = 7
Larutan bersifat asam kuat. pH = –log [H+] sisa
Larutan bersifat basa kuat.
pOH = –log [OH–] sisa
Asam kuat + basa lemah
Garam terhidrolisis sebagian. Kh = w
b
K K
[H+] = w b
K
[garam] K
Larutan penyangga asam kuat.
pH = –log [H+] sisa
Larutan penyangga basa [OH–] = K
b. [Bs]
[G]
pOH= pKb –log[Bs] [G]
Asam lemah + basa kuat
Garam terhidrolisis sebagian. [OH–]= w
a
K [G] K
pOH= ) w a
1
(pK pK log[G]
2 + −
Larutan penyangga asam.
[H
+] = K
a.
[As] [G]
pH = pK
a–
log[A ]s[G]
Larutan bersifat basa kuat.
Asam lemah + basa lemah
Garam terhidrolisis total
[H
+] =
w ab
K [K ] K
pH= w a b
1
(pK pK pK )
2 + −
Larutan penyangga asam [H+] = K
a. [As]
[G]
pH = pKa – log[As] [G]
Larutan penyangga basa [OH-] = K
b .
s
[B ] [G]
pOH= pKb – log[B ]s
[G]
K
N.
spHasil kali kelarutan (Ksp) adalah hasil kali konsentrasi ion-ion dalam larutan jenuh garam yang sukar larut dalam air. Nilai Ksp untuk elektrolit sejenis semakin besar, menunjukkan semakin mudah larut.
Kelarutan (s) merupakan konsentrasi maksimum zat terlarut. Hubungan kelarutan dan hasil kali kelarutan sebagai berikut:
Ksp = (n–1)n–1 Sn
Keterangan:
s = kelarutan (mol/liter) n = jumlah ion dari elektrolit
Jika diketahui konsentrasinya, maka: AxBy ↔ xAy+ + yBx–
Ksp AxBy = [Ay+]x + [Bx–]y
Jika harga:
• [A+y]x [B-x]y = K
sp AxBy , larutan tepat jenuh (tidak terjadi pengendapan) • [A+y]x [B-x]y < K
sp AxBy , larutan belum jenuh (tidak terjadi pengendapan) • [A+y]x [B-x]y > K
sp AxBy , larutan lewat jenuh (terjadi pengendapan)
Adanya penambahan ion senama (sejenis) pada pelarut tersebut akan memperkecil kelarutan. Penamba-han tersebut menggeser kesetimbangan ke kiri (prinsip Le Chatelier).
Kelarutan suatu elektrolit juga dipengaruhi oleh pH larutan. Keberadaan ion H+ akan mengikat anion, sehingga anion dalam larutan berkurang. Berkurangnya anion menyebabkan lebih banyak garam yang larut (sesuai prinsip Le Chatelier).
1. Dari 1 gram NaOH (Mr = 40) akan dihasilkan larutan 0,25 M sebanyak ….
A. 50 ml B. 100 ml C. 125 ml D. 150 ml E. 200 ml
2. Suatu asam lemah HA dengan konsentrasi 0,1 terionisasi sebanyak 1%. Tetapan kesetimban-gan asam lemah tersebut adalah …. A. 2,5 × 10–7
B. 5,0 × 10–7
C. 1,0 × 10–6
D. 1,0 × 10–5
E . 2,5 × 10–5
3. Untuk mengubah 40 ml larutan H2SO4 6 M menjadi H2SO4 5 M diperlukan tambahan air sebanyak …. A. 4 ml
B. 6 ml C. 7 ml D. 8 ml C. 9 ml
4. Diantara garam berikut ini yang akan mengalami hidrolisis sempurna jika dilarutkan dalam air adalah …. A. NaCN
B. NH4CN C. (NH4)2SO4 D. BaSO4 E. KCl
Latihan
Soal
5. Bila 0,1 gram NaOH dilarutkan menjadi 250 ml, maka pH larutan adalah ….
A. 1 B. 2 C. 13 D. 12 E. 7
6. Asam konjugasi dari basa H2PO4– …. A. H3PO4
B. H2PO4 C. HPO4–2
D. PO4–2
E. H3O+
7. Pada pelarutan NH3 terjadi kesetimbangan sebagai berikut.
NH3(aq) + H2O(l)↔ NH4+
(aq) + OH –
(aq)
Yang merupak an pasangan asam-basa konjugasi adalah ….
A. NH3 dan H2O B. NH4+ dan OH–
C. NH3 dan OH–
D. H2O dan NH4+
E. H2O dan OH–
8. Senyawa HClO4 dapat bersifat asam maupun basa. Reaksi yang menunjukkan bahwa HClO4 basa adalah ….
A. HClO4 + NH2–↔ ClO 4
– + NH 3
B. HClO4 + NH3↔ ClO4–+ NH 4
+
C. HClO4 + H2O ↔ ClO4–+ H 3O
+
D. HClO4 + OH–↔ ClO 4
–+ H 2O
E. HClO4 + N2H5+↔ H 2ClO4
9. Diantara oksida berikut yang dalam air dapat membirukan kertas lakmus adalah ….
A. CO2 B. SO2 C. NO2 D. CaO E. P2O5
10. Berikut ini adalah hasil uji sifat asam/basa dari beberapa garam:
No Rumus Garam Uji Lakmus Merah Biru
1 NaCl Merah Biru 2 CH3COOK Biru Biru 3 NH4Cl Merah Merah 4 Na2SO4 Biru Biru 5 NaCN Biru Biru
Garam yang mengalami hidrolisis dan sesuai dengan hasil uji lakmusnya adalah ….
A. 1, 2 dan 3 B. 1, 2 dan 4 C. 2, 3 dan 4 D. 2, 3 dan 5 E. 3, 4 dan 5
11. Satu liter larutan yang mengandung 0,1 mol NH3 (Kb = 10–5) dan 0,05 mol (NH
4)2SO4 mempunyai pH yaitu ….
A. 5 B. 5 – log 2 C. 9 D. 9 – log 2 E. 9 + log 2
12. Berdasarkan reaksi ionisasi Ag2CO3, maka rumus Ksp Ag2CO3 yang tepat adalah ….
A. [Ag+] [CO 3
2–]
B. [Ag+]2 [CO 3
2–]
C. [Ag2+] [CO 3
–]
D. [Ag+] [CO 3
2–]2
E. [Ag+]2 [CO 3
2–]2
13. Perhatikan data percobaan uji larutan berikut:
Larutan Pengamatan pada Elektroda Lampu
1 Sedikit gelembung Padam 2 Tidak ada gelembung Padam 3 Sedikit gelembung Redup 4 Banyak gelembung Menyala 5 Tidak ada gelembung Redup
Pasangan senyawa yang merupakan larutan elektrolit kuat dan elektrolit lemah berturut-turut adalah larutan nomor ….
A. 1 dan 4 B. 2 dan 3 C. 2 dan 4 D. 4 dan 3 E. 5 dan 4
14. Dicampurkan sejumlah HNO2 dengan larutan NaOH membentuk larutan penyangga. Setelah reaksi terdapat 0,02 mol NaNO2, dan 0,47 gram HNO2. pH larutan penyangga tersebut adalah …. (Ka HNO2 = 4 × 10-4 Mr HNO
2 = 47) A. 4 – log 2
B. 4 – log 4 C. 4 – log 8 D. 8 + log 2 E. 8 + log 2
15. Jika Ksp Ag2CO3 = 1 × 10–14, maka kelarutan Ag2CO3 dalam AgCl 0,1 M adalah ….
A. 5 × 10–13 mol/l
B. 1 × 10–12 mol/l
C. 2 × 10–12 mol/l
D. 5 × 10–9 mol/l
1. Jawaban: B g 1000 M Mr ml 1000 ml
g Mr M 1000
1 40 0,25 100 ml = × = × × = × × = 2. Jawaban: D
Hubungan α, Ka dan M dirumuskan sebagai: Ka = α2.M
= (1 × 10–2)2 × (1 × 10–1) = 1 × 10–5
3. Jawaban: D M1.V1 = M2.V2 6 × 40 = 5 × V2 V2 = 240/5 ml V2 = 48 ml
Tambahan air yang diperlukan = V2 – V1 = 48 ml – 40 ml
= 8 ml
4. Jawaban: B
Yang mengalami hidrolisis sempurna adalah garam dari asam lemah dan basa lemah. A. NaCN → hidrolisis sebagian karena
meru-pakan garam dari basa kuat dan asam lemah.
B. NH4CN→hidrolisis sempurna karena merupakan garam dari basa lemah dan asam lemah.
C. (NH4)2SO4→hidrolisis sebagian karena merupakan garam dari basa lemah dan asam kuat.
D. BaSO4 → tidak terhidrolisis karena merupa-kan garam dari basa kuat dan asam kuat.
Pembahasan
E. KCl → tidak terhidrolisis karena merupakan garam dari basa kuat dan asam kuat. 5. Jawaban: D
g 1000 M Mr ml 0,1 1000 40 250 100 10000 0, 01 M
= ×
= ×
=
= [OH–] = x.M
= 1 × 0,01 = 0,01 M pOH = –log [OH–]
= – log [1 × 10–2] = 2 – log 1 = 2
pH = 14 – pOH = 14 – 2 = 12
6. Jawaban: A
• Untuk mencari asam konjugasi caranya: tambahkan satu H+ pada rumus
• Untuk mencari basa konjugasi caranya: kurangkan satu H+ dari rumus.
Asam konjugasi dari: H2PO4– = H
2PO4 – + H+ = H
3PO4 7. Jawaban: E
Menurut Bronsted Lowry: Asam → Pemberi proton Basa → Penerima proton
8. Jawaban: E
HCLO4 bersifat basa jika menerima H+ menjadi H2ClO4+
9. Jawaban: D
Lakmus merah berubah menjadi lakmus biru jika dalam larutan basa. Oksida yang bersifat basa jka dilarutkan dalam air adalah oksida logam (= oksida basa), yaitu oksida dari unsur logam.
10. Jawaban: D
Garam-garam yang mengalami hidrolisis berasal dari:
• asam lemah + basa kuat • asam kuat + basa lemah • asam lemah + basa lemah
Rumus Garam Asal Garam Keterangan Uji Lakmus Merah Biru
NaCl AK + BK Tidak
mengalami
hidrolisis
Merah Biru
CH3COOK AL + BK Hidrolisis Biru Biru
NH4Cl AK + BL Hidrolisis Merah Merah
Na2SO4 AL + BK Tidak
mengalami
hidrolisis
Biru Biru
NaCN AL + BK Hidrolisis Biru Biru
Maka pernyataan yang benar adalah nomor 2, 3, dan 5.
11. Jawaban: D
pH Bufer basa lemah + garam:
– b basa lemah OH K garam = × – b basa lemah OH K garam = ×
– –5 0,1
OH 10
0,05
= ×
= 2 × 10–5
pOH = –log(2 × 10–5)
= 5 – log2
pH = 14 – (5 – log2) = 9 – log2 12. Jawaban: B
Reaksi ionisasi Ag2CO3: Ag2CO3 ↔ 2Ag+ + CO
3 2– Ksp = [Ag+]2 [CO
3 2–]
13. Jawaban: D
Larutan Pengamatan pada Jenis larutan Elektroda Lampu 1 Sedikit gelembung
Padam Elektrolit lemah
2 Tidak ada
gelembung
Padam Nonelektrolit
3 Sedikit
gelembung
Redup Elektrolit lemah
4 Banyak
gelembung
Menyala Elektrolit kuat
5 Tidak ada
gelembung
Redup Nonelektrolit
14. Jawaban: A
HNO2(aq)+ NaOH(aq)→ NaNO2(aq) + H2O(l)
mula-mula : p mol q mol
reaksi : x mol x mol x mol x mol
sisa : 0,47 gram q – x mol 0,02 mol x mol
mol HNO2 = 0,47g 0, 01 mol 47 gram/mol=
x = 0,02 mol
Larutan penyangga yang terbentuk berupa larutan garam NaNO2 dengan asam lemah HNO2.
[
]
[
]
a
asamlemah PH 1PK log
garam = −
[
]
[
]
[ ]
[
]
a 4 asam lemak pH log k loggaram
0, 01 log 4 10 log
0, 02
−
= − −
[ ]
[
]
(
)
(
)
4
4 1
5
0, 01 pH log 4 10 log
0, 02
log 410 .5.10
log 20 .10
−
− −
−
= − × +
= − = −
pH = –log2 × 10–4
= 4– log2
15. Jawaban: B AgCl ↔ Ag+ + Cl– 0,1 0,1 0,1
Kelarutan Ag2CO3 dipengaruhi oleh ion Ag+, sehingga:
Ag2CO3 ↔ 2Ag+ + CO 3
2– s 0,1 M s Ksp = (0,1)2.s
SIFAT KOLIGATIF LARUTAN
BAB 10
Sifat Koligatif Larutan
A.
Sifat koligatif larutan merupakan sifat larutan yang hanya tergantung pada banyaknya mol zat terlarut dalam larutan, dan tidak tergantung jenis zat terlarut. Jumlah zat terlarut tersebut dinyatakan dengan konsentrasi larutan yang dinyatakan dalam bentuk molaritas/kemolalan, atau fraksi mol.
Kemolalan dan Fraksi Mol
B.
1. Kemolalan
Kemolalan adalah cara menyatakan jumlah mol (n) zat terlarut dalam 1 kg pelarut. Sehingga kemolalan dinyatakan dalam mol/kg. Rumus:
n m
p
=
Keterangan:
m = kemolalan larutan n = jumlah mol zat terlarut p = massa pelarut (kg)
2. Fraksi Mol (X)
Fraksi mol digunakan untuk menyatakan perbandingan jumlah mol zat terlarut atau pelarut terhadap jumlah mol larutan. Rumus:
A A
A B B B
B A A B
n X
n n n X
n n
X X 1
= +
= +
+ =
Keterangan:
XB = fraksi mol terlarut nA = jumlah mol pelarut nB = jumlah mol terlarut
Penurunan Tekanan Uap
C.
• Tekanan uap merupakan tekanan yang ditimbulkan oleh uap jenuh suatu zat, dimana dalam keadaan jenuh proses penguapan dan pengembunan berlangsung disaat yang sama.
• Besarnya tekanan uap terkandung pada jenis zat dan suhu.
• Tekanan uap suatu zat akan bertambah jika suhu dinaikkan karena kenaikan suhu menyebabkan energi kinetik molekul-molekul cairan bertambah besar sehingga lebih banyak molekul yang naik ke permukaan cairan memasuki fase gas. Akibatnya konsentrasi uap semakin besar dan dengan demikian tekanan uap semakin besar.
• Menurut hukum Roult, jika zat terlarut sukar menguap maka larutan di permukaan terdiri atas uap zat pelarut saja.
Plarutan = Ppelarut = Xpelarut.P°pelarut
Ppelarut = Xpelarut.P°pelarut
Tapi, ingat kalau fraksi mol pelarut < 1. Jadi, tekanan uap larutan akan lebih rendah dari tekanan uap pelarut murni. Zat terlarut yang sukar menguap akan menyebabkan penurunan tekanan uap pelarut, yang bisa dihitung dengan rumus:
∆P = Xter . P°
Keterangan:
∆P = penurunan tekanan uap Xter = fraksi mol zat terlarut Po = tekanan uap murni
Kenaikan Titik Didih dan Penurunan Titik Beku
D.
• Titik didih adalah suhu pada saat tekanan uap cairan sama dengan tekanan di permukaan sehingga titik didih bergantung pada tekanan di permukaan.
• Titik beku adalah suhu pada saat tekanan uap cairan sama dengan tekanan uap padatannya (es). • Selisih antara titik didih larutan dengan titik didih pelarutnya disebut kenaikan titik didih (∆Tb). • Selisih antara titik beku pelarut dengan titik beku larutan disebut penurunan titik beku (∆Tf).
• Besar kenaikan titik didih dan penurunan titik beku untuk suatu larutan dapat dihitung menggunakan rumus:
Rumus I
Keterangan:
Tb larutan = titik didih larutan Tb pelarut = titik didih pelarut
∆Tb = kenaikan titik didih
Rumus II
∆Tf = Tf larutan – Tf pelarut
Keterangan:
Tf larutan = titik beku larutan Tf pelarut = titik beku pelarut
∆Tf = penurunan titik beku
• Kenaikan titik didih dan penurunan titik beku tergolong sifat koligatif, tidak bergantung pada jenis zat terlarut tetapi bergantung pada konsentrasi partikel dalam larutan. Besar kenaikan titik didih dan penurunan titik beku suatu larutan pun bisa dihitung dengan menggunakan rumus:
∆Tb = Kb × m
∆Tf = Kf × m
Keterangan:
∆Tb = kenaikan titik didih
∆Tf = penurunan titik beku
Kb = tetapan kenaikan titik didih molal Kf = tetapan penurunan titik beku molal m = kemolalan larutan
Tekanan Osmotik Larutan
E.
Tekanan osmotik adalah tekanan yang diberikan pada larutan yang dapat menghentikan perpindahan molekul-molekul pelarut ke dalam larutan melalui membran semi permeabel (proses osmosis).
Menurut van’t Hoff, tekanan osmotik dihitung dengan rumus:
p = M.R.T
Keterangan:
p = tekanan osmotik M = kemolaran larutan
R = tetapan gas (0,082 L.atm/mol.K) T = suhu larutan (Kelvin)
Sifat Koligatif Larutan Elektrolit
F.
i = 1 + (n – 1) α Keterangan:
α = derajat ionisasi elektrolit (pada standarnya larutan elektrolit mempunyai harga 1) n = jumlah ion dalam senyawa elektrolit
• Pertambahan sifat koligatif larutan elektrolit sebanding dengan pertambahan jumlah partikel dalam larutan. Rumus sifat koligatif untuk larutan elektrolit:
larutan pelarut pelarut b b
f f
P X .P .i
T K .m.i T K .m.i
M.R.T.i i 1 1(n 1) π
α
° =
∆ = ∆ =
=
1. Jika tekanan osmotik dari 500 ml larutan fruktosa, C6H12O6 pada suhu 32°C sebesar 2 atm, massa fruktosa yang terlarut sebanyak …. A. 7,2 gram
B. 9,0 gram C. 14,4 gram D. 18,0 gram E. 45,0 gram
2. Penambahan 5,4 g suatu zat nonelektrolit ke dalam 300 g air ternyata menurunkan titik beku sebesar 0,24°C. Jika Kf air = 1,86 °C/molal, maka Mr zat tersebut adalah ….
A. 8,04 B. 12,56 C. 60,96 D. 108,56 E. 139,50
3. Fraksi mol larutan urea dalam air 0,2. Tekanan uap jenuh air murni pada suhu 20°C sebesar 17,5 mmHg. Maka tekanan uap jenuh larutan pada suhu itu adalah ....
A. 16 mmHg B. 15 mmHg C. 14 mmHg D. 13 mmHg E. 12 mmHg
4. Untuk menaikkan titik didih 20 gram air menjadi 100,1°C pada tekanan 1 atm (Kb = 0,50), maka jumlah gula (Mr = 342) yang harus dilarutkan adalah ....
A. 16,3 gram B. 18,9 gram C. 17,1 gram D. 15,2 gram
Latihan
Soal
E. 20,5 gram
5. Suatu zat nonelektrolit (Mr = 40) sebanyak 30 gram dilarutkan dalam 900 gram air. Penurunan titik beku larutan ini adalah 1,550°C. Berapa gram dari zat tersebut harus dilarutkan ke dalam 1,2 kg air agar diperoleh larutan dengan penurunan titik beku yang setengahnya dari penurunan titik bekunya diatasnya!
A. 24 g B. 23 g C. 22 g D. 21 g E. 20 g
6. Tekanan osmotik dari 500 ml larutan yang mengandung 17,1 gram gula (Mr gula = 342) pada suhu 27°C adalah .... (R = 0,082 L.atm/ mol.K)
A. 3 atm B. 2,76 atm C. 2,46 atm D. 1, 69 atm E. 1 atm
7. Titik beku 0,1 molal NH4Br = –0,3627 °C, Kf air = 1,86°C. Berapakah derajat ionisasi NH4 …. A. 1
B. 0,95 C. 0,75 D. 0,55 E. 0,35
8. Berapakah tekanan osmotik 5,85 gram NaCl dalam 250 cm3 larutan pada suhu 27 °C …. A. 7,51 atm
D. 10,35 atm E. 11,21 atm
9. Larutan mengandung 3,24 gram zat yang tak mudah menguap juga nonelektrolit dan 200 gram air mendidih pada 100,130°C pada 1 at-mosfer. Berapakah berat molekul zat terlarut? (Kb molal air adalah 0,51)
A. 60,8 B. 61,8 C. 62,8 D. 63,8 E. 64, 8
10. Suatu data percobaan penurunan titik beku:
No
LARUTAN
Zat terlarut Jumlah mol zat
Titik beku larutan
1 CO(NH2)2 a –toC
2 CO(NH2)2 2a –2toC
3 C12H22O11 a –toC
4 C12H22O11 2a –2toC
5 NaCl a –2toC
6 NaCl 2a –4toC
Berdasarkan data tersebut dapat disimpulkan bahwa penurunan titik beku larutan tergantung pada ….
A. jumlah partikel zat terlarut B. jenis zat terlarut
C. jenis partikel zat terlarut D. konsentrasi molal larutan E. jenis pelarut
11. Larutan yang mengandung 20 gram zat non-elektrolit dalam 1l air (massa jenis air 1 g/ml) mendidih pada suhu 100,052°C. Jika Kb air = 0,52°C, maka Mr zat nonelektrolit tersebut ada-lah…
A. 20 B. 40 C. 100 D. 150 E. 200
12. Dalam 250 gram air dilarutkan 1,9 gram MgCl2, ternyata larutan membeku pada –0,372°C. Jika tetapan titik beku molal air = 1,86°C/m, derajat ionisasi garam MgCl2 adalah .... (Ar Mg = 24, Ar Cl = 35,5)
A. 0,43 B. 0,59 C. 0,75 D. 0,84 E. 0,96
13. Untuk menaikkan titik didih 250 ml air menjadi 100,1°C pada tekanan 1 atm (Kb = 0,50), maka jumlah gula (Mr = 342) yang harus dilarut-kan adalah ….
A. 86 g B. 171 g C. 342 g D. 17,1 g E. 684 g
14. Suatu larutan diperoleh dari melarutkan 6 gram urea (Mr = 60) dalam 1 liter air. Larutan yang lain diperoleh dari melarutkan 18 gram glukosa (Mr = 180) dalam 1 liter air. Pada suhu yang sama berapa tekanan osmotik larutan pertama dibandingkan terhadap larutan kedua? A. Sepertiga larutan kedua. B. Tiga kali larutan kedua.
C. Dua pertiga larutan kedua. D. Sama seperti larutan kedua. E. Tiga perdua kali larutan kedua.
15. Penambahan 5,4 gram suatu zat nonelektrolit ke dalam 300 gram air ternyata menurunkan titik beku sebesar 0,24°C. Jika Kf air = 1,86oC maka Mr zat tersebut adalah ….
Pembahasan
1. Jawaban: A
Misalkan x = fruktosa terlarut (gram)
M.R.T x 1.000
R T Mr ml
x 1.000
2 0,082 305
180 500 2 180 500 x
1.000 0, 082 305 180.000
x
25, 010 x 7,2 g π π = = × × × = × × × × × = × × = =
2. Jawaban: E
f f f T m.K g 1000 0,24 K Mr p 5,4 1000 0,24 1,86 Mr 300 5,4 1000 1,86 Mr 0,24 300 10.044 72 139,5 ∆ = = × × = × × × × = × = =
3. Jawaban: C
urea air air air
o larutan air air larutan
larutan
X X 1
0,2 X 1
X 0,8
P X .P
P 0,8.17,5 mmHg
P 14 mmHg
+ = + = = = = = 4. Jawaban: C
Misalkan x = gula yang harus dilarutkan (gram)
Titik didih larutan = titik didih air + ∆ Tb 100,1°C = 100°C + ∆Tb
∆Tb= 0,1°C
b b
T K .m
x 1.000 0,1 0,5 Mr p x 1.000 0,1 0,5 342 250 34,2 2x
x 17,1 g
∆ =
= × ×
= × ×
= =
5. Jawaban: E
• Untuk 30 gram zat nonelektrolit (Mr = 40) yang dilarutkan dalam 900 gram air, dengan penurunan titik 1,550ºC:
f1 f f1 f f f f o f
T K .m
g 1000
T . .K
Mr P 30 1.000
1,550 K
40 900 1,550 40 900 K
30 1.000 55.800 K
30.000 K 1, 86 C/m
∆ = ∆ = = × × × × = × = =
• Banyak zat tersebut harus dilarutkan ke dalam 1,2 kg air agar diperoleh larutan dengan penurunan titik beku setengah dari 1,550oC:
Misalkan x = zat yang perlu dilarutkan (gram)
f 2 f
x 1.000
T K
40 1.200 x 1.000
0,775 1, 86
40 1.200
∆ = × ×
0,775 40 1,200 x
1, 000 1, 86
× × = × 37,200 x 1, 860 x 20 gram
=
=
6. Jawaban: C
M.R.T
g 1,000 . .R.T Mr ml 17,1 1, 000
0, 082 300 342 500
420, 660 171, 000 2, 46 atm π π π π π = = = × × × = =
7. Jawaban: B
Titik beku larutan = titik beku air – ∆Tf –0,3627°C = 0°C – ∆Tf
∆Tf = 0,3627°C
n NH4Br
NH4Br NH4+ + Br–
n = 2
∆Tf = m.Kf{ 1 + (n– 1) α}
0,3627 = 0,1 × 1,86 × (1 + (2 – 1) α) 0,3627 = 0,186 + 0,186 α
0,186 α = 0,1767
α NH4 Br = 0,95
8. Jawaban: C
M.R.T g 1, 000
. R.T Mr ml 5, 85 1, 000
0, 082 300 58,5 250
143, 910 14, 625 9, 84 atm π π π π π = = = × × × = =
9. Jawaban: E
b b
T = K .m 0,13 = 0,51.m m = 0,25
0,25 = mol 1000/200 Mol = 0,25/5 = 0,05
Mr = gram/mol = 3,24/0,05 = 64,8
∆
×
10. Jawaban: A
• Penurunan titik beku adalah sifat koligatif larutan yang bergantung pada konsentrasi partikel dalam larutan dan tidak bergantung pada jenisnya (seperti atom, ion atau molekul).
• Larutan elektrolit pada konsentrasi yang sama mempunyai harga penurunan titik beku yang lebih besar dibandingkan larutan nonelektrolit karena jumlah partikelnya lebih banyak sehingga konsentrasinya lebih besar.
11. Jawaban: E Diketahui
∆Tb = titik didih larutan – titik didih pelarut murni
∆Tb = 100,052°C – 100°C
∆Tb = 0,052°C
∆Tb = Kb.m
b b
g 1000 T K . .
12. Jawaban: C
(
)
{
}
f f f f 2T K .m .i g 1.000 T K . . .i
Mr P
1, 9 1.000
0,372 1, 86 i
250 24 35,5 2
1, 86 1, 9 1.000
0,372 i
95 250 3.534
0,372 i
23.750 0,372 23.750
i 2,5
3534 i 1 (n 1) n dari MgCl 3 2,5 1 (3 1)
0,75 α α α ∆ = ∆ = = × × × + × × × = × × = × × = = = + − = = + − =
13. Jawaban: D
b b b
o b
b b
b b
T T larutan T pelarut
T 100,1 100 0,1 C
Misalkan x gula yang dilarutkan (gram) T K .m
g 1.000 T K . .
Mr P x 1.000 0,1 0,5
342 250 0,1 342 250 x
1.000 0,5 8.550 x
500 x 17,1 g
∆ = − ∆ = − = = ∆ = ∆ = = × × × × = × = =
14. Jawaban: D
urea urea glukosa glukosa M.R.T M .R.T M .R.T π π π = =
Karena suhu sama dan R merupakan ketetapan, maka: urea urea glukosa glukosa M M π π = urea glukosa urea glukosa g 6 0,1 1 60 Mr
g 18 0,1 1
180 Mr
: 1:1
Tekanan osmotik keduanya sama. π
π
π π
= = = =
=
15. Jawaban: A
f f f f
T K .m g 1.000 T K . .
Mr P
5, 4 1.000 0,24 1, 86
KIMIA UNSUR
BAB 11
S
eperti yang sudah kamu ketahui, dalam sistem periodik unsur-unsur disusun menurut kenaikan nomor atom dan konigurasi elektronnya. Unsur-unsur dengan susunan elektron terluar yang sama dikelompokan dalam satu golongan karena sifat kimianya yang sama. Unsur dengan jumlah kulit yang sama dimasukkan dalam satu periode. Jadi, dapat disimpulkan disini bahwa sifat-sifat unsur sangat ditentukan oleh konigurasi elektronnya.Seperti apakah sifat-sifat unsur dalam satu golongan atau periode? Berikut ini adalah penjelasannya.
Golongan Alkali
A.
1. Anggota
Alkali merupakan unsur-unsur golongan IA kecuali hidrogen. Karena sangat reaktif, golongan ini di alam tidak dijumpai dalam keadaan bebas. Anggotanya meliputi:
3Li, 11Na, 19K, 37Rb, 55Cs
2. Sifat-Sifat
a. Mengkilat, lunak, dan dapat ditempa. b. Penghantar panas dan listrik yang baik.
c. Energi ionisasi logam alkali dari atas ke bawah makin rendah, sehingga dari litium sampai sesium semakin reaktif.
d. Dalam satu golongan dari atas ke bawah: titik didih, titik leleh dan energi ionisasinya makin berkurang sedangkan kereaktifannya semakin besar.
e. Harga potensial reduksi standar kecuali litium dari atas ke bawah semakin negatif.
f. Kereaktifan logam alkali dari atas ke bawah semakin bertambah, hal ini disebabkan energi ionisasinya dari atas ke bawah semakin rendah sehingga semakin mudah melepaskan elektron.
g. Logam alkali dapat bereaksi dengan oksigen membentuk oksidanya.
3. Kegunaan
b. Soda kue (NaHCO3) digunakan dalam pembuatan roti, penghilang bau tengik pada mentega. c. Soda (Na2CO3) digunakan dalam industri kaca, kertas, detergen, proteksi logam.
d. Soda api (NaOH) merupakan bahan baku pembuatan sabun dan detergen. e. Aliasi Li/Pb dapat digunakan untuk membungkus kabel lunak.
Golongan Alkali Tanah
B.
1. Anggota
Alkali tanah berada di golongan IIA. Walaupun kurang reaktif dibanding golongan IA, golongan ini reaktif dan banyak dijumpai dalam bentuk senyawa di alam bebas. Anggota golongan ini adalah:
4Be, 12Mg, 20Ca, 38Sr, 56Ba
Ada beberapa yang menyebutkan bahwa Be tidak termasuk kedalam golongan alkali tanah karena ada beberapa sifat yang berbeda dengan kebanyakan anggota alkali tanah yang lain. Salah satunya adalah alkali tanah dapat bereaksi dengan hampir semua unsur nonlogam dengan ikatan ion, kecuali berilium yang membentuk ikatan kovalen.
2. Sifat-Sifat
a. Titik cair dan kekerasan melebihi logam alkali. b. Jari-jari lebih kecil daripada logam alkali se-periode.
c. Garam logam alkali tanah menghasilkan nyala dengan warna-warna tertentu, yaitu: berilium (putih), magnesium (putih), kalsium (jingga merah), stronsium (merah), dan barium (hijau).
d. Energi ionisasi pertama dan kedua, titik leleh, titik didih, dan potensial reduksi dari atas ke bawah secara beraturan bertambah kecil.
e. Logam alkali tanah kurang reaktif dibanding logam alkali seperiode. f. Reduktor yang baik.
3. Kegunaan
a. Senyawa magnesium dan stronsium banyak dipakai untuk campuran kembang api.
b. Gips (CaSO4) digunakan untuk membuat kapur tulis, bahan warna cat, pembalut tulang patah. c. CaCO3 digunakan dalam industri kertas, makanan dan gula. Campurannya dengan MgCO3 dan
Mg(OH)2 digunakan sebagai basa penetral asam lambung. d. Berilium digunakan dalam industri nuklir dan tabung sinar X.
Golongan Halogen
C.
1. Anggota
Merupakan golongan VIIA. Disebut halogen karena saat bereaksi dengan logam akan membentuk garam (dari bahasa Yunani halos = garam dan genes = pembentuk). Anggota golongan ini adalah:
2. Sifat-Sifat
a. Titik didih, titik cair dan jari-jari makin bertambah besar.
b. Dari atas ke bawah , energi ionisasi dan keelektronegatifan makin kecil.
c. Titik cair dan titik didih halogen meningkat dengan bertambahnya nomor atom. d. Dari atas ke bawah, kelarutan dalam air makin berkurang.
e. Berwujud molekul diatomik.
f. Semakin panjang jari-jari atom semakin lemah ikatan antaratom, sehingga semakin mudah diputuskan akibatnya energi ikatan makin rendah.
3. Kegunaan
a. Fluorin (F) biasa dimanfaatkan sebagai freon (pendingin pada kulkas/AC, pendorong spray), NaF sebagai pengawet kayu, telon (politetra luoro etana).
b. Bromin (Br) digunakan sebagai pembuat senyawa NaBr (obat penenang), AgBr (bahan pembuat negatif ilm), CH3Br (bahan pemadam kebakaran).
c. Iodin (I) digunakan untuk membuat senyawa NaI yang bisa menghindarkan dari penyakit gondok, iodium tinctur untuk obat luka, CHI3 untuk disinfektan.
d. Klorin (Cl) digunakan sebagai bahan baku masakan dan bahan baku industri kimia (NaCl), insektisida (DDT), bahan pembuat korek api dan mercon (KClO3) , plastik (poly vinyl chloride = PVC).
Golongan Gas Mulia
D.
1. Anggota
Kelompok yang berada di golongan VIIIA ini merupakan satu-satunya gas yang berwujud atom tunggal dan bisa ditemukan di atmosfer bumi. Mereka adalah:
2He, 10Ne, 18Ar, 36Kr, 54Xe, 86Rn
2. Sifat-Sifat
a. Konigurasi elektron untuk gas mulia berakhiran 2 dan 8 yang merupakan bentuk konigurasi elektron yang stabil. Ini menyebabkan golongan ini stabil (sukar bereaksi dengan unsur lain).
b. Dari atas ke bawah potensial ionisasinya makin kecil, reaktiitasnya makin besar, titik didih dan titik leleh makin besar.
c. Tidak berasa, tidak berwarna, tidak berbau.
3. Kegunaan
a. Helium (He) yang ringan dan tidak dapat terbakar digunakan untuk pengisi balon udara, isi tabung udara bagi penyelam. Dalam bentuk cair He dapat digunakan sebagai pendingin (refrigerant). b. Neon dan Argon digunakan sebagai pengisi lampu listrik. Dalam bentuk cair, Ne digunakan sebagai
pendingin dalam reaktor nuklir, membuat indikator tekanan tinggi, penangkal petir dan tabung televisi.
d. Xenon (Xe) digunakan untuk membuat tabung elektron, pembiusan saat pembedahan. e. Radon (Rn) bisa digunakan dalam terapi radiasi kanker.
Golongan Unsur Transisi Periode Ke-3
E.
1. Anggota
Yang termasuk ke dalam golongan ini adalah:
11Na, 12Mg, 13A1, 14Si, 15P, 16C, 17C1, 18Ar
Unsur Na, Mg, Al merupakan logam, Si merupakan metaloid (semilogam), dan unsur P, S, Cl, Ar merupakan unsur nonlogam.
2. Sifat-Sifat
a. Energi ionisasi unsur periode ketiga dari kiri ke kanan meningkat. Akan tetapi energi ionisasi Al lebih rendah dari energi ionisasi Mg dan energi ionisasi S lebih rendah dari P.
b. Jari-jari atom unsur-unsur transisi periode keempat tidak teratur dari kiri ke kanan. c. Kekuatan sifat reduktor dan oksidator dapat dilihat dari harga potensial elektroda. d. Sifat logam unsur periode ketiga dari kiri ke kanan semakin berkurang.
e. Titik leleh dan titik didih unsur periode ketiga dari natrium ke kanan meningkat hingga puncaknya di silikon, kemudian menurun.
f. Unsur-unsur dan senyawa-senyawa dari logam transisi umumnya mempunyai elektron yang tidak berpasangan dalam orbital-orbital d.
g. Unsur-unsur transisi umumnya memiliki titik leleh dan titik didih yang tinggi karena ikatan antaratom logam pada unsur transisi lebih kuat.
h. Wujud unsur-unsur → natrium sampai belerang berwujud padat, sedangkan klor dan argon berwujud gas pada suhu biasa.
3. Kegunaan
a. Aluminium dapat digunakan sebagai bahan konstruksi, komponen pesawat terbang, pelapis alat dapur, aluminium foil.
b. Silikon digunakan sebagai bahan alat-alat elektronik, bahan transistor, chip komputer dan sel surya. c. Phospor digunakan dalam pembuatan korek api dan kembang api.
d. Sulfur dapat digunakan dalam pembuatan pupuk, obat pencahar (MgSO4), bahan pembuat tinta (FeSO4.7H2O), elektrolit pada aki.
Golongan Unsur Transisi Periode Ke-4
F.
1. Anggota
Di alam golongan ini umumnya terdapat dalam bentuk senyawa oksida dan sulida. Golongan ini meliputi:
2. Sifat-Sifat
a. Sifat logam sangat keras, tahan panas, elektropositif dan penghantar listrik yang baik. Pengecualian untuk Cu merupakan logam yang lembut dan elastis.
b. Membentuk senyawa yang umumnya berwarna.
c. Dapat membentuk senyawa kompleks yang bersifat paramagnetik d. Mempunyai berbagai tingkat oksidasi.
e. Unsur transisi dan senyawanya dapat bertindak sebagai katalis.
3. Kegunaan
a. Skandium (Sc) digunakan untuk komponen pada lampu listrik yang berintensitas tinggi. b. Titanium (Ti) digunakan sebagai paduan logam yang keras dan tahan karat.
c. Vanadium (V) dapat digunakan sebagai katalis, bahan pembuat per mobil.
d. Krom (Cr) digunakan sebagai pigmen dan penyamak kulit, penyepuh peralatan logam. e. Mangan (Mn) digunakan dalam proses pembuatan baja
f. Besi (Fe) digunakan dalam pembuatan baja, perangkat elektronik, memori komputer.
g. Kobalt (Co) dan Nikel (Ni) merupakan paduan logam (alloy). Ni adalah bahan campuran stainless steel. Co juga bisa digunakan sebagai bahan sintesis vitamin B-12.
h. Tembaga (Cu) digunakan sebagai bahan pembuatan alat-alat elektronik.
i. Seng (Zn) sebagai logam pelapis antikarat, paduan logam, bahan pembuatan cat putih, antioksidan dalam pembuatan ban mobil.
Ion Kompleks
G.
Ion kompleks adalah ion yang terbentuk dari suatu kation tunggal (biasanya logam transisi) yang terikat langsung dengan beberapa ligan (bisa berupa anion atau molekul netral yang menyediakan pasangan elektron bebas).
Keterangan:
Bilangan koordinasi : jumlah ligan yang terikat
Muatan ion kompleks : muatan atom pusat + muatan ligan
Aturan Tatanama Ion Kompleks
1. Nama ion kompleks terdiri dari dua bagian yang ditulis dalam satu kata. 2. Bagian pertama: jumlah ligan dan nama ligan.
2 : di 3 : tri 4 : tetra 5 : penta 6 : heksa
5. Ligan yang bermuatan negatif (anion) berakhir “O”, misalnya CN– = siano. 6. Nama logam pusat:
• Ion kompleks negatif: gunakan akhiran –at.
• Ion kompleks positif: gunakan nama bahasa Indonesia/nama biasa. Contoh:
Cr dalam ion kompleks negatif: kromat Cr dalam ion kompleks positif: krom Fe dalam ion kompleks negatif: ferat Fe dalam ion kompleks negatif: besi
7. Ligan yang lebih dari satu jenis diurutkan sesuai alfabet. Contoh:
• [Ag(NH3)2]+ = diaminperak (I)
• K2[Zn(CN)2Br2] = kalium dibromodisianozinkat (II) • Natrium diaquatetrahidroksoferat (III)
Natrium: Na Diaqua: (H2O)2 Tetrahidrokso: (OH–)
4 ferat (III): Fe3+
Muatan ion kompleksnya = (2 × H2O) + (4 × OH–) + Fe+3 = (2 × 0) + (4 × (–1)) + (+3) = –1
Ion kompleks: [Fe(H2O)2(OH)4]–
Senyawa kompleks: Na[Fe(H2O)2(OH)4]
1. Diantara senyawa berikut ini yang dapat di-pakai sebagai obat pencuci perut adalah …. A. KNO3
B. NaHCO3 C. Na2CO3 D. MgSO4.7H2O E. CaSO4.2H2O
2. Mineral berikut yang merupakan mangan ada-lah ….
A. pirit B. pirolusit C. malachite D. ilmenit E. rutile
3. Senyawa yang dapat bereaksi dengan NaOH dan H2SO4 adalah ….
A. Cd(OH)2 B. Fe(OH)3 C. HNO3 D. H3PO3 E. Al(OH)3
4. Unsur gas mulia yang mempunyai energi ionisasi paling besar adalah ….
A. Helium B. Neon C. Argon D. Krypton E. Xenon
5. Kereaktifan gas mulia sangat rendah. Hal ini disebabkan karena semua gas mulia …. A. nomor atomnya genap
B. konigurasi elektronnya stabil
Latihan
Soal
C. energi ionisasinya rendah D. molekulnya monoatomik E. jumlah elektron terluarnya 8
6. Nama senyawa kompleks [Co(NH3)4Cl2]Cl adalah ….
A. tetraminodiklorokobal (III) klorida B. tetraamindiklorokobalt (II) diklorida C. triklorotetraaminkobal (III)
D. diklorotetraaminkobaltat (III) klorida E. tetraminkobal (III) triklorida
7. Sifat -sifat berikut ini yang bukan merupakan sifat logam alkali adalah ….
A. merupakan unsur yang sangat reaktif B. terdapat di alam dalam keadaan bebas C. dibuat dengan cara elektrolisis leburan
garamnya
D. ionnya bermuatan satu
E. senyawa-senyawanya mudah larut 8. Reaksi yang tidak mungkin terjadi adalah ….
A. F2(g) + Cl(g)→ 2HF(aq) + Cl2(g) B. Cl2(g) + 2KI(aq)→ 2HCl(aq) + I2(g) C. Br2(g) + 2HI(aq)→ 2HBr(aq) + I2(g) D. I2(g) + NaF(aq)→ F2(g) + 2NaI(aq) E. 2NaBr(g) + F2(g)→ Br2(g) + 2NaF(aq)
9. Perhatikan unsur-unsur dengan nomor atom berikut:
11X, 15Y dan 17Z
Pernyataan yang tidak benar tentang sifat unsur-unsur tersebut adalah ….
A. unsur Z bersifat nonlogam
C. ketiga unsur tersebut memiliki jumlah elektron valensi yang sama
D. X dan Z dapat membentuk senyawa dengan rumus XZ
E. jari-jari atom unsur X > Y > Z
10. Di antara unsur-unsur golongan alkali tanah yang sifatnya mirip dengan aluminium adalah ….
A. Mg B. Be C. Ra D. Ca E. Sr
11. Kelompok unsur yang merupakan oksidator kuat golongan unsur ….
A. alkali B. alkali tanah C. halogen D. gas mulia E. aluminium
12. Logam yang paling kuat bereaksi dengan air adalah ….
A. Ba B. Sr C. Mg D. Ca E. Ra
13. Unsur-unsur dibawah ini berada dalam satu golongan dalam sistem periodik, kecuali …. A. arsen
B. nitrogen C. selenium D. fosfor E. bismut
14. Unsur-unsur periode ketiga terdiri atas Na, Mg, Al, Si, P, S, Cl, dan Ar. Atas dasar konigurasi elektronnya maka dapat dikatakan bahwa …. A. Na paling sukar bereaksi
B. P, S, dan Cl cenderung membentuk basa C. Si adalah logam
D. Na, Mg dan Al dapat berperan sebagai pengoksidasi
E. Energi ionisasi pertama Ar paling besar 15. Beberapa kegunaan unsur/senyawa berikut
ini:
1. bahan baku pupuk 2. peralatan masak
3. bahan baku semen Portland 4. menetralisir asam di lambung; dan 5. pembentukan tulang
Kegunaan unsur kalsium/senyawanya terdapat pada nomor ….
1. Jawaban: D
Obat pencuci perut: garam inggris (MgSO4.7 H2O)
• KNO3 → digunakan dalam pembuatan korek api, bahan peledak, petasan.
• NaHCO3 (soda kue) → digunakan dalam pembuatan roti, penghilang bau tengik dari mentega.
• Na2CO3 (soda) → digunak an untuk menurunkan sadah air, proteksi logam, pembuatan detergen, kaca, kertas. • CaSO4.2H2O (gipsum) → bahan penutup
langit-langit ruangan, penyekat atau partisi ruangan.
2. Jawaban: B
Mineral bijih besi → FeS2 (pirit) Mineral mangan → MnO2 (pirolusit)
Mineral tembaga → Cu(OH)2CO3 (malachite) Mineral titanium → TiO2 (rutile)
Mineral titanium → FeTiO3 (ilmenit) 3. Jawaban: C
Oksida Al2O3 dapat larut dalam larutan NaOH dan HCl karena Al2O3 merupakan oksida amfoter, yaitu zat yang dapat bersifat sebagai asam dalam lingkungan basa kuat dan sebagai basa dalam lingkungan asam kuat sehingga dapat bereaksi sebagai asam atau basa.
4. Jawaban: A
Dalam satu golongan (atas ke bawah) pada sistem periodik, jari-jari atom makin panjang sehingga makin mudah melepaskan elektron, energi ionisasinya makin kecil. Maka pada gas
Pembahasan
mulia yang memiliki energi ionisasi terbesar adalah helium.
5. Jawaban: B
Kereaktifan gas mulia sangat rendah karena konfigurasinya stabil. Ini dikarenakan kulit terluarnya 8e–, kecualiHe yang kulit terluarnya 2e–, yang merupakan bentuk konfigurasi elektron yang stabil.
6. Jawaban: A
Tatanama ion dan senyawa kompleks:
• Nama ion kompleks terdiri dari dua bagian yang ditulis dalam satu kata.
• Bagian pertama: jumlah ligan dan nama ligan.
• Bagian kedua: nama logam pusat dan biloksnya.
• Jumlah ligan dinyatakan dengan awalan Yunani.
• Ligan yang bermuatan negatif (anion) berakhir “O”, misalnya CN– = siano.
• Nama logam pusat: ion kompleks negatif menggunak an ak hiran –at dan ion kompleks positif menggunakan nama bahasa Indonesia/nama biasa.
• Ligan yang lebih dari satu jenis diurutkan sesuai alfabet.
Jadi, nama senyawa kompleks [Co(NH3)4Cl2]Cl adalah tetraminodiklorokobal (III) klorida.
7. Jawaban: B Sifat Logam Alkali:
ditemukan dalam keadaan bebas di alam. • Dapat dibuat melalui proses elektrolisis
garamnya.
• Bersifat reduktor kuat sehingga mudah larut.
8. Jawaban: D
Gas halogen atas dapat mengoksidasi ion halida dibawahnya, sebaliknya gas halogen bawah tidak dapat mengoksidasi ion halida diatasnya.
9. Jawaban: C
Unsur X, Y, dan Z berada pada golongan yang berbeda sehingga jumlah elektron valensinya tidak sama.
10. Jawaban: B
Logam aluminium termasuk amfoter, unsur yang dapat bersifat asam maupun basa. Logam lainnya yang memiliki sifat yang sama adalah Be, seng, timah. Contoh zat amfoter yang lainnya adalah asam amino, protein, dan air. 11. Jawaban: D
Pada sistem periodik makin ke kanan maka oksidatornya semakin kuat. Oleh karena itu unsur yang merupakan okidator terkuat adalah golongan halogen.
12. Jawaban: C
Pada logam alkali tersebut yang paling mudah bereaksi dengan air adalah Magnesium.
13. Jawaban: C
Semua unsur yang tercantum termasuk golongan VA, kecuali selenium yang termasuk golongan VI.
14. Jawaban: E
Na, Mg, Al, Si, P, S, Cl, dan Ar adalah unsur-unsur pada perioda 3 dari kiri ke kanan. Pada suatu sistem periodik berlaku:
• Makin ke kiri makin mudah membentuk basa.
• Makin ke kiri makin bersifat reduktor sehingga paling mudah bereaksi dengan air.
• Na, Mg, Al merupakan unsur logam. Si unsur semi logam. P, S, dan Cl merupakan unsur nonlogam. Ar merupakan gas mulia. • Dari kiri ke kanan (dalam satu periode)
energi ionisasinya semakin besar. 15. Jawaban: E
SENYAWA KARBON
BAB 12
Definisi Senyawa Karbon
A.
Senyawa karbon adalah senyawa yang unsur penyusun utamanya unsur karbon (C). Berdasarkan sum-bernya, senyawa karbon dibedakan menjadi:
• Senyawa organik, senyawa karbon yang berasal dari makhluk hidup → karbohidrat, protein, lemak, dll.
• Senyawa anorganik, senyawa karbon yang tidak berasal dari makhluk hidup → CO2, O2, CO.
Karbon memiliki sifat khas, yaitu atom karbon mampu membentuk ikatan kovalen antar atom karbon sehingga terbentuk rantai karbon.
Kedudukan atom karbon berdasarkan jumlah atom karbon yang terikat pada atom karbon lain dibagi empat, yaitu:
• Atom karbon primer: atom C yang terikat dengan satu atom C lain. • Atom karbon sekunder: atom C yang terikat dengan dua atom C lain. • Atom karbon tersier: atom C yang terikat dengan tiga atom C lain. • Atom karbon kuartener: atom C yang terikat dengan empat atom C lain.
C C C C C C C
C
C C
Atom C Sekunder
Atom C Tersier
Gugus Fungsi Senyawa Karbon
B.
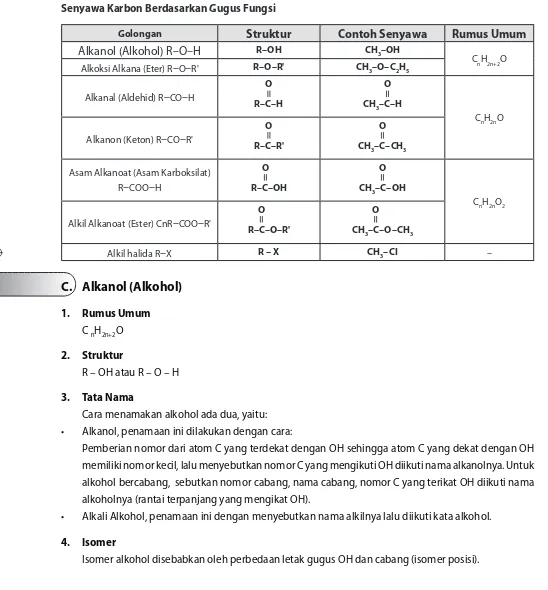
[image:40.651.25.573.172.762.2]Yang dimaksud gugus fungsi adalah atom atau gugus yang menentukan struktur dan sifat dari golongan senyawa karbon. Berdasarkan gugus fungsinya, senyawa karbon dibagi ke dalam kelompok seperti pada tabel di bawah ini.
Senyawa Karbon Berdasarkan Gugus Fungsi
Golongan
Struktur
Contoh Senyawa
Rumus Umum
Alkanol (Alkohol) R–O–H
R–OH CH3–OHCnH2n+2O Alkoksi Alkana (Eter) R
–
O–
R' R–O–R' CH3–O–C2H5Alkanal (Aldehid) R
–
CO–
HO
R–C–H
O CH3–C–H
CnH2nO Alkanon (Keton) R
–
CO–
R'O
R–C–R'
O
CH3–C–CH3
Asam Alkanoat (Asam Karboksilat) R
–
COO–
HO
R–C–OH
O
CH3–C–OH
CnH2nO2 Alkil Alkanoat (Ester) CnR
–
COO–
R'O
R–C–O–R'
O
CH3–C–O–CH3
Alkil halida R
–
X R – X CH3–CI –Alkanol (Alkohol)
C.
1. Rumus Umum
C nH2n+2O
2. Struktur
R – OH atau R – O – H
3. Tata Nama
Cara menamakan alkohol ada dua, yaitu: • Alkanol, penamaan ini dilakukan dengan cara:
Pemberian nomor dari atom C yang terdekat dengan OH sehingga atom C yang dekat dengan OH memiliki nomor kecil, lalu menyebutkan nomor C yang mengikuti OH diikuti nama alkanolnya. Untuk alkohol bercabang, sebutkan nomor cabang, nama cabang, nomor C yang terikat OH diikuti nama alkoholnya (rantai terpanjang yang mengikat OH).
• Alkali Alkohol, penamaan ini dengan menyebutkan nama alkilnya lalu diikuti kata alkohol.
4. Isomer
5. Jenis-Jenis Alkohol
Berdasarkan letak gugus OH, alkohol dibagi menjadi tiga: • Alkohol primer, gugus OH terikat pada C primer.
• Alkohol sekunder, gugus OH terikat pada C sekunder. • Alkohol tersier, gugus OH terikat pada C tersier.
6. Sifat-Sifat
• Alkohol primer dan sekunder dapat mengalami reaksi oksidasi. • Berwujud cair, mudah larut dalam air, titik didihnya relatif tinggi. • Dapat beraksi dengan asam halide (HX) menghasilkan alkil halida (R–X). • Dapat bereaksi dengan asam karboksilat membentuk ester (reaksi esteriikasi).
• Dapat bereaksi dengan logam aktif (Mg, Na, K, Al) menghasilkan asam alkanoat dan gas hidrogen. • Dapat bereaksi dengan PX3, PX5, dan SOX2 (X = F, Cl, Br, I) menghasilkan alkil halida.
• Dapat terbakar dengan mudah menghasilkan banyak energi sehingga alkohol banyak digunakan untuk bahan bakar.
• Jika alkohol dipanaskan bersama H2SO4 pekat, terjadi rekasi dehidrasi (pelepasan molekul air).
7. Kegunaan Alkohol
• Antiseptik • Bahan bakar • Bahan peledak • Bahan plastik • Kosmetik • Miras • Pelarut
Alkoksi Alkana (Eter)
D.
1. Rumus Umum
CnH2n+2O
2. Struktur
R–O–R'
3. Tata Nama
a. Sebagai alkoksi alkana (IUPAC) • R pendek sebagai alkoksi. • R panjang sebagai alkana.
b. Sebagai eter
Dengan menyebutkan nama alkil-alkilnya (sesuai urutan abjad) dan diikuti eter. Contoh: CH3 – O – CH3 (dimetil eter).
4. Isomer
Eter mempunyai isomer posisi dengan eter lain yang atom C nya sama, juga berisomer fungsi dengan alkohol yang rumus molekulnya CnH2n + nO. Misalnya C4H10O.
5. Sifat-Sifat
• Berwujud cair, berbau busuk, mudah menguap, dan uapnya mudah terbakar. • Sukar larut dalam air karena bersifat nonpolar.
• Untuk jumlah atom C yang sama, titik didih eter lebih rendah dari alkohol. • Tidak bereaksi dengan logam Na dan PX3, tetapi bereaksi dengan HX.
6. Kegunaan Eter
• Pelarut senyawa karbon • Bahan disinfektan
• Bahan pembius (anestetika)
• MTBE menaikkan angka oktan pada bensin
Alkanal (Aldehid)
E.
1. Rumus Umum
CnH2nO
2. Struktur
R–CO–H
3. Tata Nama
• Alkanal yang tidak bercabang dengan menyebutkan awalan n (normal) diikuti nama alkanalnya (sesuai banyaknya atom C).
• Alkanal yang bercabang : tentukan rantai C terpanjang yang mengandung gugus fungsi dan beri nomor dimulai dari C gugus fungsi O
–C–H sebagai alkanalnya.
• Urutan pemberian nama: nomor cabang, nama cabang, nama alkanal.
4. Isomer
Isomer alkanal disebabkan oleh adanya cabang dan le