Lampiran 1. Deskripsi klon PB 260 Batang
Pertumbuhan : Jagur
Ketegakan : Tegak Lurus Bentuk lingkar : Silindris Kulit Batang
Corak : Alur sempit, putus-putus
Warna : Cokelat tua
Mata
Letak/ bentuk mata : Rata
Bekas pangkal tangkai : Kecil, agak menonjol Payung Daun
Bentuk : Mendatar
Ukuran : Lurus
Kerapatan : Sedang-agak tertutup Jarak antar payung : Dekat-sedang
Tangkai Daun
Posisi : Mendatar
Bentuk : Lurus
Ukuran besar : Sedang-agak besar Ukuran panjang : Sedang-agak panjang Bentuk kaki : Rata-rata menonjol Anak Tangkai
Tepi daun : Agak bergelombang Penampang memanjang : Lurus
Penampang melintang : Rata-rata cekung
Letak helaian : Terpisah-bersinggungan Ekor daun : Pendek, tumpul
Lampiran 3. Bagan Penelitian
KLON PB 260 KLON RRIM 921
K2J2Z0 K2J1Z1 K2J2Z1 K2J1ZO K1J1Z0 K1J2Z1 K1J2Z0 K1J1Z1 K2J2Z0 K2J1Z1 K2J2Z1 K2J1ZO K1J1Z0 K1J2Z1 K1J2Z0 K1J1Z1 K2J2Z0 K2J1Z1 K2J2Z1 K2J1ZO K1J1Z0 K1J2Z1 K1J2Z0
K2J1Z1 K2J1ZO K1J1Z0 K1J2Z1 K1J2Z0
Lampiran 4. Bagan Alir Penelitian
Aktivitas Enzim Peroksidase (POD) Lateks dan Analisis Kulit Karet Klon PB 260 dan RRIM 921 Yang Diberi Antidepresant
Pemilihan Klon Karet
Data Awal
14 hari
Perlakuan
Enzim Fisiologi
- Protein
- Peroksidase
- Thiol
- Sukrosa
Lampiran 5. Pembuatan Larutan 1. Larutan TCA 2,5 %
- Ditimbang TCA sebanyak 10 gr
- Dimasukkan kedalam 400 ml aquadest (dapat di stok)
- Disimpan pada keadaan suhu ruangan
2. Larutan tris 0,5 M
- Ditimbang bubuk tris sebanyak 2,424 gr
- Dicampurkan kedalam 40 ml aquades
3. Larutan Pereaksi Campur
- Ditimbang Fe2SO4 sebanyak 1,5 gr
- Ditambahkan 15 ml aquades
- Diambil larutan stok molibdat sebanyak 3 gr
- Ditera menjadi 30 ml
4. Larutan Antrone
- Ditimbang antrone sebanyak 0,1 gr
- Ditambahkan larutan H2SO4 77% sebanyak 100 ml
- Didinginkan dengan menggunakan air biasa
5. Larutan Bradford
- Ditimbang 0,01 gr comassie brilliant blue (CBB)
- Diambil 5 ml ethanol 98%
- Dituangkan 10 ml phosforic acid 85%
- Disaring menggunakan kertas saring
- Ditambahkan 75 ml aquades steril
6. Buffer CaCl 0,5 M
- Ditimbang sebanyak 5,5 gr CaCl
- kemudian ditambahkan kedalam 100 ml aquades
7. Buffer Ekstrak
- Diambil 20 ml larutan EDTA 1 mM
- Ditambahkan dengan 100 ml buffer phosfat 100 mM
DAFTAR PUSTAKA
Abraham, T., J.Mathew, P. Srinivas, and C.K. Jacob. 2006. Incidence Of Tapping Panel Dryness On Popular Rubber Clones In Southern Bubber Clones In Southern Rubber Growing Region Of India. In Jacob, J., R.R. Krishnakumar and N. M. Mathew. (Eds.) Tapping Panel Dryness Of Rubber Trees. Rubber Research Institute of India, India. 55-63
Agrios, G.N. 2005. Plant Pathology. Ed ke-5. Academic Press, San Diego
Amypalupy, K. Dan Wijaya T. 2009. Ketahanan Beberapa Klon Karet Anjuran Terhadap Kekeringan. J. Penelitian Karet. 27 (1): 32-41
Anam, K. 2010. Pengukuran Kadar Protein Dengan Metode Bradford. Sekolah Pasca Sarjana IPB, Bogor
Anwar C. 2001. Manajemen dan Teknologi Budidaya Karet. FABA Indonesia Konsultan
Anwar, C. 2007. Prospek Agribisnis Karet Di Indonesia. Lembaga Riset Perkebunan Indonesia PT. Perkebunan Nusantara IX (Persero).
Astuti, A.F. 2008. Ekspresi Gen Responsif Terhadap Reactive Oxygen Species Pada Hevea Brasiliensis Akibat Pelukaan Dan Etilena Eksogen. Skripsi. IPB, Bogor
Bobbiliof, W. 1923. Anatomy and physiology of Hevea brasiliensis. Institute Orell Fussli, Zurich
Budiman, H. 2012. Budidaya Karet Unggul. Pustaka Baru, Yogyakarta.
D’ Auzac, J., Jacob, J-L., Chrestin, H. 1989. Physiology of Rubber Tree Latex. CRC Press, United States
Dalimunthe, A. 2004. Biosintesis lateks. Diakses dari : http://repository.usu.ac.id. Pada Februari 2016
Daslin, A., Woelan, S., Suhendry, I. 2009. Bahan Tanaman Klon Karet Unggul. Sungei Putih: Pusat Penelitian Karet. 18-34
Dische, Z. M. 1962. Carbohydrate. Chem. Acad. Press I.
Gaspar, T.h. 1984. Integrated Relationship of Biochemical and Physiological Peraoxidase Activities. Di dalam: H. C. Peneland Th. Gaspar
Gebelin V., Leclercq, J., Hu. S., Tang C and Montoro P. 2013. Regulation of MIR Genes in Response to Abiotic Stress in Hevea brasiliensis Int. J. Mol. Sci. 2013. 14, 19587-19604; doi:10.3390/ijms141019587. International Journal of Molecular Sciences ISSN 1422-0067
Gohet, J., L. Prevot, J. M. Eschbach, A. Clement, and J. L. Jacob. 1996. Clone, Growth, and Stimulation : Latex Production Factors. Plantations 3(1) : 30−38
Gupta, S.K., P.P. Gupta, T.P. Yadava, and C.D. Kaushik. 1990. Metabolic changes in mustard due to Alternaria leaf blight. Indian Phytopathol. 43(1): 64-69
Imelda, M. , Estiati , A. & Hartati , N. S. 2001. Induction of Mutation through GaµMa Irradition in three Cultivars of Banana. J. Annalaes Bogorienses. 7 (2) : 75-82
Irsal, Haryati, dan M. T. Manurung. 2015.Pengaruh Curah Hujan dan Hari Hujan Terhadap Produksi Tanaman Karet (Hevea brasiliensis Muell-Arg.) Umur 6, 10 dan 14 Tahun pada PT. Bridgestone Sumatera Rubber Estate Dolok Merangir. J. Agroekoteknologi. Vol 3 (2) ; 564-573
Janudianto, Prahmono A, Napitupulu H, Rahayu S. 2013. Panduan budidaya karet untuk petani skala kecil. Rubber cultivation guide for small-scale farmers. Lembar Informasi AgFor 5. Bogor, Indonesia: World Agroforestry Centre (ICRAF) Southeast Asia Regional Program
Kuswanhadi, Sumarmadji, Karyudi, Siregar, T. H. S. 2009. Optimasi Produksi Klon Karet Melalui Sistem Eksploitasi Berdasarkan Metabolisme Lateks. Prosiding Lokakarya Nasional Pemuliaan Tanaman: 152. Pusat Penelitian Karet
Lacote, R. 2007. Some Considerations Concerning the Yield Potential of Some Clones HB in IRC2007. IRRDB and CRRI : Siem Reap, Cambodia
Lakitan, B. 1993. Dasar-dasar Fisiologi Tumbuhan. PT Raja grafindo Persada,Jakarta
Lubis, V. 2014. Analisis Histologi Dan Fisiologi Latisifer Pada Tanaman Karet (Hevea Brasiliensis). Skripsi. USU, Medan
Mc Kersie BD, Leshem YY. 1994. Stress and Stress Coping in Cultivated Plants. Dordrecht: Kluwer Academic, Netherlands
Mochlisin, A. dan R. Tistama. 2014. Perkembangan dan Upaya Pengendalian Kering Alur Sadap (KAS) Pada Tanaman Karet (Hevea brasiliensis). Warta Perkaretan 33 (2), 89-102
Morgan, J.M. 1984. Osmoregulation and Water Strees in Higher Plants. Ann. Rev. Plant Physiol.35: 229-319
Nakano, Y. and Asada, K. 1981. Hydrogen Peroxide Is Scavenged By Ascorbate Peroxidase In Spinach Chloroplast. Plant Cell Physiol. 22:867–880
Nugroho, P. S. 2010. Karakterisasi Biologi Isolat-isolat Rigidoporus microporus Pada Tanaman Karet (Hevea brasiliensis) Asal Cilacap. Skripsi. Universitas Sebelas Maret, Surakarta
Oktavia, F., M. Lasminingsih, S. Ismawanto, dan Kuswanhadi. 2007. Analisis Genetik Klon-Klon Tanaman Karet (Hevea brasiliensis Muell. Arg.) Mengguankan Penanda RAPD. Jurnal Penelitian Karet. 25 (1) : 1 -12
Pasaribu, S. A., I. Suhendry, dan Sayurandi. 2014. Genotipe Terpilih Berdasarkan Karakter Pertumbuhan Dan Hasil Lateks Dari Up/03/96. Jurnal Penelitian Karet. 32(2): 98 – 108
Priyadarshan, P, M. 2011. Biology of Hevea Rubber. United Kingdom: MPG Books Group. 54, 58
Quiambao PR, Rojah NR. 2000. Peroksidase Presentati ReimMann C, Ringli C, Dudler R. 1992. Complementary DNA cloning and
sequence analysis of a pathogen-induced putative peroxidase from rice. Plant Physiol 100: 1611-1612
Saravanan, T. , Bhaskaran, R. & Muthusamy, M. 2004. Pseudomonas fluorescens Induced Enzymological Changes in Banana Roots. J. Pant Pathology. 3 (2) : 72-80
Sathik, M., M.B., Luke, L.P., Molly Thomas, Sumesh, K.V., Satheesh, P.R., Annamalainatha, K. and James Jacob. 2011. Quantative expression analysis of drought responsive genes in clones of Hevea with varying levels of drought tolerance. IRRBD Internasional Rubber Confrence, 14-17 December 2011, Chiang Mai Thailand
Setiawan, D. H dan A. Andoko. 2007. Petunjuk Lengkap Budidaya Karet. Agromedia Pustaka, Jakarta
Setyamidjaja, D. 1986. Karet: Budidaya dan Pengolahan. Cetakan II. Yasaguna, Jakarta
Siagian, N. dan T. H. S. Siregar. 2011. Pemeriksaan Kualitas Sadapan Untuk Mendukung Produktivitas Yang Tinggi. Warta Perkaretan, 30(11): 26-33 Sirait, D.D.N dan Syahnen. 2013. Pengembangan Dan Aplikasi Teknologi
Pengendalian Penyakit Kering Alur Sadap (KAS) Pada Tanaman Karet Di Propinsi Sumatera Selatan. Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan (BBP2TP), Medan
Siregar, T. H. S, Junaidi dan Atminingsih. 2013. Alternatif Penggunaan Stimulan Gas Etilen Dalam Optimasi Produksi. Makalah Pelatihan Workshop Eksploitasi Tanaman Karet Menuju Produktivitas Tinggi Dan Umur Ekonomis Optimal. Medan, 18 – 21 Maret. Balai Penelitian Sungei Putih, Medan
Siregar, T. H. S. 2014. Pola Musiman Produksi Dan Gugur Daun Pada Klon PB 260 dan RRIC 100. J. Penelitian Karet. 32 (2) : 88-97
Siregar, T. H. S., Junaidi, Sumarmadji, N. Siagian, dan Karyudi. 2008. Perkembangan Penerapan Rekomendasi Sistem Eksploitasi Tanaman Karet di Perusahaan Besar Negara. Prosiding Lokakarya Nasional Agribisnis Karet 2008. Yogyakarta, 217-232
Siregar, T. S., Tohari, H. Hartiko, dan Kayudi. 2007. Dinamika Perontokan Daun Pohon Karet dan Hasil Lateks. J. Penelitian Karet. 25 (1) : 45-75
Siswanto. 1994. Mekanisme Fisiologis Yang Berkaitan Dengan Produksi Lateks Hevea brasiliensis.Buletin Bioteknologi Perkebunan.1:23-29
Smirnoff, N. 1996. The Function And Metabolism Of Ascorbic Acid In Plants. Annals of Botany 78:661- 669
Srivastava, L. M. 2002. Plant Growth and Development. Canada: Academic Press. Steenis, C. G. K., 2005. Flora. PT. Pradyna Paramita, Jakarta
Sukma, D., R. Poerwanto, Sudarsano, N. Khumaida, S. Wiyono dan I. M. Artika. 2008. Aktivitas Kitinase dan Peroksidase dari Ekstrak Protein Daun, Akar, Kalus, dan Tunas Invitro Trichosanthes tricospidata lour. Buletin Agron (36) (1) 56-63
Sumarmadji. 1999. Respons Karakter Fisiologi Dan Produksi Lateks Beberapa Klon Tanaman Karet Terhadap Stimulasi Etilen. Disertasi. IPB, Bogor hal. 41
. 2000. Sistem Eksploitasi Tanaman Karet Yang Spesifik Diskriminatif. Warta Pusat Penelitian Karet, 19 (1-3), 31-39.
Syakir, M., S. Damanik, M. Tasma dan Siswanto. 2010. Budidaya dan Pasca Panen Karet. Pusat Penelitian dan Pengembangan Perkebunan, Bogor
Taiz, L and Zeiger, E. 2002. Plant Physiology. Third Edition. Sinauer Associates, Massachusetts
Taussky, H. H. and E. Shorr. 1953. A Microcolorimetric Methods For The Determination Of Inorganic Phosphorus. Boil. Chem. 202, 675-685 pp Thomas, W., A.Situmorang dan M.Lasminingsih. 2009. Pemilihan Klon Karet
untuk Provinsi Lampung Berdasarkan Kondisi Agroklimat. Warta Perkaretan 28(1) :19-27
Tistama, R. 2013. Faktor Histologis dan Fisiologis yang Berkaitan dengan Produksi Lateks. Workshop Eksploitasi Tanaman Karet Menuju Produktivitas Tinggi dan Umur Ekonomis Optimal
Turner, N.C. and M.M. Jones. 1980. Turgor Maintenance By Osmotic Adjustment: A Review And Evaluation. Wiley Insterscience, New York Van Loon, L.C., W.S. Pierpoint, Th. Boller, and V. Conejero. 1994.
Recommendations For Naming Plant Phatogenesis-Related Proteins. Plant Molecular Biology Report. 12 : 245-264
Vermeiren, L., Devlieghere, F., van Beest, M. Kruijf, N dan Debevere, J.1999. Developments In The Active Packaging Of Foods. Trends in Food Sci. Technol. 10, pp. 77-86
Wibowo, A. 2016. Pengaruh Pemberian NAA (Naphtalene-3-Acetic-Acid) Dan Nutrisi Untuk Pemulihan Kering Alur Sadap (KAS) Pada Tanaman Karet Quick Stater dan Slow Stater. Skripsi. USU, Medan
Woelan, S., R. Tistama dan A. Daslin. 2007. Determinasi Keragaman Genetik Hasil Persilangan Antar Populasi Berdasarkan Karakteristik Morfologi dan Teknik RAPD. Jurnal Penelitian Karet. 25 (1) : 13-26
BAHAN DAN METODE Tempat dan Waktu Penelitian
Penelitian dilaksanakan di kebun PTPN 3 Kebun Sungei Putih dan dianalisis di Laboratorium Fisiologi Balai Penelitian Sungei Putih, Kecamatan Galang, Kabupaten Deli Serdang, dengan ketinggian tempat ± 54 meter di atas permukaan laut dan tipe iklim B berdasarkan klasifikasi Oldeman (7-9 bulan basah berurutan). Penelitian berlangsung dari bulan Maret 2016 sampai Juni 2016. Bahan dan Alat
Bahan yang digunakan merupakan klon karet PB 260 mewakili metabolisme tinggi dan RRIM 921 mewakili metabolisme sedang/rendah yang ditanam pada tahun 2006 dengan jarak tanam 4 x 6 m. Tanaman karet dengan sistem sadap 1/2S d/3 (disadap 3 hari sekali dengan ½ spiral). Material yang dianalisis berupa lateks dan kulit. Bahan perlakuan terdiri dari bahan kimia komponen nutrisi Murashige & Skoog (MS), NAA dan Asam Askorbat. Bahan analisis terdiri dari bahan kimia untuk diagnosis enzim peroksidase lateks dan untuk analisis kulit beserta bahan lainnya yang mendukung penelitian ini.
Alat yang diperlukan dalam penelitian ini adalah cat minyak, pisau sadap, timbangan, glassware, spektrofotometer, sentrifius, mikropipet, alat ukur seperti meteran dan timbangan, buku data, alat tulis, kamera beserta alat-alat lain yang mendukung penelitian ini.
Metode Penelitian
perhitungan manual ada dua formula (rumus) uji T independen, yaitu uji T yang variannya sama dan uji T yang variannya tidak sama.
Untuk varian sama gunakan formulasi berikut :
Sedangkan untuk varian yang tidak sama gunakan formulasi berikut :
Keterangan :
Xa = rata-rata kelompok a Xb = rata-rata kelompok b Sp = Standar Deviasi gabungan Sa = Standar deviasi kelompok a
Sb = Standar deviasi kelompok b na = banyaknya sampel di kelompok a nb = banyaknya sampel di kelompok b
Dengan tiga faktor perlakuan yaitu : Faktor pertama : Klon
Taraf : K1 : PB 260
K2 : RRIM 921
Faktor kedua : Jenis Tanaman Taraf : J1 : Sehat
J2 : KAS Faktor ketiga : Formula
Z0 : Tanpa Formula Z1 : Pakai Formula Jumlah tanaman per perlakuan : 1 Jumlah kombinasi perlakuan : 8
Jumlah ulangan : 2,3,4,5
Pelaksanaan Penelitian
Plotting area Penelitian dan Pengujian Sampel Tanah
Tahap awal dari penelitian ini adalah ploting areal penelitian. Tanaman yang akan dijadikan tanaman sampel ditandai dengan jelas dengan cat minyak dan diberi tali untuk menghindari kesalahan pengamatan dan agar tanaman yang dijadikan tanaman sampel tidak disadap oleh penyadap. Adapun kriteria tanaman yang akan dijadikan sampel adalah tanaman yang sehat dan yang mengalami KAS parsial/sebagian (50%) yang tidak terserang penyakit. Tanaman dengan tahun tanam 2006 dan sistem sadap yang digunakan adalah ½S d/3.
Pengacakan Perlakuan
Perlakuan diacak menggunakan metode pencabutan nomor sesuai dengan banyak perlakuan yang dibutuhkan. Perlakuan terdiri dari 8 kombinasi perlakuan kemudian banyak ulangan ditetapkan sesuai dengan keadaan dilapangan. Terdapat 30 sampel dari total keseluruhan.
Pengambilan Data Awal
Data awal diambil sebelum aplikasi dilakukan yaitu pada bulan Maret sebagai data pembanding untuk keadaan aktivitas enzim peroksidase dan keadaan fisiologi tanaman karet pada sebelum atau sesudah aplikasi. Data yang diambil meliputi thiol, sukrosa, fosfat anorganik (Pi), protein dan peroksidase (POD). Pembuatan Larutan Formula Antidepresan
Perlakuan Pemberian Antidepresan
Kombinasi zat pengatur tumbuh yang diberikan sesuai dengan perlakuan dioleskan pada bidang sadap tanaman menggunakan kuas sebanyak 10 ml. Interval pemberian perlakuan adalah 1 kali dalam 2 minggu selama 3 bulan. Pengamatan Peubah Fisiologi
Peubah fisiologi diamati dengan cara mengambil sampel dan kulit kemudian dianalisi kadar sukrosa kulit, kadar fosfat anorganik kulit, kadar thiol (R – SH) kulit. Pengamatan ini dilakukan pada saat 0, 1, 2 bulan setelah pengaplikasian.
Pengamatan Peroksidase
Pengamatan kondisi tersebut diamati dengan cara mengambil sampel lateks untuk melihat perubahan aktivitas enzimatiknya. Pengamatan dilakukan pada bulan awal dan akhir penelitian.
Peubah Amatan Thiol (R – SH) (µM)
Sukrosa (µM)
Analisis kandungan sukrosa kulit menggunakan metode Dische (1962) yang telah dimodifikasi. Sampel kulit sebanyak 0,5 gram digerus menggunakan nitrogen cair dan PVPP. kemudian direndam pada larutan trikloro-asetat (TCA) 2,5% yaitu dengan melarutkan 2,5g TCA dalam 100 ml akuades sebanyak 4,5 ml pada botol film. Selanjutnya serumnya dimasukkan ke dalam tabung reaksi sebanyak 150 µL. Sampel ditambahkan 350 µL TCA 2,5% dan 3 ml pereaksi anthrone kemudian divorteks. Sampel dimasukkan ke dalam waterbath dengan suhu 1000C selama 15 menit dan dipindahkan ke dalam air biasa hingga dingin. Absorbansi sampel diukur pada panjang gelombang 627 nm dengan menggunakan spectrofotometer UV/Vis. Diukur pada 0, 1, 2 bulan pengaplikasian.
Fosfat Anorganik (Pi)
Diukur berdasarkan prinsip pengikatan oleh amonium molibdad (Taussky and Shorr, 1953). Sampel kulit sebanyak 0,5 gram digerus menggunakan nitrogen cair dan PVPP. kemudian direndam pada larutan trikloro-asetat (TCA) 2,5% sebanyak 4,5 ml pada botol film. Kemudian sampel ditambahkan dengan pereaksi campur sehingga menjadi warna biru yang kemudian diukur absorbannya pada λ 750 nm (nanometer) dengan
spektrofotometer UV/Vis. Pengamatan diukur pada 0, 1, dan 2 bulan pengaplikasian.
Analisis Enzim Peroksidase (unit/mg)
akan menyisakan serum. Selanjutnya diambil serum menggunakan mikropipet sebanyak 0,1 ml dan ditambahkan kedalam tube yang berisi 1 ml CaCl2 (1:10). lalu dihomogenkan menggunakan sentrifius dengan kecepatan 10000 rpm, dengan suhu 4°C selama 15 menit. Pembuatan Larutan A phenol-aminoantipirine (larutan fenol 810 mg dan amino antiphirine 25 mg dalam 50 ml air) dan larutan B dengan mencampurkan 30% H2O2 ditambahkan dengan larutan Buffer MES pH 6 perbandingan 1:100 dengan konsentrasi akhir 0.01M. Larutan A dan B tidak dapat dijadikan larutan stok. Pengukuran POD menggunakan spektrofotometer UV/Vis dengan menambahkan 1.4 ml larutan A dan 1.5 ml larutan B kedalam kuvet 3 ml yang lalu ditambahkan 200 µl ekstrak kedalam kuvet lalu aduk.Diukur pada absorban 510 nm Perhitungan aktifitas peroksidase dihitung dengan rumus :
A510 = Af – Ai
A510 = unit POD dengan panjang gelombang 510 nm Af = pembacaan peroksidase akhir (final)
Ai = pembacaan peroksidase awal (initial) Unit POD Aktivitas enzim peroksidase =
Protein terlarut
(Sumber : SOP. Plant Peroxidase Activity Determination, 1994). Analisis Total Protein (g)
kedalam 5 ml etanol 98% , lalu ditambahkan 10 ml asam fosfor 85%. Campuran dihomogenkan (dikocok kuat) lalu disaring dengan kertas saring dan disimpan dalam botol gelap dan suhu rendah. Stok pereaksi Bradford harus diencerkan 5 kali sebelum digunakan.
Larutan standar protein dibuat dengan menimbang 0,01 g BSA (bovine serum albumin) yang kemudian ditambahkan 10 ml buffer ektraks sehingga diperoleh larutan stok BSA dengan konsentrasi 1000 ppm. Kemudian larutan stok konsentrasi 1000 ppm diencerkan dengan melarutkan 0,5 ml larutan stok dilarutkan dengan ditambahkan 4,5 ml buffer ektraks sehingga diperoleh larutan stok BSA 100 ppm.
HASIL DAN PEMBAHASAN Hasil
Hasil pengamatan diperoleh nilai rataan thiol, fosfat anorganik (Pi), sukrosa, protein dan aktivitas enzim peroksidase (POD) (Tabel 1).
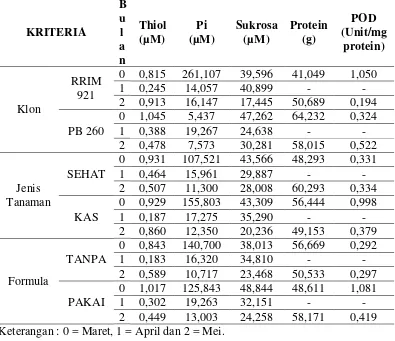
Tabel 1. Rataan Thiol, Fosfat Anorganik (Pi), Sukrosa, Protein dan Nilai Aktivitas Enzim Peroksidase (POD)
Grafik 1. Perbandingan nilai Thiol Antar Klon
Grafik 2. Perbandingan Nilai Fosfat Anorganik Antar Klon
Selama musim gugur daun menunjukkan bahwa nilai rataan nilai Pi untuk klon RRIM 921 pada bulan ke-0 adalah 261,107 µM, mengalami penurunan yang signifikan pada bulan ke-2 menjadi 14,057 µM dan pada bulan ke-2 mengalami kenaikan menjadi 16, 147 µM. Sementara kandungan Pi klon PB260 relatif lebih stabil, pada bulan ke-0 adalah 5,437 µM, yang lebih rendah daripada bulan ke-1 yang berada di kisaran 19,267 µM, dan menurun kembali pada bulan ke- 2 yang
adalah 7,573 µM. Secara umum kandungan Pi pada RRIM 921 lebih tinggi daripada PB 260 pada musim gugur daun.
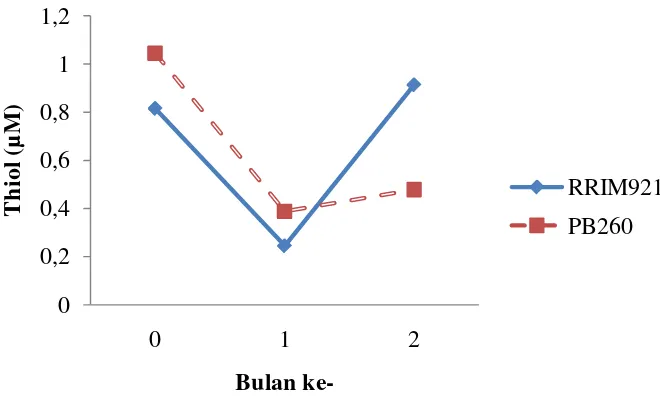
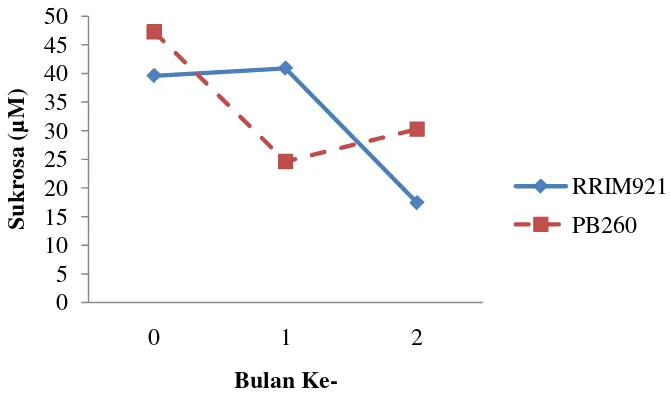
Grafik 3. Perbandingan Nilai Sukrosa Antar Klon
Seperti halnya kandungan thiol dan Pi, kandungan sukrosa juga mengalami perubahan selama 3 bulan pengamatan. Adapun kandungan sukrosa untuk PB 260 tertinggi adalah pada bulan ke-0 yaitu sebesar 47,262 µM, kemudian bulan ke-1 mengalami penurunan yaitu menjadi 24,637 µM, dan meningkat kembali pada bulan ke-2 menjadi 30,281 µM. Sedangkan untuk RRIM 921 nilai tertingginya terdapat pada bulan ke-1 yaitu 40,899 µM, bulan ke-0 yaitu 39, 596 µM, dan pada bulan Mei mengalami penurunan menjadi 17, 445 µM (Grafik 3). Dari grafik diatas dapat diketahui bahwa kandungan sukrosa pada kedua klon RRIM 921 dan PB 260 mengalami penurunan pada bulan ke-1 dan menaik pada bulan ke-2.
Pada klon RRIM 921, kandungan protein pada bulan ke-0 dan ke-2 cenderung dari 41,049 g menjadi 50,689 g. Sebaliknya untuk klon PB 260 cenderung mengalami penurunan yaitu dari 64,232 g menjadi 58,015 g. Hal ini dapat terlihat pada Grafik 4.
Grafik 4. Perbandingan Nilai Protein Antar Klon
Berbanding terbalik dengan kandungan protein, aktivitas POD pada klon RRIM 921 mengalami penurunan yaitu pada bulan ke-0 1,050 unit/mg protein menjadi 0,150 unit/mg protein pada bulan ke-2. Sedangkan untuk PB 260 cenderung mengalami kenaikan yaitu 0,324 unit/mg protein pada bulan ke-0 menjadi 0,522 unit/mg protein pada bulan ke-2 (Grafik 5).
Grafik 5. Perbandingan Aktivittas POD Antar klon
Pada Tanaman sehat ataupun yang mengalami KAS kandungan thiol terendah berubah sesuai bulan pengamatan. Pada bulan ke-0 kandungan
turut adalah 0,931 µM dan 0,929 µM. Untuk bulan ke-1 menurun menjadi 0,464 µM dan 0,187 µM. Kemudian pada bulan ke-2 tanaman sehat sedikit
mengalami peningkatan yaitu menjadi 0,507 µM dan tanaman KAS meningkat secara drastis menjadi 0,860 µM (grafik 6)
Grafik 6. Perbandingan Nilai Thiol Antara Sehat dan KAS
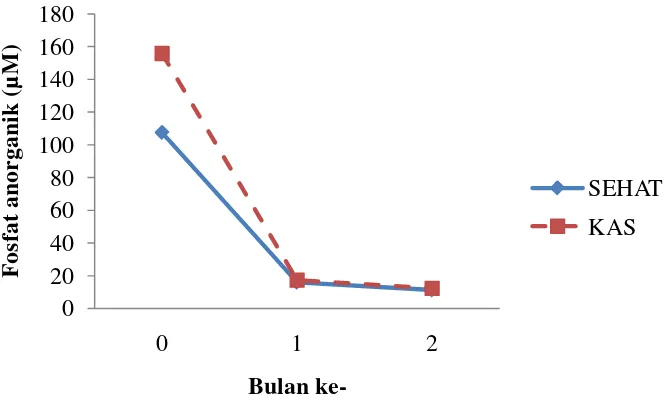
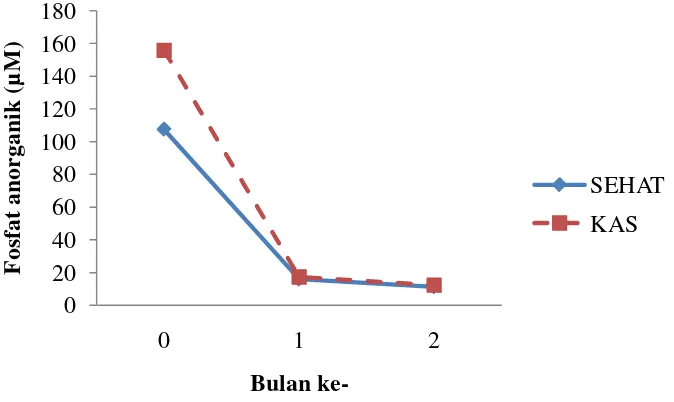
Grafik 7. Perbandingan Nilai Pi Antara Sehat dan KAS
Pola kandungan Pi Antara tanaman Sehat dan KAS relatif sama yaitu mengalami penurunan di bulan ke-1 dan bulan ke-2. Kandungan tertinggi terdapat pada bulan ke-0 yaitu berturut-turut 155,803 µM dan 140,700 µM. Sedangkan
pada bulan ke-1menjadi 15,961 µM dan 17,275 µM dan pada bulan ke-2 menjadi 11,300 µM dan 12,350 µM. Kandungan Pi pada tanaman sehat umumnya lebih rendah dari pada tanaman yang terserang KAS (Grafik 7).
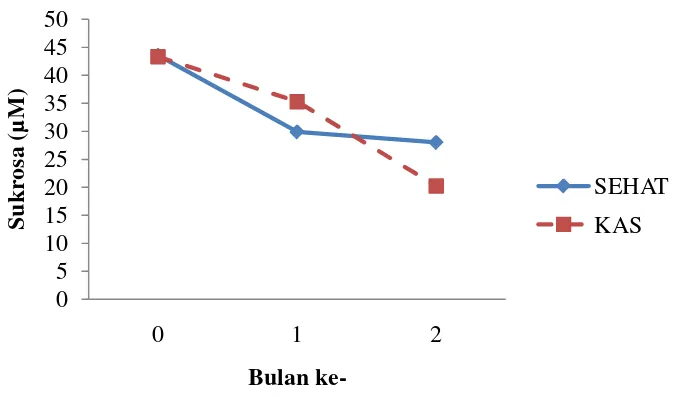
Grafik 8. Perbandingan Nilai Sukrosa Antara Sehat dan KAS
Pada awal percobaan kandungan sukrosa untuk tanaman sehat maupun KAS masih relatif tinggi berturut-turut adalah pada 43,566 µM dan 43,899 µM, kemudian bulan ke-1 mengalami penurunan yaitu menjadi 29,887 µM dan 35,290 µM, dan terus menurun pada bulan ke-2 menjadi 28,008 µM pada tanaman sehat sedangkan pada tanaman yang mengalami KAS menjadi 20,236 µM (Grafik 8).
Dari hasil penelitian diketahui bahwa kandungan Protein berdasarkan faktor jenis tanaman adalah untuk tanaman sehat cenderung mengalami kenaikan yaitu pada bulan ke-0 yaitu 48,293 g menjadi 60,293 g pada bulan ke-2. Sedangkan untuk tanaman yang mengalami Kering Alur Sadap (KAS) kandungan protein memiliki kecenderungan naik. Proteinnya pada bulan ke-0 adalah 56,444 g dan pada bulan Mei menjadi 49,153 g (Grafik 9).
Grafik 9. Perbandingan Nilai Protein Antara Sehat dan KAS
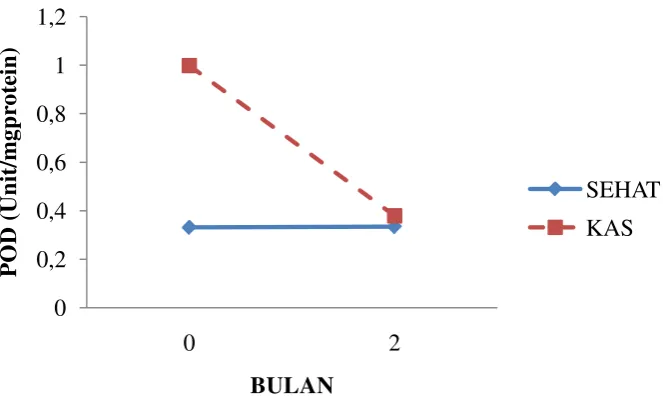
Grafik 10. Perbandingan Aktivitas POD Antara Sehat dan KAS
Aktivitas POD pada tanaman sehat lebih stabil dibandingkan tanaman yang mengalami KAS. Pada bulan ke-0 kandungan aktivitas POD yaitu 0,331 unit/mg protein lebih rendah dibandingkan nilai pada bulan Mei yaitu 0,334 unit/mg protein. Sedangkan untuk tanaman KAS nilai POD pada bulan Maret 0,998 unit/mg protein menurun drastis menjadi 0,379 unit/mg.
Untuk nilai thiol berdasarkan penggunaan formulanya pada bulan ke-0 dan ke-1 perlakuan pakai formula lebih tinggi dibandingkan yang tanpa formula yaitu
Maret 1,017 µM dan 0,302 µM sedangkan yang tanpa formula adalah 0,843 µM dan 0,183 µM. Dan untuk bulan Mei tanaman yang pakai formula lebih rendah dari tanpa formula yaitu 0,589 µM dan 0,449 µM (Grafik 11).
Grafik 11. Perbandingan Nilai Thiol Akibat Penggunaan Formula
Grafik 12. Perbandingan Nilai Pi Akibat Penggunan Formula
Grafik 12 menunjukkan bahwa nilai Pi setiap bulannya mengalami penurunan baik yang menggunakan formula ataupun yang tanpa penggunaan
formula. Pada bulan ke-0 nilai Pi yang tanpa penggunaan formula adalah 140,700 µM, kemudian turun pada bulan ke-1menjadi 16,320 µM, dan turun juga
pada bulan ke-2 menjadi 10,717 µM. Sementara kandungan Pi yang menggunakan formula berturut-turut adalah 125,843 µM, 19,263 µM dan 13,003 µM.
Grafik 13. Perbandingan Nilai Sukrosaa Akibat Penggunaan Formula Kandungan sukrosa mengalami kecenderungan menurun setiap bulannya. untuk tanpa penggunaan formula tertinggi adalah pada bulan ke-0 yaitu sebesar 38,013 µM, kemudian bulan ke-1 mengalami penurunan yaitu menjadi 34,810 µM, dan terus menurun pada bulan ke-2 menjadi 23,468 µM. Untuk penggunaan penggunaan formula nilai tertingginya terdapat pada bulan ke-0 yaitu 48,844 µM, tidak jauh berbeda dengan rataan nilai bulan ke-1 yaitu 32,151 µM, dan pada bulan ke-2 mengalami penurunan menjadi 24,258 µM (Grafik 13).
Kandungan protein tanpa formula dan pakai formula adalah berbanding terbalik. Pada perlakuan tanpa formula kandungan protein mengalami penurunan berturut-turut 56,669 g dan 50,533 g. Sementara pakai formula pada bulan ke-0 adalah 48,611 g dan pada bulan 2 meningkat menjadi 58,171 g. Pada bulan ke-0 nilai protein apabila dibandingkan antara tanpa dan pakai formula mengalami penurunan sebaliknya pada bulan ke-2 mengalami kenaikan (Grafik 14).
Grafik 14. Perbandingan Nilai Protein Akibat Penggunaan Formula
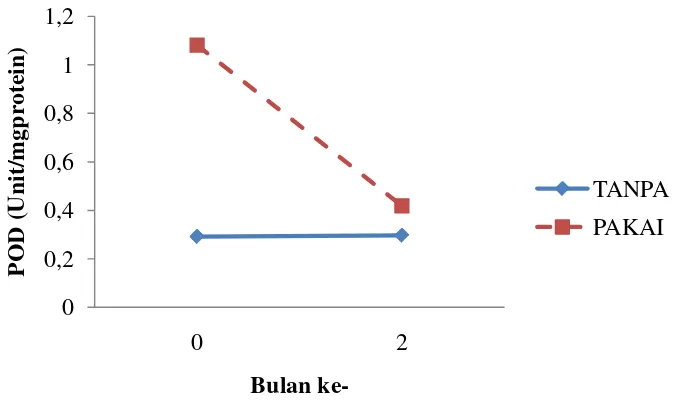
Grafik 15. Perbandingan Nilai POD Akibat Penggunaan Formula
Aktivitas POD pada tanaman yang diperlakukan tanpa formula relatif lebih stabil sedangkan pada perlakuan pakai formula aktivitas POD menurun drastis. Untuk perlakuan tanpa formula pada bulan ke-0 adalah 0,292 unit/mg protein sedangkan untuk perlakuan pakai formula adalah 1,081 unit/mg protein. Untuk bulan ke-2 perlakuan tanpa formula memiliki nilai sebesar 0,297 unit/ mg protein yaitu lebih rendah dibandingkan pada perlakuan pakai formula yaitu 0,419 mg. Umumnya aktivitas POD tanpa formula lebih rendah dibanding pakai formula.
Hasil uji t pada parameter diperoleh seperti yang terdapat pada Tabel 2. Tabel 2. Uji t Rataan Thiol, Fosfat Anorganik (Pi), Sukrosa, Protein dan Nilai Aktivitas Enzim Peroksidase (POD)
Kriteria Bulan Parameter Signifikan
RRIM 921 vs PB 260
Pada Tabel 2 menunjukkan bahwa pada perbandingan antara klon RRIM 921 dengan PB 260 yang nyata hanya pada parameter Pi pada bulan ke-0 yaitu dengan nilai signifikan sebesar 0.000, pada bulan ke-1 terdapat pada parameter sukrosa dengan nilai signifikan sebesar 0.000 sedangkan pada bulan ke-2 antar klon berbeda nyata pada parameter thiol dengan nilai signifikan 0.021, Pi dengan nilai signifikan 0.000, sukrosa dengan nilai signifikan 0.000 dan POD dengan nilai signifikan 0.048.
Perbandingan berdasarkan jenis tanaman sehat dan KAS yang memiliki perbedaan nyata adalah thiol pada bulan ke-1 dengan nilai signifikan 0.026 dan sukrosa pada bulan ke-2 dengan nilai signifikan 0.012. sedangkan untuk parameter lainnya tidak berbeda nyata.
Untuk perbandingan berdasarkan tanpa dan pakai formula yang berbeda nyata terdapat pada parameter thiol pada bulan ke-1 dengan nilai signifikan 0.033 sedangkan untuk parameter lainnya terdapat perbedaan tetapi tidak menurut uji t 5% tidak berbeda nyata.
Uji Korelasi
Hasil uji korelasi dari nilai thiol, fosfat anorganik (pi), sukrosa, protein dan nilai aktivitas enzim peroksidase (POD) Pada Bulan Mei (Tabel 3).
Tabel 3. Uji Korelasi Bulan Mei
THIOL PI SUKROSA PROTEIN POD
THIOL 1 0,534* -0,134 -0,160** -0,062**
PI 0,534* 1 -0,473* -0,156 -0,098**
SUKROSA -0,134 -0,473* 1 0,093 0,257
PROTEIN -0,160** -0,156 0,093 1 -0,529**
POD -0,062** -0,098** 0,257 -0,529** 1
Pada Tabel 3 yang menunjukkan matriks korelasi antara parameter bulan Mei dapat diketahui bahwa antara Thiol dan Pi memiliki korelasi positif dengan nilai 0.533, Thiol dan Sukrosa berkorelasi negatif dengan nilai 0.134, thiol dan protein memiliki korelasi negatif dengan nilai 0.160, dan Thiol dengan POD memiliki korelasi negatif dengan nilai 0.615, Pi dengan Sukrosa memiliki korelasi negatif dengan nilai 0.473, Pi dan Protein memiliki korelasi negatif dengan nilai 0.156, Pi dengan POD memiliki korelasi negatif dengan nilai 0.983, Protein dengan sukrosa memiliki korelasi positif dengan nilai 0.923, Sukrosa dengan POD memiliki korelasi positif dengan nilai 0.257, dan Protein dengan POD memiliki korelasi negatif dengan nilai 0.529. Hal ini dapat terlihat pada diagram dibawah ini :
Diagram 1. Korelasi Antar Parameter
100,000%
Thiol Pi Sukrosa Protein POD
KORELASI ANTAR PARAMETER
Pembahasan
Dari hasil penelitian rataan thiol antara klon RRIM 921 tidak berbeda nyata dengan dengan klon PB 260 pada bulan ke-0 dan ke-1 sedangkan pada bulan ke-2 berbeda nyata yaitu dengan nilai RRIM 921 adalah 0,913 lebih tinggi dibandingkan PB 260 yang adalah 0,478 dengan nilai signifikan 0,021. Berdasarkan jenis tanamannya pada tanaman sehat juga tidak berbeda nyata dengan tanaman yang mengalami Kering Alur Sadap (KAS) pada bulan ke-0 dan ke-2 sedangkan pada bulan ke-1 berbeda nyata dengan nilai signifikan 0,045 dimana konsentrasinya adalah tanaman sehat 0,464 memiliki nilai lebih tinggi dibandingkan tanaman yang mengalami KAS yaitu 0,187. Kemudian berdasarkan penggunaan formulanya pada perlakuan tanpa formula tidak berbeda nyata dengan yang pakai formula pada bulan ke-0 dan ke-2 dan berbeda nyata pada bulan ke-1 dengan nilai signifikan 0,033 dengan konsentrasi pada perlakuan tanpa formula 0,183 lebih rendah dibandingkan yang memakai formula yang sebesar 0,302. Dari data diatas dapat kita lihat pada musim gugur daun setiap bulannya kadar thiol pada kulit tanaman karet yang berfungsi sebagai antioksidan memiliki kisaran 0,1 sampai 0,9 dan dapat berubah karena faktor keadaan lingkungan, jenis tanaman serta pemberian antidepresan. Menurut Sumarmadji dan Tistama (2004) thiol lateks berkisar 0,4-0,9 µM. Kadar setiap komponen dapat mengalami perubahan sesuai dengan faktor lingkungan ataupun terserang patogen, hama penyakit, dan gangguan fisiologis.
mengering. Gohet et al., (1996) mengatakan Thiol (R-SH) berfungsi sebagai antioksidan, sehingga stress oksidatif sebagai akibat aktifnya metabolisme dalam sel dapat ditekan. Kadar R-SH yang rendah menunjukkan terlalu intensifnya eksploitasi sehingga perlu dikurangi dengan menurunkan intensitas sadapan maupun stimulasi. Dari hasil penelitian dapat diambil kisaran thiol pada tanaman sehat adalah 0,4-0,5 µM sedangkan tanaman sakit adalah <0,2-.>0,8 µM.
Adapun kisaran nilai protein adalah pada bulan ke-0 berdasarkan klon, RRIM 921 adalah 41,049 lebih rendah dibandingkan PB 260 yang adalah 64,232, berdasarkan jenis tanamannya tanaman sehat 48,293 memiliki nilai lebih rendah dibandingkan tanaman yang mengalami KAS yaitu 56,444 dan pada perlakuan tanpa formula 56,669 lebih tinggi dibandingkankan yang memakai formula yang sebesar 48,611. Dan untuk nilai protein pada bulan ke-2 berdasarkan klon, RRIM 921 adalah 50,689 lebih rendah dibandingkan PB 260 yang adalah 58,015, berdasarkan jenis tanamannya tanaman sehat 60,293 memiliki nilai lebih tinggi dibandingkan tanaman yang mengalami KAS yaitu 49,153 dan pada perlakuan tanpa formula 50,533 lebih tinggi dibandingkankan yang memakai formula yang sebesar 58,171. Jumlah protein pada setiap klon tanaman lain memiliki kisaran yang berbeda. Klon RRIM 921dan PB 260 memiliki kisaran yang lebih rendah dibandingkan dengan klon RRIM 623. Hal ini sesuai dengan Gohet et a., (1996) yang mengatakan bahwa pada klon RRIM 623 yang berasal dari Malaysia, kulit karet memiliki kandungan K+ yaitu 186,7 µM, Pi sebesar 20,3 Mg+ sebesar 27,5 µM, Ca+ adalah 15,5 µM, Na+ yaitu 2,9 µM, dan untuk nilai total protein adalah 67 mg/unit, serta nilai sukrosa adalah 18-27 mg/mol.
pada bulan ke-0 dan ke-2 masih dalam masa gugur daun yang berarti masa cekaman kekeringan. Hal ini sesuai dengan literatur Sathik et al (2011) yang mengatakan bahwa Pada tanaman karet, ada tiga gen yang terekspresi saat suatu klon tercekam kekeringan, yaitu Peroksidase, tingkat peroksidase yang tinggi menunjukkan keterkaitannya dalam perbaikan stres melalui detoksifikasi Species oksigen reaktif (ROS) yang diproduksi dalam jumlah besar ketika tanaman mengalami kekeringan yang dikombinasikan dengan suhu dan cahaya tinggi.
Nilai sukrosa pada bulan ke-0 perlakuan tanpa formula 38,013 lebih rendah dibandingkankan yang memakai formula yang sebesar 48,844 (sebelum aplikasi). Pada bulan ke-1 perlakuan tanpa formula 34,810 lebih tinggi dibandingkankan yang memakai formula yang sebesar 32,151. dan pada bulan ke-2 perlakuan tanpa formula ke-23,468 lebih rendah dibandingkankan yang memakai formula yang sebesar 24,258. Dari data diatas dapat kita ketahui bahwa penggunaan formula dapat menurunkan nilai sukrosa. Nilai sukrosa yang rendah akan mengindikasikan bahwa metabolisme sangat intensif. Kuswanhadi et al (2009) mengatakan sukrosa merupakan bahan utama dalam pembentukan lateks. Kadar sukrosa yang rendah menunjukkan bahwa metabolisme sangat intensif. Selain itu sukrosa dan Pi memiliki korelasi negatif yang berarti nilai Pi akan semakin tinggi, yang berarti metabolisme tinggi menyebabkan produksi tinggi. Hal ini sesuai dengan literatur Gohet and Jacob (2008) yang mengatakan bahwa Pada umumnya produksi tanaman makin tinggi dengan semakin tingginya kadar Pi dalam lateks.
adalah thiol bulan ke-1. Sebagai contoh Rataan nilai thiol pada bulan april tanpa formula adalah 0,183 sedangkan pakai formula adalah 0,302. Hal ini diduga karena pengaruh antidepresan yang mengandung asam askorbat yang memiliki peran dalam meningkatkan metabolisme tanaman. Mc Kersie dan Leshem (1994) mengatakan bahwa askorbat berperan penting dalam beberapa proses fisiologis tanaman diantaranya adalah pertumbuhan, diferensiasi, dan metabolisme. Selain itu askorbat juga berfungsi sebagai pereduktor untuk beberapa radikal bebas sehingga dapat meminimalkan kerusakan yang disebabkan oleh oxidative stres.
Pengamatan nilai aktivitas POD pada bulan ke-0 tanaman sehat sebesar 0,331 sedangkan pada bulan ke-2 menjadi 0,334. Sedangkan untuk tanaman yang mengalami KAS nilai aktivitas PODnya mengalami penurunan yaitu dari 0,998 menjadi 0,379. Sedangkan pada perlakuan tanpa formula nilai PODnya berturut-turut adalah 0,292dan 0,297. Dan untuk perlakuan pakai formula menjadi 1,081 dan 0,419. Dari data diatas dapat kita dapatkan bahwa kisaran POD pada tanaman
sehat adalah 0,2-0,4 unit/mg protein. Sedangkan untuk tanaman KAS adalah < 0,2 - >0,9 unit/mg protein. Tingginya nilai POD ini dikarenakan enzim POD
merupakan enzim yang pertama kali mengubah senyawa radikal bebas sehingga pada jaringan sakit intensitasnya paling tinggi. Menurut Agrios (2005) pada tanaman yang tahan terjadi peningkatan aktivitas peroksidase, sedangkan pada tanaman yang peka tidak ada perubahan atau bahkan turun dibandingkan dengan keadaan sehat. Enzim tersebut paling tinggi intensitasnya di dalam jaringan luka atau sakit.
KESIMPULAN DAN SARAN Kesimpulan
1. Ada perbedaan nyata nilai akibat perbedaan klon RRIM 921 dan PB 260 yaitu terlihat pada nilai pi (bulan ke-0 dan 2), thiol (bulan ke-2), sukrosa (bulan ke-1 dan 2), dan POD (bulan ke-2)
2. Tanaman KAS memiliki kandungan thiol, sukrosa yang lebih rendah dari tanaman sehat sementara Pi, POD, Protein cenderung lebih tinggi
3. Penggunaan formula cenderung menaikkan nilai thiol, Pi, protein dan aktivitas POD
4. Kisaran nilai Thiol pada kulit adalah 0,1-0,9 µM, Pi adalah 4-20 µM dan sukrosa adalah 24-60 µM, Protein 40-65 mg/unit dan POD 0,1-1 unit/mg protein. Konsentrasinya dapat berubah sesuai faktor lingkungan ataupun terserang patogen, hama penyakit, dan gangguan fisiologis
5. Korelasi positif terjadi pada parameter thiol dan pi 0.534, sukrosa dan protein 0.926, dan sukrosa dengan POD 0.257, Adapun korelasi negatif terlihat pada thiol dan sukrosa 0.134 thiol dan protein 0.160, thiol dan POD 0.615 pi dan sukrosa 0.473 pi dan protein 0.156 protein dan protein dan POD 0.529
Saran
TINJAUAN PUSTAKA Botani Tanaman
Steenis (2005) mengelompokkan kedudukan tanaman karet dalam
tatanama (sistematika) sebagai berikut: Kingdom: Plantae, Divisio: Spermatophyta, Subdivisio: Angiospermae, Kelas: Dicotyledoneae,
Ordo: Euphorbiales, Famili: Euphorbiaceae, Genus: Hevea, Species : Hevea brassiliensis Muell. Arg.
Sebagai tanaman berbiji belah akar pohon karet berupa akar tunggang yang mampu menopang batang tanaman yang tumbuh tinggi keatas. Dengan akar yang seperti itu pohon karet bisa berdiri kokoh meskipun tingginya mencapai 25 meter (Setiawan dan Andoko, 2007).
Karet merupakan pohon yang tumbuh tinggi dan berbatang cukup besar. Tinggi pohon dewasa mencapai 15-25 meter. Batang tanaman biasanya tumbuh lurus dan memiliki percabangan yang tinggi. Di beberapa kebun karet ada kecondongan arah tumbuh tanamannya agak miring ke arah utara (Nugroho, 2010).
Daun karet terdiri dari tangkai daun utama dan tangkai anak daun. Panjang tangkai daun utama 3-20 cm. Panjang tangkai anak daun sekitar 3-10 cm, pada ujungnya terdapat kelenjar. Ada tiga anak daun yang terdapat pada sehelai daun
karet. Anak daun berbentuk eliptis, memanjang dengan ujung meruncing (Astuti, 2008).
bunga betina yang tidak fertil akan mengalami pengguguran secara cepat. Buah yang bertahan berkembang, mencapai ukuran maksimum pada hari ke 80-90 dan menjadi keras pada hari ke 110 (Priyadarshan, 2011).
Buah karet berbentuk seperti setengah bola dengan pembagian ruang yang jelas. Jumlah ruang biasanya adalah tiga dan terkadang dapat mencapai enam ruang pada satu buah. Dalam setiap ruang buah terdapat biji yang berperan penting dalam perkembangbiakan. Biji karet berukuran besar dengan berat 3.5-6.0 g, memiliki kulit keras, dan berwarna coklat kehitaman dengan bercak berpola yang khas. Ukuran biji besar dengan kulit keras. Warnanya coklat kehitaman dengan bercak-bercak berpola yang khas (Astuti, 2008).
Lateks merupakan hasil fotosintesis dalam bentuk sukrosa yang ditranslokasikan dari daun melalui pembuluh tapis ke dalam pembuluh lateks. Di dalam pembuluh lateks terdapat enzim seperti invertase yang akan mengatur proses perombakan sukrosa untuk pembentukan karet. Biosintesis lateks berlangsung dalam sel-sel pembuluh lateks dengan bahan dasar berupa sukrosa yang ditranport dari daun sebagai hasil fotosintesis yang telah mengalami perubahan secara enzimatik (Dalimunthe, 2004).
Syarat Tumbuh Iklim
daerah yang cocok untuk tanaman karet adalah daerah-daerah Indonesia bagian barat, yaitu Sumatera, Jawa, dan Kalimatan, sebab iklimnya lebih basah (Budiman, 2012).
Tanah
Berbagai jenis tanah dapat sesuai dengan syarat tumbuh tanaman karet baik tanah vulkanis muda dan tua, bahkan pada tanah gambut < 2 m. Tanah vulkanis mempunyai sifat fisika yang cukup baik terutama struktur, tekstur, sulum, kedalaman air tanah, aerasi dan drainasenya, tetapi sifat kimianya secara umum kurang baik karena kandungan haranya rendah. Tanah aluvial biasanya cukup subur, tetapi sifat fisikanya terutama drainase dan aerasinya kurang baik. Reaksi tanah berkisar antara pH 3,0 - pH 8,0 tetapi tidak sesuai pada pH < 3,0 dan > pH 8,0 (Anwar, 2001).
Indonesia memiliki kisaran iklim yang luas yaitu dari tropika basah hingga semi-arid dan curah hujan merupakan unsur utama iklim yang bervariasi pada berbagai wilayah. Sebahagian besar perkebunan karet di Indonesia terletak di Sumatera dan Kalimantan dengan kisaran curah hujan antara 1.500 – 4.000 µM/th dan rata-rata bulan kering 0-4 bulan per tahun (Thomas et al., 2009).
Klon Tanaman
IRR 103, IRR 104, IRR 105, IRR 106, IRR 107, IRR 109, IRR 110, IRR 111, IRR 112, IRR 117, IRR 118, IRR 119 dan IRR 120 dan klon dengan metabolisme rendah telah diuji pada beberapa klon antara lain: AVROS 2037, BPM 107, BPM 109, PB 217, RRIC 102, PR 303, TM 2, TM 6, TM 8, TM 9, IRR 24, IRR 39, IRR 41, IRR 42 dan IRR 44.
Klon PB 260 berasal dari persilangan klon PB 5/51 dengan PB 49 yang dikategorikan sebagai tipe klon penghasil lateks. Produksi karet kering rata-rata klon PB 260 adalah 2.063 kg/ha/th. Klon PB 260 memiliki karakteristik pertumbuhan lilit batang 45 cm, tebal kulit murni 6,3 µM dan cenderung resisten
terhadap Oidium, Colletotrichum, Corynespora dan jamur upas (Daslin et al., 2009).
Potensi klon PB 260 penghasil lateks pertumbuhan jagur, resisten terhadap Corynespora colletotrichum dan Oidium. Produksi lateks
mencapai 1.5-2.5 ton/ha/th dengan warna lateks putih kekuningan. Lateks diolah dalam bentuk sheet (Janudianto et al., 2013).
Lokakarya Nasional Pemuliaan Tanaman Karet tahun 2005 telah merekomendasikan beberapa klon unggul, di antaranya adalah klon PB 260 yang telah teruji pada periode sebelumnya memiliki produktivitas mencapai 2,1 ton karet kering per hektar per tahun. Selain itu karet klon PB 260 juga memiliki
ketahanan terhadap terpaan angin karena perakarannya yang kuat (Marchino et al., 2010).
berbeda akan membutuhkan kondisi lingkungan (agroekosistem) yang sesuai guna mewujudkan tingkat produktivitas yang optimal. Hasil penelitian menunjukkan bahwa beberapa kultivar tanaman karet dapat beradaptasi pada berbagai daerah
dengan agroekosistem yang luas ataupun pada lingkungan yang spesifik (Thomas et al., 2009).
Kering Alur Sadap (KAS)
Penyakit karet sering menimbulkan kerugian ekonomis di perkebunan karet. Kerugian yang ditimbulkan tidak hanya berupa kehilangan hasil akibat kerusakan tanaman, tetapi juga biaya yang dikeluarkan dalam upaya pengendaliannya. Lebih dari 25 jenis penyakit menimbulkan kerusakan di perkebunan karet. Salah satu penyakit tanaman karet yang ditemukan pada
perkebunan karet adalah KAS (Tapping Panel Dryness, Brown Bast) (Sirait dan Syahnen, 2013).
Gambar 1. Tanaman yang terserang KAS (Foto di lapangan)
sel tilasoid. Luka kayu juga menjadi penyebab terjadinya KAS pada panel bawah. Status kejadian KAS di bidang sadapan menjadi nyata merugikan apabila dalam satu populasi telah terserang lebih dari 5%. Kejadian KAS dilapangan juga ditemukan di bidang sadap kulit perawan bahkan pada waktu awal buka sadap (Mochlisin dan Tistama, 2014).
Pengendalian penyakit KAS dapat dilakukan secara terpadu dengan pemupukan, pengikisan, pengistirahatan bidang sadapan selama 6 bulan, pengolesan fungisida Anti rot F95 (mengandung fungisida 1%, ZPT 200 ppm dan bahan lain 4%) atau pengolesan fungisida berbahan aktif triadimefon 250 g/l (Sirait dan Syahnen, 2013).
Analisis kandungan lateks pada tanaman KAS parsial diketahui menunjukkan kandungan gula tinggi, tetapi fosfat anorganik (Pi) rendah demikian pula dengan kandungan thiol meskipun tanaman diberi stimulan ethepon. Intensitas eksploitasi yang tinggi pada tanaman sehat menyebabkan kandungan gula didalam lateks turun. Sementara kandungan Pi dan thiol justru meningkat. Gula yang tersedia tidak dapat diolah karena energi yang tersedia sangat rendah dan enzim yang terlibat dalam metabolisme karet terganggu aktivitasnya. Kandungan Pi berkorelasi negatif terhadap KAS (Sumarmadji, 2000).
Gejala KAS ditandai dengan terdapatnya bagian-bagian alur sadap yang tidak mengeluarkan lateks. Bagian-bagian tersebut kemudian meluas dan akhirnya seluruh pohon tidak mengeluarkan lateks sama sekali. Kulit sebelah dalam bagian yang sakit berubah warna menjadi cokelat (Semangun, 2000).
Gugur Daun Karet
Salah satu faktor penentu terpenuhinya ketersediaan air bagi tanaman karet adalah curah hujan dan hari hujan. Curah hujan dan hari hujan merupakan faktor iklim yang ikut mengalami penyimpangan dikarenakan perubahan iklim. Perubahan iklim dapat berdampak negatif maupun positif bagi tanaman karet di lapangan (Irsal et al., 2015).
Perontokan atau gugur daun pada pohon karet lazim disebut wintering atau leaf shedding. Perontokan daun merupakan aklimatisasi saat periode kering. Perontokan daun penting dalam rangka homoeostatik, untuk mempertahankan keseimbangan antara tajuk dengan bagian tanaman lain, dan keseimbangan pohon dengan lingkungan (Siregar et al., 2007).
Morgan (1984) berpendapat bahwa perontokan daun terdiri atas 3 tahap : 1. Inisiasi perontokan daun melalui signal internal perontokan
2. Induksi perontokan melalui sintesis hormon pada daun
3. Perontokan daun yang didahului perubahan-perubahan biokimia, anatomi, dan fisiologi. Perontokan daun dapat terjadi secara serentak ataupun bertahap
Ciri musim gugur daun tahunan tidak sama di setiap wilayah. Disamping itu juga terdapat perbedaan lamanya klon mengalami gugur daun, di antaranya ada yang berlangsung serentak dan ada yang bertahap. Keserentakan gugur daun kurang dapat dibedakan antar klon (Sumarmadji, 1999).
Menurut Turner dan Jones (1980) adaptasi tanaman terhadap kekeringan : 1. Menghindari kekeringan (drought escape), yaitu kemampuan tanaman untuk
2. Penundaan dehidrasi (drought postponement) yaitu kemampuan tanaman untuk bertahan dalam kondisi kekeringan dengan cara mempertahankan status air yang tinggi melalui peningkatan absorbsi air dan mengurangi tingkat transpirasi
3. Toleran terhadap dehidrasi (dehydration tolerance) yaitu ketahanan membran sel terhadap dehidrasi
Dalam pertumbuhan karet diketahui bahwa menjelang berakhirnya musim hujan, pohon karet mulai menggugurkan daunnya. tetapi masa gugur daun pada tanaman tidak terjadi dalam waktu yang bersamaan. Masa gugur daun dipengaruhi oleh klon dan keadaan iklim setempat (Setyamidjaja, 1986).
Tanaman karet dalam menghadapi kondisi cekaman kekeringan akan beradaptasi dengan cara menggugurkan daunnya. Klon-klon karet dapat pulih kembali mendekati kondisi normal hanya terjadi jika kondisi stres air sampai pada tingkat payung daun pertama menguning 50% saja. Apabila kondisi tanaman stres sampai payung daun pertama rontok dan payung kedua mengguning 50%, payung daun kedua rontok > 75%, payung daun pertama dan kedua rontok serta batang menguning dan keriput, tanaman dapat pulih kembali, tetapi pertumbuhannya sangat lambat (Amypalupy dan Wijaya, 2009).
Fisiologi Karet
Karakter-karakter yang mendukung sifat fisiologi aliran lateks dari genotipe klon penghasil lateks dan lateks kayu memiliki jumlah ring pembuluh lebih banyak yaitu 11,75 pembuluh, diameter ring pembuluh lateks lebih besar sama dengan 34, 48 mikron, indeks penyumbatan lebih kecil sama dengan 22,99, kecepatan aliran lateks lebih besar sama dengan 8, 18 (ml/menit/cm) dan indeks hasil lebih besar sama dengan 77,03% (Pasaribu et al., 2014).
Pada umumnya klon yang berproduksi tinggi tanpa stimulasi mempunyai kadar fosfat anorganik (Pi) tinggi dan sukrosa rendah, yang menunjukkan aktifitas metabolisme yang tinggi. Sebaliknya, kadar Pi rendah dan sukrosa tinggi pada klon berproduksi rendah, yang menunjukkan rendahnya aktifitas metabolisme lateks (Lacote, 2007).
Thiol (R-SH) berfungsi sebagai antioksidan, sehingga stress oksidatif sebagai akibat aktifnya metabolisme dalam sel dapat ditekan. Kadar R-SH yang rendah menunjukkan terlalu intensifnya eksploitasi sehingga perlu dikurangi dengan menurunkan intensitas sadapan maupun stimulasi (Gohet et al., 1996).
Kisaran optimal kadar fosfat anorganik lateks adalah 10-20 µM. Semakin rendah kandungan fosfat anorganik dari kisaran optimal tersebut berarti kemampuan tanaman dalam melakukan metabolisme juga semakin berkurang. Sebaliknya, semakin tinggi kadar fosfat anorganik dari kisaran optimalnya, mengindikasikan bahwa tanaman mengalami over eksploitasi atau mungkin juga terserang penyakit (D’ Auzac et al., 1989).
sukrosa pada klon IRR 42 lebih diutamakan dalam proses pembelahan sel-sel pada jaringan kulit sehingga latisifer lebih padat pada klon PB 260 dibanding klon IRR 42 (Lubis, 2014).
Kadar sukrosa yang terukur dalam lateks merupakan selisih antara influks sukrosa dengan banyaknya sukrosa yang digunakan untuk metabolisme lateks. Kadar sukrosa lateks yang tinggi tidak mutlak memberikan gambaran pada potensi produksinya tetapi justru dapat menggambarkan produksi aktual yang rendah, karena produksi lateks dan pertumbuhan berkompetisi dengan kuat dalam hal penggunaan sukrosa (Sumarmadji, 2000).
Pada klon RRIM 623 yang berasal dari Malaysia kulit karet memiliki kandungan K+ yaitu 186,7 µM, Pi memiliki kandungan 20,3 µM, Mg+ sebesar 27,5 µM, Ca+ adalah 15,5 µM, Na+ yaitu 2,9 µM, dan untuk nilai total protein adalah 67 mg/unit, serta nilai sukrosa adalah 18-27 mg/mol (Gohet et al., 1996).
Tanaman karet dengan metabolisme rendah memiliki tingkat pemulihan terhadap KAS lebih baik dibandingkan tanaman karet dengan metabolisme tinggi. Hal tersebut diduga berkaitan dengan tipe metabolisme masing-masing klon. Tanaman karet metabolisme rendah memiliki respon fisiologis yang lebih rendah sehingga memiliki tingkat stress fisiologis yang lebih rendah dibandingkan tanaman karet metabolisme tinggi. Hal ini mempengaruhi kadar sukrosa pada tanaman, tanaman karet metabolisme rendah yang mengalami KAS akan mengalami biosintesis sukrosa dengan baik pada saat pemulihan dibandingkan dengan tanaman karet metabolisme tinggi (Wibowo, 2016).
harus mempertimbangkan nilai kritis dari karakter fisiologinya (Sumarmadji, 1999).
Beberapa faktor yang menyebabkan penurunan produksi tanaman karet antara lain adalah keletihan fisiologis tanaman, kebocoran aplikator, dan sisa panel sadap yang semakin menipis (Siregar et al., 2013).
Antidepresan
Auksin dan sitokinin berbeda dengan hormon tumbuhan yang lain. Auksin dan sitokinin merupakan agen sinyal yang sangat penting dalam mempengaruhi viabilitas tanaman. Auksin mengontrol bermacam-macam proses perkembangan tanaman diantaranya perpanjangan batang, dominansi apikal, inisiasi akar, perkembangan buah dan pertumbuhan (Taiz dan Zeiger, 2002).
Asam naftalena asetat (NAA) dan 2.4-D merupakan senyawa tanpa ciri indol tapi mempunyai aktivitas biologis seperti IAA. NAA banyak digunakan sebagai hormon akar dan selang konsentrasi yang mendorong pembesaran sel-sel pada akar adalah sangat rendah. Menurut Zaer dan Mapes (1985), NAA memiliki sifat kimia lebih stabil dibanding IAA dan tidak mudah teroksidasi oleh enzim. Anwar (2007) menambahkan bahwa NAA merupakan IAA sintetik yang sering digunakan karena memiliki sifat yang lebih tahan, tidak terdegradasi dan lebih murah. Naphthalene Asetic Acid/Naphtyl Acetic Acid (NAA) memiliki berat molekul 186.21 dengan rumus molekul C12H10O2.
dibandingkan IAA dalam menginduksi pertumbuhan akar pada stek batang. Senyawa ini cenderung lebih stabil di dalam jaringan tanaman (Srivastava, 2002).
Askorbat berperan penting dalam beberapa proses fisiologis tanaman diantaranya adalah pertumbuhan, diferensiasi, dan metabolisme. Selain itu askorbat juga berfungsi sebagai pereduktor untuk beberapa radikal bebas sehingga
dapat meminimalkan kerusakan yang disebabkan oleh cekaman oksidatif (Mc Kersie dan Leshem 1994).
Asam askorbat atau vitamin C merupakan salah satu bentuk antioksidan yang secara alami terdapat pada tumbuhan. Askorbat merupakan senyawa metabolit utama pada tumbuhan yang memiliki fungsi sebagai antioksidan, yang melindungi tanaman dari kerusakan oksidatif yang dihasilkan dari metabolisme aerobik, fotosintesis dan berbagai polutan. Askorbat juga merupakan kofaktor untuk beberapa enzim hidroksilase (misalnya prolyl hidroksilase) dan violaxanthin de-epoxidase. Askorbat berada di dinding sel sebagai baris pertahanan pertama terhadap ozon (Smirnoff, 1996).
Diantara bahan tambahan yang dianggap paling aman sebagai penyerap oksigen, asam askorbat (vitamin C) dianggap yang paling aman untuk digunakan sebagai oxygen scavenger. Pada prinsipnya, asam L-askorbat akan dioksidasi menjadi aam dehidro L-askorbat dengan bantuan enzim oksidase atau peroksidase (Vermeiren et al., 1999).
Enzim Peroksidase
aktivitas enzim peroksidase dipengaruhi juga oleh adanya serangan virus. Gupta et al. (1990) menyatakan bahwa tanaman yang tahan terhadap penyakit
cenderung memperlihatkan aktivitas peroksidase yang lebih tinggi dibandingkan dengan tanaman rentan.
Peroksidase termasuk ke dalam enzim golongan oksidoreduktase, yaitu enzim yang menggunakan hidrogen peroksida sebagai substrat. Enzim peroksidase berkaitan erat dengan sejumlah proses fisiologi yang meliputi lignifikasi, penyembuhan luka, oksidasi fenol, dan pertahanan terhadap pathogen (Reimmann et al. 1992).
Gen ketahanan hipersensitif yang dominan diekspresikan pada tanaman adalah gen penyandi enzim peroksidae dan polifenol peroksidase. Kedua enzim tersebut lebih umum berperan dalam mekanisme pertahanan terhadap penyakit
sehingga aktivitasnya dijadikan sebagai induksi ketahanan (Saravanan et al., 2004).
Nilai absolut aktivitas kitinase dan peroksidase berbeda diantara jaringan tanaman. Hal ini kemungkinan disebabkan perbedaan tingkat diferensiasi sel jaringan dan juga faktor lingkungan. Pada kalus dan tunas in vitro, lingkungan dalam kondisi steril sehingga faktor yang berpengaruh terhadap ekspresi gen kitinase dan peroksidase kemungkinan adalah faktor abiotik seperti media dan lingkungan (Sukma et al., 2008).
Penyadapan dan stimulasi etefon direspons oleh tanaman karet sebagai cekaman bagi kehidupannya. Cekaman lingkungan akan menyebabkan akumulasi Reactive Oxygen species (ROS) yang dapat menghancurkan makromolekul penyusun membran organel atau sel. Kerusakan membran tersebut akan memicu kematian sel. Untuk mengatasi cekaman tersebut, tanaman karet meningkatkan aktivitas askorbat peroksidase (APX; EC 1.11.1.9). Enzim tersebut berperan dalam detoksifikasi ROS invivo, dan berperan dalam ketahanan terhadap cekaman dan/atau mengatur lamanya aliran lateks (Astuti, 2008).
Pada tanaman yang toleran/tahan diketahui terjadi peningkatan aktivitas peroksidase, sedangkan pada tanaman yang peka tidak ada perubahan atau bahkan turun dibandingkan dengan keadaan sehat. Enzim tersebut merupakan enzim oksidase yang paling tinggi intensitasnya di dalam jaringan luka atau sakit (Agrios, 2005).
Peroksidase termasuk ke dalam enzim golongan oksidoreduktase yaitu enzim yang mengkatalis reaksi oksidasi-reduksi. Radikal bebas yang terbentuk dari proses respirasi aerobik, misalnya radikal hidroksida (OH-), superoksida (O-), dan hidrogen peroksida (H2O2), dapat merusak fraksi lipid membran dan menghasilkan lipid peroksida dan selanjutnya terurai menjadi senyawa produk oksidasi sekunder yang toksik (Dumet & Benson 2000). Molekul-molekul toksik tersebut dibatasi jumlahnya di dalam sel oleh sejumlah enzim antioksidan. Superoksida dipecahkan oleh Superoksida dismutase (SOD) dimana dalam proses tersebut dihasilkan hidrogen peroksida (H2O2) yang kemudian diuraikan oleh
enzim golongan oksidoreduktase yang menggunakan H2O2 sebagai akseptor elektron untuk mengkatalis berbagai reaksi oksidatif. Peroksidase juga membutuhkan kofaktor untuk melakukan aktivitas enzimatisnya yaitu heme
sehingga peroksidase disebut juga heme dependent peroxidase (Quiambao & Rojah 2000).
Gambar 3. Reaksi penghilangan ROS (Quiambao & Rojah 2000).
antioksidan pada bagian-bagian sel selain kloroplas seperti mitokondria, sitosol, peroksisom dan dalam inti. Sehingga dapat disimpulkan bahwa tingkat GPX yang lebih tinggi pada semua klon toleran menunjukkan relevansinya terhadap pembilasan ROS selama cekaman kekeringan (Sathik et al., 2011).
PENDAHULUAN Latar Belakang
Tanaman karet (Hevea brasiliensis Muell. Arg) termasuk dalam kelompok famili Euphorbiaceae, merupakan salah satu tanaman perkebunan penghasil karet alam utama yang berperan penting dalam perekonomian di beberapa negara di Asia Tenggara, termasuk Indonesia (Oktavia et al., 2007).
Karet merupakan salah satu komoditas perkebunan yang penting sebagai sumber devisa nonmigas bagi Indonesia, sehingga memiliki prospek yang cerah. Akan tetapi Sejak dekade 1980 hingga tahun 2010, permasalahan karet Indonesia adalah rendahnya produktivitas dan mutu karet yang dihasilkan. Oleh sebab itu, upaya peningkatan produktivitas tersebut terus dilakukan (Syakir et al., 2010).
Tanaman karet berdasarkan karakteristik metabolisme terbagi menjadi dua macam yaitu quick starter dan slow starter. Klon quick starter selama siklus sadap 20 tahun secara umum produktivitasnya dapat berkisar 42 - 46 ton/ha/siklus, sedangkan klon slow starter dapat berkisar 35 – 36 ton/ha/siklus. Pencapaian produktivitas di lapangan seringkali jauh di bawah standar yaitu hanya 13 -26 ton/ha/siklus dengan siklus 12-17 tahun sadap (Siagian dan Siregar, 2011).
Salah satu penyebab menurunnya produksivitas karet adalah gangguan kering alur sadap (KAS). Potensi terjadinya KAS meningkat seiring pertambahan umur tanaman. Intensitas KAS diklasifikasikan tinggi bila mencapai 7,3 % untuk klon slow starter, dan 9,2 % untuk klon quick starter dengan potensi kehilangan
Mekanisme terjadinya KAS dipacu oleh cekaman fisiologis menyebabkan tanaman membentuk senyawa radikal bebas seperti O2- dan H2O2 akibat cekaman dari kombinasi pelukaan dan pemberian stimulan. Senyawa-senyawa radikal bebas seperti reactve oxygene species (ROS) dapat merusak fungsi aquaporin sehingga menyebabkan transportasi air dan nutrisi ke dalam sel pembuluh lateks menjadi terganggu dan berujung terjadinya KAS (Tistama, 2013).
Beberapa bukti mengarahkan kepada korelasi yang kuat antara KAS dan cekaman stres oksidatif di dalam tanaman karet. Jaringan kayu lunak yang mengalami KAS memiliki kandungan H2O2 yang sangat tinggi jika dibandingkan dengan tanaman sehat yang mengindikasikan adanya stres oksidatif selama KAS. Penelitian sebelumnya telah menemukan bahwa ROS (reactive oxygen species) secara alami dihasilkan di dalam metabolisme tanaman. Selama stres biotik maupun abiotik, ROS tersebut terakumulasi di dalam jaringan jauh lebih cepat dengan reaksi yang dapat menghilangkan ROS tersebut. Detoksifikasi ROS melalui SOD, peroksidase dan katalase secara enzimatik maupun melalui mekanisme non enzimatik lainnya mampu menghilangkan ROS dari jaringan tanpa menimbulkan kerusakan. Dengan demikian, peroksidase dan katalase memiliki peran utama di dalam proses penghilangan molekul H2O2 di dalam jaringan biologis (Gebelin et al., 2013).
Cekaman lingkungan akan menyebabkan akumulasi reactive oxygen species (ROS) yang dapat menghancurkan makromolekul penyusun membran organel atau sel. Penyimpangan produksi lateks karena cekaman oksidatif yang
Pada tanaman karet pertumbuhan dan produksi adalah dua peubah agronomi penting yang sangat dipengaruhi oleh variasi iklim. Pola iklim tahunan yang berbeda pada utara dan selatan khatulistiwa menyebabkan waktu puncak produksi pada kedua kawasan tersebut juga berbeda mengikuti pola pertumbuhan dan gugur daun. Pada klon PB 260 produksi memiliki korelasi yang nyata dengan jumlah daun gugur, dinamika kadar karet kering dan curah hujan (Siregar, 2014).
Pohon karet merontokkan daun secara periodik disebabkan oleh periode kering setiap tahun. Di Sumatera Utara, perontokan daun karet umumnya terjadi pada bulan Februari sampai bulan April. Sejalan dengan perubahan curah hujan, daun tumbuh dan berfungsi sebagai penghasil asimilat (Siregar et al., 2007).
Adapun fungsi dari masing-masing karakter fisiologi adalah sebagai berikut: sukrosa berfungsi sebagai prekusor untuk sintesis partikel karet (cispolyisoprene), fosfat anorganik (Pi) berfungsi sebagai fosforilasi dan sebagai pembentuk energi, thiol sebagai aktivator pada berbagai enzim (Woelan et al., 2007).
Enzim peroksidase merupakan salah satu enzim tanaman yang mempunyai hubungan dengan proses ketahanan. Untuk mengetahui kepekaan dan ketahanan tanaman terhadap serangan penyakit dipergunakan pendekatan mengenai pengaruh stres lingkungan terhadap proses fisiologi tanaman. Cekaman lingkungan dapat mempengaruhi aktivitas gen dan menentukan kapan, bagaimana dan berapa banyak suatu enzim/protein dapat diproduksi dalam organ atau jaringan tanaman (Imelda et al., 2001).
gugur daun juga dapat mengurangi nilai produksi karet pada setiap tahunnya yang berdampak terhadap pertumbuhan nilai ekonomis karet dan devisa negara karenanya upaya penyembuhan penting dilakukan. Penentuan parameter yang berkaitan dengan penyembuhan KAS perlu dikembangkan, sehingga bukan ditentukan hanya melalui pengamatan visual saja. Oleh karena itu, analisis beberapa peubah metabolisme penting dilakukan terutama pada kulit tanaman karet sehingga dapat dijadikan sebuah indikator dini kepada penyembuhan KAS. Dengan adanya penelitian ini diharapkan dapat menetapkan tingkat penyembuhan KAS dengan pengaruh dari pemberian antidepresan serta kedepannya dapat mengurangi kerugian produksi akibat KAS dan gugur daun.
Tujuan Penelitian
Tujuan penelitian ini adalah untuk menetapkan dan menganalisis aktivitas enzim peroksidase (POD) pada lateks dan fisiologi kulit pada tanaman karet (Hevea brasiliensis Muell. Arg) Klon PB 260 dan RRIM 921 di saat terjadinya musim gugur daun dengan pemberian antidepresan.
Hipotesis Penelitian
Terdapat perbedaan nilai terhadap aktivitas enzim peroksidase (POD) lateks dan fisiologi kulit tanaman karet akibat perbedaan klon, jenis tanaman dan pemberian antidepresan serta dapat diketahui nilai korelasi antar perameternya. Kegunaan Penelitian
ABSTRAK
Mawaddah Putri Arisma Siregar, 2016. Aktivitas Enzim Peroksidase (POD) Lateks dan Analisis Kulit Tanaman Karet (Hevea brasiliensis Muell. Arg) Klon PB 260 Dan RRIM 921 Dengan Pemberian Antidepresant Pada Musim Gugur Daun. Di bawah bimbingan Prof. Dr. Ir. Rosmayati, M.S., Dr. Ir. Hot Setiado, M.S serta Dr. Radite Tistama.
Kering alur sadap (KAS) menyebabkan produksi turun secara signifikan dan dapat mempercepat masa peremajaan karet. Kemudian adanya masa gugur daun juga dapat mengurangi nilai produksi karet pada setiap tahunnya. Oleh karena itu, analisis beberapa peubah metabolisme penting dilakukan terutama pada kulit tanaman karet sehingga dapat dijadikan sebuah indikator dini kepada penyembuhan KAS. Penelitian bertujuan untuk mengetahui aktivitas enzim
peroksidase (POD) di lateks dan analisis kulit pada tanaman karet (Hevea brasiliensis Muell. Arg) klon PB 260 dan RRIM 921 pada saat terjadinya
ABSTRACT
Mawaddah Putri Arisma Siregar, 2016. The Activity of latex peroxidase enzyme (POD) and Physiological Analysis of Rubber Plant Bark (Hevea brasiliensis Muell. Arg) clones PB 260 and RRIM 921 Applied with Antidepressanton the Leaf Fall Period. Supervised by Prof. Dr. Ir. Rosmayati, MS., Dr. Ir. Hot Setiado, MS., and Dr. Radite Tistama.
Tapping panel dryness (KAS )significantly decreased the yield and accelerated the plant rejuvenation. Then presence of the leaf fall period also could reduce the value of the rubber production every year. Therefore, the analysis of several variables metabolism was important especially on the rubber plant bark which could be used as an early indicator for the healing of the tapping panel dryness. The research aimed to determine the activity of peroxidase (POD) in latex and the bark analysis of rubber plant (Hevea brasiliensis Muell. Arg) clones PB 260 and RRIM 92 applied with antidepressant on the leaf fall period. The research was conducted at the Laboratory of Physiology Sungei Putih Rubber Research Center from March 2016 to June 2016. The correlation analysis, the T testwere used using the program Minitab 16.0 and SPSS 20.0 with factors i.e. : clones (RRIM 921 and PB 260), types of plants (healthy and KAS) and the formula od the stimulants. Parameter observed were thiol, inorganic phosphate (pi), sucrose, protein and activity of peroxidase (POD). The results showed that the range of values Thiol bark is 0.1-0.9 mM, Pi is 4-20 mM sucrose is 24-60 mM, Protein 40-65 mg / unit and the POD 0.1-1 units / mg protein changed in accordance with the condition of the plant and environmental factors. Positive correlations obtained on thiol parameter and pi (0534), sucrose and protein (0.926), and sucrose with POD (0.257). The negative correlation obtain in thiol and sucrose (0.134), and protein thiol (0.160), thiol and POD (0.615), pi and sucrose (0.473), and protein pi (0.156), protein and protein and POD (0.529).
AKTIVITAS ENZIM PEROKSIDASE (POD) LATEKS DAN ANALISIS FISIOLOGI KULIT KARET (Hevea brasiliensis Muell. Arg) KLON PB 260 DAN RRIM 921
DENGAN PEMBERIAN ANTIDEPRESAN PADA MUSIM GUGUR DAUN
SKRIPSI
Oleh :
MAWADDAH PUTRI ARISMA SIREGAR 120301031
PEMULIAAN TANAMAN
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
AKTIVITAS ENZIM PEROKSIDASE (POD) LATEKS DAN ANALISIS FISIOLOGI KULIT KARET (Hevea brasiliensis Muell. Arg) KLON PB 260 DAN RRIM 921
DENGAN PEMBERIAN ANTIDEPRESAN PADA MUSIM GUGUR DAUN
SKRIPSI
Oleh :
MAWADDAH PUTRI ARISMA SIREGAR 120301031
PEMULIAAN TANAMAN
Skripsi Sebagai Salah Satu Syarat untuk Mendapatkan Gelar Sarjana di Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara, Medan
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
Judul : Aktivitas Enzim Peroksidase (POD) Lateks dan Analisis Fisiologi Kulit Karet (Hevea brasiliensis Muell. Arg) Klon PB 260 Dan RRIM 921 Dengan Pemberian Antidepresan Pada Musim Gugur Daun
Nama : Mawaddah Putri Arisma Siregar NIM : 120301031
Program Studi : Agroekoteknologi Minat Studi : Pemuliaaan Tanaman
Disetujui oleh: Komisi Pembimbing
(Prof. Dr. Ir. Rosmayati, MS Ketua
) (Ir. Hot Setiado, MS., Ph.D Pembimbing
) (Dr. Radite Tistama Pembimbing
Lapangan )
Mengetahui :
(
ABSTRAK
Mawaddah Putri Arisma Siregar, 2016. Aktivitas Enzim Peroksidase (POD) Lateks dan Analisis Kulit Tanaman Karet (Hevea brasiliensis Muell. Arg) Klon PB 260 Dan RRIM 921 Dengan Pemberian Antidepresant Pada Musim Gugur Daun. Di bawah bimbingan Prof. Dr. Ir. Rosmayati, M.S., Dr. Ir. Hot Setiado, M.S serta Dr. Radite Tistama.
Kering alur sadap (KAS) menyebabkan produksi turun secara signifikan dan dapat mempercepat masa peremajaan karet. Kemudian adanya masa gugur daun juga dapat mengurangi nilai produksi karet pada setiap tahunnya. Oleh karena itu, analisis beberapa peubah metabolisme penting dilakukan terutama pada kulit tanaman karet sehingga dapat dijadikan sebuah indikator dini kepada penyembuhan KAS. Penelitian bertujuan untuk mengetahui aktivitas enzim
peroksidase (POD) di lateks dan analisis kulit pada tanaman karet (Hevea brasiliensis Muell. Arg) klon PB 260 dan RRIM 921 pada saat terjadinya