ANALISIS BETAGLUKAN PADA PERSILANGAN JAMUR
TIRAM PUTIH (Pleurotus ostreatus) DENGAN KING OYSTER
(Pleurotus eryngii) MENGGUNAKAN FTIR
MURSYIDAH
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul Analisis Betaglukan Pada Persilangan Jamur Tiram Putih (Pleurotus ostreatus) dengan King Oyster (Pleurotus eryngii) Menggunakan FTIR adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
MURSYIDAH. Analisis Betaglukan Pada Persilangan Jamur Tiram Putih (Pleurotus ostreatus) dengan King Oyster (Pleurotus eryngii) Menggunakan FTIR. Dibimbing oleh IRZAMAN dan MERSI KURNIATI.
Jamur tiram (Pleurotus spp.) Secara luas dibudidayakan di seluruh dunia. jamur tiram memiliki Pleuran yang dikenal sebagai -glukan, merupakan homopolimer glukosa terikat melalui ikatan -(1,γ) dan -(1,6) glukosida. King Oyster (Pleurotus eryngii) memiliki -glukan lebih tinggi yaitu 12,91% dibandingkan jamur tiram putih (Pleourotus ostreatus) sebesar 8,29%, sedangkan dari tampilan fisik jamur tiram putih lebih menarik daripada King Oyster. Untuk menggabungkan karakteristik-karakteristik tersebut sehingga perlu dilakukan strain baru, yaitu melakukan persilangan dari kedua jamur tiram tersebut dengan tujuan menghasilkan varietas jamur baru yang unggul dari induknya, baik dari kandungan -glukan maupun tubuh buah jamur.
Tahap awal dalam penelitian ini adalah pembibitan, kemudian dilanjutkan budidaya hingga terbentuknya tubuh buah. Hasil panen jamur dilakukan uji fisik dari nilai rata-rata diameter tudung, panjang tangkai, massa jamur, dan lebar tangkai jamur, kemudian diisolasi senyawa -glucan dengan metode Yap & Ng. Isolat ini diidentifikasi kelompok fungsional ( -(1,γ), -(1,4), dan -(1,6) glukan) menggunakan Fourier Transform Infra Red (FTIR).
Karakterisasi FTIR ikatan molekul yang teridentifikasi pada ekstrak JP, JS, KP, KB, dan JT yaitu senyawa C-N, C-O, C=O, C-H, O-H, dan N-H. Sedangkan
komponen utamanya adalah -glukan dan protein. Hasil karakterisasi FTIR, senyawa -glukan, yaitu ikatan 1,4-D-glukan 1,6-D-glukan terdapat pada ekstrak JP, JS, KP, KB, dan JT, sedangkan ikatan 1,3-D-glukan hanya terdapat pada jamur persilangan (JS). JS juga memiliki intensitas pita serapan -glukan yang lebih tinggi dibandingkan JP, KP, KB, dan JT. Ini menunjukkan bahwa JS memiliki kandungan -glukan lebih tinggi dibandingkan dengan JP, KP, KB, dan JT. Sedangkan dari uji fisik, yaitu panjang tangkai, diameter tudung, massa, dan lebar tangkai jamur, JS juga cenderung mirip dengan jamur tiram putih.
Memiliki kandungan -glukan yang lebih tinggi menunjukkan bahwa JS berbeda dengan induknya, yang bisa dikatakan JS merupakan varietas baru yg memiliki kandungan yang lebih baik dari induknya dan memiliki tampilan bentuk yang menarik dan menjual seperti jamur tiram putih.
SUMMARY
MURSYIDAH. Analysis Betaglucan of The Cross White Oyster (Pleurotus ostreatus) With King Oyster (Pleurotus eryngii) Using FTIR. Supervised by IRZAMAN and MERSI KURNIATI.
Oyster mushroom (Pleurotus spp.) was widely cultivated all over the world. Oyster mushroom had a pleuran as known as -glucan, which was a homopolymer
of glucose bonded through a bond of -(1,γ) and -(1,6) glucoside. King Oyster (Pleurotus eryngii) had -glucan which was 12.91% higher than the white oyster mushroom (Pleourotus ostreatus) amounted to 8.29%, while the physical appearance of white oyster mushroom was more interesting than King Oyster. To combined these characteristics, so we needed a new strain, that was to cross from both the oyster mushrooms with the aimed of producing a new mushroom varieties were superior to the parent, both of the content of -glucan and fruiting bodies.
The first step in this research was the nursery, then continued cultivation until the formation of fruiting bodies. Mushrooms harvest analyzed physical test consists of average of diameter hood, stalk length, weight, and stalk width, and
then isolated of -glucan compounds by Yap & Ng methods. These isolates were
identified functional groups ( - (1,γ), - (1,4) and - (1,6) glucans) using Fourier Transform Infra Red (FTIR).
FTIR characterization of molecular bonds identified in the extract JP, JS, KP, KB, and JT were compounds C-N, C-O, C=O, C-H, O-H and N-H. While the main components were -glucan and protein. FTIR characterization results the
compound of -glucan, which was the bond of 1,4-D-glucan 1,6-D-glucan contained in the extract JP, JS, KP, KB, and JT, while 1,3-D-glucan contained only JS. JS also had an absorption band intensity of -glucan was higher than JP, KP, KB, and JT. This indicated that the JS had a -glucan content of higher than JP, KP, KB, and JT. While the physical test, the stem length, diameter hood, mass, and wide mushroom stalk, JS had been similar to the oyster mushroom.
Content of -glucan coumponds was higher, this indicated that the JS was different from its parent, which JS was a new variety that had better content from its parent and physical appearance more attractive and sold like white oyster mushroom.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biofisika
ANALISIS BETAGLUKAN PADA PERSILANGAN JAMUR
TIRAM PUTIH (Pleurotus ostreatus) DENGAN KING OYSTER
(Pleurotus eryngii) MENGGUNAKAN FTIR
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Alhamdulillah, segala puji dan syukur penulis panjatkan kepada Allah SWT yang telah memberi rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan tesis ini. Penelitian ini berjudul “Analisis Betaglukan Pada Persilangan Jamur Tiram Putih (Pleurotus ostreatus) dengan King Oyster (Pleurotus eringyii) Menggunakan FTIR”. Penelitian ini berlangsung selama 9 bulan, yaitu September 2015 sampai Mei 2016.
Penulis menyadari bahwa penelitian dan penulisan tesis ini dapat diselesaikan atas izin Allah dengan perantara bantuan dan dukungan dari berbagai pihak. Untuk itu penulis ucapkan terima kasih kepada Bapak Dr Ir Irzaman, M.Si dan Ibu Dr Mersi Kurniati, S.Si M.Si selaku pembimbing yang telah memberikan bimbingan, bantuan, dan arahan selama penelitian dan penulisan. Penulis juga ucapkan terima kasih kepada Bapak Dr Ir Irmansyah M.Si sebagai penguji luar komisi yang telah memberikan saran dalam penulisan. Selanjutnya terima kasih juga penulis sampaikan kepada Ibu Maya Risanti SP dan ayah asril yang selalu membantu dalam penelitian. Di samping itu, penulis juga menyampaikan terima kasih kepada Lembaga Pengelola Dana Pendidikan (LPDP) atas bantuan dana pendidikan dan penelitian. Ungkapan terima kasih juga disampaikan kepada nenek, bapak, ibu, teman-teman, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
2 METODE 2
Bahan 2
Alat 2
Prosedur Analisis Data 2
Analisis Data 9
3 HASIL DAN PEMBAHASAN 10
Hasil Karakterisasi FTIR 10
Hasil Analisis Molekul 16
Hasil Uji Fisik 18
4 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 21
LAMPIRAN 26
DAFTAR TABEL
1 Nilai Bilangan Gelombang Masing-Masing Jamur Hasil Eksperimen
dan Literatur 11
2 Analisis kandungan tiap jamur 15
3 Analisis Vibrasi dan Konstanta Gaya Ikatan dengan Mengasumsikan
Proses Regangan Asimetri 17
4 Analisis Vibrasi dan Konstanta Gaya Ikatan Gugus Fungsi O-H dengan
Mengasumsikan Proses Regangan Asimetri 17
5 Hasil Rata-Rata Uji Fisik dari Masing-Masing Jamur 18
DAFTAR GAMBAR
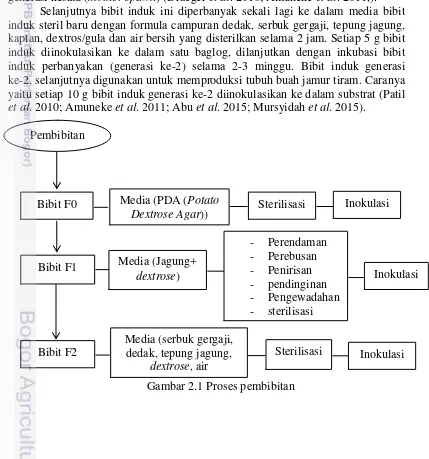
1 Proses Pembibitan 3
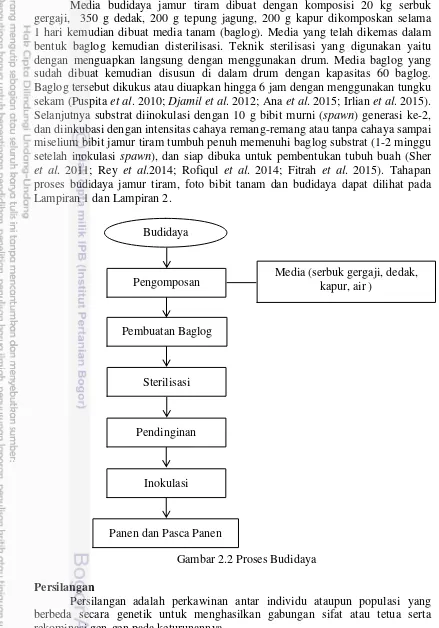
2 Proses Budidaya 4
3 Proses Persilangan 5
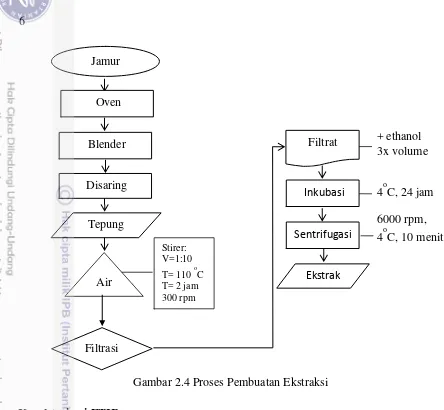
4 Proses Pembuatan Ekstraksi 6
5 Vibrasi Regangan 7
6 Vibrasi Tekuk 8
7 Ilustrasi dua buah bola yang saling terikat oleh pegas 9
8 Diagram Alir Penelitian 9
9 Spektra FTIR pada Jamur Tiram Putih Pasar (JP), Jamur Persilangan (JS), King Oyster Pasar (KP), King Oyster Budidaya (KB), Jamur
Tiram Putih Budidaya (TB) 10
10 Rumus struktur -1,3 dan -1,6 glukan 11
11 Spektra pada setiap jamur. 1,2,3, dan 4 menunjukkan puncak protein 13 12 Perbesaran pada Daerah yang Menunjukan Perbedaan Pola Spektrum
pada Ekstrak JS 14
13 Morfologi Jamur Tiram Putih, King Oyster, Jamur Persilangan 18
DAFTAR LAMPIRAN
1 Budidaya 25
2 Hasil Pembibitan dan Budidaya Jamur 26
3 Pembuatan Bibit Jamur Persilangan 27
4 Analisis Nilai Bilangan Gelombang dan Konstanta Pegas 29
1
PENDAHULUAN
Latar Belakang
Gizi sangat penting bagi kehidupan manusia. Gizi seimbang mencakup element penting seperti mineral, vitamin, dan protein. Hasil kajian menunjukkan kisaran distribusi energi gizi makro dari pola konsumsi penduduk Indonesia berdasarkan analisis data Riskesdas 2010 adalah 9-14% energi protein, 24-36% energi lemak, dan 54-63% energi karbohidrat yang belum sebaik yang diharapkan, yaitu 5-15% energi protein, 25-55% energi lemak, dan 40-60% energi karbohidrat (Hardinsyah et al. 2010; Yuen et al. 2014).
Jamur dapat menyediakan komponen seimbang dalam mencukupi kebutuhan gizi manusia. Jamur tiram memiliki nilai gizi tinggi diantaranya kaya akan protein, dengan kandungan asam amino yang sangat penting setara dengan protein hewani dan kaya serat serta rendah lemak (Bernas et al. 2006; Caglarirmak 2011; Reis et al. 2012). Jamur tiram berisi sekitar 100 senyawa bioaktif yang berbeda dan kaya polisakarida non-pati (Krishnamoorthy et al. 2014). Polisakarida diisolasi dari tubuh buah, miselium atau kaldu kultur cair (Ahmad et al. 2014). Salah satu dari zat yang berperan sebagai obat dalam jamur tiram adalah pleuran, yaitu senyawa struktur umum -glukan (Goro et al. 1970; Bak et al. 2014). -glukan merupakan polimer D-glukosa dengan ikatan -(1,3) dan -(1,6) yang terdapat pada dinding sel memiliki manfaat sebagai bahan inflamasi, hiperkolesterol, anti bakteri, oksidan, diabetes dan anti-tumor (Cohen 2002; Otakar et al. 2009; Menaga et al. 2012; Vannucci et al. 2013; Baral and Adur 2014).
Jamur tiram yang sangat populer terutama genus Pleurotus dan family Pleurotaceae. Salah satunya adalah jamur tiram putih (Pleurotus ostreatus) dan King Oyster (Pleurotus eryngii). Jamur tiram putih di Indonesia lebih banyak di konsumsi dan di produksi dibandingkan dengan King Oyster. Padahal King Oyster memiliki kandungan -glukan lebih tinggi yaitu 12,91% dan memiliki morfologi tangkai tidak bercabang, batang besar, daging batang tebal berwarna putih dengan tudung yang sempit (pada tubuh buah yang masih muda), dan pecah-pecah bagian pinggirnya dibandingkan -glukan dan morfologi pada jamur tiram putih, yaitu 8,29% yang memiliki tangkai bercabang, batang kecil dan tudung besar (Chang et al. 1999; Nitschke et al. 2011; Dung et al. 2012). Kandungan
2
Tujuan Penelitian
Tujuan dari penelitian ini adalah:
1. Menganalisis kandungan -Glukan pada jamur tiram putih, King Oyster, dan persilangan jamur tiram putih dan King Oyster
2. Membandingkan kandungan -Glukan persilangan dengan jamur tiram putih putih dan King Oyster dari hasil pembibitan dengan pasaran
3. Menghasilkan jenis jamur baru dari persilangan jamur tiram putih dan King Oyster
4. Mengetahui ikatan D-Glukosa pada jamur tiram putih, King Oyster, dan persilangan jamur tiram putih dan King Oyster dengan analisis FTIR.
2
METODE
Waktu dan Tempat
Penelitian ini dilakukan mulai bulan September 2015 sampai dengan April 2016 di Laboratorium Biofisika Material, Laboratorium Analisis Bahan Departemen Fisika, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor, Laboratorium Pusat Studi Biofarmaka LPPM IPB, Laboratorium skala kecil Babakan Raya Dramaga, Bogor dan di Desa Situ Ilir, Kecamatan Cibungbulang, Kabupaten Bogor.
Bahan
Bahan utama dalam penelitian ini adalah jamur tiram putih (Pleurotus ostreatus), King Oyster (Pleurotus eryngii), agar, kentang, dextrose, aquades, alkohol 70%, spirtus, dedak, cloran penicolt, jagung, kaptan, dan serbuk gergaji.
Alat
Alat yang digunakan dalam penelitian ini adalah laminar air flow atau kotak inkas, tabung reaksi, cawan petri, bunsen, cutter, jarum inokulasi, kertas saring, pinset, spatula, labu ukur 1000 mL, gelas ukur 1000 mL, tisue, wraping, alumunium foil, kapas sintetik, timbangan 1 kg, botol kaca berukuran 250 mL, dandang stainless kecil dan besar, dan Fourier Transform Infra Red (FTIR).
Prosedur Analisis Data
Pembibitan Jamur Tiram
3 antibiotik penisilin dalam tabung reaksi secara aseptik, kemudian di sterilisasikan. Biakan murni jamur tiram diperbanyak dengan cara memperbanyak koloni bibit jamur tiram, yaitu inokulasi ulang bibit jamur dari tabung reaksi ke dalam cawan petri isi media PDA (Draeger et al. 2010; Amuneke et al. 2011). Satu cawan petri berisi 6 sampai 10 koloni bibit jamur tiram. Jamur tiram yang sudah dikultur disimpan didalam kotak yang steril. Setelah 3 hari kultur dikontrol dan dipisahkan antara yang terkontaminasi dengan kultur yang tumbuh baik. Kultur yang tidak terkontaminasi ditumbuhkan hinggga pertumbuhan miselium memenuhi seluruh bagian media kulturnya hingga bisa diturunkan pada proses berikutnya ((Lusia et al. 2015).
Bibit jamur dari biakan murni PDA kemudian ditumbuhkan atau diinokulasikan ke dalam media bibit berupa jagung bulat. Jagung direndam selama 24 jam, kemudian direbus selama 30 menit dan ditiriskan dengan tujuan generasi kesatu (mother spawn) (Draeger et al. 2010; Amuneke et al. 2011,).
Selanjutnya bibit induk ini diperbanyak sekali lagi ke dalam media bibit induk steril baru dengan formula campuran dedak, serbuk gergaji, tepung jagung, kaptan, dextros/gula dan air bersih yang disterilkan selama 2 jam. Setiap 5 g bibit induk diinokulasikan ke dalam satu baglog, dilanjutkan dengan inkubasi bibit induk perbanyakan (generasi ke-2) selama 2-3 minggu. Bibit induk generasi ke-2, selanjutnya digunakan untuk memproduksi tubuh buah jamur tiram. Caranya yaitu setiap 10 g bibit induk generasi ke-2 diinokulasikan ke dalam substrat (Patil et al. 2010; Amuneke et al. 2011; Abu et al. 2015; Mursyidah et al. 2015).
Gambar 2.1 Proses pembibitan Bibit F0 Media (PDA (Potato
Dextrose Agar)) Sterilisasi
4
Budidaya Jamur Tiram
Media budidaya jamur tiram dibuat dengan komposisi 20 kg serbuk gergaji, 350 g dedak, 200 g tepung jagung, 200 g kapur dikomposkan selama 1 hari kemudian dibuat media tanam (baglog). Media yang telah dikemas dalam bentuk baglog kemudian disterilisasi. Teknik sterilisasi yang digunakan yaitu dengan menguapkan langsung dengan menggunakan drum. Media baglog yang sudah dibuat kemudian disusun di dalam drum dengan kapasitas 60 baglog. Baglog tersebut dikukus atau diuapkan hingga 6 jam dengan menggunakan tungku sekam (Puspita et al. 2010; Djamil et al. 2012; Ana et al. 2015; Irlian et al. 2015). Selanjutnya substrat diinokulasi dengan 10 g bibit murni (spawn) generasi ke-2, dan diinkubasi dengan intensitas cahaya remang-remang atau tanpa cahaya sampai miselium bibit jamur tiram tumbuh penuh memenuhi baglog substrat (1-2 minggu setelah inokulasi spawn), dan siap dibuka untuk pembentukan tubuh buah (Sher et al. 2011; Rey et al.2014; Rofiqul et al. 2014; Fitrah et al. 2015). Tahapan proses budidaya jamur tiram, foto bibit tanam dan budidaya dapat dilihat pada Lampiran 1 dan Lampiran 2.
Gambar 2.2 Proses Budidaya Persilangan
Persilangan adalah perkawinan antar individu ataupun populasi yang berbeda secara genetik untuk menghasilkan gabungan sifat atau tetua serta rekominasi gen-gen pada keturunannya.
Panen dan Pasca Panen Budidaya
Pengomposan Media (serbuk gergaji, dedak, kapur, air )
Pembuatan Baglog
Sterilisasi
Pendinginan
5 Tujuan utama dari hibridisasi adalah untuk menggabungkan karakteristik yang diinginkan dari strain yang berbeda dan menciptakan variabilitas baru (Kumara and Edirimanna 2009). Pada dasarnya, persilangan adalah menyatukan sel gamet dari fungi tetua yang dikehendaki. Persilangan antara jamur tiram putih (Pleurotus ostreatus) dengan King Oyster (Pleurotus eryngii) dilakukan dengan menempatkan jaringan tubuh buah dari masing-masing jamur dalam cawan petri secara berdampingan. Setelah miselium dalam cawan petri penuh maka diinokulasikan ke media F1 dengan mengambil miselium yang tumbuh bertumpuk. Tahapan pembuatan bibit persilangan dapat dilihat pada Lampiran 2.
Gambar 2.3 Proses Persilangan Pembuatan Tepung dan Ekstraksi Jamur Tiram
Jamur tiram putih dan King Oyster segar dibersihkan dan ditimbang, kemudian di oven kering hingga kering krispi. Jamur yang sudah kering kemudian dibuat tepung dengan cara diblender sampai halus dan disaring dengan saringan halus.
Masing-masing tepung jamur kemudian diekstrak. Metode ekstraksi -glukan menggunakan metode solven air, yakni ekstraksi dari tepung jamur tiram kering menggunakan solven air (100 g/L). Kemudian disaring dan diambil filtratnya. Filtratnya di tambahkan ethanol 3 kali volume, setelah itu diinkubasi selama 24 jam pada suhu 40C, dan kemudian di sentrifugasi pada 6000 rpm selama 10 menit untuk mendapatkan ekstrak (Marleta dan Duenas 2010; Widyastuti et al 2011; Donowati 2015).
Jamur tiram putih King Oyster
F0
F1
F2
6
Gambar 2.4 Proses Pembuatan Ekstraksi Karakterisasi FTIR
Infrared spectroscopy atau spektroskopi inframerah adalah salah satu dari teknik spektroskopi yang paling umum digunakan oleh kimia organik dan anorganik. Secara sederhana, pengukuran serapan dari perbedaan frekuensi inframerah pada sampel yang ditempatkan pada sampel yang ditempatkan pada sebuah beam inframerah. Tujuan utama analisa spektroskopi inframerah adalah menentukan gugus-gugus fungsi molekul (Baker et al. 2008; Ranjani et al. 2014)
Jika kita menyinari sampel senyawa organik dengan sinar inframerah yang mempunyai frekuensi tertentu, kita akan mendapatkan beberapa frekuensi tersebut diserap oleh senyawa tersebut. Berapa banyak frekuensi tertentu yang melewati
senyawa tersebut diukur sebagai “presentasi transmitansi” (Tasnim et al. 2014; Saima et al. 2015).
Spektrum adalah grafik dari panjang gelombang dan energi yang diadsorpsi oleh suatu senyawa. Spektrum inframerah adalah plot intensitas penyerapan teradap bilangan gelombang yang dinyatakan dengan jumlah gelombang dalam satuan cm-1. Bilangan gelombang adalah radiasi di daerah vibrasi inframerah dari spektrum elektromagnetik yang membentang dari 4000-400 cm-1. Sebuah molekul hanya menyerap frekuensi (energi) radiasi inframerah tertentu.
Setiap molekul memiliki energi tertentu. Bila suatu senyawa menyerap energi dari sinar inframerah, maka tingkatan energi di dalam molekul itu akan tereksitasi ke tingkatan energi yang lebih tinggi. Sesuai dengan tingkatan energi
7 yang diserap, maka yang akan terjadi pada molekul itu adalah perubahan energi vibrasi yang diikuti dengan perubahan energi rotasi.
Setiap senyawa pada keadaan tertentu telah mempunyai tiga macam gerak, yaitu gerak translasi, vibrasi, dan rotasi. Atom-atom di dalam molekul tidak dalam keadaan diam, tetapi biasanya terjadi peristiwa vibrasi. Hal ini bergantung pada atom-atom dan kekuatan ikatan yang menghubungkannya. Vibrasi molekul sangat khas untuk suatu molekul tertentu dan biasanya disebut vibrasi finger print. Vibrasi molekul dapat digolongkan atas dua golongan besar, yaitu:
1). Vibrasi Regangan (Stretching) 2). Vibrasi Bengkokan (Bending)
Dalam vibrasi ini atom bergerak terus sepanjang ikatan yang menghubungkannya sehingga akan terjadi perubahan jarak antara keduanya, walaupun sudat ikatan tidak berubah. Vibrasi regangan ada dua macam, yaitu: 1). Regangan Simetri, yaitu unit struktur bergerak bersamaan dan searah dalam
satu bidang datar.
2). Regangan Asimetri, yaitu unit struktur bergerak bersamaan dan tidak searah tetapi masih dalam satu bidang datar.
Gambar 2.5 Vibrasi regangan a) regangan simetri b) regangan asimetri (Jatmiko dan Sofian 2008)
Jika sistem tiga atom merupakan bagian dari sebuah molekul yang lebih besar, maka dapat menimbulkan vibrasi bengkokan yang mempengaruhi osilasi atom atau molekul secara keseluruhan. Vibrasi bengkokan terbagi menjadi empat macam jenis, yaitu:
1) Vibrasi Goyangan (Rocking), yaitu unit struktur bergerak mengayun asimetri tetapi masih dalam bidang datar.
2) Vibrasi Guntingan (Scissoring), yaitu unit struktur bergerak mengayun simetri dan masih dalam bidang datar.
3) Vibrasi Kibasan (Wagging), yaitu unit struktur bergerak mengibas keluar dari bidang datar.
4) Vibrasi Pelintiran (Twisting), yaitu unit struktur berputar mengelilingi ikatan yang menghubungkan dengan molekul induk dan berada di dalam bidang datar (Jatmiko dan Sofian 2008).
8
Gambar 2.6 Vibrasi bengkokan a) vibrasi goyangan, b) vibrasi guntingan, c) vibrasi kibasan, dan d) vibrasi pelintiran (Jatmiko dan Sofian 2008)
Vibrasi yang digunakan untuk identifikasi adalah vibrasi bengkokan, khususnya goyangan (rocking), yaitu yang berada di daerah bilangan gelombang 2000-400 cm-1. Karena di daerah antara 4000-2000 cm-1 merupakan daerah yang khusus yang berguna untuk identifkasi gugus fungsional. Daerah ini menunjukkan absorbsi yang disebabkan oleh vibrasi regangan. Sedangkan daerah antara 2000-400 cm-1 seringkali sangat rumit, karena vibrasi regangan maupun bengkokan mengakibatkan absorbsi pada daerah tersebut.
Dalam daerah 2000-400 cm-1 tiap senyawa organik mempunyai absorbsi yang unik, sehingga daerah tersebut sering juga disebut sebagai daerah sidik jari (fingerprint region). Meskipun pada daerah 4000-2000 cm-1 menunjukkan absorbsi yang sama, pada daerah 2000-400 cm-1 juga harus menunjukkan pola yang sama sehingga dapat disimpulkan bahwa dua senyawa adalah sama.
Prinsip kerja FTIR dibandingkan dengan panjang gelombang sinar ultraviolet dan tampak. Panjang gelombang infra merah lebih panjang, dan dengan demikian energinya lebih rendah. Energi sinar inframerah akan berikatan dengan energi vibrasi molekul. Vibrasi ulur dan tekuk adalah cara vibrasi yang dapat dieksitasi oleh sinar dengan bilangan gelombang dalam rentang 1200-1400 cm-1. Hampir semua gugus fungsi organik memiliki bilangan gelombang serapan khas di daerah yang tertentu. Jadi daerah ini disebut daerah gugus fungsi dan absorbansinya disebut absorbsi khas.
Dasar Spektroskopi Infra Merah dikemukakan oleh Hooke dan didasarkan atas senyawa yang terdiri atas dua atom atau diatom yang digambarkan dengan dua buah bola yang saling terikat oleh pegas seperti tampak pada Gambar 2.7. Jika pegas direntangkan atau ditekan pada jarak keseimbangan tersebut maka energi potensial dari sistim tersebut akan naik. Bila ikatan bergetar, maka energi vibrasi secara terus menerus dan secara periodik berubah dari energi kinetik ke energi potensial dan sebaliknya. Jumlah energi total adalah sebanding dengan frekuensi
(a) (b)
9 vibrasi dan tetapan gaya dari pegas dan massa (m1 dan m2) dari dua atom yang terikat.
Gambar 2.7 Ilustrasi dua buah bola yang saling terikat oleh pegas
Analisis Data
Pada penelitian ini, hasil panen jamur persilangan dilakukan uji fisik dari nilai rata-rata diameter tudung, panjang tangkai, massa jamur, dan lebar tangkai jamur.
Gambar 2.8 Diagram alir penelitian Selesai
Persiapan bahan
Ekstraksi
FTIR Budidaya Pembibitan
10
3
HASIL DAN PEMBAHASAN
Hasil Karakterisasi FTIR
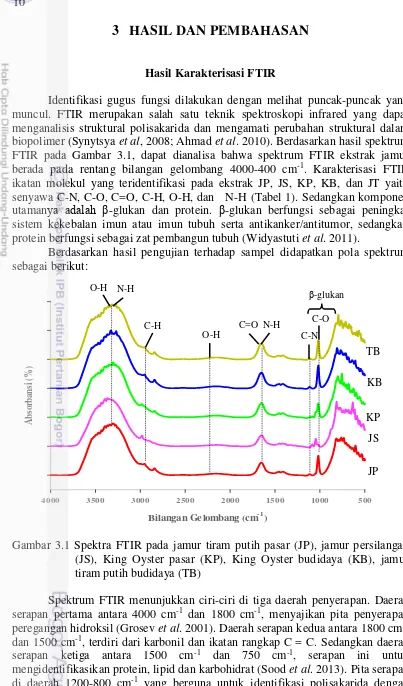
Identifikasi gugus fungsi dilakukan dengan melihat puncak-puncak yang muncul. FTIR merupakan salah satu teknik spektroskopi infrared yang dapat menganalisis struktural polisakarida dan mengamati perubahan struktural dalam biopolimer (Synytsya et al, 2008; Ahmad et al. 2010). Berdasarkan hasil spektrum FTIR pada Gambar 3.1, dapat dianalisa bahwa spektrum FTIR ekstrak jamur berada pada rentang bilangan gelombang 4000-400 cm-1. Karakterisasi FTIR ikatan molekul yang teridentifikasi pada ekstrak JP, JS, KP, KB, dan JT yaitu senyawa C-N, C-O, C=O, C-H, O-H, dan N-H (Tabel 1). Sedangkan komponen utamanya adalah -glukan dan protein. -glukan berfungsi sebagai peningkat sistem kekebalan imun atau imun tubuh serta antikanker/antitumor, sedangkan protein berfungsi sebagai zat pembangun tubuh (Widyastuti et al. 2011).
Berdasarkan hasil pengujian terhadap sampel didapatkan pola spektrum sebagai berikut:
11 struktur dan komposisi yang berbeda (Kacurakova et al. 2000; Silverstein et al. 2005: Parihar et al. 2016).
Tabel 3.1 Nilai bilangan gelombang masing-masing jamur hasil eksperimen dan literatur
Polisakarida dapat dikenali pada puncak bilangan gelombang 1040 cm-1 (ikatan C-O), 2940 cm-1 (C-H stretching), 1650 cm-1 (ikatan C=O) dan 3400 cm-1 (O-H stretching) (Ahmad et al. 2010). Polisakarida memiliki komposisi kimia berbeda,
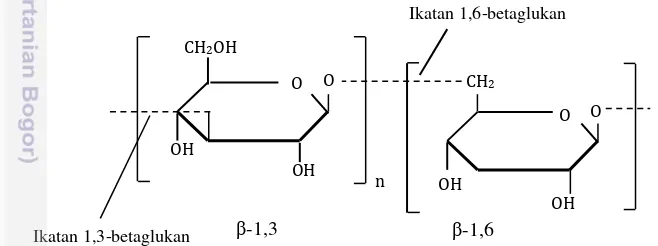
umumnya merupakan -glukan (Gambar 3.2), yang merupakan polimer D-glukosa dengan ikatan ( -1,3)-Glukan, -(1,4)-Glukan, dan -(1,6)-Glukan (Cho et al. 2014; Jantaramant et al. 2014).
Gambar 3.2 Rumus struktur -1,3 dan -1,6 glukan (Kidd 2000)
Spektrum infra merah senyawa beta glukan ditandai dengan adanya pada spektrum ekstrak jamur dapat diidentifikasi beberapa gugus fungsi. Pada ekstrak JP, JS, KP, KB, dan JT dengan bilangan gelombang masing-masing 3369 cm-1, 3310 cm-1, 3300 cm-1, 3328 cm-1, dan 3273 cm-1 menunjukkan gugus fungsi OH yang berikatan dengan N-H. Puncak ini terjadi karena vibrasi ulur dari
O
Ikatan 1,3-betaglukan -1,3 -1,6
12
atom hidrogen dengan atom lainnya. Ikatan hidrogen menyebabkan puncak melebar dan terjadi pergeseran ke arah bilangan gelombang yang lebih pendek. Pada daerah serapan 4000-3000 cm-1, spektrum JP, JS, KP, KB, dan JT menunjukkan lebar pita dengan absorbansi maksimum (transmitansi minimum) vibrasi asimetris stretching gugus OH. Di atas pita serapan 3000 cm-1 dengan gugus OH, dapat diidentifikasikan pada puncak ini adanya polisakarida (Wang et al. 2005; Bayer et al. 2014).
Spektrum JP, JS, KP, KB, dan JT pada bilangan gelombang masing-masing 2842 cm-1, 2983 cm-1, 2983 cm-1, 2841 cm-1, dan 2982 dengan gugus fungsi CH alifatik. Perubahan struktur dari ikatan C-H akan menyebabkan puncak bergeser ke arah yang maksimum. Pada puncak ini teridentifikasi adanya polisakarida karena daerah serapan berada pada 3000-2700 cm-1 (Bayer et al. 2014).
Pada pita serapan 1650 cm-1 teridentifikasi dua gugus fungsi, yaitu C=O dan N-H. Dengan masing-masing bilangan gelombang ekstrak JP, JS, KP, KB, dan JT adalah 1650 cm-1, 1652 cm-1, 1651 cm-1, 1651 cm-1, dan 1650 cm-1. Serapan ini terjadi karena adanya peregangan gugus fungsi NH yang menunjukan adanya amida dan protein dalam sampel. Jika adanya pita serapan pada bilangan gelombang 1650 cm-1 dan 1540 cm-1 ini menunjukkan adanya vibrasi amida dari protein. Dan pada serapan ini juga teridentifikasi adanya polisakarida pada bilangan gelombang 1650 cm-1 dengan gugus C=O (Gonzaga et al. 2004; Synytsya et al. 2008; Werning and Laura 2008).
Spektrum pita serapan juga terdapat pada JP, JS, KP, KB, dan JT, yaitu serapan kuat dengan masing-masing bilangan gelombang 1086 cm-1, 1115 cm-1, 1086 cm-1, 1115 cm-1, dan 1115 cm-1 dengan gugus C-O. Pada bilangan gelombang 1080-1300 cm-1 gugus fungsi kelompok C-O-C ini juga mengidentifikasikan adanya polisakarida (Asif et al. 2009; Bayer et al. 2014).
13
Gambar 3.3 Spektra pada setiap jamur. 1,2,3, dan 4 menunjukkan puncak protein Seperti terlihat pada hasil spektrum FTIR pada Gambar 3.2, dengan membandingkan bentuk kelima spektrum maka terlihat bahwa muncul spektrum-spektrum yang hampir sama, tidak menunjukkan banyak perbedaan baik JP, JS, KP, KB, dan TB. Gugus fungsi molekul yang terbentuk sama, tetapi nilai absorbansinya berbeda. Namun masih ada perbedaan beberapa peak ekstrak jamur pada daerah bilangan gelombang 800-400 cm-1. Pada ekstrak jamur KB dan TB muncul pita serapan yang lebih banyak pada daerah bilangan gelombang 800-400 cm-1 dibandingkan TP, JS, dan KP.
Secara keseluruhan spektra FTIR pada Gambar 3.2, dapat dilihat intensitas pita serapan pada masing-masing ekstrak jamur. Absorbansi berbanding lurus dengan kandungan glukan, semakin besar absorbansi maka kandungan -D-glukan semakin tinggi, begitu juga sebaliknya (Magda et al. 2014). Ekstrak jamur JS memiliki intensitas pita serapan yang lebih tinggi dibandingkan dengan ekstrak jamur lainnya. Ini menunjukkan bahwa ekstrak jamur JS memiliki konsentrasi atau kandungan -D-glukan lebih tinggi dibandingkan dengan ekstrak jamur JP, KP, KB, dan TB. Dari hasil tesebut menyatakan bahwa kadar -glukan sangat tergantung dari jenis jamurnya. Perbedaan kadar -glukan juga kemungkinan akan berkaitan dengan efek potensinya terhadap pencegahannya terhadap penyakit (Donowati 2015). Hal ini sesuai dengan tujuan persilangan, yaitu menggabungkan keragaman genetik pada suatu populasi dengan harapan akan muncul varietas baru yang sifatnya berbeda dari kedua induknya (Kingsburry 2009).
-D-Glukan
1
4
14
Jamur persilangan memiliki intensitas pita serapan protein paling tinggi yaitu pada daerah bilangan gelombang 600 cm-1 dan 1115 cm-1, sedangkan pada daerah 1652 cm-1 dan 3310 cm-1 jamur persilangan memiliki pita serapan protein yang paling rendah. Gambar 3.4 Perbesaran pada daerah yang menunjukan perbedaan pola spektrum
pada ekstrak JS
15 Tabel 3.2 Analisis kandungan tiap jamur
Kandungan Jamur serapan ikatan 1,4- -D-glukan. Menurut literatur, adanya ikatan 1,4- -D-glukan ditunjukkan oleh pita serapan pada 930-1025 cm-1 (Mandal et al. 2010; Liu et al. 2011). Ini menunjukkan bahwa ekstrak JS memiliki kadar 1,4- -D-glukan yang lebih rendah dibandingkan dengan ekstrak jamur yang lain. Sedangkan pada bilangan gelombang 1030-1070 cm-1, JS muncul pita serapan baru pada bilangan gelombang 1046 cm-1 dengan serapan yang kuat. Pita serapan 1046 cm-1 dapat diasumsikan adalah ikatan 1,6- -D-glukan. Ikatan 1,6- -D-glukan diasumsikan pada bilangan gelombang 800-1200 cm-1 karena belum didapatkan referensi yang pasti pada gelombang bilangan berapa ikatan tersebut berada (El-Batal et al. 2008).
Pada bilangan gelombang 820-920 cm-1 terdapat pita serapan baru yang lemah mendekati bilangan gelombang 890 cm-1 yang didapatkan pada spektra JS menunjukkan ikatan -glikosidik spesifik, yaitu 1,3- -D-glukan. Sedangkan pada spektra lainnya tidak didapatkan pita serapan pada daerah spesifik tersebut. Hal ini menunjukkan adanya vibrasi tekuk C-H. Berdasarkan literatur adanya ikatan 1,3- -D-glukan ditunjukkan oleh pita serapan pada 890 cm-1 (Sood et al. 2013). Ini menunjukkan bahwa JS adalah satu-satunya dari kelima jamur tersebut yang memiliki kandungan bioaktifitas yang lebih tinggi.
Pita serapan tajam pada JS di bilangan gelombang 634 cm-1, 462 cm-1, dan 437 cm-1 merupakan amida. Serapan pada bilangan gelombang 625-767 cm-1
(amida IV), 537-606 (amida V). Selain amida, peak yang muncul pada 420-808 cm-1 yang terdapat pada masing-masing ekstrak jamur menunjukkan
adanya lemak dan 1,3-α-D-glukan. Adanya lemak dapat diidentifikasi pada bilangan gelombang 1738 cm-1, 1675 cm-1, dan 720 cm-1. Sedangkan ikatan 1,3-α-D-glukan terdapat pada bilangan gelombang 930 cm-1, 920 cm-1, 850 cm-1, 830 cm-1, 822 cm-1, 542 cm-1, 448 cm-1, dan 421 cm-1 (Pereyra et al. 2003; Synytsya et al. 2008 ; Sood et al. 2013).
16
Mengonsumsi pati dalam jumlah yang banyak dapat menaikkan kadar glukosa dalam darah dan tidak baik untuk penderita diabetes. Sedangkan betaglukan tidak dapat dicerna oleh enzim pencernaan, namun berfungsi sebagai serat. Serat dapat memperlambat penyerapan glukosa ke dalam darah dan juga berfungsi memperlancar percernaan.
Selain -glukan, jamur tiram juga memiliki kandungan bioaktif lainnya seperti, fenol, vitamin B, flavin, asam organik, dan lainnya yang berfungsi sebagai antitumor, anti penuaan, dan antioksidan (Somanjana et al. 2013). Gugus fungsi C=O aromatik yang merupakan ciri khas dari senyawa flavonoid memberikan serapan tajam pada daerah bilangan gelombang 1650-1760 cm-1 dan serapan pada daerah bilangan gelombang 1000-1300 cm-1 yang menunjukkan adanya gugus fungsi C-O aromatik. Adanya gugus O-H dan aromatik merupakan ciri dari senyawa flavonoid, yang mampu bertindak sebagai antioksidan dan berfungsi menetralisir radikal bebas (Adebayo et al. 2012 dan Aggarwal et al. 2012). Berdasarkan hasil spektra kelima jamur dapat disimpulkan bahwa kelima ekstrak jamur memiliki kandungan flavanoid, tidak ada perbedaan antara jamur persilangan dengan jamur lain.
Hasil Analisis Ikatan Molekul
Setelah spektrum FTIR ekstrak jamur didapatkan, selanjutnya dianalisis ikatan molekul. Ikatan molekul dianalisis dengan menggunakan model osilasi harmonik dan model osilasi anharmonik. Analisis ikatan molekul bertujuan untuk mendapatkan nilai kontanta pegas dari masing-masing ikatan molekul dan membandingkan dengan nilai ikatan molekul pada literatur.
Ketika frekuensi vibrasi dari sampel spesifik sama dengan frekuensi dari radiasi inframerah yang mengenai langsung pada molekul, molekul tersebut menyerap radiasi dan menghasilkan puncak-puncak yang dianalisis vibrasi konstanta anharmonik, dan konstanta gaya ikatan molekul. Molekul yang muncul hanya 1 puncak dianalisis secara prinsip harmonik dan ketika molekul sejenis muncul dalam 2 puncak atau lebih akan dianalisis secara prinsip anharmonik (Mursyidah et al. 2015; Nurmaniah et al. 2015).
17 Tabel 3.3 Analisis vibrasi dan konstanta gaya ikatan dengan mengasumsikan
proses regangan simetri
Perhitungan Literatur Perhitungan Literatur
C-H
Dilihat dari Tabel 3.2 dan Tabel 3.3, konstanta gaya ikatan hasil perhitungan hampir mendekati konstanta gaya literatur (Thomas and Sorrel 1998). Hal ini menunjukkan bahwa didaerah serapan tersebut memang benar adanya gugus fungsi C-H, C=O, C-O, dan O-H, dan nilai konstanta pegas juga dipengaruhi oleh perbedaan jenis ekstrak jamur. Semakin banyak besar tetapan gaya, semakin besar frekuensi vibrasi dan makin besar jarak, energi diantara tingkat-tingkat kuantum vibrasi.
Eksperimen Literatur Perhitungan Literatur
18
Hasil Uji Fisik
Jamur dipanen pada saat pertumbuhan tubuh buah telah maksimal, yang ditandai dengan ukuran dan bentuk tubuh buah telah maksimal dan sempurna dengan bentuk tudung yang sudah seperti cangkang tiram (Djarijah dan Djaridjah 2001). Jamur yang dipanen terlambat maka hasil panen jamur mengalami pecah-pecah pada tudung dan kering. Kondisi seperti ini dapat mengurangi kualitas dan cita rasa jamur tiram serta dapat mengurangi massa jamur tiram yang dihasilkan.
Tabel 3.4 Hasil Rata-Rata Uji Fisik dari Masing-Masing Jamur
Fisik
Jenis Jamur
Jamur Tiram Putih King Oyster Persilangan Eksperimen Literatur Eksperimen Literatur Eksperimen Massa
(gram) 0.89 ± 0.34 - 0.86 ± 0.36 - 1.13 ± 1.51 Panjang
Tangkai (cm) 5.12 ± 0.86 10-15 4.78 ± 0.96 3-10 5.11 ± 1.02 Diameter
Tudung (cm) 11.82 ± 2.42 4-15 10.87 ± 2.36 2-6 11.18 ± 2.59 Lingkar
Tangkai (cm) 5.48 ± 1.17 0.5-4 5.28 ± 1.34 11-18 5.46 ± 1.32 Setelah pemanenan jamur maka dilakukan pengujian secara fisik yang meliputi massa (gram), panjang tangkai (cm), diameter tudung (cm), dan lingkar tangkai (cm) pada jamur tiram putih, King Oyster, dan persilangan. Berdasarkan Gambar 3.5 dan uji fisik dari Tabel 3.4 menunjukkan bahwa tiap-tiap jamur memiliki ukuran yang tidak jauh berbeda-beda. Namun, tujuan dari penelitian adalah persilangan, maka dalam uji ini jamur persilangan lebih spesifik dibahas.
Gambar 3.5 Morfologi a) Jamur tiram putih, b) King Oyster, c) Jamur persilangan King oyster merupakan jamur memiliki morfologi batang besar dengan ukuran 11-18 cm, tudung yang sempit 2-6 cm, dan panjang tangkai 3-10 cm (Chang et al. 1999; Nitschke et al. 2011). Berdasarkan dari Tabel 3.4, jika dibandingkan dengan ukuran fisik dari hasil budidaya sangat jauh berbeda dengan literatur. Sedangkan jamur tiram putih, dari Tabel 4 didapatkan ukuran fisik yang
19 sama dengan literatur, kecuali panjang tangkai yang lebih kecil dibandingkan dengan literatur. Berdasarkan literatur, jamur tiram putih memiliki panjang tangkai yang berukuran 10-15 cm, batang kecil berukuran 0.5-4 cm, dan tudung besar 4-15 cm (Chang et al. 1978). Hal ini disebabkan oleh beberapa faktor, yaitu bibit jamur, substrat penanaman, kondisi lingkungan, dan bahan media (Suriawiria, 2001). Adanya perbedaan ukuran, warna, serta bentuk dari tudung dan tangkai merupakan ciri penting dalam melakukan identifikasi suatu spesies jamur.
Jamur persilangan merupakan jamur dari hasil persilangan jamur tiram putih dan King Oyster. Ukuran fisik jamur silang pada Tabel 3.4 akan dibandingkan dengan ukuran fisik jamur tiram putih dan King Oyster pada literatur, untuk melihat kecenderungan ukuran fisik pada jamur tiram putih atau King Oyster.
1. Panjang tangkai jamur
Pada pertumbuhan jamur terdapat dua komponen penting yang sangat berpengaruh, yaitu oksigen dan karbondioksida. Adanya pengaruh karbondioksida yang berlebihan pada pertumbuhan menyebabkan tangkai menjadi sangat panjang dan pembentukan pada tudung menjadi tidak normal. Maka pada saat memasuki masa pertumbuhan jamur harus diperhatikan kondisi lingkungan dan disesuaikan dengan tempat tumbuh jamur yaitu dengan kondisi kelembaban yang tinggi dan sedikit cahaya.
Pada umumnya, ukuran panjang tangkai pada jamur tiram yaitu berkisar antara 10-15 cm (Cahyana et al. 1999). Jamur persilangan memiliki ukuran panjang tangkai 5.11 cm (Tabel 3.4). Berdasarkan literatur, ukuran panjang tangkai masing-masing jamur tiram putih dan King Oyster adalah 10-15 cm dan 3-10 cm. Dari hasil tersebut menunjukkan bahwa panjang tangkai jamur persilangan berada dalam kisaran ukuran jamur tiram putih.
2. Diameter tudung jamur
Ukuran diameter tudung jamur dapat mempengaruhi massa jamur, hal ini karena diameter pada tudung jamur memiliki berat sekitar 80% dari massa jamur. Maka dari itu kualitas jamur tiram juga dapat dilihat dari bentuk dan ukuran diameter pada tudung jamur. Semakin besar ukuran diameter pada jamur tiram maka menghasilkan massa jamur yang besar pula. Faktor yang dapat mempengaruhi pembentukan diameter pada tudung jamur ini adalah udara. Jamur yang kekurangan oksigen dapat menghambat sistem metabolisme pada jamur. Ukuran diameter tudung yang cukup oksigen menghasilkan ukuran diameter yang lebih besar (islami et al. 2013).
Berdasarkan hasil pengukuran diameter tudung jamur persilangan didapatkan hasil rata-rata 11.18 cm. hasil pengukuran tersebut menunjukkan bahwa ukuran tudung jamur silang terdapat dalam kisaran 4-15 cm. ini berarti ukuran tudung jamur persilangan cenderung mirip dengan ukuran tudung jamur tiram putih.
3. Massa jamur
20
yang banyak tidak terlepas dari adanya kandungan senyawa yang dibutuhkan oleh jamur pada media tanam dalam jumlah yang cukup banyak. Semakin besar tudung jamur maka menghasilkan massa jamur yang lebih besar.
Berdasarkan hasil rata-rata, massa yang paling besar diantara masing-masing jamur dari jamur tiram putih, King Oyster, dan jamur silang per baglog adalah jamur silang. Ini berarti jamur silang memiliki massa yang lebih unggul dibandingkan jamur tiram putih dan King Oyster.
4. Lebar tangkai jamur
Penampilan batang atau tangkai jamur sangat dipengaruhi oleh jumlah dan diameter badan buah (Dasa et al. 2011). Bila badan buah dalam satu baglog jumlahnya banyak maka batang akan menjadi pendek dan lingkar batangnya semakin kecil. Berdasarkan dari hasil lebar tangkai rata-rata, jamur silang memiliki lebar tangkai 5.46 cm. Hal ini menunjukkan lebar tangkai jamur silang berada pada kisaran lebar tangkai jamur tiram putih.
Berdasarkan dari panjang tangkai jamur, diameter tudung jamur, massa jamur, dan lebar tangkai jamur maka dapat disimpulkan bahwa, jamur persilangan cenderung mirip dengan jamur tiram putih. Jamur persilangan memiliki tampilan bentuk yang menarik dan menjual seperti jamur tiram putih.
4
SIMPULAN DAN SARAN
Simpulan
Spektroskopi FTIR merupakan salah satu uji alternatif yang cepat dan murah untuk memprediksi keberadaan betaglukan. Namun, FTIR memiliki keterbatasan dalam mengetahui banyaknya kandungan betaglukan yang dihasilkan. Persilangan yaitu menggabungkan keragaman genetik dari jamur tiram putih dengan King Oyster dengan harapan akan muncul varietas yang baru yang sifatnya berbeda dari kedua induknya.
Berdasarkan hasil karakterisasi FTIR, jamur persilangan merupakan jamur yang memiliki kandungan bioaktifitas lebih tinggi dibandingkan dengan jamur tiram putih dan King oyster. Kandungan bioaktifitas tinggi membuat jamur persilangan sangat cocok digunakan dalam bidang medis, khususnya dalam obat-obatan. Sedangkan dari hasil uji fisik, jamur persilangan juga memiliki tampilan menarik yang menjual sama dengan jamur tiram putih. Ini menunjukkan bahwa jamur persilangan merupakan jamur varietas baru yang lebih baik dari induknya.
Saran
21
DAFTAR PUSTAKA
Abdul DH, Irzaman, Jajang J, Touwil U, Khafit PH, Ella R, Sumarjono E. 2012. Efficiency energy in rice husk fuel and wood for pleurotus otreatus medium sterilization. Jurnal Ilmu Pertanian Indonesia (JIPI). 17 (2): 65:69.
Abu S, Erni A, Lusia ABS, Maya R, Mersi K, Irzaman. Analisis ikatan molekul protein (gugus fungsi C-N) pada miselium jamur tiram dengan metode fourier transform infrared (FTIR). Prosiding Seminar Nasional Fisika SNF2015. 4:1-6.
Adebayo EA, Oloke JK, ayandele AA, Adegunlola CO. 2012. Phytochemical, antioxidant and antimicrobial assay of mushroom metabolite from pleurotus pulmonarius-LAU 09 (JF736658). Journal of Microbiology and Biotechnology Research. 2(2):366-374.
Aggarwal P, Sharma P, Sharma S, Aggarwal J. 2012. Antioxidant mushroom: a review. International Research Journal of Pharmacy. 3(6):65-70.
Ahmad A, Anjum FM, Zahoor T, Nawaz H, Ahmed Z. 2010. Extraction and characterization of -D-glucan from oat for industrial utilization. International Journal of Biological Macromolecules. 46:304-309.
Ahmad R, Muniandy S, Shukri NIA, Alias SMU, Hamid AA, Yusoff WMW, Senafi S, Daud F. 2014. Antioxidant properties and glucan compositions of various crude extract from lentinus squarrosulus mycelial culture. Advances in Bioscience and Biotechnology. 5:805-814.
Amuneke E, Dike K, Ogbulie J. 2011. Cultivation of pleurotus ostreatus: an edible mushroom from agro base waste products. J. Microbiol. Biotech. Res. 1(3):1-14.
Ana F, Fitrah HF, Irlian N, Maya R, Mersi K, Irzaman. 2015. Metode FTIR pada karakterisasi miselium jamur tiram putih dengan bibit bermedia sorgum. Prosiding Seminar Nasional Fisika SNF2015. 4:7-10.
Bak WC, Park JH, Park JA, Ka KH. 2014. Determination of glucan contents in the fruiting bodies and mycelia of lentinula edodes cultivars. Mycobiology. 42(3): 301-304.
Baker MJ, Gazi E, Brown MD, Shanks JH, Gardner P, Clarke NW. 2008. FTIR based spectroscopic analysis in the identification of clinically aggressive prostate cancer. British Journal of Cancer. 99 (11):1859-1866.
Baral SP, Adur A. 2014. Extraction of mushroom -glucan and its immunomodulatory effects. IJPRBS. 3(2):160-171.
Barry. 2009. Mushroom and yeast beta-glucan assay procedure. Irlandia: Megazyme.
Bayer VML, Francisco AD, Chan A, Oro T, Ogliari PJ, Barreto PLM. 2014. Barley -glucans extraction and partial characterization. Food Chemistry. 154:84-89.
Belonio. 2005. Rice husk gas stove handbook. approriate technology centre. Departement of Agricultural Engineering and Environmental Management. Collage of Agricultura Central Philipine. University Iloilo City. Philipine. Bernas E, Jaworska G, Lisiewska Z. 2006. Edible mushrooms as a soupce of
22
Caglarirmak N. 2011. Edible mushrooms: an alternative food item. Economical And Societal Features. 548-554.
Cahyana YA, Muchrodji, Bakrun M. 1999. Jamur tiram pembibitan pembudidayaan dan analisis usaha. Jakarta: Penebar Swadaya.
Chang ST, Hayes WA. 1978. The biology and cultivation of edible mushrooms. ISBN: 978-0-12-168050-3.
Chang S, Buswell J, Miles P. 1999.Genetics and breeding of edible mushrooms. University of Hongkong.
Cho JH, Kim T, Yun HY, Kim HH. 2014. Facile depolymerization process of -glucan through the use of a high pressure homogenizer. American Journal of Research Communication. 2(4):168-178.
Cohen R, Persky L, Hadar Y. 2002. Biotechnological applications and potential of wood-degrading mushrooms of the genus pleurotus. Appl Microbiol Biotechnol.58: 582-594.
Dasa KS, Astutik, Hamzah A. 2011. Pemanfaatan bagas sebagai campuran media pertumbuhan jamur tiram putih. Buana Sains. 11(2):195-201.
Djarijah NM, Djarijah AS. 2001. Jamur tiram pembibitan, pemeliharaan dan pengendalian hama-penyakit. Penerbit Kanisius.Yogyakarta. ISBN:978-979-672-909-8.
Draeger KR, Wolf A. 2010. Vigor, sex and woody substrates: lessons from the cultivation of pleurotus ostreatus. Solid Waste. 10: 1-16.
Donowati T. 2015. Diversity of edible mushrooms on their beta glucan content and health benefits. Pros sem nas masy biodiv indon. 1(6):1520-1523.
Dung NTP, Tuyen DB, Quang PH. 2012. Morphological and genetic characteristics of oyster mushrooms and conditions effecting on its spawn growing. International Food Research Journal. 19:347-352.
El-Batal AI, Azab KHSH, Saada HN, Rezk RG, El-Tahawy NA. 2008. Ameliorating effects of yeast glucan with zinc bisglycinate on histological
and bochemical changes in -irradiated rats. International Journal of Agriculture and Biology. 10(4):361-368.
Fitrah HF, Ana F, Irlian N, Maya R, Ardian AS, Irzaman. 2015. Analisis efisiensi termal kompor berbahan bakar sekam dan limbah baglog pada sterilisasi jamur tiram. Jurnal Fisika dan Aplikasinya. 16(1):64-67
Gonzaga MLC, Ricardo NMPS, Heatley F, Soares SdeA. 2004. Isolation and characterization of polysaccharides from Agaricus blazei Murill. Carbohydr Polym. 60:43–9.
Goro C, Junji Hamuro, Yukiko YM, Yoshiko A, Fumiko F. 1970. Fractionation and purification of the polysaccharides with marked antitumor activity, especially lentinan, from lentinus edodes (berk.) sing, (an edible mushroom). Cancer Res. 30(11):2776-81.
Grosev VM, Bozac R, Puppels GJ. 2001. Vibrational spectroscopic characterization of wild growing mushrooms and toadstools. spectrochim. spectrochim acta a mol. Biomol. Spectrosc. 57:2815–2829. Hardinsyah, Riyadi H, Napitupulu V. 2010. Kecukupan energi, protein, lemak dan
karbohidrat. Departemen Gizi Masyarakat FEMA IPB.
23 Islami A, Purnomo AS, Sukesi. 2013. Pengaruh komposisi ampas tebu dan kayu sengon sebagai media pertumbuhan terhadap nutrisi jamur tiram (Pleurotus ostreatus). Jurnal Sains dan Seni POMITS. 2(1):2337-3520.
Jantaramanant P, Sermwiiayawong D, Noipha K, Towatana NH, Wititsuwannakul R. 2014. -glucan-containing polysaccharide extract from the grey oyster mushroom [pleurotus sajor-caju (Fr.) Sing.] stimulates glucose uptake by the L6 myotubes. International Food Research Journal. 21(2): 779-784.
Jatmiko ES, Sofian F. 2008. Rancang bangun spektroskopi FTIR (fourier transform infrared) untuk penentuan kualitas susu sapi. Jurnal Fisika Teori, Eksperimen, dan Fisika Aplikasinya. 11(1):23-28.
Kacurakova M, Capek P, Sasinkova V, Wellner N, Ebringerova A. 2000. FTIR study of plant cell wall model compounds: pectic polysaccharides and hemicelluloses. Carbohydr. Polym. 43:195–203.
Kharis MS, Nofitri, Ryan S, Setiawa HS, Habiburrahmat, Yulwan Irzaman. 2014. Analisis energi termal dari tungku berbahan bakar baglog jamur tiram, sekam padi, dan campuran 50% baglog jamur tiram dan 50% sekam padi. Semirata. 72-77.
Kidd PM. 2000. The use mushroom glucans and proteoglycans in cancer treatment. Altern Med Rev. 5(1):4-27.
Kingsbury N. 2009. Hybrid: the history and science of plant breeding. Chicago: The University of Chicago Press. ISBN 9780226437040.
Krishnamoorthy D, Sankaran M. 2014. Pleurotus ostreatus: an oyster mushroom with nutritional and medicinal properties. J Biochem Tech. 5(2): 718-726. Kumara KLW, Edirimanna ICS. 2009. Improvement of strains of two oyster
mushroom cultivars using duel culture technique. World Appl. Sci. J. 5:654-660.
Lusiana. 2015. Potensi antioksidasi ekstrak etanol jamur tiram putih (Pleurotus ostreatus). Jurnal Gradien. 11(1):1066-1069.
Magda CS, Amin K, Luis F. 2014. A high throughput assay of -1,3-D-glukan by congo red dye. Journal of Microbiological Methods. 109:140-148.
Marieta C, Dueñas MT. 2010. Study of a 2-branched (1→γ)- -D-glucan from lactobacillus suebicus CUPV221 as observed by tapping mode atomic force microscopy. Microscopy: Science, Technology, Applications and Education. 1:537-545.
Menaga D, Dhandapani R, Rajakumar S, Ayyasamy PM. 2012. Beta-glucans: a new source for human welfare. International Journal of Chemical and Pharmaceutical Sciences. 3(1):1-14.
Muhammad A. 2004. Penampilan varietas jagung unggul baru bermutu protein tinggi di jawa dan bali. Buletin Plasma Nutfah. 10 (2): 49-55.
Mursyidah, Lusia ABR, Maya R, Irzaman, Mersi K. 2015. Manufacture of Oyster Mushroom Seeds Involving Teenagers at Situ Ilir Village. Agrokreatif Jurnal Ilmiah Pengabdian kepada Masyarakat. 1(2):81-87.
Nitschke J, Modick H, Busch E, Rekowski RW, Altenbach HJ, Mölleken H. 2011. A new colorimetric method to quantify -1,3-1,6-glucans in comparison with total -1,3-glucans in edible mushrooms. Food Chemistry. 127:791– 796.
24
Parihar S, Pithawala EA, Modi HA. 2016. Evaluation of bioactive functional compound of edible mushroom pleurotus ostreatus by FTIR spectrum. International Journal of Innovative Knowledge Concepts. 2(1):2454-2415. Patil SS, Ahmed SA, Telang SM., Baig MMV. 2010. The nutritional value of
pleurotus ostreatus (jacq.:fr.) kumm cultivated on different lignocellulosic agro-wastes. Innovative Romanian Food Biotechnology. 7: 66-76.
Puspita RD, Desna, Husin AD, Irzaman, Darmasetiawan H, Siswadi. 2010. Tungku sekam sebagai bahan bakar alternatif pada sterilasasi media jamur tiram. BerkalaFisika. 13 (2): C45-C48.
Ranjani M, Rajan S, Murugesan AG, Thamilmarai S. 2014. Cultivication of medicinal mushroom (pleurotus spp) using paddy straw. World journal of pharmacy and pharmaceutical sciences. 3(3): 2033-2041.
Reis FS, Barros L, Martins A, Ferreira ICFR, Ferreira. 2012. Chemical composition and nutritional value of the most widely appreciated cultivated mushrooms: an inter-species comparative study. Food and Chemical Toxicology. 50 (2). 191–197.
Rey FI, Rofiqul U, Nofitri, Maya R, Irzaman, Irmansyah. 2014. Pemodelan ikatan kimia pada baglog miselium dan jamur tiram putih menggunakan konstanta pegas dan frekuensi vibrasi. Semirata. 114-122.
Rofiqul U, Rey FI, Nofitri, Maya R, Ardian A, Irzaman. 2014. Kajian konstanta pegas dan frekuensi vibrasi baglog miselium dan jamur tiram putih menggunakan metode fourier transform infra red (FTIR). Semirata. 123-133. Sarangi, Itisam, Ghosh D, Bhutia SK, Mallick SK, Maiti TK. 2006. Anti-tumor
and immunomodulating effeects of pleurotus ostreatus mycelia-derived proteoglycans. Interrnational Immunopharmacology. 6(8):1287-1297. Sher H, Al-Yemen M, Khan K. 2011. Cultivation of the oyster mushroom
(pleurotus ostreatus (jacq.) p. kumm.) in two different agroecological zones of pakistan. African Journal of Biotechnology. 10 (2):183-188.
Silverstein, RM, Webster, FX, & Kiemle, DJ. (β005). “Spectrometer identification
of organic compunds.” (7ª edition, chapter 2). John Wiley and Sons, Inc. Somanjana K, Snigdha P, Krishnendu A. 2013. Mushroom as the potential soyrce
of new generation of antioxidant: a review. Research Journal Pharm and Tech. 6(5):496-505.
Sood G, Sharma S, Kapoor S, Khanna PK. 2013. Optimization of extraction and characterization of polysaccharides from medicinal mushroom Ganoderma lucidum using response surface methodology. Journal of Medicinal Plants Research. 7(31):2323-2329.
Suriawiria.2001. Sukses beragrobisnis jamur kayu: shiitake, kuping, tiram. Jakarta: Penebar Swadaya. ISBN: 9789794895214.
Synytsya A, Mickova K, Synytsya A, Jablonsky I, Spevacek I, Erban V, Kovarikova E, Copikova J. 2008. Glucans from fruit bodies of cultivated mushrooms pleurotus ostreatus and pleurotus eryngii: structure and potential prebiotic activity. Carbohydrate Polymers. 76:548-556.
25 Thomas N, Sorrell. 1998. Interpreting spectra of organic molecules. University of North Carolina at Chapel Hill: University science Books Mill Valley California.
Thontowi, Kusmiati Nuswantara. β007. Produksi -glukan saccharomyces cerevisiae dalam media dengan sumber nitrogen berbeda pada air-lift fermentor. Biodiversitas. 8(4):253-256.
Vannucci L, Krizan J, Sima P, Stakheev D, Caja F, Rajsiglova L, Horak V, Saieh M. 2013. Immunostimulatory properties and antitumor activities of glucans (review). International Journal Of Oncology. 43(2):357-364.
Widyastuti N, Sukarti I, Giarni R, Tjokrokusumo D. 2015. Preliminary studies on potential oyster mushroom (pleurotus ostreatus) as an immunomodulator with a sample of lymphocytes. PSNMBI. 1(6): 1528-1531.
Widyastuti N, Baruji T, Giarni R, Isnawan H, Wahyudi P, Donowati. 2011. Analisa kandungan beta-glukan larut air dan larut alkali dari tubuh buah jamur tiram (pleurotus ostreatus) dan shiitake (lentinus edodes). Jurnal Sains dan Teknologi Indonesia. 13 (3):182-191.
Won CB, Ji HP, Young AP, Kang HK. 2014. Determination of glucan contents in the fruiting bodies and mycelia of lentinula edodes cultivars. Mycobiology. 42(3): 301-304.
26
Lampiran 1 Budidaya Pembuatan Baglog
1. Menyiapkan bahan yang akan digunakan untuk membuat media tanam, yaitu serbuk gergaji, dedak halus, kaptan, gips, tepung jagung, dan air bersih.
2. Campurkan dedak, tepung jagung, gips, dan serbuk, kemudian dikomposkan selama 1 hari.
3. Serbuk kayu diayak agar ukuran seragam dan bersih, lalu dicampurkan dengan dedak, tepung jagung, gips, dan serbuk yang telah dikomposkan, aduk hingga rata.
4. Tambahkan air secukupnya sampai kadar air mencapai 60%.
5. Masukkan campuran tersebut ke dalam kantong plastik ukuran 17x25x03, padatkan hingga merata sampai 2/3 bagian dari tinggi plastik, kemudian diberi ring bambu dan disumbat dengan kapas kemudian diikat karet. Padatan dalam plastik tersebut dinamakan baglog.
6. Baglog disterilisasikan dengan menggunakan drum pada suhu 1200C selama 6 jam.
7. Baglog yang telah disterilisasi didinginkan selama 24 jam, dan kemudian siap digunakan untuk menanam bibit.
Inokulasi (pembibitan)
1. Pastikan sebelum inokulasi dalam keadaan bersih dan menggunakan masker. 2. Bersihkan ruang inokulasi dengan menyemprotkan alkohol.
3. Semprot tangan dengan alkohol sebelum bekerja. 4. Sterilkan spatula dengan membakar pada lampu bunsen.
5. Masukkan bibit menggunakan spatula ke dalam baglog dengan terlebih dahulu membuka kapasnya sebanyak 4-5 spatula, tutup kembali kapasnya.
6. Baglog yang berisi bibit diinkubasi, yaitu disimpan di ruang tertentu pada suhu 28-300C. Tunggu sampai miselium tumbuh penuh selama 30-35 hari.
27 Lampiran 2 Gambar hasil pembibitan dan budidaya jamur
(a) Biakan murni (F0) (b) Biakan murni persilangan
(c) Bibit sebar (F1) (d) Bibit tanam (F2)
28
Lampiran 3 Pembuatan bibit jamur persilangan Pembuatan Potato Dextrose Agar (PDA)
1. Menyiapkan bahan yang akan digunakan untuk membuat PDA, yaitu kentang sebanyak 200 gram, dextrose 20 gram, agar bening 15 gram, cloromphenicol 1 kapsul, dan aquades 1 liter.
2. Kentang dikupas dan dicuci dan dipotong dadu tidak terlalu besar dan tidak terlalu kecil.
3. Kentang direbus menggunankan 1 liter aquades selama 15 menit. Kentang dimasukkan langsung setelah aquades dituangkan. Sebelum aquadesnya mendidih.
4. Setelah kentang direbus, air rebusan kentang tadi disaring dan ditambahkan aquades sampai kembali menjadi 1 liter.
5. Masukkan agar, dekstroks, dan cloromphenicol yang telah ditimbang sebelumnya. Campurkan dengan air rebusan kentang tadi sambil diaduk hingga mendidih.
6. Setelah mendidih, tuang ke dalam tabung erlenmeyer 250 mL yang kemudian ditutup menggunakan dengan kapas dan aluminium foil.
7. Erlenmeyer yang telah ditutup tadi di sterilisasi di dalam kukusan selama 30 menit.
8. Setelah disterilisasi, tuang PDA ke dalam cawan petri sebanyak 5 mL, kemudian didinginkan. Namun sebelumnya keadaan sekeliling harus steril, mulai dari cawan petri, alat yang digunakan, kotak sterilisasi, dll. Dalam menuangkan PDA ke dalam cawan petri harus dilakukan di dekat api yang berasal dari bunsen yang menyala. Bunsen harus dinyalakan selama 15 menit sebelum digunakan.
9. PDA yang telah dituang ke dalam cawan petri langsung ditutup, lalu dilapisi bagian luar dengan plastik wrap dan didiamkan selama 1 hari di dalam kotak sterilisasi.
Isolasi (kultur jaringan)
1. Menyiapkan jamur yang sehat dan layak digunakan.
2. Menyiapkan dan mensterilisasi alat-alat yang akan digunakan. Sterilisasi dengan cara penyemprotan alkohol di bagian tangan dan di sekitar kotak sterilisasi.
3. Lampu bunsen dinyalakan selama 15 menit sebelum digunakan dan bakal induk jamur (eksplan) disiapkan secara aseptik.
4. Dibuat garis tengah untuk membagi dua area sama besar pada cawan petri. 5. Tubuh buah diambil dengan menggunakan pinset dan masing-masing ditanam
di dalam cawan petri yang berisi media (PDA) diantara garis secara berdampingan.
6. Semua perlakuan dilakukan di dekat api yang berasal dari bunsen yang menyala.
7. Inkubasi media yang telah ditanami jamur selama 7 hari pada suhu kamar. 8. Hasil inkubasi diamati. Isolasi dianggap berhasil apabila di sekitar eksplan
tumbuh miselia jamur dan berwarna putih. Bagian miselium diambil yang bertumpuk, yaitu bagian tengah cawan petri diantara kedua jamur.
29 Pembuatan Bibit Sebar
1. Cuci bersih botol yang akan digunakan.
2. Menyediakan jagung 1 kg dan dextrose 40 gram. 3. Jagung yang akan digunakan dicuci bersih dengan air.
4. Jagung direbus selama 15 menit kemudian keringkan jagungnya. 5. Setelah kering, jagung dicampur dengan dextrose dan diaduk rata.
6. Setelah dicampur Dextrose, dimasukkan ke dalam botol yang telah steril, kira-kira ¾ bagian botol. Kemudian masukkan kapas secukupnya ke dalam mulut botol, sebelum ditutup dengan aluminium foil.
7. Bibit yang telah dimasukkan ke dalam botol disterilisasi dalam pengukus selama satu jam dengan suhu 100-120oC.
8. Setelah 1 jam, bibit didinginkan kemudian didiamkan selama 24 jam. 9. Inokulasi dengan subkultur jamur dengan cara aseptik.
10.Media yang telah ditumbuhi jamur (PDA) diambil menggunakan spatula yang telah di sterilisasi, kemudian dipindahkan ke dalam botol yang telah berisi bibit jagung.
11.Inokulasi dianggap berhasil apabila bibit jamur tumbuh dalam waktu 2-3 minggu.
Pembuatan Bibit Tanam
1. Sterilisasi peralatan yang akan digunakan, cuci bersih botol yang akan digunakan.
2. Serbuk gergaji dicampur dengan kapur pertanian, tepung jagung, dedak dan air.
3. Media yang telah dicampur dimasukkan ke dalam botol dan ditutup dengan aluminium foil.
4. Kemudian di steriliasai selama 1 jam di dalam pengukus.
5. Bibit didiamkan selama 24 jam, diinokulasi dengan bibit induk sebar yang telah disiapkan sebelumnya.
30
Lampiran 4 Analisis nilai bilangan gelombang dan konstanta pegas Massa tereduksi
1. O-H
μ
μ
μ 1,574 x 10-24 gram
2. C-O
μ
μ
μ 11.389 x 10-24 gram
3. C-H
μ
μ
μ 1.543 x 10-24 gram
4. C=O
μ
μ
μ 11.389 x 10-24 gram
Frekuensi Vibrasi dan Konstanta Harmonik
( )
Keterangan: : Frekuensi
: Konstanta pegas (N/m) : Massa tereduksi (gram/Kg)
Analisis konstanta pegas menggunakan persamaan osilasi harmonik berdasarkan hukum Hooke.
C-H pada JP
31
( )
( )
(
)
(
)
(
)
442 N/m
C=O pada JP
( )
( )
(
)
(
)
(
)
1100 N/m
C-O pada JP
( )
32
Analisis nilai bilangan gelombang dengan menggunakan persamaan osilasi anharmonik sederhana
Maka bilangan gelombang yang didapat sebesar:
33
Konstanta gaya ikatan:
34
RIWAYAT HIDUP