ELEKTRODE PASTA KARBON TERMODIFIKASI TANIN
DARI EKSTRAK KULIT MANGGIS UNTUK ANALISIS
ION TIMBEL(II) SECARA VOLTAMMETRI
DESI SOPIANTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Elektrode Pasta Karbon Termodifikasi Tanin dari Ekstrak Kulit Manggis untuk Analisis Ion Timbel(II) secara Voltammetri adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Desi Sopianti
ABSTRAK
DESI SOPIANTI. Elektrode Pasta Karbon Termodifikasi Tanin dari Ekstrak Kulit Manggis untuk Analisis Ion Timbel(II) secara Voltammetri. Dibimbing oleh DEDEN SAPRUDIN dan BUDI RIZA PUTRA.
Penelitian ini berfokus pada pengembangan dan penerapan elektrode pasta karbon (EPK) termodifikasi bahan alam untuk penentuan timbel(II) secara voltammetri siklik. Bahan alam yang digunakan ialah tanin dari kulit manggis dengan 2 perlakuan, yaitu tanpa ekstraksi (EM) dan dengan ekstraksi. Tanin merupakan polifenol yang dapat membentuk kompleks dengan logam. Penggunaannya sebagai pemodifikasi EPK diharapkan dapat meningkatkan kepekaan pengukuran timbel(II). Voltammogram siklik diamati pada selang potensial -0.5 sampai 1.0 V. Elektrode EM dengan komposisi 1-20%b/b tidak menunjukkan peningkatan arus puncak pada pengukuran timbel(II) 5 ppm, sementara ET 5%b/b menghasilkan arus puncak katodik 30 kali lebih besar dibandingkan dengan arus EPK-nonmodifikasi. Pengukuran optimum timbel(II) teramati pada pH 4, laju payar 100 mV/s, linearitas yang baik (r=0.9793) pada konsentrasi timbel(II) 1-5 ppm, dan selektivitas elektrode rendah terhadap tembaga(II). Elektrode termodifikasi tanin dapat diterapkan untuk sampel lingkungan.
Kata kunci: elektrode pasta karbon, tanin, timbel(II), voltammetri siklik
ABSTRACT
DESI SOPIANTI. Tannins from Mangosteen Peel Extract in-Modified Carbon Paste Electrode for Lead(II) Ions Analysis by Voltammetry. Supervised by DEDEN SAPRUDIN and BUDI RIZA PUTRA.
This investigation focused in the development and application of carbon paste electrode (CPE) which was modified using natural material for determination of lead(II) by cyclic voltammetry. Natural material used was tannin mangosteen peel, with two treatments: without extraction (EM) and with extraction. Tannins are polyphenols can form complexed tannin-metal. They can be used as modifier for CPE and it is expected can improve the sensitivity in lead(II) measurement. Cyclic voltammogram is observed at potential range from -0.5 to 1.0 V. The EM electrodes with composition of 1-20%w/w did not increase the peak in lead(II) measurement at 5 ppm, while ET 5%w/w resulted cathode peak 30 times higher than the nonmodified-CPE. The optimum measurement of lead(II) was observed at pH 4, the scan rate of 100 mV/s, good linearity (r=0.9793) in the range 1-5 ppm of lead(II), and electrode selectivity has low value toward copper(II). The modified electrode using tannins can be applied for environmental sample.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Kimia
ELEKTRODE PASTA KARBON TERMODIFIKASI TANIN
DARI EKSTRAK KULIT MANGGIS UNTUK ANALISIS
ION TIMBEL(II) SECARA VOLTAMMETRI
DESI SOPIANTI
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Februari 2015 ini ialah sensor kimia, dengan judul Elektrode Pasta Karbon Termodifikasi Tanin dari Ekstrak Kulit Manggis untuk Analisis Ion Timbel(II) secara Voltammetri.
Terima kasih penulis ucapkan kepada Bapak Dr Deden Saprudin, MSi dan Bapak Budi Riza Putra, MSi selaku pembimbing, serta seluruh staf Laboratorium Kimia Analitik (Bapak Eman, Bapak Edi, Bapak Kosasih, dan Ibu Nunung) yang telah membantu selama pelaksanaan penelitian. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Prosedur 2
HASIL DAN PEMBAHASAN 5
Ekstrak Tanin, Uji Kualitatif Tanin, dan Kadar Total Fenol 5 Karakteristik Elektrode Menggunakan K3[Fe(CN)6] 6
Pengaruh Jenis Elektrode Terhadap Pengukuran Pb(II) 8
Pengaruh Komposisi Elektrode 11
Pengaruh pH Larutan 12
Pengaruh Laju Payar 12
Linearitas dengan Voltammetri Siklik 14
Pengaruh Interferensi Logam Cu(II) 15
SIMPULAN DAN SARAN 16
Simpulan 17
Saran 17
DAFTAR PUSTAKA 17
LAMPIRAN 19
DAFTAR TABEL
1 Nilai potensial dan arus puncak redoks Pb(II) dalam buffer pH 4 10 2 Potensial dan arus katodik Pb(II) pada beberapa nilai pH 12
3 Recovery puncak reduksi Pb(II) 16
DAFTAR GAMBAR
1 Struktur tanin 5
2 Reaksi (a) Tanin dengan FeCl3 (b) Senyawa fenolik dengan pereaksi
Folin 6
3 Karakteristik K3[Fe(CN)6] 0.1 M dalam KCl 0.1 M dengan berbagai
elektrode 8
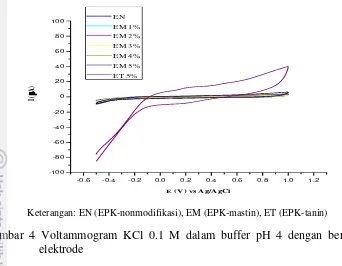
4 Voltammogram KCl 0.1 M dalam buffer pH 4 9
5 Voltammogram ion Pb(II) 5 ppm dalam KCl 0.1 M dalam buffer pH 4 10 6 Kompleks katekin (tanin) dengan Pb(II) (a) 2 gugus OH pada cincin B
(b) 1 gugus keton dan 1 gugus OH pada cincin C 11 7 Pengaruh komposisi pemodifikasi terhadap arus puncak pada
pengukuran ion Pb(II) 5 ppm dalam KCl dalam buffer pH 4 11 8 Voltammogram Pb(II) 5 ppm dalam buffer pH 4 dengan berbagai laju
payar 13
9 Hubungan akar laju payar (v½) dengan arus puncak (Ip) 13
10 Voltammogram Pb(II) 1-5 ppm dalam KCl dalam buffer pH 4 dengan
ET 5% 14
11 Kurva kalibrasi Pb(II) 15
12 Voltammogram pengaruh logam Cu(II) terhadap pengukuran Pb(II) 16
DAFTAR LAMPIRAN
1 Bagan alir penelitian 19
2 Rendemen ekstrak kasar tanin secara maserasi 19
3 Uji kualitatif tanin menggunakan FeCl3 20
4 Kadar total fenolik 20
5 Voltammogram KCl 0.1 M dengan berbagai elektrode 22 6 Pengaruh pH larutan terhadap pengukuran Pb(II) 22 7 Pengaruh perubahan laju payar terhadap arus puncak (Ip) 22
8 Uji linearitas Pb(II) 23
9 Nilai arus puncak oksidasi dan reduksi pengaruh interferensi logam
PENDAHULUAN
Dampak negatif dari pertumbuhan industri dan pemukiman yang cukup pesat adalah bertambahnya jumlah logam berat yang beracun di lingkungan. Saeni (1997) mendefinisikan logam berat sebagai unsur-unsur kimia dengan bobot jenis lebih besar dari 5 g/cm3. Salah satu dari logam berat adalah timbel (Pb) yang diketahui dapat terakumulasi di lingkungan yang berasal dari limbah buangan pabrik dan limbah rumah tangga. Adanya logam Pb tersebut dapat membahayakan tubuh manusia apabila terakumulasi dalam organ tubuh dalam konsentrasi lebih dari 150 µg/mL (Wisnu 1995), sehingga analisis unsur Pb penting dilakukan. Analisis unsur dalam bahan lingkungan, baik tanah, batuan maupun bahan biologi mempunyai kesulitan yang cukup tinggi, karena unsur pencemar tersebut memiliki konsentrasi yang sangat rendah (ng/kg sampai dengan mg/kg) dan keadaannya terikat dalam matriks yang sangat kompleks. Oleh karena itu, metode yang sensitif dan selektif perlu dikembangkan.
Beberapa metode analisis yang telah dikembangkan untuk analisis Pb, antara lain spektrofotometri serapan atom nyala (Supriyanto 2007), spektrofotometri serapan atom tungku grafit (Nazari 2011), ICP-MS (Otman et al.
2012) dan metode voltammetri seperti Differential Pulse Voltammetry (DPV),
Square Wave Voltammetry (SWV), Stripping Voltammetry (SV) serta Adsorptive Voltammetry (AdV) dengan batas deteksi yang berragam (Saryati 2007). Metode voltammetri mempunyai keunggulan dibandingkan metode analisis di atas, yaitu cuplikan yang sederhana, waktu analisis yang cepat, batas deteksi yang rendah sampai 0.1 μg/L, dan murah.
Voltammetri adalah metode elektrokimia yang mengamati perilaku spesi redoks yang ditampilkan dalam bentuk kurva arus-potensial. Potensial diragamkan secara sistematis dari spesi kimia yang mengalami oksidasi-reduksi di permukaan elektrode kerja. Arus yang dihasilkan sebanding dengan konsentrasi spesi kimia di dalam larutan. Elektrode kerja yang popular digunakan salah satunya ialah Elektrode Pasta Karbon (EPK) yang tersusun dari grafit dan minyak mineral. Elektrode berbasis karbon memiliki beberapa keunggulan yaitu rentang potensial yang luas, arus latar rendah, murah, inert, dan cocok digunakan untuk bermacam-macam sensor (Wang 2006). Akan tetapi, EPK juga memiliki kelemahan yaitu lambat dalam pengumpulan ion di sekitar permukaan elektrode (Xia 2010). Oleh karena itu, EPK umumnya dapat dimodifikasi dengan suatu senyawa pengompleks dari bahan alam untuk meningkatkan kinerjanya dalam mendeteksi logam dengan kadar yang sangat kecil. Metode-metode analisis kuantitatif logam Pb dengan EPK termodifikasi secara kimia telah dilaporkan pada penelitian sebelumnya, seperti kurkumin (Apriliani 2009), beras hitam (Devnani et al. 2014), dan kuersetin (Xia 2010).
2
buah manggis komersial telah diketahui yaitu xanton, antosianin, asam fenolat, dan tanin (Zhou et al. 2011). Tanin merupakan polifenol yang mengandung gugus-gugus hidroksil yang mempunyai pasangan elektron bebas sehingga dimungkinkan dapat membentuk kompleks dengan logam yang menyediakan orbital kosong.
Berdasarkan uraian tersebut, maka dikembangkan suatu metode analisis kuantitatif Pb(II) dengan teknik voltammetri menggunakan EPK termodifikasi tanin dari ekstrak kulit buah manggis komersial (mastin) agar hasil analisis lebih sensitif, selektif, dan murah. Pengujian dilakukan melalui dua perlakuan yaitu tanpa ekstraksi dan dengan ekstraksi, sehingga dapat ditentukan perbandingan kinerjanya.
METODE
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah serbuk grafit, parafin cair, KCl (Merck), ekstrak kulit manggis komersial (mastin), K3[Fe(CN)6]
(Wako), larutan HNO3 65%, padatan Pb(NO3)2, padatan CH3COONa.3H2O, asam
asetat (CH3COOH) 100%, akuades, etanol 95%, Folin Ciocalteau, Na2CO3
10%b/v, FeCl3 1%, dan padatan Cu(NO3)2.3H2O. Alat-alat yang digunakan pada
penelitian antara lain alat gelas, pipet mikro, pH meter, pengaduk magnet, penangas air, spektrofotometer UV-Tampak (Spektronik 20D+), penguap putar, sentrifuge, elektrode pembanding Ag/AgCl, tabung elektrode, elektrode kawat platina, seperangkat alat potensiostat/galvanostat eDAQ, dan komputer yang telah dipasang program data Echem v.2.1.0.
Prosedur
Variabel-variabel dalam penelitian ini meliputi ekstraksi tanin dari mastin, analisis total fenolik ekstrak tanin, pembuatan EPK-mastin (EM) dan EPK-tanin (ET), dan pengujian Pb(II) menggunakan teknik voltammetri siklik. Parameter dalam pengujian Pb(II) menggunakan teknik voltammetri siklik ialah pengaruh jenis elektrode kerja, komposisi EPK-tanin, pengaruh pH larutan analit, pengaruh laju payar, pengaruh konsentrasi analit, dan pengaruh interferensi logam lain (Lampiran 1).
Ekstraksi Tanin dalam Ekstrak Kulit Manggis (Moosophin et al 2010)
3
Analisis Kualitatif Tanin (Marlinda et al. 2012)
Sebanyak 2 g sampel dimasukkan ke dalam tabung reaksi, ditambahkan akuades hingga seluruh sampel terendam dan dididihkan selama 2-3 menit. Campuran disaring dan filtrat ditambahkan 2-3 tetes FeCl3 1%. Hasil positif
ditunjukkan dengan terbentuknya warna hijau, biru, atau hitam.
Analisis Total Fenolik (Santosoet al. 2009)
Sebanyak 1000 µg/mL ekstrak tanin dibuat dengan melarutkan 50 mg ekstrak dalam 50 mL etanol 96%. Kemudian larutan sampel diencerkan menjadi 100 µg/mL. Selanjutnya larutan tersebut dipipet sebanyak 2 mL ke dalam tabung reaksi, ditambahkan 5 mL akuades dan 0.5 mL reagen Folin Ciocalteau 50% dan diinkubasi selama 5 menit, kemudian ditambahkan 1 mL Na2CO3 5%. Larutan
dihomogenkan lalu diinkubasi dalam kondisi gelap selama satu jam. Serapan larutan diukur dengan spektrofotometer UV/Tampak pada panjang gelombang 760 nm. Pengukuran absorbansi sampel dilakukan 3 kali ulangan.
Asam galat digunakan sebagai standar dengan konsentrasi 5 µg/mL, 10 µg/mL, 15 µg/mL, 25 µg/mL, dan 50 µg/mL. Hasil yang diperoleh diplotkan terhadap kurva standar asam galat yang dipersiapkan dengan cara yang sama. Kandungan total fenolik dinyatakan dalam mg ekivalen asam galat/g ekstrak.
Pembuatan EPK Termodifikasi (Apriliani 2009 dengan modifikasi)
Tiga jenis elektrode yang dibuat ialah nonmodifikasi (EN), EPK-mastin (EM), dan EPK-tanin (ET). EN dibuat dengan cara mencampurkan 100 mg grafit dengan 35 µL parafin cair. EM dibuat dengan ragam mastin sebagai pemodifikasi sebanyak 1%, 2%, 3%, 4%, 5%, 10%, dan 20% perbandingan persentase berat dengan grafit sehingga diperoleh campuran pasta dengan total 100 mg. Sementara ET dibuat dengan ragam ekstrak tanin sebagai pemodifikasi sebanyak 3%, 5%, dan 10%. Masing-masing campuran tersebut kemudian ditambahkan 35 µ L parafin cair dan disonikasi selama 30 menit pada suhu ruang. Campuran tersebut diaduk hingga homogen kemudian dimasukkan ke dalam badan elektrode secara manual dengan spatula sambil ditekan, kemudian permukaan elektrode digosok sampai halus, rata, dan mengkilap.
Karakterisasi Kinerja EPK pada Sistem K3[Fe(CN)6]
4
Pengaruh Jenis Modifier Terhadap Pengukuran Pb(II)
EPK-nonmodifikasi, EPK-mastin dengan persentase 1-5% dan EPK-tanin 5% dimasukkan ke dalam sel voltammetri yang berisi larutan elektrolit KCl 0.1 M dalam larutan buffer asetat pH 4, kemudian dilakukan pengukuran arus pada potensial -0.5 V sampai 1.0 V dan laju payar 100 mV/s. Hal yang serupa dilakukan tetapi larutan dalam sel voltammetri diganti dengan larutan Pb(II) 5 ppm dengan larutan elektrolit KCl 0.1 M dalam larutan buffer asetat pH 4. Voltammogram yang diperoleh dibandingkan untuk mengetahui perubahan puncak arus yang terjadi sehingga bisa diketahui fungsi tanin sebagai modifier EPK dalam analisis logam Pb(II).
Pengaruh Komposisi EPK-tanin
EPK-tanin dengan ragam komposisi yang telah dibuat (3%, 5%, dan 10%) secara bergantian dimasukkan ke dalam sel voltammetri yang berisi larutan Pb(II) 5 ppm dengan larutan KCl 0.1 M dalam larutan buffer asetat pH 4, kemudian dilakukan pengukuran arus pada potensial -0,5 V sampai 1.0 V dan laju payar 100 mV/s. Voltammogram yang diperoleh dibandingkan untuk memperoleh komposisi EPK-tanin yang terbaik.
Pengaruh pH Larutan
Elektrode dengan komposisi terbaik dimasukkan ke dalam sel voltammetri yang berisi larutan Pb(II) 5 ppm dengan larutan KCl 0.1 M dalam buffer asetat dengan ragam pH 4, 5, 6, dan 7 lalu dilakukan pengukuran arus pada potensial -0.5 V sampai 1.0 V dan laju payar 100 mV/s. Hasil voltammogram dibandingkan untuk mendapatkan kondisi pH optimum.
Pengaruh Laju Payar
Elektrode dengan komposisi terbaik dimasukkan ke dalam sel voltammetri yang berisi larutan Pb(II) 5 ppm dengan larutan elektrolit KCl 0.1 M dalam buffer asetat pH terbaik kemudian dilakukan pengukuran arus pada potensial -0.5 V sampai 1.0 V dengan ragam laju payar yaitu 10, 20, 40, 50, 80, 100, 125, 160 mV/s. Voltammogram yang diperoleh kemudian dibandingkan untuk memperoleh laju payar terbaik.
Pengaruh Konsentrasi (Pembuatan Kurva Kalibrasi) untuk Analisis Voltammetri Siklik
Kurva kalibrasi dibuat dengan memplotkan arus puncak (Ip) dengan deret
5
Pengaruh Ion Logam Lain (Cu)
Larutan Pb(II) 1, 2, 3, 4, 5 ppm masing-masing ditambahkan larutan Cu 1 ppm dalam KCl 0.1 M dalam buffer pH 4 sebagai interferensi kemudian diukur dengan EPK-tanin 5% dengan laju payar 100 mV/s.
HASIL DAN PEMBAHASAN
Ekstrak Tanin, Uji Kualitatif Tanin, dan Kadar Total Fenol
Analisis logam Pb(II) secara voltammetri dilakukan menggunakan Elektrode Pasta Karbon (EPK) yang telah termodifikasi secara kimia. Zat aktif yang digunakan ialah tanin. Tanin diperoleh melalui 2 perlakuan yaitu tanpa ekstraksi ekstrak kulit manggis dan dengan ekstraksi. Kinerja EPK dari keduanya dibandingkan untuk menghasilkan jenis modifier terbaik. Pada penelitian ini, tanin diharapkan dapat berperan sebagai ligan untuk mengkelat logam Pb(II) sehingga dapat meningkatkan arus puncak pada voltammogram.
Tanin (Gambar 1) adalah komponen molekul organik kompleks yang terdistribusi secara luas dalam tumbuhan yang memiliki bobot molekul 500 hingga 3000 g/mol (Hagerman 2002). Tanin merupakan senyawa polifenol yang dapat membentuk senyawa kompleks dengan logam seperti Pb, Cu, Sn, dan Fe (Yenti 2014). Tanin memiliki sifat dapat larut dalam air atau senyawa alkohol karena tanin banyak mengandung fenol yang memiliki gugus OH dan dalam proses ekstraksi dari kulit manggis, tanin yang dihasilkan bukan merupakan tanin murni tetapi masih mengandung unsur-unsur lainnya.
Ekstraksi senyawa tanin dari kapsul mastin dilakukan dengan metode maserasi. Maserasi yang dilakukan merupakan maserasi dengan modifikasi (digesti) penggunaan suhu sebesar 80 ºC untuk meningkatkan kelarutan tanin ke
dalam pelarut air:etanol 95% (1:1) dengan rasio bahan dan pelarut (1:10 b/v). Rendemen ekstrak kasar tanin yang diperoleh cukup tinggi sebesar 26.96% (Lampiran 2). Menurut penelitian yang dilakukan oleh Moosophin (2010), jenis tanin yang paling dominan dalam kulit manggis ialah tanin terkondensasi. Tanin tersebut terdiri dari katekin yang tergolong proantosianidin dan merupakan turunan dari flavanol yang tidak dapat dihidrolisis dengan asam ataupun basa.
O
H O
OH
O
OH
OH
Gambar 1 Struktur tanin (Fu et al. 2007)
Analisis kualitatif tanin dilakukan dengan menggunakan pereaksi FeCl3
6
endapan coklat (Lampiran 3).Warna tersebut merupakan hasil reaksi kompleks antara 1 molekul Fe dengan 3 molekul tanin (Gambar 2a). Analisis kuantitatif ekstrak kasar tanin dilakukan dengan analisis total fenolik menggunakan reagen Folin Ciocalteau. Prinsip penentuan kadar total fenol dengan pereaksi Folin-Ciocalteau ialah pereaksi tersebut akan mengoksidasi fenolat, mereduksi asam heteropoli dari pereaksi folin menjadi suatu kompleks molibdenum-tungsten (Mo-W) berwarna biru (Gambar 2b) yang diukur pada panjang gelombang 760 nm (Schopield et al. 2001). Kadar total fenolik yang dihasilkan sebesar 167.3361 mg GAE/g sampel (Lampiran 4). Hasil tersebut menunjukkan bahwa dalam 1 gram sampel yang telah diekstraksi, terdapat senyawa fenolik (tanin) yang cukup tinggi sebesar 167.3361 mg.
Karakteristik Elektrode Menggunakan K3[Fe(CN)6]
7 terhadap perubahan temperatur, sehingga dapat digunakan sebagai standar pembanding terhadap perubahan potensial pada elektrode kerja. Elektrode Pt sebagai pendukung merupakan elektrode yang berperan sebagai tempat masuknya elektron, sehingga arus dapat dilewatkan melalui sel tanpa terlibat dalam reaksi kimia yang terjadi.
Keberhasilan dari teknik elektrokimia ini sangat dipengaruhi oleh jenis elektrode kerja yang digunakan, komposisi elektrode, dan kondisi pengukuran. Elektrode kerja yang diselidiki kinerjanya terdiri dari 3 elektrode yaitu EPK-nonmodifikasi (EN), EPK termodifikasi mastin (EM), dan EPK termodifikasi ekstrak tanin (ET). Ketiganya dibuat dengan bahan dasar grafit dan minyak parafin sehingga membentuk suatu pasta dan pemodifikasi dicampurkan dengan perbandingan tertentu (bulk modified). Grafit digunakan sebagai bahan penghantar listrik yang baik, bersifat inert, dan memiliki rentang potensial yang luas. Minyak parafin digunakan sebagai bahan pengikat (Svancara et al. 2002). Sementara tanin dalam ekstrak kulit manggis diharapkan dapat meningkatkan sensitivitas dan selektivitas dalam pengukuran Pb(II) mengingat tanin dapat mengkelat logam karena sifatnya sebagai ligan pengompleks. Kondisi pengukuran seperti pH optimum dan komposisi tanin optimum diatur agar kompleks tanin-Pb(II) dapat terbentuk.
Pasta karbon dimasukkan ke dalam badan elektrode dan diampelas dengan kertas minyak agar permukaannya rata. Elektrode EN, EM, dan ET dilakukan karakterisasi terlebih dahulu untuk mengetahui kelayakan EPK yang telah dibuat untuk pengukuran analit. Karakterisasi dilakukan menggunakan K3[Fe(CN)6] 0.1
M dalam larutan elektrolit KCl 0.1 M. Larutan elektrolit digunakan sebagai medium penghantar listrik sehingga analit tidak terpengaruh oleh perbedaan perubahan potensial yang diberikan dengan cepat (Wang 2006). Larutan elektrolit sebaiknya tidak menghasilkan arus latar yang dapat memengaruhi pengukuran analit yang ditunjukkan dalam voltammogram pada Lampiran 5.
EPK yang layak digunakan untuk pengujian selanjutnya merupakan EPK dengan hasil pengukuran puncak oksidasi dan reduksi dari K3[Fe(CN)6] baik.
Selain menguji kelayakan EPK, voltammogram K3Fe(CN)6 0.1 M (Gambar 3)
juga dapat menunjukkan kemampuan EPK termodifikasi dalam meningkatkan arus analit. Potensial anodik dan katodik yang dihasilkan oleh K3[Fe(CN)6] adalah
8
Keterangan: EN (EPK-nonmodifikasi), EM (EPK-mastin), ET (EPK-tanin)
Pengaruh Jenis Elektrode Terhadap Pengukuran Pb(II)
Ketiga jenis elektrode yang telah dikarakterisasi digunakan untuk pengukuran logam Pb(II) pada selang potensial -0.5 – 1.0 V menggunakan EPK EN, EM, dan ET. Pengukuran diawali dengan mengamati arus latar dari larutan elektrolit yang digunakan yaitu KCl 0.1 M dalam buffer asetat pH 4. Voltammogram (Gambar 4) menunjukkan bahwa KCl tidak mengalami reaksi reduksi-oksidasi pada selang potensial yang diberikan melalui pengukuran menggunakan ketiga jenis elektrode karena menurut Chang (2003) reaksi redoks K+ terjadi pada 2.93 V dan Cl- pada 1.36 V. Pada EPK termodifikasi, baik EM maupun ET, hasil tersebut menunjukkan bahwa ekstrak tanin dan mastin pada permukaan elektrode tidak mengalami reaksi redoks sehingga tidak ada gangguan pada arus latar belakang. Namun, arus blanko yang dihasilkan oleh elektrode ET lebih besar daripada elektrode yang lainnya. Menurut Taufik (2013) hal ini disebabkan oleh kemungkinan adanya arus kapasitif akibat pergerakan ion-ion negatif menuju elektrode kerja, tapi tidak terlibat dalam reaksi redoks karena potensial elektrode standar untuk blangko berada di luar selang potensial yang diberikan. Lapisan listrik ganda terbentuk pada permukaan elektrode akibat ion-ion negatif teradsorpsi pada permukaan elektrode sehingga meningkatkan arus kapasitif.
Gambar 3 Karakteristik K3[Fe(CN)6] 0.1 M dalam KCl 0.1 M dengan berbagai
9
Keterangan: EN (EPK-nonmodifikasi), EM (EPK-mastin), ET (EPK-tanin)
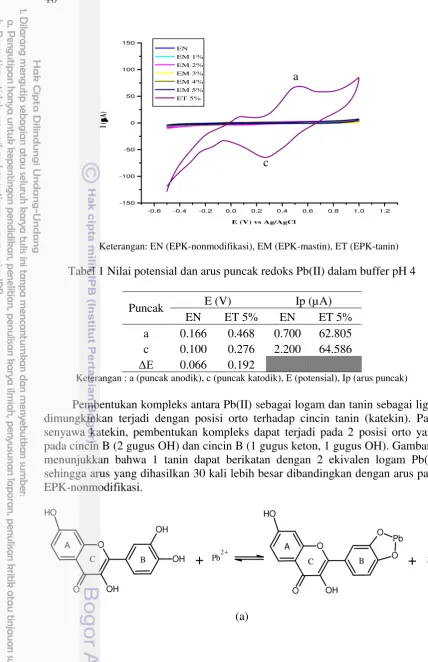
Jenis elektrode berpengaruh terhadap arus puncak yang dihasilkan. EPK-nonmodifikasi menghasilkan arus yang sangat kecil dan EPK-mastin dengan komposisi 1-5% nampak tidak menunjukkan arus puncak (Gambar 5). Hanya EPK-tanin dengan komposisi 5% yang memberikan puncak arus oksidasi dan reduksi yang besar dari Pb(II). Hal tersebut menegaskan bahwa EPK-tanin (ET) yang memiliki potensi meningkatkan sensitivitas pengukuran ion Pb(II) secara voltammetri siklik.
Tanin yang berperan sebagai ligan pengompleks membantu dalam pengumpulan ion Pb2+ di permukaan elektrode kerja melalui pembentukan
10
Tabel 1 Nilai potensial dan arus puncak redoks Pb(II) dalam buffer pH 4
Puncak E (V) Ip (µA)
EN ET 5% EN ET 5%
a 0.166 0.468 0.700 62.805 c 0.100 0.276 2.200 64.586
ΔE 0.066 0.192
Keterangan : a (puncak anodik), c (puncak katodik), E (potensial), Ip (arus puncak)
Pembentukan kompleks antara Pb(II) sebagai logam dan tanin sebagai ligan dimungkinkan terjadi dengan posisi orto terhadap cincin tanin (katekin). Pada senyawa katekin, pembentukan kompleks dapat terjadi pada 2 posisi orto yaitu pada cincin B (2 gugus OH) dan cincin B (1 gugus keton, 1 gugus OH). Gambar 6 menunjukkan bahwa 1 tanin dapat berikatan dengan 2 ekivalen logam Pb(II) sehingga arus yang dihasilkan 30 kali lebih besar dibandingkan dengan arus pada EPK-nonmodifikasi.
Keterangan: EN (EPK-nonmodifikasi), EM (EPK-mastin), ET (EPK-tanin)
a
11
Gambar 6 Kompleks katekin (tanin) dengan Pb(II) (a) 2 gugus OH pada cincin B (b) 1 gugus keton dan 1 gugus OH pada cincin C
Pengaruh Komposisi Elektrode
Reaktivitas dan daya hantar elektrode sangat dipengaruhi oleh komposisi bahan penyusun elekrode itu sendiri, sehingga perlu diragamkan berdasarkan persentase berat. Elektrode yang baik adalah elektrode dengan kecepatan transfer elektron dan respon terhadap analit yang baik. Komposisi EPK-tanin dikategorikan terbaik apabila memberikan sensitivitas tinggi yang ditunjukkan dengan arus puncak yang tinggi pada voltammogram. Persentase berat tanin dalam komposisi total ET dibuat sebesar 3%, 5%, dan 10%. Ketiganya menunjukkan voltammogram dengan tinggi arus puncak yang berbeda-beda. Arus puncak oksidasi maupun reduksi meningkat dengan meningkatnya jumlah tanin, pada EN 3% dan 5%, namun arus puncak kemudian menurun dari tanin 5% ke 10%. (Gambar 7). Hasil tersebut menunjukkan bahwa semakin banyak tanin sebagai ligan pengompleks yang terdapat dalam EPK, pengumpulan logam di permukaan elektrode juga semakin banyak, sehingga arus puncak semakin besar. Penurunan arus pada ET 10% disebabkan oleh efek penurunan konduktivitas dari grafit yang lebih besar dibandingkan efek ligan pengompleks dari tanin.
-0.6 -0.4 -0.2 0.0 0.2 0.4 0.6 0.8 1.0 1.2
Gambar 7 Pengaruh komposisi pemodifikasi terhadap arus puncak pada pengukuran ion Pb(II) 5 ppm dalam KCl 0.1 M dalam buffer pH 4
a
12
Pengaruh pH Larutan
Selain komposisi elektrode, faktor lain yang memengaruhi tinggi arus puncak yang terukur ialah kondisi pengukuran yang meliputi pH, laju payar, dan konsentrasi Pb(II) yang dianalisis. Derajat keasaman larutan (pH) berpengaruh terhadap proses terbentuknya kompleks Pb(II)-tanin. Kondisi pH dalam pengukuran harus sesuai agar kompleks antara Pb dengan tanin berlangsung secara optimum. Pada penelitian ini, buffer asetat digunakan dalam mengatur keasaman larutan Pb(II). Ragam pH larutan buffer terdiri dari pH 4, 5, 6, dan 7. Arus puncak oksidasi Pb(II) dalam buffer pH > 4 teramati pada potensial yang lebih negatif dibandingkan dengan larutan Pb(II) dalam buffer pH 4 (Tabel 2). Hal tersebut disebabkan oleh berkurangnya ion H+ yang berkompetisi dengan Pb(II) untuk berikatan dengan tanin sehingga kompleks yang terbentuk semakin kuat dan relatif lebih sulit jika direduksi. Selain itu, tingginya pH akan menghasilkan Pb(OH)2 yang berupa endapan yang menyebabkan menurunnya kompleks
timbel-tanin ditandai dengan menurunnya arus reduksi. Arus puncak optimum terjadi pada pH 4 karena pada pH ini Pb(II) berada dalam bentuk ion bebas dalam jumlah yang cukup banyak, sehingga pembentukan kompleks Pb(II)-tanin lebih banyak (Lampiran 6).
Tabel 2 Potensial dan arus katodik Pb(II) pada beberapa nilai pH pH Ec (V) Ipc (µA)
4 0.310 54.500 5 0.286 40.140 6 0.226 33.150 7 0.226 36.920
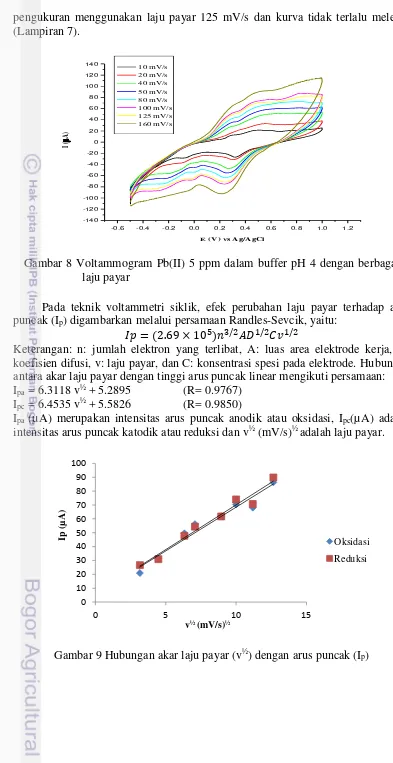
Pengaruh Laju Payar
Laju payar pengukuran memengaruhi tinggi rendahnya arus puncak dan lebar sempitnya kurva sehingga perlu dilakukan optimasi laju payar. Semakin besar laju payar, maka semakin besar pula arus puncak, tetapi kurvanya melebar. Sebaliknya semakin kecil laju payar, arus puncak semakin kecil dan kurva menyempit (Gambar 8). Menurut Foliatini (2005) laju payar berkaitan dengan kenaikan laju difusi spesi menuju elektrode. Laju payar yang besar akan mengakibatkan tipisnya lapisan difusi dan fluks (Jx) yang dihasilkan akan menjadi lebih besar. Sebaliknya laju payar yang kecil akan mengakibatkan tebalnya lapisan difusi dan fluks (Jx) yang dihasilkan akan menjadi lebih kecil, sehingga arus yang dihasilkan akan menjadi lebih kecil. Oleh karena itu, arus meningkat dengan meningkatnya laju payar. Namun, pelebaran kurva tidak diinginkan pada pengukuran Pb(II) karena pelebaran kurva akan mengganggu pengukuran terutama bila terdapat interferensi dari logam lain yang memiliki potensial setengah gelombang yang berdekatan dan kurva saling tumpang tindih.
13 pengukuran menggunakan laju payar 125 mV/s dan kurva tidak terlalu melebar (Lampiran 7).
Pada teknik voltammetri siklik, efek perubahan laju payar terhadap arus puncak (Ip) digambarkan melalui persamaan Randles-Sevcik, yaitu:
� = . × / � / � /
Keterangan: n: jumlah elektron yang terlibat, A: luas area elektrode kerja, D: koefisien difusi, v: laju payar, dan C: konsentrasi spesi pada elektrode. Hubungan antara akar laju payar dengan tinggi arus puncak linear mengikuti persamaan: Ipa = 6.3118 v½ + 5.2895 (R= 0.9767)
Ipc = 6.4535 v½ + 5.5826 (R= 0.9850)
Ipa (µA) merupakan intensitas arus puncak anodik atau oksidasi, Ipc(µA) adalah
intensitas arus puncak katodik atau reduksi dan v½ (mV/s)½ adalah laju payar.
Gambar 9 Hubungan akar laju payar (v½) dengan arus puncak (I p)
14
Hubungan antara arus puncak (Ip) dengan akar laju payar (Gambar 9) dapat
memberikan informasi mengenai koefisien difusi dari spesi elektroaktif. Hubungan yang linier dari persamaan yang didapat membuktikan bahwa proses redoks yang terjadi pada Pb(II) merupakan reaksi yang reversibel. Selain itu, menurut Wardah (2012) besarnya potensial puncak yang dihasilkan dipengaruhi oleh kinetika transfer elektron. Reaksi redoks reversibel juga ditunjukkan oleh potensial puncak yang tidak berubah dengan bertambahnya laju payar.
Linearitas dengan Voltammetri Siklik
Linearitas merupakan parameter yang menjelaskan hubungan antara konsentrasi dengan tinggi arus puncak. Linearitas diperoleh dari pengukuran larutan Pb(II) dalam berbagai ragam konsentrasi yaitu 1, 2, 3, 4, dan 5 ppm dalam buffer asetat pH 4 menggunakan EPK-tanin 5% dalam kecepatan payar 100 mV/s. Kurva kalibrasi dibuat dengan hubungan antara konsentrasi dengan arus puncak. Persamaan regresi yang diperoleh diharapkan memiliki koefisien korelasi mendekati 1 yang artinya rentang konsentrasi yang dipelajari memberikan hubungan yang linear antara konsentrasi Pb(II) dengan tinggi arus puncak sebagai dasar dari analisis kuantitatif.
Voltammogram yang dihasilkan (Gambar 10) menunjukkan semakin besar konsentrasi Pb2+ dalam larutan, maka semakin besar pula arus puncak (Ip) yang
terukur. Voltammogram tersebut kemudian diturunkan ke dalam kurva kalibrasi (Gambar 11) untuk mengetahui linearitasnya. Hasil menunjukkan bahwa hubungan antara konsentrasi dengan Ipc lebih linear dibandingkan dengan Ipa
(Lampiran 8). Hal tersebut terjadi karena ion Pb dalam larutan telah berada dalam
bentuk bebasnya yaitu Pb2+, sehingga lebih dominan tereduksi dibandingkan dengan teroksidasi. Hubungan konsentrasi Pb(II) dengan Ip mengikuti persamaan:
Ipa= 9.7332x + 1.5894 (R= 0.8584)
15
Gambar 11 Kurva kalibrasi Pb(II)
Pengaruh Interferensi Logam Lain
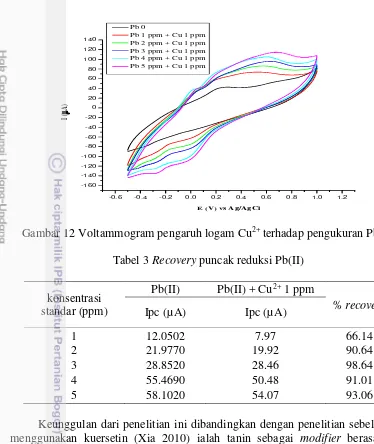
Tanin sebagai ligan tidak hanya dapat membentuk kompleks dengan logam Pb(II), tetapi mampu membentuk kompleks dengan ion logam yang lain seperti Fe, Cu, dan Sn (Yenti 2014). Hal tersebut dapat memengaruhi selektivitas pengukuran dalam penelitian ini. Selektivitas merupakan kemampuan suatu alat untuk membedakan sinyal yang berasal dari analit dengan sinyal yang berasal dari senyawa pengganggu (Harvey 2000). Uji selektvitas dilakukan menggunakan logam Cu2+ sebagai interferensi untuk mengamati terjadinya kompetisi pembentukan kompleks dengan tanin pada saat pengukuran Pb(II). Pengaruh logam Cu2+ diamati dengan mencampurkan larutan Cu2+ 1 ppm ke dalam deret konsentrasi 1-5 ppm Pb(II). Arus tanpa penambahan Cu2+ dan dengan penambahan Cu2+ dibandingkan. Pengukuran dilakukan pada kondisi optimum pengukuran Pb(II). Logam Cu2+ dipilih karena memiliki potensial reduksi yang berdekatan dengan Pb(II) yaitu 0.34 volt. Selektivitas pengukuran ditentukan dengan nilai persen perolehan kembali (recovery).
Hasil pada Gambar 10 menunjukkan hubungan yang linier pada arus puncak reduksi Pb(II) dibandingkan dengan arus puncak oksidasi, sehingga pada uji selektivitas pengamatan lebih berfokus pada puncak reduksi Pb(II). Keberadaan logam Cu2+ dalam larutan Pb(II) menggeser potensial reduksi Pb(II) ke arah yang
lebih negatif yaitu -0.0920 V (Gambar 12). Persen recovery yang diperoleh pada pengukuran mendekati 100% menandakan bahwa ion Cu2+ tidak mengganggu pengukuran arus Pb(II) jika konsentrasi ion pengganggu (Cu2+) berada dalam konsentrasi yang lebih kecil dari Pb2+. Nilai persen recovery dapat dilihat pada Tabel 3.
y = 12.2183x + 4.9796 R = 0.9793
0 10 20 30 40 50 60 70
0 1 2 3 4 5 6
Ipc
(µ
A
)
16
Gambar 12 Voltammogram pengaruh logam Cu2+ terhadap pengukuran Pb(II) Tabel 3 Recovery puncak reduksi Pb(II)
konsentrasi
Keunggulan dari penelitian ini dibandingkan dengan penelitian sebelumnya menggunakan kuersetin (Xia 2010) ialah tanin sebagai modifier berasal dari ekstrak kasar tanpa dilakukan pemurnian terlebih dahulu sudah menunjukkan sensitivitas yang baik. Selain itu, tanin diperoleh dengan mudah dan murah dari ekstrak kulit manggis komersial yang sudah banyak beredar di pasaran, dibandingkan penggunaan standar kuersetin murni yang relatif mahal sehingga metode ini lebih efisien dari segi waktu dan biaya.
SIMPULAN DAN SARAN
Simpulan
Pengukuran ion Pb(II) dapat dilakukan dengan metode voltammetri siklik menggunakan EPK termodifikasi tanin dalam ekstrak kulit manggis komersial melalui ekstraksi. Tanin dari ekstrak kulit manggis komersial tanpa ekstraksi tidak dapat meningkatkan arus puncak sehingga tidak efektif digunakan sebagai
17 meningkatkan arus reduksi Pb sebesar 30 kali lebih besar dibandingkan EPK nonmodifikasi. Kondisi pengukuran optimum terjadi dalam larutan buffer asetat pH 4 dan laju payar 100 mV/s. Pasangan redoks Pb(II) merupakan reaksi reversibel berdasarkan persamaan Randles-Sevcik. Pengukuran Pb(II) 1-5 ppm menghasilkan linearitas yang baik yaitu 0.9793. Pengukuran memiliki selektivitas yang rendah terhadap ion Cu(II).
Saran
Tanin sebagai modifier sebaiknya dilakukan pemurnian sehingga diperoleh senyawa tunggal. Selanjutnya, pembentukan kompleks dipelajari melalui karakterisasi menggunakan spektroskopi Infra Merah (FTIR). Selain itu, analisis dilakukan menggunakan teknik voltammetri lucutan anodik untuk memperoleh informasi kuantitatif dan keterulangan elektrode diamati.
DAFTAR PUSTAKA
Apriliani R. 2009. Studi penggunaan kurkumin sebagai modifier elektrode pasta karbon untuk analisis timbel (II) secara stripping voltammetry [skripsi]. Surakarta (ID): Universitas Sebelas Maret.
Chang R. 2003. Kimia Dasar: Konsep-Konsep Inti Ed. 3. Martoprawiro, penerjemah. Jakarta (ID): Erlangga. Terjemahan dari: General Chemistry: The Essential Concepts.
Devnani, Rajawat. 2014. Black rice modified carbon paste elektrode for the voltammetric determination of Pb(II), Cd(II), Cu(II) and Zn(II). Acad. Sci
84(3): 361-370 doi:10.1007/s40010-013-0112-6.
Foliatini. 2005. Studi modifikasi grafit dengan polimer dan Cu-coheksasinoferat sebagai elektroda sensor glukosa secara voltammetri.[Tesis]. Jakarta (ID): Universitas Indonesia.
Fu et al.Oligomeric proanthocyanidins from mangosteen pericarps. J Agric Food Chem 55 (19): 7689-7694 doi: 10.1021/jf071166n.
Hagerman. 2002. Condensed tannin purification and characterization of tannin-associated proteins. J Agric Food Chem 28(5): 947-952.
Harvey D. 2000. Modern Analytical Chemistry. New York (US): Mc. Graw Hill. ICUC. 2003. Fruit to the future Mangosteen. Factsheet (8) International Centre
for Underutilized Crops.
Leemensand. 1991. Plant Recources of South East Asia 3 Dye and Tanin Production Plant. Netherland (NL): Pudoc Wagengan.
Marlinda M, Sangi MS, dan Wuntu AD. Analisis senyawa metabolit sekunder dan uji toksisitas ekstrak etanol biji buah alpukat (Persea americana Mill.).
Jurnal MIPA Usrat online 1(1): 24-28.
Moosophin et al. 2010. Tannin extraction from mangosteen peel for protein precipitation in wine. KKU Res J 15 (5): 377-385.
18
Prosiding Seminar Nasional dan Workshop Perkembangan Terkini Sains Farmasi dan Klinik IV.
Nazari. 2011. Determination of trace amounts of lead by modified graphite furnace atomic absorption spectrometry after liquid phase microextraction with pyrimidine-2-thiol. AJAC (2): 757-767. doi: 10.4236/ajac.2011.27087. Otman, Al Ansi, Tufail. 2012. Determination of lead in Saudi Arabian imported
green tea by ICP-MS. J. Chem 9 (1): 79-82. doi: 10.1155/2012/132683. Saeni. 1997. Penentuan Tingkat Pencemaran Logam Berat dengan Analisis
Rambut. Bogor (ID): IPB Press.
Santoso, J., N. Aryudhani and S. H. Suseno. 2009. Kandungan senyawa fenol rumput laut hijau Caulerpa racemosa dan aktivitas antioksidannya. JKN 2 : 109-118.
Saryati, Wardiyati. 2007. Aplikasi voltammetri untuk penentuan logam berat dalam bahan lingkungan. Pusat Teknologi Bahan Industri Nuklir (PTBIN) BATAN, Tanggerang.
Schopield, Mbugua, Pell. 2001. Analysis of condensed tannins:a review. AFST
91 : 21-40.
Supriyanto, Samin, Kamal. 2007. Analisis cemaran logam berat Pb, Cu, dan Cd pada ikan air tawar dengan metode spektrometri nyala serapan atom (SSA).
BATAN ISSN 1978-0176: 147-152.
Svancara, Ogorev, Hocevar, Vitras. 2002. Perspectives of carbon paste elektrodes in stripping potentiometry. Anal Sci 18: 95-100.
Taufik M. 2013. Elektrode pasta karbon termodifikasi kuersetin untuk analisis ion tembaga(II) secara voltammetri [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Wang J. 2006. Analytical Electrochemistry Third Edition. New York (US): Willey. Wardah H. 2012. Pengembangan sensor BOD berbasis Rhodotorula mucilaginosa
UICC Y-181 terimobilisasi dalam gelatin dan alginat menggunakan elektroda emas dan boron-doped diamond termodifikasi nanopartikel emas.[Tesis]. Jakarta (ID): Universitas Indonesia.
Wisnu. 1995. Dampak Pencemaran Lingkungan. Jakarta (ID): Andi Offset.
Xia et al. 2010. Simultaneous determination of copper, lead, and cadmium at hexagonal mesoporous silica immobilized quercetin modified carbon paste elektrode. J Auto Met Chem 10: 1-6 doi: 10.1155/2010/824197.
Yenti. 2014. Pengaruh perbandingan pelarut etanol-air terhadap kadar tanin pada sokletasi daun gambir (Uncaria gambir Roxb.). SAGU 13 (1): 1-7.
19
LAMPIRAN
Lampiran 1 Bagan alir penelitian
Lampiran 2 Rendemen ekstrak kasar tanin secara maserasi
Bobot sampel awal (g)
Bobot ekstrak (g)
Rendemen (%b/b)
50.0318 13.4814 26.96
Contoh perhitungan: Rendemen = B e
B e w x 100%
= . 8 g
. 8 g x 100%
= 26.96% Ekstraksi
Tanin
Analisis Total Fenolik
Pembuatan EPK
Pengujian Pb(II) dengan voltammetri
siklik
1. EPK-nonmodifikasi 2. EPK-mastin
3. EPK-tanin
1. Pengaruh jenis elektrode kerja 2. Pengaruh komposisi EPK-tanin
20
Lampiran 3 Uji kualitatif tanin menggunakan FeCl3
Lampiran 4 Total Fenolik
Larutan Konsentrasi (µg/mL)
Transmitan
(%) Absorbans
Standar 5.2000 83.20 0.0799
10.4000 67.40 0.1713
15.6000 54.60 0.2628
26.0000 33.60 0.4737
52.0000 10.40 0.9830
Sampel - 48.80
50.00 48.80
0.3116 0.3010 0.3116
Contoh Perhitungan : 1. Konversi %T ke A
y = 0.0194x - 0.0302 R² = 0.9998
0 0.2 0.4 0.6 0.8 1 1.2
0.0000 10.0000 20.0000 30.0000 40.0000 50.0000 60.0000
Abs
o
rba
ns
i
Konsentrasi standar (µg/mL) Kontrol
negatif
Tanpa penambahan
FeCl3
Setelah Penambahan
21
� = − %�
� = − .
� = .
2. Konsentrasi sampel ulangan 1 berdasarkan kurva standar yang diperoleh Persamaan regresi linear yang diperoleh : y = 0.0194x - 0.0302
Maka : 0.3116 = 0.0194x - 0.0302 X = 17.6186 ppm Konsentrasi sampel ulangan 1 :
= × �⁄ × � ×
= . × . � .⁄ � × ⁄ .
= . �� ⁄ �
3. Kadar total fenolik rerata
kadar total fenolik rerata=x1+x2+xn3+…+x10
� � � � � �=169.0840 + 163.8404 + 169.08403
= . mg GAE g ekstrak⁄ 4. Standar Deviasi
SD=√ x1-X̅ 2+ x2-X̅ 2+ x3-X̅ 2
n-1
SD=√ 169.0840–167.3361 2+ 163.8404–167.3361 2+ 169.0840–167.3361 2
3-1
= .
%RSD=SD X̅ ×100
%RSD=167.3361 ×100=1.81%3.0274
22
Lampiran 6 Pengaruh pH larutan terhadap pengukuran Pb(II)
Lampiran 7 Pengaruh perubahan laju payar terhadap arus puncak (Ip)
v
Lampiran 8 Uji linearitas Pb(II)
23 konsentrasi
standar (ppm) Ipa (µA) Ipc (µA)
0 12.0160 6.1170
1 12.1203 18.1672
2 13.4530 28.0940
3 14.4450 34.9690
4 40.6950 61.5860
5 62.8050 64.2190
Lampiran 9 Nilai arus puncak oksidasi dan reduksi pengaruh interferensi logam Cu
Perlakuan konsentrasi
standar (ppm) Ipa (µA) Ipc (µA)
Ipa terkoreksi
Ipc terkoreksi
Pb 0 12.0160 6.1170 - -
1 12.1203 18.1672 0.1043 12.0502
2 13.4530 28.0940 1.4370 21.9770
3 14.4450 34.9690 2.4290 28.8520
4 40.6950 61.5860 28.6790 55.4690
5 62.8050 64.2190 50.7890 58.1020
Pb + Cu 1
ppm 0 40.2800 52.9900 - -
1 61.3500 60.9600 21.0700 7.9700
2 80.0800 72.9100 39.8000 19.9200
3 86.9100 81.4500 46.6300 28.4600
4 88.3800 103.4700 48.1000 50.4800
24
RIWAYAT HIDUP
Penulis dilahirkan di Sukabumi pada tanggal 12 Desember 1992 yang merupakan anak keempat dari empat bersaudara dari pasangan Bapak Sopian dan Ibu Sukaesih. Penulis menyelesaikan sekolah di SMA Muhammadiyah Sukabumi dan lulus pada tahun 2010. Penulis diterima sebagai mahasiswa diploma IPB pada tahun 2010 di Program Keahlian Analisis Kimia Direktorat Program Diploma Institut Pertanian Bogor melalui jalur Ujian Saringan Masuk IPB (USMI), dan lulus pada tahun 2013. Pada tahun yang sama penulis melanjutkan studi S1 di Institut Pertanian Bogor (IPB) melalui jalur tes alih jenis pada Program Studi Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam.

![Gambar 3 Karakteristik K 3[Fe(CN)6] 0.1 M dalam KCl 0.1 M dengan berbagai](https://thumb-ap.123doks.com/thumbv2/123dok/548454.432772/18.595.41.467.61.691/gambar-karakteristik-k-fe-cn-m-kcl-berbagai.webp)