15 cm
Lampiran 3 : Jadwal Kegiatan Penelitian
Penyiraman Disesuaikan Dengan Kondisi Lapangan
Penyulaman Disesuaikan Dengan Kondisi Lapangan
Penyiangan Disesuaikan Dengan Kondisi Lapangan
Lampiran 4. Pembuatan Larutan Kolkhisin Bahan kimia yang digunakan :
1. Kolkhisin 2. Aquadest 3. Gliserin
Tahap - tahap membuat larutan Kolkhisin :
Konsentrasi : 0.025% = 30 tanaman jadi 10 ml x 30 = 300ml Konsentrasi : 0.050% = 30 tanaman jadi 10 ml x 30 = 300ml Konsentrasi : 0.075% = 30 tanaman jadi 10 ml x 30 = 300ml Konsentrasi : 0.100% = 30 tanaman jadi 10 ml x 30 = 300ml Kebutuhan kolkhisin untuk 4 kali aplikasi yaitu :
0.025% x 1200 ml = 0.3 mg 0.050% x 1200 ml = 0.6 mg 0.075% x 1200 ml = 0.9 mg 0.100% x 1200 ml =1.2 mg
Kemudian dibuat larutan stok kolkhisin dengan melarutkan 3 mg kolkhisin dalam 100 ml aquadest. Kemudian diambil larutan berdasarkan konsentrasi sebagai berikut :
0.025% = 0.3 / 3 x 100 = 10 ml 0.050% = 0.6 / 3 x 100 = 20 ml 0.075% = 0.9 / 3 x 100 = 30 ml 0.100% = 1.2 / 3 x 100 = 40 ml
Lampiran 5. Pembuatan Larutan HCl 1 N Bahan kimia yang dibutuhkan :
1. HCl absolut 2. Aquadest
Tahap - tahap membuat larutan stok HCl 1N
- Diambil 4,78 ml HCl absolut kemudian dicampurkan alkohol absolut kedalam 95,22 ml aquadest.
- HCl 1N siap dipakai
Lampiran 6 :Pembuatan Larutan Stok Pewarna Acetocarmin 2% Bahan kimia yang digunakan :
1. Acetocarmin
2. Asam asetat glasial 45% 3. Aquadest
Tahap - tahap membuat larutan stok pewarna Acetocarmin
- Dipanaskan 100 ml asam asetat glasial 45% sampai menguap pada suhu 600 .
- Ditambahkan acetocarmin powder kedalam larutan asam asetat glasial 45%.
- Didihkan selama5-10 menit dan distirer sampai larutan berwarnamerah gelap.
Lampiran 7 : Pembuatan larutan Carnoy 2 Bahan yang dibutuhkan :
1. Asam asetat glasial 2. Kloroform
3. Ethanol
Tahap - tahap membuat larutan carnoy 2 - Disiapkan bahan kimia yang dibutuhkan
- Dicampur 1ml asam asetat glasial + 3 ml kloroform + 6 ml etahnol
Lampiran 8. Data Pengamatan Jumlah Daun (Helai) 2 MST
Perlakuan Ulangan Total Rataan
1 2 3 4 5
K0 5,67 5,33 6,00 5,33 4,67 27,00 5,40
K1 3,33 3,00 3,00 2,67 3,00 15,00 3,00
K2 4,33 3,67 4,33 3,00 3,00 18,33 3,67
K3 2,33 2,00 2,00 4,33 3,33 14,00 2,80
K4 2,00 3,67 3,33 3,00 3,00 15,00 3,00
Total 17,67 17,67 18,67 18,33 17,00 89,33 17,87
Rataan 3,53 3,53 3,73 3,67 3,40 17,87 3,57
Lampiran 9. Sidik Ragam Jumlah daun (Helai) 2 MST
Sumber dB JK KT fh Probability Ket
Ulangan 4 1,01 0,25 0,25 0,9074 tn
Perlakuan 4 69,01 17,25 17,17 0,0001 **
Galat 66 66,32 1,00
Total 74 136,34
Lampiran 10. Data Pengamatan Jumlah Daun (Helai) 3 MST
Perlakuan Ulangan Total Rataan
1 2 3 4 5
K0 9,33 8,33 10,33 8,67 7,33 44,00 8,80
K1 5,33 5,00 4,67 4,00 4,33 23,33 4,67
K2 6,67 5,67 6,67 4,67 5,33 29,00 5,80
K3 4,33 3,00 3,00 6,33 4,67 21,33 4,27
K4 3,33 6,33 6,33 4,67 6,00 26,67 5,33
Total 29,00 28,33 31,00 28,33 27,67 144,33 28,87
Rataan 5,80 5,67 6,20 5,67 5,53 28,87 5,77
Lampiran 11. Sidik Ragam Jumlah daun (Helai) 3 MST
Sumber dB JK KT fh Probability Ket
Ulangan 4 3,94 0,98 0,44 0,7802 tn
Perlakuan 4 192,75 48,18 21,42 0,0001 **
Galat 66 148,45 2,25
Total 74 345,15
Lampiran 12. Data Pengamatan Jumlah Daun (Helai) 4 MST
Perlakuan Ulangan Total Rataan
1 2 3 4 5
K0 11,33 10,33 12,33 10,67 10,67 55,33 11,07
K1 7,33 7,00 7,00 6,33 6,67 34,33 6,87
K2 9,67 8,33 9,33 7,33 9,00 43,67 8,73
K3 6,33 5,67 5,33 8,33 7,67 33,33 6,67
K4 5,33 9,00 8,67 7,33 8,33 38,67 7,73
Total 40,00 40,33 42,67 40,00 42,33 205,33 41,07
Rataan 8,00 8,07 8,53 8,00 8,47 41,07 13,69
Lampiran 13. Sidik Ragam Jumlah daun(Helai) 4MST
Sumber dB JK KT fh Probability Ket
Ulangan 4 4,18 1,04 0,49 0,7448 tn
Perlakuan 4 192,72 48,18 22,44 0,001 **
Galat 66 141,68 2,14
Total 74 338,58
Lampiran 14. Data Pengamatan Jumlah Daun (Helai) 5MST
Ulangan Total Rataan
Perlakuan 1 2 3 4 5
K0 13,67 12,67 14,33 12,67 13,33 66,67 13,33
K1 9,33 9,33 9,33 9,00 9,00 46,00 9,20
K2 12,00 11,33 11,67 10,00 12,33 57,33 11,47
K3 9,00 8,33 7,67 10,33 10,33 45,67 9,13
K4 7,67 11,33 10,67 9,67 10,67 50,00 10,00
Total 51,67 53,00 53,67 51,67 55,67 265,67 53,13
Rataan 10,33 10,60 10,73 10,33 11,13 53,13 10,63
Lampiran 15. Sidik Ragam Jumlah daun (Helai) 5 MST
Sumber dB JK KT fh Probability Ket
Ulangan 4 6,61 1,65 0,78 0,5446 tn
Perlakuan 4 190,34 47,58 22,34 0,0001 **
Galat 66 140,58 2,13
Total 74 337,54
Lampiran 16. Data Pengamatan Bobot Basah Tajuk (g)
Perlakuan Ulangan Total Rataan
1 2 3 4 5
K0 108,00 168,63 135,83 120,30 79,60 612,37 122,47 K1 142,87 63,07 144,83 116,77 105,40 572,93 114,59 K2 168,93 126,90 158,30 156,43 126,13 736,70 147,34 K3 121,37 139,10 85,63 100,47 108,17 554,73 110,95 K4 87,10 124,73 79,60 105,80 108,03 505,27 101,05 Total 628,27 622,43 604,20 599,77 527,33 2982,00 596,40 Rataan 125,65 124,49 120,84 119,95 105,47 596,40 119,28
Lampiran 17. Sidik Ragam Bobot Basah Tajuk (g)
Sumber dB JK KT fh Probability Ket
Ulangan 4 3921,35 980,33 0,94 0,4473 tn
Perlakuan 4
18
318,66 4579,66 4,38 0,0033 **
Galat 66 68939,15 1044,53
Total 74 91179,18
Lampiran 18. Data Pengamatan Bobot Basah Akar (g)
Perlakuan Ulangan Total Rataan
1 2 3 4 5
K0 11,53 15,33 11,73 10,30 6,70 55,60 11,12 K1 11,90 5,37 13,30 10,13 11,17 51,87 10,37 K2 12,50 9,93 12,30 12,67 14,17 61,57 12,31
K3 8,20 12,00 5,93 7,40 10,67 44,20 8,84
K4 5,17 9,53 9,03 11,13 9,67 44,53 8,91
Total 49,30 52,17 52,30 51,63 52,37 257,77 51,55 Rataan 9,86 10,43 10,46 10,33 10,47 51,55 10,31
Lampiran 19. Sidik Ragam Bobot Basah Akar (g)
Sumber dB JK KT fh Probability Ket
Ulangan 4 4,00 1,00 0,06 0,9936 tn
Perlakuan 4 132,05 33,01 1,91 0,1186 **
Galat 66 1138,90 17,25
Total 74 1274,97
Lampiran 20. Data Pengamatan Bobot Kering Tajuk (g)
Perlakuan Ulangan Total Rataan
1 2 3 4 5
K0 49,80 77,33 61,37 59,57 33,30 281,37 56,27 K1 64,00 20,63 62,67 55,37 48,53 251,20 50,24 K2 76,13 68,47 74,47 78,07 64,00 361,13 72,23 K3 50,23 63,73 34,47 50,97 50,67 250,07 50,01 K4 30,40 57,23 87,83 212,47 51,87 439,80 87,96 Total 270,57 287,40 320,80 456,43 248,37 1583,57 316,71 Rataan 54,11 57,48 64,16 91,29 49,67 316,71 63,34
Lampiran 21. Sidik Ragam Bobot Kering Tajuk (g)
Sumber dB JK KT fh Probability Ket
Ulangan 4 868,10 217,02 0,78 0,5403 tn
Perlakuan 4 7350,24 1837,56 6,63 0,0002 **
Galat 66 18292,41 277,15
Total 74 26510,76
Lampiran 22. Data Pengamatan Bobot Kering Akar (g)
Perlakuan Ulangan Total Rataan
1 2 3 4 5
K0 5,07 7,37 5,33 5,27 3,13 26,17 5,23
K1 5,07 2,23 6,53 5,03 5,63 24,50 4,90
K2 6,00 4,63 6,83 6,27 6,90 30,63 6,13
K3 3,67 5,47 2,83 3,40 5,13 20,50 4,10
K4 2,33 4,43 4,03 5,67 4,73 21,20 4,24
Total 22,13 24,13 25,57 25,63 25,53 123,00 24,60
Rataan 4,43 4,83 5,11 5,13 5,11 24,60 4,92
Lampiran 23. Sidik Ragam Bobot Kering Akar (g)
Sumber dB JK KT fh Probability Ket
Ulangan 4 5,50 1,37 0,31 0,8696 tn
Perlakuan 4 40,34 10,08 2,28 0,0699 tn
Galat 66 291,99 4,42
Total 74 337,84
Lampiran 24. Data Pengamatan Ratio Shoot/Root (g)
Perlakuan Ulangan Total Rataan
1 2 3 4 5
K0 10,05 10,87 11,80 12,72 9,88 55,33 11,07
K1 14,30 9,36 13,58 12,78 9,18 59,21 11,84
K2 14,46 15,77 11,43 13,05 9,74 64,44 12,89
K3 13,96 12,80 12,41 18,48 9,68 67,33 13,47
K4 12,85 13,18 8,15 9,37 12,67 56,21 11,24
Total 65,62 61,98 57,37 66,40 51,14 302,51 60,50 Rataan 13,12 12,40 11,47 13,28 10,23 60,50 12,10
Lampiran 25. Sidik Ragam Ratio Shoot/Root (g)
Sumber dB JK KT fh Probability Ket
Ulangan 4 115,64 28,91 1,29 0,3502 tn
Perlakuan 4 69,05 17,26 0,67 0,6120 tn
Galat 66 1689,24 25,59
Total 74 1873,94
Foto Lahan Penelitian
a b
c
DAFTAR PUSTAKA
Acquaah, G. 2007. Principle of plant genetice and breeding, Black well publishing pp 199-213.
Ariyanto,S.E., Parjanto., dan Supriyadi. 2010. Pengaruh Kolkhisin Terhadap Fenotip dan Jumlah Kromosom Jahe (Zingiber officinale Rosc).fakultas Pertanian. Universitas Muria Kudus. ISSN 1979-6870.
Astuti, S.M., Sakinah M.A.M., Andayani, R.B.M., Risch, A., 2011. Determination Of Saponin Compound From Anredera Cordifolia (Ten) Stennis Plant (Binahong) to Potential Treatment For Several Diseases. Journal of Agricultural Science. Vol 3, No 4; Desember 2011.
Azizah, N dan N. Bermawie. 2003. Pengaruh Kolkhisin Terhadap Pertumbuhan dan Produksi Dua Tipe Kencur ( Kaempferia gulanagl Linn). Diakses dari : http:// www. Balitro.go.id/index.php. Pada Tanggal 19 Februari 2015. Balitro. 2006. Rencana dan Strategis Balai Penelitian Tanaman Obat dan
Aromatik 2006 – 2009. Balai Penelitian Tanaman Obat dan Aromatik. Bogor.
BATAN. 2006. Kelompok Pemuliaan Tanaman. Diakses dari http://www.batan.go.id/p3tir/pertanian/pemuliaan/pemuliaan.htm. Pada tanggal 19 Februari 2015.
Crowder, L.V., 1990. Genetika Tumbuhan, penerjemah Lilik Kusdiarti, Penerbit Gajah MadaUniversity Press, Yogyakarta.
Chahal, G.S. and S.S. Gosal, 2002. Principles and Procedures of Plant Breeding Biotechnological and Conventional Approaches. Alpha Science International Ltd.Harrow, U.K, pp.413-428.
Fajrina, A., M.Idris., Mansyurdin dan N. Surya. 2012. Penggandaan Kromosom dan Pertumbuhan Somaklonal Andalas (Morus macroura Miq. Var macroura) yang Diperlakukan dengan Kolkhisin. Jurnal Biologi Universitas Andalas. 1(1) – September 2012 : 23-26.
Haryanti, S; Hastuti, R.B; Setiari, N; dan Banowo A., 2009. Pengaruh Kolkisin Terhadap Pertumbuhan, ukuran Sel Metafase dan Kandungan Protein Biji Tanaman Kacang Hijau (Vigna radiata. L). Sains danTeknologi 10:112-120
Jadrna, P., Plavcova, O., and Kobza, F. 2010. Morphological Changes in Colchicine-Treated pelargonium x hortorum L.H. Bailey Greenhouse Plant. Hort. Science. (Prague), 37: 27-33.
Kottaimuthu, R., R. Ganesan and R. Vijayan. 2011. Anredera cordifolia (Tenore) Stennis (Basellaceae) – a Nem Record For India.departement Of Botany, The American College, Madurai. Elixir Bio Diversity. 40 (2011) 5517-5518.
Priadi, D. P., Emilia, S., dan Halimi, E. S. 2005. Pengaruh waktu perendaman benih dalam larutan colchicine terhadap poliploidi, pertumbuhan dan hasil semangka (Citrullus vulgaris Schard). Tanaman Tropika 8(1):17-21. Loveless, A.R.,1991. Prinsip-Prinsip Biologi Tumbuhan untuk Daerah Tropik,
Jilid 1. Penerbit PT Gramedia Pustaka Utama, Jakarta.
Lukiati, B. 2014. Penentuan Aktivitas Antioksidan Dan Kandungan Fenol Totalekstrak Daun Gendola (Basella Rubra Linn) Dan Daun Binahong (Anredera Cordifolia Stennis) Sebagai Kandidat Obat Herbal. Seminar Nasional Biologi Universitas Negeri Malang. Jawa Timur.
Manoi, F. 2009. Binahong (Anredera cordifolia) Sebagai Obat. Warta Penelitian dan Pengembangan Tanaman Industri. Vol 15 No 1 April 2009. BALITRO. Bogor.
Mardianti, R. 2014. Ekstrak Etanolik Umbi Kembang Sungsang dan Daun Tapak Dara Sebagai Subsitusi Kolkhisin Dalam Meningkatkan Pertumbuhan dan Kualitas Buah Melon. Skripsi. Universitas Bengkulu. Bengkulu.
Nasir, M. 2002. Bioteknologi Molekuler , Teknik Rekayasa Genetik Tanaman.PT Citra Aditya Bakti. Bandung.
Parjanto, S. Moeljopawiro, W.T. Artama dan A. Purwanto. 2003. KaryotipeKromosom Salak. Zuriat. 14 (2) : 21-28.
Poespodarsono, S.1988. Dasar- dasar Ilmu Pemuliaan Tanaman. Pusat Antar Universitas. IPB. Bogor.
Raza, H., M. Jaskani, M. M. Khan and T. A. Malik. 2003. In Vitro Induction of Polyploids in Watermelon and Estimation Based on DNA Content. International Journal of Africulture and Biology 5 (3): 298-302.
Setyawan, A.D dan Sutikno. 2000. Karyotipe Kromosom Pada Allium sativum L.(Bawang Putih) dan Pisum sativum L. (Kacang kapri). Jurnal BioSMART. Vol 2. No.1 Hal 20-27.
Sinaga, E. J., E. S. Bayu dan H. Hasyim. 2014. Pengaruh Konsentrasi Kolkhisin Terhadap Pertumbuhan dan Produksi Kacang Hijau (Vigna radiata L.). Jurnal Online Agroekoteknologi Vol 2, No 3; 1238- 1244. Juni 2014. ISSN No 2337-6597.
Smith, G.V., B.E. Lawson., I. Tumbull and P.O.Downey. 2007. The Biology Of Australian Weeds 46. (Anredera cordifolia (Ten.) Steenis). Plant Protection Quarterly Vol 22 (1) 2007.
Steel, R.G dan J.H. Torrie, 1993. Prinsip Dan Prosedur Statiska (Pendekatan Biometric) Penerjemah B. Sumantri. Gramedia Pustaka Utama, Jakarta. Suharni, S. 2004. Evaluasi Morologi, Anatomi, Fisiologi Dan Sitologi Tanaman
Rumput Pakan Yang Medapat Perlakuan Kolkhisin. Tesis. Universitas Diponegoro. Semarang.
Sulistianingsih, R. 2006. Peningkatan Kualitas Anggrek Dendrobium Hibrida
dengan Pemberian Kolkhisin. Diakses melalui
http://www.agrisci.ugm.ac.id/abdi10/klinik.htm. Pada tanggal 17 April 2014.
Sulistyaningsih, E. 2004. Fertilitas Tanaman Bawang Merah Double Haploid. Jurnal Ilmu Pertanian.Vol 11. No 1. Hal 1-6.
Suminah, Sutarno dan A. D.Setyawan. 2002. Induksi Poliploidi Bawang Merah (Allium ascalonicum L.) dengan Pemberian Kolkhisin. Jurnal Biodiversitas Volume 3.No 1. Hal 174-180.
Suryo, 1995. Sitogenetika. Gadjah Mada University Press. Yogyakarta.
Starr, F. K. Starr & Loope. 2003. Anredera cordifolia Madeira vine. United States Geological Survey – Biological Resources Division Haleakala Field Station; 1-6.
Syafni. 2013. Mutasi Anggrek Dendrobium. Agroinovasi. Edisi 25 September – 1 Oktober 2013 No 3525 Tahun XLIV.Badan Penelitian dan Pengembangan Pertanian
Tatik., T. Rahayu., M. Ihsan. 2014. Kajian Perbanyakan Vegetatif Tanaman Binahong (Anredera cordifolia (Ten.) Steenis) Pada Beberapa Media Tanam. Jurnal Agronomika, Vol 09, No 02. Februari – Juli 2014.
Wang, Y. F., Xi . Y. L., Wei, Z. C and Lu, W. Z. 1989. The Effects of Gamma rays and Colchicine on Mutagenesis in Somaclonal of Lilium davidii var willmottiae. Jiangsu-Journal-of-Agricultural-science 5 : 31-37.
Wiendra,N.M.S., M. Pharmawati dan N.P.A. Astiti. 2011. Pemberian Kolkhisin dengan Lama Perendaman Berbeda Pada Induksi Poliploidi Tanaman Pacar Air (Impatiens balasamina L.). jurnal biologi Vol XV No 1 Hal ; 9-14.
Wulandari,A.S dan T.R. Wijaya. 2015. Analisis Kromosom Tanaman Jati (Tectona grandisL.) dengan Metode Pewarnaan. Jurnal Silvikultur Tropika. Vol 06 No 1. April 2015.
BAHAN DAN METODE PENELITIAN Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di lahan Percobaan Fakultas Pertanian dan Laboratorium Kultur Jaringan Tanaman Universitas Sumatera Utara Medan dengan ketinggian tempat + 25 meter diatas permukaan laut, mulai bulan Mei sampai Desember 2015.
Bahan dan Alat
Bahan yang digunakan dalam penelitian antara lain bahan tanam umbi ketiak daun dari binahong dengan diameter 2,5-3 cm, kolkhisin, pupuk kandang sapi, topsoil, air, polybag, bambu, plastik putih, label, HCl 1N, aquadest, dd-H20,
larutan carnoy 2 (6 ethanol : 3 asam asetat glacial : 1 kloroform), acetocarmin 2%, gliserin.
Alat yang digunakan dalam penelitian antara lain timbangan analitik, ayakan, cangkul, mistar, meteran, handsprayer, gembor, tali, kamera, preparat, dek glass dan alat-alat tulis.
Metode Penelitian
Penelitian ini menggunakan Rancangan Acak Kelompok (RAK) satu faktor dengan 5 perlakuan dan 5 ulangan yaitu :
Faktor : Konsentrasi Kolkhisin(K) yang terdiri dari 4 taraf, yaitu : K0 = Kontrol
K1 = 0.025%
K2 = 0.050%
K3 = 0.075%
Jumlah ulangan (Blok) : 5 ulangan Jumlah tanaman seluruhnya : 150 tanaman
Jumlah sampel : 3 tanaman
Data hasil penelitian dianalisis dengan menggunakan sidik ragam berdasarkan model linier sebagai berikut:
Yij = μ + ρi + αj + ∑ij
Yij = Hasil pengamatan pada blok ke-i akibat perlakuan kolkhisin pada taraf ke-j
μ = Nilai tengah
ρi = Efek dari blok ke-i
αj = Efek perlakuan kolkhisin pada taraf ke-j
∑ij = Galat percobaan dari blok ke-i dan kolkhisin pada taraf ke-j
PELAKSANAAN PENELITIAN Pembuatan Naungan danPersiapan Media Tanam
Naungan disiapkan dengan ukuran panjang : lebar : tinggi (10 m x 5 m x 2m). Pembuatan naungan dilakukan satu minggu sebelum penanaman binahong. Persiapan media tanam dilakukan dengan mencampurkan tanah dan pupuk kandang sapiyang sesuai komposisi dan diaduk merata kemudian dimasukkan ke dalam polybag. Media tanam kemudian disusun kedalam naungan sesuai dengan denah rancangan percobaan.
Persiapan Bahan Tanam
Bagian tanaman yang diambil untuk perbanyakan berasal dari umbi ketiak daun pada tanaman induk yang memiliki kondisi baik dan seragam dengan diameter + 2,5-3 cm.
Penanaman
Penanaman dilakukan dengan cara menanam umbi ketiak daun kedalam media tanam yang dilubangi secara tugal dengan kedalaman 2 cm kemudian ditekan agar menjadi lebih padat, kemudian disiram dengan air bersih dan ditempatkan dibawah naungan. Setelah seminggu penanaman tanaman dipindahkan ke polybag yang berukuran 3kg.
Aplikasi Kolkhisin
Pemeliharaan Penyiraman
Penyiraman dilakukan setiap hari diperlukan dengan melihat kondisi media tanam karena tanaman berada di dalam naungan.
Penyulaman
Penyulaman dilakukan selama tanaman berumur 2 MST. Penyulaman dilakukan pada tanaman yang tidak tumbuh atau pertumbuhannya tidak baik. Bahan sisipan diambil dari bibit tanaman cadangan yang sama pertumbuhannya dengan tanaman di lapangan.
Pengajiran
Pengajiran dilakukan pada saat tanaman berumur 5 MST. Pengajiran dilakukan untuk menyangga tanaman dan sebagai tempat membelitnya sulur tanaman.
Penyiangan
Penyiangan dilakukan 1-2 kali seminggu mulai dari penanaman sampai tanaman berumur 12 MST dengan cara manual dengan membersihkan gulma yang ada di lahan penelitian.
Pengendalian Hama dan Penyakit
Analisis Kromosom Pra Perlakuan
Ujung akar dipotong 3-5 mm kemudian dicuci dengan aquadest dan dimasukkan kedalam botol yang berisi dengan dd-H2O lalu ditutup dengan kertas
aluminium foil dan disimpan dalam lemari es selama 12-24 jam. Fiksasi
Ujung akar yang telah di rendam dengan dd-H2O kemudian dicuci dengan
menggunakan aquadest, lalu ujung akar difiksasi dengan menggunakan larutan carnoy 2 dan disimpan didalam refrigerator dengan suhu 50 selama 3-4 jam. Hidrolisis
Ujung akar yang telah difiksasi kemudian dicuci dengan aquadest sebanyak 3 kali. Kemudian di rendam dengan HCl 1N dan disimpan didalam oven bersuhu 600C selama +2 menit.
Pewarnaan
Ujung akar yang telah difiksasi dicuci dengan aquadest sebanyak 3 kali, lalu di rendam dengan acetocarmin 2% selama 1-3 jam dan disimpan di suhu ruangan.
Squashing
Diambil ujung akar yang telah diwarnai lalu diletakkan diatas gelas benda dan dipotong hingga tersisa 1-2 mm dari ujung kemudian ditetesi dengan gliserin lalu ditutup dengan gelas penutup dan diketuk-ketuk hingga hancur merata.
Penyegelan
Pengamatan
Pengamatan dilakukan dengan menggunakan mikroskop cahaya lalu dilihat kromosomnya. Preparat yang baik dipotret dengan menggunakan kamera mikrofotografi.
Pengamatan Parameter Morfologi Jumlah Daun (helai)
Pengamatan jumlah daun dilakukan setiap minggu mulai 2 MST. Daun yang dihitung adalah daun yang telah membuka sempurna (terbuka penuh) dan sehat.
Bobot Basah Tajuk (g)
Pengukuran bobot basah bagian atas dilakukan pada akhir penelitian yaitu setela tanaman berumur 12 MST. Perhitungan dilakukan dengan cara membersihkan bahan tanaman dengan air, kemudian dikering anginkan terlebih dahulu, lalu ditimbang dengan timbangan.
Bobot Basah Akar (g)
Pengukuran berat akar segar dilakukan pada akhir penelitian yaitu setelah tanaman berumur 12 MST. Perhitungan dilakukan dengan cara membersihkan bahan tanaman dengan air, kemudian dikering anginkan terlebih dahulu, lalu ditimbang dengan timbangan.
Bobot Kering Tajuk (g)
700 C selama 48 jam kemudian ditimbang dengan timbangan analitiksehingga diperoleh berat tajuk kering yang konstan.
Bobot Kering Akar (g)
Perhitungan berat akar kering dilakukan pada akhir penelitian yaitu setelah tanaman berumur 12 MST. Perhitungan dilakukan dengan cara mengering ovenkan bagian akar tanaman yang telah dihitung berat akar segarnya pada suhu 700 C selama 48 jam kemudian ditimbang dengan timbangan analitiksehingga diperoleh berat tajuk kering yang konstan.
Ratio Shoot / Root (g)
Perhitungan ratio shoot / root dihitung pada akhir penelitian yaitu setelah tanaman berumur 10 MST. Perhitungan dilakukan dengan cara mongering ovenkan bagian atas dan bawah tanamanpada suhu 700 C selama 48 jam kemudian ditimbang dengan timbangan analitiksehingga diperoleh ratio shoot/ root yang konstan
Parameter Pengamatan Kromosom Jumlah Kromosom
Kromosom yang tampak pada pengamatan dengan mikroskop dipotret dan dari hasil cetakan dapat dihitung jumlah kromosomnya
Ukuran Kromosom
Ukuran kromosom terdiri atas panjang lengan panjang (q) dan panjang lengan pendek (p) dan panjang total (q + p). Pengukuran panjang kromosom
dilakukan berdasarkan skala objek mikrometer. Skala yang digunakan 5 μm
Bentuk Kromosom
Bentuk kromosom ditentukan berdasarkan rasio lengan kromosom (r = q / p). Penggolongan bentuk kromosom mengikuti cara Ciupercescu et al. (1990) dalam Parjanto et al. (2003).
Karyotipe
HASIL DAN PEMBAHASAN Hasil
Berdasarkan hasil sidik ragam yang diperoleh diketahui bahwa konsentrasi kolkhisin berpengaruh nyata terhadap pengamatan parameter jumlah daun (h), perkembangan bobot basah tajuk, bobot basah akar , bobot kering tajuk serta bobot kering akar tanaman (g).
1. Jumlah daun (helai)
Data hasil pengamatan dan sidik ragam dari jumlah daun dapat dilihat pada lampiran 8-15. Sidik ragam menunjukkan bahwa konsentrasi pemberian kolkhisin berpengaruh nyata terhadap parameter jumlah daun.
Tabel 1. Rataan Jumlah Daun (helai) 2 MST
Perlakuan Jumlah daun berbedanyata menurut uji Duncan's Multiple Range Test pada taraf 5%
Berdasarkan Tabel 1 dapat dilihat bahwa perlakuan K0 berbeda nyata dengan perlakuan K1, K2, K3 dan K4. Perlakuan K2 berbeda nyata dengan K3 tetapi tidak berbeda nyata terhadap perlakuan K1 dan K4.
Tabel 2. Rataan Jumlah Daun (helai) 3 MST
Berdasarkan Tabel 2 dapat dilihat bahwa perlakuan K0 berbeda nyata dengan perlakuan K1, K2, K3 dan K4. Perlakuan K2 berbeda nyata dengan perlakuan K3 tetapi tidak berbeda nyata dengan perlakuan K1 dan K4.
Tabel 3. Rataan Jumlah Daun (helai) 4 MST
Perlakuan Jumlah daun Keterangan : Angka-angka yang diikuti oleh notasi yang sama pada kolom yang sama tidak berbeda nyata menurut Duncan's Multiple Range Test pada taraf 5%
Berdasarkan Tabel 3 dapat dilihat bahwa perlakuan K0 berbeda nyata dengan perlakuan K1, K2, K3 dan K4. Perlakuan K2 berbeda nyata dengan perlakuan K1 dan K3 tetapi tidak berbeda nyata dengan perlakuan K4.
Tabel 4. Rataan Jumlah Daun (helai) 5 MST
Perlakuan Jumlah daun berbeda nyata menurut Duncan's Multiple Range Test pada taraf 5%
2. Bobot Basah Tajuk (g)
Data hasil pengamatan dan sidik ragam dari bobot basah tajuk dapat dilihat pada lampiran 16-17. Sidik ragam menunjukkan bahwa konsentrasi pemberian kolkhisin berpengaruh nyata terhadap parameter bobot basah tajuk tanaman.
Tabel 5. Rataan Bobot Basah Tajuk
Perlakuan Bobot Basah Tajuk (g)
K2 (0.050%) 147.340a
K0 (kontrol ) 122.470b
K1 (0.025%) 114.590b
K3 (0.075%) 110.950b
K4 (0.100%) 101.050b
Keterangan : Angka-angka yang diikuti oleh notasi yang sama pada kolom yang sama tidak berbeda nyata menurut Duncan's Multiple Range Test pada taraf 5%
Gambar 2 : Bobot basah tajuk binahong dari semua perlakuan kolkhisin (K0: kontrol, K1: 0.025%, K2 : 0.050%, K3 : 0.075%, K4: 0.100%
3. Bobot Basah Akar (g)
Data hasil pengamatan dan sidik ragam dari bobot basah akar dapat dilihat pada lampiran18-19. Sidik ragam menunjukkan bahwa konsentrasi pemberian kolkhisin berpengaruh tidak nyata terhadap parameter bobot basah akar.
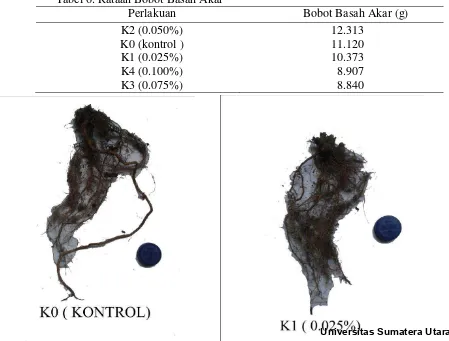
Tabel 6. Rataan Bobot Basah Akar
Perlakuan Bobot Basah Akar (g)
4. Bobot Kering Tajuk (g)
Data hasil pengamatan dan sidik ragam dari bobot kering tajuk dapat dilihat pada lampiran 20-21. Sidik ragam menunjukkan bahwa konsentrasi pemberian kolkhisin berpengaruh nyata terhadap parameter bobot kering tajuk tanaman.
Tabel 7. Rataan Bobot Kering Tajuk
Perlakuan Bobot Kering Tajuk (g)
K2 (0.050%) 72.227a berbeda nyata menurut uji Duncan's Multiple Range Test pada taraf 5%
Berdasarkan Tabel 4 dapat dilihat bahwa perlakuan K2 memiliki bobot kering tajuk terbesar dan berbeda nyata dengan bobot kering tajuk pada perlakuan K0, K1, K3 dan K4. Sedangkan perlakuan K0 tidak berbeda nyata dengan perlakuan K1dan K3 tetapi berbeda nyata dengan perlakuan K4.
5. Bobot Kering Akar (g)
Data hasil pengamatan dan sidik ragam dari bobot kering akar dapat dilihat pada lampiran 22-23. Sidik ragam menunjukkan bahwa konsentrasi pemberian kolkhisin berpengaruh tidak nyata terhadap parameter bobot kering akar.
Tabel 8. Rataan Bobot kering Akar
Perlakuan Bobot Kering Akar (g)
K2 (0.050%) 6.127
K0 (kontrol) 5.233
K1 (0.025%) 4.900
K4 (0,100%) 4.240
6. Ratio Shoot/Root (g)
Data hasil pengamatan dan sidik ragam dari ratio shoot/root dapat dilihat pada lampiran 24-25. Sidik ragam menunjukkan bahwa konsentrasi pemberian kolkhisin berpengaruh tidak nyata terhadap parameter ratio shoot/root.
Tabel 9. Rataan Ratio Shoot/Root
Perlakuan Ratio Shoot/Root
K3 (0.075%) 13.467
K2 (0.050%) 12.886
K1 (0.025%) 11.520
K4 (0.100%) 11.243
K0 (kontrol ) 11.065
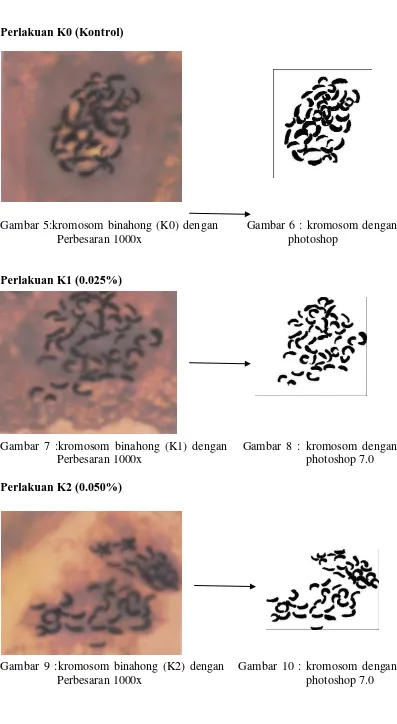
Pengamatan Kromosom Jumlah Kromosom
Tabel 10. Jumlah Kromosom
Perlakuan Jumlah kromosom (pasang)
K0 (kontrol ) 22
K1 (0.025%) 23
K2 (0.050%) 23
K3 (0.075%) 24
K4 (0.100%) 26
Tabel7menunjukkan bahwa pada masing-masing perlakuan, jumlah kromosom mengalami perubahan dimana konsentrasi kolkhisin telah berpengaruh terhadap parameter pengamatan jumlah kromosom.
Perlakuan K0 (Kontrol)
Gambar 5:kromosom binahong (K0) dengan Gambar 6 : kromosom dengan
Perbesaran 1000x photoshop
Perlakuan K1 (0.025%)
Gambar 7 :kromosom binahong (K1) dengan Gambar 8 : kromosom dengan
Perbesaran 1000x photoshop 7.0
Perlakuan K2 (0.050%)
Gambar 9 :kromosom binahong (K2) dengan Gambar 10 : kromosom dengan
Perlakuan K3 (0.075%)
Gambar 11: kromosom binahong (K3) dengan Gambar 12 : kromosom dengan
Perbesaran 1000x photoshop 7.0
Perlakuan K4 (0.1%)
Gambar 13 :kromosom binahong (K4) dengan Gambar 14: kromosom dengan
Perbesaran 1000x photoshop 7.0
Ukuran dan Bentuk Kromosom
menunjukkan bahwa kromosom binahong pada masing- masing perlakuan berbentuk metasentrik dan submetasentrik.
Tabel 11. Ukuran dan Bentuk Kromosom Pada Perlakuan K0 (Kontrol) Pasangan lengan panjang dan lengan pendek (µm).
(pasangan kromosom nomor 1,2,3,4,5,6,7, 9 ,10 ,11, 14, 15, 16, 17, 18, 21,dan 22) dan bentuk sub metasentrik (pasangan kromosom nomor 8, 12,13, 19, dan 20).
Tabel 12. Ukuran dan Bentuk Kromosom Pada Perlakuan K1 (0.025%) Pasangan
(µm), (p+q) = Panjang total kromosom (µm), C= Rasio panjang lengan panjang dan lengan pendek (µm).
tanamanbinahong pada perlakuan 0.025% menunjukkan bahwa kromosomnya berbentuk metasentrik (pasangan kromosom nomor 1, 2 ,3 ,4 ,5 ,6 ,7, 8,9 ,10 ,11, 14, 15, 16, 17, 18, 19, dan 23) dan bentuk sub metasentrik (pasangan kromosom nomor 12, 13, 21, dan 22).
Tabel 13. Ukuran dan Bentuk Kromosom Pada Perlakuan K2 (0.050%) Pasangan
(µm), (p+q) = Panjang total kromosom (µm), C= Rasio panjang lengan panjang dan lengan pendek (µm)
adalah 0.65+ 0.62 µm. Berdasarkan perhitungan nisbah lengan kromosom, tanaman binahong pada perlakuan K2(0.075%) menunjukkan bahwa kromosomnya berbentuk metasentrik (pasangan kromosom nomor 1, 2, 3, 4, 5, 6, 7, 8, 9, 10,11, 15, 16, 17, 18, 19, 20,21, 22, dan 23) dan bentuk sub metasentrik (pasangan kromosom nomor 12, 13, dan 14).
Tabel 14. Ukuran dan Bentuk Kromosom Pada Perlakuan K3 (0.075%) Nomor lengan panjang dan lengan pendek (µm)
adalah 1.74 + 1.76 µm sementara itu kisaran panjang lengan panjang kromosom adalah 1.09 + 1.07 µm sedangkan kisaran panjang lengan pendek kromosom adalah 0.66 + 0.68 µm. Berdasarkan perhitungan nisbah lengan kromosom, tanaman binahong pada perlakuan 0.075% menunjukkan bahwa kromosomnya berbentuk metasentrik (pasangan kromosom nomor 1, 2, 3,5, 6, 7, 8, 9, 10, 11, 12, 16, 18, 19, 20, 21,22, 23 dan 24) dan bentuk sub metasentrik (pasangan kromosom nomor 4, 13, 15, 17).
Keterangan : q = Panjang lengan panjang (µm) , p = Panjang lengan pendek (µm), (p+q) = Panjang total kromosom (µm), C= Rasio panjang lengan panjang dan lengan pendek (µm).
Tabel 15 menunjukkan hasil pengukuran panjang kromosom pada perlakuan K4 (0.1%) menunjukkan bahwa kisaran panjang total kromosom adalah 1.68 + 1.74 µm sementara itu kisaran panjang lengan panjang kromosom adalah 1.05 + 1.07 µm sedangkan kisaran panjang lengan pendek kromosom adalah 0.62 + 0.66 µm. Berdasarkan perhitungan nisbah lengan kromosom, tanaman binahong pada perlakuan 0.1% menunjukkan bahwa kromosomnya berbentuk metasentrik (pasangan kromosom nomor 1,2, 3, 4, 5, 7, 8, 9, 10, 11, 12,14, 18, 20,21, 22, 25 dan 26 ) dan bentuk submetasentrik (pasangan kromosom nomor 6, 13, 15, 16, 17, 19, 23 dan 24).
Karyotipe KromosomPada Masing-Masing Perlakuan
Berdasarkan jumlah kromosom binahong pada hasil penelitian dapat disusun karyotipe susunan kromosom binahong yaitu sebagai berikut :
Gambar 16 : Karyotipe pada perlakuan K1 (0.025%) yaitu 2n+ = 23 pasang Susunan karyotipe pada gambar dapat ditentukan rumus karyotipe tanaman binahong pada perlakuan K1 (0.025%) . Rumus karyotipenya yaitu = 2n =19m +4sm dengan m = kromosom metasentrik dan sm = kromosom submetasentrik.
Gambar 18 : Karyotipe pada perlakuan K3 (0.075%)yaitu 2n+ = 24 pasang Berdasarkan susunan karyotipe pada gambar dapat ditentukan rumus karyotipe tanaman binahong pada perlakuan K3(0.075%) . rumus karyotipenya yaitu = 2n =19m +5sm dengan m = kromosom metasentrik dan sm = kromosom submetasentrik.
Gambar 19 : Karyotipe pada perlakuan K4 (0.1%)yaitu 2n+ = 26 pasang
Berdasarkan susunan karyotipe pada gambar dapat ditentukan rumus karyotipe tanaman binahong pada perlakuan K4 (0.1%) . rumus karyotipenya yaitu = 2n =18m +8sm dengan m = kromosom metasentrik dan sm = kromosom submetasentrik.
Pembahasan
analisis menunjukkan rataan jumlah daun tertinggi pada minggu ke 1 terdapat pada perlakuan K0 (kontrol) yaitu sebesar 5.400 helai kemudian bertambah rendah yaitu perlakuan K2 (0.050%) sebesar 3.667 helai, K1 dan K4 sebesar 3.000 helaidan yang terendah yaitu pada perlakuan K3 sebesar 2.800 helai. Hal ini diduga bahwa pemberiankolkhisin mempengaruhi pembelahan sel pada tanaman sehingga berpengaruh pada jumlah daun yang dihasilkan. Suryo (2007) menyatakan dengan bertambahnya jumlah kromosom menyebabkan tekanan osmotik sel-sel berkurang sehingga pembelahan sel menjadi terlambat dan masa vegetatif menjadi lebih panjang . Hal ini sesuai dengan literatur Mardianti (2004) yang meyatakan bahwa kolkhisin akan efektif apabila diteteskan atau direndam pada saat sel membelah. Sebab kolkhisin akan diserap oleh sel dan mempengaruhi pembelahan sel yang sedang berlangsung dan penetesan sebaiknya dilakukanpada sore atau pagi hari disaat suhu udara rendah dan kelembabannya tinggi sehingga lebih mengefektifkan pemberian kolkhisin.
diberikan maka semakin menurunkan jumlah daun. Aryanto (2010) menyatakan terjadinya hambatan pertambahan jumlah daun pada tanaman akibat perlakuan kolkhisin hanya pada awal pertumbuhan sampai umur 1 bulan selanjutnya tidak ada hambatan. Hal ini sesuai dengan literatur Haryanti et al (2009) menyatakan bahwa perlakuan konsentrasi kolkhisin pada tanaman pacar air menurunkan jumlah daun yang nyatayaitu pada 0% menghasilkan jumlah daun sebesar 7.80 tangkai dan pada konsentrasi 0.20% memiliki 5,2 tangkai. Pada penelitian Sinaga (2014) juga menyebutkan bahwa kacang hijau yang diinduksi dengan kolkhisin berpotensi menurunkan jumlah daun, pada taraf 0% memberikan rataan terbesar yaitu 11.75 tangkai dan terendah pada taraf 0.16% yaitu 5.75 tangkai.
Berdasarkan data secara statistik menunjukkan bahwa pemberian kolkhisin memberikan pengaruh terhadap bobot basah akar. Pada perlakuan K2 (0.050%) memiliki rataan tertinggi sebesar 12.313 dan tidak nyata dengan perlakuan K0 (kontrol), K1 (0.025%), K3(0.075%) dan K4 (0.1%). Hal ini menunjukkan bahwa pemberian kolkhisin dengan metode penetesan pada pucuk (titik tumbuh) tanaman belum memberikan hasil yang baik terhadap bobot basah akar. Hal ini diduga bahwa pemberian kolkhisin menyebabkan pembentukan akar menjadi lebih lama.Hal ini sesuai dengan literatur Fajrina et al (2012) menyatakan bahwa Perlakuan kolkisin menyebabkan rentang waktu inisiasi akar menjadi lebih panjang. Hasil yang didapatkan pada tanaman andalas memperlihatkan bahwa semakin tinggi konsentrasi kolkisin menyebabkan semakin lambatnya inisiasi awal pada akar dengan waktu perendaman yang sama. Hal ini memperkuat dugaan bahwa konsenrasi kolkisinlah yang paling berpengaruh terhadap waktu inisiasi akar dibandingkan dengan lamanya perendaman pada kolkisin..
mengakibatkan reaksi fotosintesisberlangsung lebih maksimum. Pada daun yang lebih besar, penyerapan sinar matahari berlangsung lebih maksimaldibandingkan daun yang ukurannya lebih kecil padalingkungan intensitas cahaya matahari maksimal.Hal ini sesuai dengan literatur Lovelles (1991) yang menyatakan bahwa daun yang lebih banyak akan tumbuh lebih cepat karena mampu menghasilkan bahan kering yang lebih banyak jumlah klorofil yang banyak sebagai pigmen utama dalam proses fotosintesis sehingga bahan kering dapat ditimbun tanaman lebih banyak.
Berdasarkan hasil analisis secara statistik menunjukkan bahwa pemberian kolkhisin menunjukkan pengaruh yang tidak nyata pada parameter bobot kering akar. Pada perlakuan K2 (0.050%) memiliki rataan tertinggi yaitu 6.127 yang tidak nyata dengan perlakuan yang lain. Hal ini diduga bahwa pemberian kolkhisin belum memberikan hasil yang baik pada bobot kering akar karena terhambatnya pertumbuhan akar akibat pemberian kolkhisin sehingga menghasilkan berat basah akar yang rendah dan mengakibatkan berat kering akar yang rendah pula. Hal ini sesuai dengan literatur Razaet al (2003)menyatakan bahwa pemberian kolkhisin akan menyebabkan terhambatnya pembentukan akar. Peningkatan konsentrasi kolkhisin menyebabkan semakin rendahnya persentase pembentukan akar.
ini diduga bahwa kolkhisin berpengaruh positif pada pertumbuhan tajuk yang sedangkan perkembangan akar tanaman terhambat akibat pemberian kolkhisin. Hal ini didukung oleh literatur Avery et al (1999) dalam Wiendra et al (2011) menyatakan perubahan yang terjadi padatanaman akibat pemberian kolkhisin sangat bervariasi.Kolkhisin yang diberikan pada setiap individu tanamantidak mempengaruhi semua sel tanaman, tetapi hanyasebagian sel-sel saja. Adanya pengaruh yang berbeda padasel-sel tanaman disebabkan kolkhisin hanya efektif padasel yang sedang aktif membelah.
Berdasarkan hasil penelitian diketahui bahwa pemberian konsentrasi kolkhisin 0.050% memberikan karakter morfologi yang lebih baik mulai dari bobot basah dan kering baik tajuk maupun akarnya dengan rataan bobot basah tajuk sebesar 147.340 gram bobot kering tajuk sebesar 72.327 gram, bobot basah akar sebesar 12.313gram dan bobot kering akar sebesar 6.127gram. Hal ini diduga bahwa konsentrasi kolkhisin yang digunakan tepat sehingga memperlihatkan penampilan yang berbeda nyata. Sifat morfologi tanamannya tampak jauh lebih besar dibandingkan dengan kontrol yang merupakan dampak dari pembesaran sel akibat dari bertambahnya kromosom karena pemberian kolkhisin. Hal ini sesuai dengan literatur Suryo (1995) yang menyatakan bahwa tanaman yang bersifat poliploid menghasilkan ukuran morfologi lebih besar dibandingkan tanaman diploid. Kolkisin akan bekerja efektif pada konsentrasi 0,01-1 ppm untuk jangka waktu berbeda dan setiap jenis tanaman memiliki respon yang berbeda-beda
lebih kelihatan berwarna hijau. Bobot tajuk yang lebih besar pada perlakuan K2 (0.050%) memiliki nilai positif bagi pertumbuhan tanaman.Wiendra et al (2011) menyatakan bahwa daun yang lebih besar mengakibatkan reaksi potosintesis berlangsung lebih maksimum dan sifat-sifat fisiologi pada tanaman poliploid akan mengalami perubahan seiring dengan meningkatnya ukuran sel tanaman. Perubahan itu akan tampak pada pertumbuhan dan perkembangan tanaman secara keseluruhan.
Berdasarkan data analisis secara statistik diketahui bahwa konsentrasi kolkhisin pada taraf (0.075 %) dan (0.100%) belum berpengaruh terhadap semua parameter yang diamati. Hal ini menunjukkan bahwa konsentrasi kolkhisin dan penetesan kolkhisin yang digunakan belum belum dalam keadaan yang tepat sehingga belum menunjukkan pengaruh yang nyata terhadap perubahan morfologi tanaman yang diamati. Hal ini sesuai dengan literatur Suryo (1995) yang menyatakan bahwa jika konsentrasi dan lamanya waktu perlakuan kurang mencapai keadaan yang tepat maka poliploidi belum dapat diperoleh. Sebaliknya jika konsentrasinya terlalu tinggi atau waktunya perlakuan terlalu lama, maka kolkhisin akan memperlihatkan pengaruh negatif yaitu penampilan tanaman menjadi jelek, sel-sel banyak yang rusak atau bahkan menyebabkan matinya tanaman.
pada penelitian Haryanti, et al. (2009) dimana konsentrasi 0%, 0,10%, 0,15%, 0,20% pada tanaman pacar air menghasilkan jumlah daun yang nyata yaitu pada 0% menghasilkan jumlah daun sebesar 7,80 tangkai dan pada konsentrasi 0,20% sebesar 5,20 tangkai.
Berdasarkan hasil penelitian diketahui daun dan batang menjadi lebih besar dan warnanya lebih kelihatan berwarna hijau. Tajuk tanaman lebih besar dan banyak dibandingkan dengan perlakuan kontrol. Ukuran daun yang lebih besar pada perlakuan kolkhisin 0.050% memiliki nilai positif bagi pertumbuhan tanaman binahong. Daun yang lebih besar mengakibatkan reaksi fotosintesis berlangsung lebih maksimum. Pada daun yang lebih besar, penyerapan sinar matahari berlangsung lebih maksimal dibandingkan daun yang ukurannya lebih kecil padalingkungan intensitas cahaya matahari maksimal. Hal ini sesuai dengan literatur Suryo (1995) yang menyatakan bahwa tanaman yang diberikan perlakuan dengan kolkhisinmemiliki penampilan yang berbeda nyata. Sifat morfologitanaman tampak jauh lebih besar dibandingkan dengankontrol yang merupakan dampak dari pembesaran selakibat dari bertambahnya kromosom karena pemberiankolkhisin.
K2 yang memberikan respon yang terbaik pada bobot basah dan kering akar dari tanaman binahong. Hal ini sesuai dengan literatur Wanget al (1989) yang menyatakan bahwa efek penghambat dari kolkhisin pada bahan tanaman menunjukkan variasi ketebalan daun, warna daun, ukuran umbi dan karakteristik yang lain.
Pengaruh Kolkhisin Terhadap Kromosom Tanaman Binahong
Berdasarkan hasil penelitian diketahui bahwa pemberian kolkhisin telah berpengaruh terhadap perubahan jumlah kromosom. Dimana jumlah kromosom pada perlakuan K0 (kontrol) adalah 2n = 22, K1 adalah 2n+= 23, K2 adalah 2n+= 23, K3 adalah 2n+= 24 pasangsedangkan perlakuan K4adalah 2n+= 26 pasang. Berdasarkan hasil pengamatan tersebut maka terbukti bahwa pemberian kolkhisin mampu menginduksi tanaman menjadi poliploid. Halini sesuai dengan literaturChahaldan Gossal(2002) yang menyatakan bahwa poliploidi dapat dibedakan atas euploid dan aneuploid . Pada kondisi euploid, jumlah kromosom merupakan kelipatankromosom dasar (x), dapat secara autopoliploid. Variasi euploid yang dapat terjadi adalah:triploid (3x), tetraploid (4x), pentaploid (5x), heksaploid (6x), septaploid (7x), oktaploid (8x)dan seterusnya. Pada kondisi aneuploid, perubahan kromosom hanya melibatkan sebagiandari jumlah kromosom dasar, yakni satu atau beberapa kromosom dari genom di tambah ataudi kurangi. Variasi aneuploid yang dapat terjadi adalah: monosomik (2n-1), nullisomik (2n-2), trisomik (2n+1) dan tetrasomik (2n+2).
disebabkan pemberian kolkhisin dengan konsentrasi yang tinggi dapat mencegah terbentuknya benang-benang mikrotubuli dari gelendong inti. Tetapi semakin banyak mengganda kromosom maka memperlihatkan sifat tanaman yang kurang baik, yaitu jumlah daun yang sedikit dan morfologi daun yang lebih kecil-kecil dibandingkan dengan perlakuan yang lain. Halini sesuai dengan literatur Sulistyaningsih (2006) yang menyatakan bahwa kolkhisin dapat menyebabkan poliploidi dimana organisme memiliki tiga set atau lebih kromosom dalam sel-selnya, sehingga tanaman menjadi lebih kekar, bagian tanaman lebih besar sehingga sifat yang kurang baik akan menjadi lebih baik jika konsentrasi dan lama perendaman yang digunakan dalam keadaan yang tepat, tetapi jika konsentrasi dan lama perendaman yang kurang tepat dapat juga merubah sifat tanaman menjadi sebaliknya dimana tanaman tampak dalam keadaan yang jelek.
satu bagian kromosom.Duplikasi adalah penambahan kromosom.Inversi adalah penyisipan kembali gen-gensecara terbalik. Translokasi adalah pindahnyasuatu bagian kromosom ke kromosom lainyang bukan homolognya.
Berdasarkan hasil penelitian diketahui bahwa kromosom yang terpanjang adalah pada perlakuan K0(kontrol) yaitu 3.1µm dengan bentuk kromosom metasentrik dengan panjang lengan panjang (q) 1.9µm dan lengan pendek (p) 1.2 µm, sedangkan kromosom terpendek juga terdapat pada perlakuan K0(kontrol) yaitu 0.8µm dengan bentuk kromosom metasentrik dengan panjang lengan panjang (q) 0.5µm dan lengan pendek (p) 0.3 µm. Ukuran kromosom binahong pada tiap perlakuan bervariasi dari satu sel ke sel yang lain. Hal ini sesuai dengan literatur Haryanto (2010) yang menyatakan bahwa perbedaan ukuran kromosom pada tanaman yang sama ini dimungkinkan terjadi karena kromosom yang berasal dari sel tanaman yang berbeda sehingga dimungkinkan ada selisih waktu pembelahan. Parjanto et al (2003) menyatakan pada sel yang berbeda dapat terjadi perbedaan ukuran panjang kromosom yang disebabkan oleh perbedaan tingkat kondensasi.
poliploid yang meliputi: tetraploid (4n),pentaploid (5n), heksaploid (6n), septaploid(7n), oktaploid (8n) dan nonaploid (9n)
KESIMPULAN DAN SARAN Kesimpulan
1. Pemberian kolkhisin berpengaruh terhadap jumlah daun, bobot basah dan kering tajuk tetapi tidak berpengaruh terhadap bobot basah dan kering akar tanaman.
2. Konsentrasi kolkhisin 0,075% (K3) dan 0,1% (K4) berpengaruh menurunkan pertumbuhan tanaman binahong pada semua parameter jumlah daun, bobot basah dan kering tajuk serta bobot basah dan kering akar binahong secara signifikan.
3. Pemberian konsentrasi 0,050% memiliki karakter morfologi yang lebih baik dibanding perlakuan yang lain.
4.
Pemberian kolkhisin telah berpengaruh terhadap parameter pengamatan jumlah kromosom dimana terbanyak pada K4 sebanyak 26 dan terendah pada K0 sebanyak 22 pasang.Saran
TINJAUAN PUSTAKA Botani Tanaman
Menurut Tjitrosoepomo (1999) klasifikasi tanaman binahong adalah sebagai berikut Kingdom : Plantae ; Sub kingdom : Tracheobionta; Superdivisio : Spermatophyta; Divisio : Angiospermae; Kelas : Magnoliopsida Dicotyledoneae; Subkelas : Hamamelidae; Ordo : Caryophyllales; Familia : Basellaceae; Genus : Anredera; Species : Anredera cordifolia (Ten) Steenis.
Tanaman binahong memilki akar tunggang yang berdaging lunak dan berwarna coklat kotor (Manoi, 2009). Tanaman binahong memiliki rhizoma yaitu struktur batang khusus yang sumbu utamanya terdapat di dalam tanah, bercabang-cabang, tumbuh mendatar, dan dari ujungnya dapat tumbuh tunas yang muncul di atas tanah. Rhizoma berfungsi sebagai alat perkembangbiakan dan tempat penimbunan zat-zat cadangan makanan (Tjitrosoepomo, 1999).
Binahong memiliki batang yang lunak, berwarna merah dan berbentuk silindris, serta saling membelit satu sama lain. Batang berwarna merah dan memiliki permukaan yang halus Binahong dapat memilii ukuran panjang batang 3-6 meter (Kottaimuthu et al., 2011).
Daun binahong merupakan daun tunggal tersusun berseling, berwarna hijau, bentuk jantung atau berbentuk hati, panjang 5 - 10 cm, lebar 3 - 7 cm,permukaan licin dan helaian daun berdaging tipis, pangkal daun berlekuk,ujung runcing(Kottaimuthu et al., 2011).
pendek. Mahkota bunga berwarna putih dan agak lonjong, panjang mahkota dapat mencapai 1-3 mm dan memilki stamen yang berwarna putih (Smith et al., 2007).
Keterangan Gambar1 : (a) Bunga (b) tunas yang tumbuh dari rimpang dan (c) daun. Sumber : Smith et al., (2007).
Mutasi Buatan
Keragaman genetik yang dapat ditingkatkan melalui induksi mutasi antara lain adalah peningkatan variasi karakter kualitatif seperti morfologi tanaman, morfologi daun, bentuk bunga dan warna bunga. DNA merupakan komponen utama dari gen yang merupakan sasaran utama dari pemberian mutagen untuk menimbulkan mutasi yaitu perubahan sifat yang diatur oleh gen dan dapat diwariskan. Mutasi tersebut akhirnya akan membentuk keragaman genetik yang baru. Keragaman ini merupakan harapan pemulia tanaman untuk
memperbaharui varietas-varietas yang telah ada menjadi varietas yang diinginkan (Syafni, 2013).
Mutasi adalah perubahan dari struktur gen yang sifat keturunannya yang diwariskan yang dapat terjadi secara spontan maupun buatan. Mutasi buatan terjadi akibat penyinaran radioaktif atau perlakuan dengan zat – zat kimia tertentu.
a
b c
a
mutasi dan produk transgenik. Pemuliaan dengan mutasi dapat dilakukan dengan menggunakan kolkhisin pada jaringan meristem (Suryo, 1995).
Dalam bidang pemuliaan tanaman, teknik mutasi dapat meningkatkan keragaman genetik tanaman memungkinkan pemulia melakukan seleksi genotipe tanaman sesuai dengan tujuan pemuliaan yang dikehendaki. Mutasi induksi dapat dilakukan pada tanaman dengan perlakuan bahan mutagen tertentu terhadap organ tanaman seperti biji, stek batang, serbuk sari, akar, rizoma, media kultur jaringan dan sebagainya (BATAN, 2006).
Mutasi terjadi secara acak dan mutagen jarang mengubah hanya satu gen tertentu, maka perlakuan mutagenik terhadap karakter yang diwariskan secara kuantitatif dapat juga dipertimbangkannya. Semua agensia mutagenik yang telah dikenal diaplikasikan pada taraf yang menghasilkan sejumlah mutasi yang dapat terlihat, juga untuk menimbulkan keragaman pada karakter yang diwariskan secara kuantitatif (Nasir, 2002).
Mutagen Kolkhisin
Kolkisin dipakai luas di bidang biologi/pertanian untuk menghasilkan sel-sel poliploid buatan, karena pemisahan set kromosom terganggu dan sel-sel-sel-sel memiliki set kromosom yang berlipat. Tumbuhan poliploid seringkali memiliki ukuran yang lebih besar daripada tumbuhan normal sehingga disukai oleh petani maupun konsumen. Kolkhisin merupakan alkaloid toksik dan karsinogenik yang diperoleh dari ekstrak tumbuhan Colchicum autumnale dan beberapa anggota suku Colchicaceae lainnya (Sinaga et al., 2014).
dari mitosis menyebabkan penggandaan kromosom tanpa pembentukkan dinding sel, perlakuan ini dapat menyebabkan peningkatan jumlah kromosom sebelum terjadi penggandaan. Menurut Nasir (2002), penggandaan kromosom dapat terjadi secara spontan atau buatan. Penggandaan buatan terjadi bila pada pembelahan sel kromosom juga mengganda, tetapi nukleusnya gagal mengganda sehingga membentuk inti dengan jumlah kromosom ganda. Bila penggandaan kromosom terjadi segera setelah pembuahan maka individu yang dihasilkan akan menjadi poliploid sempurna, sedangkan penggandaan pada tahap perkembangan lanjut hanya membentuk sektor poliploid saja. Bila penggandaan terjadi setelah meiosis, maka pengurangan gamet akan terbentuk dan bila dibuahi dengan gamet normal maka akan terbentuk poliploidi tidak berimbang (Mardianti, 2014).
Kolkisin mempunyai pengaruh yang istimewa dalam menghentikan aktivitas benang-benang pengikat kromosom (spindle), sehingga kromosom yang sudah membelah tidak memisahkan diri pada fase anafase dari pembelahan sel hewan maupun tanaman. Senyawa ini juga ampuh dalam menyembuhkan penyakit gout. Dengan terhentinya proses pemisahan dalam metafase, maka pemberian kolkisin ini menyebabkan jumlah kromosom di dalam sel menjadi dobel. Penggunaan kolkisin untuk membentuk poliploidi telah diterapkan pada ratusan spesies tanaman dan beberapa spesies hewan (Sejati, 2008).
Satrabhandhu dan Khuatrachue (1995), menggunakan larutan kolkisin dengan konsentrasi 0,025-0,2% selama tiga-tujuh hari dalam menginduksi tanaman Morus alba tetraploid yang mana pada konsentrasi 0,10% selama tiga hari lebih banyak
menghasilkan eksplan tetraploid (47,22%). Chakraborti et al. (1998), menggunakan konsentrasi kolkisin 0,05-0,20% dalam menginduksi tetraploid pada Morus alba dengan rentang waktu perendaman 24 jam. Lin et al. (2010), memakai kolkisin 0,2-0,5% selama dua-lima hari dalam menginduksi poliploidi pada tunas Eucalyptus globules (Fajrina et al., 2012).
Nurfadalina (1997) menyatakan bahwa konsentrasi larutan kolkhisin 0,0005% dan 0,001% dengan perendaman 6 jam berpengaruh terhadap jumlah kromosom dan indeks stomata pada tanaman polong kapri. Menurut Permadi etal., (1991) umbi bawang yang dipotong secara melintang dan direndam selama
tiga jam dalam larutan kolkhisin 0,04% merupakan cara induksi poliploid yang paling efektif pada bawang merah „Sumenep‟ ( Wiendra et al., 2011).
Apabila kolkisin digunakan pada konsentrasi yang tepat maka jumlah kromosom akan meningkat, sehingga tanaman bersifat poliploid. Tanaman yang bersifat poliploid menghasilkan ukuran morfologi lebih besar dibandingkan tanaman diploid. Kolkisin akan bekerja efektif pada konsentrasi 0,01-1 ppm untuk jangka waktu 6-72 jam, namun setiap jenis tanaman memiliki respon yang berbeda-beda (Suryo, 1995).
Sel – sel tumbuhan umumnya tahan terhadap konsentrasi larutan kolkhisin yang relative kuat. Substansi kolkhisin cepat mengadakan difusi kedalam jaringan tanaman dan kemudian disebarluaskan ke berbagai bagian tubuh tanaman melalui jaringan pengangkut. Berbagai peercobaan menunjukkan bahwa penggunaan kolkhisin yang agak kuat dan dalam waktu yang singkat memberikan hasil yang lebih baik daripada kebalikannya (Suryo, 1995).
Kolkhisin akan efektif apabila diteteskan atau direndam pada saat sel membelah. Sebab kolkisin akan diserap oleh sel dan mempengaruhi pembelahan sel yang sedang berlangsung. Penetesan ini sebaiknya dilakukan pada pagi atau sore hari. Yaitu pada saat suhu udara rendah dan kelembaban tinggi. Hal ini dilakukan karena sifat kolkisin yang mudah menguap (Mardianti, 2014).
Tiap spesies tanaman mempunyai tanggapan yang berbeda terhadap konsentrasi kolkisin yang diperlukan untuk mengubah posisi kromosom. Biasanya 0.5 sampai 1.0% pasta atau larutan kolkisin dapat menimbulkan poliploidi. Kolkisin ternyata mengganggu pembentukkan serabut gelendong dan sitokenesis berikutnya, sehingga membentuk sel dengan jumlah kromosom yang meningkat.Perlakuan kolkisin biasanya mengakibatkan perbedaan tingkat ploidi dalam jaringan batang, karena itu perlu membuat pemeriksaan sitologis dari mixoploid untuk mengidentifikasi tetraploid (Crowder, 1997). Penggunaan kolkisin hanya untuk tujuan yang mempunyai arti penting, karena harganya cukup mahal. Disamping untuk tujuan pemuliaan biasanya digunakan pula pada penelitian-penelitian. Perlakuan kolkisin termasuk perlakuan mutasi karena merubah kromosom yang berakibat berubahnya sifat tanaman (Mardianti, 2014). Poliploidi
Suatu organisme yang memiliki lebih dari dua set kromosom atau genom dalam sel-sel somatiknya biasa disebut poliploidi. Poliploidi adalah perubahan satu set kromosom lengkap. Tanaman pada umumnya memiliki jumlah kromosom 2x, namun karena beberapa sebab ada pula tanaman yang memiliki jumlah kromosom haploid (x) atau triploid (3x), tetraploid (4x), dan seterusnya (Sejati, 2008).
Poliploidisasi dapat diperoleh melalui pemberian kolkisin. Kolkisin berpengaruh menghentikan aktivitas benang-benang pengikat kromosom (spindel) sehingga kromosom yang telah membelah tidak memisahkan diri dalam anaphase baik pada pembelahan sel tumbuhan maupun hewan. Dengan terhentinya proses pemisahan dalammetaphase mengakibatkan jumlah kromosom dalam suatu sel menjadi berganda. Perlakuan kolkisin dalam waktu yang makin lama bisa menghasilkan pertambahan genom sebagai suatu deret ukur seperti 4n, 8n, 16n dan seterusnya (Azizah dan Bermawi, 2003 ).
Metode pemberian kolkhisin pada tanaman jugaberpengaruh pada besar kecilnya mutasi yang terjadi.Pada penilitian Hartati (1999) penetesan pucuk tanamandengan beberapa kali kolkhisin selama satu minggumengakibatkan perubahan atau mutasi pada tanamanyang lebih besar daripada perendaman ujung kecambahdengan larutan kolkhisin. Taira et al. (1991) menerangkanmetode perendaman dengan larutan kolkhisin akan efektifbila dilakukan pada tingkat pH yang tepat yaitu antara 3,5– 7,5, yang dilakukan pada growth chamber dengan suhusiang 19oC dan malam 15oC dengan fotoperiode 18 jam (Wiendra et al., 2011).
Pengaruh poliploid dan cirri cirinya antara lain :
1. Inti dan isi sel besar . hal ini ditunjukkan oleh stomata dan butir serbuk sari
2. Daun dan bunga bertambah besar. Pertambahan ini ada batasnya hingga bila terjadi pertambahan secara terus pada jumlah kromosom tidak menyebabkan penambahan secara berlanjut.
3. Dapat terjadi perubahan senyawa kimia, termasuk peningkatan atau perubahan pada jenis atau proporsi karbohidrat, protein, vitamin atau alkaloid.
4. Laju pertumbuhannya lebih lambat dibandingkan tanaman diploid dan berbunganya juga terhambat.
5. Meiosis sering tidak teratur sehingga terjadi kromosom tidak berpasangan terbentuk bivalen , trivalent, quadrivalen, dan seterusnya.
6. Segregasi genetik berubah sehingga perbandingan segregasi menjadi tetrasonik (pada tetraploid) dan seterusnya.
7. Menurunnya fertilitas pada poliploid merupakan hal penting untuk diperhatikan pada pemuliaannya. Penurunan ini dapat terjadi pada daya hidup butir tepung sari dan jumlah biji. Derajat penurunan tergantung dari spesiesnya (Poespadarsono, 1988).
Kromosom
kromosom (r = q / p) mengikuti cara Ciupercescu et al. (1990) dalam Parjanto et al. (2003) yang dapat dilihat pada Tabel 1.
Tabel 1. Bentuk kromosom berdasarkan rasio lengan
Bentuk Kromosom Rasio lengan (r = q / p)
Metasentrik (m) 1,0 < r ≤1,7
Submetasentrik (sm) 1,7 < r ≤3,0
Akrosentrik (t) 3,0 < r ≤7,0
Telosentrik (T) > 7,0
Perbedaan kromosom secara umum menggambarkan perbedaan kandungan genetik dan protein suatu individu. Variasi utama yang dapat diamati yaitu ukuran atau panjang absolut, morfologi, ukuran relatif dan jumlah kromosom. Individu-individu dalam satu spesies mempunyai jumlah kromosom sama tetapi spesies yang berbeda dalam satu genus mempunyai jumlah kromosom berbeda. Bentuk, ukuran dan jumlah kromosom setiap spesies selalu tetap, sehingga dapat digunakan untuk tujuan taksonomi, mengetahui keanekaragaman, hubungan kekerabatan dan evolusi meskipun dalam keadaan tertentu pula terjadi variasi (Crowder, 1990).
Pengamatan Kromosom dengan Metode Squash
Kualitas squash sangat menentukan kualitas preparat. Squash yang baik menghasilkan preparat yang hanya terdiri dari selapis sel, terpisah –pisah, tidak tumpang tindih, tidak terpecah-pecah dan tidak terdenaturasi. Squash dilakukan dalam media gliserin. Gliserin bersifat kental dan licin sehingga memudahkan proses squash serta sulit menguap sehingga mampu menjaga kesegaran bahan akar (Setyawan dan Sutikno, 2000).
Menurut Stansfield (2002), bila dilakukan pengamatan di bawah mikroskop cahaya, kromosom kromosom tampak hanya sebagai butiran-butirankromosom yang halus. Kromosom menjadi terlihat berangkai karena bergulung, memendek dan menebaldan karena penambahan matriks protein padamassanya selama proses berlangsung, dan kromosomkelihatan seperti badan gelap.
Kariotipe kromosom somatik diamati pada sel-sel meristem ujung akar sebanyak10 sel tiap akar. Setiap tanaman diambil sampel 3 ujung akar. Sampel ujung akar ± 1 cmdirendam dalam larutan kolkhisin 0,05% selama 2,5 jam pada suhu 20 °C. Setelah itu selsel meristem ujung akar difiksasi dalam larutan campuran asam asetat : ethyl alcohol (1:3 v/v) kemudian dihidrolisa dengan HCl 1N pada suhu 60 °C selama 7 menit. Selanjutnyapewarnaan (staining) kromosom sel-sel meristem dengan larutan leucobasic fuchsin. Jumlahkromosom mitosis dapat diamati dengan metode squash menggunakan larutan asam asetat45% (Sulistyaningsih, 2004).
PENDAHULUAN Latar Belakang
Anredera cordifolia (Ten) Steenis atau yang dikenal sebagai binahong merupakan family dari Basalaceae yang merupakan tanaman obat. Di Indonesia tanaman binahong belum familiar tetapi di Negara Vietnam tanaman ini diperlukan dan sering dijadikan sebagai sayuran di Negara Taiwan. Tanaman ini diketahui memiliki manfaat yang luar biasa dan telah dikonsumsi lebih dari ribuan tahun lalu di China, Korea, Thaiwan. Hampir semua bagian tanaman binahong seperti umbi, batang dan daun dapat dijadikan sebagai terapi herbal (Astuti et al., 2011).
Tanaman binahong (Anredera cardifolia) merupakan tanaman obat alami yang ada di Indonesia. Daunnya banyak dimanfaatkan sebagai bahan obat tradisional untuk radang usus buntu, disentri, influenza, radang kandung kemih, campak dan cacar air. Beberapa penelitian menunjukkan bahwa ekstrak daun binahong dapat menghambat pertumbuhan bakteri E. coli , Pseudomonas aeruginosa ATCC 27853. Binahong mempunyai kandungan kimia karotenoid, saponin, pigmen antosianin, flavonoid dan polifenol, sedangkan hasil skrining ekstrak daun binahong diketahui mempunyai kandungan senyawa aktif dari golongan flavonoid, saponin, dan polifenol (Lukiati, 2014).
baku untuk industri fitofarmaka. Menurut Balitro (2006), hanya sekitar 20% bahan baku binahong untuk industri diperoleh dari hasil budidaya, sedangkan sisanya diperoleh dari hutan.
Selama ini upaya penyediaan bahan baku untuk industri obat tradisional sebagian besar berasal dari tumbuh - tumbuhan yang tumbuh di alam liar atau dibudidayakan dalam skala kecil di lingkungan sekitar rumah dengan kuantitas dan kualitas yang kurang memadai. Maka perlu dikembangkan aspek budidaya yang sesuai dengan standar bahan baku obat tradisional (Tatik et al., 2014).
Upaya untuk menigkatkan kualitas tanaman binahong perlu dilakukan untuk memenuhi permintaan konsumen yang selalu berkembang dan mengantisipasi kendala- kendala budidaya yang potensial dan jumlah tanaman binahong masih relatif terbatas. Kualitas tanaman binahong yang baik akan sangat mendukung pengembangan tanaman binahong dan meningkatkan keragaman genetiknya. Indonesia merupakan salah satu pusat keragaman genetik sehingga mempunyai potensi sumberdaya genetik yang besar untuk mendukung program pemuliaan binahong.
Perbanyakan tanaman binahong secara vegetatif umumnya dilakukan
dengan menggunakan setek sulur , rimpang serta umbi di ketiak daun. Pada penelitian Tatik et al., (2014) menyatakan penggunaan bahan tanam umbi
Pertumbuhan dan produktivitas tanaman binahong yang optimal ditentukan oleh kualitas bahan tanam yang digunakan dan banyaknya kandungan metabolit sekunder yang terdapat didalam tanaman itu sendiri. Selain itu sempitnya variasi genetik tanaman binahong menjadikan kita sulit untuk mendapatkan binahong yang bermutu baik. Oleh karena itu perlu usaha untuk meningkatkan kevariaan genetik tanaman binahong. Salah satu program pemuliaan tanaman yang dapat digunakan untuk mendapatkan kultivar atau varietas unggul adalah dengan teknik pemuliaan mutasi. Penggunaan teknik mutasi dalam program pemuliaan tanaman dilakukan untuk mendapatkan tanaman poliploidi (Sulistiahningsih, 2006).
Kolkhisin merupakan salah satu reagen untuk mutasi yang menyebabkan terjadinya poliploid. Senyawa ini dapat menghalangi terbentuknya benang- benang spindle pada pembelahan sel sehingga jumlah kromosom dalam setiap sel menjadi dua kali lipat atau terjadi proses poliploidisasi (Suharni, 2004).
Penggandaan kromosom merupakan salah satu upaya seleksi untuk meningkatkan mutu tumbuhan baik berupa peningkatan kandungan metabolit sekun-dernya maupun toleransinya terhadap faktor lingkungan terutama lingkungan yang ekstrim. Konsentrasi pemakaian kolkisin sebagai senyawa
penginduksi poliploidi beragam tergantung pada jenis tumbuhan (Fajrinaet al., 2012). Dari hasil penelitian Suharni (2004) pemberian kolkhisin
Berdasarkan uraian diatas penulis tertarik untuk melakukan mengetahui pengaruh pemberian kolkhisin terhadap morfologi dan jumlah kromosom tanaman binahong .
Tujuan Penelitian
Untuk mengetahui pengaruh pemberian konsentrasi kolkhisin terhadap morfologi dan jumlah kromosom tanaman binahong.
Hipotesis Penelitian
Ada pengaruh pemberian konsentrasi kolkhisin terhadap morfologi dan jumlah kromosom tanaman binahong.
Kegunaan Penelitian
Rosida Mahyuni : The Effect of Colchicine on Morphology and Number of Chromosome of Binahong Plant (Anredera cordifolia Tenn. Steenis.) . Supervised by Eva Sartini Bayu, and Diana Sofia Hanafiah.
The research has been conducted at Faculty of Agriculture and Plant Tissue Culture Laboratory, University of Sumatera Utara with 25 metre altitude from Mei to December 2015. The design of the research was a randomized block design of one factor with five treatments and five replications. The result data were analized with ANOVA and continued with Duncan Multiple Range Test. The treatment were K0 (control);K1 (0.025%); K2(0.050%); K3 (0.075%); K4(0.1%). This study aimed at investigating the effect of colchine on morphologycal changes and number of chromosome of binahong plant.
The result obtained from the effect of concentration colchicine 0.075 % ( K3) and 0.1 % ( K4 ) influenced number of leaves perform at 4 weeks age,increased the weight of fresh weight of roots, weight of dry roots, and weight of shoot of binahong plant at concentration colchicine 0,05 % ( K2 ) had found morphology traits better than others. The effect colchicine gave significantly to number of chromosome : 2n+=23 set (K1), 2n+=23 set (K2), 2n+=24 set (K3) and 2n+=26 set (K4) with normally chromosome 2n=22 set.
Rosida Mahyuni : Pengaruh Pemberian Kolkhisin Terhadap Morfologi dan Jumlah Kromosom Tanaman Binahong (Anredera cordifolia (Ten) Steenis). Dibimbing oleh Eva Sartini Bayu, dan Diana Sofia Hanafiah.
Penelitian ini telah dilaksanakan di lahan fakultas Pertanian Universitas Sumatera Utara dan Laboratorium Kultur Jaringan Tanaman dengan ketinggian tempat + 25 m dpl. Penelitian ini dilakukan pada bulan Mei sampai Desember 2015, menggunakan Rancangan Acak Kelompok non faktorial dengan 5 perlakuan dan 5 ulangan. Data hasil penelitian dianalisis dengan ANOVA kemudian dilanjutkan dengan Uji DMRT. Perlakuannya yaitu konsentrasi 0.00% (kontrol), 0.025%(K1), 0.05%(K2), 0.075%(K3) dan 0.1%(K4). Penelitian ini bertujuan untuk mendapatkan konsentrasi kolkhisin yang tepat terhadap karakter morfologi dan jumlah kromosom tanaman binahong.
Berdasarkan hasil penelitian menunjukkan bahwa pemberian konsentrasi kolkhisin pada 0.075% dan 0.100% mempengaruhi jumlah daun, bobot basah dan bobot kering akar serta tajuk dari tanaman binahong. Konsentrasi kolkhisin 0,05% menghasilkan tanaman binahong dengan karakter morfologi yang lebih baik dibandingkan perlakuan konsentrasi kolkhisin lainnya. Kolkhisin berpengaruh menambah jumlah kromosom yaitu 2n+ =23 pasang (K1), 2n+ =23 pasang (K2), 2n+ =24 pasang (K3) dan 2n+ =26 pasang (K4) dengan kromosom normalnya yaitu 2n=22 pasang.