SENSITIVITAS GEN SITOKROM B (Cyt b) SEBAGAI MARKA
SPESIFIK PADA GENUS
Rattus
dan
Mus
UNTUK
MENJAMIN KEAMANAN PANGAN
PRODUK ASAL DAGING
ALMIRA PRIMASARI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Sensitivitas Gen Sitokrom b (Cyt b) sebagai Marka Spesifik pada Genus Rattus dan Mus untuk Menjamin Keamanan Pangan Produk Asal Daging adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Mei 2011
ABSTRACT
ALMIRA PRIMASARI. Sensitivity of Cytochrome b (Cyt b) Genes as a Specific Marker in Rattus and Mus for Food Safety of Meat Product. Under direction of CECE SUMANTRI, HENNY NURAINI and RARAH R. A. MAHESWARI.
Appropriate techniques for detection and identification of origin of species for meat source are very important in the meat product processing to ensure the safety and halal foods. Multiplex PCR, in which many primers were used together for amplification of multiple target regions, is hopefully a suitable technique for meat sources identification. The aim of this study was to determine the specificity and sensitivity of the cytochrome b (cyt b) gene in rats as well as to design primers that can be used for detection of rat meat contamination in some processed meat products. The amplification of cyt b genes was done in seven species with different lengths of fragments which indicated specificity for cyt b genes sequences between species. The products showed specific DNA fragments of 157, 227, 274, 331, 398, 439 and 603 bp from goat, chicken, cattle, sheep, pig, horse and rat meats, respectively. Cyt b gene is sensitive as a specific marker with rats DNA that could be detected and be amplified with 100% success from as low as 1% level of contamination. Results showed that rat DNA in meatballs could be detected from 1% level contamination, otherwise rat DNA in meat floss could be detected from above 2.5% level contamination.
RINGKASAN
ALMIRA PRIMASARI. Sensitivitas Gen Sitokrom b (Cyt b) sebagai Marka Spesifik pada Genus Rattus untuk Menjamin Keamanan Pangan Produk Asal Daging. Dibimbing oleh CECE SUMANTRI, HENNY NURAINI dan RARAH R.A. MAHESWARI.
Teknik deteksi dan identifikasi asal daging pada produk olahan sangat penting untuk menjamin keamanan dan kehalalan pangan dalam upaya melindungi konsumen dari pemalsuan informasi. Perkembangan teknologi molekuler memungkinkan teknik identifikasi dengan analisis DNA yang memiliki keunggulan dibanding analisis protein atau lemak yaitu sampel yang diperlukan dalam jumlah sangat sedikit dan tidak bergantung pada keadaan jaringan. DNA lebih stabil dibandingkan dengan protein terutama pada sampel yang telah mengalami proses pemanasan dengan suhu tinggi. Teknik multipleks PCR dapat diaplikasikan untuk identifikasi jenis daging karena dapat mendeteksi dengan cepat dan akurat. Multipleks PCR adalah salah satu teknik PCR dengan beberapa primer yang digunakan bersama-sama dalam satu reaksi untuk amplifikasi beberapa daerah target.
Penggunaan DNA mitokondria (mtDNA) didasarkan pada beberapa alasan diantaranya yaitu memiliki jumlah beberapa kali lipat lebih banyak daripada DNA nukleus yang memungkinkan keberhasilan amplifikasi pada sampel yang telah terdegradasi atau dalam jumlah sedikit, laju mutasi lebih tinggi dibandingkan dengan DNA nukleus dan keragaman urutan basa nukleotida memudahkan identifikasi jenis hewan terutama dalam satu famili atau genus. DNA mitokondria diwariskan seluruhnya dari ibu, sehingga sering digunakan untuk pelacakan garis keturunan terutama di wilayah yang sangat kekal seperti wilayah gen cyt b
dibandingkan DNA nukleus yang memiliki analisis urutan yang sangat beragam antar individu karena diturunkan dari kedua tetuanya.
Penelitian tentang identifikasi jenis daging telah dilakukan oleh beberapa peneliti dengan penggunaan DNA mitokondria. Gen-gen yang paling sering digunakan sebagai penanda jenis hewan atau daging diantaranya adalah sitokrom b (cyt b), 12S dan 16S subunit ribosom RNA dan daerah displacement loop (D-loop). Adanya variasi urutan pada cyt b menyebabkan gen ini banyak digunakan sebagai penanda untuk membedakan material yang berasal dari jenis hewan yang berbeda. Penelitian ini bertujuan untuk membuat suatu primer spesifik yang berasal dari sekuen cyt b tikus dan menentukan sensitivitas gen cyt b agar dapat digunakan sebagai penanda untuk mendeteksi adanya cemaran daging tikus pada produk daging olahan.
Primer reverse tikus hasil rancangan terbukti spesifik dengan teramplifikasinya DNA tikus sepanjang 603 pb. Panjang fragmen hasil amplifikasi untuk kambing, ayam, sapi, domba, babi, kuda dan tikus berturut-turut 157 pb, 227 pb, 274 pb, 331 pb, 398 pb, 439 pb dan 603 pb. Amplifikasi gen cyt b pada tujuh jenis hewan dengan panjang fragmen yang berbeda-beda menunjukkan spesifisitas sekuen gen cyt b antar jenis hewan. Gen cyt b dapat digunakan sebagai penciri asal daging pada produk daging olahan dan sensitif sebagai marka spesifik untuk tikus terbukti dengan terdeteksinya DNA tikus pada level campuran DNA 1% dengan persentase keberhasilan dan ketepatan amplifikasi 100%. Pengujian pada produk olahan menunjukkan bahwa cemaran daging tikus pada bakso sudah dapat terdeteksi pada level cemaran 1%, sedangkan pada abon mulai dapat terdeteksi pada level cemaran di atas 2.5%.
© Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
SENSITIVITAS GEN SITOKROM B (Cyt b) SEBAGAI MARKA
SPESIFIK PADA GENUS
Rattus
DAN
Mus
UNTUK
MENJAMIN KEAMANAN PANGAN
PRODUK ASAL DAGING
ALMIRA PRIMASARI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Mayor Ilmu Produksi dan Teknologi Peternakan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Sensitivitas Gen Sitokrom b (Cyt b) sebagai Marka Spesifik pada Genus Rattus dan Mus untuk Menjamin Keamanan Pangan Produk Asal Daging
Nama : Almira Primasari
NIM : D151090111
Program Studi/Mayor : Ilmu Produksi dan Teknologi Peternakan
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc Ketua
Dr. Ir. Henny Nuraini, M.Si Anggota
Dr. Ir. Rarah R.A. Maheswari, DEA Anggota
Diketahui Ketua Program Studi/Mayor
Ilmu Produksi dan Teknologi Peternakan
Dr. Ir. Rarah R.A. Maheswari, DEA
Dekan Sekolah Pascasarjana IPB
Dr. Ir. Dahrul Syah, M.Sc.Agr
Tanggal Ujian: 23 Mei 2011 Tanggal Lulus:
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT karena dengan limpahan rahmat dan karunia-Nya lah penulis dapat menyelesaikan studi magister ini dengan baik. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2010 ini ialah identifikasi jenis atau sumber daging dengan judul: “Sensitivitas Gen Sitokrom b (Cyt b) sebagai Marka Spesifik pada Genus
Rattus dan Musuntuk Menjamin Keamanan Pangan Produk Asal Daging”.
Terima kasih penulis ucapkan kepada Prof. Dr. Ir. Cece Sumantri, M.Agr.Sc, Dr. Ir. Henny Nuraini, M.Si dan Dr. Ir. Rarah Ratih Adjie Maheswari, DEA atas segala bimbingan, saran dan motivasi yang selalu diberikan dalam penelitian dan penulisan tesis ini. Ucapan terima kasih penulis sampaikan kepada Prof. Dr. Ir. Ronny Rachman Noor, M.Rur.Sc dan Prof. Dr. Ir. Muladno, MSA yang telah memberikan kesempatan melakukan penelitian di Laboratorium Genetika Molekuler Ternak, Bagian Pemuliaan dan Genetika Ternak.
Rasa terima kasih yang tak terhingga penulis ucapkan untuk orangtua dan adik-adik tercinta atas do‟a dan semangat yang tak pernah putus diberikan. Terima kasih penulis sampaikan kepada rekan-rekan pascasarjana peternakan khususnya ITP 09 atas semangat dan kebersamaan selama studi. Terima kasih juga penulis sampaikan kepada Eryk Andreas, S.Pt, M.Si serta rekan-rekan di Animal Breeding and Genetic Science (ABGSCi) atas segala bantuan yang diberikan selama penelitian. Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2011
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 17 September 1988 di Sukabumi. Penulis adalah anak pertama dari tiga bersaudara dari pasangan (Alm.) H.Tejo Sriwijoyo dan Hj.Henny Liswara, AmKeb.
DAFTAR ISI
Pembuatan Produk Olahan Asal Daging (Kontrol Positif) ………. 21
Isolasi dan Ekstraksi DNA ………... 22
Pengujian DNA Total ………... 23
Amplifikasi Fragmen DNA Spesifik ….………... 24
Elektroforesis dan Visualisasi Produk PCR ……… 24
Analisis Data ………... 25
HASIL DAN PEMBAHASAN ………... 26
Perancangan Primer Spesifik Tikus ………... 26
Derajat Kesamaan Primer Spesifik ………... 27
Amplifikasi cyt b pada Abon ………... 47
Teknik Multipleks PCR Gen Cyt b untuk Identifikasi Spesies ……... 50
SIMPULAN DAN SARAN ………... 53
DAFTAR PUSTAKA ………... 54
DAFTAR TABEL
Halaman
1. Klasifikasi tikus ………... 5
2. Klasifikasi marmut ………... 8
3. Karakteristik DNA inti dan DNA mitokondria ……… 12
4. Teknik analisis deteksi dan identifikasi substitusi daging, lemak dan protein pada daging dan produk olahan asal daging ……… 17
5. Sekuen primer spesifik gen cyt b tujuh jenis hewan ………. 20
6. Kriteria primer tikus hasil rancangan ………...……… 27
7. Derajat kesamaan primer spesifik pada tujuh jenis hewan ……... 27
8. Hasil pengukuran konsentrasi DNA total …...……….. 34
9. Tingkat keberhasilan amplifikasi sekuen gen cyt b pada DNA campuran dengan enam level perbandingan ………..………... 42
10. Tingkat keberhasilan amplifikasi DNA bakso daging sapi dengan enam level cemaran daging tikus ………...………..…….. 44
11. Tingkat keberhasilan amplifikasi DNA bakso daging sapi dengan lima level cemaran daging tikus………..……..……… 47
12. Tingkat keberhasilan amplifikasi DNA abon daging sapi dengan lima level cemaran daging tikus ……….………….. 49
DAFTAR GAMBAR
Halaman
1. Tiga genus tikus ………... 6
2. Tikus dan mencit laboratorium ………. 7
3. Marmut (Cavia porcellus) ……… 9 4. Susunan gen dari organisasi genom mitokondria (Taylor & Turnbull
2005) ………. 11
5. Daerah cyt b dalam genom mitokondria Rattus norvegicus
(NCBI 2011) ……… 15
6. Situs penempelan primer pada sekuen gen cyt b Rattus norvegicus….... 26 7. Situs penempelan primer pada sekuen DNA mitokondria daerah cyt b
tujuh jenis hewan ……….. 29
8. Visualisasi DNA hasil ektraksi darah dan daging beberapa jenis hewan
pada gel agarose 1% ………. 32
9. Visualisasi DNA hasil ektraksi produk olahan (bakso dan abon) pada
gel agarose 1% ………. 32
10. Visualisasi hasil amplifikasi fragmen DNA spesifik tujuh jenis hewan .. 36 11. Visualisasi hasil amplifikasi fragmen DNA tikus ..……….. 37 12. Visualisasi hasil amplifikasi fragmen DNA tikus hutan ……….. 37 13. Visualisasi hasil amplifikasi fragmen DNA cyt b pada sampel DNA
marmut (Cavia porcellus) ………. 39 14. Visualisasi fragmen DNA campuran (kambing, ayam, sapi, domba,
babi, kuda dan tikus) ………. 40
15. Visualisasi hasil amplifikasi fragmen spesifik pada DNA campuran
16. Visualisasi hasil amplifikasi fragmen DNA cyt b pada sampel bakso
dengan enam level cemaran (sampel 1 dan 2) ……….…. 43
17. Visualisasi hasil amplifikasi fragmen DNA cyt b pada sampel bakso
dengan enam level cemaran (sampel 3 dan 4) ……….…. 43
18. Visualisasi hasil amplifikasi fragmen DNA cyt b pada sampel bakso
dengan lima level cemaran (sampel 1 dan 2) ……… 45
19. Visualisasi hasil amplifikasi fragmen DNA cyt b spesifik pada sampel
bakso dengan lima level cemaran (sampel 3 dan 4) ………. 46
20. Visualisasi hasil amplifikasi fragmen DNA cyt b pada sampel abon
dengan lima level cemaran (sampel 1 dan 2) ……….………... 48
21. Visualisasi hasil amplifikasi fragmen DNA cyt b pada sampel abon
DAFTAR LAMPIRAN
PENDAHULUAN
Latar Belakang
Kebutuhan pangan asal hewan dari hari ke hari terus bertambah seiring dengan meningkatnya kesadaran masyarakat terhadap manfaat gizi bagi kehidupan manusia. Daging, telur dan susu merupakan bahan pangan hewani berkualitas tinggi karena mengandung protein yang tersusun dari asam amino essensial yaitu asam amino yang tidak dapat dihasilkan oleh tubuh ataupun digantikan oleh sumber makanan lain. Peranan protein hewani terutama daging cukup penting dalam rangka mencapai standar kelayakan gizi. Perubahan pola konsumsi serta selera masyarakat, menyebabkan kebutuhan bahan pangan hewani sebagai kebutuhan primer yang harus dipenuhi untuk hidup cerdas, sehat, kreatif dan produktif sehingga peningkatan konsumsi protein hewani tersebut diharapkan dapat meningkatkan kualitas sumberdaya manusia Indonesia.
Seiring dengan perkembangan kebutuhan tersebut, keamanan pangan asal hewan juga tidak lepas dari perhatian konsumen. Keamanan pangan didefinisikan sebagai kondisi dan upaya yang diperlukan untuk pencegahan pangan dari kemungkinan cemaran biologis, kimia dan bahan lain yang dapat mengganggu, merugikan dan membahayakan kesehatan manusia (Peraturan Pemerintah Nomor 28 Tahun 2004). Pemerintah dalam merealisasikan penyediaan daging yang aman menetapkan sebagai daging ASUH, yakni aman, sehat, utuh dan halal. Aman berarti daging tidak mengandung bahaya yang dapat menimbulkan penyakit dan mengganggu kesehatan manusia. Sehat berarti daging memiliki zat-zat yang berguna bagi kesehatan dan pertumbuhan tubuh. Utuh berarti daging tidak dikurangi atau dicampur dengan bagian lain dari hewan tersebut atau bagian dari hewan lain. Halal berarti hewan dipotong dan ditangani sesuai syariat agama Islam. Pangan halal didefinisikan sebagai bahan pangan yang tidak mengandung unsur atau bahan haram atau dilarang untuk dikonsumsi umat Islam serta pengolahannya tidak bertentangan dengan syariat Islam (DEPAG RI 2001).
Banyak kasus penipuan dan kontaminasi dengan penggunaan bahan-bahan yang tidak layak konsumsi dan tidak halal. Kontaminasi bahan tersebut dapat terjadi pada tahap awal atau tahap akhir produksi dan ada juga yang tanpa disengaja. Pencampuran dengan daging lain pada produk daging olahan biasanya bertujuan untuk menekan biaya produksi. Permasalahan yang muncul adalah apabila pencampuran tersebut menggunakan jenis daging yang tidak boleh dikonsumsi oleh masyarakat tertentu terkait dengan agama dan budaya. Contoh kasus tersebut adalah telah beredarnya isu bakso sapi yang dicampur daging tikus di beberapa daerah akhir-akhir ini mengakibatkan kekhawatiran dan keresahan masyarakat terkait dengan cemaran biologis dan bahan lain sesuai dengan definisi keamanan pangan menurut PP no. 28 Tahun 2004 serta keutuhan daging dan produk olahannya.
Teknik deteksi dan identifikasi jenis hewan menjadi sangat penting dalam daging dan produk olahan untuk mengetahui keaslian produk guna menjamin keamanan dan kehalalan pangan serta melindungi konsumen dari pemalsuan informasi. Metode analisis yang akurat dengan prosedur sederhana dan cepat sangat diperlukan untuk pelabelan produk daging.
Multipleks PCR merupakan salah satu variasi dari teknik PCR dengan beberapa primer yang digunakan bersama-sama untuk amplifikasi pada beberapa daerah target. Teknik multipleks PCR sangat berguna untuk identifikasi jenis atau sumber daging karena dapat mendeteksi dengan cepat dan akurat. Teknik ini memiliki beberapa keunggulan salah satunya adalah dapat mendeteksi sampel dalam keadaan mentah maupun sudah mengalami proses pengolahan yang mengaplikasikan pemanasan dengan suhu tinggi dan dengan persentase kandungan cemaran daging yang relatif rendah.
satu famili atau genus. DNA mitokondria diwariskan seluruhnya dari ibu, sehingga mtDNA bersifat unik untuk pelacakan garis keturunan terutama di wilayah yang sangat kekal seperti wilayah gen cyt b dibandingkan DNA nukleus yang diwariskan dari kedua tetua yang dapat mengakibatkan ambiguitas karena keragaman yang tinggi antar individu. Penelitian tentang identifikasi jenis daging telah dilakukan oleh beberapa peneliti dengan penggunaan DNA mitokondria. Gen-gen yang paling sering digunakan sebagai penanda jenis hewan atau daging diantaranya adalah sitokrom b (cyt b), 12S dan 16S subunit ribosom RNA dan daerah displacement loop (D-loop).
Beberapa peneliti telah menggunakan gen sitokrom b (cyt b) untuk membedakan material yang berasal dari jenis hewan yang berbeda. Adanya variasi urutan pada cyt b menyebabkan gen ini banyak digunakan sebagai penanda untuk pengelompokan jenis hewan. Kekhasan dari gen cyt b diantaranya yaitu adanya daerah yang hampir sama untuk semua jenis hewan tetapi juga terdapat daerah yang spesifik untuk setiap jenis hewan. Kedua daerah tersebut berada dalam satu gen sehingga dalam penggunaannya untuk membedakan beberapa jenis hewan relatif lebih akurat.
Metode deteksi dan identifikasi jenis daging dan produk olahan terus dikembangkan sebagai suatu upaya perlindungan konsumen dan pelaksanaan pelabelan pangan. Teknik amplifikasi DNA spesifik untuk setiap jenis hewan pada keamanan dan kehalalan pangan dapat digunakan untuk verifikasi, sertifikasi (pengesahan), maupun untuk monitoring kebanyakan protein hewani dan produk-produk berkaitan untuk kegunaan authentikasi aman dan halal secara efisien dan efektif.
Tujuan
Manfaat
Pemanfaatan dan pengembangan penanda spesifik tersebut diharapkan dapat membantu dalam menyediakan teknologi yang aplikatif untuk melindungi konsumen dari pemalsuan informasi khususnya pada produk pangan asal daging.
Hipotesis
Penanda genetik spesifik gen sitokrom b (cyt b) pada kambing (Capra hircus), ayam (Gallus gallus), sapi (Bos taurus), domba (Ovis aries), babi (Sus scrofa), kuda (Equus cabalus) dan tikus (Rattus norvegicus) memiliki fragmen DNA unik yang mencirikan masing-masing jenis hewan tersebut.
TINJAUAN PUSTAKA
Tikus
Tikus terbagi dalam kelompok tikus besar (rat) dan tikus kecil (mice). Tikus yang sebenarnya adalah anggota dari genus Rattus berasal dari Asia. Tikus yang paling dikenal manusia adalah tikus hitam atau tikus rumah (Rattus rattus) dan tikus coklat atau tikus got (Rattus norvegicus). Tikus digolongkan ke dalam ordo Rodensia (hewan yang mengerat), sub ordo Myomorpha, famili Muridae dan subfamili Murinae. Famili muroid sangat besar dan kompleks, banyak anggota genus dan famili rodensia lain juga disebut sebagai tikus karena memiliki beberapa karakteristik yang sama dengan tikus yang sebenarnya (rat) diantaranya adalah tikus Bandicota (tikus wirok) dan Mus (mencit). Klasifikasi tikus disajikan pada Tabel 1.
Bandicota indica (tikus wirok), (2) Rattus norvegicus (tikus riul atau tikus got), (3) Rattus rattus diardii (tikus rumah), (4) Rattus tiomanicus (tikus pohon), (5)
Rattus argentiventer (tikus sawah), (6) Rattus exulans (tikus ladang), (7) Mus musculus (mencit rumah) dan (8) Mus caroli (mencit ladang).
Rattus norvegicus, Rattus rattus dan Mus musculus mempunyai distribusi geografi yang menyebar di seluruh dunia sehingga disebut sebagai hewan kosmopolit, sedangkan kelima spesies lainnya mempunyai distribusi geografi hanya di sekitar Asia Selatan dan Asia Tenggara. Tikus wirok, tikus riul, tikus sawah dan mencit ladang memiliki ekor relatif pendek terhadap kepala dan badan, serta tonjolan pada telapak kaki yang relatif kecil dan halus sehingga termasuk hewan terestrial. Tikus pohon, tikus rumah, tikus ladang dan mencit rumah memiliki ekor yang panjang serta tonjolan pada telapak kaki yang besar dan kasar sehingga termasuk hewan aboreal. Jenis tikus yang termasuk dalam tiga Genus berbeda disajikan pada Gambar 1.
(a) (b) (c)
Gambar 1 Tiga genus tikus. (a) Bandicota,(b) Rattus dan (c) Mus.
Salah satu ciri terpenting dari tikus sebagai ordo Rodensia (hewan pengerat) adalah kemampuannya untuk mengerat benda-benda yang keras. Hal ini bertujuan untuk mengurangi pertumbuhan gigi serinya yang tumbuh terus menerus. Beberapa hewan lain yang masih berkerabat dekat dengan tikus adalah bajing, landak, marmot, kelinci, tikus putih dan mencit putih. Adapun hewan yang bukan tikus tetapi mirip tikus yaitu cecurut dan tupai (Meerburg 2009). Sebanyak 64 jenis tikus masih termasuk dalam Genus Rattus diantaranya Lenothrix,
Komodomys, Palawanomys, Bunomys, Nesoromys, Stenomys, Taeromys,
Paruromys, Abditomys, Tryphomys, Limnomys, Tarsomys, Bullimus, Apomys,
Millardia, Srilankamys, Niviventer, Maxomys, Leopoldamys, Berylmys,
Mastomys, Myomys, Praomys, Hylomyscus, Heimyscus, Stochomys, Dephomys
dan Aethomys (Barnett & Anthony 2002). Rattus norvegicus Strain Albino
Hubungan antara tikus dan manusia yang bersifat mutualisme terjadi pada tikus albino (Rattus norvegicus Strain Albino) atau mencit albino (Mus musculus
Strain Albino) yang merupakan hewan laboratorium. Jenis tikus ini sering dijadikan hewan percobaan untuk pengujian obat manusia dan tingkat toksisitas racun hama terhadap manusia. Tikus dan mencit laboratorium merupakan tikus dan mencit albino yaitu tikus dan mencit yang sudah kehilangan pigmen melaninnya, sifat ini menurun pada keturunannya. Spesies dari tikus laboratorium adalah Rattus norvegicus, sedangkan mencit laboratorium adalah Mus musculus
(Barnett & Anthony 2002). Tikus dan mencit albino dapat dilihat pada Gambar 2.
(a) (b)
Gambar 2 Tikus dan mencit laboratorium. (a) Rattus norvegicus Strain Albino, (b) Mus musculus Strain Albino.
R. norvegicus memiliki ciri-ciri yaitu panjang kepala sampai badan berkisar antara 150-233 mm dan panjang kaki belakang 34-44 mm, ekor umumnya lebih pendek daripada panjang badan dan kepala dengan bobot badan berkisar antara 150-600 gram. Jika dibandingkan antara ukuran Rattus norvegicus normal dan
daripada Rattus norvegicus albino. Sebaliknya pada mencit, Mus musculus normal berukuran lebih kecil daripada Mus musculus albino. Hal ini disebabkan oleh adanya seleksi yang dilakukan oleh manusia untuk memudahkan pada saat menangani tikus dan mencit albino di laboratorium (Barnett & Anthony 2002).
Marmut
Marmut sebenarnya adalah sebutan untuk tikus Belanda atau dalam bahasa Inggris dikenal dengan nama guinea pig. Hewan ini di Indonesia seringkali disebut sebagai marmut karena mirip dengan hewan lain tetapi berukuran lebih besar dari famili Sciuridae (bajing) dengan genus Marmota. Tikus Belanda atau marmut adalah jenis hewan pengerat yang masuk ke dalam famili Caviidae dan genus Cavia. Klasifikasi marmut dapat dilihat dalam Tabel 2.
Tabel 2 Klasifikasi marmut
Gambar 3 Marmut (Cavia porcellus).
Panjang badan marmut sekitar 225-275 mm dan bobot badan sekitar 400-1200 g. Marmut memiliki kepala relatif lebih besar terhadap tubuhnya dengan leher gemuk, rumps bulat dan tidak memiliki ekor, memiliki empat jari di kaki depan, tiga jari di kaki belakang, mengeluarkan suara sangat mirip dengan babi serta menghabiskan banyak waktu untuk makan. Marmut memiliki rambut halus dengan warna yang sering dijumpai yaitu putih, coklat, coklat kekuningan, abu-abu atau buff, merah, perpaduan dua dan tiga warna. Ciri-ciri marmut liar mirip dengan marmut domestikasi. Marmut dapat bertahan hidup pada kandang sempit dalam waktu yang lama (Long 2003). Hewan ini banyak dijadikan hewan peliharaan oleh manusia karena sifatnya yang jinak dan biasa dimanfaatkan untuk diambil dagingnya.
Polymerase Chain Reaction (PCR)
Polymerase chain reaction (PCR) adalah suatu reaksi in vitro untuk menggandakan molekul DNA pada target tertentu dengan cara mensintesa molekul DNA baru yang berkomplemen dengan molekul DNA tersebut dengan enzim polimerase dan oligonukleotida pendek sebagai primer. Metode ini berjalan secara enzimatik melalui mekanisme perubahan suhu (Buzdin & Lukyanov 2007). Target PCR yaitu asam nukleat (DNA) untai ganda yang diekstraksi dari sel dan terdenaturasi menjadi asam nukleat beruntai tunggal. Komponen reaksi PCR terdiri atas pasangan primer berupa oligonukleotida spesifik untuk target gen yang dipilih, enzim (umumnya Taq polymerase, enzim thermostable dan thermoactive
diprogram secara otomatis disebut thermocycler. Mesin tersebut menyediakan kondisi termal yang diperlukan untuk proses amplifikasi (Nollet & Toldrá 2011).
Proses yang terjadi dalam mesin PCR meliputi tiga tahap utama yaitu denaturasi (pemisahan untai ganda DNA), annealing (penempelan primer) dan ekstensi (pemanjangan primer). Proses yang dimulai dari denaturasi, penempelan dan ekstensi disebut sebagai satu siklus. Produk PCR dapat langsung divisualisasikan melalui proses elektroforesis dan digunakan untuk analisis lebih lanjut (Weissensteiner et al. 2004). Produk PCR dipisahkan dengan elektroforesis gel yang diwarnai dengan bromida dan divisualisasikan dengan sinar ultraviolet (Nollet & Toldrá 2011).
Multipleks PCR
Multipleks PCR merupakan salah satu variasi dari teknik PCR dengan beberapa primer yang digunakan bersama-sama untuk amplifikasi pada beberapa daerah target (Jain 2007). Metode ini telah diterapkan pada banyak bidang uji DNA, termasuk analisis delesi, mutasi dan polimorfisme, atau uji kuantitatif PCR dan transkripsi reverse. Multipleks PCR umum digunakan untuk analisis genotipe yang memerlukan beberapa penciri secara simultan, deteksi patogen, organisme rekayasa genetik (GMO) atau untuk analisis mikrosatelit. Multipleks PCR merupakan teknik yang efisien sehingga dapat menghemat biaya untuk analisis PCR dalam skala besar. Kelemahan multipleks PCR yaitu terkadang membutuhkan prosedur optimasi panjang untuk menentukan konsentrasi primer, konsentrasi cetakan DNA, komponen buffer dan kondisi PCR yang sesuai (Römpler 2006).
1997). Meskipun dengan teknik unipleks (simpleks) PCR konvensional diperoleh hasil yang sama, pendekatan multipleks PCR memungkinkan untuk deteksi simultan yang cepat, praktis dan sederhana karena dilakukan sekaligus dalam satu tabung reaksi (Kingombe et al. 2010).
DNA Mitokondria
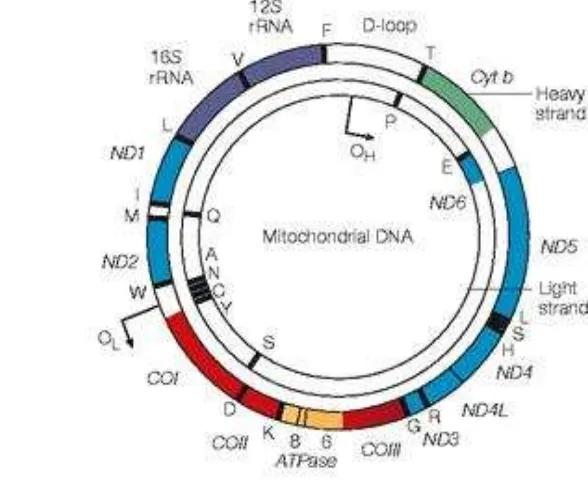
Mitokondria merupakan organel sel penghasil energi yang terdapat dalam sitoplasma. DNA mitokondria (mtDNA) memiliki sejumlah sifat genetik khas yang membedakannya dari genom inti. Genom mitokondria berbentuk sirkuler, beruntai ganda, memiliki panjang sekitar 16.5 kb yang mengandung basa guanine
(G) dan cytosine (C) berkisar antara 32-45.6%. Kedua basa tersebut menyebar tidak merata diantara kedua untai DNA. Distribusi asimetris nukleotida menimbulkan heavy strand (untai berat) dan light strand (untai ringan) ketika molekul mtDNA dipisahkan dalam gradien basa CsCl. Heavy strand atau untai H berisi lebih banyak nukleotida guanin (G) yang mempunyai berat molekul terbesar diantara keempat nukleotida, sedangkan Light strand atau untai L berisi lebih sedikit basa G. Susunan genom mitokondria disajikan pada Gambar 4.
Genom mitokondria terdiri atas gen-gen penyandi rRNA, tRNA dan protein sub unit kompleks enzim rantai respirasi, juga memiliki urutan nukleotida daerah
control region non penyandi (non-coding region) yang dikenal dengan daerah
displacement loop (D-Loop) (Taylor & Turnbull 2005). Replikasi mtDNA dimulai dengan untai-H yang terdapat dalam daerah D-loop mitokondria. Sebanyak 28 produk gen dikodekan dari untai-H, sedangkan untai-L mentranskripsi delapan RNA transfer (tRNA) dan enzim yang disebut ND6.
Jumlah molekul DNA mitokondria dalam sel sangat bervariasi. Rata-rata terdapat 4-5 salinan molekul mtDNA per mitokondria. Setiap sel dapat berisi ratusan mitokondria yang secara matematis bisa sampai beberapa ribu molekul mtDNA dalam setiap sel seperti dalam sel telur (ovum), namun rata-rata diperkirakan terdapat sekitar 500 mtDNA dalam setiap sel. Hal tersebut menjadikan keberhasilan isolasi mtDNA lebih besar (relatif terhadap penanda DNA nukleus) pada sampel biologis yang mungkin telah rusak karena panas atau kelembaban. Perbandingan karakteristik dasar DNA inti dan DNA mitokondria disajikan pada Tabel 3.
Tabel 3 Karakteristik DNA inti dan DNA mitokondria
Karakteristik DNA inti DNA mitokondria
Ukuran genom ~ 3,2 milyar pb ~ 16.569 pb
Jumlah kopi/sel 2 (1 alel setiap tetua) Dapat >1000
Total DNA/sel 99.75% 0.25%
Struktur Linier; dikemas dalam kromosom Sirkuler
Diturunkan dari Ibu dan bapak Ibu
DNA mitokondria ditinjau dari ukuran, jumlah gen dan bentuk yaitu memiliki laju mutasi yang lebih tinggi, sekitar 5-10 kali DNA nukleus, DNA mitokondria terdapat dalam jumlah banyak (lebih dari 1000 kopi) dalam tiap sel, sedangkan DNA nukleus hanya berjumlah dua kopi. DNA nukleus merupakan hasil rekombinasi DNA kedua orang tua sementara DNA mitokondria hanya diwariskan dari ibu atau maternally inherited (Butler 2005). DNA mitokondria pada sel anak seluruhnya disumbangkan oleh ibu dan sperma sama sekali tidak berkontribusi. Keunikan sistem penurunan yang menarik ini telah dimanfaatkan dalam berbagai bidang yaitu penentuan hubungan kekerabatan, studi evolusi dan migrasi, bidang forensik dan identifikasi penyakit genetik.
Kemungkinan memperoleh kembali DNA mitokondria dari sampel biologis dalam jumlah sedikit atau dari sampel biologis yang sudah terdegradasi lebih besar daripada DNA inti karena molekul DNA mitokondria terdapat dalam ratusan sampai ribuan kopi dibanding DNA inti yang hanya dua kopi pada setiap selnya. Oleh karena itu, otot, tulang, rambut, kulit, darah dan cairan tubuh lainnya dapat digunakan sebagai sumber materi untuk penentuan lokus DNA mitokondria apabila terjadi degradasi yang disebabkan oleh peralatan atau karena waktu (Butler 2005).
ATPase6/ATPase8 untuk kuda, gen ND2 (NADH dehidrogenase subunit 2) untuk keledai dan gen ND5 (NADH dehidrogenase subunit 5) untuk babi. Panjang fragmen teramplifikasi untuk kuda, keledai dan babi berturut-turut sepanjang 153, 145 dan 227 pb. Kumar et al. (2011) menggunakan teknik PCR tunggal untuk deteksi daging kambing (Capra hircus). Primer spesifik kambing (DAF-01 dan DGR-04) dirancang pada daerah kekal d-loop mitokondria dan dihasilkan produk PCR sepanjang 294 pb.
Gen Sitokrom b (Cyt b)
Cytochrome b (cyt b) adalah salah satu bagian dari sitokrom yang terlibat dalam transportasi elektron dalam mitokondria. Cyt b berisi delapan transmembran heliks yang dihubungkan oleh intramembran atau domain ekstramembran. Gen cyt b dikodekan oleh DNA mitokondria. Adanya variasi urutan pada cyt b menyebabkan gen ini banyak digunakan untuk membandingkan spesies dalam genus atau famili yang sama. Keunikan sekuen gen cyt b yaitu terdapat bagian yang bersifat kekal di dalam tingkat spesies, sehingga dapat digunakan untuk pengelompokan berdasarkan jenis hewan atau untuk penetuan hubungan kekerabatan antar jenis hewan (Widayanti 2006).
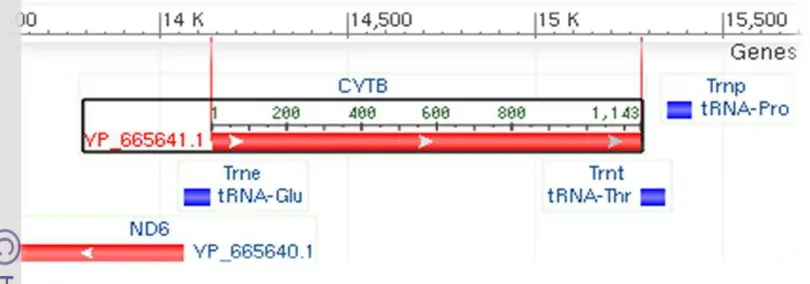
Sekuen gen cyt b yang berasal dari tikus spesies Rattus norvegicus
mempunyai panjang sekuen 1143 pb (Naidu et al. 2010), runutan genom cyt b Capra hircus sepanjang 1140 pb (Liu et al. 2007), Gallus gallus sepanjang 1143 pb (Shen & Nakamura 2000), Bos taurus sepanjang 1140 pb (Geng & Chang 2008), Ovis aries sepanjang 1140 pb (Rezaei et al. 2010), Sus scrofa 1140 pb (Han et al. 2004b), Equus cabalus sepanjang 1139 pb (Han et al. 2004a) dan
Gambar 5 Daerah cyt b dalam genom mitokondria Rattus norvegicus (NCBI 2011).
Minarovič et al. (2010) membedakan beberapa jenis hewan yaitu cerpelai (Mustela vison), ferret (Mustela putorius furo), babi (Sus scrofa domesticus), kelinci (Oryctolagus cuninculus) dan angsa (Anser anser) menggunakan sekuen
cyt b. Metode yang digunakan terdiri atas amplifikasi PCR diikuti oleh pemotongan restriksi (PCR-RFLP) sehingga teknik deteksi menjadi lebih rumit. Matsunaga et al. (1999) mengembangkan sebuah metode sederhana menggunakan multipleks PCR untuk identifikasi dari enam daging yaitu sapi, babi, ayam, domba dan kambing. Fragmen tersebut diamplifikasi dari daging yang dimasak dengan dipanaskan pada suhu 100oC atau 120oC selama 30 menit. Hasil yang diperoleh yaitu sampel yang diteliti teramplifikasi dengan panjang fragmen kambing, ayam, sapi, domba, babi dan kuda berturut-turut adalah 157 pb, 227 pb, 274 pb, 331 pb, 398 pb dan 439 pb, dengan menggunakan primer yang sama tetapi rasio primer berbeda. Berdasarkan klasifikasinya kambing digolongkan ke dalam kelas Mamalia; ordo Artiodactyla; famili Bovidae ; sub famili Caprinae; genus Capra
dan spesies Capra hircus, ayam digolongkan ke dalam kelas Aves; ordo Galliformes, Famili Phasianidae; genus Gallus; spesies Gallus gallus, sapi digolongkan ke dalam kelas Mamalia; ordo Artiodactyla; famili Bovidae; sub famili Bovinae; genus Bos; spesies Bos taurus, domba digolongkan ke dalam kelas Mamalia; ordo Artiodactyla; Famili Bovidae; sub famili Caprinae; genus
kuda digolongkan ke dalam kelas Mamalia; ordo Perissodactyla; famili Equidae; genus Equus; spesies Equus cabalus.
Obrovska et al. (2002) memperoleh fragmen spesifik 227, 274, 398 dan 498 pb masing-masing untuk ayam, sapi, babi dan kuda. Jain et al. (2007) juga memperoleh hasil yang sama untuk setiap jenis ternak yang dicobakan Matsunaga
et al. (1999) akan tetapi ditambahkan sampel kerbau untuk mengetahui perbedaannya dengan fragmen sapi.
Che et al. (2007) mengidentifikasi cemaran babi pada produk pangan untuk verifikasi kehalalan pangan. Dalmasso et al. (2004) mengidentifikasi jenis hewan pada bahan pakan dengan metode multipleks PCR. Ghovvati et al. (2009) melakukan identifikasi jenis hewan untuk mendeteksi pemalsuan produk pada industri pangan. Bottero et al. (2003) melakukan penelitian pada produk susu untuk mengidentifikasi asal susu dari sapi, kambing dan domba perah dengan metode Multipleks PCR. Zhang et al. (2007) menggunakan metode real time PCR mengidentifikasi adanya DNA sapi pada daging, susu dan keju.
Metode Deteksi Cemaran Pangan
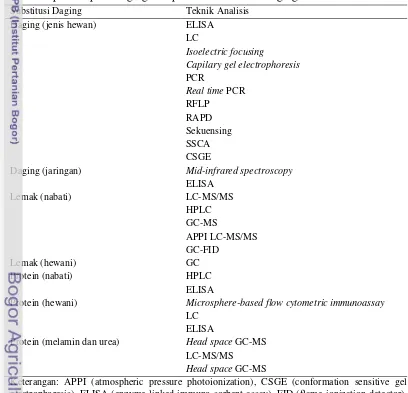
Tuntutan pengembangan metode deteksi dan identifikasi jenis daging dan produk olahannya terus meningkat sebagai suatu upaya perlindungan konsumen, perdagangan dan pelaksanaan undang-undang pelabelan pangan. Teknik identifikasi jenis daging yang cepat, murah dan akurat sangat diperlukan untuk mengetahui sumber daging yang digunakan dalam produk olahan. Pencegahan praktek curang (pemalsuan) dalam produk menjadi bagian penting dalam mengontrol regulasi produk pangan. Menurut Ballin (2010), pemalsuan atau penipuan daging dan produk olahannya dapat dikategorikan ke dalam beberapa kelompok pemalsuan yang paling mungkin terjadi yaitu asal daging, substitusi daging, perlakuan pada saat pengolahan daging dan penambahan bahan lain. Pengelompokan berdasarkan jenis substitusi daging diantaranya yaitu substitusi sumber daging lain, lemak dan protein. Beberapa teknik analisis identifikasi substitusi daging dan produk olahannya disajikan pada Tabel 4.
atau penanda untuk menelusuri asal-usul atau kekerabatan suatu jenis hewan. Identifikasi suatu jenis daging dan produk olahannya dapat dilakukan dengan metode berdasarkan pemisahan fraksi molekul (elektroforesis), metode imunologi (single diffusion, double diffusion, ELISA = enzym linked immunosorbent assay, RID = radial immunodiffusion, CIE = counter immunoelectrophoresis), komposisi asam lemak (chromatography gas dan high performance liquid chromatography). Semua metode tersebut mempunyai kelemahan yaitu hanya bisa dilakukan dalam bentuk segar (mentah), memerlukan sampel yang cukup banyak dan keakuratan rendah dalam keadaan matang (daging olahan) (Kesmen 2007).
Tabel 4 Teknik analisis deteksi dan identifikasi substitusi daging, lemak dan protein pada daging dan produk olahan asal daging
Substitusi Daging Teknik Analisis
Protein (melamin dan urea) Head space GC-MS LC-MS/MS
Head space GC-MS
Keterangan: APPI (atmospheric pressure photoionization), CSGE (conformation sensitive gel electrophoresis), ELISA (enzyme-linked immuno sorbent assay), FID (flame ionization detector), GC (gas chromatography), HPLC (high performance liquid chromatography), LC (liquid chromatography), MS (mass spectrometry), PCR (polymerase chain reaction), RAPD (random amplified polymorphic DNA), RFLP (restriction fragment length polymorphism).
Perkembangan pesat dalam teknologi molekuler memungkinkan teknik analisis berbasis DNA dan telah menyebabkan perubahan dalam identifikasi jenis daging yang biasanya dilakukan dari protein. Degenerasi DNA memiliki keuntungan yang membedakan antara jenis hewan yang berbeda. Bila dibandingkan dengan protein, DNA memiliki stabilitas termal yang lebih tinggi, terdapat dalam sebagian besar sel dan memungkinkan untuk memperoleh informasi tanpa mengetahui jaringan asal. Metode amplifikasi yang paling populer adalah polimerase chain reaction (PCR). Teknik PCR mampu membuat target yaitu asam nukleat lebih dari satu miliar kali lipat dari sampel DNA yang sangat sedikit atau dalam batas untuk deteksi (Nollet & Toldrá 2011). Oleh karena itu, sampel yang dibutuhkan lebih sedikit dibandingkan dengan pengujian berbasis protein. Teknologi DNA (hibridisasi DNA, Polymerase Chain Reaction-Random Amplified Polymorphic DNA = PCR-RAPD, PCR-Restriction Fragment Length Polymorphism = PCR-RFLP, PCR dengan primer spesifik), merupakan metode yang sangat praktis dan akurat, mempunyai kelebihan dapat mendeteksi protein yang sudah terdegradasi (matang atau produk olahan) dalam kandungan yang sangat sedikit (µg) (Nuraini 2004). Beberapa jenis analisis PCR digunakan karena mudah mengamplifikasi daerah target dari template DNA dalam waktu yang lebih singkat sehingga cocok untuk identifikasi daging dan produk olahan daging.
Identifikasi jenis hewan merupakan salah satu tujuan penggunaan penanda DNA. Hal ini dilakukan untuk bermacam kepentingan, salah satunya adalah untuk menghindari terjadinya pencemaran pada produk pangan sehingga dapat mengidentifikasi suatu bahan yang tidak seharusnya ada. Identifikasi asal daging pada sampel produk sangat berguna bagi konsumen karena beberapa alasan yaitu (a) kemungkinan kerugian ekonomi dari substitusi daging tersebut yang termasuk penipuan produk, (b) terhadap kesehatan individu yang mungkin dapat mengalami alergi spesifik pada daging tertentu dan (c) alasan keagamaan (Miguel et al.
METODE
Waktu dan TempatPenelitian ini dilaksanakan mulai bulan September 2010 sampai dengan bulan Pebruari 2011. Penelitian dilakukan di Laboratorium Genetika Molekuler Ternak Bagian Pemuliaan dan Genetika dan Laboratorium Terpadu, Departemen Ilmu Produksi dan Teknologi Peternakan, Fakultas Peternakan Institut Pertanian Bogor.
Materi
Sampel DNA
Sampel DNA diisolasi dari beberapa jenis tikus yaitu tikus got, tikus putih, tikus rumah, mencit dan tikus hutan, sebagai pembanding digunakan sampel dari berbagai jenis hewan antara lain kambing, ayam, sapi, domba, babi, kuda dan marmut (tikus Belanda). Sampel DNA yang digunakan dalam penelitian ini berasal dari darah, daging dan produk olahan. Sampel DNA yang diisolasi dari darah yaitu kambing, ayam, sapi, domba, kuda, tikus dan marmut. Sampel DNA yang berasal dari daging yaitu babi dan tikus. Sampel DNA yang berasal dari produk olahan yaitu bakso dan abon. Jumlah sampel yang berasal dari darah, daging dan produk olahan yaitu berturut-turut sebanyak 32, 4 dan 52 sampel. Pembuatan produk olahan daging (bakso dan abon) menggunakan daging tikus
Ratus norvegicus strain albino sebagai bahan campuran pada produk bakso dan abon sapi yang terdiri atas beberapa level cemaran yaitu 1; 2.5; 5; 7.5; 10; 15; 20 dan 25%.
Primer
Tabel 5 Sekuen primer spesifik gen cyt b dari tujuh jenis hewan
Jenis Hewan Reverse (5‟ –3‟) Hasil Amplifikasi
Kambing CTC GAC AAA TGT GAG TTA CAG AGG GA* 157 bp
** perancangan primer menggunakan software MEGA 4
Bahan kimia yang digunakan adalah buffer TEN (10 mM Tris-HCl, 5 mM EDTA dan 10 mM NaCl), 10 % SDS, fenol, kloroform, etanol 70 %, etanol absolut, 5M NaCl, buffer TE (10 mM Tris-HCl dan 1 mM EDTA), akuades, akuabides, 10 x buffer PCR (100 mM Tris-HCl, 500 mM KCl, 15 mM MgCl2 dan
0.1 % Triton X-100), dNTP‟s, agarose, ethidium bromida, buffer TAE (Tris-HCl, asam asetat, EDTA), loading dye dan DNA marker. Enzim yang digunakan adalah 10 mg/µl proteinase-K, RNA-se dan Taq DNA Polymerase.
Peralatan yang digunakan adalah tabung eppendorf (1.5 ; 0.5 dan 0.2 ml), tip pipet (100 ; 200 dan 1000 l), pipet mikro, mikro sentrifuse, mortar, vorteks,
water bath-shaker, vacuum dryer, spektrofotometer (GeneQuant 1300), mesin PCR GeneAmp® PCR System 9700 (Applied Biosystems™), satu set alat elektroforesis gel agarose (MUPID) dan kamera Polaroid (MP 4 Polaroid camera + UV transilluminator).
Prosedur
Perancangan Primer Reverse Tikus
Perancangan primer spesifik untuk tikus berdasarkan runutan nukleotida gen
cyt b pada tikus yang terdapat dalam GenBank (NCBI). Spesies tikus yang digunakan yaitu Rattus norvegicus sepanjang 1143 pb (nomor akses GenBank HM222710). Sekuen gen tersebut kemudian dihomologikan dengan cyt b Capra hircus (nomor akses GenBank EU130780), Gallus gallus (nomor akses GenBank AF195628), Bos taurus (nomor akses GenBank AF195628), Ovis aries (nomor akses GenBank EU365990), Sus scrofa (nomor akses GenBank AY634188) dan
kemudian dilakukan perancangan primer reverse tikus dengan melihat runutan basa yang hanya terdapat pada tikus tetapi tidak terdapat pada jenis hewan lain, sehingga diharapkan primer reverse tersebut dapat menjadi primer spesifik tikus.
Software yang digunakan untuk perancangan primer spesifik tikus adalah MEGA 4. Tahapan penggunaan program yaitu (1) runutan nukleotida yang diperoleh dari GenBank dan primer dipastikan sudah dalam bentuk FASTA (2) runutan nukleotida setiap jenis hewan dan primer tersebut dibuka pada software
MEGA 4, (3) dilakukan multiple alignment dengan terlebih dahulu mencari situs penempelan primer forward untuk semua jenis hewan dan (4) ditentukan daerah spesifik untuk tikus yang tidak terdapat pada keenam jenis hewan yang digunakan.
Uji Homologi Primer Spesifik
Uji homologi primer spesifik terhadap tujuh jenis hewan yang digunakan dalam penelitian ini dilakukan dengan genetic information processing software
GENETYX-WIN versi 4.0. Tahapan penggunaan program ini yaitu (1) software
dibuka, (2) diklik „New Sequence‟ pada „File‟, (3) diberi nama primer pada ID yang tersedia, (4) runutan primer diketik pada kotak, (4) diklik „Search Homology‟ pada „Nucleotide‟, (5) sekuen cyt b yang sudah dalam bentuk FASTA dimasukkan dengan cara diklik „add‟ lalu „ok‟ dan hasil pengujian akan langsung ditampilkan.
Pembuatan Produk Olahan Asal Daging (Kontrol Positif)
(100oC) selama 10 menit. Bakso kemudian diangkat dan ditiriskan selama 15 menit. Bakso dikemas dalam plastik untuk selanjutnya diekstraksi.
Pembuatan Abon Sapi Dicemari Daging Tikus. Daging segar yang telah dibersihkan dari lemak dicuci. Daging tikus ditambahkan kemudian dimasukkan ke dalam panci presto yang berisi air sampai permukaan daging terendam, direbus dalam air mendidih (100oC) sampai empuk selama 30 menit. Daging tersebut diangkat dan ditiriskan dalam nampan yang dialasi kertas buram untuk mempermudah penyerapan air. Persentase bahan tambahan yang digunakan untuk ketumbar halus, bawang merah, garam, gula putih dan lengkuas berturut-turut sebesar 3.75%, 3.17%, 3.06%, 9.16% dan 5.40% dari daging. Daging diremah dengan garpu, kemudian dicampurkan bumbu-bumbu yang terdiri atas garam, ketumbar, lengkuas, gula putih, bawang merah yang telah dihaluskan dan ditumbuk sampai bumbu tercampur merata. Remahan daging berbumbu tersebut digoreng sampai terjadi perubahan warna menjadi agak kecokelatan selama 45 menit dengan suhu penggorengan 172oC. Abon dikeluarkan minyaknya dengan alat penekan manual dan dikeringkan pada suhu 105oC selama 30 menit. Abon yang sudah matang disimpan dalam nampan yang dialasi kertas minyak sambil diangin-anginkan untuk selanjutnya dikemas dan siap untuk diekstraksi.
Isolasi dan Ekstraksi DNA
Isolasi dan ekstraksi DNA dilakukan pada sampel darah dan produk olahan daging mengikuti metode Sambrook et al. (1989) yang telah dimodifikasi dalam preparasi sampel dan degradasi protein.
Degradasi Protein. Sampel darah dan daging yang telah dibersihkan dari alkohol serta sampel produk olahan yang telah dipotong halus tersebut masing-masing ditambahkan 1x STE (sodium tris EDTA) sampai volume 340 µl (± 200 µl), 40 µl SDS (sodium dosesil sulfat) 10% dan 20 µl proteinase K 10 mg/ml. Tabung berisi campuran tersebut dihomogenkan dengan shaker dan diinkubasi pada suhu 55ºC selama 2 jam untuk mengoptimalkan kerja enzim dalam memecah protein.
Degradasi Bahan Organik. Sampel yang telah diinkubasi ditambahkan fenol sebanyak 400 µl, CIAA (kloroform : isoamil alkohol dengan perbandingan 24:1) sebanyak 400 µl dan 40 µl NaCl 5M, dicampurkan perlahan-lahan dan merata dengan cara menggerakkan tabung membentuk angka delapan selama satu menit. Larutan diinkubasi kembali selama 15 menit dalam suhu ruang sambil terus dibolak-balik.
Presipitasi DNA. Bahan organik yang sudah didegradasi disentrifugasi pada kecepatan 12000 rpm selama 5 menit dengan suhu 20 oC hingga fase DNA terpisah dengan fase fenol. Fase DNA dipindahkan dalam tabung baru. Sebanyak 800 µl alkohol absolut dan 40 µl 5M NaCl ditambahkan, kemudian diinkubasi pada suhu -20 ºC selama semalam. Larutan disentrifugasi pada kecepatan 12000 rpm selama 10 menit, bagian alkohol dibuang sebanyak mungkin. Bagian endapan (DNA) yang tersisa ditambahkan 800 µl alkohol 70% dan disentrifugasi pada kecepatan 12000 rpm selama 5 menit dengan suhu 20 oC, bagian alkohol yang terbentuk dibuang kembali sebanyak mungkin. Bagian DNA yang tersisa dibiarkan dalam keadaan terbuka pada suhu ruang sampai kering untuk menghilangkan alkohol, lalu ditambahkan sebanyak 100 µl larutan TE (Tris EDTA). Sampel DNA disimpan pada suhu -20 ºC dan siap untuk digunakan.
Pengujian DNA Total
Pengujian DNA hasil ekstraksi secara kualitatif dilakukan dengan elektroforesis pada gel 1%. Gel dibuat dari 0.3 gram agarose dan 30 ml larutan
Pengujian DNA hasil ekstraksi secara kuantitatif dilakukan dengan spektrofotometer GeneQuant 1300. Sampel DNA sebanyak 3µl dimasukkan ke dalam tabung eppendorf 1.5 ml ditambah air destilata sebanyak 597 µl. Larutan TE (Tris EDTA) digunakan sebagai blangko dengan cara yang sama yaitu sebanyak 3 µl larutan TE ditambah air destilata, lalu dimasukkan dalam tabung
eppendorf 1.5 ml. Sampel dan blangko di spin down selama 0.5 menit, kemudian dilakukan pengujian dengan spektrofotometer.
Amplifikasi Fragmen DNA Spesifik
Amplifikasi ruas gen cyt b dilakukan dengan metode multipleks PCR. Sampel DNA sebanyak 2 µl dimasukkan ke dalam tabung PCR 0.2 ml, ditambahkan komponen-komponen PCR yang terdiri atas primer forward 35 pmol, primer reverse masing-masing 5 pmol, campuran dNTP 200 µl, MgCl2 1
mM, dan 0.5 unit enzim Taq polymerase dan bufernya. Proses amplifikasi dilakukan pada mesin thermocycler GeneAmp® PCR System (Applied Biosystems TM) dengan suhu pradenaturasi 94oC selama 5 menit, 30 siklus yang terdiri atas denaturasi 94oC selama 30 detik, annealing 60oC selama 45 detik,
elongasi 72oC selama 1 menit dan elongasi akhir 72oC selama 5 menit. Setelah proses tersebut selesai, tabung diambil dan disimpan pada suhu ruang atau pada suhu 4oC sampai akan dianalisis lebih lanjut.
Elektroforesis dan Visualisasi Produk PCR
Produk PCR divisualisasikan dengan teknik elektroforesis gel agarose 2%. Gel dibuat dari 0.6 gram agarose dan 30 ml larutan buffer (0.5 x TBE) yang dipanaskan. Larutan agarose dibiarkan agak dingin sambil diaduk dengan stirrer,
lalu ditambahkan 2.5 μl pewarna ethidium bromide. Sebanyak 5 μl produk PCR
dilarutkan dalam 1 μl loading dye. Elektroforesis dilakukan selama 40 menit pada tegangan konstan 100 volt atau sampai pewarna bromtimol blue mencapai bagian bawah gel. Setelah elektroforesis selesai, gel diambil untuk dilakukan pemotretan menggunakan UV.
Analisis Data
yang diperoleh dianalisis secara deskriptif dan dihitung persentase keberhasilan sampel DNA yang teramplifikasi dengan rumus:
HASIL DAN PEMBAHASAN
Perancangan Primer Spesifik Tikus
Teknik multipleks PCR diaplikasikan dalam penelitian ini sehingga primer yang digunakan terdiri atas satu primer forward dengan tujuh primer reverse
untuk tujuh jenis hewan yang digunakan. Primer forward yang sama untuk semua jenis hewan mengacu pada Matsunaga et al. (1999). Primer reverse setiap jenis hewan dirancang pada daerah spesifik dalam runutan nukleotida cyt b. Primer
reverse tikus dalam penelitian ini dirancang dengan program MEGA 4.
Sekuen gen cyt b beberapa jenis hewan diperoleh dari NCBI (http://www.ncbi.nlm.nih.gov/). Sekuen cyt b tikus (Rattus norvegicus)sepanjang 1143 pb (nomor akses GenBank HM222710) disejajarkan (multiple alignment) dan dicari runutan basa yang hanya terdapat pada sekuen cyt b jenis hewan terletak di dalam gen cyt b berdekatan dengan gen tRNA Glu. Posisi penempelan primer hasil rancangan ditampilkan pada Gambar 6.
Gambar 6 Situs penempelan primer pada sekuen gen cyt b Rattus norvegicus
(nomor akses GenBank HM222710). Posisi primer forward (warna kuning/cetak tebal bergaris bawah), primer reverse hasil rancangan (warna merah/kotak).
1 atgacaaaca tccgaaaatc tcacccccta ttcaaaatca tcaaccactc ctttatcgac
Situs penempelan primer forward dimulai dari posisi basa ke-58 sampai basa ke-95, sedangkan situs penempelan primer hasil rancangan mulai dari posisi basa ke-660 sampai basa ke-633 pada runutan nukleotida sekuen gen cyt b tikus (Rattus norvegicus). Desain primer sangat penting dan menentukan pada teknik multipleks PCR, karena spesifisitas primer dan temperature melting (Tm) lebih menentukan keberhasilan amplifikasi dibandingkan dengan simpleks PCR. (Matsunaga et al. 1999). Menurut Henegariu et al. (1997) primer yang digunakan dalam multipleks PCR harus memenuhi beberapa syarat seperti panjang primer terdiri atas 18-24 pb atau lebih, kandungan basa GC 35-60% serta memiliki suhu
annealing 55-58oC atau lebih tinggi. Hasil rancangan primer reverse tikus sudah memenuhi syarat sebagai suatu rangkaian primer dan ditampilkan pada Tabel 6. Tabel 6 Kriteria primer tikus hasil rancangan
Kriteria Primertikus
Uji homologi primer spesifik terhadap tujuh jenis hewan dalam penelitian ini dilakukan melalui perhitungan persentase kesamaan runutan basa dari setiap jenis hewan yang diuji, sehingga diketahui tingkat kespesifikan dari suatu runutan DNA. Uji homologi penentuan spesifisitas menggunakan genetic information processing software GENETYX-WIN versi 4.0. Hasil uji homologi primer spesifik pada sekuen cyt b tujuh jenis hewan disajikan pada Tabel 7.
Tabel 7 Derajat kesamaan primer spesifik pada tujuh jenis hewan
Hasil penelitian menunjukkan bahwa primer forward memiliki persentase kesamaan yang relatif tinggi terhadap sekuen kambing, ayam, sapi, domba, babi, kuda dan tikus, yaitu berkisar antara 86.8 - 100% dari runutan 38 basa. Runutan primer reverse memiliki persentase kesamaan yang tinggi pada satu jenis hewan tertentu dan rendah pada jenis hewan lainnya, sehingga dapat dikatakan primer
reverse tersebut bersifat spesifik untuk satu jenis hewan tertentu. Sekuen primer
reverse ayam memiliki persentase kesamaan 100% dengan sekuen gen cyt b ayam dari runutan 27 basa, tetapi persentase kesamaan dengan jenis hewan lain adalah rendah, begitu pula dengan sekuen primer reverse sapi, domba, babi dan kuda. Hasil tersebut sesuai dengan penelitian Matsunaga et al. (1999) yaitu rasio ketidakcocokan antara primer spesifik dengan sekuen jenis hewan lain lebih dari 15% kecuali rangkaian sepasang primer kambing dan domba. Ketidaksesuaian lebih dari 15% menurunkan melting temperature (Tm) lebih dari 15oC dan membuat primer reverse menempel hanya untuk sekuen spesifik jenis hewan tertentu dalam multipleks PCR.
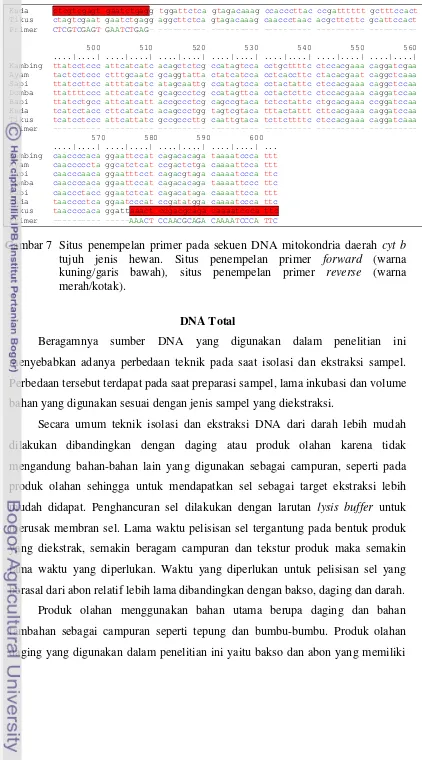
Kuda ctcgtcgagt gaatctgagg tggattctca gtagacaaag ccacccttac ccgatttttt gctttccact kuning/garis bawah), situs penempelan primer reverse (warna merah/kotak).
DNA Total
Beragamnya sumber DNA yang digunakan dalam penelitian ini menyebabkan adanya perbedaan teknik pada saat isolasi dan ekstraksi sampel. Perbedaan tersebut terdapat pada saat preparasi sampel, lama inkubasi dan volume bahan yang digunakan sesuai dengan jenis sampel yang diekstraksi.
Secara umum teknik isolasi dan ekstraksi DNA dari darah lebih mudah dilakukan dibandingkan dengan daging atau produk olahan karena tidak mengandung bahan-bahan lain yang digunakan sebagai campuran, seperti pada produk olahan sehingga untuk mendapatkan sel sebagai target ekstraksi lebih mudah didapat. Penghancuran sel dilakukan dengan larutan lysis buffer untuk merusak membran sel. Lama waktu pelisisan sel tergantung pada bentuk produk yang diekstrak, semakin beragam campuran dan tekstur produk maka semakin lama waktu yang diperlukan. Waktu yang diperlukan untuk pelisisan sel yang berasal dari abon relatif lebih lama dibandingkan dengan bakso, daging dan darah.
perbedaan perlakuan pada saat proses pengolahan. Beberapa perlakuan dalam pembuatan produk tersebut dapat menjadi penyebab kesulitan pada saat isolasi dan ekstraksi DNA. Tahapan penting yang mempengaruhi isolasi DNA dari bakso dan abon yaitu (1) proses pengolahan secara mekanik diantaranya yaitu pencacahan dan penggilingan daging pada bakso, daging diremah atau disuwir-suwir dan ditumbuk halus serta pengepresan atau pengeluaran minyak pada abon. Beberapa proses tersebut menyebabkan terjadinya perubahan ukuran partikel, bentuk dan komposisi protein penyusun daging, sehingga akan mempengaruhi keadaan sel yang di dalamnya mengandung DNA, (2) perlakuan pemanasan dengan suhu dan tekanan tinggi diantaranya yaitu perebusan adonan bakso pada suhu 80oC, perebusan dalam air mendidih (100oC), perebusan dalam panci presto dan penggorengan abon pada suhu 175oC. Proses-proses tersebut selain mengakibatkan protein terdenaturasi juga berpengaruh pada stabilitas DNA, (3) pencampuran bumbu-bumbu dan bahan lain pada bakso yaitu penambahan tepung tapioka, STPP (sodium triposfat) dan bumbu-bumbu (garam, lada, bawang putih) serta penambahan bumbu-bumbu pada abon (garam, ketumbar, lengkuas, gula putih dan bawang merah). Menurut Nuraini (2004), bahan dan bumbu-bumbu yang ditambahkan dalam produk olahan menyebabkan DNA yang diekstraksi masih tercampur dengan senyawa kontaminan seperti oligopeptide, polisakarida, protein dan bahan-bahan organik lainnya.
amplifikasi DNA tidak dipengaruhi oleh penambahan rempah-rempah atau proses pemasakan.
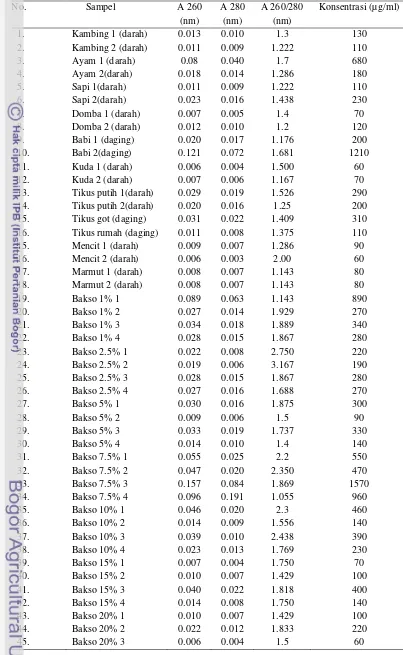
Pengujian DNA hasil ekstraksi dilakukan secara kualitatif dan kuantitatif. Penilaian kualitas DNA dilakukan dengan elektroforesis pada gel agarose 1% yang dijalankan pada tegangan 100 volt selama 40 menit. Hasil uji kualitas DNA pada gel agarose 1% disajikan pada Gambar 8 dan 9.
Gambar 8 Visualisasi DNA hasil ekstraksi darah dan daging beberapa jenis hewan pada gel agarose 1%. M: marker 100 pb, 1-2: DNA kambing, 3-4: DNA Ayam, 5-6: DNA sapi, 7-8: DNA domba, 9-10: DNA babi, 11-12: DNA kuda dan 13-14: DNA tikus.
Gambar 9 Visualisasi DNA hasil ekstraksi produk olahan (bakso dan abon) pada gel agarose 1%. M: marker 100 pb, 1-6: DNA bakso, 7-11: DNA abon.
daging akan meningkatkan degradasi DNA dan kesulitan recovery DNA yang dianalisa (Martín et al. 2007).
Secara kuantitatif hasil pengukuran konsentrasi DNA dilakukan dengan spektrofotometer. Pengukuran jumlah DNA dengan spektrofotometer didasarkan pada prinsip iradiasi sinar ultraviolet yang diserap oleh nukleotida dan protein dalam larutan. Analisis asam nukleat umumnya dilakukan untuk penentuan konsentrasi rata-rata dan kemurnian DNA yang terdapat dalam sampel. Jumlah dan kemurnian tertentu diperlukan untuk kinerja optimal sampel DNA yang digunakan. Asam nukleat menyerap sinar ultraviolet dengan pola tertentu. Sampel ditembus sinar ultraviolet dan fotodetektor cahaya pada 260 nm, semakin besar cahaya yang diserap sampel, maka semakin tinggi konsentrasi asam nukleat dalam sampel (Sambrook & Russel 2001).
Sampel asam nukleat dapat terkontaminasi dengan molekul lain seperti protein, senyawa organik dan lain-lain. Spektrofotometer dapat digunakan untuk penentuan tingkat kemurnian DNA yang berkorelasi dengan kualitas DNA yaitu dengan melihat rasio absorbansi pada panjang gelombang 260 dan 280 nm (A260/280). Rasio absorbansi pada 260 nm dan 280 nm umumnya digunakan untuk menilai kontaminasi DNA oleh protein karena protein menyerap cahaya pada panjang gelombang 280 nm. Nilai absorbansi pada 260/280 nm untuk DNA murni adalah sekitar 1.8 (~1.8). Rasio 260/280 nm memiliki sensitifitas yang tinggi untuk menilai kontaminasi DNA oleh protein. Semakin tinggi kandungan asam nukleat dalam sampel, maka semakin rendah rasio nilai absorbansi pada 260/280 nm, begitu pula sebaliknya. Nilai negatif dapat terjadi jika pelarut yang digunakan dalam sampel dan blanko berbeda atau karena terdapatnya pewarna fluoresens dalam larutan (Tataurov et al. 2008).
Pengujian Primer Spesifik
Amplifikasi Fragmen DNA Cyt b Spesifik pada Beberapa Jenis Hewan
Teknik multipleks PCR digunakan dalam penelitian ini untuk amplifikasi sampel DNA oleh primer spesifik dengan pencampuran delapan primer (satu
forward dan tujuh reverse) secara bersamaan dalam satu reaksi. Amplifikasi daerah gen cyt b DNA mitokondria berhasil dilakukan pada kambing, ayam, sapi, domba, babi dan kuda menggunakan primer yang mengacu pada Matsunaga et al.
(1999) dan amplifikasi tikus menggunakan primer reverse hasil rancangan dengan
software MEGA 4. Tujuh jenis hewan berhasil diidentifikasi berdasarkan panjang pita atau produk PCR yang dihasilkan dengan tidak terjadinya reaksi silang. Keberhasilan amplifikasi gen cyt b tersebut ditunjukkan dengan panjang fragmen teramplifikasi berbeda-beda antar hewan yang berarti terdapat kespesifikan sekuen gen cyt b pada setiap jenis hewan.
Panjang fragmen hasil amplifikasi ruas gen cyt b kambing, ayam, sapi, domba, babi dan kuda sesuai dengan hasil yang diperoleh Matsunaga et al. (1999) yaitu berturut-turut 157 pb, 227 pb, 274 pb, 331 pb, 398 pb dan 439 pb, sedangkan untuk tikus teramplifikasi sepanjang 603 pb. Hasil amplifikasi ruas gen cyt b
ketujuh jenis ternak divisualisasikan pada gel agarose 2% yang dapat dilihat pada Gambar 10.
Gambar 10 Visualisasi hasil amplifikasi fragmen DNA spesifik tujuh jenis hewan. M: marker 100 pb, 1-2: kambing, 3-4: ayam, 5-6: sapi, 7-8: domba, 9-10: babi, 11-12: kuda dan 13-14: tikus.
untuk setiap jenis hewan teramplifikasi hanya pada satu ukuran untuk setiap target (Matsunaga et al. 1999). Gambar 9 menunjukkan bahwa hasil multipleks PCR berupa pita tunggal pada ukuran target dari satu jenis hewan dan tidak dihasilkan fragmen pada amplifikasi yang tidak spesifik.
Amplifikasi Fragmen DNA Cyt b pada Beberapa Jenis Tikus
Pengujian primer tikus hasil rancangan dilakukan pada beberapa jenis tikus untuk mengetahui perbedaannya jika sampel yang digunakan berasal dari jenis tikus yang berbeda. Tikus yang digunakan yaitu tikus rumah hitam (Rattus rattus), tikus got (Rattus norvegicus), tikus putih (Rattus norvegicus), mencit (Mus musculus) dan tikus hutan (Maxomys hellwaldii). Hasil amplifikasi divisualisasikan pada gel elektroforesis 2% dan ditampilkan pada Gambar 11 dan 12.
Gambar 11 Visualisasi hasil amplifikasi fragmen DNA tikus. M: marker 100 pb, 1-3: tikus got, 4-6: tikus putih, 7-8: tikus rumah, 9: mencit.
Tikus hutan (Maxomys hellwaldii) yang digunakan dalam penelitian ini berasal dari Sulawesi Utara. Maxomys hellwaldii disebut juga tikus berduri atau tikus hutan ekor putih, hidup di hutan hujan tropis dan hanya ditemukan di Indonesia. Maxomys awalnya digolongkan sebagai subgenus dari Rattus, tetapi oleh Musser et al. (1979) tikus ini digolongkan menjadi genus tersendiri dan dimasukan ke dalam famili Muridae dan sub famili Murinae sama seperti Rattus.
Hasil menunjukkan bahwa DNA cyt b pada kelima jenis tikus dapat teramplifikasi menggunakan primer tikus hasil rancangan. Jika dilihat taksonominya kelima tikus tersebut digolongkan dalam sub ordo dan famili yang sama yaitu Myomorpha dan Muridae. Perbedaan pada tikus dan mencit terletak pada tingkat genus. Hasil yang sama diperoleh Jain et al. (2007) yaitu dengan teramplifikasinya fragmen cyt b kerbau menggunakan primer spesifik untuk sapi yang dirancang Matsunaga et al. (1999). Kesamaan taksonomi antara sapi dan kerbau sampai pada tingkat famili dan sub famili yaitu Bovidae dan Bovinae. Menurut Jain et al. (2007), hal tersebut mungkin disebabkan pada saat perancangan runutan basa sekuen primer spesifik tidak sampai pada tingkat genus, sehingga untuk membedakan daging sapi dan kerbau perlu dirancang primer dari runutan basa spesifik jenis hewan tersebut agar dapat dibedakan seperti pada rancangan primer domba dan kambing oleh Matsunaga et al. (1999).
Hasil yang diperoleh dalam penelitian ini yaitu asal DNA sudah dapat dibedakan sampai tingkat famili pada klasifikasi tikus. Jika bertujuan untuk membedakan tikus sampai pada setiap jenisnya, maka perancangan primer harus dilakukan dengan pencarian runutan khas yang hanya terdapat pada setiap genus tikus tertentu.
Amplifikasi Fragmen DNA Cyt b Spesifik pada Marmut
Gambar 13 Visualisasi hasil amplifikasi fragmen DNA cyt b pada sampel DNA tikus putih dan marmut. M: marker 100 pb, Rn: DNA tikus putih dan 1-4: DNA marmut.
Sampel DNA marmut (Cavia porcellus) tidak teramplifikasi oleh primer tikus yang berarti bahwa primer tikus hasil rancangan spesifik hanya dapat mengamplifikasi fragmen DNA cyt b tikus. Hal ini kemungkinan disebabkan terdapat perbedaan runutan nukleotida gen cyt b marmut dan tikus. Menurut Widayanti (2006), adanya variasi urutan pada cyt b menyebabkan gen tersebut banyak digunakan untuk membandingkan jenis hewan dalam genus yang sama atau famili yang sama. Berdasarkan taksonominya tikus dan marmut termasuk ke dalam ordo yang sama yaitu rodensia yang berarti sama-sama merupakan hewan pengerat. Perbedaan antara tikus dan marmut terletak pada penggolongan sub ordo. Tikus digolongkan ke dalam sub ordo Myomorpha sedangkan marmut digolongkan ke dalam sub ordo Hystricomorpha.