EFEKTIVITAS MINYAK SEREH, GARAM, ZEOLIT, DAN
KARBON AKTIF TERHADAP KELANGSUNGAN HIDUP
BENIH IKAN PATIN
Pangasius sp
PADA TRANSPORTASI
TERTUTUP
WA ODE SRY WULAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul “Efektivitas Minyak Sereh, Garam, Zeolit, dan Karbon Aktif terhadap Kelangsungan Hidup Benih Ikan Patin
Pangasius sp pada Transportasi Tertutup” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2016
Wa Ode Sry Wulan
RINGKASAN
WA ODE SRY WULAN. Efektivitas Minyak Sereh, Garam, Zeolit, dan Karbon Aktif terhadap Kelangsungan Hidup Benih Ikan Patin Pangasius sp pada Transportasi Tertutup. Dibimbing oleh EDDY SUPRIYONO dan DINAMELLA WAHJUNINGRUM.
Ikan patin Pangius sp merupakan salah satu jenis komoditas ikan air tawar dari perairan Indonesia yang memiliki nilai ekonomis tinggi. Usaha kegiatan pembenihan ikan patin tersebar di daerah Jawa Barat sedangkan usaha kegiatan pendederan dan pembesaran berada di daerah Sumatera, Kalimantan dan daerah Jawa lainnya. Untuk menunjang kegiatan produksi maka diperlukan adanya tranportasi dari lokasi usaha kegiatan pembenihan ke lokasi usaha pendederan dan pembesaran.
Teknologi transportasi ikan pada kegiatan budidaya mengalami peningkatan, diantaranya transportasi dengan menggunakan suhu rendah, penggunaan zeolit dan karbon aktif, garam dan penggunaan anastesi sebagai penenang ikan dalam transportasi ikan. Permasalahan yang timbul dari transportasi tertutup adalah kualitas air yang menurun dan terjadinya stres pada ikan akibat guncangan yang mempengaruhi kondisi fisiologis ikan yang dapat mengakibatkan kematian. Minyak sereh mengandung citronellal, sitronelol, dan geraniol. Minyak sereh adalah minyak atsiri yang mampu menurunkan metabolisme dengan cara memingsankan dan menenangkan ikan. Penelitian ini bertujuan untuk mengevaluasi minyak sereh dengan penambahan garam, zeolit dan karbon aktif dalam meminimalisir tingkat stres benih ikan patin dan mempertahankan kualitas air pada media selama transportasi serta untuk menganalisis dampak kondisi fisiologis ikan patin pasca-transportasi.
Penelitian ini dilakukan pada bulan Januari 2016 hingga April 2016 di Laboratorium Lingkungan Akuakultur, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Ikan uji yang digunakan pada percobaan ini adalah benih ikan patin dengan panjang rata-rata 5,6±0,266 cm. Penelitian ini dilaksanakan melalui tiga tahap, yaitu penelitian pendahuluan, penelitian transportasi,dan penelitian pasca-transportasi selama 30 hari. Pada penelitian pendahuluan dilakukan penentuan kemampuan puasa ikan, tingkat konsumsi oksigen, laju eksresi amonia, penentuan kapasitas zeolit dan karbon aktif dalam penyerapan TAN. Penelitian transportasi adalah tranportasi sistem tertutup selama 72 jam. Transportasi benih ikan patin dengan kepadatan 150 ekor/L dengan setiap perlakuan ditambahkan 6 g garam, 20 g zeolit, 10 g karbon aktif dan minyak sereh masing-masing perlakuan K (kontrol), 0 mg/L, 3,5 mg/L,7 mg/L dan 10,5 mg/L. Pada saat transportasi benih ikan patin selama 72 jam diamati tingkat kelangsungan hidup (TKH) dan kualitas air. Penelitian pasca-transportasi selama 30 hari dilakukan pengamatan respons fisiologis benih ikan patin yang meliputi gambaran darah dan glukosa darah; tingkat kelangsungan hidup (TKH) dan laju pertumbuhan harian (LPH).
Hasil penelitian pendahuluan menunjukkan bahwa ikan patin uji dapat bertahan hidup selama tujuh hari tanpa diberi pakan. Tingkat konsumsi oksigen (TKO) benih ikan patin sebesar 0,07±0,03 mgO2/g/jam, laju ekskresi TAN benih
pasca-transportasi menunjukkan tingkat kelangsungan hidup (TKH) benih ikan patin sebesar 86,67±1,33 %. Hasil penelitian pasca-transportasi menunjukkan pemberian minyak sereh 7 mg/L, garam 6 g, zeolit 20 g dan karbon aktif 10 g dalam transportasi tertutup berkepadatan 150 ekor selama 72 jam memberikan hasil terbaik pada tingkat kelangsungan hidup benih ikan patin tinggi dan kondisi fisiologis tetap baik. Pengamatan laju pertumbuhan harian (LPH) menunjukkan perlakuan dosis minyak sereh 7 mg/L memberikan laju pertumbuhan harian tertinggi sebesar 1,34%.
Minyak sereh pada dosis yang tepat dapat bersifat menenangkan ikan pada kegiatan transportasi. Minyak sereh 7 mg/L, garam 6 g/L, zeolit 20 g/L dan karbon aktif 10 g/L memberikan tingkat kelangsungan hidup sebesar 86,67±1,33% dalam kegiatan transportasi benih ikan patin berkepadatan 150 ekor/L selama 72 jam. Kualitas air yang meliputi suhu, DO, NH3 dan CO2 pada media pengepakan
transportasi yang masih layak untuk benih ikan patin
SUMMARY
WA ODE SRY WULAN. The Effectiveness of Lemongrass Oils, Salt, Zeolite and Activated Carbon to the Survival Rate of Seeds Striped Catfish Pangasius sp on the Closed Transport. Supervised by EDDY SUPRIYONO and DINAMELLA WAHJUNINGRUM.
Striped catfish Pangasius sp is one commodity type of freshwater fish from the water of Indonesian which has a high economic value. Enterprises of hatchery activity striped catfish in Western Java while the business activities of nursery and enlargement from the area Sumatera, Kalimantan and areas others in Java. To support the production activity so necessary transport from location of business activities spawning to nursery location and enlargement location.
Fish transport technology in aquaculture activities have increased, including transportation by using a low temperature, the use of zeolite and activited carbon, salt and the use of anesthesia as a sedative for transportation of fish. The problems that arise from a closed transport is water quality that declining and the occurence of stres on fish due to shocks that affect fish physiological conditions that can lead to death. Lemongrass oils contains citronellal, sitronelol, and geraniol. Lemongrass oils is volatile oil that can lower metabolism by drugging and calming of fish. This study aimed to evaluate of lemongrass oils with the addition of salt, zeolites and activated carbon in minimizing seed striped catfishstres levels and maintain water quality in the media during transport as well as to analyze the impact of physiological conditions striped catfish post-transport.
The study was conducted in January 2016 to April 2016 in Laboratory of Aquaculture Environment, Department of Aquaculture, Faculty of Fisheries and Marine Sciences, Bogor Agricultural Institute. The fish samples used in the experiment are the seed striped catfishwith an average length of 5.6±0.266 cm. The research was conducted through three stages: a preliminary research, transportation and post-transport for 30 days. The preliminary research conducted to determine the ability of fish fasting, oxygen consumption rate, ammonia excretion rate, determining capacity of zeolites and activated carbon in the absorption of TAN. Transport research is system transportation covered during 72 hours. The transport seed striped catfishwith a density of 150 individuals/L while each treatment was added with 6 g of salt, 20 g of zeolite, 10 g of activated carbon and lemongrass oils for each treatment where K (control), 0 mg/L, 3.5 mg/L, 7 mg/L, and 10.5 mg/L. At the time of transportation of seeds of striped catfish for 72 hours was observed survival rate and quality of water. Research post-transport during 30 days observation physiological responses seeds of striped catfish (blood profil and blood glucose); survival rate and daily growth rate.
Preliminary research results indicate the striped catfish can survive for seven days without being given feed. Striped catfish oxygen consumption rates of 0.07±0.03 mgO2/g/hour, the rate of excretion of TAN striped catfish for 48 hours
conditions remain good. Observation on the growth rate (LPH) showed a dose of lemongrass oils 7 mg/L provides the growth rate highest at 1.34%.
Lemongrass oils at the proper dose can be soothing fish transport activities. Lemongrass oils, 7 mg/L, salt 6 g/L, zeolite 20 g/L dan activated carbon 10 g/L gives a survival rate at 86.67±1.33% in transportation activity seeds of striped catfish with density 150 for 72 hours. Water quality include temperature, DO, NH3
dan CO2 on the of media packing transport is still feasible for seeds of striped
catfish.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Akuakultur
EFEKTIVITAS MINYAK SEREH, GARAM, ZEOLIT DAN
KARBON AKTIF TERHADAP KELANGSUNGAN HIDUP
BENIH IKAN PATIN
Pangasius sp
PADA TRANSPORTASI
TERTUTUP
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Efektivitas Minyak Sereh, Garam, Zeolit dan Karbon Aktif
terhadap Kelangsungan Hidup Benih Ikan Patin Pangasius sp pada Transportasi Tertutup
Nama : Wa Ode Sry Wulan NIM : C151120361
Disetujui oleh Komisi Pembimbing
Dr Ir Eddy Supriyono, MSc
Ketua
Dr Dinamella Wahjuningrum, SSi., MSi
Anggota
Diketahui oleh
Ketua Program Studi Ilmu Akuakultur
Dr Ir Widanarni, MSi
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini bisa diselesaikan. Penelitian ini dilaksanakan pada bulan Januari hingga April 2016 bertempat di Laboratorium Lingkungan, Departemen Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor, dengan judul “Efektivitas Minyak Sereh, Garam, Zeolit dan Karbon Aktif terhadap Kelangsungan Hidup Benih Ikan Patin
Pangasius sp pada Transporatasi Tertutup”.
Penulis mengucakan terima kasih kepada Bapak Dr Ir Eddy Supriyono, MSc selaku ketua komisi pembimbing yang telah memberikan tema, pengarahan dan bimbingan selama penelitian dan Ibu Dr Dinamella Wahjuningrum, SSi., MSi selaku anggota komisi pembimbing yang telah memberikan pengarahan dan bimbingan selama penelitian dan penyusunan tesis. Terima kasih pula disampaikan pada Direktorat Jenderal Pendidikan Tinggi (DIKTI), Kementerian Pendidikan dan Kebudayaan (KEMENDIKBUD) atas penyediaan Beasiswa Pendidikan Pascasarjana Dalam Negeri (BPP-DN) sehingga penulis dapat melanjutkan studi di Sekolah Pascasarjana, Institut Pertanian Bogor.
Ungkapan terima kasih juga disampaikan kepada Bapak tercinta (Alm) La Ode Musrifin Effendie, Mama tercinta Wa Ode Nurtina Ndoasa dan Kakak-kakakku serta adikku atas segala doa dan motivasinya. Selain itu ucapan terima kasih juga disampaikan untuk seluruh rekan-rekan yang telah memberi bantuan berupa saran dan pemikiran terutama untuk Humairani, Rudy dan Christy.
Penulis menyadari peyusunan tesis ini masih jauh dari kesempurnaan, maka dari itu penyusun memohon saran yang berguna dan membangun untuk menyempurnakan penyusunannya. Penulis berharap semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2016
DAFTAR ISI
DAFTAR ISI v
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 2
Perumusan Masalah 3
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
METODE PENELITIAN 3
Waktu dan Tempat Penelitian 3
Ikan Uji 3
Rancangan Penelitian 4
Penelitian Pendahuluan 4
Penelitian Transportasi 5
Penelitian Pasca-transportasi 6
Parameter yang Diamati 6
Analisis Data 8
HASIL DAN PEMBAHASAN 8
Penelitian Pendahuluan 8
Penelitian Transportasi 11
Penelitian Pasca-transportasi 13
SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 20
DAFTAR TABEL
1. Tingkah laku dan kualitas air selama pemuasaan ikan patin selama 7 hari 9 2. Tingkat konsumsi oksigen benih ikan patin selama 6 jam 9
3. Laju ekskresi TAN benih ikan patin 10
DAFTAR GAMBAR
1. Kadar amonia media yang diberikan (a) zeolit dan (b) karbon aktif 10 2. Parameter kualitas air selama transportasi benih patin (a) suhu; (b) DO;
(c) NH3; (d) CO2. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L);
perlakuan C (7 mg/L); dan pelakuan D (10,5 mg/L). 11 3. Tingkat kelangsungan hidup (TKH) awal pasca-transportasi benih ikan
Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan pelakuan D (10,5 mg/L). Huruf kecil yang berbeda pada grafik menunjukkan beda nyata untuk setiap perlakuan pada awal pasca-transportasi dan akhir pasca-pasca-transportasi (p<0,05). 13 4. Kadar glukosa darah benih ikan patin pada awal pasca-transportasi dan
akhir pasca-transportasi. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan pelakuan D (10,5 mg/L). Huruf kecil yang berbeda pada grafik menunjukkan beda nyata untuk setiap perlakuan
pada awal pasca-transportasi dan akhir pasca-transportasi (p<0,05). 14 5. Analisis gambaran darah awal transportasi dan akhir
pasca-transportasi benih ikan patin: (a) Eritosit; (b) Leukosit; (c) Hemoglobin; dan (d) hematokrit. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan pelakuan D (10,5 mg/L). Huruf kecil yang berbeda pada grafik menunjukkan beda nyata untuk setiap perlakuan pada awal pasca-transportasi dan akhir pasca-transportasi (p<0,05). 17 6. Laju pertumbuhan harian benih ikan patin pemeliharaan 30 hari
pasca-transportasi. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan perlakuan D (10,5 mg/L). Huruf kecil yang berbeda pada grafik menunjukkan beda nyata untuk setiap perlakuan pada masa pemeliharaan 30 hari pasca-transportasi (p<0,05). 18 7. Tingkat kelangsungan hidup benih ikan patin pasca-transportasi selama
30 hari pemeliharaan. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan perlakuan D (10,5 mg/L). Huruf kecil yang berbeda pada grafik menunjukkan beda nyata untuk setiap perlakuan
DAFTAR LAMPIRAN
1. Hasil pengujian kandungan minyak sereh 23
2. Prosedur pengukuran gambaran darah 24
3. Hasil analisis ragam tingkat kelangsungan hidup (TKH)
awal pasca-transportasi. 25 4. Hasil analisis ragam glukosa darah benih ikan patin 27 5. Hasil analisis ragam eritrosit benih ikan patin 28 6. Hasil analisis ragam leukosit benih ikan patin 29 7. Hasil analisis ragam hemoglobin benih ikan patin 30 8. Hasil analisis ragam hematokrit benih ikan patin 31 9. Hasil analisis ragam laju pertumbuhan harian (LPH) benih ikan patin 32 10. Hasil analisis ragam tingkat kelangsungan hidup (TKH)
1
PENDAHULUAN
Latar Belakang
Ikan patin Pangius sp merupakan salah satu jenis komoditas ikan air tawar dari perairan indonesia yang memiliki nilai ekonomis tinggi dan telah berhasil dibudidayakan secara komersil, sehingga menjadikan para pengusaha untuk membudidayakan ikan patin. Dalam usaha budidaya ikan tidak terlepas dari penyediaan benih yang merupakan faktor pembatas. Penyediaan benih dapat diperoleh dari alam dan panti-panti pembenihan. Usaha kegiatan pembenihan ikan patin tersebar di daerah Jawa Barat sedangkan usaha kegiatan pendederan dan pembesaran berada di daerah Sumatera, Kalimantan dan daerah Jawa lainnya (Sunarma 2007). Jarak antara lokasi kegiatan pembenihan menuju ke lokasi kegiatan pendederan dan pembesaran memerlukan waktu minimal 24 jam. Jadi, untuk menunjang kegiatan produksi budidaya yang diakibatkan oleh jarak antar lokasi pembenihan ke lokasi pendederan dan pembesaran maka diperlukan adanya teknologi tranportasi ikan dengan waktu transportasi lebih dari 24 jam.
Teknologi transportasi ikan terbagi atas dua, yaitu transportasi sistem basah dan sistem kering, dimana pada sistem basah, ikan ditransportasikan pada media terbuka atau tertutup dengan pemberian oksigen dan air (Wibowo, 1993). Sistem kering, biasanya menggunakan tekhnik pembiusan ikan sebelum dikemas dalam media tanpa air (Suryaningrum et al. 2007). Sistem tertutup memberikan ikan dalam kondisi tenang sehingga memungkinkan jarak transportasi lebih jauh dan kepadatan ikan bisa ditingkatkan. Teknologi transportasi jarak jauh yang tepat adalah dengan menggunakan sistem transportasi tertutup yang berkepadatan tinggi yang mampu menghemat biaya transportasi dan tidak menurunkan kualitas air sehingga tidak menyebabkan kematian pada ikan. Teknologi transportasi ikan pada kegiatan budidaya mengalami peningkatan, diantaranya transportasi dengan menggunakan suhu rendah, penggunaan zeolit dan karbon aktif, garam dan penggunaan anastesi sebagai penenang ikan dalam transportasi ikan.
Permasalahan yang timbul dari transportasi ikan adalah kualitas air yang menurun dan terjadinya stres pada ikan akibat guncangan yang mempengaruhi kondisi fisiologis ikan yang dapat mengakibatkan kematian. Stres merupakan respon bertahan pada ikan terhadap penyebab stres (stresor). Transportasi merupakan aktivitas yang dapat menimbulkan stres pada ikan. Ikan akan mengalami hiperaktivitas yang merupakan respon bertahan terhadap stres, dan jika berlebihan maka ikan akan mati. Timbulnya respon stres tersebut menunjukkan terjadinya adaptasi terhadap perubahan yang tidak terduga dan untuk mengembalikan pada kondisi homeostasis (Rachmawati et al. 2010).
2
media air transportasi ikan patin. Sedangkan untuk mengurangi tingkat stres pada ikan diperlukan penanganan yang baik melalui penggunaan anastesi yang alami. Salah satu anastesi yang alami adalah minyak sereh .
Tanaman sereh merupakan salah satu tanaman yang memiliki manfaat yang beragam dengan aroma yang khas. Minyak sereh mengandung citronellal,
sitronelol, dan geraniol. Minyak sereh banyak digunakan sebagai obat-obatan dan
reppelent (pengusir nyamuk) karena bermanfaat untuk menenangkan, antiseptik dan melemaskan otot (Lestari et al. 2012). Minyak sereh adalah minyak atsiri yang mampu menurunkan metabolisme dengan cara memingsankan dan menenangkan ikan (Supriyono et al. 2010). Proses anestesi terjadi, apabila berpindahnya bahan penenang ke dalam insang yang kemudian diserap oleh darah lalu disebarkan ke seluruh tubuh ikan. Menurut penelitian Lumenta dan Gybert (2012) menyatakan bahwa minyak sereh pada dosis 2,5 ml/L dan 3,5 ml/L memberikan respons anastesi terhadap kerang. Menurut penelitian Supriyono et al. (2010) mengatakan bahwa minyak sereh dengan dosis 10 mg/L dapat menenangkan ikan kerapu macan, mengurangi tingkat stres ikan, mempertahankan tingkat kelangsungan hidup serta laju pertumbuhan yang baik dengan lama waktu transportasi 24 jam.
Penelitian tentang garam 6 g, zeolit 20 g dan karbon aktif 10 g telah berhasil dilakukan dalam penelitian transportasi sebelumnya, sehingga perlu adanya penelitian penambahan minyak sereh dosis berbeda sebagai anastesi dalam transportasi ikan. Oleh karena itu, penelitian mengenai efektivitas minyak sereh, garam, zeolit dan karbon aktif terhadap ikan patin pada transportasi tertutup berkepadatan tinggi perlu dilakukan.
Perumusan Masalah
3
Tujuan Penelitian
Penelitian ini bertujuan untuk mengevaluasi efektivitas minyak sereh dengan penambahan garam, zeolit dan karbon aktif dalam meminimalisir tingkat stres benih ikan patin dan mempertahankan kualitas air pada media selama transportasi serta untuk menganalisis dampak kondisi fisiologis ikan patin pasca-transportasi.
Manfaat Penelitian
Hasil dari penelitian ini diharapkan dapat memberikan informasi tentang transportasi ikan menggunakan minyak sereh serta dapat diaplikasikan pada kegiatan transportasi ikan patin jarak jauh dengan kepadatan tinggi.
Hipotesis
Hipotesis dalam penelitian ini adalah dengan pemberian minyak sereh, garam, zeolit dan karbon aktif dalam transportasi ikan patin sistem tertutup dengan kepadatan tinggi dapat meminimalisir tingkat stres benih ikan patin dan tetap mempertahankan kualitas air media selama transportasi serta kondisi fisiologis ikan tetap terjaga sehingga tingkat kelangsungan hidup dan pertumbuhan pasca-transportasi tetap tinggi.
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari hingga April 2016, bertempat di Laboratorium Lingkungan Akuakultur, Budidaya Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor.
Ikan Uji
4
Rancangan Penelitian
Penelitian ini dilakukan dalam tiga tahap yaitu penelitian pendahuluan, penelitian transportasi dan penelitian pasca-transportasi. Rancangan yang digunakan dalam penelitian transportasi adalah rancangan acak lengkap dengan lima perlakuan dan masing-masing terdiri atas tiga ulangan. Perlakuan A (0 mg/L minyak sereh; 6 g/L garam; 20 g zeolit; dan 10 g karbon aktif); perlakuan B (3,5 mg/L minyak sereh; 6 g/L garam; 20 g zeolit; dan 10 g karbon aktif); perlakuan C (7 mg/L minyak sereh; 6 g/L garam; 20 g zeolit; dan 10 g karbon aktif); perlakuan D (10,5) mg/L minyak sereh; 6 g/L garam; 20 g zeolit; dan 10 g karbon aktif); dan perlakuan K (kontrol, tanpa minyak sereh, garam, zeolit dan karbon aktif).Dimana penambahan zeolit (20 g), karbon aktif (10 g) dan garam (6 g) berdasarkan pada penelitian Emu (2010). Nilai dosis minyak sereh yang akan digunakan berdasarkan hasil uji LC50. Penelitian transportasi dilakukan selama 72 jam dengan kepadatan
150 ekor/L pada setiap perlakuan media pengepakan dan dipelihara selama 30 hari pasca-transportasi.
Penelitian Pendahuluan
Prosedur Penentuan Kemampuan Puasa Ikan
Penentuan puasa ikan dilakukan dengan tujuan untuk mengetahui kelangsungan hidup ikan patin apabila tidak diberi pakan. Penentuan puasa ikan dilakukan dengan cara menyiapkan akuarium dengan ukuran 50x40x40 cm yang telah dibersihkan dan dikeringkan selama dua hari kemudian diisi air dengan ketinggian 30 cm yang diaerasi selama dua hari lalu masukan ikan uji sebanyak 20 ekor. Penelitian ini dilakukan dengan satu perlakuan dan tiga kali ulangan selama tujuh hari. Pergantian air sebanyak 5–20% yang dilakukan setiap hari. Pengamatan kualitas air dilakukan setiap hari. Parameter kualitas air yang diukur adalah DO, suhu dan pH.
Prosedur Penentuan Tingkat Konsumsi Oksigen (TKO)
5 TKO = {(DO awal – DO akhir)/W x t} x V
Keterangan :
TKO = Tingkat konsumsi oksigen (mg O2/g tubuh/jam)
DO awal = Oksigen terlarut pada awal pengamatan (mg/L) DO akhir = Oksigen terlarut pada akhir pengamatan (mg/L) W = Berat ikan uji (g)
t = Periode pengamatan (jam) V = Volume air (L)
Prosedur Penentuan Laju Ekstresi Amonia Ikan
Penentuan laju ekskresi amonia ikan bertujuan untuk mengetahui jumlah amonia yang dieksresikan tiap satuan waktu, sehingga dapat diketahui jumlah akumulasi amonia pada waktu tertentu. Percobaan ini dilakukan dengan menyiapkan 3 stoples bervolume 3 liter yang telah dibersihkan dan dikeringkan selama dua hari, kemudian diisi air hingga penuh. Ikan uji dimasukkan ke dalam setiap stoples sebanyak 3 ekor dengan ukuran rata-rata bobot tubuh 2,17±0,004 g/ekor. Kemudian dilakukan pengambilan sampel air sebanyak 30 mL setiap 12 jam selama 24 jam untuk mengukur suhu, pH, DO, dan konsentrasi TAN (Total Amonia Nitrogen).
Prosedur Kapasitas Serap Zeolit dan Karbon Aktif terhadap Amonia
Pengukuran kemampuan serap zeolit dan karbon aktif pada NH3 dapat
dilakukan dengan mengukur tingkat serap bahan aktif tersebut dalam larutan TAN. Tahapan pada proses ini diawali dengan penyiapan dua botol plastik yang salah satu bagian tutup botol dilubangi dengan jarum. Bagian leher botol diisi dengan zeolit dan karbon aktif masing-masing sebanyak 20 gram. Larutan TAN dengan konsentrasi 10 mg/L dialirkan ke dalam botol yang berisi karbon aktif dan zeolit. Pengambilan sampel air sebanyak 30 ml dilakukan pada setiap menit selama 7 menit, kemudian dilakukan pengukuran TAN, nilai pH, dan suhu pengujian ini dilakukan masing-masing 3 ulangan.
Penelitian Transportasi
Prosedur Transportasi Ikan patin dengan Penggunaan Dosis Minyak Sereh, Garam, Zeolit dan Karbon Aktif
6
kepadatan 150 ekor. Setiap kantong diberikan oksigen. Perbandingan air dalam kantong dan oksigen adalah 1:3. Kemudian kantong diikat menggunakan karet gelang lalu dimasukkan kedalam styrofoam selanjutnya di masukkan es batu 1 kap kedalam kotak styrofoam agar suhu stabil sekitar 20°C lalu ditutup. Proses transportasi dilakukan secara simulasi di laboratorium, yaitu disimpan di kotak
styrofoam yang diguncangkan di atas permukaan air menggunakan pompa air listrik. Pengamatan keadaan ikan berupa tingkat kelangsungan hidup dilakukan setiap 6 jam dan pengambilan sampel air per kantong dilakukan setiap 24 jam untuk pengamatan kualitas air.
Penelitian Pasca-transportasi
Pemeliharaan Benih Ikan Patin Pasca-transportasi
Pemeliharaan benih ikan patin dilakukan selama 30 hari setelah packing
dibongkar di dalam akuarium dengan dimensi 75x50x40 cm yang telah dicuci dan dikeringkan selama tiga hari. Akuarium diisi air dengan ketinggian 30 cm dengan volume air sebesar 112 L/akuarium dan diaerasi. Benih ikan patin dipelihara dengan pemberian pakan berupa pelet secara at satiation. Pakan yang diberikan yaitu pakan komersil dengan kandungan protein 30%. Kelangsungan hidup ikan selama pemeliharaan diamati setiap hari dengan mengamati kondisi ikan sedangkan uji kualitas air, pengukuran laju pertumbuhan harian dilakukan setiap 10 hari sampai akhir pemeliharaan, dan glukosa darah serta analisis gambaran darah dilakukan pada awal pasca-transportasi dan pada akhir pasca-transportasi. Kepadatan ikan yang dipelihara berbeda dengan kepadatan pada saat ikan ditransportasi, hal ini dikarenakan terjadinya kematian pada ikan saat transportasi.
Parameter yang Diamati
Pengukuran glukosa darah glukosa darah dan gambaran darah benih ikan patin (eritrosit; leukosit; hemoglobin; dan hematokrit) dilakukan pada ikan normal; pada awal pasca-transportasi dan pada akhir pasca-transportasi. Ikan normal adalah ikan yang bukan dari perlakuan, pengukuran kadar glukosa dan gambaran darah ikan normal dilakukan hanya untuk dijadikan sebagai perbandingan terhadap ikan yang diberikan perlakuan. Tingkat kelangsungan hidup (TKH) dan uji kualitas air diamati saat transportasi setiap 24 jam. Pertumbuhan bobot harian pada saat pemeliharaan dilakukan setiap 10 hari.
Prosedur Pengukuran Kadar Glukosa Darah
7 tersebut banyak mengandung pembuluh darah. Darah ikan diambil dengan menggunakan jarum spuit sebagai injeksi yang telah diisi dengan cairan antikogulan untuk mencegah terjadinya penggumpalan darah. Darah yang tersedot dimasukkan ke dalam tabung ependorf, kemudian disentrifuge dengan kecepatan 12.000 rpm selama 5 menit. Setelah terbentuk lapisan-lapisan yang terdiri dari lapisan plasma yang jernih di bagian atas, selanjutnya ambil 10 µl lapisan plasma tambahkan ke dalam tabung reaksi berisi 1 ml regen (glucose liquicolor) selanjutnya dihomogenkan dengan menggunakan vortex, diinkubasi selama 10 menit pada suhu kamar, baca nilai absorban pada spektrofotometer dengan λ 500 nm. Kadar glukosa darah diukur mengikuti Wedemeyer dan Yatsuke (1977) yaitu:
Glukosa darah = Absorban sampelAbsorban standar × Konsentrasi standar
Prosedur Pengukuran Gambaran Darah
Darah merupakan jaringan sirkulasi yang terdiri atas cairan plasma, sel-sel darah merah, sel-sel darah putih dan keping darah. Karakteristik parameter darah merupakan salah satu sarana yang penting untuk mengetahui tingkat kesehatan ikan. Respon ikan terhadap stresor bergantung pada jenis stres yang dialami oleh ikan tersebut, dimana jenis stres dapat diamati melalui pengukuran gambaran darah. Tujuan pengambilan darah adalah untuk mengetahui kondisi fisiologis benih ikan patin pada awal pasca-transportasi dan akhir pasca-transportasi. Cara pengambilan darah dilakukan dengan menggunakan jarum spuit yang telah diaseptiskan dengan alkohol 70% dan methanol agar tidak ada kuman pada spuit. Kemudian spuit diisi dengan Na Sitrat 0,1 ml dengan tujuan agar darah tidak membeku. Selajutnya jarum spuit disuntikkan pada pangkal ekor ikan lalu perlahan-lahan darah ikan diambil dengan spuit. Prosedur pengukuran gambaran darah yang meliputi eritrosit, leukosit, hemoglobin, dan hematokrit dapat dilihat pada lampiran 2.
Tingkat Kelangsungan Hidup
Tingkat kelangsungan hidup (TKH) dihitung dengan menggunakan rumus Huisman (1978) :
8
LPH % = {√�� �� �
− }×
Keterangan:
LPH = Laju pertumbuhan harian (%)
Wt = Berat rata-rata pada akhir pemeliharaan (g) Wo = Berat rata-rata pada akhir pemeliharaan (g) t = Periode penelitian (hari)
Parameter Kualitas Air
Pengukuran suhu pada media air menggunakan termometer air raksa (Hg) dengan satuan °C. Oksigen terlarut adalah jumlah mg/L gas oksigen yang terlarut dalam air. Kadar oksigen dalam air dapat ditentukan dengan menggunakan DO-meter. Nilai pH di lingkungan dipengaruhi oleh kadar CO2 terlarut. Alat yang
digunakan adalah pH-meter dengan metode membran elektro. Metode yang digunakan dalam pengukuran amonia adalah metode Indophenol. Nilai TAN yang terukur bergantung pada nilai pH dan suhu pada saat pengukuran. Pengukuran dilakukan dengan metode titrasi.
Analisis Data
Adapun data yang dikumpulkan dalam penelitian ini adalah data tingat kelangsungan hidup (TKH), nilai kualitas air (suhu, pH, DO, CO2, dan TAN), kadar
glukosa darah, gambaran darah ikan (eritrosit, leukosit, hemoglobin, dan hematokrit), dan laju pertumbuhan harian. Data parameter uji yang diperoleh akan di analisis secara statistik dengan menggunakan analisis ragam (ANOVA) dengan uji F pada selang kepercayaan 95% menggunakan program MS.Excel dan SPSS 17 untuk menentukan pengaruh terhadap parameter yang diamati. Jika perlakuan berpengaruh nyata maka untuk melihat perbedaan antara perlakuan akan diuji lanjut dengan menggunakan uji Duncan. Datanilai kualitas air dijelaskan secara deskriptif.
HASIL DAN PEMBAHASAN
Penelitian Pendahuluan
9 Kemampuan Puasa Ikan Patin
Benih ikan patin dengan ukuran rata-rata bobot tubuh 2,17±0,004 gram sebanyak 20 ekor/akuarium masih mampu bertahan hidup dan berenang aktif selama tujuh hari pemuasaan ikan. Data kemampuan puasa ikan dapat dilihat pada Tabel 1. Data hasil pengamatan pemuasaan ikan menunjukkan bahwa nilai kualitas air pada saat pemuasaan berada pada kisaran baik untuk pemeliharaan benih ikan patin. Tingkah laku benih ikan patin berenang aktif dan memiliki tingkat kelangsungan hidup 100%.
Tabel 1. Tingkah laku dan kualitas air selama pemuasaan ikan patin selama tujuh hari.
Tingkat Konsumsi Oksigen Ikan Patin
Tingkat Konsumsi Oksigen (TKO) merupakan kemampuan suatu individu untuk menyerap oksigen dalam mendukung proses kehidupannya. Hasil pengamatan tingkat konsumsi oksigen ikan patin (Tabel 2) menunjukkan nilai rata-rata tingkat konsumsi oksigen benih ikan patin sebesar 0,07±0,03 mgO2/g/jam.
Tabel 2. Tingkat konsumsi oksigen benih ikan patin selama 6 jam.
Jam ke- Rata-rata
10
Laju Ekskresi TAN Benih Ikan Patin
Nilai laju ekskresi total amonia nitrogen (TAN) benih ikan patin yang didapatkan dari hasil pengukuran setiap 12 jam selama 48 jam adalah 0,001±0,000 mgTAN/g/jam (Tabel 3).
Tabel 3. Laju ekskresi TAN benih ikan patin
Waktu Rata-rata Standar Devisiasi (SD)
12 0,030 0,000
24 0,099 0,022
36 0,102 0,015
48 0,100 0,007
Eksresi/Ekor 0,001 0,000
Kapasitas Serap Zeolit dan Karbon Aktif terhadap Amonia
Kapasitas serap zeolit dan karbon aktif mengalami penurunan pada setiap menit dapat dilihat pada Gambar 1.
(a) (b)
Gambar 1. Kadar amonia media yang diberikan (a) zeolit dan (b) karbon aktif.
Hasil kadar amonia menunjukkan bahwa daya serap zeolit dapat menurunkan amonia dari 1,064±2,2204 mgNH3/menit/L pada awal perlakuan menjadi 0
mgNH3/menit/L pada menit ke-7 (Gambar 1a). Sedangkan karbon aktif mengalami
penurunan dari 1,252±0 mgNH3/menit/L pada awal perlakuan menjadi 0,197±0,04
mgNH3/menit/L (Gambar 1b). Berdasarkan hasil penelitian, zeolit dan karbon aktif
dapat menyerap amonia sebesar 1,107±0 mgNH3/menit/L dan 1,055
mgNH3/menit/L. Zeolit dan karbon aktif dapat menurunkan konsentrasi amonia
yang terakumulasi dalam media pengepakan transportasi karena kedua bahan ini mampu menyerap amonia dalam waktu tertentu (Supriyono et al. 2007).
11
Penelitian Transportasi
Hasil penelitian utama selama 72 jam terdiri dari perubahan parameter kualitas air saat transportasi yang meliputi suhu, DO, NH3, dan CO2 dan tingkat
kelangsungan hidup (TKH) transportasi.
Kualitas Air Media Transportasi
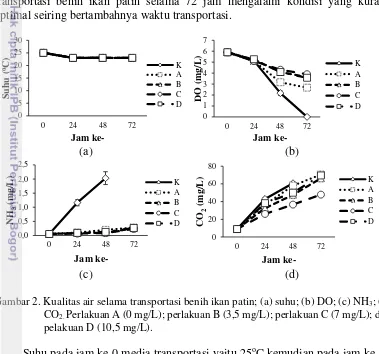
Data hasil pengamatan parameter kualitas air media transportasi yang meliputi suhu, DO, NH3, dan CO2 disajikan pada Gambar 2. Kualitas air pada
transportasi benih ikan patin selama 72 jam mengalami kondisi yang kurang optimal seiring bertambahnya waktu transportasi.
(a) (b)
(c) (d)
Gambar 2. Kualitas air selama transportasi benih ikan patin; (a) suhu; (b) DO; (c) NH3; (d)
CO2. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan
pelakuan D (10,5 mg/L).
Suhu pada jam ke-0 media transportasi yaitu 25oC kemudian pada jam ke-24 sampai jam ke-72 suhu mengalami penurunan menjadi 23oC (Gambar 2a). Suhu
memegang peranan penting dalam kegiatan transportasi ikan. Tingginya suhu dapat meningkatkan metabolisme dan menurunkan kadar oksigen, meningkatkan CO2
dan NH3 dalam media pengepakan. Suhu pada media pengepakan transportasi benih
ikan patin selama 72 jam mengalami kestabilan dengan suhu 23oC. Suhu tidak mengalami peningkatan yang tinggi pada saat transportasi tapi mengalami penurunan suhu dan suhunya menjadi stabil. Hal ini disebabkan adanya penambahan es batu ke dalam styrofoam sebagai upaya untuk menjaga suhu tetap stabil dan rendah selama transportasi (Sulmartini et al. 2009). Peningkatan suhu yang tinggi dapat menyebabkan kematian pada ikan. Suhu berpengaruh langsung
12
pada laju metabolisme ikan. Perubahan suhu dapat menyebabkan perubahan laju metabolisme ikan, semakin tinggi suhu media maka laju metabolisme ikan juga akan meningkat (Harianto 2014). Peningkatan aktivitas metabolisme menyebabkan konsumsi oksigen juga meningkat, sementara ketersediaan oksigen didalam media terbatas. Selain itu peningkatan kecepatan berespirasi juga memberikan dampak terhadap penurunan kualitas air media transportasi (Arifin 2015). Suhu yang tinggi dapat meningkat konsumsi oksigen dan menurunkan kadar oksigen dalam media pengepakan.
DO mengalami penurunan dari jam ke-0 hingga jam ke-72 (Gambar 2b). Jumlah konsumsi oksigen benih ikan patin pada media pengepakan meningkat seiring bertambahnya waktu transportasi. Penurunan DO terbesar terjadi pada perlakuan kontrol dan penurunan DO terkecil terjadi pada perlakuan 7 mg/L sebesar 3,9 ±0,2 mgO2/L. Hal ini disebabkan oleh jumlah konsumsi oksigen yang semakin meningkat dan terjadinya difusi oksigen pada saat simulasi. Menurut Yanto (2012) bahwa oksigen akan mengalami penurunan dari sebelum transportasi dan sesudah transportasi, penurunan oksigen disebabkan penggunaan oksigen oleh ikan selama transportasi. Difusi oksigen terjadi karena adanya guncangan yang keras dalam plastik pengepakan (Humairani 2015).
Konsentrasi NH3 setiap perlakuan mengalami peningkatan seiring
bertambahnya waktu (Gambar 2c). Perlakuan kontrol mengalami peningkatan tertinggi sebesar 2,030±0,091 mgNH3/L pada jam ke-48 dan jam ke-7 ikan pada
perlakuan kontrol mengalami kematian. Hal ini disebabkan pada perlakuan kontrol tidak diberi penambahan zeolit, karbon aktif, garam dan minyak sereh. Kadar amonia dapat meningkat seiring bertambahnya waktu, dari waktu sebelum transportasi dan setelah transportasi dikarenakan amonia merupakan sisa dari metabolisme ikan yang jumlahnya tergantung dari kepadatan ikan. Semakin padatnya ikan dalam media pengepakan, kadar amonia akan semakin tinggi (Yanto 2012). Tinggi ataupun rendahnya kandungan amonia di dalam media air juga dipengaruhi oleh pH, suhu dan CO2. Kadar TAN di dalam media air di pengaruhi
oleh produksi CO2. Jika CO2 mengalami peningkatan maka TAN akan mengalami
peningkatan juga (Suwandi et al. 2011). Penggunaan zeolit, karbon aktif dan garam mampu menyerap TAN yang berada dalam media air media pengepakan. Sesuai dengan penelitian Emu (2010) bahwa penggunaan zeolit, karbon aktif dan garam mampu menyerap TAN dan NH3 dalam media transportasi benih ikan patin. Dalam
waktu satu jam zeolit berukuran -40/60 mesh dengan berat 10 g mampu menurunkan kandungan amonia sampai 1,2 mg/L (Supriyono et al. 2007).
Konsentrasi CO2 mengalami peningkatan seiring bertambahnya waktu
transportasi yang diakibatkan oleh peningkatan jumlah konsumsi oksigen pada benih ikan patin dalam media pengepakan (Gambar 2d). Peningkatan konsentrasi CO2 tertinggi pada jam ke-72 terjadi pada perlakuan tanpa minyak sereh sebesar
70,50±0,79 mgCO2/L dan konsentrasi CO2 terendah pada jam ke-72 terjadi pada
perlakuan 7 mg/L 47,87±1,91 mgCO2/L. Hal ini disebabkan oleh peningkatan
konsumsi oksigen benih ikan patin dalam media pengepakan. Kandungan CO2
yang tinggi dapat menjadikan kualitas air menjadi kurang optimal yang akan mengakibatkan stres pada ikan meningkat. Peningkatan CO2 dipengaruhi oleh
13
Tingkat Kelangsungan Hidup (TKH) Awal Pasca-transportasi
Tingkat kelangsungan hidup benih ikan patin pada transportasi selama 72 jam dapat dilihat pada Gambar 3. Pengamatan tingkat kelangsungan hidup pada perlakuan pemberian garam, zeolit, karbon aktif dan minyak sereh berbeda nyata dengan perlakuan kontrol (Lampiran 3).
Gambar 3. Tingkat kelangsungan hidup (TKH) awal pasca-transportasi benih ikan patin. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan pelakuan D (10,5 mg/L). Huruf kecil yang berbeda pada grafik menunjukkan beda nyata untuk setiap perlakuan pada awal transportasi dan akhir pasca-transportasi (p<0,05).
Tingginya laju metabolisme mempengaruhi kualitas air menjadi buruk dalam media pengangkut. Hasil pengamatan tingkat kelangsungan hidup (TKH) menunjukkan bahwa TKH tertinggi selama 72 jam transportasi terdapat pada perlakuan 7 mg/L dengan nilai sebesar 86,67±1,33%, diikuti oleh perlakuan 3,5 mg/L sebesar 50,22±1,67%, lalu diikuti oleh perlakuan 10,5 mg/L sebesar 40,89±1,01%, dan diikuti oleh perlakuan tanpa minyak sereh sebesar 14,44±1,38%. Perlakuan kontrol mengalami kematian 100% pada jam ke-72.
Tingginya kematian selama transportasi pada perlakuan kontrol karena tanpa adanya pemberian zeolit, karbon aktif, garam, dan minyak sereh dalam media transportasi. Kelangsungan hidup benih ikan patin tertinggi terjadi pada perlakuan 7 mg/L sebesar 86,67±1,33%. Hal ini menunjukkan bahwa pemberian minyak sereh, zeolit, karbon aktif dan garam dengan dosis yang tepat dapat memberikan kelangsungan hidup yang cukup baik untuk transportasi ikan patin. Menurut Nirmala et al. (2012) bahwa penambahan garam ke dalam air media transportasi berpengaruh terhadap tingkat kelangsungan hidup ikan transportasi. Garam dapat mengurangi stres selama transportasi ikan (Emu 2010). Pemberian minyak sereh dengan konsentrasi 10 mg/L dapat menenangkan ikan kerapu macan, mengurangi tingkat stres ikan, mempertahankan tingkat kelangsungan hidup (Supriyono et al.
2010).
Penelitian Pasca-transportasi
Hasil dari penelitian pasca-transportasi selama 30 hari terdiri dari analisis glukosa darah; gambaran darah yang meliputi eristrosit, leukosit, hemoglobin, dan
14
hematokrit; tingkat kelangsungan hidup akhir pasca-transportasi selama 30 hari permeliharaan dan laju pertumbuhan harian (LPH).
Kadar Glukosa Darah
Hasil pengamatan kadar glukosa darah benih ikan patin pasca-transportasi dapat dilihat pada Gambar 4, dimana nilai kadar glukosa darah mengalami peningkatan dibandingkan ikan normal. Ikan normal adalah ikan yang bukan dari perlakuan, pengukuran kadar glukosa ikan normal dilakukan hanya untuk dijadikan sebagai perbandingan terhadap ikan yang diberikan perlakuan.
Gambar 4. Kadar glukosa darah benih ikan patin pada awal pasca-transportasi dan akhir pasca-transportasi. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan pelakuan D (10,5 mg/L). Huruf kecil yang berbeda pada grafik menunjukkan beda nyata untuk setiap perlakuan pada awal pasca-transportasi dan akhir pasca-transportasi (p<0,05).
Hasil pengukuran kadar glukosa darah benih ikan patin pada awal pasca-transportasi dan akhir pasca-pasca-transportasi dapat dilihat pada gambar 4. Kadar glukosa darah awal pasca-transportasi benih ikan patin mengalami kenaikan pada masing-masing perlakuan. Kadar glukosa darah tertinggi pada awal pasca-transportasi terjadi pada perlakuan 0 mg/L sebesar 81,04±0,11 mg/dL. Data hasil uji statisitik menunjukkan bahwa kadar glukosa darah benih ikan patin awal pasca-transportasi pada perlakuan 0 mg/L, perlakuan 3,5 mg/L, perlakuan 7 mg/L dan perlakuan 10,5 mg/L berbeda nyata dengan ikan normal (Lampiran 4). Hasil akhir pasca-transportasi kadar glukosa mulai mendekati ikan normal. Peningkatan kadar glukosa pasca-transportasi disebabkan oleh adanya stres pada ikan. Terjadinya peningkatan kadar glukosa pada pasca-transportasi disebabkan oleh tingkat stres ikan yang meningkat akibat dari transportasi. Namun setelah ikan patin dipelihara, kadar glukosa ikan patin mulai mengalami penurunan. Hal ini disebabkan seiring waktu pemeliharaan, respon stres ikan mulai mengalami penurunan yang menyebabkan kadar glukosa darah ikan ikut menurun. Menurut Evans et al. (2004) bahwa stres pada ikan diakibatkan dari perubahan lingkungan atau diakibatkan dari beberapa hal atau perlakuan misalnya akibat dari transportasi atau transportasi ikan. Jika ikan mengalami stres maka tubuh ikan akan mengeluarkan tanda atau alarm sebagai adanya indikasi gangguan. Tubuh ikan akan merespon dengan menskresikan hormon glukokortikoid (kortisol) dan katekolamin yang mengotrol tubuh untuk mengatasi terjadinya stres (Barton et al. 1988). Respon stres ini akan
15 meningkatkan glukosa darah karena terjadi metabolisme glukosa darah yang diakibatkan oleh kortisol dan katekolamin.
Mekanisme terjadinya perubahan glukosa selama stres adalah adanya stresor
yang akan diterima oleh organ reseptor. Melalui sistem saraf informasi penyebab stres tersebut disampaikan ke otak bagian hipotalamus. Sel kromafin menerima perintah dari hipotalamus melalui serabut saraf simpatik untuk mensekresikan hormon katekolamin. Hormon ini akan mengaktivasi enzim-enzim yang yang terlibat dalam katabolisme simpanan glikogen hati dan otot serta menekan sekresi hormon insulin. Hal inilah yang mengakibatkan glukosa darah mengalami peningkatan (Hastuti et al. 2003; Sahetapy 2011). Kadar glukosa yang meningkat mengindikasi adanya aliran glukosa ke dalam darah yang lebih besar dibandingkan pemasukan glukosa ke dalam sel. Sebalikny, kadar glukosa akan menurun apabila aliran glukosa ke dalam darah lebih rendah dibandingkan pemasukan glukosa darah ke dalam sel (Aslamyah 2006). Menurut Hastuti et al (2003) bahwa katabolisme protein yang membentuk glukosa juga bisa menghasilkan asam amino sehingga asam amino dalam darah meningkat yang mengakibatkan terjadinya penurunan glukosa darah. Asam amino yang meningkat dalam darah akan mengaktivasi
insulin yang mampu melakukan tranport glukosa sehingga glukosa dalam darah akan menurun kembali (Hastuti et al. 2003; Wendelaar 1997). Insulin berfungsi sebagai sistem pengatur yang dapat mempertahankan kadar glukosa darah agar kembali normal (Guyton 2006).
Pada tiap perlakuan ikan mulai mengalami penurunan kadar glukosa selama masa pemeliharaan. Hal ini disebabkan karena ikan sudah mulai bisa beradaptasi dengan lingkunganya dan ikan sudah di beri pakan serta lamanya masa pemeliharaan di duga mampu menurunkan kadar glukosa. Menurut Martinez-Porchas et al (2009) bahwa pakan, spesies, waktu terakhir makan, dan persedian glikogen di hati dapat mempengaruhi kadar glukosa darah pada tubuh ikan. Seiring waktu pemeliharaan, kadar glukosa darah bisa kembali normal.
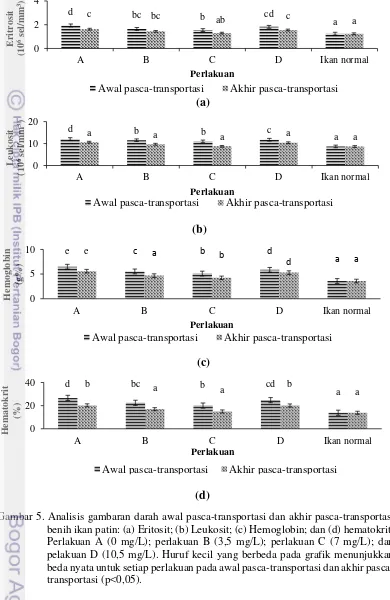
Analisis Gambaran Darah
Hasil analisis gambaran darah benih ikan patin pada awal pasca-transportasi selama 72 jam dan pada akhir pasca-transportasi selama 30 hari dapat dilihat pada Gambar 5. Parameter analisis gambaran darah yang diamati meliputi eritrosit, leukosit, hematokrit dan hemoglobin yang akan dibandingkan dengan gambaran darah ikan normal. Ikan normal adalah ikan yang bukan dari perlakuan, pengukuran kadar glukosa ikan normal dilakukan hanya untuk dijadikan sebagai perbandingan terhadap ikan yang diberikan perlakuan.
Kadar eritrosit benih ikan patin pada awal pasca-transportasi mengalami peningkatan untuk setiap perlakuan dari kadar eritrosit ikan normal (Gambar 5a). Kadar eritrosit perlakuan 0 mg/L mengalami peningkatan tertinggi sebesar 1,935±0,155 (106 sel/mm3) dan perlakuan 7 mg/L mengalami peningkatan terendah sebesar 1,54±0,01 (106 sel/mm3). Kadar eritrosit benih ikan patin pada akhir
16
Setiawati (2007) peningkatan sel darah merah adalah bagian dari usaha homeostasis
tubuh ikan dalam upaya untuk memperbanyak hemoglobin yang berguna untuk mengikat oksigen. Ikan yang hidup di air dengan kadar oksigen yang rendah akan mengalami hematopoiesis sehingga eritositnya meningkat sebagai upaya penyesuaian penambahan oksigen. Peningkatan total sel darah merah adalah hasil dari respons stres ikan saat transportasi (Supriyono et al. 2010).
Kadar leukosit benih ikan patin pada awal pasca-transportasi mengalami peningkatan untuk setiap perlakuan dari kadar leukosit ikan normal (Gambar 5b). Hasil uji statistik menyatakan bahwa adanya perbedaan nyata antara perlakuan dan ikan normal pada awal pasca-transportasi dan akhir pasca-transportasi (Lampiran 6). Kadar leukosit perlakuan 0 mg/L mengalami peningkatan tertinggi sebesar 12,05±0, 55 (106 sel/mm3) dan perlakuan 7 mg/L mengalami peningkatan terendah sebesar 10,975±0,08 (106 sel/mm3). Hasil akhir pasca-transportasi, kadar leukosit mengalami penurunan mendekati kadar leukosit ikan normal sebesar 8,675±0,22 (106 sel/mm3). Peningkatan jumlah leukosit akibat dari adanya stres yang terjadi
dalam media pengepakan selama transportasi. Peningkatan kadar total leukosit pada setiap perlakuan ikan disebabkan oleh meningkatnya tingkat stres ikan dan pengaruh lingkungan pada media transportasi yang semakin memburuk (Supriyono
et al. 2011). Kualitas air yang tidak layak dalam tranportasi diduga penyebab ikan menjadi stres. Menurut Paulo et al (2009) bahwa tingginya jumlah leukosit disebabkan oleh tingkat stres pada ikan akibat memburuknya kualitas air. Hal ini sesuai dengan penelitian Emu (2010) bahwa peningkatan leukosit terjadi akibat dari kualitas air yang memburuk dalam media pengepakan sehingga mengakibatkan ikan mengalami stres.
Kadar hemoglobin benih ikan patin pada awal pasca-transportasi mengalami peningkatan untuk setiap perlakuan dari kadar hemoglobin ikan normal (Gambar 5c). Kadar hemoglobin perlakuan 0 mg/L mengalami peningkatan tertinggi sebesar 6,5±0,10 (g%) dan perlakuan 7 mg/L mengalami peningkatan terendah sebesar 5,1±0,10 (g%). Hasil data statistik menunjukkan bahwa adanya perbedaan nyata kadar hemoglobin untuk setiap perlakuan benih ikan patin pada awal pasca-transportasi dibandingkan dengan kadar hemoglobin benih ikan patin normal 3,6±0,20 (g%) (Lampiran 7). Hasil akhir pasca-transportasi, kadar hemoglobin mulai mengalami penurunan mendekati kadar hemoglobin ikan normal. Secara fisiologis, hemoglobin memiliki hubungan yang erat dengan daya ikat oksigen dalam darah sehingga hemoglobin menentukan ketahanan tubuh (Siakpere et al. 2005). Stres dapat meningkatkan kadar hemaglobin pada tubuh ikan (Royan et al. 2014). Keadaan stres dapat mempengaruhi kadar hemaglobin dan aktivitas fisiologis pada ikan. Peningkatan kadar hemoglobin adalah respon stres ikan saat transportasi (Supriyono et al. 2011).
17 hematokrit bervariasi tergantung pada faktor nutrisi, umur ikan, jenis kelamin, ukuran tubuh dan masa pemijahan. Peningkatan kadar hematokrit merupakan respon stres pada ikan selama transportasi (Supriyono et al. 2011).
(a)
18
Stres terjadi disebabkan oleh tingginya tingkat metabolisme yang memicu kebutuhan oksigen yang meningkat dan menghasilkan peningkatan CO2, sehingga
ikan harus mengalami hematopoiesies untuk meningkatkan suplai oksigen dan mempercepat proses ekskresi CO2. Hal inilah yang menyebabkan sel kromafin
memerintahkan hormon ketekolamin sebagai respon stres yang berfungsi untuk meningkatkan kapasitas darah dalam mengangkut oksigen ke dalam darah yang bertujuan mengatasi gangguan keseimbangan homeostasis dan metabolisme yang terjadi akibat stres (Wahyu et al. 2015). Peningkatan tersebut menyebabkan meningkatnya sel darah merah, kadar hemoglobin, dan kadar hematokrit ikan (Bonga 1997). Kadar amonia yang tinggi dalam media pengepakan dapat memicu tumbuhnya bakteri sehingga menyebabkan terjadinya stres pada ikan dan mengakibatkan kenaikan total sel darah putih sebagai sistem pertahanan tubuh. Ikan yang mengalami stres akan berusaha mempertahankan diri dari kondisi buruk akibat pemaparan bakteri yang dapat dilihat dari jumlah sel darah putih yang terus meningkat serta tubuh ikan tersebut akan membentuk antibodi (Maftuch et al. 2012).
Hasil pengamatan analisis gambaran darah eritrosit, leukosit, hemoglobin, dan hematokrit menunjukkan bahwa seiring bertambahnya waktu pemeliharaan tingkat kadar eritrosit, leukosit, hemoglobin dan hematokrit mulai mendekati kadar gambaran darah ikan normal. Hal ini dikarenakan ikan mulai beradaptasi dengan lingkunganya sehingga tingkat stres ikan menurun dan mendekati kadar gambaran darah ikan normal. Semakin lama ikan dipelihara pada saat pasca-transportasi maka dapat menurunkan tingkat stres ikan sehingga kadar gambaran darah ikan mengalami penurunan juga (Supriyono et al. 2010).
Laju Pertumbuhan Harian (LPH)
Laju pertumbuhan harian benih ikan patin selama pemeliharaan 30 hari pasca-transportasi dapat dilihat pada Gambar 6. Hasil analisis statistik menunjukkan tingkat kelangsungan hidup pada setiap perlakuan berbeda nyata (Lampiran 9). Hal ini berarti pemberian garam dan kepadatan ikan saat transportasi tidak berpengaruh terhadap laju pertumbuhan harian pasca transportasi.
19 Laju pertumbuhan harian yang tertinggi terjadi pada perlakuan 7 mg/L sebesar 1,34±0,004 %. Hal ini disebabkan oleh tingkat stres yang rendah dibandingkan perlakuan yang lain. Menurut Supriyono et al. (2010) yang menyatakan bahwa pemberian minyak sereh dengan dosis yang tepat dapat mengurangi stres ikan dan kerusakan jaringan yang ringan sehingga tidak mempengaruhi nafsu makan ikan.
Tingkat Kelangsungan Hidup (TKH) Akhir Pasca-transportasi
Tingkat kelangsungan hidup benih ikan patin pada akhir pasca-transportasi selama 30 hari pemeliharaan dapat dilihat pada Gambar 7.
Gambar 7. Tingkat kelangsungan hidup benih ikan patin pasca-transportasi selama 30 hari pemeliharaan. Perlakuan A (0 mg/L); perlakuan B (3,5 mg/L); perlakuan C (7 mg/L); dan perlakuan D (10,5 mg/L). Huruf kecil yang berbeda pada grafik menunjukkan beda nyata untuk setiap perlakuan pada akhir pasca-transportasi (p<0,05).
Hasil pengamatan tingkat kelangsungan hidup (TKH) menunjukkan bahwa TKH tertinggi selama 30 hari pemeliharaan pasca-transportasi terdapat pada perlakuan 7 mg/L dengan nilai sebesar 76±2,406%, diikuti oleh perlakuan 3,5 mg/L sebesar 40,23±1,385%, lalu diikuti oleh perlakuan 10,5 mg/L sebesar 30,89±1,017%, dan diikuti oleh perlakuan tanpa minyak sereh sebesar 6,43±1,401%. Hasil uji statistik menunjukkan perbedaan nyata untuk setiap perlakuan pada akhir pasca-transportasi (Lampiran 10).
20
SIMPULAN DAN SARAN
Simpulan
Minyak sereh pada dosis yang tepat dapat bersifat menenangkan ikan pada kegiatan transportasi. Minyak sereh dosis 7 mg/L, garam 6 g/L, zeolit 20 g/L dan karbon aktif 10 g/L memberikan tingkat kelangsungan hidup sebesar 86,67±1,33% dalam kegiatan transportasi benih ikan patin berkepadatan 150 ekor/L selama 72 jam. Kualitas air pada media pengepakan transportasi yang masih layak untuk benih ikan patin sehinga benih ikan patin dapat bertahan hidup selama transportasi serta meminimalisir tingkat stres pada kondisi fisiologis seperti kadar glukosa, eritrosit, leukosit, hemoglobin dan hematokrit.
Saran
Perlu adanya penelitian lebih lanjut tentang penelitian transportasi jenis ikan yang berbeda dengan menggunakan minyak sereh sebagai bahan anestesi karena informasi mengenai penelitian minyak sereh sebagai bahan anestesi masih sedikit, sehingga perlu adanya penelitian dengan jenis ikan yang berbeda.
DAFTAR PUSTAKA
Arifin MY. 2015. Respons fisiologis benih udang mantis Harpiosquilla raphidea
pasca-transportasi sistem kering, lembab, dan basah. Tesis. Program Pascasarjana. Institut Pertanian Bogor. Bogor.
Aslamyah, S. 2006. Peningkatan peran mikroba saluran pencernaan untuk memacu pertumbuhan ikan bandeng. Disertasi. Program Pascasarjana. Institut Pertanian Bogor.
Barton BA, Schreck CB, Fowler LG. 1988. Fasting and diet content affect stres-induced canges in plasma glucose and cortisol in juvenile chinook salmon. The Progressive Fish Culturist. 50:16-22.
Bonga SW. 1997. The stres response in fish. Physiological Review. 77(3):591-625. Emu S. 2010. Pemanfaatan garam pada transportasi sistem tertutup benih ikan patin
Pangasius sp berkepadatan tinggi dalam media yang mengandung zeolit dan karbon aktif. Tesis. Program Pascasarjana. Institut Pertanian Bogor. Bogor. Evans JJ, Klesius PH, Gilbert PM, Shoemaker CA, Sarawi MA Al, Landsberg J,
21
Sparus auratus L., and wild mullet, liza klunzingeri (day), in Kuwait. Journal Fish Disease 25: 505-513.
Guyton, A.C. and Hall, J.E., 2006. Textbook of Medical Physiology. 11th ed. Philadelphia, PA, USA: Elsevier Saunders
Harianto E. 2014. Kinerja produksi ikan sidat Anguilla marmorata ukuran 7 gram dengan kepadatan tinggi pada sistem resirkulasi melalui kajian fisiologis. Tesis. Program Pascasarjana. Institut Pertanian Bogor. Bogor.
Hastuti, S., E. Supriyono., I. Mokoginta dan Subandiyono. 2003. Respon glukosa darah ikan Gurami Osphronemus gouramy, Lac terhadap stres perubahan suhu lingkungan. Jurnal Akuakultur Indonesia. 2(2):73-77.
Huisman EA. 1987. Principles of Fish Culture and Fisheries. Netherlands: Wageningen Agiculture University.
Humairani. 2015. Respon stres benih udang galah Macrobrachium rosenbergii
terhadap penambahan zeolit, karbon aktif, minyak cengkeh dan garam pada transportasi tertutup. Tesis. Program Pascasarjana. Institut Pertanian Bogor. Bogor.
Lestari RSE, Mangunwidjaja D, Suryani A, Fauzi AM, dan Rusli MS. 2012. Kajian finansial isolasi Chitronellal dan Rhodinol pada industri berbasis senyawa turunan minyak sereh wangi. Agrointek. 6:1
Liao IC, Huang HJ.1975. Studies on the respiration of economic prawns in Taiwan. I. Oxygen of egg up to young prawns of Penaeus monodon Fab. Fish Social Taiwan. 4(1):33-50.
Lumete C dan Gybert M. 2012. Efektivitas pemberian beberapa jenis dan dosis bahan anestesi pada prakondisi kerang Anodonta woodiana. Bionatural-Jurnal Ilmu-ilmu Hayati dan Fisik. 14(3):192-197
Maftuch, Nursyam H, Sukarni. 2012. Kajian penggunaan Ciprofloxacin terhadap hematologi ikan botia (Botia macracanthus, Bleeker) yang diinfeksi bakteri
Aeromonas hydrophila. J.Exp. Life Sci. 2(2):65-69.
Martinez-Porchas, M., L.R. Martinez-Cordova, and R. Ramos-Enriquez. 2009.
Cortisol and Gucose: Reliable Indicators of Fish Stres Pan-American.
Journal of Aquatic Sciences 4(2):158-178.
Nirmala K, Hadiroseyani Y, Widiasto RP. 2012. Penambahan garam dalam media air yang berisi zeolit dan karbon aktif pada transportasi sistem tertutup benih ikan gurami Osphronemus goramy Lac. Jurnal Akuakultur Indonesia. 11(2):190-201.
Paulo CFC, Pedro HSK, Elaine A, Correia S, Bernardo B. 2009. Transport of jundia
Rhamdia quelen juveniles at different loading densities: water quality and blood parameters. JournalNeotropical Ichthyology. 7(2):283-288.
Rachmawati FN, Susilo U, Sistina Y. 2010. Seminar Nasional Biologi. Respon fisiologi ikan nila Orechromis niloticus yang distimulasi daur pemuasaan dan pemberian pakan kembali. Yogyakarta. 24-25 September.
Royan F, Rejeki S, Haditomo AHC. 2014. The effects of different salinity on blood profile parameters of tilapia Oreochromis niloticus. Journal of Aquaculture Management and Technology. 3(2):109-117.
Sahetapy JMF. 2011. Toksisitas logam berat timbal (Pb) dan pengaruhnya pada konsumsi oksigen dan respon hematologi juvenil ikan kerapu macan
22
Setiawati M, Winarno TI, Suprayudi MA, Mokoginta I, Manalu W. 2007. Mineral besi sebagai peningkat vitalitas ikan kerapu bebek Cromileptes altivelis saat kondisi stres hipoksia. Jurnal Ilmu Pertanian Indonesia. 12(1):8-14.
Siakpere OK, Ake JEG, Idoge E. 2005. Haematologycal characteristics of african snakehead, Parachanna obscura. African Journal of Biotechnology. 4:527-530.
Sulmartini L, Chotimah DN, Tjahjaningsih W, Widiyatno TV, Triastuti J. 2009. Respon daya cerna dan respirasi benih ikan mas Cyprinus carpio pasca-transportasi dengan menggunakan daun bandotan Ageratum conyzoides
sebagai bahan antimetabolik. Jurnal Ilmiah Perikanan dan Kelautan. 1(1): 79–86
Sunarma A. 2007. Panduan Singkat Teknik Pembenihan Ikan Patin (Pangasius hypopthalmus). Balai Besar Pengembangan Budidaya Air Tawar Sukabumi. Supriyono E, Supendi A, Nirmala K. 2007. Pemanfaatan zeolit dan karbon aktif
pada sistem pengepakan tertutup ikan Corydoras Corydoras aenus. Jurnal Akuakultur Indonesia. 6(2):135-145.
Supriyono E, Budiyanti, Budiardi T. 2010. Respon Fisiologi Benih Ikan Kerapu Macan Ephinephelus fuscoguttatus Terhadap Penggunaan Minyak Sereh dalam Transportasi Tertutup dengan Kepadatan Tinggi. Jurnal Ilmu Kelautan. 15(2):103-112.
Supriyono E, Syahputra R, Ghozali MFR, Wahjuningrum D, Nirmala K, Kristanto, AH. 2011. Efektivitas pemberian zeolit, karbon aktif, dan minyak cengkeh terhadap hormon kortisol dan gambaran darah benih ikan patin Pangasius hypopthalamus pada transportasi dengan kepadatan tinggi. Jurnal Ikhtiologi Indonesia, 11(1):67-75.
Suryaningrum TD, Syamsidi, Ikasari D. 2007. Teknologi penanganan dan transportasi lobster air tawar. Squalen. 2:2.
Suryaningrum TD, Muljanah I, Tahapari E. 2010. Profil sensori dan nilai gizi beberapa jenis ikan patin dan hibrid nasutus. Jurnal Pascapanen dan Bioteknologi Perikanan dan Kelautan. 5(2):153-164.
Suwandi R, Jacoeb AM, Muhammad V. 2011. Pengaruh cahaya terhadap aktivitas metabolisme ikan lele dumbo Clarias gariepinus pada simulasi transportasi sistem tertutup. Jurnal Pengolahan Hasil Perikanan Indonesia. 14(2):92-97 Yanto H. 2012. Kinerja MS-222 dan kepadatan ikan botia Botia macracanthus yang
berbeda selama transportasi. Jurnal Penelitian Perikanan. 1(1):43-51. Wahyu, Supriyono E, Nirmala K, Harris E. 2015. Pengaruh kepadatan ikan selama
transportasi gambaran darah, ph darah, dan kelangsungan hidup benih ikan gabus Chana striata (Bloch, 1793). Jurnal Ikhtiologi Indonesia. 15(2):165-177.
Wedemeyer GA, Yatsuke WT. 1977. Clinical methods for assesment of the effect of enviromental stres on fish health. The chnical Papers of the U.S Fish and Wildlife Service. Fish and Wildlife Service 89:1-17.
Wendelaar, B.S.E. 1997. The stres response in fish. Physiol. Rev., 77:591-625. Wibowo. 1993. Penerapan Teknik Penanganan dan Transportasi Ikan Hidup di
Indonesia. Jakarta: Sub. BPPL. Slipi.
24
Lampiran 2. Prosedur pengukuran gambaran darah a) Perhitungan jumlah sel darah merah (Eritrosit)
Darah diambil dari ikan dengan menggunakan injeksi yang terlebih dahulu telah diisi dengan cairan antikoagukan untuk mencegah terjadinya penggumpalan darah. Darah yang tersedot dimasukkan ke dalam ependorf, dan kemudian darah dihisap dengan menggunakan pipet pencampur sampai dengan skala 0,5 dan ditambahkan dengan larutan hayens yang dihisap dengan menggunakan pipet yang sama hingga mencapai skala 101. Setelah itu, pipet digoyangkan membentuk angka delapan selama 3-5 menit. Tetesan pertama dibuang dan tetesan berikutnya diteteskn kedalam haemocytometer dan ditutup dengan kaca penutup. Perhitungan dilakukan pada 5 kotak kecil yaitu sudut kiri atas, sudut kanan atas, sudut kiri bawah, sudut kanan bawah, dan pada bagian tengah. Jumlah sel darah merah yang terhitung dikonversi dengan rumus:
b) Perhitungan jumlah sel darah putih
Metode pengambilan darahnya sama dengan metode pengambilan darah merah. Darah dihisap dengan pipet pencampur sampai dengan skala 11 dan ditambahkan larutan turk. Kemudian pipet digoyangkan hingga membentuk angka delapan selama 3-5 menit. Tetesan pertama dibuang, dan tetesan selanjutnya diteteskan diatas haemocytometer lalu ditutup dengan kaca penutup. Penghitungan dilakukan pada 5 kotak besar. Jumlah sel darah putih yang terhitung dikonversikan dengan rumus:
c) Pengukuran kadar hematokrit
Menggunakan Microhematocrit method, darah dimasukkan ke dalam tabung mikrohematokrit sampai 4/5 bagian. Kemudian salah satu ujung tabung disumbat dengan crestaseal. Darah disentrifuge pada kecepatan 12000 rpm selama 5 menit. Setelah itu akan terbentuk lapisan-lapisan yang terdiri dari lapisan plasma yang jernih di bagian atas, kemudian lapisan putih abu-abu buffy coat yang merupakan trombosit dan leukosit dan lapisan eritrosit yang berwarna merah. Nilai hematokrit ditentukan dengan mengukur persentase volume eritrosit dari darah dengan menggunakan alat baca mikrohematokrit Microcapillary hematocrit reader
dan dinyatakan dalam persentase (% Ht). d) Kadar Haemoglobin (Hb)
Pengukuran kadar haemoglobin pada prinsipnya adalah mengkoversikan haemoglobin dalam darah ke dalam bentuk asam hematin oleh asam klorida. Mula-mula darah diisap menggunakan pipet sahli hingga skala 20 mm3. Kemudian dipindahkan ke dalam tabung Hb yang berisi HCl 0,1 N sampai skala 10 (kuning). Didiamkan selama 3-5 menit agar Hb bereaksi dengan HCl membentuk asam hematin, kemudian diaduk dan ditambahkan aquadestila (sedikit demi sedikit) hingga warnanya sama dengan standar. Pembacaan skala dilakukan dengan melihat tinggi permukaan larutan yang dikocok dengan skala lajur g% yang menunjukkan
Jumlah sel darah merah = ∑ sel darah merah terhitung x 104 sel/mm3
25 banyaknya Hb dalam gram setiap 100 ml darah dan dinyatakan dalam persentase (% Hb).
Lampiran 3. Hasil analisis ragam tingkat kelangsungan hidup (TKH) awal pasca-transportasi.
I. Analisis ragam TKH awal pasca-transportasi
Analisis Ragam
JK DB KT F Sig.
TKH jam ke-24 Antar Perlakuan 777.600 4 194.400 167.908 .000 Dalam pelukuan 11.578 10 1.158
Total 789.178 14
TKH jam ke-36 Antar Perlakuan 2578.354 4 644.588 247.354 .000 Dalam pelukuan 26.059 10 2.606
Total 2604.413 14
TKH jam ke-48 Antar Perlakuan 6362.424 4 1590.606 583.382 .000 Dalam pelukuan 27.265 10 2.727
Total 6389.689 14
TKH jam ke-60 Antar Perlakuan 10073.878 4 2518.469 944.266 .000 Dalam pelukuan 26.671 10 2.667
Total 10100.549 14
TKH jam ke-72 Antar Perlakuan 13572.403 4 3393.101 2244.767 .000 Dalam pelukuan 15.116 10 1.512
26
II. Uji lanjut Duncan
TKH jam ke-24
Perlakuan N
Alpha = 0.05
1 2
K (kontrol) 3 82.0000
A(0 mg/L) 3 100.0000
B (3,5 mg/L) 3 100.0000
C (7 mg/L) 3 100.0000
D (10,5 mg/L) 3 100.0000
Sig. 1.000 1.000
TKH jam ke-36
Perlakuan N
Alpha = 0.05
1 2 3 4 5
K (kontrol) 3 58.0000
A (0 mg/L) 3 76.2200
B (3,5 mg/L) 3 81.5533
C (7 mg/L) 3 87.1100
D (10,5 mg/L) 3 97.5567
Sig. 1.000 1.000 1.000 1.000 1.000
TKH jam ke-48
Perlakuan N
Alpha = 0.05
1 2 3 4 5
K (kontrol) 3 28.4467
A (0 mg/L) 3 55.5533
B (3,5 mg/L) 3 62.6667
C (7 mg/L) 3 69.3333
D (10,5 mg/L) 3 92.0000
27
TKH jam ke-60
Perlakuan N
Alpha = 0.05
1 2 3 4 5
K (kontrol) 3 12.4433
A (0 mg/L) 3 33.1100
B (3,5 mg/L) 3 53.3333
C (7 mg/L) 3 60.2200
D (10,5 mg/L) 3 89.3333
Sig. 1.000 1.000 1.000 1.000 1.000
TKH jam ke-72
Perlakuan N
Subset for alpha = 0.05
1 2 3 4 5
K (kontrol) 3 .0000
A (0 mg/L) 3 14.4433
B (3,5 mg/L) 3 40.8900
C (7 mg/L) 3 50.2233
D (10,5 mg/L) 3 86.6667
Sig. 1.000 1.000 1.000 1.000 1.000
Lampiran 4. Hasil analisis ragam glukosa darah benih ikan patin I. Analisis ragam glukosa darah
Analisis ragam
JK DB KT F Sig.
Glukosa darah awal pasca-transportasi
Antar perlakuan 3920.926 4 980.231 1370.215 .000 Dalam perlakuan 7.154 10 .715
Total 3928.080 14
Glukosa darah akhir pasca-transportasi
Antar perlakuan 2284.773 4 571.193 464.540 .000 Dalam perlakuan 12.296 10 1.230
28
II.Uji lanjut Duncan
Glukosa darah awal pasca-transportasi
Perlakuan N
Alpha = 0.05
1 2 3 4 5
Ikan normal 3 35.1300
C ( 7 mg/L) 3 66.7900
B ( 3,5 mg/L) 3 72.2600
D (10,5 mg/L) 3 75.3850
A (0 mg/L) 3 81.0400
Sig. 1.000 1.000 1.000 1.000 1.000
Glukosa darah akhir pasca transportasi
Perlakuan N
Alpha = 0.05
1 2 3 4
C (7 mg/L) 3 34.5000 Ikan normal 3 35.1300
B (3,5 mg/L) 3 52.7150
D (10,5 mg/L) 3 59.0850
A (0 mg/L) 3 64.6100
Sig. .502 1.000 1.000 1.000
Lampiran 5. Hasil analisis ragam eritrosit benih ikan patin I. Analisis ragam eritrosit
Analisis ragam
JK DB KT F Sig.
Eritrosit awal pasca-tranportasi
Antar perlakuan .869 4 .217 15.265 .000 Dalam perlakuan .142 10 .014
Total 1.011 14
Eritrosit akhir pasca-tranportasi
Antar perlakuan .319 4 .080 7.187 .005 Dalam perlakuan .111 10 .011
29
Lampiran 6. Hasil analisis ragam leukosit benih ikan patin I. Analisis ragam leukosit
Analisis ragam Dalam perlakuan 107.518 10 10.752
30
31