RADEN WINNY GARDIANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
KONSTRUKSI VEKTOR DAN EKSPRESI PROTEIN HUMAN
EGFRvIII DOMAIN EKSTRASELULER
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Konstruksi Vektor dan Ekspresi Protein Human EGFRvIII Domain Ekstraseluler pada Escherichia coli adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan Lembaga Ilmu Pengetahuan Indonesia.
RINGKASAN
RADEN WINNY GARDIANI. Konstruksi Vektor dan Ekspresi Protein Human EGFRvIII Domain Ekstraseluler pada Escherichia coli. Dibimbing oleh SRI BUDIARTI dan ASRUL MUHAMAD FUAD.
Reseptor faktor pertumbuhan epidermal varian III (EGFRvIII) adalah mutasi dari EGFR yang mengalami delesi pada bagian ekstraseluler dari ekson 2 sampai ekson 7. Reseptor ini berperan penting dalam pertumbuhan dan proliferasi sel kanker. Bagian dari ujung-N merupakan bagian unik karena memiliki epitop unik yang berbeda dari bentuk EGFR normal dan dapat dikenali dengan antibodi spesifik anti-EGFRvIII. Fragmen antibodi untai tunggal (scFv) merupakan antibodi anti-EGFRvIII yang memiliki aktifitas spesifik yang mampu mengenali epitop EGFRvIII tersebut. Tujuan dari penelitian ini adalah untuk mengekspresikan bagian ekstraseluler dari protein reseptor ini pada Escherichia coli, mempelajarinya lebih jauh dan menganalisis interaksi antigen EGFRvIII dengan antibodi anti-EGFRvIII dengan bantuan manik magnet. Pada sistem ekspresi di E. coli biasanya menghadapi beberapa kendala, yaitu tingkat ekspresi yang rendah, kebocoran ekspresi, pembentukan badan inklusi, dan protein yang terpotong. Salah satu cara untuk mengatasi masalah tersebut adalah dengan mensekresikan protein rekombinan tersebut menuju bagian periplasma. Selain itu, periplasma E. coli telah dilaporkan dapat menjaga fungsionalitas dan stabilitas protein lebih efisien dibandingkan sitoplasma. Oleh karena itu, dalam penelitian ini telah dikonstruksi sebuah vektor pJ404 rekombinan yang mengandung sekuen gen EGFRvIII domain ekstraseluler dan sebuah peptida sinyal yang berasal dari Bacillus xylanase (xylB-sp) yang difusikan pada bagian ujung-N. Gen penanda lainnya sebuah protein fluoresen biru (bfp, mTurqoise) yang telah disubklon pada bagian ujung-C berfungsi untuk menandai ekspresi protein EGFRvIII rekombinan pada periplasma E. coli. Vektor rekombinan ditransformasikan ke dalam E. coli BL21(DE3) untuk analisis ekspresi protein dan dipurifikasi.
Hasil dari penelitian ini menunjukkan bahwa fusi gen dari EGFRvIII::bfp telah berhasil diklon dan vektor rekombinan pJ404-EGFRvIII-bfp telah berhasil dikonstruksi. Selanjutnya, protein yang mengandung fusi EGFRvIII-bfp telah berhasil diekspresikan pada periplasma E. coli. Hal tersebut ditunjukkan dengan terdeteksinya protein berukuran sekitar 32 kDa, ukuran protein yang diprediksi dari fusi protein tersebut yang ditunjukkan dari hasil analisis SDS-PAGE dan Western Blot. Pengamatan di bawah mikroskop fluoresen menunjukkan sebuah pendaran cahaya berwarna biru yang dihasilkan dari E. coli transforman yang diinduksi. Eksperimen dengan menggunakan manik magnet yang diselimuti dengan protein antigen EGFRvIII rekombinan menunjukkan bahwa sel transforman Pichia pastoris yang terdapat antibodi scFv anti-EGFRvIII pada permukaan sel dapat melekat pada permukaan manik magnet. Hal tersebut membuktikan bahwa terjadi interaksi antara antigen (pada permukaan manik magnet) dengan antibodi (pada permukaan sel). Hal ini menunjukkan bahwa fusi protein antigen EGFRvIII ini memiliki struktur yang fungsional sehingga dapat dikenali dengan baik oleh antibodi spesifiknya.
Kata kunci : EGFRvIII, ekspresi periplasma, mTurqoise, sinyal peptida xylanase (xylB_sp).
SUMMARY
RADEN WINNY GARDIANI. Vector Construction and Protein Expression of The Human EGFRvIII Extracellular Domain in Escherichia coli. Supervised by SRI BUDIARTI and ASRUL MUHAMAD FUAD.
Epidermal Growth Factor Receptor variant III (EGFRvIII) is a mutant of EGFR having deletion of its extracellular domain from exon-2 through exon-7. This receptor plays a key role in the growth and proliferation of cancer cells. It has a unique N-terminal domain with a unique epitope that differs from natural EGFR structure and readily recognized by a specific anti-EGFRvIII antibody. Anti-EGFRvIII scFv (single chain fragment antibody) is an antibody fragment having a specific activity against this reseptor. The aim of this study is to overexpress the extracellular domain of this receptor protein in Escherichia coli to be able to study this receptor protein furthermore. However, it usually encounters several problems, i.e. low expression level, leak expression, inclusion body formation, and truncated protein. One approach to solves these problems is to have recombinant protein be secreted into the periplasmic space or culture medium. Moreover, the E. coli periplasm has been reported to enable functionality and stability of the protein more efficiently compared to cytoplasm. Therefore in this research a recombinant pJ404 vector containing genes encoding EGFRvIII extracellular domain (EGFRvIIIed) and a Bacillus xylanase signal peptide ( xylB-sp) fused at its N-terminal has been constructed. Another gene encoding a blue fluoresence protein (bfp, mTurqoise) was then subcloned at the C-terminal to investigate the recombinant EGFRvIII protein expression in E. coli periplasm. The recombinant vector was transformed into E. coli BL21(DE3) followed by protein overexpression and purification.
The result showed that the gene fusion of EGFRvIII::bfp was successfully cloned and the recombinant vector pJ404-EGFRvIII-bfp had been constructed. Furthermore, the EGFRvIII-bfp fusion protein had been successfully expressed in E. coli periplasm. It shows a molecular size of approximately 32 kDa, which is corresponds to the predicted size of the fusion protein as it is showed from SDS-PAGE and Western Blot analyses. Observation under a fluorescence microscope showed a blue fluorescence emission light coming from the induced transformed E. coli. Experiment using magnetic beads covered by recombinant EGFRvIII antigen showed that transformed Pichia pastoris cells are found to be well attached on the surface of magnetic beads. It proves that there is interaction between antigen (on magnetic bead surface) and antibody (on cell surface). The result showed that EGFRvIII fusion protein has a structurally functional so that it was readily recognized by its specific antibody.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
KONSTRUKSI VEKTOR DAN EKSPRESI PROTEIN HUMAN
EGFRvIII DOMAIN EKSTRASELULER
PADA Escherichia coli
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul Tesis : Konstruksi Vektor dan Ekspresi Protein Human EGFRvIII Domain Ekstraseluler pada Escherichia coli
Nama : Raden Winny Gardiani
NIM : P051110061
Disetujui oleh Komisi Pembimbing
Dr dr Sri Budiarti Ketua
Dr Asrul Muhamad Fuad Anggota
Diketahui oleh
Ketua Program Studi Bioteknologi
Prof Dr Ir Suharsono, DEA
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian ini adalah protein rekombinan, dengan judul Konstruksi Vektor dan Ekspresi Protein Human EGFRvIII Domain Ekstraseluler pada Escherichia coli. Tesis ini merupakan hasil penelitian yang dilakukan di Laboratorium Protein Rekombinan dan Sistem Penghantaran Terarah, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) dan dibiayai oleh DIPA Pusat Penelitian Bioteknologi LIPI tahun 2013. Sebagian dari hasil penelitian ini sedang dalam penelaahan untuk dipublikasikan pada Malaysian Journal of Microbiology (MJM).
Terima kasih penulis ucapkan kepada Ibu Dr. dr. Sri Budiarti dan Bapak Dr. Asrul Muhamad Fuad, M. Si. selaku dosen pembimbing yang telah memberikan bimbingan, ilmu, arahan, dan saran selama penelitian hingga terselesaikannya penyusunan tesis ini. Penulis juga berterima kasih kepada Dr. Ir. I Made Artika, M. App. Sc. selaku penguji luar komisi pada ujian tesis. Selain itu juga, penulis mengucapkan terima kasih banyak kepada Kepala beserta semua staf Laboratorium Protein Rekombinan dan Sistem Penghantaran Terarah, Pusat Penelitian Bioteknologi-LIPI. Ucapan terima kasih juga disampaikan kepada semua sahabat Program Studi Bioteknologi angkatan 2011 atas semua semangat, perhatian dan dukungannya selama bersama-sama menuntut ilmu di IPB. Serta ucapa terima kasih juga disampaikan kepada mamah, papih, suami, anak, mertua,
kakak, adik dan seluruh keluarga atas segala do’a, dukungan dan kasih sayangnya
dalam menyelesaikan penelitian ini.
Semoga karya ilmiah ini bermanfaat bagi semua pembaca.
DAFTAR ISI
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
2 TINJAUAN PUSTAKA 2
EGFR dan EGFRvIII 2
Ekspresi Gen pada Escherichia coli 6
Ekspresi Gen di Periplasma dan di Sitosol Escherichia coli 6
Plasmid pJexpress 7
Blue Flourescent Protein (BFP) 8
3 METODE 8
Waktu dan Tempat 8
Bahan 8
Metode Penelitian 9
4 HASIL DAN PEMBAHASAN 12
Kontruksi Vektor Rekombinan 12
Ekspresi Protein Rekombinan 17
Analisis Interaksi Antibodi Anti-EGFRvIII dengan Antigen EGFRvIII 21
5 SIMPULAN DAN SARAN 23
Simpulan 23
Saran 24
DAFTAR PUSTAKA 24
LAMPIRAN 26
DAFTAR GAMBAR
1 Mekanisme transduksi sinyal oleh EGFR 3
2 Struktur galur liar dan galur mutan dari EGFR 5
3 Tipe-tipe isoform EGFR 5
4 Plasmid pJexpress 8
5 Hasil elektroforesis PCR gen bfp 12
6 Hasil restriksi gen bfp dan pJ404-EGFRvIII dengan BamHI 13 7 Hasil transformasi pJ404-EGFRvIII-bfp ke dalam E. coli DH5 pada
media LB agar + ampisilin [100g/ml] 13
8 Hasil analisis PCR koloni transforman pJ404-EGFRvIII-bfp dengan
menggunakan primer BFP_Bam_F dan BFP_Bam_R 14
9 Hasil analisis PCR penentuan arah orientasi transforman gen bfp dalam konstruk pJ404-EGFRvIII-bfp dengan menggunakan primer
pJ404_T5up_F dan BFP_Bam_R. 15
10 Hasil analisis potong transforman PJ404-EGFRvIII-bfp dengan
menggunakan enzim restriksi BamHI. 16
11 Peta konstruksi vektor rekombinan pJ404-EGFRvIII-bfp 16 12 Hasil transformasi pJ404-EGFRvIII-bfp ke dalam E. coli BL21(DE3) 17 13 Hasil pengamatan sel transforman E. coli BL21(DE3) yang diamati
di bawah mikroskop fluoresen berwarna biru 18
14 Hasil analisis SDS-PAGE dan Western Blot dari EGFRvIII-bfp terpurifikasi
yang disekresikan di periplasma E. coli. 19
15 Hasil analisis SDS-PAGE dan Western blot dari EGFRvIII-bfp terpurifikasi
yang disekresikan di sitoplasma E. coli. 20
16 Hasil pengamatan mikroskopik manik magnet yang mengandung fusi
protein BFP dan antigen EGFRvIII 21
17 Pengamatan mikroskopik interaksi antibodi-antigen antara ikatan EGFRvIII pada manik magnet terhadap antibodi anti EGFRvIII
pada permukaan sel P. pastoris 23
DAFTAR LAMPIRAN
1 Analisis urutan DNA plasmid pJ404-EGFRvIII-bfp (klon 14) dengan
primer T5up_F 26
2 Analisis urutan DNA plasmid pJ404-EGFRvIII-bfp (klon 2D9) dengan
primer T5up_F 28
3 Analisis urutan DNA plasmid pJ404-EGFRvIII-bfp (klon 2D9) dengan
primer Txn_R 30
4 Komposisi larutan dan media yang digunakan beserta cara pembuatannya 32
1
PENDAHULUAN
Latar Belakang
Epidermal growth factor receptor (EGFR) merupakan suatu protein reseptor yang memiliki berat molekul sebesar 170 kDa. Reseptor ini merupakan anggota famili reseptor tirosin kinase yang memiliki peran penting dalam pertumbuhan dan poliferasi sel. Selain itu juga, EGFR diklasifikasikan sebagai salah satu molekul reseptor pada permukaan sel yang paling sering terlibat dalam proses karsinogenesis (Pedersen et al. 2001).
Pada sel kanker banyak ditemukan EGFR yang mengalami mutasi. Epidermal growth factor reseptor variant III (EGFRvIII) merupakan salah satu jenis mutasi EGFR yang mengalami ekspresi secara berlebihan pada beberapa jenis sel kanker seperti kanker paru-paru, kanker payudara, dan kanker ovarium (Pedersen et al. 2001). Jenis dari mutasi reseptor ini tidak ditemukan pada jaringan normal sehingga dapat digunakan sebagai target terapi yang sangat ideal. Selain itu juga, EGFRvIII mengalami mutasi delesi pada ekson 2 sampai 7 yang melibatkan nukleotida 275 sampai 1075. Delesi ini membentuk sekuen peptida unik pada bagian ujung-N dan menciptakan residu glisin pada fusi antara ekson 1 dan 8 sehingga EGFRvIII tersebut dapat digunakan sebagai antigen spesifik pada penanganan terapi kanker (Pedersen et al. 2001; Gupta et al. 2010).
Escherichia coli merupakan organisme prokariot dan bakteri gram negatif yang banyak digunakan dalam sistem ekspresi protein rekombinan. Namun demikian, masalah umum yang sering dijumpai pada sistem ekspresi E. coli ialah tingkat ekspresi protein yang rendah dan kebocoran ekspresi (Giacalone 2006). Selain itu masalah pelipatan protein yang tidak benar pada ekspresi protein di dalam sitosol dan adanya keterbatasan E. coli dalam translokasi protein ke periplasma agar diperoleh protein yang fungsional juga sering menjadi kendala (Choi & Lee 2004). Ekspresi gen pada E. coli juga bisa menghasilkan protein yang sifatnya tidak larut dan tidak aktif dalam bentuk badan inklusi (inclusion bodies) yang memerlukan beberapa langkah tambahan agar menghasilkan protein yang fungsional. Salah satu cara agar diperoleh protein yang bersifat aktif dan dalam bentuk terlarut adalah dengan mengekspresikan protein rekombinan tersebut pada ruang periplasma. Untuk mengekspresikan protein pada periplasma diperlukan adanya sinyal peptida pada protein rekombinan yang diekspresikan (Peterson et al. 2006).
2
mengandung operator lacI yang mampu menjaga regulasi repressor lac. Vektor ini memiliki gen resistensi terhadap ampisilin. Ekspresi protein dapat dilakukan dengan cara diinduksi melalui penambahan isopropyl-thio-D-galactoside (IPTG) ke dalam medium.
Blue fluorescent protein (BFP) merupakan protein yang dapat berperan sebagai penanda dalam berbagai proses biologis seperti ekspresi protein atau untuk menentukan lokasi protein target di dalam sel atau organisme. Protein BFP yang digunakan adalah mTurqoise yang merupakan varian mutasi dari GFP yang berasal dari Aequorea victoria. Protein ini berukuran sekitar 29 kDa (259 asam amino), memiliki panjang gelombang emisi 434 nm dan eksitasi 474 nm. Protein fluoresen banyak digunakan dalam studi ekspresi protein pada berbagai organisme termasuk mamalia, tidak memberikan efek beracun dan tidak membentuk agregat sama sekali (Kremers et al. 2007).
Pada penelitian ini vektor pJ404 sendiri telah difusikan dengan gen EGFRvIII dan ditambahkan sinyal peptida xylanase yang dibuat secara sintetik (DNA 2.0). Konstruk yang akan dibuat adalah fusi gen EGFRvIII–bfp yang juga difusi dengan fragmen sinyal peptida dari gen xylanase (xylB_sp). Ekspresi protein rekombinan diharapkan diperoleh pada ruang periplasma E. coli.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengekspresikan domain ekstraseluler protein reseptor EGFRvIII pada ruang periplasma Escherichia coli.
Manfaat Penelitian
Manfaat dari penelitian ini antara lain diperolehnya domain ekstraseluler protein reseptor EGFRvIII yang dapat digunakan sebagai antigen untuk menghasilkan antibodi anti-EGFRvIII yang dapat digunakan untuk berbagai keperluan termasuk pengobatan kanker, diagnostik, serta untuk mempelajari interaksi antara antibodi anti-EGFRvIII dengan protein reseptor EGFRvIII sebagai antigen.
2
TINJAUAN PUSTAKA
EGFR dan EGFRvIII
-3 binding EGF-like growth factor (HB-EGF), betacellulin, dan epiregulin. Secara garis besar EGFR terdiri atas dua bagian, yaitu bagian ekstraseluler dan intraseluler. Bagian ekstraseluler terdiri atas reseptor-reseptor yang berfungsi sebagai tempat ikatan antara ligan dengan EGFR. Pada bagian intraseluler terdapat domain tirosin kinase yang berperan pada proses transduksi sinyal dalam pertumbuhan sel kanker (Burgess 2008).
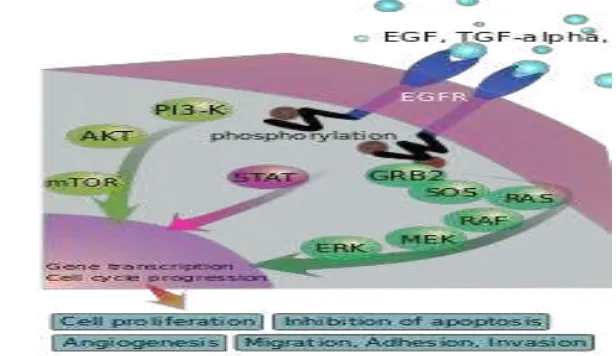
Menurut Bazley (2005), dalam kondisi normal, sebenarnya EGFR dibutuhkan oleh tubuh untuk mengatur siklus sel. Ikatan antara EGFR dengan ligan akan mengaktifkan berbagai jalur transduksi sinyal yang berperan dalam regulasi siklus sel sehingga akan terjadi proses diferensiasi, apoptosis, proliferasi, dan angiogenesis. Sebagai glikoprotein transmembran, domain ekstraseluler dari
reseptor EGFR akan berikatan dengan ligannya yaitu TGFα (transforming growth factor alpha) dan EGF (epidermal growth factor). Begitu terjadi ikatan, EGFR di intrasel yaitu tirosin kinase menjadi aktif sehingga akan merangsang mekanisme sel yang mengatur pertumbuhan sel. Dalam keadaan normal, ikatan ini akan merangsang aktifasi enzim tirosin kinase (TK) di EGFR, dan kemudian mengaktifasi sejumlah molekul dalam sel, sehingga akan mengendalikan pertumbuhan sel.
Gambar 1 Mekanisme transduksi sinyal oleh EGFR (West et al. 2008).
Apabila mengalami gangguan fungsi, EGFR dapat menyebabkan terjadinya tumor atau kanker. Gangguan fungsi EGFR dapat disebabkan oleh beberapa kondisi, seperti mutasi, amplifikasi, dan ekspresi EGFR yang berlebihan (overekspresi) (West et al. 2008). Ikatan antara ligan dengan EGFR yang mengalami gangguan fungsi akan mengaktifkan tiga jalur utama yang berperan dalam pertumbuhan sel kanker. Jalur yang pertama adalah jalur phosphatidyl inositol-3 kinase (PI3K). Aktivasi jalur PI3K akan menyebabkan terjadinya angiogenesis, tumorgenesis, dan hambatan apoptosis. Jalur yang kedua adalah
jalur PLCα yang berperan dalam transformasi dan diferensiasi sel. Jalur yang ketiga adalah jalur RAS yang akan memediasi motilitas sel dan menyebabkan progresi siklus sel secara berlebihan (Burgess et al. 2008).
4 menunjukkan bahwa EGFR mempunyai peran yang sangat penting dalam pertumbuhan sel kanker (Harari 2004).
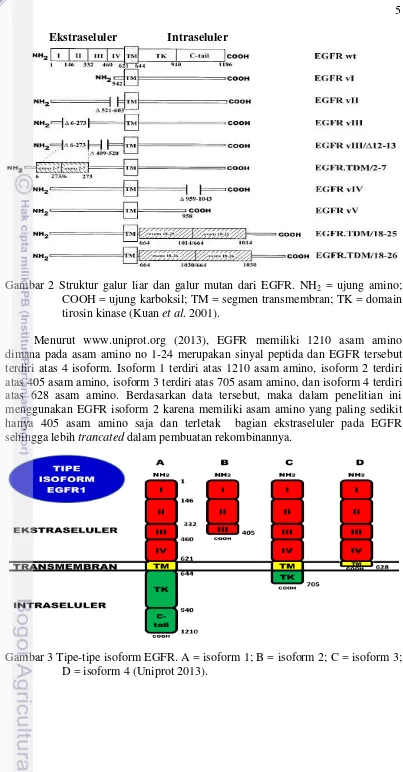
Terjadinya mutasi EGFR ini akibat dari penyusunan ulang gen yang mengalami delesi internal. Kebanyakan delesi terjadi pada ekson spesifik yang mengkodean bagian dari domain ekstraseluler dari molekul EGFR. Peningkatan perkembangan tumor salah satunya diakibatkan oleh aktivasi reseptor yang konstitutif (ligan independen), downregulasi dari reseptor yang terganggu, aktivasi dari sinyal kaskade alternatif, penghilangan mekanisme apoptosis, dan mekanisme lainnya. Mutan kelas IV dan V mengalami mutasi pada bagian intraseluler. Pada EGFRvI dan II sama dengan EGFRvIII, yaitu mengalami delesi pada daerah ekstraseluler (Kuan et al. 2001).
Varian mutan EGFR tidak hanya terjadi akibat adanya delesi ekson EGFR, tetapi juga adanya duplikasi tandem pada daerah ekstraseluler maupun intraseluler dari gen EGFR. Pada EGFR. TDM/18-25 dan EGFR. TDM/18-26 mengalami tandem duplikasi pada daerah intraseluler yang menyandikan domain tiroksin kinase dan sebagian dari domain internalisasi molekul kalsium. Pada EGFR. TDM/18-25 mengandung duplikasi tandem dari ekson 18 sampai 25, sedangakan EGFR. TDM/18-26 mengandung duplikasi tandem dari ekson 18 sampai 26. Pada EGFR. TDM/2-7 adalah mutan EGFR yang mengalami duplikasi tandem ekson 2 sampai 7 di daerah ekstraseluler (Kuan et al. 2001).
5 Ekstraseluler Intraseluler
Gambar 2 Struktur galur liar dan galur mutan dari EGFR. NH2 = ujung amino;
COOH = ujung karboksil; TM = segmen transmembran; TK = domain tirosin kinase (Kuan et al. 2001).
Menurut www.uniprot.org (2013), EGFR memiliki 1210 asam amino dimana pada asam amino no 1-24 merupakan sinyal peptida dan EGFR tersebut terdiri atas 4 isoform. Isoform 1 terdiri atas 1210 asam amino, isoform 2 terdiri atas 405 asam amino, isoform 3 terdiri atas 705 asam amino, dan isoform 4 terdiri atas 628 asam amino. Berdasarkan data tersebut, maka dalam penelitian ini menggunakan EGFR isoform 2 karena memiliki asam amino yang paling sedikit hanya 405 asam amino saja dan terletak bagian ekstraseluler pada EGFR sehingga lebih trancated dalam pembuatan rekombinannya.
6
Ekspresi Gen pada Escherichia coli
Secara umum dikenal dua sistem regulasi ekpresi gen, yaitu regulasi positif dan negatif. Regulasi ekspresi gen melibatkan suatu operon lac. Operon lac adalah operon yang dibutuhkan dalam transpor dan metabolisme dari lactosa di E. coli. Operon ini diregulasi oleh berbagai faktor seperti adanya glukosa dan laktosa. Gen struktural pada operon lac tersebut baru akan aktif bila ada induksi dari laktosa. Sistem regulasinya terjadi pada tahapan transkripsinya karena energi yang diperlukan akan menjadi lebih sedikit dan efisien. Bila tidak ada laktosa, gen lacI akan menghasilkan protein reseptor yang mengikat operator lac dan mencegah terjadinya transkripsi karena enzim RNA polimerase tidak lagi dapat melekat di situs tersebut. Akan tetapi, saat laktosa ditambahkan ke dalam mediumnya, reseptor lacI akan terlepas karena terikat pada alolaktosa lalu transkripsi ketiga gen struktural akan berjalan (Kimball 2006).
Salah satu pendekatan untuk mengendalikan ekspresi adalah dengan menggunakan vektor ekspresi yang mengandung T7 lac promoter (Studier et al. 1990). Vektor ekspresi pJ404 menggunakan promotor T5 yang memiliki sistem regulasi protein yang sama dengan promotor T7. Plasmid ini semakin optimal dengan adanya elemen operator yang mengandung operator lacI yang mampu menjaga regulasi repressor lac. Vektor ini memiliki gen resistensi terhadap ampisilin. Ekspresi protein dapat dilakukan dengan cara diinduksi melalui penambahan isopropyl-thio-D-galactoside (IPTG) ke dalam medium (DNA2.0).
Ekspresi Protein di Periplasma dan Sitosol Escherichia coli
Ekspresi protein di sitosol E. coli memiliki beberapa keunggulan seperti banyak vektor yang bisa mengekspresikan protein dengan baik di dalam sitosol. Protein yang dihasilkan jumlahnya lebih banyak dibandingkan di periplasma. Selain itu juga tidak perlu ditambahkan sinyal peptida di ujung-N, sehingga proses isolasinya lebih mudah tidak memerlukan perlakuan khusus (Choi and Lee 2004). Namun, dibalik banyaknya kemudahan dan kelebihannya ternyata sistem ekspresi di sitosol memiliki kelemahan seperti degradasi protein produk secara cepat dan seringkali protein rekombinan terakumulasi dalam sel inang dalam bentuk agregat kompak, bersifat inaktif tidak larut, yang disebut badan inklusi (inclusion bodies). Hal ini terjadi akibat keterbatasan E. coli membentuk struktur tiga dimensi protein secara benar dalam proses pelipatan pasca translasi (Glick & Pasternak 2003).
Ekspresi protein dipilih di periplasma E. coli dibandingkan di sitoplasma, diantaranya karena memiliki hasil protein yang soluble (terlarut dengan baik) dan tidak membentuk agregat, memiliki residu asam amino di ujung-N identik dengan produk gen alami, aktivitas protease di periplasma jauh lebih rendah daripada di sitosol, purifikasi protein lebih sederhana karena lebih sedikit protein kontaminan di periplasma dan meningkatkan pembentukan ikatan disulfida atau folding protein karena lingkungan periplasma lebih oksidatif daripada di sitosol (Choi & Lee 2004, Yoon et al 2010).
7 sesuai antara translasi dan translokasi untuk menghasilkan tingkat ekspresi tinggi yang optimal (Puertas & Betton 2009). Hal ini dapat dilakukan dengan menggunakan sinyal peptida pada ujung N- terminal untuk memodulasi proses ekspor protein tersebut ke periplasma E. coli. Selain itu juga hanya vektor tertentu saja yang bisa mengekspresikan protein di periplasma. Hasilnya pun lebih sedikit dibandingkan dengan di sitosol karena periplasma memiliki volume yang jauh lebih kecil dibandingkan dengan sitosol.
Salah satu cara agar diperoleh protein yang bersifat aktif dan dalam bentuk terlarut adalah dengan mengekspresikan protein rekombinan pada ruang periplasma. Untuk mengekspresikan protein pada periplasma diperlukan suatu sinyal peptida pada protein rekombinan yang diekspresikan (Peterson et al. 2006).
Penambahan sinyal peptida merupakan salah satu cara untuk mengekspresikan protein rekombinan dengan baik pada ruang periplasma E. coli. Sinyal peptida yang digunakan pada penelitian ini adalah sinyal peptida dari gen xylanase yang berasal dari Bacillus sp. yang merupakan bakteri gram positif (Choi & Lee 2004). Sinyal peptida ini telah dilaporkan dapat melakukan translokasi beberapa jenis protein rekombinan ke dalam periplasma E. coli BL21(DE3) dengan baik, termasuk human leptin (Jeong & Lee 2000), alkaline phosphatase (Choi et al. 2000), human granulocyte colony simulating factor (Jeong & Lee 2001; Yim et al. 2001).
Plasmid pJexpress
Vektor DNA adalah molekul DNA yang dipergunakan untuk membawa dan memperbanyak potongan DNA yang dibawanya. Vektor harus mampu mengadakan replikasi dalam sel inang sehingga banyak salinan molekul DNA yang dihasilkan. Vektor yang sering digunakan adalah plasmid bakteri. Plasmid adalah bahan genetik ekstra kromosom yang diwariskan secara tetap. Ciri-ciri plasmid antara lain berukuran kecil dan hanya mengandung beberapa gen, pembawa informasi genetika, terlepas dari DNA kromosom atau kadang-kadang dapat terintegrasi dengan DNA kromosom dan dapat diisolasi dengan mudah dari sel bakteri (Jusuf 2009).
8
Gambar 4 Plasmid pJexpress (DNA2.0).
Blue Flourescent Protein (BFP)
Protein fluoresen (FP) telah menjadi alat yang sangat populer untuk menggambarkan bagian in vivo dari sel terutama mempelajari lokalisasi, pergerakan, dan interaksi protein di dalam sel hidup. Protein fluoresen banyak digunakan dalam studi ekspresi protein pada berbagai organisme termasuk mamalia, tidak memberikan efek beracun dan tidak membentuk agregat sama sekali (Kremers et al. 2007).
Blue fluorescent protein (BFP) merupakan protein yang dapat berperan sebagai penanda dalam berbagai proses biologis seperti ekspresi protein atau untuk menentukan lokasi protein target di dalam sel atau organisme. Protein BFP yang digunakan adalah mTurqoise yang merupakan varian mutasi dari GFP yang berasal dari Aequorea victoria. Protein ini berukuran sekitar 29 kDa (259 asam amino), memiliki panjang gelombang emisi 434 nm dan eksitasi 474 nm (Kremers et al. 2007).
3
METODE
Waktu dan Tempat
Penelitian ini dilakukan pada bulan April 2013 sampai dengan Desember 2014 di Laboratorium Protein, Vaksin dan Sistem Pengantaran Terarah, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Bogor.
Bahan
9 digunakan sebagai vektor ekspresi. Gen bfp yang digunakan berasal dari plasmid pJ434-bfp (DNA2.0). E.coli DH5 digunakan sebagai inang untuk subkloning gen dan E. coli BL21(DE3) digunakan sebagai inang untuk ekspresi protein rekombinan.
Metode Penelitian
Isolasi plasmid dan gen
Plasmid pJ404-EGFRvIII diisolasi dengan teknik miniprep dan lisis alkali, serta dianalisis dengan teknik elektroforesis gel agarosa (Ausubel 2002). Gen bfp diamplifikasi dan diisolasi dengan teknik PCR menggunakan satu pasang primer spesifik, yaitu BFP_Bam_F : 5 ‘GCT GGA TCC ATG GTG AGC AAG GGC
GAA 3’ dan BFP_Bam_R : 5 ‘GTG GGA TCC CTT ATA CAG TTC GTC CAT
ACC CAG 3’, menggunakan plasmid pJ434-bfp sebagai cetakan.
Subkloning gen bfp ke dalam vektor ekspresi
Gen bfp dan plasmid pJ404-EGFRvIII dipotong dengan enzim restriksi BamHI dan dipurifikasi menggunakan Gel DNA Extraction Kit (GeneAid). Selanjutnya gen bfp disubklon ke dalam plasmid pJ404-EGFRvIII pada situs BamHI menggunakan teknik umum ligasi dan ditransformasi ke dalam E. coli DH5 (Ausubel 2002). Transformasi pada E. coli dilakukan dengan metode kejut panas (Ausubel 2002), E. coli transforman diseleksi menggunakan medium seleksi Luria Bertani (LB) agar mengandung ampisilin (50 ug/ml). Analisis PCR-koloni dilakukan terhadap E. coli transforman yang diperoleh menggunakan primer spesifik, BFP_Bam_F dan BFP_Bam_R. Selanjutnya, dilakukan analisis arah orientasi dengan menggunakan primer pJ404_T5up_F dan BFP_Bam_R. Selanjutnya, plasmid rekombinan yang diperoleh dianalisis potong dengan enzim restriksi BamHI dan analisis sekuen DNA menggunakan primer pJ404_T5up_F :
5 ‘GCG GAT AAC AAT TAC GAG CTT CAT GCA CAG TG 3’ dan pJ404_Txn_R : 5 ‘TTT GCC TGG CGG CAG TAG CGC 3’. Plasmid
rekombinan dengan sekuen DNA yang benar selanjutnya ditransformasi ke dalam E. coli BL21(DE3) dengan metode kejut panas (heat shock) (Chemgroups protocol 2010).
Ekspresi protein rekombinan pada E. coli BL21(DE3)
Biakan E.coli BL21(DE3) rekombinan disiapkan dengan cara menumbuhkan satu koloni E. coli pada 1 ml media LB yang mengandung ampisilin [50 µg/ml]. Biakan diinkubasi dalam inkubator bergoyang pada 250 rpm, suhu 37oC selama 18 jam. Selanjutnya biakan sel tersebut dimasukkan ke dalam 25 ml medium LB baru yang mengandung ampisilin [50 µg/ml] dan diinkubasi pada suhu 20oC dan 250 rpm selama 2-3 jam hingga konsentrasi sel (OD600)
10
bawah mikroskop fluoresens Leica DM1000 dengan pembesaran 100 x dengan filter biru (filter D).
Ekstraksi protein rekombinan dari ruang periplasma
Biomasa dipisahkan dari cairan biakan E. coli BL21(DE3) rekombinan melalui sentrifugasi, biomasa sel diresuspensi dengan 80 ml larutan dapar (30mM tris-Cl dan 20 % sukrosa, pH = 8,0) per liter biakan. Suspensi sel selanjutnya disimpan di atas es selama 15 menit, kemudian ditambahkan 1mM EDTA dan disimpan kembali diatas es selama 15 menit. Suspensi sel selanjutnya diagitasi pada 6000 rpm selama 20 menit. Biomassa sel kemudian ditambahkan 5 mM MgSO4, selanjutnya diagitasi selama 20 menit dengan kecepatan 8000 rpm.
Cairan supernatan mengandung protein rekombinan yang berasal dari periplasma dipisahkan dari biomasa sel untuk analisis lebih lanjut (Novagen 2001).
Ekstraksi protein rekombinan dari sitosol.
Setelah dipisahkan melalui sentrifugasi, biomasa sel hasil ekstraksi di periplasma kemudian dicuci dengan larutan dapar TBS pH = 7,4. Biomasa sel (pellet) diresuspensi dengan 4 ml larutan dapar lisis (100mM Tris-HCl pH 8,8, 3mM EDTA, 1mM PMSF) untuk setiap 1 gram berat basah sel. Lisis sel dilakukan dengan metode freeze-thawing yaitu dengan membekukan sel yang telah diresuspensi dengan larutan dapar lisis dengan cara dimasukkan ke dalam freezer selama 15 menit, kemudian dibiarkan mencair pada suhu ruang selama (± 10 menit). Proses ini diulang sebanyak 10 kali. Selanjutnya suspensi sel disentrifugasi pada 12.000 rpm pada suhu 4oC selama 5 menit dan bagian supernatan yang mengandung protein rekombinan dipisahkan dari pellet sel. Selanjutnya dilakukan analisis protein, baik yang diekstraksi dari ruang periplasma maupun dari sitosol, dengan metode SDS-PAGE.
Purifikasi protein dengan kromatografi afinitas
11
Analisis SDS PAGE dan Hibridisasi Western Blot
Protein rekombinan hasil lisis sel dianalisis menggunakan SDS-PAGE (konsentrasi poliakrilamid 15%) dan hibridisasi. Prosedur SDS-PAGE dilakukan sesuai metode dari Ausubel et al (2002) dengan pewarnaan coomassie blue. SDS-PAGE dimulai dengan pembuatan gel poliakrilamid 15% yang terdiri dari stacking gel dan separating gel (Lampiran 5).
Western blot dilakukan dengan mempersiapkan membran nitroselulosa, kertas Whatman dan sponge yang direndam terlebih dahulu dalam buffer elektrotransfer beserta gel hasil SDS-PAGE tanpa pewarnaan. Pada bagian blotter diletakkan sponge dan kertas Whatman yang sudah direndam dalam transfer buffer. Gel hasil elektroforesis diletakkan di bawah membran nitroselulosa dan dihindari adanya rongga udara. Pada bagian atasnya, diberi kertas Whatman dan sponge yang sudah direndam dalam elektrotransfer buffer. Setelah itu, blotter ditutup kuat-kuat dan dilakukan running pada tegangan 90 Volt, 40 mA selama dua jam.
Tahapan hibridisasi diawali dengan membran nitroselulosa direndam dan di agitasi dengan larutan blocking (0,5% susu bebas lemak di dalam bufer TBS) selama 1 jam. Membran lalu dicuci dengan larutan washing (bufer TBST) sebanyak 3 kali masing-masing selama 15, 5, dan 5 menit. Membran kemudian direndam dan di agitasi dengan antibodi primer OctA-probe (H5) (Santa Cruz, USA) yang dicampur dengan larutan blocking dengan perbandingan 1:2000 selama semalam lalu dicuci seperti langkah sebelumnya. Kemudian, membran direndam dan di agitasi kembali dengan antibodi sekunder goat anti-mouse IgG-AP 1:3500 selama 2 jam. Membran kemudian dicuci lagi sesuai dengan langkah sebelumnya dan ditambahkan developer yaitu Western Blue Stabilized Substrate for Alkaline Phosphatase (Promega, USA).
Analisis Interaksi Antibodi Anti-EGFRvIII dengan Antigen EGFRvIII
Interaksi antibodi-antigen dilakukan dengan menggunakan Pure Proteome TM Nickel Magnetic Beads (Milipore, US). Manik magnet ini diperlakukan terlebih dahulu untuk mengikat protein EGFRvIII rekombinan (antigen) yang mengandung fusi dengan protein BFP (Blue Fluorecens Protein) dan His Tag. Sebelum digunakan untuk mengikat protein antigen tersebut, manik magnet dibersihkan terlebih dahulu. Sebanyak 25 L suspensi manik magnet dimasukkan ke dalam tabung mikro 1,5 mL. Tabung diletakkan pada magnetic stand agar menghilangkan larutan antigen, tabung diletakkan kembali pada magnetic stand dan larutan di pipet. Manik magnet yang telah berikatan dengan protein antigen EGFRvIII kemudian dibersihkan sebanyak dua kali dengan binding buffer dengan cara yang sama seperti di atas. Selanjutnya, manik magnet disuspensi dengan 150
12
filter D ( eksitasi = 355-425 nm, emisi 470 nm). Setelah protein antigen EGFRvIII terikat pada manik magnet, 20 L manik magnet dicampurkan dengan 20 L sel Pichia pastoris transforman (yang mengandung antibodi scFv) dan diinkubasi dengan agitasi rendah selama 1 jam pada suhu ruang. Sel P. pastoris transforman yang digunakan dalam proses ini merupakan sel yang telah diinduksi dengan metanol dan telah dibersihkan dengan bufer A dan PMSF sebanyak tiga kali. Untuk memisahkan cairan dan suspensi sel yang tidak terikat dari manik magnet, tabung diletakkan pada magnetic stand dan suspensi sel dipipet keluar. Selanjutnya, manik magnet diresuspensi dengan 100 L binding buffer dan inkubasi selama 1 menit di suhu ruang. Proses ini untuk membersihkan manik magnet dari sel yang tidak terikat dan dilakukan sebanyak tiga kali. Manik magnet di suspensi dengan 20 L binding buffer dan diamati di bawah mikroskop fluoresen Leica DM1000 dengan filter N2.1 dan filter D.
4
HASIL DAN PEMBAHASAN
Konstruksi Vektor Rekombinan
Potongan gen bfp yang terdapat di dalam plasmid pJ434-bfp diklon ke dalam vektor ekspresi pJ404-EGFRvIII. Potongan gen bfp diperoleh melalui amplifikasi gen bfp pada pJ434-bfp dengan teknik PCR menggunakan satu pasang primer spesifik, yaitu BFP_Bam_F dan BFP_Bam_R. Hasil isolasi gen target yang telah dianalisis elektroforesis gel agarosa menunjukkan bahwa potongan DNA bfp telah berhasil diperoleh (Gambar 5) ditunjukkan adanya pita tunggal berukuran sekitar 750 bp yang sesuai dengan ukuran yang diharapkan. Hal ini berarti bahwa gen target telah siap diklon ke dalam vektor.
Gambar 5 Hasil elektroforesis PCR gen bfp. 1 dan 2 = Gen bfp ; 3 = Marka DNA 1 kb.
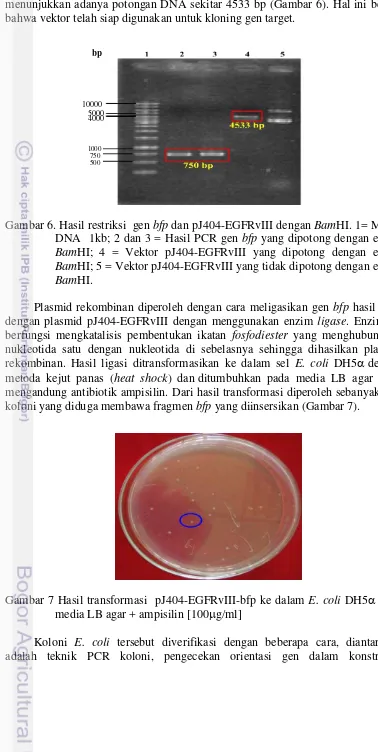
Produk PCR (insert) dan vektor pJ404-EGFRvIII kemudian dipotong dengan enzim restriksi BamHI. Hasil restriksi bfp kemudian diperiksa dengan elektroforesis pada gel agarosa 1% (Gambar 6) menunjukkan adanya pita tunggal berukuran sekitar 750 bp ketika dipotong dengan BamHI. Lebih lanjut, hasil potong terhadap vektor pJ404-EGFRvIII dengan menggunakan BamHI
13 menunjukkan adanya potongan DNA sekitar 4533 bp (Gambar 6). Hal ini berarti bahwa vektor telah siap digunakan untuk kloning gen target.
Gambar 6. Hasil restriksi gen bfp dan pJ404-EGFRvIII dengan BamHI. 1= Marka DNA 1kb; 2 dan 3 = Hasil PCR gen bfp yang dipotong dengan enzim BamHI; 4 = Vektor pJ404-EGFRvIII yang dipotong dengan enzim BamHI; 5 = Vektor pJ404-EGFRvIII yang tidak dipotong dengan enzim BamHI.
Plasmid rekombinan diperoleh dengan cara meligasikan gen bfp hasil PCR dengan plasmid pJ404-EGFRvIII dengan menggunakan enzim ligase. Enzim ini berfungsi mengkatalisis pembentukan ikatan fosfodiester yang menghubungkan nukleotida satu dengan nukleotida di sebelasnya sehingga dihasilkan plasmid rekombinan. Hasil ligasi ditransformasikan ke dalam sel E. coli DH5dengan metoda kejut panas (heat shock) danditumbuhkan pada media LB agar yang mengandung antibiotik ampisilin. Dari hasil transformasi diperoleh sebanyak 103 koloni yang diduga membawa fragmen bfp yang diinsersikan (Gambar 7).
Gambar 7 Hasil transformasi pJ404-EGFRvIII-bfp ke dalam E. coli DH5 pada media LB agar + ampisilin [100g/ml]
Koloni E. coli tersebut diverifikasi dengan beberapa cara, diantaranya adalah teknik PCR koloni, pengecekan orientasi gen dalam konstruksi,
10000 5000
750 4000
1000 500
14
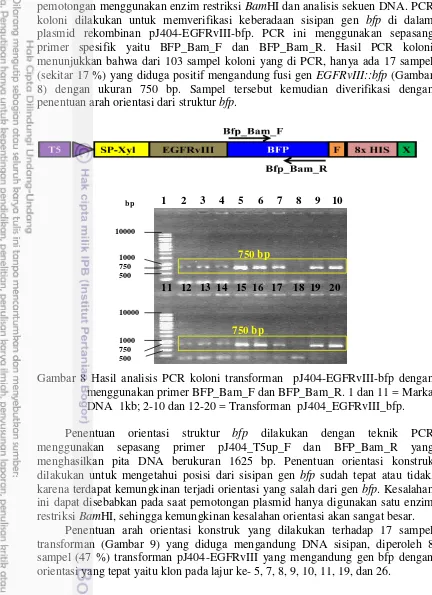
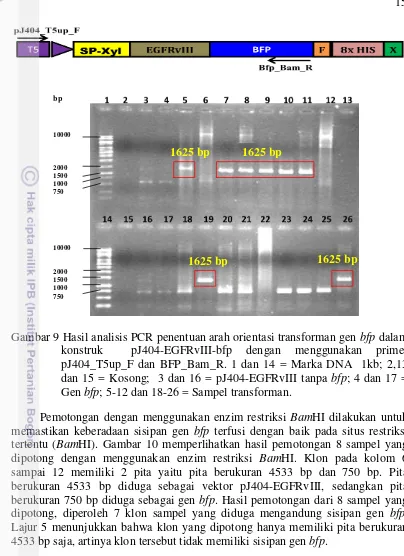
pemotongan menggunakan enzim restriksi BamHI dan analisis sekuen DNA. PCR koloni dilakukan untuk memverifikasi keberadaan sisipan gen bfp di dalam plasmid rekombinan pJ404-EGFRvIII-bfp. PCR ini menggunakan sepasang primer spesifik yaitu BFP_Bam_F dan BFP_Bam_R. Hasil PCR koloni menunjukkan bahwa dari 103 sampel koloni yang di PCR, hanya ada 17 sampel (sekitar 17 %) yang diduga positif mengandung fusi gen EGFRvIII::bfp (Gambar 8) dengan ukuran 750 bp. Sampel tersebut kemudian diverifikasi dengan penentuan arah orientasi dari struktur bfp.
Gambar 8 Hasil analisis PCR koloni transforman pJ404-EGFRvIII-bfp dengan menggunakan primer BFP_Bam_F dan BFP_Bam_R. 1 dan 11 = Marka DNA 1kb; 2-10 dan 12-20 = Transforman pJ404_EGFRvIII_bfp. Penentuan orientasi struktur bfp dilakukan dengan teknik PCR menggunakan sepasang primer pJ404_T5up_F dan BFP_Bam_R yang menghasilkan pita DNA berukuran 1625 bp. Penentuan orientasi konstruk dilakukan untuk mengetahui posisi dari sisipan gen bfp sudah tepat atau tidak, karena terdapat kemungkinan terjadi orientasi yang salah dari gen bfp. Kesalahan ini dapat disebabkan pada saat pemotongan plasmid hanya digunakan satu enzim restriksi BamHI, sehingga kemungkinan kesalahan orientasi akan sangat besar.
15
Gambar 9 Hasil analisis PCR penentuan arah orientasi transforman gen bfp dalam konstruk pJ404-EGFRvIII-bfp dengan menggunakan primer pJ404_T5up_F dan BFP_Bam_R. 1 dan 14 = Marka DNA 1kb; 2,13 dan 15 = Kosong; 3 dan 16 = pJ404-EGFRvIII tanpa bfp; 4 dan 17 = Gen bfp; 5-12 dan 18-26 = Sampel transforman.
Pemotongan dengan menggunakan enzim restriksi BamHI dilakukan untuk memastikan keberadaan sisipan gen bfp terfusi dengan baik pada situs restriksi tertentu (BamHI). Gambar 10 memperlihatkan hasil pemotongan 8 sampel yang dipotong dengan menggunakan enzim restriksi BamHI. Klon pada kolom 6 sampai 12 memiliki 2 pita yaitu pita berukuran 4533 bp dan 750 bp. Pita berukuran 4533 bp diduga sebagai vektor pJ404-EGFRvIII, sedangkan pita berukuran 750 bp diduga sebagai gen bfp. Hasil pemotongan dari 8 sampel yang dipotong, diperoleh 7 klon sampel yang diduga mengandung sisipan gen bfp. Lajur 5 menunjukkan bahwa klon yang dipotong hanya memiliki pita berukuran 4533 bp saja, artinya klon tersebut tidak memiliki sisipan gen bfp.
bp
10000
2000 1500 1000 750
10000
2000 1500 1000 750
1625 bp
1625 bp 1625 bp
16
Gambar 10 Hasil analisis potong transforman PJ404-EGFRvIII-bfp dengan menggunakan enzim restriksi BamHI. 1 = Marka DNA 1 kb; 2 = PJ404-EGFRvIII yang tidak dipotong dengan enzim restriksi BamHI; 3 = pJ404-EGFRvIII dipotong dengan enzim restriksi BamHI; 4 = pJ404-EGFRvIII-bfp yang tidak dipotong dengan enzim restriksi BamHI; 5-12 = pJ404-EGFRvIII-bfp dipotong dengan enzim restriksi BamHI.
Pada analisis sekuensing dipilih 2 klon secara acak dari 7 klon positif, yaitu klon 14 dan 2D9. Analisis sekuensing dilakukan 2 tahap, yang pertama dilakukan dengan membaca urutan DNA dari ujung-N dengan menggunakan primer pJ404_T5up_F dan dari arah ujung-C dengan menggunakan primer pJ404_Txn_R. Hasil analisis sekuensing menunjukkan bahwa klon tersebut memiliki urutan DNA yang sesuai dengan urutan DNA gen sintetik yang dibuat baik dari arah depan (Lampiran 1 dan 2) maupun arah belakang (Lampiran 3), hal ini berarti proses fusi gen bfp pada ujung-C dari EGFRvIII pada plasmid pJ404-EGFRvIII telah berhasil dilakukan. Gambar 11 menunjukkan peta konstruksi fusi gen EGFRvIII::bfp dalam plasmid pJ404. Pada ujung-N, gen EGFRvIII difusi dengan sekuen sinyal peptida xylanase (xylB_sp). Sekuen sinyal peptida ini dimaksudkan untuk mempermudah proses modulasi translokasi protein secara langsung dari sitoplasma ke dalam periplasma E. coli. Pada ujung-C dari gen EGFRvIII difusi dengan sekuen 8xHis-tag dan flag tag. Pemberian tag tersebut dilakukan untuk memfasilitasi purifikasi dan deteksi EGFRvIII pada proses ekspresi protein.
Gambar 11 Peta konstruksi vektor rekombinan pJ404-EGFRvIII-bfp. T5 = promotor T5; xylB_sp = sinyal peptida xylanase; EGFRvIII = gen EGFRvIII; BFP = gen bfp/ blue protein fluorescen; 8xHis = polihistidin tag; F = flag tag; X = stop kodon; NdeI, NguI, XhoI, AgeI, BamHI, SalI, Sphl = enzim restriksi.
4533 bp
750 bp
bp
10000 5000 4000
17
Ekspresi Protein Rekombinan
Escherichia coli dipilih sebagai inang ekspresi umumnya karena bakteri ini paling luas digunakan untuk ekspresi protein rekombinan fungsional dari berbagai organisme (Giacalone et al. 2006). Selain itu, E.coli juga memiliki kelebihan, diantaranya pertumbuhan cepat dan mudah dalam media yang tidak mahal dan variasi vektor ekspresi yang sudah siap tersedia. Pada penelitian ini, Plasmid rekombinan yang telah berhasil dikonstruksi kemudian ditransformasikan ke dalam E.coli BL21(DE3) dengan metode kejut panas untuk ditumbuhkan di dalam media LB agar yang ditambahkan ampisilin [100g/ml] (Gambar 12). Proses seleksi transforman di media seleksi ampisilin bertujuan untuk memperoleh transforman yang memiliki kestabilan genetik. Semua transforman E.coli BL21(DE3) EGFRvIII-bfp mampu tumbuh pada media LB agar yang ditambahkan ampisilin [100g/ml] (Gambar 12).
Gambar 12 Hasil transformasi pJ404-EGFRvIII-bfp ke dalam E.coli BL21(DE3) dengan metode kejut panas yang ditumbuhkan pada media LB agar + ampisilin [100g/ml]. K = Koloni E.coli BL21(DE3) transforman. Transforman E.coli BL21(DE3) selanjutnya ditumbuhkan pada media LB cair + ampisilin [100g/ml] dengan menggunakan suhu 20oC untuk diinduksi dan diekstraksi proteinnya. Pada penelitian ini E. coli BL21(DE3) rekombinan diinduksi dengan ditambahkan IPTG (isopropyl-β-D-thiogalactopyranoside) ke dalam medium bertujuan untuk menginduksi ekspresi gen di bawah kontrol promoter T5 (Yildir et al. 1998). Temperatur rendah dapat memfasilitasi proses pelipatan protein yang benar, sehingga memungkinkan ekspresi dan lokalisasi protein target yang efisien. Selain itu, temperatur rendah dapat memelihara stabilitas plasmid, sehingga meminimalkan kehilangan plasmid dari sel, dan oleh karena itu dapat meningkatkan tingkat ekspresi ( Giacalone et al. 2006).
18
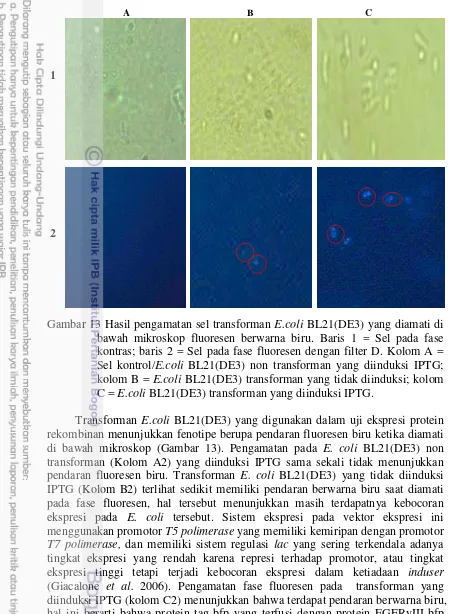
Gambar 13 Hasil pengamatan sel transforman E.coli BL21(DE3) yang diamati di bawah mikroskop fluoresen berwarna biru. Baris 1 = Sel pada fase kontras; baris 2 = Sel pada fase fluoresen dengan filter D. Kolom A = Sel kontrol/E.coli BL21(DE3) non transforman yang diinduksi IPTG; kolom B = E.coli BL21(DE3) transforman yang tidak diinduksi; kolom C = E.coli BL21(DE3) transforman yang diinduksi IPTG.
Transforman E.coli BL21(DE3) yang digunakan dalam uji ekspresi protein rekombinan menunjukkan fenotipe berupa pendaran fluoresen biru ketika diamati di bawah mikroskop (Gambar 13). Pengamatan pada E. coli BL21(DE3) non transforman (Kolom A2) yang diinduksi IPTG sama sekali tidak menunjukkan pendaran fluoresen biru. Transforman E. coli BL21(DE3) yang tidak diinduksi IPTG (Kolom B2) terlihat sedikit memiliki pendaran berwarna biru saat diamati pada fase fluoresen, hal tersebut menunjukkan masih terdapatnya kebocoran ekspresi pada E. coli tersebut. Sistem ekspresi pada vektor ekspresi ini menggunakan promotor T5 polimerase yang memiliki kemiripan dengan promotor T7 polimerase, dan memiliki sistem regulasi lac yang sering terkendala adanya tingkat ekspresi yang rendah karena represi terhadap promotor, atau tingkat ekspresi tinggi tetapi terjadi kebocoran ekspresi dalam ketiadaan induser (Giacalone et al. 2006). Pengamatan fase fluoresen pada transforman yang diinduksi IPTG (kolom C2) menunjukkan bahwa terdapat pendaran berwarna biru, hal ini berarti bahwa protein tag bfp yang terfusi dengan protein EGFRvIII-bfp berhasil diekspresikan oleh E.coli BL21(DE3).
Transforman E.coli BL21(DE3) selanjutnya di ekstraksi proteinnya baik dari bagian periplasma maupun bagian sitoplasma. Ekstraksi protein target dari
1
2
B
19 periplasma E. coli menggunakan cara osmotic shock karena cara ini terbukti dapat membantu merobek membran luar bakteri (Novagen 2001). Sedangkan ekstraksi protein dari sitoplasma menggunakan metode freeze thawing untuk merusak membran dalam bakteri.
Purifikasi protein menggunakan kromatografi kolom afinitas Ni-NTA agarose (Qiagen) dilakukan untuk isolasi dan purifikasi protein rekombinan yang dihasilkan oleh E.coli BL21(DE3). Analisis level ekspresi EGFRvIII-bfp, diidentifikasi menggunakan metode SDS-PAGE dan Western blot. Analisis ini dapat mendukung hasil pengamatan ekspresi fusi protein Tag bfp (Gambar 14). SDS-PAGE dapat memberikan informasi tentang ukuran (bobot molekul) dari protein EGFRvIII-bfp dengan cara membandingkan pita yang dihasilkan dengan ukuran protein standar dalam satuan kilodalton (kDa). Western blot dilakukan untuk mendeteksi protein target yaitu EGFRvIII-bfp. Fusi protein EGFRvIII-bfp memiliki flag-tag, maka antibodi primer yang digunakan adalah mouse anti-flag/ OctA-probe (H5) (Santa Cruz,USA). Antibodi sekunder yang digunakan adalah goat anti-mouse-AP conjugate (Santa Cruz, USA).
Gambar 14 Hasil analisis SDS-PAGE dan Western blot dari EGFRvIII-bfp terpurifikasi yang disekresikan di periplasma E. coli. A = SDS-PAGE; B = Western Blot. 1 dan 20 = Protein periplasma yang belum dipurifikasi (ekstrak protein); 2 dan 19 = Fraksi flow through; 3 dan 18 = Fraksi washing; 4-8 dan 13-17 = Fraksi elusi ; 9 dan 12 = Kontrol untuk western blot (gen GCSF); 10 = Marka protein unstain; 11 = Marka protein prestain.
20
Gambar 15 Hasil analisis SDS-PAGE dan Western Blot dari EGFRvIII-bfp terpurifikasi yang disekresikan di sitoplasma E. coli. A = SDS-PAGE; B = Western Blot. 1 = Marka protein prestain; 2 = kosong; 3-7 = Fraksi elusi; 8 = Fraksi washing, 9 = Fraksi flow through; 10 = Protein sitoplasma yang belum dipurifikasi (ekstrak protein).
Gambar 14 merupakan hasil purifikasi protein periplasmik yang dianalisis dengan SDS-PAGE dan western blot. Gambar 15 merupakan hasil purifikasi protein sitoplasmik yang dianalisis dengan SDS-PAGE dan western blot. Gambar 14 ( Lajur 1 dan 20) dan 15 ( Lajur 10) menunjukkan bahwa pada protein periplasma maupun sitoplasma yang belum dipurifikasi terbentuk beberapa pita protein yang diduga merupakan protein target yaitu fusi EGFRvIII-bfp. Hasil SDS-PAGE yang telah dipurifikasi proteinnya, baik protein periplasmik (Gambar 14A, Lajur 4-8) maupun sitoplasmik (Gambar 15, Lajur 3-7) tidak terlihat jelas pita proteinnya, hal tersebut bisa dikarenakan transfer pita ke gel masih kurang optimal dan ekspresi proteinnya masih rendah. Ketika protein periplasmik (Gambar 14B, lajur 13-17) tersebut dianalisis dengan western blot terlihat bahwa terdapat pita protein yang cukup tebal berukuran 32 kDa yang merupakan pita protein target yaitu EGFRvIII-bfp ( http://web.expasy.org/cgi-in/compute_pi/pi_tool). Hasil tersebut menunjukkan bahwa sistem ekspresi yang digunakan dalam penelitian ini mampu mengekspresikan EGFRvIII-bfp sebagai protein yang terlarut. Hal tersebut diduga bahwa sinyal peptida xylanase mampu menghantarkan protein EGFRvIII-bfp dengan baik menuju periplasma E. coli BL21(DE3) sehingga dapat disekresikan dengan baik. Namun, protein sitoplasmik (Gambar 15 Lajur 3-7) tersebut dianalisis dengan western blot terlihat bahwa selain terdapat pita protein yang cukup tebal berukuran 32 kDa yang merupakan pita protein target, terdapat juga pita yang berukuran 38,5. Pita tersebut diduga sebagai berat molekul dari sinyal peptida xylanase yang masih terbawa saat ekstraksi protein sitosolik. Pita tersebut sesuai dengan berat molekul yang terdapat pada sinyal peptida xylanase (38,5 kDa; http://www.uniprot.org/).
21
Analisis Interaksi Antibodi Anti-EGFRvIII dengan Antigen EGFRvIII
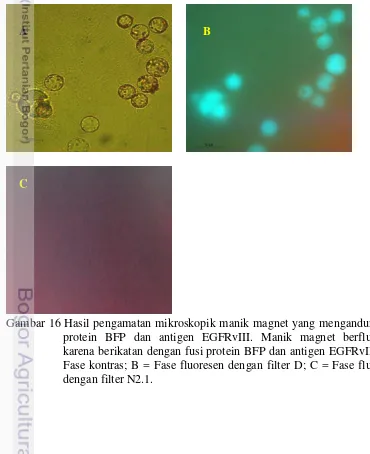
Interaksi antibodi-antigen dapat dilihat dengan bantuan Pure Proteome TM Nickel Magnetic Beads. Manik magnet ini dapat digunakan untuk purifikasi protein yang memiliki His Tag. Protein antigen EGFRvIII yang digunakan telah berfusi dengan protein fluoresen BFP dan terdapat His Tag. Protein EGFRvIII terlebih dahulu diikat dengan manik magnet sehingga terpapar pada permukaan manik magnet agar mempermudah untuk melihat interaksi antibodi-antigen. Pada fase kontras (Gambar 16 A), terlihat bahwa manik magnet bercahaya. Manik magnet yang mengikat protein antigen EGFRvIII terlihat memancarkan pendaran berwarna biru, hal tersebut menunjukkan bahwa manik magnet dapat mengikat protein antigen EGFRvIII-BFP dengan baik (Gambar 16 B). Adanya pendaran cahaya tersebut disebabkan adanya kesesuaian antara panjang gelombang () eksitasi (434 nm) dan emisi (474 nm) fluoresensi BFP dengan eksitasi (355 nm) dan emisi (425 nm) dari filter D. Pada filter N2.1, protein BFP tidak tampak mengeluarkan pendaran cahaya karena filter N2.1 memiliki rentang emisi dan eksitasi yang lebih tinggi dibandingkan dengan BFP, yaitu sekitar eksitasi 515 nm hingga 560 nm dan emisi 590 nm (Gambar 16 C). Akibatnya, manik magnet yang mengikat antigen EGFRvIII-BFP tersebut tidak berpendar ketika dilihat dengan filter N2.1.
Gambar 16 Hasil pengamatan mikroskopik manik magnet yang mengandung fusi protein BFP dan antigen EGFRvIII. Manik magnet berfluoresen karena berikatan dengan fusi protein BFP dan antigen EGFRvIII. A = Fase kontras; B = Fase fluoresen dengan filter D; C = Fase fluoresen dengan filter N2.1.
A B
22
Antigen EGFRvIII yang mengandung fusi BFP dan terikat pada manik magnet diharapkan dapat berinteraksi dengan antibodi anti-EGFRvIII (yaitu scFv) yang terekspresi pada permukaan sel P. pastoris. Untuk membuktikan hal tersebut, P. pastoris transforman yang mengandung fusi gen scFv dengan TagRFP yaitu P. pastoris pJ912-AG-RFP::scFv diinteraksikan dengan antigen EGFRvIII, kemudian diamati di bawah mikroskop fluoresen baik dengan fase kontras maupun fase fluoresen menggunakan dua filter fluoresen berbeda (filter D dan N2.1) (Gambar 17). Antibodi scFv anti-EGFRvIII terdapat pada permukaan sel P. pastoris (S), sedangkan antigen EGFRvIII terikat pada bagian manik magnet (MM). Pada fase kontras (Gambar 17 A) maupun fase fluoresen dengan filter D (Gambar 17 B) terlihat bahwa sel P. pastoris yang mengandung antibodi scFv (S) tampak melekat pada permukaan manik magnet yang telah berikatan dengan antigen EGFRvIII (MM). Selain itu juga, ketika diamati dengan menggunakan filter D (Gambar 17 B) terlihat bagian antigen EGFRvIII maupun antibodi scFv anti-EGFRvIII tersebut berpendar, hal tersebut dikarenakan pada antibodi scFv mengandung fusi TagRFP yang memiliki puncak emisi sebesar 584 nm sehingga emisi fluoresen dari TagRFP dapat tertangkap oleh filter D yang memiliki emisi
470 nm. Hasil tersebut menunjukkan adanya interaksi antara molekul antibodi scFv anti-EGFRvIII pada permukaan sel P. pastoris (S) dengan antigen EGFRvIII pada permukaan manik magnet (MM).
23
Gambar 17 Pengamatan mikroskopik interaksi antibodi-antigen antara protein EGFRvIII pada permukaan manik magnet (fluoresen biru) dengan protein antibodi anti-EGFRvIII pada permukaan sel P. pastoris (fluoresen merah). Sel transforman P. pastoris/pJ912-AG -RFP::scFv tampak berfluoresens biru (cyan) dengan filter D dan merah dengan filter N2.1. A = Fase kontras; B = Fase fluoresen dengan filter D (biru/cyan); C = Fase fluoresen dengan filter N2.1 (merah); MM = manik magnet yang mengikat antigen EGFRvIII-BFP; S = sel transforman P. pastoris/pJ912-AG-RFP::scFv.
5
SIMPULAN DAN SARAN
Simpulan
Gen bfp berhasil dikloning ke dalam vektor ekspresi pJ404-EGFRvIII, sehingga menghasilkan konstruk plasmid pJ404-EGFRvIII-bfp. Protein rekombinan EGFRvIII::BFP berhasil diekspresikan pada E. coli BL21(DE3) yang ditunjukkan dengan adanya fluoresen biru pada sel bakteri tersebut. Hasil analisis SDS-PAGE dan western blot menunjukkan bahwa protein rekombinan berhasil diekpresikan di periplasma E. coli BL21(DE3) dengan memiliki ukuran 32 kDa. EGFRvIII yang telah diekspresikan pada periplasma E. coli BL21(DE3)
A B
C
S
S
S
MM MM
24
menunjukkan adanya afinitas (binding affinity) terhadap antibodi spesifik scFv anti-EGFRvIII yang diekspresikan pada permukaan sel P. pastoris.
Saran
Perlu dilakukan pengukuran konsentrasi protein EGFRvIII rekombinan secara kuantitatif, baik protein pada periplasma maupun sitoplasma untuk mengetahui jumlah protein rekombinan yang dihasilkan. Analisis pengikatan afinitas antara EGFRvIII dengan antibody scFv dapat dilakukan dengan metode lain yang lebih akurat seperti menggunakan metode ELISA.
DAFTAR PUSTAKA
Ausubel FM, Brent R, Kingston RE, Moore DD, Seidman JG, Smith JA, Sruhl K. 2002. Short Protocol in Molecular Biology. 5th Edition. John Wiley & Sons Inc.
Bazley LA, Gullick WJ. The epidermal growth factor receptor family. Endocrine-Related Cancer. 2005;12:S17-S27.
Burgess AW, Garrett TPJ. EGF receptor family extracellular domain structures and functions. In: Halley JD, Gullick WJ, editors.EGFR Signalisng networks in cancer therapy. New York: Humana Press; 2008. p. 3-14. Choi JH, Jeong KJ, Kim SC, Lee SY. 2000. Efficient secretory production of
alkaline phosphatase by high cell density culture of recombinant Escherichia coli using the Bacillus sp. Endoxylanase signal sequence. Appl Microbiol Biotechnol 53: 640-645.
Choi JH, Lee SY. 2004. Secretory and extracellular production of recombinant protein using Escherichia coli. Appl Microbiol Biotechnol 64 (5) : 625-635. DNA 2.0. 2012. Bacterial expression vectors [Internet]. [diunduh 02 Des 2012]
https://www.dna20.com/pJexpress.php.
Gholipour A, Moosavian M, Galehdari H, Makvandi M, Rajabi Memari H, Alvandi A. 2010. Cloning and periplasma expression of peptidoglycan-associated lipoprotein (PAL) protein of Legionella pneumophila in Escherichia coli. Jundishapur J Microbiol. 2010; 3(1): 1-9.
Giacalone MJ, Gentile AM, Lovitt BT, Berkley NL, Gunderson CW, Surber MW. 2006. Toxic protein expression in Escherichia coli using a rhamnose-based tightly regulated and tunable promoter system. BioTec 40 : 355-364. Glick BR, Pasternak JJ. 2003. Molecular Biotechnology Principles and
Applications of Recombinant DNA. Ed Ke-3. Washington: ASM Press. Gupta P, SY Han, M Holgoda-Madruga, SS Mitra, G Li, RT Nitta, AJ Wong.
2010. Development of an EGFRvIII Specific Recombinant Antibodi.BMC Biotechnology 10 :72.
Harari P. Epidermal growth factor receptor inhibition strategies in oncology. Endocrine-Related Cancer. 2004;11:689-708.
25 Kimball J. 2006. The Operon. [terhubung berkala]. http://users.rcn.com/jkimball.ma.ultranet/BiologyPages/L/LacOperon.htm. [20 Februari 2013].
Jeong KJ, Lee SY. 2001. Secretory production of human granulocyte colony-stimulating factor in Escherichia coli. Protein ExprPurif 23(2): 311-8. Kremers GJ, Goedhart J, van den Heuvel DJ, Gerritsen HC, Gadella TWJ. (2007).
Improved green and blue fluorescent proteins for expression in bacteria and mammalian cells. Biochemistry 46: 3775-3783.
Kuan CT, CJ. Wikstrand, DD. Bigner. 2001. EGF mutan receptor vIII as a molecular target in cancer therapy. Endocrine- Related Cancer 8 : 83-96. Novagen. 2001. Protein Purification Affinity Binding with Ni-NTA His-Bind
Resins. United States.
Pedersen MW, Meltorn M, Damstrup L, Poulsen H. 2001. The type III epidermal growth factor mutation. Annals of Oncology 12 : 745-760.
Peterson E, SM. Owens, RL. Henry. 2006. Monoclonal Antibodi Form and Function : Manufacturing the right Antibodies for Treating Drug Abuse. The AAPS Journal 2006: 8(2) Article 43.
Studier FW, Rosenberg AH, Dunn JJ, Duberdorff JW. 1990. Meth Enzymol. 185: 60-89.
Uniprot, 2013. P00533-2, Isoform 2 of epidermal growth factor receptor, Homo sapiens [Internet]. [diunduh 2013 Maret 11] http://www.uniprot.org/uniprot/P00533.
West CM, Joseph L. Epidermal growth factor receptor-targeted therapy. The British Journal of Radiology. 2008; 81:S36-S44.
Yildir C, ZI. Onsan, B. Kirdar. 1998. Optimization of starting time and period of induction and inducer concentration in production of the restriction enzyme EcoRI from recombinant. Turkish Journal of Chemistry 22 : 221-226.
Yim SC, Jeong KJ, Chang HN, Lee SY. 2001. High level secretory production of human G-CSF by fed-batch culture of recombinant Esherichia coli. Bioproc Biosystems Eng 24 : 249-254.
Yoon SH, Kim SK, Kim JF. 2010. Secretory production of recombinant proteins in Escherichia coli. Recent Patent Biotechnol. 4: 23-29.
26
Lampiran 1 Analisis urutan DNA plasmid pJ404-EGFRvIII-bfp (klon 14) dengan primer T5up_F
T5 promoter
EGFRvIII
bfp EGFRvIII
BamHI bfp
EGFRvIII
XhoI EGFRvIII
SPXyl
27
bfp bfp
bfp
28
Lampiran 2 Analisis urutan DNA plasmid pJ404-EGFRvIII-bfp (klon 2D9) dengan primer T5up_F
T5 promoter
EGFRvIII
EGFRvIII
bfp bfp
BamHI bfp
EGFRvIII
XhoI EGFRvIII
NdeI
29
bfp
bfp
30
Lampiran 3 Analisis urutan DNA plasmid pJ404-EGFRvIII-bfp (klon 2D9) dengan primer Txn_R
stop 8X His Tag Sal Flag Tag
T
BamHI bfp
bfp
bfp
31
bfp
bfp
EGFRvIII
EGFRvIII
BamHI EGFRvIII
bfp
32
Lampiran 4 Komposisi larutan dan media yang digunakan beserta cara pembuatannya
Media dan Larutan Komposisi dan Cara Pembuatan GTE (Glukosa/Tris/EDTA) 8 steril dicampurkan dengan akuades steril hingga volume mencapai 200 mL.
Sebanyak 9 g glukosa dilarutkan dalam 50 mL akuades dan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
Sebanyak 6,05 g Tris-basa dilarutkan dalam 30 mL akuades dan ditambahkan 3 M HCl hingga mencapai pH 8,0. Larutan ditambahkan akuades hingga mencapai volume 52 mL dan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
Sebanyak 3,722 g Na2EDTA.2H2O dilarutkan
dalam 14 mL akuades dan ditambahkan 10 M NaOH hingga mencapai pH 8,0. Larutan ditambahkan akuades hingga mencapai volume 20 mL dan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
Sebanyak 4 mL 10 M NaOH steril dan 20 mL 10% (b/v) SDS steril dilarutkan dalam akuades steril hingga volume mencapai 200 mL. Larutan disimpan pada suhu 4oC.
Sebanyak 8 g NaOH dilarutkan dalam 20 mL akuades dan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
Sebanyak 10 g SDS dilarutkan dalam 100 mL akuades dan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
33 asetat glasial dan 37,29 g Na2EDTA dilarutkan
dalam akuades hingga mencapai volume 1000 mL. Larutan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit. Untuk membuat 0,5 x buffer TAE (running elektroforesis DNA), 10 mL 50 x buffer TAE diencerkan dengan 990 mL akuades steril.
Sebanyak 6 mL gliserol, 0,05 g x xylene
gliserol dilarutkan ke dalam akuades hingga mencapai volume 100 mL. Setelah itu disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit. Larutan disimpan pada suhu 4oC.
Sebanyak 1 g tripton, 0,5 g ekstrak yeast, dan 1 g NaCl dilarutkan ke dalam 100 mL akuades, dan 1,7 g bacto agar. Media disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit. Media disimpan pada suhu 4oC.
34 dengan 5x larutan stok. Larutan disimpan pada suhu 4oC.
Sebanyak 15,5 g Tris base (128 mM), 72 g glisin (959 mM) dan 5 g SDS dilarutkan dalam 1 L akuades.
Coomassie blue dicampur dengan larutan staining Solutions dengan perbandingan 1 : 8.
Sebanyak 40 mL metanol, 7 mL asam asetat dan 53 mL akuades dicampur kemudian dihomogenkan.
Sebanyak 3,03 g Tris base (25mM) dan 14,4 g glisin 192 mM dicampurkan dengan 200 mL metanol. Larutan tersebut kemudian ditambahkan akuades hingga volume 1 L.
Sebanyak 100 mL 1 M Tris-Cl pH 7,5 (100 mM) dicampurkan dengan 100 mL 1,5 M NaCl (150 mM) dan ditambahkan akuades steril hingga 1 L.
Sebanyak 12,114 g Tris-basa dilarutkan dalam 30 mL akuades dan ditambahkan 3 M HCl hingga mencapai pH 8,0. Larutan ditambahkan akuades hingga mencapai volume 100 mL dan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
Sebanyak 9,1 g Tris-basa dilarutkan dalam 30 mL akuades dan ditambahkan 3 M HCl hingga mencapai pH 8,8. Larutan ditambahkan akuades hingga mencapai volume 50 mL dan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
Sebanyak 0,02383 g IPTG dilarutkan dalam 1 mL akuades steril.
35 20 % Sukrosa
1 M NaCl
1 M Tris-Cl pH 7,5
Binding dan washing buffer (untuk reagen purifikasi protein)
Elution buffer (untuk reagen purifikasi protein)
Sebanyak 2 gram sukrosa dilarutkan ke dalam akuades steril.
Sebanyak 2,922 g NaCl dilarutkan dengan 50 mL akuades dan disterilkan dengan menggunakan autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
Sebanyak 12,114 g Tris-basa dilarutkan dalam 30 mL akuades dan ditambahkan 3 M HCl hingga mencapai pH 7,5. Larutan ditambahkan akuades hingga mencapai volume 100 mL dan disterilkan dalam autoklaf pada suhu 121oC, tekanan 1 atm selama 15 menit.
36
Lampiran 5 Komposisi gel poliakrilamid
Bahan Volume (mL)
Gel pemisah (15%) Gel penahan (8%) Akuabides
1,5 M Tris-HCl, pH 8,8 1,5 M Tris-HCl, pH 6,8 10 % SDS
40 % Akrilamid
10 % Amonium persulfat TEMED
2375 937,5
- 50 1625
25 2,5
1380 - 250
37
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 24 Juli 1989 dari pasangan Drs. Raden Tjutju Setia Rahman dan Unay Sunariah, S. Pd. Penulis merupakan anak kedua dari tiga bersaudara dengan kakak Tb. Akhlan WSR dan adik Daeng Anggit AR, serta merupakan istri dari Hadiman Saputra, dan telah dikaruniai putra yaitu Kenshin Alano Muhammad Saputra.