HIDROGEN DAN OKSIGEN DARI AIR
DISERTASI
OLEH
MINTO SUPENO
NIM: 038103003
Program Doktor (S-3) Ilmu Kimia
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
Disertasi
Untuk memperoleh gelar Doktor dalam Ilmu Kimia pada Universitas
Sumatera Utara dengan wibawa Rektor Universitas Sumatera Utara
Profesor Chairuddin P. Lubis, DTM&H., Sp.A(K)
dipertahankan pada tanggal 28 Maret 2007
di Medan, Sumatera Utara
Oleh
MINTO SUPENO
NIM: 038103003
Program Doktor (S-3) Ilmu Kimia
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
Nama : MINTO SUPENO
NIM : 038103003
Program : Doktor (S-3)
Program Studi : Kimia
MENYETUJUI,
Promotor
Prof. Dr. Seri Bima Sembiring, M.Sc.
Co. Promotor, Co. Promotor,
Prof. Basuki Wirjosentono, M.S., Ph.D. Prof. Dr. H. R. Brahmana, M.Sc.
PROGRAM STUDI DOKTOR SEKOLAH PASCASARJANA
ILMU KIMIA
Ketua, Direktur,
PROMOTOR
Prof. Dr. Seri Bima Sembiring, M.Sc.
Guru Besar Tetap Ilmu Kimia Anorganik
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
CO – PROMOTOR
Prof. Basuki Wirjosentono, M.S., Ph.D.
Guru Besar Tetap Ilmu Kimia Polimer
Fakultas Matematika dan Ilmu Pengetahuan Alam
Universitas Sumatera Utara
CO – PROMOTOR
Prof. Dr. Hemat R. Brahmana, M.Sc.
Guru Besar Tetap Ilmu Kimia Organik
Fakultas Matematika dan Ilmu Pengetahuan Alam
Ketua
: Prof. Dr. Seri Bima Sembiring, M.Sc.
Anggota
: Prof. Basuki Wirjosentono, M.S., Ph.D.
Prof. Dr. Hemat R. Brahmana, M.Sc.
Prof. Dr. Tonel Barus
Prof. Dr. Yunazar Manjang
BENTONIT ALAM TERPILAR SEBAGAI MATERIAL
KATALIS/ Co-KATALIS PEMBUATAN GAS
HIDROGEN DAN OKSIGEN DARI AIR
DISERTASI
Saya mengakui bahwa disertasi ini adalah hasil kerja saya sendiri,
kecuali beberapa kutipan dan ringkasan yang masing-masing
disebutkan sumbernya.
Medan, 28 Maret 2007
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa yang telah melimpahkan rahmat-Nya kepada penulis sehingga penulis dapat menyelesaikan penelitian dan penulisan desertasi ini berjudul “BENTONIT ALAM TERPILAR SEBAGAI MATERIAL KATALIS/ Co-KATALIS PEMBUATAN GAS HIDROGEN DAN OKSIGEN DARI AIR”. Pada kesempatan ini penulis juga ingin menyampaikan ucapan terima kasih yang tulus kepada :
1. Bapak Rektor Universitas Sumatera Utara Medan, Prof. Dr. Chairuddin P. Lubis, DTM&H., Sp.A(K), yang telah memberikan bantuan biaya pendidikan selama penulis mengikuti pendidikan di Sekolah Pascasarjana Universitas Sumatera Utara Medan.
2. Ibu Direktur Sekolah Pascasarjana Universitas Sumatera Utara, Prof. Dr. Ir. T. Chairun Nisa B., M.Sc.
3. Bapak Ketua Program Studi Ilmu Kimia Sekolah Pascasarjana Universitas Sumatera Utara, Prof. Dr. H.R. Brahmana, M.Sc.
4. Bapak Pembimbing penulis Prof. Dr. Seribima Sembiring, M.Sc., Prof. Basuki Wirjosentono, M.S., Ph.D., dan Prof. Dr. H.R. Brahmana, M.Sc. yang telah banyak meluangkan waktu untuk memberikan sumbangan pikiran baik maupun saran kepada penulis.
5. Bapak dan Ibu Staf Pengajar di Sekolah Pascasarjana Universitas Sumatera Utara khususnya Program Studi Ilmu Kimia.
6. Rekan-rekan mahasiswa Sekolah Pascasarjana Universitas Sumatera Utara khususnya Program Studi Ilmu Kimia.
Medan, 28 Maret 2007
Penulis,
ABSTRAK
Berdasarkan analisis, maka bentonit Kecamatan Padang Tualang Kabupaten Langkat merupakan jenis Na–bentonit. Bentonit ini dijenuhkan dengan larutan natrium klorida NaCl 1 M selama 1 (satu) hari untuk memperkaya Na–bentonit. Na–bentonit selanjutnya diaktivasi menggunakan asam sulfat (0,5 – 2,0) M selama 24 jam, lalu dikeringkan. Material ini diinterkalasi dan dipilarisasi menggunakan larutan TiCl4 0,82 M dan dikalsinasi pada suhu 350°C
menghasilkan bentonit terpilar TiO2 dan selanjutnya dianalisa menggunakan
XRD, FTIR, Luas Permukaan (BET) dan SEM. Dari data hasil analisa diketahui bahwa aktivasi yang terbaik untuk bentonit terpilar yang baik terjadi pada konsentrasi asam sulfat 1,5 M.
Pengetsaan bentonit terpilar TiO2 dilakukan dengan menggunakan larutan (HNO3/
HF/ CH3COOH/ I2) dan larutan HF/ H2O/ NH4F dengan maksud untuk
ABSTRACT
Bentonite obtanained from Kecamatan Padang Tualang, Kabupaten Langkat was a Na–bentonite. This bentonite was saturated with 1 M NaCl solution for 1 day to enrich the Na–bentonite. Then the Na–bentonite was activated by (0.5 – 2.0) M H2SO4 for 24 hours, then was dried. In the end this material was intercalated and
pillaried with 0.82 M Ti complex solution and calcinated at 350°C to produce TiO2–bentonite and analyzed using XRD, FTIR, Surface area (BET) and SEM.
From the analysis data, it was known that the best activation condition for Na– bentonite was at the H2SO4 at concentration of 1,5 M.
Etching TiO2–bentonite using (HNO3/ HF/ CH3COOH/ I2) and HF/ H2O/ NH4F
solutions was made to increase the hole at the between the layer distances inside the silica, then heated at 400–500°C for 1 hour. The resulting etched TiO2–
bentonite which was heated at 450°C produce the material with a wide surface area 92,01 m2/g and the porous volum 0,044 cm3/g and was scanned with SEM.
The etched pillary TiO2–bentonite was used as a co-catalyst in the
hydrolisis of H2O, and showed that the total hydrogen and oxygen gases produced
was 78.5 % after 4 days, compared was only 60.4 % using non-etched TiO2–
Halaman
UCAPAN TERIMA KASIH vii
ABSTRAK ix
ABSTRACT x
DAFTAR ISI xi
DAFTAR GAMBAR xiv
DAFTAR TABEL xvi
DAFTAR LAMPIRAN xvii
BAB 1 PENDAHULUAN
1.1. Latar Belakang 1
1.2. Permasalahan 4
1.3. Tujuan Penelitian 4
1.4. Manfaat Penelitian 5
BAB 2 TINJAUAN PUSTAKA
2.1. Koloid Anorganik 6
2.1.1. Kaolinit (Tipe 1 : 1) 13
2.1.2. Haloisit (Tipe 1 : 1) 15
2.1.3. Montmorilonit (Tipe 2:1) 16
2.1.4. Ilit (Tipe 2:1) 19
2.1.5. Vermikulit (Tipe 2 : 1 ) 20
2.1.6. Khlorit (Tipe 2 : 2) 22
2.2. Bentonit 23
2.2.1. Proses Terjadinya Bentonit di Alam 23
2.2.2. Komposisi Bentonit 25
2.3. Lempung Terpilar 42 2.3.1. Prinsip Pilarisasi Lempung Terpilar 44 2.3.2. Jenis-jenis Agen Pemilar 46 2.3.3. Interkalasi Agen Pemilar 50 2.3.4. Preparasi Lempung Terpilar 54
2.3.5. Lempung Induk 56
2.3.6. Larutan Pemilar 57
2.3.7. Reaksi Pertukaran Ion 57
2.4. Aplikasi Lempung Terpilar 61
2.5. Proses Etsa terhadap Silikon 62 2.6. Luas Permukaan dan Porositas Padatan 65 2.7. Sifat-sifat Adsorpsi Lempung Terpilar 70
2.8. Titania (TiO2) 73
2.9. Semikonduktor Titania 75
BAB 3 METODOLOGI PENELITIAN
3.1. Alat Penelitian 77
3.2. Bahan Penelitian 77
3.3. Lokasi Penelitian 78
3.4. Metode Penelitian 78
3.4.1. Penyediaan Na–Bentonit 78
3.4.2. Aktivasi Na-Bentonit dengan Asam 79 3.4.3. Interkalasi dan Pilarisasi 80 3.4.4. Pengetsaan Bentonit TiO2 80
3.4.5. Pembuatan Gas Hidrogen dan Oksigen Menggunakan Katalis/ Co-katalis Bentonit TiO2 81
3.4.6. Pengujian Gas Hidrogen 81
4.2.1. Pembuatan Na–Bentonit 95 4.2.2. Interkalasi dan Pilarisasi 96
4.2.3. Pengetsaan Bentonit Terpilar TiO2 96
4.2.4. Bentonit Terpilar TiO2 sebagai Katalis
Pembuatan Gas Hidrogen 97
BAB 5 KESIMPULAN DAN SARAN
5.1. Kesimpulan 99
5.2. Saran-saran 99
DAFTAR REFERENSI 100
Halaman
Gambar 2.1. Struktur Kristal Memperlihatkan Pola Kelompok Atom
akan Berulang-ulang pada Tiga Arah 9
Gambar 2.2. Struktur Tunggal Silika Tetraeder 11
Gambar 2.3. Struktur Kaolinit dari Lembar-lembar Silika
Tetrahedral dan Oktahedral 14
Gambar 2.4. Model Struktur Montmorilonit 17
Gambar 2.5. Skematis Proses Pengolahan Bentonit 31
Gambar 2.6. Sketsa Diagram Struktur Montmorilonit 41
Gambar 2.7. Mekanisme Hidrasi dan Dispersi Ca–Bentonit 42
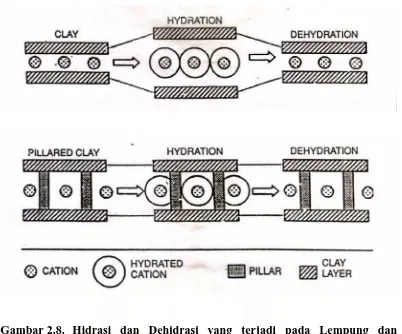
Gambar 2.8. Hidrasi dan Dehidrasi yang Terjadi pada Lempung dan
PILC 45
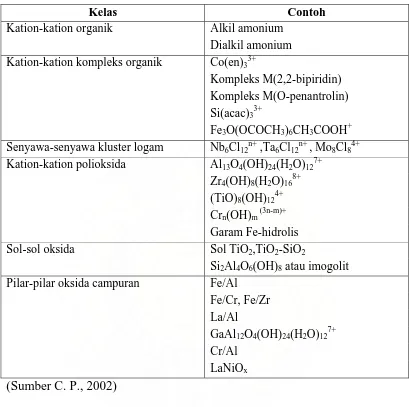
Gambar 2.9. Prinsip Pilarisasi pada Lempung Terpilar 46
Gambar 2.10. Struktur Spesies Polimer 48
Gambar 2.11. Ilustrasi dari Beberapa Hasil Lempung Terpilar dengan
menggunakan Agen Pemilar 50
Gambar 2.12. Prosedur Preparasi Lempung Terpilar 55
Gambar 2.13. Struktur Lempung Terpilar 60
Gambar 2.14. Klasifikasi 5 Tipe Adsosrpsi 69
Gambar 2.15. Struktur Lapisan Terpilar 71
Gambar 2.16. Penggambaran Ideal Sampel yang Diperoleh Melalui
Radiasi dan Sebelum Radiasi 76
Gambar 4.1. Hasil Difraktogram untuk Na–Bentonit 86
Gambar 4.2. Hasil Difraktogram Bentonit Terpilar 88
Gambar 4.3. Spektrum Serapan FT-IR untuk Na–Bentonit 91
Gambar 4.4. Spektrum Serapan FT-IR Bentonit Terpilar–TiO2 91
Gambar 4.5. Foto SEM untuk Na–Bentonit 94
Gambar 4.6. Foto SEM untuk Bentonit Terpilar Tio2 yang Dietsa dan
Dipanaskan 450°C 95
Gambar 4.7. Pilarisasi Bentonit Menggunakan TiO2 dan
Terbentuknya Hole pada Silika Setelah Dietsa 97
Gambar 4.8. Bentonit Terpilar TiO2 sebagai Katalis Pembuatan
Halaman
Tabel 2.1. Beberapa Mineral dari Keenam Tipe Silikat Tanah 7
Tabel 2.2. Mineral-mineral Filosilikat Utama dalam Tanah 8
Tabel 2.3. Hasil Analisis Sampel Bentonit 26
Tabel 2.4. Beberapa Agen Pemilar 47
Tabel 2.5. Evaluasi Luas Permukaan 2 (dua) Zr-PILC Kalsinasi pada
Temperatur Berbeda 52
Tabel 2.6. Pengaruh Kation Asal Lempung terhadap Sifat Tekstur
Lempung Terpilar 53
Tabel 2.7. Beberapa Jenis Bahan Pengetsa untuk Semikonduktor 64
Tabel 4.1. Beberapa Mineral yang Terdapat pada Analisa Difraksi
Sinar-X 87
Tabel 4.2. Hasil Perhitungan Basal Spacing 90
Tabel 4.3. Analisa Gugus dari FTIR 92
Tabel 4.4. Penentuan Luas Permukaan dan Volum Pori Total dengan
Menggunakan Persamaan BET 93
Halaman
Lampiran 1. Hasil FT-IR untuk Bentonit Terpilar TiO2 pada H2SO4
0,5 M 104
Lampiran 2. Hasil FT-IR untuk Bentonit Terpilar TiO2 pada H2SO4
1 M 105
Lampiran 3. Hasil FT-IR untuk Bentonit Terpilar TiO2 pada H2SO4
2 M 106
Lampiran 4. Hasil Diffraksi Sinar-X Bentonit Terpilar TiO2 pada
H2SO4 0,5 M 107
Lampiran 5. Hasil Diffraksi Sinar-X Bentonit Terpilar TiO2 pada
H2SO4 1 M 108
Lampiran 6. Hasil Diffraksi Sinar x Bentonit Terpilar TiO2 pada
H2SO4 2 M 109
Lampiran 7. Hasil Luas Permukaan untuk Alumina sebagai Standar 110 Lampiran 8. Hasil Luas Permukaan untuk Bentonit Terpilar TiO2
pada Asam Sulfat 0,5 M 111
Lampiran 9. Hasil Luas Permukaan untuk Bentonit Terpilar TiO2
pada Asam Sulfat 1 M 112
Lampiran 10. Hasil Luas Permukaan untuk Bentonit Terpilar TiO2
pada Asam Sulfat 1,5 M 113
Lampiran 11. Hasil Luas Permukaan untuk Bentonit Terpilar TiO2
pada Asam Sulfat 2 M 114
Lampiran 12. Hasil Luas Permukaan Bentonit-TiO2 yang Dietsa
(450°C) 115 Lampiran 13. Hasil Luas Permukaan Bentonit-TiO2 yang Dietsa
1.1. Latar Belakang
Di Sumatera Utara terdapat dua jenis bentonit alam yaitu bentonit
wyoming dan non bentonit wyoming, dan keduanya mempunyai komposisi utama
SiO2/ Al2O3 dengan perbandingan (4 – 6 : 1). Bentonit merupakan nama umum
dari jenis tanah liat yang dapat digunakan untuk mengadsorpsi warna, minyak,
lemak dan lilin. Tanah pemucat adalah suatu silikat dari bermacam-macam
komposisi, dengan penyusun utama SiO2 dan Al2O3 yang mengandung air dan
terikat secara kimia. Selain kedua senyawa di atas bentonit juga mengandung
CaO, MgO, Fe2O3, Na2O dan K2O. Berdasarkan teori dari Davis dan Masser
bahwa perbedaan pada perbandingan kadar SiO2 dan Al2O3 akan mempengaruhi
daya aktif. Tanah yang mempunyai perbandingan SiO2 dan Al2O3 yang besar
adalah tanah yang paling baik mengadsorpsi. Sedangkan tanah yang mempunyai
perbandingan SiO2 dan Al2O3 kecil mempunyai kemampuan mengadsorpsi yang
kecil. Perbandingan SiO2 dan Al2O3 untuk bentonit yang baik 5 – 6 : 1 yang
mampu mengadsorpsi, dan mempunyai luas permukaan besar.
Bentonit mempunyai kemampuan daya koloid yang kuat, bila
bercampur dengan air maka dapat mengembang (wyoming). Bentonit dalam
g/mm3 dan titik leleh antara 1330 – 1430°C. Bentonit alam pada umumnya
mengandung sedikit kalsit, karbonat, gipsum dan kwarsa. Permukaan dan
pori-pori bentonit alam dapat diperbesar dengan teknik aktivasi kimia maupun fisik
(Burch, R., 1997), atau dengan pemilaran menggunakan unsur Zr, Ti, Fe, Na, Ca
melalui teknik interkalasi dan kalsinasi pada suhu 450°C menghasilkan bentonit
terpilar yang disebut serbuk fotokatalis ( Vansant, E.R., 1998; Palverejen, M.,
2002).
Serbuk fotokatalis semikonduktor telah banyak dipelajari ditemukan
bahwa aktivitas dari fotokatalis ini semakin baik dengan turunnya ukuran partikel
yang menyebabkan naiknya luas permukaan. Penurunan ukuran partikel antara
5–10 nm menyebabkan perubahan struktur pita energi menjadi semikonduktor
yang dikenal sebagai efek samping kwantum. Penelitian lebih lanjut telah
dilakukan menghasilkan fotokimia dari berbagai macam ukuran dan bentuk,
partikel semikonduktor kolokogenide seperti CdS, ZnS, CdSe, GeSe, ZnSe dan
semikonduktor oksida dari jenis ZnO, Fe2O3, TiO2 telah banyak digunakan untuk
fotokatalis untuk memproduksi hidrogen dari air (Miyoshi, H., 1989).
Prinsip mengubah permukaan dan pori-pori bentonit adalah dengan
melarutkan logam-logam yang terdapat pada pori bentonit dengan suatu asam dan
karena logam sudah larut maka pori-pori menjadi lebih luas. Metode lain untuk
memperluas pori dengan cara pemilaran, dalam hal ini pori-pori bentonit yang
mengandung logam Na dan K diinterkalasi dengan kation logam yang
diameternya lebih besar sehingga pori tersebut mengembang, selanjutnya
Logam-logam akan membentuk oksida-oksida yang berikatan dengan antar lapis,
menghasilkan bentonit terpilar (Palverejen, M., 2002). Melalui teknik ini porositas
bentonit akan menjadi besar, oksida-oksida logam sebagai agen pemilar dapat
digunakan untuk katalis.
Pada penelitian ini dilakukan interkalasi pori-pori bentonit
menggunakan TiO2 dan suhu kalsinasi dari 300 – 500°C untuk menghasilkan
bentonit terpilar– TiO2. Bagian isolatornya yaitu oksida-oksidanya dapat dietsa
untuk menghilangkan oksida-oksida dengan menggunakan campuran HF/ H2O/
NH4F atau HF/ HNO3/ H2O atau dengan menggunakan CF4/ H2 yang
menghasilkan lapisan silikon yang bebas dari oksida dan silikon ini selanjutnya
dietsa dengan larutan HF/ HNO3/ CH3COOH/ I2 sehingga silikon akan terlarut.
Besarnya luas permukaan yang dihasilkan tergantung waktu yang digunakan
untuk mengetsa. Jika waktu yang digunakan terlalu lama SiO2 atau Si larut semua
dan hal demikian tidak diharapkan sehingga waktu yang digunakan untuk
mengetsa perlu dikontrol (Wouter, I., 1999; Sze, S.M., 1997).
Jika teknik pengetsaan ini tercapai maka permukaan dan pori-pori
bentonit terpilar menjadi lebih besar yang diduga menghasilkan makropori
bentonit terpilar. Pemilaran dengan menggunakan TiO2 dan pengetsaan silikat
bentonit ini dapat mengubah sifat fisik dan kimia, meningkatkan basal spasing
(d001), luas permukaan spesifik, volume total, keasaman permukaan dan
Bentonit terpilar TiO2 ini dapat digunakan untuk katalis pada
pembuatan gas hidrogen dan oksigen dari air, maka dalam penelitian ini peneliti
tertarik untuk meneliti penyediaan bentonit terpilar ini sebagai katalis.
1.2. Permasalahan
Bentonit alam mempunyai 60% kandungan silikatnya, untuk
menyediakan material ini sebagai katalis maka perlu meningkatkan luas
permukaan dan volum porinya dengan cara melakukan interkalasi dengan TiO2
dan menjadi bentonit terpilar–TiO2.Oksida logam titania ini merupakan material
yang sensitif terhadap cahaya dan baik menjadi katalis fotokimia. Jika bentonit
terpilar TiO2 dilakukan pengetsaan dengan bahan kimia maka bentonit terpilar
yang teretsa dapat menjadi co-katalis. Sehingga perlu dipelajari pembuatan
katalis yang sensitif terhadap cahaya matahari dari bentonit alam dan apakah
bentonit terpilar TiO2 yang telah dietsa dapat sebagai co-katalis pembuatan gas
hidrogen dan oksigen dari air.
1.3. Tujuan Penelitian
Pemilaran bentonit menggunakan TiO2 menghasilkan bentonit–TiO2
yang akan meningkatkan basal spacing, atau porositas dan luas permukaan.
Dengan menggunakan campuran HF/ CH3COOH/ HNO3 / I2 akan mengetsa
silikat dan menjadi hole (h+) yang ada pada SiO2. Karena material ini telah
menjadi makropori maka dapat menyerap molekul air dan pilar oksida logam
gas hidrogen dari air. Dengan demikian tujuan penelitian ini mempelajari apakah
bentonit terpilar TiO2 yang dibuat dapat digunakan katalis dan co-katalis pada
pembuatan gas hidrogen dan oksigen dari air.
1.4. Manfaat Penelitian
Penelitian ini bermanfaat untuk pengembangan ilmu terutama rekayasa
nanopori serta dapat juga digunakan untuk mempelajari penyediaan katalis dari
2.1. Koloid Anorganik
Fraksi anorganik tanah terdiri dari pecahan batuan dan mineral dengan
komposisi dan ukuran yang berbeda-beda. Selain komposisi beragam, fraksi
anorganik itu di dalam tanah didominasi oleh ikatan-ikatan silikat dan oksida.
Fraksi anorganik kadang-kadang dapat dibedakan menurut mineral primer dan
sekunder. Namun kadang-kadang pembagian ini menimbulkan kesulitan oleh
karena seringkali dalam endapan mineral sekunder dianggap mineral primer,
karena mineral sekunder sering tercampur mineral primer.
Dengan berdasarkan ukuran, maka dikenal tiga fraksi utama anorganik
di dalam tanah:
1. Fraksi kasar (0,05 – 2,00 mm) disebut fraksi pasir
2. Fraksi halus (0,002 – 0,05 mm) disebut debu
3. Fraksi sangat halus < 0,002mm disebut liat (USDA, 1975).
Dalam ilmu tanah biasanya liat dianggap koloid, meskipun ada liat
dalam jumlah yang sedikit yang tidak bermuatan. Atas dasar penyusunan SiO4–
tetrahedral dalam strukturnya, maka dikenal enam tipe silikat tanah yaitu: siklo,
Tabel 2.1. Beberapa Mineral dari Keenam Tipe Silikat Tanah
Silikat tanah Mineral
Siklosilikat Inosilikat Nesosilikat Filosilikat Sorosilikat Tetosilikat Turmalin
Amfibol, Piroksi, Hornblende Garnet, Olifin, Zirkon, Topaz
Kaolinit, Montmorillonit, Ilit, Vermikulit, Klorit Epidot
Felspat, Zeolit
(Tan, 1982)
Fraksi pasir dan sebagian besar debu termasuk ke dalam siklo, ino,
neso, soro atau tektosilikat. Faksi-fraksi ini merupakan “Kerangka” dari tanah.
Oleh karena ukuran mineral termasuk kasar, maka luas permukaannya yang kecil
dan tidak memperlihatkan sifat-sifat koloid. Meskipun tidak aktif dalam
melaksanakan reaksi-reaksi kimia, fraksi ini berpartisipasi sedikit dalam hal
serapan. Kebanyakan mineral-mineral pasir dan debu diketahui penting pula
dalam pembentukan liat. Fraksi liat termasuk tipe filosilikat.
Tanah liat memegang peranan penting dalam kimia tanah, karena sifat
permukaannya yang berbeda dengan butir-butir mineral yang ukurannya lebih
besar. Kebanyakan mineral tanah liat berstruktur kristal, sedangkan fraksi lain
memperlihatkan perkembangan kristal yang sangat lemah (poorly exhibit crystal)
atau tidak mengkristal sama sekali. Beberapa tipe tanah liat dapat pula berbentuk
amorf, misalnya gel silika, alumina, okida besi dan sebagainya. Fraksi tanah liat
yang lain dapat disebutkan poligorskit (mineral berstruktur rantai), misalnya
ataupun amorf. Jika tanah liat itu bersifat amorf, maka bentuknya sukar dikenal.
Dengan metode analisis yang canggih dapat dilihat perbedaan yang jelas antara
tanah liat mengkristal dan amorf.
Tabel 2.2. Mineral-mineral Filosilikat Utama dalam Tanah
Tipe Lapisan Nama Kelompok Mineral
1 : 1
2 : 1
2 : 2
Kaolinit Montmorilonit Mika Ilit Vermikulit Khlorit Kaolinit Haloisit Khrisotil Lizardit Antogorit Montmorilonit Beidelit Saponit Hektorit Saukonit Muskovit Paragonit Biotit Flogopit Ilit Vermikulit Khlorit (Tan,1982)
Dalam ilmu tanah tanah liat dianggap amorf jika mineral
memperlihatkan bentuk yang tidak dibatasi bidang-bidang datar, jika diperiksa
dengan sinar-x, penyusunan atom dalam tanah liat amorf tidak beraturan, sehingga
Berbeda dalam sistem kristal, penyusunan atom biasanya berulang-ulang
beraturan (regular pattern) dengan arah tiga dimensi. Dalam bahan yang bersifat
amorf seperti gelas, ikatan kimia dan komponen-komponen atom acapkali hanya
pengulangan unit-unitnya. Penyusunan atom-atom akan menghasilkan satu unit
bangunan kristal yang disebut sel satuan, bangunan ini memperlihatkan pola
kelompok atom-atom yang posisinya berulang-ulang dalam arah tiga dimensi
dalam ruang menurut sumbu x, y dan z
Gambar 2.1. (A) Struktur kristal memperlihatkan pola kelompok atom yang kedudukan atom akan berulang-ulang pada tiga arah di dalam ruang menurut sumbu x, y, z. (B) Gambar dari satu satuan sel, menunjukkan panjang satuan a, b dan c pada garis terputus-putus yang terletak pada sumbu x, y, dan z dan membentuk kristal kubus (Tan,1982).
Sumbu z kadang-kadang disebut sumbu c, ukuran atau panjang
pinggiran (edges) sel satuan pada tiap arah dinyatakan dengan istilah-istilah a, b
kristal berbentuk kubus, panjang a, b dan c adalah sama dan sudut-sudut α, β dan
γ masing-masing 90°. Dalam tanah liat sudut-sudut ini bervariasi menurut
struktur, dengan menempatkan beberapa sel satuan secara bersama-sama susunan
kristal akan menghasilkan apa yang disebut struktur kisi. Sebuah kristal yang
sempurna dapat terdiri dari beberapa sel satuan, yang masing-masing satuan
selnya mempunyai volum lebih kurang 1 μm3. Kelompok-kelompok atom di
dalam kisi kristal dapat tersusun dalam bidang-bidang pada jarak yang sama di
sepanjang arah kristal. Beberapa tipe bidang atom dapat digambarkan di dalam
kristal dengan jarak antar bidang yang disebut dengan jarak d (d-spacing). Bidang
yang dibatasi oleh a dan b paralel dengan sumbu-sumbu x dan y (Gambar 2.1)
memotong sumbu z dan c, tetapi tidak memotong sumbu x dan y. Menurut sistem
“Indeks” dari Miller (Miller Indices System, Grimshaw, 1971) bidang ini diberi
kode 001, jarak dasar (Basal (001) Spacing) memegang peranan penting dalam
mengidentifikasikan mineral liat dengan analisis difraksi sinar-x. Bidang yang
memotong sumbu a sejajar sumbu b dan c diberi kode 100, sedangkan yang
memotong sumbu a dan c diberi kode 010.
Silikat dibangun menurut silika tetrahedral, dalam hal ini setiap atom
oksigen menerima satu valensi dari atom silikon. Agar kebutuhan divalensinya
tercapai, maka atom-atom oksigen dapat mengadakan ikatan dengan kation
lainnya (Gambar 2.2). Ikatan silika tetrahedral menghasilkan tiga kelompok
penyusunan struktur dari silikat-silikat: rantai, lembar, dan struktur jaringan
(frame work structure). Mineral-mineral silikat tanah liat dicirikan oleh struktur
menggambarkan kerangka tiga dimensi dari ikatan sederhana dari unit-unit
silikon-oksigen. Akan tetapi ia dibangun oleh lapisan mampat (Stacked layer) dari
lembar-lembar silika tetrahedral dan oktahedral. Lembar-lembar ini dibangun oleh
pengikatan tiga atom oksigen di dalam sel tiap tetrahedral dengan satuan silika
tetraheral yang berhadapan, silika tetraeder disusun menurut cincin heksagonal.
Gambar 2.2. Struktur tunggal silika tetraeder (atas), penyusunan beberapa silika tetraeder ke dalam bentuk lembar dengan bekerjasama atom-atom oksigen (Tan, 1982).
Dalam pola silika tetrahedral seperti ini, satu atom oksigen dalam tiap
tetrahedral secara elektris tetap tidak berimbang. Agar tercapai kebutuhan valensi
dua, maka yang terakhir diikatkan pada Al dalam koordinasi oktahedral. Dengan
susunan serupa ini yakni lapisan dan lembar-lembar silika tetrahedral dan Al
oktahedral, maka struktur berlapis dari tanah liat terbentuk. Beberapa lapisan
Namun setiap lapisan merupakan satuan yang bebas dan dianggap sebagai satuan
kristal. Ikatan lapisan-lapisan secara relatif kuat, misalnya kaolinit, atau relatif
lemah seperti montmorilonit. Di dalam tiap lapisan, kelompok atom tertentu akan
berulang-ulang atomnya dalam arah lateral. Kelompok ini atau unit lapisan (Unit
Layer) disebut satuan sel, sementara jumlah lapisan ditambah dengan bahan antar
lapisan disebut struktur unit.
Dengan dasar jumlah lembar-lembar tetraeder dan oktaeder dalam satu
lapis, maka dikenal tipe struktur tanah liat sebagai berikut :
1:1 (Diamorfik)
2:1 (Trimorfik)
2:2 (Tetramorfik)
2:1:1 (Tetramorfik)
Golongan kaolinit termasuk kedalam tipe 1 : 1 karena komposisinya
terdiri atas satu lembar Si–tetraeder dan satu lembar Al–oktaeder, golongan
montmorilonit termasuk kedalam tipe 2 : 1, karena strukturnya terbangun dari dua
lembar Si–tetraeder dan satu lembar Al–oktaeder. Golongan khlorit adalah contoh
dari tipe 2 : 2. Sedangkam paligorskit dan sepiolit termasuk tipe 2 : 1 :1. Setiap
golongan mineral tanah liat dapat dibagi menjadi 2 kelompok yakni: diokdaeder
dan trioktaeder. Jika dua dari tiga posisi oktaeder diduduki oleh Al3+, maka
keadaan ini disebut diokataeder, jika semua posisi oktaeder diduduki Mg 2+, maka
ini disebut trioktaeder.
Sebagai tambahan dari uraian di atas, pelekatan (stacking) dari
dalam pola beraturan ataupun tidak, gejala ini menghasilkan mineral bertingkat
(interstratified group) atau mineral lapisan tercampur. Struktur mineral ini amat
beragam jika dua atau lebih tipe berbeda dari satuan lapisan dapat melekatkan
bersama-sama. Misalnya unit-unit vermikulit dengan khlorit dengan smektit, mika
dengan smektit, dan kaolinit dengan smektit.
2.1.1. Kaolinit (Tipe 1 : 1)
Mineral kaolinit adalah alumino-silikat yang terhidrasi dengan
komposisi kimia umum Al2O3 : SiO2 : H2O = 1:1:2 atau 2SiO2.Al2O3.2H2O per
satuan sel. Seperti telah dinyatakan, golongan ini termasuk tanah liat filosilikat
dengan tipe 1 : 1. Kristalnya terdiri dari lapisan aluminium oktahedral tersusun di
atas lembar silika tetraeder (Gambar 2.3). Lembar-lembar ini memanjang terus
menerus dengan arah a dan b dan satu tersusun di atas lembar lainnya dalam arah
sumbu z atau c. Satuan sel adalah non-simetris, dengan satu lembar silika
tetraeder pada satu sisi dan satu lembar aluminium oktaeder pada sisi lain. Sebagai
akibatnya, bidang dasar (basal – plane) atom-atom oksigen pada satu unit krsital
berseberangan dengan bidang dasar ion-ion OH dari lapisan berikutnya. Gejala
terakhir menghasilkan mineral-mineral memiliki dua tipe permukaan. Kedua
lembar yang membentuk satu satuan lapisan (unit layer) diikat oleh atom oksigen.
Atom oksigen ini satu valensinya berpegangan erat dengan silikon, sedangkan
yang lain memegang Al secara ikatan koordinasi sedangkan satuan-satuan lapisan
ruang antar-misel dengan dimensi tertentu. Basal spacing dari mineral kaolinit
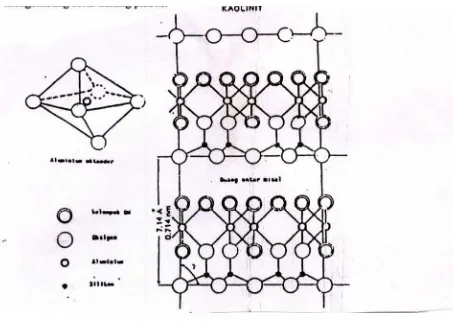
[image:32.595.123.576.177.499.2]adalah 7,14 Å.
Gambar 2.3. Struktur kaolinit terdiri dari lembar-lembar silika tetrahedral dan aluminium oktahedral (Tan, 1982)
Hanya sedikit jika tidak nol berlangsung substitusi isomorf dan muatan
permanen persatuan sel. Namum berhubung dengan terdapatnya gugusan OH
yang tersembul (exposed), maka muatan negatis kaolinit beragam tergantung pH.
Seperti terlihat strukturnya, posisi gugusan OH membuka kesempatan bagi
disosiasi ion H, yang menjadi alasan untuk perkembangan muatan beragam
terutama bidang gugusan OH yang tertentu pada permukaan yang tersembul dari
terdapat, tetapi gugusan ini terletak sebagai bidang bagian permukaan dari Al-okta
yang ditutupi oleh jaringan atom-atom oksigen. Kemungkinan disosiasi H+
melalui jaringan oksigen ini masih belum diketahui. Sebagai akibatnya nilai KTK
kaolinit menjadi kecil dan dapat berubah jika pH berubah, nilai KTK biasanya
antara 1-10 me/ 100 g. Oleh karena kuatnya ikatan struktural, maka partikel
kaolinit tidak mudah pecah. Keadaan ini juga menyebabkan kaolinit bersifat sukar
mengerut dan mengembang serta kurang plastis.
Keterbatasan permukaan aktif menyebabkan daya adsorpsinya rendah.
Luas permukaan spesifik kaolinit kira-kira 7 – 30 m2/g. Ada tidaknya kaolinit
dalam suatu tanah dapat diidentifikasi dengan difraksi sinar-x dengan menetapkan
nilai d (jarak antara bidang atom di dalam kristal). Nilai d untuk kaolinit d001
adalah 7,14 Å. Anggota golongan kaolinit adalah kaolinit, dikit, nakrit dan
haloisit. Kecuali haloisit, mineral lainnya tidak dapat mengebang dalam air. Dari
mineral-mineral disebutkan di atas mineral kaolinit yang distribusinya terluas.
Mineral ini banyak didapati pada tanah ordo ultisol dan oxisol di daerah tropik.
2.1.2. Haloisit (Tipe 1:1)
Mineral ini mempunyai komposisi umum Al2O3.2SiO2.4H2O.
Strukturnya mirip kaolinit, perbedaan dengan kaolinit terletak pada susunan yang
tidak beraturan dari lapisan-lapisan dan terdapatnya dua atau lebih antar lapisan
air (water interlayer). Molekul-molekul air terikat bersama-sama menurut pola
heksagonal, molekul air ini selanjutnya terikat dengan lapisan-lapisan kristal
memiliki nilai α =10,1 Å lebih besar dari kaolinit. Jika haloisit dipanaskan, maka
nilai d turun menjadi 7,2 Å. Mineral yang airnya telah keluar disebut metahaloisit.
Haloisit dilaporkan cepat berubah menjadi metehaloisit jika suhu menjadi 50°C.
Haloisit umumnya berbentuk pipa (tubular) jika dilihat melalui mikroskop
elektron, bentuk ini berbeda dengan kaoilinit yang berbentuk heksagonal. Proses
pembentukan dan kemantapan haloisit di dalam tanah diketahui dipengaruhi oleh
kelembaban tanah. Kondisi tanah lembab diperlukan untuk perkembangan mineral
itu. Terdapat indikasi bahwa haloisit dipercaya sebagai bahan asal dari kaolinit.
Proses pembentukan kaolinit mengikuti urutan (sequence) pelapukan berikut ini:
Montmorilonit Haleisit Metahaloisit Kaolinit
2.1.3. Montmorilonit (Tipe 2 : 1)
Mineral dalam kelompok ini kadang-kadang disebut smektit dan
mempunyai komposisi beragam. Namun rumus umum dinyatakan sebagai
Al2O3.4SiO2.H2O + xH2O. Nama montmorilonit diperuntukkan bagi jenis
aluminosilikat berhidrasi dengan substitusi rendah. Tipe tanah liat ini sering pula
disebut bentonit. Montmorilonit memiliki ion-ion Mg2+ dan Fe3+ di dalam posisi
oktaeder, sementara beidelit yang baik tidak mengdung Mg dan Fe di dalam
lembar oktaeder. Beidelit dicirikan oleh kandungan Al yang tinggi. Muatan
lapisan silika semua berasal dari penggantian Si4+ oleh Al3+.
Dua macam teori struktur dari montmorilonit ialah (1) menurut
Hofmann dan Endell serta (2) menurut Edelman dan Favajee. Kedua teori itu
sehingga berlawanan dengan kaolinit. Satu lembar aluminium oktaeder terselip
atau terjepit di antara dua lembar silika tetraeder.
Ikatan antara lapisan relatif lemah dan mempunyai ruang antar
lapisan yang dapat mengembang jika kandungan air meningkat. Perbedaan antara
struktur Hofmann dan Endell dengan struktur menurut Edelman dan Favajee
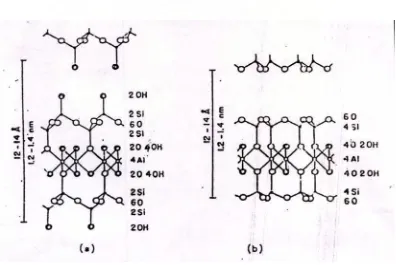
[image:35.595.115.511.356.621.2]adalah dalam penyusunan jaringan silika tetraeder seperti yang dilukiskan pada
Gambar 2.4. Edelmann dan Favajee berpendapat bahwa susunan alternatif dari
silika tetraeder terwujud dengan ikatan Si-O-Si bersudut 180°, dengan bidang
dasar terdiri dari gugusan OH yang diikat oleh silika di dalam tetraeder.
Gambar 2.4. (a) Model Struktur montmorilonit menurut Edelman dan Favajee, dan (b) Model struktur menurut Hofmann dan Endell (Tan, 1982)
Muatan negatif montmorilonit umumnya berasal dari substitusi
lebih rendah dengan syarat jari-jari atom relatif sama. Hanya terdapat sedikit
muatan berubah, karena semua gugusan hidroksil berlokasi dalam bidang
permukaan yang ditutupi oleh jaringan atom-atom oksigen. Van Olphen (1977)
mengemukakan nilai KTK monmorilonit kira-kira 70 me/ 100g, luas permukaan
antara 700–800 m2/g dan oleh karena besarnya nilai ini maka montmorilonit
memperlihatkan sifat plastis dan melekat kuat jika basah. Montmorilonit
umumnya berukuran sangat halus, sedangkan komponen-komponen dalam lapisan
tidak terikat kuat. Jika mengadakan persentuhan dengan air, maka ruang di antara
lapisan mineral mengembang, menyebabkan volume tanah liat dapat berlipat
ganda. Terdapat tanda bahwa jarak dasar (basal spacing) montmorilonit
meningkat secara seragam jika terjadi penyerapan air. Beberapa peneliti mencatat
bahwa meningkatnya jarak dasar dapat berlangsung perlahan-lahan, yaitu pertanda
pembentukan kulit hidrasi di sekeliling kation-kation yang terdapat di antara
lapisan.
Tingginya daya mengembang atau mengerut dari montmorilonit
menjadi alasan kuat, mengapa mineral ini dapat menyerap dan memfiksasi ion-ion
logam dan persenyawaan organik. Jerapan persenyawaan organik menjurus
pembentukan kompleks organo-mineral. Ion-ion organik dipercaya dapat
menggantikan kedudukan kation-kation organik di dalam ruang antar misel.
Jerapan persenyawaan organik sperti gliserol dan etilen glikol merupakan penciri
dalam mengidentifikasi montmorilonit dengan analisa difraksi sinar-x. Jika
ini dicirikan oleh puncak difraksi dari jarak dasar 10 Å, sedangkan nilai untuk
kondisi kering udara adalah 12,4 – 14 Å.
Dari keanekaragaman jenis tanah liat, monmorilonit ditemukan dalam
bentuk tanah kebanyakan montmorilonit termasuk oktaeder, dan banyak
ditemukan pada jenis tanah Vertisol, Mollisol, Affisol maupun Entisol. Tingginya
daya plastis, mengembang dan mengkerut mineral ini menyebabkan tanah
menjadi plastis jika basah dan keras jika kering. Retakan-retakan pada permukaan
tanah akan terlihat jika permukaan tanah mengering.
2.1.4. Ilit (Tipe 2 : 1)
Golongan mineral ini termasuk mineral mika (2 : 1) yang tidak
mengembang, namun berbeda dengan mika sesungguhnya yang termasuk dalam
mineral sekunder. Mineral ini juga dikenal dengan nama mika berair (hydrous
mica) atau mika tanah. Dalam kelompok ini ilit digunakan untuk mineral berbutir
halus sedangkan berbutir kasar dinamakan mika berair. Sejumlah peneiliti
menolak mengklasifikasikan ilit sebagai tanah liat, mereka mengukakan ilit adalah
mika berukuran tanah liat sehingga tidak dapat dimasukkan ke dalam mineral
tanah liat (Theng, 1974). Namum mineralogi tanah liat ilit dimasukkan dalam soil
taxonomy (USDA,1975). Van Olphen (1977) berpendapat, bahwa mika terutama
muskovit adalah prototipe dari ilit, hubungannya yang dekat dengan mika menjadi
alasan namanya disebut sebagai mika berair atau mika tanah.
Mineral ilit hampir mirip komposisinya dengan muskovit, tetapi
berpendapat bahwa suatu seri yang berkelanjutan dari suatu ilit terjadi ketika
berlangsung perubahan mineral muskovit menjadi montmorilonit.
H2KAl3Si3O12 Seri Ilit Al2O3.4 SiO2.H2O + x H2O
Muskovi Montmorilonit
Oleh karena ilit mengandung K dalam ruang di antara lapisan, maka
unit lapisan terikat lebih kuat dibandingkan dengan monmorilonit. Jadi ruang di
antara misel dari ilit dapat mengembang jika ditambahkan air. Nilai jarak dasar
(basal spacing) adalah 10 Å, sedangkan KTK kira-kira 30 me/ 100 g. Plastisitas,
pengerutan dan pengembangan mineral ilit jauh lebih kecil dibandingkan dengan
montmorilonit sehingga sifat mineral ini lebih mirip kaolinit daripada
montmorilonit, kandungan K dalam ilit berkisar antara 5 – 8 %.
Ilit ditemukan pada tanah-tanah mollisol, alfisol, spodosol, aridisol,
inceptisol dan entisol. Pada tanah yang dipengaruhi oleh curah hujan yang tinggi,
mineral ilit cenderung berubah menjadi montmorilonit, sedangkan di bawah
pengaruh iklim sedang atau bersuhu tinggi, strutur ilit dilaporkan dapat berubah
menjadi strutur kaolinit.
2.1.5. Vermikulit (Tipe 2:1)
Nama vermikulit berasal dari “vermiculare” atau “vermicularis” dalam
bahasa latin berarti mirip cacing = wormlike, yang jika dipanaskan mineralnya
dapat memanjang hingga 20–30 kali dari ukuran semula. Kelompok mineral ini
membentuk jonjotan mirip mika sperti ilit. Vermikulit dapat dibagi ke dalam dua
(clay vermiculit). Vermikulit sesungguhnya tidak dianggap sebagai mineral tanah
liat, tetapi sebagai mineral pembentuk batuan (Douglas, 1977). Vermikulit
berukuran tanah liat ditemukan dalam tanah dianggap sebagai “vermikulit liat”
atau vermikulit tanah. Kehadiran dalam fraksi tanah liat untuk pertama kalinya
diperkenalkan pada tahun 1974 di Skodlandia. Pelacakan mineral ini dalam tanah
dilakukan dengan alat Sinar–x dengan puncak difraksi pada 14 Å sehingga
acapkali mineral ini disebut sebagai mineral 14 Å. Tanah liat vermikulit adalah
magnesium–aluminium silikat, dengan Mg menduduki posisi oktaeder di antara
dua lembar silika tetraeder, beberapa atom Fe juga ditemukan. Rumus kimia
secara umum dituliskan sebagai berikut:
22 MgO. 5Al2O3. Fe2O3. 22 SiO2. 40 H2O atau Mg3 Si4O10(OH)2x H2O
Struktur vermikulit amat mirip dengan struktur khlorit, perbedaannya
ialah terdapatnya lapisan yang terdiri dari molekul-molekul air setebal 5 Å di
dalam ruang antar misel. Di dalam lapisan tetraeder terjadi penggantian Si4+ oleh
Al3+, sehingga muatan negatif pada mineral ini adalah tinggi. Vermikulit termasuk
mieneral tanah liat yang tertinggi nilai KTK-nya. Nilai KTK vermikulit kira-kira
150 me/ 100 g dan lebih besar dari montmorilonit. Kebanyakan vermikulit tanah
berstruktur dioktaeder dan diketahui dapat menfiksasi K+, NH4, dan kation
lainnya. Daya menfiksasi ini lebih besar dibandingkan dengan bentonit atau ilit.
Pengenalan tanah liat vermikulit biasanya dilakukan dengan analisa difraksi
sinar-x dan dengan metode Defferential Termal Analysis (DTA). Dengan sinar-sinar-x
700°C, maka nilai d akan turun menjadi 11,8 atau 9,3 Å. Dalam tanah umumnya
sebagian vermikulit berlapis tercampur dengan montmorilonit, khlorit, dan biotit,
jika vermikulit diberi larutan KCl akan dihasilkan mineral dengan struktur mika.
Vermikulit dalam jumlah yang relatif sedikit diketemukan pada
tanah-tanah ultisol, mollisol, dan aridisol. Ionnya lebih mudah terbentuk pada tanah-tanah
berdrainase baik dan berlawanan dengan pembentukan montmorilonit yang
menghendaki lembab.
2.1.6. Khlorit (Tipe 2:2)
Mineral tanah liat ini tersusun dari magnesium dan aluminium silikat
berair yang memiliki hubungan dengan mineral mika. Kebanyakan khlorit
berwarna hijau, struktur khlorit mirip dengan talk atau tanah liat tipe 2:1 yang
memperlihatkan kemiripan dengan vermikulit. Namun kini sejumlah penulis
bersepakat menyebut khlorit sebagai mineral tipe 2:2. Lapisan oktaeder terdiri dari
hidroksida Al dan Mg yang terjepit di antara dua lembar silika tetraeder. Lembar
Mg atau Mg(OH)2 sebelumnya disebut lembar brusit. Dalam ruang antar misel
juga ditempati oleh lembar brusit, sehingga disebut tanah liat tipe 2 :2. Komposisi
mineral beragam, tetapi komposisi umum dilaporkan adalah:
(Mg, Fe, Al)6(Si, Al)4 O10 (OH)8.
Substitusi isomorfik berlangsung di dalam kedua lapisan tetraeder
maupun oktaeder. Kation Si dapat digantikan oleh Al dan Fe dapat menggantikan
Jika pergantian Mg oleh Al dalam lembar brusit, maka menimbulkan
muatan positip. Muatan positip ini akan menetralisir muatan negatif dari lapisan
mika sebagai akibatnya khlorit memiliki muatan yang rendah dan dengan nilai
KTK yang kecil. Khlorit ditemukan dalam jumlah sedikit tercampur dengan jenis
tanah liat lain. Pada tanah afisol, mollisol, dan andosol kebanyakan mineral
khlorit termasuk trioktaeder.
2.2. Bentonit
Bentonit adalah istilah perdagangan untuk sejenis lempung yang
banyak mengandung mineral montmorilonit (sekitar 85 %), yaitu suatu mineral
hasil pelapukan, pengaruh hidrotermal, atau akibat transformasi/ devitrifikasi dari
tufa gelas yang diendapkan di dalam air dalam suasana alkali. Fragmen sisanya
pada umumnya terdiri dari campuran mineral kuarsa/ kristobalit, feldspar, kalsit,
gipsum, kaolinit, plagioklas, illit, dan lain sebagainya (Zulkarnaen, Wardoyo, S.,
Marmer, D.H., 2002).
Lempung merupakan salah satu komponen tanah yang tersusun atas
senyawa alumina silikat dengan ukuran partikel yang lebih kecil dari 2 μm.
Struktur dasarnya merupakan filosilikat atau lapisan silikat yang terdiri dari
lembaran tetrahedral silikon–oksigen dan lembaran oktahedral aluminium–
oksigen–hidroksida (Lestari, S., 2002).
2.2.1. Proses Terjadinya Bentonit di Alam
1. Terjadi karena proses pelapukan batuan
Faktor utama yang menyebabkan pelapukan batuan adalah
komposisi kimiawi mineral batuan induk dan kelarutannya dalam air.
Mineral-mineral utama dalam pembentukan bentonit adalah plagioklas, kalium–
feldspar, biotit, muskovit, serta sedikit kandungan senyawa alumina dan
ferromagnesia. Secara umum faktor yang mempengaruhi pelapukan batuan ini
adalah iklim, jenis batuan, relief, dan tumbuh-tumbuhan yang berada di atas
batuan tersebut.
Pembentukan bentonit sebagai hasil pelapukan batuan dapat juga
disebabkan oleh adanya reaksi antara ion-ion hidrogen yang terdapat di dalam
air dan di dalam tanah dengan persenyawaan silikat yang terdapat di dalam
batuan.
2. Terjadi karena proses hidrotermal di alam
Proses hidrotermal mempengaruhi alterasi yang sangat lemah,
sehingga mineral-mineral yang kaya akan magnesium, seperti hornblende dan
biotit cenderung membentuk mineral klorit. Pada alterasi lemah, kehadiran
unsur-unsur logam alkali dan alkali tanah (kecuali kalium), mineral mika,
ferromagnesia, feldspar, dan plagioklas pada umumnya akan membentuk
montmorilonit, terutama disebabkan karena adanya unsur magnesium.
Larutan hidrotermal merupakan larutan yang bersifat asam yang
mengandung klorida, sulfur, karbon dioksida, dan silika. Larutan alkali ini
selama unsur alkali tanah tetap terbentuk sebagai akibat penguraian batuan
asal. Pada alterasi lemah, adanya unsur alkali tanah akan membentuk bentonit.
3. Terjadi karena proses transformasi dan devitrifikasi mineral-mineral dari
gunung berapi
Proses transformasi (pengubahan) abu vulkanis yang mempunyai
komposisi gelas akan menjadi mineral lempung (mengalami devitrifikasi
secara perlahan-lahan) yang lebih sempurna, terutama pada daerah danau,
lautan, dan cekungan sedimentasi. Transformasi dari gunung berapi yang
sempurna akan terjadi apabila debu gunung berapi diendapkan dalam
cekungan seperti danau dan air. Bentonit yang berasal proses transformasi
pada umumnya bercampur dengan sedimen laut lainnya yang berasal dari
daratan, seperti batu pasir dan danau.
4. Terjadi karena proses pengendapan batuan
Proses pengendapan bentonit secara kimiawi dapat terjadi sebagai
endapan sedimen dalam suasana basa (alkali) dan terbentuk pada cekungan
sedimen yang bersifat basa, di mana unsur pembentuknya antara lain:
karbonat, silika pipih, fosfat laut, dan unsur lainnya yang bersenyawa dengan
unsur aluminium dan magnesium (Proyek Kerja Dinas Pertambangan Daerah
Sumatera Utara, 2001).
2.2.2. Komposisi Bentonit
Berdasarkan hasil analisis terhadap sampel bentonit yang diambil
Tabel 2.3. Hasil Analisis Sampel Bentonit
Komposisi %
Kalsium oksida (CaO) Magnesium oksida (MgO) Aluminium oksida (Al2O3)
Ferri oksida (Fe2O3)
Silika (SiO2)
Kalium oksida (K2O)
Air 0,23 0,98 13,45 2,18 74,9 1,72 4
2.2.3. Sifat-sifat Umum Bentonit
Sifat-sifat umum dari bentonit adalah:
1. Memiliki kilap lilin,
2. Memiliki warna yang cukup bervariasi, mulai dari warna dasar putih, hijau
muda kelabu, merah muda dalam keadaan segar, dan akan berubah warna
menjadi krem apabila telah melapuk, dan lama-kelamaan akan menjadi kuning
dengan sedikit kemerahan, atau kecoklatan, serta hitam keabu-abuan,
tergantung pada jenis dan jumlah fragmen mineralnya,
3. Bersifat sangat lunak, dan plastis, memiliki porositas yang tinggi, ringan,
mudah pecah, terasa seperti sabun, mudah menyerap air, dan dapat melakukan
pertukaran ion (ion exchanging),
4. Mempunyai berat jenis berkisar antara 2,4 – 2,8 g/ml.
2.2.4. Jenis-jenis Bentonit
1. Swelling Bentonite (bentonit yang dapat mengembang) atau sering juga
disebut Bentonit Jenis Wyoming atau Na-bentonit, yaitu jenis mineral
montmorilonit yang mempunyai partikel lapisan air tunggal (Single Water
Layer Particles) yang mengandung kation Na+ yang dapat dipertukarkan.
Bentonit jenis ini mempunyai kemampuan mengembang hingga 8 (delapan)
kali apabila dicelupkan ke dalam air, dan tetap terdispersi beberapa waktu di
dalam air. Dalam keadaan kering, berwarna putih, atau kuning gading,
sedangkan dalam keadaan basah dan terkena sinar matahari akan berwarna
mengkilap. Perbandingan antara kation Na+ dan kation Ca+ yang terdapat di
dalamnya sangat tinggi, serta suspensi koloidalnya mempunyai pH 8,5 sampai
9,8. Kandungan NaO dalam bentonit jenis ini, pada umumnya lebih besar dari
2 %. Karena sifat-sifat yang dimilikinya, maka bentonit jenis ini dapat
digunakan sebagai bahan lumpur bor, penyumbat kebocoran bendungan,
bahan pencampur cat, sebagai bahan baku farmasi, bahan perekat pada pasir
cetak dalam industri pengecoran, dan lain sebagainya.
2. Non Swelling Bentonite (Bentonit yang kurang dapat mengembang) atau
sering juga disebut Ca-bentonit, yaitu jenis mineral montmorilonit yang
kurang dapat mengembang apabila dicelupkan di dalam air, namun setelah
diaktifkan dengan asam, maka akan memiliki sifat menyerap sedikit air dan
akan cepat mengendap tanpa membentuk suspensi. Yang mempunyai pH-nya
sekitar 4,0 – 7,1. Daya tukar ionnya juga cukup besar. Bentonit jenis ini
mengandung kalsium dan magnesium yang relatif lebih banyak dibandingkan
bentonit jenis ini dapat digunakan sebagai bahan penyerap (pemucat) warna
(Bleaching Earth).
2.2.5. Kegunaan (Pemanfaatan) Bentonit
Pemanfaatan bentonit dalam bidang industri, sangat erat kaitannya
dengan sifat yang dimiliki oleh bentonit itu sendiri, yaitu:
a. Komposisi dan jenis mineral
Untuk mengetahui komposisi dan jenis mineral yang terkandung
dalam bentonit, dilakukan pengujian dengan menggunakan Difraksi Sinar–X.
Tujuannya adalah untuk mengetahui secara kualitatif komposisi mineral yang
terkandung di dalamnya.
b. Sifat Kimia
Pengujian terhadap beberapa sifat kimia yang terkandung di dalam
bentonit perlu dilakukan untuk mengetahui kualitas (mutu) yang dimilikinya.
c. Sifat Teknologi
Pemanfaatan bentonit berkaitan dengan sifat teknologi yang
dimiliki bentonit tersebut, yaitu antara lain: sifat pemucatan, sifat bagian
suspensi yang dapat digunakan untuk pengerasan semen, sifat mengikat dan
melapisi untuk pembuatan makanan ternak dan industri logam.
d. Sifat Pertukaran Ion
Pengujian terhadap sifat pertukaran ion bertujuan untuk
mengetahui seberapa besar jumlah air (uap air) yang dapat diserap oleh
untuk proses selanjutnya. Hal ini sangat penting diketahui karena bentonit
diharapkan dapat membentuk dinding diafragma yang mencegah terjadinya
rembesan air.
e. Daya Serap
Sifat daya serap yang dimiliki bentonit terjadi karena adanya ruang
pori-pori antar ikatan mineral lempung, serta ketidakseimbangan antara
muatan listrik dalam ion-ionnya. Daya serap tersebut pada umumnya berada
pada ujung permukaan kristal, serta diameter ikatan mineral lempung. Hal ini
disebabkan karena bentonit dapat digunakan sebagai bahan penyerap dalam
berbagai keperluan, baik dalam keadaan basah (suspensi) maupun kering
(tepung).
f. Luas Permukaan
Luas permukaan bentonit dinyatakan dalam jumlah total luas
permukaan kristal atau butir kristal bentonit yang berbentuk tepung dalam
setiap gram massa bentonit tersebut (m2/g). Semakin tinggi luas
permukaannya maka semakin banyak pula zat-zat yang terbawa atau melekat
pada bentonit. Sifat ini dimanfaatkan sebagai bahan pembawa (carrier) dalam
insektisida dan pestisida serta sebahai bahan pengisi (filler) dalam industri
kertas (pulp), dan bahan pengembang industri makanan dan plastik.
g. Kekentalan dan Suspensi
Sifat kekentalan dan daya serap yang tinggi sangat diharapkan
terutama untuk pengeboran minyak, eksplorasi, industri cat, dan industri
Sebelum digunakan dalam berbagai aplikasi, bentonit harus diaktifkan
dan diolah terlebih dahulu. Ada 2 (dua) cara yang dapat dilakukukan untuk
aktivasi bentonit, yaitu:
1. Secara Pemanasan (heat activation and extrusion)
Pada proses ini, bentonit dipanaskan pada temperatur 300 – 350°C untuk
memperluas permukaan butiran bentonit.
2. Secara Kontak Asam
Tujuan dari aktivasi kontak asam adalah untuk menukar kation Ca+ yang ada
dalam Ca-bentonit menjadi ion H+ dan melepaskan ion Al, Fe, dan Mg dan
pengotor-pengotor lainnya dari kisi-kisi struktur, sehingga secara fisik
bentonit tersebut menjadi lebih aktif. Untuk keperluan tersebut asam sulfat dan
asam klorida adalah zat kimia yang umum digunakan. Selama proses
bleaching tersebut, Al, Fe, dan Mg larut dalam larutan, kemudian terjadi
penyerapan asam ke dalam struktur bentonit, sehingga rangkaian struktur
(framework) mempunyai area yang lebih luas. Proses pelepasan Al dari
bentonit disajikan dalam persamaan berikut ini:
(Al4)(Si8)O20(OH)4 + 3 H+ (Al3)(Si8)O20(OH)2 + Al3+ + 2 H2O
(Al4)(Si8)O20(OH)4 + 6 H+ (Al2)(Si8)O20(OH)2 + 2 Al3+ + 4 H2O
Pada kondisi di atas, separuh dari atom Al berpindah dari struktur bersama
dengan gugus hidroksida. Menurut Thomas, Hickey, dan Stecker, atom-atom
Al yang tersisa masih terkoordinasi dalam rangkaian tetrahedral dengan 4
Perubahan dari gugus oktahedral menjadi tetrahedral membuat kisi kristal
bermuatan negatif pada permukaan kristal, sehingga dapat dinetralisir oleh ion
hidrogen. Pada proses aktivasi selanjutnya terjadi pelarutan lebih banyak lagi.
Persamaan reaksinya dapat dituliskan sebagai berikut ini:
(Al2)(Si8)O20(OH)4 + 3 H+ Al3+ + (Al)(Si8H4)O20
(Al2)(Si8)O20(OH)4 + 6 H+ 2 Al3+ + (Si8H8)O20
Sementara proses pengolahan bentonit dapat dilihat secara skematis berikut:
Bentonit Alam
Basa - Soda abu - Soda api Asam
- Asam sulfat - Asam klorida
Bentonit aktif - Bahan penyerap
(Bleaching earth)
[image:49.595.155.471.319.587.2]Bentonit aktif - Bahan perekat - Bahan pengisi - Bahan lumpur bor
Gambar 2.5. Skematis Proses Pengolahan Bentonit
Setelah bentonit selesai diaktivasi dan diolah, maka bentonit tersebut
siap untuk digunakan untuk beberapa aplikasi selanjutnya, yaitu:
1. Bentonit sebagai Bahan Penyerap (Adsorben) atau Bahan Pemucat pada
Proses penyerapan zat warna (pigmen) merupakan proses yang
sering digunakan, seperti penyerapan zat warna pada minyak hewani, minyak
nabati, minyak bumi, dan lain-lain. Untuk keperluan tersebut dibutuhkan suatu
bahan penyerap yang tepat dan murah.
Dalam keadaan awal, bentonit mempunyai kemampuan tinggi
untuk menjernihkan warna. Kemampuan penyerapan warna ini dapat
ditingkatkan melalui proses pengolahan dan pemanasan.
Berdasarkan kandungan alumino silikat hidrat yang terdapat dalam
bentonit, maka bentonit tersebut dapat dibagi atas 2 (dua) golongan, yaitu:
a. Activated clay, merupakan lempung yang mempunyai daya pemucatan
yang rendah,
b. Fuller’s earth, biasanya digunakan sebagai bahan pembersih bahan wool
dari lemak.
Fuller’s earth adalah sejenis lempung yang secara alami
mempunyai sifat daya serap terhadap zat warna pada minyak, lemak, dan
pelumas. Karakteristik dari lempung jenis ini adalah mempunyai kandungan
air yang tinggi, plastisitas yang rendah, dan struktur yang berlapis-lapis.
Sebagian besar fuller’s earth menunjukkan perbandingan silika terhadap
alumina antara 4 – 6. Sifat alami lain adalah pH antara 6,5 – 7,5, dengan
porositas 60 – 70 %, dan luas permukaan butiran 170 – 200 Å. Mineral ini
pada umumnya didominasi oleh mineral montmorilonit, atapulgit, dengan
Proses penyerapan zat warna organik yang terdapat dalam minyak,
lemak, dan pelumas terdiri atas penyerapan fisika dan kimia. Peyerapan secara
kimia pada prinsipnya adalah merusak zat warna dengan penambahan
oksidator, misalnya hidrogen peroksida. Penyerapan secara fisika adalah
karena kontak antara permukaan butiran pada kondisi tertentu, yang meliputi
temperatur, waktu kontak, pengadukan, dan konsentrasi yang dinyatakan oleh
Frieundlich.
Proses pemucatan kelapa sawit dengan menggunakan adsorben
pada prinsipnya adalah merupakan proses adsorbsi, di mana pada umumnya
minyak kelapa sawit dipucatkan dengan kombinasi antara adsorben dengan
pemanasan. Hal ini disebabkan karena minyak kelapa sawit adalah salah satu
minyak nabati yang sulit untuk dipucatkan karena mengandung pigmen –
karotenoid yang tinggi dibandingkan dengan minyak biji-bijian lainnya.
Penggunaan adsorben dengan pemanasan yang dilakukan dalam
proses pemucatan ini tidak selalu sama untuk semua produk pengolahan
minyak kelapa sawit, tetapi tergantung kepada kondisi minyak kelapa sawit,
proses pabrik, dan sifat adsorben yang digunakan.
Pada umumnya, penggunaan adsorben adalah 1 – 5 % dari massa
minyak dengan pemanasan pada suhu 120°C selama ± 1 jam. Dalam hal ini,
adsorben yang sering digunakan adalah bentonit (dalam hal ini berfungsi
sebagai bleaching earth/ tanah pemucat) dan arang aktif (activated charcoal).
Bahan pemucat ini merupakan sejenis tanah dengan komposisi
besi oksida. Daya pemucatan bleaching earth ditimbulkan oleh adanya ion-ion
Al3+ pada permukaan partikel adsorben yang dapat mengasorbsi partikel zat
warna (pigmen). Sementara daya pemucatan tersebut tergantung pada
perbandingan antara komponen SiO2 dan AlO2 yang terdapat dalam bleaching
earth tersebut.
Aktivasi adsorben dengan asam mineral (misalnya HCl/ H2SO4)
akan mempertinggi daya pemucatan, karena asam mineral tersebut akan
bereaksi dan melarutkan komponen berupa tar, garam Ca dan Mg yang
menutupi pori-pori adsorben. Di samping itu, asam mineral melarutkan Al2O3
sehingga menaikkan perbandingan jumlah SiO2 dan Al2O3 dari (2 – 3) : 1
menjadi (5 – 6) : 1.
Bentonit yang telah ditambang diangkut ke tempat penampungan
sementara (stock pile). Bentonit dalam bentuk bongkahan atau lepas, baik
dalam kondisi basah maupun kering, dilakukan penirisan dan pengeringan.
Kemudian dimasukkan ke dalam reaktor (aktivasi) dengan menambahkan air
dan asam sulfat. Langkah selanjutnya adalah pencucian untuk menghilangkan
kotoran-kotoran yang melekat pada mineral montmorilonit untuk selanjutnya
akan masuk ke dalam thickener. Media pemisahannya adalah air. Setelah itu,
akan masuk ke dalam proses penyaringan dan dilakukan pengeringan.
Bentonit yang telah kering dimasukkan ke proses penggerusan
untuk mendapatkan ukuran butiran kurang lebih 200 mesh.
Penggunaan lempung sebagai katalis telah lama diperkenalkan,
yaitu pada proses perengkahan minyak bumi dengan menggunakan mineral
montmorillonit yang telah diasamkan. Namun, penggunaan lempung sebagai
katalis memiliki kelemahan, yaitu tidak tahan terhadap suhu tinggi. Oleh
karena itu diperkenalkan jenis material baru lempung terpilar yang memiliki
stabilitas termal relatif lebih tinggi dari material asal.
3. Bentonit sebagai Bahan Penukar Ion
Pemanfaatan bentonit sebagai bahan penukar ion didasarkan pada
sifat permukaan bentonit yang bermuatan negatif, sehingga kation-kation
dapat terikat secara elektrostatik pada permukaan bentonit. Sifat ini juga
merupakan hal yang penting dalam pengubahan Ca–bentonit menjadi Na–
bentonit. Bentonit di Indonesia memiliki daya penukar kation dengan ukuran
kapasitas tukar kation (KTK) yang berbeda-beda untuk masing-masing daerah,
yaitu berkisar antara 50–100 meq/ 100 g. Hal ini disebabkan karena perbedaan
komposisi kandungan kimianya.
4. Bentonit sebagai Lumpur Bor
Penggunaan utama mineral lempung adalah pada industri lumpur
bor, yaitu sebagai lumpur pemilar dalam pengeboran minyak bumi, gas bumi,
serta uap panas bumi.
Bentonit yang telah ditambang, dipersiapkan untuk proses
pengolahan, di mana jika kondisinya masih basah, harus ditiriskan terlebih
dahulu sedangkan jika kondisinya telah kering maka dapat langsung dilakukan
pengeringan kembali, di mana sumber panas untuk pengeringan tersebut
berasal dari energi listrik. Setelah butiran bentonit sesuai dengan ukuran
tertentu maka dimasukkan ke dalam reaktor untuk proses aktivasinya. Dalam
hal ini, fraksi pasir harus dihilangkan untuk mempertinggi kualitas bentonit
sebagai lumpur pengeboran. Ke dalam reaktor aktivasi dimasukkan sejumlah
air dan H2SO4. Setelah proses ini selesai maka dilakukan pengeringan kembali
dengan sumber panas dari energi listrik. Tahap berikutnya adalah penggerusan
untuk mencapai ukuran butiran halus bentonit (200 mesh) sebelum
dimasukkan ke dalam siklon. Hasil siklon berupa produk dicampur dengan
karbosil metil selulosa (CMC) dan ditampung di silo.
Aktivasi bentonit untuk lumpur bor adalah merupakan suatu
perlakuan untuk mengubah Ca–bentonit menjadi Na–bentonit dengan
penambahan bahan alkali. Bahan alkali yang umum digunakan adalah natrium
karbonat dan natrium hidroksida. Dengan perubahan tersebut diharapkan sifat
hidrasi, dispersi, reologi, swelling, dan lain-lain akan berubah, sehingga dapat
dimanfaatkan sebagai bahan lumpur bor.
Persyaratan bentonit untuk lumpur bor menurut API (American
Petroleum Institute) adalah sebagai berikut:
• Kekentalan suspensi bentonit untuk 10 g dalam 350 ml air adalah 15.
• Dapat lewat melalui penyaringan melalui kertas saring (filter), yakni untuk
larutan 10 g dalam 350 ml air harus lebih kecil dari 15 ml.
• Sisa tertampung oleh ayakan 200 mesh adalah < 2,5 %.
Sementara persyaratan bentonit untuk lumpur bor menurut OCMA
(Oil Companies Materials Association) adalah sebagai berikut:
• Kekentalan suspensi bentonit untuk 6,5 g dalam 100 ml air adalah 15.
• Dapat lewat melalui penyaringan melalui kertas saring (filter), yakni untuk
larutan 6,5 g dalam 100 ml air harus lebih kecil dari 15 ml.
• Sisa tertampung oleh ayakan 200 mesh adalah <15 %.
• Sisa tertampung oleh ayakan 100 mesh (keadaan basah) adalah <2,5 %.
• Sisa tertampung oleh ayakan 100 mesh (keadaan kering) adalah >98 %.
• Kandungan uap air (kelembaban) adalah <15 %.
5. Bentonit sebagai Bahan Konstruksi Bangunan
Kepulauan Indonesia sebagaimana pada umumnya berada di
daerah tropis, mempunyai bermacam–macam jenis tanah, di antaranya
mempuyai sifat yang kurang baik. Di antaranya sifat fisik, seperti
plastisitasnya tinggi, degradasi kurang baik, akibatnya sifat teknik yang
dimiliki juga menjadi kurang baik, seperti daya dukungnya yang rendah.
Seperti yang telah diketahui, tanah merupakan bahan konstruksi dalam
bangunan sipil. Namun yang tersedia tidak terlalu seperti yang diharapkan.
Bentonit merupakan salah satu jenis lempung yang banyak terdapat di
beberapa wilayah di Indonesia. Bentonit mempunyai sifat fisik dan sifat teknik
yang buruk jika digunakan sebagai bahan konstruksi. Bentonit juga bersifat
ekspansif, yaitu mempunyai kemampuan mengembang cukup besar bila
memadatkannya, sehingga bentonit jenuh ini tidak akan mampu memukul
gaya-gaya yang bekerja padanya.
Pemakaian bentonit sebagai bahan konstruksi bangunan haruslah
dikombinasikan dengan suatu bahan tertentu untuk memperbaiki sifat-sifat
bentonit tersebut sebelum digunakan. Salah astu bahan yang dapat digunakan
adalah kapur yang merupakan sisa atau limbah industri gas asetilen. Limbah
pada proses pengolahan asetilen berbentuk butiran halus yang masih
mengandung air. Secara fisik, limbah ini menyerupai kapur sedangkan secara
kimia, limbah ini mengandung oksida-oksida logam dan persenyawaan kimia
lainnya.
Berdasarkan sifat fisik dan komposisi kimianya, limbah ini dapat
digunakan sebagai bahan aditif kimia dalam stabilitas tanah. Karena dengan
kandungan: 70,90 % kalsium hidrat; 0,31 % magnesium oksida; 0,66 % silika;
2,56 % alumina; 1,76 % besi oksida; pH 12,5; dan kadar air 3,76 %, maka
limbah ini memenuhi syarat untuk dapat digunakan sebagai bahan alternatif
pengganti kapur yang merupakan salah satu bahan aditif kimia yang
digunakan untuk stabilisasi tanah.
6. Bentonit sebagai Bahan Perekat Pasir Cetak
Untuk keperluan pasir cetak, teknik pengolahannya cukup
sederhana, yaitu:
Bentonit yang telah ditambang, dipersiapkan untuk proses pengolahan, di
mana jika kondisinya masih basah, maka perlu dilalukan penirisan untuk
siap untuk dilakukan pengeringan selanjutnya di mana sumber panas berasal
dari energi listrik.
Tahap berikutnya adalah penggerusan untuk memperkecil ukuran butiran
sampai 200 mesh. Hasil penggerusan ini diproses lebih lanjut di dalam siklon.
Setelah proses siklon selesai maka bentonit sebagai bahan perekat pada
pembuatan pasir cetak disimpan di silo.
7. Bentonit untuk Pembuatan Tambahan Makanan Ternak (Urea Mollases Block)
Untuk dapat digunakan dalam pembuatan tambahan makanan
ternak, bentonit harus memenuhi persyaratan sebagai berikut:
• Kandungan bentonit yang digunakan dalam pembuatan tambahan makanan
ternak < 30 %.
• Ukuran butiran bentonit adalah 200 mesh. • Memiliki daya serap >60 %.
• Memiliki kandungan mineral montmorilonit sebesar 70 %.
8. Bentonit untuk Industri Kosmetik
Untuk dapat digunakan dalam industri kosmetik, bentonit harus
memenuhi persyaratan sebagai berikut:
• Mengandung mineral magnesium silikat (Ca–bentonit).
• Mempunyai pH netral.
• Kandungan air dalam bentonit adalah <5 %.
• Tidak mengalami perubahan panas selama dan setelah pemanasan.
Secara umum dapat dikemukakan bahwa mineral montmorilonit
termasuk ke dalam kelompok smektit. Beberapa mineral yang termasuk ke dalam
kelompok ini adalah beidelit, hektorit, dan stevensit.
Pada praktiknya, komposisi montmorilonit itu sendiri adalah berbeda
dari bentonit yang satu dengan bentonit yang lain dan kandungan elemennya
bervariasi tergantung pada proses pembentukannya di alam. Setiap struktur kristal
montmorilonit mempunyai 3 (tiga) lapisan utama, yaitu lapisan oktahedral dari
lapisan aluminium dan oksigen yang terletak di antara 2 (dua) lapisan silikon dan
oksigen. Kandungan air kristalnya juga bervariasi sehingga jarak antar partikelnya
dapat berubah-ubah, sehingga dapat mengembang (swelling). Adapun rumus
umum kimia dari montmorilonit itu sendiri, yaitu: [Al2O3.4SiO2.xH2O]. Molekul
montmorilonit terdiri dari lapisan-lapisan yang berjarak beberapa Amstrong. Salah
satu lapisan berbentuk silika terkoordinasi dan dikombinasikan dengan lapisan
alumina dan magnesia yang oktahedral.
Partikel montmorilonit sangatlah kecil sehinngga strukturnya hanya
dapat disimpulkan melalui penelitian menggunakan Difraksi Sinar-X (X-Ray
Difraction).
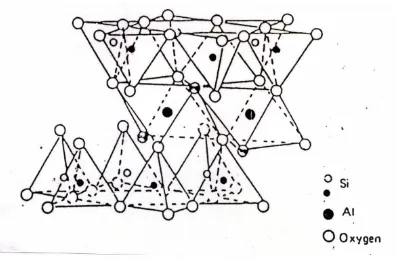
Gambar 2.6 di bawah ini menunjukkan sketsa diagram dari struktur
montmorilonit. Kation yang dapat dipertukarkan dapat terjadi di antara lapisan
silika dan ruang sumbu alumino silikat dari montmorilonit tersebut yang terhidrasi
Gambar 2.6. Sketsa Diagram Struktur Montmorilonit (Cool, P., 2002)
2.2.6. Hidrasi pada Mineral Montmorilonit
Secara teori dapat diterangkan bahwa susunan partikel lempung
umumnya terdiri atas lapisan-lapisan yang bertumpuk seperti tumpukan kartu.
Tumpukan tersebut terdiri dari lapisan silikat, alumina, dan oksigen yang di
dalamnya terdapat gugusan hidrosil serta logam–logam. Bila tersuspensi di dalam
air akan memperbesar jarak antara lapisan sampai beberapa Amstrong dan ini
berarti akan meningkatkan daya swelling dari lempung tersebut. Jenis lempung
yang terbaik yang berkenaan dengan hal ini adalah jenis Na–montmorilonit. Di
dalam air, lempung jenis ini akan mengembang sampai lapisan-lapisan tersebut
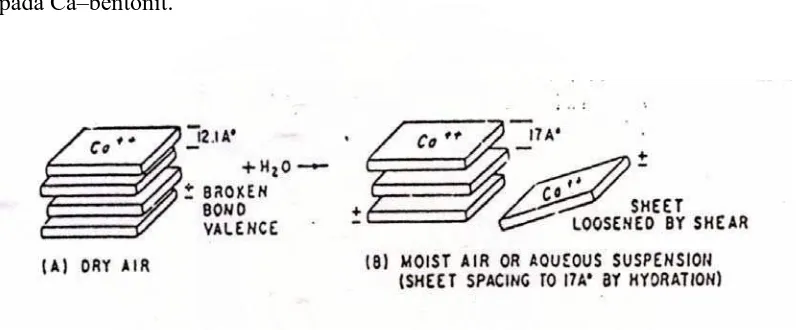
Jarak antar lapisan pada Na–bentonit kering adalah 9,8 Å sedangkan
pada Ca–bentonit adalah 12,1 Å. Pada saat terjadinya hidrasi yang disebabkan
oleh udara yang lembab ataupun suatu kondisi yang berair, maka jarak tersebut
akan bertambah. Pada Ca–bentonit menjadi 17 Å dan pada Na–bentonit akan
bertambah menjadi 17 – 40 Å dan selanjutnya tumpukan tersebut akan berpisah
dan membentuk suspensi. Gambar 2.7 menyajikan mekanisme hidrasi dan dispersi
[image:60.595.114.513.285.450.2]pada Ca–bentonit.
Gambar 2.7. Mekanisme Hidrasi dan Dispersi pada Ca-bentonit (Figueras, F., 1988)
2.3. Lempung Terpilar (Pillaried Inter Layered Clay/ PILC)
Lempung Terpilar (PILC) adalah sebuah kelas yang menarik dari
material-material dengan ukuran pori yang kecil secara 2 dimensi. Oleh karena
Lempung Terpilar (PILC) mempunyai luas permukaan yang tinggi dengan
porositas yang tetap, maka sangat baik digunakan untuk adsorbsi dan sebagai
katalis. Sejak pori-pori Lempung Terpilar (PILC) dapat dilokalisasikan ke dalam
daerah pori yang kecil, substrat ini membentuk sebuah jembatan antara mikropori
silika dan alumina) pada sisi lainnya. Sejarah dari Lempung Terpilar (PILC)
dimulai pada tahun 1955, namun studi intensifnya yang pertama dinyatakan
sekitar pada tahun 1980. Selama perintisan kerja ini, kation organik dan pilar
organometalik adalah yang terutama digunakan. Sekarang kation polioksida
anorganik merupakan yang paling baik karena stabil pada suhu tinggi. Dengan
cara mengubahnya secara alami, ukuran pilar dan porositas, maka akan
didapatkan Lempung Terpilar (PILC) yang berbeda. Pori-porinya dikombinasikan
dengan bahan-bahan antar pilar dengan bahan dasar lempung, sangat penting
dalam berbagai aplikasi seperti adsorbsi gas, reaksi-reaksi katalitik, dan lain
sebagainya.
Preparasi pertama Lempung Terpilar (PILC) menggunakan ion
tetra-alkil-amonium dan menghasilkan lempung yang mengembang yang dapat
berfungsi sebagai penyaring molekuler (molecular sieves) untuk adsorbsi
molekular organik. Montmorilonit yang telah diinterkalasi oleh 1,4–diazobisiklo–
2,2,2–oktana ditemukan memiliki sifat penyaring molekul dan aktifitas katalitik
yang baik untuk reaksi esterifikasi asam karboksilat. Meskipun stabilitas termal
lempung organik ini lebih rendah dari 300°C sehingga membatasi penggunaannya
sebagai katalis. Kebutuhan dunia industri terhadap masalah material yang
memiliki sifat katalitik berkembang sangat cepat sehingga memacu munculnya
material Lempung Terpilar kation polioksida yang stabil di atas suhu 600°C.
Preparasi Lempung Terpilar (PILC) atau Cross-Lined Smectite (CLS)