TRANSESTERIFIKASI HETEROGEN MINYAK SAWIT MENTAH DAN METANOL MENGGUNAKAN KATALIS PADAT KALSIUM OKSIDA
SKRIPSI
Diajukan Untuk melengkapi Tugas dan Memenuhi Syarat Mencapai Gelar Sarjana Sains
RIANI SARI SEMBIRING 040802015
DEPARTEMENT KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
TRANSESTERIFIKASI HETEROGEN MINYAK SAWIT
MENTAH DAN METANOL MENGGUNAKAN KATALIS PADAT
KALSIUM OKSIDA
SKRIPSI
Oleh :
RIANI SARI SEMBIRING
040802015
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : TRANSESTERIFIKASI HETEROGEN MINYAK SAWIT MENTAH DAN METANOL
MENGGUNAKAN KATALIS PADAT KALSIUM OKSIDA
Kategori : SKRIPSI
Nama : RIANI SARI SEMBIRING
Nomor Induk Mahasiswa : 040802015
Program Studi : SARJANA (S-1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA
UTARA
Disetujui di: Medan, Juni 2009 Komisi Pembimbing:
Pembimbing II Pembimbing I
Dra. Tirena B. Siregar, ST. M.Eng. Dr.Marpongahtun M.Sc NIP.130 365 343 NIP.131 796 151
Diketahui/Disetujui oleh:
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
TRANSESTERIFIKASI HETEROGEN MINYAK SAWIT MENTAH DAN METANOL MENGGUNAKAN KATALIS PADAT KALSIUM OKSIDA
SKRIPSI
Dengan kesadaran sepenuhnya saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing dicantumkan sumber aslinya.
Medan, Juni 2009
PENGHARGAAN
Puji Syukur yang tak terhingga penulis ucapkan dengan segala kerendahan hati dan diri kepada Allah SWT, Sang Khaliq yang senantiasa mencurahkan segala nikmat Iman, Islam dan Ihsan, serta Shalawat dan Salam kepada Nabi Allah sebagai patron insan terbaik ; Rasulullah Muhammad SAW sehingga penulis dapat menempuh fase – fase perjalanan aktualisasi penelitian dan transformasi hasil menjadi sebuah skripsi.
Skripsi ini berjudul “TRANSESTERIFIKASI HETEROGEN MINYAK SAWIT
MENTAH DAN METANOL MENGGUNAKAN KATALIS PADAT KALSIUM OKSIDA ”. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Sains (S.Si) Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Sumatera Utara Medan.
Penulis mengucapkan terima kasih kepada kedua orang tua yang selalu sabar membimbing penulis, kepada ayahanda Drs.Kurnia Sembiring.MS dan ibunda Murniati Kepada adik-adik Malinda Sari Sembiring.Deddy Wijaya Sembiring dan Ade Dermawan Sembiring. Terima Kasih buat doa dan motivasinya, tanpa kalian dan keluarga semua penulis bukanlah apa - apa. Juga kepada Bapak dan Ibu guru SMU NEGRI 2 BINJAI yang telah membukakan jalan pada penulis sehingga penulis tertarik berkiprah di ilmu Kimia.
Kepada Dosen Pembimbing I: Ibu Dr.Marpongahtun M.Sc, Dosen Pembimbing II: Ibu Dra. Tirena B. Siregar, ST. M.Eng. yang telah membimbing penulis dengan kesabaran tinggi mulai tahap awal orientasi penelitian sampai tahap akhir selesainya penulisan skripsi ini, kepada Ibu Dr. Rumondang Bulan, M.S. dan Bapak Drs. Firman Sebayang, M.S. selaku ketua dan sekretaris Departemen Kimia yang telah mensyahkan skripsi ini, Ibu Herlince Sihotang.MSi. selaku Dosen Wali penulis, terlebih untuk semua Bapak/Ibu Staf Laboratorium Kimia Fisika dan Kimia Polimer serta Bapak/ Ibu Staf Pengajar Departemen Kimia secara keseluruhan. Kepada seluruh assisten, teknisi dan laboran Lab. Kimia Fisika, Lab. Polimer dan Lab. Komputer: Mas Edi, Kak Mas, Bang Rahmad, Bang Husni, Kak Ulfa, Kak Lina, Kak Lili, Kak Ria, Kak Yana, Bang Pujo, Fadli, Fendi, Tarra, Kiki, Sri, Misbah, Mega, Rahma, Rina, Reni, Ami, Nia, Ismail, dan Adi yang telah menjalani hari – hari bersama penulis dalam menjalankan amanah ilmu pengetahuan, atas semua kebersamaan dan persahabatan yang telah terjalin dan akan tetap terjalin, atas semuanya penulis ucapkan terima kasih. Penghargaan untuk persahabatan spesial kepada teman - teman stambuk 2004 (Aminah, Atun, Pipit, Yenny, Iva, Rina, Ridwan, Ika, Mona, Hasrul, Hisar, Ferdinan R, Ferdinan M, Esther, Refanti, Eve, Melfa, Wespan, Doly, Jasmer, Desmi, Jhon, Kardiyanto, Rosida, Henny, Mangisi, Raskita, Desi, Marisi, Firdaus, dan Julia). Teman-teman Asrama putri yang selalu menemani hari-hari penulis (Amah, Lia, Fitri, Lili, K’sri, Amel, Anisma, Imai, Desy, K’rita, K’wiwid, Tina, Iin, Vivi, Ice, dll) Salam optimis buat teman – teman mahasiswa yang selalu menyuarakan perubahan dan selalu melakukan proses pendewasaan berfikir. Apresiasi besar kepada semua pihak yang telah, dan sedang terlibat secara langsung maupun tak langsung sehingga skripsi ini selesai sebagaimana mestinya.
ABSTRAK
HETEROGENOUS TRANSESTERIFICATION OF CRUDE
PALM OIL WITH METHANOL USING CALCIUM OXIDE AS
BASE CATALYST
ABSTRACT
DAFTAR ISI
Halaman
Judul ... i
Persetujuan ... ii
Pernyataan ... iii
Penghargaan ... iv
Abstrak ... v
Abstract ... vi
Daftar Isi ... vii
Daftar Gambar ... x
Daftar Tabel ... xi
Daftar Lampiran ... xii
BAB 1 PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Permasalahan ... 3
1.3. Pembatasan Masalah ... 3
1.4. Tujuan Penelitian ... 4
1.5. Manfaat Penelitian ... 4
1.6. Metodologi Penelitian ... 4
1.7. Lokasi Penelitian ... 5
BAB 2 TINJAUAN PUSTAKA ... 6
2.1. Minyak Kelapa Sawit Mentah (Crude Palm Oil, CPO) ... 6
2.1.1. Komposisi Minyak Kelapa Sawit... 6
2.1.2. Standar Mutu Minyak kelapa sawit ... 8
2.2. Transesterifikasi ... 10
2.2.1. Katalisis Heterogen ... 13
2.2.2. Kalsium Oksida, CaO ... 18
2.3. Biodiesel... 20
2.3.1. Keunggulan Biodiesel ... 21
2.3.2. Sifat Fisik Bahan Bakar Diesel ... 22
2.3.3. Standar Biodiesel ... 24
BAB 3 BAHAN DAN METODE PENELITIAN ... 25
3.1. Bahan – Bahan dan Alat – Alat Penelitian ... 25
3.1.1. Bahan – Bahan Penelitian 3.1.2. Alat – Alat Penelitian ... 26
3.2. Desain Penelitian ... 26
3.3. Metode Penelitian ... 28
3.3.1. Skema Penelitian ... 28
3.3.1.1. Skema Umum ... 28
3.3.1.2. Proses Transesterifikasi Asam... 29
3.3.2. Pembuatan Reagen ... 31
3.3.2.1. Larutan Pencuci ... 31
3.3.2.2. Larutan KOH 0.1N ... 31
3.3.2.3. Larutan Indikator Fenolftalein... 31
3.3.2.4. Larutan Alkohol Netral ... 31
3.3.2.5. Larutan H2C2O4 0.1N ... 31
3.3.2.6. Standardisasi Larutan KOH 0.1N ... 31
3.3.3. Pengambilan Data ... 31
3.3.3.1. Penentuan Kadar Air pada Sampel ... 31
3.3.3.2. Proses Transesterifikasi ... 32
3.3.3.2.1. Proses Transesterifikasi Asam ... 32
3.3.3.2.2. Proses Transesterifikasi Basa ... 32
3.3.4. Karakterisasi Produk ... 35
3.3.4.1. Penentuan Kadar Air pada CPO ... 35
3.3.4.2. Penentuan Kadar Asam Lemak bebas... 35 3.3.4.3. Penentuan Densitas ... 35
3.3.4.4. Penentuan Koefisien Viskositas ... 36
3.3.4.5. Penentuan Komposisi Asam Lemak Bebas ... 36
3.3.4.6. Perhitungan Yield Metil Ester ... 37
3.3.5. Pengolahan dan Analisis Data Statistik ... 37
3.3.5.1. Analisis Regresi Linear Berganda ... 37
3.3.5.2. Analisis Residu ... 38
3.3.5.3. Analisis Korelasi ... 38
3.3.5.3.1. Analisis Korelasi Pearson ... 38
3.3.5.3.2. Analisis Korelasi Ganda... 39
BAB 4 HASIL DAN PEMBAHASAN ... 41
4.1. Hasil ... 41
4.2. Analisis Data Statistik ... 42
4.2.1. Transesterifikasi Asam ... 42
4.2.1.1. Persamaan Regresi Linear Sederhana ... 42
4.2.1.2. Persamaan Regresi Linear Berganda ... 45
4.2.1.3. Analisis Korelasi ... 46
4.2.1.3.1. Analisis Korelasi Pearson ... 46
4.2.1.3.2. Analisis Korelasi Ganda... 47
4.3. Pembahasan ... 50
4.3.1. Transesterifikasi Basa ... 52
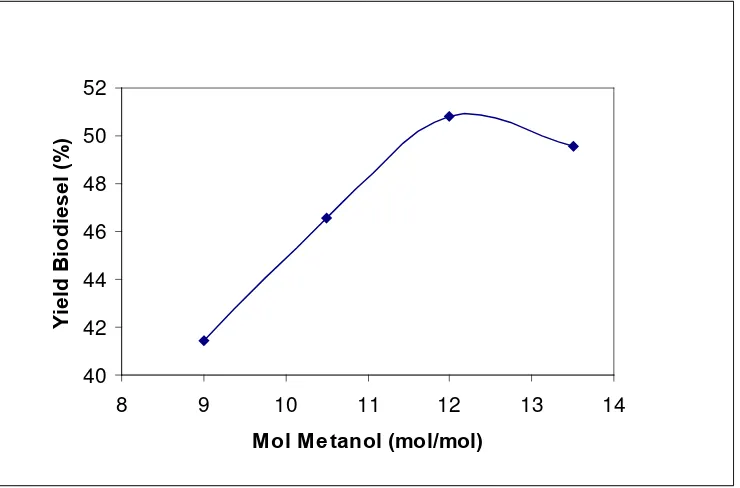
4.3.1.1. Pengaruh Perbandingan Mol Sisa CPO dengan Metanol pada Proses Transesterifikasi Basa terhadap Yield Metil Ester... 52
4.3.1.2. Pengaruh Waktu pada Proses Transesterifikasi Basa terhadap Yield Metil Ester... 53
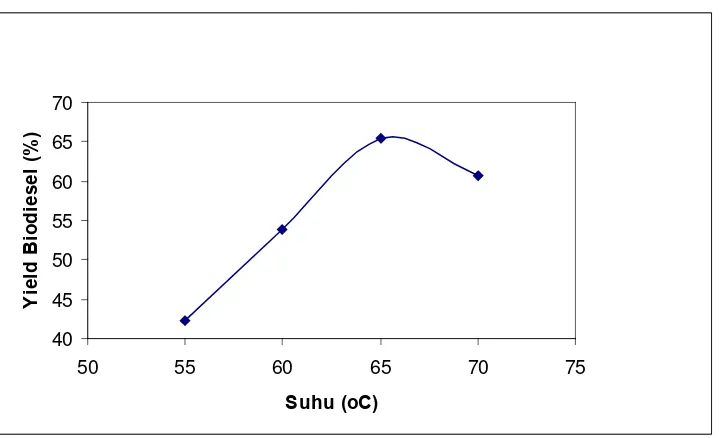
4.3.1.3. Pengaruh Suhu Reaksi pada Proses Transesterifikasi Basa terhadap Yield Metil Ester ... 54
4.3.2. Sifat Fisik Biodiesel ... 57
BAB V KESIMPULAN DAN SARAN ... 59
5.1. Kesimpulan ... 59
DAFTAR GAMBAR
Halaman
Gambar 2.1. Reaksi Transesterifikasi antara Trigliserida dan Metanol ... 11
Gambar 2.2. Mekanisme Reaksi Heterogen ... 14
Gambar 2.3. Mekanisme Reaksi Katalisis Heterogen menurut Langmuir-H ... 14
Gambar 2.4. Mekanisme Reaksi Katalisis Heterogen menurut Rideal-eley ... 15
Gambar 2.5. Mekanisme Reaksi Transesterifikasi Basa Heterogen menggunakan katalis CaO... 20
Gambar 3.1. Skema Umum Penelitian ... 27
Gambar 3.2. Skema Proses Transesterifikasi Tahap Pertama... 28
Gambar 3.3. Skema Proses Transesterifikasi Tahap Kedua ... 29
Gambar 4.1. Estimasi Kurva Regresi Linear Sederhana Pada Pengaruh Perbandingan Mol terhadap yield metil ester ... 43
Gambar 4.2. Estimasi Kurva Regresi Linear Sederhana Pada Pengaruh Perbandingan Waktu terhadap yield metil ester ... 44
Gambar 4.3. Estimasi Kurva Regresi Linear Sederhana Pada Pengaruh Perbandingan Suhu terhadap yield metil ester ... 44
Gambar 4.4. Grafik Pengaruh Perbandingan Mol Metanol dan Sisa CPO pada Proses Transesterifikasi Basa Heterogen menggunakan Katalis CaO terhadap yield metil ester pada suhu 60oC dan waktu reaksi 90 menit ... 50
Gambar 4.5. Grafik Pengaruh Waktu pada Proses Transesterifikasi Basa Heterogen menggunakan Katalis CaO terhadap yield metil ester pada suhu 60oC dan waktu reaksi 120 menit ... 51
DAFTAR TABEL
Halaman
Tabel 2.1. Komposisi Asam Lemak Minyak Kelapa Sawit... 7
Tabel 2.2. Tabel 2.3. Komponen Minor dari Minyak Kelapa Sawit ... 7
Tabel 2.4. Standar Biodiesel Nasional (SNI 04-7182-2006) ... 24
Standar Mutu Minyak Kelapa Sawit ... 9
Tabel 3.1. Komposisi Minyak Sawit Mentah, CPO ... 25
Tabel 3.2. Bahan – Bahan Penelitian ... 25
Tabel 3.3. Alat – Alat Penelitian ... 26
Tabel 3.4. Pedoman untuk Memberikan Interprestasi terhadap Koefisien Korelasi .. 39
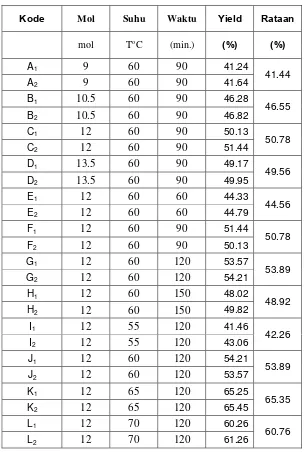
Tabel 4.1. Data Hasil Transesterifikasi Heterogen antara Metanol dan Sisa CPO menggunakan Katalis CaO ... 41
Tabel 4.2. Karakteristik Metil Ester Hasil Transesterifikasi Heterogen menggunakan Katalis CaO pada Perbandingan Mol ... 49
Tabel 4.3. Karakteristik Metil Ester Hasil Transesterifikasi Heterogen menggunakan Katalis CaO pada perbandingan Waktu ... 49
Tabel 4.4. Karakteristik Metil Ester Hasil Transesterifikasi Heterogen menggunakan Katalis CaO pada perbandingan suhu ... 49
DAFTAR LAMPIRAN
Halaman Tabel 1. Tabel Jumlah Yield yang Diperoleh pada Proses Transesterifikasi ... 65 Tabel 2. Tabel Pengukuran Densitas Metil Ester Hasil Transesterifikasi ... 66 Tabel 3. Tabel Pengukuran Kadar Asam Lemak Bebas Metil Ester
Hasil Transesterifikasi ... 67 Tabel 4. Tabel Pengukuran Koefisien Viskositas Metil Ester Hasil
Transesterifikasi ... 68 Tabel 5. Tabel Penggandaan antar Variabel – Varibel Bebas Terhadap Variabel Terikat... 69 Tabel 6. Penggandaan Koefisien Penyimpangan Yield... 70 Tabel 7. Penggandaan Nilai untuk Menghitung Koefisien Korelasi antara
Perbandingan Mol dengan Yield Metil Ester ... 71 Tabel 8. Penggandaan Nilai untuk Menghitung Koefisien Korelasi antara
Suhu dengan Yield Metil Ester... 71 Tabel 9. Penggandaan Nilai untuk Menghitung Koefisien Korelasi antara
Waktu Reaksi dengan Yield Metil Ester ... 71 Tabel 10. Tabel Output Korelasi Pearson SPSS antara Perbandingan Mol
Metanol dan Sawit Mentah dengan Yield Metil Ester ... 72 Tabel 11. Tabel Output Korelasi Pearson SPSS antara Suhu dengan Yield
Metil Ester ... 72 Tabel 12. Tabel Output Korelasi Pearson SPSS antara Waktu Reaksi dengan
Yield Metil Ester... 72 Gambar 1. Analisis Kromatografi Gas (GC) terhadap CPO ... 73 Gambar 2. Analisis Kromatografi Gas (GC) terhadap Sisa CPO ... 74 Gambar 3. Analisis Kromatografi Gas (GC) terhadap Metil Ester Hasil
Transesterifikasi Basa Heterogen menggunakan Katalis CaO dengan perbandingan Mol ... 75 Transesterifikasi Metanol dan Minyak Sawit Mentah dengan
Gambar 4. Analisis Kromatografi Gas (GC) terhadap Metil Ester Hasil
Transesterifikasi Basa Heterogen menggunakan Katalis CaO dengan perbandingan Waktu ... 76 Gambar 5. Analisis Kromatografi Gas (GC) terhadap Metil Ester Hasil
Transesterifikasi Basa Heterogen menggunakan Katalis CaO dengan perbandingan Suhu ... 77 Tabel 13. Tabel Komposisi CPO ... 78 Tabel 14. Tabel Komposisi sisa CPO ... 78 Tabel 15. Tabel Perhitungan Bilangan Setana pada Transesterifikasi dengan
Katalis Basa Heterogen CaO pada Perbandingan Mol ... 79 Tabel 16. Tabel Perhitungan Bilangan Setana pada Transesterifikasi dengan
Katalis Basa Heterogen CaO pada Perbandingan Waktu Reaksi ... 79 Tabel 17. Tabel Perhitungan Bilangan Setana pada Transesterifikasi dengan Katalis
ABSTRAK
HETEROGENOUS TRANSESTERIFICATION OF CRUDE
PALM OIL WITH METHANOL USING CALCIUM OXIDE AS
BASE CATALYST
ABSTRACT
BAB 1 PENDAHULUAN
1.8. Latar Belakang
Indonesia mulai tahun 2007 dicatat sebagai produsen minyak nabati terbesar di dunia, mengungguli Malaysia, dengan proyeksi produksi minimal 17 juta ton/tahun di areal produktif 5,5 juta hektar. Tahun 2009 ekspor CPO diprediksi akan naik 7.1%. Peningkatan volume ekspor komoditas tersebut disebabkan oleh mulai membaiknya pasar Eropa dan daya saing minyak sawit meningkat dengan pemberlakuan pungutan ekspor 0% sehingga harga lebih kompetitif di pasar dunia (Bisnis-Indonesia, 2008)
Minyak sawit mentah juga dapat diolah menjadi berbagai produk hilir seperti oleokimia yang mempunyai nilai jual tinggi. Salah satu alternatif adalah mengolah minyak sawit mentah menjadi biodiesel (Darnoko, 2005). Alasan utama penggunaan bahan bakar biodiesel adalah seiring dengan ketersediaan minyak bumi yang terbatas, salah satu bahan dasar pembuatan biodiesel adalah minyak sawit yang diproduksi sepanjang tahun. Bahan bakar biodiesel merupakan sumber energi alternatif yang ramah lingkungan serta tidak merusak lingkungan (Fauzi, 2004).
Berdasarkan data terakhir yang diperoleh dari United State Department of Agriculture (USDA) pada bulan maret 2009 bahwa produksi total minyak sawit Indonesia adalah 19,7 juta ton yang artinya mengalami peningkatan sekitar 12,5 juta ton atau 174 % dari produksi minyak sawit 10 tahun terakhir (sekitar 7,2 jutan ton) (USDA, 2009)
Minyak mentah dengan kadar asam lemak bebas lebih dari 2% perlu dilakukan penurunan kadar asam lemak bebas hingga lebih kecil dari 2% (Ramadhas, 2005). CPO biasanya mengandung sekitar 5% asam lemak bebas yang akan mengganggu reaksi pembentukan biodiesel, maka asam lemak bebas harus dihilangkan atau dikonversi dengan menggunakan katalis asam melalui reaksi esterifikasi (Prakoso, 2006). Penelitian sebelumnya dilakukan oleh Darnoko pada tahun 2005, dengan melakukan transesterifikasi terhadap RBDPO dengan menggunakan katalis basa KOH 1% berat CPO dengan perbandingan mol metanol dan minyak sawit mentah adalah 6 : 1 pada suhu 50oC dan reaksi berlangsung selama 90 menit.
Penelitian sebelumnya dilakukan oleh Pujo widodo pada tahun 2007, dengan melakukan transesterifikasi terhadap CPO dengan menggunakan katalis asam H2SO4
0.5 % b/b CPO, perbandingan mol metanol : CPO yaitu 6 : 1 (mol/mol) , suhu reaksi 60oC, dan waktu reaksi yaitu 60 menit, menghasilkan yeild tertinggi. Dilanjutkan dengan transesterifikasi basa dengan menggunakan katalis KOH 1% b/b CPO .perbandingan mol metanol : CPO yaitu 9 : 1 (mol/mol) , suhu reaksi 60oC, dan waktu reaksi yaitu 60 menit .
Katalisis homogen kurang efektif. Karena pada katalisis homogen, katalis sukar dipisahkan dari produk dan sisa reaktannya sedangkan katalisis heterogen pemisahan antara katalis dan produknya serta sisa reaktan mudah dipisahkan, dengan demikian, karena mudah dipisahkan dari campuran reaksinya, waktu hidup yang panjang dan kestabilannya terhadap perlakuan panas, katalisis heterogen lebih banyak digunakan dalam industri kimia (Setyawan, 2003). Penelitian yang dilakukan oleh Reddy menghasilkan biodiesel dengan menggunakan nano kalsium oksida dalam kondisi suhu kamar. Tetapi kecepatan reaksi begitu lambat dan membutuhkan 6-24 jam untuk memperoleh konversi (hasil) yang tinggi. Dia juga telah meneliti deaktivitasi setelah tiga kali siklus dengan asam lemak.
Setelah berkurangnya kadar asam lemak bebas pada perlakuan transesterifikasi asam antara minyak sawit mentah dan metanol dengan menggunakan katalis H2SO4
lalu akan dilanjutkan dengan transesterifikasi basa pada produk yang dihasilkan (transesterifikasi dua tahap) menggunakan katalis CaO, sehingga diharapkan akan menghasilkan konversi sempurna pada trigliserida yang terkandung dalam minyak sawit mentah menjadi metil ester (biodiesel).
Adapun permasalahan pada penelitian ini adalah:
1. Bagaimana pengaruh perbandingan mol terhadap yield metil ester yang terbentuk pada transesterifikasi heterogen tahap kedua antara metanol dan sisa CPO dengan menggunakan katalis CaO.
2. Bagaimana pengaruh waktu terhadap yield metil ester yang terbentuk pada transesterifikasi heterogen tahap kedua antara metanol dan sisa CPO dengan menggunakan katalis CaO.
3. Bagaimana pengaruh suhu terhadap yield metil ester yang terbentuk pada transesterifikasi heterogen tahap kedua antara metanol dan sisa CPO dengan menggunakan katalis CaO.
1.10. Pembatasan Masalah
Dalam penelitian ini permasalahan dibatasi pada:
1. Sampel yang digunakan adalah sisa CPO yang berasal dari hasil transesterifikasi CPO dengan metanol menggunakan katalis H2SO4.
a. Transesterifikasi Asam
Perlakuan dengan perbandingan mol metanol : CPO yaitu 1:6 (mol/mol); suhu 60 oC, dan waktu reaksi yaitu 60 menit.
b. Transesterifikasi Basa
Perlakuan dengan berbagai variasi perbandingan mol metanol : sampel yaitu 1:9 sampai 1:13,5 (mol/mol); waktu reaksi yaitu 60 menit sampai 150 menit ; suhu reaksi yaitu 55oC sampai 70oC.
2. Katalis yang digunakan pada transesterifikasi asam adalah H2SO4 0.5% (b/b
CPO), dan pada transesterifikasi basa adalah CaO 8% (b/b sisa CPO).
3. Sisa CPO dan Metil ester yang diperoleh dianalisa dengan instrumen kromatografi gas (GC).
4. Volume Sampel yang digunakan adalah 50 mL.
1.11. Tujuan Penelitian
Tujuan penelitian ini adalah untuk memperoleh gambaran mengenai pengaruh perbandingan mol, waktu reaksi dan suhu reaksi terhadap yield metil ester yang terbentuk pada transesterifikasi heterogen antara metanol dan sisa CPO dengan menggunakan katalis CaO.
1.12. Manfaat Penelitian
Dengan diperolehnya gambaran yang jelas terhadap pengaruh perbandingan mol methanol : sampel, waktu reaksi dan suhu reaksi terhadap yield metil ester yang terbentuk pada transesterifikasi heterogen antara metanol dan sisa CPO dengan katalis CaO maka penelitian ini diharapkan dapat berguna bagi dunia industri, masyarakat dan peneliti sebagai parameter yang sesuai dalam pembuatan metil ester (biodiesel) melalui reaksi transesterifikasi.
1.13. Metodologi Penelitian
Penelitian ini adalah penelitian laboratorium dengan menggunakan Sampel yang diperoleh dari transesterifikasi CPO dan metanol menggunakan katalis H2SO4,
sebagai populasi yang bersifat homogen yang kemudian akan dikonversi menjadi metil ester (biodiesel) melalui reaksi transesterifikasi heterogen dengan pengambilan sampel secara acak sederhana.
Pada proses transesterifikasi asam dilakukan tanpa variasi mol reaktan, suhu reaksi, waktu reaksi ,konsentrasi katalis, kecepatan pengadukan dan volume CPO berfungsi sebagai variabel tetap. Sedangkan proses transesterifikasi basa dilakukan dengan variasi mol reaktan, waktu reaksi dan suhu reaksi.
Pengambilan Data meliput i: 1. Transesterifikasi Basa
a. Pengaruh Perbandingan Mol
Menentukan yield metil ester hasil transesterifikasi dengan variasi perbandingan mol metanol : sisa CPO yaitu 1;9, 1:10,5, 1:12, dan 1:13,5 (mol/mol), dengan suhu tertentu dan waktu tertentu. Menggunakan katalis CaO 8% (b/b sisa CPO) dan pengadukan 800 rpm.
b. Pengaruh waktu
Menentukan yield metil ester hasil transesterifikasi dengan variasi waktu yaitu 60 menit, 90 menit , 120 menit dan 150 menit , dengan perbandingan mol maksimum dan suhu reaksi tertentu. Menggunakan katalis CaO 8% (b/b sisa CPO)
c. Pengaruh Suhu
Menentukan yield metil ester hasil transesterifikasi dengan variasi suhu yaitu 55oC, 60oC, 65oC dan 70oC, dengan perbandingan mol maksimum dan waktu reaksi 120 menit. Menggunakan katalis CaO 8% (b/b sisa CPO) dan pengadukan 800 rpm
2. Replikasi setiap proses dilakukan pengulangan sebanyak dua kali untuk masing-masing sampel.
Analisa data meliputi analisis regresi linear, analisis regresi ganda dua variabel bebas, analisis residu, analisis korelasi Pearson, analisis korelasi ganda dua variabel bebas dan uji signifikansi koefisien korelasi tiga variabel bebas dengan menggunakan aplikasi Software SPSS (Statistical Package for Service Solution) Versi 12.0.
1.14. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Kimia Fisika, Fakultas Matematika dan
BAB 2
TINJAUAN PUSTAKA
2.1. Minyak Kelapa Sawit Mentah (Crude Palm Oil, CPO)
Tanaman kelapa sawit (Elaeis guineensis) dapat menghasilkan dua jenis minyak, yakni: minyak kelapa sawit mentah (CPO) yang diekstraksi dari mesokrap buah kelapa sawit, dan minyak inti sawit (Palm Kernel Oil, PKO) diekstraksi dari biji atau inti kelapa sawit. Minyak kelapa sawit mentah (CPO) dapat diubah menjadi beberapa bentuk, yaitu diantaranya adalah RBDPO (Refined, Bleached, Deodorized Palm Oil), Stearin dan Olein. Stearin adalah fraksi CPO yang berwujud padat pada suhu kamar dan Olein adalah fraksi CPO yang berwujud cair pada suhu kamar.
Minyak kelapa sawit ini diperoleh dari mesokrap buah kelapa sawit melalui ekstraksi dan mengandung sedikit air serta serat halus yang berwarna kuning sampai merah dan berbentuk semi solid pada suhu ruang yang disebabkan oleh kandungan asam lemak jenuh yang tinggi. Dengan adanya air dan serat halus tersebut menyebabkan minyak kelapa sawit mentah tidak dapat langsung digunakan sebagai bahan pangan maupun non pangan (Naibaho, 1988).
2.1.1. Komposisi Minyak Kelapa Sawit Minyak kelapa sawit tersusun atas
asam lemak jenuh penyusun lemak berasal dari sumber hewani, dan asam lemak tak jenuh penyusun minyak berasal dari sumber nabati (Ketaren, 1986).
Asam lemak yang paling dominan pada minyak kelapa sawit adalah Asam palmitat (C16:0 asam lemak jenuh) dan asam oleat (C18:1 asam lemak tak jenuh).
Tabel 2.1. Komposisi asam lemak minyak kelapa sawit (May, 1994)
No
Asam Lemak Persen Kompsosisi (%) Berat
Molekul(gr/mol)
1 Asam Laurat (12:0) 0.0 – 0.4 200.32388
2 Asam Miristat (14:0) 0.6 – 1.7 228.37806
3 Asam Palmitat (16:0) 41.1 – 47.0 256.43224
4 Asam Stearat (18:0) 3.7 – 5.6 284.48642
5 Asam Oleat (18:1) 38.2 – 43.6 282.47048
6 Asam Linoleat (18:2) 6.6 – 11.9 280.45454
7 Asam Linolenat (18:3) 0.0 – 0.6 280.45454
Disamping komponen utama penyusun minyak kelapa sawit berupa asam lemak jenuh dan tak jenuh (stearin dan olein), juga terdapat komponen minor yang terdapat pada minyak kelapa sawit dalam jumlah kecil. Minyak kelapa sawit mengandung sekitar 1% komponen minor diantaranya: karoten, vitamin E (tokoferol dan tokotrienol), sterol, posfolipid, glikolipid, terpen dan hidrokarbon alifatik. (May, 1994).
Tabel 2.2. Komponen minor dari minyak kelapa sawit (Tan, 1981).
1 Karotenoid 500-700
2 Tokoperol dan Tokotrienol 600-1.000
3 Sterol 326-527
4 Phospholipid 5-130
5 Triterpen Alkohol 40-80
6 Metil Sterol 40-80
7 Squalen 200-500
8 Alkohol Alifatik 100-200
9 Hidrokarbon Alifatik 50
lebih besar dibandingkan dengan tomat. Selain itu studi epidemilogi mutakhir menentukan adanya hubungan antara konsumsi pangan kaya karotenoid dengan penurunan terjadinya kanker (May, 1994).
2.1.2. Standar Mutu Minyak Kelapa Sawit
Seiring cukup berperannya minyak kelapa sawit dalam perdagangan dunia, baik industri pangan maupun nonpangan, maka standar mutu dalam perdangangan minyak kelapa sawit perlu dipertimbangkan. Dalam hal ini minyak kelapa sawit harus benar-benar murni dan tidak tercampur dengan minyak nabati lain.
Mutu minyak kelapa sawit yang baik mempunyai kadar air kurang 0,1 persen dan kadar kotoran lebih kecil dari 0,01 persen, kandungan asam lemak bebas serendah mungkin (kurang lebih 2 persen), bilangan peroksida dibawah 2, bebas dari warna merah dan kuning (harus berwarna pucat) tidak berwarna hijau, jernih dan kandungan logam berat serendah mungkin atau bebas dari ion logam (Ketaren, 1986).
Mutu minyak sawit juga dipengaruhi oleh kadar asam lemak bebasnya, karena jika kadar asam lemaknya bebasnya tinggi, maka akan timbul bau tengik di samping juga dapat merusak peralatan karena mengakibatkan timbulnya korosi. Faktor-faktor yang dapat menyebabkan naiknya kadar asam lemak bebas dalam CPO antara lain adalah :
- Kadar air dalam CPO.
- Enzim yang berfungsi sebagai katalis dalam CPO tersebut.
Warna minyak kelapa sawit sangat dipengaruhi oleh kandungan karoten dalam minyak tersebut. Oleh karena itu para produsen berusaha untuk menghilangkannya dengan berbagai cara. Salah satu cara yang digunakan ialah dengan menggunakan bleaching earth (Tambun, 2002).
Kadar air dapat mengakibatkan naiknya kadar asam lemak bebas karena air pada CPO dapat menyebabkan terjadinya hidrolisa pada trigliserida dengan bantuan enzim lipase dalam CPO tersebut. Reaksi hidrolisa dapat menyebabkan kerusakan minyak atau lemak, hal ini terjadi karena terdapatnya sejumlah air dalam minyak atau lemak tersebut, reaksi ini akan mengakibatkan ketengikan pada minyak. (Ketaren, 1986).
suatu analisa terhadap minyak. Analisa pengujian minyak yang dimaksud meliputi: warna atau lovibond, kadar asam lemak bebas (% FFA), bilangan iodin, kadar monogliserida, bilangan peroksida, titik asap (smoke point), kadar logam, kadar air, kadar kotoran, dan moisture (Lawson, 1985).
Faktor-faktor yang mempengaruhi mutu minyak kelapa sawit: 1. Asam Lemak Bebas (Free Fatty Acid).
Asam lemak bebas dalam konsentrasi tinggi dapat menyebabkan ketengikan serta
dapat mengakibatkan turunnya rendeman minyak kelapa sawit.
2. Kadar Zat Menguap dan Kotoran
Dapat menyebabkan terjadinya proses hidrolisa pada minyak kelapa sawit.
3. Kadar Logam
Adanya logam dapat berfungsi sebagai katalisator sehingga dapat menyebabkan
terjadinya reaksi oksidasi pada minyak kelapa sawit.
4. Angka Oksidasi
Proses oksidasi yang disebabkan oleh logam jika berlangsung intensif akan
mengakibatkan ketengikan dan perubahan warna (menjadi semakin gelap).
5. Pemucatan
Kualitas minyak juga dipengaruhi oleh kualitas warna dan konsentrasi bahan pemucat yang digunakan (Tim Penulis PS, 1997).
N
Tabel 2.3. Standar mutu minyak kelapa sawit.
K k i ik K d
1 Asam Lemak Bebas 5%
2 Kadar Kotoran 0,5%
3 Kadar Zat Menguap 0,5%
4 Bilangan Peroksida 6 meq
5 Bilangan Iodin 44 – 58 mg/gr
6 Bilangan Safonifikasi 195-205
7 Kadar Logam 10 ppm
8 Lovibond 3 – 4 R
Sumber : Direktorat Jenderal Perkebunan, 1989
transesterifikasi antara minyak kelapa sawit dengan metanol serta penambahan katalis, baik katalis asam maupun katalis basa. Biodiesel juga dapat diperoleh dari hasil konversi RBDPO dan fraksi-fraksinya seperti stearin dan olein.
Biodiesel yang berasal dari minyak kelapa sawit mempunyai sifat-sifat kimia dan sifat fisika yang sama dengan minyak bumi (petroleum diesel) sehingga dapat digunakan secara langsung untuk mesin diesel dengan melakukan pencampuran dengan bahan bakar petroleum diesel dengan tidak perlu melakukan modifikasi apapun pada mesin diesel (Fauzi, 2004).
2.2. Transesterifikasi
Ester merupakan suatu senyawa turunan asam karboksilat dimana gugus hidroksi dari asam karboksilat digantikan oleh gugus alkoksi. Esterifikasi merupakan reaksi pembentukan ester antara asam karboksilat dan alkohol, esterifikasi adalah reaksi ionik yang merupakan kombinasi dari reaksi adisi dan penyusunan ulang (rearrangement) (Wahyu, 2004).
Reaksi esterifikasi dapat dibagi atas dua jenis, diantaranya adalah sebagai berikut:
1. Esterifikasi langsung, yang merupakan reaksi antara alkohol dengan asam lemak.
RCOOH + R`OH RCOOR` + H2O
Reaksinya merupakan reaksi substitusi nukleofilik gugus asil. Reaksinya tidak langsung secara substitusi, tetapi melalui 2 tahap. Tahap pertama adalah adisi nukleofilik dan diikuti tahap kedua yaitu eliminasi. (Wahyu, 2004).
2. Transesterifikasi, yang meliputi reaksi:
a. Alkoholisis, merupakan reaksi antara ester dengan alkohol membentuk ester yang baru.
RCOOR` + R``OH RCOOR`` + R`OH
b. Asidolisis, merupakan reaksi antara ester dengan asam karboksilat membentuk ester yang baru.
c. Interesterifikasi merupakan suatu reaksi ester dengan ester lainnya atau disebut ester interchange (Sreenivasan, 1978).
Transesterifikasi atau alkoholisis adalah reaksi pertukaran gugus alkohol dari suatu ester dengan ester lain. Kehadiran katalis (asam kuat atau basa kuat) akan mempercepat pembentukan ester. Transesterifikasi dapat dikatalisis oleh asam-asam Brönsted, lebih sering digunakan sulfonat dan asam sulfat (Srivastava, 2000).
Secara umum reaksi transesterifikasi antara trigliserida dan alkohol (metanol) dapat digambarkan sebagai berikut:
Gambar 2.1. Reaksi Transesterifikasi antara trigliserida dan metanol
Reaksi antara minyak atau lemak dengan alkohol merupakan reaksi yang bersifat bolak-balik. Oleh sebab itu alkohol harus ditambahkan berlebih untuk membuat reaksi berjalan kearah kanan (Syah, 2006). Menurut azas Le Chatelier bahwa: “Setiap perubahan pada salah satu variabel sistem keseimbangan akan menggeser posisi keseimbangan kearah tertentu yang akan menetralkan/ meniadakan pengaruh variabel yang berubah tadi” (Bird, 1993).
Biodiesel dapat berupa metil ester atau etil ester tergantung jenis alkohol yang digunakan. Tetapi yang paling sering diproduksi adalah metil ester karena metanol mudah didapat dan tidak mahal (Haryanto, 2000). Metanol lebih reaktif dibandingkan dengan etanol, sehingga penggunaan metanol menghasilkan mono dan diasilgliserol yang relatif lebih rendah dibandingkan dengan penggunaan etanol pada kondisi reaksi yang sama (Freedman, 1984). Biodiesel adalah senyawa mono alkil ester yang diproduksi melalui reaksi transesterifikasi antara trigliserida (minyak nabati seperti minyak kelapa sawit) dengan metanol menjadi metil ester dan gliserol dengan bantuan katalis. Katalis yang digunakan dapat berupa asam (H2SO4, HCl, BF3) atau berupa
basa (alkoksi logam, alkali hidroksida), penggunaan katalis basa akan lebih mempercepat reaksi. Reaksi transesterifikasi merupakan reaksi kesetimbangan sehingga digunakan metanol berlebih untuk menggeser arah reaksi kekanan
Trigliserida Metanol Gliserol Metil Ester
(Yuenmay, 2004). Transesterifikasi dilakukan pada suhu 50oC – 70oC dan pada kondisi tekanan atmosfer. Suhu reaksi pada transesterifikasi minyak kelapa sawit yang sesuai adalah pada 60oC, hal ini disebabkan karena suhu ini mendekati titik didih metanol (65oC) dan titik leleh CPO (55oC), pada suhu ini reaktan akan tercampur secara homogen (Foon, 2004).
Parameter-parameter proses transesterifikasi diantaranya adalah kandungan asam lemak bebas dan zat menguap, perbandingan mol alkohol dengan CPO, jenis alkohol, jenis dan jumlah katalis, suhu, waktu reaksi dan pengadukan. (Meher 2004).
penting untuk memastikan terjadinya reaksi diseluruh bagian reaktor, kecepatan pengaduk sebesar 350 rpm. (Foon, 2004).
Perbandingan mol yang sesuai antara metanol dan CPO pada proses transesterifikasi basa adalah 9:1 (Meher, 2004). Transesterifikasi dengan menggunakan katalis basa dilakukan didalam reaktor curah (batch reactor) pada suhu 60oC. Waktu reaksi yang dibutuhkan untuk mengkonversi trigliserida, digliserida dan monogliserida menjadi metil ester adalah selama 60 menit. Konsentrasi katalis maksimum adalah 1% KOH (b/b CPO) (Cheryan, 2000). Katalis yang umum digunakan dalam transesterifikasi basa adalah NaOH, KOH dan NaOMe. Penggunaan KOH sebagai katalis lebih baik dibanding NaOH. Penggunaan NaOH dan NaOMe dapat menyebabkan pembentukan beberapa produk samping seperti garam natrium (sabun) yang mengendap dan perlu pemisahan lebih lanjut. penggunaan KOH mempunyai keuntungan, pada akhir reaksi dengan penambahan asam posfat sehingga terbentuk kalium posfat yang dapat digunakan sebagai pupuk (Ahn, 1995).
2.2.1. Katalisis Heterogen
Katalis adalah zat yang dapat mempengaruhi kecepatan reaksi tetapi zat tersebut tidak mengalami perubahan kimia pada akhir reaksi. Katalis tidak berpengaruh pada energi bebas ∆G0, jadi juga tidak berpengaruh terhadap tetapan kesetimbangan k. Umumnya kenaikan konsentrasi katalis juga menaikkan kecepatan reaksi, jadi katalis ini ikut dalam reaksi tetapi pada akhir reaksi diperoleh kembali (Sukardjo, 2002).
Keuntungan lain dari katalisis heterogen adalah tidak korosif, ramah terhadap lingkungan, memiliki waktu hidup yang panjang dan dapat memberikan aktifitas dan selektifitas yang tinggi (Gryglewicz, 1998 ; Tanabe, 1999).
Adapun mekanisme reaksi katalisis heterogen secara umum adalah sebagai berikut:
1. Difusi molekul reaktan ke permukaan katalis 2. Adsorpsi reaktan pada permukaan katalis. 3. Reaksi difusi reaktan pada permukaan katalis. 4. Reaksi dalam lapisan adsorpsi.
5. Desorpsi produk reaksi dari permukaan katalis.
6. Abfusi pada produk keluar dari permukaan katalis (Laidler, 1987)
Desorpsi 5 Abfusi
2 6
1
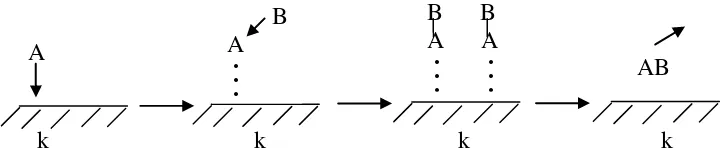
Gambar 2.2. Mekanisme Reaksi Heterogen
Mekanisme katalisis heterogen menurut Langmuir-hinshelwood 1. Atom A dan B teradsorpsi kepermukaan katalis.
2. Atom A dan B berdifusi melalui permukaan. 3. Atom A dan B berinteraksi satu sama lain.
4. Sebuah molekul terbentuk dan terjadi desorpsi (Sariyusriati, 2008).
A B A B . . . . . .
A B . . . .
. . A B
Reaksi
k k k k
Gambar 2.3. Mekanisme katalisis heterogen menurut Langmuir-Hinshelwood
Mekanisme katalisis heterogen menurut Rideal-Eley 1. Atom A diadsorpsi oleh permukaan katalis (k).
Difusi adalah peristiwa mengalirnya / berpindahnya suatu zat dalam pelarut dari bagian berkonsentrasi tinggi ke bagian berkonsentrasi rendah. Proses difusi molekul reaktan kepermukaan atau difusi pada produk desorpsi merupakan proses yang paling lambat dan tidak dapat ditentukan kecuali pada penentuan proses teknik yang melibatkan penyerapan katalis.
2. Atom B lewat, kemudian berinteraksi dengan atom A yang ada dipermukaan katalis (k).
Katalis menyediakan suatu permukaan dimana pereaksi-pereaksi (atau substrat) untuk sementara terjerap.
3. Atom A dan B saling berinteraksi satu sama lain 4. Sebuah molekul terbentuk dan terjadi desorpsi
Terbentuk molekul produk dalam permukaan katalis kemudian terlepas molekul produk dari permukaan katalis. Ikatan dalam substrat-substrat menjadi lemah sehingga memadai terbentuknya produk baru. Ikatan antara produk baru dan katalis lebih lemah sehingga akhirnya terlepas. (Sariyusriati, 2008).
[image:30.595.107.469.505.585.2]k k k k Gambar 2.4. Mekanisme katalisis heterogen menurut Rideal-Eley
Permukaan padatan yang kontak dengan suatu larutan cenderung untuk menghimpun lapisan dari molekul-molekul zat terlarut pada permukaannya akibat ketidakseimbangan gaya-gaya pada permukaan.
Difusi adalah peristiwa mengalirnya / berpindahnya suatu zat dalam pelarut dari bagian berkonsentrasi tinggi ke bagian yang berkonsentrasi rendah. Proses difusi molekul reaktan kepermukaan atau difusi pada produk desorpsi kedalam gas utama
A
B A . . .
B B
A A
. . . .
merupakan proses yang paling lambat dan tidak dapat ditentukan kecuali pada penentuan proses teknik yang melibatkan penyerapan katalis (Laidler, 1987).
Permukaan spesifik, Specific surface yang besar lebih diharapkan karena laju perpindahan massa akan meningkat sehingga akan meningkatkan laju reaksi kimia secara keseluruhan. Permukaan spesifik yang besar ini berhubungan dengan diameter partikel yang kecil dan seluruh permukaan porinya.
Pori yang kecil membatasi kemampuan senyawa mendifusi ke dalam permukaan sebelah dalam, internal surface, demikian juga difusi produk keluar dari pori. Sehingga didalam pemilihan diameter pori dan keseragaman diameter pori untuk menyediakan specific surface dan tahanan difusi didalam permukaan sebelah dalam perlu diperhatikan. Tahanan difusi yang terjadi di dalam katalis disebabkan karena gesekan antar molekul maupun dengan dinding pori.
Proses heterogen selalu melibatkan energi aktivasi yang cukup besar sedang difusi dalam gas tidak melibatkan energi aktivasi. Didalam adsorpsi dan desorpsi sangat lambat didalam poses heterogen karena keduanya melibatkan energi aktivasi yang cukup besar (Laidler,1987).
Secara umum, apabila suatu partikel padat terdispersi dalam suatu media cair, maka partikel tersebut dapat melalui beberapa mekanisme, yaitu :
1. Terjadinya peristiwa adsorpsi yang bersifat selektif terhadap spesies bermuatan yang terdapat didalam dispersi tersebut.
2. Terjadinya peristiwa ionisasi gugus-gugus yang terdapat pada permukaan padatan, sehingga meninggalkan muatan tertentu pada permukaan padat tersebut. Mekanisme ini sering terjadi ketika pada suatu permukaan partikel padat terdapat gugus yang mudah terionisasi, misalnya -COOH (Lestari,2008).
Bila digunakan logam atau oksidanya sebagai katalis maka kita berusaha untuk membuat permukaan yang dapat bekerja secara katalisis sebesar-besarnya. Untuk keperluan itu sering kali dipergunakan pendukung. Pendukung disini adalah dengan permukaan yang besar seperti batu apung, arang aktif oksida, aluminium, kalium oksida dan silikat oleh pelekatan bagian-bagian logam diatas bahan pendukung ini. Permukaan aktif kadang-kadang diperbesar sampai seratus kali lipat atau lebih. Karena itu bobot dari katalis dari yang sesungguhnya kadang-kadang hanya berjumlah sebagaian kecil dari seluruh bobot dari katalis yang sesungguhnya.
Pada umumnya inhibitor adalah suatu zat kimia yang dapat menghambat atau memperlambat suatu reaksi kimia (Surya, 2004). Reaksi permukaan katalis dapat terhambat jika suatu substansi asing berikatan pada sisi aktif katalis sehingga memblok kepada subtrat molekul-molekul. Jenis penghambatan ini disebut peracunan dan penghambat atau katalis negatif tersebut merupakan racun katalis.
Suatu katalis jika sudah terpakai beberapa kali maka aktivitasnya akan berkurang. Ini berarti bahwa kemampuan untuk mempercepat reaksi tertentu telah berkurang. Gejala ini dapat disebabkan oleh beberapa faktor diantaranya oleh suhu yang terlalu tinggi katalis dapat lumer sebagaian atau disenter, penyebab lain yaitu katalis dapat bereaksi dengan produk atau kotoran yang terdapat didalam bahan dasar. Penyebab yang terkenal dari pengurangan aktivitas katalis adalah belerang dan persenyawaan belerang, air lembab (vouch) dan uap minyak dapat dapat dimasukkan kedalam kelompok ini yang dikenal dengan racun katalis atau poisoning catalyst.
Bila setelah beberapa waktu, aktivitas katalis telah turun sampai dibawah minimum yang dapat diterima, katalis itu harus apkir atau berhenti. Beberapa katalis yang tidak aktif dapat diperbaiki kembali dengan jalan regenerasi. Dalam hal ini dipergunakan uap, zat cair, zat asam atau gas lain. Katalis sering juga digenerasi dengan pengolahan memakai asam mineral, dimana logamnya dapat larut (Bergeyk, 1982).
Didalam dunia industri katalis yang digunakan: 1. Harus murni
2. Stabil tehadap panas
5. Tahan terhadap keracunan
6. Kesederhanaan dalam cara pembuatannya 7. Mudah didapat
8. Harganya murah (Leach, 1983).
Pada zaman sekarang ini, banyak sekali jenis katalis padat yang telah digunakan dalam reaksi transesterifikasi minyak nabati menjadi biodisel seperti oksida logam alkali tanah atau campuran logam alkali dengan aluminium dan zeolit namun kebanyakan katalis logam alkali mudah mengalami kerusakan dan memilki waktu hidup yang singkat sementara itu CaO adalah katalis basa yang memiliki waktu hidup yang panjang (Liu, 2008).
2.2.2. Kalsium oksida, CaO
Nama lain dari Kalsium oksida adalah lime, caustic, quicklime atau gamping. CaO merupakan oksida basa yang didapat dari batuan gamping dimana terkandung kalsium oksida sedikitnya 90% dan magnesia 0-5%, kalsium karbonat, silika, alumina, feri oksida terdapat sedikit sebagai ketidakmurnian.
Ditinjau dari komposisinya, ada beberapa jenis gamping. Gamping hidraulik didapat dari pembakaran batu gamping yang mengandung lempung, gamping berkadar kalsium tinggi lebih dimanfaatkan didalam reaksi kimia. Gamping dolomit yang biasanya 35-45% CaO dan 10-25% MgO.
Kalsium karbonat dan juga magnesium didapat dari endapan batu gamping marmer, kapur (chalk), dolomit atau kulit kerang. Untuk tujuan penggunaan kimia, biasanya batu gamping yang agak murni lebih disukai sebagai bahan awal, karena dapat menghasilkan gamping berkadar kalsium tinggi.
Kalsinasi CaCO3 pada suhu 900oC . Reaksinya :
CaCO3(p) CaO(p) + CO2(g)
Sebagaimana ditunjukkan diatas reaksi kalsinasi tersebut bersifat dapat balik. Pada suhu dibawah 650oC tekanan keseimbangan CO2 hasil dekomposisi cukup rendah.
CaO (Massa relatif 56,08 g/mol) memilki sifat higroskopis, titik lelehnya 2600oC dan titik didihnya 2850oC, tidak larut dalam HCl, struktur kristalnya oktahedral, memiliki luas permukaannya 0,56 m2/g (West, 1984).
CaO biasanya digunakan sebagai mortar, industri pupuk, industri kertas, industri semen, pemutih (bleaching) dan sebagai katalis (Austin, 1984 ; Liu, 2008). CaO memiliki sisi-sisi yang bersifat basa dan CaO telah diteliti sebagai katalis basa yang kuat dimana untuk menghasilkan biodiesel menggunakan CaO sebagai katalis basa mempunyai banyak manfaat, misalnya aktivitas yang tinggi, kondisi reaksi yang rendah, masa katalis yang lama, serta biaya katalis yang rendah. Reddy menghasilkan biodiesel dengan menggunakan nano kalsium oksida dalam kondisi suhu kamar. Tetapi kecepatan reaksi begitu lambat dan membutuhkan 6-24 jam untuk memperoleh konversi (hasil) yang tinggi. Dia juga telah meneliti deaktivitasi setelah tiga kali siklus dengan asam lemak. Zhu memperoleh 93% hasil dari minyak jarak pagar menggunakan CaO sebagai katalis tetapi katalis tersebut harus direaksikan dengan larutan amonium karbonat dan dikalsinasi pada suhu yang tinggi (Liu, 2008).
Zhang et al,1988, menemukan bahwa air menyebabkan peningkatan aktivitas dan selektivitas alkohol aseton ketika MgO digunakan sebagai basa. Mereka menduga bahwa ion OH- merupakan sisi aktif dalam adisi aldol pada aseton. Baru baru ini aktivitas katalitik CaO dalam reaksi transesterifikasi minyak kedelai menjadi biodiesel meningkat dengan penambahan sedikit air dalam metanol
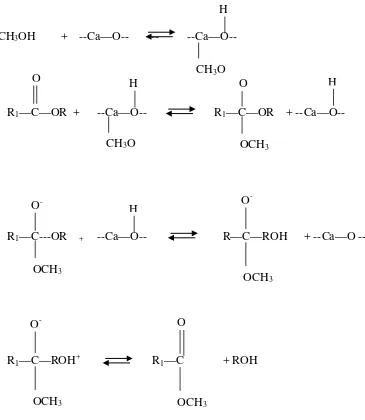
Mekanisme reaksi transesterifikasi padat dengan katalis basa CaO di dalam penambahan sedikit air :
CaO sebagai katalisis heterogen, dimana O2- bereaksi dengan H+ dari H2O
untuk membentuk OH -, direaksikan lebih mudah oleh reaktan pada reaksi kimia. Kemudian OH- direaksikan dengan H+ dari metanol untuk membentuk metoksi anion dan Air. Metoksi anion merupakan sisi aktif.
Mekanisme transesterifikasi gliserida untuk menghasilkan biodiesel yaitu : 1. Metoksi anion meyerang karbon yang terikat dengan karbonil dari molekul trigliserida untuk membentuk zat antara tetrahedral
2. Tetrahedral intermediate mengambil H+ dari CaO .Tetrahedral metoksi juga dapat bereaksi dengan metanol untuk membentuk metoksi anion 3. Langkah terakhir adalah pengaturan kembali zat antara tetrahedral yang
CH3OH + --Ca—O-- -- --Ca—O--
R1—C—OR + --Ca—O-- R1—C—OR + --Ca—O--
R1—C---OR + --Ca—O-- R—C—ROH + --Ca—O --
[image:35.595.119.484.84.504.2]R1—C—ROH+ R1—C + ROH
Gambar 2.5. Mekanisme reaksi transesterifikasi basa heterogen dengan katalis CaO
2.3. Biodiesel
Biodiesel merupakan bahan bakar mesin diesel yang berupa ester metil/etil asam-asam lemak yang berasal dari sumber daya hayati atau monoalkil ester dari asam-asam lemak rantai panjang yang diturunkan dari bahan yang dapat diperbaharui, seperti minyak tumbuhan dan lemak hewan. Biodiesel merupakan metil ester asam lemak yang diperoleh dengan cara transesterifikasi trigliserida dari minyak tumbuhan dengan metanol.
O
CH3O
H
OCH3
O H
OCH3
O- H
OCH3
O
-OCH3
O
-OCH3
O
CH3O
Pada prinsipnya, proses transesterifikasi adalah mengeluarkan gliserin dari minyak dan mereaksikan asam lemak bebasnya dengan alkohol (biasanya metanol) menjadi alkohol ester (Fatty Acid Methyl Ester) atau biodiesel. Reaksi antar senyawa ester misal CPO dengan senyawa alkohol (metanol) memerlukan katalis untuk mempercepat reaksinya. Reaksi alkoholisis merupakan reaksi setimbang, pergeseran reaksi ke kanan biasanya dilakukan dengan menggunakan alkohol berlebih. Dalam reaksi alkoholisis, alkohol bereaksi dengan ester dan menghasilkan ester baru. Reaksi ini merupakan reaksi dapat balik yang pada suhu kamar tanpa bantuan katalisator akan berlangsung sangat lambat (Meher, 2004).
2.3.1. Kunggulan Biodiesel
Biodiesel juga bersifat biodegradable dan tidak beracun, disamping itu juga biodiesel memiliki flash point (temperatur terendah yang dapat menyebabkan uap biodiesel dapat menyala) yang tinggi daripada diesel normal, sehingga tidak menyebabkan mudah terbakar. Biodiesel juga menambah pelumasan mesin, menambah ketahanan mesin dan mengurangi frekuensi pergantian mesin. Keuntungan lain dari biodiesel yang cukup signifikan adalah sifat emisi yang rendah dan mengandung oksigen sekitar 10-11% (Lotero, 2004)
Pengembangan palm biodiesel yang berbahan baku minyak kelapa sawit terus dilakukan karena selain untuk mengantisipasi cadangan minyak bumi yang semakin terbatas, produk biodiesel juga termasuk produk yang ramah lingkungan.
Penggunaan biodiesel juga akan meningkatkan kualitas udara lokal dengan mereduksi emisi gas berbahaya, seperti karbon monooksida (CO), ozon (O3), nitrogen
oksida (NOx), sulfur dioksida (SO2), dan hidrokarbon reaktif lainnya, serta asap dan
partikel yang dapat terhirup. Hasil pengamatan menunjukkan bahwa kadar emisi gas buang seperti CO, CO2, NOx, SO2, dan hidrokarbon dari bahan bakar campuran palm
biodiesel dan solar lebih rendah dibandingkan dengan bahan bakar solar murni. (Tim Peneliti PPKS Medan).
teroksigenasi relatif sempurna atau terbakar habis, nontoksik dan dapat terurai secara alami (biodegradable).
Palm biodiesel dibuat dengan menggunakan bahan baku minyak kelapa sawit (CPO), produksinya dapat dilakukan melalui transesterifikasi minyak kelapa sawit dengan metanol. Proses ini dianggap lebih efisien dan ekonomis bila dibandingkan dengan cara esterifikasi hidrolisis dengan metanol (Fauzi, 2004).
2.3.2. Sifat Fisik Bahan Bakar Diesel
Sifat sifat penting dari bahan bakar mesin diesel antara lain adalah viskositas, pour point, flash point, carbon residue, bilangan setana (cetane number) dan nilai kalor.
Viskositas merupakan sifat fisik yang penting bagi bahan bakar mesin diesel. Viskositas yang terlalu tinggi dapat mempersulit proses pembentukan butir – butir cairan/ kabut saat penyemprotan/ atomisasi. Viskositas bahan bakar yang terlalu rendah akan dapat mengakibatkan kebocoran pada pompa injeksi bahan bakar. Kedua hal yang ekstrim ini dapat menimbulkan kerugian, sehingga salah satu persyaratan bahan bakar mesin diesel adalah nilai viskositas standar bahan bakar mesin diesel.
Pour point atau titik tuang adalah suhu terendah dimana bahan bakar dapat dialirkan. Untuk daerah bersuhu rendah, bahan bakar dipersyaratkan tidak membeku. Titik tuang yang terlalu tinggi akan menyebabkan kesulitan pada pengaliran bahan bakar.
Titik nyala atau flash point adalah suhu terendah dimana bahan bakar dalam campurannya dengan udara akan menyala. Bila nyala tersebut terjadi secara terus menerus maka suhu tersebut dinamakan titik bakar (fire point). Titik nyala yang terlampau tinggi dapat menyebabkan keterlambatan penyalaan, sementara apabila titik nyala terlampau rendah akan menyebabkan timbulnya detonasi yaitu ledakan – ledakan kecil yang terjadi sebelum bahan bakar masuk ruang bakar. Hal ini juga dapat meningkatkan resiko bahaya pada saat penyimpanan.
Warna bahan bakar tidak secara langsung berpengaruh terhadap kinerja motor/ mesin diesel. Warna yang terlalu terang, dapat dikoreksi dengan penambahan zat warna tertentu sehingga masuk dalam standar warna bahan bakar mesin diesel.
Nilai kalor bahan bakar menentukan jumlah konsumsi bahan bakar tiap satuan waktu. Makin tinggi nilai kalor bahan bakar menunjukkan bahan bakar tersebut semakin sedikit pemakaiannya. Tidak ada standar khusus yang menentukan nilai kalor minimal yang harus dimiliki oleh bahan bakar mesin diesel. Konsumsi mesin diesel memerlukan energi sebesar 40.1 MJ/Kg.
Bilangan Setana adalah ukuran kualitas penyalaan sebuah bahan bakar diesel dalam keadaan terkompresi. Bilangan setana dari minyak diesel konvensional dipengaruhi oleh struktur molekul hidrokarbon penyusun. Normal parafin dengan rantai panjang mempunyai bilangan setana lebih besar daripada sikloparafin, isoparafin, olefin dan aromatik. Bilangan setana dari bodiesel juga sangat bervariasi. Bahan bakar untuk mesin diesel harus mempunyai bilangan setana 40 atau lebih tinggi. Metil ester dari asam lemak palmitat dan stearat mempunyai bilangan setana hingga 75, sedangkan bilangan setana untuk linoleat hanya mencapai 33. Semakin rendah bilangan setana maka semakin rendah pula kualitas penyalaannya karena memerlukan suhu penyalaan yang lebih tinggi (Hendartomo, 2006)
2.3.3. Standar Biodiesel
Standar biodiesel menurut Standar Biodiesel Nasional (SNI 04-7182-2006) : Tabel 2.4. Standar Biodiesel Nasional (SNI 04-7182-2006)
No Parameter Unit Bilangan
1 Densitas, Density (40oC) kg/m3 850 – 890
2 Viskositas, Viscosity (40oC) mm2/s (cSt) 2.3 – 6.0
3 Bilangan Setana, Cetane Number - min. 51
4 Titik Nyala, Flash Point(close cup) oC min. 100
6 Korosi Tembaga, Copper Strip Corrosion
(3 jam, 50 oC) - max. no 3
7 Residu Karbon, Carbon Residue % mass max. 0.05
8 Air dan Endapan, Water and Sediment % vol max. 0.05 9 Suhu Destilasi, Distillation Temperature,
90% recovered
o
C max. 360
10 Abu Sulfat, Sulfated Ash % mass max. 0.02
11 Sulfur ppm (mg/kg) max. 100
12 Kandungan Posfor, Phosporus Content ppm (mg/kg) max. 10
13 Bilangan Asam, Acid Number mg-KOH/g max. 0.8
14 Gliserin Bebas, Free Gliceryn % mass max. 0.02
BAB 3
BAHAN DAN METODE PENELITIAN
Penelitian ini adalah merupakan penelitian yang dilakukan di laboratorium (expriment laboratory) dan termasuk kedalam kategori field research.
3.1. Bahan – Bahan dan Alat – Alat Penelitian 3.1.1. Bahan – Bahan Penelitian
Bahan dasar penelitian ini adalah Minyak sawit mentah, CPO yang diperoleh dari PT.PALMCOCO LABORATORIES. Adapun komposisi dari Minyak sawit mentah, CPO ditampilkan dalam tabel 3.1.
Tabel 3.1. Komposisi Minyak Sawit Mentah, CPO
Nomor CPO
% Berat
Rumus Nama
1 12:0 Laurat 0.17
2 14:0 Myristat 1.02
3 16:0 Palmitat 42.22
4 18:0 Stearat 4.20
5 18:1 Oleat 37.67
6 18:2 Linoleat 13.87
7 18:3 Linoleneat 0.49
8 20:0 Arachidat 0.33
9 Kadar air 0.19
Tabel 3.2. Bahan-bahan penelitian
Nama Bahan Spesifikasi Merek
Alkohol Teknis 96% Bratachem
Fenolftalein p.a.98% E. Merck
H2SO4 (p) p.a. 95 % - 97 % E. Merck
CaO p.a. 98 % E. Merck
Metanol p.a. 99,8 % E. Merck
n-Heksan p.a. 99 % E. Merck
Na2SO4 Anhidrat p.a. 99,5 % E. Merck
KOH Pelet E. Merck
3.1.2. Alat – Alat Penelitian
Sedangkan alat – alat yang digunakan disusun dalam tabel tabel 3.3. Tabel 3.3. Alat-alat penelitian
Nama Alat Spesifikasi Merek
Instrumen Kromatografi Gas Kolom: SGE BPX70 Detektor : FID
Agilent Technologies
Labu Leher Tiga 250 mL Pyrex
Neraca Analitis (presisi ± 0.0001 gr) Mettler AE-200 Swiss
Oven 30 – 200 oC Precision Scientific
Pemanas dan Pengaduk 0-1200 rpm Fisher Scientific
Pendingin Liebig - Pyrex
Pengaduk Magnet - -
Piknometer 2 mL Pyrex
Rotari Evaporator 30 – 100 oC Heidolph WB 2000
Termometer 0 – 110 oC Silber Brand
Viskosimeter Oswald - Pyrex
Penelitian ini didesain sebagai berikut : A.. Preparasi katalis
Bahan yang digunakan adalah CaO produksi Merck CAS-No. (1305-78-8).
Preparasi Kalsium Oksida, CaO
CaO harus dihaluskan terlebih dahulu dengan menggunakan lumpang dan alu yang terbuat dari porselin sampai terbentuk serbuk, kemudian serbuk CaO tersebut diletakkan diatas permukaan cawan penguap dengan ketebalan ± 1 mm. Untuk menghilangkan kadar air yang masih terkandung didalam CaO maka serbuk CaO dimasukkan kedalam oven dan dikeringkan pada suhu 110oC selama 60 menit, kemudian disimpan dalam desikator.
B. Populasi
Dalam penelitian ini yang digunakan sebagai populasi adalah sisa CPO dari transesterifikasi CPO dengan metanol menggunakan katalis H2SO4.
C. Variabel-Variabel Penelitian
1. Variabel bebas : - perbandingan mol reaktan - waktu reaksi
- suhu reaksi 2. Variabel terikat: - yield metil ester 3. Variabel tetap : - konsentrasi katalis
- kecepatan pengadukan - volume sisa CPO
D. Pengambilan Data
4. Transesterifikasi Basa
Menentukan yield metil ester hasil transesterifikasi dengan variasi perbandingan mol CPO dengan Metanol yaitu 1:9, 1:10.5, 1:12 dan 1:13.5 (mol/mol), dengan waktu tertentu dan suhu tertentu. Menggunakan katalis CaO 8% (b/b sisa CPO) dan pengadukan 800 rpm.
b. Pengaruh Waktu
Menentukan yield metil ester hasil transesterifikasi dengan variasi waktu 60 menit, 90 menit, 120 menit, dan 150 menit, dengan perbandingan mol maksimum dan suhu reaksi tertentu. Menggunakan katalis CaO 8% (b/b sisa CPO) dan pengadukan 800 rpm.
c. Pengaruh Suhu
Menentukan yield metil ester hasil transesterifikasi dengan variasi suhu yaitu 55oC, 60oC, 65oC dan 70oC, dengan perbandingan mol maksimum dan waktu reaksi 120 menit. Menggunakan katalis CaO 8% (b/b sisa CPO) dan pengadukan 800 rpm.
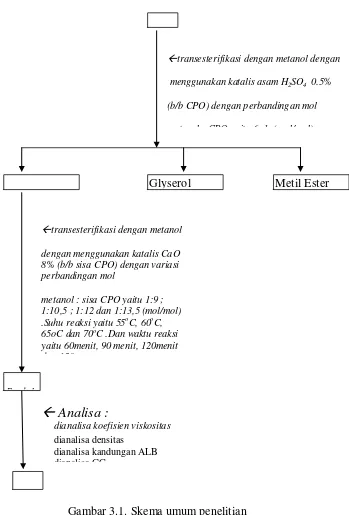
transesterifikasi dengan metanol dengan
menggunakan katalis asam H2SO4 0.5%
(b/b CPO) dengan perbandingan mol
t l CPO it 6 1 ( l/ l)
transesterifikasi dengan metanol
dengan menggunakan katalis CaO 8% (b/b sisa CPO) dengan variasi perbandingan mol
metanol : sisa CPO yaitu 1:9 ; 1:10,5 ; 1:12 dan 1:13,5 (mol/mol) .Suhu reaksi yaitu 55oC, 60oC, 65oC dan 70oC .Dan waktu reaksi yaitu 60menit, 90 menit, 120menit d 150
Analisa :
dianalisa koefisien viskositas dianalisa densitas
dianalisa kandungan ALB dianalisa GC
3.3. Metode Penelitian 3.3.1. Skema Penelitian 3.3.1.1. Skema Umum
[image:44.595.140.489.230.745.2]Penelitian ini dilakukan menurut bagan alir yang terlihat pada gambar (3.1) berikut dan skema proses transesterifikasi lebih terperinci dapat dilihat pada diagram alir (Gambar 3.2).
Gambar 3.1. Skema umum penelitian
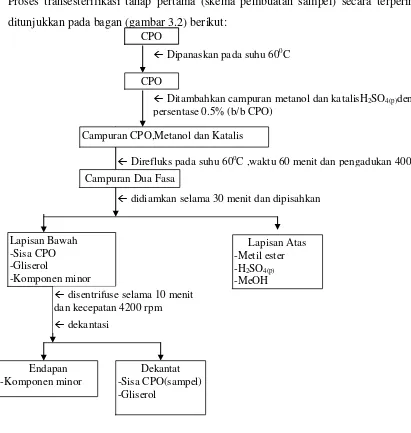
P d k
3.3.1.2.Proses Transesterifikasi Tahap Pertama (skema pembuatan sampel) Proses transesterifikasi tahap pertama (skema pembuatan sampel) secara terperinci ditunjukkan pada bagan (gambar 3.2) berikut:
[image:45.595.82.493.98.531.2]
Gambar 3.2. Proses transesterifikasi tahap pertama (skema pembuatan sampel) CPO
Dipanaskan pada suhu 600C
Ditambahkan campuran metanol dan katalisH2SO4(p)dengan
persentase 0.5% (b/b CPO)
Direfluks pada suhu 60oC ,waktu 60 menit dan pengadukan 400 rpm
didiamkan selama 30 menit dan dipisahkan
Lapisan Bawah -Sisa CPO -Gliserol
-Komponen minor
Campuran CPO,Metanol dan Katalis
Campuran Dua Fasa
Lapisan Atas -Metil ester -H2SO4(p)
-MeOH
Endapan -Komponen minor
Dekantat -Sisa CPO(sampel) -Gliserol
disentrifuse selama 10 menit dan kecepatan 4200 rpm
CPO
CPO
3.3.1.3.Proses Transesterifikasi Heterogen antara Sisa CPO dan Metanol Menggunakan Katalis CaO
[image:46.595.90.500.174.679.2]Proses transesterifikasi heterogen antara sisa CPO dan metanol menggunakan katalis CaO (skema pembuatan metil ester tahap kedua) secara terperinci ditunjukkan pada bagan (gambar 3.3) berikut:
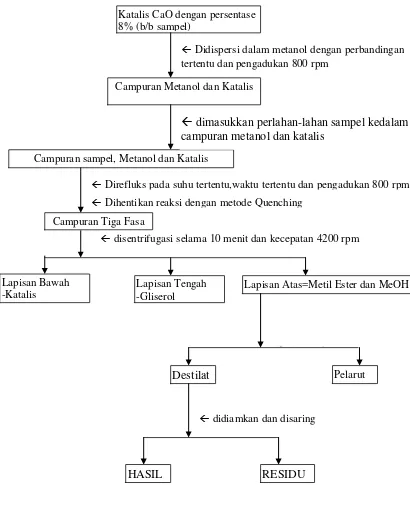
Gambar 3.3. Proses transesterifikasi heterogen antara sisa CPO dan metanol menggunakan katalis CaO (skema pembuatan metil ester tahap kedua)
3.3.2. Pembuatan Reagen
Katalis CaO dengan persentase 8% (b/b sampel)
Didispersi dalam metanol dengan perbandingan tertentu dan pengadukan 800 rpm
Campuran Metanol dan Katalis
Campuran sampel, Metanol dan Katalis
Direfluks pada suhu tertentu,waktu tertentu dan pengadukan 800 rpm
Campuran Tiga Fasa
disentrifugasi selama 10 menit dan kecepatan 4200 rpm
Lapisan Bawah -Katalis
Lapisan Tengah -Gliserol
Lapisan Atas=Metil Ester dan MeOH
d
k
Destilat Pelarut
d
b hk
d
SO
didiamkan dan disaring
RESIDU HASIL
Dihentikan reaksi dengan metode Quenching
3.3.2.1. Larutan Pencuci
Larutan pencuci dibuat dengan melarutkan 10 gram kalium bikromat dalam 200 mL
asam sulfat pekat, kemudian ditambah dengan 7,5 mL akuades, dikocok, disimpan
dalam botol berwarna gelap dan didiamkan satu malam sebelum digunakan.
3.3.2.2. Larutan KOH 0,1N
Sejumlah 2,8053 gr KOH pelet dilarutkan dengan akuades dalam labu takar 500 mL
sampai garis tanda dan dikocok sampai homogen.
3.3.2.3. Larutan Indikator Fenolftalein
Sejumlah 0,5 gr fenolftalein dilarutkan dengan etanol 70% dalam labu takar 50 mL sampai garis tanda.
3.3.2.4. Larutan Alkohol Netral
Sebanyak 200 mL alkohol 96 %, ditambahkan 4 tetes indikator fenolftalein dan dititrasi dengan larutan KOH 0,1 N hingga larutan menjadi berwarna merah muda kemudian larutan tersebut didiamkan hingga berubah menjadi jernih kembali.
3.3.2.5. Larutan H2C2O4 0,1N
Sejumlah 6,3033 gr kristal H2C2O4.2H2O dilarutkan dengan akuades dalam labu takar
500 mL sampai garis tanda dan dikocok sampai homogen. 3.3.2.6. Standardisasi Larutan KOH 0.1N
Dipipet sebanyak 5 mL KOH 0,1N dimasukkan kedalam gelas Erlenmeyer, ditambahkan dengan 3 tetes indikator Fenolftalein, kemudian dititrasi dengan menggunakan larutan H2C2O4.2H2O 0,1N sampai terjadi perubahan warna dari bening
menjadi merah muda.
3.3.3. Pengambilan Data
3.3.3.1. Penentuan Kadar Air pada CPO
1. Keringkan cawan dalam oven pada suhu 103oC sedikitnya 15 menit, dinginkan dalam desikator, lalu timbang.
2. Lelehkan CPO dengan pemanasan pada suhu 45oC sampai 50oC dan aduk rata. 3. Timbang 5 gram contoh uji CPO yang sudah dilelehkan tersebut kedalam wadah
yang sudah dikeringkan tadi.
5. Panaskan dalam oven pada suhu 130oC selama 30 menit, kemudian segera masukkan kedalam desikator, dinginkan selama 15 menit, lalu timbang.
6. Ulangi pemanasan dalam oven selama 30 menit, pendinginan dalam desikator dan penimbangan beberapa kali, sampai selisih berat antara 2 penimbangan berturut-turut tidak melebihi 0.02% dari berat contoh uji. (ASTM D 1796).
3.3.3.2. Proses Transesterifikasi
3.3.3.2.1. Proses Transesterifikasi Asam atau Proses Pembuatan Sampel
1. Dimasukkan 100 mL CPO kedalam labu leher tiga lalu dipanaskan hingga mencapai suhu 60oC.
2. Dimasukkan metanol (1:6 mol/mol CPO) kedalam gelas beaker lalu ditambahkan 0,25 mL H2SO4(p) (0,5% b/b CPO) setetes demi setetes dan diaduk hingga
homogen selanjutnya ditambahkan kedalam CPO dalam labu leher tiga.
3. Direfluks selama 60 menit pada suhu 60oC dengan kecepatan pengadukan konstan 400 rpm.
4. Hasil refluks dimasukkan kedalam corong pisah dan didiamkan selama 30 menit sehingga fasa gliserol terpisah dengan fasa metil ester.
5. Fasa metil ester dicuci dengan 10% (v/v) akuades hangat yang suhunya sekitar 50oC hingga larutan pencuci bersifat netral lalu didiamkan hingga terbentuk 2 fasa.
6. Fasa metil ester dipisahkan dalam rotavapor vakum sehingga pelarut terpisah dengan fasa metil ester, lalu ditambahkan dengan 0,1 gr Na2SO4 anhidrat dan
didiamkan selama 1 jam selanjutya disaring.
7. Metil ester murni dianalisa kandungan asam lemak bebas, densitas, viskositas dan konsentrasi metil ester. (ASTM D 6751).
3.3.3.2.2. Proses Transesterifikasi Basa Dengan Katalis CaO 7. Pengaruh Perbandingan Mol
1. Dimasukkan metanol (1:9 mol/mol sisa CPO) kedalam labu leher tiga lalu ditambahkan 3.56 gram CaO ( 8% b/b sisa CPO), diaduk hingga homogen dengan menggunkan magnetik stirer dengan kecepatan konstan 800 rpm. 2. Diteteskan setetes demi setetes 50 ml sisa CPO kedalam labu leher tiga lalu
3. Direfluks selama waktu tertentu dan pada suhu tertentu dengan kecepatan pengadukan konstan 800 rpm.
4. Dihentikan reaksi dengan metode Quenching untuk menghentikan jalannya reaksi dengan mengalirkan air es kedalam kondensor.
5. Hasil refluks dimasukkan kedalam corong pisah dan didiamkan selama 30 menit sehingga terbentuk campuran tiga fasa.
6. Campuran tiga fasa disentrifuse selama 10 menit dengan kecepatan 4200 rpm sehingga fasa gliserol dan campuran katalis terpisah dengan fasa metil ester. 7. Fasa metil ester dicuci dengan 10% (v/v) akuades hangat yang suhunya sekitar
50oC hingga larutan pencuci bersifat netral lalu didiamkan hingga terbentuk 2 fasa.
8. Fasa metil ester dipisahkan dalam rotavapor vakum sehingga pelarut terpisah dengan fasa metil ester, lalu ditambahkan dengan 0,1 gr Na2SO4 anhidrat dan
didiamkan selama 1 jam selanjutya disaring.
9. Metil ester murni dianalisa kandungan asam lemak bebas, densitas, viskositas dan konsentrasi metil ester.
10.Perlakuan yang sama untuk variasi perbandingan mol metanol dan sisa CPO yaitu 1:10.5, 1:12 dan 1:13,5 (mol/mol). (ASTM D 6751).
2. Pengaruh Waktu
1. Dimasukkan metanol (sesuai dengan perbandingan mol maksimum) kedalam labu leher tiga lalu ditambahkan 3.56 gram CaO ( 8% b/b sisa CPO), diaduk hingga homogen dengan menggunkan magnetik stirer dengan kecepatan konstan 800 rpm.
2. Diteteskan setetes demi setetes 50 ml sisa CPO kedalam labu leher tiga lalu dipanaskan hingga mencapai suhu tertentu.
3. Direfluks selama 60 menit pada suhu tertentu dengan kecepatan pengadukan konstan 800 rpm.
4. Dihentikan reaksi dengan metode Quenching untuk menghentikan jalannya reaksi dengan mengalirkan air es kedalam kondensor.
5. Hasil refluks dimasukkan kedalam corong pisah dan didiamkan selama 30 menit sehingga terbentuk campuran tiga fasa.
7. Fasa metil ester dicuci dengan 10% (v/v) akuades hangat yang suhunya sekitar 50oC hingga larutan pencuci bersifat netral lalu didiamkan hingga terbentuk 2 fasa.
8. Fasa metil ester dipisahkan dalam rotavapor vakum sehingga pelarut terpisah dengan fasa metil ester, lalu ditambahkan dengan 0,1 gr Na2SO4 anhidrat dan
didiamkan selama 1 jam selanjutya disaring.
9. Metil ester murni dianalisa kandungan asam lemak bebas, densitas, viskositas dan konsentrasi metil ester.
10.Perlakuan yang sama untuk variasi waktu 90 memit, 120 menit dan 150 menit. (ASTM D 1298).
3. Pengaruh Suhu
1. Dimasukkan metanol (sesuai dengan perbandingan mol maksimum) kedalam labu leher tiga lalu ditambahkan 3.56 gram CaO ( 8% b/b sisa CPO), diaduk hingga homogen dengan menggunkan magnetik stirer dengan kecepatan konstan 800 rpm.
2. Diteteskan setetes demi setetes 50 ml sisa CPO kedalam labu leher tiga lalu dipanaskan hingga mencapai suhu 600C.
3. Direfluks selama (sesuai dengan waktu maksimum) pada suhu 550C dengan kecepatan pengadukan konstan 800 rpm.
4. Dihentikan reaksi dengan metode Quenching untuk menghentikan jalannya reaksi dengan mengalirkan air es kedalam kondensor.
5. Hasil refluks dimasukkan kedalam corong pisah dan didiamkan selama 30 menit sehingga terbentuk campuran tiga fasa.
6. Campuran tiga fasa disentrifuse selama 10 menit dengan kecepatan 4200 rpm sehingga fasa gliserol dan campuran katalis terpisah dengan fasa metil ester. 7. Fasa metil ester dicuci dengan 10% (v/v) akuades hangat yang suhunya sekitar
50oC hingga larutan pencuci bersifat netral lalu didiamkan hingga terbentuk 2 fasa.
8. Fasa metil ester dipisahkan dalam rotavapor vakum sehingga pelarut terpisah dengan fasa metil ester, lalu ditambahkan dengan 0,1 gr Na2SO4 anhidrat dan
didiamkan selama 1 jam selanjutya disaring.
10.Perlakuan yang sama untuk variasi suhu 60oC, 650C dan 700C. (ASTM D 445).
3.3.4. Karakterisasi Produk 3.3.4.1. Penentuan Kadar Air CPO
Sebanyak 5 gram sampel dimasukkan kedalam cawan yang telah dikeringkan. Kemudian dipanaskan pada suhu 130oC selama 3 jam. Dihitung kadar air yang hilang.
Kadar air dari sampel dihitung berdasarkan rumus berikut:
100% ) 1 ( ) 2 1 ( W W W W Air Kadar − −
= ……. ... (3.0)
dimana W = berat wadah (g)
W1= berat wadah dengan contoh (g)
W2 = berat wadah contoh uji setelah dikeringkan (g) (ASTM D1796)
3.3.4.2. Penentuan Kadar Asam Lemak Bebas
Sebanyak 1 gr sampel dimasukkan kedalam gelas Erlenmeyer. Kemudian ditambahkan 20 mL n-heksan dan 20 mL alkohol netral. Ditambahkan 3 tetes indikator fenolftalein lalu dititrasi dengan larutan KOH 0,1 N hingga warna larutan berubah dari bening menjadi merah muda. Dihitung volume KOH yang terpakai.
Kadar asam lemak bebas dari sampel dihitung berdasarkan rumus berikut: % 100 1000 256 ) (% sampel KOH KOH g x x N x mL ALB Bebas Lemak Asam
Kadar = ... (3.1)
atau : sampel KOH KOH g x N x mL Asam
Bilangan = 56.1 ... (3.2)
dimana mLKOH = volume KOH yang diperlukan untuk titrasi, NKOH = konsentrasi
KOH, gsampel = massa CPO yang digunakan (ASTM D 664).
3.3.4.3. Penentuan Densitas
Mula-mula piknometer kosong yang kering dan bersih ditimbang beratnya. Kemudian
piknometer harus dalam keadaan bersih lalu ditimbang beratnya. Dilakukan
pengulangan sebanyak 3 kali.
Densitas dari sampel dapat dihitung berdasarkan persamaan berikut:
piknometer
osong k piknometer sampel
piknometer V
m m
Densitas(ρ)= + − ... (3.3) dimana m = massa dan V = volume (ASTM D1298)
3.3.4.4. Penentuan Koefisien Viskositas
Dimasukkan 10 mL aquades kedalam Viskosimeter Oswald, lalu dihisap larutan
dengan bola karet penghisap hingga melewati batas atas viskosimeter, dihitung waktu
yang dibutuhkan oleh larutan untuk mengalir dari batas atas hingga batas bawah.
Dilakukan pengulangan sebanyak 3 kali. Perlakuan yang sama dilakukan pada sampel
yang akan dihitung nilai viskositasnya.
Koefisien viskositas dari sampel dapat dihitung dengan cara
membandingkannya dengan nilai viskositas akuades yang telah diukur terlebih dahulu
waktu alirnya, berdasarkan persamaan berikut:
aquades sampel
sampel
aquades aquades
sampel x
t t
η
ρ
ρ
η
× ×
= ... (3.4)
dimana ρ = densitas (gr/cm3), t = waktu alir sampel (detik) dan η = viskositas
(cSt). Koefisien viskositas aquades pada suhu 40oC ; =0,6407mm2/s
( )
cSt aquadesη (ASTM D445)
3.3.4.5. Penentuan Komposisi Asam Lemak Bebas
Penentuan Kadar produk metil ester menggunakan instrumen kromatografi gas
Agilent Technologies yang didukung dengan perangkat lunak AgilentTechnologies
Coorporation. Volume sampel sebanyak 2 μliter, kolom yang digunakan adalah SGE
detektor Flame Ionization Detector (FID). Analisis yang dilakukan yaitu analisis
kandungan asam lem