ISOLASI DAN UJI KEMAMPUAN BAKTERI ENDOFIT DIAZOTROF YANG MEMFIKSASI NITROGEN BEBAS PADA AKAR KELAPA
SAWIT (Elaeis guineensis Jaqc.)
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
MISFALLA FIRRANI 070805016
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
ISOLASI DAN UJI KEMAMPUAN BAKTERI ENDOFIT DIAZOTROF YANG MEMFIKSASI NITROGEN BEBAS PADA AKAR KELAPA SAWIT
(Elaeis guineensis Jaqc.)
SKRIPSI
OLEH:
MISFALLA FIRRANI 070805016
Pembimbing 2 Pembimbing 1
Drs. Kiki Nurtjahja, M.Sc. Prof. Dr. Dwi Suryanto, M. Sc NIP. 196212111998031001 NIP. 196404091994031003
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : ISOLASI DAN UJI KEMAMPUAN BAKTERI
ENDOFIT DIAZOTROF YANG MEMFIKSASI NITROGEN BEBAS DARI AKAR KELAPA SAWIT (Elaeis guineensis Jacq.)
Kategori : SKRIPSI
Nama : MISFALLA FIRRANI
Nomor Induk Mahasiswa : 070805016
Program Studi : SARJANA (S1) BIOLOGI
Departemen : BIOLOGI
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN
ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Diluluskan di
Medan, Januari 2012
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Drs. Kiki Nurtjahja, M.Sc. Prof. Dr. Dwi Suryanto, M. Sc NIP.196212111998031001 NIP. 196404091994031003
Diketahui/Disetujui oleh
Departemen Biologi FMIPA USU Ketua,
PERNYATAAN
ISOLASI DAN UJI KEMAMPUAN BAKTERI ENDOFIT DIAZITROF YANG
MEMFIKSASI NITROGEN BEBAS PADA AKAR KELAPA SAWIT (Elaeis
guineensis Jacq.).
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Januari 2012
PENGHARGAAN
Puji dan syukur Penulis panjatkan kepada Tuhan Yang Maha Esa, yang telah memberikan kasih dan karunia-Nya sehingga Penulis dapat menyelesaikan hasil penelitian ini yang berjudul “Isolasi dan uji kemampuan bakteri endofit diazotrof yang memfiksasi nitrogen bebas pada akar kelapa sawit (Elaeis guineensis Jaqc.)”.
Pada kesempatan ini Penulis juga ingin mengucapkan terimakasih yang sebesar-besarnya kepada Prof. Dr. Dwi Suryanto selaku Dosen Pembimbing I dan Drs. Kiki Nurtjahja, M.Scselaku Dosen Pembimbing II. Penulis juga mengucapkan terima kasih kepada Dra.Nunuk Priyani, M.Sc selaku dosen penguji I dan Dra. Isnaini Nurwahyuni, M,Sc selaku Dosen Penguji II dan Yurnaliza, S.Si, M,Si yang telah banyak memberikan dorongan, bimbingan, arahan, waktu serta perhatian yang besar saat penulisan hasil penelitian ini. Penulis juga mengucapkan terima kasih kepada Dr. Nursahara Pasaribu, M.Sc selaku Ketua Departemen Biologi FMIPA USU dan Drs. Arlen.H.J., M,Si selaku Dosen Pembimbing Akademik, kepada seluruh Dosen Departemen Biologi FMIPA USU serta Pegawai Administrasi Program Studi Biologi FMIPA USU (Bang Erwin, Kak Ros dan Bu Ipit) atas kebaikan yang diberikan selama ini kepada penulis.
Penulis juga mengucapkan banyak terima kasih kepada Ayahanda Muharramsyah dan Aida Fitriani (almh) yang telah memberikan doa, perhatian dan kasih sayangnya kepada penulis, serta adik-adikku yang tersayang (Moh.Rizky, Nur Farrahin Syafitri, Moh. Alfaraby),kepada nenekku (Hj.Zulaiha dan Naimah), kepada kekasih hati Alda Mora Hutasuhut dan kepada seluruh keluarga yang telah banyak memberikan motivasi dan semangat dalam penulisan skripsi ini.
Penulis menyadari sepenuhnya bahwa masih banyak kekurangan dalam penyusunan skripsi ini, baik dari bahasa maupun isinya, untuk itu Penulis mengharapkan kritik dan saran yang membangun dari semua pihak demi kesempurnaan skripsi ini.Semoga bermanfaat bagi ilmu pengetahuan.Atas partisipasi dan dukungan penulis ucapkan terima kasih.
ISOLASI DAN UJI KEMAMPUAN BAKTERI ENDOFIT DIAZOTROF YANG MEMFIKSASI NITROGEN BEBAS PADA AKAR KELAPA SAWIT (Elaeis
guineensis Jaqc.)
ABSTRAK
Penelitian tentang isolasi dan uji kemampuan bakteri endofit diazotrof yang memfiksasi nitrogen bebas pada akar kelapa sawit (Elaeis guineensis Jaqc.) telah dilakukan di Laboratorium Mikrobiologi dan di rumah kasa Departemen Biologi FMIPA USU. Penelitian ini bertujuan untuk mengetahui adanya bakteri endofit diazotrof dan pengaruhnya terhadap pertumbuhan kelapa sawit. Hasil isolasi bakteri endofit menunjukkan terdapat 20 isolat bakteri yang berhasil dikarakterisasi secara morfologi dan biokimia. Beberapa isolat memiliki karakter yang sama yaitu NFB 2, NFB 14 dan NFB 16, NFB 11, NFB 12 dan NFB 19, NFB 15 dan NFB 20, isolat-isolat tersebut mempunyai sifat morfologi dan biokimia yang sama. Uji kemampuan menambat N2 dari 20 isolat menunjukkan bahwa isolat NFB 2, NFB 3 dan NFB 4 dengan masing-masing aktivitas ARA 2.10, 2.78, dan 3.13 ppm/jam. Pengamatan morfometri bibit kelapa sawit yang diberi perlakuan isolat menunjukkan adanya hubungan antara kemampuan menambat N2
Kata kunci: bakteri endofit, diazotrof, fiksasi nitrogen, kelapa sawit
ISOLATION AND ASSAY OF DIAZOTROPHIC ENDOPHITYC BACTERIAL FIXED FREE NITROGEN FROM PALM OIL ROOT (Elaeis guineensis Jaqc.)
ABSTRACT
A study on isolation and assay of diazotrophic endophytic bacterial isolates from palm oil root has been done in Laboratory of Microbiology and green house of Department of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara. The aim of the study was to know diazotrophic bacteria isolated from palm oil root and their role in palm oil growth. Twenty bacterial isolates were successfully isolated, and were morphologically and biochemically characterized. Some isolates shared the same characteristics i.e. NFB 2, NFB 14 and NFB 16, NFB 11, NFB 12 and NFB 19, and NFB 15 and NFB 20. Assay on nitrogen fixation of all isolates showed that NFB 2, NFB 3 and NFB 4 fixed nitrogen more than others which were shown by ARA activities of 2.10, 2.78 and 3.13 ppm/h, respectively. There was a correlation between the ability to fix nitrogen with plant height, number of leaves, and number of roots.
DAFTAR ISI Halaman PERSETUJUAN PENGHARGAAN ABSTRAK DAFTAR ISI DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN i iii v vii vii i ix
Bab 1. Pendahuluan
1.1 Latar Belakang 1
1.2 Permasalahan 2
1.3 Tujuan 3
1.4 Hipotesis 3
1.5 Manfaat 3
Bab 2. Tinjauan Pustaka
2.1 Bakteri Endofit 4
2.2 Bakteri Penambat Nitrogen 5
2.3 Biofertilizer 6
2.4 Peranan Unsur Hara 7
Bab 3. Bahan Dan Metode
3.1 Waktu dan Tempat 9
3.2 Bahan 9
3.3 Sterilisasi dan Isolasi Akar Sawit 10
3.4 Persiapan Kecambah Kelapa sawit 10
3.5 Uji Kemampuan Menambat N2 dari Udara 11
3.6 Pembuatan Suspensi Bakteri Endoffit 11
3.7 Introduksi Bakteri Endofit 11
3.8 Reisolasi Bakteri Endofit 11
Bab 4. HASIL DAN PEMBAHSAN
4.1 Isolasi dan Karakteristik Bakteri Endofit 13
4.2 Uji Kemampuan MenambatN2 dari Udara 15
4.3 Pengamatan Morfometri Bibit Kelapa Sawit yang Diintroduksi Bakteri Endofit
BAB 5. KESIMPULAN DAN SARAN
5.1 Kesimpulan 5.2 Saran
DAFTAR PUSTAKA LAMPIRAN
18
23 23
DAFTAR TABEL
Halaman
Tabel 1 Karakteristik sifat morfologi koloni dan sel, dan sifat biokimia bakteri endofit yang diisolasi dari kelapa sawit
14
Tabel 2 Tabel 3
Aktivitas Asai Reduksi Asetilen (ARA)
Pengaruh isolat bakeri endofit dengan metode introduksi terhadap tinggi tanaman, jumlah daun dan jumlah akar kelapa sawit umur ±5 bulan.
17
DAFTAR GAMBAR
halaman Gambar 1 Kecambah kelapa sawit (Elaeis guineensis Jaqc.) var
Dura Pasifera umur 3 bulan dengan (a) plumula dan (b) radikula
9
Gambar 2 Pelikel Pada Media Nitrogen Free Bromthymol Blue (NFB)
16
Gambar 3 Histrogan Uji Asai Reduksi Asitilen (ARA) 18
Gambar 4 Gambar 5
Morfologi bibit kelapa sawit umur ±5 bulan
Histogram pengaruh isolat bakteri endofit dengan metode introduksi terhadap tinggi tanaman, jumlah daun dan jumlah akar
20
DAFTAR LAMPIRAN
Halaman Lampiran 1 Tanaman sawit yang diberi perlakuan isolat endofit
penambat nitrogen umur ±5 bulan
27
Lampiran 2 Penelitian uji biokimia sederhana bakteri endofit kelapa sawit
28
Lampiran 3 Isolat bakteri endofit pada media NFB 29 Lampiran 4
Lampiran 5
Rata-rata pengamatan pertumbuhan kelapa sawit dari bulan I-Vdari tiga ulangan dengan interval pengamatan dua minggu sekali.
Komposisi Media Nitrogen Free BromthymolBlue (NFB)
30 32
ISOLASI DAN UJI KEMAMPUAN BAKTERI ENDOFIT DIAZOTROF YANG MEMFIKSASI NITROGEN BEBAS PADA AKAR KELAPA SAWIT (Elaeis
guineensis Jaqc.)
ABSTRAK
Penelitian tentang isolasi dan uji kemampuan bakteri endofit diazotrof yang memfiksasi nitrogen bebas pada akar kelapa sawit (Elaeis guineensis Jaqc.) telah dilakukan di Laboratorium Mikrobiologi dan di rumah kasa Departemen Biologi FMIPA USU. Penelitian ini bertujuan untuk mengetahui adanya bakteri endofit diazotrof dan pengaruhnya terhadap pertumbuhan kelapa sawit. Hasil isolasi bakteri endofit menunjukkan terdapat 20 isolat bakteri yang berhasil dikarakterisasi secara morfologi dan biokimia. Beberapa isolat memiliki karakter yang sama yaitu NFB 2, NFB 14 dan NFB 16, NFB 11, NFB 12 dan NFB 19, NFB 15 dan NFB 20, isolat-isolat tersebut mempunyai sifat morfologi dan biokimia yang sama. Uji kemampuan menambat N2 dari 20 isolat menunjukkan bahwa isolat NFB 2, NFB 3 dan NFB 4 dengan masing-masing aktivitas ARA 2.10, 2.78, dan 3.13 ppm/jam. Pengamatan morfometri bibit kelapa sawit yang diberi perlakuan isolat menunjukkan adanya hubungan antara kemampuan menambat N2
Kata kunci: bakteri endofit, diazotrof, fiksasi nitrogen, kelapa sawit
ISOLATION AND ASSAY OF DIAZOTROPHIC ENDOPHITYC BACTERIAL FIXED FREE NITROGEN FROM PALM OIL ROOT (Elaeis guineensis Jaqc.)
ABSTRACT
A study on isolation and assay of diazotrophic endophytic bacterial isolates from palm oil root has been done in Laboratory of Microbiology and green house of Department of Biology, Faculty of Mathematics and Natural Sciences, University of Sumatera Utara. The aim of the study was to know diazotrophic bacteria isolated from palm oil root and their role in palm oil growth. Twenty bacterial isolates were successfully isolated, and were morphologically and biochemically characterized. Some isolates shared the same characteristics i.e. NFB 2, NFB 14 and NFB 16, NFB 11, NFB 12 and NFB 19, and NFB 15 and NFB 20. Assay on nitrogen fixation of all isolates showed that NFB 2, NFB 3 and NFB 4 fixed nitrogen more than others which were shown by ARA activities of 2.10, 2.78 and 3.13 ppm/h, respectively. There was a correlation between the ability to fix nitrogen with plant height, number of leaves, and number of roots.
BAB 1
PENDAHULUAN
1.1 Latar Belakang
Kelapa sawit merupakan tanaman andalan Indonesia khususnya Sumatera Utara.
Tanaman kelapa sawit merupakan penghasil terbesar minyak goreng dan penghasil
devisa non migas yang sangat penting. Banyak usaha yang telah dilakukan agar
produktivitas dari tanaman ini meningkat. Usaha-usaha yang telah dilakukan seperti
perluasan areal perkebunan kelapa sawit, memanajemen pengolahan kebun kelapa sawit
yaitu dengan melakukan pemupukan dan pengendalian penyakit. Menurut Satyawibawa
& Widyastuti(2001) perkebunan kelapa sawit dapat dibangun di daerah bekas lahan
primer, sekunder dan bekas perkebunan tanaman lain seperti karet, kelapa, kopi dan teh.
Perawatan tanaman kelapa sawit meliputi beberapa hal, antara lain penyulaman,
penanaman tanaman sela, pemberantasan hama dan pemangkasan penyakit, dan
penyerbukan buatan. Kemampuan tanaman sawit untuk tumbuh dan berkembang sangat
bergantung pada responnya terhadap unsur-unsur cuaca serta masalahnya pada
ketersediaan air dan nitrogen. Nitrogen salah satu unsur hara yang banyak diserap oleh
tanaman kelapa sawit dalam proses produksi tandan buah. Sehingga penelitian tentang
nitrogen dapat menghasilkan perubahan biaya pemupukan yang tinggi (total 40%-60%
biaya pemeliharaan serta dapat menekan biaya produksi) (Statistik Perkebunan
Indonesia, 1999).
Penggunaan mikroba penyubur tanah dapat memberikan berbagai manfaat, yaitu
menyediakan sumber hara bagi tanaman, melindungi akar dari gangguan hama dan
penyakit, menstimulasisistem perakaran agar berkembang sempurna dan memperpanjang
usia akar, memacu mitosis jaringan meristem pada titik tumbuh pucuk, kuncup bunga dan
endofit merupakan bakteri yang hidup dalam jaringan tanaman tanpa membahayakan
inangnya (Radji, 2004).
Hampir setiap tanaman tingkat tinggi memiliki beberapa mikroba endofit yang
menghasilkan senyawa biologi atau metabolit sekunder.Endofit merupakan mikroba yang
berasosiasi dengan jaringan tanaman sehat yang bersifat netral. Bahan aktif yang
dihasilkan bakteri endofit diperkirakan memiliki kemampuan yang sama dengan bahan
aktif yang dihasilkan inangnya. Telah banyak penelitian yang dilakukan untuk
mengisolasi mikroba endofit pada tanaman, misalnya pada tanaman obat (Tan & Zou,
2001), tanaman perkebunan dan tanaman budidaya seperti padi (Zinniel et al, 2002),
buah-buahan seperti strawberry (Moussaif et al., 1977) dan tanaman hutan (Strobel, 2002;
Suryanarayanan et al., 2003). Kolonisasi bakteri endofit yang ada di dalam jaringan
tanaman yang mengeksploitasi substrat karbon yang disuplai oleh tanaman tanpa
berkompetisi dengan mikroba lain. Bakteri ini sering kali berlokasi dalam akar di bawah
tanah atau berada dalam jaringan yang kompak seperti buku batang dan pembuluh xylem
sehingga bakteri ini mampu tumbuh pada lingkungan dengan tekanan O2 yang rendah yang sangat penting bagi aktivitas enzim nitrogenase (James & Oliver, 1997).Beberapa
bakteri endofit bersifat diazotrof selain mampu menambat N2 juga mampu mensekresikan
asam indol-3-asetat (Ladha et al., 1997).Potensi N yang disumbangkan oleh bakteri
endofit diazotrof endofitik lebih besar dari diazotrof nonendofitik, karena N yang berhasil
ditambat tidak ada yang hilang.
1.2 Permasalahan
Belum diketahuinya seberapa besar pengaruh bakteri endofit yang diintroduksinya
1.3 Tujuan
Tujuan penelitian ini untuk mengetahui adanya bakteri endofit diazotrof dan mengetahui
pengaruhnya terhadap pertumbuhan tanaman.
1.4 Manfaat
Dengan diketahuinya bakteri endofit diazotrof yang mampu menambat N membantu
menyediakan unsur N yang tersedia pada tanaman.
1.5 Hipotesis
Terdapat bakteri endofit diazotrof dalam tanaman kelapa sawit (Elaeis guineensis Jacq.)
BAB 2
TINJAUAN PUSTAKA
2.1 Bakteri Endofit
Bakteri endofit adalah mikroba yang hidup di dalam jaringan membentuk koloni dalam
jaringan tanaman tanpa membahayakan inangnya. Setiap tanaman tingkat tinggi dapat
mengandung beberapa bakteri endofit yang mampu menghasilkan senyawa biologi atau
metabolit sekunder yang diduga sebagai akibat koevolusi atau transfergenetik dari
tanaman inangnya ke mikroba endofit (Tan & Zhou, 2001 dalam Radji, 2004).Tipe
asosiasi biologis antara mikroba endofit dengan tanaman inang bervariasi dari netral,
komensalisme sampai simbiosis.Pada situasi ini tanaman merupakan sumber makanan
bagi mikroba endofit dalam melengkapi siklus hidupnya (Clay, 1988).
Bakteri endofit dapat diisolasi dari permukaan jaringan tanaman yang steril atau
diekstraksi dari jaringan tanaman bagian dalam.Secara khusus, bakteri masuk ke jaringan
melalui jaringan yang berkecambah, akar, stomata, maupun jaringan yang rusak (Zinniel
et al., 2002).Bakteri endofit maupun rizobakteri lainnya merupakan bagian dari
mikroflora alamiah dari tanaman yang sehat di lapangan. Bakteri ini dapat dikatakan
sebagai kontributor penting bagi kesehatan tanaman (Kloepper et al., 1999 dalam Aini &
Abadi, 2004). Menurut Hallman et al., (1999) dalam Aini & Abadi (2004), telah diketahui
pula bahwa bakteri endofit berperan dalam kesehatan tanaman dalam hal: (1)
antagonisme langsung atau penguasaan relung atas patogen, (2) menginduksi ketahanan
sistemik dan (3) meningkatkan toleransi tanaman terhadap tekanan lingkungan. Karena
sifat-sifat tersebut bakteri endofit telah terbukti dapat dimanfaatkan sebagai pengendali
hayati penyakit tanaman bahkan dapat mengurangi serangan hama tanaman
2.2 Bakteri Penambat Nitrogen
Kebutuhan bakteri terhadap unsur N dapat di pengaruhi oleh sumber N yang terdapat
dalam berbagai senyawa organik maupun dari N udara. Peranan nitrogen secara biologis
oleh sejumlah spesies bakteri endofit diazotrof memiliki keunggulan di bandingkan
rhizosfer, karena keberadaanya di dalam jaringan interseluler tanaman yang tidak mudah
hilang, sementara hara nitrogen yang berada di alam sangat bersifat labil, mudah tercuci
air dan erosi, dan mudah nguap ke udara.Selain itu sejumlah bakteri endofit juga mampu
menghasilkan asam indol asetat (AIA) yang merupakan fitohormon golongan auksin yang
berperan dalam memperpanjang sel dan organ (Robert, 1975). Beragam jenis bakteri
bertanggung jawab pada penambatan N hayati, mulai dari Sianobakter dan bakteri
fotosintetik pada air tergenang dan permukaan tanah sampai pada bakteri heterotrofik
dalam tanah dan zona akar (Ladha et al., 1997; Boddey et al., 1995;
Kyuma, 2004).Bakteri mampu melakukan penambatan nitrogen udara maupun simbiosis.
Secara umum, fiksasi nitrogen biologis sebagai bagian dari input nitrogen untuk
mendukung pertumbuhan tanaman telah menurun akibat intensifikasi pemupukan
anorganik (Hindersah dan Simarmata, 2004).Unsur nitrogen termasuk unsur utama dan
merupakan faktor pembatas dalam pertumbuhan, sehingga merupakan kunci keberhasilan
pertumbuhan tanaman (Purwaningsih, 2004).
Bakteri penambat N di daerah perakaran dan bagian jaringan tanaman padi, yaitu
Pseudomonas spp., Enterobacteriaceae, Bacillus, Azotobacter, Azospirillum dan
Herbaspirillum telah terbukti secara nyata menambat N (James & Olivares., 1997).
Bakteri penambat N pada rizosfer tanaman gramineae, seperti Azotobacterpaspali dan
Beijirinckia spp. merupakan kelompok bakteri aerobik yang mengkolonisasi permukaan
akar (Baldani et al., 1992).Azotobacter merupakan bakteri penambatan yang mampu
menghasilkan substansi zat pemacu tumbuh giberelin, sitokinin dan asam indol asetat,
sehingga pemanfaatannya dapat memacu pertumbuhan akar (Alexander, 1976). Populasi
Azotobacter dalam tanah dipengaruhi oleh pemupukan
dan jenis tanaman. Kelompok prokariot fotosintetik terbesar dan menyebar secara luas yai
meningkatkan kesuburan ekosistem tanah.Pertumbuhan Sianobaktermeningkatkan
pertumbuhan agregat sehingga mempengaruhi filtrasi, aerasi dan suhu tanah. Keberadaan
Sianobakterterhadap kebutuhan N tanaman ditentukan oleh besarnya biomasa, masa antar
dua musim tanaman, laju penambatan N, dan besarnya N tanah yang tersedia bagi
tanaman.Potensi N yang disumbangkan oleh bakteri penambat nitrogen yang hidup bebas
tidak terlalu tinggi, karena nitrogen yang berhasil ditambat berada diluar jaringan
tanaman, sehingga sebagian hilang sebelum di serap oleh tanaman (Ladha et al., 1997).
2.3 Biofertilizer
Biofertilizer didefinisikan sebagai produk yang mengandung mikroba hidup atau sel
mikroba yang tersembunyi yang mengaktifkan proses biologis untuk membuat pupuk atau
membentuk unsur yang tidak tersedia menjadi tersedia bagi tanaman. Aktifitas mikroba
ini mempengaruhi ekosistem tanah dan menghasilkan zat tambahan buat tanaman (Parr et
al., 2002). Kemampuan tanah untuk menyediakan unsur hara bagi tanaman merupakan
masalah yang sering dialami pertanaman kelapa sawit, termasuk pada pertanaman yang
belum di hasilkan. Keterbatasan seperti ini akan menjadi faktor pembatas terhadap
ketersediaan unsur hara yang dapat di manfaatkan oleh tanaman seperti nitrogen.
Keterbatasan oleh tanaman dapat menyebabkan sistem pemupukan yang dilakukan tidak
efektif (Statistik Perkebunan, 1997-1999).
Bagaimanapun, spesies dan kuantitas unsur hara tanaman bervariasi tergantung
pada sumber daya dan bahan-bahan mentah yang digunakan untuk memproduksi pupuk.
Mikroba tersebut dan sumber nutrien diperoleh dari bahan baku yang digunakan untuk
meningkatkan kesehatan dan unsur hara tanah. Ada macam-macam jenis biofertilizer
yang tersedia tergantung bahan baku yang digunakan, bentuk-bentuk pemanfaatan dan
sumber mikroba (DOAE 2003; Higa & Parr 1994; Ngampimol & Kunathiga., 2008).
Dalam lingkup terminologi ini, biofertilizer meliputi perumusan mikroba pengikat
2.4Peranan Unsur Hara Nitrogen
Nitrogen merupakan unsur hara yang utama bagi pertumbuhan tanaman, yang pada
umumnya sangat diperlukan untuk pembentukan atau pertumbuhan bagian-bagian
vegetatif tanaman, seperti daun, batang dan akar. Fungsi nitrogen yang selengkapnya bagi
tanaman adalah untuk meningkatkan pertumbuhan tanaman, dapat menyehatkan
pertumbuhan daun, daun tanaman lebar dengan warna yang lebih hijau, meningkatkan
kadar protein dalam tubuh tanaman, meningkatkan kualitas tanaman penghasil daunan,
meningkatkan perkembangbiakan mikroorganisme di dalam tanah (Sutedjo, 1987). Faktor
nitrogen merupakan istilah yang biasa untuk menyatakan berapa jauh suatu bahan
kekurangan nitrogen untuk peruraian.Istilah ini didefenisikan sebagai jumlah unit
nitrogen anorganik yang harus disediakan. Berdasarkan massa dapat menghindari
immobilitas nitrogen dari lingkungan. Diantara unsur-unsur mineral esensial untuk
pertumbuhan dan reproduksi tanaman-tanaman hijau tingkat tinggi terdapat lebih banyak
atom nitrogen dari bahan organik kering dari pada unsur lainnya yang berasal dari tanah
nitrogen dalam bahan tanaman sering dijumpai dalam jumlah yang lebih banyak dari pada
unsur-unsur lainnya. Walaupun konsentrasi K kemungkinan lebih tinggi dalam sebagian
bahan tanaman, nitrogen melebihi jumlah total semua unsur mineral esensial lainnya.
Tidaklah mengherankan jika unsur ini merupakan yang paling universal untuk produksi
tanaman yang optimum (Engelstad, 1997).
Begitu besarnya peranan N bagi tanaman, penyediaannya dibutuhkan sekali oleh
para petani.Surnber N utama tanah adalah dari bahan organik melalui proses mineralisasi
NH4+ dan NO3¯ .Selain itu N dapat juga bersumber dan atmosfir (78 % melalui curah hujan (8 -10 % N tanah), penambatan (fiksasi) oleh mikroba tanah baik secara simbiosis
dengan tanaman maupun hidup bebas.Walaupun sumber ini cukup banyak secara alami,
namun untuk memenuhi kebutuhan tanaman maka diberikan secara sengaja dalam bentuk
pupuk, seperti urea, ZA, dan sebagainya maupun dalam bentuk pupuk kandang ataupun
pupuk hijau.Selain sangat mutlak dibutuhkan, nitrogen dengan mudah dapat hilang atau
menjadi tidak tersedia dalam tanaman. Ketidaktersediaan nitrogen dari dalam tanah dapat
NH+menjadi NO4¯ menjadiNO3¯, terfiksasi oleh mineralisasi atau dikonsumsi oleh mikroba tanah. Bentuk NO3¯lah yang selalu terlendri dan mudah larut, maka dikaji pergerakannya ke permukaan agar tidak hilang sehingga menjadi efisiensi pemupukan
(Sanche, 1976; Mengel dan Kirby, 1982). Karena rendahnya efisiensi pupuk N pada
tanaman ini disebabkan oleh banyaknya N yang hilang karena curah hujan tinggi serta
penanganan pupuk dan tanaman yang kurang baik pada kondisi paling optimum,
penyerapan pupuk N yang diberikan ke tanaman hanyalah sekitar 40-50% (Mousaif et al.,
BAB 3
BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilaksanakan pada Bulan Maret sampai Agustus 2011 di Laboratorium
Mikrobiologi dan rumah kasa FMIPA USU Medan.
3.2 Bahan
Bahan yang digunakan adalah isolat bakteri endofit, kecambah kelapa sawit varietas
Dura Pasifera (Gambar 1) yang sehat diperoleh dari Pusat Penelitian Kelapa Sawit
(PPKS) Medan. Nutrien Agar (NA), akuades steril, sodium hipoklorit 5,3%, etanol
70%. Media Nitrogen Free Bromthymol Blue (NFB) semi solid. Komposisi media dapat
dilihat pada Lampiran 5 hlm 33.
Gambar 1.Kecambah kelapa sawit (Elaeis guineensis Jaqc.) var. Dura Pasifera umur 3 bulan dengan (a). plumula dan (b). radikula
a
3.3 Sterilisasi dan IsolasiAkar Sawit
Sterilisasi bakteri endofit dari akar kelapa sawit yang dilakukan menurut metode Radu &
Kqueen (2002) yaitu akar kelapa sawit diambil dari lokasi segera dicuci untuk
menghilangkan kotoran yang menempel, dikeringkan, lalu dibungkus dengan kertas koran
dan dimasukkan ke dalam kantong plastik. Selanjutnya akar kelapa sawit dibawa
ke laboratorium untuk tahap isolasi. Tahap awal yang dilakukan adalah mencuci bagian
akar dan dipotong-potong sepanjang 2-3 cm dengan air mengalir selama 20
menit, kemudian disterilisasi dengan merendamnya di dalam larutan secara berturut-turut:
etanol 75% selama 2 menit, larutan sodium hipoklorit 5,3% selama 5 menit, dan etanol
75% selama 30 detik, lalu dibilas dengan akuades steril sebanyak 2 kali, dikeringkan
dengan kertas saring steril. Setelah kering, bagian ujung kiri dan kanan akar tanaman
dibuang ± 1 cm agar lebih bersih.Bagian akar diletakkan di dalam media agar
NFB. Koloni yang muncul dari bagian akar tanaman sebelah dalam disubkultur ke media
agar NFB yang baru sampai didapatkan biakan murni.Isolat murni yang diperoleh
dikarakterisasi morfologinya dengan pewarnaan Gram dan uji biokimia metabolisme
bakteri uji sitrat, uji motilitas, uji gelatin, uji sulfida, uji katalase dan uji hidrolisis pati
(Lay, 1994).
3.4 Persiapan Kecambah Kelapa Sawit
Kecambah kelapa sawit umur 3 bulan disterilkan dengan cara direndam dalam
larutan sodium hipoklorit 5,3% selama ± 1 menit, kemudian dibilas dengan akuades
steril, lalu direndam dalam etanol 70% selama ± 5 detik dan dibilas dengan akuades steril
sebanyak 2 kali. Kecambah kelapa sawit steril ditanam dalam polibag berukuran diameter
x tinggi yaitu 17x35 cm yang telah berisi tanah yang telah disterilkan dengan cara
mengukusnya selama ± 3 jam. Kecambah disiram setiap hari dengan akuades steril
3.5Uji Kemampuan Menambat N2 dari Udara
Uji bakteri endofit menambat N2 dilakukan dengan metode asai reduksi asetilen
(ARA) (FAO, 1983).Isolat-isolat bakteri endofit ditumbuhkan pada medium NFB cair
pada suhu ruang selama satu hari. Selanjutnya kultur berumur satu hari dengan populasi
sekitar 109 sel ml-1 tersebut diinokulasikan sebanyak 100 µl pada 10 ml medium NFB semi padat dan diinkubasi selama 10 hari pada suhu ruang. Analisis reduksi asetilen
dilakukan setelah terbentuk suatu pelikel berwarna putih pada inkubasi 10 hari. Analisis
ini diawali dengan melakukan penggantian tutup kapas dengan tutup karet. Selanjutnya
diambil 10% udara yang tersisa pada tabung dengan menggunakan jarum suntik dan
diganti dengan gas asetilen, diikuti dengan perlakuan inkubasi selama satu jam. Etilen
yang terbentuk dideteksi dan diukur dengan menggunakan gas kromatografi (GC).
Pengujian ini dilakukan di IPB, Bogor.
3.6 Pembuatan Suspensi Bakteri Endofit
Pembuatan suspensi bakteri endofit dilakukan menurut metode Bresson & Borges
(2003). Biakan bakteri endofit disubkultur dalam media NA dan diinkubasi selama ± 2
hari. Hasil subkultur biakan bakteri endofit diambil dengan jarum ose dan dimasukkan ke
dalam tabung reaksi yang berisi 10 ml akuades steril. Setelah itu dihomogenkan dengan
cara divortex dan disamakan kekeruhannya dengan standar Mac Farland sehingga
diperoleh suspensi bakteri dengan kerapatan sel 108CFU/ml.
3.7 Introduksi Bakteri Endofit
Introduksi bakteri endofitdilakukan melalui metode potong+rendam (Irfan, 2009;
masuk ke dalam jaringan akar dan satu sebagai kontrol dengan 3 kali ulangan untuk
masing-masing perlakuan. Untuk perlakuan metode potong+rendam yaitu bibit kelapa
sawit yang telah berumur ± 2 minggu, dicabut dari polibag kemudian dicuci dan direndam
dalam 20 ml suspensi bakteri endofit dengan kerapatan sel 108CFU/ml selama 60 menit dan dilakukan pemotongan bagian akarnya secara aseptis ± 2 cm. Kontrol tanpa bakteri
endofit diperlakukan sama tetapi hanya menggunakan akuades steril.
3.8Reisolasi Bakteri Endofit
Setelah minggu terakhir pengamatan dilakukan reisolasi bakteri endofit dan pengamatan
mikroskopis bakteri endofit di dalam jaringan tanaman secara histologis. Reisolasi bakteri
endofit dari akar tanaman kelapa sawit dilakukan menurut metode Radu & Kqueen
(2002). Tahap awal yang dilakukan adalah mencuci bagian akar tanaman (3-5 cm) dengan
air mengalir selama 20 menit. Bagian permukaan akar tanaman disterilisasi dengan
merendam secara berturut-turut di dalam larutan etanol 75% selama 2 menit, larutan
sodium hipoklorit 5,3% selama 5 menit, dan etanol 75% selama 30 detik, dibilas dengan
akuades steril sebanyak 2 kali. Akar tanaman yang sudah steril selanjutnya dihaluskan
dengan alu lumpang lalu dimasukkan ke dalam tabung reaksi steril yang berisi akuades
steril dengan perbandingan 1:10 sehingga konsentrasi kultur cair awal adalah 10-1. Kultur cair diambil sebanyak 1 ml dan dituang ke dalam cawan petri steril dengan metode cawan
tuang lalu diinkubasi dan dilakukan perhitungan jumlah koloni bakteri endofit yang
BAB 4
HASIL DAN PEMBAHASAN
4.1 Isolasi dan Karakteristik Bakteri Endofit
Hasil isolasi bakteri endofit diazotrof pada akar kelapa sawit diperoleh 20 isolat bakteri
ciri karakterisasi morfologi, koloni sel dan sifat biokimia dari 20 bakteri endofit diazotrof
(Tabel 1). Dari Tabel 1 menunjukkan warna koloni bakteri endofit bervariasi, warna krem
terdapat pada isolat NFB 1, NFB 6, NFB 7, NFB 13, NFB 14, NFB 15, NFB 19 dan NFB
20, warna putih pada isolat NFB2, NFB3, NFB 4, NFB5, NFB 8, NFB9, NFB 10, NFB
11 dan NFB 12. Sedangkan warna merah pada isolat NFB 16 dan NFB 18, warna merah
muda pada isolat NFB 17. Dari Tabel 1 juga menunjukkan bahwa sebagian besar bakteri
endofit kelapa sawit adalah Gram negatif hanya satu yang merupakan Gram positif yaitu
NFB 17. Dari hasil penelitian Kumala (2008) akar kelapa sawit kebanyakan bakteri
endofit diazotrof adalah Gram negatif dan berbentuk basil seperti Herbaspirillum spp. dan
Azotobacter.
Sebagian besar bakteri endofit diazotrof pada akar kelapa sawit berbentuk basil
kecuali NFB 1 berbentuk kokus.Penelitian yang telah dilakukan oleh Khairani (2010)
mendapatkan hasil bakteri endofit yang berbentuk basil lebih banyak dari pada bakteri
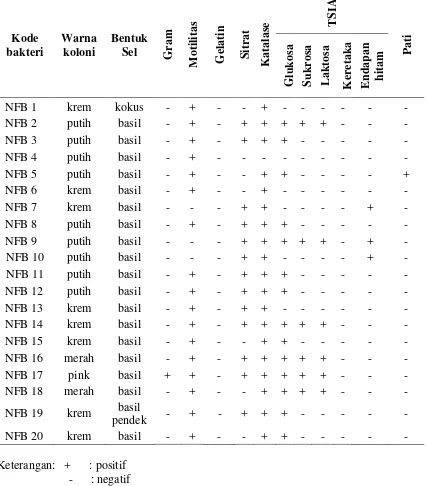
Tabel 1.Karakterisasi sifat morfologi koloni dan sel, dan sifat biokimia bakteri endofit yang disolasi dari kelapa sawit
Kode bakteri
Warna koloni
Bentuk Sel Gram
M ot ilita s Ge la tin S itr at K at al as
e TS
IA Pat i G lukos a Sukr os a L ak tos a K ere tak a E ndap an h itam
NFB 1 krem kokus - + - - + - - - -
NFB 2 putih basil - + - + + + + + - - -
NFB 3 putih basil - + - + + + - - - - -
NFB 4 putih basil - + - - - -
NFB 5 putih basil - + - - + + - - - - +
NFB 6 krem basil - + - - + - - - -
NFB 7 krem basil - - - + + - - - - + -
NFB 8 putih basil - + - + + + - - - - -
NFB 9 putih basil - - - + + + + + - + -
NFB 10 putih basil - - - + + - - - - + -
NFB 11 putih basil - + - + + + - - - - -
NFB 12 putih basil - + - + + + - - - - -
NFB 13 krem basil - + - + + - - - -
NFB 14 krem basil - + - + + + + + - - -
NFB 15 krem basil - + - - + + - - - - -
NFB 16 merah basil - + - + + + + + - - -
NFB 17 pink basil + + - + + + + + - - -
NFB 18 merah basil - + - - + + + + - - -
NFB 19 krem basil
pendek - + - + + + - - - - -
NFB 20 krem basil - + - - + + - - - - -
Keterangan: + : positif - : negatif
TSIA : Triple Sugar Iron Agar
Uji biokimia sederhana yang dilakukan meliputi uji motilitas, uji gelatin, uji sitrat,
bahwa isolat NFB 7, NFB 9 dan NFB 10 bersifat tidak motil yang ditandai dengan tidak
adanya jejak pergerakan bakteri di dalam medium, sedangkan 17 isolat lainnya bersifat
motil. Hal ini menunjukkan bahwa bakteri mencari nutrisi untuk berkembang biak. Hasil
uji sitrat mengindikasikan bahwa isolat NFB 1, NFB 4, NFB 5, NFB 6, NFB 18 dan NFB
20 tidak mampu menggunakan Na-sitrat sebagai satu-satunya sumber karbon sedangkan
isolat lainnya mampu menggunakan Na-sitrat sebagai sumber karbon. Pada uji gelatinase
semua isolat menunjukkan hasil yang negatif yang tidak mencerna gelatin.Penelitian yang
dilakukan oleh Khairani (2010) yang mengisolasi bakteri endofit pada tanaman padi juga
mendapatkan hal yang serupa pada uji gelatin.Sedangkan pada uji hidrolisis pati hanya
satu isolat yaitu NFB 5 menunjukkan hasil positif dengan adanya zona bening disekitar
koloni.Hal ini menandakan bahwa isolat tersebut mampu menghidrolisis pati. Dari uji
katalase dengan penambahan larutan H2O2 3% mengindikasikan bahwa isolat NFB 4 tidak memiliki enzim katalase yang ditandai dengan tidak terbentuknya gelembung udara
disekitar koloni bakteri sedangkan isolat lainnya memiliki enzim katalase. Menurut Lay
(1994), mikroorganisme tumbuh dan berkembang biak dengan berbagai bahan yang
terdapat dalam lingkungan. Zat hara yang terdapat di sekeliling dari molekul sederhana
seperti H2S dan NH4+ atau molekul organik yang kompleks seperti protein dan disakarida.Penggunaan zat hara tergantung aktivitas metabolisme mikroba.Metabolisme
sering kali menghasilkan hasil sampingan yang dapat digunakan untuk identifikasi
mikroba. Pengamatan aktivitas metabolisme ini diketahui dari kemampuannya untuk
menggunakan dan menguraikan molekul yang komplek seperti disakarida pati, lemak,
protein, asam nukleat dan asam amino. Hasil dari berbagai uji ini digunakan untuk
menunjukkan spesifikasi setiap mikroorganisme.
4.2 Uji Kemampuan Menambat N2 dari Udara
Seleksi bakteri endofit dalam menambat N2 dilakukan dengan metode asai reduksi asetilen (ARA). Dalam metode ini medium isolasi yang digunakan adalah Nitrogen Free
Bromthymol Blue semi padat yang dapat memperlihatkan reaksi yang berbeda dari setiap
isolat lainnya merubah warna media menjadi biru atau hijau.Perubahan warna media
menjadi biru atau hijau pada isolat diazotrof endofitterjadi karena adanya proses
alkalinisasi yaitu terjadinya oksidasi pada medium yang mengandung malat (Krieg &
Dobereiner, 1984). Selain perubahan warna, beberapa isolat mampu membentuk pelikel
berwarna putih di bawah permukaan medium NFB semi padat (Gambar 2). Pelikel yang
terbentuk menunjukkan kondisi yang baik untuk aktivitas nitrogenase. Hal ini disebabkan
karena di dalam medium tidak ada kelebihan oksigen, laju difusi oksigen sama dengan
laju respirasi organisme. Pembentukan pelikel pada permukaan medium NFB semi padat
[image:31.612.290.393.277.491.2]juga dijumpai pada percobaan Kirchof et al. (1997) pada berbagai strain Herbaspirillum.
Gambar 2. Pelikel pada Media Nitrogen Free Bromthymol Blue (NFB).
Kemampuan bakteri diazotrof endofit dalam menambat N2 diukur berdasarkan
kemampuan enzim nitrogenase dalam mereduksi asetilen (C2H2) menjadi etilen (C2H4
C
)
sebagaimana reaksi berikut :
2H2 + 2H+ + 2e- C2H
Dari uji aktivitas reduksi asetilen terhadap 20 bakteri endofit diazotrof dapat
dilihat hasil yang didapat seperti pada Tabel 2 berikut ini : 4
Pelikel
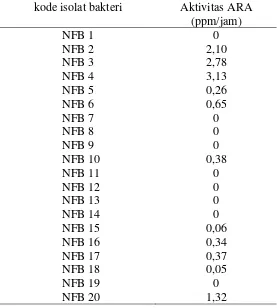
Tabel 2.Aktivitas Asai Reduksi Asetilen (ARA)
kode isolat bakteri Aktivitas ARA
(ppm/jam)
NFB 1 0
NFB 2 2,10
NFB 3 2,78
NFB 4 3,13
NFB 5 0,26
NFB 6 0,65
NFB 7 0
NFB 8 0
NFB 9 0
NFB 10 0,38
NFB 11 0
NFB 12 0
NFB 13 0
NFB 14 0
NFB 15 0,06
NFB 16 0,34
NFB 17 0,37
NFB 18 0,05
NFB 19 0
NFB 20 1,32
Tidak semua isolat mempunyai kemampuan menambat N2 udara, tetapi bervariasi mulai bakteri yang tidak mengikat N2 sampai yang menambat N2 sebesar 3,13 ppm/jam. Dari hasil pengukuran diperoleh tiga isolat yang mempunyai potensi menambat
nitrogen tinggi. Isolat yang tergolong tinggi kemampuannya ada tiga, yaitu NFB 2(2,10
ppm/jam), NFB 3(2,78 ppm/jam) dan NFB 4 (3,13 ppm/jam). Susilowati et al. (2007)
Gambar 3. Histrogam uji Asai Reduksi Asetilen (ARA)
4.3 Pengamatan Morfometri Bibit Kelapa Sawit yang Diintroduksi Bakteri Endofit
Hasil pengamatan morfometri di lapangan menunjukkan bahwa pada bibit kelapa sawit
yang diintroduksi dengan isolat bakteri endofit melalui metode potong rendam
menghasilkan pertumbuhan yang jauh lebih baik bila dibandingkan dengan kontrol (tanpa
bakteri endofit). Pengaruh bakteri endofit dengan metode introduksi terhadap tinggi
tanaman, jumlah daun dan banyak akar yang menunjukkan perbedaan yang nyata dapat
dilihat pada Tabel 3.
kons
ent
ra
si
A
R
A
(
ppm
/j
sm
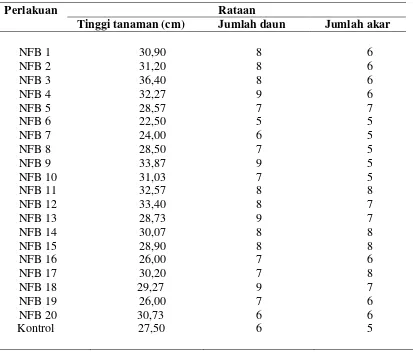
Tabel 3. Pengaruh bakteri endofit dengan metode introduksi terhadap tinggi tanaman, jumlah daun dan jumlah akar, kelapa sawit umur ± 5 bulan
Perlakuan Rataan
Tinggi tanaman (cm) Jumlah daun Jumlah akar
NFB 1 NFB 2 NFB 3 NFB 4 NFB 5 NFB 6 NFB 7 NFB 8 NFB 9 NFB 10 NFB 11 NFB 12 NFB 13 NFB 14 NFB 15 NFB 16 NFB 17 NFB 18 NFB 19 NFB 20 Kontrol 30,90 31,20 36,40 32,27 28,57 22,50 24,00 28,50 33,87 31,03 32,57 33,40 28,73 30,07 28,90 26,00 30,20 29,27 26,00 30,73 27,50 8 8 8 9 7 5 6 7 9 7 8 8 9 8 8 7 7 9 7 6 6 6 6 6 6 7 5 5 5 5 5 8 7 7 8 8 6 8 7 6 6 5
Pengaruh pemberian isolat terhadap tinggi tanaman, jumlah daun dan jumlah akar
memberikan pengaruh terhadap tanaman sebagaimana terlihat pada Gambar 4.
[image:34.612.143.544.533.677.2]Pada perlakuan dengan metode potong rendam, rata-rata tinggi tanaman, jumlah
daun dan banyak akar bervariasi sedangkan pada perlakuan kontrol memiliki rata-rata
jumlah daun, tinggi tanaman yang tidak berbeda jauh dengan perlakuan, tetapi jumlah
akar sedikit. Menurut Thakuria et al. (2004) bahwa mekanisme pertumbuhan tanaman
oleh bakteri endofit dapat terjadi melalui beberapa cara diantaranya melarutkan senyawa
fosfat, fiksasi nitrogen, merangsang pertumbuhan akar lateral dan menghasilkan hormon
pertumbuhan seperti etilen, auksin dan sitokinin. Pengaruh bakteri endofit terhadap tinggi
tanaman, jumlah daun dan jumlah akar kelapa sawit dapat dilihat di dalam grafik.
A. Tinggi tanaman (cm)
B. Jumlah daun (helai)
T
in
g
g
i t
a
n
a
ma
n
(
cm)
Isolat
jum
la
h da
un
(he
la
i)
C. Jumlah akar
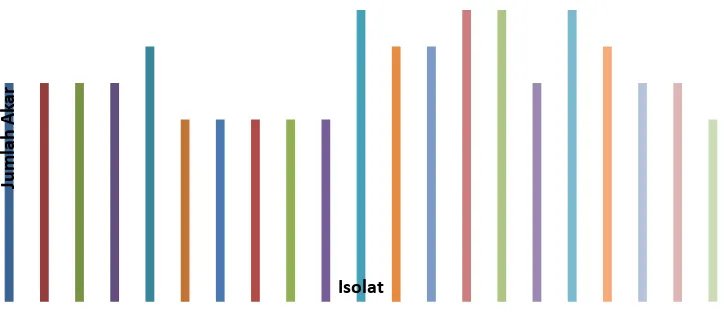
Gambar 5. Histogram pengaruh isolat bakteri endofit dengan metode terhadap: A. Tinggi tanaman(cm); B. Jumlah daun (helai); C.Jumlah akar.
Dari Gambar 5a dapat dilihat bahwa kode isolat NFB 3, NFB 9 dan NFB 12
memiliki tingkat pertumbuhan yang lebih tinggi. NFB 6 merupakan isolat paling kecil
pengaruhnya dalam penambahan tinggi tanaman dibanding dengan isolat lainnya. Pada
pertumbuhan kelapa sawit belum menunjukkan perbedaan yang sangat nyata dalam tinggi
tanaman.Hal ini menunjukkan adanya kontribusi penambatan N2 oleh bakteri diazotrof endofit yang diinokulasikan ke dalam tanaman kelapa sawit.Besarnya aktivitas enzim
nitrogenase tergantung pada ekspresi dari setiap bakteri diazotrof endofit. Diketahui
bahwa sekitar 90% penambatan N2 pada tanaman kedelai terjadi selama periode
perkembangan reproduktif dan 10% pada dua bulan pertama masa vegetatif (Salisbury &
Rose, 1995). Pertumbuhan tanaman tergantung pada ketersediaan energi dan kemampuan
bakteri penambat N2
untuk bersaing dengan mikroba lain yang hidup dan
berkembangbiaknya juga tergantung kepada sumber yang sama (Alexander, 1976).
Dari Gambar 5b yang diketahui bahwa NFB 4, NFB 9, NFB 13 dan NFB 18 lebih
banyak memiliki daun dengan rata-rata 9 helai dan yang paling sedikit jumlah daunnya
adalah NFB 6. Menurut Ozawa et al. (2000), kontribusi bakteri diazotrof endofit sangat
nyata setelah fase pembungaan. Hasil penelitian ini sejalan dengan hasil penelitian
Ozawa et al. (2000), yang menyatakan bahwa inokulasi isolat bakteri diazotrof endofit
Ju
m
lah
A
k
ar
terkadang memberikan respon tanaman dengan aktivitas penambatan N2 dan kadar N
tanaman lebih tinggi daripada tanaman kontrol, namun secara rataan tidak berbeda nyata.
Dari gambar Gambar 5c menunjukkan bahwa NFB 11, NFB 14, NFB 15 dan
NFB 17 memiliki rata-rata jumlah akar yang lebih banyak dibandingkan tanaman lain dan
kontrol. Menurut Vasudevan et al., (2002) bahwa bakteri endofit dapat merangsang
tanaman untuk membentuk akar lateral. Jumlah akar yang meningkat dapat memperluas
penyerapan unsur hara. Khalid et al., (2004) menyatakan pada gandum bahwa bakteri
rizosfer dapat menghasilkan etilen, yang digunakan tanaman untuk meningkatkan panjang
akar hingga 17,3%, berat kering akar 13,5%, panjang tajuk 37,7% dan berat kering tajuk
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil penelitian tentang isolasi dan uji kemampuan bakteri endofit diazotrof yang
memfiksasi nitrogen bebas pada akar tanaman kelapa sawit (Elaeis gueneensis Jaqc.),
dapat disimpulkan bahwa :
1. Tidak semua isolat bakteri endofit memiliki Asai Reduksi Asetilen (ARA).
2. Isolat NFB2, NFB 3 dan NFB 4 menunjukkan nilai ARA yang tertinggi dibanding
dengan isolat lain.
3. Isolat bakteri endofit yang memiliki ARA tertinggi memberikan pengaruh positif
terhadap tinggi tanaman, jumlah daun dan jumlah akar.
5.2 Saran
Sebaiknya dilakukan penelitian lebih lanjut mengenai kemampuan bakteri endofit yang
DAFTAR PUSTAKA
Albrecht, S.L., Sylvia, J.J., Fuhraman, P.G., Hartel & Zuberef, D.A. 1998.Eukaryotic Algae and Cyanobacteria.Principles and Application of Soil Microbiology. Prentice-Hall. Inc 94-131.
Alexander, M. 1976. Introduction to Soil Microbiology.Nitrogen Cycle.John Wiley & Son. New York.
Aryantha, I.N.P., Nganro, N.R., Sukrasno &Nandina, E. 2002.Development of Sustainable Agricultural System. One Day Discussion on The Minimization of Fertilizer Usage.Menristek-BPPT. Jakarta.
Baldani, V.L.D., Baldani, J.L., Olivers,F.L. &Dobereiner,J. 1992. Identification of Rice by the N-fixing bacteri Herbaspirillum spp.And Azospirillum brasilense.p. 705.In New Horizons in Nitrogen Fixation. R. Palacions, K. Moor, W.E. and Newton (Eds.). Kluwer Academic Publishers.Dordrecht/Bosten/ London.
Boodey, R.M., Olivera, O.C., Urquiaga, S., Reis, V.M, Olivares, F.L,. Baldani, V.LD. & Doberenier, J. 1995. Biological Nitrogen Fixation Associated with Sugar Cane and Rice: Contribution and Prospects for Improvement. Plant Soil 174: 195-209.
Boonkered, N. 2008.Biofertilizer development februari 2010.
Clay, K. 1988. Fungal Endophytes of Grasses: A Defensive Mutualism Between Plants and Fungi. Ecology69 (1): 10-16.
DOAE. 2003. Bioextract (B.E.). Web library.Department of Agricultural Extension, Thailand. Available in Thai from:
Efendi.2009. Efektivitas Introduksi Bakteri Endofit Pada Bibit Kelapa Sawit Terhadap Pengendalian Infeksi Ganoderma boninensis Pat.USU Digital Library. Medan.
Elvira-Recuenco, M.& van Vuurde, J.W.L. (2000). Natural incidence of endophytic bacteria in pea cultivarsunder field conditions.Can J Microbiol 46: 1036–1041.
FAO. 1983.To Evaluate the Nitrogenase Activity of Legume Nodules using Acetylene Reducing Activity. Technical Handbook on Symbiotic Nitrogen Fixation Food and Agricultural Organization of The United Nation-Rome.
Higa,T. & Parr, G.S. Beneficial and effective microorganism for a sustainable agriculture and environment. Int. Nature farming res. Center (INFRC).Atam. Japan.
Harjono &Widyastuti, S.M. 2001. Antifungal Activity of Purified Endochitinase Produced by Biocontrol Agent Trichoderma reesei Against Ganodermaphilippii. Pakistan Journal of Biological Sciences 4(10): 1232-1234.
Hindersah, R. &Simarmata, T. 2004.Potensi Rizobakteri Azotobacter dalam Meningkatkan Kesehatan Tanah.Jurnal Natur Indonesia5(2): 127-133
Irfan. 2009. Efektivitas Introduksi Fungi Endofit Pada Bibit Kelapa Sawit Terhadap Pengendalian Infeksi Ganoderma boninensis Pat. USU Digital Library. Medan.
James, E. & Olivares, F.L. 1997. Infection and Colonization of Sugarcane and Other Grami-naceous Plant by Endophytic Diazotrophicus. Critical Reviews In Plant Science17:77-119.
Khairani, G. 2010. Isolasi dan Uji Kemampuan Bakteri Endofit Penghasil Hormon IAA (Indole Acetic Acid) dari Akar Tanaman Padi (Oryza sativa L.). USU Digital Library. Medan.
Khalid, A., Arshad, M. & Zahrir, Z.A. 2004.Screening plant growth promoting Rhizobacteria for improving growth and yield off wheat.App Microbiology 96:473
Kirchof, G.V.M., Reis, J.L., Baldani, B., Eckret, Doberiner, J. & Hartman, A. 1997.Occurrunce physicological and moleculler analysis of endophytic diazotropic bacteria in graminaeous plants.Plant and Soil 194: 45-55
Kloepper, J.W., Rodriguez-Kabana, R., Mcinroy, J.A. &Young, R.W. 1992.Rhizosphere Bacteria Antagonistis to Soybean Cyst (Heterodera glycines) and Root Knot (Meloidogyne incognita) Nematodes: Identification by Fatty Acid Analysis and Foliar Diseases. Australasian Plant Pathology28(1): 21-26.
Krieg, N.R. & Doberiner, J. 1984.Genus Azospirillum.in Krieg, N.R., & Hold, J.G. (Eds). Vol.1. The Williams & Wilkins Co. Baltimore.
Kumala, S. 2008. Isolasi bakteri endofit ranting tumbuhan dan aktifitas xilinase.6(4):14:5
Ladha, J.K., De Bruijn, F.J. & Malik, K.A. 1997. Introducing Assecins Oppurtunities for Nitrogen Fixation in Rice: A Frointer Project Plant and Soil 194: 1-10.
Mengel, K.&Kirkby, E.A. 1982.Principles of Plant Nutrition 3rd edition International Potash Institute. Warblaufen-Bern Switzerland.
Mousaif, M., Jacques, P., Schaarwachter, P., Budzikiewicz, H. & Thonart, P. 1997.
Production of cyclosporins from Acremonium luzulae.App.
EnvironmentalMicrobiology63: 1739-1743.
Ngampimol, H. & Kunathigan, V. 2008.The study of shelf for liquid biofertilizer from vegetable waste.Au J.T 11(4): 204-208.
OST Product.Inc., 1999.Organic Soil Treatment. Rajhawali Pharajaya. Jakarta. Hlm.8.
Ozawa, T,.Matsui, E. & Okumura, K. 2000.Endhophytic N2 fixing bacteria in leguminous
crops.Osama Pref. Univ. Osaka Japan.
Purwaningsih, S. 2004. Pengujian Mikroba sebagai Pupuk Hayati terhadap Pertumbuhan Tanaman Acacia mangium pada Pasir Steril di Rumah Kaca.Biodiversitas 5(2) : 85-88
Radji, M. 2004. Pemberian Vaksin Melalui Tanaman Transgenik.Majalah Ilmu Kefarmasian Indonesia. 1(1): 1-9.
Radu, S & Kqueen, C.Y. 2002.Preliminary screening of endophytic fungi from medicinal plants in Malaysia for antimicrobial and antitumor activity.Malaysiana Journal of Medical Science 9(2): 23-33.
Ramamoorthy, S,.Melikian H.E., Qian, Y.&Blakely, R.D. 1998.Biosynthesis, N-glycosylation, and surface trafficking of biogenic amine transporter proteins.Methods Enzymol296:347-370
Robert, M.D. 1975.Plant Physiology.Affiliated East-West Press PVT.LTD. New Delhi.
Russel, E. W. 1973. Soil Condition and Plant Growth 10th edition Longman-ELBS, London.
Salisbury, F.B. & Ross, C.W. 1995. Fisiologi Tumbuhan. Jilid kedua.Institut Teknologi Bandung.
Satyawibawa, I.& Widyastuti, Y. E. 2001. Kelapa sawit: usaha budidaya, pemanfaatan hasil, dan aspek pemasaran.Cetakan ketiga belas. Penebar Swadaya. Jakarta. Hlm. 94-95, 113-114
Statistik Perkebunan Indonesia, 1997-1999.Kelapa Sawit. Departemen Kehutanan dan Perkebunan. Direktorat Jendral Perkebunan. Jakarta.
Strobel, G. A. 2002. Microbial gift from rain forest.Can. J. Plant.Pathol24:14-20
Sturz, A.V., Christie, B.R.& Nowak, J. 2000.Bacterialendophytes: potential role in developing sustainable sys-tems of crop production. Crit Rev Plant Sci 19: 1–30.
Suryanarayanan, T. S., Venkatesan, G.&Murali, T.S. 2003.Endophytic fungal communities in leaves of tropical forest trees: diversity and distruction patterns.Current Science85(4): 489-493
Sutedjo, M. M. 1987. Pupuk Dan Cara Pemupukan. Penerbit Rhineka Cipta. Jakarta.
Susilowati, Saraswati. Hastuti, R.D. & Yuniarti, E. 2007.Increasing of N-uptake by Inoculation of Diazotroph Endophytic Bacteria in Vermiculite Media.Tanah dan Iklim.Bogor.
Tan, R. X. & Zou, W. X., 2001.Endophytes: A rich of functionalmetabolites. Nat. Prod. Rep18: 448-459
Thakuria, D., Talukdar, N.C., Goswani, L., Hazarika & Boro, R.C. 2004. Characterization and screening of bacteria from Rhizosphere of rice grown in acidic soil of assam. Current Science 86: 978-985.
Tim Bina Karya Tani. 2009. Pedoman Bertanam Kelapa Sawit. Penerbit Yrama Widya. Bandung.
Vasudevan, P., Reddy, M.S., Kavitha, S., Velusamy & Paulraj, R.S.D. 2002. Role of biological preparation in enhancement of rice seedling growth and grain yield.Current Science 83: 1140-1143.
Lampiran 2. Uji biokimia sederhana bakteri endofit kelapa sawit
r
Koloni bakteri endofit pada media natrium agar (NA) pada umur satu hari.
Pewarnaan Gram bakteri endofit pada akar tanaman kelapa sawit Gram negatif (a)
dan Gram positif (b) perbesaran 10x10.
Bakteri endofit pada uji biokimia sederhana A. Uji Triple Sugar Iron Agar /TSIA; B. Uji gelatin; C. Uji Simon Citrat Agar/SCA; dan D. Uji Pati, umur 48 jam
A. B. C. D.
Lampiran 4 Rata-rata pengamatan pertumbuhan kelapa sawit dari bulan I-V dari tiga ulangan dengan interval pengamatan dua minggu sekali
Kode Isolat
Pengamatan 1
Pengamatan 2 Pengamatan
3
Pengamatan 4 Pengamatan 5 Pengamatan 6
T J.D T J.D T J.D T J.D T J.D T J.D
NFB 1 5,5cm 2 10,83 2 18,17 3 19,27 3 22,5 5 25,7 4
NFB 2 5,23 1 8,83 2 16,33 3 18,63 3 33,1 4 25,17 4
NFB 3 6,27 2 10,17 2 1int8 3 19,23 3 25,83 4 25,8 4
NFB 4 7,5 2 11,5 2 18,33 3 20,2 3 24,3 4 26,27 9
NFB 5 9,5 2 11 2 16,83 3 18,4 3 23,1 3 23,7 4
NFB 6 6,17 3 8,9 2 14,63 3 17,53 3 19,57 3 20,53 3
NFB 7 4,57 1 12 2 13 3 15 3 19 3 20,1 4
NFB 8 5,17 2 9,23 2 18,33 3 18,4 3 20,3 4 22,7 4
NFB 9 7,3 2 12,6 3 20 3 20,53 3 25,83 4 27,23 5
NFB 10 5,53 2 10,77 2 15,5 3 16,5 3 23,63 4 23,9 9
NFB 11 5,93 2 11,07 2 20,17 3 21,47 3 25,83 4 27,57 4
NFB 12 5,1 2 9,97 2 17,5 3 18,7 3 22,33 3 24,1 4
NFB 13 5,03 2 11 2 17,33 3 18,93 3 22,43 4 25,87 5
NFB 14 5,47 1 12,1 2 18,77 3 21,3 3 25,2 4 27,17 5
NFB 15 4,93 2 9,87 2 14,53 3 18 3 24,47 3 24,9 4
NFB 16 4,38 1 8,85 1 13,4 2 20,05 2 21,83 3 21,75 4
NFB 17 9 2 11,67 2 18,8 3 17,77 3 25,7 4 27,7 5
NFB 18 6,43 1 12,13 2 17,17 3 20,27 3 24,17 4 26,33 4
NFB 19 5,7 1 8,73 2 14,27 3 17,67 3 23,13 4 22,27 4
NFB 20 7,07 1 10,7 2 17,67 3 16,03 3 19,3 3 23,57 4
kode Pengamatan 7
Pengamatan 8 Pengamatan
9
Pengamatan 10
T J.D T J.D T J.D T J.D
NFB 1 27,57 5 29 7 29,43 7 30,9 8
NFB 2 26,7 4 29,13 5 30,9 6 31,2 8
NFB 3 27 5 29,37 6 29,9 6 36,4 8
NFB 4 28,8 5 30,4 6 31,73 7 32,27 8
NFB 5 25,7 5 26,7 6 28,67 7 28,57 7
NFB 6 21,27 4 21,3 5 22 5 22,5 5
NFB 7 20,3 4 22 5 23,5 6 24 6
NFB8 23,9 4 25 5 27,57 6 28,5 7
NFB 9 29,63 5 30,97 7 31,73 7 33,87 9
NFB 10 25,53 5 26,47 5 27 6 31,03 7
NFB 11 29,2 5 30,87 6 31,23 7 32,57 8
NFB 12 23,73 5 28,6 7 31,07 7 33,4 9
NFB 13 25,93 5 27,37 5 27,23 8 28,73 9
NFB 14 28,8 5 29,13 6 30,23 7 30,07 8
NFB 15 27,13 5 27,73 7 28,73 7 28,9 8
NFB 16 22,05 4 22,7 5 24,25 6 26 7
NFB 17 28,9 4 29,7 6 30,63 6, 30,2 7
NFB 18 23,67 5 25,47 6 27,5 7 29,27 9
NFB 19 23,87 5 24,3 5 25,27 5 26 7
NFB 20 25,2 5 27,23 6 29,17 6 30,73 7
Lampiran 5.Komposisi media Nitrogen Free BromthymolBlue (NFB)
Media NFB semi solid : Malic acid 5 g, KH2PO4 0,5g, MgSO4 + 7H2O 0,2g, NaCl 0,1g, CaCl2 + 2H2O 0,02g, minor element solution (CuSO4 + 5H2O 0,4g; ZnSO4 + 7H2O 0,12g; H2BO3 1,4g; N2MoO4 + 2H2O 1g; MnSO4 + H2O 1,5g dan H2O 100ml), Bromthymol blue solution, 0,5% dalam 0,2N KOH 2ml, Fe-EDTA 4ml, pH 6,8, vitamin
Lampiran 6. Jumlah bakteri reisolasi
NFB 1 132 146 162 440 147
NFB 2 204 198 200 602 201
NFB 3 254 198 233 684 228
NFB 4 278 199 254 731 247
NFB 5 165 134 200 499 166
NFB 6 102 78 87 267 89
NFB 7 183 98 120 401 137
NFB 8 230 124 154 508 169
NFB 9 167 134 178 513 171
NFB10 198 135 211 544 181
NFB11 203 187 145 535 178
NFB 12 298 102 102 502 167
NFB13 178 186 186 550 183
NFB 14 128 135 167 430 143
NFB 15 186 99 101 386 129
NFB 16 98 120 126 344 115
NFB 17 167 154 202 523 174
NFB 18 223 139 107 469 156
NFB 19 147 156 198 501 167
NFB 20 Kontrol 134 0 147 12 176 0 457 12 152 4 KODE ISOLAT