Keragaman Genetik Gyrinops verstegii asal Papua
Berdasarkan RAPD dan Mikrosatelit
RIMA HERLINA SETIAWATI SIBURIAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Tesis Keragaman Genetik Gyrinops verstegii asal Papua Berdasarkan RAPD dan Mikrosatelit adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Juli 2009
ABSTRACT
RIMA HERLINA SETIAWATI SIBURIAN. Genetic Variation of Gyrinops verstegii originated from Papua based on RAPD and Mikrosatelit. Under direction of ULFAH JUNIARTI SIREGAR and ISKANDAR ZULKARNAEN SIREGAR
Gyrinops verstegii is one of the potential tree species for the production of agarwood in the eastern part of Indonesia. In its natural habitat, this species is found to be morphologically variable. This morpho-variation may reflect the degree of genetic diversity as usually observed in many plant species. However, genetic information of Gyrinops verstegii is still lacking. A genetic inventory was therefore undertaken, aiming at estimating the genetic variation using wild population sampled from low and high altitudes, i.e. Kebar and Manokwari. Genetic analyses were performed using two DNA markers, i.e RAPD and microsatellites following standard procedures. Results showed that the genetic variability of Kebar population (He= 0,2944) was higher than that of Manokwari (He= 0.2357). AMOVA analysis showed that most of the variation is stored in individual level contributing to 89 % of the total variation. Dendrogram analysis showed that the reproductive populations, i.e mother tree and its progenies of each location, were grouped together. This molecular information can be used for scientific consideration in developing strategies for conservation and breeding.
RINGKASAN
RIMA HERLINA SETIAWATI SIBURIAN. Keragaman Genetik Gyrinops verstegii asal Papua berdasarkan RAPD dan Mikrosatelit. Dibimbing oleh ULFAH JUNIARTI SIREGAR dan ISKANDAR ZULKARNAEN SIREGAR.
Gyrinops verstegii merupakan salah satu tanaman penghasil gaharu yang berasal dari Papua. Gyrinops verstegii yang dijumpai di alam memiliki morfologi daun yang agak berbeda, terutama pada daerah dengan ketinggian tempat tumbuh yang berbeda. Perbedaan morfologi ini menunjukkan tingkat keragaman genetik seperti yang umum dijumpai pada berbagai jenis tumbuhan lain.
Informasi keragaman genetik, berupa tingkat dan distribusi keragaman yang ada pada suatu jenis sangat penting untuk diketahui berkaitan dengan penyusunan strategi pemuliaan (breeding) dan juga konservasinya. Keragaman genetik yang ada merupakan sumberdaya yang dapat memberikan peluang untuk dilakukannya rekombinasi, evaluasi dan seleksi. Informasi keragaman genetik dapat diperoleh dengan melakukan kegiatan inventarisasi genetik baik melalui pengujian lapangan (field trial) ataupun analisis dengan bantuan penanda genetik. Penelitian ini bertujuan untuk mengetahui variasi genetik tanaman Gyrinops verstegii yang berasal dari dataran rendah dan tinggi (Manokwari dan Kebar) dengan menggunakan penanda DNA RAPD dan Mikrosatelit.
Nilai keragaman genetik Gyrinops verstegii dalam populasi dengan menggunakan metode RAPD menunjukkan keragaman genetik populasi Kebar (He = 0,2944) lebih tinggi dibanding populasi Manokwari. (He = 0,2357). Hasil AMOVA menunjukkan bahwa sumbangan keragaman terbesar diberikan oleh keragaman antar individu yakni sebesar 89% dari total ragam.
Analisis dendogram berdasarkan jarak genetik, menunjukkan bahwa populasi induk dan anakan dalam satu lokasi membentuk satu kelompok dengan jarak genetik yang kecil, sedang antar populasi induk Manokwari dan Kebar memiliki jarak genetik yang besar. Hal ini menggambarkan kedua kelompok tersebut terpisah dan diduga hal ini menjadi penghalang terjadinya aliran gen. Informasi keragaman genetik ini diharapkan dapat menjadi dasar strategi pengembangan konservasi dan pemuliaan.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sabagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Keragaman Genetik Gyrinops verstegii asal Papua
Berdasarkan RAPD dan Mikrosatelit
RIMA HERLINA SETIAWATI SIBURIAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Silvikultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Keragaman Genetik Gyrinops verstegii asal Papua Berdasarkan RAPD dan Mikrosatelit
Nama : Rima Herlina Setiawati Siburian
NIM : E 451070021
Disetujui Komisi Pembimbing
Dr.Ir. Ulfah Juniarti Siregar, M.Agr Dr. Ir. Iskandar Z. Siregar. M.For.Sc
Ketua Anggota
Diketahui
Koordinator Mayor Dekan Sekolah Pasca Sarjana Silvikultur Tropika
Prof. Dr. Ir. I G K Tapa Darma, M.Sc Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas segala hikmat dan karuniaNya, sehingga penelitian ini dapat diselesaikan dengan baik. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2008 ini ialah keragaman genetik, dengan judul Keragaman Genetik Gyrinops verstegii asal Papua Berdasarkan RAPD dan Mikrosatelit.
Gyrinops verstegii merupakan salah satu jenis tanaman penghasil gaharu yang dapat dijumpai pada daerah kepala burung Papua, namun memiliki bentuk morfologi daun yang agak berbeda antara daerah Kebar (dataran tinggi) dan Manokwari (daerah dataran rendah). Perbedaan morfologi ini dapat disebabkan oleh faktor lingkungan dan genetik. Informasi genetik berupa tingkat dan distribusi keragaman yang ada pada suatu jenis sangat penting untuk diketahui, berkaitan dengan penyusunan strategi pemuliaan. Dalam upaya tersebut, penulis mencoba melakukan penelitian mengenai keragaman genetik Gyrinops verstegii guna memberikan informasi dalam menunjang program pemuliaan dan konservasi sumberdaya genetik terutama untuk spesies tersebut.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Ulfah Juniarti Siregar, M.Agr dan Bapak Dr. Ir. Iskandar Z. Siregar, M.For.Sc selaku pembimbing yang telah banyak memberikan masukan dan saran dalam pelaksanaan dan penyelesaian tesis ini. Di samping itu, penghargaan penulis sampaikan kepada seluruh staf dan teman-teman Laboratorium Silvikultur IPB, Bapak Prof. Dr. Ir. Alex Hartana, M.Sc beserta staf Laboratorium Biologi tumbuhan PAU IPB, dan Ibu Agustina Ika beserta staf NAMRU-2 Jakarta. Ungkapan terimakasih juga disampaikan kepada ayah, ibu, suami, anak-anakku (Ista dan Lia), serta seluruh keluarga dan sahabat atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bokondini Papua pada tanggal 23 Mei 1973 dari ayah Drs. S.D. Siburian dan ibu R. Simatupang. Penulis merupakan putri pertama dari tiga bersaudara.
Keragaman Genetik Gyrinops verstegii asal Papua
Berdasarkan RAPD dan Mikrosatelit
RIMA HERLINA SETIAWATI SIBURIAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Tesis Keragaman Genetik Gyrinops verstegii asal Papua Berdasarkan RAPD dan Mikrosatelit adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Juli 2009
ABSTRACT
RIMA HERLINA SETIAWATI SIBURIAN. Genetic Variation of Gyrinops verstegii originated from Papua based on RAPD and Mikrosatelit. Under direction of ULFAH JUNIARTI SIREGAR and ISKANDAR ZULKARNAEN SIREGAR
Gyrinops verstegii is one of the potential tree species for the production of agarwood in the eastern part of Indonesia. In its natural habitat, this species is found to be morphologically variable. This morpho-variation may reflect the degree of genetic diversity as usually observed in many plant species. However, genetic information of Gyrinops verstegii is still lacking. A genetic inventory was therefore undertaken, aiming at estimating the genetic variation using wild population sampled from low and high altitudes, i.e. Kebar and Manokwari. Genetic analyses were performed using two DNA markers, i.e RAPD and microsatellites following standard procedures. Results showed that the genetic variability of Kebar population (He= 0,2944) was higher than that of Manokwari (He= 0.2357). AMOVA analysis showed that most of the variation is stored in individual level contributing to 89 % of the total variation. Dendrogram analysis showed that the reproductive populations, i.e mother tree and its progenies of each location, were grouped together. This molecular information can be used for scientific consideration in developing strategies for conservation and breeding.
RINGKASAN
RIMA HERLINA SETIAWATI SIBURIAN. Keragaman Genetik Gyrinops verstegii asal Papua berdasarkan RAPD dan Mikrosatelit. Dibimbing oleh ULFAH JUNIARTI SIREGAR dan ISKANDAR ZULKARNAEN SIREGAR.
Gyrinops verstegii merupakan salah satu tanaman penghasil gaharu yang berasal dari Papua. Gyrinops verstegii yang dijumpai di alam memiliki morfologi daun yang agak berbeda, terutama pada daerah dengan ketinggian tempat tumbuh yang berbeda. Perbedaan morfologi ini menunjukkan tingkat keragaman genetik seperti yang umum dijumpai pada berbagai jenis tumbuhan lain.
Informasi keragaman genetik, berupa tingkat dan distribusi keragaman yang ada pada suatu jenis sangat penting untuk diketahui berkaitan dengan penyusunan strategi pemuliaan (breeding) dan juga konservasinya. Keragaman genetik yang ada merupakan sumberdaya yang dapat memberikan peluang untuk dilakukannya rekombinasi, evaluasi dan seleksi. Informasi keragaman genetik dapat diperoleh dengan melakukan kegiatan inventarisasi genetik baik melalui pengujian lapangan (field trial) ataupun analisis dengan bantuan penanda genetik. Penelitian ini bertujuan untuk mengetahui variasi genetik tanaman Gyrinops verstegii yang berasal dari dataran rendah dan tinggi (Manokwari dan Kebar) dengan menggunakan penanda DNA RAPD dan Mikrosatelit.
Nilai keragaman genetik Gyrinops verstegii dalam populasi dengan menggunakan metode RAPD menunjukkan keragaman genetik populasi Kebar (He = 0,2944) lebih tinggi dibanding populasi Manokwari. (He = 0,2357). Hasil AMOVA menunjukkan bahwa sumbangan keragaman terbesar diberikan oleh keragaman antar individu yakni sebesar 89% dari total ragam.
Analisis dendogram berdasarkan jarak genetik, menunjukkan bahwa populasi induk dan anakan dalam satu lokasi membentuk satu kelompok dengan jarak genetik yang kecil, sedang antar populasi induk Manokwari dan Kebar memiliki jarak genetik yang besar. Hal ini menggambarkan kedua kelompok tersebut terpisah dan diduga hal ini menjadi penghalang terjadinya aliran gen. Informasi keragaman genetik ini diharapkan dapat menjadi dasar strategi pengembangan konservasi dan pemuliaan.
© Hak Cipta milik IPB, tahun 2009
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sabagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
Keragaman Genetik Gyrinops verstegii asal Papua
Berdasarkan RAPD dan Mikrosatelit
RIMA HERLINA SETIAWATI SIBURIAN
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Silvikultur
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Keragaman Genetik Gyrinops verstegii asal Papua Berdasarkan RAPD dan Mikrosatelit
Nama : Rima Herlina Setiawati Siburian
NIM : E 451070021
Disetujui Komisi Pembimbing
Dr.Ir. Ulfah Juniarti Siregar, M.Agr Dr. Ir. Iskandar Z. Siregar. M.For.Sc
Ketua Anggota
Diketahui
Koordinator Mayor Dekan Sekolah Pasca Sarjana Silvikultur Tropika
Prof. Dr. Ir. I G K Tapa Darma, M.Sc Prof. Dr. Ir. Khairil A. Notodiputro, M.S
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas segala hikmat dan karuniaNya, sehingga penelitian ini dapat diselesaikan dengan baik. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Juli 2008 ini ialah keragaman genetik, dengan judul Keragaman Genetik Gyrinops verstegii asal Papua Berdasarkan RAPD dan Mikrosatelit.
Gyrinops verstegii merupakan salah satu jenis tanaman penghasil gaharu yang dapat dijumpai pada daerah kepala burung Papua, namun memiliki bentuk morfologi daun yang agak berbeda antara daerah Kebar (dataran tinggi) dan Manokwari (daerah dataran rendah). Perbedaan morfologi ini dapat disebabkan oleh faktor lingkungan dan genetik. Informasi genetik berupa tingkat dan distribusi keragaman yang ada pada suatu jenis sangat penting untuk diketahui, berkaitan dengan penyusunan strategi pemuliaan. Dalam upaya tersebut, penulis mencoba melakukan penelitian mengenai keragaman genetik Gyrinops verstegii guna memberikan informasi dalam menunjang program pemuliaan dan konservasi sumberdaya genetik terutama untuk spesies tersebut.
Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Ulfah Juniarti Siregar, M.Agr dan Bapak Dr. Ir. Iskandar Z. Siregar, M.For.Sc selaku pembimbing yang telah banyak memberikan masukan dan saran dalam pelaksanaan dan penyelesaian tesis ini. Di samping itu, penghargaan penulis sampaikan kepada seluruh staf dan teman-teman Laboratorium Silvikultur IPB, Bapak Prof. Dr. Ir. Alex Hartana, M.Sc beserta staf Laboratorium Biologi tumbuhan PAU IPB, dan Ibu Agustina Ika beserta staf NAMRU-2 Jakarta. Ungkapan terimakasih juga disampaikan kepada ayah, ibu, suami, anak-anakku (Ista dan Lia), serta seluruh keluarga dan sahabat atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Juli 2009
RIWAYAT HIDUP
Penulis dilahirkan di Bokondini Papua pada tanggal 23 Mei 1973 dari ayah Drs. S.D. Siburian dan ibu R. Simatupang. Penulis merupakan putri pertama dari tiga bersaudara.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xii
DAFTAR GAMBAR ... xiii
PENDAHULUAN... 1
Latar Belakang... 1
Masalah... 2
Tujuan Penelitian... 3
Manfaat Penelitian... 3
TINJAUAN PUSTAKA ... 4
Botani Tumbuhan Gaharu... 4
Karakteristik morfologi Gyrinops verstegii ... 5
Keragaman Genetik Tanaman Hutan ... 5
RAPD (Random Amplified Polymorphic DNA) ... 7
Mikrosatelit ... 10
METODE PENELITIAN ... .... 12
Tempat dan Waktu Penelitian ... 12
Bahan dan Alat Penelitian... 13
Prosedur Penelitian ... 14
Pengambilan Sampel ... 14
Ekstraksi DNA ... 14
Seleksi Primer ... 15
PCR (Polymerase Chain Reaction) ... 17
Analisis Data ... 17
HASIL DAN PEMBAHASAN ... 20
Polimorfisme RAPD dan Mikrosatelit... 20
Keragaman Genetik Gyrinops verstegii berdasarkan RAPD ... 22
Keragaman dalam Populasi ... 22
DAFTAR TABEL
DAFTAR GAMBAR
Halaman 1. Bentuk bunga dan buah Gyrinops verstegii... 6 2. Tahapan-tahapan pada proses PCR (Polymerase Chain Reaction)... 11 3. Peta lokasi pengambilan sampel di daerah Manokwari dan Kebar ... 12 4. Anakan dan Induk tanaman Gyrinops verstegii ... 13 5. Cara penilaian pita dengan sistim scoring ... 18 6. Profil pita DNA dengan primer OPO 09, OPO 10, OPY 13, OPY 9 dan
OPO 14 ... 20 7. Profil hasil elektroforesis untuk primer 6 PA 18 F dan 6PA 18 R-FAM (a)
dan 14 PA 17 F dan 14 PA 17 R ... 21 8. Dendogram Jarak Genetik Antar Populasi Gyrinops verstegii berdasar
PENDAHULUAN
Latar Belakang
Gaharu merupakan hasil dari pohon-pohon terinfeksi yang tumbuh didaerah tropis dan berasal dari marga Aquilaria, Gyrinops dan Gonystilus yang keseluruhannya termasuk dalam famili Thymeleaceae. Marga Aquilaria terdiri dari 15 species, tersebar mulai dari India, Pakistan, Myanmar, Thailand, Kamboja, Cina Selatan, Malaysia, Filipina dan Indonesia. Enam diantaranya ditemukan di Indonesia (A. malaccensis, A. microcarpa, A. hirta, A. becariana, A. cumingiana dan A. filaria). Keenam jenis tersebut terdapat hampir di seluruh kepulauan Indonesia, kecuali Jawa, Bali dan Nusa Tenggara. Marga Gonystilus memiliki 20 spesies, tersebar di Asia Tenggara mulai dari Malaysia, Peninsula, Serawak, Sabah, Indonesia, Papua New Guinea, Philipina dan kepulauan Salomon serta Kepulauan Nicobar. Sembilan spesies diantaranya terdapat di Indonesia yaitu di Sumatera, Kalimantan, Bali, Maluku dan Papua. Marga Gyrinops memiliki tujuh spesies, enam diantaranya tersebar di Indonesia bagian Timur (Annonimous 2009)
Tanaman penghasil gaharu yang telah diidentifikasi dan banyak terdapat di Papua adalah jenis Aquilaria filarial, Aquilaria secundana, Aquilaria tomentosa, Aetoxylon sympethalum, Enkleia malacensis, Wikstroemia poliantha, Wikstroemia androsaemofilia,
Girynops cumingiana, Girynops salicifolia, Girynops audate dan Girynops podocarpus
(Sumarna 2005). Jenis Girynops verstegii menurut Sumarna lebih banyak penyebarannya pada daerah provinsi NTT dan NTB, sedang daerah Papua diketahui tidak termasuk daerah penyebaran jenis ini. Namun menurut hasil survey Waroy (2006), jenis Gyrinops verstegii dapat dijumpai pada sekitar daerah kepala burung Papua.
Girynops verstegii yang dijumpai pada daerah ini memiliki morfologi daun yang agak berbeda, terutama pada daerah dengan letak topografi yang berbeda. Keragaman ini menurut Soerianegara dan Djamhuri (1979), disebabkan adanya keragaman geografis (antar provenansi), keragaman lokal (keragaman antar tempat tumbuh, antar tapak), keragaman antar pohon, dan keragaman di dalam pohon.
sumber daya yang dapat memberikan peluang untuk dilakukannya rekombinasi, evaluasi dan seleksi. Informasi keragaman genetik dapat diperoleh dengan melakukan kegiatan inventarisasi genetik, baik melalui pengujian lapangan (field trial) ataupun analisis dengan bantuan penanda genetik.
Penelitian tentang keragaman genetik Gyrinops verstegii perlu dilakukan untuk memperoleh informasi keragaman genetik tanaman ini baik di dalam maupun antar populasi. Penelitian terdahulu mengenai beberapa jenis tanaman penghasil gaharu telah dilakukan, namun penelitian mengenai keragaman genetik species Gyrinops verstegii belum pernah dilakukan.
Analisis Permasalahan
Tanaman Gyrinops verstegii yang berasal dari daerah kepala burung di Papua memiliki bentuk daun yang berbeda. Daun yang berasal dari daerah Kebar (dataran tinggi) memiliki bentuk agak oval dan tebal, sedangkan daun yang berasal dari Asai Manokwari (daerah dataran rendah) memiliki bentuk lonjong serta bergelombang dan lebih tipis dibandingkan daun dari daerah Kebar. Berdasarkan hal tersebut pertanyaan yang diajukan dalam penelitian ini adalah; i). Apakah perbedaan bentuk morfologi daun dan kondisi tempat tumbuh dari kedua populasi akan mempengaruhi keragaman genetik, sekalipun berasal dari spesies tanaman yang sama? dan ii) Sejauh mana perbedaan genetik antara populasi tanaman dewasa dengan anakannya pada daerah yang sama.
Sebagai langkah awal untuk mempelajari keragaman genetik tanaman Gyrinops verstegii maka perlu dilakukan seleksi awal terhadap primer-primer yang polimorfisme. Metode ekstraksi DNA serta analisis genetik terhadap beberapa jenis tanaman hutan tropis seperti Tectona grandis, Shorea leprosula, Casuarina equisetifolia, Paraserianthes falcataria, Araucaria cunninghamii, Eusideroxylon zwageri, Pinus densiflora, dan Chamaecyparis formonsensis, telah banyak dilakukan, dan informasi mengenai kesesuaian primer yang digunakan dalam pengujian keragaman genetik ini perlu dilakukan terlebih dahulu, sebelum melakukan pengujian terhadap keragaman genetik baik dalam populasi maupun antar populasi.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui keragaman genetik tanaman Gyrinops verstegii yang berasal dari dua tempat tumbuh dengan ketinggian yang berbeda di Papua, dengan menggunakan penanda DNA RAPD dan Mikrosatelit.
Manfaat Penelitian
TINJAUAN PUSTAKA Botani Tumbuhan Gaharu
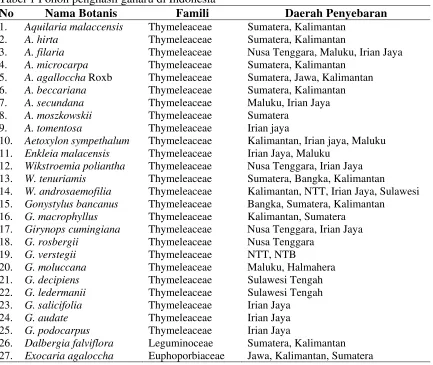
Secara botanis, pohon penghasil gaharu tergolong tumbuhan tinggi dari divisio : spermatophyta, klas : Dicotyledoeneae, serta memiliki 3 famili yaitu : Thymeleaceae, Euporbiaceae,dan Leguminoceae dan berasal dari genus : Aquilaria, Aetoxylon, Enkleia, Gonystylus, Wikstroemia, Girynops, Dalbergia, dan Exxocaria (Sumarna 2005). Data sementara pohon penghasil gaharu dalam Sumarna (2005) dapat dilihat pada Tabel 1.
Tabel 1 Pohon penghasil gaharu di Indonesia
No Nama Botanis Famili Daerah Penyebaran
1. Aquilaria malaccensis Thymeleaceae Sumatera, Kalimantan
2. A. hirta Thymeleaceae Sumatera, Kalimantan
3. A. filaria Thymeleaceae Nusa Tenggara, Maluku, Irian Jaya
4. A. microcarpa Thymeleaceae Sumatera, Kalimantan
5. A. agalloccha Roxb Thymeleaceae Sumatera, Jawa, Kalimantan
6. A. beccariana Thymeleaceae Sumatera, Kalimantan
7. A. secundana Thymeleaceae Maluku, Irian Jaya
8. A. moszkowskii Thymeleaceae Sumatera
9. A. tomentosa Thymeleaceae Irian jaya
10. Aetoxylon sympethalum Thymeleaceae Kalimantan, Irian jaya, Maluku
11. Enkleia malacensis Thymeleaceae Irian Jaya, Maluku
12. Wikstroemia poliantha Thymeleaceae Nusa Tenggara, Irian Jaya
13. W. tenuriamis Thymeleaceae Sumatera, Bangka, Kalimantan
14. W. androsaemofilia Thymeleaceae Kalimantan, NTT, Irian Jaya, Sulawesi
15. Gonystylus bancanus Thymeleaceae Bangka, Sumatera, Kalimantan
16. G. macrophyllus Thymeleaceae Kalimantan, Sumatera
17. Girynops cumingiana Thymeleaceae Nusa Tenggara, Irian Jaya
18. G. rosbergii Thymeleaceae Nusa Tenggara
19. G. verstegii Thymeleaceae NTT, NTB
20. G. moluccana Thymeleaceae Maluku, Halmahera
21. G. decipiens Thymeleaceae Sulawesi Tengah
22. G. ledermanii Thymeleaceae Sulawesi Tengah
23. G. salicifolia Thymeleaceae Irian Jaya
24. G. audate Thymeleaceae Irian Jaya
25. G. podocarpus Thymeleaceae Irian Jaya
26. Dalbergia falviflora Leguminoceae Sumatera, Kalimantan
27. Exocaria agaloccha Euphoporbiaceae Jawa, Kalimantan, Sumatera
Karakteristik Morfologis Gyrinops verstegii
Bentuk batang Gyrinops verstegii adalah silindris, tidak berbanir, dan tekstur kulit bagian luar agak kasar serta tidak bergetah. Warna kulit batang adalah coklat keputih-putihan dan bagian dalam batang berwarna putih. Menurut Moega et al. (2001), tinggi pohon Gyrinops verstegii dapat mencapai 25 m, dengan diameter 40 cm. Daun elips memanjang, urat daun lateral sejajar, berukuran 10- 20 cm, lebar 2 – 3 cm, dan berwarna hijau licin. Pembungaan terminal mendukung 6-8 bunga. Bunga berupa tabung berukuran 3,5 mm, warna putih kehijauan, benangsari berjumlah 5. Buah bulat telur berukuran 1 cm. Morfologi dan warna daun Gyrinops verstegii dapat dilihat pada Gambar 1.
Gambar 1 Bentuk bunga dan buah Gyrinops verstegii.
Keragaman Genetik Tanaman Hutan
Dalam hal ini keragaman banyak dipengaruhi oleh perbedaan genetik yang diturunkan dari tetua kepada keturunannya, dan disebut keragaman genetik (genetic variation) (Soerianegara dan Djamhuri 1979).
Keragaman genetik dari suatu keturunan merupakan hasil dari perkembangbiakan secara seksual. Perkembangbiakan secara seksual terjadi dengan adanya sel reproduktif (gamet) jantan dan betina yang bersatu melalui proses perkawinan, sel reproduktif yang bersatu mengalami proses meiosis dimana terjadi proses reduksi jumlah kromosom dari diploid (2n) dalam sel tetua menjadi haploid (n) dalam gamet mengikuti hukum segregasi secara bebas (Hukum Mendel I). Selanjutnya pada saat perkawinan terjadi rekombinasi gamet secara acak menurut Hukum Mendel II. Selain itu pada saat meiosis, kromosom homolog juga akan mengalami pindah silang dan kadang-kadang terjadi perubahan susunan genetik karena mutasi yang akan menambah keragaman dari keturunan (Crowder 1986).
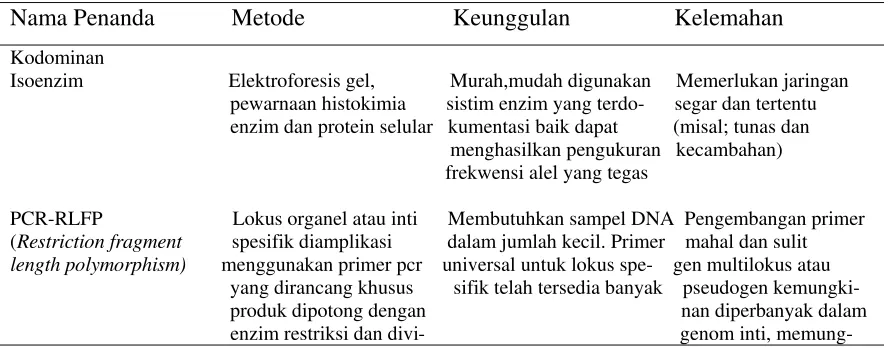
[image:30.612.85.529.547.723.2]Seiring dengan perkembangan bioteknologi molekuler, penemuan metode-metode penanda genetik telah mempercepat pendugaan keragaman genetik tanaman. Penanda genetik molekuler dapat menilai keragaman genetik tanpa dipengaruhi lingkungan bahkan umur tanaman. Penanda molekuler yang telah digunakan dalam penelitian keragaman suatu populasi tanaman hutan adalah isoenzim, restriction fragment length polymorphism (RFLP), simple sequence repeat (SSR), amplified fragment lenght polymorphism (AFLP), dan random amplified polymorphic DNA (RAPD) dengan berbagai kelebihan dan kekurangannya (Tabel 2).
Tabel 2 Penanda Molekuler yang telah digunakan pada tanaman kehutanan
Nama Penanda Metode Keunggulan Kelemahan
Kodominan
Isoenzim Elektroforesis gel, Murah,mudah digunakan Memerlukan jaringan pewarnaan histokimia sistim enzim yang terdo- segar dan tertentu enzim dan protein selular kumentasi baik dapat (misal; tunas dan menghasilkan pengukuran kecambahan) frekwensi alel yang tegas
Nama Penanda Metode Keunggulan Kelemahan
sualisasi langsung dengan kinkan kesalahan iden- elektroforesis gel. titas dan frekwensi alel
SSR (Simple sequence Primer PCR untuk me- Alel lokus tunggal yang Lokasi bermikrosatelit repeats) ngamplifikasi motif- tegas dapat dinilai berbeda antar taxa, motif berulang yang sehingga diperlukan hipervariabel dalam pengembangan yang genom inti atau organel mahal dan sulit untuk setiap jenis baru. Dominan
RAPD (Random Primer sequen pendek Analisis secara acak Lokasi genomik tidak Amplified Polymorphic digunakan untuk dapat diketahui tanpa DNA) mengamplifikasi lokus persilangan yang acak pada seluruh dikontrol genom dengan PCR
AFLP (Amplified DNA genomik total lebih reproduksibel Lebih mahal dibanding Fragment lenght dipotong dengan 2 dibanding RAPD RAPD label radioaktif Polymorphism) enzim restriksi dengan skoring otomatis tersedia mungkin diperlukan Selektif dengan meng-
Gunakan primer
RAPD (
Random Amplified Polymorphic DNA
)
Pertama kali teknik RAPD dilakukan oleh Williams et al. (1990) diacu dalam Septimayani (2002), berhasil mengamplifikasi DNA yang bersifat polimorfik dengan menggunakan primer acak serta bantuan enzim Taq DNA polymerase. RAPD banyak digunakan karena mempunyai beberapa keuntungan. Selanjutnya Williams et al. (1990) mengungkapkan bahwa metode RAPD lebih sederhana, cepat, DNA yang diperlukan sedikit, tidak perlu terlalu murni, dan tidak menggunakan satu primer.
Disamping kelebihan tersebut teknik ini juga memiliki kelemahan yakni dapat memberikan hasil yang berbeda-beda apabila diulang, sehingga dianggap kurang handal (reliable), khususnya bagi keperluan diagnostik yang disebabkan oleh rendahnya akurasi pengulangan hasil amplifikasi. Selain itu Ellsworth et al. (1993) mengungkapkan bahwa RAPD sensitif terhadap perubahan kecil dalam reaksi yang dapat menggangu kemampuan reproduksi pola-pola pita, karena perbedaan eksperimen, alat PCR dan laboratorium.
DNA (RAPD), dan (4) tahap pengujian kualitas dan kuantitas hasil amplifikasi. Menurut Sambrook (1989), daun yang masih muda dengan berat 0,2 - 0,3 g cukup untuk menghasilkan DNA yang sesuai dengan kebutuhan selama analisis, sementara itu menurut Karsinah (1999) dari jaringan tanaman dewasa dan daun kering masih bisa didapatkan ekstrak DNAnya. Menurut Kimball (1992), sel berkembang dengan cara menggandakan diri dan memperbesar volume sel. Oleh karena itu, semakin muda suatu jaringan daun akan memberikan peluang yang lebih besar dalam menghasilkan DNA dalam jumlah yang lebih besar daripada daun yang sudah lebih tua umurnya.
Ekstraksi DNA pada prinsipnya adalah suatu proses pengisolasian DNA dengan cara fisik (penggerusan) dibantu oleh senyawa-senyawa kimia dengan metode tertentu sehingga didapat DNA yang terpisah dari kontaminan. Keberhasilan pengekstrakan DNA dapat diketahui dengan pengujian kuantitas dan kualitas DNA. Uji kuantitas dan kualitas DNA dilakukan dengan proses elektroforesis dengan menggunakan gel agarose. Untuk melihat DNA hasil ekstraksi digunakan alat UV transilluminator.
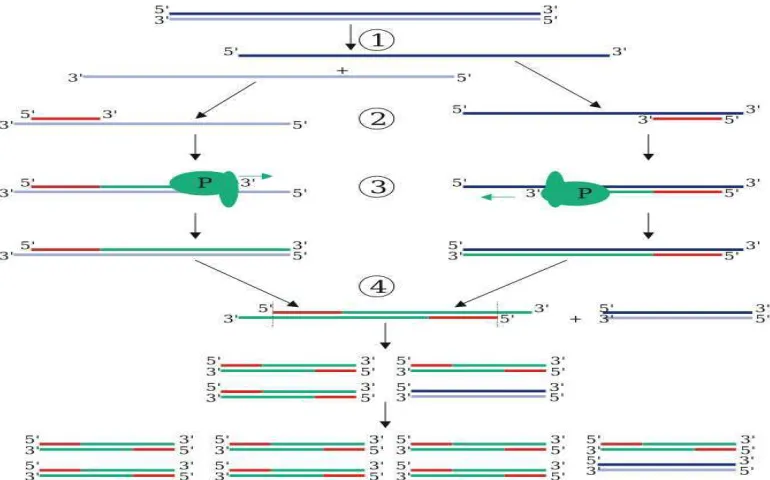
Proses amplifikasi DNA dengan metode (RAPD), pada intinya adalah proses perbanyakan DNA secara enzimatis. Pada tahap ini terdapat tiga proses, yaitu (1) proses denaturasi DNA pada suhu 950 C, (2) proses penempelan DNA (annealing) dan (3) proses ekstensi.
DNA adalah materi genetik yang terdiri atas dua utas ganda yang berpilin (Watson et al. 1987). Menurut Jusuf (1991), pada suhu tinggi pita ganda tersebut berpisah menjadi dua utas tunggal. Apabila pita ganda DNA telah terpisah, maka pada tahap kedua terjadi penempelan primer pada kedua ujung DNA sebagai titik awal pembacaan dan perbanyakan basa-basa DNA. Selanjutnya dilakukan proses pemanjangan dan pembentukan utas DNA yang baru (ekstensi).
produk non spesifik. Jika konsentrasi primer terlalu rendah, hasil dari produk PCR akan rendah (Abdullah dan Retnoningrum 2003).
Tahap terakhir dari RAPD adalah elektroforesis hasil amplifikasi. Pada tahap ini terjadi pemisahan pita-pita DNA berdasarkan perbedaan berat molekulnya. Pita DNA yang mempunyai berat molekul lebih ringan akan berjalan lebih cepat. Keragaman antar populasi dapat dilihat dengan melihat perbedaan pola pita (polymorfisme) DNA antar populasi.
Teknik ini dapat tercipta dengan adanya penemuan Taq polymerase tersebut. DNA polymerase berasal dari bakteri Thermus aquaticus yang ditemukan di daerah yang panas pada musim panas. DNA polymerase ini stabil pada suhu yang tinggi dalam proses amplifikasi, yaitu terjadi pada saat tahap denaturasi. Metode PCR ini memiliki tingkat kesensitifan yang tinggi dalam mengamplifikasi DNA walaupun dalam ukuran yang kecil.
Peran enzim ini bisa optimal apabila suhu sistem tepat dan primer telah bekerja dalam permulaan pembacaan. Kecocokan primer dengan sekuens yang akan diamplifikasi merupakan hal yang penting, dimana primer diharapkan bersifat komplementer dengan sekuens DNA target yang akan diamplifikasi.
Gambar 2 Tahapan-tahapan pada proses PCR (Polymerase Chain Reaction).
Mikrosatelit
Mikrosatelit merupakan rangkaian pola nukleotida antara dua sampai enam pasang basa yang berulang secara berurutan. Mikrosatelit biasa digunakan sebagai penanda genetik untuk menguji kemurnian galur, studi filogenetik, lokus pengendali sifat kuantitatif dan forensik. Mikrosatelit diamplifikasi menggunakan teknik PCR dengan beberapa pasang mikrosatelit. Hasil PCR dideteksi menggunakan teknik elektroforesis gel poliakrilamida (PAGE) yang dilanjutkan dengan pewarnaan perak.
Ada beberapa permasalahan dalam penggunaan penanda mikrosatelit. Permasalahan ini dapat dikelompokkan ke dalam problem teknis praktis dan problem data. Problem praktik meliputi : 1. Pemilihan primer untuk mikrostelit, banyak jenis primer yang telah didesain untuk analisi mikrosatelit pada tanaman. Primer-primer itu perlu diskrining dan dioptimasi sebelum diaplikasikan pada jenis tanaman tertentu, karena setiap tanaman mempunyai karakteristik spesifik yang berbeda satu sama lain. 2. slippage selama proses amplifikasi, termopolimerase dapat slip sehingga meghasilkan produk yang berbeda dalam ukurannya. 3. ukuran produk amplifikasi berbeda dari ukuran produk sebenarnya. Ketidakakuratan dalam identifikasi alel mungkin juga disebabkan oleh Taq polimerase yang menambah nukleotida adenosin sampai ujung 3’ produk amplifikasi.
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di dua lokasi yaitu; 1) lokasi pengambilan sampel daun
Gyrinops verstegii yakni di daerah Asai Manokwari dan Kebar, Papua (Gambar 3) dan 2)
lokasi analisis genetik yang dilakukan di Laboratorium Silvikultur Fakultas Kehutanan
IPB, Laboratorium Biologi Tumbuhan Pusat Antar Universitas (PAU) IPB, dan Naval
Medical Researh Unit 2 (NAMRU) Jakarta. Penelitian dilaksanakan pada bulan Juli 2008
[image:36.612.92.523.287.596.2]– April 2009.
Gambar 3 Peta lokasi pengambilan sampel di daerah Manokwari dan Kebar.
Adapun keadaan umum lokasi tempat tumbuh Gyrinops verstegii di daerah
Manokwari dan Kebar disajikan dalam Tabel 3, dengan total sampel yang diamati adalah
114.
Peta Inset :
Sumber :
Peta RB BAKOSURTANAL & BP3D Kab. Manokwari
PETA LOKASI PENELITIAN
LEGENDA :
Lokasi I
Tabel 3 Keadaan umum lokasi tempat tumbuh Gyrinops verstegii asal Papua No. Variabel Data Manokwari Kebar 1. Curah hujan (mm/Thn) 2.688 2.383 2. Kelembaban udara (%) 81 82,97 3. Suhu Udara (0C) 31,50 27,50 4. Ketinggian tempat (m dpl) 100-300 >500 5. Topografi Datar – bergelombang Datar - bergelombang 6. Kemiringan (0-25%) (> 25 %) 7. Jenis tanah Podsolik merah kuning Podsolik merah kuning 8. Jarak antar Induk Tanaman (m) 460 255
9. Jarak antar induk dan anakan(m) 2,5 1,8 10. Jumlah tanaman induk 11 20
11. Jumlah anakan 34 49
Sumber: 1-7 = BPS (2008)
8-11 = Hasil pengamatan 2009
Bahan dan Alat Penelitian
Bahan yang digunakan dalam penelitian ini adalah daun tanaman Gyrinops
verstegii baik dari induk tanaman maupun anakan seperti terlihat dalam Gambar 4.
Untuk proses ekstraksi, bahan kimia yang digunakan adalah buffer ekstrak, PVP 2%,
Chloroform IAA, phenol, isopropanol dingin, NaCl, Etanol 95%, buffer TE, aquabidest,
H2O, primer random (OPO dan OPY), primer mikrosatelit (Tabel 4), Qiagen Taq
polymerase, agarose, buffer TAE 1x, blue juice 10x, marker, Etidium bromida.
Acrilamide, APS, Temed, Formalin, NaOH, NH4OH, Asetat 1 %, Amonia, AgNO3.
[image:37.612.91.294.495.673.2]
Sedangkan alat yang digunakan adalah sarung tangan karet, gunting, tube 1.5 ml, tube
0,2 ml spidol permanen, mortar, pestel, pipet mikro, tips, rak tube, vortex, mesin sentrifugasi,
waterbath, freezer, timbangan analitik, desikator, mesin PCR, bak elektroforesis, cetakan agar,
microwave, gelas ukur, ultraviolet transilluminator, alat foto DNA
Prosedur Penelitian Pengambilan Sampel
Prosedur pengambilan sampel dilapangan adalah sebagai berikut (Yunanto 2006) :
1. Daun diambil dari setiap individu baik pada populasi pohon maupun tingkat
anakan sebanyak 2 – 5 lembar daun.
2. Daun tersebut selanjutnya dimasukkan kedalam plastik klips yang berisi silika gel
dengan perbandingan 1 : 5 (v/v)
3. Dalam satu lokasi diharapkan dapat dijumpai 10 hingga 20 pohon demikian pula
dengan jumlah anakan pada tiap-tiap pohon
4. Setiap pohon yang daunnya diambil diukur tinggi, diameter dan letak
geografisnya dengan menggunakan alat ukur, sedang untuk tingkat anakan akan
diukur jarak tumbuhnya dari pohon induk
5. Data mengenai tinggi, diameter dan letak geografis, serta pemetaan pohon induk
maupun anakan dicatat kedalam lembar data (datasheet).
Ekstraksi DNA
Metode yang digunakan untuk ekstraksi DNA ini adalah metode CTAB (Cetyl
Trimethyl Ammonium Bromide) yang telah dimodifikasi (Murray & Thompson 1980).
Sebagian besar metode untuk ekstraksi DNA dari jaringan tanaman yang terdapat dalam
literatur, memerlukan waktu yang lama dan bahan kimia yang mahal seperti chesium
khlorida sehingga kurang efisien (Brown 1991).
Daun dipotong dengan ukuran 2 X 2 cm, kemudian digerus dengan menambahkan
nitrogen cair di dalam pestel/mortar yang bersih. Hasil gerusan kemudian dimasukkan
kedalam tabung mikro 2 ml dan ditambahkan larutan penyangga sebanyak 500 – 700 µl.
maka tabung yang berisi hasil gerusan tersebut di vortex. Setelah itu diinkubasi dalam
dalam water bath selama 45 menit – 1 jam sambil dibolak-balik setiap 15 menit. Suhu
optimal yang digunakan dalam proses inkubasi berkisar antara 65-700C. Apabila proses
inkubasi melebihi suhu optimal maka DNA yang ada dalam tube akan rusak.
Setelah proses inkubasi, tabung mikro tersebut diangkat dan didinginkan selama
15 menit kemudian ditambahkan kloroform sebanyak 500 µl dan fenol sebanyak 10 µl,
lalu sentrifugasi pada kecepatan 13.000 rpm selama 2 menit. Hasil sentrifugasi
(supernatan) akan terpisah menjadi dua fase yaitu bagian atas merupakan fase air yang
berisi asam nukleat dan bagian bawah yaitu fase organik yang berisi pelarut organik. Fase
air dipisahkan dari fase organik dengan menggunakan pipet mikro lalu dipindahkan
kedalam tabung mikro baru. Kemudian ditambahkan chloroform dan fenol sebanyak dua
kali yang bertujuan untuk memperoleh DNA yang memiliki tingkat kemurnian tinggi.
Supernatan yang telah terpisah dari fase organik, ditambahkan isoproponal dingin
sebanyak 500 µl dan NaCl atau NaOAc sebanyak 300 µl. Campuran ini disimpan dalam
freezer selama 45 menit – 1 jam. Hasil pengendapan tersebut disentrifuge pada kecepatan
13.000 rpm selama 2 menit kemudian cairan dalam tabung mikro dibuang. Hasil
pengendapan akan berupa pelet DNA. Pelet DNA ini kemudian ditambahkan etanol 300
µl dan disentrifuge selama 2 menit pada kecepatan 13.000 rpm, kemudian cairan etanol
tersebut dibuang. Setelah itu pelet DNA yang tersisa dalam tabung mikro dikeringkan
dalam desikator dengan posisi terbalik selama 10 menit lalu ditambahkan larutan TE
sebanyak 20 µl difortex kemudian disimpan didalam freezer.
Selama proses pengeringan pelet DNA, disiapkan agarose 1 % (0,33 gram agarose
dalam 33 ml TAE). Untuk proses elektroforesis, diambil 3 µl DNA ditambahkan 2 µl
blue juice 10 X dan kemudian di running pada tegangan 100 volt selama ± 30 menit.
DNA akan bergerak kearah positif (anoda). Hasil elektroforesis kemudian direndam
dalam larutan etidium Bromide (ETBR) 10 µl per 200 ml aquades selama 3 – 5 menit dan
selanjutnya dilihat pada UV transiluminator.
Seleksi Primer
Primer adalah rantai pendek DNA yang dihasilkan secara buatan biasanya antara
sintesis oleh enzim yang disebut DNA polymerase yang diperoleh dari bakteri Thermus
aquaticus. Enzim ini biasa disebut juga Taq DNA polymerase. Enzim ini sesuai untuk
proses amplifikasi karena dapat bertahan pada suhu tinggi hingga 950C meskipun suhu
optimum bagi aktifitas enzim adalah 720C. Setelah terjadi annealing selanjutnya
dilakukan perbanyakan fragmen DNA melalui proses ekstensi pada suhu 720C.
Seleksi primer dimaksudkan untuk mencari primer acak yang menghasilkan
penanda polimorfik, karena tidak semua primer nukleotida dapat menghasilkan produk
amplifikasi (primer positif) dan dari primer positif tidak semuanya menghasilkan fragmen
DNA polimorfik. Proses penyeleksian primer yang digunakan dalam metoda RAPD
mengikuti primer yang pernah diuji oleh Azwin (2007), karena belum ada penelitian
pendahuluan terhadap jenis Gyrinops verstegii yang dapat mengamplifikasi DNA
tanaman ini. Dalam penelitian ini digunakan 5 primer yang dipilih dari golongan OPO
[image:40.612.92.524.372.488.2]dan 5 primer dari golongan OPY yang diproduksi oleh Operon Technology (Tabel 4).
Tabel 4 Primer golongan OPO dan OPY dalam metode RAPD
No. Primer Urutan Basa No. Primer Urutan Basa
1. OPO-06 5’CCACGGGAAG’3 1. OPY-02 5’CATCGCCGCA’3
2. OPO-09 5’TCCCACGCAA’3 2. OPY-06 5’AAGGCTCACC’3
3. OPO-10 5’TCAGAGCGCC’3 3. OPY-08 5’AGGCAGAGCA’3
4. OPO-14 5’AGCATGGCTC’3 4. OPY-09 5’GTGACCGAGT’3
5. OPO-18 5’CTCGCTATCC’3 5. OPY-11 5’AGACGATGGG’3
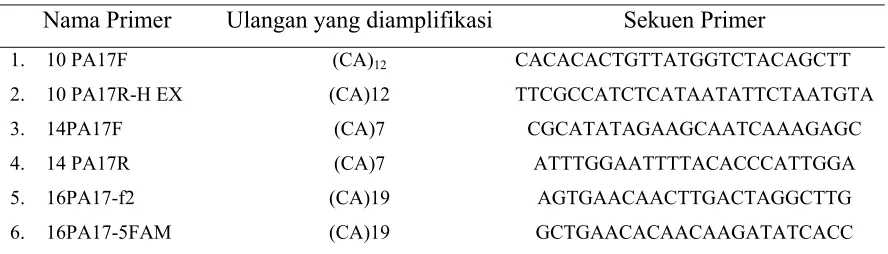
Pengujian dengan primer mikrosatelit, didasarkan dari hasil penelitian terdahulu
yang dilakukan oleh Eurlings dan Gravendeel (2006) (Tabel 5).
Tabel 5 Daftar primer Mikrosatelit yang digunakan dalam penelitian
Nama Primer Ulangan yang diamplifikasi Sekuen Primer
1. 10 PA17F 2. 10 PA17R-H EX
3. 14PA17F
[image:40.612.85.529.576.703.2]Nama Primer Ulangan yang diamplifikasi Sekuen Primer 7. 6PA18F 8. 6PA18R-FAM (CA)8 (CA)8 TGAGGCGTGAGTGAGATATTGATT CCTTCCTCTCTTCTTACCTCACCA
PCR (Polymerase Chain Reaction)
Proses PCR membutuhkan 4 komponen utama yaitu H2O, HotStar Mix, primer
dan DNA. DNA hasil proses ektraksi sebelum dilakukan proses amplifikasi PCR harus
dilakukan pengenceran dengan menggunakan aquabidest. Besarnya perbandingan antara
DNA dengan aquabidest tergantung dari tebal dan tipisnya DNA hasil ekstraksi.
Untuk proses PCR, DNA 1,5 µl dicampurkan dengan HotStar Mix 7,5 µl,
Nuclease-free water 2,5 µl dan primer 1,5 µl) disentrifugasi selama 5-10 detik kemudian
dimasukkan kedalam mesin PCR. Tahapan serta suhu PCR seperti disajikan dalam Tabel
[image:41.612.83.527.345.505.2]6.
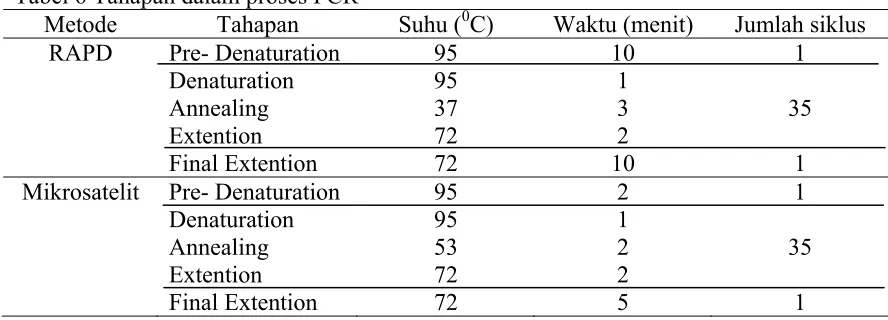
Tabel 6 Tahapan dalam proses PCR
Metode Tahapan Suhu (0C) Waktu (menit) Jumlah siklus RAPD Pre- Denaturation
Denaturation Annealing Extention Final Extention 95 95 37 72 72 10 1 3 2 10 1 35 1 Mikrosatelit Pre- Denaturation
Denaturation Annealing Extention Final Extention 95 95 53 72 72 2 1 2 2 5 1 35 1
Pengujian polimorfisme dilakukan dengan melihat pita hasil PCR yang
divisualisasi berdasarkan hasil elektroforesis. Hasil pengujian ini dikatakan polimorfisme
jika pola pita yang dihasilkan mempunyai sekurang-kurangnya lebih dari satu variasi,
sedang hasil pengujian dikatakan monomorfik jika tidak memperlihatkan adanya variasi
pada pola pita hasil elektroforesis.
Analisis Data
Hasil PCR yang telah dielektroforesis difoto dan dianalisis dengan melakukan
kedalam data biner berdasarkan ada atau tidak adanya pita sedang untuk data mikrosatelit
dihitung berdasarkan banyaknya alel yang ditemukan sesuai panjang basa. Contoh proses
skoring dapat dilihat pada Gambar 5.
Lokus Individu
1 2 3 4 5 6 7 8 9 10
L-1
L-2
L-3
L-4
Lokus Individu
1 2 3 4 5 6 7 8 9 10
Lokus 1 1 1 1 1 0 1 1 0 1 1
Lokus 2 1 1 1 1 1 0 1 1 1 0
Lokus 3 0 1 0 1 1 1 0 1 0 1
[image:42.612.85.529.133.409.2]Lokus 4 1 0 1 1 0 1 1 0 0 1
Gambar 5 Cara penilaian pita dengan sistim skoring
Keterangan : 1= ada pita, 0 = tidak ada pita
Hasil perhitungan pita-pita DNA tersebut kemudian dianalisis untuk mengetahui
keragaman dalam populasi maupun antar populasi. Parameter keragaman genetik yang
dihitung dalam penelitian ini adalah;
a. Persentase Lokus Polimorfik (PLP)
Suatu lokus gen dikatakan polimorfik jika sekurang-kurangnya ada dua varian
yang berbeda (alel). Sedang untuk monomorfik tidak memperlihatkan variasi
genetik. Persentase lokus polimorfik dihitung dengan rumus;
Persentase Lokus Polimorfik (PLP) =
∑
(∑
)+∑
( ) ) (LM LP
LP
X 100%
b. Jumlah alel yang teramati (na) =
∑
∑
Lokus Alel
c. Jumlah alel yang efektif (ne) =
∑
ipi2
1
dimana, pi ; frekuensi genetik tipe ke i
d. Heterozigositas harapan (He) = 1 –
∑
i
pi2
dimana ; pi = frekuensi genetik tipe ke i
e. Diferensiasi genetik (Gst) =
HT HS
HT )
( −
dimana; HT = keragaman populasi total HS = keragaman populasi tunggal
Parameter keragaman genetik yang diukur seperti jumlah alel yang diamati (na),
jumlah alel yang efektif (ne), jumlah lokus polimorfik, persen lokus polimorfik (PLP) dan
heterozigitas harapan (He), diolah dengan software Pop Gene 1.32. Jarak genetika antara
populasi dihitung menggunakan koefisien Dice dan pembuatan dendogram
menggunakan unweighted pair-group method arithmetic (UPGMA) berdasarkan jarak
genetik Nei dengan perangkat lunak numerikcal taxonomy and multivariate system
(NTSYS) versi 1.80 (Rohlf 1993 dalam Hannum et al. 2003). Analisis lanjutan mengenai
sumber-sumber keragaman yang terjadi dalam populasi maupun antar populasi
HASIL DAN PEMBAHASAN
Polimorfisme RAPD dan Mikrosatelit
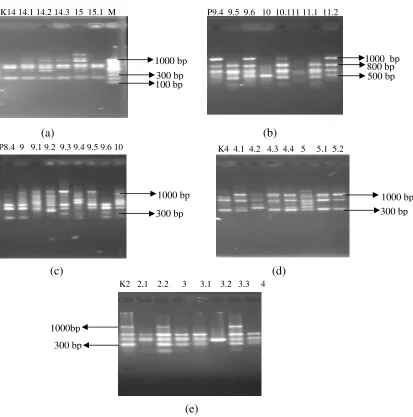
Penelitian ini menggunakan primer dari Operon Technology, dimana dari 10 primer acak yang diseleksi, primer yang menghasilkan pita amplifikasi yang bervariasi pada metode RAPD adalah primer OPO-09, OPO-10, OPY-13, OPY-09 dan OPY-14 seperti terlihat pada Gambar 6.
(a) (b)
(c) (d)
[image:44.612.124.537.215.632.2](e)
Gambar 6. Profil pita DNA dengan primer OPO 09, OPO 10, OPY 13, OPY 9 dan OPO 14
Keterangan: (a) Primer OPO 9, (b) Primer OPO 10, (c) Primer OPY 13, (d) Primer OPY 9, (e) Primer OPO 14, M=Marker; P= induk Manokwari, K= induk Kebar; angka digit satu=induk, angka digit dua=anakan
100 bp300 bp 1000 bp
500 bp 1000 bp
800 bp P9.4 9.5 9.6 10 10.111 11.1 11.2
K14 14.1 14.2 14.3 15 15.1 M
1000 bp P8.4 9 9.1 9.2 9.3 9.4 9.5 9.6 10
300 bp 300 bp
1000 bp K4 4.1 4.2 4.3 4.4 5 5.1 5.2
300 bp 1000bp
Skoring yang dilakukan terhadap pita-pita DNA hasil elektroforesis menunjukkan adanya perbedaan jumlah lokus untuk masing-masing primer. Pada primer OPO 09 ditemukan 10 lokus polimorfik, sedang untuk primer OPO 10 ditemukan 13 lokus dan untuk primer OPY 13, OPY 9 dan OPO 14 ditemukan 15 lokus polimorfik dengan panjang 200 bp hingga 1500 bp.
Pengujian polimorfik DNA dengan metode mikrosatelit menggunakan dua pasang primer yang dari hasil penelitian terdahulu (Eurlings dan Gravendeel, 2006). Dalam penelitian ini primer yang diuji adalah dua pasang primer mikrosatelit yakni 14 PA 17F; 14 PA 17R dan 6 PA 18F; 6 PA 18R-FAM, yang menghasilkan pita polimorfik yang lebih spesifik, yakni dua lokus dan empat alel dengan panjang alel berkisar dari 257 bp hingga 300 bp seperti disajikan pada Gambar 7.
[image:45.612.103.505.311.462.2]
( a) (b)
Gambar 7. Profil hasil elektroforesis untuk primer 6 PA 18 F dan 6PA 18 R-FAM (a) dan 14 PA 17 F dan 14 PA 17 R
Keterangan : P= induk Manokwari, K= induk Kebar; angka digit satu=induk, angka digit dua=anakan
Resolusi dari setiap pita DNA hasil amplifikasi dalam penelitian ini tidak selalu terlihat dengan jelas. Hal ini tergantung pada jumlah fragmen yang diamplifikasi yang terdapat pada tanaman. Makin banyak fragmen DNA yang teramplifikasi pada genom tanaman maka resolusi pita DNA yang dihasilkan akan semakin jelas. Pada genom tanaman lebih kurang 90% dari DNA genom merupakan urutan berulang (Weising et al. 1995). Disamping itu adanya kompetisi tempat penempelan primer pada genom menyebabkan salah satu fragmen akan diamplifikasi dalam jumlah yang banyak dan fragmen lainnya sedikit. Hasil amplifikasi DNA dengan menggunakan primer yang sama pada individu dalam satu populasi yang sama tidak semuanya memiliki intensitas, jumlah dan ukuran pita yang sama. Perbedaan jumlah dan ukuran pita DNA yang dihasilkan oleh
100 200 300 1500
100 200 1500
setiap primer menggambarkan kompleksitas genom tanaman (Grattapalia et al. 1992). Karena pita DNA merupakan hasil berpasangannya nukleotida primer dengan nukleotida genom tanaman, maka semakin banyak primer yang digunakan akan semakin terwakili bagian-bagian genom dan tergambar keadaan genom tanaman yang sesungguhnya.
Perbedaan hasil intensitas ini pada umumnya disebabkan karena 1) makin banyak fragmen DNA yang diamplifikasi pada tanaman, maka intensitas pita DNA yang dihasilkan makin tegas, 2) adanya kompetisi tempat penempelan primer pada DNA genom yang menyebabkan salah satu fragmen akan diamplifikasi dalam jumlah banyak dan fragmen lainnya sedikit, 3) kemurnian dan konsentrasi cetakan DNA akan mempengaruhi efisiensi amplifikasi. DNA yang memiliki tingkat kontaminasi yang tinggi dari senyawa-senyawa seperti polisakarida dan fenolik seringkali menghasilkan fenotipe penanda RAPD yang tidak jelas.
Secara teoritis polimorfisme yang dideteksi berdasarkan RAPD merupakan hasil dari beberapa kejadian diantaranya 1) insersi DNA berukuran besar pada fragmen diantara sepasang situs penempelan primer yang mengakibatkan jarak amplifikasi terlalu besar sehingga fragmen tersebut hilang atau tidak teramplifikasi, 2) delesi pada bagian genom yang membawa satu atau dua situs penempelan primer sehingga mengakibatkan hilangnya fragmen, 3) subtitusi nukleotida yang mengubah homologi antara primer dengan DNA genom sehingga menyebabkan hilangnya fragmen atau mengubah ukuran fragmen, 4) insersi atau delesi fragmen kecil DNA yang dapat mengubah ukuran fragmen yang diamplifikasikan.
Keragaman Genetik Gyrinops verstegii Berdasarkan RAPD
Keragaman Dalam Populasi
menggunakan software POPGENE versi 3.2 dan diperoleh nilai-nilai variabilitas genetik (Tabel 7).
Tabel 7. Variabilitas genetik dalam populasi Gyrinops verstegii
Populasi N PPL na ne He
Induk Manokwari 11 73,53 1,7353 1,4077 0,2357 Anakan Manokwari 34 86,76 1,8676 1,4700 0,2744 Induk Kebar 20 92,65 1,9265 1,4952 0,2944 Anakan Kebar 49 94,12 1,9412 1,4778 0,2839
Keterangan:
PPL= Percentage of Polymorphic Loci ; na = Observed number of alleles ; ne = Effective number of alleles; He = Nei’s (1973) gene diversity
Seperti terlihat pada Tabel 7 keragaman genetik populasi induk Gyrinops verstegii yang berasal dari daerah Kebar memiliki nilai He yang tinggi yakni sebesar 0,2944 dengan persen polimorfik sebesar 92,65%, sedang He populasi anakan daerah Kebar sebesar 0,2839 dengan persen polimorfik lokus sebesar 94,12%. Nilai heterozigositas yang teramati dari penelitian ini dapat dikatakan tinggi.
Beberapa hasil penelitian terhadap tanaman kehutanan yang lain juga menunjukkan nilai variasi genetik yang tinggi. Azwin (2007) melakukan penelitian dengan teknik RAPD pada species gaharu yang berbeda (Aquilaria mallaciensis Lamk) yang menunjukkan nilai heterozigositas (He) sebesar 0,2454. Hamrick et al. (1992) melakukan pengamatan terhadap nilai heterozigositas tumbuhan berkayu di hutan tropis, mendapatkan nilai He sebesar 0,149. Bahkan Siregar (2004) melakukan penelitian terhadap jenis Pinus merkusii di Indonesia, memperoleh nilai He yang cukup tinggi untuk populasi Aceh, sebesar 0,361.
HARDY-WEINBERG (He) yang merupakan hasil survei genetik pada lokus-lokus yang polimorfik.
Keragaman Genetik Antar Populasi
[image:48.612.89.515.306.380.2]Peubah lain yang digunakan untuk mencirikan variasi genetik antar populasi adalah jarak genetik. Jarak genetik mengukur perbedaan struktur genetik antar dua populasi pada suatu lokus gen tertentu. Pebedaan genetik dari dua atau lebih populasi pada umumnya dianalisis dengan sebuah matrik dimana elemen-elemennya berupa jarak genetik dan pasangan kombinasi dari masing-masing populasi (Finkeldey 2005). Data mengenai jarak genetik dalam penelitian ini disajikan pada Tabel 7.
Tabel 7 Jarak Genetik Gyrinops verstegii Manokwari dan Kebar
Manokwari Anakan Manokwari Kebar Anakan Kebar Manokwari 0.0000
Anakan Manokwari 0.0309 0.0000
Kebar 0.0805 0.0932 0.0000
Anakan Kebar 0.0964 0.1024 0.0282 0.0000
Berdasarkan data jarak genetik diatas terlihat bahwa jarak genetik antara populasi induk Kebar dan anakan Kebar sangat dekat yakni 0,0282 dibandingkan jarak genetik antara populasi Manokwari dengan anakan Manokwari, dengan jarak genetik 0,0309. Sedang untuk nilai jarak genetik antar kedua adalah sebesar 0,0805 dan jarak genetik antara populasi anakan sebesar 0,1024.
Gambar 8. Dendogram Jarak Genetik Antar Populasi Gyrinops verstegii berdasar UPMA (Keterangan: Mkw_tetua = Pohon Induk Manokwari; Mkw_anakan = Anakan Manokwari; Kbr_tetua=
Pohon induk Kebar; Kbr_anakan = Anakan Kebar)
Hasil analisis jarak genetik dan dendrogram di atas menunjukkan pengelompokkan populasi yang sangat jelas menurut wilayah tempat tumbuh masing-masing populasi. Pengelompokan ini terdiri dari dua kelompok, dimana tanaman inang dan anakan membentuk kelompok sesuai lokasi tempat tumbuhnya. Jarak genetik antar kedua kelompok ini berdasarkan dendogram diatas, mengindikasikan bahwa hubungan kekerabatan kedua populasi ini cukup jauh bahkan terpisah dan terisolasi. Dengan demikian dapat diduga bahwa antara kedua populasi tidak terjadi aliran gen. Hal ini diperkuat dengan hasil pengamatan yang menunjukkan bahwa anakan dari masing-masing populasi tidak ada yang mirip dengan induk tanaman dari populasi lain. Selain itu waktu pembungaan dari kedua populasi berbeda, sehingga tidak memungkinkan terjadinya aliran gen.
Sumber Keragaman Genetik Gyrinops verstegii Berdasarkan Mikrosatelit Untuk menelaah lebih dalam mengenai penyebab terjadinya keragaman genetik yang cukup besar dari masing-masing populasi dilakukan uji lanjutan yang lebih spesifik dengan menggunakan metode mikrosatelit. Skoring yang dilakukan terhadap hasil elektroforesis, selanjutnya dianalisis dengan menggunakan software Arlequin dari Schneider et al. (2000) untuk sumber keragaman pada populasi yang diteliti. Hasil perhitungan software ini berbentuk tabel AMOVA seperti disajikan dalam Tabel 8.
Tabel 8. Hasil Perhitungan AMOVA
Sumber db Jumlah Komponen Persentase Indeks Nilai P
keragaman Kuadrat ragam ragam Fiksasi
Antar group 1 5,638 0,0375 4,66 Fct = 0,0466 0,3196ns
Antar populasi
dengan group 2 2,501 0,0141 1,74 Fsc = 0,0183 0,0528 ns
Antar individu
dalam populasi 110 67,944 -0,1363 -16,92 Fis = -0,1808 1,0000ns
Antar individu 114 101,500 0,8903 110,52 Fit = -0,1062 1,0000 ns
Total 227 177,583 0,8056
Keterangan: db : derajat bebas, korelasi random pairs allel didapat dari nilai relatif dengan seluruh populasi (Fct), Korelasi random, pairs allel didapat dari nilai relatif populasi dengan seluruh group (Fsc), korelasi random pairs didapat dari nilai relatif populasi (Fis), tidak berbeda nyata (ns).
Hasil perhitungan sidik ragam molekuler (AMOVA) menunjukkan semua komponen sumber keragaman tidak berbeda nyata, baik persentase ragam antar group (4,66), keragaman antar populasi dengan grup (1,74), keragaman antar individu dalam populasi (-16,92) serta keragaman antar individu (110,52). Namun persentase ragam terbesar dalam penelitian ini disumbangkan oleh keragaman antar individu yakni sebesar 110,52 dari total seluruh ragam. Hal ini menunjukkan bahwa keragaman yang terjadi antar populasi lebih disebabkan karena adanya variasi genetik antar individu.
Hal ini mendukung hasil analisis jarak genetik antar populasi dengan metode RAPD, dimana jarak antar populasi induk dan tanaman sangat dekat dibanding jarak genetik antara kedua grup (Manokwari – Kebar).
Implikasi Genetik Terhadap Sistim Silvikultur
Berdasarkan hasil penelitian ini, maka strategi konservasi yang sebaiknya dilakukan adalah mengkonservasi individu dalam populasi. Hal ini perlu menjadi pertimbangan mengingat keragaman genetik terbesar ada dalam individu pohon didalam populasi, sehingga konsentrasi pengumpulan materi genetik perlu mempertimbangkan jumlah pohon yang banyak dalam suatu populasi untuk dikonservasi.
Secara umum konservasi genetik dapat dilakukan melalui dua pendekatan, yaitu secara in-situ dan ex-situ. In-situ berarti melestarikan pohon dan tegakan pada sebaran alamnya, sedangkan ex-situ adalah melindungi gene atau gene complexes pada kondisi buatan atau setidaknya di luar kondisi alaminya (gene bank), bilamana materi konservasi genetik yang dibangun berbentuk koleksi klon yang ada di lapangan.
Program konservasi sumberdaya genetik dianggap berhasil apabila informasi genetik dapat dipreservasi untuk jangka waktu tertentu. Tujuan utama program konservasi sumberdaya genetik Gyrinops verstegii bukan mempreservasi rangkaian nukleotida DNA saja, tetapi juga untuk membangun populasi yang dapat beradaptasi dengan lingkungan dan perubahan lingkungan yang paling umum. Oleh sebab itu dalam mengkonservasi tanaman Gyrinops verstegii, perlu dipertimbangkan aspek tujuan konservasi itu sendiri apakah untuk tujuan mempertahankan hasil produksi ataukah untuk tujuan pelestarian keragaman genetik tanaman.
Informasi tentang besarnya tingkat keragaman genetik, belum dapat menjelaskan hubungannya dengan parameter-parameter kuantitatif seperti diameter batang, tinggi pohon, lebar tajuk dan sebagainya. Oleh sebab itu, untuk dapat menyusun strategi konservasi yang menyeluruh perlu dilakukan pengamatan terhadap aspek pertumbuhan, sistim perkawinan dan lain-lain.
SIMPULAN DAN SARAN
Simpulan
Simpulan dari penelitian ini adalah sebagai berikut:
1. Keragaman genetik Gyrinops verstegii asal Papua cukup besar hal ini ditunjukkan oleh nilai he dimana populasi induk Manokwari sebesar 0,2357, populasi anakan Manokwari 0,2744, Populasi Kebar 0,2944 dan populasi anakan Kebar 0,2839. Dari keempat populasi tersebut, populasi induk Kebar memiliki nilai keragaman genetik terbesar.
2. Berdasarkan analisis jarak genetik, populasi induk dan anakan membentuk satu kelompok dengan jarak genetik yang kecil, sedang antar populasi induk Manokwari dan Kebar memiliki jarak genetik yang besar. Hal ini menggambarkan bahwa kedua kelompok tersebut terpisah, diduga karena adanya penghalang sehingga aliran gen tidak dapat terjadi.
3. Hasil AMOVA dengan penanda mikrosatelit mengkonfirmasi pemisahan populasi induk - anakan Manokwari dan populasi induk - anakan Kebar , dimana keragaman terbesar berasal dari keragaman antar individu.
Saran
1. Informasi molekuler yang dihasilkan diharapkan dapat menjadi bahan pertimbangan dalam melakukan kegiatan konservasi dan pemuliaan serta pemanfaatan kayu gaharu lestari khususnya untuk tanaman Gyrinop verstegii di Papua.
DAFTAR PUSTAKA
Abdullah C. dan Retnoningrum D. S. 2003. Deteksi Bakteri Patogen Streptococcus pyogenes dengan Teknik Polymerase Chain Reaction (PCR) [Minggu, 5 Februari 2006]
[Anonim] 2009. Gaharu; HHBK yang menjadi Primadona. http:/wahanagaharu. blogspot.com/2009/1/gaharu-hhbk.html [1 April 2009]
Asgarin 2005. Pemasaran Domestik dan Ekspor Gubal Gaharu dan Kemedangan Indonesia dan Regulasinya. Pelatihan Nasional Budidaya dan Pengelolaan Gaharu, 28 – 30 November 2005 di Biotrop Bogor.
Azwin 2007. Evaluasi Stabilitas Genetik Tanaman Gaharu (Aquilaria malaccensis Lamk) Hasil kultur invitro. Sekolah Pasca Sarjana IPB. Bogor.
Brown TA. 1991. Pengantar Kloning Gena. Prof. Soemiati Ahmad Muhammad dan Praseno, penerjemah. Yogyakarta: Yayasan Essentia Medica. Terjemahan dari : Gene Cloning an Introduction.
[BPS] 2009. Manokwari dalam Angka. Badan Pusat Statistik. Manokwari.
Crowder LV. 1986. Plant Genetics. Terjemahan K. Lilik dan Soetarso (1986). Genetika Tumbuhan. Yogyakarta: Gajah Mada University Press.
Ellsworth DL, Rittenhouse KD and Honeycutt RL. 1993. Artifactual variation in randomly amplified polymorphic DNA banding patterns. Biotechniques 14:214-217.
Estoup A, Jarne P, Cornent JM 2002. Homoplasy and mutation model at microsatellite loci and their consequences for population genetic analysis. Mol. Ecol. 11: 1591 -1604.
Eurlings M and Gravendeel B, 2006. Search For DNA Markers to Discriminate Cultivate from Wild Gaharu (Agarwood). Convention on International Trade in Endangered Species of Wild Fauna and Flora. NHN – Leiden University.
Finkeldey, R. 2005. Pengantar Genetika Hutan Tropis. E. Jamhuri , I.Z. Siregar, U.J. Siregar dan A.W. Kertadikara, penerjemah. GÖttingen : Institute of Forest Genetics and Forest Tree Breeding Georg-August-Univerity-Göttingen. Terjemahan dari : An Introduction to Tropical Forest Genetics.
Grattapalia, D., J. Chaparro, P. Wilcox, S. Mc Cord, D. Werner, H. Amerson, S. Mc Keand, F. Bridgwater, R. Whetten,D.O’Malley and R, Sederoff. 1992. Mapping in Woody Plants with RAPD Marker: Application to Breeding in Forestry and Horticulture. P. 37-40. In Application of RAPD Technology to Plant Breeding . Join Plant Breeding Symposia Series. November 1, 1992. Minnepolis.
Hannum, S, Hartana A, Suharsono, 2003. Kemiripan Genetika Empat Kelapa Genjah Berdasarkan pada Random Amplified Polymorphic DNA. Hayati. Jurnal Biosains Vol. 10 No. 04 Desember 2003.
Jusuf, M. 1991. Genetika. Pusat Antar Universitas. Bogor: Institut Partanian Bogor.
Kimball, J. W. 1992. Biologi. Erlangga. Jakarta.
Namkoong G., Boyle T., Gregorius H.R., Joly H., Savolainen O., Ratnam W., Young A. 1996. Testing Criteria and Indicators for Assessing the Sustainability of Forest Management: Genetic Criteria and Indicators. CIFOR Working Paper No.10, Bogor: CIFOR.
Qiagen. 2001. HotStar Tag PCR Handbook. Germany; Qiagen
Salosa, D. D., 2001. Karakterisasi Beberapa Pohon Penghasil Gaharu di Desa Aibore Kecamatan Napan. Skripsi Sarjana Kehutanan Fakultas Kehutanan Universitas Negeri Papua. (tidak diterbitkan).
Sambrook, J. E. F. Fritsch and T. Maniatis. 1989. Molecular Cloning: a laboratory manual. 2nd Edition. Cold Spring Harbor Laboratory Press New York.
Schneider, S.,D. Rosseli,L Excoffer 2000. Arlequin ver 3.1 Genetic and Biometry Laboratory Dept of Antropology and Ecology University of Geneva, Switzerland Septimayani, I. 2002. Studi Keragaman Genetik 16 Aksesi Blewah (Cucumis melo L)
dengan Metode Random Amplified Polymorphic DNA (RAPD). [Skripsi]. Bogor, Departemen Budi Daya Pertanian, Fakultas Pertanian, Institut Pertanian Bogor.
Siregar, I Z., Hattemer. H H, 2004. Patterns of Genetic Structure and Variation of Merkus Pine (Pinus merkusii) in Indonesia. Journal of Tropical Forest Science 16 (2); 160-172
Soerianegara I., Djamhuri E. 1979. Pemuliaan Pohon Hutan. Bogor: Departemen Manajemen Hutan, Fakultas Kehutanan IPB.
Suryanto, Dwi. 2003. Melihat Keragaman Organisme melalui Beberapa Teknik Genetika Molekuler. www.library.usu.ac.id/modules.php [Minggu, 5 Februari 2006]
Sumarna, Y., 2005. Strategi Budidaya dan Pengembangan Produksi Gaharu . Pelatihan Nasional Budidaya dan Pengelolaan Gaharu, 28 – 30 November 2005 di Biotrop Bogor.
Waroy , D. 2006. Karakteristik Pohon Penghasil Gaharu di Kampung Asai Distrik Manokwari Utara. (Skripsi). Universitas Negeri Papua.
Watson, J. D., Nancy H. P., Jeffrey W. Roberts, Joan A. Steiz, and Alan M. Weiner. 1987. Molecular Biology of The Gene. Cummings Publishing Company Inc.
Weising, K,H. Nybom, K. Wolff and W. Meyer. 1995. DNA Fingerprinting in plant and fungi. CRC Press, Boca Raton, Fla.
Welsh JR. 1991. Dasar-dasar Genetika dan Pemuliaan Tanaman. Mogea JP, penerjemah. Jakarta: Penerbit Erlangga. Terjemahan dari: Fundamental of Plant Genetic and Breeding.
Yunanto T. 2006. Implikasi genetik sistem silvikultur TPTJ pada jenis Shorea johorensis di HPH PT Sari Bumi Kusuma berdasarkan Random Amplified Polymorphic DNA (RAPD) [skripsi]. Bogor: Fakultas Kehutanan. Institut Pertanian Bogor.
Keragaman Genetik Gyrinops verstegii asal Papua
Berdasarkan RAPD dan Mikrosatelit
RIMA HERLINA SETIAWATI SIBURIAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa Tesis Keragaman Genetik Gyrinops verstegii asal Papua Berdasarkan RAPD dan Mikrosatelit adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Bogor, Juli 2009
ABSTRACT
RIMA HERLINA SETIAWATI SIBURIAN. Genetic Variation of Gyrinops verstegii originated from Papua based on RAPD and Mikrosatelit. Under direction of ULFAH JUNIARTI SIREGAR and ISKANDAR ZULKARNAEN SIREGAR
Gyrinops verstegii is one of the potential tree species for the production of agarwood in the eastern part of Indonesia. In its natural habitat, this species is found to be morphologically variable. This morpho-variation may reflect the degree of genetic diversity as usually observed in many plant species. However, genetic information of Gyrinops verstegii is still lacking. A genetic inventory was therefore undertaken, aiming at estimating the genetic variation using wild population sampled from low and high altitudes, i.e. Kebar and Manokwari. Genetic analyses were performed using two DNA markers, i.e RAPD and microsatellites following standard procedures. Results showed that the genetic variability of Kebar population (He= 0,2944) was higher than that of Manokwari (He= 0.2357). AMOVA analysis showed that most of the variation is stored in individual level contributing to 89 % of the total variation. Dendrogram analysis showed that the reproductive populations, i.e mother tree and its progenies of each location, were grouped together. This molecular information can be used for scientific consideration in developing strategies for conservation and breeding.
RINGKASAN
RIMA HERLINA SETIAWATI SIBURIAN. Keragaman Genetik Gyrinops verstegii asal Papua berdasarkan RAPD dan Mikrosatelit. Dibimbing oleh ULFAH JUNIARTI SIREGAR dan ISKANDAR ZULKARNAEN SIREGAR.
Gyrinops verstegii merupakan salah satu tanaman penghasil gaharu yang berasal dari Papua. Gyrinops verstegii yang dijumpai di alam memiliki morfologi daun yang agak berbeda, terutama pada daerah dengan ketinggian tempat tumbuh yang berbeda. Perbedaan morfologi ini menunjukkan tingkat keragaman genetik seperti yang umum dijumpai pada berbagai jenis tumbuhan lain.
Informasi keragaman genetik, berupa tingkat dan distribusi keragaman yang ada pada suatu jenis sangat penting untuk diketahui berkaitan dengan penyusunan strategi pemuliaan (breeding) dan juga konservasinya. Keragaman genetik yang ada merupakan sumberdaya yang dapat memberikan peluang untuk dilakukannya rekombinasi, evaluasi dan seleksi. Informasi keragaman genetik dapat diperoleh dengan melakukan kegiatan inventarisasi genetik baik melalui pengujian lapangan (field trial) ataupun analisis dengan bantuan penanda genetik. Penelitian ini bertujuan untuk mengetahui variasi genetik tanaman Gyrinops verstegii yang berasal dari dataran rendah dan tinggi (Manokwari dan Kebar) dengan menggunakan penanda DNA RAPD dan Mikrosatelit.
Nilai keragaman genetik Gyrinops verstegii dalam populasi dengan menggunakan metode RAPD menunjukkan keragaman genetik populasi Kebar (He = 0,2944) lebih tinggi dibanding populasi Manokwari. (He = 0,2357). Hasil AMOVA menunjukkan bahwa sumbangan keragaman terbesar diberikan oleh keragaman antar individu yakni sebesar 89% dari total ragam.
Analisis dendogram berdasarkan jarak genetik, menunjukkan bahwa populasi induk dan anakan dalam satu lokasi membentuk satu kelompok dengan jarak genetik yang kecil, sedang antar populasi induk Manokwari dan Kebar memiliki jarak genetik yang besar. Hal ini menggambarkan kedua kelompok tersebut terpisah dan diduga hal ini menjadi penghalang terjadinya aliran gen. Informasi keragaman genetik ini diharapkan dapat menjadi dasar s