FERMENTABILITAS DAN KECERNAAN RANSUM KOMPLIT
YANG MENGANDUNG Indigofera sp. DAN LIMBAH
TAUGE DENGAN RUMEN SIMULATION
TECHNIQUE (RUSITEC)
SKRIPSI
SITI SYAFA’AH
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
i
RINGKASAN
SITI SYAFA’AH. D24080280. 2012. Fermentabilitas dan Kecernaan Ransum Komplit yang Mengandung Indigofera sp. dan Limbah Tauge dengan Rumen Simulation Technique (Rusitec). Skripsi. Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas Peternakan, Institut Pertanian Bogor.
Pembimbing Utama : Prof. Dr. Ir. Erika B. Laconi, MS Pembimbing Anggota : Dr.Ir.Muhammad Ridla, M.Agr
Domba jonggol dan domba garut merupakan domba lokal yang telah berkembang dan beradaptasi di Indonesia. Pakan utama domba adalah hijauan yang ketersediaannya sangat bergantung pada musim. Pemberian hijauan saja belum dapat mencukupi kebutuhan nutrisi domba. Untuk itu dibutuhkankonsentrat, namunharga konsentrat relatif mahal. Bahan pakan alternatif sumber serat dan protein serta adaptif terhadap musim yaituIndigofera sp. dan limbah tauge. Indigofera sp.memiliki kandungan protein 27% dan kandungan serat kasar 21,4%, limbah tauge mengandung protein kasar 14,42%dan serat kasar 38,5%. Fermentabilitas dan kecernaan merupakan faktor penting untuk mengetahui kualitas pakan. Tujuan penelitian ini adalah mengkaji fermentabilitas dan kecernaan ransum komplit yang mengandung Indigofera sp dan limbah tauge dengan metode Rusitec pada domba garut dan domba jonggol.
Rancangan yang digunakan dalam penelitianadalah Rancangan Acak Lengkap pola faktorial 2x2dengan dua ulangan. Faktor pertama yaitu perbedaan sumber hijauan; ransum yang mengandung Indigofera sp. dan ransum yang mengandung limbah tauge dalam bentuk mash dengan susunan ransum berupa hijauan : konsentrat 30: 70. Faktor kedua yaitu pengaruh perbedaan cairan rumen bangsa domba; domba garut dan domba jonggol. Cairan rumen yang digunakan berasal dari 8 ekor domba yaitu 4 ekor domba jonggol dan 4 ekor domba garut. Bahan pakan konsentrat yang digunakan dalam penelitian ini adalah onggok, jagung, bungkil kelapa, CaCO3, molasses, bungkilkedelai, premix, danNaCl. Parameter yang diukur adalah konsentrasi pH rumen, VFA Parsial, konsentrasi NH3, Koefisien Cerna Bahan Kering (KCBK), dan Koefisien Cerna Bahan Organik (KCBO). Data yang diperoleh dianalisis dengan sidik ragam (ANOVA) menggunakan program SAS 9.1, jika terdapat perbedaan yang nyata dilakukan uji Duncan.
Hasil penelitian menunjukkan bahwa pH pakan mengandung Indigofera sp.
(6,74±0,03) dan limbah tauge (6,47±0,03) tidak berbeda nyata. Konsentrasi NH3 ransum yang mengandung Indigofera sp. (42,25±8,69 mg%) lebih tinggi dari limbah tauge (31,90±0,05 mg%) (P<0,05). Namun, konsentrasi VFA Parsial pada kedua pakan tidak berbeda nyata. Kecernan bahan kering pakanmengandung Indigofera sp.
(68,63±0,47 %) lebih tinggi dari ransummengandung limbah tauge (62,71±4,07) (P<0,05). Begitu juga halnya dengan Kecernaan Bahan Organik Indigofera sp.
(69,72±1,59 %) lebih tinggi dari limbah tauge (63,37±2,65 %) (P<0,05). Tidak ada perbedaan terhadap konsentrasi pH, NH3, VFA Parsial, KCBK, dan KCBO pada pengaruh perbedaan cairan rumen domba jonggol dan domba garut serta interaksi antara perbedaan sumber hijauan dan sumber bangsa.
ii
ABSTRACT
RUSITECFermentability and DigestibilityComplete Ration ContainingIndigofera sp. and Bean Sprouts Waste
Syafa’ah, S, Erika. B. L and M. Ridla
Indigofera sp. leaves and bean sprouts waste have high protein and crude fiber content which are potential to be used as feedstuff for sheep. The aim of this research was to evaluate charasteristic fermentatif (VFA parsial and NH3 concentration) and digestibility (DM & OM digestibility) of garut sheep and jonggol sheep through improvement of feed management using Indigofera sp. and bean sprout waste by technicRUSITEC. The rations were complete feed containing 30% of Indigofera sp. and 30% of bean sprout waste. The experiment held October 2011 to March 2012, used factorial completely randomazed design (2 x 2 within 2 replications). First factor was type of ration (Indigofera sp. and bean sproute waste), second factor was rumen fluid of different breed of sheep (garut sheep and jonggol sheep). The data’s were analyzed by SAS 9.1. Significant effect of result would analyzed by Duncan Multiple Range Test. The results showed that pH and VFA partial concentration were not influenced by the ration and breed, but for the NH3 concentration, DMD, and OMD were influenced by the ration. The NH3 concentration of Indigofera sp. (42,25±8,69 mg%) was higher than bean sproute waste (31,90±0,05 mg%) (P<0,05).
Whereas Indigofera’s DM (68,63 ± 0,47%) & OM (69,72 ± 1,59%) digestibility was higher than bean sproute waste (DMD (62,71 ± 4,07 %); OMD (63,37 ± 2,65%)) (P<0,05).
iii
FERMENTABILITAS DAN KECERNAAN RANSUM KOMPLIT
YANG MENGANDUNGIndigofera sp.DAN LIMBAH
TAUGE DENGAN RUMEN SIMULATION
TECHNIQUE (RUSITEC)
SITI SYAFA’AH
D24080280
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Peternakan
pada Fakultas Peternakan Institut Pertanian Bogor
DEPARTEMEN ILMU NUTRISI DAN TEKNOLOGI PAKAN FAKULTAS PETERNAKAN
iv Judul :Fermentabilitas dan Kecernaan Ransum Komplit yang Mengandung
Indigofera sp.dan Limbah Tauge dengan Rumen Simulation Technique (RUSITEC)
Nama : Siti Syafa’ah
NIM : D24080280
Menyetujui,
Pembimbing Utama,
(Prof. Dr. Ir. Erika B. Laconi, MS) NIP: 196109161 98703 2 002
Pembimbing Anggota
(Dr.Ir.Muhammad Ridla, M.Agr) NIP: 19631206 198903 1 003
Mengetahui: Ketua Departemen
Ilmu Nutrisi dan Teknologi Pakan Institut Pertanian Bogor
(Dr. Ir. Idat Galih Permana, MSc.Agr) NIP: 19670506 199103 1 001
v
RIWAYAT HIDUP
pada tahun 2005 dan diselesaikan tahun 2008.Penulis diterima di IPB pada tahun
2008 melalui jalur Penerimaan Beasiswa Santri Berprestasi Kementrian Agama
Republik Indonesia di Fakultas Peternakan Departemen Ilmu Nutrisi dan Teknologi
Pakan. Tingkat Pertama pada tahun 2008/2009 penulis aktif di Koran Kampus IPB
sebagai Reporter, 2009/2010 sebagai Internal Finance Manager, tahun 2010/2011 menjabat sebagai Pimpinan HRD. Pada tahun 2008/2009 penulis aktif di DPM IPB.
Tahun 2009/2010 penulis aktif di BEM Fakultas Peternakan IPB sebagai Sekretaris
Departemen Sosial Lingkungan dan Kemasyarakatan (Soslingmas) dan tahun
2010/2011 menjabat sebagai Kepala Departemen Soslingmas. Penulis juga aktif di
CSS MORA IPB Departemen Sosial dan Lingkungan, 2010/2011 menjabat sebagai
Steering Comitte di Majalah I.Com. Penulis bersama teman satu tim pernah mendapatkan dana hibah dari DIKTI sebanyak 7 PKM (1 PKMK, 1 PKMM, 5
PKMP). Penulis menjadi finalis pada LKTI Agroindustry Fair serta mendapatkan penghargaan 104 Inovasi Indonesia Bussinese Inovation Center (BIC) sebagai peneliti utama dengan judul penelitian “Pakan Kombinasi Lumpur Sawit dan
Ampas Teh Untuk Meningkatkan Kandungan Omega-3 pada Susu Kambing
Perah”. Penulis juga pernah menjadi asisten pratikum Kimia, Tingkat Persiapan Bersama pada tahun 2010, asisten Perancangan Percobaan tahun 2011 serta asisten
Mikrobiologi Nutrisi, Departemen Ilmu Nutrisi dan Teknologi Pakan, Fakultas
Peternakan pada tahun 2012.
Bogor, September 2012
SITI SYAFA’AH D24080280 Penulis dilahirkan pada tanggal 26 April 1990 di
Kudus, Jawa Tengah. Penulis adalah anak ketiga dari pasangan Bapak Sami’un dan Ibu Karnah. Tahun 1996 penulis mengawali pendidikannya di Sekolah Dasar
Negri 01 Bacin Kudus dan diselesaikan tahun 2002.
Pendidikan lanjutan tingkat pertama dimulai tahun 2002
dan diselesaikan tahun 2005 di MTs NU Banat Kudus.
vi
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas rahmat dan
karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Fermentabilitas
dan Kecernaan Ransum Komplit yang Mengandung Indigofera sp dan Limbah
Tauge dengan Rumen Simulasi Technique (RUSITEC). Skripsi ini merupakan
salah satu syarat untuk mendapatkan gelar Sarjana Peternakan.
Skripsi ini memberikan informasi mengenai fermentabilitas dan kecernaan
ransum yang mengandung Indigofera sp. dan limbah tauge yang dikaji dengan menggunakan tehnik RUSITECpada domba garut dan domba jonggol. Harapan dari
hasil penelitian ini adalah memanfaatkan Indigofera sp. dan limbah tauge sebagai sumber hijauan berkualitas untuk ransum penggemukan.Selain itu ketersediaan
hijauan tersebut melimpah, murah, mudah difermentasi dan mudah dicerna oleh
domba, sehingga produktivitas domba lokal dapat ditingkatkan.
Penulis memahami bahwa masih banyak kekurangan dalam penulisan skripsi
ini. Penulis mengharapkan saran dan kritik untuk perbaikan skripsi. Semoga
penulisan skripsi ini dapat bermanfaat dan diaplikasikan dengan baik.
Bogor, September 2012
vii
Potensi Indigofera sp.sebagai pakan ternak Ruminansia ... 3
Potensi Limbah Tauge sebagai pakan ternak Ruminansia ... 4
RUSITEC (Rumen Simulation Technique) ... 6
Cairan Rumen ... 7
Pengukuran KCBK dan KCBO (Czerkwski Methode) ... 21
Analisis Data ... 22
HASIL DAN PEMBAHASAN ... 22
Kandungan Nutrient Ransum Penelitian ... 23
Konsentrasi pH Cairan Rumen ... 24
viii
Produksi VFA Cairan Rumen ... 26
Kecernaan Bahan Kering (KCBK) ... 33
Kecernaan Bahan Organik (KCBO) ... 34
Pembahasan Umum ... 35
KESIMPULAN DAN SARAN ... 37
Kesimpulan ... 37
Saran ... 37
UCAPAN TERIMAKASIH ... 38
DAFTAR PUSTAKA ... 39
ix
DAFTAR TABEL
Nomor Halaman
1. Kandungan NutrientIndigoferasp. ... 4
2. KandunganNutrientLimbahTauge ... 6
3. KomposisiBahanRansumPenelitian ... 17
4. Kandungan NutrientRansum Penelitian ... 17
5. KonsentrasipH Cairan Rumen denganTehnikRUSITEC ... 24
6. Produksi N-AmoniaCairan Rumen denganTehnikRUSITEC ... 25
7. Produksi VFACairanRumen ... 28
8. Kecernaan Bahan KeringdenganTehnikRUSITEC ... 33
x
DAFTAR GAMBAR
Nomor Halaman
1. Daun Indigoferasp. ... 3
2. Limbahtauge kacang hijau ... 5
3. AlatRusitec dengan 8 vessel ... 7
4. Sintesis VFA olehmikroorganisme di rumen ... 10
xi
DAFTAR LAMPIRAN
Nomor Halaman
1. Sidik Ragam NH3 denganmenggunakan SAS 9.1 ... 44
2. Sidik RagamVFA Total denganmenggunakan SAS 9.1 ... 44
3. Sidik RagamAsetat ... 45
4. SidikRagamPropionat ... 45
5. Sidik RagamIsobutirat ... 45
6. Sidik RagamButirat ... 46
7. Sidik RagamIsovalerat ... 46
8. Sidik Ragam Valerat ... 46
9. Sidik RagamKCBK ... 47
1
PENDAHULUAN
Latar Belakang
Domba merupakan ternak potensial untuk dipelihara di Indonesia. Usaha
penggemukan domba banyak diminati pengusaha dan peternak karena perputaran
modal yang cepat dan pemeliharaan yang praktis. Permasalahan yang dihadapi oleh
sebagian peternak adalah ketersediaan pakan. Kecukupan hijauan dinegara tropis
seperti Indonesia sangat fluktuatif tergantung pada kondisi klimatologis dan
ketersediaannya. Selain itu, pemberian rumput saja belum dapat mencukupi
kebutuhan ternak secara maksimal, sehingga diperlukan konsentrat untuk
meningkatkan produktivitas domba. Namun, pada umumnya harga konsentrat relatif
mahal. Untuk itu diperlukan adanya pakan alternatif dengan harga yang lebih murah
dan dapat mencukupi kebutuhan nutrisi ternak. Salah satu bahan pakan yang
mungkin dapat dijadikan sebagai pakan alternatif sumber serat dan protein pada
domba pedaging yang murah adalah Indigofera sp. dan limbah tauge.
Indigofera sp.adalah salah satu leguminosa hijauan yang mempunyai kandungan protein sekitar 27% (Abdullah, 2010). Tanaman ini sangat mudah
dikembangkan pada daerah tropis dengan produksi daunnya mencapai 4096 kg
BK/ha dan sudah diujikan seara in vivo pada ternak puyuh dan kambing perah (Abdullah, 2010). Selain itu pakan potensial lainnya adalah limbah tauge kacang
hijau. Limbah tauge yang merupakan hasil buangan dari pembuatan tauge juga
mempunyai potensi untuk dijadikan sebagai pakan ternak. Hasil survey Rahayu et al. (2010), dari sisi kuantitatif potensi limbah tauge yang berada di Kota Madya Bogor
cukup besar yaitu sekitar 1,5 ton/hari. Penelitian tersebut juga menunjukkan bahwa
limbah ini dapat diberikan hingga 50% dalam ransum domba dengan kandungan
protein kasar (PK) sebesar 13,63%.Kualitas daun Indigofera sp.yang meningkat dapat dikembangkan lebih luas lagi untuk memenuhi kebutuhan nutrisi ruminansia
terutama domba. Begitu pula ketersediaan limbah tauge yang melimpah dapat
dijadikan sebagai alternatif pengganti sumber nutrisi protein pada konsentrat yang
harganya semakin lama semakin meningkat. Sumber pakan hijauan alternatif
Indigofera sp.dan limbah taugediharapkan dapat dimanfaatkan sebagai sumber pakan hijauan berprotein murah dan sebagai bahan pakan yang layak dikembangkan di
2 Kemampuan ternak ruminansia berbeda beda dalam hal memanfaatkan
pakan. Nilai fermentabilitas dan kecernaan suatu pakan merupakan salah satu
indikator yang terbaik dari nilai nutrisi. Ada beberapa metode yang dapat digunakan
untuk mengevaluasi kecernaan dan fermentabilitas pakan salah satunya adalah
metode Rusitec (Rumen Simulation Technique). Dalam penelitian ini menggunakan
Indigofera sp.dan limbah tauge dalam ransum domba dievaluasi nilainya dengan menggunakan metode Rusitec.
Tujuan Penelitian
Penelitian ini bertujuan untuk mempelajari fermentabilitas dan kecernaan
ransum yang mengandung Indigofera sp.dan limbah tauge melalui pengukuran produksi VFA parsial, NH3, kecernaan bahan kering dan bahan organik dengan
3
TINJAUAN PUSTAKA
Potensi Indigofera sp.sebagaiPakan Ternak Ruminansia
Indigofera sp.adalah genus besar dari sekitar 700 jenis tanaman berbunga milik keluarga Fabaceae (Schrire, 2005). Terdapat di seluruh daerah tropis dan subtropis di dunia, dari beberapa jenis mencapai zona di kawasan Timur Asia.
Indigofera sp.memberikan peluang yang menjanjikan dalam hal pemenuhan kebutuhan ternak ruminansia terhadap penyediaan hijauan pakan. Menurut Hassen et al., 2008 produksi bahan kering (BK) total Indigofera sp. adalah 21 ton/ha/tahun dan produksi bahan kering daun 5 ton/ha/tahun. Indigofera sp. memiliki kandungan protein yang tinggi, toleran terhadap musim kering, genangan air, dan tahan terhadap
salinitas. Tepung daun Indigofera sp.mengandung protein kasar (PK) 22,30-31,10%, NDF 18,90-50,40%, kecernaan in vitro bahan organik berkisar 55,80-71,70%, kandungan serat kasar sekitar 15,25%. Selain itu legum ini memiliki kandungan
mineral yang cukup untuk pertumbuhan optimal ternak. Kandungan mineral yang
terkandung, yaitu Ca 0,97-4,52%, P 0,19-0,33%, Mg 0,21-1,07%, Cu 9-15,30 ppm,
Zn 27,20-50,20 ppm, dan Mn 137,40-281,30 ppm (Hassen et al., 2007) serta memiliki kandungan tanin sebanyak 9,35% (Ologhobo,2009).
Gambar1. Daun Indigofera sp.
Sumber : Fotopenelitian, 2011
Taksonomi tanaman Indigofera sp.sebagai berikut : Divisi : Spermatophyta
Sub Divisi : Angiospermae
4 Bangsa : Rosales
Suku : Leguminosae
Marga : Indigofera
Jenis : Indigofera arrecta L.
Ciri-ciri legum Indigofera sp.adalah tinggi kandungan protein dan toleran terhadap kekeringan dan salinitas menyebabkan sifat agronominya sangat diinginkan.
Saat akar terdalamnya dapat tumbuh kemampuannya untuk merespon curah hujan
yang kurang dan ketahanan terhadap herbivora merupakan potensi yang baik
sebagaicover crop (tanaman penutup tanah) untuk daerah semi- kering dan daerah kering (Hassen et al., 2006). Interval defoliasi tanaman ini yaitu 60 hari dengan intensitas defoliasi 100 cm dari permukaan tanah pada batang utama dan 10 cm dari
pangkal percabangan pada cabang tanaman (Suharlina, 2010).
Tabel1. Kandungan NutrientIndigofera sp.
Kandungan Nutrient Presentase (a) Presentase (b)
Bahan Kering (%) 21,97 93,21
Keterangan: a) Kandungan nutrient Indigofera sp. sebagai pakan basal kambing boerka (Simanihuruk et al., 2009), b) Kandungan nutrient Indigofera sp. ransum penelitian, Laboratorium Ilmu Nutrisi dan Teknologi Pakan, 2011, NDF = Neutral Dietergent Fiber, ADF = Acid Detergent Fiber.
Potensi Limbah Tauge sebagai Pakan Ternak Ruminansia
Limbah tauge adalah sisa dari produksi tauge yang terdiri dari kulit kacang
hijau atau angkup tauge dan pecahan-pecahan tauge yang diperoleh pada saat
pengayakan atau ketika pemisahan untuk mendapatkan tauge yang dapat dikonsumsi.
Limbah tauge biasanya dibuang begitu saja di pasar atau oleh para pengrajin tauge,
sehingga hal tersebut berpeluang untuk mencemari lingkungan. Potensi limbah tauge
5 terutama untuk pengrajin tauge di daerah Bogor. Sebagai contoh, total produksi tauge
di daerah Bogor sekitar 6,5 ton/hari (Rahayu et al., 2010). Limbah tauge dihasilkan dari kacang hijau yang mengalami perubahan fisik secara biologi dan kimia menjadi
tauge, kemudian dilakukan pengayakan tauge di pasar sebelum dijual ke konsumen.
Kacang hijau mempunyai kandungan protein yang tinggi dan susunan asam amino
yang mirip dengan susunan asam amino kedelai. Salah satu kekurangan kacang hijau
adalah adanya kandungan anti tripsin yang dapat menghambat penyerapan protein.
Salah satu cara untuk mengurangi kandungan anti nutrisinya adalah dengan
memberikan perlakuan pada kacang tersebut seperti perendaman, perkecambahan,
dan pemanasan (Belinda, 2009).
Gambar2. Limbah taugekacang hijau Sumber : Foto Penelitian, 2011
Selama proses perkecambahan, beberapa kandungan pati diubah menjadi
bagian yang lebih kecil dalam bentuk gula maltosa. Karbohidrat sebagai bahan
persediaan makanan dirombak oleh enzim alfa amilase dan beta amilase yang bekerja
saling mengisi. Alfa amilase mengubah pati menjadi dekstrin, sedangkan beta
amilase memecah dekstrin menjadi maltosa. Molekul protein dipecah menjadi asam
amino sehingga pada kecambah terjadi kenaikan konsentrasi asam amino yaitu lisin
24%, threonin 19%, alanin 29%, dan fenilalanin 7%. Lemak dihidrolisa menjadi
asam lemak yang mudah dicerna. Beberapa mineral seperti Ca dan Fe yang biasa
terikat erat dapat dilepaskan sehingga menjadi bentuk yang lebih bebas. Dalam setiap
100 gram tauge mengandung energi 50 kkal, kalsium 32 mg, potasium 235 mg, besi
897 mg, fosfor 75 mg, seng 960 mg, asam folat 160 mg, vitamin C 20 mg, dan
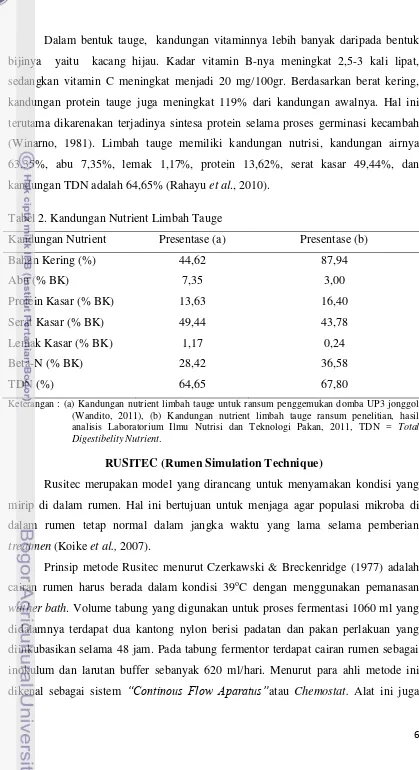
6 Dalam bentuk tauge, kandungan vitaminnya lebih banyak daripada bentuk
bijinya yaitu kacang hijau. Kadar vitamin B-nya meningkat 2,5-3 kali lipat,
sedangkan vitamin C meningkat menjadi 20 mg/100gr. Berdasarkan berat kering,
kandungan protein tauge juga meningkat 119% dari kandungan awalnya. Hal ini
terutama dikarenakan terjadinya sintesa protein selama proses germinasi kecambah
(Winarno, 1981). Limbah tauge memiliki kandungan nutrisi, kandungan airnya
63,35%, abu 7,35%, lemak 1,17%, protein 13,62%, serat kasar 49,44%, dan
kandungan TDN adalah 64,65% (Rahayu et al., 2010). Tabel 2. Kandungan Nutrient Limbah Tauge
Kandungan Nutrient Presentase (a) Presentase (b)
Bahan Kering (%) 44,62 87,94
Keterangan : (a) Kandungan nutrient limbah tauge untuk ransum penggemukan domba UP3 jonggol (Wandito, 2011), (b) Kandungan nutrient limbah tauge ransum penelitian, hasil analisis Laboratorium Ilmu Nutrisi dan Teknologi Pakan, 2011, TDN = Total Digestibelity Nutrient.
RUSITEC (Rumen Simulation Technique)
Rusitec merupakan model yang dirancang untuk menyamakan kondisi yang
mirip di dalam rumen. Hal ini bertujuan untuk menjaga agar populasi mikroba di
dalam rumen tetap normal dalam jangka waktu yang lama selama pemberian
treatmen (Koike et al., 2007).
Prinsip metode Rusitec menurut Czerkawski & Breckenridge (1977) adalah
cairan rumen harus berada dalam kondisi 39oC dengan menggunakan pemanasan
wather bath. Volume tabung yang digunakan untuk proses fermentasi 1060 ml yang didalamnya terdapat dua kantong nylon berisi padatan dan pakan perlakuan yang
diinkubasikan selama 48 jam. Pada tabung fermentor terdapat cairan rumen sebagai
inokulum dan larutan buffer sebanyak 620 ml/hari. Menurut para ahli metode ini
7 merupakan pengukur fermentasi in vitro yang biasa dipakai untuk menentukan derajat penggunaan makanan (Johnson,1966).
Gambar3. Alat Rusitec dengan 8 vessel Sumber : Foto Penelitian, 2011
Cairan rumen sebagai sumber inokulum merupakan bagian yang penting
untuk penyelidikan fermentasi in vitro. Menurut Johnson (1966) para ahli menyarankan pentingnya pemberian ransum yang sama dengan substrat yang akan
diselidiki daya cerna pada hewan yang dijadikan sebagai induk semang mengingat
banyak perbedaan dalam jenis jenis bakteri rumen yang kebutuhannya berbeda-beda.
Tetapi dalam sistem RUSITEC, hal ini tidak diperlukan karena adanya masa “prelim” beberapa hari sebelum masa pengamatan.
Keasaman (pH), menurut Hungate (1966) keasaman dalam rumen berkisar
antara 5,5-7,0, namun para peneliti berpendapat sekitar 6,9. Untuk memelihara
kehidupan mikroba perlu keasaman mendekati netral. Dalam sistem RUSITEC pH
fermentor mendekati normal karena dialirkan kedalamnya buffer McDougall sebagai saliva buatan. Pada RUSITEC di dalam rumen buatan, mikroorganisme dapat
bertahan dengan memberi makan seperti ruminansia normal setiap hari dan
memperhatikan kondisi fisiologis yang benar meliputi suhu, pH, dan saliva. (Dong
Yet al., 1997).
Cairan Rumen
Cairan rumen dapat diambil dari limbah pemotongan ternak, dari tubuh
ternak hidup dengan menggunakan stomach tube, atau dari ternak yang memiliki lubang fistula (Hungate, 1966). Cheng et al. (1980) menyatakan bahwa pada kondisi anaerob, asam lemak dan cairan rumen dapat dengan cepat menghancurkan
8 Penghuni terbesar dalam cairan rumen adalah bakteri yaitu 1010-1012/ml
cairan rumen dan populasi terbesar kedua diduduki oleh protozoa yang dapat
mencapai 105–106sel/ml cairan rumen, namun demikian karena ukuran tubuhnya lebih besar dari bakteri maka biomassanya ternyata cukup besar yakni mengandung
lebih kurang 40% total nitrogen mikroba rumen (Hungate, 1966).
Sistem Pencernaan Ternak Ruminansia
Mikroba rumen dan induk semang (ternak) hidup secara simbiosis. Secara
umum terdapat empat jenis mikroorganisme rumen, yaitu bakteri (1010-105
zoospora/ml, mewakili 5 jenis), dan bakteriofag (108-109/ml). Bakteri mendegradasi
selulosa, hemiselulosa, pati, protein, dan sangat sedikit jumlah minyak untuk
menghasilkan VFA dan protein mikroba di dalam rumen. Protozoa mencerna
karbohidrat dan protein. Fungi memiliki peran dalam fermentasi rumen yaitu sebagai
pencerna pakan serat karena fungi membentuk koloni pada jaringan selulosa pakan.
Rizoid fungi tumbuh jauh menembus dinding sel tanaman sehingga pakan lebih
terbuka untuk dicerna oleh enzim bakteri rumen (Kamra, 2005).
Protozoa memiliki jumlah yang lebih sedikit dibandingkan dengan bakteri,
ukuran tubuh protozoa lebih besar sehingga total biomassanya hampir sama dengan
bakteri (McDonaldet al., 2002). Protozoa bersifat fagosit aktif (pemangsa/predator) terhadap bakteri rumen terutama bakteri amilolitik. Bakteri amilolitik menempel
granula pati dan sifat makan protozoa yang menelan partikel-partikel pati sehingga
bakteri amilolitik ikut termakan bersama granula pati (Subrata et al., 2005). Sebanyak 70% dari total bakteri metanogen bersimbiosis dengan protozoa (Jouany,
1991). Produksi H2 dari hasil fermentasi akan dimanfaatkan oleh bakteri metanogen
untuk diubah menjadi gas metan (CH4). Hal ini akan merugikan karena pembentukan
metan merupakan proses pemborosan yang dapat mengurangi 6-10% gross energi
(Jayanegara, 2008) yang seharusnya dapat dikonversi dalam pembentukan produk
fermentasi.
Pencernaan merupakan perubahan fisik dan kimia yang dialami bahan pakan
dalam alat pencernaan. Proses pencernaan tersebut meliputi : (1) pencernaan
mekanik, (2) pencernaan hidrolitik dan (3) pencernaan fermentatif. Pencernaan
mekanik terjadi dimulut oleh gigi melalui proses mengunyah dengan tujuan untuk
9 melalui pencernaan hidrolitik, dimana zat makanan akan diuraikan menjadi
molekul-molekul sederhana oleh enzim-enzim pencernaan yang dihasilkan oleh hewan
(Sutardi, 1980). Hasil pencernaan fermentatif berupa Volatile Fatty Acids (VFA), NH3, dan air diserap di sebagian rumen dan sebagian lagi di abomasum dan dicerna
secara hidrolitik oleh enzim enzim pencernaan sama seperti yang terjadi di hewan
monogastrik. Pencernaan berlangsung dari suatu saluran yang terentang dari mulut
ke anus (Fradson, 1996). Zat makanan tersebut dalam saluran pencernaan mengalami
perombakan menjadi zat-zat yang siap untuk diserap tubuh hewan (Tilman et al., 1986).
Sistem pencernaan ruminansia sangat bergantung pada perkembangan
populasi mikroba yang mendiami retikulorumen dalam mengolah setiap bahan pakan
yang dikonsumsi. Mikroba tersebut berperan sebagai pencerna-pencerna serat dan
sumber protein. Adanya mikroba yang berperan dalam pencernaan pakan di dalam
rumen menyebabkan ternak ruminansia mampu mencerna pakan berserat yang
berkualitas rendah, sehingga kebutuhan asam-asam amino untuk ternak tidak
sepenuhnya tergantung pada protein pakan yang diberikan (Sutardi, 1980).
Pencernaan Fermentatif
Proses pencernaan pada ruminansia terjadi secara mekanis di dalam mulut,
fermentatif oleh mikroba dalam rumen dan hidrolisis oleh enzim pencernaan ternak
inang. Proses pencernaan fermentatif zat makanan dirombak oleh mikroba menjadi
senyawa lain yang berbeda sifat kimianya sebagai zat intermediate. Produk dari hasil pencernaan fermentatif yaitu asam lemak terbang (VFA), NH3, sel mikroba, gas
metan, CO2 dan air. Gas metan akan dikeluarkan dengan cara eruktasi dan VFA
diserap melalui dinding rumen. Sekitar 75% dari total VFA yang diproduksi akan
diserap langsung retikulo-rumen yang masuk ke darah, sekitar 20% diserap di
abomasum dan omasum, dan sisanya sekitar 5% diserap usus halus (McDonald et al., 2002).
Peningkatan produksi VFA menunjukkan mudah atau tidaknya pakan
tersebut didegradasi oleh mikroba rumen (Sakinah, 2005).Ransum yang diberikan
kepada ternak ruminansia sebagian besar terdiri dari karbohidrat. Degradasi
karbohidrat di dalam rumen dilakukan dengan dua tahapan yaitu 1) karbohidrat
10 sederhana (monosakarida glukosa) oleh enzim-enzim mikroba rumen, 2)
monosakarida menjadi piruvat yang selanjutnya akan diubah menjadi produk akhir
yaitu VFA (asetat, propionat dan butirat) (McDonald et al., 2002).
Selulosa Pati
Selobiosa Maltosa
Glukosa
2 ATP
2 NAD+
2 NADH
Piruvat 2 NADH 2 NAD+
CO2 CH4
Asam Laktat Asetil Co-A
4 NADH NADH
4 NAD NAD +
Propionat Asetat Butirat
Gambar4. Sintesis VFA oleh mikroorganisme di rumen Sumber : Damron (2006)
Menurut McDonald et al. (2002) proporsi molar dari VFA terdiri dari 65% asetat, 21% propionat, dan 14% butirat. Hal ini sangat dipengaruhi oleh jenis pakan
yang dikonsumsi. Kecepatan produksi VFA dan sel bakteri berhubungan dengan
konsumsi TDN(Arora, 1989). Karbohidrat seperti selulosa, hemiselulosa, pectin,
pati, dan gula tercerna lainnya merupakan substrat utama dalam proses fermentasi.
Karbohidrat ini didegradasi menjadi bentuk heksosa dan pentosa sebelum
difermentasi menjadi VFA oleh piruvat (France dan Dijkstra, 2005).
Banyaknya VFA yang dihasilkan di dalam rumen sangat bervariasi
tergantung pada jenis ransum yang dikonsumsi. Konsentrasi VFA total yang layak
bagi kelangsungan hidup ternak 70-150 mM (McDonald et al., 2002) dengan titik optimumnya adalah 110 mN (Suryapratama, 1999).Menurut France dan Dijikstra
(2005) konsentrasi VFA total dapat turun menjadi 30 mM atau meningkat sampai
200 mM, namun pada umumnya konsentrasi VFA berkisar antara 70-130 mM.
11 terlihat jelas pada pakan hijauan tetapi kurang terlihat pada pakan konsentrat. Tinggi
rendahnya konsentrasi VFA dipengaruhi oleh pakan basal, tipe karbohidrat pakan,
bentuk fisik pakan, tingkat konsumsi, frekuensi pakan, dan penggunaan aditif kimia.
Menurut Salawu et al. (1997) faktor yang mempengaruhi konsentrasi VFA adalah kandungan serat kasar dan unsur karbon yang terdapat dalam protein. Selain itu jenis
dan jumlah mikroorganisme juga mempengaruhi konsentrasi VFA.
Berdasarkan penelitian Fitri (2010), produksi VFA total hasil fermentasi in vitro empat jenis daun leguminosa pohon secara berurutan dari gamal, kaliandra, kelor, dan lamtoro, yaitu 110,17 mM; 97,67 mM; 138,04 mM; dan 110,38
mM.Perbandingan antara asamlemak terbang yang dihasilkan tidak tetap,
bergantungpada tipe makanan, pengolahan dan frekuensi pemberian makan
(Soewardi,l974).Umumnya perbandingan VFA berkisar 65% asetat, 20% propionat,
10% butirat dan5% valerat (Sutardi, 1977). Ransum dari penguat akan rnenghasilkan
perbandingan 45% asetat, 40% propionat, 5-10% butirat dan 2-8% valerat. Apabila
konsentrat dalamransum meningkat, maka proporsi asetat menurun dan asam
propionat meningkat(Ranjhan, 1980).
Ternak mengkonsumsi pakan yang cukup akan protein untuk memenuhi
kebutuhan protein dalam tubuhnya. Protein dalam rumen mengalami proteolisis
seperti halnya karbohidrat. Protein pakan di dalam rumen dipecah oleh mikroba
menjadi peptida dan asam amino, beberapa asam amino dipecah lebih lanjut menjadi
amonia. Amonia merupakan hasil metabolisme protein dan nitrogen bukan protein.
Amonia dalam rumen adalah sumber nitrogen yang akan digunakan oleh mikroba
rumen dalam pembentukan protein mikroba (McDonald et al., 2002).
Amonia dalam cairan rumen merupakan produk akhir dari proteolisis yang
dirombak oleh populasi bakteri rumen. Amonia juga merupakan sumber nitrogen
utama untuk sintesis protein oleh populasi bakteri rumen. Pada waktu tertentu,
konsentrasi amonia dalam rumen tergantung pada laju relatif pelepasan dan
pembentukan kembali amonia. Amonia dalam cairan rumen dibentuk ketika asam
amonia berlebihan yang dimetabolisme ke dalam intraselular oleh berbagai macam
mikroorganisme. Saat amonia dalam intraselular meningkat, amonia akan
dikeluarkan sebagian dimana amonia ini tersedia dan akan dimanfaatkan oleh
12 optimum dalam cairan rumen berkisar antara 85 hingga lebih dari 300mg/l
(McDonald., 2002).
Kadar amonia dalam rumen merupakan petunjuk antara proses degradasi dan
proses sintesis protein oleh mikroba rumen. Ketika kandungan protein pakan tahan
degradasi, maka konsentrasi amonia dalam rumen akan rendah dan pertumbuhan
mikroba rumen akan lambat yang menyebabkan turunnya kecernaan pakan
(McDonald et al., 2002). Amonia merupakan sumber nitrogen utama untuk sintesis protein mikroba, oleh karena itu konsentrasinya dalam rumen merupakan suatu hal
yang perlu diperhatikan.
Konsentrasi amonia harus dalam keadaan cukup untuk menunjang sintesis
protein mikroba. Kekurangan amonia akan menyebabkan pertumbuhan bakteri yang
lambat sehingga degradasi karbohidrat melambat. Kelebihan amonia akan
menyebabkan amonia terakumulasi di rumen yang kemudian akan diserap oleh darah
dan dibawa ke hati untuk dikonversi menjadi urea. Beberapa urea akan dikembalikan
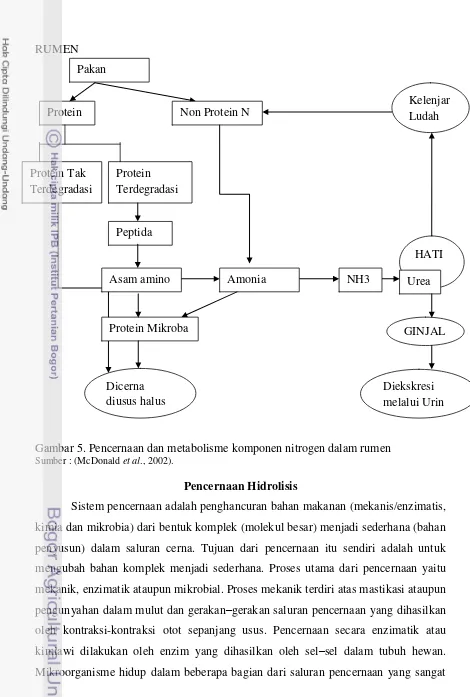
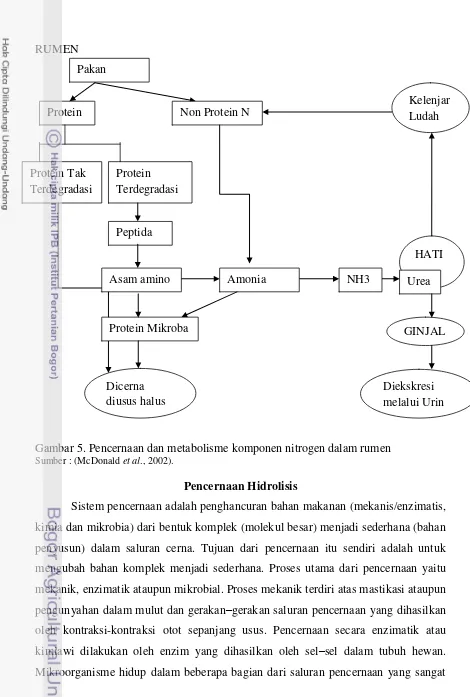
ke saliva dan ada yang langsung diekskresikan melalui urin (McDonaldet al., 2002) (Gambar5). Menurut Sutardi (1980) kadar amonia yang dibutuhkan untuk menunjang
pertumbuhan mikroba rumen berkisar antara 4-12 mM yang setara dengan
5,6-16,8mg/100ml. McDonald et al. (2002) menjelaskan bahwa konsentrasi optimum NH3 di dalam rumen berkisar 85-300 mg/l yang setara dengan 6-21 mM.
Menurut McDonald et al. (2002) kisaran konsentrasi NH3 yang optimal untuk sintesis protein oleh mikroba rumen adalah 6 - 21 mM. Konsentrasi nitrogen amonia
sebesar 5% sudah mencukupi kebutuhan nitrogen mikroba. Faktor utama yang
mempengaruhi penggunaan NH3 adalah ketersediaan karbohidrat dalam ransum yang
berfungsi sebagai sumber energi untuk pembentukan protein mikroba. Amonia dapat
dimanfaatkan oleh mikroba dan penggunaannya perlu disertai dengan sumber energi
yang mudah difermentasi, misalnya dedak padi. Berdasarkan penelitian Kasim
(1994), rata-rata produksi amonia hasil fermentasi in vitro empat jenis daun leguminosa pohon secara berurutan dari angsana, kupu-kupu, sengon, dan lamtoro
13 RUMEN
Gambar 5. Pencernaan dan metabolisme komponen nitrogen dalam rumen Sumber : (McDonald et al., 2002).
Pencernaan Hidrolisis
Sistem pencernaan adalah penghancuran bahan makanan (mekanis/enzimatis,
kimia dan mikrobia) dari bentuk komplek (molekul besar) menjadi sederhana (bahan
penyusun) dalam saluran cerna. Tujuan dari pencernaan itu sendiri adalah untuk
mengubah bahan komplek menjadi sederhana. Proses utama dari pencernaan yaitu
mekanik, enzimatik ataupun mikrobial. Proses mekanik terdiri atas mastikasi ataupun
pengunyahan dalam mulut dan gerakan–gerakan saluran pencernaan yang dihasilkan oleh kontraksi-kontraksi otot sepanjang usus. Pencernaan secara enzimatik atau
kimiawi dilakukan oleh enzim yang dihasilkan oleh sel–sel dalam tubuh hewan. Mikroorganisme hidup dalam beberapa bagian dari saluran pencernaan yang sangat
14 penting dalam pencernaan ruminansia. Pencernaan oleh mikroorganisme ini juga
dilakukan secara enzimatik yang enzimnya dihasilkan oleh sel–sel mikroorganisme (Tillman et al., 1991).
Kecernaan merupakan presentase pakan atau zat nutrisi tertentu dalam pakan
yang larut dalam saluran pencernaan sehingga dapat diserap oleh dinding sel
pencernaan. Kecernaan dipengaruhi oleh beberapa faktor diantaranya : (1) adanya
enzim yang mempengaruhi lingkungan fisiologis rumen, (2) komposisi nutrien bahan
pakan dan antinutrisi yang terkandung dalam pakan, dan (3) kapasitas saluran
pencernaan ternak (Church, 1979).
Menurut McDonald et al.(2002), kecernaan pakan dapat didefinisikan dengan cara menghitung bagian zat makanan yang tidak dikeluarkan melaui feses dengan
asumsi zat makanan tersebut telah diserap oleh ternak. Pengukuran kecernaan dapat
dilakukan dengan memberikan sejumlah pakan tertentu kepada ternak dan
menghitung jumlah feses yang dikeluarkan oleh ternak. Pengukuran kecernaan
sebaiknya dilakukan dengan lebih dari satu ternak. Selain itu, kecernaan pakan juga
dapat dihitung cepat dilaboratorium yaitu dengan menggunakan cairan rumen.
Kecernaan dapat dibedakan menjadi kecernaan bahan kering dan bahan organik.
Faktor faktor yang mempengaruhi kecernaan yaitu komposisi bahan pakan,
perbandingan komposisi antara bahan pakan satu dengan bahan pakan lainnya,
perlakuan pakan, suplementasi enzim dalam pakan, ternak dan level pemberian
pakan (McDonald et al., 2002). Berdasarkan penelitian Kasim (1994) kecernaan bahan kering hasil fermentasi in vitro empat jenis daun leguminosa pohon secara berurutan dari angsana, kupu-kupu, sengon, dan lamtoro dalam bentuk segar, yaitu
37,70%, 39,70%, 32,10%, dan 43,80%.
Kecernaan bahan organik merupakan faktor penting yang dapat menentukan
nilai pakan (McDonald et al., 2002). Semakin tinggi bahan organik yang dikonsumsi akan menghasilkan nilai kecernaan bahan organik yang semakin tinggi pula
(Resdiani, 2010). Sebagian besar komponen bahan kering terdiri dari bahan organik
sehingga faktor faktor yang mempengaruhi tinggi rendahnya Koefisien Cerna Bahan
Kering (KCBK) akan mempengaruhi juga tinggi rendahnya Koefisien Kecernaan
Bahan Organik (KCBO) ransum. Semakin tinggi KCBK maka semakin tinggi pula
15 organik menggambarkan senyawa protein, karbohidrat, lemak yang dapat dicerna
oleh ternak (Menke et al., 1986).Berdasarkan penelitian Kasim (1994) kecernaan bahan organik hasil fermentasi in vitro empat jenis daun leguminosa pohon secara berurutan dari angsana, kupu-kupu, sengon, dan lamtoro dalam bentuk segar, yaitu
16
MATERI DAN METODE
Lokasi dan Waktu Penelitian
Penelitian inidilakukan pada bulan Oktober 2011 sampai bulan Maret 2012 di
kandang percobaan laboratorium Ternak Ruminansia Kecil Kandang B, Fakultas
Peternakan, Institut Pertanian Bogor untuk proses pengambilan isi rumen sedangkan
untuk analisis dilakukan di BATAN (Balai Tenaga Nuklir Nasional) Jakarta,
laboratorium Nutrisi Ternak Daging Kerja dan Olahraga, Fakultas Peternakan,
Institut Pertanian Bogor, dan Laboratorium Biokimia, Pusat Studi Pangan dan Gizi
Universitas Gadjah Mada. Waktu penelitian diperkirakan selama 6 bulan.
Materi
Bahan yang digunakan dalam penelitian ini adalah isi rumen, ransum berbasis
Indigofera sp., ransum limbah tauge, gas CO2, aquades 40oC, saliva buatan, nylon, Na2CO3, 0,01 M H2SO4, dan larutan volatile acid standar mix (VSA) 0,5 mikroliter LB 15952 (46975-1).
Alat yang digunakan dalam praktikum ini adalah termos, tali, gelas platik
dengan ukuran 2L, alat RUSITEC, tabung gas CO2, baskom, sarung tangan, penjepit,
cawan conway, titrasi, pipet, tabung film, gas bag, botol penampung effluent,
timbangan, oven 60oC, oven 105oC, tanur, loyang, benang jahit, sentrifuge, injektor,
detector, tabung gas pembawa, cawan porselen, eksikator, dan GC Simatzu DC 8A.
Ransum Penelitian
Ransum perlakuan terdiri dari Indigofera sp., limbah tauge, onggok, jagung, bungkil kelapa, CaCO3, molases, bungkil kedelai, premix, dan NaCl.Daun Indigofera sp.dan limbah tauge dijemur dan dicampur dengan bahan pakan lainnya dalam bentuk pelet. Kemudian pelet ditumbuk halus menjadi mash untuk proses Rusitec.
Ransum disusun dengan imbangan hijauan dan konsentrat 30:70 dengan kandungan
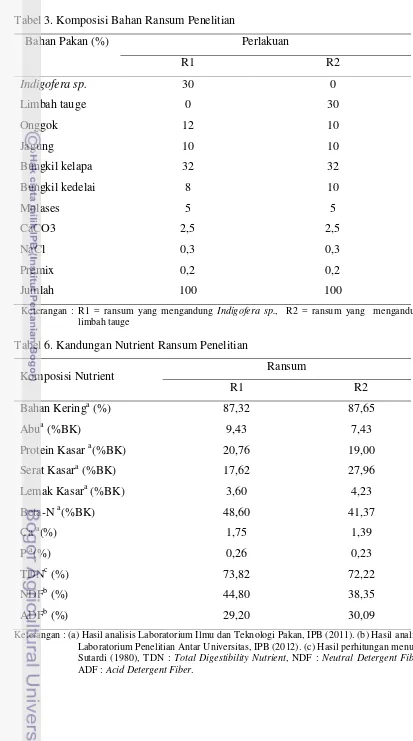
17 Tabel 3. Komposisi Bahan Ransum Penelitian
Bahan Pakan (%) Perlakuan
18
Metode
1) Pengambilan isi rumen
Pengambilan rumen dilakukan di kandang B Fakultas Peternakan Institut
Pertanian Bogor. Rumen domba diambil dari rumen domba garut dan domba
jonggol yang dipelihara selama 3 bulan pada kandang individu untuk diambil isi
rumennya yang akan digunakan sebagai sumber mikroorganisme pada
RUSITEC. Pada masa hidupnya domba diberi pakan yang
mengandungIndigofera sp. dan limbah tauge. Pengambilan isi rumen dilakukan dengan cara memotong domba kemudian bagian perut domba dibuka. Bagian
fundus dan pangkal esofagus diikat dengan menggunakan tali. Hal ini untuk
meminimalisir terkontaminasinya isi rumen dengan gas O2.Isi rumen dipisahkan
dengan saluran pencernaan kemudian segera ditampung kedalam gelas plastik
ukur dengan ukuran 2 liter dan dibaca volume rumennya. Isi rumen dari gelas
ukur tersebut dimasukkan ke dalam termos panas. Sebelum termos digunakan,
termos diisi air yang bersuhu 40oC selama satu jam. Hal ini digunakan agar
dinding dalam termos sesuai dengan suhu isi rumen. Aquades di dalam termos
dibuang dan cairan rumen dimasukkan ke dalam termos. Selanjutnya isi rumen
tersebut di bawa ke BATAN untuk dianalisis Rusitec.
2) Persiapan RUSITEC
Tutup termos dibuka kemudian isi rumen tersebut disaring dengan kain
kasa berlapis 4 untuk dipindahkan pada gelas ukur plastik. Selama penyaringan
sampai rumen digunakan untuk starter Rusitec dilakukan dibawah aliran gas CO2 agar tetap dalam kondisi anaerob. Cairan yang berada di gelas ukur plastik
ditakar sebanyak 400 ml untuk diletakkan pada masing-masing vessel yang
memiliki kapasitas 800 ml. Selain itu vessel yang terdapat cairan rumen
sebanyak 400 ml dicampur dengan 400 ml saliva buatan. Padatan isi rumen yang
terdapat pada kertas saring ditimbang kurang lebih 75 gram kemudian
dimasukkan ke dalam nylon dan diikat dengan menggunakan benang jahit.
Sebelum digunakan kantong nylon dilakukan pengeringan pada suhu 55oC.
19 limbah tauge dimasukkan ke dalam kantong nylon dan diikat dengan benang
jahit.
Pemberian pakan dilakukan sesuai dengan pakan yang dikonsumsi oleh
domba ketika hidup. Padatan dan pakan yang telah terbungkus dengan kantong
nylon dimasukkan ke dalam feed container. Feed container dimasukkan ke dalam vessel yang telah diberikan kode sebelumnya. Vessel dimasukkan
kedalam wather bath yang bersuhu sekitar 380C-420C. Terdapat 2 selang pada vessel, satu selang dihubungkan pada botol penampung effluent, dan selang
lainnya dihubungkan dengangas bag. Selang yang menghubungkan vessel dengan saliva buatan dipasang. Kemudian aliran saliva buatan dinyalakan dan
alat Rusitec dinyalakan.
3) Proses RUSITEC
Sebanyak 8 vessel yang berisi masing-masing cairan rumen yang sesuai
dengan perlakuan penelitian. Vessel A dan vessel E berisi cairan rumen domba
garut yang diberi pakan berbasis Indigofera sp. Vessel B dan vessel F berisi cairan rumen domba jonggol yang diberi pakan berbasis limbah tauge. Vessel C
dan vessel G berisi cairan rumen domba jonggol yang diberi pakan berbasis
Indigofera sp. Vessel D dan vessel H diisi dengan cairan rumen domba garut yang diberi pakan limbah tauge. Proses running RUSITEC dilakukan selama 24 jam. Kemudian setelah 24 jam dilakukan penggantian pakan baru dan
pengambilan pakan yang terdapat dalam vessel.
Penggantian pakan dilakukan dengan cara aliran saliva buatan dimatikan
terlebih dahulu kemudian saluran RUSITEC dimatikan. Selama RUSITEC
dimatikan wather bath tidak dimatikan. Gas bag dilepas dari selang dan segera ditutup. Botol yang berisi efluent dilepas dari selang dan segera ditutup dengan
menggunakan plastik film. Produksi efluent dicatat untuk selanjutnya digunakan
analisis NH3. Kemudian selang saliva buatan di lepas dan vessel dikeluarkan dari
wather bath dipindah dalam wadah yang berisi air hangat supaya kondisi thermal
tetap stabil. Feed container dilepas padatan yang posisinya diatas diambil, dan dicuci dengan menggunakan saliva buatan dan diperas. Padatan tersebut akan
dianalisis kecernaan bahan kering dan bahan organiknya. Cairan hasil perasan
20 diletakkan di bawah pakan lama, kemudian vessel ditutup. Dalam pengerjaan
penggantian pakan cairan rumen yang berada di dalam vessel harus dialiri gas
CO2 agar tetap dalam kondisi anaerob. Vessel ditutup dan dimasukkan ke dalam
wather bath dan proses RUSITEC berlanjut.
4) Analisis NH3
Efluent dari inkubasi 24 jam yang berasal dari tabung dianalisis NH3
dengan cara menggunakan cawan conway. Bibir cawan conway dan tutup diolesi
dengan vaselin, effluent yang berasal dari proses fermentasi diambil 1.0 ml
kemudian ditempatkan pada salah satu ujung alur cawan conway. Larutan
Na2CO3 jenuh sebanyak 1.0 ml ditempatkan pada salah satu ujung cawan conway
bersebelahan dengan supernatant. Larutan asam borat berindikator sebanyak 1.0
ml ditempatkan dalam cawan kecil yang terletak di tengah cawan conway.
Cawan conway yang sudah diolesi vaselin ditutup rapat hingga kedap udara,
larutan Na2CO3 dicampur dengan effluent hingga merata dengan cara
menggoyang–goyangkan dan memiringkan cawan tersebut. Setelah itu dibiarkan selama 24 jam dalam suhu kamar. Setelah 24 jam suhu kamar dibuka, asam borat
berindikator dititrasi dengan H2SO4 0.005 N sampai terjadi perubahan warna dari
biru menjadi merah. Hasil titrasi dicatat.
N-NH3 (mM) = ml H2SO4 x N H2SO4 x 1000
g sampel x BK sampel
5) Analisis VFA Parsial (Gas Chromatografi)
Sebanyak10 mlsampelefluentdisentrifugasiselama 10menit. Hal tersebut
untuk memisahkan supernatan dari padatan. Larutan standar yaitu 4% 2-metil
valericdalamasam format(w/w) sebanyak 250ml dicampurdengan
21 digunakan untuk mengukur VFA parsial adalah larutan volatile acid standar mix
(VSA) sebanyak 0,5 mikroliter
VFA parsial dideteksi dengan menggunakangascromatograph(GC-14B,
Simadzu DC 8A) dilengkapidengan tempat pengemas (10%
carbowax20MTPASP1000dengan 1% H3PO4padacromosorbWAW80/100) dan
nyala detektorionisasi terhubung kecromatro-integrator. H2dengan tekanangas
120kPa seperti gas perantara. Suhu oven sekitar 170oC,
sedangkansuhukolomdetektor, dan injectormasing-masing 140oC, 230oC, dan
230oC.Sampel yang telah di sentrifuge disuntikkan sebanyak 0,5 Mliter dengan
menggunakan syringe kedalam injektor. data ditampilkan dalam bentuk
kromatogram. Garis kurva yang terbentuk diukursetelah minimal 1,565
menituntuk C2(asetat), 2,24untuk C3(propionat), 2,832untukIC4(iso-butirat),
3,42untuknC4(butirat), 4,575untukIC5(iso-valerat), 5,855untukNc5(valerat).
Rumus yang digunakan dalam perhitungan VFA parsial adalah :
6) Pengukuran KCBK dan KCBO(Czerkawski & Breckenridge Methode)
Kantong nylon dimasukkan kedalam oven 55oC untuk mendapatkan
bobot konstan. Kantong nylon diisi sampel pakan sebanyak 20 gram kemudian
ditali dengan menggunakan benang jahit. Kantong nylon yang berisi sample
pakan kemudian diinkubasi selama 48 jam. Setelah diinkubasi kantong nylon
dicuci dengan saliva mengalir dan diperas kemudian dioven 55oC dengan
menggunakan loyang sampai berat konstan dan ditimbang. Sample dimasukkan
kedalam cawan porselin yang bersuhu oven 105oC selama 24 jam. Cawan
porselin yang berisi sampel dimasukkan kedalam eksikator sekitar 10 menit.
Bobot kehilangan kadar air dicatat. Cawan porselin beserta sampel dimasukkan
ke dalam tanur yang bersuhu 450-600oC untuk menghitung bahan organik. C2= x pengenceran x konsentrasi standard (10 Mmol)
area sampel
22 KCBK = x 100
KCBO = x 100
Keterangan :
KCBK = Koefisien Cerna Bahan Kering (%)
KCBO = Koefisien Cerna Bahan Organik (%)
Analisis Data
Dalam penelitian ini digunakan Rancangan Acak Lengkap pola faktorial 2x2
dengan 2 ulangan dengan faktor pertama adalahjenis ransum (Indigofera sp. dan limbah tauge), faktor kedua yaitu bangsa domba lokal (UP3 Jonggol dan Garut).
Model yang digunakan adalah sebagai berikut :
Yij = µ + Ai + Bj + (AB)ij+ ɛij
Keterangan:
Yijk : nilai pengamatan perlakuan ke-i dan ke-j
µ : nilai tengah
Ai : pengaruh perlakuan bangsa domba (UP3 Jonggol dan Garut) ke-i
Bj : pengaruh perlakuan jenis ransum (berbasis Indigofera sp.. dan limbah tauge) ke-j
(AB)ij : interaksi antara bangsa dan jenis ransum
ɛij : pengaruh galat percobaan
Data yang diperoleh dianalisis dengan sidik ragam (Analysis of Variance) untuk mengetahui pengaruh perlakuan terhadap peubah yang diamati. Jika perlakuan
berpengaruh nyata terhadap peubah yang diukur diuji menggunakan uji lanjut
Duncan untuk mengetahui perbedaan diantara perlakuan tersebut (Mattjik dan
Sumertajaya, 2006).
BK sampel – BK residu BK sampel
23
HASIL DAN PEMBAHASAN
Kandungan Nutrien Ransum Penelitian
Penelitian ini menggunakan ransum perlakuan yang terdiri dari Indigofera sp., limbah tauge, onggok, jagung, bungkil kelapa, CaCO3, molases, bungkil kedelai, premix, dan NaCl. Bahan-bahan tersebut dicampur dan dibentuk mashdengan
perbandingan hijauan dan konsentrat yaitu 30:70. Sumber hijauan yang digunakan
adalah Indigofera sp. dan limbah tauge. Legum Indigofera sp. didapat dari UP3 Jonggol sedangkan limbah tauge didapat dari Pasar Bogor. Limbah tauge dapat
digolongkan sebagai hijauan karena mengandung serat kasar yang tinggi mencapai
49,44% (Rahayu et al., 2010).
Terdapat perbedaan kandungan nutrient pada ransum yang mengandung
Indigofera sp., dan limbah tauge. Ransum yang mengandung Indigofera sp.,
memiliki kandungan protein kasar lebih besar dari pada limbah tauge yaitu 20,76% .
Hal ini dikarenakan sumber hijauan limbah tauge memiliki protein yang lebih rendah
dibanding dengan leguminosa Indigofera sp. Leguminosa mempunyai kandungan protein yang cukup tinggi, karena simbiosis yang terjadi antara mikroorganisme
tanah yaitu Rhizobium sp. pada bintil akar membuat leguminosa mampu memfiksasi nitrogen dari udara (Fondevila et al., 2002). Kandungan serat kasar Indigofera sp.
17,62% lebih kecil dari limbah tauge, namun NDF Indigofera sp. lebih tinggi dari limbah tauge dan ADF limbah tauge lebih besar dari Indigofera sp.Hal tersebut menandakan bahwa serat kasar Indigofera sp. lebih mudah dicerna dari limbah tauge. Serat kasar dapat mempengaruhi kecernaan pakan. Semakin tinggi kandungan serat
kasar, kecernaan pakan akan semakin menurun.
Kandungan lemak pada ransum penelitian tidak berbeda antara Indigofera sp. dan limbah tauge. Imbangan Ca dan P ransum yang mengandung Indigofera sp.
yaitu 3:1 sedangkan imbangan pada ransum yang mengandung limbah tauge yaitu
2:1. Imbangan Ca dan P pada ransum non ruminansia adalah antara 1:1 hingga 2:1,
sedangkan ternak ruminansia dapat lebih toleran dengan imbangan yang lebih tinggi.
Keberadaan Ca yang tinggi dapat menimbulkan gangguan, yaitu dapat
mengakibatkan defisiensi pada beberapa mineral seperti Mg, Fe, Mn, dan Cu
24 Kandungan TDN ransum penelitian relatif sama umumnya berkisar antara
72,22-73,82 %. Kandungan TDN ransum ini sudah memenuhi kebutuhan ransum
ternak kambing dan domba yaitu 54-56% (NRC, 2007).
KonsentrasipH Cairan Rumen
Fermentasi pakan di dalam rumen akan mempengaruhi nilai pH, yaitu
semakin tinggi aktivitas fermentasi makan nilai pH akan semakin turun. Faktor lain
yang mempengaruhi nilai pH cairan rumen adalah produksi saliva. Saliva yang
diproduksi domba bersifat alkalis dan berperan sebagai buffer untuk menjaga keseimbangan pH rumen. Sekresi saliva dipengaruhi oleh bentuk fisik pakan,
kandungan bahan kering, volume cairan isi perut dan stimulasi psikologis .Nilai pH
cairan rumen merupakan faktor yang besar pengaruhnya terhadap kondisi rumen,
baik dalam mendukung pertumbuhan mikroba rumen maupun dalam menghasilkan
produk produknya yang berupa VFA dan N-NH3 (McDonald et al., 2002). Pengukuran pH rumen penting dilakukan, terutama pada ternak yang mengkonsumsi
ransum dengan tingkat konsentrat yang tinggi.
Hal pengukuran pH cairan rumen pada penelitian ini menujukkan bahwa
ransum yang diberikan tidak berpengaruh nyata terhadap pH cairan rumen. Begitu
juga dengan bangsa dan interaksi ransum-bangsa tidak nyata pengaruhnya terhadap
pH cairan rumen.
Tabel 5. Konsentrasi pH Cairan Rumen dengan Teknik Rusitec
Bangsa Ransum Rataan
R1 R2
D1 6,77 ± 0,02 6,76 ± 0,04 6,77 ± 0,03
D2 6,71 ± 0,04 6,18 ± 0,03 6,44 ± 0,04
Rataan 6,71 ± 0,03 6,47 ± 0,03
Keterangan : Hasil analisis Laboratorium Biokimia, Pusat Studi Pangan dan Gizi Universitas Gadjah Mada (2012), R1 = ransum yang mengandung Indigofera sp., R2= ransum yang mengandung limbah tauge, D1= domba garut, D2 = domba yang berdomisili di jonggol.
Pada Tabel 5 dapat dilihat bahwa kisaran pH cairan rumen antara 6,18 sampai
6,77. Secara umum, pH cairan rumen yang dicapai pada penelitian ini berada pada
kondisi yang cukup optimal untuk berlangsungnya proses metabolisme di dalam
25 makanan diperlukan pH rumen 6-7. Bila kondisi pH tersebut kurang dari enam,
proteolisis dan deaminasi akan terhambat, karena tertekannya pertumbuhan bakteri
rumen, begitu juga pembentukan amonia akan terhambat. Nilai pH merupakan faktor
penting yang menunjukkan keadaan dan fungsi yang normal dari rumen. Nilai pH
dapat menggambarkan populasi mikroba dan produk fermentasi serta fungsi fisiologi
pada rumen terutama pergerakan dan fungsi penyerapan (Istiqomah et al., 2011).
Konsentrasi NH3Cairan Rumen
Kadar amoniak dalam cairan rumenmerupakan petunjuk adanya proses
degradasi(perombakan) protein yang masuk dalam rumen danproses sintesis protein
oleh mikroba rumen. Proteinyang masuk ke dalam rumen, sebagian akan
mengalamiperombakan oleh enzim proteolitik yang dikandung oleh mikroba rumen.
(McDonald, 2002). Untuk mengetahui efisiensi penggunaan nitrogen pada
ruminansia, pengukuran konsentrasi amonia perlu dilakukan (Wohlt, 1976). Produksi
NH3 pada penelitian ini disajikan dalam Tabel 6.
Tabel 6. Produksi NH3Cairan Rumen dengan Tehnik RUSITEC
Bangsa Ransum Rataan
R1 (mM) R2 (mM)
D1 10,67± 0,56 7,10 ± 0,02 8,88 ± 2,08
D2 8,11± 2,42 7,06 ± 0,21 7,59 ± 1,43
Rataan 9,38a ± 1,93 7,09b ± 0,12
Keterangan : a, b) Superskrip yang tidak sama dalam satu baris berarti berbeda nyata (P<0,05).Hasil analisis Laboratorium Biokimia, Pusat Studi Pangan dan Gizi Universitas Gadjah Mada (2012), R1 = ransum yang mengandung Indigofera sp., R2= ransum yang mengandung limbah tauge, D1= domba garut, D2 = domba yang berdomisili di jonggol.
Ransum yang berbasisIndigofera sp. lebih banyak memproduksi NH3 dari pada limbah tauge (P<0,05). Hal ini dikarenakan kandungan protein ransum yang
mengandung Indigofera sp. lebih besar dari kandungan protein limbah tauge. Konsentrasi amonia pakan yang mengadung limbah tauge lebih rendah dari
26 protein yang sulit terdegradasi dapat disebabkan oleh banyaknya kandungan serat
kasar yang tidak dapat dicerna.
Perbedaan cairan rumen domba garut dan domba jonggol tidak memberikan
pengaruh nyata terhadap rataan konsentrasi amonia, walaupun cairan rumen domba
garut lebih tinggi menghasilkan amonia dibandingkan cairan rumen domba jonggol.
Hal ini menunjukkan tidak adanya perbedaan aktivitas fermentasi mikrobadomba
garut dan domba jonggol dalam mendegradasi protein sehingga bakteri rumen kedua
ternak tersebut memiliki kemampuan yang sama dalam mendegradasi protein.
Konsentrasi amonia sangat berhubungan dengan jumlah populasi mikroba rumen,
khususnya bakteri proteolitik (Bach et al., 2005).
Konsentrasi amonia normal untuk pertumbuhan mikroba rumen adalah 4-12
mM. Konsentrasi amonia dalam penelitian ini umumnya tinggi berkisar antara
7,06-10,07 mM yang sangat membantu dalam pembentukan protein mikroba rumen.
(Sutardi, 1980). Hal ini menunjukkan bahwa konsentrasi amonia yang dihasilkan
dalam penelitian ini sudah dapat dimanfaatkan optimal oleh mikroba rumen untuk
mensintesis protein mikroba yang akan diserap di organ pasca rumen. Tingginya
konsentrasi disebabkan oleh tidak adanya penyerapan amonia oleh dinding rumen, N-recycling, pembuangan melalui urin dan terjadi lisis mikroba yang dapat menambah jumlah amonia dalam fermentor sehingga amonia terakumulasi (Afriyanti, 2008)
Produksi VFA Cairan Rumen
Karbohidrat seperti selulosa, hemiselulosa, pektin, pati dan gula tercerna
lainnya merupakan substrat utama dalam proses fermentasi. Karbohidrat ini
difermentasi menjadi bentuk heksosa dan pentosa yang kemudian dikonversi menjadi
piruvat, selanjutnya piruvat dirubah menjadi VFA (Dijkstra, 2005). VFA merupakan
sumber energi utama bagi ternak ruminansia melalui proses glukoneogenesis yaitu
diserapnya VFA (khususnya propionat) ke dalam sistem peredaran darah yang
kemudian diubah oleh hati menjadi gula darah. Gula darah inilah yang akan
mensuplai sebagian besar kebutuhan energi bagi ternak ruminansia (Lehninger,
1982). VFA umumnya terdiri dari asetat, propionat dan butirat, akan tetapi juga
terdiri dari valerat, caproat, isobutirat, isovalerat, 2-metilbutirat dalam jumlah sedikit
serta beberapa jenis asam lainnya yang diproduksi di rumen sebagai hasil akhir
27 Produksi VFA total yang dihasilkan dalam penelitian ini menujukkan bahwa
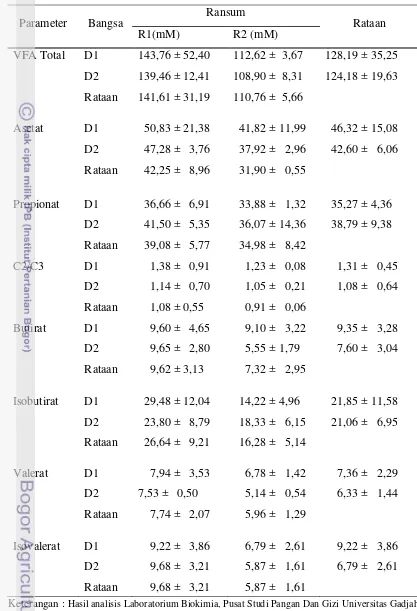
ransum yang digunakan tidak berpengaruh nyata terhadap produksi VFA total, begitu
juga dengan pengaruh bangsa dan interaksi keduanya. Produksi VFA cairan rumen
selama penelitian diperlihatkan pada Tabel 8. Pengaruh yang tidak nyata terhadap
produksi VFA total menunjukkan bahwa reaksi yang ditimbulkan rumen terhadap
pakan Indigofera sp. dan limbah tauge tersebut hampir sama, karena menurut McDonald et al. (2002) volume VFA yang terdapat dalam rumino-retikulum menunjukkan aktivitas mikroba rumen. Bahan makanan yang mudah difermentasi
akan meningkatkan aktivitas mikroba, sehingga volume VFA yang dihasilkan
meningkat.
Produksi VFA total yang dihasilkan berkisar antara 108-143 mM, nilai
tersebut masih berada di atas kisaran konsentrasi VFA yang dihasilkan oleh mikroba
rumen dalam kondisi normal yaitu 80–160 mM (Sutardi, 1980). Jika dilihat VFA total ransum penelitian hampir mendekati optimum. Kondisi ini disebabkan oleh
sumber karbohidrat mudah tercerna yang terdapat dalam ransum penelitian juga
menyumbang kadar energi pakan Indigofera sp. dan limbah tauge. Bahan organik yang mudah terfermentasi dalam ransum penelitian seperti molases dan onggok akan
memenuhi kebutuhan mikroba secara cepat setelah pemberian pakan (Dixon, 1986).
Produksi VFA total dipengaruhi oleh beberapa faktor antara lain, sifat karbohidrat,
laju makanan meninggalkan rumen, frekuensi pemberian makan, dan aktivitas
mikroba dalam mencerna pakan (Sutardi, 1980).
VFA Total terbesar pada penelitian ini dicapai oleh cairan rumen domba
garut yang diberi pakan Indigofera sp.yaitu 143,764 mM. Peningkatan konsentrasi VFA total mencerminkan peningkatan sumber protein dan karbohidrat yang mudah
tercerna (bahan organik) di dalam ransum yang mengandung Indigofera sp. yang dapat difermentasi oleh mikroba rumen. Hal ini sejalan dengan dengan hasil
penelitian yang diperoleh Blummelet al. (1993), yaitu peningkatan karbohidrat mudah terdegradasi meningkatkan bahan kering tercerna. Bahan kering tercerna akan
diubah oleh mikroba rumen menjadi VFA dan protein mikroba dengan meningkatnya
pertumbuhan. Penambahan sumber protein tidak dapat menstimulasi pertumbuhan
mikroba rumen tanpa diimbangi penambahan sumber karbohidrat mudah
28 Tabel 7. Produksi VFA Cairan Rumen dengan Menggunakan Tehnik RUSITEC
Parameter Bangsa
29 Jika dihubungkan dengan komposisi zat makanan (Tabel 4), ransum
Indigofera sp. mengandung kalsium yang lebih tinggi dibandingkan dengan limbah tauge. Kalsium dan fosfor ini sangat dibutuhkan mikroba rumen untuk menjamin
pertumbuhannya. Durand dan Kawashima (1980) mengatakan bahwa untuk
pertumbuhan mikroba rumen dan berlangsungnya proses fermentasi secara baik
dibutuhkan suplai mineral yang cukup, termasuk dalam hal ini kalsium dan fosfor.
Dengan lebih tingginya kandungan kalsium dan fosfor pada ransum Indigofera sp.,
menyebabkan aktivitas mikroba lebih baik, sehingga memungkinkan menghasilkan
VFA yang lebih tinggi. Kandungan NDF yang menggambarkan serat kasar yang
dapat dicerna pada ransum yang mengandung Indigofera sp. lebih tinggi dari pada limbah tauge diduga dapat meningkatkan kandungan substrat serat sehingga mampu
menstimulasi peningkatan bakteri selulolitik.
Kandungan Beta-N pada ransum yang mengandung Indigofera sp. dapat digunakan untuk menstimulasi peningkatan populasi bakteri amilolitik sehingga
mampu meningkatkan degradasi amilosa. Kandungan tanin yang terdapat pada
Indigofera sp. dapat menurunkan populasi protozoa yang berkontribusi terhadap peningkatan bakteri rumen terutama amilolitik. Bakteri amilolitik biasanya
menempel pada granula pati dan ketika protozoa menelan partikel partikel pati maka
bakteri amilolitik ikut tertelan bersama granula pati (Subrata et al., 2005). Efek penurunan protozoa ini mampu mengoptimalkan proses fermentasi yang dapat
meningkatkan produksi VFA total sehingga penyediaan energi untuk ternak
meningkat.
Produksi VFA total ransum yang mengandung limbah tauge lebih rendah
dariIndigofera sp. Hal ini dikarenakan tingginya kandungan serat kasar pada limbah tauge. Serat kasar yang cukup tinggi tersebut kemungkinan banyak mengandung
dinding sel dan liginin sehingga bagian isi sel sedikit sekali yang difermentasi oleh
mikroba rumen dan konsentrasi VFA total menjadi lebih rendah (Selly, 1994).
Konsentrasi VFA cairan rumen domba garut tidak berbeda nyata dengan cairan
rumen domba jonggol. Hal tersebut menunjukkan bahwa mikroba rumen domba
garut dan domba jonggol memiliki kemampuan yang sama dalam memproduksi
30 Hal ini sejalan dengan pernyataan Mendozaet al. (1993) bahwa populasi protozoa yang tinggi akan mendegradasi pati dalam jumlah yang sedikit sehingga akan
menghasilkan VFA yang rendah. Produksi VFA total juga sangat berhubungan
dengan mikroba rumen, khususnya bakteri selulolitik dan amilolitik (Church, 1979).
Asam Asetat
Produksi asam asetat yang dihasilkan dalam penelitian ini secara statistik
tidak dipengaruhi oleh perlakuan ransum dan perlakuan bangsa begitu juga dengan
interaksi keduanya. Produksi asam asetat terbesar yaitu domba garut yang mendapat
pakan Indigofera sp. Hal ini dikarenakan domba garut lebih efisien dalam mencerna serat kasar pakan, dan Indigofera sp. merupakan pakan yang mudah dicerna serat kasarnya. McDonaldet al.(2002) mengatakan bahwa besarnya asam asetat yang dihasilkan dipengaruhi oleh kadar serat kasar ransum yang dikonsumsi ternak.
Kandungan serat kasar ransum Indigofera sp. lebih rendah jika dibandingkan dengan kandungan serat kasar limbah tauge, namun asam asetat yang dihasilkan pada
penelitian ini menunjukkan ransum Indigofera sp. memproduksi asam asetat lebih banyak dari pada limbah tauge. Hal ini disebabkan serat kasar limbah tauge tidak
mudah dicerna oleh ruminansia. Hal tersebut dapat dilihat dari kandungan NDF
(Tabel 4) pakan Indigofera sp. lebih besar dari limbah tauge, sehingga Indigofera sp.
dapat dimanfaatkan dengan baik oleh domba garut.
Asam Propionat
Asam propionat tergolong asam glukogenik, sebab di dalam hati asam
tersebut diubah menjadi glukosa. Secara umum glukosa berguna sebagai sumber
energi utama bagi organ-organ tubuh, antara lain: otak, syaraf, kelenjar susu dan
janin. Menurut Brockman (1993) kurang lebih 50% glukosa pada ternak ruminansia
berasal dari asam propionat. Asam propionat yang dihasilkan dalam penelitian ini
tidak dipegaruhi oleh perlakuan ransum dan jenis bangsa domba. Asam propionat
tertinggi terdapat pada domba jonggol yang diberi ransum berbasis Indigofera sp.
yaitu sebesar 38,087 mM. Semakin tinggi kandungan karbohidrat mudah dicerna
maka kandungan propionat juga akan semakin tinggi. Hal ini didukung oleh pH
31 didalam rumen mudah difermentasi oleh mikroba. Hal ini menunjukkan pakan
Indigofera sp. mudah difermentasi oleh domba jonggol sehingga lebih efisien untuk program penggemukan. Peningkatan propionat sangat penting untuk domba pedaging
karena merupakan sumber energi. Propionat yang terserap dapat menyuplai 30%
(atau lebih) glukosa untuk ruminansia (Parakkasi, 1999).
Imbangan Asetat dan Propionat
Nisbah C2/C3 di dalam rumen dapat memberikan indikasi tentang
pemanfaatan hasil fermentasi tersebut lebih ke arah penggemukan dibandingkan ke
arah pembentukan susu (Arora,1989). Dari hasil penelitian dapat dilihat bahwa
nisbah terkecil terdapat pada domba jonggol. Hal ini mengindikasikan bahwa domba
jonggol lebih cocok digunakan untuk domba penggemukan dibandingkan dengan
domba garut.
Asam Butirat
Produksi asam butirat pada penelitian ini tidak nyata dipengaruhi perlakuan.
Produksi asam butirat tertinggi dihasilkan oleh domba jonggol yang mendapat
ransum Indigofera sp.Produksi asam butirat tertinggi dihasilkan oleh ransum
Indigofera sp. yaitu sebesar 9,629 mM. Menurut McDonald et al.(2002) asam butirat dapat dibentuk didalam rumen dari asam asetat atau dari gabungan yang
membangkitkan aktivitas acetil coenzim A seperti asam piruvat dan glutamat.
Selanjutnya dikatakan bahwa asam lemak rantai panjang dan asam lemak bercabang
oleh sel-sel mikroba rumen akan merangsang pembentukan butirat.
McDonald et al. (2002) pada umumnya perbandingan proporsi molar VFA domba yang mendapat ransum hijauan dibanding konsentrat 70:30 sekitar 65% asetat
(C2),20% propionat (C3), 10% butirat (C4) dan 5% valerat (C5). Proporsi VFA
dalam cairan rumenbervariasi tergantung dari macam ransum dan waktu setelah
makan. Hasil analisis proporsi molar VFA pada penelitian ini adalah 38,2% asetat,
35,7% propionat, 19,1% butirat dan 7% valerat. Ransum yang mengandung proporsi
konsentrat lebih banyak dari hijauan akan rnenghasilkan perbandingan 45% asetat,
40% propionat, 5-10% butirat dan 2-8% valerat. Apabila konsentrat dalamransum
meningkat, maka proporsi asetat menurun dan asam propionat meningkat(Ranjhan,