REKAYASA PROSES EKSTRAKSI KULIT BUAH
LANGSAT (Lansium domesticum var. langsat) SEBAGAI
BAHAN ANTIBAKTERI DAN ANTIOKSIDAN
VITA NOVALINA LAWALATA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENGAI DISERTASI DAN
SUMBER INFORMASI
Saya menyatakan dengan sebenar-benarnya bahwa segala pernyataan dalam disertasi saya yang berjudul : “Rekayasa proses ekstraksi kulit buah langsat (lansium domesticum var.langsat) sebagai bahan antibakteri dan antioksidan” merupakan karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau di kutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir disertasi ini.
Bogor, Juli 2012
Vita Novalina Lawalata
ABSTRACT
Vita Novalina Lawalata. Process Engineering of Langsat Fruit Peel (Lansium domesticum var. langsat) Extraction as Antibacterial and Antioxidant. Under direction of TUN TEDJA IRAWADI, KHASWAR SYAMSU, and IRMA HERAWATI SUPARTO.
Langsat, a fruit plant in the family of Meliaceae, has long been used in traditional medicine to treat fever, diarrhea, malaria, and tumor. This study aims to obtain the optimum extraction condition and method of langsat fruit peel with the best antibacterial and antioxidant activities. The methods used to determine activities were agar diffusion method, dillution method for MIC (minimum inhibitory concentration) and MBC (minimum bactericidal concentration) for antibacterial and DPPH (1,1-diphenyl-1-picrilhydrazyl) for antioxidant activity. Solvents used in the maceration extraction were hexane (non polar), ethyl acetate (semi-polar) and ethanol (polar). Solvent that gave the best antibacterial and antioxidant activity was further used for the microwave extraction. Conventional extraction methods namely reflux and maceration were then compared to microwave extraction. The microwave power and extraction time was determined based on the highest total phenol extract of langsat fruit peel. The best extraction method was used to optimize the extraction process with response surface method to determine the optimal conditions for the extraction of langsat fruit peel.
The results showed that ethanol extracts have the highest antibacterial and antioxidant activity compared to other extracts. The MIC and MBC values of ethanol extracts were 62.5 and 125 ppm for bacteria S. aureus, while the bacteria
E. coli with value of 500 and 1000 ppm, respectively. The antioxidant activity of ethanol extract DPPH method has IC50 value of 77.60 ppm. Microwave with
power of 400 watt for 3 minutes, produced the highest total phenol extract. Extraction with microwave produced phenol with a total of 13.92% and 22.64%, higher than extraction with reflux and maceration. The optimum extraction of langsat fruit peel was obtained at the microwave power of 336.56 watts and for extraction time of 3.24 minutes, which resulted in a total phenolic extract of the langsat fruit peel 44.07 mg TAE/g. The validation results experimentally showed the value of total phenols 0.66% smaller than predicted. Validation results showed an increase in antibacterial and antioxidant activity than before the optimization, the MIC and MBC values for S. aureus were 31.25 and 62.5 ppm, whereas E. coli
with value of 125 and 250 ppm. The antioxidant activity of the validation result has IC50 value of 47.44 ppm.
RINGKASAN
Vita Novalina Lawalata. Rekayasa Proses Ekstraksi Kulit Buah Langsat (Lansium domesticum var. langsat) Sebagai Bahan Antibakteri dan Antioksidan. Dibimbing oleh TUN TEDJA IRAWADI, KHASWAR SYAMSU, dan IRMA HERAWATI SUPARTO.
Tanaman langsat merupakan tanaman buah-buahan yang banyak terdapat di wilayah Kalimantan, Maluku, dan Sulawesi, dan telah lama digunakan dalam pengobatan tradisional sebagai obat diare, malaria, demam, dan tumor. Kulit buah langsat merupakan limbah dari tanaman langsat yang dapat digunakan sebagai penghasil senyawa bioaktif. Untuk meningkatkan nilai tambah pemanfaatan kulit buah langsat, maka dilakukanlah penelitian dengan judul Rekayasa Proses Ekstraksi Kulit Buah Langsat (Lansium domesticum var. langsat) Sebagai Bahan Antibakteri dan Antioksidan.
Untuk memperoleh senyawa aktif yang terdapat dalam kulit buah langsat dilakukan ekstrak kulit buah langsat secara maserasi dengan 3 jenis pelarut yang berbeda kepolarannya, yaitu pelarut non polar heksana, pelarut semi polar etil asetat, dan pelarut polar etanol. Hasil identifikasi fitokimia secara kualitatif menunjukkan kulit buah langsat mengandung senyawa flavonoid, saponin, steroid, tanin, dan triterpenoid. Semua ekstrak kulit buah langsat berpotensi digunakan sebagai bahan fitofarmaka karena memiliki nilai LC50 (lethal
concentration 50%) dibawah 1000 ppm, yaitu 400.60-754.13 ppm.
Ketiga jenis ekstrak mempunyai pengaruh antibakteri yang berbeda terhadap bakteri uji. Semakin besar konsentrasi ekstrak daya hambat bakterinya juga semakin besar. Daya penghambatan ekstrak etanol lebih besar dibandingkan ekstrak etil asetat dan heksana, yaitu 3.44-10.22 mm untuk bakteri Staphylococcus aureus dan 1.11-7.83 mm untuk bakteri Escherichia coli. Diameter hambat ekstrak etanol masih lebih kecil 2-6 kali dibandingkan dengan antibiotik kloramfenikol. Efektifitas antibakteri uji dinyatakan dalam konsentrasi hambat minimum (KHM) dan konsentrasi bunuh minimum (KBM). S. aureus merupakan bakteri yang lebih sensitif terhadap ekstrak etanol kulit buah langsat dengan nilai KHM 62.5 ppm dan KBM 125 ppm. E. coli merupakan bakteri yang lebih resisten dengan nilai KHM 500 ppm dan KBM 1000 ppm.
Aktivitas antioksidan diukur dengan metode peredaman radikal bebas DPPH (1,1-difenil-1-pikrilhidrazil) yang dinyatakan dengan nilai IC50 (inhibition
concentration 50%). Ekstrak etanol memiliki aktivitas antioksidan yang lebih baik dengan nilai IC50 77.60 ppm dibandingkan ekstrak etil asetat IC50 189.26
ppm dan ekstrak heksana IC50 2298.06 ppm. Nilai IC50 ekstrak etanol masih lebih
kecil 20 kali dibandingkan senyawa antioksidan sintetik BHT (butil hidroksi toluen).
TAE/g. Metode ekstraksi dengan gelombang mikro dibandingkan dengan metode konvensional yaitu refluks dan maserasi. Hasil penelitian menunjukkan bahwa metode ekstraksi dengan gelombang mikro menghasilkan total fenol yang lebih tinggi yaitu 45.92 mg TAE/g dibandingkan metode ekstraksi refluks 40.33 mg TAE/g dan maserasi 37.44 mg TAE/g. Perbandingan metode ekstraksi gelombang mikro dengan metode refluks yang sama-sama menggunakan prinsip pemanasan pada penelitian ini, terlihat bahwa ekstraksi dengan gelombang mikro menghasilkan total fenol 13.86% lebih tinggi dibandingkan metode refluks.
Penentuan kondisi optimum proses ekstraksi kulit buah langsat dengan metode permukaan respon (RSM) menggunakan historical data ekstraksi dengan gelombang mikro. Hasil analisis ragam pada proses optimasi menggunakan RSM menunjukkan bahwa model kuadratik bersifat nyata dan layak untuk digunakan. Kondisi optimum ekstraksi kulit buah langsat diperoleh pada daya gelombang mikro 336.56 watt dan waktu ekstraksi 3.24 menit menghasilkan total fenol 44.04 mg TAE/g. Hasil validasi secara eksperimen menunjukkan bahwa model dapat digunakan untuk memprediksi rendemen total fenol ekstrak, dengan nilai total fenol hasil validasi lebih kecil 0,66% dibandingkan prediksinya. Hasil validasi menunjukkan peningkatan aktivitas antibakteri dan antioksidan dibandingkan sebelum optimasi yaitu nilai KHM dan KBM untuk S. aureus 31.25 dan 62.5 ppm, sedangkan E. coli 125 dan 250 ppm. Aktivitas antioksidan hasil validasi memiliki nilai IC50 47.44 ppm lebih kecil 38.86% dibandingkan nilai IC50 77.60
ppm sebelum optimasi pada metode ekstraksi maserasi. Nilai IC50 yang lebih kecil
@ Hak Cipta milik IPB, Tahun 2012
Hak Cipta dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber.
a. Pengutipan nama untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjuan suatu masalah;
b. Pengutipan tidak merugikan kepentingan yang wajar IPB.
REKAYASA PROSES EKSTRAKSI KULIT BUAH
LANGSAT (Lansium domesticum var. langsat) SEBAGAI
BAHAN ANTIBAKTERI DAN ANTIOKSIDAN
VITA NOVALINA LAWALATA
Disertasi
Sebagai salah satu syarat untuk memperoleh gelar Doktor Pada
Program Studi Teknologi Industri Pertanian
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji pada Ujian Tertutup : 1. Prof. Dr. Dra. Purwatiningsih Sugita, MS 2. Dr. Ir. Liesbetini Hartoto, MS
Judul Disertasi : Rekayasa Proses Ekstraksi Kulit Buah Langsat (Lansium domesticum var. langsat) Sebagai Bahan Antibakteri dan Antioksidan
Nama : Vita Novalina Lawalata
NRP : F 361070071
Menyetujui
Komisi Pembimbing
Prof. Dr. Ir. Tun Tedja Irawadi, MS Ketua
Prof. Dr. Ir. Khaswar Syamsu, MSc Dr. dr. Irma Herawati Suparto, MS Anggota Anggota
Mengetahui
Ketua Program Studi Dekan Sekolah Pascasarjana IPB Teknologi Industri Pertanian
Dr. Ir. Machfud, MS Dr. Ir. Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur kehadirat Allah Yang Maha Kuasa, karena hanya dengan
anugerah dan rahmat-Nya maka disertasi ini dapat diselesaikan. Disertasi ini
disusun dalam rangka memenuhi salah satu syarat dalam menyelesaikan studi
Doktor pada Program Studi Teknologi Industri Pertanian, Institut Pertanian
Bogor.
Bantuan berbagai pihak banyak penulis terima selama proses penyelesaian
disertasi ini, karena itu pada kesempatan ini penulis menyampaikan rasa hormat
dan ucapan terima kasih yang tulus serta penghargaan yang setinggi-tingginya
kepada :
1. Prof. Dr. Ir. Tun Tedja Irawadi, MS, selaku ketua komisi pembimbing, Prof.
Dr. Khaswar Syamsu, MSc, dan Dr. dr. Irma Herawati, MS, masing-masing selaku anggota komisi pembimbing yang telah meluangkan waktu, pikiran
serta keikhlasannya dalam membimbing dan memberikan arahan, masukan
serta dorongan sehingga disertasi ini dapat diselesaikan.
2. Bapak Dr. Ir. Machfud, MS., Bapak Prof. Dr. Ir. Irawadi Djamaran, Bapak Dr.
Eng. Taufik Djatna, S.TP, M.Si, Ibu Dr. Titi Candra Sunarti, S.TP, M.Si, dan
Ibu. Prof. Dr. Ir. Ani Suryani, DEA, selaku Ketua dan Sekretaris Program
Studi Teknologi Industri Pertanian, SPs-IPB yang telah membantu selama
penulis menempuh pendidikan di Program Studi Teknologi Industri Pertanian.
3. Rektor IPB, Dekan dan Sekretaris Sekolah Pascasarjana IPB, Dekan dan
Wakil Dekan FATETA IPB atas kesempatan dan fasilitas selama penulis
melaksanakan studi.
4. Penguji luar komisi ujian tertutup Prof. Dr. Dra. Purwatiningsih Sugita, MS,
Dr. Ir. Liesbetini H, MS, atas masukan dan koreksinya. Prof. Dr. Wahono
Sumaryono, dan Prof.(Emeritus) Dr. Ir. M. Anwar Nur, MSc atas kesediaan
menjadi penguji luar komisi ujian terbuka.
5. Rektor Universitas Pattimura dan Dekan Fakultas Pertanian Universitas
Pattimura Ambon atas ijin dan kesempatan yang diberikan kepada penulis
untuk melanjutkan jenjang pendidikan S3.
6. Kepala Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian
yang diberikan selama penelitian.
7. Papa D. Lawalata dan Mama J Lawalata/P, Papa mertua A. Taihutu dan mama
S. Taihutu/N, kakakku An dan keluarga, Ety dan keluarga, serta Non (Alm)
dengan rasa hormat penulis persembahkan ucapan terima kasih yang tulus atas
segala doa dan pengorbanan yang tiada tara, baik materil maupun moril untuk
penyelesaian studi penulis.
8. Suami tercinta Jafri Taihutu, SH, anakku Grahacristo Aldo Miquel yang selalu
sabar dan memberikan dukungan serta motivasi, baik dalam suka maupun
duka. Terima kasih atas pengorbanan yang telah diberikan selama ini.
9. Seluruh rekan kuliah di Program Studi Teknologi Industri Pertanian,
khususnya rekan-rekan TIP 2007 atas dukungan, kebersamaan dan semangat
saling menguatkan untuk menyelesaikan pendidikan ini.
10.Semua pihak yang telah membantu dan memberikan masukan dalam
penelitian hingga tersusunnya disertasi ini.
Semoga hasil penelitian ini dapat bermanfaat bagi pembangunan
agroindustri di Indonesia dan khususnya di Maluku, serta pengembangan ilmu pengetahuan dan masyarakat luas.
Bogor, Juli 2012
RIWAYAT HIDUP
Penulis dilahirkan di Ambon tanggal 20 November 1972 sebagai anak ke-4 dari ke-4 bersaudara dari pasangan bapak D. Lawalata dan ibu J. Lawalata/P. Penulis menikah pada tahun 2006 dengan Jafri Taihutu, SH dan dikaruniai seorang anak yang bernama Grahacristo Aldo Miquel.
Sekolah dasar, sekolah menengah pertama, sekolah menengah atas, dan pendidikan sarjana ditamatkan di Ambon. Pada tahun 2001, penulis melanjutkan studi S2 di Program Studi Pascapanen Program Pascasarjana IPB dengan biaya BPPS Dikti dan menamatkannya pada tahun 2004. Kesempatan untuk melanjutkan studi S3 pada Program Studi Teknologi Industri Pertanian IPB diperoleh pada tahun 2007 juga dengan biaya BPPS Dikti.
Penulis bekerja sebagai staff pengajar pada Fakultas Pertanian Universitas Pattimura (UNPATTI) Ambon.
Artikel imiah berjudul “Identifikasi Fitokimia dan Aktivitas Antibakteri Ekstrak Kulit Buah Langsat (Lansium domesticum var. langsat)” akan diterbitkan pada Jurnal Ilmiah Gema Agro , ISSN: 1410-08431, Tahun XII No. 31 Agustus 2012. Artikel lain berjudul “Uji Toksisitas Ekstrak Kulit Buah Langsat (Lansium domesticum var. langsat)” akan diterbitkan pada Jurnal Ilmiah Agroforestri ISSN 1907-7556, Volume 4 Nomor 3 September 2012.
DAFTAR ISI
Halaman
HALAMAN JUDUL ... i
HALAMAN PENGESAHAN ... ii
DAFTAR ISI ... iii
DAFTAR TABEL ... iv
DAFTAR GAMBAR ... v
PENDAHULUAN Latar Belakang ... 1
Perumusan Masalah ... .. 3
Tujuan Penelitian ... 4
Hipotesis ... ... 4
Ruang Lingkup Penelitian ... 4
TINJAUAN PUSTAKA Tanaman Langsat ... 7
Senyawa Antibakteri dari Tanaman ... 10
Senyawa Antioksidan dari Tanaman ... 12
Ekstraksi Konvensional... . 15
Ekstraksi Berbantu Gelombang Mikro ... 16
Metode Permukaan Respon (Respon Surface Method) ... 20
METODE PENELITIAN Waktu dan Tempat ... 23
Bahan dan Alat ... 23
Tahapan Penelitian ... 23
Preparasi sampel... 25
Ekstraksi kulit buah langsat ... 26
Penentuan kandungan fitokimia... .... 26
Uji toksisitas metode BSLT ... .. 28
Pengujian aktivitas antibakteri ... ... 28
Pengujian aktivitas antioksidan ... ... 29
Uji kandungan total fenol ... .. 29
Optimasi proses ekstraksi kulit buah langsat... ... 30
IDENTIFIKASI FITOKIMIA DAN EVALUASI TOKSISITAS EKSTRAK KULIT BUAH LANGSAT Abstrak... .. 33
Pendahuluan... .. 33
Bahan dan Metode ... . 34
Hasil dan Pembahasan ... . 35
Evaluasi taksonomi dan analisis proksimat... 35
Ekstraksi dan identifikasi fitokimia... 36
Aktivitas toksisitas metode BSLT... . 38
BUAH LANGSAT
Abstrak... .. 41
Pendahuluan... .. 41
Bahan dan Metode ... 42
Hasil dan Pembahasan ... 43
Aktivitas antibakteri ekstrak kulit buah langsat... 43
Aktivitas antioksidan ekstrak kulit buah langsat... 47
Simpulan... . 50
OPTIMASI PROSES EKSTRAKSI KULIT BUAH LANGSAT DENGAN BANTUAN GELOMBANG MIKRO Abstrak... .. 53
Pendahuluan... .. 53
Bahan dan Metode ... 56
Hasil dan Pembahasan ... 57
Ekstraksi kulit buah langsat dengan gelombang mikro... 57
Perbandingan metode ekstraksi... 59
Optimasi proses ekstraksi kulit buah langsat dengan gelombang mikro... ... 61
Validasi model ... 64
Simpulan... . 65
PEMBAHASAN UMUM... . 67
SIMPULAN dan SARAN... 73
DAFTAR PUSTAKA ... ... 75
DAFTAR TABEL
Halaman
1 Nilai konstanta elektrik beberapa pelarut ... 18
2 Rangkuman hasil penelitian ekstrak kulit buah dengan gelombang mikro ... 19
3 Faktor dan level faktor yang dikaji pada proses ekstraksi kulit buah langsat dengan bantuan gelombang mikro... 30
4 Kandungan proksimat kulit buah langsat ... 35
5 Rendemen dan hasil uji fitokimia kulit buah langsat ... 37
6. Nilai LC50 uji toksisitas metode BSLT ekstrak kulit buah langsat ... 39
DAFTAR GAMBAR
Halaman
1 Buah langsat ... 8
2 Struktur kimia senyawa alkaloid... 10
3 Struktur kimia senyawa fenol... ... 11
4 Struktur kimia senyawa isopren... ... 12
5 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan ... 15
6 Spektrum elektromagnetik ... 16
7 Diagram alir pelaksanaan penelitian ... 24
8 Aktivitas dan ruang lingkup penelitian ... 25
9 Diameter hambat ekstrak kulit buah langsat terhadap bakteri S. aureus dan E. coli ... 43
10 Nilai IC50 masing-masing ekstrak dengan kontrol BHT ... 48
11 Struktur flavonoid dengan aktivitas antiradikal ... 50
12 Pengaruh daya gelombang mikro dan waktu ekstraksi terhadap total fenol ekstrak kulit buah langsat ... 57
13 Perbandingan metode ekstraksi terhadap kandungan total fenol ekstrak kulit buah langsat ... 60
14 Plot residual uji kenormalan respon total fenol ekstrak kulit buah langsat terhadap daya gelombang mikro dan waktu ekstraksi ... 63
DAFTAR LAMPIRAN
Halaman
1 Hasil identifikasi/determinasi tumbuhan ... 85
2 Prosedur analisis proksimat kulit buah langsat ndrah ... 86
3 Data pengamatan uji toksisitas (larva yang mati) dan penentuan nilai LC50 dengan analisis probit... 89
4 Data pengukuran diameter hambat (mm) bakteri ... 92
5 Nilai absorbansi ekstrak kulit buah langsat dan BHT... 92
6 Persen inhibisi ekstrak kulit buah langsat dan HBT ... 92
7 Kurva IC50 BHT dan ekstrak kulit buah langsat ... 93
8 Data nilai absorbansi untuk pengukuran total fenol ... 94
9 Analisis keragaman dan uji Duncan pengaruh daya gelombang mikro dan waktu ekstraksi terhadap total fenol ekstrak kulit buah langsat... 95
10 Nilai absorbansi metode maserasi dan refluks ... 95
11 Uraian jumlah kuadrat dari urutan model untuk respon total fenol ekstrak kulit buah langsat ... 96
12 Hasil analisis ringkasan beberapa model yang dicobakan untuk respon total fenol ekstrak kulit buah langsat... 96
13 Analisis keragaman (ANOVA) terhadap model kuadratik respon permukaan Untuk total fenol ekstrak kulit buah langsat... 96
14 Keluaran variabel hasil optimasi menggunakan Design Expert 7 ... 97
15 Data Pengamatan total fenol pada validasi model optimasi ... 97
16 Nilai konsentrasi hambat minimum (KHM) dan konsentrasi bunuh minimum (KBM) hasil validasi ekstrak kulit buah langsat ... 97
PENDAHULUAN
Latar Belakang
Tanaman merupakan salah satu sumber berbagai senyawa metabolit
sekunder yang telah banyak dimanfaatkan bagi kehidupan manusia. Metabolit
sekunder pada tanaman mengandung senyawa aktif dengan aktivitas biologis
tertentu yang dapat dimanfaatkan sebagai bahan obat, kosmetik maupun flavour.
Penemuan suatu senyawa aktif dari tanaman yang bermanfaat untuk kehidupan
merupakan daya penggerak untuk meningkatkan nilai ekonomi suatu komoditas
pertanian, yang berpeluang menjadi produk utama dari suatu komoditas.
Perkembangan penelitian tumbuhan berkaitan dengan aktivitas biologis
seperti aktivitas antibakteri dan antioksidan menjadi perhatian yang menarik dalam upaya penggalian senyawa baru potensial yang bermanfaat bagi kesehatan
manusia dan juga bermanfaat di bidang industri pangan. Dalam kaitannya dengan
manfaat di bidang kesehatan, sifat antibakteri suatu senyawa dapat menghambat
atau membunuh bakteri patogen, sedangkan antioksidan dapat menghambat atau
menunda terjadinya reaksi radikal bebas, sehingga sifat tersebut menjadi penting
dalam pencegahan berbagai penyakit dan dapat juga digunakan sebagai pengawet
produk pangan.
Beberapa jenis tumbuhan, khususnya dari famili Meliaceae telah diketahui
pemanfaatannya sebagai bahan antibakteri maupun antioksidan seperti
Azadirachta indica, Cuseuta reflexa, Dysoxylum cauliflorum Hiern, Melia
azedarach, Naregamia alata, Swietenia mahagoni dan Walsura robusta Roxb
(Nahak and Sahu 2010; Mukesh et al. 2011; Ting et al. 2011; Voravuthikunchai et
al. 2010 ). Salah satu tumbuhan dari famili Meliaceae yang juga diduga memiliki
aktivitas antibakteri dan antioksidan adalah langsat (Lansium domesticum ).
Tanaman langsat merupakan tanaman buah-buahan yang banyak terdapat di
wilayah Kalimantan, Maluku, dan Sulawesi, dan telah lama digunakan dalam
pengobatan tradisional. Buah langsat bermanfaat untuk kelancaran sistem
pencernaan, pencegahan kanker kolon, serta mengurangi dampak dari kanker kolon akibat radikal bebas. Selain daging buah, bagian kulit buah, biji, daun, dan
penyembuh bekas gigitan serangga berbisa, dan tumor (Heyne 1987; Mokosuli
2008; Verheij dan Coronel 1992). Berdasarkan hasil empiris, penggunaan
tanaman langsat diduga dapat menyembuhkan penyakit-penyakit yang disebabkan
oleh mikroorganisme dan radikal bebas, sehingga diperkirakan tanaman ini
mengandung senyawa aktif antibakteri dan antioksidan.
Belum banyak laporan ilmiah pemanfaatan tanaman langsat sebagai bahan
antibakteri maupun antioksidan, hanya terdapat tiga publikasi ilmiah. Ekstrak
kulit buah, biji dan kulit batang langsat sebagai bahan antibakteri (Korompis et al.
2010). Ekstrak kulit batang langsat sebagai bahan antioksidan dan anti kanker
(Mokosuli 2008). Ekstrak buah langsat sebagai bahan kosmetik inhibitor enzim
tirosinase (Tilaar et al. 2008). Metabolit sekunder yang dikandung dalam kulit
batang langsat adalah alkaloid, flavonoid, saponin, steroid, tanin, dan triterpenoid
(Mokosuli 2008). Akan tetapi belum ada informasi mengenai aktivitas antioksidan
dan optimasi proses ekstraksi kulit buah langsat.
Optimasi proses diperlukan untuk mendapatkan kondisi proses ekstraksi
optimal yang menghasilkan rendemen ekstrak dan total senyawa aktif yang tinggi
dengan aktivitas antibakteri dan antioksidan terbaik. Optimasi proses dilakukan
dengan metode statistik, yaitu metode permukaan respon (response surface
method- RSM). Penggunaan RSM untuk optimasi proses ekstraksi dilaporkan oleh
beberapa peneliti diantaranya, optimasi ekstraksi antioksidan dari kulit kacang
(Ballard et al. 2009), optimasi ekstraksi komponen fenolik buah apel (Mustafa
and Kjersti 2010), optimasi ekstraksi komponen fenolik daun Azadirachta indica
(Hismath et al. 2010), dan optimasi ekstraksi senyawa flavonoid dari daun
Gynura medica (Liu et al. 2010).
Metode ekstraksi komponen aktif dari tanaman umumnya menggunakan
ekstraksi dengan pelarut secara maserasi, perkolasi, soxhlet, dan reflux. Pelarut
yang digunakan untuk ekstraksi harus dapat melarutkan zat yang diinginkan.
Kemampuan pelarut untuk mengekstrak sangat ditentukan oleh kesesuaian tingkat
kepolaran bahan yang akan diekstrak dengan pelarut. Untuk memperoleh
komponen aktif dari tanaman yang belum diketahui sepenuhnya, maka
digunakanlah pelarut yang berbeda tingkat kepolarannya, yaitu pelarut polar, semi
3
Teknik ekstraksi konvensional seperti maserasi, perkolasi, soxhlet, dan
reflux membutuhkan waktu, penanganan, dan biaya bahan pelarut yang tinggi.
Metode ekstraksi lain yang berkembang dewasa ini adalah ekstraksi dengan
bantuan gelombang mikro. Metode ekstraksi dengan bantuan gelombang mikro
merupakan salah satu alternatif untuk menggantikan proses ekstraksi
konvensional (maserasi, perkolasi, soxhlet, dan reflux ) karena lebih efisien, yaitu
waktu ekstraksi lebih singkat, penggunaan pelarut lebih sedikit, selektivitas tinggi
terhadap molekul target dan kualitas produk lebih baik (Krishnaswamy et al.
2012; Rafiee et al. 2011; Jyothi et al. 2010; Thomas et al. 201; Jain et al. 2009).
Berdasarkan studi pustaka dan hasil-hasil penelitian diatas, maka sangatlah
penting untuk melakukan kajian lebih lanjut tentang rekayasa proses ekstraksi
kulit buah langsat sebagai bahan antibakteri dan antioksidan. Pada penelitian ini,
ekstraksi kulit buah langsat dilakukan secara maserasi menggunakan tiga jenis
pelarut yang berbeda tingkat kepolarannya. Tiga jenis ekstrak yang dihasilkan diuji aktivitas antibakteri dan antioksidan. Ekstrak yang memiliki aktivitas terbaik
dioptimasi proses ekstraksinya dengan metode ekstraksi menggunakan bantuan
gelombang mikro.
Perumusan Masalah
Senyawa antibakteri dan antioksidan yang banyak beredar merupakan
senyawa sintetik yang mempunyai efek samping dalam penggunaannya.
Berdasarkan pertimbangan kesehatan dan kecenderungan pola hidup kembali ke
alam memicu pencarian sumber-sumber senyawa antibakteri dan antioksidan
alami, salah satunya dengan menggunakan tanaman obat, yaitu langsat. Penelitian
tanaman langsat, khususnya kulit buah langsat hanya sampai tahapan antibakteri.
belum dilakukan penentuan nilai konsentrasi hambat minimum, konsentrasi bunuh
minimum, dan aktivitas antioksidan serta optimasi proses ekstraksi untuk
mendapatkan hasil ekstrak yang maksimal.
Sampai saat ini tumbuhan langsat hanya diambil buahnya, sedangkan kulit
buahnya menjadi limbah. Untuk meningkatkan nilai tambah pemanfaatan kulit
buah langsat sebagai penghasil senyawa bioaktif, maka diperlukan penelitian
dan antioksidan. Pemanfaatan kulit buah langsat dalam penelitian ini diharapkan
dapat dijadikan alternatif sumber alami sebagai senyawa antibakteri dan
antioksidan baru. Selain itu dapat dijadikan produk bahan baku industri farmasi
dan pangan, sehingga mempunyai nilai tambah dalam pengembangan agroindustri
di daerah asalnya.
Tujuan Penelitian
Tujuan yang ingin dicapai dalam penelitian ini adalah :
1. Mendapatkan jenis pelarut untuk ekstraksi kulit buah langsat dengan aktivitas
antibakteri dan antioksidan terbaik;
2. Mendapatkan kondisi proses ekstraksi yang optimum untuk ekstraksi kulit
buah langsat dengan bantuan gelombang mikro.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah :
1. Jenis pelarut yang digunakan untuk ekstraksi kulit buah langsat diduga
berpengaruh terhadap aktivitas antibakteri dan antioksidan;
2. Proses ekstraksi kulit buah langsat diduga optimal pada daya gelombang
mikro dan waktu ekstraksi tertentu.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah :
1. Ekstraksi kulit buah langsat secara maserasi dengan pelarut heksana, etil
asetat dan etanol;
2. Identifikasi komponen fitokimia ekstrak kulit buah langsat dan evaluasi
aktivitas toksisitasnya;
3. Evaluasi aktivitas antibakteri dan antioksidan ekstrak kulit buah langsat;
4. Penentuan nilai konsentrasi hambat minimum (KHM) dan konsentrasi bunuh
minimum (KBM) ekstrak kulit buah langsat yang memiliki diameter hambat
5
5. Ekstraksi kulit buah langsat dengan metode gelombang mikro pada pelarut
terpilih, dengan menggunakan berbagai daya gelombang mikro dan waktu
ekstraksi;
6. Perbandingan metode ekstraksi kulit buah langsat;
7. Optimasi kondisi proses ekstraksi kulit buah langsat dengan bantuan
TINJAUAN PUSTAKA
Tanaman Langsat
Tanaman langsat (Lansium domesticum) termasuk dalam famili Meliaceae
dan penyebaran tumbuhan ini berasal dari Peninsula, Thailand sampai Borneo
dalam jumlah besar. Pada jumlah kecil, L. domesticum Corr. ditanam di Vietnam,
Myanmar, India, Srilanka, Hawaii, Australia, Suriname, dan Puerto Rico.
Tumbuhan ini tumbuh subur di daerah tropis dengan ketinggian 800 m diatas
permukaan laut, tanah dengan drainase yang baik dan pH tanah sedikit asam
sampai netral sekitar 5.5-6.6, curah hujan yang cukup sekitar 2000-3000 mm per
tahun dan suhu 25-35 oC.
Langsat merupakan tanaman buah musiman yang cukup dikenal di Indonesia. Langsat termasuk dalam spesies L. domesticum. Spesies ini terdiri dari
beberapa varietas yang sangat bervariasi dalam sifat-sifat pohon dan buahnya,
sehingga ada para ahli yang memisahkannya kedalam kelompok yang berlainan.
Pada garis besarnya, ada dua kelompok besar buah ini, yakni yang dikenal dengan
duku dan yang dinamakan langsat. Kemudian ada kelompok campuran
duku-langsat, serta kelompok terakhir yang di Indonesia dikenal sebagai kokosan
(Muhamad 2010). Kelompok duku dicirikan dengan butiran buahnya agak besar,
cenderung bulat, berkulit agak tebal namun cenderung tidak bergetah bila masak.
Kelompok langsat dicirikan dengan bentuk buah yang berbentuk bulat telur,
berkulit tipis dan bergetah (putih) sekalipun telah masak (Ashari 2006).
Manfaat utama tanaman langsat, yaitu dimakan dalam keadaan segar atau
diolah menjadi makanan olahan lainnya, seperti kismis, selai, dan pure. Bagian
tanaman lainnya yang bermanfaat dan digunakan secara tradisional adalah biji
yang pahit rasanya, ditumbuk dan dicampur air untuk obat cacing, obat demam,
dan juga obat malaria. Kulit kayunya dimanfaatkan sebagai obat disentri dan
malaria, sementara tepung kulit kayu ini dijadikan tapal untuk mengobati gigitan
kalajengking. Kulit buahnya juga digunakan sebagai obat diare, dan kulit buah
yang dikeringkan biasanya dibakar sebagai pengusir nyamuk.
Buah langsat mengandung daging buah sebanyak 68%, sisanya berupa kulit
8
terasa manis. Setiap 100 g buah langsat mengandung 56 kalori, 0.9 g protein, 0.20
g lemak, 14.30 g karbohidrat, 17 mg kalsium, 24 mg fosfor, 1.10 mg zat besi, 0.07
mg vitamin B1, 3 mg vitamin C, dan 84.10 g air (Depkes 1992).
Gambar 1 Buah langsat
Penelitian aktivitas biologis dan kandungan fitokimia tanaman langsat
masih belum banyak dilakukan dan dipublikasikan, hanya terdapat empat
publikasi, diantaranya : ekstrak etanol 95% biji langsat digunakan sebagai
insektisida larva Lepidoptera (Leatemia dan Muray 2004). Ekstrak etanol kulit
buah langsat mempunyai aktivitas antibakteri terhadap bakteri Escherichia coli,
Salmonella typhi, Vibrio cholerae, dan Staphylococcus aureus dengan diameter
hambat masing –masing sebesar 9.0, 11.0, 8.7, dan 11.0 mm (Korompis et al.
2010). Ekstrak etanol 75% kulit batang langsat basah dan kering mengandung
senyawa fitokimia golongan alkaloid, flavonoid, saponin, tanin, triterpenoid dan
steroid. Ekstrak ini memiliki aktivitas antioksidan, dengan metode
1,1-difenil-2-pikrilhidrazil (DPPH) dengan nilai IC50 sebesar 205.38 dan 174.19 ppm, dengan
metode asam tiobarbiturat (TBA) dengan daya hambat sebesar 85.22% dan
82.83% pada konsentrasi 200 ppm, aktivitas antikanker pada sel murine leukimia
P388 dengan nilai IC50 15.48 dan 12 ppm (Mokosuli 2008). Ekstrak hidroetanol
buah langsat dengan dosis 2-5% digunakan sebagai bahan kosmetik (Tilaar et al.
2008).
Beberapa varietas dari spesies L. domesticum, yaitu duku dan kokosan yang
telah diteliti bioaktivitasnya adalah kulit kayu tanaman duku digunakan untuk
digunakan sebagai penghambat pertumbuhan Plasmodium falciparum (Angela et
al. 2003). Ekstrak etanol, fraksi n-heksana, diklorometana, dan etil asetat biji duku
secara maserasi memiliki aktivitas antibakteri terhadap bakteri E. coli, S. typhi,
dan Shigella flexneri. Fraksi diklrometana mempunyai aktivitas paling kuat
dengan nilai konsentrasi hambat minimum (KHM) untuk E. coli 0.3125 mg/ml, S.
flexneri 0.625 mg/ml dan S. typhi 0.625 mg/ml (Loekitowati dan Hermansjah
2000). Ekstrak etanol kulit buah duku secara refluks memiliki aktivitas antibakteri
terhadap bakteri E. coli, S. typhi, dan S. dysenteriae, ekstrak 1 mg kulit buah duku
setara dengan 0.0490 µg tetrasiklin hidroklorida terhadap E. coli, setara dengan
0.0116 µg tetrasiklin hidroklorida terhadap S. typhi, dan setara dengan 0.2170 µg
tetrasiklin hidroklorida terhadap S. dysenteriae (Inayah et al. 2004). Fraksi etil
asetat kulit batang kokosan yang diekstrak secara maserasi dengan metanol
memiliki aktivitas antibakteri terhadap bakteri E. coli pada konsentrasi 1000 ppm
dengan diameter hambat 8 mm (Mayanti et al. 2006).
Senyawa dari kulit buah duku yang berhasil diisolasi, yaitu asam lansat,
merupakan senyawa mayor pada kulit buah (Kiang et al. 1967). Senyawa
minornya, yaitu asam lansiolat merupakan triterpen dari golongan lanosta dan
lansiosida yang merupakan triterpen glikosida (Nishizawa et al. 1983). Senyawa
Onoceroid berhasil diisolasi dari fraksi n-heksana kulit buah kokosan (Kosela et
al. 2001). Senyawa mayor pada daun duku, yaitu asam lansiolat, sedangkan
senyawa minor adalah triterpen sikloartanoid yang memiliki aktivitas antitumor
(Nishizawa et al. 1989). Senyawa mayor pada biji duku, yaitu senyawa
tetranotriterpenoid dan triterpenoid, sedangkan senyawa minornya adalah
mexicanolida yang memiliki aktivitas antimalaria (Nishizawa et al. 1985, 1988,
1989; Saewan et al. 2006). Senyawa onoceroid berhasil diisolasi dari fraksi
n-heksana kulit buah kokosan (Kosela et al. 2001). Senyawa pada kulit batang duku
adalah triterpen onoceranoid yang bersifat antifeedant (Omar et al. 2007).
Senyawa triterpen onoceranoid pada kulit buah dan biji duku memiliki aktivitas
antimikroba terhadap P. aeruginosa, B. subtilis, C. albicans, A. niger, dan T.
mentagrophytes (Ragasa et al. 2006). Senyawa terpenoid dari kulit batang L.
domesticum kultivar kokosan memiliki aktivitas antibakteri terhadap bakteri E.
10
Senyawa Antibakteri dari Tanaman
Senyawa antibakteri adalah senyawa kimia atau biologi yang dapat
menghambat pertumbuhan dan aktivitas bakteri. Beberapa bagian tanaman
mengandung senyawa yang dapat bersifat sebagai antibakteri. Senyawa tersebut
diproduksi secara biologis oleh tanaman, dan dapat menghambat pertumbuhan
dan aktivitas bakteri. Senyawa tersebut dapat berasal dari bagian tanaman seperti
seperti daun, bunga, buah, biji, akar, rimpang, kulit buah atau kulit batang.
Senyawa antibakteri yang berasal dari tanaman sebagian besar diketahui
merupakan metabolit sekunder tanaman, terutama dari golongan alkaloid, fenolik
dan terpenoid (Cowan 1999).
Alkaloid secara umum merupakan senyawa bersifat basa yang mengandung
satu atau lebih atom nitrogen dan banyak sekali ragamnya termasuk struktur
kimianya. Hampir semua alkaloid yang ditemukan di alam mempunyai keaktifan
biologis tertentu, ada yang sangat beracun tetapi adapula yang sangat berguna dalam pengobatan. Misalnya kuinin, morfin, dan stignin adalah alkaloid yang
terkenal dan mempunyai efek fisiologis dan psikologis. Alkaloid dapat ditemukan
dalam berbagai bagian tumbuhan seperti biji, daun, ranting dan kulit batang.
Gambar 2 Struktur kimia senyawa alkaloid (Robinson 1995)
Sebagian besar alkaloid dibentuk dari asam-asam amino seperti lisin,
fenilalanin, tirosin dan triptofan, serta kerangka-kerangka asam amino tersebut
sebagian besar masih tetap dalam struktur senyawa-senyawa alkaloid dan
turunannya. Banyak jenis alkaloid yang bersifat terpenoid atau sebagai terpenoid
termodifikasi, beberapa jenis lainnya berupa senyawa aromatik, seperti kolkhisina
yang mengandung gugus basa sebagai gugus rantai samping (Harbone 2006).
Aktivitas senyawa-senyawa alkaloid dari tanaman sebagai senyawa antibakteri diantaranya, senyawa diaboline (1-acetyl-19.20-didehydro
-17,18-epoxycuron-17-ol) yang diisolasi dari biji Strychnos potatorum dan bersifat
V. cholerae (Mallikharjuna dan Seetharam 2009). Senyawa alkaloid cryptolepine
dan quindoline yang diisolasi dari tanaman Sida acuta bersifat antibakteri dengan
nilai MIC 16-400 µg/ml dan MBC 80-400 µg/ml terhadap bakteri S. aureus, B.
cereus, S. carmonum, L. inoccua, E. faecalis, S. flexneri, S. dysenteriae, S. typhi,
S. paratyphi dan E. coli (Karou et al. 2005). Tujuh senyawa alkaloid yang
diisolasi dari bagian tanaman Hypecoum erectum L. bersifat antibakteri khususnya
bakteri S. aureus, B. Cereus, B. subtilis, E. coli, P. aeruginosa dan E. carotovora
(Yinfen et al, 2011).
Senyawa fenolik merupakan substansi yang mempunyai satu cincin
aromatik dengan satu atau lebih substitusi gugus hidroksil (OH) yang termasuk
gugus fungsional. Senyawa golongan fenolik sejak lama telah digunakan sebagai
senyawa antimikroba. Sebagian besar senyawa fenol dalam bentuk glikosida
cenderung bersifat polar, karena adanya gugus-gugus hidroksil pada struktur dasar
fenolik, sehingga mudah larut dalam pelarut polar, seperti etanol, metanol dan air (Houghtan dan Raman 1998).
Gambar 3 Struktur kimia senyawa fenol (http: www.wikipedia.org/wiki/fenol)
Senyawa fenolik diklasifikasikan menjadi tiga kelompok yaitu (1) golongan
fenol sederhana (vanilin, gingerol, shogaol, guaiakol dan eugenol), asam fenol (ρ
-kresol, 3-etilfenol, hidrokuinon dan asam galat), (2) turunan asam hodroksinamat (ρ-kumarin, kafein dan firulin), (3) flavonoid (antosianin, flavonon, flavonol dan tanin) (Nychas 1995; Shahidi dan Nackzk 1995).
Beberapa senyawa fenolik yang bersifat antibakteri, seperti senyawa caffeic
acid, verbascoside, oleuropein, luteolin 7-0-glucosidase, rutin dan apigenin yang
disolasi dari daun zaitun bersifat antibakteri terhadap bakteri B. cereus, B. subtilis,
S. aureus, P. aeruginosa, E. coli, dan Klebsiella pneumoniae (Pereira et al. 2007).
Senyawa terpenoid terbentuk sebagai metabolit sekunder dari tanaman
senyawa-12
senyawa terpenoid yang dikenal sebagai senyawa utama pada tanaman yang
bersifat sebagai penyusun minyak atsiri. Sebagian besar terpenoid mempunyai
kerangka karbon yang dibangun oleh penyambungan dua atau lebih unit C-5 yang
disebut unit isopren. Terpenoid mempunyai rumus dasar yaitu (C5H8)n atau
dengan nama lain adalah isoprene-2 metil-2,3 butadiena (Teiser 1994 diacu dalam
Naufalin 2005).
Gambar 4 Struktur kimia senyawa isopren (Robinson 1995)
Secara kimia terpenoid umumnya larut dalam lemak dan terdapat dalam
sitoplasma sel tumbuhan. Kebanyakan terpenoid alam mempunyai struktur siklik
dan mempunyai suatu gugus fungsi atau lebih (hidroksil, karbinil, dll), sehingga
pada langkah akhir sintesis terjadi siklisasi dan oksidasi atau penggabungan
struktur lainnya (Harborne 2006).
Golongan terpenoid yang mempunyai aktivitas antibakteri antara lain
phytadiene dan 1,2-seco-cladieallan yang diisolasi dari herba meniran aktif
menghambat bakteri S. aureus dan E. coli (Gunawan et al. 2008). Senyawa
borneol, sineol, pinene, kamfene, kamfor, nerelidol, linalool, indol dan kadinen
efektif menghambat pertumbuhan B. subtilis, S. aureus, Salmonella enterica dan
E. coli (Friedman et al. 2004).
Senyawa Antioksidan dari Tanaman
Antioksidan didefenisikan sebagai senyawa yang dapat menunda,
memperlambat dan mencegah proses oksidasi (Moein et al. 2007). Proses atau
reaksi oksidasi menghasilkan produk radikal bebas yang dapat memicu reaksi
berantai yang kemudian dapat merusak sel. Radikal bebas adalah atom atau
molekul yang elektron terluarnya tidak berpasangan, sehingga menjadikannya
sekitarnya untuk memperoleh pasangan elektron dalam mencapai kestabilan atom
atau molekul.
Senyawa antioksidan dapat menstabilkan radikal bebas dengan melengkapi
kekurangan elektron yang dimiliki radikal bebas dan menghambat terjadinya
reaksi berantai dan reaksi oksidasi lainnya. Mekanisme antioksidan dalam
menghambat radikal bebas diantaranya dengan mendonorkan atom hidrogen pada
radikal bebas
Mekanisme penghambatan radikal bebas merupakan suatu deret reaksi
bertahap, meliputi tahap inisiasi, propagasi dan terminasi. Tahap permulaan
(inisiasi) adalah tahap pembentukan awal radikal-radikal bebas. Tahap
perambatan (propagasi) merupakan tahapan radikal bebas mengawali sederetan
reaksi sampai terbentuk radikal bebas baru yang sering disebut sebagai reaksi
berantai. Tahap pengakhiran (terminasi) adalah tahap terputusnya daur propagasi
oleh reaksi-reaksi pengakhiran (terminasi). Reaksi ini mengubah radikal bebas menjadi radikal bebas yang stabil dan tidak reaktif
Inisiasi : RH R• + H• Propagasi : R• + O2 ROO•
: ROO• + RH ROOH + R• Terminasi : ROO• + ROO• non radikal
R• + ROO• non radikal
Berdasarkan sumbernya antioksidan dibagi menjadi dua, yaitu antioksidan
sintetik dan alami. Antioksidan sintetik diperoleh dari hasil sintesis reaksi kimia,
seperti butyl hidroksi anisol (BHA), butil hidroksi toluena (BHT), dan tersier butil
hidrokuinon (TBHQ). Antioksidan alami diperoleh dari hasil ekstraksi bahan
alami atau terbentuk dari reaksi-reaksi kimia selama pengolahan (Trilaksani 2003)
Antioksidan alami umumnya berasal dari tanaman dan komponen tersebut
terkandung dalam seluruh bagian tanaman, seperti akar, daun, bunga, buah, biji,
serbuk sari, kulit kayu, dan kulit buah (Mokbel dan Hashinaga 2005; Runtuwene
dan Tangkuman 2008; Mosquera et al. 2007; Sartini et al. 2007; Juniarti et al.
2009; Kognou et al. 2011). senyawa-senyawa yang umumnya terkandung dalam
antioksidan alami adalah fenol, polifenol, dan yang paling umum adalah flavonoid
(flavonol, isoflavon, flavon, katekin, flavonon), turunan asam sinamat (asam kafeat,
14
Beberapa senyawa antioksidan alami yang diisolasi dari tumbuhan,
diantaranya, senyawa flavonoid luteolin, kaempferol, quercetin, dan isoquercetin
yang diisolasi dari herba Sonchus oleraceus L memiliki aktivitas oksidan yang
kuat dengan IC50 12, 13, 11, dan 22 µg/ml dibandingkan senyawa standar α
-tocopherol (IC50 24 µg/ml) dan curcumin (IC50 24 µg/ml) (Yin Jie et al. 2008),
senyawa fenol (-)epikatekin, dan isosantomisol dari kulit batang manggis hutan
memiliki aktivitas antioksidan kuat dengan nilai IC50 8.6, dan 9.7 µg/ml lebih
tinggi dibandingkan dengan senyawa standar asam askorbat (IC50 18.1 µg/ml), α
-tokoferol (IC50 32.8 µg/ml), dan BHA (IC50 35.1 µg/ml) (Muharni et al. 2009).
Senyawa fenol geraniin, corilagin, ellagic acid, dan galiic acid yang diisolasi dari
kulit buah rambutan dengan nilai IC50 0.79, 1.42, 1.64, dan 2.49 ppm lebih kuat
dibandingkan dengan standar BHT IC50 68.8 ppm (Thitilertdecha et al. 2010).
Aktivitas antioksidan tidak dapat diukur secara langsung, melainkan melalui
efek antioksidan dalam mengontrol proses oksidasi. Terdapat beberapa metode yang bisa digunakan untuk mengukur aktivitas antioksidan dan setiap metode
memiliki mekanisme yang berbeda, sesuai dengan kandungan senyawa
antioksidannya. Beberapa metode pengukuran aktivitas antioksidan diantaranya,
metode DPPH (2,2-difenil-1-pikrilhidrasil), 2,2-azinobis(3-ethyl-benzothiazoline
-6-sulfonic acid) (ABTS), ferric reducing antioxidant power (FRAP), dan cuprac
reducing antioxidant capacity (CUPRAC) (Thaipong et al. 2006; Krishnaiah et al.
2011). Pada penelitian ini dilakukan pengujian aktivitas antioksidan dengan
metode DPPH.
Senyawa DPPH (dalam etanol) berwarna ungu tua terdeteksi pada panjang
gelombang sinar tampak sekitar 517 nm. DPPH bersifat peka terhadap cahaya,
oksigen dan pH. Radikal bebas DPPH dapat menangkap atom hidrogen dari
senyawa antioksidan yang dicampurkan, kemudian bereaksi menjadi bentuk
tereduksinya yang ditandai dengan berkurangnya intensitas warna ungu larutan
DPPH menjadi kuning. Senyawa antioksidan akan mendonorkan atom hidrogen
kepada DPPH dan selanjutnya akan terbentuk radikal baru yang bersifat stabil
atau tidak reaktif (1,1-difenil-2- pikrilhidrasil) (Wikanta et al. 2005). Struktur
DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan dapat dilihat pada
Gambar 5 Struktur DPPH dan DPPH tereduksi hasil reaksi dengan antioksidan (Wikanta et al. 2005)
Ekstraksi konvensional
Ekstraksi adalah proses pemisahan komponen-komponen terlarut dari
campuran komponen tidak terlarut dengan menggunakan pelarut yang sesuai.
Ekstraksi dengan pelarut dilakukan dengan melarutkan bahan kedalam pelarut
organik, sehingga komponen pembentuk bahan akan terlarut kedalam pelarut.
Ekstraksi merupakkan proses pemisahan dengan pelarut yang melibatkan
perpindahan zat terlarut ke dalam pelarut. Proses pemindahan zat terlarut
(komponen bioaktif) dari dalam bahan ke pelarut dapat dijelaskan dengan teori
difusi. Perpindahan massa komponen bahan dari dalam padatan ke cairan terjadi
melalui dua tahapan pokok. Tahapan pertama adalah difusi dari dalam padatan ke
permukaan padatan dan tahapan kedua adalah perpindahan massa dari permukaan
padatan ke cairan, kedua proses tersebut berlangsung secara seri.
Metode ekstraksi konvensional yang umum digunakan ada tiga macam,
yaitu maserasi, refluks, dan perkolasi. Pada dasarnya, prinsip refluks disamakan
dengan cara soxhlet, karena menggunakan sistem pemanasan pada suhu tertentu
(Houghton dan Ramman 1998). Maserasi merupakkan ekstraksi dengan cara
perendaman sampel ke dalam pelarut yang sesuai disertai pengadukan, sehingga
senyawa aktif terlarut sempurna. Refluks adalah ekstraksi dengan pelarut dan
bahan pada tempat yang sama , menggunakan pemanasan dan kondensor balik,
sehingga pelarut akan masuk kembali secara kontinyu dalam tempat proses
ekstraksi berlangsung. Metode soxhlet adalah ekstraksi dengan menggunakan
peralatan soxhlet, pelarut dan sampel berada pada tempat terpisah, ekstraksi
terjadi secara kontinyu akibat pergerakan pelarut melalui proses pemanasan dan
kondensasi. Perkolasi adalah ekstraksi sampel menggunakan pelarut secara
16
Pemilihan pelarut untuk proses ekstraksi tergantung dari sifat komponen
yang akan diekstraksi. Salah satu sifat yang penting adalah polaritas suatu
senyawa dilihat dari gugus polarnya (seperti gugus OH, COOH, dan lain-lain).
Suatu senyawa polar diekstrak dengan menggunakan pelarut polar, demikian juga
untuk senyawa semi polar dan non polar. Derajat polaritas bergantung pada
besarnya tetapan dielektrik, makin besar tetapan dielektrik makin polar pelarut
tersebut. Pelarut yang umum digunakan dalam ekstraksi komponen bioaktif dari
tanaman, yaitu pelarut non polar (heksan, sikloheksan, dan toluen), pelarut semi
polar (khloroform, diklorometana, dietil eter, dan etil asetat) dan pelarut polar
(methanol, etanol, dan air) (Houghton dan Raman 1998).
Ada berbagai macam jenis pelarut yang dapat digunakan untuk proses
ekstraksi. Jenis dan mutu pelarut yang digunakan sangat menentukan keberhasilan
proses ekstraksi. Pelarut yang digunakan harus mempunyai persyaratan antara lain
harus dapat melarutkan zat yang diinginkan, mempunyai titik didih yang cukup rendah, murah, tidak toksik, dan tidak mudah terbakar. Untuk menseleksi awal
kemungkinan tumbuh-tumbuhan mempunyai aktivitas antimikroba dan
antioksidan, maka untuk mengekstraksinya dapat digunakan air, alkohol, atau
pelarut organik yang lainnya.
Ekstraksi Berbantu Gelombang Mikro
Ekstraksi dengan bantuan gelombang mikro merupakan proses ekstraksi yang memanfaatkan energi yang ditimbulkan oleh gelombang mikro. Gelombang
mikro adalah radiasi elektromagnetik dengan panjang gelombang antara 1 cm – 1 m dengan frekuensi antara 0.3 – 30 GHz). Dalam spektrum frekuensi, gelombang
mikro terletak antara gelombang radio dan inframerah (Mandal et al. 2007).
Pemanasan dengan menggunakan gelombang mikro merupakan akibat dari
adanya interaksi antara kandungan bahan dengan gelombang elektromagnetik.
Prinsip pemanasan menggunakan gelombang mikro berdasarkan tumbukan
langsung dengan material atau pelarut dan diatur oleh dua fenomena, yaitu
konduksi ionik dan rotasi dipol.
Konduksi ionik mengacu pada migrasi elektroforetik ion dalam pengaruh
perubahan medan listrik. Dalam pengaruh suatu medan listrik, ion-ion yang terdapat pada bahan yang dipanaskan akan bergerak dan bergesekan sehingga
menimbulkan panas. Rotasi dipol merupakan pengaturan kembali dipol-dipol
molekul akibat medan listrik yang terus berubah dengan cepat. Gelombang mikro
bekerja dengan melewatkan radiasi gelombang mikro pada molekul-molekul
yang terdapat pada bahan, sehingga molekul-molekul ini akan menyerap energi
elektromagnetik tersebut. Proses penyerapan energi ini disebut pemanasan
dielektrik. Kebanyakan molekul pada bahan bersifat dipol elektrik (memiliki
muatan negatif dan positif), sehingga dengan adanya medan listrik yang
berubah-ubah yang diinduksikan melalui gelombang mikro, masing-masing sisi akan
berputar untuk saling mensejajarkan diri satu sama lain. Perputaran molekul ini
akan menimbulkan gesekan atau tabrakan antar molekul yang akhirnya akan
membangkitkan panas. Energi panas yang dihasilkan inilah yang berfungsi
sebagai agen pemanasan (Jain et al. 2009)
Pemanasan gelombang mikro melibatkan tiga konversi energi, yaitu
konversi energi listrik menjadi energi elektromagnetik, energi elektromagnetik
menjadi energi kinetik, dan energi kinetik menjadi energi panas. Poin kunci yang
menjadikan energi gelombang mikro menjadi alternatif yang menarik guna
menggantikan pemanasan konvensional adalah, pada pemanasan konvensional,
pemanasan terjadi melalui gradien suhu, sedangkan pada pemanasan gelombang mikro, pemanasan terjadi melalui interaksi langsung antara material dengan
gelombang mikro. Hal tersebut mengakibatkan transfer energi berlangsung lebih
cepat, dan berpotensi meningkatkan kualitas produk (Zhang dan Hayward 2006;
Das et al. 2009).
Ekstraksi berbantu gelombang mikro dipengaruhi oleh jenis pelarut, volume
18
pelarut dipilih berdasarkan kelarutan senyawa target, interaksi antara pelarut
dengan matriks bahan serta kemampuan pelarut dalam menyerap energi
gelombang mikro (Brachet et al. 2002; Kaufman et al. 2007; Mandal et al. 2007).
Ukuran kemampuan pelarut dalam menyerap energi gelombang mikro dan
mengubahnya menjadi panas dinyatakan sebagai faktor disipasi atau tangen loss (tan ). Tangen loss merupakan perbandingan antara dielektrik loss ( '') yang mengindikasikan efisiensi pelarut dalam mengkonversi energi gelombang mikro
menjadi panas dan konstanta dielektrik ( ') yang merupakan ukuran kemampuan
pelarut untuk menyerap energi gelombang mikro . (Jain et al. 2009; Mandal et al
2007). Nilai konstanta dielektrik, dielektrik loss dan tangen loss disajikan pada
Tabel 1.
Tabel 1 Nilai konstanta dielektrik beberapa pelarut
Pelarut Konstanta
dielektrik ( ') Dielektrik loss ( '')
Faktor disipasi (tan x 104
)
Heksan 1.88 0.000019 0.1
Etil asetat 6.02 3.2 5316
Aceton 20.7 11.5 5555
Etanol 24.3 6.1 2500
Metanol 32.7 15.2 6400
Air 80 12 1500
Sumber : Mandal et al. (2007) dan Jain et al. (2009)
Volume pelarut harus cukup agar bahan yang akan diekstrak terendam
seluruhnya dalam pelarut. Pada ekstraksi konvensional, volume pelarut yang lebih
banyak dapat meningkatkan rendemen ekstrak, tetapi pada ekstraksi berbantu
gelombang mikro volume pelarut yang lebih banyak dapat menghasilkan
rendemen yang rendah. Hasil penelitian yang dilakukan pada ekstraksi kulit buah
delima (Pomegranate) menggunakan gelombang mikro, menunjukkan bahwa
kulit buah delima yang diekstrak dengan air destilat dengan rasio bahan per
pelarut 1:20 memberikan rendemen total fenol yang lebih tinggi dibandingkan
dengan rasio 1:10 dan 1:40 ( Zheng et al. 2011). Prazad et al. (2011) melakukan
ekstraksi daun mangrove (Ceriops. decandra sp) menggunakan pelarut etanol
dengan rasio bahan per pelarut 1:10, 1:15, 1:20, 1:25 dan 1:30 dengan
menggunakan gelombang mikro, hasil penelitian menunjukan rendemen total
Waktu menentukan jumlah komponen bioaktif yang dapat diekstraksi dari
bahan. Secara umum dengan meningkatnya waktu ekstraksi maka jumlah
komponen yang terekstrak akan semakin banyak, tetapi ekstraksi dengan bantuan
gelombang mikro membutuhkan waktu yang jauh lebih singkat. Seringkali waktu
ekstraksi 15-20 menit memberikan hasil yang baik (Mandal et al. 2007; Prazad et
al. 2011; Rafiee et al. 2011; Singh et al. 2011), bahkan pada bahan dan kondisi
ekstraksi tertentu membutuhkan waktu yang lebih singkat untuk memperoleh hasil
yang optimum, seperti ekstraksi total fenol dari buah Canarium. album L
membutuhkan waktu 15 detik (Zhiyong danXia 2007), ekstraksi pektin dari buah
apel membutuhkan waktu 40 detik (Wang et al. 2007), ekstraksi asam fenol dari
kulit buah jeruk (Citrus mandarin) membutuhkan waktu 49 detik (Hayat et al.
2009), dan ekstrasi total fenol dari kulit buah delima (Pomegranate)
membutuhkan waktu 60 detik (Zheng et al. 2011).
Daya gelombang mikro dan waktu merupakan dua fator yang saling mempengaruhi. Kombinasi daya yang rendah atau sedang dengan waktu yang
panjang merupakan pilihan yang bijak untuk menghindari terjadinya degradasi
termal produk. Secara umum efisiensi ekstraksi dengan waktu ekstraksi yang
singkat akan meningkat seiring dengan meningkatnya daya gelombang mikro,
begitu pula sebaliknya. Tetapi pada daya yang tinggi, variasi daya tidak
memberikan pengaruh yang nyata pada rendemen ekstrak (Zhiyoung et al. 2007;
Hayat et al 2009; Dhobi et al. 2010).
Beberapa hasil penelitian penggunaan gelombang mikro untuk proses
ekstraksi komponen aktif dari bahan alam disajikan pada Tabel 2.
Tabel 2 Rangkuman hasil penelitian ekstraksi kulit buah dengan gelombang mikro
NO. Bahan Perlakuan Hasil Referensi
1. Kulit jeruk mandarin (citrus mandarin)
Optimasi ekstraksi dengan gelombang mikro (MAE)
Daya gelombang mikro 100, 150 dan 200 W. Waktu 30,45, 60 detik
Konsentrasi metanol 60, 70, 80 %
Rasio bahan per pelarut (1:10), (1:15), dan (1:20)
Ekstraksi dengan ultrasonik (USE) menggunakan alat sonikasi : daya 200 W, 59 kHz, 80% methanol, rasio 1:20,selama 60 menit.
Ekstraksi maserasi dengan pengadukan (RE): 60 menit, methanol 80%, 1:20.
Kondisi ekstraksi optimal dgn MAE: daya 152 W, 49 detik, 66% methanol, 1:16
Total fenol ekstraksi
dengan MAE (175.22 mg GAE/g) lebih tinggi dari USE (162.93 mg/g) danRE (79.80 mg/g).
Aktivitas antioksidan
ekstraksi dengan MAE
(26.03%) lebih tinggi dari USE (25.37%) dan RE (22%)
20
Tabel 2 lanjutan
NO. Bahan Perlakuan Hasil Referensi
2. Kulit buah delima (Punica granatum)
Optimasi ekstraksi dengan gelombang mikro:
Daya gelombang mikro (% power) ; 20, 60, dan 80% Waktu ekstraksi: 10, 35, dan
60 detik
Rasio bahan per pelarut; (1:10), (1;25), dan (1:40)
Kondisi ekstraksi optimal 80% power = 600 watt, 60 detik dan rasio bahan per pelarut 1:20 menghasilkan total fenol 210.36 mg/g dengan aktivitas antioksidan IC50 14.53 µg/ml
Xueling et al. 2011
3. Kulit buah longan (Dimocarpus longan Lour.)
Ekstraksi dengan MAE
5 g sampel dalam 50 ml etanol 95%
Daya 500 watt, suhu 80 oC Waktu ekstraksi 5 menit Ekstraksi dengan Soxhlet (SEL)
5 g sampel dalam 80 ml etanol 95%
Waktu ekstraksi 2 jam
Rendemen ekstraksi dengan MAE 12.8% lebih tinggi dari ekstraksi SEL 10.9%. Total fenol MAE 96.78 mg/g lebih tinggi dari SEL 90.35 mg/g.
Yingming et al. 2008
Metode Permukaan Respon ( Respon Surface Method )
Respon Surface Method (RSM) adalah kumpulan teknik matematika dan
statistik yang digunakan untuk membentuk model dan menganalisis masalah
dalam suatu respon yang dipengaruhi oleh beberapa peubah dan bertujuan untuk
mengoptimalisasi respon (Oramahi 2008). Ide dasar metode ini adalah
memanfaatkan desain eksperimen berbantuan statistika untuk mencari nilai
optimal dari suatu respon. Metode ini pertama kali diajukan sejak tahun 1951 dan
sampai saat ini telah banyak dimanfaatkan baik dalam dunia penelitian maupun
aplikasi industri. Dalam banyak masalah RSM, bentuk hubungan antara respon
dan peubah bebasnya tidak diketahui, jadi langkah pertama adalah mendapatkan suatu pendugaan yang cocok untuk fungsi yang sebenarnya antara y dan
hubungan bebasnya. Untuk pendugaan ini biasanya digunakan satu polinomial
orde rendah, jika respon telah dimodelkan dengan baik oleh fungsi linier dari
peubah bebasnya, maka fungsi yang diduga adalah model ordo pertama. Y= βο + βixі + β2x2 + ... + βkxxk +
Jika ada lengkungan dalam sistem, maka polinominal dengan ordo lebih tinggi
Y= βο + Σβixі + Σβ2x2 + ... + Σβkxxk +
Hampir semua persoalan RSM menggunakan salah satu dari kedua model
ini. Memang model polinomial ini bukan satu-satunya model untuk menduga
hubungan fungsi yang sebenarnya, tetapi untuk wilayah yang relatif kecil maka
model ini dapat digunakan dengan baik. Metode kuadrat terkecil juga dapat
digunakan untuk menduga parameter dalam pendugaan polinomial. Analisis
respon surface kemudian dibentuk menggunakan pengepasan surface. Jika
pengepasan surface merupakan suatu pendugaan yang memadai dari fungsi
respon yang sebenarnya, maka analisis dari pengepasan surface kira-kira sama
dengan analisis sistim yang sebenarnya (Montgomery 1997)
Analisis untuk menduga fungsi respon sering disebut sebagai analisis
permukaan respon yang pada dasarnya serupa dengan analisis regresi yaitu
menggunakan prosedur pendugaan parameter fungsi respon berdasarkan metode
kuadrat terkecil (least square method), hanya saja dalam analisis permukaan respon diperluas dengan menerapkan teknik-teknik matematik untuk menentukan
titik-titik optimum agar dapat ditemukan respon yang optimum. Penentuan
kondisi operasi optimum diperlukan fungsi respon ordo kedua dengan
menggunakan rancangan yang sesuai dalam mengumpulkan data percobaan.
Penentuan kondisi optimum proses dilakukan menggunakan analisis kanonik dan
analisis plot kontur permukaan respon. Analisis kanonik dalam metode
permukaan respon adalah mentransformasikan permukaan respon dalam bentuk
kanonik, sedangkan plot kontur adalah suatu seri garis atau kurva yang
mengidentifikasikan nilai-nilai peubah uji pada respon yang konstan dan plot
kontur ini memegang peranan penting dalam mempelajari analisis permukaan
respon.
Nlai R2 merupakan ukuran kesesuaian model dalam kemampuannya untuk
menerangkan keragaman nilai peubah Y. semakin tinggi R2 berarti model
semakin mampu menerangkan perilaku peubah Y (Rigas et al. 2001; Mattjik dan
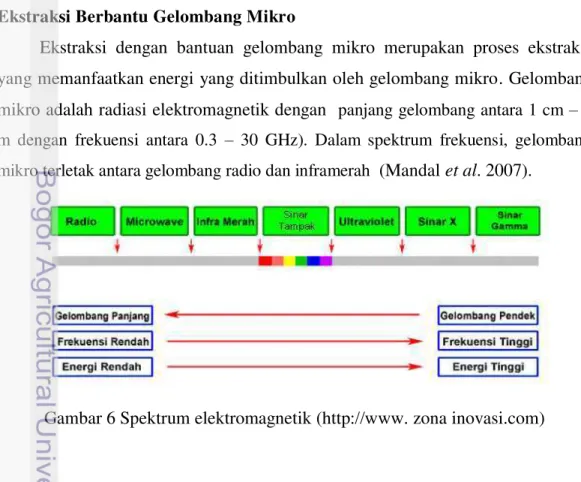
Sumertajaya 2002). Uji signifikan model dan uji asumsi residual dilakukan untuk
mengetahui pengaruh variabel bebas terhadap respon dan model dikatakan tepat
apabila uji asumsi residual menunjukkan plot residual menyebar acak disekitar nol
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan di Laboratorium Balai Besar Penelitian dan
Pengembangan Pascapanen Pertanian Bogor dan Laboratorium Pusat Studi
Biofarmaka Lembaga Penelitian dan Pengabdian pada Masyarakat IPB Bogor,
dari bulan April 2011 sampai Mei 2012.
Bahan dan Alat
Bahan utama yang digunakan dalam penelitian ini adalah kulit buah Langsat
(Lansiumdomesticum) yang diperoleh dari Kabupaten Mamuju Provinsi Sulawesi
Barat. Bahan kimia untuk ekstraksi terdiri dari heksana, etil asetat dan etanol 70%, serta bahan-bahan kimia lainnya untuk analisa. Bakteri uji yang digunakan
adalah Staphylococcus aureus ATCC 25923 dan Escherichia coli ATCC 25922.
Bahan-bahan lain yang digunakan adalah larva udang (Artemia salina Leach), air
laut untuk uji toksisitas, media padat nutrient agar (NA), media cair nutrient
broth (NB) untuk perbanyakan dan pemeliharaan kultur bakteri,
1,1-difenil-1-pikrilhidrazil (DPPH) dan butil hidroksi toluen (BHT) untuk uji antioksidan.
Peralatan yang digunakan dalam penelitian ini meliputi alat shaker, vakum
evaporator, autoklaf, inkubator, pipet mikro, multiwell plates, seperangkat alat
elisa reader, spektrofotometer, oven microwave Panasonic tipe NN.S215WF/MF
dan peralatan gelas untuk analisis kimia.
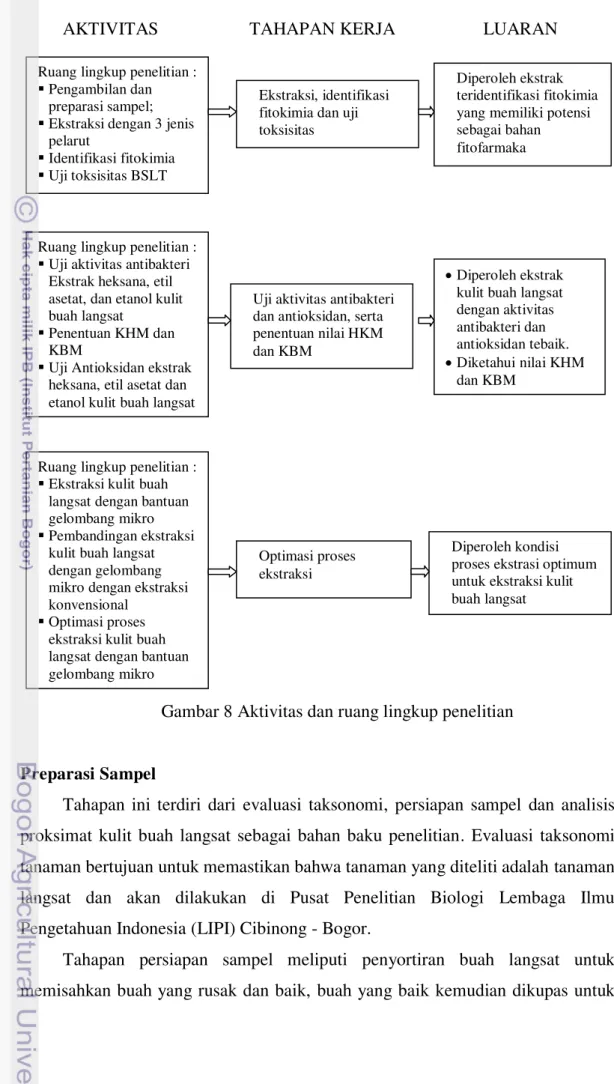
Tahapan Penelitian
Penelitian ini akan dilakukan dalam beberapa tahapan percobaan yang
meliputi : 1) Preparasi sampel, 2) Ekstraksi kulit buah langsat, 3) Identifikasi
fitokimia dan evaluasi toksisitas ekstrak kulit buah langsat, 4) Uji aktivitas
antibakteri dan antioksidan ekstrak kulit buah langsat, 5) Optimasi proses
ekstraksi kulit buah langsat dengan bantuan gelombang mikro. Diagram alir
24
Gambar 7 Diagram alir pelaksanaan penelitian
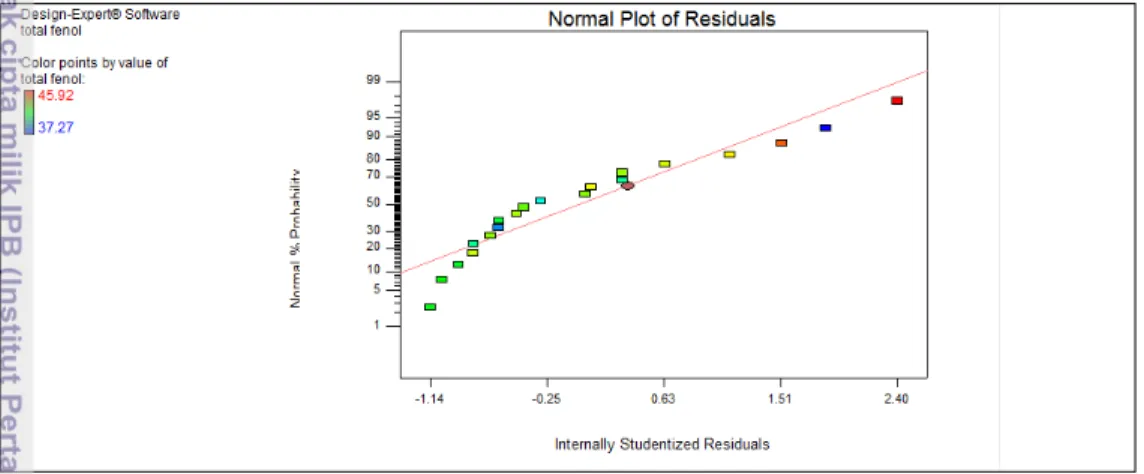
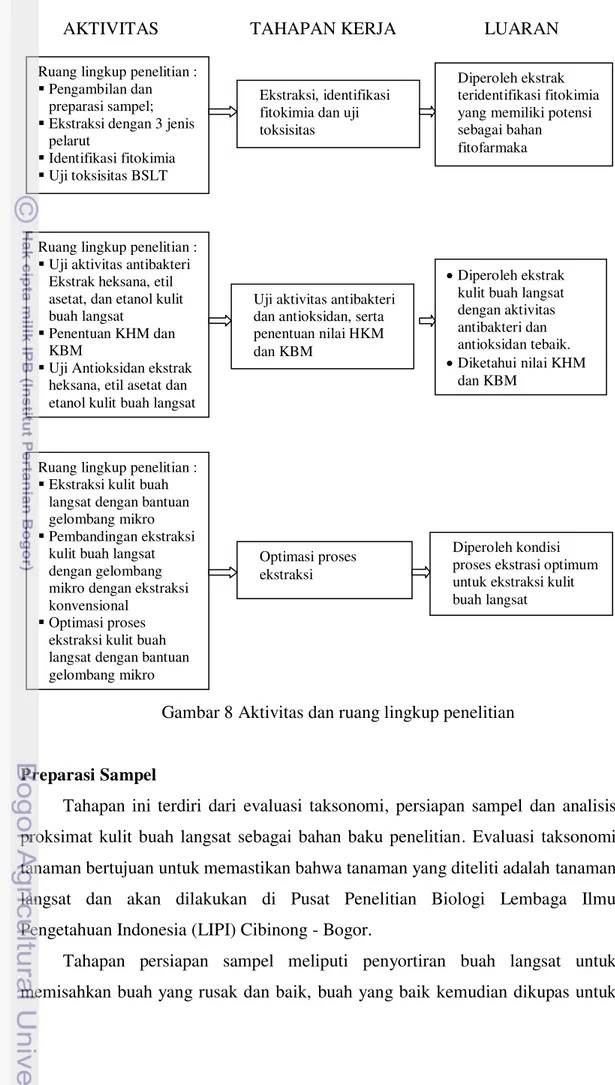
Dari tahapan yang disajikan pada Gambar 7, dapat dikelompokan menjadi 3
tahapan besar dengan beberapa ruang lingkup penelitian seperti disajikan pada
Gambar 8.
Kulit buah langsat
Preparasi sampel
Ekstraksi secara Maserasi
(dengan pelarut heksana, etil asetat dan etanol)
Uji fitokimia
Uji toksisitas
Ekstrak terpilih Penentuan KHM dan KBM
Optimasi proses ekstraksi Ekstrak heksana Ekstrak etil asetat Ekstrak etanol 70%
Ekstrak optimal
Validasi
Uji antibakteri
AKTIVITAS TAHAPAN KERJA LUARAN
Gambar 8 Aktivitas dan ruang lingkup penelitian
Preparasi Sampel
Tahapan ini terdiri dari evaluasi taksonomi, persiapan sampel dan analisis
proksimat kulit buah langsat sebagai bahan baku penelitian. Evaluasi taksonomi
tanaman bertujuan untuk memastikan bahwa tanaman yang diteliti adalah tanaman
langsat dan akan dilakukan di Pusat Penelitian Biologi Lembaga Ilmu
Pengetahuan Indonesia (LIPI) Cibinong - Bogor.
Tahapan persiapan sampel meliputi penyortiran buah langsat untuk
memisahkan buah yang rusak dan baik, buah yang baik kemudian dikupas untuk Ruang lingkup penelitian :
Pengambilan dan preparasi sampel;
Ekstraksi dengan 3 jenis pelarut
Identifikasi fitokimia
Uji toksisitas BSLT
Ekstraksi, identifikasi fitokimia dan uji toksisitas
Diperoleh ekstrak teridentifikasi fitokimia yang memiliki potensi sebagai bahan fitofarmaka
Ruang lingkup penelitian :
Uji aktivitas antibakteri Ekstrak heksana, etil asetat, dan etanol kulit buah langsat
Penentuan KHM dan KBM
Uji Antioksidan ekstrak heksana, etil asetat dan etanol kulit buah langsat
Uji aktivitas antibakteri dan antioksidan, serta penentuan nilai HKM dan KBM
Diperoleh ekstrak kulit buah langsat dengan aktivitas antibakteri dan antioksidan tebaik. Diketahui nilai KHM
dan KBM
Ruang lingkup penelitian :
Ekstraksi kulit buah langsat dengan bantuan gelombang mikro
Pembandingan ekstraksi kulit buah langsat dengan gelombang mikro dengan ekstraksi konvensional
Optimasi proses ekstraksi kulit buah langsat dengan bantuan gelombang mikro
Optimasi proses ekstraksi
26
memisahkan kulit buah dari daging buahnya. Kulit buah kemudian dikeringkan
dengan oven selama 6 jam pada suhu 60o C. Setelah kering, kulit buah dihaluskan
menggunakan hammer mill menjadi berbentuk serbuk dengan ukuran 60 mesh.
Analisis proksimat dilakukan untuk menentukan karakteristik kulit buah
langsat yang meliputi analisis kadar air, kadar protein, kadar lemak, kadar abu,
kadar serat, dan kadar karbohidrat.
Ekstraksi kulit buah langsat
Proses ekstraksi kulit buah langsat dilakukan secara maserasi menggunakan
pelarut- pelarut yang berbeda polaritasnya, yaitu pelarut heksana (nonpolar),
etilasetat (semipolar) dan etanol (polar). Ekstraksi dilakukan pada suhu ruang
selama 24 jam. Serbuk kulit buah langsat sebanyak 25 g direndam dalam pelarut
heksana, etil asetat dan etanol dengan perbandingan 1:10 (b/v) sambil dishaker.
Campuran- campuran tersebut kemudian disaring, dan selanjutnya ampas serbuk kulit buah langsat tersebut dimaserasi kembali dengan perlakuan sama seperti