KAPANG ENDOFIT DARI TUMBUHAN PESISIR
SARANG SEMUT (
Hydnophytum formicarum
) DAN
POTENSINYA SEBAGAI ANTIHIPERGLIKEMIK
RITA SAHARA
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul kapang endofit dari tumbuhan pesisir sarang semut (Hydnophytum formicarum) dan potensinya sebagai antihiperglikemik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2013
Rita Sahara
ABSTRAK
RITA SAHARA. Kapang Endofit dari Tumbuhan Pesisir Sarang Semut (Hydnophytum formicarum) dan Potensinya sebagai Antihiperglikemik. Dibimbing oleh IRIANI SETYANINGSIH dan KUSTIARIYAH TARMAN.
Tumbuhan epifit sarang semut Hydnophytum formicarum merupakan salah satu tumbuhan pesisir yang digunakan sebagai obat tradisional oleh masyarakat pedalaman. Mikroba endofit dapat menghasilkan senyawa metabolit sekunder yang mirip dengan senyawa yang dihasilkan oleh tumbuhan inangnya. Tujuan penelitian ini untuk menentukan aktivitas penghambatan ekstrak kapang endofit
dari tumbuhan sarang semut terhadap enzim α-glukosidase. Tahapan penelitian yang dilakukan meliputi isolasi kapang endofit, karakterisasi, uji antagonisme, kultivasi, ekstraksi, dan pengujian aktivitas antihiperglikemik. Hasil isolasi endofit diperoleh 7 isolat yaitu 1A,1B, 2A, 2B, 3, 6A dan 6B dengan karakterisasi yang berbeda. Kapang 3 dan kapang 6B merupakan isolat kapang terpilih dalam uji antagonisme. Pola pertumbuhan kapang menunjukkan bahwa kapang mencapai fase stasioner pada hari ke-21 sampai hari ke-24. Ekstrak media kultur dan miselium mengandung flavonoid dan fenol hidrokuinon. Hasil uji inhibisi ekstrak
media kultur terhadap aktivitas enzim α-glukosidase pada konsentrasi 20000 ppm sebesar 72.63%.
Kata kunci: aktivitas enzim α-glukosidase, kapang endofit, tumbuhan sarang semut
ABSTRACT
RITA SAHARA. Endophytic Fungi from Sarang Semut (Hydnophytum formicarum) and the Prospect as Antihyperglycemic. Supervised by IRIANI SETYANINGSIH and KUSTIARIYAH TARMAN
Epiphytic plant sarang semut Hydnophytum formicarum is one of the coastal plants that used as traditional medicine. Microbial endophytic can produce secondary metabolite compounds similar to compounds produced by plants of its host. The purpose of this research was to determine the activity of the endophytic fungi extracts to inhibit α-glucosidase. This research included isolation, cultivation, extraction, characterization, and assay the antihyperglycemic activity. The results showed 7 types of endophytic isolates included 1A, 1B, 2A, 2B, 3, 6A and 6B with a different characterization. Endophytic fungus 3 and 6B were the selected isolate based on antagonism test. A fungal growth patterns showed that the stationary phase of the fungus was on the 21th day until 24th day. Phytochemical test on extracts of mycelium and culture media showed that the extracts containing flavonoids and phenols hydroquinone. The screening results showed that the fungal broth extract with concentration of 20000 ppm had α -glucosidase inhibitor activity 72.63%.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan pada
Departemen Teknologi Hasil Perairan
KAPANG ENDOFIT DARI TUMBUHAN PESISIR
SARANG SEMUT (
Hydnophytum formicarum
) DAN
POTENSINYA SEBAGAI ANTIHIPERGLIKEMIK
RITA SAHARA
TEKNOLOGI HASIL PERAIRAN
FAKULTAS PERIKANAN DAN ILMU KELAUTAN INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kapang Endofit dari Tumbuhan Pesisir Sarang Semut (Hydnophytum formicarum) dan Potensinya sebagai Antihiperglikemik
Nama : Rita Sahara
NIM : C34090015
Program Studi : Teknologi Hasil Perairan
Disetujui oleh
Dr Ir Iriani Setyaningsih, MS Pembimbing I
Dr Kustiariyah Tarman, SPi, MSi Pembimbing II
Diketahui oleh
Dr Ir Ruddy Suwandi MS, MPhil Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga penulis dapat menyelesaikan skripsi ini. Penelitian ini dilaksanakan pada bulan Januari hingga Juli 2013 dengan judul “Kapang Endofit dari Tumbuhan Pesisir Sarang Semut (Hydnophytum formicarum) dan Potensinya sebagai Antihiperglikemik”.
Penulis mengucapkan terima kasih kepada Dr Ir Iriani Setyaningsih, MS dan Dr Kustiariyah Tarman SPi, MSi selaku dosen pembimbing serta Dr Desniar SPi, MSi selaku dosen penguji, yang telah banyak memberi kritik, saran dan bimbingannya. Terima kasih juga penulis sampaikan kepada Mama, Bapak, dan adik-adikku tersayang Janah, Iky dan Bapak Udin Fabanyo beserta keluarga yang telah memberikan semangat, doa dan dukungannya. Penghargaan penulis sampaikan kepada Ibu Ema, Mbak Dini, Mbak Wiwi, Mbak Ina, Ibu Dewi, Pak Eman yang telah membantu penulis selama penelitian di Laboratorium serta teman seperjuangan Tim Mikrobiologi (Wenny Tiara, Ayu Puspita, Dwi Safitri, Ia Arga, Dhani Aprianto, Cholila), Tika Ayu, Detti Pujiyanti serta THP 46 (Alto) atas segala bantuan dan motivasinya.
Semoga karya ilmiah ini dapat bermanfaat bagi semua pihak yang memerlukannya.
Bogor, Oktober 2013
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
METODE 3 Bahan 3
Alat 3
Prosedur Analisis Penelitian 3
Preparasi sampel 5
Isolasi kapang endofit dari umbi tumbuhan pesisir sarang semut (Hydnophytum formicarum) 5
Karakterisasi isolat kapang endofit 6
Seleksi kapang endofit 6
Kultivasi isolat kapang antagonis 6
Ekstraksi media kultur isolat kapang antagonis 7
Uji inhibitor enzim α-glukosidase tahap 1 7
Kultivasi dan Penentuan kurva pertumbuhan kapang endofit terpilih 8
Kultivasi dan optimasi kapang endofit terpilih 8
Ekstraksi senyawa aktif media kultur dan miselium kapang endofit terpilih 8
Uji fitokimia 9
Uji inhibitor enzim α-glukosidase tahap 2 10
HASIL DAN PEMBAHASAN 9 Isolat dan morfologi kapang endofit tumbuhan pesisir sarang semut (Hydnophytum formicarum) 10
Ekstrak media kultur kapang 3 dan kapang 6B 17 Aktivitas Inhibitor Ekstrak Media Kultur Kapang 3 dan Kapang 6B terhadap Enzim α-Glukosidase (Uji Tahap 1) 18 Pertumbuhan kapang 3 20 Ekstrak Media Kultur dan Ekstrak Miselium Kapang 3 21 Aktivitas Inhibitor Ekstrak Media Kultur dan Ekstrak Miselium Kapang 3 terhadap Enzim α-Glukosidase (Uji Tahap 2) 22 Komponen Aktif Ekstrak Media Kultur dan Ekstrak Miselium Kapang 3 24
SIMPULAN DAN SARAN 25
Simpulan 25 Saran 26
DAFTAR PUSTAKA 26
LAMPIRAN 30
RIWAYAT HIDUP 39
DAFTAR TABEL
1 Sistem reaksi enzim untuk satu sampel 8
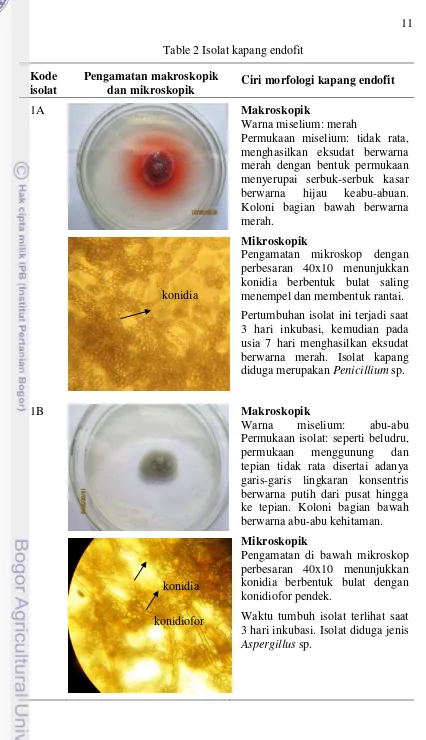
2 Isolat kapang endofit 10
3 Nilai rendemen ekstrak etil asetat kapang 3 dan kapang 6B 17 4 Penghambatan ekstrak kapang 3 dan 6B terhadap aktivitas enzim α
-glukosidase pada kondisi statis dan shaking dengan masa inkubasi 7 hari
19
5 Penghambatan ekstrak media kultur dan ekstrak miselium kapang
terhadap aktivitas enzim α-glukosidase dengan masa inkubasi 21 hari 22 6 Penghambatan akarbose terhadap aktivitas enzim α-glukosidase 23 7 Komponen aktif ekstrak media kultur dan miselium 24
DAFTAR GAMBAR
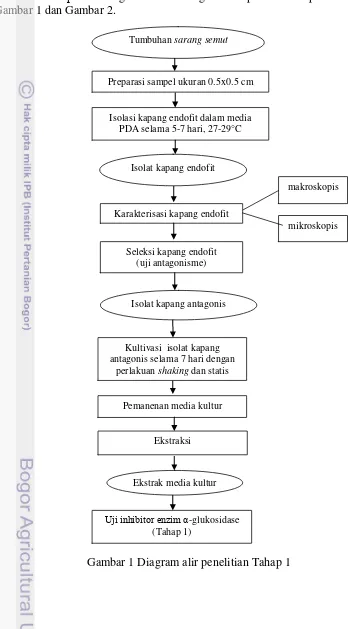
1 Diagram alir penelitian tahap 1 4
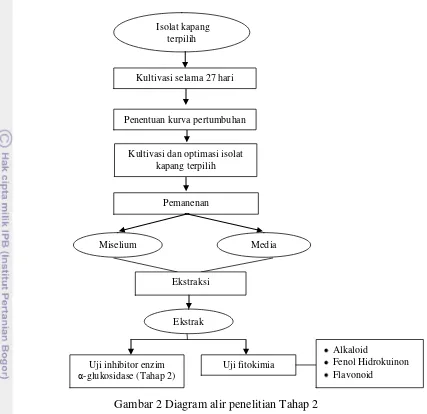
2 Diagram alir penelitian tahap 2 5
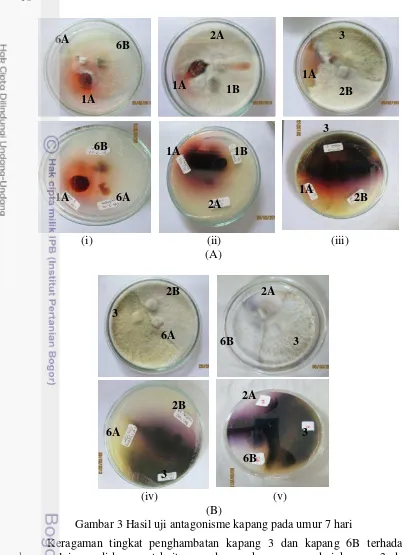
3 Hasil uji antagonisme kapang pada umur 7 hari 16 4 Persamaan reaksi enzimatis α- glukosidase 18
5 Kurva pertumbuhan kapang 3 20
DAFTAR LAMPIRAN
1 Perhitungan rendemen ekstrak eti asetat media kultur kapang 3 dan 6B 30 2 Hasil penimbangan bobot kering miselium kapang 3 31
3 Kultivasi kapang 3 selama 27 hari 32
4 Perhitungan rendemen ekstrak kapang 34
5 Hasil uji inhibisi ekstrak media kapang 3 terhadap enzim α-glukosidase 35 6 Hasil uji inhibisi ekstrak media miselium kapang 3 terhadap enzim α
-glukosidase 36
7 Hasil uji inhibisi ekstrak akarbose terhadap enzim α-glukosidase 37
PENDAHULUAN
Latar Belakang
Keanekaragaman hayati hutan mangrove di Indonesia yang tinggi merupakan aset yang sangat penting mulai dari manfaat ekologi sampai dengan sebagai sumber pangan dan obat tradisional (Darsono 1999). Salah satu tanaman obat yang belum banyak diteliti pemanfaatannya adalah tumbuhan sarang semut. Menurut Soeksmanto et al. (2010), tumbuhan sarang semut hidup sebagai tumbuhan epifit pada beberapa tanaman inang seperti kayu putih (Melalueca), cemara gunung (Casuarina), kaha (Castanopsis) dan pada beberapa tanaman inang yang hidup di pesisir (Nothophagus). Pemanfaatan tumbuhan sarang semut sebagai pengobatan tradisional telah dilakukan secara turun-temurun oleh masyarakat pedalaman Papua karena dianggap mampu mengobati beberapa penyakit seperti, maag, ambeien, mimisan, sakit punggung, alergi, gangguan asam urat, stroke, jantung koroner, TBC, tumor, kanker, serta penstimulasi produksi air susu (Subroto dan Hendro 2008).
Diabetes mellitus merupakan salah satu penyakit hiperglikemia yang ditandai oleh kurang responsifnya sel-sel tubuh terhadap insulin. Beberapa faktor yang menyebabkan penyakit diabetes mellitus diantaranya faktor hidup yang kurang sehat, genetik, virus, gangguan hormonal atau penyebab lainnya (Corwin 1996). Waring (2007) menyatakan bahwa mekanisme pengobatan diabetes mellitus antara lain melalui tiga cara, yaitu penambahan insulin dari luar, merangsang sekresi insulin, dan menurunkan kadar glukosa darah melalui penghambatan aktivitas α-glukosidase. Penderita diabetes di berbagai belahan dunia, baik negara berkembang dan negara maju tiap tahunnya meningkat dan hal inilah yang menjadi masalah besar dalam dunia kesehatan saat ini. Wild et al.
(2004) melaporkan bahwa prevalensi diabetes untuk semua kelompok usia di seluruh dunia pada tahun 2000 sebesar 2.8% dan diperkirakan meningkat menjadi 4.4% pada tahun 2030. Prevalensi diabetes mellitus di Indonesia berkisar 1.5–2.5%, kecuali daerah Manado yang prevalensinya mencapai 6% (DEPKES RI 2005).
Pemanfaatan yang berlebihan pada tanaman induk dikhawatirkan dapat mengakibatkan penurunan populasi alami dalam waktu yang cepat (Radji 2005). Salah satu cara yang dilakukan untuk memenuhi kebutuhan sekaligus menjaga kelestarian tanaman induk adalah dengan mengembangkan bioteknologi kapang endofitnya. Pengembangan bioteknologi kapang endofit memberikan beberapa keuntungan yaitu menghasilkan senyawa bioaktif secara cepat, memproduksi senyawa bioaktif yang tidak terbatas jumlahnya serta pertumbuhannya tidak tergantung cuaca atau musim karena pertumbuhannya dilakukan pada media yang khusus dan cocok sebagai media pertumbuhannya (Ramdanis et al. 2012).
2
menghambat aktivitas enzim α-glukosidase. Artanti et al. (2012) berhasil membuktikan bahwa ekstrak media cair dan ekstrak miselium kapang endofit
Colletotrichum sp. yang diisolasi dari Taxus sumatrana telah terbukti mampu
menghambat aktivitas enzim α-glukosidase sebesar 79.5% dan 18.2%. Hasil penelitian Ramdanis (2012) menunjukkan bahwa ekstrak etil asetat isolat kapang endofit dari biji mahoni mengandung flavonoid. Lukacinova et al. (2008) melaporkan bahwa senyawa golongan flavonoid menunjukkan sifat antidiabetes. Oleh karena itu, kapang endofit tumbuhan sarang semut diharapkan dapat menghasilkan metabolit sekunder yang memiliki khasiat antidiabetes yang sama dengan metabolit yang dihasilkan tumbuhan inangnya.
Perumusan Masalah
Masalah yang diangkat dalam penelitian adalah meningkatnya jumlah penderita penyakit diabetes mellitus menjadi masalah besar dalam dunia kesehatan Indonesia. Timbulnya efek samping yang kurang baik akibat penggunaan obat-obat konvensional dalam pengobatan diabetes menyebabkan banyak penderita yang beralih ke pengobatan tradisional. Penggunaan tumbuhan sarang semut secara terus-menerus dan berlebihan dikhawatirkan dapat mengurangi ketersediaan tumbuhan sarang semut di alam karena belum adanya teknik budidaya tumbuhan ini dikarenakan masih hidup secara liar. Oleh karena bioteknologi kapang endofit dari tumbuhan sarang semut patut dikembangkan sebagai bahan obat antihiperglikemik.
Tujuan Penelitian
Tujuan dari penelitian ini adalah mendapatkan isolat kapang endofit dari tumbuhan sarang semut (Hydnophytum formicarum), mendapatkan kapang terseleksi dari uji antagonisme, menentukan senyawa aktif pada ekstrak kapang endofit sarang semut dengan menggunakan uji fitokimia, dan menentukan aktivitas penghambatan ekstrak kapang endofit terhadap enzim α-glukosidase.
Manfaat Penelitian
Penelitian ini dapat memberikan informasi mengenai senyawa metabolit sekunder yang terkandung dalam kapang endofit tumbuhan sarang semut yang berpotensi sebagai senyawa inhibitor enzim α-glukosidase.
Ruang Lingkup Penelitian
3 METODE
Penelitian ini dilaksanakan pada bulan Januari sampai dengan Juli 2013. Isolasi, kultivasi, ekstraksi dan uji fitokimia kapang endofit dilakukan di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor. Proses evaporasi sampel dilakukan di Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor serta pengujian aktivitas penghambatan enzim α-glukosidase dilakukan di Laboratorium Pusat Studi Biofarmaka.
Bahan
Bahan utama yang digunakan dalam penelitian adalah isolat kapang endofit yang diisolasi dari umbi tumbuhan pesisir sarang semut (Hydnophytum formicarum). Medium yang digunakan terdiri dari Potato Dextrose Agar (PDA) untuk media isolasi kapang endofit, Potato Dextrose Broth (PDB) untuk media kultivasi dan penentuan kurva pertumbuhan kapang endofit. Pelarut yang digunakan dalam proses ekstraksi yaitu etil asetat dan metanol. Bahan yang dipakai untuk uji fitokimia adalah pereaksi Wagner, pereaksi Meyer, pereaksi Dragendorff, H2SO4 pekat, etanol 70%, larutan FeCl3 5%, serbuk Mg, larutan amil alkohol. Bahan uji inhibitor enzim α-glukosidase adalah p-nitrofenil-α -D-glukopiranosa (Sigma), serum bovine albumin, enzim α-glukosidase (Sigma), bufer fosfat (pH 7), Glukobay, Dimethyl Sulfoxide (DMSO), HCl 2N, dan Na2CO3.
Alat
Alat-alat yang digunakan untuk preparasi dan isolasi sampel adalah pisau,
laminar air flow, autoklaf, cawan petri, Bunsen, lemari pendingin. Alat yang digunakan untuk karakterisasi adalah mikroskop. Alat yang digunakan untuk kultivasi dan ekstraksi adalah labu Erlenmeyer, timbangan analitik, kertas saring, kertas pH, aluminium foil, gunting, shaker incubator, soxhlet (Schott Duran),
rotary evaporator (Heidolph VV2000). Alat yang digunakan untuk uji fitokimia adalah tabung reaksi, labu Erlenmeyer, corong gelas, sudip, dan pipet tetes. Alat
yang digunakan untuk uji inhibitor enzim α-glukosidase adalah microplate
(Nunc), pipet mikro (Eppendorf), inkubator (Binder), spektrofotometer UV-Vis (Epoch).
Prosedur Analisis Penelitian
4
penentuan kurva pertumbuhan kapang endofit selama 27 hari, kultivasi kapang endofit, ekstraksi, uji fitokimia, dan penentuan aktivitas daya hambat kapang
endofit terhadap enzim α-glukosidase. Diagram alir penelitian dapat dilihat pada Gambar 1 dan Gambar 2.
Gambar 1 Diagram alir penelitian Tahap 1 Tumbuhan sarang semut
Preparasi sampel ukuran 0.5x0.5 cm
Isolasi kapang endofit dalam media PDA selama 5-7 hari, 27-29°C
makroskopis
Seleksi kapang endofit (uji antagonisme) Karakterisasi kapang endofit
mikroskopis Isolat kapang endofit
Isolat kapang antagonis
Pemanenan media kultur Kultivasi isolat kapang antagonis selama 7 hari dengan
perlakuan shaking dan statis
Ekstraksi
Uji inhibitor enzim α-glukosidase (Tahap 1)
5
Gambar 2 Diagram alir penelitian Tahap 2 Preparasi sampel
Sampel yang digunakan adalah tumbuhan epifit sarang semut (Hydnophytum formicarum) yang diperoleh dari hutan bakau di pesisir Kecamatan Seget, Kabupaten Sorong, Papua Barat. Sampel dalam bentuk segar kemudian dikirim ke Bogor dan dipreparasi di Laboratorium Mikrobiologi Hasil Perairan.
Isolasi kapang endofit dari umbi tumbuhan pesisir sarang semut (Hydnophytum formicarum)
Teknik isolasi kapang endofit dari umbi tumbuhan sarang semut (Hydnophytum formicarum) dilakukan dengan metode langsung (direct innoculation) (Noverita et al. 2009). Sebelum dilakukan isolasi kapang endofit, terlebih dahulu dilakukan proses sterilisasi permukaan. Caranya adalah umbi tumbuhan sarang semut dicuci dengan air mengalir kemudian dipotong menjadi ukuran 0.5 cm x 0.5 cm. Potongan sampel disterilkan dengan cara dicelupkan dalam alkohol 70% selama 1 menit, kemudian dicuci dengan aquades steril ± 1 menit diulang dua kali. Potongan sampel yang sudah kering ditransfer dalam media kultur agar potato dextrose agar (PDA), lalu diinkubasi selama 5-7 hari
Pemanenan
Kultivasi dan optimasi isolat kapang terpilih
Ekstraksi
Penentuan kurva pertumbuhan
Miselium Media
kultur
Uji fitokimia
Alkaloid
Fenol Hidrokuinon Flavonoid
Uji inhibitor enzim α-glukosidase (Tahap 2)
Ekstrak Isolat kapang
terpilih
6
pada suhu ruang (27oC). Koloni yang mempunyai bentuk yang berbeda dengan koloni lainnya dapat dianggap sebagai isolat yang berbeda kemudian diisolasi sampai diperoleh isolat murni dengan cara sebagai berikut.Kapang endofit yang telah tumbuh pada media isolasi PDA kemudian dipindahkan ke dalam media PDA lainnya dengan cara mengambil sedikit hifa dengan ose dari setiap koloni endofit yang berbeda dan diinkubasi selama 5-7 hari pada suhu 27 oC hingga diperoleh isolat murni. Koloni yang berbeda bentuk maupun warna disubkultur lagi pada media PDA baru (Ramadhan 2011).
Karakterisasi isolat kapang endofit (Gandjar et al. 2000)
Isolat kapang endofit terseleksi kemudian dikarakterisasi secara makroskopis dan mikroskopis. Pengamatan koloni secara makroskopis dilakukan dengan cara pengamatan langsung berdasarkan ciri-ciri morfologi meliputi pengamatan warna permukaan dan tepian koloni, ada atau tidak adanya garis-garis radial serta lingkaran-lingkaran konsentris. Karakterisasi secara mikroskopis dilakukan dengan cara membuat preparat terlebih dahulu. Pembuatan preparat yaitu dengan membersihkan kaca obyek dan kaca penutup dengan mengunakan alkohol. Kemudian, satu tetes gliserol diteteskan di tengah kaca obyek. Sebanyak satu ose miselium kapang endofit diletakkan pada gliserol yang telah diteteskan di kaca obyek. Kaca penutup preparat kemudian diletakkan di atas kaca obyek sebagai penutup. Preparat lalu diamati dibawah mikroskop dengan perbesaran 40x10 meliputi pengamatan pada bentuk hifa, ada atau tidaknya septa serta bentuk konidia dan konidiofor dan dicocokkan dengan buku identifikasi kapang endofit menurut Gandjar et al. (2000).
Seleksi kapang endofit (Sudantha dan Abadi 2011)
Isolat kapang endofit yang telah diisolasi dari tumbuhan sarang semut dilakukan uji antagonisme untuk memperoleh kapang endofit terseleksi yang akan digunakan pada tahap penelitian selanjutnya. Uji antagonisme dilakukan dengan cara menumbuhkan beberapa buah kapang di dalam satu cawan petri yang diinkubasi di dalam suhu ruang. Pengamatan dilakukan terhadap pertumbuhan koloni kapang endofit dan adanya zona hambatan di antara koloni kapang endofit yang beroposisi. Kapang endofit yang menunjukkan daya hambatan terbesar terhadap pertumbuhan kapang lainnya adalah kapang endofit yang mampu beroposisi dan bertindak sebagai antagonis dan dipilih sebagai sampel untuk uji selanjutnya.
Kultivasi isolat kapang antagonis (Artanti et al. 2011)
7 Ekstraksi senyawa aktif media kultur kapang antagonis (Artanti et al. 2011) Produksi senyawa aktif dari kapang endofit diperoleh dari proses ekstraksi. Ekstraksi media kultur kapang hasil uji antagonisme dilakukan dengan metode maserasi. Metode maserasi digunakan untuk mengekstraksi sampel yang relatif mudah rusak oleh panas. Metode ini dilakukan dengan mencampur sampel dan pelarut etil asetat dengan perbandingan 1:1 kemudian dilakukan pengocokkan atau pengadukan selama 3x24 jam tanpa proses pemanasan. Proses pengocokan dilakukan sebanyak 3x24 jam dengan asumsi maserasi sudah tidak efektif mengekstraksi komponen aktif yang terkandung di dalam sampel. Pemisahan media kultur dan hasil ekstrak etil asetat dilakukan dengan corong pisah dan didiamkan beberapa saat sampai fase antara media kultur dan ekstrak etil asetat memisah dengan jelas.
Ekstrak yang diperoleh selanjutnya dipekatkan menggunakan rotary evaporator pada suhu 40oC. Suhu ini digunakan agar ekstrak tidak kehilangan senyawa aktif yang tidak tahan panas (Restasari 2008). Ekstrak media kultur yang diperoleh merupakan sampel yang akan digunakan pada uji tahap 1 enzim α-glukosidase.
Uji inhibitor enzim α-glukosidase tahap 1 (Sancheti et al. 2009)
Campuran reaksi dalam uji ini meliputi larutan kontrol blanko (B0), larutan blanko (B1), larutan kontrol sampel (S0) dan larutan sampel (S1). Persiapan larutan kontrol blanko (B0) dan blanko (B1) dilakukan dengan pembuatan substrat dengan cara melarutkan p-nitrofenil α-D-glukopiranosa dalam bufer fosfat 0.1 M pH 7.0 dan pembuatan larutan enzim α-glukosidase dengan cara melarutkan 1 mg α-glukosidase dalam 100 mL bufer fosfat (pH 7). Campuran reaksi blanko terdiri dari 10 µL larutan dimetil sulfoksida (DMSO), 50 µL bufer fosfat 0.1 M (pH 7.0), 25 µL p-nitrofenil α-D-glukopiranosa sebagai substrat, dan 25 µL larutan enzim α-glukosidase. Perbedaan antara blanko dan kontrol blanko, pada kontrol blanko tidak menggunakan enzim α-glukosidase. Campuran reaksi kemudian diinkubasi pada suhu 37°C selama 30 menit. Reaksi dihentikan oleh penambahan 100 µL larutan natrium karbonat 0.2 M, kemudian diukur pada panjang gelombang 400 nm dengan spektrofotometer.
Persiapan larutan kontrol sampel (S0) dan sampel (S1) dilakukan dengan melarutkan ekstrak kapang dalam bufer. Campuran reaksi sampel terdiri dari 10 µL ekstrak kapang, 50 µL bufer fosfat 0.1 M (pH 7.0), 25 µL p-nitrofenil α -D-glukopiranosa 0.5 mM sebagai substrat, dan 25 µL larutan enzim α-glukosidase. Perbedaan antara sampel dan kontrol sampel, pada kontrol sampel tidak menggunakan enzim α-glukosidase. Campuran reaksi kemudian diinkubasi pada suhu 37°C selama 30 menit. Reaksi dihentikan oleh penambahan 100 µ L larutan natrium karbonat 0.2 M. Absorban dari p-nitrofenol diukur pada panjang gelombang 400 nm dengan spektrofotometer. Sampel dilakukan dalam tiga ulangan.
8
Tabel 1 Reaksi inhibisi enzim α-glukosidase
B0 (µL) B1 (µL) S0 (µL) S1 (µL)
Pengujian daya hambat ekstrak terhadap aktivitas α -glukosidase dihitung dalam % inhibisi dengan rumus :
% inhibisi = – - x 100% Keterangan :
K = Absorbansi terkoreksi dari blanko (B1) dikurangi kontrol blanko (B0) S0 = Absorbansi terkoreksi dari kontrol sampel
S1 = Absorbansi terkoreksi dari sampel
Ekstrak media kultur kapang yang menunjukkan nilai inhibisi enzim α -glukosidase terbesar dijadikan sebagai kapang terpilih yang digunakan untuk uji selanjutnya.
Kultivasi dan Penentuan kurva pertumbuhan kapang endofit terpilih (Tarman 2011)
Isolat kapang terpilih hasil uji inhibitor enzim -glukosidase tahap 1 kemudian dikultivasi untuk menentukan kurva pertumbuhannya. Sebanyak 5% isolat kapang endofit diinokulasi ke dalam labu Erlenmeyer berisi 250 mL media PDB kemudian dikultivasi dalam keadaan statis pada suhu ruang selama 27 hari. Penentuan kurva pertumbuhan isolat kapang terpilih dilakukan dengan cara pengambilan sampel setiap 3 hari sekali untuk mengetahui pertumbuhan dari isolat kapang tersebut. Hasil fermentasi kapang disaring dan ditimbang biomassanya kemudian dibuat kurva pertumbuhan antara waktu pengambilan sampel dengan bobot biomassa.
Kultivasi dan optimasi kapang endofit terpilih
Kultivasi isolat kapang endofit dilakukan setelah diketahui waktu pertumbuhan kapang optimal. Kultivasi dilakukan dengan cara 5% isolat kapang diinokulasikan ke dalam labu Erlenmeyer 500 mL yang berisi medium cair PDB 250 mL kemudian diinkubasikan pada suhu 27°C sesuai dengan waktu optimasi yang dihasilkan pada penentuan kurva pertumbuhan.
Ekstraksi senyawa aktif media kultur dan miselium kapang endofit terpilih Ekstraksi kapang endofit terpilih meliputi ekstraksi media kultur (broth) dan ekstraksi miselium kapang endofit (Artanti et al. 2011). Ekstraksi media kultur menggunakan pelarut etil asetat yang dimaserasi selama 3x24 jam. Perbandingan antara media kultur dan etil asetat yaitu 1:1.
9 selalu baru dan dilakukan dengan alat khusus sehingga proses penyaringan terjadi secara kontinyu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik. Miselium yang telah disaring kemudian dikeringkan menggunakan freeze dryer dan diekstraksi dengan pelarut metanol. Sampel kering yang telah ditimbang kemudian dimasukkan ke dalam selongsong yang terbuat dari kertas saring. Selongsong kemudian dimasukkan ke dalam alat ekstraksi soxhlet dan diekstraksi hingga larutan berwarna jernih. Lama proses ekstraksi miselium 3-4 jam. Ekstrak yang diperoleh selanjutnya dipekatkan untuk mengetahui rendemen. Pemekatan dilakukan dengan menggunakan rotary evaporator pada suhu 40oC. Suhu ini digunakan agar ekstrak tidak kehilangan senyawa aktif yang tidak tahan panas (Restasari 2008). Hasil ekstrak media kultur dan miselium digunakan sebagai sampel untuk uji fitokimia dan uji inhibitor enzim α-glukosidase tahap 2.
Uji Fitokimia (Harborne1987)
Uji fitokimia pada ekstrak kapang endofit tumbuhan sarang semut yang dilakukan meliputi pemeriksaan senyawa alkaloid, flavonoid, dan fenol hidrokuinon.
1) Uji alkaloid
Sebanyak 0.05 gram sampel dilarutkan dalam 10 tetes asam sulfat 2 N kemudian disaring menggunakan kertas saring dan diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
Prinsip dari metode analisis ini adalah reaksi pengendapan yang terjadi karena adanya penggantian ligan.Atom nitrogen yang mempunyai pasangan elektron bebas pada alkaloid dapat mengganti ion iodo dalam pereaksi-pereaksi tersebut. Pereaksi Meyer mengandung merkuri klorida dan kalium iodida. Pereaksi Dragendorf mengandung kalium iodida dan bismuth subnitrat dalam asam asetat glasial. Pereaksi Wagner mengandung iod dan kalium iodida. Dalam pengujian ini yang terbentuk endapan adalah dengan pereaksi dragendorf. Diduga hal ini disebabkan oleh karena kandungan senyawa alkaloid yang sedikit pada sampel sehingga hanya satu pereaksi yang sensitif bereaksi terhadap sampel.
2) Uji flavonoid
Sebanyak 0.05 gram sampel ditambahkan serbuk magnesium 0,10 mg dan 0.40 mL amil alkohol dan 4 mL alkohol kemudian campuran dikocok. Warna merah, kuning atau jingga yang terbentuk pada lapisan amil alkohol menunjukkan adanya flavonoid. Penambahan serbuk magnesium dan asam klorida pada pengujian flavonoid akan menyebabkan tereduksinya senyawa flavonoid yang ada sehingga menimbulkan reaksi warna merah yang merupakan ciri adanya flavonoid pada sampel.
3) Uji fenol hidrokuinon
10
larutan FeCl3 5%. Warna hijau atau hijau biru yang terbentuk menunjukkan adanya senyawa fenol dalam bahan.
Uji inhibitor enzim α-glukosidase tahap 2 (Sancheti et al. 2009)
Metode yang dilakukan pada uji inhibitor enzim α-glukosidase tahap 2 sama dengan uji inhibitor enzim α-glukosidasetahap 1. Nilai konsentrasi sampel dan persen inhibisinya diplot masing-masing pada sumbu x dan y pada persamaan regresi logaritmik. Persamaan regresi linear yang diperoleh dalam bentuk persamaan y = a ln(x) + bx digunakan untuk mencari nilai Inhibitor Concentration 50% (IC
50) dari masing-masing sampel dengan menyatakan nilai y sebesar 50 dan nilai x yang akan diperoleh sebagai IC
50. Nilai IC50 menyatakan besarnya konsentrasi larutan sampel yang dibutuhkan untuk menghambat aktivitas enzim α-glukosidase sebesar 50%.
HASIL DAN PEMBAHASAN
Isolat dan Morfologi Kapang Endofit dari Tumbuhan Pesisir Sarang Semut (Hydnophytum formicarum)
Hal terpenting yang harus diperhatikan dalam melakukan proses isolasi kapang endofit yaitu proses sterilisasi permukaan. Sterilisasi permukaan sampel dilakukan untuk menghindari terjadinya kontaminasi mikroorganisme yang dapat tumbuh saat isolasi kapang endofit berlangsung. Pada penelitian ini digunakan larutan alkohol 70% sebagai desinfektan pada proses sterilisasi permukaan. Mekanisme kerja alkohol sebagai desinfektan yaitu dapat mendenaturasi protein dan melarutkan lemak pada membran protein mikroba sehingga dapat merusak sel mikroba kontaminan (Siswandono 1995).
11 Table 2 Isolat kapang endofit
Kode isolat
Pengamatan makroskopik
dan mikroskopik Ciri morfologi kapang endofit
1A Makroskopik
Warna miselium: merah
Permukaan miselium: tidak rata, menghasilkan eksudat berwarna merah dengan bentuk permukaan menyerupai serbuk-serbuk kasar berwarna hijau keabu-abuan. Koloni bagian bawah berwarna merah.
Mikroskopik
Pengamatan mikroskop dengan perbesaran 40x10 menunjukkan konidia berbentuk bulat saling menempel dan membentuk rantai. Pertumbuhan isolat ini terjadi saat 3 hari inkubasi, kemudian pada usia 7 hari menghasilkan eksudat berwarna merah. Isolat kapang diduga merupakan Penicillium sp.
1B Makroskopik
Warna miselium: abu-abu Permukaan isolat: seperti beludru, permukaan menggunung dan
Pengamatan di bawah mikroskop perbesaran 40x10 menunjukkan konidia berbentuk bulat dengan konidiofor pendek.
Waktu tumbuh isolat terlihat saat 3 hari inkubasi. Isolat diduga jenis
Aspergillus sp. konidia
12 Kode isolat
Pengamatan makroskopik dan
mikroskopik Ciri morfologi kapang endofit
2A Makroskopik
Warna miselium: putih Permukaan miselium: permukaan seperti kapas berwarna putih, hifa menyebar dengan tepian rata. Koloni bagian bawah berwarna putih namun terlihat ada bintik-bintik hitam kecil yang mengelilingi miselia.
Mikroskopik
Pengamatan di bawah mikroskop dengan perbesaran 40x10 menunjukkan konidiofor bercabang pendek.
Dalam waktu sehari pertumbuhan isolat mulai menyebar, setelah 3 hari inkubasi hifa mulai lebat. Isolat belum teridentifikasi.
2B Makroskopik
Warna miselium: putih
Permukaan miselium: tumbuh lebat dengan bentuk tepian rata. Koloni bagian bawah berwarna putih.
Mikroskopik
Pengamatan di bawah mikroskop dengan perbesaran 40x10 menunjukkan konidia berbentuk lonjong dengan konidiofor yang panjang.
Dalam waktu tumbuh sehari hifa sudah mulai menyebar dan lebat. Isolat belum teridentifikasi.
konidiofor
konidia
13 Kode
isolat
Pengamatan makroskopik dan
mikroskopik Ciri morfologi isolat kapang
3 Makroskopik
Warna miselium: bagian tengah berwarna cokelat dan dibagian tepih berwarna putih.
Permukaan miselium: miselia seperti kapas dan berwarna putih dengan tepian rata, menghasilkan pigmen warna cokelat kehitaman di dalam media agar.
Mikroskopik
Hasil pengamatan mikroskop perbesaran 40x10, terlihat bahwa konidiofor bersepta pendek dan konodia berbentuk bulat.
Dalam waktu tumbuh 1 hari, hifa mulai menyebar dan memenuhi cawan petri. Isolat belum
Permukaan miselium: isolat berbentuk serbuk berwarna cokelat keemasan dengan tepian tidak rata. Sebalik koloni berwarna kuning kecokelatan. Mikroskopik
Pengamatan di bawah mikroskop dengan perbesaran 40x10 menunjukkan konidia berbentuk semi bulat dan konidiofor kecil dan pendek.
Waktu tumbuh isolat selama 6 hari menunjukkan hifa mulai menyebar dan berwarna kuning. Isolat diduga jenis Aspergillus sp.
konidia konidiofor
konidia
14 Kode isolat
Pengamatan makroskopik
dan mikroskopik Ciri morfologi kapang endofit
6B Makroskopik
Warna miselium: putih
Permukaan miselium: bentuk seperti kapas dengan tepian yang rata, garis-garis lingkaran konsentris yang mengelilingi miselia hingga ke tepian terlihat dengan jelas. Koloni sebalik berwarna putih kekuningan.
Mikroskopik
Pengamatan di bawah mikroskop dengan perbesaran 40x10 menunjukkan konidiofor berbentuk panjang dan bersepta.
Pertumbuhan isolat sangat cepat, dalam waktu 1 hari hifa mulai menyebar dan lebat. Isolat belum teridentifikasi.
Pertumbuhan kapang dapat dilihat dari penampakannya yang berserabut seperti kapas yang mula-mula berwarna putih, tetapi jika spora timbul maka akan terbentuk berbagai warna tergantung dari jenis kapang tersebut (Fardiaz 1992). Setiap isolat memiliki ciri-ciri dan waktu tumbuh yang berbeda. Hasil penelitian menunjukkan waktu tumbuh isolat kapang ada yang kurang dari 5 hari dan ada yang lebih dari 5 hari. Menurut Ramadhan (2011) ciri-ciri koloni kapang yang dianggap kapang endofit yaitu memiliki waktu tumbuh lebih dari 5 hari, tumbuh di sekitar sampel umbi tumbuhan yang ditanam pada media PDA dan memiliki morfologi yang berbeda-beda. Pujiyanto dan Rejeki (2010) juga mempertegas bahwa mikroba endofit yang ditanam pada media agar memiliki waktu tumbuh 3-5 hari.
Kapang 1A diduga merupakan isolat kapang jenis Penicillium sp. Hal ini sesuai dengan ciri morfologi isolat kapang menurut Gandjar et al. (2006) bahwa
Penicillium purpurogenum memiliki permukaan seperti beludru kasar dengan tepian koloni yang rata, miselia berwarna putih atau merah muda, konidia lebat berwarna hijau keabu-abuan dan menghasilkan eksudat berwarna merah serta koloni bagian bawahnya berwarna merah tua hingga hitam. Mendez et al. (2011) berhasil memproduksi dan mendapatkan pigmen merah alami dari eksudat isolat kapang Penicillium purpurogenum yang berpotensi sebagai pewarna alami dalam industri makanan.
Kapang 1B dan 6A diduga merupakan isolat kapang jenis Aspergillus sp. Koloni isolat 1B memiliki permukaan seperti beludru berwarna abu-abu dengan tepian yang rata dan sebalik koloni berwarna hijau kehitam-hitaman. Hal ini sesuai dengan Gandjar et al. (2006) yang telah mengidentifikasi isolat kapang
15
Aspergillus fumigatus memiliki ciri-ciri berwarna hijau tua dengan konodiofor dan yang lebat. Konidia bulat hingga semibulat berwarna hijau. Koloni 6A memiliki isolat koloni dengan permukaan tidak rata berwarna cokelat keemasan menyerupai serbuk kasar dan sebalik koloni berwarna kuning kecokelatan. Sesuai dengan identifikasi Raper dan Fennel (1965) terhadap isolat Aspergillus unguis yang memiliki ciri-ciri berwarna kuning, saat fungi berumur tua koloni berubah menjadi warna kecokelatan serta bentuk permukaan koloni tidak rata. Isolat kapang 2A, 2B, 3 dan 6B merupakan jenis isolat yang belum teridentifikasi.
Hasil Seleksi Kapang Endofit
Uji seleksi kapang endofit dilakukan melalui uji antagonisme (Sudantha dan Abadi 2007). Uji antagonisme dilakukan untuk memperoleh kapang yang bertindak sebagai antagonis. Mekanisme antagonis pada mikroba dapat terjadi melalui tiga cara yaitu parasitisme secara langsung, antibiosis dengan menghasilkan metabolik sekunder yang bersifat toksin dan kompetisi dalam hal ruang dan kebutuhan nutrisi (Pradana et al. 2013).
Hasil uji antagonisme menunjukkan bahwa kapang 3 dan kapang 6B memiliki pertumbuhan yang lebih dominan daripada kapang lainnya (Gambar 3). Hasil uji antagonisme menunjukkan interaksi antara kapang 3 terhadap kapang 1A dan kapang 2B menunjukkan pola interaksi parasitisme, yaitu kapang 3 mampu tumbuh di atas koloni kapang 1A dan 2B (Gambar 3.A.iii). Kapang 3 juga menunjukkan pola interaksi kompetisi terhadap kapang 6A dan kapang 2B (Gambar 3.B.iv) serta kapang 6B dan 2A (Gambar 3.B.v), kompetisi yang terjadi adalah kompetisi ruang dan makanan artinya kapang 3 mampu mengambil ruang dan nutrisi yang tersedia dalam media dengan menghambat pertumbuhan kapang lainnya.
Kapang 6B memiliki pertumbuhan yang dominan terhadap kapang 1A dan 6A (Gambar 3.A.i). Kapang 6B mampu tumbuh di atas kapang 6A dan menghambat pertumbuhan kapang 6A, pola interaksi ini adalah parasitisme. Pola interaksi yang terbentuk antara kapang 6B dan 1A adalah antibiosis, dimana kapang 1A menghasilkan eksudat berwarna merah sebagai resisten diri selama proses uji anatagonisme berlangsung. Widyastuti (2008) menyatakan bahwa fungi dan mikroorganisme lain memproduksi substansi kimia yang dalam bentuk metabolit sekunder, enzim, toksin, senyawa organik maupun senyawa organik sebagai bentuk pertahanan diri dalam kompetisi. Hal ini juga dilaporkan oleh Sudantha dan Abadi (2007) bahwa isolat jamur endofit Trichoderma spp. dan
16
Gambar 3 Hasil uji antagonisme kapang pada umur 7 hari
Keragaman tingkat penghambatan kapang 3 dan kapang 6B terhadap kapang lainnya diduga erat kaitannya dengan kemampuan dari kapang 3 dan kapang 6B berkompetisi dengan kapang lain terutama sebagai mikoparasit dan kecepatan tumbuh. Widyastuti (2007) juga mempertegas bahwa kemampuan mikoparasit merupakan kemampuan mikroba memproduksi enzim ekstraseluler untuk merusak dinding sel fungi lain yang kemudian digunakan sebagai sumber makanan. Kejadian seperti ini dilaporkan oleh Papavizas (1985) dalam Sudantha dan Abadi (2007), bahwa mekanisme mikoparasitisme dimulai dengan pelunakan sel inang jamur lainnya oleh enzim yang dihasilkan oleh mikoparasit
Trichoderma sebelum kerusakan dan kematian sel inang jamur lainnya. Ismed et al. (2011) melaporkan bahwa Trichoderma hamatum memproduksi enzim
17 glukanase dan kitinase yang dapat menyebabkan eksolisis hifa inang.
Trichoderma harzianum strain 1295-22 juga menghasilkan antibiotik volatil yang mampu mengurangi pertumbuhan miselium Rhizoctonia solani.
Kapang endofit yang lebih dominan terhadap pertumbuhan kapang endofit lain adalah kapang endofit yang bertindak sebagai antagonis. Hasil seleksi antagonisme menunjukkan kapang 3 dan 6B bersifat antagonis terhadap kapang lain selanjutnya untuk menyeleksi kapang terpilih dilakukan uji pendahuluan penghambatan enzim α-glukosidase Tahap 1.
Ekstrak Media Kultur Kapang 3 dan Kapang 6B
Ekstraksi adalah metode pemisahan suatu komponen cair dari campurannya menggunakan sejumlah massa pelarut sebagai tenaga pemisah. Beberapa faktor yang berpengaruh dalam proses ekstraksi adalah temperatur, waktu kontak, perbandingan solute, faktor ukuran partikel, pengadukan dan waktu dekantasi (Yasita dan Intan 2009). Sampel yang diekstrak yaitu media kultur kapang 3 dan kapang 6B hasil pemanenan dengan masa inkubasi 7 hari dengan perlakuan shaking dan statis. Ekstraksi media kultur kapang 3 dan kapang 6B dilakukan dengan maserasi menggunakan etil asetat sebagai pelarut.
Kelebihan metode maserasi adalah relatif sederhana, yaitu tidak memerlukan alat-alat yang rumit, relatif mudah, murah dan dapat menghindari rusaknya komponen senyawa akibat panas (Meloan 1999). Etil asetat digunakan karena memiliki polaritas sedang (semi polar) sehingga mampu melarutkan senyawa-senyawa yang bersifat polar maupun non polar. Selain itu, etil asetat tidak bercampur dengan media kultur sehingga mudah dipisahkan dengan media kultur (Nursid 2010). Semua filtrat yang diperoleh dari hasil ekstraksi kemudian diuapkan menggunakan rotary evaporator sehingga diperoleh rendemen ekstrak kental etil asetat kapang 3 dan kapang 6B.
Hasil evaporasi dari ekstrak media kultur kapang 3 dan kapang 6B dengan pelarut etil asetat menghasilkan sifat yang berbeda. Ekstrak etil asetat kapang 3 berwarna cokelat kehitaman dan berbentuk pasta dengan tekstur kasar, sedangkan ekstrak etil asetat kapang 6B berwarna kuning kecokelatan dan berbentuk pasta dengan tekstur keras. Perbedaan rendemen disebabkan kemampuan pelarut dalam proses ektraksi untuk memperoleh zat aktif dalam sampel, dan kelarutan zat aktif dalam pelarut yang berbeda (Adewole et al.
2006). Nilai rendemen (% b/v) ekstrak etil asetat kapang 3 dan kapang 6B dapat dilihat pada Tabel 3.
Tabel 3 Nilai rendemen ekstrak etil asetat kapang 3 dan kapang 6B
Jenis sampel Rata-rata rendemen
(% b/v)* Ekstrak media kultur kapang 3 Shaking 9.5
Ekstrak media kultur kapang 3 Statis 7.83
Ekstrak media kultur kapang 6B Shaking 8.5
18
Nilai rendemen ektrak etil asetat kapang 3 dan kapang 6B dengan perlakuan shaking dan statis menghasilkan nilai rata-rata rendemen yang berbeda-beda. Nilai rendemen ekstrak dengan perlakuan shaking (keadaan goyang) menghasilkan nilai lebih besar daripada rendemen ekstrak dengan perlakuan statis (tidak digoyang). Adewole et al. (2006) menyatakan bahwa perbedaan rendemen disebabkan kemampuan pelarut dalam proses ektraksi untuk memperoleh zat aktif dalam sampel, dan kelarutan zat aktif dalam pelarut. Rendemen ekstrak yang diperoleh dipengaruhi oleh kondisi alamiah senyawa aktif pada bahan, metode ekstraksi, waktu ekstraksi, ukuran partikel sampel, serta pelarut sampel (Harborne 1987). Hasil ekstrak etil asetat kapang 3 dan kapang 6B digunakan sebagai sampel pada uji inhibitor enzim α-glukosidase tahap 1.
Aktivitas Inhibitor Ekstrak Media Kultur Kapang 3 dan Kapang 6B terhadap Enzim α-Glukosidase (Uji Tahap 1)
Alfa glukosidase merupakan enzim yang berfungsi memecah karbohidrat menjadi glukosa dan monosakarida lainnya di dalam saluran pencernaan manusia (Kim et al. 2008). Senyawa yang dapat menghambat aktivitas enzim tersebut menunjukkan indikasi sebagai inhibitor enzim α-glukosidase. Penelitian
uji daya hambat aktivitas α-glukosidase secara in vitro ini menggunakan ρ -nitrofenil-α-D-glukopiranosida sebagai substrat.
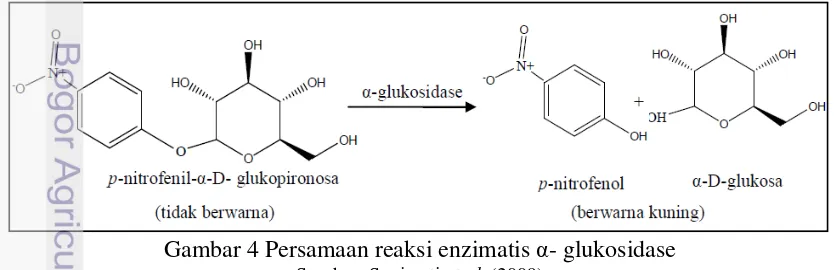
Prinsip pengujian penghambatan α-glukosidase adalah terjadinya perubahan warna substrat yang berubah menjadi warna produk. Menurut Sugiwati et al. (2009) daya hambat terhadap aktivitas α-glukosidase dipelajari secara pseudo-substrat dengan mengetahui kemampuan sampel untuk menghambat reaksi hidrolisis glukosa pada substrat p nitrofenil-α-D glukopiranosida sehingga substrat akan terhidrolisis menjadi α-D-glukosa dan p
nitrofenol yang berwarna kuning (Gambar 4). Hasil hidrolisis tersebut dapat diukur absorbansinya dengan spektofotometer UV-Vis. Rahman et al. (2011)
menyatakan bahwa semakin besar kemampuan inhibitor untuk menghambat maka produk yang dihasilkan semakin sedikit atau warna larutan setelah inkubasi lebih cerah dibandingkan dengan larutan tanpa inhibitor.
Gambar 4 Persamaan reaksi enzimatis α- glukosidase Sumber: Sugiwati et al. (2009)
19 Penelitian pendahuluan ini mengacu pada Artanti et al. (2011) yang melakukan pengujian ekstrak kapang endofit terhadap aktivitas enzim α-glukosidase dengan masa inkubasi 7 hari. Ekstrak diuji pada konsentrasi 625 ppm; 1250 ppm; 2500 ppm; 5000 ppm dan 10000 ppm. Aktivitas penghambatan ekstrak media kultur
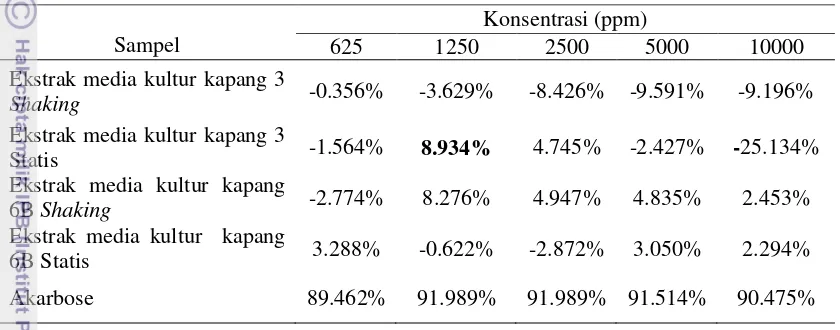
kapang 3 dan 6B terhadap enzim α-glukosidase dapat dilihat pada Tabel 4. Tabel 4 Penghambatan ekstrak kapang 3 dan 6B terhadap aktivitas enzim α
-glukosidase pada kondisi statis dan shaking dengan masa inkubasi 7 hari
Sampel
Ekstrak media kultur kapang
6B Shaking -2.774% 8.276% 4.947% 4.835% 2.453%
Ekstrak media kultur kapang
6B Statis 3.288% -0.622% -2.872% 3.050% 2.294%
Akarbose 89.462% 91.989% 91.989% 91.514% 90.475%
Hasil uji tahap 1 menunjukkan bahwa secara umum ekstrak media kultur kapang 3 dan 6B yang diinkubasi selama 7 hari pada kondisi shaking (digoyang) dan statis (tidak digoyang) tidak menunjukkan adanya aktivitas penghambatan
enzim α-glukosidase (Tabel 4). Namun, pada beberapa sampel dengan konsentrasi tertentu menunjukkan aktivitas penghambatan enzim α-glukosidase . Ekstrak media kultur kapang 3 dengan perlakuan statis dengan konsentrasi 1250 ppm dan 2500 ppm menunjukkan nilai inhibisi adalah sebesar 8.943% dan 4.745%. Ekstrak media kultur kapang 6B dengan perlakuan shaking pada konsentrasi 1250 ppm, 2500 ppm, 5000 ppm dan 10000 ppm berturut-turut menunjukkan nilai inhibisi adalah sebesar 8.276%, 4.947%, 4.835% dan 2.453%. ekstrak media kultur kapang 6B dengan perlakukan statis dengan pada konsentrasi 625 ppm, 5000 ppm dan 10000 ppm berturut-turut adalah sebesar 3.288%, 3.050% dan 2.294%. Hal ini diduga saat dipanen pada hari ke-7 kedua kapang belum menghasilkan metabolit sekunder yang mampu menghambat aktivitas enzim α-glukosidase.
Menurut Powthong et al. (2012), beberapa faktor yang mempengaruhi keberadaan senyawa bioaktif dari suatu kapang endofit saat kultivasi yaitu, tingkat inokulum, pemilihan medium kultur, periode inkubasi dan pelarut yang digunakan untuk ekstraksi. Penelitian Artanti et al. (2011) menunjukkan bahwa ekstrak media kultur kapang yang diiisolasi dari tumbuhan Taxus sumatrana
memiliki penghambatan aktivitas enzim α-glukosidase pada 2 jenis kapang yaitu sebesar 18.2% dan 18.6%. Sathiyaseelan dan Stella (2012) juga melaporkan bahwa ekstrak media kultur isolat Actinomycetes sp. yang diinkubasi selama 7 hari menunjukkan dari 8 isolat Actinomycetes sp, hanya 1 jenis yang menunjukkan aktivitas penghambatan enzim α–glucosidase yang signifikan.
20
kapang 3 merupakan isolat kapang yang akan digunakan sebagai sampel dalam pengujian selanjutnya.
Pertumbuhan Kapang 3
Pengukuran pH dilakukan untuk mengetahui perubahan suasana pH media yang telah ditumbuhi kapang selama proses fermentasi. Hasil pengamatan selama proses fermentasi, nilai pH media kultur kapang 3 turun dari 5 menjadi 4 selama 27 hari masa inkubasi. Nilai pH media kultur dari hari ke-0 sampai hari ke-12 sebesar 5. Nilai pH kemudian mengalami penurunan pada hari ke-15 sampai hari ke-27 yaitu 4. Perubahan pH yang terjadi menunjukkan terjadinya pertumbuhan kapang dan menghasilkan suatu senyawa yang bersifat asam atau basa. Gandjar et al. (2006) menyatakan bahwa pada umumnya kapang hidup pada lingkungan dengan nilai pH di bawah 7. Kondisi pH suatu media mempengaruhi pertumbuhan kapang, karena beberapa enzim tertentu hanya aktif sesuai dengan pH substrat tertentu. Srikandace et al. (2007) mengemukakan bahwa perubahan pH pada media fermentasi disebabkan oleh aktivitas metabolisme isolat kapang.
Kurva pertumbuhan kapang menunjukkan bahwa waktu mempunyai hubungan yang erat dengan fase pertumbuhan kapang (Srikandace et al. 2007). Produksi metabolit sekunder pada kapang endofit berfluktuasi dan berhubungan dengan tahap pertumbuhannya. Metabolit sekunder dari kapang dapat dipanen pada fase stasioner dari pertumbuhan kapang (Gandjar et al. 2006). Penentuan kurva pertumbuhan kapang endofit diperoleh dari menimbang biomassa kering kapang. Hal ini dilakukan untuk mengetahui waktu yang tepat untuk panen atau waktu kapang tersebut menghasilkan sel paling banyak (Wuryanti 2008).
Kapang 3 diduga mengalami fase adaptasi pada hari ke-0 sampai hari ke-3 yaitu kapang melakukan adaptasi dengan media dan lingkungannya. Jumlah awal sel yang dipindah ke media baru mempengaruhi cepat lambatnya proses adaptasi. Wuryanti (2008) mengemukakan bahwa jika media dan lingkungan
21 pertumbuhan sama dengan media sebelumnya, mungkin tidak perlu waktu adaptasi.
Kapang diduga mengalami fase eksponensial dari hari ke-12 sampai hari ke-15, hal ini dapat dilihat pada peningkatan jumlah biomassa sel kapang yang banyak. Kapang mengalami fase deselerasi pada hari ke-15 sampai hari ke-18, hal ini dapat dilihat dari biomassa sel kapang yang mengalami peningkatan sel yang relatif sedikit. Fase deselerasi kapang ditandai dengan pertumbuhan sel-sel kapang yang mulai menurun.
Kapang 3 memiliki fase stasioner pada hari ke-21 sampai hari ke-24 (Gambar 5). Fase stasioner dimulai ketika biomassa sel kapang tidak lagi menunjukkan pertambahan jumlah yang signifikan. Jumlah biomassa tertinggi dihasilkan pada hari ke-21 sehingga ditentukan bahwa hari optimasi panen kapang 3 berada pada hari ke-21. Penelitian Simanjuntak et al. (2002) membuktikan bahwa produk metabolit sekunder mulai dihasilkan kapang dengan intensitas terbesar pada akhir fase eksponensial atau awal fase stasioner (saat beberapa sumber nutrisi mulai terbatas) hingga akhir fase kematian. Menurut Gandjar et al. (2006), fase stasioner kapang, yaitu banyaknya jumlah sel yang bertambah sama dengan banyaknya jumlah sel yang mati. Penurunan kecepatan tumbuh terjadi karena keterbatasan unsur-unsur pertumbuhan setelah digunakan pada fase sebelumnya. Srikandace et al. (2007) menyatakan bahwa keterbatasan sumber utama sintesis tersebut antara lain gula sebagai sumber karbon dan protein sebagai sumber asam amino atau nitrogen. Hal ini dapat menyebabkan terjadinya pelepasan zat-zat hasil proses katabolisme yang merupakan metabolit sekunder.
Melewati hari ke-24, kapang memasuki fase kematian, jumlah sel kapang semakin berkurang dan tidak ada penambahan jumlah sel kapang. Hal ini terjadi karena nutrisi dalam media serta cadangan makanan di dalam sel telah habis.
Ekstrak Media Kultur dan Ekstrak Miselium Kapang 3
Ekstraksi yang dilakukan adalah proses ekstraksi media kultur menggunakan pelarut etil asetat (semi polar) dan ekstraksi miselium kapang menggunakan pelarut metanol (polar). Pelarut etil asetat digunakan karena memiliki polaritas sedang sehingga mampu melarutkan senyawa aktif yang bersifat polar maupun nonpolar. Pelarut metanol merupakan pelarut polar yang bersifat multipolar pelarut yang dapat melarutkan hampir semua senyawa organik, baik polar, semi polar, dan non polar sehingga mudah diuapkan (Putri et al. 2010). Menurut Borges et al. (2006), senyawa penghambat α-glukosidase pada umumnya adalah senyawa semi polar hingga polar yang memiliki ikatan glikosida pada strukturnya.
Ekstrak dari kedua sampel memiliki warna yang sama yaitu cokelat kehitam-hitaman dan berbentuk pasta yang diduga mengandung metabolit sekunder (Gambar 6). Nilai rendemen (% b/v) ekstrak kasar media kultur kapang 3
22
berpolaritas sesuai dengan pelarutnya, sehingga jenis pelarut yang digunakan dapat mempengaruhi jumlah rendemen yang dihasilkan.
Gambar 6 Ekstrak kasar kapang 3, a) ekstrak etil asetat, b) ekstrak metanol
Aktivitas Inhibitor Ekstrak Media Kultur dan Ekstrak Miselium Kapang 3 terhadap Enzim α-Glukosidase (Uji Tahap 2)
Uji tahap 2 dilakukan untuk menentukan aktivitas ekstrak media kultur dan miselium kapang 3 sebagai isolat terpilih dalam menghambat enzim α -glukosidase. Aktivitas penghambatan ekstrak media kultur dan ekstrak miselium kapang 3 dapat dilihat pada Tabel 5.
Tabel 5 Penghambatan ekstrak media kultur dan ekstrak miselium kapang 3
terhadap aktivitas enzim α-glukosidase dengan masa inkubasi 21 hari
Konsentrasi sampel (ppm)
% inhibisi ekstrak media kultur
% inhibisi ekstrak miselium
1250 14.54 9.083
5000 43.68 31.22
10000 60.69 38.06
15000 67.19 42.22
20000 72.63 42.55
Daya inhibisi ekstrak kapang 3 terhadap enzim α-glukosidase pada berbagai konsentrasi menghasilkan nilai yang berbeda-beda. Perbedaan ini terjadi karena adanya perbedaan distribusi metabolit sekunder yang dapat
menghambat aktivitas α-glukosidase (Purwatresna 2012). Nilai inhibisi enzim α -glukosidase tertinggi ditunjukkan oleh ekstrak media kultur kapang 3 pada konsentrasi 20000 ppm dengan nilai inhibisi sebesar 72.63%, sedangkan nilai inhibisi ekstrak miselium kapang 3 pada konsentrasi yang sama menunjukkan nilai inhibisi sebesar 42.55% (Tabel 5). Hal ini dikarenakan zat terlarut yang memiliki aktivitas penghambatan α-glukosidase lebih banyak pada ekstrak media dibandingkan dengan ekstrak miselium. Hal ini sesuai dengan Srikandace
et al. (2007), selama kapang dikultivasi, hasil metabolisme kapang banyak dilepas ke dalam media cair, termasuk metabolit sekunder yang dihasilkan.
Ekstrak media kultur yang diekstraksi menggunakan pelarut etil asetat
(semi polar) memiliki penghambatan terhadap aktivitas enzim α-glukosidase lebih tinggi dibandingkan dengan ekstrak miselium yang diekstraksi
23 menggunakan pelarut metanol (polar). Sesuai dengan penelitian Dewi et al.
(2007) bahwa ekstrak etil asetat (pelarut semipolar) kapang Aspergillus terreus
menunjukkan nilai inhibisi enzim α-glukosidase paling tinggi dibandingkan dengan ekstrak pelarut (polar dan nonpolar) lainnya. Ramdanis (2012) juga mengemukakan bahwa hasil uji penghambatan aktivitas α-glukosidase pada ekstrak etil asetat kapang endofit biji mahoni dengan konsentrasi 1000µg/mL menunjukkan potensi penghambatan lebih besar dibandingkan dengan ekstrak air dan metanol. Borges et al. (2006) mengemukakan karena pada umumnya senyawa penghambat enzim α-glukosidase adalah senyawa mirip gula yang bersifat semi polar hingga polar.
Salah satu jenis obat sintetik sebagai antidiabetes adalah akarbose yang dapat mengurangi kadar gula dengan mengintervensi penyerapan sari pati dalam usus (Lehninger 2004). Akarbose merupakan obat golongan inhibitor α -glukosidase yang dipasarkan dengan nama komersial Glukobay. Pengujian inhibisi akarbose dilakukan sebagai kontrol positif. Hasil pengujian akarbose dapat dilihat pada Tabel 6.
Tabel 6 Penghambatan akarbose terhadap aktivitas enzim α-glukosidase
Konsentrasi sampel
Nilai inhibisi akarbose yang dihasilkan pada konsentrasi 10 ppm adalah 92.93%. Jika dibandingkan, nilai inhibisi sampel pada konsentrasi 20000 ppm lebih kecil dibandingkan dengan nilai inhibisi akarbose pada konsentrasi 10 ppm hal ini karena yang diuji adalah hanya supernantan saja, bukan senyawa murni. Hirsh et al. (1997) melaporkan penggunaan 0.1 mg/ml akarbose pada tikus dapat menurunkan absorbsi glukosa sebesar 20%.
Nilai IC50 dapat didefinisikan sebagai besarnya konsentrasi yang dapat menghambat aktivitas enzim α-glukosidase, yaitu menghambat aktivitas enzim
α-glukosidase sebanyak 50%. Nilai IC50 untuk aktivitas enzim α-glukosidase pada ekstrak media sebesar 6593 ppm, nilai IC50 pada ekstrak miselium sebesar 29020 ppm sedangkan nilai IC50 pada akarbose sebesar 0.7505 ppm. Hasil ini membuktikan bahwa ekstrak media kultur memiliki aktivitas penghambatan lebih baik daripada ekstrak miselium, namun memiliki aktivitas penghambatan yang lebih kecil jika dibandingkan dengan akarbose. Penelitian terdahulu menunjukkan bahwa ekstrak dari isolat kapang endofit memiliki aktivitas penghambatan enzim α-glukosidase dengan IC50 8.6 µg/mL (Dewi et al. 2007), 28.40 µg/mL (Ramadhan 2011) dan 73.64 µg/mL (Ramdanis 2012).
Hasil penelitian ini menunjukkan bahwa ekstrak media maupun miselium tidak mempunyai potensi yang baik sebagai inhibitor enzim α-glukosidase karena IC
50 yang dihasilkan lebih dari 50 ppm. Menurut Zulhipri et al. (2007) bahwa bila suatu sampel memiliki nilai IC50 lebih kecil dari 50 ppm, maka
24
Enzim memiliki sisi aktif yang dapat mengenali secara spesifik substrat yang sesuai, sehingga memungkinkan untuk merancang inhibitor enzim yang dapat menghalangi pengikatan substrat pada enzim. Ada dua jenis utama penghambat enzim, yaitu yang bekerja secara tidak dapat balik (irreversible) dan dapat balik (reversible). Jenis inhibisi enzim oleh inhibitor secara reversible terdiri dari dua jenis, yakni kompetitif dan nonkompetitif. Inhibisi reversible kompetitif terjadi jika inhibitor berkompetisi dengan substrat untuk berikatan dengan sisi aktif enzim. Inhibisi reversible nonkompetitif terjadi jika inhibitor tidak berikatan pada sisi aktif enzim dan mengubah konformasi molekul enzim sehingga menurunkan aktivitas katalitik enzim (Lehninger 2004).
Mekanisme kerja inhibisi dari ekstrak media kultur dan miselium kapang 3 terhadap enzim α-glukosidase yang berperan sebagai penghambat belum diketahui secara pasti. Menurut Lehninger (2004) apabila ingin mengetahui mekanisme inhibisi dari suatu inhibitor maka perlu dilakukan pemetaan kebalikan ganda data kecepatan enzim. Liu et al. (2006) menyatakan bahwa mekanisme inhibitor terhadap kerja enzim α-glukosidase yaitu dengan mengikat enzim tersebut secara reversible kompetitif. Jenis inhibisi kompetitif bersifat kompetisi antara substrat dengan inhibitor.Inhibitor dengan struktur yang mirip dengan substrat normal berkompetisi dengan substrat normal untuk berikatan pada sisi aktif dari enzim.
Komponen Aktif Ekstrak Media Kultur dan Ekstrak Miselium Kapang 3
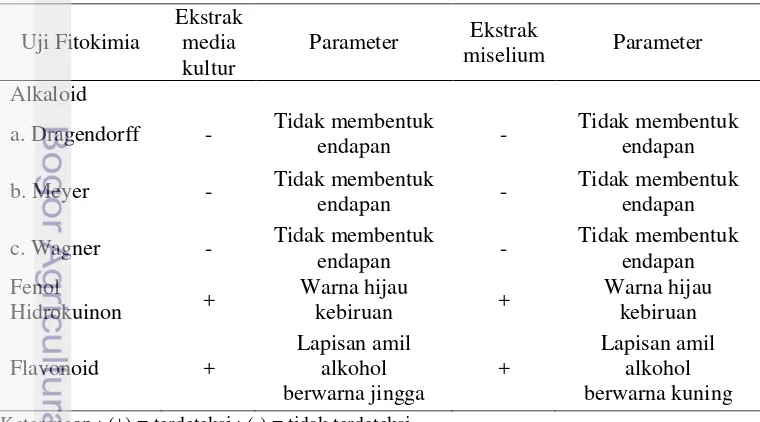
Komponen aktif merupakan kelompok senyawa fungsional yang terkandung dalam bahan pangan dan dapat memberikan pengaruh biologis (Kannan et al. 2009). Penapisan komponen aktif ini dilakukan dengan metode uji fitokimia yang meliputi alkaloid, flavonoid dan fenol hidrokuinon. Uji fitokimia dilakukan terhadap ekstrak media kultur dan miselium kapang 3 (Tabel 6).
Table 7 Komponen aktif ekstrak media kultur dan miselium kapang 3
Keterangan : (+) = terdeteksi ; (-) = tidak terdeteksi
a. Dragendorff - Tidak membentuk
25 Berbagai penelitian menyebutkan senyawa flavonoid berperan sebagai antidiabetes. Flavonoid merupakan senyawa polar karena memiliki gugus hidroksil yang tidak tersubstitusi. Oleh karena itu pelarut seperti etanol, metanol, etil asetat dapat digunakan untuk mengekstrak flavonoid dari jaringan tumbuhan (Markham 1988). Flavonoid dapat dikelompokkan menjadi 9 kelas, yaitu anthosianin, proanthosianidin, flavonol, flavon, glikoflavon, biflavonil, chlacone
dan aurone, flavanon, serta isoflavon. Flavonoid umumnya terdapat dalam jaringan tumbuhan terikat pada gula sebagai glikosida dan aglikon flavonoid (Harborne 1987). Lukacinova et al. (2008) melaporkan bahwa senyawa golongan flavonol dan flavon menunjukkan sifat antidiabetes pada uji in vivo
pada tikus seperti kuersetin dan krisin. Fawzy et al. (2008) juga menyatakan bahwa senyawa aktif kuersetin dan kempferol dari tanaman Cynanchum acutum
memiliki aktivitas antidiabetes yang dapat menurunkan gula darah. Hasil penelitian Ramdanis (2012) menunjukkan bahwa ekstrak etil asetat dari isolat kapang endofit dari biji mahoni mengandung flavonoid. Berdasarkan penelitian Hartika (2009) menyatakan bahwa ekstrak flavonoid buah mahkota dewa dengan konsentrasi 1% (b/v) mampu menginhibisi aktivitas enzim α-glukosidase sebesar 23,06-40,26%.
Hasil uji fitokimia menunjukkan bahwa ekstrak media kultur dan ekstrak miselium mengandung fenol (Tabel 7). Fenol merupakan struktur aromatik yang memiliki ikatan satu atau lebih gugus hidroksil. Umumnya mudah larut dalam air karena sering berikatan dengan gula sebagai glikosida dan biasanya terdapat dalam vakuola sel (Harborne 1987). Hasil penelitian Rahman (2011) menunjukkan bahwa polisakarida ekstraseluler Porphyridium cruentum mengandung komponen fenol
hidrokuinon, yang mempunyai aktivitas antihiperglikemik dengan nilai inhibisi α -glukosidase 71.57%. Ekstrak etanol sarang semut memiliki kandungan fenol hidrokuinon (Engida et al. 2013).
SIMPULAN DAN SARAN
Simpulan
Isolat kapang endofit yang diperoleh dari tumbuhan pesisir sarang semut
Hydnophytum formicarum yaitu isolat 1A,1B, 2A, 2B, 3, 6A dan 6B dengan karakterisasi yang berbeda. Kapang 3 merupakan isolat kapang terpilih sebagai kapang antagonis. Nilai inhibisi enzim α-glukosidase tahap 1 pada ekstrak media kultur kapang 3 dan 6B yang diinkubasi selama 7 hari dengan keadaan shaking
dan statis tidak memiliki nilai inhibisi yang baik. Biomassa kapang paling banyak diproduksi pada hari ke-21. Nilai inhibisi terbesar enzim α-glukosidase pada tahap 2 adalah ekstrak media kultur kapang 3 pada konsentrasi 20000 ppm yaitu sebesar 72.63% dengan IC50 sebesar 6593 ppm, sedangkan nilai inhibisi ekstrak miselium kapang 3 pada konsentrasi yang sama memiliki nilai inhibisi sebesar 42.55% dengan IC50 29020 ppm. Kandungan flavonoid dan fenol
26
bahwa ekstrak kapang endofit 3 ini berpotensi namun perlu dikembangkan lebih lanjut sebagai sumber bahan baru penghasil inhibitor α-glukosidase.
Saran
Saran untuk penelitian selanjutnya yaitu perlu dilakukan pengembangan potensi kapang endofit sebagai sumber bahan baru penghasil inhibitor α -glukosidase dengan cara menentukan masa inkubasi dan metode ekstraksi terbaik. Selain itu, perlu dilakukan identifikasi jenis kapang endofit yang berhasil diisolasi dari tumbuhan sarang semut, analisis untuk menentukan senyawa aktif lain yang berperan dalam menginhibisi kerja enzim α-glukosidase serat pengujian aktivitas antihiperglikemik secara in vivo.
DAFTAR PUSTAKA
[DEPKES RI] Departemen Kesehatan Republik Indonesia. 2005.
Pharmaceutical Care untuk Penyakit Diabetes Melitus. Jakarta (ID): Direktorat Bina farmasi Komunitas dan Klinik Dirjen Bina Kefarmasian dan Alat Kesehatan Departemen Kesehatan RI.
Adewole SO, Ezkiel A, Martins C. 2006. Morphological changes an hypoglycemic effects of Annona muricata linn. (Annonaceae) leaf aqueous
extract on pancreatic β-cells of streptozotocin-treated diabetic rats. African Journal of Biomedical Research. 9: 173-187.
Artanti N, Tachibana S, Kardono LBS, Sukiman H. 2011. Screening of
endophytic fungi having ability for antioxidant and α-glukosidase inhibitor activities isolated from Taxus sumatrana. Pakistan Journal of Biological Sciences. 14(22): 1019-1023.
Borges de ME, Gomes AS, Carvalho I. 2006. α- and β- glucosidase inhibitors: chemical structure and biological activity. Tetrahedron 62: 10277-10302. Corwin EJ. 1996. Patofisiologi: Buku Saku. Jakarta (ID): EGC.
Darsono P. 1999. Pemanfaatan sumber daya laut dan implikasinya bagi masyarakat nelayan. Oseana. 24(4): 1 – 9.
Engida AM, Kasim NS, Tsigie YA, Ismadji S. 2013. Extraction, identification and quantitative HPLC analysis of flavonoids from sarang semut (Myrmecodia pendan). Industrial Crops and Products. 41: 392-396.
Fawzy GA, Abdallah HM, Marzouk MS, Soliman FM, Sleem AA. 2008. Antidiabetic and antioxidant activities of major flavonoids of Cynanchum acutum L. (Asclepiadaceae) growing in Egypt. Z.Naturforsch. 63: 658-662. Fardiaz S. 1992. Mikrobiologi Pangan I. Jakarta (ID): Gramedia Pustaka Utama. Gandjar I, Samson RA, Vermeulen, Oetari A, Santoso I. 2000. Pengenalan
Kapang Tropik Umum. Jakarta (ID): Yayasan Obor Indonesia.
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Yayasan Obor Indonesia.
27 Hartika R. 2009. Aktivitas inhibisi α-glukosidase ekstrak senyawa golongan flavonoid buah mahkota dewa. [Skripsi]. Bogor (ID): Institut Pertanian Bogor. Hirsh AJ, Yao SY, Young DJ, Cheeseman CI. 1997 Inhibition of glucose
absorption in the rat jejunum: A novel action of alpha-D-glucosidase inhibitors. Gastroenterology. 113:205-211.
Ingavat N, Dobereiner J, Wijayakrutta S, Mahidol C, Ruchirawat S, Kittakoop P.
2009. Aspergillusool A, an α-glukosidase inhibitor from marine-derived fungus Aspergillus aculeatus. Journal of Natural Products. 72: 2049-2052.
Ismed S B, Mariana, Fachruzi I. 2011. Formulasi biopestisida berbahan aktif jamur endofitik dan bakteri rhizosfir spesifik lokasi lahan pasang surut untuk pengendalian penyakit busuk pangkal batang padi (Rhizoctonia solani). Seminar Nasional Pestisida Nabat.i 4: 71-82.
Kannan A, Hetttiarachchy N, Narayan S. 2009. Colon and breast anti-cancer effects of peptide hydrolysates derivates from rice bran. The Open Bioactive Compounds Journal. 2: 17-20.
Kim KY, Nam KA, Kurihara H, Kim SM. 2008. Potent α-glukosidase inhibitors purified from the red alga Grateloupia elliptica. Phytochemistry. 69(16): 2820-2825.
Kumala S, Agustina E, Wahyudi P. 2006. Uji aktivitas antimikroba metabolit sekunder kapang endofit tanaman trengguli (Cassia futula l). Jurnal Bahan Alam Indonesia. 6(2): 46-48.
Lehninger AL, David LN, Michael MC. 2004. Biochemistry. Indiana: WH Freeman.
Liu Y, Zou L, Lin M, Wen-Hua Chen, Bo Wang. 2006. Synthesis and pharmacological activities of xanthone derivatives as alpha-glucosidase inhibitors. Bioorganics and MedicalChemistry. 14: 5683-5690.
Lukacinova A, Mojzis J, Benacka R, Keller J, Maguth T, Kurila P, Vasko L, Racz O, Nistiar F. 2008. Preventive effects of flavonoids on alloxan-induced diabetes mellitus in rats. JournalActa VeterinariaBrno. 77 : 175-182.
Madan M, Thind KS. 1998. Physiology of Fungi. India: New Apcon.
Markham KR. 1988. Cara mengidentifikasi Flavonoid. Padmawinata K, penerjemah. Bandung (ID): Institut Teknologi Bandung. Terjemahan dari:
Techniques of Flavonoid Identification.
Meloan CE. 1999. Chemical Separation. New York (USA): J Willey.
Mendez A, Catalina P, Julio CM, Gabriela M, Cristobal NA. 2011. Red pigment production by Penicillium purpurogenum GH2 is influenced by pH and temperature. Journal of Zhejiang University (Biomed & Biotechnol).2(12): 961-968.
Noverita, Fitria D, Sinaga E. 2009. Isolasi dan uji aktivitas antibakteri jamur endofit dari daun dan rimpang Zingiber ottensii. Jurnal Farmasi Indonesia.
4(4): 171 -176.
Nursid M, Pratitis A, Chasanah E. 2010. Kultivasi kapang MFW-01-08 yang diisolasi dari ascidia Aplidium longithorax dan uji aktivitas sitotoksiknya terhadap Sel kanker payudara T47D. Jurnal Pascapanen dan Bioteknologi Kelautan dan Perikanan. 5(2): 103-110.