EKSTRAK SARANG SEMUT (Hydnophytum formicarum)
DAN POTENSINYA SEBAGAI ANTIHIPERGLIKEMIK
WENNY TIARA ANDHIKA RAHAYU
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa skripsi berjudul Ekstrak Sarang Semut (Hydnophytum formicarum) dan Potensinya sebagai Antihiperglikemik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2013 Wenny Tiara Andhika Rahayu NIM C34090055
ABSTRAK
WENNY TIARA ANDHIKA RAHAYU. Ekstrak Sarang Semut (Hydnophytum formicarum) dan Potensinya sebagai Antihiperglikemik. Dibimbing oleh KUSTIARIYAH TARMAN dan IRIANI SETYANINGSIH.
Sarang semut (Hydnophytum formicarum) merupakan salah satu tumbuhan epifit pada pohon bakau yang berasal dari Papua dan oleh masyarakat setempat dilaporkan berkhasiat sebagai obat antidiabetes. Inhibisi α-glukosidase merupakan salah satu mekanisme obat antidiabetes oral yang digunakan untuk mengobati diabetes mellitus. Penelitian ini bertujuan untuk menguji aktivitas antihiperglikemik dari ekstrak sarang semut sebagai inhibitor α-glukosidase. Penelitian ini dilakukan dalam beberapa tahap, yaitu ekstraksi umbi sarang semut, uji fitokimia, uji kandungan flavonoid, uji inhibisi α-glukosidase, dan uji toksisitas dengan metode BSLT. Uji fitokimia membuktikan bahwa ekstrak metanol mengandung fenol dan flavonoid, ekstrak air mengandung fenol, flavonoid, dan tanin. Kandungan flavonoid ekstrak metanol dan air sebesar 0.559% (b/b) dan 0.585% (b/b). Ekstrak metanol menghambat aktivitas α-glukosidase hingga 98.55%, dan ekstrak air menghambat aktivitas α-α-glukosidase hingga 9.37%. LC50 ekstrak metanol sebesar 735.02 ppm (tergolong toksik
rendah), dan ekstrak air sebesar 258166.58 ppm (tergolong non toksik). Kata kunci: fitokimia, flavonoid, α-glukosidase, sarang semut, toksisitas
ABSTRACT
WENNY TIARA ANDHIKA RAHAYU. Extract of Sarang Semut (Hydnophytum formicarum) and The Prospect as Antihyperglycemic. Supervised by KUSTIARIYAH TARMAN and IRIANI SETYANINGSIH.
Sarang semut (Hydnophytum formicarum) as an epiphyte of mangrove plant from Papua is increasingly popular to be used as antidiabetic medicine. Inhibition of α-glucosidase is one of mechanism of actions of an oral antidiabetic for diabetes mellitus treatment. The purpose of this research was to determine the antihyperglycemic activity of the sarang semut extract as α-glucosidase inhibitor. The research was performed in several steps: extraction of tuber of sarang semut, phytochemical test, α-glucosidase inhibition test, toxicity test using BSLT method. The phytochemical test indicated that methanol extract contained phenol and flavonoid, and water extract contained phenol, flavonoid, and tannin. Flavonoid concentration of methanol and water extracts were 0.559% (b/b) and 0.585% (b/b). Methanol extract inhibited α-glucosidase activity up to 98.55%, while water extract up to 9.37%. LC50 value of methanol extract was 735.02 ppm (categorized
as a low toxic material), and water extract was 258166.58 ppm (as non toxic material).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Perikanan
pada
Departemen Teknologi Hasil Perairan
EKSTRAK SARANG SEMUT (Hydnophytum formicarum)
DAN POTENSINYA SEBAGAI ANTIHIPERGLIKEMIK
WENNY TIARA ANDHIKA RAHAYU
DEPARTEMEN TEKNOLOGI HASIL PERAIRAN FAKULTAS PERIKANAN DAN ILMU KELAUTAN
INSTITUT PERTANIAN BOGOR BOGOR
Judul SkIipsi: Ekstrak Sarang Semut (HydnophytumJorlJ/icarllln) dan Potcnsinya sebagai Antihiperglikemik
Nama : Wenny Tiara Andhika Rahayu
NIM : C34090055
Disetujui oleh
Dr Kustiariyah Tarman, SPi, MSi Dr Ir Iriani Setyaningsih, MS
Pembimbing I Pembimbing II
Diketahui oleh
Tanggal Lulus:
Judul Skripsi : Ekstrak Sarang Semut (Hydnophytum formicarum) dan Potensinya sebagai Antihiperglikemik
Nama : Wenny Tiara Andhika Rahayu NIM : C34090055
Disetujui oleh
Dr Kustiariyah Tarman, SPi, MSi Pembimbing I
Dr Ir Iriani Setyaningsih, MS Pembimbing II
Diketahui oleh
Dr Ir Ruddy Suwandi, MS, MPhil Ketua Departemen
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga penulis dapat menyelesaikan karya ilmiah dengan judul “Ekstrak Sarang Semut (Hydnophytum formicarum) dan Potensinya sebagai Antihiperglikemik”.
Terima kasih penulis ucapkan kepada Dr Kustiariyah Tarman, SPi, MSi dan Dr Ir Iriani Setyaningsih, MS selaku dosen pembimbing. Dr Ir Sri Purwaningsih, MSi selaku dosen penguji. Dr Ir Ruddy Suwandi, MS, MPhil selaku Ketua Departemen Teknologi Hasil Perairan dan Dr Ir Agoes Mardiono Jacoeb, Dipl Biol selaku Ketua Program Studi Teknologi Hasil Perairan. Pusat Kajian Sumberdaya Pesisir dan Lautan (PKSPL) yang telah menyediakan sampel penelitian. Direktorat Jenderal Pendidikan Tinggi (DIKTI) pada Program Kreativitas Mahasiswa bidang Penelitian (PKM-P) yang telah memberikan bantuan biaya penelitian.
Terima kasih juga penulis sampaikan kepada Ibu, Mbak Arie, Ee Yauwah (Amoy dan Meri), Jasa Penginapan (Tenny, Rika, Shita), Libby, Suci, Kyo, Farah. Penulis juga berterima kasih untuk yang membantu dalam melakukan penelitian (Ibu Emma, Mbak Dini, Mbak Ina, Ibu Nunuk, Mbak Wiwi, Kak Mita, Mbak Eka, Feky, Om Men, dan Ibu Nunung).
Di samping itu terima kasih penulis sampaikan kepada teman seperjuangan (Onge, Mpus, Piti, Mamih, Dani), serta teman-teman THP 46, 45,47, dan 48 atas segala motivasinya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2013
DAFTAR ISI
DAFTAR TABEL vi DAFTAR GAMBAR vi DAFTAR LAMPIRAN vi PENDAHULUAN 1 Latar Belakang 1 Perumusan Masalah 2 Tujuan Penelitian 2 Manfaat Penelitian 2Ruang Lingkup Penelitian 2
METODE 2
Bahan 3
Alat 3
Prosedur Analisis Penelitian 3
Preparasi sampel 3
Ekstraksi sampel 4
Uji fitokimia 4
Uji kandungan flavonoid 4
Uji inhibisi enzim α-glukosidase 5
Uji toksisitas Brine Shrimp Lethality Test 6
HASIL DAN PEMBAHASAN 7
Ekstrak Sarang Semut (Hydnophytum formicarum) 7
Komponen Kimia Sarang Semut (Hydnophytum formicarum) 8
Kandungan Flavonoid Sarang Semut 11
Aktivitas Inhibisi Enzim α-Glukosidase 12
Uji Toksisitas Brine Shrimp Lethality Test 15
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 16
LAMPIRAN 21
DAFTAR TABEL
1 Reaksi inhibisi enzim α-glukosidase 6
2 Nilai rendemen ekstrak metanol dan air sarang semut 8 3 Hasil uji fitokimia ekstrak metanol dan air sarang semut 9 4 Nilai kandungan flavonoid ekstrak metanol dan air sarang semut 11 5 Nilai inhibisi enzim α-glukosidase ekstrak metanol dan air sarang semut 12
6 Nilai inhibisi enzim α-glukosidase acarbose 13
7 Hasil uji toksisitas ekstrak sarang semut 15
DAFTAR GAMBAR
1 Diagram alir prosedur penelitian 4
2 Ekstrak metanol dan air 8
DAFTAR LAMPIRAN
1 Perhitungan rendemen ekstrak sarang semut 21
2 Hasil uji fitokimia ekstrak metanol 22
3 Hasil uji fitokimia ekstrak air 23
4 Hasil uji inhibisi enzim α-glukosidase ekstrak metanol 24 5 Hasil uji inhibisi enzim α-glukosidase ekstrak metanol 25 6 Kandungan flavonoid ekstrak metanol dan air sarang semut 26
7 Hasil uji toksisitas ekstrak metanol 27
PENDAHULUAN
Latar Belakang
Diabetes melitus merupakan suatu kelainan metabolik kronis yang memiliki dampak signifikan terhadap kesehatan atau kondisi konsentrasi glukosa dalam darah secara kronis lebih tinggi daripada nilai normal (hiperglikemia) akibat tubuh kekurangan insulin atau fungsi insulin tidak efektif (Subroto 2006). Indonesia menempati urutan ke-4 dengan jumlah penderita diabetes terbesar di dunia setelah India, Cina, dan Amerika Serikat (WHO 2010). Indonesia memiliki persentase sekitar 8,6% dari total penduduk, pada tahun 1995 terdapat 4,5 juta penderita diabetes dan diperkirakan pada tahun 2025 akan meningkat menjadi 12,4 juta penderita (DEPKES 2005).
Obat antihiperglikemik terdiri atas dua jenis, yaitu suntikan insulin dan obat antidiabetes oral (Lee et al. 2007). Obat antidiabetes oral berguna untuk penderita yang alergi terhadap insulin atau yang tidak menggunakan suntikan. Obat antidiabetes oral sebagian besar memberikan efek samping yang tidak diinginkan seperti diare, sakit kepala, mual, dan muntah (BPOM 2009).
Pengobatan tradisional melalui pemanfaatan tumbuhan mangrove secara praktis telah dilakukan oleh masyarakat di Indonesia khususnya di daerah pesisir sejak jaman dahulu (Wanma 2007). Salah satu tumbuhan yang digunakan untuk pengobatan tradisional adalah Hydnophytum formicarum atau sarang semut yang berasal dari Papua. Tumbuhan sarang semut merupakan tumbuhan epifit yang menempel di pohon besar yang bagian batang bawahnya menggelembung dan berisi rongga-rongga yang digunakan sebagai tempat tinggal semut. Tumbuhan sarang semut tersebar dari hutan bakau dan pohon-pohon dipinggir pantai hingga ketinggian 2.400 m di atas permukaan laut, mulai dari Sumatera, Kalimantan, Jawa, hingga Papua. Tumbuhan ini secara turun temurun dikonsumsi dalam bentuk rebusan bubuk umbinya dan dimanfaatkan untuk menyembuhkan penyakit seperti kanker, tumor, asam urat, migrain, periodontitis, jantung koroner, TBC, dan leukemia (Subroto dan Saputro 2006), selain itu dimanfaatkan untuk mengobati penyakit diabetes melitus (Taebe et al. 2012).
Penelitian tentang tumbuhan sarang semut saat ini lebih fokus pada bidang taksonomi, ekologi, dan budidaya. Penelitian mengenai kajian kimia, farmakologi, dan toksisitas di dalam tumbuhan sarang semut masih terbatas (Subroto 2006). Hasil uji penapisan kimia membuktikan sarang semut mengandung senyawa flavonoid (Subroto dan Saputro 2006). Senyawa golongan flavonoid memiliki sifat antidiabetes (Lukacinova et al. 2008).
Waring (2007) menyatakan bahwa mekanisme pengobatan diabetes mellitus antara lain melalui tiga cara, yaitu penambahan insulin dari luar, merangsang sekresi insulin, dan menurunkan kadar glukosa darah melalui penghambatan aktivitas glukosidase. Penelitian sarang semut dalam menghambat aktivitas α-glukosidase belum dilakukan, sehingga perlu dilakukan penelitian ekstrak umbi sarang semut sebagai antihiperglikemik dalam menghambat aktivitas α-glukosidase.
2
Perumusan Masalah
Kasus diabetes yang masih banyak terjadi di Indonesia dan termasuk dalam penyakit degeneratif. Penyakit ini tidak menyebabkan kematian secara langsung, tetapi dapat berakibat fatal dan dapat menyebabkan komplikasi penyakit. Tumbuhan sarang semut (Hydnophytum formicarum) dimanfaatkan secara tradisional sebagai obat antidiabetes oleh masyarakat pesisir Papua, tetapi belum ada yang meneliti efektivitas sebagai antihiperglikemik dalam menghambat aktivitas enzim α-glukosidase.
Tujuan Penelitian
Tujuan umum dari penelitian ini adalah mengetahui potensi ekstrak tumbuhan sarang semut dalam menghambat aktivitas enzim α-glukosidase. Tujuan khusus dari penelitian ini adalah untuk mendapatkan ekstrak air dan ekstrak metanol dari sarang semut, serta menentukan rendemennya, menentukan komponen aktif dengan menggunakan uji fitokimia, menentukan kandungan flavonoid pada kedua ekstrak, menentukan aktivitas antihiperglikemik pada kedua ekstrak dalam menghambat aktivitas enzim α-glukosidase, dan menentukan aktivitas toksisitasnya dengan menggunakan metode Brine Shrimp Lethality Test.
Manfaat Penelitian
Tumbuhan sarang semut (Hydnophytum formicarum) yang sudah dikenal sebagai obat antidiabetes secara tradisional dan turun temurun oleh masyarakat Papua dapat dibuktikan secara ilmiah sebagai antihiperglikemik dengan menghambat aktivitas enzim α-glukosidase.
Ruang Lingkup Penelitian
Ruang lingkup penelitian ini adalah tumbuhan sarang semut (Hydnophytum formicarum), uji fitokimia, flavonoid, inhibisi enzim α-glukosidase, serta toksisitas.
METODE
Penelitian “Ekstrak Sarang Semut (Hydnophytum formicarum) dan Potensinya sebagai Antihiperglikemik” dilaksanakan pada bulan Januari sampai dengan Juni 2013. Preparasi dan ekstraksi sampel dilakukan di Laboratorium Mikrobiologi Hasil Perairan Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan dan Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Uji inhibisi enzim α-glukosidase dan uji kandungan flavonoid dilakukan di Pusat Studi
3 Biofarmaka. Uji toksisitas dilakukan di Laboratorium Kimia Analitik dan Laboratorium Bioteknologi Hasil Perairan II.
Bahan
Bahan-bahan yang digunakan pada penelitian ini adalah umbi dari tumbuhan sarang semut (Hydnophytum formicarum), akuades, dan metanol sebagai pelarut dalam ekstraksi, bahan uji inhibisi enzim α-glukosidase adalah p-nitrofenil-α-D-glukopiranosa, enzim α-glukosidase, bufer fosfat (pH 7), Glucobay, Dimethyl Sulfoxide (DMSO), HCl 2 N, dan Na2CO3. Bahan yang dipakai untuk uji
fitokimia adalah pereaksi Wagner, pereaksi Meyer, pereaksi Dragendorff, etanol 30%, asam asetat anhidrat, H2SO4 pekat, etanol 70%, larutan FeCl3 1%, CHCl3,
serbuk Mg, larutan amil alkohol, dan HCl 2 N. Bahan uji kandungan flavonoid adalah larutan heksametilentetramina 0.5% b/v, larutan HCl 25%, akuades, AlCl3,
larutan asam asetat glasial 5% v/v, kuersetin murni, aseton, dan etil asetat. Bahan uji toksisitas adalah larva udang Artemia salina dan air laut steril.
Alat
Alat-alat yang digunakan untuk preparasi dan ekstraksi sampel adalah pisau, blender (Philips HR2870), soxhlet (Schott Duran), rotary evaporator (Heidolph VV2000). Alat yang digunakan untuk uji fitokimia adalah tabung reaksi, labu Erlenmeyer, penangas air, corong gelas, sudip, dan pipet tetes. Alat yang digunakan untuk uji kandungan flavonoid adalah corong pisah dan vortex. Alat yang digunakan untuk uji inhibisi enzim α-glukosidase adalah microplate (Nunc), pipet mikro (Eppendorf), inkubator (Binder), spektrofotometer UV-Vis (Epoch). Alat yang digunakan untuk uji toksisitas adalah labu takar, sumur uji, lampu TL, dan aerator.
Prosedur Analisis Penelitian
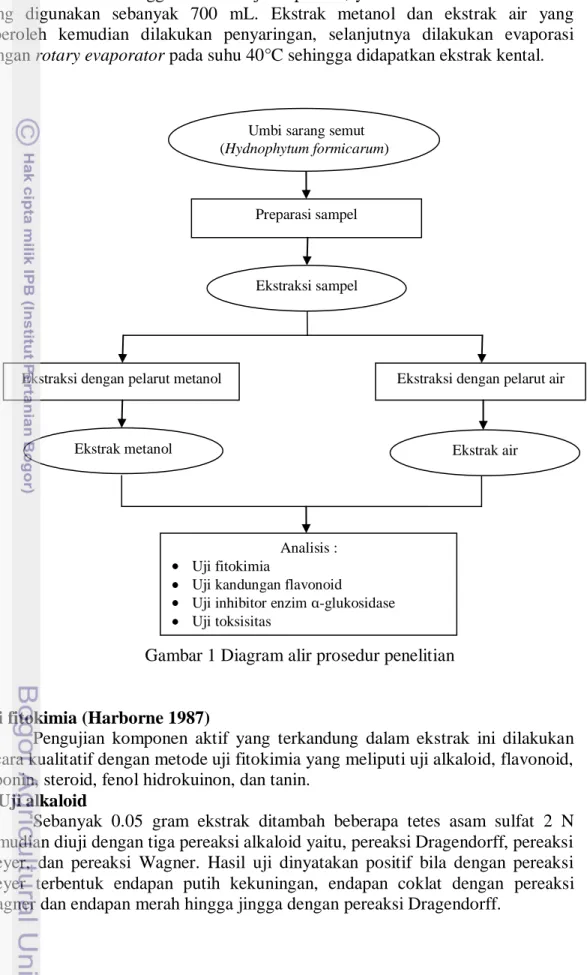
Penelitian ini terdiri dari beberapa tahapan yaitu preparasi sampel, ekstraksi sampel, uji fitokimia, uji kandungan flavonoid, uji inhibisi enzim α-glukosidase, dan uji toksisitas. Diagram alir prosedur penelitian dapat dilihat pada Gambar 1.
Preparasi sampel (Soeksmanto et al. 2010)
Persiapan bahan baku dilakukan dengan membuang kulit luar umbi sarang
semut dan dibersihkan dari semut dan kotoran. Umbi yang telah bersih, kemudian dilakukan pemotongan dan dikeringkan pada suhu ruang. Bahan baku sarang semut (Hydnophytum formicarum) berasal dari hutan bakau di pesisir Pulau Waigeo, Raja Ampat, Papua Barat. Umbi yang telah kering, kemudian dihaluskan dengan menggunakan blender hingga menjadi serbuk.
4
Ekstraksi sampel (Simanjuntak et al. 2010)
Serbuk umbi tanaman sarang semut sebanyak 25 gram diekstraksi dengan
metode soxhletasi menggunakan dua jenis pelarut, yaitu metanol dan air. Pelarut yang digunakan sebanyak 700 mL. Ekstrak metanol dan ekstrak air yang diperoleh kemudian dilakukan penyaringan, selanjutnya dilakukan evaporasi dengan rotary evaporator pada suhu 40°C sehingga didapatkan ekstrak kental.
Gambar 1 Diagram alir prosedur penelitian
Uji fitokimia (Harborne 1987)
Pengujian komponen aktif yang terkandung dalam ekstrak ini dilakukan
secara kualitatif dengan metode uji fitokimia yang meliputi uji alkaloid, flavonoid, saponin, steroid, fenol hidrokuinon, dan tanin.
1 Uji alkaloid
Sebanyak 0.05 gram ekstrak ditambah beberapa tetes asam sulfat 2 N kemudian diuji dengan tiga pereaksi alkaloid yaitu, pereaksi Dragendorff, pereaksi Meyer, dan pereaksi Wagner. Hasil uji dinyatakan positif bila dengan pereaksi Meyer terbentuk endapan putih kekuningan, endapan coklat dengan pereaksi Wagner dan endapan merah hingga jingga dengan pereaksi Dragendorff.
Preparasi sampel
Ekstraksi dengan pelarut metanol Ekstraksi dengan pelarut air
Analisis : Uji fitokimia
Uji kandungan flavonoid
Uji inhibitor enzim α-glukosidase Uji toksisitas
Ekstrak metanol Ekstrak air
Umbi sarang semut (Hydnophytum formicarum)
5
2 Uji flavonoid
Sebanyak 0.05 gram ekstrak ditambahkan serbuk magnesium 0.10 mg dan 0.40 mL amil alkohol (campuran asam klorida 37% dan etanol 95% dengan volume yang sama) dan 4 mL alkohol kemudian campuran dikocok. Warna merah, kuning atau jingga yang terbentuk pada lapisan amil alkohol menunjukkan adanya flavonoid.
3 Uji saponin
Saponin dideteksi dengan uji busa pada 0.05 gram ekstrak dalam air panas. Busa yang stabil selama 30 menit dan tidak hilang setelah ditambahkan 1 tetes HCl 2 N menunjukkan adanya saponin.
4 Uji steroid
Sebanyak 0.05 gram ekstrak dilarutkan dalam 2 mL kloroform, 10 tetes anhidra asetat dan 3 tetes asam sulfat pekat. Larutan berwarna merah yang terbentuk untuk pertama kali kemudian berubah menjadi biru dan hijau, menunjukkan reaksi positif.
5 Uji fenol hidrokuinon
Sebanyak 1 gram ekstrak ditambahkan dengan 20 mL etanol 70%. Larutan
yang dihasilkan diambil sebanyak 1 mL kemudian ditambahkan 2 tetes larutan FeCl3 5%. Warna hijau atau hijau biru yang terbentuk menunjukkan adanya
senyawa fenol dalam bahan.
6 Uji Tanin
Sebanyak 1 gram ekstrak ditambahkan ke dalam 100 mL air panas kemudian dididihkan selama 5 menit dan disaring. Sebanyak 5 mL filtrat ditambah FeCl3 1%. Hasil positif ditandai munculnya warna hijau kehitaman.
Uji kandungan flavonoid (Codex 1986 diacu dalam Nobre et al. 2005)
Sebanyak 200 mg ekstrak sarang semut dimasukkan ke dalam labu takar. Kemudian ditambah 1 mL larutan heksametilentetramina (HMT) 0.5%, 20 mL aseton, dan 2 mL larutan HCl, kemudian dipanaskan selama 30 menit dengan menggunakan penangas air. Campuran disaring menggunakan kapas, filtrat dimasukkan ke dalam labu takar ukuran 100 mL. Campuran filtrat kemudian ditambahkan dengan aseton sampai volume 100 mL.
Sebanyak 20 mL filtrat dan 20 mL akuades dimasukkan ke dalam corong pisah, lalu diekstraksi dengan etil asetat (ekstraksi pertama dengan 15 mL etil asetat, ekstraksi kedua dan ketiga dengan 10 mL etil asetat). Fraksi etil asetat dikumpulkan dalam labu takar ukuran 50 mL, kemudian ditambahkan etil asetat hingga 50 mL. Sebanyak 10 mL dari campuran tersebut dimasukkan ke dalam labu takar ukuran 25 mL, lalu direaksikan dengan 1 ml larutan AlCl3 2% b/v dan
larutan asam asetat glasial 5% v/v dalam metanol sampai 25 mL. Pencampuran larutan menggunakan vorteks kemudian dibaca nilai absorbansinya pada panjang gelombang 370.8 nm menggunakan spektrofotometer UV-Vis. Kurva standar dibuat dengan kuersetin murni dengan konsentrasi 0,5; 1; 5; 10; dan 15 ppm.
Uji inhibisi enzim α-glukosidase (Sancheti et al. 2009)
Persiapan larutan kontrol blanko (B0) dan blanko (B1) dilakukan dengan
pembuatan substrat dengan cara melarutkan p-nitrofenil α-D-glukopiranosa dalam bufer fosfat 0.1 M pH 7.0 dan pembuatan larutan enzim α-glukosidase dengan cara melarutkan 1 mg α-glukosidase dalam 100 mL bufer fosfat (pH 7). Campuran
6
reaksi blanko terdiri dari 10 µL larutan dimetil sulfoksida (DMSO), 50 µL bufer fosfat 0.1 M (pH 7.0), 25 µL p-nitrofenil α-D-glukopiranosa sebagai substrat, dan 25 µL larutan enzim α-glukosidase. Perbedaan antara blanko dan kontrol blanko, pada kontrol blanko tidak menggunakan enzim α-glukosidase. Campuran reaksi kemudian diinkubasi pada suhu 37°C selama 30 menit. Reaksi dihentikan oleh penambahan 100 µL larutan natrium karbonat 0.2 M, kemudian diukur pada panjang gelombang 400 nm dengan spektrofotometer.
Persiapan larutan kontrol sampel (S0) dan sampel (S1) dilakukan dengan
melarutkan ekstrak sarang semut dalam bufer. Campuran reaksi sampel terdiri dari 10 µL ekstrak sarang semut, 50 µL bufer fosfat 0.1 M (pH 7.0), 25 µL p-nitrofenil D-glukopiranosa 0.5 mM sebagai substrat, dan 25 µL larutan enzim α-glukosidase. Perbedaan antara sampel dan kontrol sampel, pada kontrol sampel tidak menggunakan enzim α-glukosidase. Campuran reaksi kemudian diinkubasi pada suhu 37°C selama 30 menit. Reaksi dihentikan oleh penambahan 100 µL larutan natrium karbonat 0.2 M. Absorban dari p-nitrofenol diukur pada panjang gelombang 400 nm dengan spektrofotometer. Sampel dilakukan dalam tiga ulangan. Reaksi enzim selengkapnya untuk satu sampel dapat dilihat pada Tabel 1.
Konsentrasi larutan acarbose 1% sebagai pembanding yang digunakan dibuat dari tablet Glucobay yang dilarutkan dalam akuades dan HCl 2N (1:1) dengan konsentrasi 1% (b/v) digunakan sebagai standar, kemudian disentrifugasi dan supernatan diambil sebanyak 10 µL dan dimasukkan ke dalam campuran reaksi seperti dalam sampel.
Tabel 1 Reaksi inhibisi enzim α-glukosidase
B0 (µL) B1 (µL) S0 (µL) S1 (µL)
Ekstrak sarang semut - - 10 10
DMSO 10 10 - -
Buffer 50 50 50 50
Substrat 25 25 25 25
Enzim - 25 - 25
Inkubasi 37°C selama 30 menit
Na2CO3 100 100 100 100
Pengujian daya hambat ekstrak terhadap aktivitas α -glukosidase dihitung dalam % inhibisi dengan rumus :
% inhibisi = – - x 100% Keterangan :
K = Absorbansi terkoreksi dari blanko (B1) dikurangi kontrol blanko (B0)
S0 = Absorbansi terkoreksi dari kontrol sampel
S1 = Absorbansi terkoreksi dari sampel
Uji toksisitas Brine Shrimp Lethality Test (Meyer et al. 1982)
Persiapan larva Artemia salina dilakukan dengan menetaskan telur larva
selama 48 jam sebelum dilakukan uji. Penetasan dilakukan dengan cara merendam telur tersebut dalam air laut di dalam wadah yang diberi suplai oksigen dari aerator dan diberi penerangan dengan lampu TL 20 Watt.
7 Pelaksanaan uji dilakukan dengan memasukkan larva ke dalam sumur uji dengan tujuh kelompok perlakuan yang berisi larutan 5; 50; 100; 500; 1000; 3000; dan 5000 ppm dari ekstrak metanol dan ekstrak air sarang semut dengan pelarut air laut. Masing-masing sumur uji berisi 10 ekor larva dan volume akhir setiap sumur sebesar 2 mL. Setiap perlakuan dilakukan tiga kali ulangan. Inkubasi dilakukan selama 24 jam, selanjutnya dihitung jumlah larva yang mati. Nilai LC50
diperoleh dengan cara menghitung menggunakan rumus y = a + bx. Nilai a dan b diperoleh dengan perhitungan menggunakan rumus regresi linier berdasarkan data dari titik konsentrasi yang digunakan. Nilai x yang diperoleh merupakan konsentrasi larutan yang menyebabkan kematian terhadap 50% larva.
HASIL DAN PEMBAHASAN
Ekstrak Sarang Semut (Hydnophytum formicarum)
Ekstraksi merupakan suatu proses penarikan komponen aktif dari suatu campuran padatan atau cairan dengan menggunakan pelarut jenis tertentu. Pelarut yang digunakan tidak tercampur atau hanya tercampur sebagian dengan campuran padatan atau cairan (Gamse 2002). Faktor-faktor yang berpengaruh terhadap proses ekstraksi adalah lama ekstraksi, suhu, dan jenis pelarut yang digunakan (Khopkar 2003).
Metode ekstraksi yang digunakan adalah soxhletasi. Soxhletasi merupakan salah satu metode berdasarkan jenis sampelnya yaitu ekstraksi padat cair. Instrumentasinya meliputi labu alas bulat sebagai tempat hasil ekstraksi, tempat sampel padat dan kondensor (Dewi 2005). Pambayun et al. (2007) menyatakan bahwa ekstraksi dengan soxhlet memberikan hasil ekstrak yang lebih tinggi karena pada cara ini digunakan pemanasan yang diduga memperbaiki kelarutan ekstrak.
Pelarut yang digunakan untuk proses ekstraksi adalah air dan metanol. Pelarut air dipilih karena mengacu pada pengalaman empiris masyarakat Papua yang menggunakan serbuk umbi sarang semut sebagai obat dengan cara perebusan (Bustanussalam 2010). Menurut Suryanti et al. (2006), pelarut metanol digunakan karena merupakan pelarut umum yang dapat melarutkan sebagian besar senyawa yang ada dalam simplisia.
Proses evaporasi digunakan untuk memisahkan pelarut dari senyawa bioaktif yang terikat. Suhu yang digunakan adalah 40°C untuk mencegah terjadinya kerusakan senyawa aktif (Harborne 1987). Hasil evaporasi dari filtrat umbi sarang semut (Hydnophytum formicarum) dengan pelarut metanol dan air menghasilkan sifat yang berbeda. Ekstrak metanol berwarna hijau kehitaman dan berbentuk pasta dengan tekstur lunak, sedangkan ekstrak air berwarna hitam pekat dan berbentuk pasta dengan tekstur keras. Hasil ekstrak metanol dan ekstrak air sarang semut dapat dilihat pada Gambar 2.
8
Gambar 1 (a) ekstrak metanol (b) ekstrak air
Nilai rendemen ekstrak sarang semut yang diperoleh dari pelarut metanol dan air dapat dilihat pada Tabel 2. Rendemen ekstrak air lebih tinggi daripada ekstrak metanol. Hasil tersebut menunjukkan bahwa semakin tinggi tingkat kepolaran pelarut yang digunakan maka rendemen yang dihasilkan semakin tinggi pula. Hal ini sesuai dengan hasil yang diperoleh Simanjuntak et al. (2010), jumlah rendemen ekstrak air sarang semut (Myrmecodia pendens Merr. & Perry) lebih tinggi daripada ekstrak metanol dengan metode refluks. Pambayun et al. (2007) menyatakan bahwa bahan terekstrak yang diperoleh semakin tinggi dengan semakin polarnya pelarut.
Tabel 2 Nilai rendemen ekstrak metanol dan air sarang semut Jenis sampel Rata-rata rendemen (% b/b)*
Ekstrak metanol 4.98 Ekstrak air 11.135
*dihitung terhadap 25 gram serbuk
Perbedaan rendemen disebabkan kemampuan pelarut dalam proses ektraksi untuk memperoleh zat aktif dalam sampel, dan kelarutan zat aktif dalam pelarut yang berbeda (Adewole et al. 2006). Pelarut metanol melarutkan senyawa gula, asam amino dan glikosida (Hounghton dan Raman 1998). Pelarut air mudah melarutkan antosianin, pati, tanin, polipeptida, dan lektin (Cowan 1999). Rendemen ekstrak yang diperoleh dipengaruhi oleh kondisi alamiah senyawa aktif pada bahan, metode ekstraksi, waktu ekstraksi, ukuran partikel sampel, serta pelarut sampel (Harborne 1987).
Komponen Kimia Sarang Semut (Hydnophytum formicarum)
Uji fitokimia merupakan uji yang digunakan untuk memberikan informasi jenis senyawa aktif yang terkandung dalam tumbuhan. Beberapa dari senyawa tersebut memberikan efek fisiologis yang lebih dikenal sebagai senyawa atau komponen kimia aktif (Copriyadi et al. 2005). Informasi mengenai senyawa sangat berguna bagi ahli sintesis kimia organik untuk memprediksi senyawa aktif sehingga dapat lebih berkhasiat. Tumbuhan yang diuji fitokimia dapat berbagai bentuk seperti segar, kering, serbuk, ekstrak, dan bentuk sediaan (Harborne 1987).
9 Uji ini dilakukan pada ekstrak metanol dan ekstrak air. Hasil analisis komponen fitokimia dapat dilihat pada Tabel 3.
Hasil uji fitokimia ekstrak metanol diketahui positif mengandung fenol hidrokuinon dan flavonoid. Ekstrak air menunjukkan adanya fenol hidrokuinon, flavonoid, dan tanin (Tabel 3). Kardono (2003) menyatakan bahwa kandungan metabolit sekunder yang berbeda pada jenis tanaman yang sama, terjadi karena perbedaan jenis pelarut yang digunakan saat ekstraksi, variasi genetik individual, dan kondisi geografis tempat tumbuh.
Tabel 3 Hasil uji fitokimia ekstrak metanol dan air sarang semut
Keterangan : (+) = terdeteksi ; (-) = tidak terdeteksi
Alkaloid
Alkaloid merupakan senyawa kimia tumbuhan hasil metabolit sekunder yang terbentuk untuk mempertahankan diri dari serangan luar. Pada umumnya alkaloid larut dalam air (Sirait 2007). Senyawa ini bersifat basa dan mengandung satu atau lebih atom nitrogen sebagai bagian dari sistem siklik (Harborne 1987). Alkaloid berfungsi sebagai analgesik narkotik, kodein untuk obat batuk, dan kuinin sebagai antimalaria (De padua et al. 1999).
Hasil pengujian alkaloid pada ekstrak metanol dan air sarang semut memiliki hasil negatif. Hasil pengujian fraksi air dan n-butanol sarang semut memiliki hasil negatif pada alkaloid (Bustanussalam 2010). Alkaloid memiliki
Uji Fitokimia Ekstrak
metanol Parameter
Ekstrak
air Parameter Alkaloid
1 Dragendorff - Tidak membentuk
endapan -
Tidak membentuk endapan 2 Meyer - Tidak membentuk
endapan -
Tidak membentuk endapan 3 Wagner - Tidak membentuk
endapan -
Tidak membentuk endapan Fenol
Hidrokuinon + Warna hijau + Warna hijau
Flavonoid + Lapisan amil alkohol berwarna kuning + Lapisan amil alkohol berwarna jingga
Tanin - Warna kuning + Warna hijau kehitaman Saponin - Tidak terbentuk busa - Busa tidak stabil
Steroid - Tidak terjadi
perubahan warna -
Tidak terjadi perubahan warna
10
sifat farmakologis, yaitu memperlebar saluran pernafasan pada penderita sesak nafas (Sumardjo 2008).
Fenol hidrokuinon
Fenol merupakan struktur aromatik yang memiliki ikatan satu atau lebih gugus hidroksil (Harborne 1987). Kuinon adalah senyawa yang mempunyai kromofor pada benzokuinon yang terdiri atas dua gugus karbonil yang berkonjugasi dengan dua ikatan rangkap karbon (Ketaren 2008). Hasil penelitian Escudero et al. (2008) menunjukkan bahwa komponen fenol yang diisolasi dari daun Piper aduncum L. memiliki aktivitas antioksidan.
Hasil uji fitokimia menunjukkan bahwa ekstrak metanol dan air mengandung fenol. Ekstrak etanol sarang semut memiliki kandungan fenol hidrokuinon (Engida et al. 2013). Senyawa fenol berfungsi sebagai antioksidan karena kemampuannya meniadakan radikal bebas (Oktaviana 2010).
Flavonoid
Flavonoid umumnya terdapat pada tumbuhan sebagai glikosida. Flavonoid diklasifikasikan menjadi flavon, flavonol, flavanon, flavanonol, isoflavon, calkon, dihidrokalkon, auron, dan antosianidin (Sirait 2007). Flavonoid Flavonoid berperan dalam pengobatan beberapa penyakit seperti asma, katarak, diabetes, rematik, migrain, wasir dan periodontitis (Subroto dan Saputro 2006).
Hasil pengujian fitokimia flavonoid menunjukkan bahwa ekstrak air dan metanol sarang semut positif terdapat flavonoid. Hal ini sesuai dengan penelitian Bustanussalam (2010) yang menunjukkan bahwa fraksi air dan n-butanol sarang semut memiliki hasil positif pada flavonoid, serta Engida et al. (2013) yang menunjukkan bahwa ekstrak etanol sarang semut memiliki kandungan flavonoid. Sharma et al. (2008) menyatakan bahwa senyawa flavonoid dari biji Eugenia jambolana (L) berperan sebagai antidiabetes melalui mekanisme insulinotropik.
Tanin
Tanin merupakan senyawa polifenol yang dapat larut dalam air, gliserol, metanol, kloroform, dan eter. Secara kimia terdapat dua jenis tanin, yaitu tanin terkondensasi dan tanin yang terhidrolisis (Harborne 1987). Kandungan senyawa tanin pada sarang semut secara empiris digunakan untuk pengobatan wasir dan mimisan (Subroto dan Saputro 2006).
Hasil uji fitokimia menunjukkan ekstrak air mengandung tanin, sedangkan ekstrak metanol menunjukkan hasil negatif. Fraksi air sarang semut memiliki hasil positif pada tanin (Bustanussalam 2010), serta ekstrak etanol 70% daun Hydnophytum formicarum menunjukkan hasil positif pada tanin (Yuliastuti 2011). Tanin berperan sebagai antioksidan karena dapat menangkap senyawa radikal bebas (Dangles et al. 2000).
Saponin
Saponin adalah glikosida triterpena dan sterol yang telah terdeteksi dalam lebih dari 90 suku tumbuhan (Suradikusumah 1989). Senyawa ini larut dalam air, sedikit atau tidak sama sekali larut dalam etanol dan metanol (Harborne 1987). Saponin memiliki aktivitas antimikroba, merangsang sistem imun dan mengatur tekanan darah (Astawan dan Kasih 2008).
11 Hasil pengujian saponin pada ekstrak metanol dan air sarang semut memiliki hasil negatif. Fraksi air dan n-butanol sarang semut memiliki hasil negatif pada saponin (Bustanussalam 2010), serta ekstrak etanol 70% daun sarang semut menunjukkan hasil negatif pada saponin (Yuliastuti 2011). Ekstrak air dari tumbuhan Dioscorea nipponica Mak. mengandung komponen saponin yang biasa digunakan sebagai obat penyakit cardiovascular (Cui et al. 2004).
Steroid
Steroid adalah golongan triterpena yang kerangka dasarnya terbentuk dari sistem cincin siklopentana prehidrofenantrena. Senyawa ini awalnya hanya sebagai komponen pada substansi hewan saja, tetapi akhir-akhir ini steroid juga ditemukan pada substansi tumbuhan (Harborne 1987). Silva et al. (2002) menyatakan bahwa komponen steroid dari daun Agave attenuata memiliki aktivitas anti-inflamasi.
Hasil uji fitokimia menunjukkan ekstrak air dan metanol tidak mengandung steroid. Hal ini sesuai dengan penelitian Bustanussalam (2010) yang menunjukkan bahwa fraksi air dan n-butanol sarang semut memiliki hasil negatif pada steroid. Kurniawati et al. (2005) menyatakan bahwa senyawa steroid terdapat dalam jumlah yang tinggi pada tanaman pegagan dan digunakan sebagai bahan obat.
Kandungan Flavonoid Sarang Semut (Hydnophytum formicarum)
Analisis kandungan flavonoid pada penelitian ini dilakukan dengan cara metode kolorimetrik menggunakan AlCl3sebagai pereaksi kromogenik. Penelitian
Tadera et al. (2006) membuktikan bahwa golongan senyawa flavonoid berperan sebagai penghambat aktivitas enzim α-glukosidase. Chang et al. (2002) menyatakan bahwa kandungan flavonoid yang terukur pada penentuan konsentrasi flavonoid terdiri dari golongan flavon dan flavonol yang terdapat pada ekstrak karena hanya golongan flavon dan flavonol yang dapat membentuk kompleks stabil dengan AlCl3. Hasil pengukuran kandungan flavonoid dapat dilihat pada
Tabel 4.
Tabel 4 Nilai kandungan flavonoid ekstrak metanol dan air sarang semut Jenis sampel Kandungan flavonoid (%b/b)
Ekstrak metanol 0.559 Ekstrak air 0.585
Nilai kandungan flavonoid ekstrak air lebih tinggi daripada ekstrak metanol (Tabel 4). Ekstrak metanol sarang semut memiliki kandungan flavonoid yang lebih tinggi dibandingkan ekstrak metanol buah mahkota dewa yaitu sebesar 0.0054% (Rohyami 2008). Menurut Pradono et al. (2011), kandungan flavonoid dan senyawa fenolik lain di dalam tumbuhan berbeda-beda di antara setiap bagian, jaringan, dan umur tumbuhan, serta dipengaruhi oleh faktor-faktor lingkungan.
Kandungan flavonoid yang terukur setara dengan kuersetin. Persamaan garis yang diperoleh pada kurva standar kuersetin adalah y= 0.054+0,018x dengan
12
koefisien korelasi 0.992 (Lampiran 7). Kuersetin merupakan flavonol yang paling aktif dan umumnya terdapat dalam tumbuhan. Lukacinova et al. (2008) melakukan penelitian antidiabetes pada uji senyawa golongan flavonol dan flavon secara in vivo pada tikus dan menyatakan bahwa daya inhibisi senyawa golongan flavonol jauh lebih tinggi daripada flavon.
Aktivitas Inhibisi Enzim α-Glukosidase
Enzim α-glukosidase adalah enzim yang bekerja dalam pembentukan glukosa di usus halus manusia melalui pemecahan karbohidrat (Lehninger 2004). Menurut Bosenberg (2008), proses pencernaan karbohidrat menjadi oligosakarida yang kemudian akan diubah lagi menjadi glukosa oleh enzim α-glukosidase yang dikeluarkan oleh sel-sel usus halus. Adanya penghambatan kerja enzim α-glukosidase berfungsi untuk pengembalian kadar glukosa dalam darah dengan batas normal.
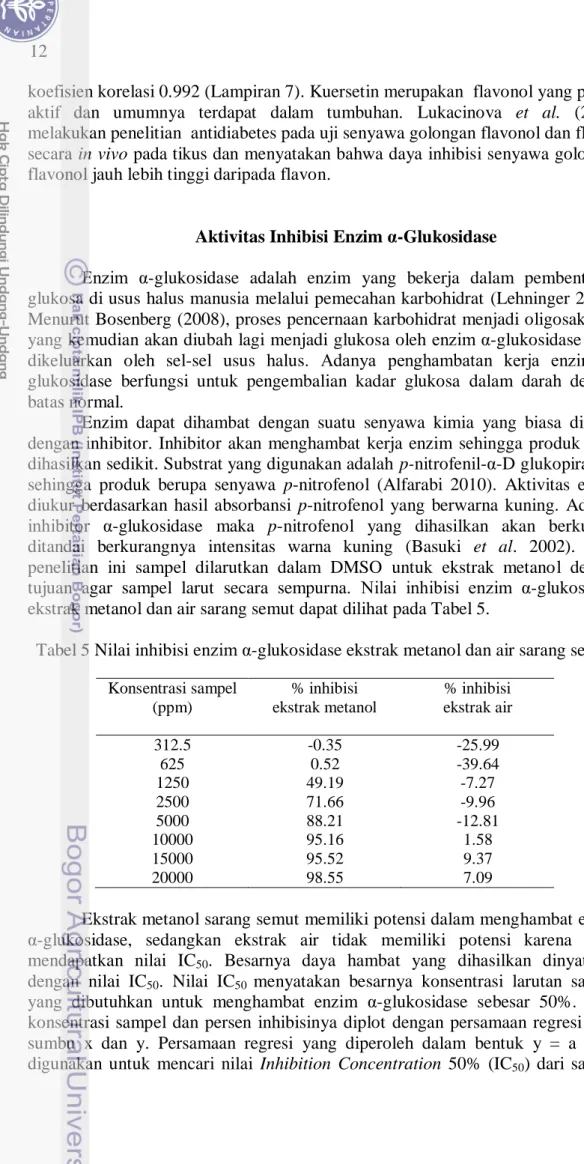
Enzim dapat dihambat dengan suatu senyawa kimia yang biasa disebut dengan inhibitor. Inhibitor akan menghambat kerja enzim sehingga produk yang dihasilkan sedikit. Substrat yang digunakan adalah p-nitrofenil-α-D glukopiranosa sehingga produk berupa senyawa p-nitrofenol (Alfarabi 2010). Aktivitas enzim diukur berdasarkan hasil absorbansi p-nitrofenol yang berwarna kuning. Adanya inhibitor α-glukosidase maka p-nitrofenol yang dihasilkan akan berkurang ditandai berkurangnya intensitas warna kuning (Basuki et al. 2002). Pada penelitian ini sampel dilarutkan dalam DMSO untuk ekstrak metanol dengan tujuan agar sampel larut secara sempurna. Nilai inhibisi enzim α-glukosidase ekstrak metanol dan air sarang semut dapat dilihat pada Tabel 5.
Tabel 5 Nilai inhibisi enzim α-glukosidase ekstrak metanol dan air sarang semut Konsentrasi sampel (ppm) % inhibisi ekstrak metanol % inhibisi ekstrak air 312.5 -0.35 -25.99 625 0.52 -39.64 1250 49.19 -7.27 2500 71.66 -9.96 5000 88.21 -12.81 10000 95.16 1.58 15000 95.52 9.37 20000 98.55 7.09
Ekstrak metanol sarang semut memiliki potensi dalam menghambat enzim α-glukosidase, sedangkan ekstrak air tidak memiliki potensi karena tidak mendapatkan nilai IC50. Besarnya daya hambat yang dihasilkan dinyatakan
dengan nilai IC50. Nilai IC50 menyatakan besarnya konsentrasi larutan sampel
yang dibutuhkan untuk menghambat enzim α-glukosidase sebesar 50%. Nilai konsentrasi sampel dan persen inhibisinya diplot dengan persamaan regresi pada sumbu x dan y. Persamaan regresi yang diperoleh dalam bentuk y = a + bx digunakan untuk mencari nilai Inhibition Concentration 50% (IC50) dari sampel
13 dengan menyatakan nilai y sebesar 50 dan nilai x yang akan diperoleh sebagai IC50. Nilai rata-rata IC50 ekstrak metanol sarang semut yang dihasilkan sebesar
1959 ppm. Nilai IC50 sarang semut lebih baik dibandingkan nilai IC50 Spirulina
platensis. Hasil penelitian Surbakti (2013) menunjukkan bahwa nilai IC50
biomassa kering dari Spirulina platensis lebih dari 2000 ppm.
Ekstrak metanol dan air sarang semut dengan konsentrasi 20 µg/mL atau setara dengan 20000 ppm menghambat kerja enzim α-glukosidase sebesar 98.55% dan 7.09% (Tabel 5). Daya inhibisi α-glukosidase ekstrak metanol lebih baik daripada ekstrak air sarang semut. Hal ini sesuai dengan Sugiwati (2005) yang menunjukkan bahwa ekstrak metanol Phaleria macrocarpa (Scheff.) Boerl memiliki aktivitas inhibisi α-glukosidase yang lebih tinggi dibandingkan ekstrak air. Putri et al. (2010) menyatakan bahwa pelarut metanol dapat melarutkan hampir semua senyawa organik yang ada pada sampel, baik senyawa polar maupun non polar sehingga menyebabkan perbedaan ketertarikan senyawa metabolit saat proses ekstraksi.
Pada penelitian ini, ekstrak air sarang semut tidak menunjukkan potensi yang baik dalam menghambat enzim α-glukosidase. Jeli dan Makiyah (2011) menyatakan bahwa infusa Hydnophytum formicarum dapat meminimalkan gambaran kerusakan pankreas pada tikus diabetes terinduksi aloksan dengan dosis 130 mg/kgBB. Ekstraksi secara infusa menggunakan pelarut air pada temperatur penangas air 96-98°C selama 15-20 menit (DEPKES RI dan DITJEN POM 2000). Pada penelitian ini, ekstrak air didapatkan dengan menggunakan metode soxhletasi dengan waktu lebih dari 24 jam. Soxhletasi memiliki kelemahan yaitu tidak baik untuk zat aktif yang tidak tahan panas (Harborne 1987). Waktu untuk menguapkan pelarut lebih lama atau waktu ekstraksi yang lama dapat menyebabkan kerusakan zat aktif yang tidak tahan panas (DEPKES 1986).
Salah satu jenis obat sintetik antidiabetes komersial adalah acarbose yang dapat mengurangi kadar gula dengan cara mengendalikan penyerapan makanan dalam usus (Lehninger 2004). Obat ini bekerja dengan menghambat enzim di usus halus yang memecah karbohidrat menjadi glukosa (Bayer 2009). Pengujian inhibisi acarbose dilakukan sebagai kontrol positif. Nilai inhibisi enzim α-glukosidase acarbose dapat dilihat pada Tabel 6.
Tabel 6 Nilai inhibisi enzim α-glukosidase acarbose Konsentrasi sampel (ppm) % inhibisi 0.001 -54.86 0.01 1.40 0.1 18.73 0.5 79.34 1 93.96
Nilai inhibisi dengan konsentrasi 1 ppm, memiliki aktivitas paling tinggi yaitu sebesar 93.96% (Tabel 6). Nilai IC50 acarbose yang dihasilkan sebesar
0.1624 ppm. Zulhipri et al. (2007) menyatakan bahwa suatu sampel memiliki nilai IC50 lebih kecil dari 50 ppm, maka sampel tersebut dinyatakan aktif memiliki daya
14
dapat disimpulkan tidak mempunyai potensi yang baik sebagai inhibitor enzim α-glukosidase karena IC50 yang dihasilkan sebesar 1959 ppm.
Penghambat enzim terdiri atas dua jenis utama, yaitu yang bekerja secara irreversible dan reversible (Lehninger 2004). Penghambat irreversible bekerja dengan merusak gugus fungsional molekul enzim bagi aktivitas katalitiknya. Penghambat terikat secara kovalen pada sisi aktif enzim dan membentuk kompleks penghambat enzim yang bersifat tetap. Penghambat reversible bekerja karena adanya reaksi kesetimbangan di antara enzim dan inhibitor. Penghambat berikatan dengan enzim melalui ikatan yang lemah sehingga dilepaskan dari enzim dengan cara pengenceran, filtrasi gel, atau dialisis (King 1994).
Penghambat reversible terbagi menjadi dua jenis, yaitu penghambat reversible nonkompetitif dan penghambat reversible kompetitif. Penghambat reversible nonkompetitif terjadi apabila penghambat tidak berikatan pada sisi aktif enzim dan mengubah konformasi molekul enzim. Penghambat reversible kompetitif terjadi apabila adanya kompetisi penghambat dengan substrat untuk berikatan dengan sisi aktif dari enzim (Ophardt 2003).
Mekanisme kerja ekstrak sarang semut (Hydnophytum formicarum) yang berperan sebagai penghambat belum diketahui secara pasti. Mekanisme inhibisi dari suatu inhibitor apabila ingin diketahui maka perlu dilakukan pemetaan kebalikan ganda data kecepatan enzim (Lehninger 2004). Liu et al. (2006) menyatakan bahwa mekanisme inhibitor terhadap enzim α-glukosidase yaitu mengikat enzim secara reversible kompetitif. Inhibitor dengan struktur yang mirip dengan substrat normal berkompetisi dengan substrat normal untuk berikatan pada sisi aktif dari enzim.
Penyakit diabetes melitus dibagi beberapa kelompok, yaitu diabetes melitus tipe 1, diabetes melitus tipe 2, dan diabetes melitus pada kehamilan. Penyebab timbulnya diabetes melitus tipe 1 akibat kerusakan pada sel beta pulau Langerhans yang memproduksi insulin. Diabetes melitus tipe 2 ditandai dengan sel beta pulau Langerhans tidak rusak tapi insulin yang disekresikan jumlahnya sedikit dan tidak mencukupi kebutuhan tubuh akan insulin. Jenis diabetes melitus saat hamil karena adanya hormon plasenta yang bersifat anatagonis terhadap insulin. Kadar glukosa darah dapat dikontrol dengan cara mengkonsumsi obat tradisional yang berpotensi sebagai antidiabetes (Mahler 1991). Senyawa yang berpotensi sebagai antidiabetes dapat menghambat pemecahan karbohidrat dengan menghambat kerja enzim α-glukosidase, sehingga absorpsi glukosa dapat dicegah (Sundaram et al. 1998).
Menurut Tadera et al. (2006), golongan senyawa flavonoid berperan sebagai inhibitor enzim α-glukosidase. Penelitian Tiwari et al. (2007) membuktikan bahwa buah Sonneratia caseolaris memiliki nilai inhibisi enzim α-glukosidase dengan IC50 sebesar 15 ppm.
Aktivitas inhibisi enzim α-glukosidase dari Sonneratia lebih tinggi dibandingkan sarang semut. Senyawa flavonoid pada tumbuhan memberikan perlindungan terhadap stres lingkungan dan sinar ultraviolet (Winarno 1995). Sarang semut tumbuh sebagai epifit di hutan rawa dan mangrove seperti pada tumbuhan Melaleuca cajuputi dan Bruguiera gymnorrhiza (Parinding 2007). Apabila dibandingkan dengan tempat hidupnya, Sonneratia lebih bergantung terhadap cahaya serta mudah beradaptasi dengan kadar oksigen yang rendah dibandingkan Bruguiera (Bengen 2001). Hal ini sesuai dengan pernyataan
15 Rathore et al. (2003) menyatakan bahwa radiasi sinar matahari yang lebih tinggi dapat meningkatkan kandungan flavonoid pada gandum, serta penelitian Penuelas et al. (1999) membuktikan bahwa udara dengan kadar CO2 yang tinggi dapat
meningkatkan senyawa flavonoid. Menurut Pradono et al. (2011), faktor-faktor lingkungan yang mempengaruhi kadar flavonoid adalah suhu, sinar UV, sinar tampak, nutrisi, ketersediaan air, dan kadar CO2 pada atmosfer.
Uji Toksisitas Brine Shrimp Lethality Test
Metode Brine Shrimp Lethality Test (BSLT) dilakukan dengan cara pembuatan larutan ekstrak sarang semut yang diuji pada larva Artemia salina. Metode BSLT dipilih karena metode ini sering digunakan untuk praskrining terhadap senyawa aktif yang terkandung dalam ekstrak karena sederhana, cepat, mudah, murah, dapat dipercaya, dan hasilnya representatif (Meyer et al. 1982). Tamat et al. (2007) menyatakan bahwa ekstrak tersebut termasuk golongan tidak toksik maka kemungkinan dapat dikembangkan untuk tujuan yang luas, misalnya sebagai suplemen atau bahan baku kosmetika, sedangkan apabila termasuk golongan senyawa toksik maka kemungkinan dapat dikembangkan sebagai bahan baku obat. Hasil uji toksisitas pada ekstrak metanol dan air sarang semut dapat dilihat pada Tabel 7.
Tabel 7 Hasil uji toksisitas ekstrak sarang semut Pelarut (ppm) Mortalitas (%) LC50 (ppm) Kategori 5 50 100 500 1000 3000 5000 Metanol 0 3.33 3.33 3.33 33.33 53.33 56.67 735.02 Toksik rendah Air 3.33 3.33 6.67 10 16.67 23.33 23.33 258166.58 Tidak toksik Ekstrak metanol memiliki LC50 lebih rendah yaitu sebesar 735.02 ppm
dibandingkan dengan ekstrak air yaitu sebesar 258166.58 ppm (Tabel 7). Hal ini sesuai dengan penelitian Sugiwati (2005), ekstrak metanol buah mahkota dewa memiliki nilai LC50 lebih rendah dibandingkan ekstrak air, serta penelitian
Soeksmanto et al. (2009) yang membuktikan bahwa ekstrak air sarang semut tidak mendapatkan nilai LC50 karena tidak dijumpai kematian meskipun menggunakan
dosis hingga 3750 mg/kg bb pada mencit. Menurut McLaughlin et al. (1998), senyawa dengan LC50 ≤ 30 ppm dinyatakan sangat toksik, LC50 antara 31-200
ppm dinyatakan toksik, LC50 antara 201-1000 ppm dinyatakan toksik rendah, dan
16
SIMPULAN DAN SARAN
Simpulan
Rendemen ekstrak air lebih tinggi dari ekstrak metanol yaitu sebesar 11.135% dan 4.98%. Ekstrak metanol mengandung fenol dan flavonoid, sedangkan ekstrak air mengandung fenol, flavonoid, dan tanin. Kandungan flavonoid ekstrak metanol dan ekstrak air sarang semut sebesar 0.559% (b/b) dan 0.585% (b/b). Aktivitas inhibitor enzim α-glukosidase ekstrak metanol lebih baik daripada ekstrak air. Nilai inhibisi α-glukosidase ekstrak metanol terbesar 98.55% dengan IC50 sebesar 1959 ppm. Ekstrak air tidak menunjukkan potensi yang baik
dalam menghambat enzim α-glukosidase. Nilai kandungan flavonoid yang tinggi pada ekstrak air, tidak dapat membuktikan aktivitas yang baik dalam menghambat enzim α-glukosidase. Ekstrak metanol bersifat toksik rendah dengan nilai LC50
sebesar 735.02 ppm. Ekstrak air bersifat tidak toksik dengan nilai LC50 sebesar
258166.58 ppm.
Saran
Penelitian lebih lanjut perlu dilakukan untuk menentukan metode ektraksi dan waktu ekstraksi yang optimum yang tidak merusak komponen bioaktif sarang semut. Analisis lebih lanjut juga diperlukan untuk menentukan senyawa golongan flavonoid atau senyawa aktif lain yang berperan dalam menghambat kerja enzim α-glukosidase. Selain itu, diperlukan pengujian aktivitas antihiperglikemik secara in vivo.
DAFTAR PUSTAKA
[BPOM] Badan Pengawas Obat dan Makanan. 2009 Juli 1. Informasi obat antidiabetik oral. Informasi Produk Terapetik. 19(1):11.
[DEPKES] Departemen Kesehatan. 1986. Sediaan Galenik. Jakarta (ID): Dirjen Pengawasan Obat dan Makanan.
[DEPKES] Departemen Kesehatan. 2005. Jumlah penderita diabetes Indonesia ranking ke-4 di dunia. [internet]. [diacu 2012 Oktober 2]. Tersedia dari http://www.depkes.go.id/index.php.
[DEPKES RI dan DITJEN POM] Departemen Kesehatan Republik Indonesia dan Direktorat Jenderal Pengawasan Obat dan Makanan. 2000. Parameter Standar Umum Ekstrak Tumbuhan Indonesia. Jakarta (ID): Departemen Kesehatan RI. [WHO] World Health Organization. 2010. Diabetes [internet]. [diacu 2012
Oktober 2]. Tersedia dari: http://www.who.int/dietphysicalactivity.
Adewole SO, Ezkiel A, Martins C. 2006. Morphological changes an hypoglycemic effects of Annona muricata linn. (Annonaceae) leaf aqueous extract on pancreatic β-cells of streptozotocin-treated diabetic rats. African Journal of Biomedical Research 9: 173-187.
17 Alfarabi M. 2010. Kajian antidiabetogenik ekstrak daun sirih merah (Piper
crocatum) in vitro [tesis]. Bogor (ID): Institut Pertanian Bogor.
Astawan M, Kasih AL. 2008. Khasiat Warna-Warni Makanan. Jakarta (ID): Gramedia Pustaka Utama.
Basuki T, Indah DD, Nina A, Kardono LBS. 2002. Evaluasi aktivitas daya hambat enzim α-glukosidase dari ekstrak kulit batang, daun, bunga dan buah kemuning [Murraya Paniculata (L.) Jack.]. Prosiding Seminar Nasional Tumbuhan Obat Indonesia XXI; 2002 Maret 27-28; Surabaya, Indonesia. Surabaya (ID): Universitas Surabaya. hlm 314-318.
Bayer. 2009. Product information glucobay (acarbose) [internet]. [diacu 2013 Mei 4]. Tersedia dari: http://www.bayerresources.com.au/PI/file9350.pdf.
Bengen DG. 2001. Pedoman Teknis Pengenalan dan Pengelolaan Ekosistem Mangrove. Bogor (ID): Pusat Kajian Sumberdaya Pesisir dan Lautan, Institut Pertanian Bogor.
Bosenberg LH. 2008. The mechanism of action of oral antidiabetic drugs: a review of recent literature. The Journal of Endocrinology, Metabolism, and Diabetes of South Africa. 13(3):80-88.
Bustanussalam. 2010. Penentuan struktur molekul dari fraksi air tumbuhan “sarang semut” Myrmecodia pendens Merr. & Perry yang mempunyai aktivitas sitotoksik dan sebagai antioksidan [tesis]. Bogor (ID):Institut Pertanian Bogor. Chang CC, Yang MH, Wen HM, Chern JC. 2002. Estimation of total flavonoids
content in propolis by two complementary colorimetric methods. Journal Food Drug Analysis. 10: 178-182.
Copriyadi J, Yasmi E, Hidayati. 2005. Isolasi dan karakterisasi senyawa kumarin dari kulit buah jeruk purut (Citrus hystrix DC). Jurnal Biogenesis. 2(1):13-25. Cowan MM. 1999. Plant products as antimicrobial agents, Clinical Microbiology
Review. 12 (4) : 82-564.
Cui CB, Xu C, Gu QQ, Chu SD, Ji HH, Jing G. 2004. A new furostanol saponin from the water-extract of Dioscorea nipponica Mak., the raw material of the traditional Chinese herbal medicine wei ao xin. Chinese Chemical Letters. 15(10):1191-1194.
Dangles O, Fargeix G, Dufour C. 2000. Antioxidant properties of anthocyanins and tannins: a mechanistic investigation with catechin and the 3’,4’,7-trihydroxyflavylium ion. Journal Royal Society of Chemistry. 2:1653-1663. De Padua LS, Bunyapiaphatsara N, Lemmens RHMJ. 1999. Plant Resources of
South-East Asia: Medicinal and Poisonous Plants 1. Bogor (ID): Prosea Foundation.
Dewi DC. 2005. Pemisahan Kimia. Malang (ID): Universitas Islam Negeri Malang.
Engida AM, Kasim NS, Tsigie YA, Ismadji S. 2013. Extraction, identification and quantitative HPLC analysis of flavonoids from sarang semut (Myrmecodia pendan). Industrial Crops and Products. 41:392-396.
Escudero MR, Escudero FR, Remsberg CM, Takemoto JK, Davies NM, Yanez JA. 2008. Identification of polyphenols and anti-oxidant capacity of Piper aduncum L. The Open Bioactive Compounds Journal, 1:18-21.
Gamse T. 2002. Liquid-liquid Extraction and Solid-Liquid Extraction. New York (US): Graz Pr.
18
Harborne. 1987. Metode Fitokimia, Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Sudiro I, penerjemah. Bandung (ID): Penerbit ITB. Terjemahan dari: Phytochemical Methods.
Houghton PJ, Raman A. 1998. Laboratory Handbook for the Fractionation of Natural Extracts. London (GB): Chapman & Hall.
Jeli MM, Makiyah SNN. 2011. Pengaruh pemberian infusa tumbuhan sarang semut (Hydnophytum formicarum) terhadap gambaran histologi pankreas pada tikus (Rattus norvegicus) diabetes terinduksi aloksan. Majalah Kesehatan Pharma Medika. 3(1):200-204.
Kardono LBS. 2003. Kajian kandungan kimia mahkota dewa (Phaleria macrocarpa). Di dalam: Prosiding Pameran Produk Obat Tradisional dan Seminar Sehari Mahkota Dewa. Jakarta: Pusat Penelitian dan Pengembangan Farmasi dan Obat Tradisional Departemen Kesehatan, hlm 72-76.
Ketaren S. 2008. Pengantar Teknologi Minyak dan Lemak Pangan. Jakarta (ID): UI. Press.
Khopkar SM. 2003. Konsep Dasar Kimia Analitik. Jakarta (ID): UI-Press.
King FD. 1994. Medicinal Chemistry: Principles and Practice. Cambridge (GB): The Royal Society of Chemistry.
Kurniawati A, Darusman LK, Rachmawaty RY. 2005. Pertumbuhan, produksi dan kandungan triterpenoid dua jenis pegagan (Centella asiatica L (Urban)) sebagai bahan obat pada berbagai tingkat naungan. Buletin Agronomi. 33(3):62-67.
Lee SK, Hwang JY, Song JH, Jo JR, Kim MJ, Kim ME, Kim JI. 2007. Inhibitory activity of Euonymus alatus against alpha glucosidase in vitro and in vivo. Nutrition Research and Practice. 1(3):184-188.
Lehninger AL. 2004. Dasar-dasar Biokimia Jilid II. Thenawidjaja M, penerjemah. Jakarta (ID): Erlangga. Terjemahan dari : Principles of Biochemistry.
Liu Y, Zou L, Lin M, Wen-Hua Chen, Bo Wang. 2006. Synthesis and pharmacological activities of xanthone derivatives as alpha-glucosidase inhibitors. Bioorganics and Medical Chemistry. 14:5683-5690.
Lukacinova A, Mojzis J, Benacka R, Keller J, Maguth T, Kurila P, Vasko L, Racz O, Nistiar F. 2008. Preventive effects of flavonoids on alloxan-induced diabetes mellitus in rats. Acta Veterinaria Brno. 77 : 175-182.
Mahler RJ. 1991. Diabetes, Obesity, and Vascular Disease. London (GB) : Hemisphere.
McLaughlin JL, Rogers LL, Anderson JE. 1998. The use of biological assays to evaluate botanicals. Drug Information Journal. 32:513-524.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, Mclaughlin JL. 1982. Brine shrimp: a convenient general bioassay for active plant constituents. Planta Medica. 45:31-34.
Nobre CP, Raffin FN, Moura TF. 2005. Standardization of extracts from Momordica charantia L. (Cucurbitaceae) by total flavonoids content determination. Acta Farmaceutica Bonaerense 24(4):562-566.
Oktaviana PR. 2010. Kajian kadar kurkuminoid, total fenol dan aktivitas antioksidan ekstrak temulawak (Curcuma xanthorriza) pada berbagai teknik pengeringan dan proporsi pelarutan [skripsi]. Surakarta (ID): Universitas Sebelas Maret.
19 Ophardt CE. 2003. Mechanism of drug action by enzyme inhibition [internet]. [diacu 2013 Mei 4]. Tersedia dari:http://www.elmhurst.edu/chm/chembook/65 1enzymeinhibit.html.
Pambayun R, Gardjito M, Sudarmadji S, Kuswanto KR. 2007. Kandungan fenol dan sifat antibakteri dari berbagai jenis ekstrak produk gambir (Uncaria gambir Roxb). Majalah Farmasi Indonesia. 18(3):141-146.
Parinding Z. 2007. Potensi dan karakteristik bio-ekologis tumbuhan sarang semut di Taman Nasional Wasur Merauke Papua [tesis]. Bogor (ID): Institut Pertanian Bogor.
Pradono DI, Darusman LK, Susanti A. 2011. Inhibisi lipase pankreas secara in vitro oleh ekstrak air dan etanol daun asam jawa (Tamarindus indica) dan rimpang kunci pepet (Kaempferiae rotundae). Jurnal Natur Indonesia. 13(2):146-154.
Penuelas J, Estiarte M, Kimball EA. 1999. Flavonoid responses in wheat grown at elevated CO2: green versus senescent leaves. Photosynthetica. 37 (4):615-619.
Putri WS, Supriyanti FMT, Zackiyah. 2010. Penentuan aktivitas dan jenis inhibisi ekstrak metanol kulit batang Artocarpus heterophyllus Lamk sebagai inhibitor tirosinase. Jurnal Sains dan Teknologi Kimia. 1(1):94-99.
Rathore D. Agrawal SB, Singh A. 2003. Influences of supplemental UV-B radiation and mineral nutrients on biomass, pigment, and yield of two cultivars of wheat (Triticum aestivum L.). International Journal of Biotronics. 32:1-15. Rohyami Y. 2008. Penentuan kandungan flavonoid dari ekstrak metanol daging
buah mahkota dewa (Phaleria macrocarpa Scheff Boerl). Logika. 5 (1):1-8. Sancheti Shruti, Sancheti Sandesh, Seo S. 2009. Chaenomeles Sinensis: A potent
α-and β-glucosidase inhibitor. American Journal of Pharmacology and Toxicology. 4(1):8-11.
Sharma B, Viswanath G, Salunke R, Roy P. 2008. Effects of flavonoid-rich extract from seeds of Eugenia jambolana (L.) on carbohydrate and lipid metabolism in diabetic mice. Food Chemistry. 2:697-705.
Sembiring B, Ma’mun, Ginting EI. 2006. Pengaruh kehalusan bahan dan lama ekstraksi terhadap mutu ekstrak temulawak (Curcuma xanthorriza Roxb). Buletin Penelitian Tanaman Obat dan Aromatik. 17(2):53-58.
Silva BP, Sousa AC, Silva GM, Mendes TP, Parente JP. 2002. A new bioactive steroidal saponin from Agave attenuata. Zeitschrift für Naturforschung. 57c:423-428.
Simanjuntak P, Fanny, Subroto MA. 2010. Isolasi senyawa aktif dari ekstrak hipokotil sarang semut (Myrmecodia pendens Merr. & Perry) sebagai penghambat xantinoksidase. Jurnal Ilmu Kefarmasian Indonesia . 8(1):49-54. Sirait M. 2007. Penuntun Fitokimia dalam Farmasi. Bandung (ID): Penerbit ITB. Soeksmanto A, Simanjuntak P, Subroto MA. 2010. Uji toksisitas akut ekstrak air
tanaman sarang semut (Myrmecodia pendans) terhadap histologi organ hati mencit. Jurnal Natur Indonesia. 12(2):152-155.
Subroto MA. 2006. Ramuan Herbal untuk Diabetes Melitus. Jakarta (ID): Penebar Swadaya.
Subroto MA. 2006 Desember. Terpercaya di antara 71 jenis. Buletin Internal Landas. 16:7.
Subroto MA, Saputro H. 2006. Gempur Penyakit dengan Sarang Semut. Jakarta (ID): Penebar Swadaya.
20
Sugiwati S. 2005. Aktivitas antihiperglikemik dari ekstrak buah mahkota dewa [Phaleria macrocarpa (Scheff.)Boerl.] sebagai inhibitor alfa-glukosidase in vitro dan in vivo pada tikus putih [tesis]. Bogor (ID): Institut Pertanian Bogor. Sumardjo D. 2008. Pengantar Kimia: Buku Panduan Kuliah Mahasiswa
Kedokteran dan Program Strata 1 Fakultas Bioeksakta. Jakarta (ID): Buku Kedokteran EGC.
Sundaram A, Moses CRA, Ilango A, Seshiah V. Newer antidiabetic drugs. International Journal of Diabetes in Developing Countries. 18: 26-30.
Suradikusumah E. 1989. Kimia Tumbuhan. Bogor (ID): Pusat Antar Universitas Ilmu Hayat IPB.
Surbakti TR. 2013. Aktivitas antihiperglikemik dan antioksidan dari Spirulina platensis pada umur panen yang berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Suryanti V, Udin Z, Harliana D. 2006. Aktivitas antijamur ekstrak rimpang temu glenyeh (Curcuma soloensis val.). Jurnal Alchemy. 5(1):31-38.
Tadera K, Minami Y, Takamatsu K, Matsuoka T. 2006. Inhibition of α-glucosidase and α-amylase by flavonoids. Journal of Nutritional Science and Vitaminology. 52:149-153.
Taebe B, Randalinggi EA, Manggau MA, Usmar. 2012. Uji efek hipoglikemik kombinasi ekstrak etanol propolis dan ekstrak etanol sarang semut (Myrmecodia pendens Merr & Perry) pada mencit (Mus musculus). Majalah Farmasi dan Farmakologi. 16 (3): 151-158.
Tamat SR, Wikanta T, Maulina LS. 2007. Aktivitas antioksidan dan toksisitas senyawa bioaktif dari ekstrak rumput laut hijau Ulva reticulata Forsskal. Jurnal Ilmu Kefarmasian Indonesia. 5(1):31-36.
Tiwari AK, Viswanadh V, Gowri PM, Ali AZ, Radhakrishan SVS, Agawane SB, Madusudhana K, Rao JM. 2010. Oleanolic acid an α-glucosidase inhibitory and antihyperglycemic active compound from the fruits of Sonneratia caseolaris. Journal of Medicinal and Aromatic Plants. 1(1):19-23.
Wanma A. 2007 Juli. Pemanfaatan hutan mangrove “Bruguiera gymnorhiza (L) Lamk sebagai bahan penghasil karbohidrat”. Warta Konservasi Lahan Basah. 15 (2): 6.
Waring WS. 2007. Antidiabetic drugs. Elsevier Medicine. 35(11):590-591.
Winarno FG. 1995. Pangan, Gizi, Teknologi dan Konsumen. Jakarta (ID): Gramedia Pustaka Utama.
Yuliastuti W. 2011. Uji aktivitas penghambatan enzim alfa-glukosidase dan penapisan fitokimia dari beberapa tanaman family Apocynaceae dan Rubiaceae [skripsi]. Depok (ID): Universitas Indonesia.
Zulhipri, Kartika IR, Sumaji I. 2007. Uji fitokimia dan aktivitas antidiabetes ekstrak biji rambutan (Nephelium lappaceum L) dengan berbagai pelarut. Ebbers Papyrus. 13(3):89-97.
21 Lampiran 1 Perhitungan rendemen ekstrak sarang semut
Jenis pelarut Ulangan
Bobot awal (gram) Botol kosong (gram) Botol isi sampel (gram) Rendemen (%) Rata-rata Metanol 1 25 36.3900 37.5039 4.46 4.98 2 25 37.9566 39.3396 5.53 Air 1 25 36.7910 40.4114 14.48 11.135 2 25 35.8454 37.7928 7.79 a. Ekstak Metanol Rendemen ulangan 1 = –
x 100% = – x 100% = 4.46% Rendemen ulangan 2 = – x 100% = 5.53% Rata-rata :
= 4.98%
b. Ekstrak Air Rendemen ulangan 1 = –x 100% = – x 100% = 14.48% Rendemen ulangan 2 = – x 100% = 7.79% Rata-rata : = 11.135%
22
Lampiran 2 Hasil uji fitokimia ekstrak metanol
Alkaloid Tanin
Fenol hidrokuinon Steroid
23 Lampiran 3 Hasil uji fitokimia ekstrak air
Alkaloid Tanin
Fenol hidrokuinon Steroid
24
Lampiran 4 Hasil uji inhibisi enzim α-glukosidase ekstrak metanol
y = 28.47ln(x) + 89.41 R² = 0.818 y = 27.94ln(x) + 93.71 R² = 0.889 y = 21.68ln(x) + 94.58 R² = 0.913 -50 0 50 100 150 0.0 0.5 1.0 1.5 2.0 2.5 % i n hibi si Konsentrasi (%)
IC
50Ekstrak metanol
25 Lampiran 5 Hasil uji inhibisi enzim α-glukosidase acarbose
y = 21.82ln(x) + 90.11 R² = 0.982 y = 20.97ln(x) + 90.91 R² = 0.957 y = 19.44ln(x) + 82.71 R² = 0.902 -100 -50 0 50 100 150 0 0.2 0.4 0.6 0.8 1 1.2 % i n hibi si Konsentrasi (ppm)
IC
50Acarbose
26
27 Lampiran 7 Hasil uji toksisitas ekstrak metanol
y = 1.586x - 0.454 R² = 0.893 0 1 2 3 4 5 6 0 1 2 3 4 P ro b it % m o rt al it as Log konsentrasi
28
Lampiran 8 Hasil uji toksisitas ekstrak air
y = 0.437x + 2.635 R² = 0.913 0 0.5 1 1.5 2 2.5 3 3.5 4 4.5 0 1 2 3 4 P ro b it % m o rt al it as Log konsentrasi
29
RIWAYAT HIDUP
Penulis dilahirkan di Jakarta, pada.tanggal 16 September 1991. Penulis merupakan anak kedua dari dua bersaudara dari pasangan bernama Suloso dan Endang Puji Astuti. Pendidikan formal yang ditempuh penulis dimulai di SDN Pekayon 13 Jakarta pada tahun 1997 hingga tahun 2003. Penulis melanjutkan pendidikan pada tahun yang sama di SMPN 91 Jakarta hingga tahun 2006. Pendidikan formal selanjutnya ditempuh di SMA Angkasa 1 Jakarta pada tahun 2006 dan lulus pada tahun 2009.
Penulis diterima sebagai mahasiswa di Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan, Institut Pertanian Bogor melalui jalur USMI (Undangan Seleksi Masuk IPB) pada tahun 2009. Selama perkuliahan, penulis aktif berorganisasi dalam bidang Pengembangan Sumberdaya Manusia (PSDM) Himpunan Mahasiswa Teknologi Hasil Perairan (HIMASILKAN) tahun 2011 dan Badan Eksekutif Mahasiswa Fakultas Perikanan dan Ilmu Kelautan (BEM FPIK) sebagai sekretaris Biro Coorporation tahun 2012, anggota FPC (Fisheries Processing Club) pada tahun 2011-2012. Penulis juga aktif sebagai asisten praktikum m.k Avertebrata Air tahun 2012. Selain itu penulis juga aktif dalam kepanitiaan berbagai kegiatan kemahasiswaan di Institut Pertanian Bogor.