FRAKSINASI SENYAWA ANTIMIKROBA KAPANG
ENDOFIT DARI TUMBUHAN PESISIR SARANG SEMUT
(Hydnophytum formicarum)
NURZAKIAH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis berjudul ”Fraksinasi senyawa antimikroba kapang endofit dari tumbuhan pesisir sarang semut (Hydnophytum formicarum)” adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Oktober 2015
RINGKASAN
NURZAKIAH. Fraksinasi senyawa antimikroba kapang endofit dari tumbuhan pesisir sarang semut (Hydnophytum formicarum). Dibimbing oleh KUSTIARIYAH TARMAN dan DESNIAR.
Sarang semut merupakan tumbuhan epifit yang hidup menempel pada tumbuhan lain. Sarang semut telah terbukti memiliki aktivitas antikanker, antioksidan, serta memiliki aktivitas penghambatan terhadap beberapa jenis bakteri. Tumbuhan obat yang sudah diketahui khasiatnya diduga memiliki mikroba endofit yang mampu menghasilkan senyawa aktif yang mirip dengan inangnya. Isolasi kapang endofit dari umbi tumbuhan sarang semut (Hydnophytum formicarum) telah dilakukan dan menghasilkan tujuh isolat kapang endofit yang berbeda. Penelitian sebelumnya menunjukkan kapang endofit sarang semut (kode RS3 dan RS6B) memiliki aktivitas antibakteri terhadap bakteri Escherichia coli dan Staphylococcus aureus. Tujuan penelitian ini adalah menentukan aktivitas antimikroba ekstrak kapang endofit sarang semut terpilih dan menentukan fraksi yang aktif terhadap mikroba uji.
Uji aktivitas antimikroba kapang endofit dari tumbuhan pesisir sarang semut menunjukkan bahwa isolat kapang RS1A memiliki penghambat yang signifikan lebih tinggi dengan rata-rata diameter zona hambat 4,7 mm terhadap bakteri E. coli dan Bacillus subtilis dibandingkan dengan isolat lainnya (p<0,05). Rendemen ekstrak kultur isolat kapang RS1A tertinggi terdapat pada kultur statis hari ke-21 yaitu 0,0381%. Hasil uji aktivitas antimikroba menunjukkan ekstrak isolat RS1A pada kultur statis hari ke-21 memiliki zona hambat yang signifikan lebih tinggi dibandingkan kultur shaker terhadap bakteri E. coli (p<0,05). Uji aktivitas antimikroba ekstrak media kapang RS1A dengan kultur statis hari ke-21 juga menunjukkan ekstrak kapang RS1A memiliki aktivitas penghambatan terhadap B. subtilis, B. subtilis ATCC 19659, S. aureus ATCC 6538, dan Candida maltosa. Ekstrak kasar kapang RS1A mengandung senyawa alkaloid, flavonoid, fenol hidrokuinon, dan steroid. Fraksinasi senyawa antimikroba kapang RS1A menggunakan tiga jenis eluen. Hasil uji bioautografi dengan eluen B (etil asetat:metanol:n-heksana=3:1:1) menunjukkan fraksi dapat menghambat ketiga jenis mikroba uji. Penghambatan terjadi pada nilai Rf 0,69 terhadap B. subtilis dan E.coli, serta pada nilai Rf 0,53 terhadap B. subtilis dan C. maltosa. Kedua fraksi tersebut diduga merupakan senyawa golongan fenol berdasarkan hasil penyemprotan dengan pereaksi anisaldehida-asam sulfat yang menghasilkan warna kuning. Pemisahan fraksi aktif dengan kromatografi lapis tipis preparatif (KLTP) menunjukkan zona hambat hanya terdapat pada fraksi 2 yaitu 9,5 mm terhadap bakteri B. subtilis.
SUMMARY
NURZAKIAH. Fractionation of Antimicrobial Compounds of Endophytic Fungi from Coastal Plant Sarang Semut (Hydnophytum formicarum). Supervised by KUSTIARIYAH TARMAN and DESNIAR.
Sarang semut is an epiphytic plant living attached to other plants. In some studies, sarang semut showed anticancer activity, antioxidant, and inhibitory activity against several types of bacteria. Medicinal plants contain endophytic microbes that can produce active compounds similar to the compounds derived from their host. Seven isolates of endophytic fungi from sarang semut tuber (Hydnophytum formicarum) were screened for antimicrobial activity. Isolates RS3 and RS6B known to have antibacterial activity against Escherichia coli and Staphylococcus aureus. The aims of this study were to determine antimicrobial activity of selected endophytic fungus from sarang semut plan and the active fraction with antimicrobial activity.
Screening of endophytic fungi for antimicrobial activity from sarang semut plants showed that isolate RS1A exhibited the widest activity with zone of inhibition 4.7 mm against E. coli and B. subtilis compared to other isolates (p<0,05). Isolate RS1A showed the highest crude extract on static culture (day 21) with extract yield was 0,0381%. Antibacterial activity of the isolate RS1A by the static culture harvested on day-21 was significantly higher against E. coli (p<0,05). Crude extract of isolate RS1A from static culture harvested on day-21 also showed antimicrobial activity against B. subtilis, B. subtilis ATCC 19659, S. aureus ATCC 6538, and C. maltosa. Compounds detected in the extracts were alkaloids, flavonoids, phenols hydroquinone, and steroids. Fractionation of antimicrobial compounds from RS1A using three types of eluent. Bioautography test with eluent B (ethyl acetate:methanol:n-heksane=3:1:1) revealed that fractions inhibited all three microbes tested. Inhibition occurs in the Rf value of 0.69 against B. subtilis and E. coli, and on the Rf value of 0.53 against B. subtilis and C. maltosa. Both fraction were suspected as a group of phenol compounds based on the staining with anisaldehyde-sulfuric acid reagent which produces a yellow color. Fractionation using preparative TLC resulted that only fraction 2 was active against B. subtilis with an inhibition zone of 9.5 mm.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
FRAKSINASI SENYAWA ANTIMIKROBA KAPANG
ENDOFIT DARI TUMBUHAN PESISIR SARANG SEMUT
(Hydnophytum formicarum)
NURZAKIAH
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PRAKATA
Puji syukur penulis ucapkan kehadirat Allah SWT yang telah melimpahkan Rahmat dan Karunia-Nya, sehingga penulis dapat menyelesaikan tesis dengan judul “Fraksinasi senyawa antimikroba kapang endofit dari tumbuhan pesisir sarang semut (Hydnophytum formicarum)”. Tesis ini merupakan salah satu syarat untuk mendapatkan gelar Magister Sains di Program Studi Teknologi Hasil Perairan, Sekolah Pascasarjana, Institut Pertanian Bogor.
Kesuksesan penulis mengikuti pendidikan di Sekolah Pascasarjana IPB ini tidak lepas dari dukungan berbagai pihak. Penulis menyampaikan banyak terima kasih yang setulusnya kepada:
1. Dr Kustiariyah Tarman, SPi, MSi selaku ketua komisi pembimbing dan Dr Desniar, SPi, MSi sebagai anggota komisi pembimbing atas kesediaan
waktu untuk membimbing, memberikan arahan dan masukan selama penyusunan tesis ini.
2. Dr Ir Wini Trilaksani, MSc selaku ketua program studi Teknologi Hasil Perairan dan Dr Tati Nurhayati, SPi MSi selaku perwakilan gugus kendali mutu atas kesediaan waktu dan masukan yang diberikan kepada penulis. 3. Dr Ir Sri Purwaningsih, MSi selaku penguji luar komisi atas ketersediaan
waktu dan masukan yang diberikan.
4. Keluarga besar penulis ayah A. Kadir. Z (alm) dan ibu Nurilas HR, serta kakak-kakak Desy Saswita, Widyastuti, Fahruddin, dan Nelmayati atas doa, semangat, dan dukungan selama penulis menempuh studi.
5. Bapak dan Ibu staf pengajar, staf administrasi dan laboran Program Studi Teknologi Hasil Perairan serta laboran Kimia Analitik, Departemen Kimia yang telah banyak membantu selama penulis menempuh studi.
6. Teman-teman pascasarjana THP 2012, THP 44, penghuni Wisma Ar-riyad, alumni SMAN Plus generasi 7, dan semua sahabat yang telah banyak memberikan semangat kepada penulis.
DAFTAR ISI
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xii
1 PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Perumusan Masalah 2
2 METODE PENELITIAN 3
Waktu dan Tempat 3
Bahan dan Alat 3
Prosedur Penelitian 3
Seleksi Kapang Endofit 4
Kultivasi Kapang Endofit 4
Ekstraksi 6
Uji Aktivitas Antimikroba 6
Uji Senyawa Aktif 7
Fraksinasi dan Biautografi 7
Fraksinasi dengan kromatografi lapis tipis (KLT) 7
Pengujian bioautografi 7
Fraksinasi dengan kromatografi lapis tipis preparatif (KLTP) 8
Analisis Data 8
3 HASIL DAN PEMBAHASAN 10
Seleksi Kapang Endofit Sarang Semut 10
Pertumbuhan Isolat Kapang RS1A 11
Ekstrak Kapang RS1A 13
Aktivitas Antimikroba Kapang RS1A 15
Senyawa Aktif Kapang RS1A 19
Fraksi Aktif Kapang RS1A 20
4 SIMPULAN DAN SARAN 24
Simpulan 24
Saran 24
DAFTAR PUSTAKA 25
LAMPIRAN 31
DAFTAR TABEL
1 Hasil uji senyawa ekstrak kasar media isolat kapang RS1A 19 2 Fraksi aktif hasil bioautografi isolat kapang RS1A 22
3 Aktivitas antimikroba fraksi isolat kapang RS1A 23
DAFTAR GAMBAR
1 Isolat kapang endofit tumbuhan pesisir sarang semut 4
2 Diagram alir penelitian 5
3 Diagram alir fraksinasi senyawa antimikroba kapang endofit
tumbuhan sarang semut 8
4 Diameter zona hambat isolat kapang endofit tumbuhan sarang semut
terhadap bakteri E. coli ( ) dan B. subtilis ( ) 10 5 Kurva pertumbuhan isolat kapang RS1A selama 30 hari
( kultur shaker, kultur statis) 12
6 Nilai pH isolat kapang RS1A selama 30 hari
( kultur shaker, kultur statis) 13
7 Rendemen media isolat kapang RS1A ( shaker, statis) 14 8 Aktivitas antimikroba ekstrak isolat kapang RS1A terhadap bakteri
E. coli (kultur dengan shaker, konsentrasi ekstrak 1 mg, 2 mg), (kultur statis, konsentrasi ekstrak 1 mg, 2 mg) 15 9 Aktivitas antimikroba ekstrak isolat kapang RS1A terhadap bakteri
B. subtilis (kultur dengan shaker, konsentrasi ekstrak 1 mg,
2 mg), (kultur statis, konsentrasi ekstrak 1 mg, 2 mg) 16 10 Aktivitas antimikroba ekstrak media isolat kapang RS1A
( konsentrasi ekstrak 0,5 mg, 1 mg, 2 mg,
kontrol positif kloramfenikol 300 µg) 17
11 Kromatogram ekstrak media isolat kapang RS1A (A) kloroform:metanol (9:1), (B) etil asetat:metanol:n-heksana (3:1:1), (C) n-heksana:etil asetat
(1:4) 21
12 Biautogram ekstrak kapang RS1A dengan eluen B (etil asetat:metanol:n-heksana (3:1:1)) terhadap (1) E. coli (2) B. subtilis (3) C. maltosa 22
DAFTAR LAMPIRAN
1 Hasil uji univariate pengaruh perbedaan jenis bakteri uji dan isolat
kapang terhadap diameter zona hambat 33
2 Hasil uji lanjut Duncan pengaruh perbedaan isolat kapang terhadap
diameter zona hambat 33
3 Kultur isolat kapang endofit RS1A dengan shaker dan kultur statis 33 4 Hasil uji univariate pengaruh perbedaan kondisi kultivasi dan konsentrasi
ekstrak isolat kapang RS1A terhadap diameter zona hambat pada bakteri
E. coli 34
5 Hasil uji lanjut Duncan pengaruh interaksi kondisi kultivasi dan
konsentrasi ekstrak isolat kapang RS1A terhadap diameter zona hambat
pada bakteri E. coli 37
6 Hasil uji univariate pengaruh perbedaan kondisi kultivasi dan konsentrasi ekstrak isolat kapang RS1A terhadap diameter zona hambat pada bakteri
B. subtilis 38
7 Hasil uji lanjut Duncan pengaruh interaksi kondisi kultivasi dan
konsentrasi ekstrak isolat kapang RS1A terhadap diameter zona hambat
pada bakteri B. subtilis 40
8 Hasil aktivitas antibakteri ekstrak isolat kapang endofit RS1A (kultur
1
1 PENDAHULUAN
Latar Belakang
Sarang semut merupakan tumbuhan epifit yang hidup menempel pada tumbuhan lain. Tumbuhan sarang semut hidup menempel pada tumbuhan kayu putih (Melalucea), cemara gunung (Casuarina), Kaha (Castanopsis) dan pada beberapa tumbuhan pesisir. Tumbuhan sarang semut tersebar di hutan bakau dan pohon-pohon pinggir pantai hingga ketinggian 2.400 m di atas permukaan laut (Subroto dan Saputro 2008). Tumbuhan ini dinamakan sarang semut karena bagian dalam hipokotil tumbuhan ini digunakan sebagai sarang oleh semut terutama dari genus Irydomyrmex. Sarang semut merupakan anggota famili Rubiaceae yang terdiri dari 5 genus, tetapi hanya 2 genus saja yang berasosiasi dengan semut, yaitu Hydnophytum dan Myrmecodia. Jenis Hydnophytum formicarum, Myrmecodia pendans, dan Myrmecodia tuberosa telah diketahui memiliki potensi sebagai obat (Soeksmanto et al. 2010).
Sarang semut dipercaya sebagai obat terutama oleh masyarakat Papua. Pemanfaatan tumbuhan sarang semut sebagai pengobatan tradisional telah dilakukan secara turun-temurun karena dianggap mampu mengobati beberapa penyakit, misalnya maag, ambeien, mimisan, sakit punggung, alergi, gangguan asam urat, stroke, jantung koroner, TBC, tumor, kanker, serta penstimulasi produksi air susu (Subroto dan Saputro 2008).
Manfaat sarang semut telah dibuktikan melalui beberapa penelitian. Ekstrak sarang semut diketahui memiliki aktivitas antikanker dengan nilai IC50 27,61 ppm terhadap sel kanker HeLa dan 54,57 ppm terhadal sel kanker MCM-B2 (Soeksmanto et al. 2010), serta dapat dijadikan sebagai agen terapi/therapeutic agents (Zuas et al. 2014). Sarang semut mengandung antioksidan dengan kandungan flavonoid dan polifenol masing-masing adalah 2,96 mg/g berat kering dan 16,41 mg/g berat kering (Engida et al. 2014; Sanjaya et al. 2014). Sarang semut bemanfaat sebagai imunomodulator karena meningkatkan proliferasi limfosit (Hertiani et al. 2010) serta dapat meningkatkan fungsi hati pada tikus percobaan (Sujono et al. 2014). Ekstrak buah sarang semut mengandung flavonoid, fenol, tanin dan karbohidrat, serta memiliki aktivitas sitotoksik dan antioksidan (Bustanussalam 2010). Sarang semut Hydnophytum formicarum juga diketahui memiliki aktivitas penghambatan terhadap beberapa jenis bakteri yaitu Staphylococcus aureus, Bacillus cereus, Shigella dysenteriae dan Corynebacterium diphtheriae (Prachayasittikul et al. 2008).
2
Eksplorasi suatu organisme sebagai sumber senyawa bioaktif dari kapang endofit lebih menguntungkan dibandingkan dengan isolasi dari inangnya. Kapang endofit dapat dijadikan sebagai alternatif melindungi dan menjaga kelestarian tumbuhan inang dan habitat alaminya (Onifade 2007, Kjer et al. 2010). Pemanfaatan kapang endofit lebih menguntungkan karena kultur kapang endofit lebih mudah dilakukan, dapat diproduksi dalam jumlah yang besar dalam waktu yang singkat, serta tidak tergantung musim dan cuaca (Dompeipen et al. 2011). Rendemen senyawa aktif yang sangat sedikit juga menjadi masalah dalam pengembangan senyawa bioaktif sebagai bahan obat (Bhakuni dan Rawat 2005), sehingga diperlukan pengembangan kapang endofit sebagai sumber antibiotik
yang lebih hemat biaya dan tersedia dalam jumlah yang banyak (Denis et al. 1988, Stobel et al. 1996, Ho et al. 2005).
Isolasi kapang endofit dari umbi tumbuhan sarang semut (Hydnophytum formicarum) telah dilakukan Sahara (2013) dan menghasilkan tujuh isolat kapang endofit berbeda. Penelitian terkait kemampuan kapang endofit sarang semut sebagai bahan antimikroba belum banyak dilakukan, sehingga perlu dilakukan penelitian untuk mengetahui potensi tersebut. Penelitian lain mengenai antibakteri kapang endofit sarang semut ini menyebutkan isolat RS3 dan RS6B memiliki aktivitas antibakteri terhadap bakteri Escherichia coli dan Staphylococcus aureus (Fajri 2014; Indra 2015).
Tujuan Penelitian
Penelitian ini bertujuan untuk menentukan aktivitas antimikroba ekstrak kapang endofit sarang semut terpilih dan menentukan fraksi yang aktif terhadap mikroba uji.
Rumusan Masalah
3
2 METODE
Waktu dan Tempat
Penelitian dilaksanakan pada Januari 2014 hingga Desember 2014, di Laboratorium Mikrobiologi Hasil Perairan, Departemen Teknologi Hasil Perairan, Fakultas Perikanan dan Ilmu Kelautan dan Laboratorium Kimia Analitik, Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bahan dan Alat
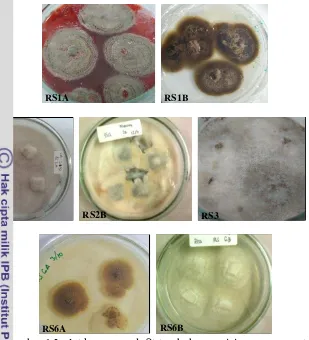
Bahan yang digunakan pada penelitian ini adalah 7 isolat kapang endofit (kode RS1A, RS1B, RS2A, RS2B, RS3, RS6A, dan RS6B) koleksi Laboratorium Mikrobiologi Hasil Perairan, Teknologi Hasil Perairan hasil isolasi dari umbi tumbuhan pesisir sarang semut (Hydnophytum formicarum) yang berasosiasi dengan tumbuhan bakau Avicennia sp. dari Sorong, Papua (Gambar 1). Bahan lain yang digunakan yaitu akuades, alkohol 70 %, kertas pH, beberapa media pertumbuhan kapang dan bakteri yaitu Potato Dextrose Agar (PDA), Potato Dextrose Broth (PDB), Nutrient Agar (NA), Nutrient Broth (NB), dan Mueller Hinton Agar (MHA), serta etil asetat sebagai pelarut dalam proses ekstraksi. Mikroba uji yang digunakan yaitu Staphylococcus aureus ATCC6538, Bacillus subtilis, Bacillus subtilis ATCC19659, Escherichia coli, Escherichia coli ATCC8739, Pseudomonas aeruginosa ATCC15442, Candida maltosa, serta antibiotik kloramfenikol sebagai kontrol positif pada uji. Bahan-bahan yang digunakan dalam pengujian fraksi aktif dan bioautografi yaitu pelat alumina oxide silica gel 60 F254 (Merck) KgaA, etil asetat, metanol, kloroform, n-heksana, pereaksi warna anisaldehida-asam sulfat (komposisi: 0,5 mL anisaldehida, 10 mL asam asetat glacial, 85 mL metanol, 5 mL asam sulfat pekat), dan pelat kaca silica gel PF254 20x20 cm (Merck).
Alat yang digunakan pada penelitian ini antara lain clean bench (Thermo Scientific 1300 Series A2), oven, autoklaf (Yamato SM52), shaker, corong pemisah, mikropipet, spektrofotometer (UV Vis UV-2500), inkubator (Thermolyne type 42000), vacuum rotary evaporator (Heidolph VV 2000), vortex (Pasolina type NS-8), timbangan digital (Max 410 g and HF400), kertas saring, dan alat-alat gelas yaitu cawan petri, gelas ukur, gelas piala, labu Erlenmeyer, tabung reaksi, dan pipet volumetrik.
Prosedur Penelitian
4
Gambar 1 Isolat kapang endofit tumbuhan pesisir sarang semut
Seleksi Kapang Endofit
Isolat kapang endofit tumbuhan sarang semut koleksi laboratorium diremajakan terlebih dahulu dengan cara ditumbuhkan dalam media PDA baru. Proses peremajaan dilakukan dengan cara mengambil potongan kapang koleksi kemudian dipindahkan ke media PDA steril dan diinkubasi pada suhu ruang (27-29 oC) selama 7 hari.
Seleksi kapang endofit dilakukan secara langsung terhadap mikroba uji, yaitu bakteri B. subtilis dan E. coli. Bakteri uji diremajakan terlebih dahulu dalam media NA miring dan diinkubasi selama 24 jam pada suhu 37 oC. Bakteri selanjutnya dikultur dalam media NB steril. Kultur bakteri sebanyak 100 µL yang telah diinkubasi pada suhu 37 oC selama 24 jam ditambahkan ke dalam 20 mL media NA semisolid. Cawan petri yang berisi campuran NA semisolid dan kultur bakteri kemudian dibiarkan memadat. Isolat kapang pada media PDA yang telah berumur 7 hari kemudian dipotong bulat (diameter 1 cm) dan dipindahkan ke cawan tersebut. Cawan diinkubasi pada suhu 37 oC selama 24 jam. Aktivitas antimikroba diindikasi dengan terbentuknya zona bening (Papuangan 2009).
Kultivasi Kapang Endofit
Tahapan kultivasi dilakukan untuk menentukan waktu kultivasi terbaik kapang endofit yang diperoleh. Kapang terpilih hasil seleksi yang dikultur pada media PDA ditumbuhkan pada media PDB (prekultur) selama 7 hari pada suhu ruang (27-29 oC). Kapang hasil prekultur (10 mL) diinokulasikan ke dalam 200 mL
RS3
RS1A RS1B
RS2A RS2B
5
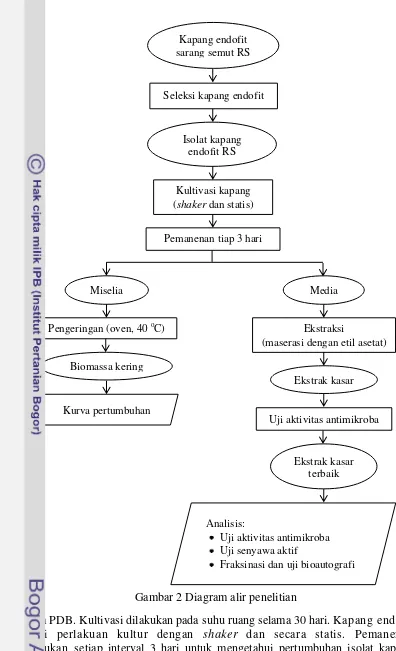
Gambar 2 Diagram alir penelitian
media PDB. Kultivasi dilakukan pada suhu ruang selama 30 hari. Kapang endofit diberi perlakuan kultur dengan shaker dan secara statis. Pemanenan dilakukan setiap interval 3 hari untuk mengetahui pertumbuhan isolat kapang tersebut. Uji yang dilakukan pada setiap pemanenan terdiri dari penghitungan
Ekstrak kasar terbaik
Analisis:
Uji aktivitas antimikroba Uji senyawa aktif
Fraksinasi dan uji bioautografi Kapang endofit
sarang semut RS
Seleksi kapang endofit
Isolat kapang endofit RS
Kultivasi kapang (shaker dan statis)
Pemanenan tiap 3 hari
Miselia Media
Pengeringan (oven, 40 oC) Ekstraksi
(maserasi dengan etil asetat)
Biomassa kering
Ekstrak kasar
6
biomassa kering kapang, pH dan aktivitas antibakteri dari ekstrak media pertumbuhan kapang. Penentuan biomassa kering kapang dilakukan dengan menyaring miselia menggunakan kertas saring, kemudian dikeringkan menggunakan oven (suhu 40 oC). Bobot kering miselia ditimbang sehingga didapatkan biomassa kapang. Kurva pertumbuhan kapang ditentukan berdasarkan waktu kultivasi dan bobot biomassa (Srikandace et al. 2007). Selama pengamatan, ekstrak media kapang diuji aktivitas antimikrobanya terhadap B. subtilis dan E. coli.
Kultivasi dalam jumlah yang lebih besar dilakukan setelah diketahui waktu pertumbuhan kapang optimal. Kultivasi dilakukan dengan cara 15 mL prekultur kapang endofit terseleksi diinokulasikan ke dalam enam buah labu Erlenmeyer yang masing-masing berisi 300 mL media PDB steril. Kapang dikultur pada suhu ruang (27-29 oC) hingga mencapai waktu optimal sesuai dengan yang dihasilkan pada tahap penentuan kurva pertumbuhan.
Ekstraksi
Proses ekstraksi dilakukan terhadap media kultur yang telah dipisahkan dengan miselia. Ekstraksi menggunakan pelarut etil asetat dengan metode maserasi. Proses maserasi dilakukan dengan menambahkan etil asetat pada media kultur kemudian diberi goyangan menggunakan shaker selama 24 jam. Ekstrak yang diperoleh kemudian dipisahkan dari media menggunakan corong pisah. Proses ini dilakukan sebanyak 3 kali. Ekstrak dipekatkan menggunakan vacuum rotary evaporator pada suhu 40 °C sehingga diperoleh ekstrak kasar dari media kultur (Nursid et al. 2010).
Uji Aktivitas Antimikroba
7
antimikroba khamir C. maltosa dilakukan dengan cara yang sama menggunakan media PDA dan PDB yang diinkubasi pada suhu ruang (27-29 oC) selama 48 jam.
Uji Senyawa Aktif (Harborne 1987)
Uji alkaloid : 10 mg sampel dimasukkan ke dalam tabung reaksi lalu ditambahkan dengan H2SO4 dan dikocok hingga benar-benar tercampur. Campuran disaring lalu masing-masing ditambahkan pereaksi Meyer, Wagner, dan Dragendorff. Sampel dinyatakan positif mengandung senyawa alkaloid dengan melihat adanya endapan putih, endapan coklat, dan endapan jingga pada masing-masing pereaksi.
Uji flavonoid : 10 mg sampel ditambahkan 0,05 mg serbuk Mg, setelah itu ditambahkan 0,2 mL amil alkohol dan 4 mL alkohol. Hasil uji positif bila larutan berwarna merah, kuning atau jingga pada lapisan amil alkohol.
Uji terpenoid dan steroid : 10 mg sampel ditambah dengan kloroform, lalu ditetesi dengan anhidrida asam asetat sebanyak 5 tetes. Larutan ditambahkan dengan 3 tetes H2SO4. Larutan akan berwarna merah. Hasil uji steroid positif bila warna larutan berubah menjadi biru atau hijau, sedangkan hasil uji triterpenoid positif bila terbentuk warna merah kecoklatan atau ungu pada lapisan permukaan sampel.
Uji fenol hidrokuinon : 10 mg sampel dicampurkan dengan 0,25 mL etanol, selanjutnya ditambahkan 2 tetes FeCl3 5 %. Senyawa fenol hidrokuinon dalam bahan uji ditunjukkan oleh terbentuknya warna hijau/biru yang berubah menjadi merah.
Fraksinasi dan Biautografi
Ekstrak kasar terpilih difraksinasi menggunakan kromatografi lapis tipis (KLT). Fraksi yang memiliki daya hambat terhadap mikroba uji berdasarkan uji biautografi kemudian diisolasi dengan kromatografi lapis tipis preparatif (KLTP) (Gambar 3).
Fraksinasi dengan kromatografi lapis tipis (KLT)
Ekstrak kasar kapang endofit terpilih difraksinasi dengan kombinasi pelarut (eluen) yang memiliki tingkat kepolaran berbeda. Pencarian kombinasi eluen dilakukan dengan menotolkan ekstrak pada pelat KLT dan dielusi dengan kombinasi pelarut. Pelarut yang digunakan adalah metanol, etanol, aseton, etil asetat, diklorometana, kloroform, dan n-heksana. Hasil elusi yang terbentuk kemudian diamati di bawah sinar UV 254 dan 366 (Gritter et al. 1991). Sebuah KLT yang ditotolkan dengan ekstrak kembali dielusi setelah kombinasi eluen terbaik diperoleh. Pelat ini disiapkan untuk mendeteksi banyaknya bercak senyawa yang terkandung dalam ekstrak. Pelat kemudian dikeringkan dan disemprot dengan pereaksi warna anisaldehida-asam sulfat. Selanjutnya pelat dipanaskan pada suhu 110 oC selama 10 menit. Bercak yang timbul diamati dan dihitung nilai Rf-nya(Kusumaningtyas et al. 2008). Kombinasi eluen terpilih yang digunakan adalah kloroform:metanol (9:1), etil asetat:metanol:n-heksana (3:1:1), dan n-heksana:etil asetat (1:4).
Pengujian bioautografi
8
dengan eluen terpilih seperti pada pengujian sebelumnya. Media MHA yang telah dicampur dengan suspensi bakteridituang di atas pelat KLT di dalam cawan petri steril dan dibiarkan memadat. Cawan selanjutnya diinkubasi pada suhu 37 oC selama 24 jam dan dilakukan pengamatan zona hambat pada pelat.
Gambar 3 Diagram alir fraksinasi senyawa antimikroba kapang endofit tumbuhan sarang semut
Fraksinasi dengan kromatografi lapis tipis preparatif (KLTP)
Kromatografi lapis tipis preparatif (KLTP) dilakukan menggunakan pelat kaca berukuran 20x20 cm2 dengan fase diam silika gel PF254 yang telah dipanaskan selama satu jam pada suhu 110 oC. Ekstrak diteteskan memanjang membentuk pita pada pelat kaca dan dielusi dengan perbandingan eluen terpilih. Pelat kaca dikeringkan dan senyawa hasil KLTP diambil dengan cara dikerik. Hasil kerikan dilarutkan dengan pelarut awal ekstrak yaitu etil asetat, kemudian ekstrak kembali dipekatkan. Bagian yang diambil pada KLTP merupakan senyawa dengan nilai Rf yang aktif sebagai antibakteri berdasarkan hasil uji bioautografi. Senyawa terpilih pada KLTP diuji kembali aktivitas antibakterinya menggunakan paper disk.
Analisis Data
Data kurva pertumbuhan kapang dan rendemen ekstrak dianalisis menggunakan analisis deskriptif yang merupakan hasil rata-rata dari dua kali ulangan beserta nilai standar deviasinya dan ditampilkan dalam bentuk grafik. Rancangan percobaan yang digunakan pada tahap seleksi kapang adalah rancangan acak lengkap dan pada pengujian antimikroba menggunakan rancangan acak lengkap faktorial dengan dua faktor. Faktor perlakuannya yang digunakan
Fraksinasi dengan KLT
Deteksi bercak dengan UV dan penyemprotan reagen anisaldehida-asam sulfat
KLT bioautografi
Fraksi aktif
Fraksinasi dengan KLTP
Uji aktivitas antimikroba
9
pada uji antimikroba adalah perbedaan kondisi kultivasi dan perbedaan konsentrasi ekstrak. Model rancangan yang digunakan adalah:
Yijk = µ + αi + βj + (αβ)ij + εijk
Keterangan:
Yijk = nilai pengamatan pada faktor A taraf ke-i faktor B taraf ke-j dan ulangan ke-k
µ = komponen aditif dari rataan αi = pengaruh utama faktor A βj = pengaruh utama faktor B
αβij = komponen interaksi dari faktor A dan faktor B εijk = pengaruh acak yang menyebar normal (0, σ2) Hipotesis yang digunakan dalam penelitian ini adalah:
1 H0 : Perbedaan kondisi kultivasi tidak berpengaruh terhadap nilai diameter zona hambat yang dihasilkan
H1 : Perbedaan kondisi kultivasi berpengaruh terhadap nilai diameter zona hambat yang dihasilkan
2 H0 : Perbedaan konsentrasi ekstrak tidak berpengaruh terhadap nilai diameter zona hambat yang dihasilkan
H1 : Perbedaan konsentrasi ekstrak berpengaruh terhadap nilai diameter zona hambat yang dihasilkan
Selang kepercayaan yang digunakan adalah 95% untuk menyatakan perbedaan nyata menggunakan software Statistical Process for Social Science (SPSS) versi 16.0. Selanjutnya data dianalisis dengan analisis ragam (univariate). Jika dari hasil analisis ragam berbeda nyata, maka dilakukan uji lanjut dengan menggunakan uji Duncan. Uji lanjut untuk interaksi perbedaan jenis bakteri dengan konsentrasi ekstrak ((αβ)ij) dilakukan dengan rancangan acak lengkap (RAL) univariate dan uji lanjut Duncan. Faktor yang digunakan adalah perbedaan kondisi kultivasi dengan taraf konsentrasi ekstrak. Nilai kritis Duncan dihitung dengan persamaan sebagai berikut :
Rp =
=
rh = atau 1/rh =
10
3 HASIL DAN PEMBAHASAN
Seleksi Kapang Endofit Sarang Semut
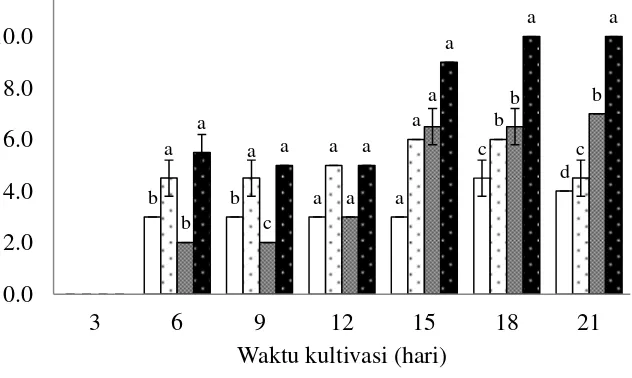
Pengujian antagonis isolat kapang endofit dari tumbuhan pesisir sarang semut terhadap mikroba uji secara langsung merupakan seleksi awal untuk memilih isolat yang memiliki potensi menghambat pertumbuhan mikroba. Isolat kapang endofit sarang semut aktif baik terhadap bakteri Gram-positif (B. subtilis) maupun bakteri Gram-negatif (E. coli) (Gambar 4). Hasil analisis ragam (univariate) menunjukkan bahwa perbedaan jenis bakteri tidak berpengaruh terhadap diameter zona hambat. Pengaruh terhadap diameter zona hambat hanya terlihat pada perbedaan isolat kapang endofit sarang semut yang digunakan (p<0,05) (Lampiran 1).
Hasil uji lanjut Duncan menunjukkan bahwa aktivitas antimikroba isolat kapang RS1A memiliki perbedaan yang signifikan dibandingkan dengan isolat kapang endofit sarang semut lainnya (p<0,05) (Lampiran 2). Isolat RS1A juga memiliki nilai penghambatan mikroba tertinggi dengan nilai rata-rata diameter zona hambat 4,7 mm terhadap kedua jenis bakteri uji, sehingga isolat RS1A ini dipilih sebagai isolat yang digunakan pada uji selanjutnya.
Keterangan: Huruf a, b, c, dan d adalah hasil uji lanjut Duncan terhadap isolat kapang berbeda yang menunjukkan beda nyata (p<0,05).
Gambar 4 Diameter zona hambat isolat kapang endofit tumbuhan sarang semut terhadap bakteri E. coli ( ) dan B. subtilis ( )
Perbedaan isolat kapang dapat memberikan potensi antimikroba yang berbeda. Hal ini diduga karena 7 isolat kapang endofit tumbuhan pesisir sarang semut ini terdiri dari beberapa jenis kapang berbeda, sehingga dapat memiliki aktivitas antimikroba yang berbeda pula. Pengamatan makroskopis dan mikroskopis pada 7 isolat kapang endofit sarang semut oleh Sahara (2013) menduga bahwa kapang endofit dari tumbuhan sarang semut ini terdiri dari Penicillium sp., Aspergillus sp., dan beberapa isolat yang belum teridentifikasi.
11
Perbedaan potensi antimikroba pada tiap isolat terkait dengan komposisi kapang endofit dan kandungan kimia dari tanaman inang yang memiliki keanekaragaman tinggi. Jenis tertentu bisa menghasilkan senyawa yang mirip dengan inangnya, tetapi ada pula yang menghasilkan senyawa bioaktif yang berbeda. Jenis kapang yang berbeda ini memungkinkan terjadinya perbedaan komponen aktif yang terdapat pada kapang tersebut (Huang et al. 2008). Menurut Li et al. (2005) dan Jeffrey et al. (2008) terdapat paling tidak satu isolat aktif yang diperoleh dari tiap spesies tumbuhan inang, tetapi persentase isolat aktif tersebut berbeda pada tiap spesies. Hasil penelitian Pelaez et al. (1998) juga menyebutkan isolasi 9 spesies tumbuhan dari habitat yang sama menghasilkan 152 spesies endofit dengan keanekaragaman yang tinggi. Hasil uji menunjukkan sebanyak 93 aktivitas antimikroba terdeteksi, yang terdiri dari 61 uji terhadap bakteri dan 32 uji terhadap jamur.
Pertumbuhan Isolat Kapang RS1A
Pertumbuhan isolat kapang ditentukan berdasarkan biomassa kering miselia. Menurut Carlile et al. (2001) pertumbuhan kapang terdiri dari empat fase, yaitu fase lag (adaptasi), fase log (pertumbuhan), fase stasioner dan fase kematian. Isolat RS1A yang dikultivasi dengan shaker menunjukkan fase adaptasi hingga hari ke-6, pada fase ini terjadi penyesuaian kapang dengan lingkungan sehingga belum terjadi penambahan jumlah sel yang besar. Fase pertumbuhan berlangsung hingga hari ke-18. Pertumbuhan kapang pada fase ini meningkat, penambahan jumlah sel terjadi dengan cepat. Hari ke-18 hingga hari ke-30 kultivasi, kapang RS1A berada pada fase stationer yang ditandai dengan pertumbuhan kapang yang lambat. Isolat kapang RS1A yang dikultur pada kondisi statis mengalami fase adaptasi hingga hari ke-9, mengalami fase pertumbuhan hingga hari ke-12 dan hingga hari ke-30 kapang RS1A yang dikultur secara statis masih berada pada fase stasioner. Hari ke-30 kultivasi pada kedua jenis kultur belum menunjukkan penurunan biomassa kapang yang menandakan mulai terjadinya fase kematian. Pertumbuhan isolat kapang RS1A yang dikultur dengan shaker dan statis masing-masing tertinggi pada hari ke-24 dan hari ke-27 dengan bobot kering miselia masing-masing 0,6985 g/100 mL dan 0,7180 g/100 mL. Kurva pertumbuhan isolat kapang RS1A dapat dilihat pada Gambar 5.
12
Gambar 5 Kurva pertumbuhan isolat kapang RS1A selama 30 hari ( kultur shaker, kultur statis)
Kondisi aerasi juga membantu penyebaran nutrien dalam media. Kultur dalam kondisi statis menyebabkan nutrien dalam media cenderung terperangkap dibagian bawah kapang. Hal ini yang diduga dapat menyebabkan terbatasnya nutrisi yang dapat diserap oleh kapang. Hasil penelitian menunjukkan miselia dan media kultur pada kultivasi dengan shaker dan secara statis memiliki perbedaan (Lampiran 3). Isolat kapang RS1A yang dikultur menggunakan shaker memiliki bentuk miselia yang mengambang dan bercampur dengan media. Kultur berwarna merah muda kemudian dapat berubah menjadi warna merah seiring lamanya waktu kultur. Isolat RS1A yang dikultivasi dalam kondisi statis memiliki pertumbuhan miselium di permukaan media. Kultur berwarna merah dan miselia berada pada permukaan media membentuk lapisan yang semakin hari semakin menebal disertai dengan produksi eksudat diatasnya.
Shahriarinour et al. (2011) menyebutkan miselium pada kultur statis tumbuh dan membentuk lapisan diatas media yang secara signifikan mempengaruhi waktu dan area kontak antara sel kapang dan substrat media. Hal tersebut yang memungkinkan terjadinya penurunan pertumbuhan pada kultur statis dibandingkan dengan kultur dengan shaker. Menurut Gandjar et. al. (2006), pada media dengan kultur yang digoyang (shaker) akan terlihat kapas-kapas kecil melayang dalam media. Bentuk seperti kapas tersebut adalah spora atau konidia tunggal yang sudah tumbuh menjadi miselium.
Kondisi media dengan jumlah nutrisi terbatas menyebabkan laju pembiakan
menjadi berkurang dan beberapa sel mengalami kematian (Srikandace et al. 2007). Media PDB yang digunakan pada penelitian ini
mengandung sumber nutrisi yang berasal dari kentang dan dekstrosa. Kusumaningtyas et al. (2010) menyatakan sumber karbon merupakan komponen terpenting dalam media pertumbuhan, karena sel-sel mikroba sebagian besar terdiri dari unsur-unsur karbon dan nitrogen. Nursid et al. (2010) juga menyebutkan bahwa karbon, hidrogen, dan oksigen merupakan penyusun utama metabolit sekunder yang juga sering mengandung nitrogen. Media kultivasi cair
13
yang digunakan diharapkan dapat menyediakan nutrisi dan bahan dasar bagi kapang untuk mensintesis senyawa metabolit sekunder.
Kondisi lingkungan sangat mempengaruhi kultur kapang endofit. Metabolit sekunder yang dihasilkan kapang endofit berkolerasi dengan faktor lingkungan (Samuel et al. 2011). Salah satu hal yang mempengaruhi pertumbuhan kapang adalah nilai pH. Nilai pH substrat sangat penting dalam pertumbuhan kapang, karena enzim-enzim tertentu hanya akan mengurai suatu substrat pada pH tertentu (Gandjar et al. 2006).
Pengukuran pH dilakukan untuk mengetahui perubahan suasana pH media pada kultur dengan shaker dan statis selama proses kultivasi. Hasil penelitian menunjukkan bahwa selama 30 hari kultivasi, kapang yang dikultur dengan shaker dan secara statis memiliki nilai pH yang berkisar antara 4,5-5 (Gambar 6). Hasil pengukuran pH pada isolat kapang RS1A ini hampir sama dengan isolat RS3 yang berasal dari inang yang sama. Isolat kapang kapang RS3 yang dikultivasi selama 27 hari memiliki nilai pH berkisar antara 4-5 (Sahara 2013).
Perubahan pH pada media kultivasi disebabkan oleh adanya aktivitas metabolisme isolat kapang. Perubahan pH menunjukkan terjadinya pertumbuhan kapang dan menghasilkan suatu senyawa yang bersifat asam atau basa. Fungi biasanya lebih menyukai pH di bawah 7 (Gandjar et al. 2006). Nilai pH yang dihasilkan pada penelitian ini masih berkisar pada pH optimum kapang dalam memproduksi zat aktif. Rajasekar et al. (2012) menyebutkan produksi agen antimikroba sangat dipengaruhi kondisi pH media, yaitu pH antara 5-9.
Gambar 6 Nilai pH isolat kapang RS1A selama 30 hari ( kultur shaker, kultur statis)
Ekstrak Kapang RS1A
14
kultivasi hasil metabolisme kapang banyak yang dilepaskan ke media cair, termasuk metabolit sekunder yang dihasilkan. Hasil ekstraksi menunjukkan ekstrak media isolat RS1A yang dikultur dengan shaker dan statis masing-masing tertinggi pada hari ke-18 dan hari ke-21 dengan rendemen ekstrak masing-masing 0,0237% dan 0,0381% (Gambar 7). Rendemen ekstrak tertinggi pada kapang RS1A diperoleh ketika memasuki fase stasioner (akhir fase log) untuk kultur dengan shaker dan pada fase stasioner untuk kultur secara statis.
Hubungan antara pertumbuhan dan pembentukan produk tergantung pada peranan produk dalam metabolisme sel. Pola kinetika pertumbuhan dan pembentukan produk terdiri dari tiga macam, yaitu pertama growth-associated product dimana sintesis produk selama pertumbuhan sel biasanya merupakan produk langsung dari jalur katabolisme misalnya fermentasi anaerobik glukosa menjadi etanol atau berupa produk antara misalnya asam amino. Kedua, non growth-associated product yaitu sintesis produk setelah pertumbuhan dan produk yang terbentuk setelah pertumbuhan sel dinamakan metabolit sekunder, serta yang ketiga mixed-growth-associated product (Wang et al. 1979). Ekstrak tertinggi pada hari ke-21 dengan kultur statis diduga merupakan produk non growth-associated karena berada pada fase stasioner yaitu ketika pertumbuhan kapang sudah menurun.
Gambar 7 Rendemen ekstrak media isolat kapang RS1A ( shaker, statis) Pertumbuhan kapang melambat ketika memasuki fase stasioner dan pembentukan metabolit sekunder meningkat yang biasanya berkaitan dengan pertahanan terhadap kondisi terbatas (Gandjar et al. 2006). Sintesis metabolit sekunder dimulai pada saat mulai habisnya beberapa komponen utama nutrien pada media pertumbuhan. Keterbatasan sumber utama nutrien tersebut menyebabkan terjadinya pelepasan zat-zat hasil proses katabolisme yang merupakan metabolit sekunder (Srikandace et al. 2007).
Rendemen yang diperoleh dari hasil proses ekstraksi juga ditentukan oleh jenis pelarut yang digunakan. Pelarut yang digunakan pada penelitin ini adalah etil asetat. Etil asetat digunakan karena memiliki polaritas sedang (semipolar) sehingga mampu melarutkan senyawa-senyawa yang bersifat non polar sampai
15
polar. Menurut Nursid et al. (2010) etil asetat juga tidak bercampur dengan media kultur sehingga mudah dipisahkan dengan media. Penelitian terhadap ekstrak media kultur dan miselia pada beberapa jenis pelarut untuk menghambat pertumbuhan bakteri patogen manusia dan ikan menunjukkan bahwa ekstrak etil asetat dari media kultur menghasilkan penghambatan yang lebih baik dibandingkan pada ekstrak miselia (Samuel et al. 2011; Tarman et al. 2011).
Aktivitas Antimikroba Kapang RS1A
Pengujian aktivitas antimikroba ekstrak media isolat RS1A dilakukan terhadap bakteri Gram-negatif E. coli dan bakteri Gram-positif B. subtilis selama 21 hari. Pengujian ini dilakukan untuk mengetahui waktu kultur optimum yang mampu menghasilkan senyawa antimikroba terbaik. Ekstrak media isolat kapang RS1A memiliki aktivitas antimikroba yang ditunjukkan dengan adanya zona hambat terhadap masing-masing mikroba uji (Gambar 8 dan Gambar 9).
Keterangan: Huruf a, b, c, dan d adalah hasil uji lanjut Duncan terhadap perbedaan interaksi antara kondisi kultivasi dan konsentrasi ekstrak yang menunjukkan beda nyata (p<0,05).
Gambar 8 Aktivitas antimikroba ekstrak isolat kapang RS1A terhadap bakteri E. coli (kultur dengan shaker, konsentrasi ekstrak 1 mg, 2 mg), (kultur statis, konsentrasi ekstrak 1 mg, 2 mg)
16
statis memiliki zona hambat lebih tinggi dibandingkan kultur shaker. Konsentrasi ekstrak juga berpengaruh terhadap diameter zona hambat dimana konsentrasi ekstrak 2 mg memiliki penghambatan yang signifikan lebih tinggi dibandingkan konsentrasi ekstrak 1 mg.
Hasil analisis univariate uji aktivitas antimikroba ekstrak isolat kapang RS1A terhadap B. subtilis selama 21 hari menunjukkan secara umum kondisi kultivasi dan konsentrasi ekstrak tidak mempengaruhi peningkatan diameter zona hambat (p<0,05) (Lampiran 6). Hasil uji lanjut Duncan hanya menunjukkan adanya perbedaan interaksi kondisi kultivasi dan konsentrasi ekstrak pada hari ke-3 dan 6 (p<0,05) (Lampiran 7).
Keterangan: Huruf a, b, c, dan d adalah hasil uji lanjut Duncan terhadap perbedaan interaksi antara kondisi kultivasi dan konsentrasi ekstrak yang menunjukkan beda nyata (p<0,05).
Gambar 9 Aktivitas antimikroba ekstrak isolat kapang RS1A terhadap bakteri B. subtilis (kultur dengan shaker, konsentrasi ekstrak 1 mg, 2 mg), (kultur statis, konsentrasi ekstrak 1 mg, 2 mg)
Pemilihan waktu kultivasi terbaik pada penelitian ini dilihat dari aktivitas antimikroba dan jumlah ekstrak yang dihasilkan. Hasil analisis statistik menunjukkan ekstrak RS1A yang dikultur statis selama 21 hari memiliki nilai penghambatan terhadap bakteri E.coli yang signifikan lebih tinggi dibandingkan kultur shaker (p<0,05). Rendemen ekstrak pada kultur statis hari ke-21 juga menunjukkan nilai tertinggi, sehingga perlakuan ini dipilih sebagai ekstrak yang digunakan untuk uji selanjutnya.
Waktu kultivasi mempengaruhi zona hambat yang dibentuk oleh ekstrak isolat RS1A. Hari ke-21 kultivasi kapang RS1A pada perlakuan kultur statis berada pada fase stationer. Hal ini menunjukkan senyawa antimikroba pada isolat RS1A terakumulasi pada fase ini. Augustine et al. (2005) menyebutkan produksi metabolit yang dikeluarkan ke lingkungan ini maksimum pada akhir fase log dan relatif konstan selama fase stasioner. Fase stasioner merupakan fase penting
karena banyak metabolit sekunder dapat dipanen pada fase ini (Gandjar et al. 2006). Srikandance et al. (2007) juga menyebutkan bahwa pada fase
17
ini jumlah sel tetap, laju pertumbuhan menurun dan beberapa sel mati karena nutrien dalam media berkurang. Metabolisme pada fase ini masih terus berlangsung dan produk metabolisme yang cenderung menumpuk. Sintesis metabolit sekunder dimulai pada saat mulai habisnya beberapa komponen utama nutrien pada media pertumbuhan. Sel-sel kapang pada fase ini diduga juga lebih tahan terhadap keadaan ekstrim.
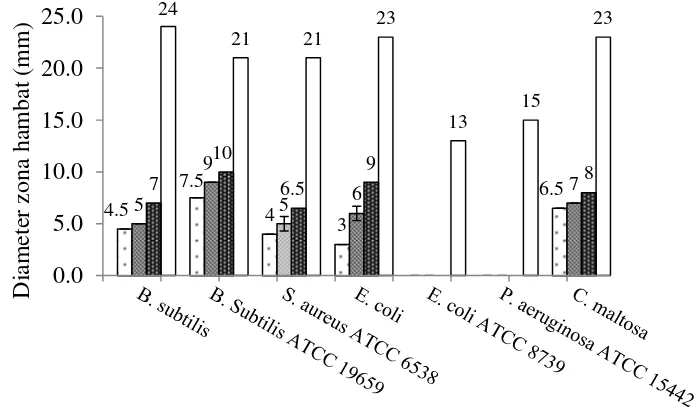
Uji aktivitas antimikroba ekstrak media isolat RS1A dengan kultur statis hari ke-21 selanjutnya dilakukan tehadap jenis mikroba lain, yaitu B. subtilis, B. subtilis ATCC 19659, S. aureus ATCC 8739, E. coli, E. coli ATCC 8739, P. aeruginosa ATCC 15442, dan C. maltosa (Gambar 10). Hasil uji menunjukkan bahwa ekstrak isolat RS1A memiliki aktivitas penghambatan terhadap bakteri B. subtilis, B. subtilis ATCC 19659, S. aureus ATCC 8739, E. coli, dan khamir C. maltosa.
Gambar 10 Aktivitas antimikroba ekstrak media isolat kapang RS1A ( konsentrasi ekstrak 0,5 mg, 1 mg, 2 mg,
kontrol positif kloramfenikol 300 µg)
Besar zona hambat pada setiap mikroba uji berbeda-beda. Hal ini dapat disebabkan karena beberapa faktor yang mempengaruhi aktivitas antimikroba, yaitu jenis, jumlah, umur dan latar belakang kehidupan bakteri; konsentrasi zat antibakteri; suhu dan waktu kontak; serta sifat fisiko-kimia substrat (pH, kadar air, tegangan permukaan, jenis dan jumlah zat terlarut, koloid dan senyawa lainnya) (Frazier dan Westhoff 1983).
Jenis bakteri uji merupakan salah satu faktor yang mempengaruhi aktivitas antimikroba. Hasil uji menunjukkan adanya penghambatan terhadap ketiga jenis bakteri Gram-positif. Umumnya bakteri Gram-positif lebih peka terhadap senyawa antibakteri (Fardiaz 1989). Perbedaan ini didasarkan oleh adanya perbedan struktur dinding sel. Struktur dinding sel bakteri Gram-positif berlapis tunggal dengan kandungan lipid yang rendah (1-4%) sehingga memudahkan bahan bioaktif masuk ke dalam sel. Struktur dinding sel bakteri Gram-negatif lebih kompleks, terdiri dari tiga lapisan yaitu lapisan luar lipoprotein, lapisan tengah lipopolisakarida yang berperan sebagai penghalang masuknya bahan bioaktif antibakteri, dan lapisan dalam berupa peptidoglikan dengan kandungan
18
lipid tinggi (11-12%) (Brooks et al. 2001). Bakteri Gram-positif memiliki dinding sel yang terdiri dari lapisan peptidoglikan sebanyak 90%, sedangkan bakteri Gram-negatif lapisan peptidoglikannya hanya 5-20%. Senyawa antibakteri dapat mencegah sintesis peptidoglikan pada sel yang sedang tumbuh, sehingga bakteri Gram-positif umumnya lebih peka dibandingkan Gram-negatif (Harapini et al. 1996).
Ekstrak kapang RS1A hanya dapat menghambat pertumbuhan bakteri Gram-positif dan E. coli. Aktivitas penghambatan tidak ditemukan pada bakteri Gram-negatif E. coli ATCC 8739 dan P. aeruginosa ATCC 15442. Bakteri E. coli dan E. coli ATCC 8739 merupakan bakteri yang berasal dari satu spesies. Keduanya adalah spesies yang sama, tetapi mereka bisa memiliki sifat yang berbeda dan tingkat sensitivitas yang berbeda pula. E. coli ATCC (American Type Culture Collection) 8739 adalah strain referensi yang biasa digunakan dalam uji aktivitas antimikroba yang diisolasi dari feses (www.atcc.org).
Aktivitas antimikroba juga terdeteksi pada khamir C. maltosa. Penghambatan ekstrak terhadap C. maltosa pada konsentrasi 2 mg lebih tinggi dibandingkan dengan konsentrasi 1 mg dan 0,5 mg. Hal ini menunjukkan bahwa ekstrak isolat RS1A tidak hanya memiliki aktivitas penghambatan terhadap bakteri, tetapi juga memiliki aktivitas antifungi. Kapang endofit yang diisolasi dari
tumbuhan obat berpotensi sebagai penghasil senyawa antifungi. Mufida et al. (2013) menyebutkan kapang endofit yang diisolasi dari tumbuhan
obat (Mezzetia parviflora Becc.) memiliki aktivitas penghambatan terhadap fungi patogen Candida albicans, Malassezia furfur, Aspergillus Niger, dan Rhizopus sp.
Konsentrasi ekstrak juga merupakan faktor yang menentukan aktivitas antimikroba. Ekstrak isolat kapang RS1A dengan konsentrasi berbeda menghasilkan diameter zona hambat yang berbeda. Penggunaan 2 mg ekstrak isolat RS1A menunjukkan penghambatan yang lebih tinggi dibandingkan penggunaan ekstrak 1 mg dan 0,5 mg pada uji terhadap bakteri B. subtilis, B. subtilis ATCC 19659, S. aureus ATCC 8739, E. coli, dan khamir C. maltosa. Pelczar dan Chan (2008) menyebutkan semakin tinggi konsentrasi suatu bahan antibakteri maka aktivitas antibakterinya semakin kuat pula. Hasil ini didukung oleh pernyataan Prawata dan Dewi (2008), bahwa efektivitas suatu zat antibakteri dipengaruhi oleh konsentrasi zat tersebut. Konsentrasi zat yang meningkat menyebabkan meningkatnya kandungan senyawa aktif yang berfungsi sebagai antibakteri sehingga kemampuannya dalam membunuh suatu bakteri juga semakin besar. Roslizawaty et al. (2013) telah melakukan pengujian aktivitas antibakteri ekstrak dan air rebusan sarang semut terhadap bakteri E. coli. Hasil uji menunjukkan bahwa ekstrak sarang semut memiliki zona hambat yang lebih luas dibandingkan dengan air rebusan sarang semut dan semakin tinggi konsentrasi ekstrak semakin luas zona hambat yang terbentuk.
19
terhadap biosintesis protein pada siklus pemanjangan rantai asam amino, yaitu dengan menghambat pembentukan ikatan peptida (Susanti et. al 2009).
Senyawa Aktif Kapang RS1A
Uji kualitatif yang dilakukan untuk menentukan senyawa yang terdapat dalam ekstrak kasar media isolat kapang RS1A adalah uji alkaloid, flavonoid, fenol hidrokuinon, dan steroid/terpenoid. Hasil uji dan perbandingannya dengan penelitian-penelitian sebelumnya dapat dilihat pada Tabel 1.
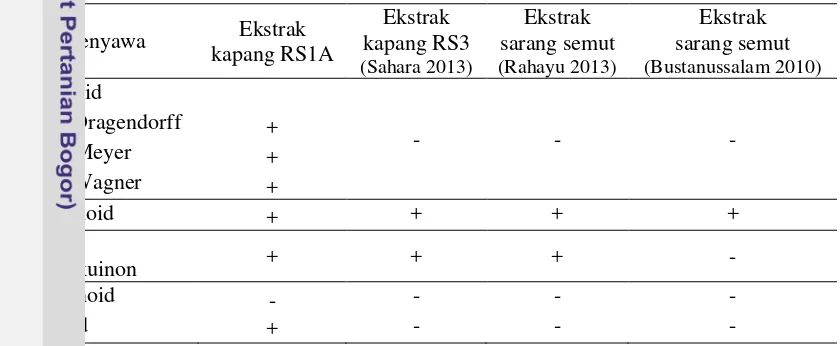
Ekstrak kasar media isolat RS1A mengandung senyawa alkaloid, flavonoid, fenol hidrokuinon, dan steroid. Ekstrak isolat kapang RS3 yang berasal dari inang yang sama hanya mengandung flavonoid dan fenol (Sahara 2013). Penelitian lain menyebutkan ekstrak sarang semut Myrmecodia pendans mengandung flavonoid (Bustanussalam 2010), dan sarang semut Hydnophytum formicarum mengandung flavonoid dan fenol (Rahayu 2013). Menurut Tan dan Zou (2001), mikroba endofit dapat menghasilkan senyawa bioaktif yang karakternya mirip atau sama dengan inangnya. Hal ini disebabkan adanya pertukaran genetik yang terjadi antara inang dan mikroba endofit secara evolusioner. Mikroba endofit mampu menghasilkan senyawa metabolit sekunder diantaranya alkaloid, terpen, steroid, flavonoid, kuinon, dan fenol. Senyawa-senyawa ini sebagian besar mempunyai potensi yang besar sebagai senyawa bioaktif.
Tabel 1 Hasil uji senyawa ekstrak kasar media isolat kapang RS1A
Senyawa Ekstrak
Alkaloid adalah golongan terbesar dari senyawa hasil metabolisme sekunder. Alkaloid diketahui memiliki aktivitas antimikroba dan sifat antiparasit (Pfoze et al. 2011). Golongan alkaloid dikenal karena toksisitasnya, namun tidak semua senyawa alkaloid bersifat toksik. Beberapa diantaranya telah digunakan sebagai obat analgesik, antiplasmodik, dan memiliki efek bakterisidal (Ogbuagu 2008). Mekanisme kerja alkaloid sebagai antibakteri diprediksi melalui penghambatan sintesis dinding sel yang akan menyebabkan lisis pada sel sehingga sel akan mati (Lamothe et al. 2009).
20
jenis flavonoid dapat berfungsi sebagai zat antibiotik yang efektif menghambat pertumbuhan Aspergillus niger, B. subtilis, Candida albicans, E. coli, Micrococcus luteus, P. aeruginosa, Saccharomyces cerevisiae, S. aureus dan Staphylococcus epidermidis (Vijayasanthi et al. 2012). Mekanisme penghambatan flavonoid terhadap pertumbuhan bakteri diduga karena kemampuan senyawa tersebut membentuk komplek dengan protein ekstraseluler, mengaktivasi enzim, dan merusak membran sel. Pada umumnya senyawa flavonoid dapat menghambat pertumbuhan bakteri Gram-positif dan Gram-negatif (Cowan 1999). Flavonoid dapat berfungsi sebagai bahan antimikroba dengan membentuk ikatan komplek dengan dinding sel dan merusak membran (Pepeljnjak et al. 2005).
Steroid juga merupakan senyawa metabolit sekunder yang telah dikenal berfungsi sebagai penolak serangga dan serangan mikroba (Harborne 1987). Steroid dapat berinteraksi dengan membran fosfolipid sel yang bersifat impermeabel terhadap senyawa-senyawa lipofilik sehingga menyebabkan integritas membran menurun, morfologi membran sel berubah, dan akhirnya dapat menyebabkan membran sel rapuh dan lisis (Bangham dan Horne 2006).
Fraksi Aktif Kapang RS1A
Fraksinasi dengan KLT adalah metode penting untuk analisis kualitatif dan kuantitatif untuk mendeteksi senyawa obat karena memiliki beberapa keuntungan dibandingkan kromatografi lain, diantaranya lebih mudah dilakukan tanpa biaya yang mahal. Pemilihan kombinasi eluen pada fraksinasi dilakukan berdasarkan proses uji coba dan mengacu pada penelitian sebelumnya.Kombinasi eluen yang dipilih adalah kloroform:metanol (9:1), etil asetat:metanol:n-heksana (3:1:1), dan n-heksana:etil asetat (1:4). Eluen yang berfungsi sebagai fase gerak ini mendeteksi adanya fraksi ekstrak isolat kapang RS1A yang ditandai dengan bercak pada masing-masing kromatogram.
Tahap penting dalam uji dengan KLT adalah deteksi senyawa. Terdapat tiga cara dalam deteksi senyawa dengan KLT, yaitu secara fisik (lampu UV), kimia (pewarnaan reagen), fisika-kimia (aplikasi isotop), dan secara biologis (aplikasi biodetektor) (Pyka 2014). Deteksi senyawa pada penelitian ini dilakukan menggunakan lampu UV dan pewarnaan dengan reagen anisaldehida-asam sulfat. Hasil fraksinasi dengan KLT yang dideteksi dengan dua cara tersebut beserta nilai faktor retensi (Rf) pada masing-masing kromatogram dapat dilihat pada Gambar 11.
Nilai Rf digunakan sebagai acuan identifikasi senyawa. Nilai Rf pada masing-masing eluen menunjukkan bahwa ekstrak media isolat kapang RS1A dapat memisahkan tujuh hingga sembilan komponen senyawa pada pendeteksian dengan lampu UV dan dengan reagen anisaldehida-asam sulfat. Eluen menunjukkan bercak dengan nilai Rf antara 0,14 sampai 0,89.
21
(A) (B) (C)
Gambar 11 Kromatogram ekstrak media isolat kapang RS1A (A) kloroform:metanol (9:1), (B) etil asetat:metanol:n-heksana (3:1:1), (C) n-heksana:etil asetat (1:4)
Pewarnaan KLT dengan reagen anisaldehida-asam sulfat merupakan metode visualisasi serbaguna yang baik untuk mendeteksi bercak pada KLT. Reagen anisaldehida-asam sulfat ini dapat mendeteksi senyawa-senyawa, diantaranya fenol, steroid, terpenoid, glikosida dan saponin. Hasil pewarnaan yang menunjukkan warna yang berbeda dapat dijadikan acuan dalam menduga golongan senyawa (Wagner dan Bladt 1996). Penyemprotan KLT dengan reagen anisaldehida-asam sulfat pada kromatogram menunjukkan beberapa bercak berwarna kuning-coklat dan biru-ungu yang masing-masing diduga sebagai senyawa fenol dan steroid.
Hasil pemisahan senyawa dengan KLT dilanjutkan dengan pengujian bioautografi untuk melihat bercak yang aktif menghambat pertumbuhan mikroba uji. Bioautografi merupakan metode umum untuk mendeteksi senyawa antimikroba pada KLT (Betina 1972). Menurut Colorado et al. (2007) bioautografi adalah teknik cepat dan sederhana yang menggabungkan kelebihan dari pemisahan pada KLT dengan deteksi pada uji aktivitas antimikroba. Teknik ini menampilkan fraksi yang berfungsi sebagai antimikroba secara langsung. Fraksi aktif hasil uji bioautografi isolat kapang RS1A dapat dilihat pada Tabel 2.
Bioautografi isolat kapang RS1A dilakukan terhadap mikroba uji B. subtilis, E.coli, dan C. maltosa. Kromatogram pada tiap jenis eluen aktif terhadap bakteri dan pada Rf berbeda. Ekstrak media isolat RS1A yang dielusi dengan eluen B dapat menghambat ketiga jenis mikroba uji pada nilai Rf 0,29; 0,42; 0,53 dan 0,69 (Gambar 12). Penghambatan pada nilai Rf 0,69 diperoleh pada uji terhadap bakteri B. subtilis dan E.coli. Fraksi dengan nilai Rf 0,53 dapat menghambat bakteri B. subtilis dan khamir C. maltosa. Kromatogram dengan eluen A dan C hanya menghambat pertumbuhan B. subtilis dan C. maltosa pada nilai Rf antara 0,14-0,58. Berdasarkan hasil bioautografi tersebut fraksinasi selanjutnya dengan
22
KLTP dilakukan terhadap fraksi 1 (Rf 0,53) dan fraksi 2 (Rf 0,69) menggunakan eluen B yaitu etil asetat : metanol : n-heksana (3:1:1).
Tabel 2 Fraksi aktif hasil bioautografi isolat kapang RS1A
Eluen Jenis mikroba uji Fraksi aktif (Rf)
A. kloroform:metanol (9:1) B. subtilis
0,14
Zona hambat pada bioautogram bila dibandingkan dengan hasil kromatogram dengan penyemprotan reagen anisaldehida-asam sulfat cenderung berada pada warna kuning-coklat. Warna kuning dan coklat pada nilai Rf 0,53 dan 0,69 diduga menunjukkan senyawa antibakteri yang termasuk dalam golongan senyawa fenol sesuai dengan acuan yang terdapat pada Wagner dan Bladt (1996). Samuel et al. (2011) menyebutkan skrining komponen bioaktif sebagai antibakteri dari jamur endofit hasil laut menunjukkan adanya senyawa golongan fenol dengan nilai Rf 0,538; 0,714 dan 0,8 masing-masing pada Aspergillus flavus, Geotrichum candidum, dan Acremonium species.
(1) (2) (3)
Gambar 12 Biautogram ekstrak kapang RS1A dengan eluen B (etil asetat:metanol:n-heksana (3:1:1)) terhadap (1) E. coli (2) B. subtilis (3) C. maltosa
Fraksi yang memiliki aktivitas antimikroba diisolasi menggunakan KLTP berdasarkan profil kromatogram dan perbandingan eluen yang digunakan pada uji sebelumnya (eluen B). Silika gel pada pelat KLTP diambil pada titik aktif berdasarkan hasil terpilih pada uji bioautografi. Hasil pemisahan diamati kembali menggunakan KLT yang dapat dilihat pada Gambar 13.
23
Gambar 13Kromatogram fraksi aktif isolat kapang RS1A
Uji aktivitas antimikroba fraksi 1 terhadap B. subtilis dan C. maltosa serta pada fraksi 2 terhadap E. coli tidak menunjukkan adanya penghambatan. Berkurang atau hilangnya aktivitas antimikroba pada fraksi ini diduga disebabkan tidak adanya efek sinergis senyawa antimikroba dengan senyawa lain sehingga ketika terjadi pemisahan aktivitasnya menjadi lebih kecil. Pengekstrakan kembali fraksi yang telah diisolasi dari adsorben juga dapat mempengaruhi aktivitas antimikroba fraksi.
Proses isolasi dengan KLTP terjadi berdasarkan perbedaan daya serap dan daya partisi adsorben serta kelarutan dari komponen-komponen kimia yang akan bergerak mengikuti kepolaran eluen. Daya serap adsorben terhadap komponen kimia tidak sama. Adsorben yang digunakan pada penelitian ini adalah silika gel. Silika gel umumnya mengandung zat tambahan kalsium sulfat untuk mempertinggi daya lekatnya (Munson 2010). Hal ini memungkinkan adanya senyawa pada fraksi yang tertinggal pada silika gel yang telah diisolasi, dimana pada penelitian ini menunjukkan zat warna merah pada silika gel masih terlihat setelah proses ekstraksi fraksi.
Tabel 3 Aktivitas antimikroba fraksi isolat kapang RS1A Fraksi Bakteri Uji Zona Hambat
(mm)* Fraksi 1 B. subtilis
C. maltosa
- -
Fraksi 2 E. coli
B. subtilis
- 9,5 *konsentrasi 1 mg/disk
F1
24
4 SIMPULAN DAN SARAN
Simpulan
Isolat kapang RS1A dari tumbuhan pesisir sarang semut (Hydnophytum formicarum) menjadi isolat terpilih berdasarkan hasil seleksi aktivitas antimikroba terhadap bakteri E. coli dan B. subtilis. Aktivitas antimikroba maksimum pada ekstrak isolat RS1A yang dikultur dalam kondisi statis selama 21 hari. Ekstrak isolat RS1A memiliki aktivitas penghambatan terhadap bakteri B. subtilis, B. subtilis ATCC 19659, S. aureus ATCC 6538, E. coli, dan khamir C. maltosa. Senyawa yang terkandung dalam ekstrak isolat RS1A adalah alkaloid, flavonoid, fenol hidrokuinon, dan steroid. Fraksinasi dengan KLT dan biautografi menunjukkan adanya zona hambat pada nilai Rf 0,69 dan 0,53. Kedua fraksi tersebut diduga merupakan senyawa golongan fenol. Fraksi 2 isolat kapang RS1A aktif terhadap bakteri B. subtilis dengan zona hambat 9,5 mm.
Saran
25
DAFTAR PUSTAKA
Augustine SK, Bhavsar SP, Kapadnis BP. 2005. Production of a growth dependent metabolite active against dermatophytes by Streptomyces rochei AK 39. Indian Journal of Medical Research. 121:164-170.
Bangham AD, Horne RW. 1962. Action of saponins on biological cell membranes. Nature. 196: 952-953.
Betina V. 1972. Bioautography in paper and thin layer chromatography and its scope in the antibiotic field. Journal of Chromatoghrapy. 78:41-51.
Bhakuni DS, Rawat DS. 2005. Bioactive Marine Natural Products. New Delhi (IN): Springer-Anamaya.
Brooks GF, Butel JS, Morse SA. 2001. Mikrobiologi Kedokteran. Widorini N, penerjemah. Jakarta (ID): Salemba Medika. Terjemahan dari: Medical Microbiology.
Bustanussalam. 2010. Penentuan struktur molekul dari fraksi air tumbuhan “sarang semut” Myrmecodia pendans Merr. & Perry yang mempunyai aktivitas sitotoksik dan sebagai antioksidan [tesis]. Bogor (ID): Institut Pertanian Bogor.
Carlile J, Watkinson SC, Gooday GW. 2001. The Fungi, Second Edition. London (GB): Elsevier Academic Press.
Choiron M, Jayus, Suwasono S. 2013. Pengaruh ketersediaan oksigen pada produksi epiglukan oleh Epicoccum nigrum menggunakan media molases. Agrointek. 7(1):11-20.
Colorado JR, Galeano EJ, Martinez AM. 2007. Development of direct bioautography as reference method for testing antimicrobial activity of gentamicin against Escherichia coli. Vitae. 14(1):67-71.
Cowan, M.M. 1999. Plant product as antimicrobial agents. Journal of Potential endophytic microbes selection for antidiabetic bioactive compounds production. Asian Journal of Biochemistry. 6(6):465-471. Engida AM, Faika S, Nguyen-Thi BT, Ju YH. 2014. Analysis of major
antioxidants from extracts of Myrmecodia pendans by UV/visible spectrophotometer, liquid chromatography/tandem mass spectrometry, and high-performance liquid chromatography/UV techniques. Journal of Food and Drug Analysis. 30:1-7.
Fajri NF. 2014. Pengaruh media pertumbuhan terhadap potensi antibakteri dan antihiperglikemik kapang endofit tumbuhan pesisir Sarang Semut Hydnophytum formicarum [skripsi]. Bogor (ID): Institut Pertanian Bogor. Fardiaz S. 1989. Mikrobiologi Pangan Penuntun Praktikum Laboratorium. Bogor
(ID): IPB.
26
Gandjar I, Sjamsuridzal W, Oetari A. 2006. Mikologi Dasar dan Terapan. Jakarta (ID): Yayasan Obor Indonesia.
Gritter PM, Bobbit BH, Schawarting AE. 1991. Pengantar Kromatografi. Padmawinata K, penerjemah. Bandung (ID): ITB. Terjemahan dari: Introduction of Chromatography.
Harborne JB. 1987. Metode Fitokimia. Edisi kedua. Padmawinata K, Soediro I, penerjemah. Bandung (ID): ITB. Terjemahan dari: Phytochemical Methods. Hertiani T, Sasmito E, Sumardi, Ulfah M. 2010. Preliminary study on
immunomodulatory effect of sarang-semut tubers Myrmecodia tuberosa and Myrmecodia pendans.Journal of Biological Sciences. 10(3): 136-141. Ho CK, Chang SH, Lung JH, Tsai CJ, Chen KP. 2005. The strategies to increase
Taxol production by using Taxus mairei cells transformed with TS and DBAT genes. International Journal of Applied Science and Engineering. 3(3):179-185.
Holo H, Nilssen O, Nes IF. 1991. Lactococcin A, a new bacteriocin from Lactococcus lactis subsp. cremoris: isolation and characterization of the protein and its gene. Journal of Bacteriology. 173(12):3879-3887.
HuangWY, Cai YZ, Hyde KD, Corke H, Sun M. 2008. Biodiversity of endophytic fungi associated with 29 traditional Chinese medicinal plants. Fungal diversity. 33:61-75.
Indra ZF. 2015. Aktivitas antibakteri dan antihiperglikemik kapang endofit RS-6B dari sarang semut pada perlakuan media berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Jeffrey LSH, Son R, Tosih S. 2008. Preliminary screening of endophytic fungi isolated from medicinal plants at MARDI Sessang, Sarawak for their bioactivity. Journal of Tropical Agriculture and Food Science. 36(1):121- 126.
Kjer J, Debbab A, Aly HA, Proksch P. 2010. Methods for isolation of marine-derived endophytic fungi and their bioactive secondary products. Nature Protocols. 5(3):479-490.
Kusumaningtyas E, Astuti E, Darmono. 2008. Sensitivitas metode bioautografi kontak dan agar overlay dalam penentuan senyawa antikapang. Jurnal Ilmu Kefarmasian Indonesia. 6(2):75-79.
Kusumaningtyas E, Natasia M, Darmono. 2010. Potensi metabolit kapang endofit rimpang lengkuas merah dalam menghambat pertumbuhan Eschericia coli dan Staphylococcus aureus dengan media fermentasi potato dextrose broth (PDB) dan potato dextrose yeast (PDY). Seminar Nasional Teknologi Peternakan dan Veteriner; 2010 Agustus 3-4; Bogor, Indonesia. Bogor (ID): Pusat Penelitian Pengembangan Peternakan. hlm 819-824.
Lamothe RG, Mitchell G, Gattuso M, Diarra MS, Malouin F, Bouarab K. 2009. Plant antimicrobial agents and their effects on plant and human pathogens. Inernational Journal of Molecular Sciences. 10:3400-3419.
Li HY, Qing C, Zhang YL, Zhao ZW. 2005. Screening for endophytic fungi with antitumour and antifungal activities from Chinese medicinal plants. World Journal of Microbiology and Biotechnology. 21:1515-1519.