KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA ISOLASI ALKALOIDA DARI EKSTRAK METANOL
DAUN KITOLOD (Hippobroma longiflora (L.) G. Don)
SKRIPSI
OLEH:
SUCI LESTARI LUBIS
NIM 111524067
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA ISOLASI ALKALOIDA DARI EKSTRAK METANOL
DAUN KITOLOD (Hippobroma longiflora (L.) G. Don)
SKRIPSI
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
SUCI LESTARI LUBIS
NIM 111524067
PROGRAM EKSTENSI SARJANA FARMASI
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGESAHAN SKRIPSI
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA ISOLASI ALKALOIDA DARI EKSTRAK METANOL
DAUN KITOLOD (Hippobroma longiflora (L.) G. Don)
OLEH:
SUCI LESTARI LUBIS NIM 111524067
Dipertahankan di hadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: 6 Februari 2015 Disetujui Oleh:
Pembimbing I, Panitia Penguji,
Dra. Herawaty Ginting, M.Si., Apt. Dra. Aswita Hafni Lubis, M.Si., Apt.
NIP 195112231980032002 NIP 195304031983032001
Pembimbing II, Dra. Herawaty Ginting, M.Si., Apt.
NIP 195112231980032002
Dr. M. Pandapotan Nasution, MPS., Apt. Dr NIP 194908111976031001 NIP 195107231982032001
Dr. Panal Sitorus, M.Si., Apt.
NIP 195310301980031002Medan, Maret 2015 Fakultas Farmasi
Universitas Sumatera Utara Wakil Dekan I,
iv
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat, hidayah dan anugerah-Nya, sehingga penulis dapat menyelesaikan penelitian dan menyusun skripsi ini. Skripsi ini disusun sebagai salah satu syarat mencapai gelar Sarjana Farmasi pada Fakultas Farmasi Universitas Sumatera Utara, dengan judul “Karakterisasi Simplisia dan Skrining Fitokimia serta Isolasi Alkaloida Dari Ekstrak Metanol Daun Kitolod (Hippobroma longiflora (L.) G. Don)”.
Pada kesempatan ini dengan segala kerendahan hati penulis mengucapkan terima kasih yang sebesar-besarnya kepada Ibu Dra. Herawaty Ginting M.Si., Apt., dan Bapak Dr. M. Pandapotan Nasution, MPS., Apt., yang telah membimbing dan memberikan petunjuk serta saran-saran selama penelitian hingga selesainya skripsi ini, Bapak Prof. Dr. Sumadio Hadisahputra, Apt., selaku Dekan Fakultas Farmasi USU Medan yang telah memberikan fasilitas sehingga penulis dapat menyelesaikan pendidikan, Bapak Prof. Dr. Muchlisyam, M.Si., Apt, selaku Ketua Program Studi Ekstensi Sarjana Farmasi USU, Ibu Dra. Aswita Hafni Lubis, M.Si., Apt., Ibu Dra. Suwarti Aris, M.Si., Apt., dan Bapak Dr. Panal Sitorus M.Si., Apt. selaku dosen penguji yang telah memberikan kritik, saran dan arahan kepada penulis dalam menyelesaikan skripsi ini, Bapak dan Ibu Kepala Laboratorium Penelitian dan Farmakognosi yang telah memberikan fasilitas, petunjuk dan membantu selama penelitian, Ibu staf pengajar Fakultas Farmasi USU Medan yang telah mendidik selama perkuliahan.
v
Affandi yang selalu memberikan dorongan dan semangat serta teruntuk para sahabat yang telah memberi bantuan, dukungan dan motivasi.
Penulis menyadari bahwa skripsi ini masih banyak kekurangan. Oleh karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari semua pihak guna memperbaiki skripsi ini. Akhir kata penulis berharap semoga skripsi ini bermanfaat bagi ilmu pengetahuan khusus bidang farmasi.
Medan, Maret 2015 Penulis
vi
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA ISOLASI ALKALOIDA DARI EKSTRAK METANOL DAUN KITOLOD
(Hippobroma longiflora (L.) G. Don)
ABSTRAK
Kitolod (Hippobroma longiflora (L.) G. Don) merupakan salah satu tanaman aromatik dari suku Campanulaceae. Tujuan dari penelitian ini adalah untuk mengetahui karakteristik simplisia, dan skrining fitokimia untuk mengetahui golongan senyawa metabolit sekunder yang terkandung dalam daun kitolod serta mengisolasi senyawa alkaloida. Isolat yang diperoleh dikarakterisasi isolat dengan spektrofotometri ultraviolet (UV) dan inframerah (IR).
Penelitian ini meliputi karakterisasi dan skrining fitokimia, dan ekstraksi yang dilakukan secara perkolasi menggunakan pelarut metanol kemudian dilanjutkan dengan isolasi alkaloida dengan metode pengocokan asam basa. Ekstrak alkaloida kasar dianalisa secara kromatografi lapis tipis (KLT) dengan fase gerak kloroform:metanol:ammonia dengan beberapa perbandingan kemudian pemisahan dilanjutkan dengan kromatografi preparatif, sebagai penampak bercak digunakan pereaksi Dragendorff. Kemurnian isolat ditentukan dengan kromatografi lapis tipis (KLT) satu arah dengan 3 pelarut yang berbeda dan KLT 2 arah, isolat yang diperoleh dikarakterisasi menggunakan spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
Hasil karakterisasi daun kitolod meliputi kadar air diperoleh 3,33%, kadar sari larut air 16,65%, kadar sari larut etanol 20,02%, kadar abu total 1,26%, kadar abu tidak larut asam 0,98%. Skrining fitokimia simplisia daun kitolod memberikan hasil positif terhadap alkaloida, flavonoida, steroid/triterpenoid, glikosida, saponin dan tanin. Isolasi dari ekstrak alkaloida kasar diperoleh isolat murni yaitu isolat (Rf 0,43).
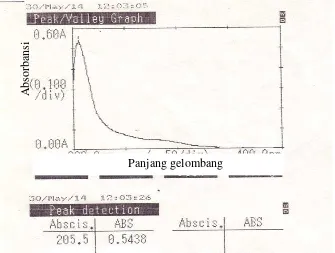
Isolat memberikan absorbansi maksimum pada panjang gelombang λmax = 205,5 nm. Spektrofotometri inframerah menunjukkan adanya gugus O-H, C-H alifatis dari metilen (CH2) dan metil (CH3), C=C, C-N dan C-O.
vii
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICAL SCREENING AND ISOLATION OF ALKALOIDS FROM METHANOL EXTRACT OF
KITOLOD LEAVES (Hippobroma longiflora (L.) G. Don)
ABSTRACT
Kitolod (Hippobroma longiflora (L.) G. Don) is an aromatic plant of the family Campanulaceae. The purpose of this research was to determine the simplex characteristics, and to determine the group of chemical compounds contained in kitolod leaves and the isolation of alkaloidal compounds. The isolates were characterized by ultraviolet (UV) and infrared (IR) spectrophotometries.
This research included simplex characterization, phytochemical screening, extraction by percolation with methanol, and then the isolation of alkaloidal compounds from the methanol extract by acid-base shake up method. The crude alkaloidal extract was analyzed by Thin Layer Chromatography with choloroform:methanol:ammonia as mobile phase at different ratios and then the isolation of alkaloids was carried out by preparative thin layer chromatography, and visualized by Dragendorff reagent. The purity of isolates was confirmed by one-dimensional thin layer chromatography with 3 different solvents and two-dimensional Thin Layer Chromatography. The pure isolate was characterized by ultraviolet and infrared spectrophotometries.
The result of simplex characterization gave the water content 3.33%, water-soluble extract 16.65 %, ethanol-water-soluble extract 20.02%, total ash 1.26%, acid-insoluble ash 0.98%. Phytochemical screening showed that kitolod leaves gave positive results for the presence of alkaloid, flavonoid, steroid/triterpenoid, glycoside, saponin and tannin. The crude alkaloid extract yielded one pure isolate with Rf = 0.43.
The measurement of UV spectrum of the isolate gave maximum absorption at wavelength of 205.5 nm, indicating the presence of chromophore and infrared spectrrum indicated the presence of OH, aliphatic C-H of methylene (CH2), and methyl (CH3), C=C, C-N and C-O functional groups.
Key words: kitolod leaf, Hippobroma longiflora, Campanulaceae, phytochemical
viii
DAFTAR ISI
Halaman
JUDUL ... i
HALAMAN PENGESAHAN ... iii
KATA PENGANTAR ... iv
ABSTRAK ... vi
ABSTRACT ... vii
DAFTAR ISI ... viii
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xiv
DAFTAR LAMPIRAN ... xv
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Hipotesis ... 3
1.4 Tujuan Penelitian ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Uraian Tumbuhan ... 5
2.1.1 Habitat ... 5
2.1.2 Nama daerah ... 5
2.1.3 Nama asing ... 5
2.1.4 Morfologi tumbuhan ... 5
ix
2.1.6 Kandungan kimia ... 6
2.1.7 Kegunaan ... 6
2.2 Uraian Kandungan Kimia Tumbuhan ... 7
2.2.1 Alkaloida ... 7
2.3 Ekstraksi ... 15
2.4 Metode Pengocokan Asam basa ... 17
2.5 Cara Umum Isolasi Senyawa Kimia dari Tumbuhan... 18
2.5.1 Kromatografi lapis tipis ... 19
2.5.2 Kromatografi lapis tipis preparatif ... 22
2.5.3 Kromatografi lapis tipis dua arah ... 23
2.6 Spektrofotometri ... 23
2.6.1 Spektrofotometri sinar ultraviolet ... 23
2.6.2 Spektrofotometri sinar inframerah ... 24
BAB III METODE PENELITIAN ... 28
3. 1 Alat-alat yang digunakan ... 28
3. 2 Bahan-bahan yang digunakan ... 28
3. 3 Pembuatan Larutan Pereaksi ... 29
3.3.1 Pereaksi mayer ... 29
3.3.2 Pereaksi bouchardat ... 29
3.3.3 Pereaksi Dragendorff ... 29
3.3.4 Pereaksi Liebermann-Burchad ... 29
3.3.5 Pereaksi asam klorida 2N ... 29
3.3.6 Larutan natrium hidroksida 2N ... 29
x
3.3.8 Pereaksi Molish ... 30
3.3.9 Perekasi besi (III) klorida 1% ... 30
3.3.10 Pereaksi timbal (II) asetat 0,4 M ... 30
3.3.11 Larutan pereaksi kloralhidrat 70% b/b ... 30
3. 4 Pengambilan dan Pengolahan Tumbuhan ... 30
3.4.1 Pengambilan tumbuhan ... 30
3.4.2 Identifikasi tumbuhan ... 31
3.4.3 Pembuatan simplisia ... 31
3. 5 Pemeriksaan Karakteristik Simplisia ... 31
3.5.1 Pemeriksaan makroskopik serbuk simplisia ... 31
3.5.2 Pemeriksaan mikroskopik serbuk simplisia ... 32
3.5.3 Penetapan kadar air ... 32
3.5.4 Penetapan kadar sari yang larut air ... 32
3.5.5 Penetapan kadar sari yang larut etanol ... 33
3.5.6 Penetapan kadar abu ... 33
3.5.7 Penetapan kadar abu yang tidak larut asam ... 33
3. 6 Skrining Fitokimia ... 34
3.6.1 Pemeriksaan alkaloida ... 34
3.6.2 Pemeriksaan flavonoida ... 34
3.6.3 Pemeriksaan glikosida ... 34
3.6.4 Pemeriksaan saponin ... 35
3.6.5 Pemeriksaan tanin ... 35
3.6.6 Pemeriksaan steroid/triterpenoid ... 36
xi
3.8 Isolasi Senyawa Alkaloida dari Ekstrak Metanol dengan Cara
Pengocokan Asam Basa ... 36
3.9 Analisis Ekstrak Alkaloida Kasar Secara KLT ... 37
3.10 Isolasi Senyawa Alkaloida secara KLT Preparatif ... .. ... 38
3.11 Uji Kemurnian Isolat dengan KLT Satu Arah ... 39
3.12 Uji kemurnian Isolat dengan KLT Dua Arah ….. ... 39
3.13 Karakterisasi Isolat ... 40
3.13.1 Karakterisasi isolat dengan spektrofotometri UV ... 40
3.13.2 Karakterisasi isolat dengan spektrofotometri IR ... 40
BAB IV HASIL DAN PEMBAHASAN ... 41
4.1 Hasil Identifikasi Tumbuhan ... 41
4.2 Hasil Pemeriksaan Makroskopik Simplisia ... 41
4.3 Hasil Pemeriksaan Mikroskopik ... 41
4.4 Hasil Ekstraksi ... 44
4.5 Hasil Isolasi Senyawa Alkaloida dengan Cara Pengocokan Asam Basa ... 44
4.6 Hasil Analisis Ekstrak Alkaloida Kasar secara KLT ... 45
4.7 Hasil Isolasi Senyawa Alkaloida secara KLT Preparatif ... 45
4.8 Hasil Uji Kemurnian dengan KLT Satu Arah ... 45
4.9 Hasil Uji Kemurnian KLT Dua Arah ... 46
4.10 Hasil Karakterisasi Isolat dengan Spektrofotometri UV ... 46
4.11 Hasil Karakterisasi Isolat dengan Spektrofotometri IR ……. ... 47
BAB V KESIMPULAN DAN SARAN ... 49
5. 1 Kesimpulan ... 49
xii
xiii
DAFTAR TABEL
Tabel Halaman 4.1 Tabel hasil pemeriksaan karakterisasi serbuk simplisia daun kitolod. 42
xiv
DAFTAR GAMBAR
Gambar Halaman
2.1 Gambar struktur pirol ... 9
2.2 Gambar struktur pirolidin ... 9
2.3 Gambar struktur stakidrin ... 9
2.4 Gambar struktur higrin ... 9
2.5 Gambar struktur pirolizidin ... 10
2.6 Gambar struktur retronesin ... 10
2.7 Gambar struktur piridina ... 10
2.8 Gambar struktur piperidin ... 10
2.9 Gambar struktur nikotin ... 11
2.10 Gambar struktur konini ... 11
2.11 Gambar struktur tropan ... 11
2.12 Gambar struktur atropine ... 11
2.13 Gambar struktur isokuinolin ... 11
2.14 Gambar struktur papaverin ... 12
2.15 Gambar struktur kuinolizidin ... 12
2.16 Gambar struktur sitisin ... 12
2.17 Gambar struktur kuinolin ... 12
2.18 Gambar struktur kinin ... 13
2.19 Gambar struktur aporfina ... 13
2.20 Gambar struktur morfin ... 13
2.21 Gambar struktur indol ... 13
xv
2.23 Gambar struktur imidazol ... 14
2.24 Gambar struktur pilokarpin ... 14
2.25 Gambar struktur purin ... 14
2.26 Gambar struktur kafein ... 15
2.27 Gambar struktur steroid ... 15
2.28 Gambar struktur solanidin ... 15
4.1 Gambar Spektrofotometri UV ... 46
xvi
DAFTAR LAMPIRAN
Lampiran Halaman
1 Identifikasi tumbuhan ... 54
2 Bagan kerja penelitian ... 55
3 Bagan pembuatan ekstrak metanol daun kitolod ... 56
4 Bagan isolasi senyawa alkaloida ekstrak metanol dengan metode pengocokan asam basa ... 57
5 Gambar makroskopik tumbuhan kitolod ... 58
6 Gambar dari mikroskopik serbuk simplisia dari daun kitolod …. ... 60
7 Perhitungan hasil penetapan kadar ... 61
8 Hasil kromatogram KLT dari beberapa fase gerak ... 66
9 Hasil kromatogram KLT preparatif ... 67
10 Hasil kromatogram KLT satu arah ... 68
vi
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA ISOLASI ALKALOIDA DARI EKSTRAK METANOL DAUN KITOLOD
(Hippobroma longiflora (L.) G. Don)
ABSTRAK
Kitolod (Hippobroma longiflora (L.) G. Don) merupakan salah satu tanaman aromatik dari suku Campanulaceae. Tujuan dari penelitian ini adalah untuk mengetahui karakteristik simplisia, dan skrining fitokimia untuk mengetahui golongan senyawa metabolit sekunder yang terkandung dalam daun kitolod serta mengisolasi senyawa alkaloida. Isolat yang diperoleh dikarakterisasi isolat dengan spektrofotometri ultraviolet (UV) dan inframerah (IR).
Penelitian ini meliputi karakterisasi dan skrining fitokimia, dan ekstraksi yang dilakukan secara perkolasi menggunakan pelarut metanol kemudian dilanjutkan dengan isolasi alkaloida dengan metode pengocokan asam basa. Ekstrak alkaloida kasar dianalisa secara kromatografi lapis tipis (KLT) dengan fase gerak kloroform:metanol:ammonia dengan beberapa perbandingan kemudian pemisahan dilanjutkan dengan kromatografi preparatif, sebagai penampak bercak digunakan pereaksi Dragendorff. Kemurnian isolat ditentukan dengan kromatografi lapis tipis (KLT) satu arah dengan 3 pelarut yang berbeda dan KLT 2 arah, isolat yang diperoleh dikarakterisasi menggunakan spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
Hasil karakterisasi daun kitolod meliputi kadar air diperoleh 3,33%, kadar sari larut air 16,65%, kadar sari larut etanol 20,02%, kadar abu total 1,26%, kadar abu tidak larut asam 0,98%. Skrining fitokimia simplisia daun kitolod memberikan hasil positif terhadap alkaloida, flavonoida, steroid/triterpenoid, glikosida, saponin dan tanin. Isolasi dari ekstrak alkaloida kasar diperoleh isolat murni yaitu isolat (Rf 0,43).
Isolat memberikan absorbansi maksimum pada panjang gelombang λmax = 205,5 nm. Spektrofotometri inframerah menunjukkan adanya gugus O-H, C-H alifatis dari metilen (CH2) dan metil (CH3), C=C, C-N dan C-O.
vii
SIMPLEX CHARACTERIZATION AND PHYTOCHEMICAL SCREENING AND ISOLATION OF ALKALOIDS FROM METHANOL EXTRACT OF
KITOLOD LEAVES (Hippobroma longiflora (L.) G. Don)
ABSTRACT
Kitolod (Hippobroma longiflora (L.) G. Don) is an aromatic plant of the family Campanulaceae. The purpose of this research was to determine the simplex characteristics, and to determine the group of chemical compounds contained in kitolod leaves and the isolation of alkaloidal compounds. The isolates were characterized by ultraviolet (UV) and infrared (IR) spectrophotometries.
This research included simplex characterization, phytochemical screening, extraction by percolation with methanol, and then the isolation of alkaloidal compounds from the methanol extract by acid-base shake up method. The crude alkaloidal extract was analyzed by Thin Layer Chromatography with choloroform:methanol:ammonia as mobile phase at different ratios and then the isolation of alkaloids was carried out by preparative thin layer chromatography, and visualized by Dragendorff reagent. The purity of isolates was confirmed by one-dimensional thin layer chromatography with 3 different solvents and two-dimensional Thin Layer Chromatography. The pure isolate was characterized by ultraviolet and infrared spectrophotometries.
The result of simplex characterization gave the water content 3.33%, water-soluble extract 16.65 %, ethanol-water-soluble extract 20.02%, total ash 1.26%, acid-insoluble ash 0.98%. Phytochemical screening showed that kitolod leaves gave positive results for the presence of alkaloid, flavonoid, steroid/triterpenoid, glycoside, saponin and tannin. The crude alkaloid extract yielded one pure isolate with Rf = 0.43.
The measurement of UV spectrum of the isolate gave maximum absorption at wavelength of 205.5 nm, indicating the presence of chromophore and infrared spectrrum indicated the presence of OH, aliphatic C-H of methylene (CH2), and methyl (CH3), C=C, C-N and C-O functional groups.
Key words: kitolod leaf, Hippobroma longiflora, Campanulaceae, phytochemical
1
BAB I
PENDAHULUAN
1.1 Latar Belakang
Peranan penting tanaman obat dalam masalah kesehatan di Indonesia maupun didunia saat ini semakin berkembang. Perkembangan ini didukung oleh penelitian-penelitian terhadap tanaman obat baik di tingkat nasional maupun internasional (Farnsworth, 1966). Umumnya dinegara-negara berkembang pengobatan tradisional telah lama digunakan dan merupakan bagian integral dari budaya daerah tersebut. Sediaan obat berasal dari tanaman, baik dalam bentuk ramuan sediaan ekstrak kasar atau campuran (Ira, et al., 2009).
Indonesia yang dengan jumlah penduduk lebih dari 200 juta jiwa, memiliki lebih kurang 30.000 spesies tumbuhan dan 940 spesies diantaranya termasuk tumbuhan berkhasiat. Tanaman tersebut menghasilkan metabolit sekunder dengan struktur molekul dan aktifitas biologi yang beranekaragam serta memiliki potensi sangat baik untuk dikembangkan menjadi obat (Sari, 2006). Tumbuhan berkhasiat obat ini telah banyak diteliti untuk mencari senyawa baru ataupun menambah keanekaragaman senyawa yang telah ada. Penelitian tersebut dilakukan dengan berbagai pendekatan seperti cara empiris, etnobotani dan etnofarmakologi (Suhirman, 2011). Upaya selanjutnya untuk pengisolasian senyawa murni dan turunannya sebagai bahan dasar obat modern (Hernani, 2004).
2
(Hippobroma longiflora) termasuk suku Campanulaceae berasal dari Hindia Barat menyebar ke berbagai wilayah dibelahan dunia, baik di Amerika, Australia, Afrika, Eropa dan Asia. Bagian yang bermanfaat dari tanaman kitolod ini adalah daunnya digunakan sebagai obat luka (Hutapea, 1994), efek fisiologis yang kuat terutama pada susunan syaraf pusat (Alondra, et al.,2014), obat anti radang (Suparni, 2012), obat gangguan mata seperti mata berair, mata plus, minus, katarak, glaukoma (Nuraini, 2014). Menurut pakar jamu dan tanaman obat yang juga mempunyai kebun TOGA dan pabrik jamu Dayang Sumbi, tanaman kitolod ini dapat mengobati gangguan pada mata khususnya katarak, rabun dan mata minus (Nuraini, 2014). Pernyataan ini diperkuat berdasarkan penggunaan secara tradisional oleh keluarga sendiri sebagai obat katarak. Sejumlah kandungan metabolit sekunder yang terkandung dalam daun kitolod ini antara lain alkaloida, flavonoida, glikosida, steroid/triterpenoid, saponin dan tanin (Hutapea, 1994). Menurut Harborne (1987) sebagai basa, alkaloida biasanya diekstraksi dengan pelarut alkohol yang bersifat asam lemah untuk memisahkan senyawa yang terkandung berdasarkan kepolarannya yang kemudian diendapkan dengan larutan ammonia pekat. Senyawa alkaloida diekstraksi secara perkolasi dengan menggunakan pelarut yang kemudian diisolasi dengan menggunakan metode asam basa selanjutnya alkaloida kasar yang diperoleh dipisahkan dengan kromatografi lapis tipis analitik yang dipantau dengan kromatografi lapis tipis preparatif (Gritter, et al., 1991).
3
1.2Perumusan Masalah
a. apakah karakterisasi simplisia daun kitolod dapat dilakukan.
b. apa sajakah golongan senyawa kimia yang terkandung di dalam simplisia daun kitolod.
c. apakah senyawa alkaloida dari daun kitolod dapat diisolasi menggunakan metode pengocokan asam basa dan dilanjutkan dengan KLT preparatif.
d. Apakah senyawa alkaloida hasil isolasi dapat dikarakterisasi secara spektrofotometri sinar ultraviolet (UV) dan inframerah (IR).
1.3Hipotesis
a. karakterisasi simplisia daun kitolod dapat dilakukan dengan menggunakan prosedur pada Materia Medika Indonesia, World Health Organizarion (WHO) dan Farnsworth.
b. golongan senyawa kimia yang terkandung di dalam simplisia daun kitolod dapat ditentukan dengan melakukan skrining fitokimia.
c. senyawa alkaloida dari daun kitolod dapat diisolasi dengan menggunakan metode pengocokan asam basa dan KLT preparatif.
d. senyawa alkaloida hasil isolasi dapat dikarakterisasi dengan spektrofotometri sinar ultraviolet (UV) dan inframerah (IR).
1.4Tujuan Penelitian
a. untuk mengetahui karakteristik simplisia daun kitolod.
b. untuk mengetahui golongan senyawa kimia yang terdapat pada daun kitolod. c. untuk mengisolasi senyawa alkaloida dari daun kitolod.
4
spektrofotometri sinar ultraviolet (UV) dan inframerah (IR).
1.5Manfaat Penelitian
5
BAB II
TINJAUAN PUSTAKA
2.1Uraian Tumbuhan
Uraian tumbuhan meliputi daerah tumbuh, nama daerah, nama asing, morfologi tumbuhan, sistematika tumbuhan, kandungan kimia dan kegunaan dari tumbuhan.
2.1.1 Habitat
Kitolod (Hippobroma longiflora (L.) G. Don) merupakan tanaman yang berasal dari Hindia Barat tumbuh liar di pinggir saluran air atau sungai, serta tempat yang lembab dan terbuka (Yohana, et. al., 2005).
2.1.2Nama daerah
Menurut Hariana (2007) kitolod (Hippobroma longiflora (L.) G. Don) memiliki nama daerah:
Sunda : Daun tolod Jawa : Daun kendali Melayu : Lidah payau
2.1.3Nama asing
Belanda : ster ven bethlehem (Hariana, 2007), Inggris : star of bethelem (Ali, 2003). China : Ma zui cao
Hawaiian : pua hōkū
Prancis : etoile de Bethléem
2.1.4 Morfologi tumbuhan
6
di tempat terbuka dengan tinggi dapat mencapai 50 cm, bercabang dari pangkal batang, batangnya bulat, helaian daun berwarna hijau, bergerigi sampai melekuk, merupakan daun tunggal, lebar daun 2 - 3 cm, panjang 5 - 15 cm, bunga tunggal, tegak, bertangkai panjang, keluar dari ketiak daun, mahkota bunga menyerupai bintang, berwarna putih, buah berbentuk lonceng,berwarna hijau dan merunduk, biji bulat telur, berukuran kecil, berwarna putih, akar tanaman merupakan akar tunggang (Nuraini, 2014).
2.1.5 Sistematika tumbuhan
Menurut Plantamor (2008) kitolod (Hippobroma longiflora (L.) G. Don) diklasifikasikan sebagai berikut:
Kingdom : Plantae
Divisio : Spermatophyta Subdivisio : Angiospermae Kelas : Dicotyledoneae Bangsa : Asterales
Suku : Campanulaceae
Marga : Hippobroma
Jenis : Hippobroma longiflora (L.) G. Don
2.1.6 Kandungan kimia
Kitolod (Hippobroma longiflora (L.) G. Don) mengandung senyawa kimia seperti alkaloida, saponin, flavonoida dan polifenol (Murtie, 2013).
2.1.7 Kegunaan
7
seperti mata berair, mata plus, minus, katarak, glaukoma (Nuraini, 2014), epilepsi (Ira, et. al., 2009).
2.2 Uraian Kandungan Kimia Tumbuhan
2.2.1 Alkaloida
Alkaloida adalah suatu golongan senyawa sekunder yang terbanyak ditemukan di dalam dunia tumbuhan. Alkaloida tersebar luas dalam berbagai familia tumbuhan. Semua alkaloida mengandung paling sedikit satu atom nitrogen sehingga bersifat basa dan pada sebagian besar alkaloida atom nitrogen ini merupakan bagian dari cincin heterosiklik (Lenny, 2006). Menurut Harborne, alkaloida adalah senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen yang terletak dalam sistem siklik. Di samping itu alkaloida dapat didefinisikan sebagai suatu senyawa yang mengandung nitrogen, dan bersifat basa, terdapat pada tumbuhan dalam jumlah yang relatif kecil dan mempunyai aktivitas farmakologi. Selain unsur nitrogen, alkaloida juga mengandung oksigen dan sulfur (Hanafi, 2012).
Sifat alkaloida yang paling umum adalah bersifat basa, kebasaan dari alkaloida ini bergantung pada ketersediaan pasangan elektron sunyi dari atom N untuk disumbangkan membentuk ikatan kovalen koordinasi (Cordell, 1981). Bila gugus fungsi yang berdekatan dengan nitrogen bersifat sebagai penolak elektron, seperti gugus alkil, maka ketersediaan elektron disekitar nitrogen akan bertambah, mengakibatkan alkaloida bersifat lebih basa, sebaliknya bila gugus fungsi yang melekat pada nitrogen bersifat sebagai penarik elektron, seperti gugus karbonil maka ketersediaan elektron disekitar nitrogen akan berkurang, mengakibatkan alkaloida bersifat netral bahkan sedikit bersifat asam (Lenny, 2006).
8
sehingga alkaloida dapat terurai oleh pengaruh oksigen, panas, cahaya dan terhadap metode yang sesuai dipakai untuk isolasi. Penguraian alkaloida selama atau setelah isolasi dapat menjadi masalah yang serius jika disimpan dalam waktu lama. Pembentukan garam dengan asam organik seperti tartrat, sitrat atau asam anorganik seperti asam klorida, asam sulfat dapat mengurangi penguraian alkaloida (Cordell, 1981). Fungsi alkaloida dalam tumbuhan belum diketahui secara pasti, kemungkinan berfungsi sebagai penarik atau penghalau serangga, ataupun dapat bersifat sebagai zat pengatur tumbuh. (Harborne, 1987). Klasifikassi alkaloida menurut Hegnauer (Farnsworth, 1966) adalah sebagai berikut:
1. Alkaloida Sejati
Alkaloida ini dibentuk atau berasal dari asam amino yang umumnya mempunyai unsur nitrogen yang terikat pada cincin heterosiklik dan kebanyakan bersifat basa seperti vinkristin dan reserpin, kecuali kolkisin yang tidak mempunyai cincin heterosiklik dan tidak bersifat basa.
2. Protoalkaloida
Alkaloida ini dibentuk dari asam amino, tetapi unsur nitrogennya tidak terikat pada cincin heterosiklik dan bersifat basa. Contohnya meskalin dan efedrin.
3. Pseudoalkaloida
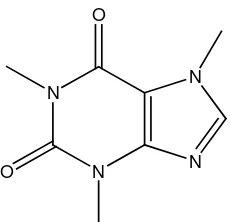
Alkaloid ini merupakan alkaloida bukan turunan asam amino, pada umumnya mempunyai unsur nitrogen yang terikat pada cincin heterosiklik dan biasanya bersifat basa. Alkaloida yang penting dari golongan ini adalah alkaloida golongan purina seperti kafein.
9
A. Non heterosiklik atau atipikal alkaloida, disebut juga protoalkaloida atau amin biologis misalnya efedrin yang terdapat dalam Ephedra distachya.
B. Heterosiklik atau tipikal alkaloida yang dibagi ke dalam 12 grup berdasarkan struktur cincinnya, yaitu:
1. Alkaloida golongan pirol dan pirolidin:
Contohnya, golongan pirol yaitu stakidrin pada tumbuhan Stachys tuberifera dan golongan pirolidin yaitu higrin pada tumbuhan Erythroxylon coca.
H N
Gambar 2.1 Struktur pirol
H N
Gambar 2.2 Struktur pirolidin
Gambar 2.3 Struktur stakidrin
N CH3
H2
C C CH3
O
10
2. Alkaloida golongan pirolizidin: Contohnya, retronesin pada Crotalaria retus.
N
Gambar 2.5 Struktur pirolizidin
N HO
OH
H
Gambar 2.6 Struktur retronesin
3. Alkaloida golongan piridin dan piperidin:
Contohnya, golongan piridin yaitu nikotin pada tumbuhan Nicotiana tobacum dan golongan piperidin yaitu koniin pada tumbuhan Coninum maculatum.
N
Gambar 2.7 Struktur piridin
H N
11
Gambar 2.9 Struktur nikotin
N
H CH2 H2 C
CH3
Gambar 2.10 Struktur koniin 4. Alkaloida golongan tropan:
Contohnya, atropin pada tumbuhan Atropa belladonna.
Gambar 2.11 Struktur tropan
Gambar 2.12 Struktur atropin
5. Alkaloida isokuinolin:
Contohnya, papaverin pada tumbuhan Papaver somniferum.
N
12
N H3CO
H3CO
OCH3
OCH3 Gambar 2.14 Struktur papaverin
6. Alkaloida golongan kuinolizidin:
Contohnya, sitisin pada tumbuhan Cytisus scoparius.
N
Gambar 2.15 Struktur kuinolizidin
N H
H NH
O
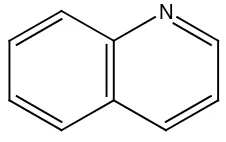
Gambar 2.16 Struktur sitisin 7. Alkaloida golongan kuinolin:
Contohnya, kinin pada tumbuhan Cinchona ledgeriana.
N
[image:30.595.207.412.84.213.2] [image:30.595.234.364.408.525.2] [image:30.595.241.354.632.703.2]
13
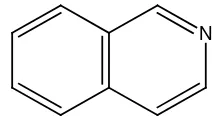
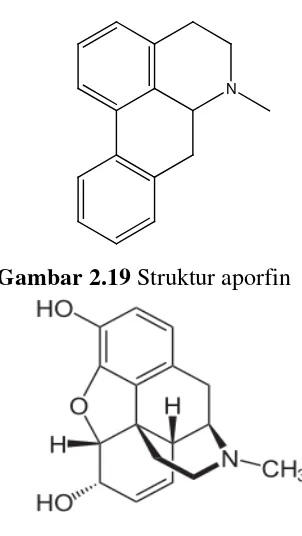
Gambar 2.18 Struktur kinin 8. Alkaloida golongan aporfin:
Contohnya, morfin pada tumbuhan Papaver somniferum
N
Gambar 2.19 Struktur aporfin
Gambar 2.20 Struktur morfin 9. Alkaloida golongan indol:
Contohnya, reserpin pada tumbuhan Rauwolfia serpentin.
H N
[image:31.595.211.375.84.211.2][image:31.595.209.360.293.561.2] [image:31.595.211.314.647.718.2]
14 N H N O H3CO
OCH3 OCH3 OCH3 H COOCH3 H H OCH3 O
Gambar 2.22 Struktur reserpin
10. Alkaloida golongan imidazol:
Contohnya, pilokarpin pada tumbuhan Pilocarpus jaborandi.
H N
N
Gambar 2.23 Struktur imidazol
N N O O CH3 CH3
Gambar 2.24 Struktur pilokarpin
11.Alkaloida golongan purin:
Contohnya, kafein pada tumbuhan Coffea Arabica.
N
N
N H N
[image:32.595.144.442.86.191.2] [image:32.595.210.420.403.511.2]15
N
N N
N O
O
Gambar 2.26 Struktur kafein 12.Alkaloida golongan steroid:
Contohnya, solanidin pada tumbuhan Solanum tuberosum.
Gambar 2.27 Struktur steroid
N
HO
CH3
CH3 H3C
CH3
Gambar 2.28 Struktur solanidin
2.3 Ekstraksi
[image:33.595.245.360.83.194.2]16
atsiri, alkaloida, flavonoida dan lain-lain. Diketahuinya senyawa aktif yang dikandung simplisia akan mempermudah pemilihan dalam pelarut dan cara ekstraksi yang tepat, metode ekstraksi dengan menggunakan pelarut (Depkes RI, 2000).
A. Cara dingin
1. Maserasi
Maserasi adalah proses penyarian simplisia dengan cara perendaman menggunakan pelarut dengan sesekali pengadukan pada temperatur kamar. Maserasi yang dilakukan pengadukan secara terus menerus disebut maserasi kinetik, sedangkan dilakukan pengulangan penambahan pelarut telah dilakukan penyaringan terhadap maserat pertama dan seterusnya disebut remaserasi.
2. Perkolasi
Perkolasi adalah proses penyarian simplisia dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri dari tahap pelembaban bahan, tahap perendaman antara, tahap perkolasi sebenarnya (penetesan/penampungan ekstrak) terus menerus sampai diperoleh perkolat yang jumlahnya 1 - 5 kali jumlah bahan yang diekstraksi.
B. Cara panas
1. Refluks
Refluks adalah proses penyarian simplisia dengan menggunakan alat pada temperatur titik didihnya, selama waktu tertentu, jumlah pelarut terbatas yang relatif konstan dengan adanya pendingin balik.
2. Digesti
17 40-50oC.
3. Sokletasi
Sokletasi adalah proses penyarian dengan menggunakan pelarut yang selalu baru, dilakukan menggunakan alat soklet sehingga terjadi ekstraksi kontinu dengan pelarut relatif konstan dengan adanya pendingin balik.
4. Infundasi
Infundasi adalah proses penyarian dengan menggunakan pelarut air yang padapada temperatur 90oC selama 15 menit. Hasilnya disebut infus (infusum). 5. Dekoktasi
Dekoktasi adalah proses penyarian dengan menggunakan pelarut air pada temperatur 90oC selama 30 menit. Hasilnya disebut dekok (dekoktum).
2.4 Metode Pengocokan Asam Basa
Diketahui bahwa beberapa golongan senyawa tertentu, seperti asam dan basa, yang terdapat di dalam suatu sampel dapat diekstraksi menggunakan cara yang telah disesuaikan. Golongan bahan alam yang diekstraksi dengan cara ini adalah alkaloida, yang banyak terdapat dalam tumbuhan sebagai garam. Uraian mengenai cara ekstraksi senyawa pokok ini adalah sebagai berikut.
a. Alkaloida dapat diperoleh dari garamnya dengan cara membasakan serbuk kering bahan tanaman dengan menggunakan amonia encer. Alkaloida akan terdapat dalam bentuk basa bebas yang tak lagi berupa garam ionik dan lebih larut dalam pelarut organik seperti kloroform.
18
yang tak bercampur (immiscible).
c. Larutan kloroform akan mengandung basa bebas, yang kemudian diekstraksi dengan asam encer, misalnya diekstraksi tiga kali dengan asam klorida 2N dan alkaloida ini akan pindah dari fase organik ke fase berair sebagai garam klorida. Lapisan kloroform yang tersisa dapat diuji dengan reaksi warna khusus untuk alkaloida (reagen Dragendorff) untuk memastikan bahwa semua alkaloida telah ditransfer kelapisan cairan asam.
d. Lapisan asam dibasakan kembali dengan ammonia menghasilkan pengendapan alkaloida, kemudian diekstraksi kembali dengan pelarut organik (Heinrich et al.,2005).
2.5 Cara Umum Isolasi Senyawa Kimia dari Tumbuhan
Isolasi senyawa kimia dari bahan alam adalah suatu usaha untuk memisahkan senyawa yang bercampur sehingga diperoleh senyawa tunggal. Isolasi senyawa kimia ini banyak dilakukan dengan kromatografi (Robinson, 1995).
Kromatografi adalah suatu metode pemisahan berdasarkan proses migrasi dari komponen-komponen senyawa di antara dua fase yaitu fase diam (dapat berupa zat cair atau zat padat) dan fase gerak (dapat berupa gas atau zat cair). Fase gerak membawa zat terlarut melalui media sehingga terpisah dari zat terlarut lainnya yang terelusi lebih awal atau lebih akhir. Umumnya zat terlarut dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau gas yang disebut eluen. Fase diam dapat bertindak melarutkan zat terlarut sehingga terjadi partisi antara fase diam dan fase gerak. Proses ini suatu lapisan cairan pada penyangga yang inert berfungsi sebagai fase diam (Depkes RI, 1995).
19
diam yang dapat berupa zat padat atau zat cair. Fase diam berupa zat padat maka cara tersebut dikenal sebagai kromatografi serapan, sedangkan yang berupa zat cair maka dikenal sebagai kromatografi partisi (Depkes RI, 1995; Sastrohamidjojo, 1985).
Pemisahan dan pemurnian kandungan kimia tumbuhan terutama dilakukan dengan menggunakan salah satu dari lima teknik kromatografi atau gabungan teknik tersebut. Kelima teknik kromatografi itu adalah: kromatografi kolom (KK), kromatografi kertas (KKt), kromatografi lapis tipis (KLT), kromatografi gas cair (KGC), dan kromatografi cair kinerja tinggi (KCKT). Pemilihan teknik kromatografi bergantung pada sifat kelarutan senyawa yang akan dipisah (Harborne, 1987).
2.5.1 Kromatografi lapis tipis
Kromatografi lapis tipis merupakan metode pemisahan campuran analit dengan mengembangkan analit melalui suatu lempeng kromatografi lalu melihat komponen atau analit yang terpisah dengan penyemprotan atau pewarnaan (Gandjar dan Rohman, 2012).
Fase diam yang terdiri atas bahan berbutir-butir dilapiskan pada penyangga berupa plat, gelas, logam atau lapisan yang cocok. Campuran yang akan dipisah, berupa larutan ditotolkan berupa bercak ataupun pita, setelah itu plat atau lapisan dimasukkan ke dalam bejana tertutup rapat yang berisi larutan pengembang yang cocok (fase gerak), pemisahan terjadi selama pengembangan, selanjutnya senyawa yang tidak berwarna harus ditampakkan (Stahl, 1985).
20
panjang (366 nm). Senyawa tidak dapat dideteksi maka harus disemprot dengan pereaksi yang membuat bercak tersebut tampak yaitu pertama tanpa pemanasan, kemudian bila perlu dengan pemanasan (Gritter, et al., 1991; Stahl, 1985). Kromatografi lapis tipis dapat dipakai untuk dua tujuan yaitu:
1. Metode untuk mencapai hasil kualitatif (analitik) dan kuantitatif (preparatif). 2. Mencari sistem pelarut yang akan dipakai dalam kromatografi kolom (Gritter, et
al., 1991; Stahl, 1985).
a. Fase diam (lapisan penyerap)
Pada kromatografi lapis tipis pada fase diam berupa lapisan tipis yang terdiri bahan padat yang dilapiskan pada permukaan penyangga datar yang biasanya terbuat dari kaca atau logam. Lapisan fase diam melekat pada permukaan dengan bantuan bahan pengikat. Beberapa contoh fase diam yang digunakan untuk pemisahan dalam kromatografi lapis tipis yaitu silika gel, alumina, kieselguhr dan selulosa. Kromatografi lapis tipis lapisan fase diam harus sesedikit mungkin mengandung air, karena air akan menempati semua titik penyerapan sehingga tidak akan ada senyawa yang melekat, maka sebelum digunakan plat kromatografi lapis tipis perlu diaktifkan dengan pemanasan pada 110oC selama 30 menit (Gritter, et al., 1991).
b. Fase gerak (pelarut pengembang)
Fase gerak ialah medium angkut yang terdiri dari satu atau campuran pelarut, jika diperlukan sistem pelarut multi komponen, harus berupa suatu campuran sesederhana mungkin yang terdiri atas tiga komponen (Stahl, 1985).
21
memperhatikan polaritasnya (Gandjar dan Rohman, 2012).
Hal ini sepasang pelarut atau lebih yang dapat saling melarutkan akan memisah menjadi menjadi dua lapisan. Hal ini lazim terjadi pada dua pelarut yang sangat berbeda kepolarannya dicampur sehingga dapat dilihat berupa bercak berbentuk bulan setengah, bukan bentuk yang bundar atau lonjong ((Gritter, et al., 1991).
c. Harga Rf
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan dengan harga Rf (Retardation Factor = faktor penghambatan) (Stahl, 1985).
Rf= Jarak titik pusat bercak dari titik awal Jarak garis depan pelarut dari titik awal
Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari pusat bercak. Harga Rf berada antara 0,00 – 1,00. Harga Rf ini sangat berguna untuk mengidentifikasi suatu senyawa (Eaton, 1989).
Faktor-faktor yang mempengaruhi harga Rf adalah sebagai berikut (Sastrohamidjojo, 1985):
a. struktur kimia dari senyawa yang sedang dipisahkan b. bersifat penyerap
c. tebal dan kerataan lapisan penyerap d. jenis pelarut dan derajat kemurniannya
22 g. jumlah cuplikan yang digunakan
h. suhu
i. kesetimbangan
2.5.2 Kromatografi lapis tipis preparatif
Metode pemisahan senyawa bahan alam yang memakai peralatan yang paling dasar merupakan kromatografi lapis tipis (KLT) preparatif. Ketebalan penyerap yang sering dipakai adalah 0,5 - 2 mm, ukuran plat kromatografi biasanya 20 x 20 cm atau 20 x 40 cm. Ketebalan lapisan yang terbatas dan ukuran plat sudah tentu mengurangi jumlah bahan yang dapat dipisahkan dengan KLT preparatif. KLT preparatif dapat memisahkan bahan alam dalam jumlah gram, sebagian besar pemakaian hanya dalam jumlah milligram. Penjerap yang paling umum digunakan adalah silika gel dan dipakai untuk pemisahan senyawa lipofil maupun campuran senyawa hidrofil. Pemilihan pelarut ditentukan berdasarkan pemeriksaan pendahuluan memakai KLT analitik (Hostettmann, et al., 1995).
23 a. menyemprot dengan air (misalnya saponin).
b. menutup plat dengan sepotong kaca,lalu menyemprot salah satu sisi menggunakan pereaksi semprot.
c. menambahkan senyawa pembanding
2.5.3 Kromatografi lapis tipis dua arah (two-dimensional TLC)
KLT dua arah atau KLT dua dimensi ini bertujuan untuk meningkatkan resolusi sampel ketika komponen-komponen solut mempunyai karakteristik kimia yang hampir sama, karena nilai Rf juga hampir sama. Dua sistem fase gerak yang berbeda dapat digunakan secara berurutan pada suatu campuran tertentu sehingga memungkinkan untuk melakukan pemisahan analit yang mempunyai tingkat polaritas yang hampir sama maka KLT dua dimensi dapat dipakai untuk memeriksa kemurnian isolat. KLT dua dimensi dilakukan dengan melakukan penotolan sampel di salah satu sudut lapisan lempeng tipis dan mengembangkannya sebagaimana biasa dengan fase gerak pertama. Lempeng kromatografi selanjutnya dikeluarkan dari chamber pengembang dan fase gerak dibiarkan menguap dari lempeng. Lempeng
dimasukkan ke dalam chamber yang menggunakan fase gerak kedua sehingga pengembangan dapat terjadi pada arah kedua yang tegak lurus dengan arah pengembangan yang pertama. Pemisahan tergantung pada kemampuan untuk memodifikasi selektifitas eluen pertama (Rohman, 2009).
2.6 Spektrofotometri
2.6.1Spektrofotometri sinar ultraviolet
24
molekul dalam daerah spektrum ultraviolet sangat tergantung pada struktur elektronik dari molekul yang bersangkutan (Sastrohamidjojo, 1985).
Penyerapan radiasi UV terjadi melalui eksitasi elektron dalam suatu molekul obat ke level energi yang lebih tinggi. Transisi ini terjadi dari tingkat elektronik dasar suatu molekul ke salah satu level dalam keadaan elektronik tereksitasi (Gandjar dan Rohman, 2012). Tipe eksitasi tergantung pada panjang gelombang yang diserap cahaya. Gugus yang dapat mengabsorpsi cahaya sinar ultraviolet disebut gugus kromofor (Dachriyanus, 2004).
Pelarut yang banyak digunakan untuk spektrofotometri sinar UV adalah etanol 95% karena kebanyakan golongan senyawa larut dalam pelarut tersebut dan etanol tidak menyerap sinar UV. Pelarut lain yang digunakan adalah air, metanol, n-heksana, eter minyak bumi dan eter. Konsentrasi dari analit di dalam larutan bisa
ditentukan dengan cara mengukur absorbansi pada panjang gelombang tertentu dengan menggunakan hukum Lambert - Beer (Gandjar dan Rohman, 2007; Harborne, 1987).
Spektrofotometer UV pada umumnya digunakan untuk:
1. menentukan jenis kromofor, ikatan rangkap yang terkonjugasi dan ausokrom dari suatu senyawa organik.
2. menjelaskan informasi dari struktur berdasarkan panjang gelombangnya. (Dachriyanus, 2004).
2.6.2 Spektrofotometri sinar inframerah
Spektrofotometri inframerah pada umumnya digunakan untuk: 1. menentukan gugus fungsi suatu senyawa organik.
25
Pengukuran pada spektrum inframerah dilakukan pada daerah cahaya inframerah tengah (mid-infrared) yaitu pada panjang gelombang 2.5 - 50 �m atau bilangan gelombang 4000 - 200 cm-1. Energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Pita absorpsi sinar inframerah sangat khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi (Dachriyanus, 2004).
Hanya frekuensi (energi) dari radiasi inframerah tertentu yang dapat diserap oleh suatu molekul. Agar molekul dapat menyerap radiasi inframerah, maka molekul harus mempunyai gambaran, yakni momen dipol pada molekul harus berubah selama vibrasi (Gandjar dan Rohman, 2012).
Daerah inframerah terletak antara spektrum elektromagnetik cahaya tampak dan spektrum radio, yakni antara bilangan gelombang 4000 - 400 cm-1. Penggunaan spektrofotometri inframerah lebih banyak ditujukan untuk identifikasi suatu senyawa melalui gugus fungsinya. Spektrum inframerah senyawa organik bersifat khas, artinya senyawa yang berbeda akan mempunyai spektrum yang berbeda pula (Noerdin, 1985).
Penafsiran spektrum inframerah dari suatu senyawa yang belum diketahui ditujukan pada penentuan ada atau tidaknya gugus fungsional utama seperti C=O, O-H, N-O-H, C-O, C=C, C≡C, C=N, C≡N, dan NO2. Langkah-langkah yang dilakukan untuk memeriksa pita - pita yang terpenting pada hasil dari
spektrum inframerah (Pavia, et al., 1988): 1. Gugus karbonil
Gugus C=O memberikan puncak yang kuat pada daerah 1820-1660 cm-1.
26 langsung ke nomor 3).
Asam : lihat gugus O-H, merupakan serapan melebar di daerah 3300- 2500 cm-1.
Amida : lihat gugus N-H, merupakan serapan medium di daerah 3500 cm-1, kadang-kadang dengan puncak rangkap.
Ester : lihat gugus C-O, merupakan serapan medium di daerah 1300- 1000 cm-1.
Anhidrida : mempunyai dua serapan C=O di daerah 1810 dan 1760 cm-1. Aldehida : lihat gugus C-H, merupakan dua serapan lemah di daerah 2850
dan 2750 cm-1 yaitu disebelah kanan serapan C-H. Keton : kemungkinan bila kelima senyawa di atas tidak ada. 3. Bila gugus C=O tidak ada
Alkohol atau fenol : lihat gugus O-H, serapan melebar di daerah 3600-3300 cm-1 yang diikuti adanya serapan C- O di daerah 1300-1000 cm-1.
Amina : lihat gugus N-H, yaitu serapan medium di daerah 3500 cm-1.
Eter : lihat gugus C-O (dan tidak adanya O-H), yaitu serapan medium di daerah 1300-1000 cm-1.
4. Ikatan rangkap dua atau cincin aromatik
− Serapan lemah C=C di daerah 1650 cm-1.
27
− cocokkan kemungkinan di atas dengan memperhatikan serapan pada daerah C-H aromatik di sebelah kiri 3000 cm-1, sedangkan C-H alifatis terjadi di sebelah kanan daerah tersebut.
5. Ikatan rangkap tiga
− Serapan medium dan tajam dari C≡N di daerah bilangan gelombang 2250 cm-1.
− Serapan medium dan tajam dari C≡C di daerah bilangan gelombang 2150 cm-1.
6. Gugus nitro
− Dua serapan yang kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1. 7. Hidrokarbon
− Apabila keenam serapan di atas tidak ada.
− Serapan C-H alifatis di daerah sebelah kanan 3000 cm-1.
28
BAB III
METODE PENELITIAN
Metode penelitian meliputi pengumpulan dan pengolahan sampel, karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, analisis ekstrak dengan kromatografi lapis tipis, isolasi alkaloida dengan metode pengocokan asam basa, uji kemurnian isolat dan karakterisasi isolat dengan spektrofotometri ultraviolet dan spektrofotometri inframerah.
3.1. Alat-Alat yang Digunakan
Alat-alat yang digunakan pada penelitian ini adalah alat-alat gelas laboratorium, cawan penguap, spatula, blender (Panasonic), eksikator, seperangkat alat destilasi, chamber, plat KLT dan plat kaca KLT preparatif, pipet kapiler, spray kromatografi, oven listrik (Stork), tanur, krus porselen, penjepit tabung, kertas saring bebas abu, labu bersumbat, hair dryer (Maspion), neraca analitik (Vibra AJ), neraca kasar (Saherand), penangas air (Yenaco), rotary evaporator (Boeci 461), lemari pengering, mikroskop (Olympus), penjepit tabung, objek glass, deck glass, lampu spiritus, tisu lensa, spektrofotometer UV-Vis (Shimadzu) dan spektrofometer IR (IR-Prestige 21).
3.2. Bahan-Bahan yang Digunakan
Bahan-bahan yang digunakan dalam penelitian ini adalah, sebagai sampel digunakan daun kitolod (Hippobroma longiflora (L.) G. Don). Semua bahan yang digunakan kecuali dinyatakan lain adalah yang berkualitas proanalisa yaitu n-heksana, etilasetat, etanol, amil alkohol, benzen, toluen, metanol, kloroform,
29
timbal (II) asetat, kalium iodida, asam sulfat pekat, asam klorida pekat, asam asetat anhidrida, bismut (III) nitrat, serbuk magnesium, amonia, kalium bromida, kloralhidrat, dan floroglusin HCI, air suling,
3.3 Pembuatan Larutan Pereaksi
3.3.1 Pereaksi mayer
Sebanyak 1,359 gram raksa (II) klorida ditimbang, dilarutkan dalam air suling hingga 60 ml. Wadah lain kalium iodida ditimbang sebanyak 5 gram, dilarutkan dalam 10 ml air suling, kemudian keduanya dicampurkan dan ditambahkan air suling hingga 100 ml (Depkes RI, 1995).
3.3.2 Pereaksi bouchardat
Sebanyak 4 gram kalium iodida ditimbang, dilarutkan dalam air suling dan sebanyak 2 gram iodium ditimbang, dilarutkan dalam larutan kalium iodida dan dicukupkan dengan air suling hingga 100 ml (Depkes RI, 1995).
3.3.3 Pereaksi Dragendorff
Sebanyak 0,6 gram bismut (III) nitrat ditimbang, dilarutkan dalam 2 ml asam klorida pekat, lalu ditambahkan 10 ml air suling. Wadah lain dilarutkan 6 gram kalium iodida dalam 10 ml air suling. Kedua larutan dicampurkan dengan 7 ml asam klorida pekat dan 15 ml air suling (Harborne, 1987).
3.3.4 Pereaksi Liebermann-Burchard
Dua puluh bagian asam asetat anhidrat dicampurkan dengan satu bagian asam sulfat pekat (Harborne, 1987).
3.3.5 Pereaksi asam klorida 2N
30
3.3.6 Pereaksi natrium hidroksida 2N
Sebanyak 8,002 gram kristal natrium hidroksida ditimbang, dilarutkan dalam air suling sehingga diperoleh larutan 100 ml.
3.3.7 Pereaksi asam sulfat 2N
Sebanyak 9,808 ml asam sulfat pekat diencerkan dengan air suling secukupnya hingga volume 100 ml (Depkes RI, 1995).
3.3.8 Pereaksi Molish
Sebanyak 3 gram α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5N hingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.9 Pereaksi besi (III) klorida 1%
Sebanyak 1 gram besi (III) klorida ditimbang, dilarutkan dalam air suling sehingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.10 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 gram timbal (II) asetat ditimbang, dilarutkan dalam air suling bebas karbondioksida sehingga diperoleh larutan 100 ml (Depkes RI, 1995).
3.3.11 Larutan pereaksi kloralhidrat 70% b/b
Sebanyak 70 gram kristal kloralhidrat ditimbang lalu dilarutkan dalam 30 ml air suling (Depkes RI, 1995).
3.4 Pengambilan dan Pengolahan Tumbuhan
3.4.1 Pengambilan tumbuhan
Sampel daun yang digunakan dalam penelitian ini adalah daun yang dewasa yang tidak terlalu tua dari kitolod (Hippobroma longiflora (L.) G. Don) yang diambil
31
dengan tumbuhan yang sama dari daerah lain dengan asumsi bahwa semua tumbuhan kitolod sama dan seragam secara genetika karena termasuk satu spesies yakni Hippobroma longiflora (L.) G. Don.
3.4.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Herbarium Bogoriense, Bidang Botani Pusat Penelitian Biologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI) Bogor. Hasil identifikasi tumbuhan dapat dilihat pada Lampiran 1 halaman 54.
3.4.3 Pembuatan simplisia
Daun kitolod segar (2,3 kg) dibersihkan dari pengotor, kemudian dicuci dengan air mengalir hingga bersih, ditiriskan, lalu ditimbang (3,3 kg), lalu dikeringkan di lemari pengering dengan suhu ±500C selama 5 hari. Tumbuhan dianggap kering apabila diremas akan hancur, lalu ditimbang (580 g), selanjutnya tumbuhan diserbukkan dengan menggunakan blender, ditimbang (450 g),dan disimpan dalam wadah tertutup rapat yang terlindung dari sinar matahari.
3.5 Pemeriksaan Karakteristik Simplisia
Pemeriksaan karakteristik simplisia meliputi dari pemeriksaan makroskopik simplisia,pemeriksaan mikroskopik serbuk simplisia, penetapan kadar air, penetapan kadar sari yang larut air, penetapan kadar sari yang larut etanol, penetapan kadar abu total, penetapan kadar abu tidak larut asam (Depkes RI, 1995).
3.5.1Pemeriksaan makroskopik simplisia dan serbuk
32
3.5.2 Pemeriksaan mikroskopik serbuk simplisia
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia daun kitolod. Caranya: Sedikit serbuk simplisia ditaburkan di atas kaca objek yang telah ditetesidengan larutan kloralhidrat dan ditutup dengan kaca penutup, kemudian diamati di bawah mikroskop. Hasil pemeriksaan mikroskopik dapat dilihat pada Lampiran 6 halaman 60 .
3.5.3 Penetapan kadar air
Sebanyak 200 ml toluen dan 2 ml air suling dimasukkan ke dalam labu alas bulat, dipasang alat penampung dan pendingin, kemudian didestilasi selama 2 jam. Destilasi dihentikan dan dibiarkan dingin selama 30 menit, kemudian volume air dalam tabung penerima dibaca dengan ketelitian 0,05 ml, lalu ke dalam labu tersebut dimasukkan 5 gram serbuk simplisia yang telah ditimbang seksama, labu dipanaskan hati-hati selama 15 menit. Saat toluen mendidih kecepatan tetesan diatur 2 tetes untuk tiap detik sampai sebagian besar air terdestilasi setelah terdestilasi bagian dalam pendingin dibilas dengan toluen. Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan mendingin pada suhu kamar, setelah air dan toluen memisah sempurna, volume air dibaca dengan ketelitian 0,05 ml. Selisih kedua volume air yang dibaca sesuai dengan kandungan air yang terdapat dalam bahan yang diperiksa. Kadar air dihitung dalam persen (WHO, 1992).
3.5.4 Penetapan kadar sari yang larut air
33
sampai kering dalam cawan dangkal berdasarkan rata yang telah ditara. Sisa dipanaskan sampai kering pada suhu 1050C hingga bobot tetap. Kadar sari yang larut dalam air dihitung dalam persen terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.5.5 Penetapan kadar sari larut etanol
Sebanyak 5 gram serbuk yang telah dikeringkan di udara dimaserasi selama 24 jam dengan 100 ml etanol (95%) menggunakan labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Disaring dengan cepat untuk menghindarkan penguapan dari etanol, sejumlah 20 ml filtrat diuapkan sampai kering dalam cawan dangkal berdasar rata yang telah ditara. Sisa dipanaskan sampai kering pada suhu 105oC hingga bobot tetap. Kadar sari yang larut dalam etanol dihitung dalam persen terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.5.6 Penetapan kadar abu
Sebanyak 2 gram serbuk yang telah dihaluskan ditimbang seksama, dimasukkan ke dalam krus porselen yang telah terlebih dahulu dipijar dan ditara, kemudian diratakan, lalu krus dipijarkan perlahan-lahan sampai bobot tetap. Kadar abu dihitung dalam persen terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.5.7 Penetapan kadar abu yang tidak larut asam
34
Residu dan kertas saring dipijar sampai bobot tetap. Kadar abu yang tidak larut dalam asam dihitung terhadap bahan yang telah dikeringkan di udara (Depkes RI, 1995).
3.6 Skrining Fitokimia
3.6.1 Pemeriksaan alkaloida
Sebanyak 0,5 gram serbuk simplisia ditimbang, kemudian ditambahkan 1 ml asam klorida 2N dan 9 ml air suling, dipanaskan di atas penangas air selama 2 menit, didinginkan dan disaring. Filtrat dipakai untuk tes alkaloida, diambil 3 tabung reaksi, lalu ke dalam masing-masing tabung reaksi dimasukkan 0,5 ml filtrat. Pada tabung pertama ditambahkan 2 tetes pereaksi Meyer, tabung kedua ditambahkan 2 tetes pereaksi Bouchardat, dan tabung ketiga ditambahkan 2 tetes pereaksi Dragendorff. Alkaloida disebut positif jika terjadi endapan atau kekeruhan paling sedikit dua dari tiga percobaan di atas (Depkes RI, 1995).
3.6.2 Pemeriksaan flavonoida
Sebanyak 10 gram serbuk simplisia kemudian ditambahkan 100 ml air panas, dididihkan selama 5 menit dan disaring dalam keadaan panas, filtrat yang diperoleh kemudian diambil 5 ml lalu ditambahkan 0,1 gram serbuk Mg dan 1 ml asam klorida pekat dan 2 ml amil alkohol, lalu dikocok, dan dibiarkan memisah. Flavonoida positif jika terjadi warna merah, kuning, jingga pada lapisan amil alkohol (Farnsworth, 1966).
3.6.3 Pemeriksaan glikosida
35
Sebanyak 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dikocok dan didiamkam selama 5 menit, lalu disaring. Sebanyak 20 ml filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M dan dikocok lalu didiamkan selama 5 menit, disaring. Filtrat diekstraksi dengan 20 ml campuran 3 bagian kloroform dan 2 bagian isopropanol, ini dilakukan sebanyak tiga kali. Kumpulan sari air diuapkan pada temperatur tidak lebih dari 50oC sisanya dilarutkan dalam 2 ml metanol. Larutan ini digunakan untuk percobaan berikut: larutan sisa dimasukkan ke dalam tabung reaksi, diuapkan di atas penangas air, sisanya ditambahkan 2 ml air dan 5 tetes pereaksi Molish, kemudian ditambahkan hati-hati 2 ml asam sulfat pekat melalui dinding tabung, bila terbentuk cincin ungu pada batas kedua cairan menunjukkan adanya gula (Depkes RI, 1995).
3.6.4 Pemeriksaan saponin
Sebanyak 0,5 gram serbuk simplisia ditimbang, dimasukkan dalam tabung reaksi lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat- kuat selama 10 detik, jika terbentuk buih yang stabil selama tidak kurang dari 10 menit setinggi 1 - 10 cm dan dengan penambahan 1 tetes asam klorida 2N buih tidak hilang maka menunjukkan adanya saponin (Depkes RI, 1995).
3.6.5 Pemeriksaan tanin
36
3.6.6 Pemeriksaan steroida/triterpenoida
Sebanyak 1 gram serbuk simplisia ditimbang, lalu dimaserasi dengan 20 ml n-heksana selama 2 jam, lalu disaring. Filtrat diuapkan dalam cawan penguap, pada
sisa ditambahkan 2 tetes asam asetat anhidrida dan 1 tetes asam sulfat pekat, apabila timbul warna ungu atau merah kemudian berubah menjadi hijau biru menunjukkan adanya steroid/triterpenoid (Harborne, 1987).
3.7 Pembuatan Ekstrak Metanol Daun Kitolod
Pembuatan ekstrak daun kitolod dilakukan dengan cara perkolasi menggunakan pelarut metanol.
Cara kerja: Sebanyak 330 gram serbuk simplisia daun kitolod dibasahi dengan penyari, ditutup dan dibiarkan selama 3 jam, kemudian dimasukkan ke dalam alat perkolator. Larutan penyari metanol dituang secukupnya sampai semua simplisia terendam dan terdapat selapis cairan penyari di atasnya, mulut tabung perkolator ditutup dengan aluminium foil dan dibiarkan selama 24 jam, kemudian kran dibuka dan dibiarkan tetesan ekstrak mengalir dengan kecepatan 20 tetes per menit, perkolasi dihentikan pada saat beberapa tetes perkolat tidak bereaksi ketika ditambahkan pereaksi Mayer, Bouchardat dan Dragendorff. Pelarut yang digunakan sebanyak 6 liter. Perkolat yang diperoleh kemudian dipekatkan dengan alat penguap vakum putar (rotary evaporator) pada temperatur yang tidak lebih dari 50oC sampai diperoleh ekstrak kental daun kitolod (Depkes RI, 1995). Bagan pembuatan ekstrak metanol dapat dilihat pada Lampiran 3 halaman 56 .
3.8 Isolasi Senyawa Alkaloida dari Ekstrak Metanol dengan Metode Pengocokan Asam Basa
37
menggunakan metode pengocokan asam basa sampai diperoleh ekstrak alkaloida kasar.
Cara kerja: Sebanyak 26,50 gram ekstrak kental ditambahkan HCI 2N hingga pH 2 - 3, dikocok lalu disaring dan filtrat dibasakan dengan NH4OH (p) hingga pH 9 - 10. Dikocok dengan 100 ml kloroform dalam corong pisah, lapisan air dan lapisan kloroform dipisahkan. Lapisan kloroform ditambahkan HCI 2N sama banyak dalam corong pisah, dikocok. Lapisan kloroform dan lapisan asam dipisahkan. Lapisan asam dibasakan dengan NH4OH (p) hingga pH 9 - 10. Dikocok dengan 100 ml kloroform dalam corong pisah, lapisan air dan lapisan kloroform dipisahkan. Lapisan kloroform ditambahkan HCI 2N sama banyak dalam corong pisah, dikocok. Lapisan kloroform dan lapisan asam. dipisahkan. Lapisan asam dibasakan dengan NH4OH (p) hingga pH 9 - 10. Dikocok dengan 100 ml kloroform dalam corong pisah. Lapisan air dan lapisan kloroform dipisahkan. Lapisan kloroform yang diperoleh dikumpulkan kemudian dipekatkan dengan rotary evaporator pada temperatur tidak lebih dari 40oC hasilnya diperoleh ekstrak kasar alkaloida daun kitolod (Fergusson, 1956). Bagan isolasi senyawa alkaloida dari ekstrak metanol dengan metode pengocokan asam basa dapat dilihat pada Lampiran 4 halaman 57.
3.9 Analisis Ekstrak Alkaloida Kasar Secara KLT
38
Cara kerja: Ekstrak alkaloida kasar dilarutkan dalam metanol, ditotolkan pada plat lapis tipis, kemudian dimasukan ke dalam chamber yang telah jenuh dengan uap fase gerak, setelah pengembangan selesai plat dikeluarkan dan dikeringkan, plat disemprot dengan penampak bercak Dragendorff dan dipanaskan di oven pada suhu 110℃ selama beberapa menit (Gritter, et al.,1991). Warna yang terbentuk diamati dan dihitung harga Rf semua bercak. Fase gerak yang menghasilkan noda (bercak) paling banyak jumlahnya adalah fase gerak yang terbaik. Hasil analisis ekstrak alkaloida kasar secara KLT dapat dilihat pada Lampiran 8 halaman 66 .
3.10 Isolasi Senyawa Alkaloida Secara KLT Preparatif
39
3.11 Uji Kemurnian Isolat Dengan KLT Satu Arah
Uji kemurnian isolat hasil isolasi dilakukan dengan KLT satu arah menggunakan tiga fase gerak yang berbeda yaitu kloroform:metanol:ammonia (85:15:1), metanol:diklorometan:ammonia (30:70:1), dan benzen:etilasetat (80:40), sebagai penampak bercak digunakan Dragendorff.
Caranya: Isolat ditotolkan pada plat lapis tipis, lalu dimasukan ke dalam chamber yang telah jenuh dengan uap fase gerak, setelah pengembangan selesai plat dikeluarkan dan dikeringkan, lalu plat disemprot dengan penampak bercak Dragendorff, dipanaskan di oven pada suhu 110℃ selama 10 menit (Gritter, et al., 1991). Hasil uji diperoleh kemurnian isolat dapat dilihat pada Lampiran 10 halaman 68.
3.12 Uji Kemurnian Isolat Dengan KLT Dua Arah
40
3.13 Karakterisasi Isolat
Karakterisasi isolat dilakukan dengan spektrofotometri ultraviolet dan spektrofotometri inframerah dilakukan di Laboratorium Penelitian Fakultas Farmasi USU Medan.
3.13.1 Karakterisasi isolat dengan spektrofotometri UV
Cara kerja:
Isolat hasil isolasi dilarutkan dalam pelarut metanol, lalu dimasukkan dalam kuvet yang telah dibilas dengan metanol, selanjutnya absorbansi larutan sampel diukur pada panjang gelombang 200 - 400 nm (Dachriyanus, 2004).
3.13.2 Karakterisasi isolat dengan spektrofotometri IR Cara kerja:
Karakterisasi isolat dengan spektrofotometri IR dilakukan dengan cara mencampurkan 1 mg isolat dengan 100 mg kalium bromida menggunakan alat mixture vibrator kemudian dicetak menjadi pelet KBr pada tekanan 11,5 ton
41
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil Identifikasi Tumbuhan
Hasil identifikasi tumbuhan yang dilakukan di Herbarium Bogoriense Bidang Botani Pusat Penelitian Biologi-LIPI Bogor menunjukkan bahwa tumbuhan yang diteliti termasuk spesies Hippobroma longiflora (L.) G. Don. dari suku Campanulaceae.
4.2 Hasil Pemeriksaan Makroskopik Simplisia
Hasil pemeriksaan makroskopik simplisia daun kitolod bercirikan pada helaian daun berwarna hijau, tegak, ujungnya runcing, bergerigi bagian tepi daun sampai melekuk, berbulu, panjang 5 - 6.5 cm, lebar 2 - 3 cm, kasar, bau sangat tajam, rasa pahit.
4.3 Hasil Pemeriksaan Mikroskopik
Hasil pemeriksaan mikroskopik dari penampang melintang daun kitolod segar memperlihatkan ada trikoma, stomata, 2 lapis epidermis terdiri dari 1 lapis epidermis atas dan 1 lapis epidermis bawah, jaringan pagar (palisade), jaringan bunga karang (spons), dan jaringan pengangkut yaitu xilem dengan penebalan spiral.
Hasil pemeriksaan mikroskopik serbuk simplisia daun kitolod terdapat stomata tipe anomositik yaitu jumlah sel tetangga tiga atau lebih satu sama lain sama, jaringan palisade, xilem dengan penebalan spiral, dan rambut penutup uniseluler (Maria, 2009).
42
Tabel 4.1 Hasil pemeriksaan karakterisasi serbuk simplisia daun kitolod.
No Karakterisasi Simplisia Hasil
(%)
1. Penetapan kadar air 3,33
2. Penetapan kadar sari yang larut air 16,65 3. Penetapan kadar sari yang larut etanol 20,02
4. Penetapan kadar abu total 1,26
5. Penetapan kadar abu yang tidak larut asam 0,98
Monografi simplisia daun kitolod tidak terdaftar di buku Materia Medika Indonesia (MMI), sehingga perlu pembakuan mengenai parameter karakterisasi simplisia daun kitolod.
Penetapan kadar air dilakukan berhubungan dengan mutu simplisia agar tidak mudah ditumbuhi mikroorganisme, hasil yang diperoleh adalah 3,33%. Persyaratan kadar air simplisia daun kitolod memenuhi persyaratan dari literatur yaitu tidak melebihi 5%. Kadar air yang melebihi 5% dapat menjadi media yang baik untuk pertumbuhan mikroba, keberadaan jamur atau serangga, serta mendorong kerusakan karena terjadi proses hidrolisis (Depkes RI, 1995).
43
Penetapan kadar abu total dilakukan untuk mengetahui kandungan mineral internal (abu fisiologis) yang berasal dari jaringan tanaman itu sendiri dan eksternal (abu non-fisiologis) yang merupakan residu dari luar seperti pasir dan tanah yang terdapat dalam sampel (Ditjen POM 2000; WHO 1992). Kadar abu tidak larut asam untuk menunjukkan jumlah silikat, khususnya pasir yang ada pada simplisia dengan cara melarutkan abu total dalam asam klorida (WHO, 1992).
Penetapan kadar abu pada simplisia daun kitolod menunujukkan kadar abu total sebesar 1,26% dan kadar abu tidak larut asam 0,98%. Kadar abu total pada umumnya untuk masing-masing simplisia tidak sama. Umumnya syarat kadar abu tidak larut asam < 1% dan simplisia daun kitolod memenuhi persyaratan.
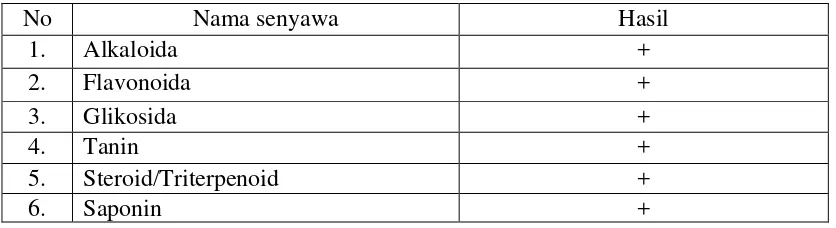
[image:61.595.97.515.442.556.2]Hasil skrining fitokimia serbuk simplisia daun kitolod (Hippobroma longiflora (L.) G. Don) dapat dilihat pada tabel berikut:
Tabel 4.2 Hasil skrining fitokimia serbuk simplisia daun kitolod.
No Nama senyawa Hasil
1. Alkaloida +
2. Flavonoida +
3. Glikosida +
4. Tanin +
5. Steroid/Triterpenoid +
6. Saponin +
44
memberikan warna kuning pada lapisan amil alkohol. Ini dianggap bahwa flavonoida positif pada simplisia daun kitolod (Farnsworth, 1966).
Skrining glikosida ditunjukkan dengan penambahan pereaksi Molish dan asam sulfat pekat dimana terbentuk cincin ungu. Pereaksi Molish merupakan pereaksi umum yang digunakan untuk identifikasi karbohidrat, dalam hal ini adalah gula (Depkes RI, 1995), sedangkan skrining pada tanin dengan penambahan FeCl3 memberikan warna biru kehitaman yang menunjukan adanya tanin (Farnsworth, 1966). Skrining steroid/triterpenoid dengan penambahan pereaksi Liebermann-Burchard memberikan warna merah keunguan dan hijau biru menunjukkan adanya senyawa steroid/triterpenoid (Harborne, 1987), sedangkan skrining pada saponin menghasilkan busa yang stabil dengan tinggi busa 3 cm dan tidak hilang dengan penambahan HCl 2N (Depkes RI, 1995).
4.4 Hasil Ekstraksi
Sebanyak 330 gram serbuk simplisia daun kitolod diekstraksi dengan cara perkolasi menggunakan pelarut metanol sehingga diharapkan kandungan senyawa kimia yang terdapat didalamnya dapat tersari sempurna. Ekstrak metanol setelah diuapkan dengan alat rotary evaporator menghasilkan ekstrak kental metanol sebanyak 30,134 gram.
4.5 Hasil Isolasi Senyawa Alkaloida dengan Metode Pengocokan Asam Basa
45
sedangkan penambahan basa adalah untuk membebaskan kembali alkaloida dari bentuk garam sehingga dapat dengan mudah diekstraksi dengan pelarut organik yang sesuai.
4.6 Hasil Analisis Ekstrak Alkaloida Kasar secara KLT
Hasil analisis KLT menggunakan fase diam silika gel F254 dan penampak bercak Dragendorff, diperoleh fase gerak terbaik kloroform:metanol:ammonia dengan perbandingan (85:15:1) karena menghasilkan pemisahan noda yang paling baik.
4.7 Hasil Isolasi Senyawa Alkaloida secara KLT Preparatif
Hasil kromatografi lapis tipis preparatif dari ekstrak alkaloida kasar daun kitolod terdapat 3 pita yang berwarna merah jingga, masing-masing dikerok dan direndam selama satu malam dalam metanol kemudian disaring lalu diuapkan dan diperoleh 3 isolat, yaitu isolat pertama pada nilai Rf 0,43 setelah titik penotolan, isolat kedua pada nilai Rf 0,62, dan isolat ketiga pada nilai Rf 0,73, selanjutnya direndam dengan metanol dingin sehingga diperoleh kristal amorf yang berwarna putih yang berupa isolat murni. Isolat pertama kemudian dilanjutkan dengan uji kemurnian dengan KLT 1 arah dan KLT 2 arah.
4.8 Hasil Uji Kemurnian KLT Satu Arah
46 diduga bahwa isolat yang diperole