KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA ISOLASI SENYAWA ALKALOIDA DARI
BIJI TUMBUHAN Tephrosia vogelii Hook.f.
SKRIPSI
DIAJUKAN OLEH :
LILYS SITORUS NIM : 050814014
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA ISOLASI SENYAWA ALKALOIDA DARI
BIJI TUMBUHAN Tephrosia vogelii Hook.f.
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar sarjana Farmasi pada
Fakultas Farmasi Universitas Sumatera Utara
OLEH :
LILYS SITORUS NIM : 050814014
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN
Judul :
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA
SERTA ISOLASI SENYAWA ALKALOIDA DARI
BIJI TUMBUHAN Tephrosia vogelii Hook.f.
Oleh : LILYS SITORUS NIM : 050814014
Dipertahankan Dihadapan Panitia Penguji Skripsi Fakultas Farmasi
Universitas Sumatera Utara Pada tanggal: April 2010
Pembimbing I, Panitia Penguji,
(Dr. M. Pandapotan Nst, MPS, Apt) (Prof.Dr.ner.nat. Effendy De Lux Putra Su.,Apt)
NIP : 194 908 111 976 031 001 NIP : 195 306 191 983 031 001
Pembimbing II, (Dr. M. Pandapotan Nst, MPS, Apt)
NIP : 194 908 111 976 031 001
(Dra. Aswita Hafni Lubis, M.Si., Apt) (Dra. Marline Nainggolan, M.Si., Apt) NIP : 195 304 031 983 032 001 NIP : 195 709 091 985 112 001
KATA PENGANTAR
Puji dan syukur penulis panjatkan kehadirat Tuhan Yang Maha Kuasa
atas segala rahmat, anugerah, kasih dan kuasa-Nya, sehingga penulis dapat
menyelesaikan penelitian dan menyusun skripsi ini.
Terima kasih yang tulus dan tak terhingga penulis ucapkan kepada
Ayahanda Y. Sitorus dan Ibunda T. Harianja, Abangku Sumihar Sitorus, Irfan
Sitorus, berserta kakakku Siti Aisyah Sitorus, dan adik-adikku tercinta Mery
Sitorus dan Erna Wati Oktoria Sitorus, yang dengan penuh kesabaran mendoakan
dan mendukung penulis selama pendidikan sampai pada penyelesaian skripsi ini.
Ucapan terima kasih dan penghargaan yang tulus dan sebesar-besarnya
kepada Bapak Dr. M. Pandapotan Nst, MPS, Apt dan Ibu Dra. Aswita Hafni
Lubis, Msi, Apt, selaku pembimbing yang penuh ketulusan dan kesabaran
membimbing dan mengarahkan penulis dari awal penelitian hingga selesainya
penulisan skripsi ini.
Pada kesempatan ini dengan segala kerendahan hati penulis juga ingin
mengucapkan terima kasih yang sebesar-besarnya kepada:
1. Bapak Dekan Fakultas Farmasi Prof. Dr. Sumadio Hadisahputra, Apt, yang
telah memberikan fasilitas sehingga penulis dapat menyelesaikan pendidikan.
2. Bapak Prof.Dr.ner.nat. Effendy De Lux Putra Su; Apt, selaku seketaris
Jurusan Farmasi.
3. Bapak Dr. Muchlisyam, M.Si, Apt, selaku penasehat akademik yang telah
4. Bapak/ Ibu staff penguji yang telah membimbing dan memberikan
masukan-masukan kepada penulis dalam penulisan skripsi ini.
5. Bapak/ Ibu staff pengajar jurusan Farmasi di Fakultas Farmasi USU yang telah
mendididk dan membimbing penulis selama menuntut ilmu pengetahuan di
Jurusan Farmasi.
6. Bapak Panal Sitorus, M.Si, Apt, selaku kepala laboratorium Farmakognosi
beserta seluruh staff yang telah mengijinkan penulis menggunakan fasilitas
laboratorium selama penelitian.
7. Teman-teman Mahasiswa/I Jurusan Farmasi serta semua pihak yang telah
memberikan bantuan, dorongan, semangat hinggga selesainya penulisan
skripsi ini.
Penulis menyadari bahwa skripsi ini masih memiliki banyak kekurangan,
oleh sebab itu dengan segala kerendahan hati penulis bersedia menerima kritik
dan saran untuk skripsi ini. Semoga penelitian ini dapat menjadi sumbangan yang
berarti bagi ilmu pengetahuan pada umumnya dan ilmu farmasi pada khususnya.
Medan, Maret 2010
Penulis
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA
ISOLASI SENYAWA ALKALOIDA DARI BIJI TUMBUHAN
Tephrosia vogelii Hook.f.
ABSTRAK
Telah dilakukan karakterisasi simplisia, skrining fitokimia, isolasi dan
karakterisasi senyawa alkaloida dari biji tumbuhan Tephrosia vogelii Hook.f. suku
Papilionaceae.
Skrining fitokimia dilakukan terhadap senyawa golongan alkaloida,
flavonoida, glikosida, glikosida antrakinon, saponin, tanin dan
triterpenoida/steroida. Ekstraksi dilakukan dengan pelarut etanol 96% dan
senyawa alkaloida diisolasi dari ekstrak kasar dengan metode pengocokan asam
basa, selanjutnya dilakukan pemisahan alkaloida secara KLT preparatif dengan
fase gerak kloroform - metanol - amonia (85 : 15 : 1). Isolat yang diperoleh
dikarakterisasi dengan spektrofotometer ultra violet dan spektrofotometer infra
merah.
Hasil karakterisasi simplisia diperoleh kadar abu total 7,70% , kadar abu
yang tidak larut dalam asam 1,73% , kadar sari yang larut dalam air 22,46%,
kadar sari yang larut dalam etanol 12,19% , dan kadar air 7,96% . Hasil
pemeriksaan makroskopik serbuk simplisia Tephrosiae vogelii semen adalah biji
berwarna hitam berdiameter 0,5 cm, berbentuk lonjong tipis, bentuk permukaan
licin, dan rasanya pahit. Hasil pemeriksaan mikroskopik serbuk simplisia dijumpai
adanya parenkim, rambut penutup, epidermis, berkas pembuluh. Hasil penapisan
menunjukkan adanya senyawa golongan alkaloida, flavonoida glikosida, saponin,
dan triterpenoida/ steroida. Pemisahan dengan KLT menghasilkan isolat A1 (Rf
0,86) yang memberikan absorbansi ultra violet pada λ 207 nm sedangkan
spektrum infra merah menunjukkan adanya gugus C-H alifatis dari CH2 dan CH3,
C=0, ikatan rangkap C=C, dan ikatan C-N.
THE CHARACTERIZATION OF SIMPLEX AND PHYTOCHEMICAL SCREENING ISOLATION OF ALKALOIDAL COMPOUNDS OF SEED
OF Tephrosia vogelii Hook.f.
ABSTRACT
The characterization of simplex, phytochemical screening, isolation and characterization of alkaloidal compounds of the seeds of Tephrosia vogelii
Hook.f. of the family Papilionaceae have been carried out.
Phytochemical screening are carried out for the presence of alkaloidal, flavonoid, glycoside, anthraquinone glycoside, saponin, tannin and triterpenoid/steroid. Extraction was carried out using 96% ethanol as solvent and alkaloidal compounds were isolated by acid-base shake up method. Separation of alkaloidal compounds were carried out by preparative TLC with chloroform -methanol - ammonium hydroxide (85 : 15 : 1) as mobile phase. The isolate was characterized by ultra violet and infra red spectrophotometries.
The characterization of simplex gave the total ash value 7.71%, the acid insoluble ash value 1.73%, the water soluble extract value 2.46%, the ethanol soluble extract value 12.19%, and the water content 7.96%. The result of microscopic examination of Tephrosiae vogelii semen. showed that the seeds are black in colour, diameter 0.5 cm, oval, thin, smooth and bitter. Microscopic examination of seeds showed the presence of parenchyma tic cells, glandular hair, epidermis, and vascular bundle. Phytochemical screening showed the presence of the alkaloidal, glycoside, saponin, and triterpenoid/ steroid. The separation of alkaloid by preparative TLC gave one isolate A1 (Rf 0.86). Isolate exhibited an
ultra violet absorption at 207 nm and infra red spectrum showed the presence of – CH aliphatic bond of CH2 and CH3, C=0 bond, double bond of C=C, and C-N
bond functionalities.
DAFTAR ISI
Halaman
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR ... iii
ABSTRAK ... v
ABSTRACT ... vi
DAFTAR ISI ... vii
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
BAB I PENDAHULUAN ... 1
BAB II TINJAUAN PUSTAKA ... 4
2.1 Uraian Tumbuhan... 4
2.1.1 Habitat ... 4
2.1.2 Nama Daerah... 4
2.1.3 Marfologi ... 4
2.1.4 Sistematika tumbuhan ... 5
2.2 Uraian Kimia... 5
2.2.1 Alkaloida ... 5
2.2.2 Glikosida ... 13
2.2.3 Saponin... 15
2.2.5 Flavonoid ... 17
2.3 Ekstraksi... 17
2.4 Kromatografi ... 20
2.4.1 Kromatografi lapis tipis ... 21
2.5 Spektrofotometri Ultra Violet ... 23
2.6 Spektrofotometri Infra Merah ... 24
BAB III METODE PENELITIAN ... 27
3.1. Alat-alat yang digunakan ... 27
3.2. Bahan-bahan yang digunakan ... 27
3.3. Pembuatan Larutan Pereaksi ... 28
3.3.1. Pereaksi Mayer... 28
3.3.2. Pereaksi Bauchardat ... 28
3.3.3. Pereaksi Dragendorff ... 28
3.3.4. Pereaksi Liebermann- Burchard... 29
3.3.5. Pereaksi asam klorida 2 N... 29
3.3.6. Pereaksi natrium hidroksida 2 N ... 29
3.3.7. Pereaksi asam sulfat 2 N ... 29
3.3.8. Pereaksi asam nitrat 0,5 N... 29
3.3.9. Pereaksi Molish... 29
3.3.10.Pereaksi besi (III) klorida 1% ... 29
3.3.11.Pereaksi timbal (II) asetat 0,4 M ... 29
3.3.12.Pereaksi dapar fosfat pH 7,4 ... 30
3.3.13.Pereaksi kloralhidrat 71% b/b ... 30
3.4.1. Pengumpulan sampel bahan tumbuhan... 30
3.4.2. Identifikasi tumbuhan... 30
3.4.3. Pembuatan Simplisia... 30
3.5. Karakterisasi Simplisia ... 31
3.5.1 Pemeriksaan makroskopik ... 31
3.5.2 Pemeriksaan mikroskopik ... 31
3.5.3 Penetapan kadar abu total... 31
3.5.4 Penetapan kadar abu yang tidak larut dalam asam... 31
3.5.5 Penetapan kadar sari yang larut dalam air... 32
3.5.6 Penetapan kadar sari yang larut dalam etanol ... 32
3.5.7 Penetapan kadar air ... 32
3.6. Skrining Fitokimia ... 33
3.6.1 Pemeriksaan alkaloida... 33
3.6.2 Pemeriksaan flavonoida ... 34
3.6.3 Pemeriksaan glikosida... 35
3.6.4 Pemeriksaan glikosida antrakinon... 35
3.6.5 Pemeriksaan saponin... 35
3.6.5.1Uji busa ... 35
3.6.6 Pemeriksaan tanin ... 36
3.6.7 Pemeriksaan triterpenoida / steroida bebas ... 36
3.7 Pembuatan Ekstrak ... 36
3.8 Isolasi Senyawa Alkaloida dari Ekstrak Etanol dengan Metode Pengocokan Asam Basa ... 37
Tipis (KLT) ... 38
3.10 Isolasi senyawa alkaloida secara Kromatografi Lapis Tipis Preparatif 39 3.11 Analisis Senyawa Alkaloida Hasil Isolasi secara Kromatografi lapis tipis (KLT) dengan satu arah memakai fase gerak yang berbeda ... 39
3.12 Uji Kemurnian Senyawa Alkaloida Hasil Isolasi ... 40
3.13 Karakterisasi Isolat ... 41
3.13.1 Karakterisasi isolat dengan spektrofotometri ultra violet ... 41
3.13.2 Karakterisasi isolat dengan spektrofotometri infra merah ... 41
BAB IV HASIL DAN PEMBAHASAN ... 42
BAB V KESIMPULAN DAN SARAN ... 47
5.1 Kesimpulan ... 47
5.2 Saran ... 47
DAFTAR PUSTAKA ...
48
LAMPIRAN ...
DAFTAR TABEL
Halaman
Tabel 1 Hasil karakterisasi simplisia ... 59
Tabel 2 Hasil skrining fitokimia serbuk simplisia Tephrosiae
DAFTAR GAMBAR
Halaman
Gambar 1 Tumbuhan Tephrosia vogelii Hook.f. ... 51
Gambar 2 Hasil pemeriksaan mikroskopik serbuk simplisia biji tumbuhan Tephrosiae vogelii semen. ... 52
Gambar 5 Kromatogram KLT ekstrak etanol biji tumbuhan Tephrosia vogelii Hook.f. dengan fase gerak kloroform – metanol - amonia ( 85 : 15 : 1) ... 62
Gambar 6 Isolasi senyawa alkaloida secara KLT preparatif... 63
Gambar 7 Kromatogram KLT satu arah dari isolat dengan berbagai Fase gerak yang berbeda ... 64
Gambar 8 Kromatografi KLT dua arah dari pada isolat ... 65
Gambar 9 Spektrum ultra violet isolat A1... 66
Gambar 10 Spektrum infra merah isolat A1... 66
KARAKTERISASI SIMPLISIA DAN SKRINING FITOKIMIA SERTA
ISOLASI SENYAWA ALKALOIDA DARI BIJI TUMBUHAN
Tephrosia vogelii Hook.f.
ABSTRAK
Telah dilakukan karakterisasi simplisia, skrining fitokimia, isolasi dan
karakterisasi senyawa alkaloida dari biji tumbuhan Tephrosia vogelii Hook.f. suku
Papilionaceae.
Skrining fitokimia dilakukan terhadap senyawa golongan alkaloida,
flavonoida, glikosida, glikosida antrakinon, saponin, tanin dan
triterpenoida/steroida. Ekstraksi dilakukan dengan pelarut etanol 96% dan
senyawa alkaloida diisolasi dari ekstrak kasar dengan metode pengocokan asam
basa, selanjutnya dilakukan pemisahan alkaloida secara KLT preparatif dengan
fase gerak kloroform - metanol - amonia (85 : 15 : 1). Isolat yang diperoleh
dikarakterisasi dengan spektrofotometer ultra violet dan spektrofotometer infra
merah.
Hasil karakterisasi simplisia diperoleh kadar abu total 7,70% , kadar abu
yang tidak larut dalam asam 1,73% , kadar sari yang larut dalam air 22,46%,
kadar sari yang larut dalam etanol 12,19% , dan kadar air 7,96% . Hasil
pemeriksaan makroskopik serbuk simplisia Tephrosiae vogelii semen adalah biji
berwarna hitam berdiameter 0,5 cm, berbentuk lonjong tipis, bentuk permukaan
licin, dan rasanya pahit. Hasil pemeriksaan mikroskopik serbuk simplisia dijumpai
adanya parenkim, rambut penutup, epidermis, berkas pembuluh. Hasil penapisan
menunjukkan adanya senyawa golongan alkaloida, flavonoida glikosida, saponin,
dan triterpenoida/ steroida. Pemisahan dengan KLT menghasilkan isolat A1 (Rf
0,86) yang memberikan absorbansi ultra violet pada λ 207 nm sedangkan
spektrum infra merah menunjukkan adanya gugus C-H alifatis dari CH2 dan CH3,
C=0, ikatan rangkap C=C, dan ikatan C-N.
THE CHARACTERIZATION OF SIMPLEX AND PHYTOCHEMICAL SCREENING ISOLATION OF ALKALOIDAL COMPOUNDS OF SEED
OF Tephrosia vogelii Hook.f.
ABSTRACT
The characterization of simplex, phytochemical screening, isolation and characterization of alkaloidal compounds of the seeds of Tephrosia vogelii
Hook.f. of the family Papilionaceae have been carried out.
Phytochemical screening are carried out for the presence of alkaloidal, flavonoid, glycoside, anthraquinone glycoside, saponin, tannin and triterpenoid/steroid. Extraction was carried out using 96% ethanol as solvent and alkaloidal compounds were isolated by acid-base shake up method. Separation of alkaloidal compounds were carried out by preparative TLC with chloroform -methanol - ammonium hydroxide (85 : 15 : 1) as mobile phase. The isolate was characterized by ultra violet and infra red spectrophotometries.
The characterization of simplex gave the total ash value 7.71%, the acid insoluble ash value 1.73%, the water soluble extract value 2.46%, the ethanol soluble extract value 12.19%, and the water content 7.96%. The result of microscopic examination of Tephrosiae vogelii semen. showed that the seeds are black in colour, diameter 0.5 cm, oval, thin, smooth and bitter. Microscopic examination of seeds showed the presence of parenchyma tic cells, glandular hair, epidermis, and vascular bundle. Phytochemical screening showed the presence of the alkaloidal, glycoside, saponin, and triterpenoid/ steroid. The separation of alkaloid by preparative TLC gave one isolate A1 (Rf 0.86). Isolate exhibited an
ultra violet absorption at 207 nm and infra red spectrum showed the presence of – CH aliphatic bond of CH2 and CH3, C=0 bond, double bond of C=C, and C-N
bond functionalities.
BAB I
PENDAHULUAN
1.1Latar Belakang
Kekayaan jenis tumbuhan di Indonesia sangat berlimpah, termasuk di
dalamnya adalah tumbuhan yang dapat dimanfaatkan untuk tujuan pengobatan.
Namun informasi tentang nama maupun kandungan kimia serta ramuannya belum
banyak dipublikasikan sehingga pemanfaatan tumbuhan untuk tujuan pengobatan
hanya didasarkan pada pengalaman turun-temurun. Informasi ini hanya terbatas
pada pengalaman setiap daerah sehingga manfaat satu jenis tumbuhan dapat
berbeda-beda antara satu daerah dengan daerah lain (Mursito, 2001)
Salah satu tumbuhan berkhasiat obat yang digunakan masyarakat adalah
biji tumbuhan Tephrosia vogelii Hook.f. famili Papilionaceae.Biji tumbuhan ini
digunakan sebagai minyak gosok dengan cara: biji digongseng kemudian
dihaluskan maka akan diperoleh minyaknya, misalnya digunakan sebagai obat
terkilir, obat rematik. Informasi tentang tumbuhan ini masih sedikit sekali
(Anonim, 1995).
Kandungan senyawa kimia yang terdapat dalam biji tumbuhan Tephrosia
vogelii Hook.f. adalah golongan senyawa alkaloida, glikosida, flavonoida, steroida
dan saponin (Anonim, 2005). Seperti diketahui bahwa alkaloida merupakan suatu
golongan senyawa yang mempunyai bermacam-macam aktivitas biologis;
diantaranya sebagai analgetik, midriatik, miotik, meningkatkan tekanan darah,
tumbuhan Spermatofita, pada kelas Dicotyledoneae dan Monocotyledoneae dari
sub divisio Angiospermae. Beberapa suku tumbuhan yang terkenal kaya
mengandung alkaloida diantaranya adalah Apocynaceae, Loganiaceae, dan
Papilionaceae ( Fergusson, 1956; Tyler, 1977 ).
Berdasarkan hal di atas maka penulis tertarik untuk melakukan
penelitian terhadap biji tumbuhan Tephrosia vogelii Hook.f. yang merupakan
salah satu tumbuhan yang kaya dengan senyawa alkaloida. Pada penelitian ini
dilakukan karakterisasi simplisia, skrining fitokimia, dan isolasi senyawa
alkaloida menggunakan kromatografi lapis tipis serta identifikasi terhadap
senyawa hasil isolasi dengan spertrofotometri ultra violet dan spektrofotometri
infra merah.
1.2Perumusan Masalah
1 Simplisia Tephrosiae vogelii semen belum pernah dikarakterisasi.
2. Golongan senyawa kimia apakah yang terdapat pada biji tumbuhan
Tephrosia vogelii Hook.f
3. Apakah senyawa alkaloida yang ada pada biji tumbuhan Tephrosia vogelii
Hook.f. dapat diisolasi dengan pelarut etanol dan dikarakterisasi dengan
1.3Hipotesis
1. Simplisia Tephrosiae vogelii semen dapat dikarakterisasi.
2. Diduga biji tumbuhan Tephrosia vogelii Hook.f. mengandung senyawa
golongan alkaloida.
3. Diduga senyawa alkaloida yang ada pada biji tumbuhan Tephrosia
vogelii Hook.f. dapat diisolasi dengan pelarut etanol dan dapat
dikarakterisasi dengan spektrofotometri ultra violet dan infra merah.
1.4Tujuan
1. Untuk mengetahui karakteristik simplisia Tephrosiae vogelii semen
2. Untuk mengetahui golongan senyawa kimia yang terdapat pada biji
tumbuhan Tephrosia vogelii Hook.f.
3. Untuk dapat mengisolasi senyawa alkaloida dari biji tumbuhan Tephrosia
vogelii Hook.f. serta isolat yang diperoleh dapat dikarakterisasi dengan
spektrum ultra violet dan infra merah
1.5Manfaat
1. Diperoleh informasi karakteristik simplisia Tephrosiae vogelii semen.
2. Sebagai sumber informasi mengenai golongan senyawa kimia yang
terdapat pada biji tumbuhan Tephrosia vogelii Hook.f.
3. Sebagai sumber informasi mengenai spektrum ultra violet dan spektrum
infra merah alkaloida hasil isolasi dari biji tumbuhan Tephrosia vogelii
BAB II
TINJAUAN PUSTAKA
2.1. Uraian Tumbuhan
2.1.1 Habitat
Tumbuhan Tephrosia vogelii Hook.f. banyak ditemukan di Desa Limbong,
Kecamatan Sianjur Mula-Mula, Kabupaten Toba Samosir, Sumatera Utara. Pada
umumnya tumbuh ditempat yang terkena sinar matahari, tidak begitu lembab,
semak belukar, di pinggir jalan, dan tepi hutan (Anonoim, 1995 ).
2.1.2 Nama Daerah
Nama daerah tumbuhan Tephrosia vogelii Hook.f.adalah sekar kupu,
kembang kupu (jawa); bunga kupu-kupu (sumatera) (Anonoim, 1995 ).
2.1.3 Marfologi
Tumbuhan Tephrosia vogelii Hook.f. merupakan tumbuhan berbatang
tegak,dan cabang yang umumnya tumbuh pada pangkal batang dan tumbuh
melebar, tingginya antara 2-4 m Bagian-bagian tubuhnya berbulu lembut seperti
beladu dan mengkilap. Jumlah anak-anak daun tiap tangkainya antara 11-25
halaman.Masing-masing anak daun berbentuk lonjong atau lanset (Lanceolatus)
ada juga bundar telur (ovatus) .Tandan perbungaannya keluar keujung cabang dan
ketiak daun yang letaknya dibagian atas tumbuhan. Bunga-bunganya yang
letaknya dibagian bawah,mekar lebih dahulu sehingga dalam satu gagang
perbungaannya bisa dijumpai bunganya yang mekar dan buah polong yang muda
sekaligus bunga berbentuk kupu-kupu berwarna ungu muda. Buah polong yang
Permukaannya berbulu rapat seperti beledu warnanya coklat muda mengkilap.
Jumlah biji pada masing-masing polong antara 10-20 buah Setiap buah polong
berbiji banyak. ( Heyne,1987)
2.1.4 Sistematika tumbuhan
Sistematika tumbuhan biji tumbuhan Tephrosia vogelii Hook.f. adalah
sebagai berikut (Tjtrosoepomo, 1994):
Divisi : Spermatophyta
Subdivisi : Angiospermae
Kelas : Dicotyledoneae
Banga : Fabales
Suku : Papilionaceae
Marga : Tephorosia
Jenis : Tephrosia vogelii Hook.f.
2.2 Uraian Kimia
2.2.1 Alkaloida
Alkaloida merupakan suatu senyawa yang secara umum bekerja pada
sistem saraf pusat, mempunyai atom nitrogen yang biasanya pada cincin
heterosiklis dan dibiosintesis dalam tumbuhan dari asam amino atau turunannya
(Waller and Nowacki, 1978).
Alkaloida dalam tumbuhan biasanya terdapat pada daun, akar, kulit kayu
dan buah (Fergusson, 1956). Selain dalam tumbuhan, alkaloida ditemukan pada
hewan seperti kambing. Alkaloida juga ditemukan pada mikroorganisme, seperti
piosianin pada bakteri Pseudomonas aeruginosa, dan ergolin pada jamur
Alkaloida dapat dibedakan dari sebagian besar komponen tumbuhan lain
berdasarkan sifat basanya dan biasanya terdapat dalam tumbuhan sebagai garam
dengan berbagai asam organik. Garam ini merupakan senyawa padat berbentuk
kristal tanwarna, meskipun ada juga yang berwarna, contohnya berberina dan
serpentine berwarna kuning (Robinson, 1995). Alkaloida bebas tidak larut dalam
air tetapi larut dalam pelarut organik, sebaliknya alkaloida dalam bentuk garam
larut dalam air tetapi tidak larut dalam pelarut organik (Fergusson, 1956).
Klasifikasi alkaloida ada dua cara, yaitu:
I. Klasifikasi alkaloida berdasarkan senyawa pembentuknya
(Sastrohamidjojo, 1996), yaitu:
1. Alkaloida sejati (true alkaloid)
Alkaloida ini dibentuk dari asam amino yang umumnya mempunyai
unsur nitrogen yang terikat pada cincin heterosiklik dan kebanyakan
bersifat basa. Contohnya vinkristin dan reserpin.
2. Protoalkaloida
Alkaloida ini dibentuk dari asam amino, tetapi unsur nitrogenya tidak
terikat pada cincin heterosiklik dan kebanyakan bersifat basa.
Contohnya meskalin dan dimetiltriptamin.
3. Pseudoalkaloida
Pseudoalkaloida tidak dibentuk dari asam amino dan pada umumnya
mempunyai unsur nitrogen yang terikat pada cincin heterosiklik dan
biasanya bersifat basa. Alkaloida yang penting dalam golongan ini
adalah alkaloida steroida, contohnya solanidin dan alkaloida purin,
II. Klasifikasi alkaloida berdasarkan letak atom nitrogennya (Trease and
Evans, 1983), yaitu:
A. Non heterosiklis, disebut juga protoalkaloida
Contoh : efedrin pada tumbuhan Ephedra sinica
B. Heterosiklis, dibagi dalam 12 golongan berdasarkan struktur cincinnya
yaitu:
1. Alkaloida golongan pirol dan pirolidin, yaitu alkaloida yang
mengandung inti pirol dan pirolidin dalam struktur kimianya.
Contohnya higrin pada tumbuhan Erythtroxylon coca.
N H
pirolidin
N H
Pirol
2. Alkaloida golongan pirolizidin, yaitu alkaloida yang mengandung
inti pirollizidin dalam struktru kimianya. Contohnya retronesin pada
retronesin
3. Alkaloida golongan piridin dan piperidin, yaitu alkaloida yang
mengandung inti piridin dan piperidin dalam struktur kimianya.
Contohnya nikotin pada tumbuhan Nicotiana tabaccum yang
mempunyai inti piridin dan koiin pada tumbuhan conium maculatum
yang mempunyai inti piperidin.
nikotin
N
piridin
N H
4. Alkaloida golongan tropan, yaitu alkaloida yang mengandung inti
tropan dalam struktur kimianya. Contohnya atropin pada tumbuhan
Atropa belladonna
tropan N
atropin
5. Alkaloida golongan kuinolin, yaitu alkaloida yang mengandung inti
kuinolin dalam struktur kimianya. Contohnya kuinin pada tumbuhan
Cinchona officinalis.
N
6. Alkaloida golongan isokuinolin, yaitu alkaloida yang mengandung
inti isokuinolin dalam struktur kimianya. Contohnya papaverin pada
tumbuhan Papaver somniferum.
7. Alkaloida golongan aporfin, yaitu alkaloida yang mengandung inti
aporfin dalam struktur kimianya. Contohnya boldin pada tumbuhan
Peumus boldus.
N
aporf in
HO
N
H3CO
H3CO
CH3
H3CO
8. Alkaloida golongan norlupinan, yaitu alkaloida yang mengandung
inti norlupinan dalam struktur kimianya, disebut juga alkaloida lupin.
Contohnya sitisin pada tumbuhan Cytisus scoparius
N
NH H
H
O N
norlupinan
sitisin
9. Alkaloida golongan indol atau benzopirol, yaitu alkaloida yang
mengandung inti indol dalam struktur kimianya. Contohnya psilosin
pada tumbuhan Psilocybe sp.
10. Alkaloida golongan imidazol atau glioksalin, yaitu alkaloida yang
mengandung inti imidazol dalam struktur kimianya. Contohnya
pilokarpin pada tumbuhan Pilocarpus jaborandi.
N N
imidazol
11. Alkaloida golongan purin, yaitu alkaloida yang mengandung inti
purin dalam struktur kimianya. Contohnya kafein pada tumbuhan
Coffea arabica
12. Alkaloida steroida, yaitu alkaloida yang mengandung inti steroida
(siklopentano perhidrofenantren) dalam struktur kimianya.
Contohnya solanidin pada tumbuhan Lycopersicum esculentum.
N
HO
CH3
CH3 H3C
CH3
solanidin
2.2.2 Glikosida
Glikosida adalah senyawa organik yang bila di hidrolisis menghasilkan
satu atau lebih gula yang disebut glikon dan bagian bukan gula yang disebut
aglikon. Gula yang paling sering dijumpai dalam glikosida ialah glukosa (Lewis,
1977). Glikosida dihidrolisis dengan cara pendidihan dalam asam encer. Secara
kimia dan secara fisiologi, glikosida alam cenderung dibedakan berdasarkan
bagian aglikonnya (Robinson, 1995).
Berdasarkan hubungan ikatan antara glikon dan aglikonnya, glikosida
dapat dibagi menjadi empat (Farnsworth, 1966), yaitu:
1. O-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh
2. S-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh atom
S, contohnya : sinigrin
CH2 CHCH2C
NOSO3K
S C6H11O5
sinigrin
3. N-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh
atom N, contohnya : krotonosida.
N
N N
N NH2
C5H9O4 HO
krotonosida
4. C-glikosida, jika ikatan antara glikon dengan aglikon dihubungkan oleh
atom C, contohnya : barbaloin
CH2OH
H C6H11O5
OH O OH
2.2.3 Saponin
Saponin merupakan senyawa aktif permukaan yang kuat, dapat
menimbulkan busa jika dikocok dalam air, dan pada konsentrasi rendah sering
menyebabkan hemolisis sel darah merah (Robinson, 1995). Uji saponin yang
sederhana ialah dengan mengocok ekstrak alkohol-air dari timbuhan dalam tabung
reaksi, maka akan terbentuk busa yang bertahan lama pada permukaan cairan.
Saponin juga dapat diperiksa dalam ekstrak kasar berdasarkan kemampuannya
menghemolisis sel darah dan memberikan reaksi warna yang karakteristik pada uji
Liebermann-Burchard (Farnsworth, 1966: Harborne, 1987).
Berdasarkan bagian aglikonnya, dikenal dua jenis saponin, yaitu saponin
steroida dan saponin triterpenoida (Farnsworth, 1966).
sapogenin steroida O
O
HO
CH3
CH3 H3C
COOH
HO
2.2.4 Triterpenoida /steroida
Triterpenoida adalah senyawa yang kerangka karbonnya berasal dari
enam satuan isopren dan secara biosintesis dibuat dari senyawa hidrokarbon C30
asiklik, yaitu skualena (Harborne, 1987).
skualena
Streoida merupakan triterpena yang mempunyai inti siklopentano
perhidrofenantren (Harborne, 1987). Inti steroida dasar sama dengan inti
kolesterol, tetapi pada posisi 10 dan 13 terdapat gugus metil yang terikat pada
sistem cincin. Pada umumnya steroida tumbuhan berupa alkohol dengan gugus
hidroksil pada C3 sehingga steroida sering juga disebut sterol. Sistem penomoran
senyawa steroida adalah sebagai berikut (Robinson, 1995).
2.2.5 Flavonoid
Flavonoid adalah derivat benzo-gamma-piron yang mengandung gugus
hidroksil pada molekulnya dan merupakan pigmen kuning yang terdapat dalam
tumbuhan tinggi. Flavonoida banyak terdapat dalam famili Polygonaceae,
Rutaceae, Leguminosae (sub famili Papilionoideae), Umbiferae, dan Compositae.
Flavonoid terdapat pada semua bagian tumbuhan seperti buah, tepung sari, akar,
batang dan daun. Flavonoid terdapat dalam bentuk bebas maupun terikat sebagai
glikosida. Glikosidanya larut dalam air dan etanol tapi tidak larut dalam pelarut
organik, sedangkan geninnya (aglikon) tidak larut dalam air tetapi larut dalam
pelarut- pelarut organik misalnya eter, etil asetat, aseton dan lainnya.
Klasifikasi flavonoid dalam tumbuhan berdasarkan sifat kelarutannya
dan reaksi-reaksi warnanya, kemudian dilanjutkan dengan kromatografi kertas
satu dimensi dari ekstrak terhidrolisis dan dua dimensi dari ekstrak alkohol
langsung. Kerangka dan skema pemberian nomor dan tipe-tipe flavonoid adalah
sebagai berikut :
O
OH
O
O
O
Flavanon
O
O
Isof lavon
O
leukoantosianidin OH
HO OH
O
khalkon 4
3 2
5 6
2.3 Ekstraksi
Ekstraksi adalah kegiatan penarikan kandungan kimia yang dapat larut
sehingga terpisah dari bahan yang tidak dapat larut dengan pelarut cair. Senyawa
aktif yang terdapat dalam berbagai simplisia dapat digolongkan ke dalam
golongan minyak atsiri, alkaloida, flavonoida dan lain-lain. Dengan diketahuinya
senyawa aktif yang dikandung simplisia akan mempermudah pemilihan pelarut
dan cara ekstraksi yang tepat (DitJen POM, 2000).
Metode ekstraksi dengan menggunakan pelarut ada beberapa cara, yaitu
(Depkes, 1986):
1. Maserasi
Maserasi adalah proses penyarian simplisia menggunakan pelarut
dengan beberapa kali pengocokan atau pengadukan pada temperatur ruangan
(kamar). Cairan penyari akan menembus dinding sel dan masuk kedalam rongga
sel yang mengandung zat aktir yang akan larut, karena adanya perbedaan
konsentrasi antara larutan zat aktif didalam dan di luar sel maka larutan terpekat
didesak keluar. Proses ini berulang sehingga terjadi keseimbangan konsentrasi
antara larutan di dalam dan di luar sel.
Maserasi digunakan untuk penyarian simplisia yang mengandung zat
aktif yang mudah larut dalam cairan penyari. Cairan penyari yang digunakan
dapat berupa air, etanol, metanol, etanol-air atau pelarut lainnya. Maserasi berarti
dilakukan pengulangan penambahan pelarut setelah dilakukan penyaringan
maserat pertama, dan seterusnya.
Keuntungan cara penyarian dengan maserasi adalah cara pengerjaan dan
2. Perkolasi
Perkolasi adalah cara penyarian yang dilakukan dengan mengalirkan
cairan penyari melalui serbuk simplisia yang telah dibasahi. Proses perkolasi
terdiri dari tahapan pengembangan bahan, tahap maserasi antara, tahap perkolasi
sebenarnya (penetasan/penampungan ekstrak), terus menerus sampai diperoleh
ekstrak (perkolat).
3. Refluks
Refluks adalah ekstraksi dengan pelarut pada temperatur titik didihnya,
selama waktu tertentu dan jumlah perlarut terbatas yang relatif konstan dengan
adanya pendingin balik.
4. Sokletasi
Sokletasi adalah ekstraksi dengan menggunakan pelarut yang selalu baru
yang umumnya dilakukan dengan alat khusus sehingga terjadi ekstraksi kontinu
dan jumlah pelarut relatif konstan dengan adanya pendingin balik.
5. Digesti
Digesti adalah maserasi kinetik (dengan pengadukan kontinu) pada
temperatur yang lebih tinggi dari temperatur ruangan, yaitu secara umum
dilakukan pada temperatur 40-500C.
6. Infundasi
Infundasi adalah proses penyarian yang umumnya digunakan untuk
menyari zat kandungan aktif yang larut dalam air dari bahan-bahan nabati. Proses
7. Dekok
Dekok adalah infus pada waktu yang lebih lama dan temperatur sampai
titik didih air.
2.4 Kromatografi
Kromatografi adalah suatu metode pemisahan berdasarkan proses
migrasi dari komponen-komponen senyawa diantara dua fase, yaitu fase diam dan
fase gerak. Fase gerak membawa zat terlarut melakui media sehingga terpisah dari
zat terlarut lainnya yang terelusi lebih awal atau lebih akhir. Umumnya zat terlarut
dibawa melewati media pemisah oleh aliran suatu pelarut berbentuk cairan atau
gas yang disebut eluen. Fase diam dapat bertindak melarutkan zat terlarut
sehingga terjadi partisi antara fase diam dan fase gerak. Dalam proses ini suatu
lapisan cairan pada penyangga yang inert berfungsi sebagai fase diam (Depkes.
1995).
Cara-cara kromatografi dapat digolongkan sesuai dengan sifat-sifat dari
fase diam, yang dapat berupa zat padat atau zat cair. Jika fase diam berupa zat
padat disebut kromatografi serapan; jika berupa zat cair disebut kromatografi
partisi. Karena fase gerak dapat berupa zat cair atau gas maka terdapat empat
macam sistem kromatografi, yaitu:
1. Fase gerak cair-fase diam padat (kromatografi serapan):
− kromatografi lapis tipis
− kromatografi kolom
2. Fase gerak gas-fase diam padat:
3. Fase gerak cair-fase diam cair (kromatografi partisi):
− kromatografi kertas
4. Fase gerak gas –fase diam cair:
− kromatografi gas-cair
Semua pemisahan dengan kromatografi tergantung pada kenyataan
bahwa senyawa-senyawa yang dipisahkan terdistribusi diantara fase gerak dan
fase diam dalam perbandingan yang sangat berbeda-beda dari satu senyawa
terhadap senyawa yang lain (Sastrohamidjojo, 1991).
2.4.1 Kromatografi lapis tipis
Kromatografi lapis tipis termasuk kromatografi adsorpsi (serapan),
dimana sebagai fase diam digunakan zat padat yang disebut adsorben (penyerap)
dan fase gerak adalah zat cair yang disebut dengan larutan pengembang.
Kromatografi lapis tipis dapat dipakai untuk dua tujuan, yaitu:
1. Sebagai metode untuk mencapai hasil kualitatif, kuantitatif, atau preparatif.
2. Untuk mencari sistem pelarut yang akan dipakai dalam kromatografi kolom.
Pada kromatografi lapis tipis, fase diam berupa lapisan tipis yang terdiri
atas bahan padat yang dilapiskan pada permukaan penyangga datar yang biasanya
terbuat dari kaca. Lapisan melekat pada permukaan dengan bantuan bahan
pengikat. Beberapa contoh fase diam yang digunakan untuk pemisahan dalam
kromatografi lapis tipis yaitu silika gel, alumina, kieselguhr dan selulosa (Gritter,
dkk.,1991).
Pada kromatografi lapis tipis lapisan fase diam harus sesedikit mungkin
mengandung air, karena air akan menempati semua titik penyerapan sehingga
kromatografi lapis tipis perlu diaktifkan dengan pemanasan pada 1100C selama 30
menit (Gritter, dkk., 1991; Stahl, 1985)
Fase gerak terdiri dari satu atau beberapa pelarut dan bila diperlukan
dapat menggunakan sistem pelarut multi komponen, berupa suatu campuran
sesederhana mungkin yang terdiri atas maksimum tiga komponen. Pada
pemisahan senyawa organik selalu menggunakan pelarut campuran, tujuannya
untuk memperoleh polaritasnya yang tepat sehingga diperoleh pemisahan
senyawa yang baik. Kombinasi pelarut berdasarkan atas polaritas masing-masing
pelarut sehingga dengan demikian akan diperoleh sistem pengembang yang
cocok (Stahl, 1985).
Jarak pengembangan senyawa pada kromatogram biasanya dinyatakan
dengan harga Rf (Stahl, 1985).
Jarak yang ditempuh oleh tiap bercak dari titik penotolan diukur dari
pusat bercak. Harga Rf berada antara 0,00 – 1,00. Harga Rf ini sangat berguna
untuk mengindentifikasi suatu senyawa (Eaton, 1989).
Faktor-faktor yang mempengaruhi harga Rf adalah sebagai berikut
(Sastrohamidjojo, 1991):
1. Struktur kimia senyawa yang dipisahkan
2. Sifat penyerap
3. Tebal dan kerataan lapisan penyerap
4. Pelarut dan derajat kemurniannya
5. Derajat kejenuhan uap pengembang dalam bejana
7. Jumlah cuplikan yang digunakan
8. Suhu
2.5 Spektrofotometri Ultra Violet
Serapan molekul di dalam daerah ultra violet bergantung pada struktur
elektronik dari molekul. Apabila suatu molekul menyerap radiasi ultra violet, di
dalam molekul tersebut terjadi perpindahan tingkat energi elektron-elektron ikatan
pada orbital molekul paling luar dari tingkat energi yang lebih rendah ke tingkat
energi yang paling tinggi (Noerdin, 1985;Silverstein, et al., 1986)
Spektrum ultra violet dari suatu senyawa biasanya diperoleh dengan
melewatkan cahaya dengan panjang gelombang tertentu (cahaya monokromati)
melalui larutan encer senyawa tersebut.
Sistem (gugus atom) yang menyebabkan terjadinya absorpsi cahaya
disebut kromofor. Kromofor yang menyebabkan terjadinya transisi σÆσ* ialah
senyawa yang mempunyai elektron pada orbital molekul σ, yaitu molekul organik
jenuh yang tidak mempunyai atom dengan pasangan elektron sunyi. Senyawa
yang mempunyai transisi σÆσ* mengabsorpsi cahaya pada panjang gelombang
sekitar 150 nm.
Kromofor yang menyebabkan terjadinya transisi nÆσ* ialah senyawa
yang hanya mempunyai orbital molekul n dan σ, yaitu molekul organik jenuh
yang mempunyai satu atau lebih atom dengan pasangan elektron sunyi. Kromofor
yang menyebabkan terjadinya transisi πÆπ* ialah senyawa yang mempunyai
elektron pada orbital molekul π. Senyawa yang mempunyai transisi nÆσ* dan
Kromofor yang menyebabkan transisi nÆπ* ialah senyawa yang
mempunyai orbital molekul n maupun π yaitu senyawa yang mengandung atom
yang mempunyai pasangan elektron sunyi dan orbital π. Senyawa yang
mempunyai transisi nÆπ* mengabsorpsi cahaya yang panjang gelombang
200-400 nm (Creswell, et al., 1982; Geissman, 1977).
2.6 Spektrofotometri Infra Merah
Daerah infra merah terletak antara spektrum elektromagnetik cahaya
tampak dan spektrum radio, yakni antara 4000 dan 400 cm-1. penggunaan
spektrofotometri infra merah untuk maksud analisa lebih banyak ditujukan untuk
identifikasi suatu senyawa melalui gugus fungsinya. Spektrum infra merah
senyawa organik bersifat khas, artinya senyawa yang berbeda akan mempunyai
spektrum yang berbeda pula (Noerdin, 1985).
Penafsiran spektrum infra merah dari suatu senyawa yang belum
diketahui haruslah ditujukan pada penentuan ada atau tidaknya beberapa gugus
fungsional utama seperti C=O, O-H, N-H, C-O, C=C, C≡C, C=N, C≡N, dan NO2.
Langkah-langkah yang umum dilakukan untuk memeriksa pita-pita yang penting
pada hasil spektrum infra merah (Pavia, et al., 1988):
1. Gugus karbonil
Gugus C=O memberikan puncak yang kuat pada daerah 1820-1660 cm-1
2. Bila gugus C=O ada, periksalah gugus-gugus berikut (jika C=O tidak ada
langsung ke nomor 3).
Asam : periksalah gugus O-H, merupakan serapan melebar di
Amida : periksalah gugus N-H, merupakan serapan medium n
didaerah 3500 cm-1, kadang-kadang dengan puncak
rangkap.
Ester : periksalah gugus C-O, merupakan serapan medium
didaerah 1300-1000 cm-1.
Anhidrida : mempunyai dua serapan C=O di daerah 1810 dan 1760
cm-1
Aldehida : periksalah gugus C-H, merupakan dua serapan lemah
Didaerah 2850 dan 2750 cm-1 yaitu disebelah kanan
serapan C-H
.Keton : kemungkinan bila kelima senyawa di atas tidak ada
3. Bila gugus C=O tidak ada
Alkohol atau fenol : periksalah gugus O-H, merupakan serapan melebar
di daerah 3600-3300 cm-1 yang diikuti adanya
serapan C-O di daerah 1300-1000 cm-1.
Amina : periksalah gugus N-H, yaitu serapan medium di
Daerah 3500 cm-1.
Eter : periksalah gugus C-O (dan tidak adanya O-H), yaitu
Serapan medium di daerah 1300-1000 cm-1.
4. Ikatan rangkap dua atau cincin aromatik
− Serapan lemah C=C di daerah 1650 cm-1
− Serapan medium sampai kuat pada daerah 1650-1450 cm-1 sering
− Buktikan kemungkinan di atas dengan memperhatikan serapan pada
daerah C-H aromatik di sebelah kiri 3000 cm-1, sedangkan C-H alifatis
terjadi di sebelah kanan daerah tersebut.
5. Ikatan rangkap tiga
− Serapan medium dan tajam dari C≡N di daerah 2250 cm-1
− Serapan medium dan tajam dari C≡C di daerah 2150 cm-1
6. Gugus nitro
− Dua serapan yang kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1
7. Hidrokarbon
− Apabila keenam serapan di atas tidak ada
−
Serapan C-H alifatis di daerah 3000 cm-1
− Serapan yang sangat sederhana di daerah 1450 cm-1 (CH2) dan 1375
cm-1 (CH3)
BAB III
METODE PENELITIAN
Metode penelitian ini meliputi pengumpulan dan pembuatan simplisia,
karakterisasi simplisia, skrining fitokimia, pembuatan ekstrak, analisis ekstrak
dengan kromatografi lapis tipis, isolasi alkaloida dari ekstrak etanol, uji
kemurnian isolat dan karakterisasi isolat dengan spektrofotometri ultra violet dan
spektrofotometri infra merah.
3.1 Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah: Spektrofotometer
infra merah (QP 5000 Shimadzu), spektrofotometer ultra violet (QP 5000
Shimadzu), seperangkat alat penentuan kadar air, seperangkat alat kromatografi
lapis tipis, eksikator, oven listrik (Fisher Scientific), neraca analitik (Sartorius),
neraca kasar (Ohaus), penguap vakum putar (Buchi 461), penangas air, blender
(National), tanur (Ney M-525 Series II) alat-alat gelas.
3.2 Bahan-bahan yang digunakan
Bahan yang digunakan adalah biji tumbuhan bunga kupu-kupu
(Tephrosia vogelii Hook.f.). Bahan kimia yang digunakan berkualitas pro analisa
(E.Merck) yaitu: natrium hidroksida, asam asetat anhidrida, asam sulfat, benzen,
besi (III) klorida, bismut (III) nitrat, etanol 96%, eter, etil asetat, iodium,
isopropanol, kalium iodida, kloralhidrat, kloroform, metanol, natrium hidroksida,
n-heksan, α-naftol, petroleum eter, plat pra lapis silika gel 60 F254 , raksa (II)
klorida, asam nitrat, asam asetat glacial, serbuk seng, silika gel 60 mesh 230-400
ASTM, timbal (II) asetat dan toluen. Selain itu juga digunakan air suling, etanol
96 % hasil destilasi.
3.3Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi yaitu pereaksi Mayer, Bouchardat, Molish,
timbal (II) asetat 0,4 M, kloralhidrat 71% b b, dapar fosfat pH 7,4, pereaksi asam
klorida 2 N, asam sulfat 2 N, natrium hidroksida 2 N, asam nitrat 0,5 N, besi (III)
klorida 1 %, pereaksi Liebermann-Burchard , pereaksi Dragendorff.
3.3.1 Pereaksi Mayer
Sebanyak 1,359 g raksa (II) klorida ditimbang, dilarutkan dalam air
suling hingga 60 ml. Pada wadah lain kalium iodida sebanyak 5 g dilarutkan
dalam 10 ml air suling. Kedua larutan dicampurkan lalu ditambahkan air suling
hingga 100 ml (Depkes, 1989)
3.3.2 Pereaksi Bouchardat
Sebanyak 4 g kalium iodida ditimbang, dilarutkan dalam air suling dan
sebanyak 2 g iodium ditimbang, dilarutkan dalam larutan kalium iodida dan
dicukupkan dengan air suling hingga 100 ml (Depkes, 1989)
3.3.3 Pereaksi Dragendorff
Sebanyak 0,85 g bismut (III) nitrat ditimbang, dilarutkan dalam 10 ml
asam asetat glasial, lalu ditambahkan 40 ml air suling. Pada wadah lain dilarutkan
8 g kalium iodida dalam 30 ml air suling. Kedua larutan dicampurkan sama
banyak, lalu ditambahkan 20 ml asam asetat glasial dan diencerkan dengan air
3.3.4 Pereaksi Liebermann-Burchard
Dua puluh bagian asam asetat anhidrida dicampurkan dengan satu
bagian asam sulfat pekat dan 50 bagian kloroform, dicampur. Larutan ini harus
dibuat baru (Harborne, 1987)
3.3.5 Pereaksi asam klorida 2 N
Sebanyak 17 ml asam klorida pekat diencerkan dengan air suling
secukupnya hingga volume 100 ml (Depkes, 1979)
3.3.6 Pereaksi natrium hidroksida 2 N
Sebanyak 8,002 g kristal natrium hidroksida ditimbang, dilarutkan dalam
air suling sehingga diperoleh larutan 100 ml (Depkes, 1979)
3.3.7 Pereaksi asam sulfat 2 N
Sebanyak 9,8 ml asam sulfat pekat diencerkan dengan air suling
secukupnya hingga volume 100 ml (Depkes, 1979)
3.3.8 Pereaksi asam nitrat 0,5 N
Sebanyak 31,5 ml asam nitrat pekat diencerkan dengan air suling
secukupnya hingga volume 100 ml (Depkes, 1979)
3.3.9 Pereaksi Molish
Sebanyak 3 g α-naftol ditimbang, dilarutkan dalam asam nitrat 0,5 N
hingga diperoleh larutan 100 ml (Depkes, 1989)
3.3.10 Pereaksi besi (III) klorida 1%
Sebanyak 1 g besi (III) klorida ditimbang, dilarutkan dalam air suling
3.3.11 Pereaksi timbal (II) asetat 0,4 M
Sebanyak 15,17 g timbal (II) asetat ditimbang, dilarutkan dalam air
suling bebas karbondioksida sehingga diperoleh larutan 100 ml (Depkes, 1989)
3.3.12 Pereaksi dapar fosfat pH 7,4
Sebanyak 16 g natrium fosfat dan 4,4 g natrium dihidrogen fosfat
dilarutkan dalam air suling hingga 100 ml (Depkes, 1989)
3.3.13 Pereaksi kloralhidrat 71% b b
Sebanyak 50 g kloralhidrat ditimbang, dilarutkan dalam 20 ml air suling
(Depkes, 1989)
3.4Pengumpulan dan Pembuatan Simplisia
3.4.1 Pengumpulan sampel bahan tumbuhan
Sampel yang digunakan dalam penelitian ini adalah biji tumbuhan
Tephrosia vogelii Hook.f. yang masih segar, berwarna hitam dan cukup tua
selama kurang lebih 5 bulan, diambil dari Desa Limbong, Kecamatan Sianjur
Mula-Mula, Kabupaten Toba Samosir Sumatera Utara. Pengambilan sampel
dilakukan secara purposif tanpa membandingkan dengan tumbuhan yang sama
dari daerah lain.
3.4.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Pusat Penelitian dan Pengembangan
Biologi LIPI, Bogor. Hasil identifikasi tumbuhan dapat dilihat pada lampiran I
halaman 50, dan gambar tumbuhan terdapat pada lampiran 1, gambar 1 halaman
3.4.3 Pembuatan Simplisia
Biji tumbuhan Tephrosia vogelii Hook.f. dibersihkan dari pengotoran,
dicuci dengan air bersih, ditiriskan selama kurang lebih 8 jam dan dikeringkan di
udara terbuka (diangin-anginkan) serta terlindung dari sinar matahari langsung.
Simplisia yang telah kering (rapuh) diserbuk dengan blender dan disimpan
dengan wadah tertutup rapat.
3.5Karakterisasi Simplisia
Karakterisasi simplisia meliputi pemeriksaan makroskopik simplisia,
mikroskopik serbuk simplisia, penetapan kadar abu, penetapan kadar abu yang
tidak larut dalam asam, penetapan kadar sari yang larut dalam air, penetapan
kadar sari yang larut dalam etanol dan penetapan kadar air (Depkes, 1989).
3.5.1 Pemeriksaan makroskopik
Pemeriksaan makroskopik dilakukan dengan cara mengamati bentuk,
rupa, warna, ukuran, bau simplisia
3.5.2 Pemeriksaan mikroskopik
Pemeriksaan mikroskopik dilakukan terhadap serbuk simplisia. Serbuk
simplisia diletakkan pada kaca objek, ditetesi dengan larutan kloralhidrat lalu
ditutup dengan kaca penutup selanjutnya diamati di bawah mikroskop (gambar
simplisia Tephrosiae vogelii semen dapat dilihat pada lampiran 2, gambar 2
halaman 52).
3.5.3 Penetapan kadar abu total
Sebanyak 2 g serbuk yang telah digerus ditimbang seksama, dimasukkan
diratakan. Lalu krus dipijarkan pada suhu 600 0C sampai arang habis, kemudian
didinginkan dan ditimbang perlahan-lahan sampai bobot tetap. Kadar abu dihitung
terhadap bahan yang telah dikeringkan di udara (WHO, 1992)
3.5.4 Penetapan kadar abu yang tidak larut dalam asam
Abu yang diperoleh pada penetapan kadar abu dididihkan dengan 25 ml
asam klorida encer selama 5 menit, bagian yang tidak larut dalam asam
dikumpulkan, disaring melalui kertas saring bebas abu, dicuci dengan air panas.
Residu dan kertas saring dipijar pada suhu 600 0C sampai bobot tetap kemudian
didinginkan dan ditimbang. Kadar abu yang tidak larut dalam asam dihitung
terhadap bahan yang telah dikeringkan di udara (WHO, 1992)
3.5.5 Penetapan kadar sari yang larut dalam air
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama
24 jam dengan 100 ml air-kloroform (2,5 ml kloroform dalam air sampai 1 liter)
menggunakan labu bersumbat sambil berkali-kali dikocok selama 6 jam pertama,
kemudian dibiarkan selama 18 jam dan disaring. Sejumlah 20 ml filtrat diuapkan
sampai kering dalam cawan dangkal dasar rata yang telah ditara. Sisa dipanaskan
sampai kering pada suhu 105 0C hingga bobot tetap. Kadar sari yang larut dalam
air dihitung dalam persen terhadap bahan yang telah dikeringkan di udara.
(Materia Medika Indonesia, 1989)
3.5.6 Penetapan kadar sari yang larut dalam etanol
Sebanyak 5 g serbuk yang telah dikeringkan di udara dimaserasi selama
24 jam dengan 100 ml etanol 96% menggunakan labu bersumbat sambil
berkali-kali dikocok selama 6 jam pertama, kemudian dibiarkan selama 18 jam. Disaring
diuapkan sampai kering dalam cawan dangkal dasar rata yang telah ditara. Sisa
dipanaskan sampai kering pada suhu 105 0C hingga bobot tetap. Kadar sari yang
larut dalam etanol dihitung dalam persen terhadap bahan yang telah dikeringkan
di udara.
3.5.7 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode azeotropi (destilasi). Alat
meliputi labu alas 500 ml, alat penampung, tabung penerima 5 ml berskala 0,05
ml pendingin, tabung penyambung, pemanas.
Cara kerja :
Ke dalam labu kering dari alat untuk penentuan kadar air ditambahkan
200 ml toluen dan 2 ml air suling, lalu didestilasi selama 2 jam. Toluen
didinginkan selama 30 menit dan volume air dalam tabung penampung dari alat
penentuan kadar air dibaca dengan ketelitian 0,05 ml. Selanjutnya ke dalam labu
dimasukkan 5 g bahan sampel yang telah ditimbang seksama, labu dipanaskan
hati-hati selama 15 menit. Setelah toluen mulai mendidih, kecepatan tetesan diatur
2 tetes untuk tiap detik. Setelah sebagian besar air terdestilasi, kecepatan tetesan
dipercepat menjadi 4 tetes untuk tiap detik (dengan cara menaikkan suhu). Setelah
volume air tidak bertambah lagi, bagian dalam pendingin dibilas dengan toluen.
Destilasi dilanjutkan selama 5 menit, kemudian tabung penerima dibiarkan
mendingin sampai suhu kamar. Volume air dibaca setelah air dan toluen memisah
sempurna. Selisih kedua volume air yang dibaca sesuai dengan kandungan air
yang terdapat di dalam bahan yang diperiksa. Kadar air dihitung dalam persen
terhadap berat sampel yang telah dikeringkan di udara (WHO,1992) (contoh
3.6Skrining Fitokimia
Pemeriksaan skrining fitokimia dilakukan berdasarkan metode dari
Depkes (1989) dan Farnsworth (1966) yang meliputi senyawa alkaloida,
flavonoida, glikosida, glikosida antrakinon, saponin, tanin dan
triterpenoida/steroida.
3.6.1 Pemeriksaan alkaloida
Sebanyak 0,5 g serbuk simplisia ditimbang, kemudian ditambahkan 1 ml
asam klorida 2 N dan 9 ml air suling, dipanaskan di atas penangas air selama 2
menit, didinginkan dan disaring. Filtrat dipakai untuk percobaan berikut:
− Tiga tetes filtrat, ditambahkan 2 tetes pereaksi Mayer, akan terbentuk endapan
berwarna kuning.
− Tiga tetes filtrat, ditambahkan 2 tetes pereaksi Bouchardat akan terbentuk
endapan berwarna jingga.
− Tiga tetes filtrat, ditambahkan 2 tetes pereaksi Dragendorff akan terbentuk
endapan berwarna kuning.
Alkaloida positif jika terjadi endapan atau kekeruhan paling sedikit pada dua dari
tiga percobaan di atas (Materia Medika Indonesia, 1989).
3.6.2 Pemeriksaan flavonoida
Sebanyak 0,5 g serbuk simplisia ditimbang, ditambahkan 10 ml etanol,
kemudian direfluks selama 10 menit dan disaring panas-panas melalui kertas
saring. Filtrat diencerkan dengan air 10 ml air suling. Setelah dingin ditambahkan
eter minyak tanah, diaduk hati-hati lalu didiamkan sebentar. Lapisan etanolnya
asetat dan disaring. Filtrat digunakan untuk uji flavonoida dengan cara sebagai
berikut:
− filtrat sebanyak 1 ml diuapkan sampai kering 0,5 g , sisanya dilarutkan dalam
1 ml sampai 2 ml etanol 96 % lalu ditambah 0,5 g serbuk seng dan 2 ml asam
klorida 2 N, didiamkan selama 1 menit. Kemudian ditambahkan 10 tetes asam
klorida pekat, jika dalam waktu 2 sampai 5 menit terjadi warna merah intensif
menunjukkan adanya flavonoida.
− filtrat sebanyak 1 ml diuapkan sampai kering, sisanya dilarutkan dalam etanol
96% kemudian ditambahkan 0,1 g serbuk magnesium dan 10 tetes asam
klorida pekat. Jika terjadi warna merah jingga sampai merah ungu
menunjukkan adanya flavonoida (Materia Medika Indonesia, 1989).
3.6.3 Pemeriksaan glikosida
Sebanyak 3,0 g serbuk simplisia ditimbang, dikocok dengan 30 ml
campuran dari 7 bagian etanol 96 % dan 3 bagian air suling, ditambah dengan
asam klorida 2 N, direfluks selama 10 menit, dinginkan dan disaring. Pada 20 ml
filtrat ditambahkan 25 ml air suling dan 25 ml timbal (II) asetat 0,4 M diaduk dan
didiamkan selama 5 menit, lalu disaring. Filtrat dikocok dengan 20 ml campuran 3
bagian kloroform dan 2 bagian isopropanol, lapisan air dipisahkan dari lapisan
pelarut organik. Ini dilakukan sebanyak tiga kali. Lapisan air digabung dan
diuapkan pada temperatur tidak lebih dari 50 0C. Sisanya dilarutkan dalam 2 ml
etanol 96%. Larutan ini digunakan untuk percobaan berikut: larutan sisa
dimasukkan ke dalam tabung reaksi, diuapkan di atas penangas air, sisanya
2 ml asam sulfat pekat melalui dinding tabung. Jika terbentuk cincin ungu pada
batas kedua cairan menunjukkan adanya gula yang berarti adanya glikosida (
Materia Medika Indonesia, 1989 )
3.6.4 Pemeriksaan glikosida antrakinon
Sebanyak 0,2 g serbuk simplisia ditimbang, ditambahkan 5 ml asam sulfat
2 N, dididihkan sebentar, didinginkan. Ditambahkan 10 ml benzen dikocok dan
didiamkan. Lapisan benzen dipisahkan dan disaring. Lapisan benzen dikocok
dengan 2 ml natrium hidroksida 2 N dan didiamkan. Jika lapisan air berwarna
merah dan lapisan benzen tidak berwarna menunjukkan adanya glikosida
antrakinon (Materia Medika Indonesia, 1979)
3.6.5 Pemeriksaan saponin
3.6.5.1 Uji busa
Sebanyak 0,5 g serbuk simplisia ditimbang, dimasukkan dalam tabung
reaksi lalu ditambahkan 10 ml air panas, didinginkan kemudian dikocok kuat-kuat
selama 10 detik, jika terbentuk buih yang stabil selama tidak kurang dari 10 menit
setinggi 1-10 cm dan dengan penambahan 1 tetes asam klorida 2 N buih tidak
hilang menunjukkan adanya saponin (Materia Medika Indonesia, 1989).
3.6.6 Pemeriksaan tanin
Sebanyak 0,5 g serbuk simplisia ditimbang, dikocok dengan 10 ml air
suling, lalu disaring. Filtratnya diencerkan dengan air suling sampai tidak
berwarna. Larutan diambil sebanyak 2 ml dan ditambahkan 1-2 tetes larutan
pereaksi besi (III) klorida 1%. Apabila terjadi warna biru atau hijau kehitaman
menunjukkan adanya tanin. (Materia Medika Indonesia, 1989)
Sebanyak 1 g serbuk simplisia ditimbang, ditambahkan n-heksan lalu
didiamkan selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap.
Pada sisanya ditambahkan asam asetat anhidrida dan asam sulfat pekat (pereaksi
Lieberman-Burchard ). Timbulnya warna ungu dan merah yang kemudian
berubah menjadi hijau biru menunjukkan adanya triterpenoida/steroida (Harborne,
1987) (Hasil karakterisasi simplisia dapat dilihat pada lampiran 3, tabel 1 halaman
59 ; hasil skrining fitokimia serbuk simplisia dapat dilihat pada lampiran 3, tabel 2
halaman59).
3.7 Pembuatan Ekstrak
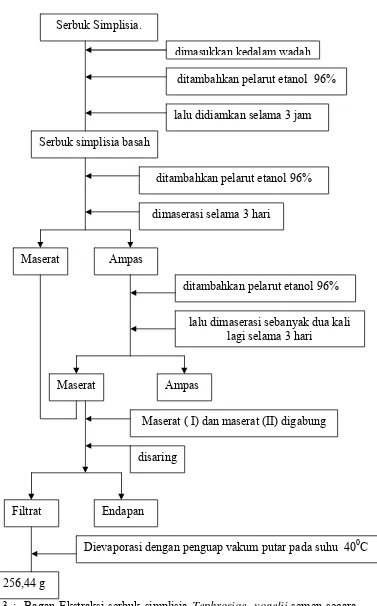
Senyawa alkaloida diekstraksi dengan cara maserasi menggunakan
pelarut etanol 96%.
Cara kerja:
Serbuk simplisia sebanyak 1 kg dimasukkan ke dalam wadah kaca
berwarna, lalu ditambahkan pelarut etanol 96% secukupnya sampai serbuk
simplisia basah, didiamkan beberapa jam. Setelah itu ditambah pelarut etanol 96%
sampai bahan tumbuhan terendam sempurna. Maserasi dilakukan selama tiga hari
tiga malam (72 jam) sambil sesekali diaduk. Kemudian disaring sehingga
diperoleh maserat. Kemudian ampas bahan tumbuhan ditambahkan pelarut etanol
96% yang baru sampai bahan tumbuhan terendam sempurna. Proses maserasi
dilakukan dua kali lagi masing-masing selama tiga hari sambil sesekali diaduk.
Semua maserat yang diperoleh digabung dan disaring, kemudian pelarutnya
diuapkan dengan alat penguap vakum putar pada suhu tidak lebih dari 40 0C.
ekstrak ini dilakukan analisis secara kromatografi lapis tipis untuk melihat
kandungan kimianya (Adams et al, 1970) (Hasil ekstraksi serbuk simplisia secara
maserasi dapat dilihat pada lampiran 4, gambar 3 halaman 60).
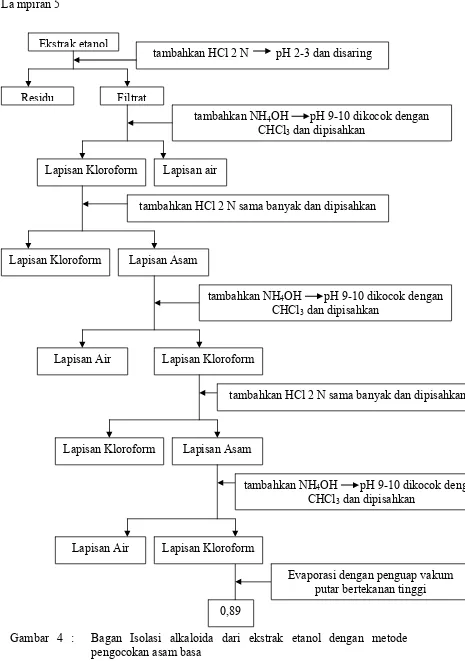
3.8 Isolasi Senyawa Alkaloida dari Ekstrak Etanol dengan Metode
Pengocokan Asam Basa
Senyawa alkaloida yang terdapat dalam ekstrak etanol 96% diisolasi
dengan menggunakan metode pengocokan asam basa sampai diperoleh alkaloida
kasar .
Cara kerja :
Sebanyak 200 g ekstrak etanol ditambahkan HCI 2 N hingga pH 2-3,
disaring dan filtrat dibasakan dengan NH4OH hingga pH 9-10. Kemudian filtrat
ini dikocok dengan 100 ml kloroform dalam corong pisah, lapisan air dan lapisan
kloroform dipisahkan. Perlakuan ini dilakukan sebanyak tiga kali.Lapisan
kloroform yang diperoleh dikumpulkan dan disaring. Volume kloroform yang
diperoleh diuapkan menjadi sepertiganya dengan penguap vakum putar pada suhu
tidak lebih dari 40 0C. Kemudian terhadap fraksi kloroform ditambahkan HCl 2 N
sama banyak, dikocok dalam corong pisah, lalu lapisan asam dan lapisan
kloroform dipisahkan. Perlakuan ini dilakukan sebanyak tiga kali. Lapisan asam
dikumpulkan dan disaring, kemudian dibasakan dengan NH4OH hingga pH 9-10,
dikocok dengan 100 ml kloroform kemudian kedua lapisan dipisahkan. Perlakuan
ini dilakukan sebanyak tiga kali, lapisan kloroform dikumpulkan dan diuapkan
dengan penguap vakum putar bertekanan rendah sampai didapat ekstrak alkaloida
1956) (Hasil isolasi alkaloida dari ekstak etanol dengan metode pengocokan asam
basa dapat dilihat pada lampiran 5, gambar 4 halaman 61 ).
3.9 Analisis Senyawa Alkaloida Hasil Isolasi Secara Kromatografi Lapis
Tipis ( KLT )
Terhadap ekstrak alkaloida kasar dilakukan KLT untuk melihat
kandungan alkaloidanya menggunakan plat pra lapis silika gel 60 F254 dengan fase
gerak kloroform - metanol - amonia (85 : 15 : 1). Sebagai penampak bercak
dipakai pereaksi Dragendorff.
Cara kerja :
Ke dalam chamber dimasukkan campuran pengembang. Ekstrak etanol
ditotolkan pada plat pra lapis silika gel 60 F254, setelah kering dimasukkan
kedalam chamber yang telah jenuh dengan uap pengembang dan ditutup rapat.
Sesudah pengembangan selesai plat dikeluarkan dari chamber dan dikeringkan di
udara, kemudian plat disemprot
dengan larutan penampak bercak Dragendorff, warna bercak yang terjadi diamati
dan dihitung harga Rf-nya. (Hasil kromatogram ekstak etanol dan dapat dilihat
pada lampiran 6, gambar 5 halaman 62 ).
(Adams et al, 1970; Sastro Hamidjojo, 1985; Stahl, 1985)
3.10Isolasi Senyawa Alkaloida Secara Kromatografi Lapis Tipis Preparatif
Isolasi senyawa alkaloida dilakukan secara KLT preparatif, sebagai fase
gerak digunakan kloroform - metanol - amonia (85 : 5 : 1) dan sebagai penampak
Cara kerja:
Ekstrak diencerkan dengan etanol dan ditotolkan pada jarak 2 cm dari tepi
bawah plat pra lapis silika gel 60 F254 berukuran 20 x 20 cm yang telah diaktifkan
sehingga membentuk pita. Setelah kering plat pra lapis silika gel 60 F254
dimasukkan kedalam bejana yang telah jenuh dengan uap fase gerak kloroform -
metanol - amonia (85 : 5 : 1), pengembang dibiarkan naik membawa komponen
yang ada. Setelah mencapai batas pengembang plat dikeluarkan dari bejana lalu
dikeringkan. Bagian tengah plat ditutup dengan kaca yang bersih sedangkan pada
sisi kanan dan kiri plat disemprot dengan pereaksi Dragendorff dan dipanaskan
dengan hair dryer. Bercak berwarna merah jingga yang terdapat pada sisi kiri yang
dihubungkan pada sisi kanan terhadap isolat yang diperoleh dikerok dan
dikumpulkan, direndam dengan metanol satu malam dan disaring kemudian
pelarutnya diuapkan. Kemudian dilakukan uji kemurnian terhadap isolat A1 yang
diperoleh (Hasil isolasi senyawa alkaloida secara kromatogram KLT preparatif
dapat dilihat pada lampiran 7, gambar 6 halaman63).
3.11Analisis Senyawa Alkaloida Hasil Isolasi Secara Kromatografi Lapis
Tipis ( KLT ) Dengan Satu Arah Memakai Fase Gerak Yang Berbeda
Terhadap ekstrak alkaloida kasar dilakukan KLT untuk melihat
kandungan alkaloidanya menggunakan plat pra lapis silika gel 60 F254 dengan fase
gerak kloroform - metanol - amonia dengan berbagai perbandingan, yaitu : (85 :
15 : 1), dan (95 : 5 : 1). Sebagai penampak bercak dipakai pereaksi Dragendorff.
Ke dalam chamber dimasukkan campuran pengembang. Ekstrak etanol ditotolkan
pada plat pra lapis silika gel 60 F254, setelah kering dimasukkan kedalam chamber
yang telah jenuh dengan uap pengembang dan ditutup rapat. Sesudah
pengembangan selesai plat dikeluarkan dari chamber dan dikeringkan di udara,
kemudian plat disemprot dengan larutan penampak bercak Dragendorff, warna
bercak yang terjadi diamati dan dihitung harga Rf-nya. (Adams et al, 1970; Sastro
Hamidjojo, 1985; Stahl, 1985). (Hasil kromatogram KLT satu arah dengan
memakai fase gerak berbeda dapat dilihat pada lampiran 8, gambar 7 halaman 64).
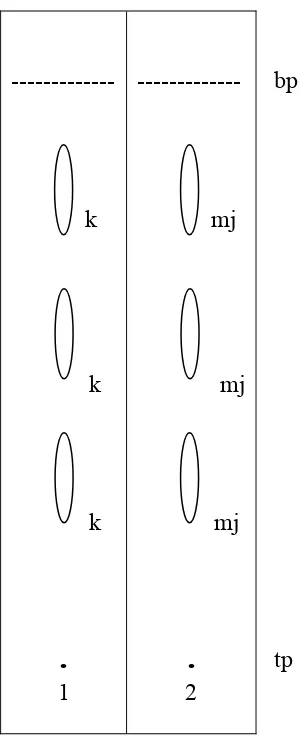
3.12Uji Kemurnian Senyawa Alkaloida Hasil Isolasi
Terhadap isolat A1 dilakukan uji kemurnian dengan KLT dua arah dengan
menggunakan fase gerak I yaitu kloroform - metanol - amomia (85: 5: 1) dengan
fase diam plat pra lapis silika gel 60 F 254 dan sebagai penampak bercak
digunakan pereaksi Dragendorff.
Cara kerja:
Isolat A1 ditotolkan pada plat pra lapis silika gel 60 F 254 ukuran 10x10
lalu dielusi memakai fase gerak I yaitu kloroform - metanol - amonia (85 : 5 : 1)
hingga mencapai batas pengembangan, kemudian plat dikeluarkan didalam bejana
dan dikeringkan. Setelah plat kering dielusi kembali dengan arah yang berbeda
900 memakai fase gerak II yaitu kloroform - metanol - amonia (95 : 5 : 1) dan
disemprot dengan memakai pereaksi Dragendorff, setelah itu plat di hair dryer
sampai kering lalu diamati warna yang terbaik. (Hasil kromatogram KLT dua arah
3.13Karakterisasi Isolat
Karakterisasi senyawa hasil isolasi dilakukan dengan spektrofotometri
ultra violet dan spektrofotometri infra merah.
3.13.1 Karakterisasi isolat dengan spektrofotometri ultra violet
Karakterisasi isolat A1 dengan spektrofotometri ultra violet dilakukan
dengan cara melarutkan zat hasil isolasi dengan kloroform kemudian diukur
absorbansinya pada panjang gelombang 200-400 nm (spektrum ultra violet dapat
dilihat pada lampiran 10, gambar 9 halaman 66).
3.13.2 Karakterisasi isolat dengan spektrofotometri infra merah
Karakterisasi isolat dengan spektrofotometri infra merah dilakukan
dengan cara mencampur isolat dengan kalium bromida menggunakan alat mixture
vibrator kemudian dicetak menjadi pellet pada tekanan 11,5 ton ; pellet yang
terjadi dimasukkan ke dalam alat spektrofotometer infra merah lalu diukur
spektrum ultra merahnya pada bilangan gelombamng 4000-650 cm-1 (spektrum
BAB IV
HASIL DAN PEMBAHASAN
Hasil identifikasi yang dilakukan oleh Pusat penelitian dan
Pengembangan Biologi Bogor terhadap tumbuhan yang diteliti adalah tumbuhan
Tephrosia vogelii Hook.f. suku Papilionaceae.
Tephrosia vogelii Hook.f. termasuk dalam suku Papilionaceae yang
mengandung berbagai jenis senyawa alam. Hasil penelusuran pustaka
menunjukkan bahwa masyarakat menggunakan biji Tephrosia vogelii Hook .f.
digunakan sebagai minyak gosok dengan cara: biji digongseng kemudian
dihaluskan maka akan diperoleh minyaknya, misalnya digunakan sebagai obat
terkilir, obat rematik. Informasi tentang tumbuhan ini masih sedikit sekali
(Anonim, 1995).. Tephrosia vogelii Hook.f. mengandung alkaloida, flavonoida ,
glikosida, saponin dan triterpenoida / steroida.
Hasil karakterisasi dari serbuk simplisia adalah sebagai berikut : kadar abu
total 7,70%, kadar abu yang tidak larut dalam asam 1,73%, kadar sari yang larut
dalam air 22,46%, kadar sari yang larut dalam etanol 12,19%, dan kadar air
7,96%. Hal ini menunjukkan bahwa serbuk simplisia telah memenuhi persyaratan
kadar air yaitu tidak lebih dari 10% (Depkes, 1989)
Pemeriksaan makroskopik simplisia dari pada Tephrosiae vogelii semen
adalah biji berwarna hitam berukuran 0,5 cm, berbentuk lonjong tipis, bentuk
permukaan licin dan tidak berbau.
Hasil pemeriksaan mikroskopik serbuk simplisia dijumpai adanya