EFEKTIVITAS CENDAWAN
Duddingtonia flagrans
DAN
Saccharomyces cerevisiae
DALAM PENGENDALIAN
CACING
Haemonchus contortus
PADA DOMBA
RIZA ZAINUDDIN AHMAD
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi dengan judul Efektivitas cendawan Duddingtonia flagrans dan Saccharomyces cerevisiae dalam pengendalian cacing Haemonchus contortus pada domba adalah karya saya dengan arahan dan bimbingan komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun.
Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka dibagian akhir disertasi ini
Bogor, Januari 2008
ABSTRACT
RIZA ZAINUDDIN AHMAD. The Efectivity of Duddingtonia flagrans and
Saccharomyces cerevisiae fungi in controlling Haemonchus contortus
worm in sheep. Under the Supervision of Fadjar Satrija, Nampiah Sukarno, and Fachriyan Hasmi Pasaribu.
Duddingtonia flagrans mold was applied as the biological control to Haemonchus contortus worm. The preliminary study showed that the prospect of using Saccharomyces cerevisiae as agent of biological control could be combined with D. flagrans. This study was carried out in four steps experiment to study effectivity of D. flagrans and S. cerevisiae as biological control agents for H. contortus in sheep.
The first step was to study characteristic of S.cerevisiae growth to various effects of medium, light intensity, temperature, rumen fluid and storing time. The test was carried out by inoculating this yeast in media and then was given by above treatments. This experiment showed that the growth of yeast was not effected by these treatments.
The activity of chitinase, protease enzymes and attractant of both fungi were observed in the second step of experiment. The test was carried out by harvesting fungi in agar media, and then the content of these enzymes were observed. The worms larvae which approached to the fungi was assayed for attractant . The activitiy of intra celluler chitinase of D.flagrans and S.cerevisiae were: 3.1812 units/gr and 4.2563 units/gr, respectively. The content of protease activity were 7.1315 units/gr for D.flagrans and 0.0052 unit/gr for S.cerevisiae. Meanwhile, the activity assayed of extra celluler chitinase in D.flagrans and S.cerevisiae were: 2.1724 units/gr dan 2.1812 units/gr, respectively. Meanwhile, the protease activity of both fungi were relatively small. The attractant of S. cerevisiae was (45%) higher than D. flagrans (40%).
The third step was to study the effect of D. flagrans and S. cerevisiae spores by in vitro assayed to find out its ability to reduce H.contortus L3 in agar medium and coproculture. The assayed was carried out by administration both fungi to L3in agar medium and coproculture. The result of experiment showed that larvae was significantly reduced by D. flagrans in both media. S. cerevisiae did not kill larvae directly, but It acted a bacteria competitor which was needed for developing larvae in coproculture.
The fourth step was to study the effect of drenching D. flagrans and S. cerevisiae spores on microscopical structure of reproduction organ, L3 reduce and worm fecundity in infected sheep by H. contortus. The assayed test were carried out by administration both fungi to infected sheep. The observation of histopathological changes in female reproduction organ (ovum) and male (sperm) showed that the treatment groups were significantly different compared to the control group (P<0.01). D.flagrans only destroyed spermatocid cells significantly (P <0.01). S. cerevisiae destroyed spermatocid cells and ovum cells significantly (P<0.01). The administration of both fungi did not effect the size of reproduction organs i e. copulatriks bursae, spiculum and vulva flap. The administration of D.flagrans in in vivo could significantly reduced H.contortus larvae (P<0.05) in infected sheep. Base on all results above we concluded that D.flagrans and S.cerevisiae seem could be use as biological control againts H.contortus.
RINGKASAN
RIZA ZAINUDDIN AHMAD. Efektivitas cendawan Duddingtonia flagrans dan Saccharomyces cerevisiae dalam pengendalian cacing Haemonchus contortus pada domba. Dibimbing oleh Fadjar Satrija, Nampiah Sukarno, dan Fachriyan Hasmi Pasaribu.
Kapang Duddingtonia flagrans telah digunakan sebagai pengendalian hayati terhadap cacing parasit saluran pencernaan, termasuk Haemonchus contortus di berbagai negara. Penelitian pendahuluan memperlihatkan prospek pemanfaatan Saccharomyces cerevisiae sebagai agen pengendali hayati yang dapat dikombinasikan dengan D. flagrans. Studi ini dilakukan dalam empat tahap percobaan untuk mempelajari efektivitas D. flagrans dan S. cerevisiae sebagai agen pengendali hayati cacing H. contortus pada domba.
Percobaan tahap pertama mempelajari karakter pertumbuhan S.cerevisiae isolat lokal yang akan digunakan. Uji pengaruh media, intensitas
cahaya, suhu, cairan rumen dan waktu simpan terhadap pertumbuhan S. cerevisiae dilakukan dengan cara menginokulasi khamir tersebut pada media
(Bacto Agar, Corn Meal Agar, Potato Dextrose Agar, Sabouraud Dextrose Agar, dan Sabouraud Dextrose Broth), media yang terkena cahaya dan tidak, diberi cairan rumen yang telah disaring atau tidak, media bersuhu 22-30oC, 25oC, 37oC, dan 39oC, waktu simpan 1-12 bulan. Percobaan ini menunjukkan bahwa pertumbuhan khamir tidak dipengaruhi oleh jenis medium, aplikasi cahaya, rumen dan temperatur. Viabilitas dari sel khamir tidak juga dipengaruhi oleh perlakuan penyimpanan sampai dengan 12 bulan pada suhu 4-10oC.
Aktivitas enzim kitinase, protease dan zat atraktan yang terkandung dalam kedua cendawan diamati pada percobaan tahap kedua. Uji enzim dilakukan dengan menginokulasikan kedua cendawan tersebut pada media agar, kemudian memanennya dan diperiksa aktivitas enzim intra seluler dan ekstra seluler yang dikandungnya. Hasil yang diperoleh aktivitas kitinase intra seluler pada D. flagrans dan S. cerevisiae sebesar: 3,1812 unit/gr dan 4,2563 unit/gr, dan kandungan aktivitas protease adalah: 7,1315 unit/gr pada D.flagrans dan 0,0052 unit/gr pada S.cerevisiae. Sedangkan uji aktivitas kandungan enzim ekstra seluler kitinase pada D. flagrans dan S.cerevisiae adalah: 2,1724 gr/unit dan 2,1812 unit/gr, sedangkan kandungan proteasenya adalah 0,0003 unit/gr pada D. flagrans dan 0,00 unit/gr pada S. cerevisiae. Adapun kandungan atraktan yang dimiliki S. cerevisiae sebanyak (45%) adalah lebih besar dibandingkan dengan D. flagrans (40%).
C. Diberi D.flagrans dosis bertingkat; D dan E Diberi. S.cerevisiae dosis bertingkat. Percobaan dilakukan dalam Rancangan Acak Lengkap (RAL), dengan 5 ulangan. Hasil percobaan ini memperlihatkan kemampuan D.flagrans secara nyata dapat mereduksi larva H.contortus pada kedua media tersebut. Cendawan D.flagrans dan S. cerevisiae dapat tumbuh/ berinteraksi pada media agar. Khamir S. cerevisiae secara in vitro tidak dapat membunuh larva secara langsung. Namun spora S.cerevisiae yang diberikan dengan dosis tinggi akan tumbuh dalam pupukan tinja dan menjadi kompetitor dalam memperebutkan sumber nutrisi yang diperlukan bagi perkembangan larva.
Pada percobaan in vivo tahap keempat ini dipelajari pengaruh pencekokan spora D. flagrans dan S. cerevisiae terhadap struktur mikroskopik organ reproduksi serta fekunditas cacing pada domba yang diinfeksi H.contortus. Uji dilakukan sebagai berikut; 20 ekor (4 kelompok) domba dengan perlakuan yang telah bebas cacing dan diinfeksi kembali, diberi perlakuan selama 5 minggu sebagai berikut; I. (kontrol), II. Diberi D. flagrans, III. Diberi S. cerevisiae, IV. Diberi D. flagrans dan S. cerevisiae. Pada perlakuan ini kemudian diperiksa jumlah telur pergram tinja, daya tetas telur larva pergram tinja setiap minggu. Sedangkan fekunditas, jumlah cacing dewasa dan perubahan organ reproduksi cacing betina dan jantan dewasa diamati setelah domba dikurbankan pada akhir perlakuan. Pengamatan histopatologi terhadap organ reproduksi betina (ovum) dan jantan (sperma) menunjukkan perubahan signifikan (P<0,01) antara kelompok kontrol dan perlakuan. Kapang D. flagrans secara signifikan hanya merusak sel spermatosit cacing jantan. Dalam perlakuan yang sama pemberian S. cerevisiae secara signifikan menimbulkan kerusakan pada sel spermatosit cacing jantan dan sel ovum cacing betina. Pemberian D. flagrans secara in vivo mampu mereduksi larva H. contortus secara nyata (P<0,05) pada domba yang diinfeksi cacing H. contortus. Pemberian kedua cendawan ini tidak mempengaruhi terhadap ukuran organ reproduksi bursa kopulatriks, spikulum dan vulva flap. Berdasarkan seluruh hasil studi di atas kami menyimpulkan bahwa D.flagrans dan S.cerevisiae tampaknya dapat digunakan sebagai agen pengendali hayati cacing H.contortus.
©Hak Cipta milik IPB, tahun 2007 Hak Cipta dilindungi undang-undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. Pengutipan hanya untuk kepentingan pendidikan, penelitian,
penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar IPB
2. Dilarang mengumumkan dan memperbanyak sebagian atau seluruh
Penguji pada Ujian Tertutup: Drh. Risa Tiuria, MS, PhD Penguji pada Ujian Terbuka: 1. Dr. Ir. Ika Mustika
EFEKTIVITAS CENDAWAN
Duddingtonia flagrans
DAN
Saccharomyces cerevisiae
DALAM PENGENDALIAN
CACING
Haemonchus contortus
PADA DOMBA
RIZA ZAINUDDIN AHMAD
Disertasi
Sebagai salah satu syarat untuk memperoleh
gelar Doktor pada
Program Studi Sains Veteriner
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Disertasi : Efektivitas cendawan Duddingtonia flagrans dan Saccharomyces cerevisiae dalam pengendalian cacing Haemonchus contortus pada domba
Nama : Riza Zainuddin Ahmad NIM : B 063050051
Disetujui, Komisi Pembimbing
Drh. Fadjar Satrija, MSc, PhD Ketua
Dr. Ir. Nampiah Sukarno Prof. Dr. Drh. Fachriyan H Pasaribu Anggota Anggota
Diketahui
Ketua Program Studi Sains Veteriner
Dekan Sekolah PascaSarjana IPB
Drh. Bambang Pontjo P, MS, PhD Prof. Dr. Ir. Khairil A Notodiputro, MS
PRAKATA
Syukur Alhamdullilah dipanjatkan ke hadirat Allah SWT yang telah memberikan taufiq dan Hidayah-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Maret 2006 ini ialah pengendalian hayati dengan judul Efektivitas cendawan Duddingtonia flagrans dan Saccharomyces cerevisiae dalam pengendalian cacing Haemonchus contortus pada domba.
Terima kasih penulis ucapkan kepada Bapak Drh. Fadjar Satrija, MSc, PhD, Dr. Ir. Nampiah Sukarno dan Prof. Dr. Drh. Fachriyan Hasmi Pasaribu selaku pembimbing, serta Drh. Bambang Pontjo Priosoeryanto, MS, PhD. yang telah banyak memberi saran dan arahan. Disamping itu, penghargaan penulis sampaikan kepada Kepala Balai, peneliti, teknisi Balai Besar Penelitian Veteriner, Departemen Pertanian, dosen dan teknisi Institut Pertanian Bogor yang telah memberikan fasilitas, membantu mengumpulkan data dari awal hingga terselesainya penelitian ini. Ungkapan terima kasih juga disampaikan kepada keluarga, istri, anak dan Dewan Kesejahteraan Mesjid di Bogor atas bantuan moril, doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2008
RIWAYAT HIDUP
Penulis dilahirkan pada tanggal 23 Nopember 1964 di Jakarta, merupakan anak ke 2 dari 3 bersaudara dari pasangan Alm. Zainuddin Ahmad MSc dan H. Suryati. Pendidikan sarjana ditempuh pada Fakultas Kedokteran Hewan di FKH IPB, dan lulus pada tahun 1987. Setahun kemudian, penulis menyelesaikan pendidikan Dokter Hewan di perguruan tinggi yang sama. Pada tahun 2001 penulis menyelesaikan studi pendidikan S2 di Fakultas PascaSarjana di IPB juga.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xiv
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
PENDAHULUAN Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA Cacing H.contortus ... 4
Klasifikasi dan Morfologi ... 4
Patogenesis ... 6
Epidemiologi dan Pengendalian ... 6
Kapang Nematofagus D. flagrans ... 6
Klasifikasi dan Morfologi ... 7
Mekanisme memangsa nematoda ... 7
Karakter D. flagrans isolat lokal ... 8
Khamir S. cerevisiae ... 9
Klasifikasi dan Morfologi ... 9
Siklus hidup ... 10
Pemanfaatan S.cerevisiae ... 11
Pengaruh terhadap reproduksi cacing ... 12
Enzim ... 12
PERTUMBUHAN Saccharomyces cerevisiae PADA BERBAGAI JENIS MEDIUM, INTENSITAS CAHAYA,TEMPERATUR, RUMEN DAN LAMA PENYIMPANAN Abstract ... 14
Halaman
Pendahuluan ... 15
Bahan dan Metode ... 17
Hasil dan Pembahasan ... 20
Kesimpulan ... 27
AKTIVITAS ENZIM KITINASE, PROTEASE DAN ZAT KEMOATRAKTAN YANG TERKANDUNG PADA Duddingtonia flagrans DAN Saccharomyces cerevisiae Abstract ... 28
Abstrak ... 28
Pendahuluan ... 29
Bahan dan Metode ... 30
Hasil dan Pembahasan ... 34
Kesimpulan ... 37
INTERAKSI ANTARA Duddingtonia flagrans DAN Saccharomyces cerevisiae DENGAN LARVA INFEKTIF Haemonchus contortus PADA MEDIUM AGAR DAN PUPUKAN TINJA Abstract ... 38
Abstrak ... 38
Pendahuluan ... 39
Bahan dan Metode ... 41
Hasil dan Pembahasan ... 44
Kesimpulan ... 50
GANGGUAN FUNGSI REPRODUKSI CACING Haemonchus contortus PADA DOMBA YANG DIBERI CENDAWAN Duddingtonia flagrans DAN Saccharomyces cerevisiae Abstract ... 51
Abstrak ... 51
Pendahuluan ... 52
Bahan dan Metode ... 53
Halaman
Kesimpulan ... 65
PEMBAHASAN UMUM ... 66
KESIMPULAN DAN SARAN ... 71
DAFTAR PUSTAKA ... 72
DAFTAR TABEL
Halaman
1 Pertumbuhan S. cerevisiae pada berbagai macam medium setelah
diinkubasi selama 3 hari pada suhu kamar (22-310C) ... 21
2 Pengaruh cahaya, pemberian cairan rumen, lama penyimpanandan temperatur terhadap pertumbuhan S. cerevisiae pada umur 3 hari setelah inokulasi sel ... 24
3 Aktivitas enzim intra seluler Kitinase dan Protease yang dimiliki oleh D. flagrans dan S. cerevisiae ... 34
4 Aktivitas ekstra seluler enzim Kitinase dan Protease yang dimiliki oleh D. flagrans dan S. cerevisiae ... 34
5 Kelompok agar percobaan dan perlakuannya ... 42
6 Kelompok hewan dan perlakuan (tahap I) ... 42
7 Kelompok hewan dan perlakuan (tahap II) ... 43
8 Jumlah L3 H.contortus yang bertahan hidup pada uji kemampuan reduksi D.flagrans S. cerevisiae dalam medium agar ... 48
9 Kemampuan reduksi D.flagrans dan S. cerevisiae terhadap larva H. contortus pada pupukan tinja ... 48
10 Kemampuan reduksi D.flagrans dan S. cerevisiae setelah pasase di saluran pencernaan terhadap larva H. contortus pada pupukan tinja ………... 49
11 Pembagian Kelompok hewan dan perlakuan ... 54
12 Persentase jumlah telur yang berkembang menjadi larva3 selama 5 minggu ... 58
13 Fekunditas cacing ... 58
14 Jumlah cacing yang ditemukan di abomasum domba ... 59
15 Persentase perubahan patologis pada alat reproduksi (spermatosit) cacing jantan ... 63
16 Ukuran bursa kopulatriks dan spikulum cacing jantan ... 63
17 Persentase perubahan patologis pada alat reproduksi (ovum) cacing betina ... 64
DAFTAR GAMBAR
Halaman
1 Organ reproduksi cacing dewasa H. contortus ... 4
2 Siklus hidup H.contortus ... 5
3 Klamisdospora dan konidia D. flagrans, perbesaran 10 x 40, pewarnaan H.E ... 7
4 Mekanisme kapang pemangsa larva cacing ... 9
5 Isolat S. cerevisiae, perbesaran 10 x 40, pewarnaan laktofenol blue ... 10
6 Pertumbuhan S.cerevisiae pada berbagai medium ... 22
7 Pertumbuhan S. cerevisiae dengan perlakuan ... 23
8 Pertumbuhan S. cerevisiae pada berbagai macam suhu ... 23
9 Pertumbuhan S. cerevisiae setelah disimpan ... 25
10 Persentase larva H. contortus yang bergerak mendekati isolat uji ……. 36
11 Larva3H. contortus yang dibunuh oleh kapang D. flagrans pada media agar CMA, inkubasi 4 hari pada suhu kamar ... 44
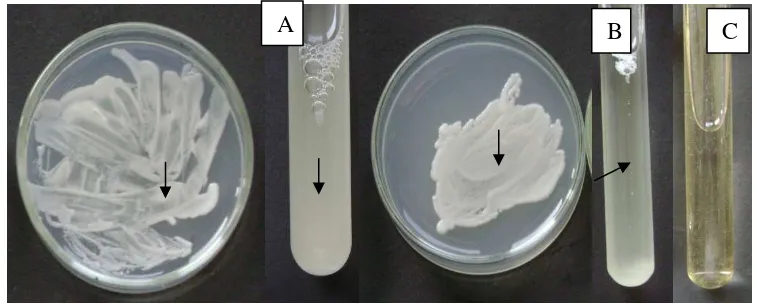
12 Kapang D.flagrans dan S.cerevisiae yang tumbuh pada media agar CMA inkubasi 4 hari pada suhu kamar ... 45
13 Jumlah telur pergram tinja (EPG/ TPG) selama 5 minggu ... 57
14 Potongan longitudinal inti spermatosit pada testis cacing jantan ... 60
DAFTAR LAMPIRAN
Halaman
1 Pembuatan Media Agar ... 79
2 Penghitungan Telur Pergram Tinja ... 80
3 Penghitungan Larva Pergram Tinja ... 81
4 Pembuatan Slide Preparat ... 82
5 Pembuatan Larutan Buffer Neutral Formaline (BNF) ... 83
6 Pewarnaan dengan Hemaktosilin Eosin (HE) ... 84
7 Pewarnaan dengan Minyak Cengkeh (MC) ... 85
Latar Belakang
Kecacingan merupakan salah satu masalah serius yang dihadapi
peternakan ruminansia kecil di Indonesia. Cacing parasit yang penting pada
domba adalah Haemonchus contortus yang menyebabkan haemonchosis.
Infeksi cacing penghisap darah ini menyebabkan penurunan bobot badan, diare,
kekurusan dan kadang-kadang kematian ternak (Soulsby 1986). Sigi lapang di
beberapa daerah di Propinsi Jawa Barat, menunjukkan bahwa umumnya seekor
hewan dapat terinfeksi oleh 3-4 macam spesies yang didominasi oleh cacing
H. contortus dan Trichostrongylus spp. dengan rata-rata prevalensi sebesar 67%
(Kusumamihardja dan Zalizar 1992). Kerugian akibat infeksi nematoda termasuk
H. contortus pada kambing diperkirakan mencapai Rp 7.000.000.000/tahun
(Rachmat et al. 1998) serta diperkirakan terus meningkat bila tidak dilakukan
upaya pengendalian dengan sungguh-sungguh.
Haemonchosis dapat dikendalikan dengan berbagai cara. Penggunaan
obat anti cacing (anthelmintika) untuk membunuh/mengusir cacing dalam tubuh
hewan, merupakan cara yang umum digunakan. Keuntungan metode ini dapat
dengan cepat menekan infeksi dan mengurangi efek patofisiologisnya. Meskipun
demikian, penggunaan anthelmintika yang sama dalam jangka panjang beresiko
menyebabkan resistensi cacing terhadap obat dan adanya residu pada organ.
Untuk mendapatkan hasil yang optimal, penggunaan antelmintika ini harus
dipadukan dengan manajemen beternak yang baik untuk mengurangi
kemungkinan kontak antara ternak dengan larva infektif. Alternatif lain dalam
pengendalian haemonchosis yaitu dengan pengendalian biologis menggunakan
agen hayati, serta pengembangan vaksin dan seleksi ras ternak yang tahan
terhadap parasit (Patra 2007; Waller dan Larsen 1994; Waller et al. 2006).
Upaya pengendalian haemonchosis pada peternakan domba di
Indonesia, sulit dilaksanakan karena hewan dipelihara dengan pola peternakan
tradisional yang kurang memperhatikan manejemen pemeliharaan dan
kesehatan hewan. Saat ini penanggulangan umumnya dilakukan dengan
pemberian anthelmintika, namun berbagai studi menemukan adanya resistensi
akibat pemakaian dalam jangka panjang dengan dosis yang kurang tepat dari
et al. 2001).Untuk itu perlu dicari suatu cara penanggulangan penyakit cacing H.
contortus yang lebih efektif dan efisien.
Penelitian penggunaan Duddingtonia flagrans sebagai pengendali hayati
parasit cacing nematoda pada ternak sudah banyak dilakukan di beberapa
negara. Cendawan ini bekerja dengan cara menangkap larva infektif (L3) di
lapangan sehingga akan menurunkan tingkat kontaminasi larva di lapangan.
Pemberian konidiaspora D. flagrans pada domba dapat menurunkan tingkat
kontaminasi larva H.contortus di lapangan sebesar 70-90% (Larsen 2000;
Chandrawathani et al. 2004; Waller 1997). Uji coba pengendalian hayati
haemonchosis dengan menggunakan cendawan D. flagrans, juga sudah
dilakukan di Indonesia sejak tahun 2000 dengan tingkat reduksi larva sebesar
70% (Beriajaya et al. 2001; Ahmad et al. 2002).
Dalam bidang peternakan khamir Saccharomyces cerevisiae digunakan
secara komersial sebagai probiotik dan imunostimulan untuk ternak (Agarwal et
al. 2000; Kompiang 2002; Fox 2002; Thanardkit et al. 2002). Penelitian
pendahuluan menunjukkan bahwa pemberian S. cerevisiae dalam tape sebagai
pakan pada cacing tanah (Lumbricus sp.) berdampak pada penurunan
kemampuan produksi kokon (telur) cacing tanah. Hasil ini sejalan dengan
penelitian Pitojo (1995), yang dapat memperlihatkan penurunan kemampuan
reproduksi kelinci jantan pasca pemberian ragi Saccharomyces sp. Fenomena ini
membuka peluang kemungkinan penggunaan Saccharomyces cerevisiae untuk
menurunkan kemampuan reproduksi cacing parasit.
Penggunaan kapang D. flagrans dan khamir S. cerevisiae secara
simultan diharapkan dapat meningkatkan efektivitas pengendalian hayati
H. contortus. Peningkatan efektivitas tersebut dapat dicapai melalui reduksi
jumlah larva oleh kapang nematofagus D. flagrans di lapangan, dan pada saat
yang sama terjadi pula penurunan kemampuan reproduksi cacing dewasa di
dalam tubuh domba. Oleh karena itu perlu dipelajari interaksi yang mungkin
terjadi antara kapang dan khamir tersebut.
Studi ini dilakukan melalui rangkaian empat tahap percobaan. Pada tahap
pertama, karakter isolat lokal S. cerevisiae yang akan digunakan sebagai
kandidat pengendali hayati terhadap H. contortus dipelajari dengan menguji
pengaruh berbagai medium, temperatur, kebutuhan terhadap cahaya, cairan
rumen dan waktu simpan bahan terhadap pertumbuhan isolat coba. Tahap
D. flagrans dan S. cerevisiae yang mungkin berperan dalam mekanisme
pengendalian H. contortus. Pada tahap ketiga diuji kemampuan membunuh
secara in vitro dan interaksi yang terjadi antara kedua cendawan pada medium
agar dan tinja. Percobaan dilakukan untuk menguji daya reduksi terhadap L3.
Untuk lebih meyakinkan isolat tersebut dapat digunakan sebagai pengendali
hayati, maka pada tahap keempat dilakukan uji kemampuan isolat tersebut
sebagai pengendali biologis terhadap H. contortus. Di dalam tahap ini dilakukan
juga pengamatan terhadap perubahan organ reproduksi, fekunditas, produksi
dan daya tetas telur, dan populasi cacing dewasa.
Tujuan Penelitian
1. Mempelajari sifat-sifat isolat lokal S. cerevisiae sebagai cendawan
kandidat pengendali biologis H. contortus.
2. Mengevaluasi kemampuan masing-masing cendawan D. flagrans dan
S. cerevisiae dan interaksinya dalam mereduksi jumlah larva stadium 3
(L3) H. contortus secara in vitro.
3. Mempelajari mekanisme penurunan jumlah larva oleh D. flagrans dengan
S. cerevisiae dan interaksinya pada uji in vitro dan in vivo.
4. Mempelajari perubahan patologis organ reproduksi cacing dewasa
setelah pemberian cendawan D. flagrans dan S. cerevisiae.
Manfaat Penelitian
Diharapkan hasil studi ini dapat digunakan sebagai acuan dalam
penggunaan kapang D. flagrans dan khamir S. cerevisiae sebagai agen
TINJAUAN PUSTAKA
Cacing H. contortus
Klasifikasi dan Morfologi
Haemonchus contortus adalah cacing dari Kelas Nematoda, Ordo
Strongylida dan Super famili Trichostrongyloidea. Cacing dewasa hidup di dalam
abomasum ruminansia kecil termasuk domba dan kambing. Cacing jantan
panjangnya 10-20 mm, dan betina 18-30 mm. Cacing jantan dan betina dapat
dibedakan melalui pengamatan morfologi organ reproduksinya (Urquhart et al.
1987).
Organ reproduksi cacing betina terdiri dari ovarium, oviduk, uterus dan
diakhiri dengan vagina pendek yang bermuara pada vulva. Uterus dan vagina
dihubungkan dengan ovijector. Cacing betina mempunyai vulva flap yang
berfungsi dalam proses kopulasi dan pengeluaran telur. Setiap ekor cacing
betina dewasa mampu bertelur sampai 10.000 butir perhari.
Gambar 1. Organ reproduksi cacing dewasa H. contortus. jantan(A) dan betina (B). (V) vulva flap, (BK) Bursa Kopulatriks, (G) Gubernakulum (S)
Spikulum. Pewarnaan minyak cengkeh. Pembesaran 10 x10
S B
V A
BK
G
Cacing jantan memiliki organ reproduksi yang terdiri dari testis tunggal
yang memanjang dan vas deferens berujung di duktus ejakulatori. Selain itu,
terdapat asesori organ reproduksi yang terdiri dari sepasang spikulum dan
gubernakulum. Pada saat kopulasi, spikulum yang diarahkan oleh gubernakulum
dimasukkan ke dalam untuk menyalurkan sperma. Pada ujung posterior tubuh
cacing jantan, ditemukan pelebaran kutikula yang disebut bursa kopulatriks.
Organ ini berfungsi membantu proses pelekatan cacing jantan dan betina pada
saat proses kopulasi (Gambar1).
Gambar 2. Siklus hidup H. contortus
H. contortus siklus hidupnya langsung dan terdiri dari fase pre-parasitik
(hidup bebas) di luar tubuh induk semang (inang), serta fase parasitik dalam
tubuh inangnya. Siklus dimulai dengan keluarnya telur yang diproduksi cacing
betina bersama tinja inang. Pada suhu dan kelembaban optimal (18-260C; 80-100% RH) telur akan menetas mengeluarkan larva stadium 1 (L1). Setelah
melalui dua kali molting larva tersebut kemudian berkembang menjadi L2 dan
selanjutnya L3 (larva infektif) dalam waktu 4-6 hari. Selanjutnya L3 berpindah ke
rerumputan atau batang semak. Domba akan terinfeksi bila memakan
rerumputan yang mengandung L3. Di dalam inang L3 akan berkembang dan
tumbuh menjadi (L4) atau disebut tahappradewasa. Selanjutnya L4 berkembang
menjadi larva5 (L5) atau tahapan dewasa yang siap bertelur pada hari ke-15
sampai ke-20 setelah infeksi (Urquhart et al. 1987) (Gambar 2).
Patogenesis
Gangguan Infeksi ditimbulkan ketika L4 dan cacing dewasa menghisap
darah pada mukosa abomasum. Setiap ekor cacing mampu menghisap 0,05 ml
darah setiap hari. Domba yang terinfeksi cacing mengalami kekurusan, kurang
darah dan kematian. Hipoproteinemia juga sering terjadi pada domba yang
terinfeksi serta mengakibatkan udema yang dikenal dengan istilah bottle jaw.
Epidemiologi dan pengendalian
Diperkirakan prevalensi infeksi cacing parasit gastrointestinal termasuk
cacing H. contortus mencapai 80% dari seluruh populasi ruminansia kecil (domba
dan kambing) di Indonesia (Satrija dan Beriajaya 1998). Penelitian di Jawa Barat
menunjukkan bahwa infeksi mulai terjadi pada awal musim hujan dan mencapai
puncaknya menjelang akhir musim hujan (Ridwan et al. 1996).
Penanggulangan penyakit haemonchosis umumnya dilakukan dengan
menggunakan obat nematoda (antelmintika) secara berkala, namun pemakaian
antelmintika secara terus-menerus akan menimbulkan galur nematoda yang
tahan (resisten) terhadap anthelmintika. Resistensi akan lebih cepat terjadi bila
dipakai terus menerus dengan dosis dan cara pemberian yang tidak tepat
(Waller 1997; Haryuningtyas et al. 2001).
Pengendalian hayati merupakan salah satu alternatif dalam upaya
pengendalian haemonchosis. Pada dasarnya pengendalian hayati adalah upaya
kerugian pada inangnya. Namun harus diingat bahwa agen tidak membunuh
seluruh populasi penyebab penyakit (Larsen 2000). Agen hayati pengendali
biologis harus aman bagi inang dan lingkungannya. Untuk memenuhi hal
tersebut perlu dipenuhi syarat-syaratnya yaitu aman, mudah didapat,
diperbanyak, dan mampu membunuh agen penyebab penyakit. Oleh karena itu,
meski banyak isolat yang tergolong nematofagus namun hanya sedikit yang
dapat digunakan.
Kapang Nematofagus D. flagrans
Klasifikasi dan morfologi
D. flagrans ialah kapang yang tergolong ke dalam kelas Deuteromycetes
dan famili Moniliaceae (Yeates 2000; Jacobs 2002). D. flagrans termasuk dalam
kelompok kapang bermitospora. Kapang ini berkembang biak secara aseksual
(anamorf), dengan bantuan spora (konidia)(Gambar 3). Berdasarkan analisis
sekuen 18S rDNA menunjukkan bahwa D. flagrans berkerabat dekat dengan
Arthrobotrys oligospora (Yeates 2000; Ahren 2002) sehingga kemampuan kedua
kapang tersebut sering dibandingkan.
Gambar 3. Klamisdospora (A) dan konidia (B) D.flagrans. Perbesaran 10 x 40, pewarnaan H.E
Habitat D. flagrans sama seperti kapang nematofagus lainnya yaitu
tumbuh pada suhu 20-30oC, kelembaban 90%, pH sedikit asam bergantung pada spesiesnya, memerlukan oksigen dan sedikit mineral, dapat tumbuh pada tanah
pertanian dan bekas pemeliharaan ternak. Mampu membentuk jerat pada
temperatur antara 10-35oC, dan setelah diinkubasi selama 3 minggu umumnya
A
B
akan membentuk klamidospora (Gronvold et al. 1996a). Klamidospora adalah
modifikasi dari hifa berupa penebalan dinding sel-sel hifa yang membentuk
struktur reproduksi, namun fungsi sebenarnya untuk mempertahankan diri.
Dalam bentuk klamidospora, D. flagrans tahan terhadap perubahan suhu, iklim
yang ekstrim. Kapang D. flagrans mempunyai beberapa keunggulan, yaitu tidak
menyebabkan terjadinya keracunan pada inang, efektif membunuh larva cacing
nematoda ternak dan mudah diaplikasikan (Larsen 2000).
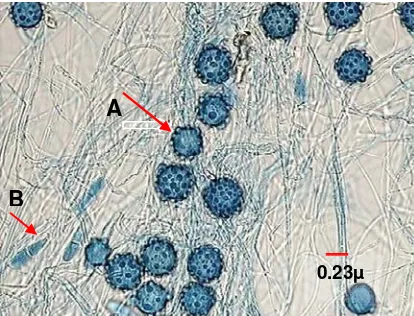
Mekanisme memangsa nematoda
D. flagrans termasuk golongan kapang nematofagus yang bekerja
mengendalikan parasit nematoda sebagai predator larva, membunuh cacing
dengan cara membuat perangkap terhadap larva infektif. Pada saat larva
bergerak mengenai hifa, kapang ini akan mengeluarkan zat kemoatraktan yang
mengandung sekresi. Larva yang tertarik datang, akan melekat pada hifa dan
selanjutnya dijerat oleh hifa vegetatif. Selanjutnya kapang mensekresikan enzim
pengurai kutikula untuk memudahkan hifa melakukan penetrasi pada kutikula
(Gronvold et al. 1993). Hifa vegetatif yang masuk ke dalam tubuh larva akan
tumbuh dan berkembang hingga larva akhirnya mati (Gambar 4).
Kapang D. flagrans mempunyai kemampuan memproduksi enzim
kitinase dan protease (Ahman 2000; Meyer dan Wiebe 2003) yang akan dipakai
dalam proses pengendalian parasit nematoda. Selain itu juga mempunyai
nematotoksin yaitu lektin yang diduga turut membantu di dalam membunuh larva
(Rosen 1996). Namun pada penelitian lain diketahui bahwa lektin dalam kapang
A. oligospora yang sekelas dengan D. flagrans tidak efektif membunuh larva
(Birck et al. 2004).
D. flagrans adalah kapang nematofagus pilihan untuk mengendalikan
larva parasit cacing nematoda pada ternak di masa kini dan mendatang. Pilihan
tersebut berdasarkan penelitian yang telah dilakukan sebelumnya (Gronvold et
al. 1993; Larsen 2000, Patra 2007). Kapang D. flagrans lebih efektif dan efisien
dalam membunuh larva nematoda dibandingkan dengan Arthrobotrys spp, meski
Arthrobotrys oligopora dapat memproduksi lebih banyak konidia dengan
perlakuan yang sama (Mendoza-Degives et al. 1999). Hal ini disebabkan
kemampuan D. flagrans untuk membentuk klamidospora.
Karakter D. flagrans isolat lokal
Isolat D. flagrans yang digunakan dalam studi ini merupakan isolat lokal
dari tanah asal Bogor pada tahun 2001. Karakterisasi isolat tersebut telah
dilakukan untuk mempelajari potensinya sebagai kapang nematofagus (Ahmad
2003). Kapang tersebut dapat tumbuh pada berbagai macam medium CMA,
PDA, SDA, tumbuh pada suhu 22 - 300C, dapat membuat jerat untuk larva infektif, mereduksi larva H. contortus, memerlukan cahaya, dan tahan disimpan
selama 4 bulan pada kulkas (suhu 4 - 100C)
Gambar 4. Mekanisme kapang pemangsa larva cacing
A. Konidia kapang nematofagus. B. Larva III H.contortus
(Sumber : Barron 1977)
Khamir S. cerevisiae
Klasifikasi dan morfologi
Saccharomyces cerevisiae ialah salah satu cendawan yang tergolong ke
dalam kelompok khamir. Berasal dari kata Saccharo (sugar) dan Myces (fungi)
yang artinya cendawan gula. Pada saat berkembang biak khamir akan
membelah diri dan menghasilkan tunas yang berkecambah multipolar. Tunas
yang terbentuk terdapat di seluruh permukaan dinding. Diameter spora
berukuran 5-10 µ. Khamir S. cerevisiae tergolong dalam kelas Saccharomycetes
dan famili Saccharomycetaceae (Dube 1996). S. cerevisiae merupakan khamir
bersel tunggal yang berkembang biak secara aseksual dan seksual dengan
cepat. Perkembangbiakan melalui tunas kecambah multipolar dan tunas dapat
terbentuk pada seluruh permukaan dinding sel (Gambar 5). Reproduksi seksual
membentuk askospora di dalam askus. Di dalam satu askus umumnya terdapat
4 buah askospora dengan berbagai bentuk. Khamir ini mempunyai ciri morfologi
mikroskopis membentuk blastospora (spora) yang berbentuk bulat lonjong,
silindris, oval atau bulat telur pendek dan panjangnya yang dipengaruhi oleh
strain (Elliot 1994; Dube 1996).
Gambar 5. Isolat S. cerevisiae , perbesaran 10 x 40, pewarnaan laktofenol blue. A. Sel spora
Menurut besarnya sel ada 3 kelompok khamir yaitu: Kelompok yang
pertama besar selnya berukuran (3,5-10,0) x (5,0-19)μ; kelompok yang kedua berukuran (3,0-8,0) x (4,0-18) μ dan kelompok ketiga (2,5-7,0) x (4,5-18) μ. Selain ketiga macam bentuk sel di atas, ada juga sel berfilamen yang terdapat
pada spora berukuran lebih besar dari 30 μ dan berpseudomiselium. Sedangkan morfologi makroskopik mempunyai koloni berbentuk bulat, warna putih, krim
abu-abu hingga kecoklatan, permukaan koloni berkilau sampai kusam, licin, dengan
tekstur lunak (Lodder 1970; Barnet et al. 2000).
Siklus hidup
Khamir ini mempunyai perubahan pada fase haploid dengan sebuah
diplofase yang sebenarnya. Strain haploid memiliki salah satu dari 2 tipe kawin
yaitu a dan α, dan sel-sel dengan tipe kawin berbeda dapat bercampur melakukan perkawinan. Peleburan ke dua sel diikuti dengan peleburan inti, dan
tunas pertama yang dihasilkan adalah zigote yang berisi sebuah inti yang
diploid. Diplo fase dibentuk sampai kondisi lingkungan cocok untuk menginduksi
terjadinya sporulasi, Keseluruhan sel dikonversi kedalam sebuah askus; terjadi
A
miosis dan dihasilkan 4 askospora. Germinasi dari askospora kembali lagi dari
permulaan haplofase (Elliot 1994).
S. cerevisiae dapat memproduksi beberapa macam enzim yang penting,
seperti kitinase dan protease untuk mendukung mekanisme dalam pengendalian
terhadap H.contortus bila diinduksi oleh kondisi tertentu (Carstens et al. 2003;
Poulsen et al. 2006). S. cerevisiae juga memiliki enzim-enzim lainnya seperti
asparaginase dan katalase serta berkemampuan berfermentasi, berasimilasi,
dan memperbanyak diri dengan cepat (Dunlop dan Roon 1975; Petrova et al.
2002; Selvaggini et al. 2004).
Pemanfaatan S. cerevisiae
S. cerevisiae telah banyak digunakan untuk kepentingan manusia mulai
zaman Mesir kuno dipakai sebagai ragi dalam pembuatan roti, sebagai
pengembang adonan. Sejalan dengan kemajuan teknologi, S. cerevisiae mulai
digunakan untuk berbagai keperluan bioteknologi khususnya rekayasa genetik.
Khamir ini diketahui sebagai genomik eukariotik pertama yang telah
disekuensing secara lengkap, dipakai untuk pengembangan pengetahuan dasar
tentang fungsi dan organisasi dari fisiologi dan sel genetika eukariotik. Selain itu
S. cerevisiae dapat digunakan sebagai probiotik, imunostimulan dan dipakai
sebagai vitamin B komplek. Di dalam industri alkohol digunakan pula sebagai
cendawan penghasil alkohol (etanol), pembuat bir. (Dube 1996: Ahmad 2005a).
Di bidang Veteriner dan Peternakan S. cerevisiae digunakan sebagai
probiotik, feed aditif bersama-sama dengan mikroba lainnya khususnya bakteri
yang menguntungkan untuk ternak seperti Bacillus pumilus, Lactobacillus
acidophilus, Streptococcus lactis (Shin et al. 1989). Sebagai probiotik S.
cerevisiae akan meningkatkan asupan nutrisi dengan cara mendapatkan lebih
banyak nutrisi dari sumber pakan ternak sehingga pada akhirnya akan
meningkatkan bobot badan domba dan sapi (Chaucheyras et al. 1996, 2005;
Callaway dan Martin 1997; Sullivan dan Martin 1999; Ratnaningsih 2000).
S. cerevisiae dapat digunakan sebagai imunostimulan pada hewan dengan cara
meningkatkan kesehatan hewan. Adapun bagian yang digunakan untuk bahan
imunostimulan adalah dinding sel S. cerevisiae khususnya bagian Beta glukan
dan Mannan. Imunostimulan digunakan untuk ternak hewan dan ikan di dalam
(Estrada et al. 1997; Fox 2002; Sitthipun et al. 2000), misalnya pada ayam
mampu menurunkan populasi Salmonella thyphimurium (Istiana et al. 2002).
Pengaruh terhadap reproduksi cacing
S. cerevisiae umumnya digunakan sebagai probiotik dan imunostimulan,
namun belum ada penelitian yang menggunakan cendawan ini sebagai
pengendali biologis. Pada percobaan pendahuluan pemberian S. cerevisiae
pada cacing tanah (Lumbricus sp.) dapat menaikkan bobot badan dan
menurunkan produksi kokon (telur). Pada media koprokultur S. cerevisiae dapat
menurunkan larva H. contortus baik dalam dosis tunggal maupun kombinasi
dengan D. flagrans.
Pemberian S. cerevisiae dalam jumlah tertentu, dapat merusak proses
spermatogenesis pada saluran reproduksi, pada kelinci terjadi karena
terhambatnya proses spermatogenesis pada tahap meiosis dan spermiogenesis.
Hal ini diduga adanya gangguan pembentukan dan pelepasan hormon
gonadotropin sebagai penyebab gangguan spermatogenesis pada testis (Pitojo
1995). Ada dugaan bahwa yang dirusak pada cacing H. contortus juga sistem
reproduksinya. Pengurangan jumlah larva pada telur cacing H. contortus yang
menetas pada percobaan pendahuluan, menunjukkan adanya kemampuan
S. cerevisiae di dalam membunuh, merusak telur cacing, merusak saluran
reproduksi cacing jantan dan betina di dalam domba dengan enzim-enzim yang
dimiliki S. cerevisiae.
Enzim
Enzim merupakan protein untuk katalis (percepatan) reaksi kimia. Enzim
berfungsi merubah bentuk suatu susunan molekul menjadi susunan lain yang
lebih sederhana berupa produk. Enzim bereaksi secara spesifik, dan bekerja
seperti kunci dan gembok, artinya suatu aktivitas enzim hanya bereaksi terhadap
susunan molekul tertentu. Aktivitas kerja enzim dipengaruhi oleh beberapa faktor
seperti inhibitor (memperlambat reaksi), aktivator (mempercepat reaksi), kofaktor,
koenzim, suhu, pH, dan konsentrasi dari substrat (Lexicon 2007; Medicine,
2007).
Enzim kitinase adalah enzim pencerna yang memecah ikatan glikosida
dalam kitin, menghidrolisis kitin menjadi kitosan (Somashekar dan Joseph 1996).
pertama Endokitinase mereduksi polimer menjadi oligomer. Selanjutnya oligomer
berdegradasi menjadi monomer oleh eksokitinasekitobiase. Enzim-enzim ini
disintesa oleh arthropoda, nematoda, protozoa, dan moluska (Muzzarelli 2002).
Enzim protease adalah enzim yang memecah protein menjadi peptida
atau ikatan asam amino yang lebih sederhana. Protease terdiri dari asam
aspartat, asam glutamik cysteine metallo, serine, dan threonine. Protein sendiri
mempunyai arti kumpulan asam amino yang disusun oleh rantai linier yang
mempunyai gugus karboksil dan amin nitrogen, polimer linier yang dibuat dari 20
L-α asam amino yang berbeda.
Kitin mempunyai arti berbeda yaitu polisakarida yang tidak larut terdiri dari
β (1-4) berikatan dengan N-asetil D-Glukosamin (GLc Nac) unit. Kitin merupakan polisakarida yang banyak ditemukan di alam sebagai komponen struktur
kepiting, serangga, cacing, cendawan dan tumbuhan lain. Polimer kitin umumnya
membentuk diameter 3 nm dan stabil dalam bentuk ikatan hidrogen antara gugus
amin dan karbonil (Gooday 1994). α kitin adalah bentuk yang ada pada nematoda dan umumnya ditemukan sebagai komponen struktur pembentuk
rangka lainnya seperti protein dan glukan, ditemukan sebanyak 20-38% pada
cacing (Skjak-Braek et al. 1989).
Kemampuan kedua cendawan tersebut, yang diduga memiliki enzim
kitinase dan protease akan mampu berpotensi sebagai nematofagus dalam
mereduksi larva. Kedua enzim yang tergolong enzim hidrolitik diperlukan dalam
mekanisme membunuh nematoda. Dukungan kandungan enzim tersebut
digunakan untuk menetrasi dinding kutikula larva, yang umumnya terdiri dari
protein dan kitin sebagai bahan penyusun dinding (Anke 1997).
Pada akhirnya penggunaan kedua macam cendawan ini akan
menurunkan populasi H. contortus baik dalam jumlah telur, maupun larvanya
bila hidup bersama dalam satu media. Kerja sinergis inilah yang diharapkan
dalam membunuh cacing, karena kapang D. flagrans mempunyai target
membunuh larva di luar tubuh domba. Selain itu khamir S. cerevisiae dan
kapang D.flagrans targetnya adalah merusak saluran reproduksi cacing larva dan
TEMPERATUR, RUMEN DAN LAMA PENYIMPANAN
Abstract
Saccharomyces cerevisiae yeast has been used for various purposes in attempting to enhance human health as well as improving livestock productivity. Our preliminary experiment indicated possible use of S.cerevisiae in biological control of parasitic nematodes. In order to utilize this yeast as a biological control agent for parasitic worm in sheep, it is necessary to study growth characteristics of S. cerevisiae local isolate. The yeast was isolated from fermented cassava from Cianjur, West Java. One of the factors influenced the growth of yeast is environmental factor such as type of medium, light, rumen, and temperature. The viability of yeast cell after storage was also important to be studied for developing a good quality of biological control agent. Hence, the aim of this research was to analyze the effect of environmental factor on the growth of S. cerevisiae and the viability of the yeast cells after storage. The growth analyses were carried out using solid and liquid medium of Bacto Agar, Corn Meal Agar, Sabouraud Dextrose Agar, Potato Dextrose Agar and Sabouraud Dextrose Broth. The effect of light was studied by exposed the culture to light with the intensity of sun for 3 days. The effect of sheep rumen fluid analysed by adding the filtered rumen fluid into the medium and 4 temperature treatments, 22-310C, 250C, 370C, and 390C were used to study the optimal growth temperature. The viability of the cell was studied by storing the yeast culture for 1 and 12 months at 4-100C. The results showed that the growth of yeast was not affected by the type of medium; application of light, rumen fluid and temperature. The viability of yeast cell was also not affected by the storage treatment until 12 months at 4-100C.
Key words: S. cerevisiae, environmental factor, rumen, viability after storage
Abstrak
Khamir Saccharomyces cerevisiae telah dimanfaatkan untuk berbagai tujuan terkait dengan peningkatan kesehatan manusia dan produktivitas ternak. Penelitian pendahuluan mengindikasikan kemungkinan pemanfaatan S.cerevisiae untuk pengendalian hayati nematoda parasit. Untuk itu perlu dilakukan penelitian tentang khamir ini sebagai agen pengendali hayati cacing parasit, maka perlu dipelajari karakterisasi S. cerevisiae isolat lokal. Khamir ini diisolasi dari singkong yang difermentasi dari Cianjur Jawa Barat. Satu faktor yang mempengaruhi pertumbuhan khamir adalah faktor lingkungan seperti jenis tipe medium, cahaya, rumen dan suhu. Viabilitas dari sel khamir sesudah disimpan juga penting untuk menjadi pelajaran pengembangan kualitas yang baik bagi agen pengendali hayati. Tujuan dari penelitian ini untuk menganalisa pengaruh faktor lingkungan terhadap pertumbuhan
dilakukan dengan menggunakan medium padat dan cair dari Bacto agar, Corn Meal agar, Sabouraud Dextrose Agar, Potato Dextrose Agar dan Sabouraud Dextrose Broth. Pengaruh cahaya dipelajari dengan cara kultur diekspose dengan cahaya matahari selama 3 hari. Pengaruh dari rumen domba dianalisa dengan menambahkan cairan rumen yang telah difiltrasi ke dalam medium dan 4 perlakuan suhu yaitu 22-310C, 250C, 370C dan 390C dipelajari untuk mendapatkan suhu yang optimal bagi pertumbuhan. Viabilitas dari sel dipelajari melalui penyimpanan kultur khamir dalam waktu 1 dan 12 bulan pada suhu 4-10oC. Penelitian ini menunjukkan bahwa pertumbuhan khamir tidak dipengaruhi oleh jenis medium, aplikasi cahaya, cairan rumen dan temperatur. Viabilitas dari sel khamir tidak juga dipengaruhi oleh perlakuan penyimpanan sampai dengan 12 bulan pada suhu 4-10oC.
Kata kunci : S. cerevisiae, faktor lingkungan, rumen, viabilitas sesudah disimpan
PENDAHULUAN
Saccharomyces cerevisiae ialah salah satu cendawan yang tergolong ke dalam kelompok khamir (yeast). Dalam bidang veteriner, peternakan dan perikanan
S. cerevisiae sering digunakan sebagai probiotik dan imunostimulan (Estrada et al,
1997; Fox 2002; Sitthipun et al. 2000 Chaucheyras et al. 1996, 2005; Ratnaningsih 2000), Hal ini karena aktivitas S.cerevisiae dapat meningkatkan atau merangsang pertumbuhan bakteri pencerna serat dan mikroba penghasil protein rumen pada ternak ruminansia (Estrada et al. 1997; Chaucheyras et al. 1996). Seperti umumnya cendawan sejati lainnya, dinding sel S. cerevisiae mengandung β glukan yang tinggi. β glukan merupakan salah satu bahan bioaktif yang berfungsi sebagai imunostimulan pada hewan, karena dapat merangsang pertumbuhan sel-sel limfosit T dan B .
Hasil penelitian kami sebelumnya menunjukkan bahwa S. cerevisiae isolat lokal yang diisolasi dari tape asal Cianjur dapat menekan pertumbuhan bakteri penyebab salmonelosis pada dan menurunkan produksi telur (kokon) cacing tanah (Lumbricus sp) (Istiana et al. 2002). Hal ini membuka peluang kemungkinan pemanfaatan S.cerevisiae dalam pengendalian hayati cacing parasit pada domba. Hasil penelitian pendahuluan yang dilakukan pada disertasi ini menunjukkan bahwa
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Laboratorium Mikologi, Balai Besar Penelitian Veteriner, Departemen Pertanian, Bogor. Penelitian dilakukan selama 13 bulan yang dimulai bulan Maret tahun 2006 sampai dengan bulan April tahun 2007.
Disain Penelitian
Penelitian ini dilakukan untuk mempelajari pertumbuhan S.cerevisiae isolat lokal (Istiana et al. 2002) yang mendapat berbagai perlakuan yaitu cahaya, cairan rumen, jenis medium, suhu, dan lama penyimpanan. Media yang digunakan adalah media cair Sabouroud Dextrosa Broth (SDB) dan berbagai macam media agar yaitu; Bacto Agar (BA), Corn Meal Agar (CMA), Potato Dextose Agar (PDA) dan
Sabouroud Dextrosa Agar (SDA); intensitas cahaya yaitu gelap dan terang; Berbagai suhu inkubasi yaitu 22-310C, 250C, 370C dan 390C; lama penyimpanan yaitu 1 bulan dan satu tahun dan selama periode penyimpanan yaitu 2; 3; 4; 5 dan 6 bulan; kemudian uji pertumbuhan terhadap penambahan cairan rumen yaitu dengan dan tanpa penambahan cairan rumen pada media SDA. Pengamatan dilakukan secara kualitatif dan kuantitatif.
Teknik perbanyakan
Sebelum S..cerevisiae digunakan, khamir ini diperbanyak dengan cara menginokulasikan isolat tersebut pada media SDA. Selanjutnya kultur diinkubasi pada suhu kamar (min 220C – maks 310C) selama 3 hari. Setelah kultur berumur 3 hari selanjutnya disimpan di dalam lemari es sampai digunakan untuk uji lanjut.
Teknik Inokulasi
Teknik Penghitungan
Jumlah sel S.cerevisiae yang ditumbuhkan pada media padat dihitung dengan cara menambahkan 5 ml aquades steril pada media, lalu kultur dikerok dan dihomogenkan. Sebanyak 1 ml larutan kultur diencerkan sampai 100 kali pengenceran. Selanjutnya 0,2 mm2 larutan kultur dimasukan ke dalam hemositometer dan jumlah spora dihitung dengan pembesaran 400 kali. Penghitungan jumlah sel S. cerevisiae pada media cair dilakukan dengan cara mengambil 1 ml larutan kultur dan diencerkan 10 kali, kemudian 0,2 mm2 larutan kultur dimasukan ke dalam hemositometer untuk dilakukan penghitungan jumlah sel cendawan.
Uji pengaruh medium terhadap pertumbuhan cendawan
Isolat S. cerevisiae yang telah diperbanyak diuji pertumbuhannya pada medium cair SDB dalam tabung (volume 20 ml) dan cawan-cawan Petri (ø : 5 cm) yang berisi medium SDA, PDA, CMA dan BA (Waller et al. 1994). Masing-masing perlakuan diulang sebanyak 3 ulangan. Kultur kemudian diinkubasikan pada suhu 250C selama 3 hari. Pengamatan dilakukan setiap hari dan pemanenan dilakukan pada hari ke-3 setelah inokulasi dengan menghitung jumlah sel yang terbentuk menggunakan hemositometer.
Uji pengaruh cahaya terhadap pertumbuhan cendawan
Uji pengaruh suhu terhadap pertumbuhan cendawan
Pengujian dilakukan pada media cair SDB Sebanyak 1,65 x 1010 sel
S. cerevisiae diinokulasikan pada tabung reaksi bervolume 10 ml yang berisi 9 ml medium SDB, kemudian diinkubasikan selama 3 hari pada suhu 22-310C; 250C; 370C; dan 390C. Masing-masing perlakuan diulang sebanyak 3 ulangan. Panen dilakukan pada hari ke 3 setelah inokulasi dengan cara menghitung jumlah sel menggunakan hemositometer.
Uji pengaruh lama penyimpanan terhadap pertumbuhan cendawan
Pengujian dilakukan pada media padat SDA. Satu jarum ose S. cerevisiae
ditumbuhkan pada media padat SDA dan diinkubasi pada suhu 25°C selama 3 hari. Kultur selanjutnya disimpan di dalam lemari es bersuhu 4-140C selama 1 hari; 1; 2; 3; 4; 5; dan 6 bulan dan 1 tahun. Pada saat panen sel dihitung dengan hemositometer.
Uji pengaruh cairan rumen terhadap pertumbuhan cendawan
HASIL DAN PEMBAHASAN
Pengaruh medium terhadap pertumbuhan
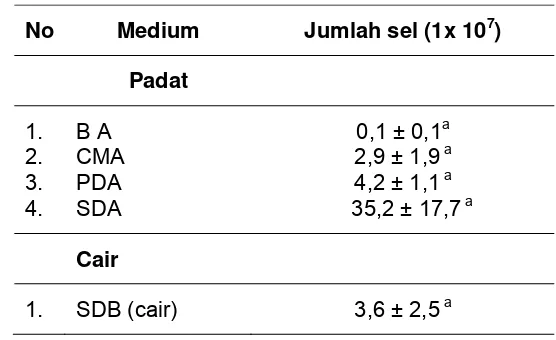
S. cerevisiae dapat tumbuh pada kedua bentuk media yaitu media padat dan media cair, Pertumbuhan S. cerevisiae pada media padat berkisar antara 1 x 106 dan 3,5 x 108 sel/ cawan , sedangkan pada media cair ialah 3,6 x 107 sel/tabung. Masing-masing cawan Petri dan tabung mengandung media dalam jumlah yang sama yaitu10 ml. Pertumbuhan S.cerevisiae terbaik pada media padat terjadi pada media SDA (Gambar 6). Dalam waktu tiga hari isolat yang ditumbuhkan dalam media tersebut mencapai 3,52 x 108 jumlah sel dalam setiap cawan Petri (Tabel 1). Pertumbuhan paling lambat terdapat pada medium BA dengan jumlah sel cendawan sebanyak 1 x 106 .untuk setiap cawannya. Pertumbuhan S. cerevisiae pada kedua media lainnya yaitu CMA dan PDA menghasilkan jumlah sel cendawan yang hampir sama yaitu antara 2,9 – 4,2 x 107.
asam-asam amino. Sedangkan kalium, dan magnesium digunakan untuk elemen fungsional aktif dalam metabolisme (Dube 1996; Griffin 1994).
[image:38.612.178.456.380.550.2]Meski di dalam inokulasi pada media SDA lebih banyak inokulum yang diberikan pada media cair (1,65 x 1010 sel) dibandingkan dengan media padat (1 x 106 sel), namun hasil pengamatan pada 3 hari setelah inokulasi menunjukkan populasi sel pada media padat lebih tinggi dari media cair. Hal ini diduga karena terdapat perbedaan dari faktor yang mempengaruhi pertumbuhan cendawan pada media padat dan cair. Rendahnya ketersediaan oksigen dan mudahnya limbah metabolisme sel cendawan terlarut pada media cair yang meracuni sel cendawan, diduga dapat menurunkan populasi cendawan pada media cair SDA pada hari ke-3 setelah inokulasi. Populasi cendawan pada media SDA padat, hampir sepuluh kali lebih besar dari populasi pada media cair. Namun perbedaan ini secara statistik tidak signifikan (Tabel 1).
Tabel 1. Pertumbuhan S. cerevisiae pada berbagai macam medium setelah diinkubasi selama 3 hari pada suhu kamar (22-310C)
No Medium Jumlah sel (1x 107)
Padat
1. B A 0,1 ± 0,1a 2. CMA 2,9 ± 1,9a 3. PDA 4,2 ± 1,1a 4. SDA 35,2 ± 17,7a
Cair
1. SDB (cair) 3,6 ± 2,5 a
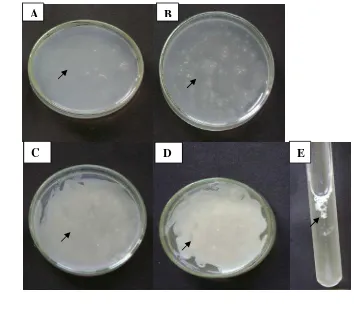
Gambar 6. Pertumbuhan S.cerevisiae (tanda panah) pada berbagai macam medium A. (Bacto Agar) (BA). B (Corn Meal Agar) CMA. C. (Potato Dextrose Agar) (PDA) D. Sabouraud Dextrosa Agar (SDA) E. (
raud Dextrose Broth) (SDB) pada suhu kamar (min 220C– maks 310C ) dan setelah diinkubasi 3 hari.
Pengaruh cairan rumen terhadap pertumbuhan
Gambar 7 dan Tabel 2 menunjukkan bahwa jumlah populasi S. cerevisiae
tidak berbeda (3,3 dan 3,4 x 107 spora) serta dapat bertahan hidup, tumbuh dengan baik pada media yang mengandung cairan rumen steril dari domba maupun tanpa diberi cairan. Meskipun di dalam cairan rumen steril tersebut terdapat berbagai macam enzim seperti pepsin dan renin dengan bersifat asam kurang lebih pH 5.
S. cerevisiae masih dapat beradaptasi serta tumbuh dengan baik. Hal ini dapat dikatakan bahwa secara in vitro S. cerevisiae dapat tumbuh dengan baik pada cairan rumen.
Sebagai agen pengendali hayati parasit pada rumen domba, S. cerevisiae
harus mampu tumbuh pada rumen domba tidak saja secara in vitro juga secara in vivo. Uji secara in vivo dilakukan pada percobaan III dan IV pada Disertasi ini.
D
E
C
[image:40.612.208.398.82.333.2]
Gambar 7. Pertumbuhan S.cerevisiae (tanda panah) dengan perlakuan. A. Cahaya dan B. Tanpa cahaya C. Kontrol. D. Dengan cairan rumen atau E. Tanpa cairan rumen diinkubasi 3 hari pada suhu kamar
Gambar 8. Pertumbuhan S.cerevisiae (tanda panah) pada berbagai macam suhu A. Suhu kamar (min 22 0C–maks 310C ) B, 250C.C. 370C. D.390C.
diinkubasi 3 hari pada media Sabouroud Dextrosa Broth (SDB).
A
B
C
D E
B
[image:40.612.199.403.419.606.2]Pengaruh suhu terhadap pertumbuhan
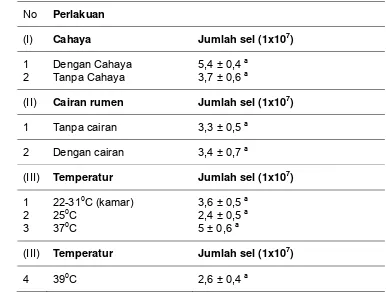
Tabel 2 dan Gambar 8 juga menunjukkan bahwa S. cerevisiae memiliki kisaran suhu untuk tumbuh yang lebar yaitu 20-390C dengan pertumbuhan optimum pada suhu 370C. Suhu optimum yang diperoleh pada percobaan ini berbeda dengan yang dilaporkan oleh Onions (1986) dan Griffin (1994) yaitu 280C. Perbedaan suhu optimum yang diperoleh diduga disebabkan oleh perbedaan strain S. cerevisiae
yang digunakan.
Walaupun dengan jumlah populasi yang lebih rendah, S. cerevisiae isolat lokal yang digunakan pada penelitian ini mampu tumbuh pada suhu 39oC yaitu suhu rata-rata pada rumen domba dengan jumlah populasi yang terbentuk cukup tinggi yaitu 2,6 x107 spora.
[image:41.612.119.505.414.707.2]Kisaran suhu pertumbuhan S. cerevisiae yang relatif luas (200C sampai dengan 400C) memungkinkan khamir ini dapat tumbuh dengan baik di luar maupun di dalam rumen domba sebagai inang dari parasit H. contortus.
Tabel 2. Pengaruh cahaya, pemberian cairan rumen, lama penyimpanan dan temperatur terhadap pertumbuhan S. cerevisiae pada umur 3 hari setelah inokulasi sel
No Perlakuan
(I) Cahaya Jumlah sel (1x107)
1 Dengan Cahaya 5,4 ± 0,4 a 2 Tanpa Cahaya 3,7 ± 0,6 a
(II) Cairan rumen Jumlah sel (1x107) 1 Tanpa cairan 3,3 ± 0,5 a
2 Dengan cairan 3,4 ± 0,7 a
(III) Temperatur Jumlah sel (1x107) 1 22-310C (kamar) 3,6 ± 0,5 a
2 250C 2,4 ± 0,5 a 3 370C 5 ± 0,6 a
(IV) Lama Penyimpanan Jumlah sel (1x107) 1 1 hari 6,3 ± 0,4 a
2 1 tahun 3,5 ± 0,2 a
[image:42.612.136.505.87.147.2]Keterangan: Angka-angka dengan huruf yang sama superskrip tidak berbeda nyata (P>0,05)
Gambar 9 . Pertumbuhan S.cerevisiae setelah disimpan (tanda panah) (A). Umur 1 hari. (B) umur 1 tahun pada media SDA dan SDB (C). Kontrol. Inkubasi 3 hari pada suhu kamar (22-310C).
Pengaruh lama penyimpanan terhadap pertumbuhan
Tabel 2 dan Gambar 9 menunjukkan pengaruh lamanya waktu simpan di dalam kulkas dengan suhu kurang lebih 4-100C selama satu tahun. Hasil pengamatan menunjukkan bahwa terdapat penurunan jumlah sel hampir 50% pada umur satu tahun walaupun secara statistik tidak berbeda nyata. Selain itu, jumlah sel yang dihasilkan dan viabilitasnya maísih relatif tinggi sebagai sumber inokulum yaitu 3,5 x 107 sel per cawan Petri.
Pada percobaan pendahuluan diketahui bahwa dengan dosis tertentu khamir ini dapat mereduksi larva cacing. Pada percobaan ini didapat hasil S.cerevisiae
isolat lokal dapat tumbuh pada berbagai macam medium, suhu, intensitas cahaya dan tahan disimpan dalam kulkas (4-100C) sampai dengan 1 tahun.
Berdasarkan data dari hasil uji kemampuan tumbuh pada berbagai faktor lingkungan yang berhubungan dengan kondisi rumen domba secara in vitro menunjukkan bahwa S. cerevisiae mampu tumbuh pada baik pada lingkungan
[image:42.612.110.489.197.349.2]rumen maupun luar rumen. Selain itu khamir ini dapat tumbuh pada berbagai macam media semisintetis dan mempunyai viabilitas yang cukup baik pada daya simpan satu tahun. Hal ini menjadikan S. cerevisiae merupakan isolat yang potensil sebagai agen pengendali hayati cacing parasit H. contortus. Uji lanjut untuk mengetahui sifat-sifat S. cerevisiae pada kondisi in vivo akan dilakukan pada percobaan tahap ke III dan IV. Berdasarkan tersedianya informasi yang lengkap tentang S. cerevisiae dari hasil uji in vitro dan in vivo diharapkan penggunaan
S.cerevisiae dapat menghasilkan dampak pengendalian cacing parasit yang optimal karena dapat mereduksi cacing di dalam dan di luar tubuh tubuh hewan. Sementara cendawan D. flagrans yang digunakan sebagai agen pengendali hayati cacing parasit tersebut hanya dapat membunuh larva infektif H. contortus di luar tubuh inang dengan cara menjeratnya. Sehingga timbul dugaan sementara bahwa
S. cerevisiae lebih unggul di dalam mereduksi cacing H.contortus dibandingkan dengan D. flagrans. Namun dugaan ini harus dibuktikan dengan pengujian terhadap
kemampuan khamir dalam mengendalikan larva, telur dan cacing dewasa
H. contortus. Pengujian akan dilakukan secara bertahap melalui uji in vitro dan in vivo.. Selain itu, mekanisme S. cerevisiae dalam mengendalikan cacing juga perlu dipelajari untuk mendapatkan hasil yang optimal dari pengendali hayati cacing parasit. Salah satu mekanisme pengendalian yang dilakukan oleh S. cerevisiae
KESIMPULAN
• Dari kelima uji terhadap pertumbuhan S. cerevisiae yang meliputi pengaruh berbagai macam medium, intensitas cahaya, temperatur, dan penambahan cairan rumen serta uji lamanya waktu simpan menunjukkan bahwa khamir tersebut memiliki potensi untuk digunakan sebagai agen pengendali hayati parasit cacing pada domba.
• S.cerevisiae dapat tumbuh pada berbagai macam medium (BA, CMA, SDA, PDA (medium padat), dan SDB (medium cair); kisaran suhu pertumbuhan cukup luas yaitu dari 22-310C; 250C; 370C sampai 390C.
Duddingtonia flagrans
DAN
Saccharomyces cerevisiae
Abstract
Chitinase and protease enzymes are needed by nematophagous fungi in the nematode killing mechanisms. The aim of this experiment is to study the activity of chitinase and protease enzymes as well as attractants that may be possessed by nematophagous fungi Duddingtonia flagrans and Saccharomyces cerevisiae. The measurement of intra cellular enzymes were conducted by sonicating the isolates, adding some chemicals, and then reading in spectrophotometer. The measurement on the activity of extra cellular enzymes was done by adding a trigger (protein or chitin) in isolates, incubating them for 4 days, adding some chemicals, and then reading in spectrophotometer. The result of experiment showed that intra cellular protease activitiy in D.flagrans (7.1315 units/gr) was significantly higher (P<0.05) than that of S. cerevisiae (0.0052 unit/gr). The activitiy of chitinase in D.flagrans and S. cerevisiae were 3.1812 units/gr and 4.2563 units/gr, this value was not significantly different (P<0.05). The activity of extra cellular chitinase of S. cerevisiae (2.1810 units/gr) was significantly higher (P<0.05) than that of D. flagrans (2.172 units/gr). The content of intra cellular proteases of both fungi were very weak (< 0.0003 unit/gr). The S. cerevisiae attractant was stronger than that of D. flagrans (45% vs 40%).
Key words: D. flagrans, S.cerevisiae, chitinase, protease
Abstrak
Enzim kitinase dan protease diperlukan cendawan nematofagus di dalam mekanisme membunuh cacing nematoda. Tujuan dari percobaan ini untuk mempelajari aktivitas enzim kitinase dan protease serta atraktan yang mungkin dimiliki cendawan nematofagus Duddingtonia flagrans dan Saccharomyces cerevisiae. Pengukuran aktivitas enzim intra seluler dilakukan dengan cara menyonikasi isolat, ditambahkan beberapa reaksi kimia dan dibaca pada spektrofotometer. Pengukuran aktivitas enzim ekstra seluler dilakukan dengan cara menambahkan trigger (protein atau kitin) pada isolat lalu diinkubasikan selama 4 hari, ditambahkan beberapa pereaksi kimia, dan kemudian dibaca aktivitasnya pada spektrofotometer. Hasil percobaan ini menunjukkan bahwa aktivitas protease intra seluler pada D.flagrans (7,1315 unit/gr) lebih kuat dibandingkan dengan S. cerevisiae 0,0052 unit/gr (P<0,05). Aktivitas kitinase intra seluler pada D.flagrans dan S. cerevisiae tidak berbeda nyata secara berurutan yaitu masing-masing sebesar: 3,1812 unit/gr dan 4,2563 unit/gr. S. cerevisiae memiliki enzim kitinase ekstra seluler yang akitivitasnya (2,181unit/gr) lebih kuat (P<0,05) dibandingkan dengan D.flagrans (2,172 gr/unit). Kandungan protease ektra seluler kedua cendawan sangat lemah (< 0,0003 unit/gr).Atraktan
S. cerevisiae (45%) lebih kuat dari atraktan D.flagrans (40%).
PENDAHULUAN
Cendawan nematofagus secara alamiah menjadikan nematoda hidup
bebas maupun parasit hewan dan tumbuhan sebagai salah satu sumber nutrisi
utamanya. Untuk merubah tubuh dan telur cacing menjadi sumber nutrisi,
cendawan menggunakan enzim kitinase dan protease pada saat menembus
kutikula, selanjutnya hifa vegetatif akan tumbuh di dalam tubuh cacing. Protease
juga berfungsi merubah protein menjadi asam amino yang diperlukan untuk
nutrisi dari cendawan tersebut. Kedua enzim yang tergolong enzim hidrolitik
saling bekerja sama pada saat penetrasi pelindung telur dan cacing mengandung
lapisan kitin dan protein (Croll dan Matthew 1977). Lapisan struktur pelindung
larva cacing dan telur tersebut, akan dilisiskan kemudian cendawan akan masuk
dan mengambil nutrisi.
Di dalam pengendalian hayati cacing parasit termasuk H. contortus
kemampuan cendawan untuk membunuh cacing dipengaruhi oleh konsentrasi
enzim yang dikandungnya. Studi yang telah dilakukan Huang et al. (2004) dan
Yang et al. (2007) menunjukkan bahwa beberapa enzim hidrolitik ekstra seluler
seperti serine protease, kitinase dan kolagenase sangat membantu dalam proses
penetrasi ke dalam tubuh nematoda sehingga menjadi salah satu faktor
patogenitas cendawan. Selanjutnya Park et al. (2002) melaporkan bahwa kapang
Arthrobotrys spp, Dactylellina spp, Dactylella spp, Gamsylella spp dan
Harposporium leptospira diketahui memiliki aktivitas protease dan ligninase
setelah diuji metabolit yang dihasilkannya melalui proses induksi oleh media.
Sejalan dengan studi tersebut Ahman et al. (1996), Ahman (2000), Meyer dan
Wiebe (2003) telah melakukan uji aktivitas enzim protease dan kitinase yang
dikandung oleh kapang D.flagrans.
Oleh karena itu penting kiranya diketahui aktivitas serta kandungan enzim
kitinase dan protease pada kapang D. flagrans dan khamir S. cerevisiae isolat
lokal yang akan digunakan sebagai pengendali hayati terhadap cacing
H.contortus. Penelitian ini dirancang untuk mempelajari aktivitas enzim intra
seluler dan ekstra seluler yang terkandung oleh cendawan D. flagrans dan S.
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan di Pusat Penelitian Sumber Daya Hayati dan
Bioteknologi IPB, dan Balai Besar Penelitian Veteriner. Penelitian ini dilakukan
selama 7 bulan dimulai bulan Mei sampai dengan bulan Desember tahun 2006.
Isolat Cendawan
D. flagrans yang digunakan diisolasi dari tanah Kebun Raya Bogor. Isolat
ini telah dikarakterisasi dapat membunuh larva H.contortus dan dapat tumbuh
pada suhu 200C sampai dengan 370C dalam berbagai media seperti CMA, PDA (Ahmad 2003). Isolat S. cerevisiae yang digunakan diisolasi dari Cianjur pada
tahun 2002 (Istiana et al. 2002). Kedua isolat lokal diperbanyak dari biakan yang
disimpan dalam media Sabouraud Dextrosa Agar (SDA) dan diremajakan setiap
4 bulan.
Teknik Perbanyakan
Isolat lokal S. cerevisiae yang akan diuji, diperbanyak dengan cara
menginokulasikan pada media agar Corn Meal Agar (CMA) dan menginkubasi
isolat pada suhu kamar (min 22oC- maks 30oC) selama 4 hari. Sedangkan isolat
D.flagrans diperbanyak pada media agar Potato Dekstrosa Agar (PDA) pada
suhu kamar (min 22 oC –maks 300C) selama 10 hari.
Teknik Pemanenan
Pada cawan Petri berisi isolat yang dipanen ditambahkan air steril
secukupnya, lalu dikerok dengan gelas penutup. Selanjutnya isolat dipindahkan
ke dalam tabung dan disimpan dalam refrigerator (4-10o C) sebelum digunakan.
Desain Penelitian
Uji yang dilakukan terhadap isolat adalah uji kandungan enzim dan
atraktan. Setiap uji dilakukan dalam 3 ulangan seperti sebagai berikut di bawah
Persiapan Isolat untuk Pemeriksaan Enzim
Isolat-isolat lokal yang telah diperbanyak kemudian dipanen, selanjutnya
dilakukan pengujian aktivitas kandungan enzim kitinase dan protease khamir
S. cerevisiae dan kapang D. flagrans. Kapang dan khamir tersebut disonikasi,
lalu diperiksa aktivitas kandungan intra seluler enzim kitinase dan protease yang
dimilikinya. Sedangkan untuk uji kandungan enzim ekstra seluler ditambahkan
trigger (kitin atau protein sebanyak 2% B/V dari berat cendawan yang diuji), lalu
diinkubasikan 2 hari pada suhu kamar kemudian diperiksa aktivitas enzimnya.
Pengukuran Aktivitas Kitinase.
Pemeriksaan aktivitas kitin dilakukan menurut Imoto dan Yagashita
(1971) yang telah dimodifikasi dalam beberapa tahap seperti sebagai berikut;
a. Penyiapan koloidal kitin.
Ke dalam Erlenmeyer dimasukkan 20 gr kitin dan 400 ml HCl pekat, lalu
ditutup rapat dan dibiarkan semalam pada temperatur 4oC. Keesokan harinya larutan tersebut disaring dengan menggunakan glasswool. Filtrat yang didapat
ditambah 200 ml air dingin dan pH larutan diatur menjadi 7,0 dengan
menambahkan secara perlahan-lahan NaOH 10 N. Setelah disentrifugasi pada
7000 rpm, suhu 4oC selama 10 menit, filtrat dibuang dan pelet ditambahkan dengan air dingin sebelum disentrifugasi sekali lagi. Pelet (koloidal kitin) yang
didapat disimpan pada 4oC.
b. Pengukuran aktivitas kitinase.
Aktivitas enzim kitinase ditentukan berdasarkan jumlah N-asetil-D
glukosamin yang dibebaskan hidrolisa substrat koloidal kitin. Senyawa
N-asetil-D- glukosamin diukur dengan metode Schales (Imoto dan Yagashita 1971) yang
telah dimodifikasi. Satu unit aktivitas dinyatakan sebagai jumlah
N-asetil_D-glukosamin (M mol) yang terbentuk permenit pada kondisi assainya.
Untuk mengukur aktivitas enzim kitinase setiap contoh diikuti dengan
kontrol. Contoh terdiri dari 200 μl substrat kol