BAB I
PENDAHULUAN 1.1 Latar Belakang
Kekayaan jenis tumbuhan di Indonesia sangat bervariasi, termasuk didalamnya tumbuhan yang dapat dimanfaatkan sebagai obat. Namun informasi tentang nama maupun kandungan dan ramuannya belum banyak diteliti sehingga pemanfaatan tumbuhan untuk tujuan pengobatan hanya didasarkan pada pengalaman turun-temurun (Mursito, 2001).
Tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) suku Myrtaceae merupakan salah satu tanaman berkhasiat obat yang banyak digunakan oleh masyarakat, khususnya masyarakat Tapanuli. Bagian yang digunakan adalah daun, buah, biji dan akar. Biasanya digunakan untuk mengobati disentri, sakit perut, obat luka, gangguan pencernaan, hepatitis, keputihan, sariawan, wasir darah, pendarahan rahim, haid, radang dinding pembuluh darah dan penghilang rasa haus.
Kandungan kimia daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) mengandung saponin, tanin, triterpenoid/steroid, flavonoida (Anonim 1, 2007).
Berdasarkan hal di atas maka peneliti tertarik untuk mengisolasi senyawa triterpenoid/steroid yang terdapat pada daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) dengan cara maserasi menggunakan pelarut etanol 80 %. Lalu ekstrak etanol difraksinasi dengan n-heksan. Selanjutnya dianalisis dengan kromatografi lapis tipis (KLT). Dilanjutkan dengan kromatografi kolom dan senyawa hasil isolasi di karakterisasi secara spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
1.2 Perumusan Masalah
1. Apakah senyawa triterpenoid/steroid dapat di ekstraksi secara maserasi dengan pelarut etanol 80 % lalu difraksinasi dengan n-heksan
2. Apakah senyawa triterpenoid/steroid dapat di isolasi dengan cara KLT dan kromatografi kolom dengan menggunakan pelarut landaian.
3. Apakah senyawa triterpenoid/steroid hasil isolasi dapat di karakterisasi secara spektrofotometri UV dan spektrofotometri IR.
1.3 Hipotesis
1. Senyawa triterpenoid/steroid yang terdapat pada daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) dapat di ekstraksi secara maserasi dengan etanol 80 % lalu difraksinasi dengan n-heksan
2. Senyawa triterpenoid/steroid dapat di isolasi dengan KLT, dan kromatografi kolom dengan menggunakan pelarut landaian.
1.4 Tujuan Penelitian
1. Untuk mengekstraksi senyawa triterpenoid/steroid yang terdapat dalam daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.)
2. Untuk mengisolasi senyawa triterpen/steroid yang terdapat dalam daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.)
3. Untuk karakterisasi senyawa hasil isolasi secara spektrofotometri UV dan IR
1.5 Manfaat Penelitian
ISOLASI SENYAWA TRITERPENOID/STEROID DARI DAUN TUMBUHAN KARAMUNTING
(Rhodomyrtus tomentosa Wight. )
SKRIPSI
OLEH:
040804013
APRILA ROSA NASUTION
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
ISOLASI SENYAWA TRITERPENOID/STEROID DARI DAUN TUMBUHAN KARAMUNTING
(Rhodomyrtus tomentosa Wight. )
SKRIPSI
Diajukan untuk melengkapi salah satu syarat untuk mencapai gelar Sarjana Farmasi pada Fakultas Farmasi
Universitas Sumatera Utara
OLEH:
040804013
APRILA ROSA NASUTION
FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
PENGESAHAN SKRIPSI
ISOLASI SENYAWA TRITERPENOID/STEROID DARI DAUN TUMBUHAN KARAMUNTING
(Rhodomyrtus tomentosa Wight.)
OLEH:
APRILA ROSA NASUTION NIM: 040804013
Dipertahankan Dihadapan Panitia Penguji Skripsi Fakultas Farmasi Universitas Sumatera Utara
Pada Tanggal: Desember 2008
Pembimbing I Panitia Penguji
(Dra. Siti Aman, MS., Apt. ) (Dra. Misra Gafar, MS., Apt. ) NIP 130 517 493 NIP 131 569 407
Pembimbing II (Dra. Siti Aman, MS., Apt. ) NIP 130 517 493
(Dra. Aswita Hafni Lubis, M.Si., Apt. ) (Dra. Suwarti Aris, MSi., Apt.) NIP 131 270 667 NIP 131 126 695
(Drs. Suryadi Achmad, Msc,Apt. ) NIP 131 459 471
Dekan Fakultas Farmasi,
KATA PENGANTAR
Puji dan syukur kepada Tuhan Yang Maha Kuasa karena kasih dan anugerahNya sehingga penulis dapat menyelesaikan penelitian dan penyusunan skripsi ini.
Ucapan terima kasih dan penghargaan yang tulus kepada Ayahanda Alm.Syafiruddin Nasution dan Ibunda Dra. Sari Ganti Dalimunthe yang tercinta, kakanda Suci, adik-adikku Tia, Dina, Raja, Muharram, serta kepada semua keluarga atas perhatian, nasehat dan dorongan semangat serta dukungan doa yang tiada ternilai harganya.
Dengan segala ketulusan hati penulis juga menyampaikan terima kasih kepada Ibu Dra. Siti Aman, MS., Apt. dan Dra. Aswita Hafni Lubis, M.Si., Apt. yang telah membimbing penulis dengan penuh kesabaran dan tanggung jawab selama melakukan penelitian hingga selesainya penulisan skripsi ini.
Pada kesempatan ini penulis juga mengucapkan terima kasih kepada:
1.Bapak Dekan Fakultas Farmasi Prof. Dr. Sumadio Hadisahputra, Apt. yang telah memberikan fasillitas kepada penulis sehingga dapat menyelesaikan skripsi ini.
2.Ibu Dra. Erly Sitompul, MS., Apt. sebagai Dosen wali yang telah banyak membimbing penulis selama masa perkuliahan.
3.Ibu dan Bapak staf penguji yang telah memberikan petunjuk dan bimbingannya kepada penulis sehingga penulis dapat menyelesaikan skripsi ini.
4.Ibu Dra. Marline Nainggolan, MS., Apt. selaku Kepala Laboratorium Fitokimia beserta seluruh staf yang telah mengizinkan penulis menggunakan fasilitas laboratorium selama penelitian.
5.Kepada teman-teman dan sahabatku “Imagipho” Rima, Yeni, Indah, Kak Vini, Memel, Kak Riri yang telah banyak membantu dan memotivasi penulis untuk menyelesaikan skripsi ini.
6.Bapak Agusmal Dalimunthe, MS. Apt. dan Ibu Fat Aminah MS. Apt. dan teman-teman asisten lab. Tablet Yakub, Bang Awal, Ari, Tiwi
8.Kepada senior-senior ku Kak Ipeh, Bang reva, Bang Boy, Ndeath, Kak Merlin, Kak Dani, rekan Farmasi stambuk 2004 lainnya, dan adik-adik stambuk 2005, 2006,2007 yang tidak dapat disebutkan satu persatu yang selalu menjadi teman berbagi suka duka, membantu dan memberi dorongan semangat kepada penulis.
Penulis menyadari bahwa tulisan ini masih banyak kekurangan, oleh karena itu sangat diharapkan kritik dan saran yang bersifat membangun dari pembaca.
Medan, Desember 2008
Penulis
(Aprila Rosa Nasution)
ABSTRAK
Telah dilakukan ekstraksi, isolasi dan identifikasi senyawa triterpenoid/steroid dari daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) suku Myrtaceae. Ekstraksi dilakukan secara maserasi menggunakan pelarut etanol 80 %, lalu di fraksinasi dengan n-heksan, dilakukan pemisahan dengan Kromatografi Lapis Tipis(KLT) menggunakan fase gerak n-heksan / etil asetat dengan perbandingan (90:10; 80:20; 70:30; 60:40; 50:50; 40:60) dilanjutkan dengan kromatografi kolom menggunakan pelarut landaian yaitu n-heksan / etil asetat dengan perbandingan ( 0:100; 10:90; 20:80; 30:70; 40:60; 50:50; 60:40; 70:30; 80:20; 90:10; 100:0), diakhiri dengan metanol. Isolat yang diperoleh dari hasil kromatografi kolom berbentuk kristal, kemudian dimurnikan dengan cara mencucinya dengan metanol dingin. Uji kemurnian isolat dilakukan dengan cara KLT dua arah. Terhadap isolat yang diperoleh dilakukan karakterisasi dengan spektrofotometri ultraviolet dan spektrofotometri infra merah.
ABSTRACT
The extraction, isolation, and identification of triterpenoid/steroid of the leaves of Rhodomyrtus tomentosa Wight family Myrtaceae have been carried out.
Extraction was carried out by maceration in ethanol 80 %, then it was partitioned using hexane. N-hexane fraction was analysed by thin layer chromatography using n-hexane / ethyl acetate as mobile phase by ratio of (90:10; 80:20; 70:30; 60:40; 50:50: 40:60) and was fractionated by column chromatography using n-hexane / ethyl acetate with ratio of (0:100; 10:90; 20:80; 30:70; 40:60; 50:50; 60:40; 70:30; 80:20; 90:10; 100:0) and ended with methanol. The isolate obtained from column chromatography result was in crystal form, then it was purified by washing with cold methanol. The purity test of crystal was done with two dimensional thin layer chromatography. The identification of isolates was carried out by ultraviolet and infrared spectrophotometric methods.
DAFTAR ISI
JUDUL ... i
LEMBAR PENGESAHAN ... ii
KATA PENGANTAR...iv
ABSTRAK ...vi
ABSTRACT ... ...vii
DAFTAR ISI...viii
DAFTAR LAMPIRAN ...xi
DAFTAR TABEL...xii
DAFTAR GAMBAR ...xiii
BAB I PENDAHULUAN ... ...1
1.1 Latar Belakang ... ...1
1.2 Perumusan Masalah ... ...2
1.3 Hipotesis ... ...2
1.4 Tujuan Penelitian ... ...3
1.5 Manfaat Penelitian ... ...3
BAB II TINJAUAN PUSTAKA...4
2.1 Uraian Tumbuhan...4
2.2 Uraian Kimia...5
2.2.1 Triterpenoid...5
2.2.2 Triterpen sebenarnya...5
2.3 Ekstraksi...7
2.4 Kromatografi...8
2.5 Kromatografi Lapis Tipis (KLT)...10
2.6 Harga Rf ( Retardation factor)...13
2.7 Kromatografi Kolom...14
2.8 KLT Preparatif...15
2.9 Spektrofotometri UV...16
2.10 Spektrofotometri IR...17
BAB III METODOLOGI PENELITIAN ... ...20
3.1 Alat-alat... ...20
3.2 Bahan-bahan ... ...21
3.3 Pembuatan Larutan Pereaksi ... ...21
3.3.1 Pereaksi Liebermann-Burchard untuk peneyemprot...21
3.3.2 Pereaksi Liebermann-Burchard untuk identifikasi...21
3.4 Pengumpulan dan Pengolahan Sampel ... ...21
3.4.1 Pengumpulan Sampel... ...21
3.4.2 Identifikasi Tumbuhan ... ...22
3.4.3. Pengolahan Sampel ...22
3.4.4 Penetapan kadar air ...22
3.5 Pemeriksaan Triterpenoid/ Steroid daun tumbuhan Karamunting (Rhodomyrtus tomentosaWight.) ...23
3.6 Pembuatan Ekstrak ...23
3.8 Analisis Fraksi n-heksan secara Kromatografi Lapis Tipis...24
3.9 Pemisahan Fraksi n-heksan secara Kromatografi Kolom ...25
3.10 Proses Pemurnian Kristal...25
3.11 Uji Kemurnian Isolat ...26
3.12 Identifikasi Senyawa Hasil Isolasi ...26
3.12.1 Identifikasi Senyawa Hasil Isolasi secara Spektrofotometri UV ...26
3.10.2 Identifikasi Senyawa Hasil Isolasi secara Spektrofotometri IR ...……...26
BAB IV HASIL DAN PEMBAHASAN ...……...28
BAB V KESIMPULAN DAN SARAN ...……...30
5.1 Kesimpulan ...……...30
5.2 Saran ...……...30
DAFTAR PUSTAKA ...31
DAFTAR LAMPIRAN
Lampiran 1. Identifikasi Tumbuhan Karamunting ( Rhodomyrtus tomentosa
Wight.)………...33
Lampiran 2. Gambar Tumbuhan dan daun tumbuhan karamunting ( Rhodomyrtus tomentosa Wight.)……….34
Lampiran 3. Perhitungan PK air………...35
Lampiran 4. Bagan Ekstraksi Senyawa Triterpenoid/Steroid dari Serbuk daun tumbuhan karamunting ( Rhodomyrtus tomentosa Wight.)………...36
Lampiran 5. Kromatogram hasil KLT Fraksi n-heksan daun tumbuhan karamunting (Rhodomyrtus tomenosa Wight.)………...38
Lampiran 6. Kromatogram analisis KLT hasil Kromatografi Kolom Fraksi n-heksan daun tumbuhan karamunting ( Rhodomyrtus tomentosa Wight.)………..39
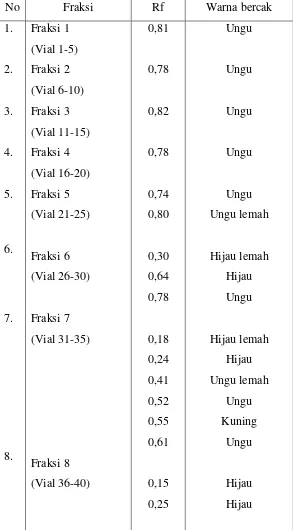
Lampiran 7. Harga Rf hasil Kromatografi Kolom Fraksi n-heksan daun tumbuhan karamunting ( Rhodomyrtus tomentosa Wight.)………41
Lampiran 8. Kromatogram hasil uji kemurnian kristal dengan KLT dua arah ...……...43
Lampiran 9. Spektrum UV ...44
DAFTAR TABEL
DAFTAR GAMBAR
Gambar 1. Tumbuhan Karamunting (Rhodomyrtus tomentosa Wight.)...34
Gambar 2. Daun tumbuhan Karamunting (Rhodomyrtus tomentosa Wight.)...34
Gambar 3. Kromatogram Hasil KLT fraksi n-heksan daun tumbuhan Karamunting (Rhodomyrtus tomentosa Wight.)...38
Gambar 4. Kromatogram Analisis KLT Hasil Kromatografi Kolom dari fraksi n-heksan daun tumbuhan Karamunting (Rhodomyrtus tomentosa Wight.)……….39
Gambar 5. Kromatogram Hasil Uji Kemurnian kristal dengan KLT dua arah...43
Gambar 6. Spektrum UV...44
BAB I
PENDAHULUAN 1.1 Latar Belakang
Kekayaan jenis tumbuhan di Indonesia sangat bervariasi, termasuk didalamnya tumbuhan yang dapat dimanfaatkan sebagai obat. Namun informasi tentang nama maupun kandungan dan ramuannya belum banyak diteliti sehingga pemanfaatan tumbuhan untuk tujuan pengobatan hanya didasarkan pada pengalaman turun-temurun (Mursito, 2001).
Tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) suku Myrtaceae merupakan salah satu tanaman berkhasiat obat yang banyak digunakan oleh masyarakat, khususnya masyarakat Tapanuli. Bagian yang digunakan adalah daun, buah, biji dan akar. Biasanya digunakan untuk mengobati disentri, sakit perut, obat luka, gangguan pencernaan, hepatitis, keputihan, sariawan, wasir darah, pendarahan rahim, haid, radang dinding pembuluh darah dan penghilang rasa haus.
Kandungan kimia daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) mengandung saponin, tanin, triterpenoid/steroid, flavonoida (Anonim 1, 2007).
Berdasarkan hal di atas maka peneliti tertarik untuk mengisolasi senyawa triterpenoid/steroid yang terdapat pada daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) dengan cara maserasi menggunakan pelarut etanol 80 %. Lalu ekstrak etanol difraksinasi dengan n-heksan. Selanjutnya dianalisis dengan kromatografi lapis tipis (KLT). Dilanjutkan dengan kromatografi kolom dan senyawa hasil isolasi di karakterisasi secara spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
1.2 Perumusan Masalah
1. Apakah senyawa triterpenoid/steroid dapat di ekstraksi secara maserasi dengan pelarut etanol 80 % lalu difraksinasi dengan n-heksan
2. Apakah senyawa triterpenoid/steroid dapat di isolasi dengan cara KLT dan kromatografi kolom dengan menggunakan pelarut landaian.
3. Apakah senyawa triterpenoid/steroid hasil isolasi dapat di karakterisasi secara spektrofotometri UV dan spektrofotometri IR.
1.3 Hipotesis
1. Senyawa triterpenoid/steroid yang terdapat pada daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) dapat di ekstraksi secara maserasi dengan etanol 80 % lalu difraksinasi dengan n-heksan
2. Senyawa triterpenoid/steroid dapat di isolasi dengan KLT, dan kromatografi kolom dengan menggunakan pelarut landaian.
1.4 Tujuan Penelitian
1. Untuk mengekstraksi senyawa triterpenoid/steroid yang terdapat dalam daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.)
2. Untuk mengisolasi senyawa triterpen/steroid yang terdapat dalam daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.)
3. Untuk karakterisasi senyawa hasil isolasi secara spektrofotometri UV dan IR
1.5 Manfaat Penelitian
BAB II
TINJAUAN PUSTAKA 2.1.Uraian Tumbuhan
Tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) adalah tumbuhan liar pada tempat yang mendapat sinar matahari cukup, seperti di lereng gunung, semak belukar, lapangan yang tidak terlalu gersang. Ciri-ciri tumbuhan ini termasuk dalam kelompok perdu, daun tunggal, permukaan daun berambut bila diraba terasa kasar, pangkal daun membulat, tepi daun rata, ujung daun meruncing. Bunga termasuk bunga majemuk berwarna ungu kemerah-merahan, buahnya dapat dimakan, mempunyai biji berukuran kecil. (Anonim 1, 2007)
Sistematika tumbuhan Kingdom : Plantae
Divisi : Spermatophyta Sub divisi : Angiospermae Kelas : Dicotyledoneae Bangsa : Myrtales Suku : Myrtaceae Marga : Rhodomyrtus
Jenis : Rhodomyrtus tomentosa Wight.
2.2.Uraian kimia 2.2.1. Triterpenoid
Triterpenoid adalah senyawa yang kerangka karbonnya berasal dari enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C-30 asiklik, yaitu skualena, senyawa ini tidak berwarna, berbentuk kristal, bertitik leleh tinggi dan bersifat optis aktif (Harborne,1987).
Menurut Harborne (1987) senyawa triterpenoid dapat dibagi menjadi empat golongan,yaitu: triterpen sebenarnya, saponin, steroid, dan glikosida jantung.
2.2.2 Triterpen sebenarnya
Berdasarkan jumlah cincin yang terdapat dalam struktur molekulnya triterpen sebenarnya dapat dibagi atas:
1. Triterpen asiklik yaitu triterpen yang tidak mempunyai cincin tertutup, misalnya skualena.
2. Triterpen trisiklik adalah triterpen yang mempunyai tiga cincin tertutup pada struktur molekulnya, misalnya: ambrein.
3. Triterpen tetrasiklik adalah triterpen yang mempunyai empat cincin tertutup pada struktur molekulnya, misalnya:lanosterol.
4. Triterpen pentasiklik adalah triterpen yang mempunyai lima cincin tertutup pada struktur molekulnya, misalnya α-amirin.
2.2.3 Steroid
siklopentana. Dahulu sering digunakan sebagai hormon kelamin, asam empedu, dll. Tetapi pada tahun-tahun terakhir ini makin banyak senyawa steroid yang ditemukan dalam jaringan tumbuhan .Tiga senyawa yang biasa disebut fitosterol terdapat pada hampir setiap tumbuhan tinggi yaitu: sitosterol, stigmasterol, dan kampesterol.(Harborne, 1987; Robinson, 1995)
Menurut asalnya senyawa steroid dibagi atas:
1. Zoosterol, yaitu steroid yang berasal dari hewan misalnya kolesterol.
2. Fitosterol, yaitu steroid yang berasal dari tumbuhan misalnya sitosterol dan stigmasterol
3. Mycosterol, yaitu steroid yang berasal dari fungi misalnya ergosterol
4. Marinesterol, yaitu steroid yang berasal dari organisme laut misalnya spongesterol.
Berdasarkan jumlah atom karbonnya, steroid terbagi atas:
1. Steroid dengan jumlah atom karbon 27, misalnya zimasterol 2. Steroid dengan jumlah atom karbon 28, misalnya ergosterol 3. Steroida dengan jumlah atom karbon 29, misalnya stigmasterol
2.3.Ekstraksi
dikeringkan lebih dahulu kemudian dihaluskan pada derajat kehalusan tertentu (Harborne, 1987)
Beberapa metode ekstraksi dengan menggunakan pelarut (Ditjen POM, 2000) yaitu:
A.Cara Dingin 1. Maserasi
Maserasi adalah proses penyarian simplisia menggunakan pelarut dengan beberapa kali pengocokan atau pengadukan pada temperatur kamar. Keuntungan ekstraksi dengan cara maserasi adalah pengerjaan dan peralatan yang digunakan sederhana, sedangkan kerugiannya yakni cara pengerjaannya lama, membutuhkan pelarut yang banyak dan penyarian kurang sempurna.
2.Perkolasi
Perkolasi adalah ekstraksi dengan pelarut yang selalu baru sampai terjadi penyarian sempurna yang umumnya dilakukan pada temperatur kamar. Proses perkolasi terdiri
dari tahap pengembangan bahan, tahap perendaman antara, tahap perkolasi sebenarnya(penampungan ekstrak) secara terus menerus sampai diperoleh ekstrak (perkolat). Untuk menentukan akhir dari pada perkolasi dapat dilakukan pemeriksaan zat secara kualitatif pada perkolat akhir.
B.Cara Panas 1.Refluks
2.Digesti
Digesti adalah maserasi dengan pengadukan kontinu pada temperatur lebih tinggi dari temperatur ruangan (umumnya 25-300 C).
3.Sokletasi
Sokletasi adalah ekstraksi mengunakan pelarut yang selalu baru, dengan menggunakan alat soxhlet sehingga terjadi ekstraksi kontinu dengan jumlah pelarut relatif konstan dengan adanya pendingin balik.
4.Infundasi
Infundasi adalah ekstraksi dengan pelarut air pada temperatur 900 C selama 15 menit. 5.Dekok
Dekok adalah ekstraksi dengan pelarutb air pada temperatur 90oC selama 30 menit.
Penguapan ekstrak larutan dilakukan dengan penguap berpusing dengan pengurangan tekanan, yaitu rotary evaporator sehingga diperoleh ekstrak yang kental.(Harborne, 1987)
2.4.Kromatografi
2.4.1. PEMAKAIAN KROMATOGRAFI
Kita melakukan kromatografi pada hakikatnya untuk menjawab tiga pertanyaan; senyawa apa yang ada? Berapa banyaknya? Bagaimana kita memperoleh komponen yang murni?
Pemakaian Kualitatif (Senyawa apa yang ada?)
Pemakaian kromatografi secara kualitatif mengungkapkan ada atau tidak adanya senyawa tertentu dalam cuplikan. Agar dapat terdeteksi dalam campuran, banyaknya senyawa itu harus memadai supaya dapat diukur.
Kromatografi kualitatif memberi informasi mengenai kerumitan suatu campuran. Campuran di kromatografi pada berbagai kondisi dan bahkan dengan beberapa cara atau cara gabungan.
Kromatografi kualitatif sering dipakai untuk menetapkan pola sidik jari campuran yang rumit, yang komponennya mungkin diketahui atau harga diketahui sebagian.ini dapat dilakukan pada campuran seperti ekstrak jaringan, urin, darah, bahan kimia kasar, atau obat. Cuplikan yang diperiksa dikromatografi dan hasilnya dibandingkan dengan pola normal.
Dua keuntungan utama kromatografi sebagai metode kualitatif yaitu cuplikan senyawa yang dibutuhkan untuk analisis sangat sedikit dan biasanya waktu analisis pendek.
Pemakaian Kuantitatif (Berapa banyak yang ada?)
Metode kuantitatif dipakai untuk penetapan kadar cuplikan secara rutin, umumnya sebagai bagian dari pengendalian mutu di industri dan terutama dalam pemantauan masalah lingkungan air dan udara.
Pemakaian preparatif (Bagaimana kita memperolehnya?)
Kromatografi preparatif dipakai untuk memperoleh komponen campuran dalam jumlah yang memadai (mg sampai g) dalam keadaan murni sehingga komponen itu dapat dicirikan lebih lengkap atau dipakai pada reaksi berikutnya.(Gritter, 1991)
2.5. Kromatografi lapis tipis
Kromatografi lapis tipis adalah kromatografi serapan, dimana sebagai fasa tetap (diam) berupa zat padat yang disebut adsorben (penyerap) dan fasa gerak adalah zat cair yang disebut larutan pengembang (Gritter, 1991)
Penyerap untuk KLT ialah silika gel, alumina, kiselgur, dan selulosa. Penyerap biasanya mengandung pengikat atau mengandung zat tambahan lain.
Silika gel
Silika gel merupakan penyerap yang paling banyak dipakai dalam KLT. Senyawa netral yang mempunyai gugusan sampai tiga pasti dapat dipisahkan pada lapisan yang diaktifkan dengan memakai pelarut organik atau campuran pelarut yang normal. Karena sebagian besar silika gel bersifar sedikit asam, maka asam sering agak mudah dipisahkan, jadi meminimumkan reaksi asam-basa antara penyerap dengan senyawa yang dipisahkan.
Alumina
Kiselgur dan selulosa
Kiselgur dan selulosa merupakan bahan penyangga lapisan zat cair yang dipakai dalam sistem KCC, dan lapisan tipis selulosa berkaitan erat dengan kromatografi kertas klasik. Kromatografi jenis ini selalu dipakai untuk pemisahan senyawa polar seperti asam amino, karbohidrat, nukleotida, dan berbagai senyawa hidrofil alam lainnya.
Air
Ada atau tidak adanya air di dalam penyerap kromatografi atau penyangga sangat penting. Lapisan silika gel atau alumina yang akan dipakai untuk kerja penyerapan harus sesedikit mungkin mengandung air, karena jika tidak, maka air akan menempati semua titik penyerapan sehingga tidak akan ada linarut yang melekat. Lapisan yang mengandung air yang sedikit itu akan diaktifkan dan dibuat pemanasan pada 1000C, mungkin terjadi dehidrasi yang tak bolak-balik pada penyerap dan menyebabkan pemisahan kurang efektif. Kemudian lapisan harus disimpan di dalam desikator atau kotak kering. Lapisan niaga (siap pakai) keaktifannya beragam, tetapi biasanya dapat dipakai langsung begitu saja, atau dapat diaktifkan lagi dengan pemanasan.
Memilih pelarut pengembang
Pelarut-pelarut yang biasanya digunakan atau sering dikombinasikan dalam kromatografi lapis tipis adalah n-heksana, eter minyak tanah, karbon tetraklorida, eter, kloroform, etil asetat, asam asetat glasial, aseton, etanol, metanol dan air. Urutan ini berdasarkan bertambahnya sifat kepolaran dari pelarut tersebut.
Menotolkan cuplikan
Campuran yang akan dikromatografi harus dilarutkan di dalam pelarut yang agak non polar untuk ditotolkan pada lapisan. Pada umumnya, dipakai larutan 0,1-1%. Hampir segala macam pelarut dapat dipakai, tetapi yang terbaik yang bertitik didih 500 dan 1000C. Pelarut yang demikian mudah ditangani dan mudah menguap dari lapisan. Air hanya dipakai jika tidak ada pilihan lain.
2.6 Harga Rf (Retardation factor)
Identifikasi dari senyawa-senyawa hasil pemisahan KLT dapat dilakukan dengan penambahan pereaksi kimia dan reaksi-reaksi warna. Tetapi lazimnya untuk identifikasi digunakan harga Rf. Harga Rf didefenisikan sebagai berikut:
Rf = Jarak yang ditempuh oleh senyawa dari titik penotolan Jarak yang ditempuh oleh pelarut dari titik penotolan
Harga-harga Rf untuk senyawa-senyawa murni dapat dibandingkan dengan harga-harga standar.Perlu diperhatikan bahwa harga-harga-harga-harga Rf yang diperoleh hanya berlaku untuk campuran tertentu dari pelarut dan penyerap yang digunakan.
Faktor-faktor yang dapat mempengaruhi harga Rf: 1. Struktur kimia dari senyawa yang dipisahkan 2. Sifat dari penyerap dan derajat aktifitasnya 3. Tebal dan kerataan dari lapisan penyerap
4. Pelarut(dan derajat kemurniannya) fasa bergerak
5. Derajat kejenuhan dari uap dalam mana bejana pengembangan yang digunakan
6. Teknik percobaan
7. Jumlah cuplikan yang digunakan 8. Suhu
9. Kesetimbangan
2.7. Kromatografi kolom
jumlah besar. Campuran yang akan dipisahkan diletakkan berupa pita diatas bagian penyerap yang berada pada tabung kaca. Fasa gerak dibiarkan mengalir melalui kolom yang disebabkan oleh gaya berat. Pita senyawa yang terlarut bergerak melalui kolom dengan laju yang berbeda, memisah dan dikumpulkan berupa fraksi-fraksi pada saat keluar dari bawah kolom (Gritter, 1991)
Tujuan kromatografi kolom adalah memisahkan komponen cuplikan dalam waktu yang masuk akal, menjadi pita atau puncak, ketika cuplikan itu bergerak melalui kolom. Dalam praktek, dengan melihat bentuk puncak biasanya kita dapat menaksir daya pisah sampai derajat yang memungkinkan kita memilih dengan cepat panjang kolom yang diperlukan untuk pemisahan. Keefisienan kolom merupakan fungsi dari parameter kolom, seperti laju aliran pelarut, ukuran partikel kemasan kolom, cara mengemas kolom, dan viskositas pelarut (Johnson, 1978)
Kolom kromatografi dapat berupa pipa gelas yang dilengkapi dengan kran dan gelas penyaring didalamnya. Ukuran kolom tergantung pada banyaknya zat yang akan dipisahkan. Untuk menahan penyerap yang diletakkan di dalam kolom dapat digunakan gelas wool atau kapas. Ukuran partikel penyerap untuk kolom biasanya lebih besar dari KLT yaitu 63 - 250µm yang dijalankan dengan gaya tarik bumi.
2.8. Kromatografi lapis tipis preparatif
Salah satu metode pemisahan yang memerlukan biaya paling murah dan memakai peralatan sangat sederhana ialah kromatografi lapis tipis preparatif (KLTP).Walaupun KLTP dapat memisahkan dalam jumlah gram,sebagian besar pemakaian hanya dalam jumlah miligram. KLT preparatif dilakukan dengan menggunakan lapisan tebal (sampai 1 mm) sebagai pengganti lapisan penyerap yang tipis (Harborne, 1987)
Pada kromatografi lapis tipis preparatif, cuplikan yang akan dipisahkan ditotolkan berupa garis pada salah satu sisi pelat lapisan besar dan dikembangkan secara tegak lurus pada garis cuplikan sehingga campuran akan terpisah menjadi beberapa pita. Pita ditampakkan dengan cara yang tidak merusak jika senyawa itu tanwarna, dan penyerap yang mengandung senyawa pita dikerok dari pelat kaca. Kemudian cuplikan dielusi dari penyerap dengan pelarut polar. Cara ini berguna untuk memisahkan campuran reaksi sehingga diperoleh senyawa murni untuk telaah pendahuluan, untuk menyiapkan cuplikan analisis, untuk meneliti bahan alam yang lazimnya berjumlah kecil dan campurannya rumit dan untuk memperoleh cuplikan yang murni untuk mengkalibrasi kromatografi lapis tipis kuantitatif (Gritter, 1991)
2.9.Spektrofotometri ultraviolet
Spektrofotometri ultraviolet merupakan suatu analisis yang berdasarkan atas pengukuran resapan suatu larutan yang dilalui radiasi monokromatis. Penyerapan cahaya oleh molekul dalam daerah spektrum ultraviolet tergantung pada struktur elektronik dari molekul. Spektrum ultraviolet dari senyawa-senyawa organik berkaitan erat dengan transisi-transisi diantara tingkatan-tingkatan tenaga elektronik (Sastrohamidjojo, 1998)
Spektrum ultraviolet merupakan suatu gambar antara panjang gelombang atau frekuensi serapan lawan intensitas serapan (transmisi atau absorbansi). Spektrofotometri ultraviolet berguna pada penentuan struktur molekul organik dan pada analisis kuantitatif (Creswell, 1982)
Panjang gelombang cahaya ultraviolet tergantung pada mudahnya promosi elektron dimana molekul-moloekul yang memerlukan banyak energi untuk promosi elektron yang menyerap radiasi ultraviolet pada panjang gelombang yang lebih pendek. Molekul yang memerlukan energi yang lebih sedikit akan menyerap pada panjang gelombang yang lebih panjang (Fessenden dan Fessenden, 1995; Noerdin, 1985).
Istilah-istilah yang sering digunakan dalam spektrofotometri ultraviolet (Sirvestein, 1986; Wingrove and Caret, 1981) antara lain:
1. Kromofor adalah gugus tidak jenuh yang menyerap radiasi di daerah ultraviolet dengan hampir semua kromofor mempunyai ikatan tak jenuh. Contohnya C=C, C=O, dan NO2
3. Pergeseran batokromik adalah pergeseran serapan maksimum ke arah panjang gelombang yang lebih panjang yang disebabkan substitusi pada kromofor(oleh ausokrom) atau pengaruh pelarut
4. Pergeseran hipsokromik adalah pergeseran serapan ke arah panjang gelombang lebih pendek yang disebabkan substitusi atau pengaruh pelarut
5. Efek hipokromik yaitu suatu kenaikan dalam intensitas serapan 6. Efek hipokromik yaitu suatu penurunan dalam intensitas serapan.
2.10.Spektrofotometri Inframerah
Sinar inframerah bila dilewatkan melalui cuplikan senyawa organik maka sejumlah frekuensi akan diserap sedangkan frekuensi yang lain diteruskan tanpa diserap. Daerah inframerah terletak antara spektrum elektromagnetik cahaya tampak dan spektrum radio, yakni antara 4000-400 cm-1 (Noerdin, 1985; Sastrohamidjojo, 1985).
Spektrofotometri inframerah memungkinkan identifikasi gugus fungsional karena gugus fungsi tersebut menunjukkkan serapan yang spesifik pada daerah inframerah. Spektrum inframerah khas untuk senyawa tertentu, sehingga metoda ini tepat untuk menentukan struktur senyawa yang belum dikenal yaitu dengan cara membandingkannya terhadap senyawa yang sudah diketahui. Sangat jarang dua senyawa organik memiliki spektrum inframerah yang identik baik dalam posisi maupun intensitas puncak-puncaknya (Wingrove and Caret, 1981).
C=O, O-H, N-H, C-O, C=C, C≡N, C≡C dan NO2. Langkah-langkah yang umum untuk memeriksa gugus yang penting pada spektrum inframerah (Pavia, et al., 1988) adalah: 1.Apakah terdapat gugus karbonil?
Gugus C=O memberikan puncak pada daerah 1820-1660 cm-1 . Puncak ini biasanya merupakan serapan yang terkuat dengan lebar medium pada spektrum.
2.Jika gugus C=O ada, periksalah gugus-gugus berikut dan jika C=O tidak ada langsung ke nomor 3.
Asam : apakah ada gugus –OH?
Yaitu serapan melebar di daerah 3300-2500 cm-1 (biasanya tumpang tindih dengan C-H).
Amida : apakah ada N-H?
Yaitu serapan medium di dekat 3500 cm-1 , kadang-kadang dengan puncak rangkap. Ester : apakah ada C-O?
Yaitu serapan dengan intensitas medium di daerah 1300 – 1000 cm-1. Anhidrida : mempunyai dua serapan C=O di daerah 1810 dan 1760 cm-1. Aldehida : apakah ada C-H aldehida?
Yaitu dua serapan lemah di dekat 2850-2750 cm-1 disebelah kanan serapan C-H Keton : jika kelima kemungkinan diatas tidak ada.
3.Jika gugus C=O tidak ada
Alkohol/fenol : periksalah gugus –OH, yaitu serapan melebar di daerah 3600-3300 cm -1
yang diperkuat adanya serapan C-O di daerah 1300-1000 cm-1.
Eter : periksalah gugus C-O ( dan tidak adanya –OH ), yaitu serapan medium di daerah 1300 – 1000 cm-1- .
4. Ikatan rangkap dua atau cincin aromatik yaitu adanya : - C=C yang mempunyai serapan lemah di daerah 1650 cm-1.
-
Serapan medium sampai kuat pada daerah 1650-1450 cm-1 sering menunjukkan adanya cincin aromatik.
5. Ikatan rangkap tiga yaitu adanya;
- C=N yang mempunyai serapan medium dan tajam di daerah 2250 cm-1.
- C=C mempunyai serapan lemah tapi tajam di daerah 2150 cm-1 periksa juga CH asetilenik di dekat 3300 cm-1.
6. Gugus nitro
Yaitu adanya dua serapan kuat di daerah 1600-1500 cm-1 dan 1390-1300 cm-1. 7. Hidrokarbon
- Apakah keenam kemungkinan diatas tidak ada. - Serapan utama di daerah CH dekat 3000 cm-1.
BAB III
METODOLOGI PENELITIAN
Metodologi penelitian adalah metode eksperimental laboratorium yang meliputi pengumpulan dan pengolahan sampel, pemeriksaan steroid, pembuatan ekstrak dengan cara maserasi menggunakan pelarut etanol 80%, kemudian dilakukan fraksinasi dengan pelarut n-heksan, lalu dianalisis dengan kromatografi lapis tipis (KLT), kromatografi kolom, hasil kromatografi kolom berbentuk kristal, dicuci dengan metanol dingin untuk memurnikannya, uji kemurnian kristal dilakukan KLT dua arah dan identifikasi senyawa hasil isolasi secara spektrofotometri ultraviolet (UV) dan spektrofotometri inframerah (IR).
3.1 Alat-alat yang digunakan
Alat-alat yang digunakan dalam penelitian ini adalah: alat-alat gelas laboratorium, blender (philips), elektromantel, hair dryer (national), neraca kasar (Ohaus), neraca analitik (Mettler Toledo), oven listrik (Fischer Scientific), penangas air (Yenaco), rotary evaporator (Buchi 461), seperangkat alat kromatografi lapis tipis (KLT) dan kromatografi kolom, spektrofotometer ultraviolet (Shimadzu QP 5000), spektrofotometer inframerah ( FTIR-8201 PC Shimadzu).
3.2 Bahan-bahan yang digunakan
berkualitas proanalisa (E. Merck) yaitu asam asetat anhidrat, asam sulfat, etanol, etilasetat,kloroform,metanol, n-heksan, toluen, silika gel GF254, silika gel 60H (mesh 70 – 230 ASTM), air suling, dan metanol hasil destilasi.
3.3 Pembuatan Larutan Pereaksi
Pembuatan larutan pereaksi menurut Depkes (1979), E.Merck (1978): Liebermann-Burchard.
3.3.1 Pereaksi Liebermann-Burchard untuk penyemprot
Sebanyak 5ml asam asetat anhidrat ditambah 5 ml asam sulfat pekat, kemudian campuran dimasukkan ke dalam 50 ml etanol. Pengerjaan dilakukan dalam kondisi dingin dan pereaksi dibuat baru.
3.3.2 Pereaksi Liebermann-Burchard untuk Identifikasi
Terdiri dari 20 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat. Kedua asam ini ditambahkan secara berurutan pada sampel yang akan diuji.
3.4 Pengumpulan dan Pengolahan Sampel 3.4.1 Pengumpulan sampel
3.4.2 Identifikasi tumbuhan
Identifikasi tumbuhan dilakukan di Pusat Penelitian dan Pengembangan Biologi, LIPI, Bogor. Hasil identifikasi tumbuhan dapat dilihat pada lampiran 1 halaman 33.
3.4.3 Pengolahan sampel
Daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) dibersihkan dari pengotoran, dicuci, ditiriskan, dan dikeringkan di udara terbuka (diangin-anginkan) terlindung dari cahaya matahari langsung. Sampel yang telah kering dan rapuh diserbuk. Kemudian dilakukan penetapan kadar air.
3.4.4 Penetapan Kadar Air
Penetapan kadar air dilakukan dengan metode azeotropi (destilasi toluen). Alat penetapan kadar air terdiri dari labu alas bulat 500 ml, alat penampung, pendingin, tabung penyambung, tabung penerima 5ml.
Cara kerja:
toluen memisah sempurna, dibaca volume air dengan ketelitian 0,05 ml. Kadar air dihitung dalam persen (Depkes, 1989 dan WHO, 1992). Perhitungan kadar air dapat dilihat pada lampiran 3 halaman 35.
3.5 Pemeriksaan Triterpenoid/steroid daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.)
Sebanyak 1 gram serbuk daun tumbuhan karamunting, dimaserasi dengan n-heksan selama 2 jam, disaring, lalu filtrat diuapkan dalam cawan penguap. Pada sisanya, ditambahkan pereaksi LB. Timbulnya warna ungu atau merah ungu yang kemudian berubah menjadi hijau biru menunjukkan adanya Triterpenoid/steroid.
3.6 Pembuatan Ekstrak
Pembuatan ekstrak dilakukan secara maserasi menggunakan pelarut etanol 80%. Cara kerja:
3.7 Isolasi senyawa Triterpenoid/steroid dari ekstrak etanol Dengan cara fraksinasi menggunakan pelarut n-heksan. Cara kerja:
Dua (2) gram ekstrak etanol ditambahkan dengan 10 ml aquades, panaskan sampai homogen. Tambahkan 25 ml n-heksan, ekstraksi atau kocok selama 15 menit, lalu pisahkan dengan corong pisah. Ambil lapisan n-heksan (lapisan atas). Dibuat perlakuan sebanyak 3 kali. Sari n-heksan dikumpulkan lalu diuapkan sampai kental. Bagan ekstraksi dapat dilihat pada lanjutan lampiran 4 halaman 37.
3.8 Analisis Fraksi n-heksan secara Kromatografi Lapis Tipis
Analisis fraksi n-heksan dilakukan dengan KLT menggunakan fase diam plat pra lapis tipis silika gel GF254 dan fase gerak campuran n-heksan-etil asetat dalam berbagai perbandingan, yaitu (90:10; 80:20; 70:30; 60:40; 50:50; 40:60). Penampak bercak yang digunakan adalah pereaksi LB.
Cara kerja:
3.9 Pemisahan Fraksi N-heksan dengan Kromatografi Kolom
Pemisahan fraksi n-heksan dilakukan dengan kromatografi kolom menggunakan pelarut landaian yaitu n-heksan:etil asetat dengan perbandingan (0:100; 10:90; 20:80; 30:70; 40:60; 50:50; 60:40; 70:30; 80:20; 90:10; 100:0), diakhiri dengan metanol, dan fase diam silika gel 60 ukuran partikel 0,063 – 0,200 mm (mesh 70 – 230 ASTM).
Cara kerja:
Seperangkat alat kromatografi kolom dipasang sedemikian rupa, kemudian ke dalam dasar kolom dimasukkan kapas yang telah dibebas-lemakkan dengan metanol. Silika gel dibuat bubur dengan larutan fase gerak, diaduk sampai homogen dan bebas dari gelembung udara, kemudian dimasukkan ke dalam kolom yang telah diisi dengan fase gerak sambil kran dibuka secara perlahan-lahan dan dinding kolom diketuk-ketuk untuk menghilangkan gelembung udara. Kran ditutup dan dibiarkan selama 24 jam. Larutan fase gerak diturunkan sampai setinggi lebih kurang 1 cm di atas fase diam. Fraksi n-heksan dimasukkan ke dalam bejana kromatografi kolom (yang sebelumnya telah dicampur dengan fase diam) sambil fase gerak ditambahkan sedikit demi sedikit melalui dinding kolom dan kran dibuka perlahan-lahan sehingga ekstrak turun. Hasil elusi masing-masing ditampung sebanyak 10 ml dalam vial.Untuk pola kromatogram yang sama digabung menjadi satu fraksi. Kromatogram analisis KLT hasil kromatografi kolom dapat dilihat pada lampiran 6 halaman 39.
3.10 Proses Pemurnian Kristal
3.11 Uji Kemurnian Isolat
Uji kemurnian dilakukan terhadap senyawa hasil isolasi dengan KLT dua arah menggunakan fase diam plat pra lapis tipis silika gel GF254, dengan fase gerak I n-heksan:etil asetat (80:20) dan fase gerak II toluen:etil asetat (40:60) dan penampak bercak adalah pereaksi LB.
Cara kerja:
Isolat ditotolkan pada plat pra lapis tipis silika gel GF254, kemudian dielusi dengan memakai fase gerak I dan dibiarkan fase gerak naik hampir sampai batas pengembangan, kemudian plat dikeluarkan, diberi tanda dan dikeringkan di udara terbuka, dielusi kembali dengan fase gerak II dengan posisi yang berbeda dan dibiarkan fase gerak naik mencapai hampir batas pengembangan, kemudian plat dikeluarkan dari chamber, diberi tanda dan dikeringkan. Setelah kering disemprot dengan penampak bercak LB .Lalu dipanaskan pada suhu 1100C selama 10 menit. Perubahan warna yang terjadi diamati dan harga Rf dihitung. Hasil kromatogram dapat dilihat pada lampiran 8 halaman 43.
3.12 Identifikasi senyawa hasil isolasi
Identifikasi senyawa hasil isolasi dilakukan secara spektrofotometri UV dan spektrofotometri IR.
3.12.1 Identifikasi Senyawa Hasil Isolasi Secara Spektrofotometri UV
3.12.2 Identifikasi Senyawa Hasil Isolasi Secara Spektrofotometri IR
Senyawa hasil isolasi dilarutkan dalam kloroform kemudian larutan tersebut ditempatkan diantara plat NaCl, kemudian dimasukkan ke dalam alat spektrofotometer inframerah dan diukur absorbansinya pada bilangan gelombang 4000 – 400 cm-1.
BAB IV
HASIL DAN PEMBAHASAN
Ekstraksi terhadap serbuk daun tumbuhan karamunting (Rhodomyrtus tomentosa Wight.) dilakukan dengan cara maserasi menggunakan pelarut etanol 80 % dengan tujuan untuk menarik semua senyawa yang ada pada tumbuhan, kemudian terhadap ekstrak etanol dilakukan fraksinasi dengan pelarut n-heksan dimana diharapkan senyawa-senyawa non polar khususnya triterpenoid/steroid dapat disari dengan sempurna.
Analisis KLT dari fraksi n-heksan digunakan fase diam silika gel GF254, fase gerak n-heksan:etil asetat dengan berbagai perbandingan, yaitu (90:10; 80:20; 70:30; 60:40; 50:50; 40:60) dengan penampak bercak Liebermann-Burchard. Diperoleh perbandingan fase gerak yang baik yaitu 80:20, menghasilkan 7 senyawa Triterpenoid/steroid dengan harga Rf : merah ungu (0,14), hijau lemah (0,26), hijau (0,36), ungu (0,55), ungu lemah (0,62), ungu lemah (0,68) dan ungu (0,83).
BAB V
KESIMPULAN DAN SARAN 5.1. Kesimpulan
Senyawa triterpenoid/steroid dari daun tumbuhan karamunting(Rhodomyrtus tomentosa Wight.) dapat diekstraksi dengan cara maserasi menggunakan pelarut etanol 80 %, kemudian difraksinasi dengan n-heksan. Dari hasil KLT diperoleh perbandingan fase gerak yang bagus yaitu n-heksan / etil asetat (8:2). Hasil dari kromatografi kolom diperoleh isolat berupa kristal dengan Rf 0,74.
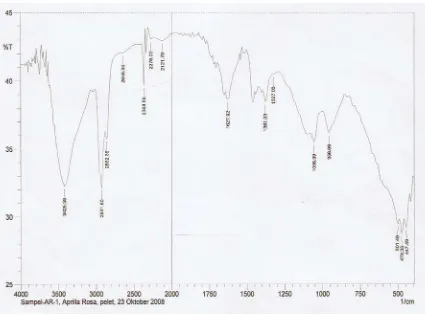
Hasil spektrofotometri ultraviolet dari isolat memberikan panjang gelombang maksimum (λ) 225 nm yang menunjukkan adanya gugus kromofor, yaitu gugus fungsi berupa ikatan tak jenuh yang menyerap radiasi di daerah UV. Hasil spektrofotometri Inframerah menunjukkan adanya ikatan O-H yang bertumpang tindih dengan C-H aromatis ditunjukkan pada bilangan gelombang 3425,58; gugus C-O pada bilangan gelombang 1300-1000, dan gugus C=C pada bilangan gelombang 1627,92.
5.2. Saran
- Disarankan untuk peneliti selanjutnya untuk dapat melanjutkan identifikasinya dengan GC-MS
DAFTAR PUSTAKA
Anonim, (2007), Rhodomyrtus tomentosa Wight Anonim, (2007)
Creswell, C .J., Runquist, O. A. dan Campbell, M .H. (1982). Analisis Spektrum Senyawa Organik. Edisi II. Bandung:Penerbit ITB, Hal. 45-51, 77-99.
Crout, D. H.,Geisman,T. A., (1969). Organic Chemistry of Secondary Plant Metabolism. San Fransisco:California. Hal 53-55.
Departemen Kesehatan RI. (1989). Materia Medika Indonesia. Ed. V. Jakarta: Depkes RI. Hal. 515-516, 518-520, 549-552.
Departemen Kesehatan RI. (1979). Farmakope Indonesia. Edisi III. Jakarta: Depkes RI. Hal. 649, 653, 659, 712.
E. Merck. (1978). Dyeing Reagents for Thin Layer and Paper chromatography. Federal republic of Germany. Hal. 1.
Farnsworth, N.P. (1966). Biological And Phytochemical Screening Of Plants. Journal Of Pharmaceutical Sciences. Volume 55. Number 3. Chicago:Reheis Chemical Company. Hal. 255-260.
Gritter, R. J., Bobbitt, J. And Schwarting, A. E.(1991). Pengantar Kromatografi. Edisi II. Bandung:Penerbit ITB. Hal 146, 160-168.
Harborne, J. B.(1987). Metode Pemisahan Cara Modern Menganalisis Tumbuhan. Penerjemah Dr. Kosasih P. dan Dr.Iwang S. Edisi 2. Bandung: Penerbit ITB. Hal. 48-49,71-72,102-104,147-148,152.
Hostettmann, K., Hostettmann., Marston, A., (1995). Cara Kromatografi Preparatif. Terjemahan: Padmawinata, K. Bandung: Penerbit ITB. Hal 9-11.
Johnson, L, Edward. (1978). Dasar Kromatografi Cair. Bandung:Penerbit ITB Hal.22.
Pavia, D.L, Lampman, G.M,nKriz, G.S (1979), Introduction To Spectroscopy, Edisi I, Philadelphia : Saunders College. Hal. 29,78-80.
Robinson, T. (1995). Kandungan Organik Tumbuhan Tinggi. Terjemahan: K. Padmawinata. Bandung: Penerbit ITB. Hal. 139, 152-156.
Sastrohamidjojo, H. (1985). Kromatografi. Edisi I. Cetakan pertama.Yogyakarta:Liberty Hal.29-32, 126-136.
Sastrohamidjojo, H. (1988). Spektroskopi. Edisi kedua.Yogyakarta:Liberty.Hal 1-2 34-36.
Silverstein, R.M., Basler, G. C., dan Morril, T.C. (1986). Penyidikan Spektrometrik Senyawa Organik. Penerjemah : Hartono, dkk. Jakarta. Penerbit Erlangga. Hal. 305-308.
Stahl, E. (1985). Analisis Obat Secara Kromatografi dan Mikroskopi. Terjemahan: K. Padmawinata dan I. Sudiro. Bandung: Penerbit ITB. Hal. 3-18 .
Lampiran 2.
Gambar 1.Tumbuhan Karamunting (Rhodomyrtus tomentosa Wight.)
Lampiran 3. Penetapan kadar air Perhitungan:
Berat sample 1 = 5,055 gram Volume penjenuhan (V penj) = 1,9
Volume 1 ( V 1) = 2,3
% kadar air = V1 – V penj X 100 % = 2,3 – 1,9 X 100 % = 7,91 % Berat sample 5,055
Berat sample 2 = 5,010 gram Volume 1 = 2,3
Volume 2 = 2,7
% kadar air = V2 – V 1 X 100 % = 2,7 – 2,3 X 100 % = 7,98 % Berat sample 5,010
Berat sample 3 = 5,205 Volume 2 = 2,7 Volume 3 = 3,1
% kadar air = V3-V2 X 100 % = 3,1 – 2,7 X 100 % = 7,68 % Berat sample 5,205
% rata rata = 7,91 % + 7,98% + 7,68 %
Lampiran 4.
Bagan Ekstraksi daun karamunting(Rhodomyrtus tomentosa Wight.)
500 g Serbuk Daun Karamunting
Dimaserasi dengan etanol 80% selama 2 x 24 jam
Disaring
Maserat I Ampas
Dimaserasi kembali dengan etanol 80% sebanyak 3 kali Disaring
Maserat II Ampas
Dikumpulkan Dipekatkan dengan Rotary evaporator Ekstrak Etanol
Lampiran 4.Lanjutan
Dipisahkan dengan corong pisah
Lampiran 5.
Fase gerak n-heksan:etil asetat
Gambar 3. Kromatogram hasil KLT fraksi n-heksan daun karamunting(Rhodomyrtus tomentosa Wight.)
Keterangan : Fase diam silika gel GF254,penampak bercak Liebermann Burchard,u = ungu, u = merah ungu ,ul = ungu lemah,h = hijau,hl= hijau lemah,kl = kuning lemah,b = biru,bp = batas pengembangan,tp = titik penotolan.
.
.
. . .
. .
daun karamunting (Rhodomyrtus tomentosa Wight.)ul daun karamunting (Rhodomyrtus tomentosa Wight.)
Lampiran 7.
Lampiran 8.
I
.
II
Gambar 5. Kromatogram hasil uji kemurnian kristal dengan KLT dua arah
Keterangan: Fase diam silika gel GF254,fase gerak n-heksan:etil asetat (8:2),Toluol:etil asetat(4:6),penampak bercak Liebermann-Burchard,mu = merah ungu.
Lampiran 9.
Panjang Gelombang
Lampiran 10.