EKSPLORASI DAN IDENTIFIKASI BAKTERI AGENS
HAYATI DARI PERMUKAAN TUBUH LUNDI
(COLEOPTERA: SCARABAEIDAE)
SELVIA WULAN HAJIJAH
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Eksplorasi dan Identifikasi Bakteri Agens Hayati dari Permukaan Tubuh Lundi (Coleoptera: Scarabaeidae) adalah benar karya saya dengan arahan dari dosen pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam daftar pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
ABSTRAK
SELVIA WULAN HAJIJAH. Eksplorasi dan Identifikasi Bakteri Agens Hayati dari Permukaan Tubuh Lundi (Coleoptera: Scarabaeidae). Dibimbing oleh GIYANTO.
Pengendalian hayati merupakan teknik pengendalian organisme pengganggu tanaman yang ramah lingkungan. Penelitian ini bertujuan mengeksplorasi dan mengidentifikasi bakteri agens hayati yang berasal dari permukaan tubuh lundi (Coleoptera: Scarabaeidae). Penelitian ini dilakukan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman IPB dari bulan Maret hingga September 2015. Isolat bakteri yang diperoleh dari hasil isolasi adalah sebanyak 15 isolat asal Jonggol dan 11 isolat asal Cikabayan. Isolat tersebut terdiri atas 13 bakteri Gram negatif dan 13 bakteri Gram positif. Satu dari 26 isolat bakteri, LC06, merupakan patogen pada tanaman sedangkan isolat lainnya bukan patogen pada tanaman. Hasil uji antagonisme menunjukkan bahwa terdapat 14 isolat bakteri memiliki reaksi antagonis terhadap Helminthosporium oryzae, 20 isolat terhadap Pyricularia oryzae, delapan isolat terhadap Rhizoctonia solani, dan dua isolat terhadap Xanthomonas oryzae pv. oryzae. Isolat bakteri LJ10 dan LJ13 memiliki persentase penghambatan tertinggi dibandingkan dengan isolat lainnya. Isolat LJ10 memiliki persentase penghambatan sebesar 26.6% terhadap H. oryzae, 30.3% terhadap P. oryzae dan 52.2% terhadap R. solani. Isolat LJ13 memiliki persentase penghambatan sebesar 28.5% terhadap H. oryzae dan P. oryzae, 34.5% terhadap R. solani, dan juga 53.3% terhadap X. oryzae pv. oryzae. Hasil identifikasi tersebut menunjukkan bahwa isolat LJ10 memiliki kemiripan sekitar 97% sampai 98% dengan bakteri Citrobacter farmeri, sedangkan isolat LJ13 memiliki kemiripan sebesar 97% dengan bakteri Bacillus sp..
ABSTRACT
SELVIA WULAN HAJIJAH. Exploration and Identification of Bacteria as Biological Agents from White Grub’s Body Surface (Coleoptera: Scarabaeidae). Supervised by GIYANTO.
Biological control is an control technique of pest in sustainable agriculture. This research aimed to explore and identify biological agents from body surface of white grub. This research was conducted at the Laboratory of Plant Bacteriology, Department of Plant Protection IPB from March until September 2015. Isolation of bacteria from white grub’s body surface yielded 15 isolates from Jonggol and 11 isolates from Cikabayan. The bacterial isolates consisted of 13 isolates of Gram positive and 13 isolates of Gram negative. One of the isolates ie. LC06 is a plant-patogenic bacteria and the others are non-plant-pathogenic bacteria. Antagonistic test showed that 14 isolates had antagonistic activity to Helminthosporium oryzae, 20 isolates to Pyricularia oryzae, eight isolates to Rhizoctonia solani, and two isolates to Xanthomonas oryzae pv. oryzae. The LJ10 and LJ13 isolates had higher inhibition than the others isolates. The LJ10 isolate had the percentage inhibition of 26.6% to H. oryzae, 30.3% to P. oryzae and 52.2% to R. solani. The LJ13 isolate had the peresentage inhibition of 28.5% to H. oryzae and P. oryzae, 34.5% to R. solani, and also 53.3% to X. oryzae pv. oryzae. The molecular identification based on 16S rRNA sequence showed that the LJ10 isolate had 97% to 98% similarity to Citrobacter farmeri, whereas the LJ13 isolate had 97% similarity to Bacillus sp..
©Hak Cipta milik IPB, tahun 2016 Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
EKSPLORASI DAN IDENTIFIKASI BAKTERI AGENS
HAYATI DARI PERMUKAAN TUBUH LUNDI
(COLEOPTERA: SCARABAEIDAE)
SELVIA WULAN HAJIJAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT yang telah melimpahkan segala rahmat dan karunia-Nya sehingga penulis mampu menyelesaikan tugas akhir yang berjudul “Eksplorasi dan Identifikasi Bakteri Agens Hayati dari Permukaan Tubuh Lundi (Coleoptera: Scarabaeidae)”. Penulisan tugas akhir penelitian ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Terima kasih penulis sampaikan kepada Dr Ir Giyanto, MSi selaku dosen pembimbing skripsi yang selalu memberikan bimbingan, pengetahuan, saran, arahan, dan masukan kepada penulis. Ucapan terima kasih juga penulis sampaikan kepada Ir Djoko Prijono, MAgrSc selaku dosen penguji yang telah memberikan kritik dan saran untuk menyempurnakan penulisan tugas akhir ini. Terima kasih kepada orang tua dan adik-adik tercinta yang selalu memberi semangat dan dukungan dalam belajar. Ucapan terima kasih juga ditujukan kepada Yusriah, Iis, Geubrina, Anggun, Elvira, Rizkah, Lina, Tatit Sastrini MSi, Syaiful Khoiri MSi, Bapak Rofiq, keluarga IMBR 48, keluarga Laboratorium Bakteriologi dan teman-teman Proteksi Tanaman 48 yang tidak bisa disebutkan satu per satu serta pihak lain yang mendukung terlaksananya tugas akhir penulis.
Semoga karya tulis ini dapat bermanfaat.
Bogor, Maret 2016
1
DAFTAR ISI
DAFTAR TABEL viii
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
BAHAN DAN METODE 3
Tempat dan Waktu 3
Alat dan Bahan 3
Metode Penelitian 3
Pengambilan Sampel Lundi 3
Peremajaan Isolat Patogen 3
Isolasi Bakteri dari Sampel Lundi 4
Uji Gram 4
Seleksi Bakteri Calon Agens Hayati 4 Uji reaksi hipersensitif 4
Uji antagonisme 4
Identifikasi Bakteri dengan Teknik Molekuler 6 Ekstraksi DNA total bakteri 6 Amplifikasi DNA gen 16S rRNA bakteri 6 Sekuensing dan penyejajaran DNA gen 16S rRNA 7
HASIL DAN PEMBAHASAN 8
Lokasi Pengambilan Sampel dan Jenis Sampel Lundi 8 Jenis dan Jumlah Isolat Bakteri Calon Agens Hayati 9 Pengujian Gram dan Hipersensitif 9 Pengujian Potensi Antagonisme 11 Identifikasi Bakteri dengan Teknik Molekuler 13
SIMPULAN DAN SARAN 16
Simpulan 16
Saran 16
DAFTAR PUSTAKA 17
LAMPIRAN 21
RIWAYAT HIDUP 26
3
DAFTAR TABEL
1 Isolat bakteri calon agens hayati hasil isolasi dari permukaan tubuh lundi 9 2 Hasil pengujian Gram dan hipersensitif bakteri calon agens hayati 10 3 Persentase penghambatan radial yang dihasilkan oleh bakteri calon agens 11
hayati terhadap empat jenis patogen penting padi
4 Penghambatan yang dihasilkan oleh LJ10 dan LJ13 12 5 Analisis sekuen parsial gens 16s rRNA dua isolat bakteri 14
DAFTAR GAMBAR
DAFTAR LAMPIRAN
1 Uji antagonisme antara bakteri calon agens hayati dengan patogen 5 2 Pengukuran jari-jari miselium cendawan dalam pengujian antagonisme 5 3 Lokasi pengambilan sampel lundi 8
4 Jenis sampel lundi 8
5 Respons reaksi hipersensitif pada tanaman tembakau 10 6 Potensi antagonisme bakteri calon agens hayati terhadap cendawan 12
Patogen
7 Miselium cendawan patogen yang terpapar bakteri agens hayati dengan 13 perbesaran 400 kali
8 Potensi antagonisme bakteri calon agens hayati terhadap bakteri patogen 13 9 Karakter morfologi isolat bakteri calon agens hayati dengan kode isolat 13
LJ10 dan LJ13
10 Hasil amplifikasi DNA bakteri calon agens hayati dengan penanda 1kb 14
1 Karakteristik morfologi bakteri calon agens hayati dari permukaan tubuh 22 lundi
1
PENDAHULUAN
Latar Belakang
Organisme pengganggu tanaman (OPT) adalah setiap organisme yang dapat mengganggu pertumbuhan dan atau perkembangan tanaman sehingga tanaman menjadi rusak, pertumbuhannya terhambat, dan atau mati. OPT dapat dikategorikan dalam empat kelompok utama, yaitu hama vertebrata, hama invertebrata, patogen, dan gulma. Menurut Agrios (2005), mikroorganisme patogen biasanya menyebabkan penyakit pada tanaman dengan mengganggu metabolisme sel tanaman melalui enzim, toksin, zat pengatur tumbuh, dan zat lainnya yang menyerap nutrisi secara terus menerus dari sel inang untuk kebutuhannya. Beberapa patogen juga dapat menyebabkan penyakit dengan tumbuh dan berkembang biak pada jaringan xilem atau floem tanaman, sehingga dapat menghambat transportasi hara mineral dan air melalui jaringan pengangkut tanaman tersebut.
Cendawan Pyricularia oryzae, Rhizoctonia solani, dan Helminthosporium oryzae (Santoso dan Anggiani 2009) serta bakteri Xathomonas oryzae pv. oryzae (Hifni 1993) merupakan patogen penyebab penyakit-penyakit penting pada tanaman padi. Patogen-patogen tersebut dapat menyebabkan penurunan kuantitas dan kualitas hasil produksi padi. Cendawan P. oryzae menyebabkan penyakit blas yang merupakan salah satu masalah dalam produksi padi di seluruh dunia. Serangan penyakit blas di daerah endemik dapat menyebabkan kehilangan hasil 11% sampai 50% (Yolanda 2013). Cendawan R. solani penyebab hawar pelepah daun bakteri menyebabkan kehilangan hasil padi di Indonesia sebesar 20%, dan pada keparahan penyakit di atas 25% kehilangan hasil bertambah 4% untuk tiap kenaikkan 10% keparahan (Suparyono 1999). Bakteri X. oryzae pv. oryzae penyebab penyakit hawar daun bakteri menyebabkan kerugian hasil panen sebesar 21% sampai 36% pada musim hujan dan sebesar 18% sampai 28% pada musim kemarau (Suparyono dan Sudir 1992 dalam Wahyudi et al. 2011). Penyakit bercak daun coklat yang disebabkan cendawan H. oryzae dapat menyebabkan kehilangan hasil yang bervariasi yaitu 4% sampai 52% (Barnwal et al. 2013).
Tindakan pengendalian patogen dapat dilakukan dengan berbagai macam teknik pengendalian. Menurut Dent (1995), beberapa teknik pengendalian yang dilakukan dalam pengendalian OPT antara lain pengendalian kimiawi, pengendalian biologi, kultur teknis, varietas tahan, dan rekayasa genetik. Greenberg et al. (2012) juga menjelaskan bahwa pengelolaan hama terpadu (PHT) dapat dianggap sebagai komponen kunci dari sistem pertanian berkelanjutan. PHT didefiniskan sebagai pendekatan yang berkelanjutan untuk mengelola OPT dengan penggabungan teknik biologi, fisik mekanis, dan kimiawi dengan mengurangi risiko kesehatan dan pencemaran lingkungan.
2
menghasilkan stimulan. Organisme yang umum digunakan dalam pengendalian hayati adalah cendawan dan bakteri antagonis (Agrios 2005).
Agens hayati atau organisme yang menguntungkan bagi tanaman dapat diperoleh dari wilayah OPT berasal dan juga dapat diperoleh dari wilayah lain (Norris et al. 2003). Messenger (1976) menyebutkan beberapa kriteria yang dapat menjadi pertimbangan dalam memilih area eksplorasi agens hayati di antaranya daerah asal spesies target, daerah yang memiliki iklim dan kondisi lingkungan yang relatif sama, dan daerah yang berdekatan dengan target. Selain itu, eksplorasi juga dapat dilakukan di daerah yang memiliki sejarah lahan, vegetasi, dan struktur habitat yang menyajikan keragaman maksimal. Eksplorasi yang dilakukan pun harus luas dan bervariasi sehingga dapat memaksimalkan kemungkinan dalam penemuan agens hayati.
Banjo et al. (2006) menemukan bahwa terdapat beberapa bakteri patogen dan non-patogen yang berasosiasi dengan permukaan tubuh dan saluran pencernaan lundi. Bakteri non-patogen yang ditemukan antara lain Bacillus subtilis dan B. furmus. Beberapa bakteri dari genus Bacillus telah diketahui mampu menghambat pertumbuhan bakteri patogen tanaman, di antaranya: Erwinia carotovora penyebab penyakit busuk lunak pada umbi kentang (Javandira et al. 2013) dan X. oryzae pv. oryzae (Findy 2009). Lundi merupakan fase larva dari kumbang famili Scarabaeidae. Menurut Roma et al. (2012), lundi biasanya berkembang baik pada tumpukan bahan organik yang sedang mengalami proses pembusukan. Besar kemungkinan bahwa permukaan tubuh lundi terpapar oleh berbagai jenis mikroorganisme, salah satu di antaranya adalah yang berpotensi sebagai agens hayati.
Tujuan Penelitian
Penelitian ini bertujuan mendapatkan isolat bakteri agens hayati yang berasal dari permukaan tubuh lundi (Coleoptera: Scarabaeidae).
Manfaat Penelitian
3
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dari bulan Maret hingga September 2015.
Alat dan Bahan
Alat yang digunakan dalam penelitian yaitu cangkul, box plastik, cutter, gunting, kantong plastik, jarum suntik, laminar air flow, shaker, vortex, tabung reaksi, cawan petri, labu erlenmeyer, jarum inokulum, autoklaf, cork borrer, tabung appendorf, kaca objek, kaca penutup, timbangan, microwave, mikroskop compound, mesin PCR, UV transilluminator, alat tulis, serta kamera digital.
Bahan yang digunakan dalam penelitian yaitu sampel lundi, media potato dextrose agar (kentang 200g/L, D-glucose 20 g/L, agar 15g/L), nutrient agar (beef extract 3g/L, peptone 5g/L, agar 15g/L), nutrient broth (beef extract 3g/L, peptone 5g/L), sucrose peptone agar (sukrosa 20g/L, peptone 5 g/L, K2HPO4 0.5
g/L, MgSO4-7H2O 0.25 g/L, agar 12 g/L), KOH 3%, alkohol 70%, gliserol,
tanaman tembakau, spritus, tissue, air akuades, digestion solution, proteinase, RNAse, lysis solution, etanol 50%, lysozim, wash buffer I, wash buffer II, elution buffer, agarose 1%, loading dye, EtBr, PCR component, dan isolat bakteri Xanthomonas oryzae pv. oryzae serta isolat cendawan patogen Pyricularia oryzae, Helmintosporium oryzae, Rhizoctonia solani yang diperoleh dari koleksi Laboratorium Bakteriologi Departemen Proteksi Tanaman IPB.
Metode Penelitian Pengambilan Sampel Lundi dari Lapangan
Pengambilan sampel lundi dilakukan di kebun pendidikan kelapa sawit IPB Jonggol dan kebun percobaan Cikabayan IPB Darmaga dengan pengambilan sampel secara bebas sesuai jumlah sampel yang dibutuhkan. Pengambilan sampel tersebut dilakukan dengan tujuan untuk mendapatkan sampel lundi yang mengandung bakteri calon agens hayati. Sampel lundi yang telah diperoleh tersebut kemudian ditempatkan di dalam wadah atau box plastik dengan tujuan agar sampel tersebut tidak rusak.
Peremajaan Isolat Patogen
4
Isolasi Bakteri dari Sampel Lundi
Lundi diambil sebanyak satu larva kemudian dimasukkan ke dalam tabung erlenmeyer yang berisi 100 ml air steril. Tabung erlenmeyer tersebut kemudian dikocok menggunakan shaker dengan kecepatan 100 rpm selama 1 jam hingga diperoleh suspensi yang diharapkan berisi calon isolat bakteri agens hayati. Suspensi tersebut kemudian diencerkan dengan pengenceran berseri (10-1 hingga 10-5) yaitu dengan cara 1 ml suspensi diambil dan dimasukkan ke dalam tabung reaksi yang telah berisi air steril sebanyak 9 ml. Hasil pengenceran tersebut kemudian diambil sebanyak 100 µl dan kemudian disebar menggunakan metode cawan sebar pada media NA masing-masing sebanyak dua ulangan. Penyebaran dilakukan di dalam laminar air flow untuk menghindari terjadinya kontaminasi. Selanjutnya media tersebut diinkubasi selama 24 hingga 48 jam serta diberi label sesuai tingkat pengencerannya (Hadioetomo 1993). Bakteri calon agens hayati yang telah tumbuh dimurnikan dan diremajakan hingga diperoleh isolat murni calon bakteri agens hayati.
Uji Gram
Uji Gram merupakan salah satu prosedur yang penting dan banyak digunakan dalam klasifikasi bakteri. Teknik sederhana dengan KOH bisa digunakan sebagai pengujian cepat dalam pendugaan klasifikasi bakteri. Metode ini dapat dilakukan dengan mencampurkan satu lup isolat bakteri dengan dua tetes KOH 3%. Bakteri Gram negatif akan menghasilkan lendir selama proses pencampuran sedangkan bakteri Gram positif tidak menghasilkan lendir. Jika hasilnya diragukan, uji Gram dapat dilakukan dengan metode pewarnaan Gram menggunakan safranin, cristal violet, dan larutan iodium (Schaad et al. 2001).
Seleksi Bakteri Calon Agens Hayati
Uji reaksi hipersensitif. Pengujian reaksi hipersensitif bertujuan untuk mengetahui potensi patogenisitas bakteri calon agens hayati terhadap tanaman. Uji hipersensitif tersebut dilakukan terhadap tanaman tembakau pada jaringan daun yang telah membuka sempurna. Isolat bakteri calon agens hayati dibiakkan pada media nutrient broth (NB) dan diinkubasi selama 24 jam. Setelah itu, sebanyak 1 ml isolat bakteri tersebut diinfiltrasikan ke dalam jaringan daun tembakau menggunakan alat suntik steril tanpa jarum melalui permukaan bawah daun. Pengamatan terhadap gejala yang muncul dilakukan setelah 24 jam. Gejala nekrosis menunjukkan bahwa bakteri bersifat patogen pada tanaman atau bereaksi positif, sedangkan jaringan daun yang tidak bergejala menunjukkan bahwa bakteri bersifat non-patogen pada tanaman atau bereaksi negatif.
5
R2
Uji antagonisme terhadap bakteri X. oryzae pv. oryzae dilakukan pada media nutrient agar (NA) sedangkan uji antagonisme terhadap cendawan patogen dilakukan pada media potato dextrose agar (PDA). Pengamatan dilakukan dengan cara mengukur ada atau tidaknya zona bening yang ditimbulkan oleh bakteri agens hayati terhadap bakteri patogen. Pengukuran pada uji antagonisme terhadap cendawan patogen dilakukan dengan mengukur jari-jari miselium cendawan yang menjauhi bakteri calon agens hayati (R1) dan jari-jari miselium cendawan yang mendekati bakteri calon agens hayati untuk melihat persentase hambatan pertumbuhan radial (Gambar 2).
Data hasil pengukuran jari-jari miselium cendawan patogen selanjutnya dihitung menggunakan rumus persentase hambatan pertumbuhan radial (Royse dan Ries 1977 dalam Soesanto et al. 2013) sebagai berikut:
% penghambatan pertumbuhan radial =R −R
R x %
Keterangan:
R1: jari-jari miselium cendawan patogen yang menjauhi isolat bakteri. R2: jari-jari miselium cendawan patogen yang mendekati isolat bakteri.
Persentase penghambatan bakteri patogen selanjutnya dihitung menggunakan rumus persentase penghambatan menurut Findy (2009) dengan modifikasi sebagai berikut:
% penghambatan pertumbuhan bakteri = − x % Keterangan:
R1: koloni bakteri patogen pada perlakuan kontrol.
R2: koloni bakteri patogen pada perlakuan bakteri agens hayati.
Gambar 1 Uji antagonisme: bakteri calon agens hayati dengan bakteri patogen X. oryzae pv. oryzae (A), dan bakteri calon agens hayati dengan cendawan patogen (B). Huruf a menunjukkan bakteri calon agens hayati, b menunjukkan bakteri patogen, dan c menunjukkan cendawan patogen
b
a c
R1
A B
6
Identifikasi Bakteri yang Berpotensi sebagai Agens Hayati dengan Teknik Molekuler
Ekstraksi DNA total bakteri. Proses ekstraksi DNA kromosom bakteri diawali dengan penyiapan biakan bakteri pada media cair. Bakteri ditumbuhkan pada media NB selama 24 hingga 48 jam untuk mendapatkan massa bakteri. Selanjutnya ekstraksi DNA kromosom bakteri dilakukan dengan menggunakan KIT komersial (Thermoscientific geneJET Genomic DNA Purification KIT #K0722) dengan mengikuti petunjuk dari perusahaan dengan sedikit modifikasi (Sunarno et al. 2014). Sebanyak 1.5 ml biakan bakteri tersebut dimasukkan ke dalam tabung eppendorf dan disentrifugasi dengan kecepatan 8 000 rpm selama 10 menit pada suhu ruang hingga diperoleh pelet bakteri.
Pelet bakteri yang telah diperoleh selanjutnya diresuspensikan kembali dengan menambahkan digestion solution sebanyak 180 μl dan proteinase K
sebanyak 20 μl hingga diperoleh suspensi bakteri. Suspensi tersebut dibuat homogen dengan menggunakan vortex mixer selama 15 detik dan diinkubasi pada suhu 56oC selama 30 menit. Setiap 10 menit, suspensi tersebut dibolak-balik. Setelah diinkubasi, sebanyak 20 μl RNAse ditambahkan ke dalam suspensi tersebut selanjutnya diinkubasi pada suhu ruang selama 10 menit. Kemudian,
sebanyak 200 μl lysis solution ditambahkan pada suspensi lalu divortex kembali selama 15 detik. Setelah itu, sebanyak 400 μl etanol 50% ditambahkan pada suspensi tersebut.
Purifikasi DNA dilakukan terhadap kedua jenis suspensi bakteri. Suspensi bakteri yang telah diperoleh dari proses ekstraksi DNA dimasukkan ke dalam collection tube (saringan) dan disentrifugasi dengan kecepatan 6 000 rpm selama satu menit. Kemudian debrish, yang berada pada bagian/lapisan bawah saringan, dibuang. Lapisan epifase, yang berada pada lapisan teratas saringan, dibiarkan tetap berada dalam saringan kemudian ditambahkan dengan 500 μl wash buffer I dan disentrifugasi kembali dengan kecepatan 10 000 rpm selama satu menit. Kemudian lapisan debrish dibuang kembali sedangkan lapisan epifase
ditambahkan dengan 500 μl wash buffer II dan disentrifugasi kembali pada kecepatan 12 000 rpm selama tiga menit. Sentrifugasi diulang kembali untuk mengeringkan pelet. Kemudian larutan epifase diambil dan dipindahkan pada tabung eppendorf baru. Selanjutnya ditambahkan dengan elution buffer sebanyak 50-200 μl dan dibiarkan selama tiga menit. Kemudian disentrifugasi dengan kecepatan 12 000 rpm selama 3 menit hingga diperoleh pelet DNA bakteri. Pelet DNA bakteri disimpan pada suhu -20oC.
Amplifikasi DNA gen 16S rRNA bakteri calon agens hayati. Proses amplifikasi dilakukan dengan memodifikasi metode Rolph et al. (2001). Proses tersebut menggunakan mesin PCR dengan beberapa tahapan. Pre-denaturation pada suhu 94oC selama 3 menit, siklus yang digunakan sebanyak 35 siklus (denaturation pada suhu 94oC selama 30 detik, annealing pada suhu 57oC selama
7
dianalisis ukuran masing-masing fragmen DNA yang dibandingkan dengan marker 1 kb.
8
HASIL DAN PEMBAHASAN
Lokasi Pengambilan Sampel dan Jenis Sampel Lundi (Coleoptera: Scarabaeidae)
Pengambilan sampel lundi dilakukan pada dua lokasi perkebunan kelapa sawit, yaitu kebun pendidikan kelapa sawit IPB Cikabayan dan Jonggol (Gambar 3). Kebun pendidikan kelapa sawit IPB Cikabayan terletak di Desa Babakan, Kecamatan Dramaga, Kabupaten Bogor, Jawa Barat pada 6o33’7.5636” LS dan
106o42’56.6664” BT di ketinggian 169.878 mdpl. Kebun pendidikan kelapa sawit IPB Jonggol terletak di Desa Singasari, Kecamatan Jonggol, Kabupaten Bogor, Jawa Barat pada 6o28’27,9984” LS dan 107o1’56,8704” BT dengan ketinggian
101.971 mdpl.
Tanaman kelapa sawit yang ditanam pada kedua lokasi pengambilan sampel lundi tersebut merupakan kelapa sawit jenis tenera. Tanaman kelapa sawit di lokasi Cikabayan berumur 18 tahun sedangkan pada lokasi Jonggol berumur 4.2 tahun. Kebun di lokasi Cikabayan dilakukan pemupukan kimiawi setiap enam bulan satu kali dan dilakukan pemanenan satu kali dalam satu bulan. Sedangkan kebun di lokasi Jonggol, pemupukan kimiawi dilakukan setiap enam bulan satu kali dan pemupukan organik sebelum tanam. Pengendalian hama dan penyakit pada lokasi tersebut dilakukan hanya jika terdapat serangan OPT dengan intensitas tinggi.
Sampel lundi yang diperoleh dari kedua lokasi pengambilan sampel merupakan lundi dari ordo Coleoptera famili Scarabaeidae (Gambar 4). Lundi merupakan fase larva dari kumbang. Variasi waktu perkembangan larva dipengaruhi oleh jenis makanan dan iklim (Wibawanti 2010). Larva dari famili Scarabaidae memiliki kepala dan abdomen yang kuat dan hidup di dalam tanah. Larva makan bahan organik mati, perakaran, dan umbi-umbian (Kalshoven 1981).
Gambar 3 Lokasi pengambilan sampel: kebun Pendidikan Kelapa Sawit IPB Cikabayan (A), Kebun Pendidikan Kelapa Sawit Jonggol (B)
Gambar 4 Jenis sampel lundi: penampakan keseluruhan tubuh lundi dari famili Scarabaeidae (A), penampakan ujung abdomen lundi bagian ventral yang memiliki banyak seta
A B
9
Perilaku lundi didominasi oleh faktor cahaya. Di lingkungan alami, jika lundi ditempatkan pada permukaan medium perkembangbiakan lundi akan cepat bergerak turun menjauhi cahaya. Selain itu, lundi tersebut biasanya berkembang baik pada tumpukan bahan organik yang sedang mengalami proses pembusukan (Roma et al. 2012).
Jenis dan Jumlah Isolat Bakteri Calon Agens Hayati Hasil Isolasi dari Permukaan Tubuh Lundi
Bakteri calon agens hayati hasil isolasi dari permukaan tubuh lundi dikarakterisasi berdasarkan karakter morfologinya (Lampiran 1). Hal tersebut dilakukan dengan tujuan untuk menyeleksi bakteri calon agens hayati berdasarkan jenis bakteri yang berbeda. Koloni-koloni bakteri yang diperoleh diduga menunjukkan jenis koloni yang berbeda (Lampiran 2).
Tabel 1 Isolat bakteri calon agens hayati hasil isolasi dari permukaan tubuh lundi Lokasi asal Jumlah koloni (CFU/ekor) Jenis isolat
Jonggol 15 x 106 15
Cikabayan 1.9 x 106 11
Total 26
Jumlah dan jenis isolat bakteri calon agens hayati yang diperoleh dari sampel lundi asal Jonggol lebih banyak jika dibandingkan dengan bakteri asal Cikabayan (Tabel 1). Hal tersebut diduga karena bahan organik di lokasi Cikabayan mengalami tingkat pelapukan bahan organik yang sudah lanjut, karena umur tanaman kelapa sawit pada lokasi tersebut jauh lebih tua jika dibandingkan dengan tanaman kelapa sawit pada lokasi Jonggol. Tingkat pelapukan bahan organik yang sudah lanjut berpengaruh pada jumlah dan keragaman mikroorganisme yang ada pada lokasi tersebut. Menurut Yuniven (2014), tingkat pelapukan bahan organik pada tanah yang sudah lanjut menyebabkan ketersediaan unsur hara yang diperlukan tanaman menjadi tidak lagi tersedia dan organisme tanah tidak mendapatkan sumber makanan dan energi.
Selain itu, sejarah lahan juga dapat mempengaruhi keragaman dan jumlah mikroorganisme yang ada pada lahan tersebut. Sejarah lahan kelapa sawit Jonggol yang dijadikan lokasi pengambilan sampel lundi merupakan lahan hutan. Sejarah lahan kelapa sawit Cikabayan yang dijadikan lokasi pengambilan sampel lundi merupakan lahan perkebunan karet. Menurut Swibawa et al. (2009), keragaman vegetasi pada suatu wilayah dapat berdampak terhadap keragaman biota dalam tanah. Semakin menurunnya keragaman vegetasi tanaman maka jumlah biota tanah pun akan menurun pula. Salah satu penyebab penurunan keragaman vegetasi adalah konversi hutan menjadi lahan pertanian.
Pengujian Gram dan Reaksi Hipersensitif Calon Bakteri Agens Hayati
10
negatif lebih sensitif dan tidak memiliki ketahanan terhadap penghambat basa seperti larutan KOH sehingga dinding sel akan pecah kemudian DNA keluar dan terbentuklah benang-benang lendir. Bakteri Gram positif memiliki dinding sel yang tahan terhadap larutan KOH dan melekat sehingga ada DNA yang dibebaskan (Shivas dan Beasley 2005).
Hasil pengujian reaksi hipersensitif menunjukkan bahwa secara keseluruhan semua isolat bakteri calon agen hayati tidak bersifat patogenik tanaman kecuali isolat LC06 yang bersifat patogen tanaman (tabel 2). Bakteri yang bersifat patogen tanaman tersebut ditandai dengan adanya gejala nekrosis pada jaringan daun tanaman tembakau yang diuji, sedangkan bakteri non-patogen ditandai dengan tidak adanya gejala nekrosis pada jaringan daun tembakau (Gambar 4).
Tabel 2 Hasil pengujian Gram dan hipersensitif bakteri calon agens hayati Kode
isolat
Pengujian Kode Isolat
Pengujian
Gramd Hipersensitife Gram Hipersensitif
LJa01b - - LJ14 - -
aIsolat bakteri calon agens hayati yang diperoleh dari permukaan tubuh lundi asal Jonggol, bangka
menunjukkan penomoran isolat, cIsolat bakteri calon agens hayati yang diperoleh dari permukaan
tubuh lundi asal Cikabayan, dTanda + menunjukkan bakteri Gram positif, tanda – menunjukkan
bakteri Gram negatif, eTanda + menujukkan adanya gejala nekrosis pada daun saat uji
hipersensitif, tanda – menujukkan tidak ada gejala apapun saat uji hipersensitif
Ketahanan tanaman dalam pengujian hipersensitif akan mengenali adanya molekul khusus yang dihasilkan oleh patogen. Infeksi pada jaringan daun oleh bakteri patogen menyebabkan hancurnya semua membran seluler dari sel-sel yang berkontak dengan bakteri, kemudian diikuti dengan pengeringan dan nekrosis pada jaringan daun yang terserang bakteri tersebut. Jaringan daun yang mengalami nekrosis bertujuan mengisolasi patogen dari substansi hidup di sekitarnya sehingga menyebabkan patogen tersebut mati (Agrios 2005).
Gambar 5 Reaksi hipersensitif: gejala nekrosis (A), tanpa gejala nekrosis (B)
11
Pengujian Potensi Antagonisme Bakteri Calon Agens Hayati terhadap Patogen Penting pada Tanaman Padi
Pengujian potensi antagonisme dengan metode dual culture memperlihatkan bahwa pertumbuhan cendawan patogen dapat dihambat oleh beberapa jenis bakteri calon agens hayati dari permukaan tubuh lundi. Begitu pula dengan pengujian potensi antagonisme dengan metode cross streak terhadap bakteri patogen. Persentase penghambatan dan jumlah bakteri yang mampu menghambat pertumbuhan patogen menunjukkan hasil yang bervariasi (Tabel 3).
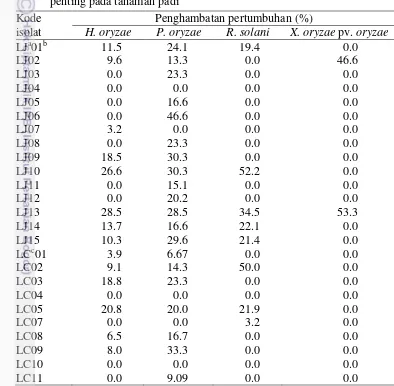
Tabel 3 Persentase penghambatan radial dan zona bening yang dihasilkan oleh bakteri calon agens hayati dari permukaan tubuh lundi terhadap patogen penting pada tanaman padi
aIsolat bakteri calon agens hayati yang diperoleh dari permukaan tubuh lundi asal Jonggol, bangka
menunjukkan penomoran isolat, cIsolat bakteri calon agens hayati yang diperoleh dari permukaan
tubuh lundi asal Cikabayan
12
yaitu 52.2% terhadap R. solani, 30.3% terhadap P. oryzae, dan 26.6% terhadap H. oryzae. Isolat LJ13 mampu menekan semua jenis patogen uji dengan persentase hambat yang bervariasi. Persentase penghambatan terhadap patogen uji yang dihasilkan isolat LJ13 yaitu 34.5% terhadap R. solani, 28.5% terhadap P. oryzae, dan 28.5% terhadap H. oryzae, serta 53.3% terhadap X. oryzae pv. oryzae.
Uji lebih lanjut yang dilakukan pada dua calon bakteri agens hayati potensial (LJ10 dan LJ13) menunjukkan keefektifan yang berbeda terhadap ke empat patogen uji berdasarkan hasil analisis ragam (Lampiran 3). Persentase penghambatan yang dihasilkan oleh bakteri LJ10 dan LJ13 juga menunjukkan nilai yang berbeda nyata pada H. oryzae, R. solani dan X. oryzae pv. oryzae, tetapi tidak berbeda nyata pada P. oryzae (Tabel 4).
Tabel 4 Persentase penghambatan radial yang dihasilkan oleh bakteri LJ10 dan LJ13 terhadap empat jenis patogen uji
zKode Isolat Persentase penghambatana
H. oryzae P. oryzae R. solani X. oryzae pv. oryzae LJ10 22.523b 29.220a 48.767a 00.000b LJ13 27.777a 27.437a 36.953b 53.000a
aAngka selajur yang diikuti oleh huruf yang sama tidak berbeda nyata menurut uji Tukey pada
taraf 5%
Penghambatan pada cendawan patogen ditandai dengan adanya jarak antara cendawan patogen dan bakteri calon agens hayati (Gambar 6). Jarak tersebut menunjukkan pertumbuhan hifa cendawan yang abnormal jika dibandingkan dengan pertumbuhan hifa cendawan pada arah yang berlawanan. Hifa abnormal diduga karena adanya senyawa anticendawan yang dihasilkan oleh bakteri.
Pengamatan struktur sel pada hifa cendawan yang menjauhi bakteri agens hayati secara mikroskopis juga menunjukkan adanya bentuk morfologi hifa yang abnormal (Gambar 7). Pertumbuhan hifa cendawan yang tidak normal tersebut diduga karena adanya senyawa anticendawan yang dihasilkan bakteri calon agens hayati. Senyawa anticendawan tersebut kemudian menghambat pertumbuhan cendawan patogen uji. Eliza et al. (2007) menyatakan bahwa senyawa anticendawan yang dihasilkan oleh bakteri secara umum mengakibatkan terjadinya pertumbuhan yang abnormal pada hifa (malformasi), yang ditunjukkan dengan pembengkakan dan pemendekan hifa dan mengakibatkan hifa tidak dapat berkembang dengan sempurna. Di samping itu juga ditemukan hifa patogen yang lisis. Hal ini disebabkan karena bakteri menghasilkan enzim kitinase yang dapat melisis dinding sel patogen, dinding sel beberapa cendawan patogen dilaporkan disusun oleh senyawa kitin.
Gambar 6 Potensi antagonisme bakteri calon agens hayati terhadap cendawan patogen: H. oryzae (A), R. solani (B), P. oryzae (C)
13
Pertumbuhan bakteri patogen yang terhambat ditunjukkan dengan adanya zona bening (Gambar 8). Zona bening yang terlihat dapat diakibatkan karena adanya senyawa antibiotik yang dihasilkan oleh bakteri calon agens hayati. Senyawa antibiotik merupakan hasil dari metabolisme sekunder bakteri. Menurut Javandira et al. (2013), pengaruh senyawa antibiotik memiliki peran dalam proses sintesa protein sel. Sintesa protein sel dapat terhambat bila terkena senyawa antibiotik sehingga sel menjadi rusak dan tidak dapat melakukan sintesa protein. Beberapa jenis antibiotik yang biasa digunakan di antaranya adalah streptomisin, tetrasiklin, sikloheksamid, dan blastisidin (Agrios 2005).
Identifikasi Bakteri Calon Agens Hayati dengan Teknik Molekuler
Isolat bakteri calon agens hayati dari permukaan tubuh lundi yang memiliki potensi paling baik jika dibandingkan dengan isolat bakteri lainnya dalam menghambat keempat patogen uji kemudian diidentifikasi menggunakan teknik molekuler. Bakteri tersebut adalah isolat bakteri LJ10 (Gambar 9A) dan isolat bakteri LJ13 (Gambar 9B).
Hasil amplifikasi fragmen gen 16S rRNA calon bakteri agens hayati dengan kode isolat LJ10 dan LJ13 menggunakan primer universal berhasil menampilkan pita DNA dengan ukuran 1500 bp (Gambar 10). Pita DNA dari kedua isolat yang
A
Gambar 7 Miselium cendawan patogen yang terpapar oleh bakteri agens hayati dengan perbesaran 400 kali: hifa cendawan patogen R. solani normal (A), hifa mengerut dan mengecil (B), hifa keriting (C)
C B
A B
Gambar 8 Potensi antagonisme: perlakuan kontrol (A), adanya zona bening yang terlihat di antara bakteri LJ13 dan Xanthomonas oryzae pv. oryzae (B)
A B
14
telah melalui proses PCR berhasil diisolasi dengan menghasilkan pita sesuai dengan ukuran pasang basa untuk mengidentifikasi gen 16S rRNA yaitu dengan ukuran ~1500 pb. Hal ini menunjukkan bahwa primer serta kondisi PCR yang digunakan dapat mengamplifikasi amplikon dengan baik sesuai dengan target gen 16S rRNA. Urutan basa nukleotida yang diperoleh (Lampiran 4 dan 5) kemudian disejajarkan pada data Genbank.
Analisis sekuen parsial gen mengindikasikan bahwa isolat LJ10 termasuk ke dalam genus Citrobacter sedangkan isolat LJ13 termasuk ke dalam genus Bacillus (Tabel 5). Hasil analisis genotipe tersebut menyebutkan bahwa isolat LJ10 memiliki kedekatan ciri genetik terdekat dengan Citrobacter farmeri sebesar 97 hingga 98% sedangkan isolat LJ13 memiliki kedekatan ciri genetik terdekat dengan Bacillus sp. sebesar 97%.
Tabel 5 Analisis sekuen parsial gen 16s rRNA dua isolat bakteri dari permukaan tubuh lundi dengan gen 16s rRNA di pusat GenBank
Kode Isolat Spesies homolog Quent query (%)
Sel bakteri Bacillus spp. berbentuk batang dan lurus, berukuran 0.5-2.5 μl x 1.2-10 μl, dan sering membentuk rantai atau berpasangan dengan ujung yang bulat atau persegi. Bakteri tersebut termasuk dalam kelompok Gram positif. Umumnya endospora berbentuk oval, namun terkadang berbentuk bulat atau silinder dan sangat tahan pada kondisi yang buruk, aerobik atau aerobik fakultatif, dengan Gambar 10 Hasil amplifikasi DNA bakteri calon agens hayati dengan penanda
(marker) 1 kb: bakteri dengan kode isolat LJ10 (1) dan LJ13 (2)
15
keragaman yang besar dari kemampuan fisiologis yang peka terhadap panas, pH, dan salinitas. Bakteri tersebut dapat ditemukan pada habitat yang luas, beberapa spesies adalah patogen pada vertebrata dan invertebrata (Holt et al. 1994).
Bakteri Bacillus sp. tergolong memiliki mekanisme antagonis berupa antibiosis terhadap jamur (Abidin et al. 2015). Antimikroba dan antifungal yang dihasilkan oleh Bacillus sp. di antaranya adalah surfactin (fengycin, iturin, bacillomycin) dan senyawa peptid antibiotik lain (Stein 2005). Selain itu, Bacillus sp. telah diketahui mampu memacu pertumbuhan bagi tanaman karena diketahui dapat membantu menghasilkan hormon pertumbuhan seperti asam indoleasetat (IAA), asam giberelat, sitokinin, dan etilen pada tanaman (Sulistiani 2009).
Senyawa antibiotik yang dihasilkan bakteri dari genus Bacillus dapat merusak dinding sel bakteri patogen. Sehingga aktivitas metabolisme bakteri patogen menjadi terganggu dan menyebabkan sel bakteri patogen mati. Pengaruh senyawa antibiotik juga memiliki peran dalam proses sintesa protein sel. Sintesa protein sel dapat terhambat bila terkena senyawa antibiotik sehingga sel menjadi rusak dan tidak dapat melakukan sintesa protein (Javandira et al. 2013).
Bakteri Citrobacter farmeri merupakan salah satu bakteri dari genus Citrobacter (Bruckner et al. 1997). Bakteri dari genus Citrobacter pada umumnya melakukan pergerakan dengan menggunakan flagela peritrichous dan bersifat anaerobik fakultatif. Suhu optimal perkembangannya yaitu 37oC. D-glukosa dan karbohidrat lainnya dikatabolisme dengan memproduksi asam dan gas. Bakteri tersebut dapat ditemukan pada feses manusia dan hewan. Seringkali diisolasi dari spesimen klinis sebagai patogen oportunistik. Selain itu juga dapat ditemukan di tanah, air, limbah, dan makanan (Holt et al. 1994).
Citrobacter farmeri merupakan salah satu patogen manusia (Bruckner et al. 1997). Berbagai literatur menyebutkan bahwa isolat bakteri dari spesies tersebut merupakan menyebabkan penyakit pada manusia dalam beberapa kasus, di antaranya menyebabkan kematian pada penderita meningitis yang juga menderita kanker nasofaring (Tan et al. 2010) dan infeksi pada anak penderita sindrom usus pendek (short-bowel-syndrome) (Bruckner et al. 1997).
Bakteri dari genus Citrobacter sp. telah diketahui dapat menyebabkan infeksi pada manusia pada hampir semua usia termasuk usia remaja dan menengah. Infeksi yang diakibatkan bakteri tersebut juga terjadi pada pria maupun wanita dengan proporsi yang signifikan pada populasi laki-laki. Besarnya infeksi Citrobacter telah meningkat dari waktu ke waktu mengingat potensinya untuk menyebabkan infeksi nosokomial dan meningkatnya jumlah pasien dengan imunitas lemah (immunocompromised) di rumah sakit; C. koseri dan C. freundii menjadi spesies yang paling umum terisolasi (Nayar et al. 2014).
16
SIMPULAN DAN SARAN
Simpulan
Isolat bakteri yang diisolasi dari permukaan tubuh lundi (Coleoptera: Scarabaeidae) yaitu sebanyak 26 jenis, 21 di antaranya memiliki potensi sebagai agens hayati. Isolat bakteri yang memiliki kemampuan antagonis terhadap Helminthosporium oryzae yaitu sebanyak 14 isolat, 20 isolat terhadap Pyricularia oryzae, delapan terhadap Rhizoctonia solani, dan dua isolat terhadap Xanthomonas oryzae pv. oryzae. Isolat bakteri LJ10 mampu menghambat pertumbuhan cendawan patogen H. oryzae, P. oryzae dan R. solani. Isolat bakteri LJ13 tidak hanya mampu menghambat ketiga cendawan patogen tetapi juga mampu menghambat pertumbuhan bakteri X. oryzae pv. oryzae. Hasil identifikasi molekuler menunjukkan bahwa isolat bakteri LJ10 memiliki kemiripan sebesar 97% hingga 98% terhadap bakteri Citrobacter farmeri, sedangkan isolat bakteri LJ13 memiliki kemiripan sebesar 97% terhadap bakteri Bacillus sp..
Saran
17
DAFTAR PUSTAKA
Abidin Z, Aini LQ, Abadi AL. 2015. Pengaruh bakteri Bacillus sp. dan Pseudomonas sp. terhadap pertumbuhan jamur patogen Sclerotium rolfsii Sacc. penyebab penyakit rebah semai pada tanaman kedelai. Jurnal Hama Penyakit Tumbuhan. 3(1):1-10.
Agrios GN. 2005. Plant Pathology. Ed ke-5. San Diego (US): Elsevier.
Banjo AD, Lawal OA, Adeyemi AI. 2006. The microbial fauna assosiated with the larvae of Oryctes monoceros. Journal of Applied Sciences Research. 2(11):837-843.
Barnwal MK, Kotasthane A, Magculia N, Mukherjee PK, Savary S, Sharma AK, Singh HB, Singh US, Sparks AH, Variar M, Zaidi N. A review on crop losses, epidemiology and disease management of rice brown spot to identify research priorities and knowledge gaps. Journal Plant Pathology. 136:443-457. Doi 10.1007/s10658-013-0195-6.
Bruckner DA, Colonna P, Gleen D, Sharon, Abbott, Janda JM. 1997. Citrobacter farmeri Bacteremia in a child with Short-Bowel Syndrome. Journal of Clinical Microbiology. 35(12):3353-3354.
Dent D. 1995. Integrated Pest Management. London (GB): Chapman Hall. Eliza MA, Munif A, Djatnika I, Widodo. 2007. Karakter fisiologis dan peranan
antibiosis bakteri perakaran Graminae terhadap Fusarium dan pemacu pertumbuhan tanaman pisang. Jurnal Hortikultura. 17(2):150-160.
Findy K. 2009. Aktivitas penghambatan Bacillus sp. terhadap Xanthomonas oryzae pv. oryzae, Pseudomonas syringae pv. glycines, dan Pseudomonas fluerescens [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Greenberg SM, JA John, SA John. 2012. Principles and practices of integrated pest management on cotton in the Lower Rio Grande Valley of Texas. Di dalam: Larramendy ML, Sonia S, editor. Integrated Pest Management and Pest Control-Current and Future Tactics. Weslaco (US): intech. hlm 3-34. Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek. Jakarta (ID):
Gramedia Pustaka Utama.
Hifni HR. 1993. Kinerja penelitian tanaman pangan. Variasi Patogen Hawar Daun Bakteri Padi di Indonesia. Simposium penelitian tanaman pangan III. 1993 Agustus 23-25; Jakarta/Bogor. Bogor (ID): PEI. Hal 503-507.
Holt JG, Noel RK, Peter HAS, James TS, Stanley TW. 1994. Bergey’s Manual of Determinative Bacteriology. Ed ke-8. New York (USA): Sanstache.
Javandira C, Lukman QA, Abadi LA. 2013 Pengendalian penyakit busuk lunak umbi kentang (Erwinia carotovora) dengan memanfaatkan agens hayati Bacillus subtilis dan Pseudomonas fluorescens. Jurnal Hama Penyakit Tumbuhan. 1(1):90-97.
Kalshoven LGE. 1981. The Pests of Crops in Indonesia. Laan PA Van Der , penerjemah. Jakarta (ID): Ichtiar Baru. Terjemahan dari: De Plagen van de Cultuurgewassen in Indonesia.
18
Nayar R, Indu S, Asfia S. 2014. Epidemiology, prevalence and identification of Citrobacter species in clinical specimens in a tertiary care hospital in India. International Journal of Scientific and Research Publications. 4(4):1-6. Norris RF, Edward PC, Marcos K. 2003. Concepts in Integrated Pest
Management. New Jersey (US): Prentice Hall.
Rolph HJ, Lennon A, Riggio MP, Saunders WP, Kenzie DM, Coldero L, Bagg J. 2001. Molecular identification of microorganism from endodontic infections. Journal of Clinical Microbiology. 39(9):328-3289.
Roma I, Tio US dan Syahnen. 2012. Mengapa O.rhinoceros menjadi hama pada tanaman kelapa sawit. Medan (ID): Balai Besar Perbenihan dan Proteksi Tanaman Perkebunan (BBPPTP) Medan.
Santoso, Anggiani N. 2009.Pengendalian penyakit blas dan penyakit cendawan lainnya [Internet]. [diunduh 2015 Oktober 08]. Tersedia pada: http://www.litbang.pertanian.go.id/bbpadi_2009_itp_20_cendawan.pdf. Schaad NW, Jones JB, Chun W. 2001. Laboratory Guide for Identification of
Plant Pathogenic Bacteria, 3rd ed. St. Paul (US): APS Press.
Shivas R, Beasley D. 2005. Pengelolaan koleksi patogen tanaman. [Internet]. [diunduh pada 2016 Januari 3] Tersedia pada: http://daff.gov.au.
Soesanto L, Endang M, Ruth FR, Ratna SD. 2013. Uji kesesuaian empat isolat Trichoderma spp. dan daya hambat in vitro terhadap beberapa patogen tanaman. Jurnal Hama Penyakit Tumbuhan Tropika. 13(2):117-123.
Stein T. 2005. Bacillus subtilis antibiotics: structures, syntheses and specific functions. Journal of Molecular Microbiology. 56(4):845-857. doi: 10.1111/j.1365-2958.2005.04587.x
Sulistiani. 2009. Formulasi spora Bacillus sebagai agens hayati dan PGPR (Plant Growth Promoting Rhizobacteria) pada berbagai bahan pembawa [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Sunarno, Muna F, Fitri N, Malim A, Karuniawati A, Soebandrio A. 2014. Metode cepat ekstraksi DNA Corynebacterium diphtheriae untuk pemeriksaan PCR. Buletin Penelitian kesehatan. 42(2):85-92.
Suparyono S. 1999. Peran sklerotium dan bentuk lain pathogen Rhizoctonia solani Kuhn. sebagai sumber inokulum awal penyakit hawar pelepah padi. Jurnal Perlindungan Tanaman Indonesia. 5:7-12.
Supriadi. 2006. Analisis risiko agens hayati untuk pengendalian patogen pada tanaman. Jurnal Litbang Pertanian. 25(3):75-80.
Swibawa IG, Evizal R, Aini FK, Susilo FX, Hairiah K. 2009. Penurunan keragaman pohon dan nematoda akibat alih guna hutan menjadi lahan pertanian memacu munculnya masalah nematoda. Di dalam: Kurniawan A, Undaharta NKE, Wibawa IPAH, Tirta IG, Sujarwo W, editor. Konservasi Flora Indonesia dalam Mengatasi Dampak Pemanasan Global. Seminar Konservasi; 2009 Juli 14; Bali, Indonesia. Bali: LIPI. hlm 688-697.
Tan CK, Lai CC, Lin SH, Liao CH. 2010. Fatal Citrobacter farmeri meningitis in a patient with nasopharyngeal cancer. Journal of Clinical Microbiology. 48(4):1499-1500. doi: 10.11.28/JCM.00282-10.
19
Wibawanti R. 2010. Pengenalan dan pengendalian hama (Oryctes rhinoceros) pada tanaman kelapa. [Internet]. [diunduh pada 2015 Maret 16]. Tersedia pada: http://ditjenbun.pertanian.go.id/perlindungan/berita-216-upaya-pengend-alian-kumbang-kelapa-oryctes-rhinoceros-di-yogyakarta.html. Yolanda K. 2013. Penyakit blast padi. [Internet]. [diunduh pada: 22 Feb 2016].
Tersedia pada: http://babel.litbang.pertanian.go.id/ind/index.php?option= com_content &view=article&id=198: penyakit-blast-padi&catid=15:info-teknologi.
21
22
Lampiran 1 Karakteristik morfologi bakteri calon agens hayati dari permukaan tubuh lundi asal Jonggol dan Cikabayan
aisolat bakteri yang diperoleh dari permukaan tubuh lundi asal Jonggol, bangka menunjukkan
penomoran isolat, cIsolat bakteri yang diperoleh dari permukaan tubuh lundi asal Cikabayan
Kode LJ08 Putih kekuningan Bundar Tidak
beraturan
Datar
LJ09 Kekuningan Bundar tengah timbul
LJ15 Kekuningan Tidak beraturan
LC10 Kekuningan Tidak beraturan
Berombak Datar
23
Lampiran 2 Karakteristik koloni bakteri hasil isolasi dari permukaan tubuh lundi berumur 4 hari yang terlihat pada media NA: bakteri LC01 (a), LC02 (b), LC03 (c), LC05 (d), LC06 (e), LC03 (f), LJ04 (g), LJ10 (h)
a b
c d
e f
24
Lampiran 3 Hasil analisis ragam penghambatan isolat bakteri calon agens hayati dari permukaan tubuh lundi terhadap beberapa patogen penting pada tanaman padi
Sumber DB JK KT Fhit Pr > F Helminthosporium oryzae
Perlakuan 1 41.39626667 41.39626667 14.46 0.0191 Error/Galat 4 11.45493333 2.86373333
Total Terkoreksi 5 52.85120000 Pyricularia oryzae
Perlakuan 1 4.77041667 4.77041667 4.03 0.1150 Error/Galat 4 4.72906667 1.18226667
Total Terkoreksi 5 9.49948333 Rhizoctonia solani
Perlakuan 1 209.3322667 209.3322667 16.50 0.0153 Error/Galat 4 50.7397333 12.6849333
Total Terkoreksi 5 260.0720000
Xanthomonas oryzae pv. oryzae
Perlakuan 1 4213.500000 4213.500000 1455.72 <.0001 Error/Galat 4 11.577800 2.894450
Total Terkoreksi 5 4225.077800
Lampiran 4 Urutan nukleotida parsial gen 16S rRNA isolat bakteri LJ10
25
Lampiran 5 Urutan nukleotida parsial gen 16S rRNA isolat bakteri LJ13
26
RIWAYAT HIDUP
Penulis dilahirkan di Bangka pada tanggal 4 Mei 1994 dari Bapak Achmad Nurshad FU dan Ibu Murdiana. Penulis adalah putri pertama dari tiga bersaudara. Tahun 2011 penulis dinyatakan lulus dari SMA Negeri 2 Bengkulu Selatan dan pada tahun yang sama penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor melalui jalur SNMPTN Undangan.
Selama mengikuti perkuliahan, penulis aktif mengikuti beberapa kegiatan organisasi, di antaranya adalah sebagai anggota Dewan Gedung Asrama Putri Silva Sari IPB pada tahun 2011, Bendahara Departemen Internal BEM Fakultas Pertanian IPB pada tahun 2012, anggota Organic Farming Club Departemen Proteksi Tanaman pada tahun 2012, pengurus di Departemen Mitra Desa BEM Fakultas Pertanian IPB pada tahun 2013, dan anggota Ikatan Mahasiswa Bumi Raflesia pada tahun 2011 hingga 2015. Selain itu, penulis juga aktif di berbagai kepanitiaan, antara lain: anggota divisi medis kegiatan TPB Cup pada tahun 2011, bendahara divisi Logstran kegiatan Masa Perkenalan Kampus Mahasiswa Baru (MPKMB) 49 IPB pada tahun 2012, penanggung jawab divisi dana usaha organisasi daerah IMBR dalam kegiatan Gebyar Nusantara IPB pada tahun 2012, sekretaris kegiatan Masa Perkenalan Fakultas (MPF) Saung Tani 49 Faperta IPB 2013, penanggung jawab kelompok dalam kegiatan Masa Perkenalan Departemen (MPD) Poepa 49 pada tahun 2013, anggota divisi Acara dan LO kegiatan Future Leader Agriculture (FLA) pada tahun 2013, anggota divisi acara dalam kegiatan National Plant Protection (NPV) pada tahun 2015, bendahara kegiatan Agriculture Youth Leader Camp (AYLC) II pada tahun 2015.
Penulis menjadi asisten praktikum Dasar-Dasar Proteksi Tanaman pada tahun 2014, serta asisten praktikum Pestisida dalam Proteksi Tanaman dan asisten Pendidikan Agama Islam pada tahun 2015. Selain itu, penulis pun pernah bekerja