EVALUASI KEAMANAN TEPUNG TEMPE DARI KEDELAI
TRANSGENIK MELALUI UJI SUBKRONIS
DENGAN TIKUS PERCOBAAN
MARYANI SUWARNO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Evaluasi Keamanan Tepung Tempe dari Kedelai Transgenik Melalui Uji Subkronis Dengan Tikus Percobaan adalah benar karya saya dengan arahan komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014
Maryani Suwarno F251110341
RINGKASAN
MARYANI SUWARNO. Evaluasi Keamanan Tepung Tempe dari Kedelai Transgenik Melalui Uji Subkronis Dengan Tikus Percobaan. Dibimbing oleh MADE ASTAWAN dan TUTIK WRESDIYATI.
Tempe merupakan pangan sumber protein yang penting bagi bangsa Indonesia. Sebagai sumber protein yang berasal dari nabati, tahu dan tempe berkontribusi sedikitnya 9.2% dari pola konsumsi protein penduduk Indonesia. Tempe sudah dikenal sejak abad ke-17 dan hingga kini masih diproduksi secara tradisional. Tempe dibuat dari kedelai melalui proses fermentasi menggunakan kapang Rhizopus sp. Umumnya proses pembuatan tempe dari mulai pencucian kedelai hingga akhir proses fermentasi memerlukan waktu sekitar tiga hingga empat hari.
Dari total produksi kedelai di dunia, 75% berupa kedelai transgenik. Amerika, Brazil dan Argentina sebagai negara penghasil kedelai terbanyak di dunia (80% dari total produksi dunia) lebih dari 90% petaninya membudidayakan kedelai transgenik. Kebutuhan kedelai untuk konsumsi yang mencapai 2,5-3 juta ton per tahun memaksa Indonesia untuk mengimpor sebanyak 1.95 juta ton per tahun. Sebagian besar kedelai impor berupa kedelai transgenik atau dikenal sebagai Genetically Modified (GM) soybean. Penggunaan kedelai untuk pembuatan tempe mencapai 50% dari total kebutuhan nasional.
Kekhawatiran akan pangan yang berasal dari tanaman transgenik mengharuskan pangan yang berasal dari tanaman transgenik diuji keamanannya dan dievaluasi untuk melihat adanya potensi toksisitas dan alergi, komponen gizi atau racun baru, stabilitas gen yang disisipi, serta dampak buruk yang disebabkan oleh proses rekayasa genetik. Tujuan dari penelitian ini adalah untuk mengevaluasi keamanan tempe yang dibuat dari kedelai transgenik, melalui uji subkronis pada tikus jantan Sprague-Dawley. Pengujian toksisitas terhadap tempe dari kedelai transgenik dilakukan mengikuti prinsip pengujian European Food Safety Authority (EFSA, 2011) pada tikus percobaan.
Tidak ada perbedaaan bobot badan akhir, pertambahan bobot badan, FCE, serta bobot organ hati dan ginjal antar kelompok tikus percobaan. Analisis hematologi menunjukkan tidak terdapat perbedaan pada kadar hemoglobin, eritrosit, leukosit, hematokrit dan trombosit antar perlakuan. Hasil analisis serum juga menunjukkan tidak terdapat perbedaan pada nilai SGOT, SGPT, protein total, albumin, globulin, glukosa, trigliserida, ureum dan kreatinin antar perlakuan.
Pengamatan mikroskopik terhadap sediaan histologi jaringan hati tidak menunjukkan adanya kelainan. Hal ini sesuai dengan analisis serum terhadap SGOT, SGPT, trigliserida, glukosa, protein total, albumin dan globulin yang menunjukkan fungsi hati dalam keadaan baik. Hasil pengamatan pada jaringan ginjal tikus seluruh kelompok perlakuan, juga menunjukkan tidak adanya kerusakan. Hal ini sesuai dengan analisis kadar ureum dan kreatinin serum yang mengindikasikan bahwa fungsi ginjal dalam keadaan baik.
Hasil penelitian ini menyimpulkan bahwa tidak ada dampak yang merugikan akibat mengonsumsi tempe dari kedelai transgenik. Beberapa penelitian jangka panjang sebelumnya terhadap kedelai transgenik juga menunjukkan bahwa konsumsi kedelai transgenik bersifat aman dan tidak menimbulkan dampak yang merugikan kesehatan.
Dengan demikian dapat disimpulkan bahwa konsumsi tepung tempe yang berasal dari kedelai transgenik bersifat aman dan tidak merugikan kesehatan.
SUMMARY
MARYANI SUWARNO. Safety Evaluation of Tempe Made from Transgenic Soybean Using Subchronic Test on Rats. Supervised by MADE ASTAWAN and TUTIK WRESDIYATI
Tempe, made from soybean fermented with Rhizopus sp., is important for Indonesian people. As a protein source, tempe and tofu contributes about 9.2% of daily protein requirement. Tempe is made from soybean fermented with Rhizopus sp. Generally, the process of tempe production, from washing, soaking until fermentation process is about three to four days.
Soybean utilization for tempe production is 50% from its total national supply. To fulfill the need for soybean consumption that reached up to 2,5 – 3 million tons per year, Indonesia has to import this commodity. Around 1,9 million tons of imported soybean or about 78% of total supply per year, are mostly transgenic soybean or known as Genetically Modified (GM) Soybean (80% global production of soybean is transgenic).
Concerns about food derived from transgenic plants require food derived from genetically modified crops should be tested and evaluated for the presence of potential toxicity and allergies, nutritional or toxic components of the new protein, the stability of the inserted genes, and the adverse effects caused by the genetic engineering process. The aim of this research was to evaluate the safety of tempe made from transgenic soybean, by a subchronic test approach using male Sprague-Dawley rats. Toxicity evaluation of tempe from transgenic soybean was based on EFSA (2011) principal using animal laboratory.
This research was conducted in three major phases, namely the process of tempe and tempe flour production for feed formulation, treatment of experimental laboratory rats, blood analysis and histological observations. For 90 days, three groups of male rats (each group contain seven rats) were fed ad libitum with tempe flour from transgenic soybean, tempe flour from non-transgenic soybean and casein as protein sources. Clinical parameters was observed to examine that all rats were healthy and in good condition. Every six days the rats body weight were measured. A leftover feed was weighed to be counted in feed conversion efficiency (FCE).
All rats were sacrified on day 90 using anesthezid dose of ketamin and xylazine, where the blood, liver and kidney were collected. Blood is taken from the heart to be analyzed hematology and serum profile. Hematology profile include measuring levels of hemoglobin, erythrocytes, leukocytes, platelets and hematocryte. The serum parameters include enzyme levels in serum GOT,GPT, glucose, triglycerides, total protein, albumin, globulin, ureum and creatinine. Liver and kidneys were weighed to be prepared for histology. Rat body weight, body weight gain, FCE, the analysis of hematology and serum and organ weights were then statistically analyzed using a complete randomized design followed with post hoc Duncan test.
The result of this research showed that consumption of tempe flour derived from transgenic soybean was safe, and caused no adverse effect on health. Previous researches on transgenic soybean also showed that consumption of transgenic soybean for long term in rat showed no adverse effect on health.
It can be concluded that the consumption of soybean flour derived from transgenic soybeans are safe and not harmful to health.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
EVALUASI KEAMANAN TEPUNG TEMPE DARI KEDELAI
TRANSGENIK MELALUI UJI SUBKRONIS
DENGAN TIKUS PERCOBAAN
MARYANI SUWARNO
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul : Evaluasi Keamanan Tepung Tempe dari Kedelai Transgenik Melalui Uji Subkronis Terhadap Tikus Percobaan
Nama : Maryani Suwarno NIM : F251110341
Disetujui Komisi Pembimbing
Prof Dr Ir Made Astawan, MS
Ketua Anggota
Prof Drh Tutik Wresdiyati PhD, PA VET
Diketahui
Ketua Program Studi Ilmu Pangan a.n. Dekan Sekolah Pascasarjana IPB
Prof Dr Ir Ratih Dewanti-Hariyadi, MSc Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ ala atas segala karunia dan rahmat-Nya, karya tulis ini berhasil diselesaikan. Penelitian dengan judul Evaluasi Keamanan Tepung Tempe dari Kedelai Transgenik melalui Uji Subkronis dengan Tikus Percobaan dilaksakan sejak bulan Januari 2013.
Penghargaan dan ucapan terima kasih dihaturkan kepada Badan Penelitian dan Pengembangan Pertanian Kantor Pusat Jakarta, (surat Perjanjian Pelaksanaan Kegiatan, No : 709/LB.620/I.1/2/2013 tanggal 25 Februari 2013 atas nama Made Astawan) atas bantuan dana penelitian.
Penghargaan dan terima kasih yang tiada terhingga kepada Prof Dr Ir Made Astawan, MS dan Prof Drh Tutik Wresdiyati, PhD. PAVET selaku komisi pembimbing, atas kesabaran dan keikhlasannya dalam memberikan bimbingan, arahan, nasehat, dorongan semangat, mulai dari penulisan proposal, selama pelaksanaan penelitian dan hingga penulisan tugas akhir ini selesai. Begitu banyak ilmu dan cerita yang akan menjadi hikmah untuk masa depan penulis.
Penulis menghaturkan terima kasih kepada Prof (R) Dr.Ir. Sri Widowati MAppSc. atas kesediaanya menjadi dosen penguji luar komisi pada ujian tesis.
Terima kasih kepada Mursyid, Prima, Pa Adi dan Pa Iwan, atas banyak bantuannya selama penulis melaksanakan penelitian.
Penghargaan dan terima kasih kepada para dosen dalam lingkup departemen Ilmu dan Teknologi Pangan dan Ilmu Pangan IPB, serta dosen dan staf di Laboratorium Histologi FKH atas ilmu yang penulis dapatkan selama ini.
Teristimewa penulis ucapkan terima kasih kepada suami tercinta, Dondick Wicaksono, anak-anakku Arsa dan Maher, kedua mertuaku Mama Lola dan Papa Hariadi Wiroto, serta Ibuku Mamih Heriyana atas kesabaran, keikhlasan, do’a, kasih sayang serta dukungan moril dan materilnya selama penulis berjuang menyelesaikan studi master ini.
Kepada semua pihak yang telah membantu, semoga Allah subhanahu wa ta’ala berkenan membalas setiap kebaikan itu dengan balasan yang lebih baik. Amiin.
Semoga karya ilmiah ini bermanfaat.
Bogor, Mei 2014
DAFTAR ISI
DAFTAR TABEL DAFTAR GAMBAR DAFTAR LAMPIRAN
PENDAHULUAN 1
Latar Belakang 1
Tempe dan Kedelai dalam Sistem Pangan Indonesia 1
Kualitas Gizi pada Tempe 3
Rekayasa Genetik pada Kedelai 5
Keamanan Tanaman Transgenik 7
Kebijakan Pangan Transgenik di Indonesia 9
Menguji Keamanan Pangan Transgenik 10
Perumusan dan Pendekatan Masalah 12
Tujuan Penelitian 12
Hipotesis 12
METODE PENELITIAN 12
Waktu dan Tempat 12
Bahan dan Alat 13
Tahapan penelitian 13
1. Pembuatan tempe dan tepung untuk formulasi ransum 13
2. Pembuatan ransum tikus percobaan 13
3. Perlakuan hewan percobaan 15
4. Pengambilan darah untuk Analisis Hematologi dan Serum 15
5. Histologi 16
6. Analisis statistika dan pengamatan histologi 16
HASIL DAN PEMBAHASAN 16
Formulasi Ransum Tikus Percobaan 16
Parameter Klinis dan Pertumbuhan Tikus Percobaan 17
Profil Hematologi Tikus Percobaan 19
Analisis Serum Darah Tikus Percobaan 21
Pengamatan Histologi Jaringan Hati dan Ginjal 25
Fragmentasi DNA dalam Tempe 28
KESIMPULAN DAN SARAN 30
Kesimpulan 30
Saran 30
DAFTAR PUSTAKA 34
DAFTAR TABEL
1 Produksi kedelai dunia (dalam juta ton) 2
2 Volume dan nilai impor beberapa bahan pokok, tahun 2011 2 3 Komposisi gizi kedelai dan tempe (per 100 gram bahan kering) 3
4 Kandungan asam amino bebas pada tempe 4
5 Tanaman transgenik dunia dominan 2010 7
6 Rumus formulasi komposisi ransum tikus percobaan 15 7 Analisis proksimat kasein, tepung tempe transgenik dan tepung tempe
non transgenik 17
8 Komposisi bahan dalam 100 gram ransum 17
9 Parameter klinis tikus percobaan 18
10 Kenaikan bobot dan konsumsi ransum tikus selama 90 hari percobaan 19 11 Nilai hematologi darah tikus setelah 90 hari percobaan 19 12 Profil biokimia serum tikus setelah 90 hari percobaan 24 13 Berat organ per 100 gram bobot badan tikus percobaan 26 14 Hasil penelitian jangka panjang terhadap kedelai transgenik 31
DAFTAR GAMBAR
1 Statistik produksi kedelai dunia 2
2 Peta sebaran tanaman transgenik dunia 7
3 Pengujian keamanan produk pangan transgenik dengan tikus percobaan 10
4 Bagan alir penelitian 14
5 Pertumbuhan tikus yang diberi ransum tepung tempe kedelai transgenik dan tepung tempe kedelai non-transgenik dibandingkan dengan
kasein (kontrol) 18
6 Foto jaringan hati tikus percobaan dengan pewarnaan HE setelah
pemberian ransum selama 90 hari percobaan 27
7 Jaringan ginjal tikus percobaan dengan pewarnaan HE setelah
pemberian ransum selama 90 hari 28
DAFTAR LAMPIRAN
1 Hasil analisis sidik ragam seluruh parameter menggunakan
RIWAYAT HIDUP
Penulis dilahirkan di Tasikmalaya pada 26 Februari 1980 sebagai anak sulung dari tiga bersaudara pasangan Wawan Suwarno (Alm.) dan Heriyana Baehaki. Pendidikan sarjana ditempuh di Program Studi Teknologi Pangan dan Gizi, Fakultas Teknologi Pertanian, Institut Pertanian Bogor pada tahun 1998 dan lulus pada tahun 2003. Pada tahun 2011, penulis diterima di Program Studi Ilmu Pangan pada Program Pascasarjana IPB dan lulus pada bulan Mei 2014.
Saat ini penulis menjadi pengajar Food Safety di Lembaga Training BOTC Jakarta. Sebelumnya, penulis pernah bekerja di Hotel Salak the Heritage Bogor, PT Ultrajaya Milk Industry Bandung, PT Tupperware Indonesia Jakarta dan PT Eksonindo Multy Product Industry Bandung antara tahun 2003 hingga 2011.
1
PENDAHULUAN
Latar Belakang
Tempe dan Kedelai dalam Sistem Pangan Indonesia
Tempe merupakan produk asli Indonesia yang memiliki nilai gizi dan ekonomi tinggi. Tempe dibuat dari kedelai melalui proses fermentasi menggunakan kapang Rhizopus sp. Sebagai sumber protein, tempe dikonsumsi dalam jumlah yang lebih banyak dari jenis pangan sumber protein lainnya. Angka kecukupan gizi (AKG) protein orang Indonesia sebanyak 52 gram per hari, terpenuhi oleh konsumsi tahu dan tempe sebanyak 4.9 g atau sekitar 9.2%; susu dan telur sebanyak 5.8% dan serealia sebanyak 39.3% (Hardinsyah 2013).
Kedelai memegang peranan penting dalam sistem pangan di Indonesia. Sebanyak 83.7% dari total pasokan kedelai nasional digunakan untuk pembuatan tahu dan tempe (Hardinsyah 2013). Bahkan menurut Astawan (2013), 50% atau sekitar 1.3 juta ton kedelai nasional digunakan oleh produsen tempe. tempe dikonsumsi sebanyak 19.1g/kapita/hari atau sekitar 7 kg/kapita/tahun, dimana orang perkotaan mengonsumsi protein nabati ini lebih banyak dibandingkan dengan orang di daerah pedesaan, yaitu 21.3g/kapita/hari, sedangkan di pedesaan hanya 17 g/kapita/hari. Pola kebiasaan akan konsumsi tempe dan tahu terkonsentrasi di wilayah Jawa dan Bali serta sebagian kecil Sumatra. Penduduk Jawa Timur mengonsumsi tempe dan tahu hingga sebanyak 64.3 g/kapita/tahun atau 7.4 g protein/kapita/hari, mencukupi sekitar 14% angka kecukupan gizi protein (Hardinsyah 2013).
Tempe memiliki beberapa keunggulan dibandingkan kedelai utuhnya, di antaranya daya cerna protein, karbohidrat dan lemaknya lebih tinggi (lebih mudah dicerna); kandungan beberapa vitamin lebih tinggi; ketersediaan (bioavalabilitas) mineral menjadi lebih baik karena hilangnya faktor antigizi; serta ditemukannya berbagai komponen bioaktif yang sebelumnya tidak ada pada kedelai. Beberapa komponen bioaktif ini memiliki aktivitas antioksidan, antidiare serta mencegah penyakit degeneratif (Astuti et al. 2000; Nout dan Kiers 2005;). Selain kualitas gizinya lebih baik dari kedelai utuhnya, tempe diketahui berpotensi sebagai pangan hipoalergenik, karena proses fermentasi dapat mengurangi sifat alergenisitas dari protein kedelai (Wilson et al. 2005; Song et al. 2008).
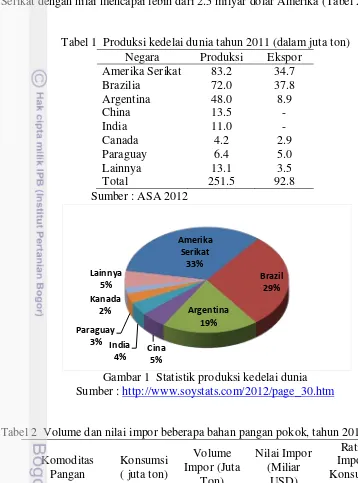
Kedelai yang berasal dari daratan Cina dapat tumbuh di iklim tropis maupun sub-tropis, tumbuh pada kisaran suhu 20-30oC pada saat musim panas. Kedelai paling baik tumbuh pada tanah aluvial dengan kandungan organik yang tinggi. Masa panen kedelai mencapai antara 80 hingga 120 hari (OECD 2000). Negara penghasil kedelai terbesar di dunia adalah Amerika, Brazil dan Argentina yang mencapai 80% dari total produksi global (Gambar 1). Pada tahun 2011, produksi kedelai dunia mencapai 251 juta ton (Tabel 1).
2
kedelai mencapai sekitar 2.3 juta ton biji kering. Untuk memenuhi kekurangannya, pemerintah telah mengimpor sebanyak lebih dari 1.9 juta ton atau sekitar 78% dari total kebutuhan kedelai nasional (BPS 2012). Impor terbesar berasal dari Amerika Serikat dengan nilai mencapai lebih dari 2.5 milyar dolar Amerika (Tabel 2).
Tabel 1 Produksi kedelai dunia tahun 2011 (dalam juta ton) Negara Produksi Ekspor
Amerika Serikat 83.2 34.7
Gambar 1 Statistik produksi kedelai dunia
Sumber :
3
Kualitas Gizi pada Tempe
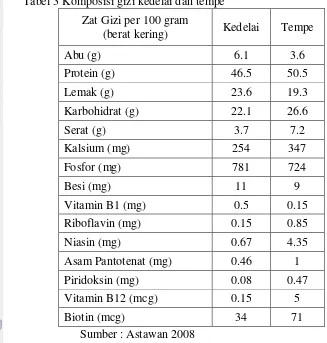
Secara umum, walaupun kandungan gizi antara kedelai dan tempe tidak berbeda jauh (Tabel 3), namun kualitas gizi tempe dapat dikatakan lebih baik dibandingkan dengan kualitas gizi kedelai utuhnya (Astawan 2008). Hal ini disebabkan selama pembuatan tempe, komponen zat gizi dalam kedelai yang berupa karbohidrat, protein serta lemak mengalami perubahan secara kimia dan biokimia (Astuti et al. 2000; Nout dan Kiers 2005). Adanya enzim protease, lipase dan amylase yang dihasilkan oleh kapang R.oligosporus menjadikan tempe lebih lebih mudah dicerna (Astawan 2008).
Tabel 3 Komposisi gizi kedelai dan tempe Zat Gizi per 100 gram
(berat kering) Kedelai Tempe
Abu (g) 6.1 3.6
Protein (g) 46.5 50.5
Lemak (g) 23.6 19.3
Karbohidrat (g) 22.1 26.6
Serat (g) 3.7 7.2
Kalsium (mg) 254 347
Fosfor (mg) 781 724
Besi (mg) 11 9
Vitamin B1 (mg) 0.5 0.15 Riboflavin (mg) 0.15 0.85
Niasin (mg) 0.67 4.35
Asam Pantotenat (mg) 0.46 1 Piridoksin (mg) 0.08 0.47 Vitamin B12 (mcg) 0.15 5
Biotin (mcg) 34 71
Sumber : Astawan 2008
Kandungan karbohidrat yang mencapai 35% (bk) pada bijinya terdiri dari gula bebas 10% (5% sukrosa, 4% stakiosa dan 1% rafinosa) serta antara 20-30% berupa polisakarida non-pati (Non Starch Polysaccharides), 8% selulosa serta sisanya berupa polisakarida pectin (Choct et al. 2010). Oligosakarida stakiosa dan rafinosa selain bersifat sebagai prebiotik juga dapat menyebabkan flatulensi jika dikonsumsi karena sifatnya yang tidak dapat dicerna (Rupérez 2006). Proses perendaman, pertunasan (sprouting) serta fermentasi kedelai dapat meningkatkan daya cerna karbohidrat serta mengurangi kandungan oligosakarida hingga 100%
4
energinya. Selain rafinosa dan stakiosa, beberapa oligosakarida dengan berat molekul yang besar juga ikut terdegradasi selama proses fermentasi dikarenakan
aktivitas enzim karbohidrase, salah satunya α -galaktosidase (Wang et al. 2003; Nout dan Kiers 2005).
Selama proses fermentasi, protein dalam kedelai mengalami degradasi dan hidrolisis menjadi peptida sederhana dan asam-asam amino bebas. Derajat hidrolisis protein tergantung kepada strain dari Rhizopus. Umumnya tempe yang dikonsumsi di Indonesia dihasilkan dari proses fermentasi 48 jam dengan Rhizopus oligosporus. Perbedaan lamanya fermentasi mempengaruhi kadar asam amino bebas yang terkandung dalam tempe (Handoyo dan Morita 2006). Kandungan asam amino bebas pada tempe meningkat selama proses fermentasi (Tabel 4). Selama proses fermentasi berlangsung, protein globulin yang ada dalam kedelai terdegradasi sehingga menjadikan protein yang terdapat dalam kedelai lebih mudah dicerna. Protein globulin yang terdegradasi selama fermentasi 48-72 jam adalah sekitar 90%, sedangkan protein albumin terdegradasi sekitar 60% (Handoyo dan Morita 2006). Dalam Astawan (2008), nilai daya cerna protein pada kedelai rebus 75% sedangkan pada tempe meningkat menjadi 83%.
Tabel 4 Kandungan asam amino bebas pada tempe Asam Amino Bebas
(mg/100 g kedelai)
Lama Fermentasi (jam)
0 24 48
Asam Amino Esensial
Isoleusin 4.6 5.2 9.5
Leusin 4.2 6.6 10.1
Lisin 5.1 52.6 3.3
Metionin 2.1 0.7 1.3
Fenilalanin 1.4 5.6 6.2
Threonin 0.2 0.2 0.4
Valin 3.8 2.8 6.1
Asam Amino Semi Esensial
Arginin 26.7 32.4 7.6
Glysin 2.7 5.2 21.4
Histidin 1.7 26.4 2.0
Tyrosin 1.3 13.1 4.6
Asam Amino non-esensial
Alanin 11.2 104 229.7
Asparagin (Asn) 1.5 22.5 20.1 Aspartat (Asp) 3.6 5.4 17.1
Sistein 0.9 4.5 6.4
Glutamat 42.1 16.7 140.0
Prolin 1.0 6.8 20.7
Serin 0.1 1.5 3.6
Ornitin 1.4 5.1 0.0
GABA 2.7 21.4 7.1
5
Kandungan lemak pada tempe sedikit lebih rendah dibandingkan kadar lemak pada kedelai utuhnya. Selama proses fermentasi enzim lipase menghidrolisis triasilgliserol menjadi asam lemak bebas. Asam lemak bebas kemudian digunakan oleh kapang sebagai sumber energinya sehingga tempe memiliki kandungan lemak yang lebih rendah (Astuti et al. 2000). Kandungan asam lemak bebas meningkat pada kedelai rebus, yaitu 0.5% menjadi 21% pada tempe (Astawan 2008).
Faktor antigizi yang secara alami terdapat dalam kedelai, seperti tripsin inhibitor dan asam fitat menghilang atau berkurang banyak selama proses perendaman, perebusan dan fermentasi. Hal ini dikarenakan adanya enzim fitase yang diproduksi oleh R.oligosporus. Fitase akan mengubah fitat menjadi fosfor dan inositol (Astawan 2008). Selama proses pembuatan tempe, fitat berkurang hingga 65% (Sudarmaji dan Markakis 1977). Berkurangnya fitat dapat meningkatkan ketersediaan mineral karena fitat diketahui dapat mengkelat berbagai mineral seperti Zn, Fe, Ca. Dengan berkurangnya fitat pada tempe, mineral seperti zat besi akan meningkat ketersediaannya sehingga dapat dipergunakan oleh tubuh (Kasaoka et al.
1997; Macfarlene et al. 1990).
Kadar vitamin B-kompleks dalam tempe meningkat selama proses fermentasi, karena aktivitas beberapa bakteri, seperti Klebsiella pneumoniae dan
Citrobacter freundii yang memproduksi vitamin B12 (Keuth dan Bisping 1994). Dalam Mo et al. (2013), kandungan vitamin B12 dalam tempe adalah sekitar
0.16-0.72 μg/kg, sedangkan di Indonesia, umumnya kandungan vitamin B12 adalah sekitar 5 µg/100g (Astwan 2008). Selama proses perendaman, vitamin B12 diproduksi oleh Klebsiella pneumoniae. Walaupun diketahui kelompok
Enterobactericeae ini dapat menghasilkan enterotoxin, namun selama proses pembuatan tempe, baik Citrobacter freundi maupun Klebsiella pneumoniae tidak dapat menghasilkan enterotoksin shiga-like toxin. Tidak hanya vitamin B12 yang dihasilkan oleh bakteri ini, namun juga riboflavin dan vitamin B6 (Keuth dan Bisping, 1994). Umumnya vitamin B12 terdapat pada produk-produk hewani, namun kandungan vitamin B12 yang tinggi pada tempe menjadikan tempe sebagai satu-satunya sumber vitamin B12 yang potensial dari bahan pangan nabati (Astawan 2008).
Rekayasa Genetik pada Kedelai
Kedelai merupakan tanaman pangan yang penting di dunia, dibudidayakan karena kandungan minyak dan proteinnya yang cukup tinggi (FAO 1992). Dengan kandungan minyak sebesar 20% (per berat kering biji) menjadikan minyak kedelai sebagai sumber minyak pangan terbesar di dunia, mencapai 50% dari total produksi minyak yang berasal dari biji-bijian (oilseed) di dunia (FAO 1992). Tidak hanya kandungan proteinnya yang tinggi dalam biji, yaitu mencapai 40-45%, kedelai juga mengandung semua asam amino esensial yang diperlukan oleh tubuh. Kelengkapan asam aminonya menjadikan kedelai memiliki kualitas protein yang sebanding dengan protein hewani (Dixit et al. 2011).
6
Tanaman transgenik atau dikenal sebagai GMO menurut definisi WHO adalah organisme yang telah mengalami perubahan pada materi genetiknya sehingga organisme tersebut memiliki sifat-sifat yang tidak dimiliki sebelumnya. Gen yang disisipkan ke dalam organisme tersebut dapat berasal dari spesies yang sama ataupun berbeda (WHO 2002). Proses rekayasa genetika memungkinkan suatu organisme memiliki sifat yang berbeda yang secara alami tidak dimiliki oleh organisme tersebut. Karakter dari tanaman rekayasa genetika yang dihasilkan antara lain toleran terhadap herbisida (herbicide tolerant), resisten terhadap insektisida (Bt toxin), virus, jamur atau nematoda, atau bahkan bersifat toleran terhadap herbisida sekaligus resisten terhadap insektisida atau yang dikenal dengan istilah stacked trait
(Petriccione 2004). Tanaman hasil rekayasa genetika dengan karakteristik tersebut secara ekonomi sangat menguntungkan. Dengan produktivitas yang lebih tinggi, para petani kedelai dapat menghasilkan lebih banyak kedelai dalam area yang sama dengan sumber daya manusia yang lebih sedikit, yang artinya secara ekonomi lebih menguntungkan (Mensah 2007).
Secara global, produksi kedelai dapat ditingkatkan untuk dapat memenuhi permintaan pasar yang makin tinggi, seiring dengan bertambahnya penduduk dunia. Sejarah munculnya tanaman rekayasa genetika dengan karakter di atas dikarenakan antara tahun 1988 sampai 1990 produksi tanaman pangan global mengalami kerugian hingga mencapai 40% yang disebabkan oleh kurangnya kontrol terhadap serangan hama, penyakit, virus dan gulma. Delapan jenis tanaman pertanian penting adalah beras, barley, jagung, kentang, kedelai, kapas dan kopi. Kerugian mencapai 42.1% dari angka prediksi panen, dimana 15.6% disebabkan oleh serangan hewan (animal pest), 13.3% karena penyakit dan 13.2% disebabkan oleh gulma (Oerke 2006).
Selain bersifat tahan terhadap penyakit atau toleran terhadap herbisida, proses rekayasa genetika dapat menghasilkan tanaman dengan komposisi gizi yang lebih tinggi. Sebut saja kedelai yang menghasilkan kadar asam oleat lebih tinggi dibanding kedelai konvensional atau beras yang mengandung beta karoten, dikenal sebagai Golden Rice (James 2008). Saat ini, tanaman pertanian transgenik yang paling banyak dibudidayakan adalah yang bersifat tahan terhadap serangan hama dan penyakit. Contohnya kedelai toleran terhadap herbisida, atau dikenal sebagai
Roundup Ready (RR)®soybean dan Bt corn, yaitu jagung yang menghasilkan toksin yang berasal dari bakteri Bacillus thuringiensis (Bt), dimana gen yang disisipi mengkode protein kristal (Bt toxin) yang bersifat toksik terhadap lepidopteran. Selain bersifat toleran terhadap herbisida dan menghasilkan toksin bagi insektisida, ada juga tanaman pangan yang resisten terhadap virus.
Saat ini tanaman pertanian hasil rekayasa genetik atau dikenal sebagai
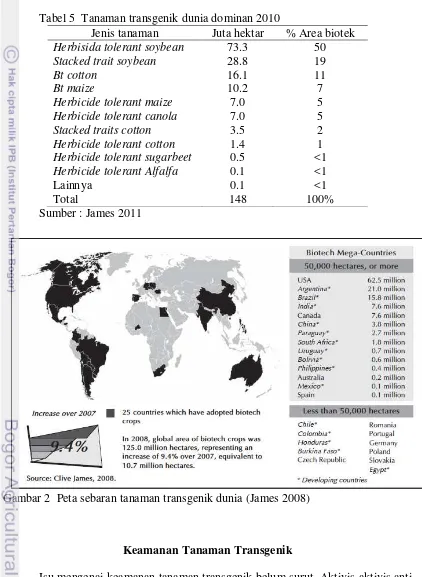
biotech crops di dunia didominasi oleh tanaman kedelai dengan karakter toleran terhadap herbisida (herbicide tolerant soybean) yang mencapai 50% area tanam keseluruhan tanaman biotek. Dari keseluruhan tanaman kedelai, 75% kedelai dunia dibudidayakan dari bibit transgenik, yaitu mencapai 75.4 juta hektar dari 100 juta hektar area yang ditanami kedelai. Total area dan peta sebaran tanaman transgenik dunia dapat dilihat pada Tabel 5 dan Gambar 2.
7
(EPSPS). Kekurangan enzim EPSPS ini akan mengganggu biosintesis asam amino aromatik fenilalanin, triptofan dan tirosin, sehingga akan mengganggu sintesis protein dan pertumbuhan tanaman. Enzim EPSPS secara alami terdapat pada hampir seluruh tanaman, fungi dan bakteri, namun tidak terdapat pada hewan (Padgette et al. 1995).
Tabel 5 Tanaman transgenik dunia dominan 2010
Jenis tanaman Juta hektar % Area biotek
Herbisida tolerant soybean 73.3 50
Stacked trait soybean 28.8 19
Bt cotton 16.1 11
Bt maize 10.2 7
Herbicide tolerant maize 7.0 5
Herbicide tolerant canola 7.0 5
Stacked traits cotton 3.5 2
Herbicide tolerant cotton 1.4 1
Herbicide tolerant sugarbeet 0.5 <1
Herbicide tolerant Alfalfa 0.1 <1
Lainnya 0.1 <1
Total 148 100%
Sumber : James 2011
Gambar 2 Peta sebaran tanaman transgenik dunia (James 2008)
Keamanan Tanaman Transgenik
8
Uni Eropa merupakan wilayah yang memilki regulasi yang ketat mengenai tanaman genetik. Jika dilihat dari peta sebaran tanaman transgenik, hanya beberapa negara di wilayah Uni Eropa yang telah mengadopsi tanaman transgenik. Uni Eropa juga membatasi impor komoditas dan pangan yang berasal dari transgenik dan mewajibkan produk transgenik yang beredar di pasaran harus diberi keterangan pada label / kemasannya bahwa produk tersebut mengandung transgenik. Toleransi kadar transgenik dalam pangan pun sangat kecil, yaitu 0.9% untuk pangan yang mengandung transgenik yang telah diotorisasi atau nol (zero tolerance) untuk pangan dengan kandungan transgenik yang belum diotorisasi. Proses otorisasi tersebut melalui tahapan yang panjang, lama dan memerlukan biaya yang sangat besar. Hanya perusahaan yang sangat besar lah yang mampu untuk mengomersialisasikan produk transgenik mereka ke daratan Eropa (Davison 2010).
Menurut definisi yang termuat dalam regulasi EC no.258/97 pangan yang berasal dari tanaman transgenik termasuk dalam kategori novel food, yaitu pangan atau bahan baku (ingredient) yang tidak pernah ada sejarahnya pernah dikonsumsi di wilayah EU sebelum Mei 1997. Oleh karenanya, semua jenis pangan transgenik yang akan dipasarkan di wilayah ini harus melalui uji keamanan serta evaluasi yang sama dengan novel foods. European Food Safety Authority (EFSA) merupakan badan yang bertanggung jawab untuk hal ini. Pengaturan secara spesifik mengenai pangan dan pakan transgenik dan pelabelannya tercantum dalam GM Food and Feed Regulation EC No.1829/2003. Setiap pangan hasil rekayasa genetika harus dievaluasi keamanannya secara kasus per kasus, termasuk potensi toksisitas, gizi, dan alergi, sebelum dapat dikomersialisasikan dan dipasarkan (Arvanitoyannis et al. 2005). Bahkan WHO (2009) dalam websitenya, menyebutkan bahwa produk pangan transgenik menjadi salah satu isu keamanan pangan dunia (global food safety issue) dan harus dievaluasi keamanannya (assessment of new food technologies, such as genetically modified food).
Hingga kini, baru sedikit otorisasi yang disahkan oleh Uni Eropa untuk dapat mengadopsi budidaya tanaman transgenik untuk konsumsi manusia. Dalam 14 tahun terakhir sejak pertama kali tanaman trangenik diperkenalkan dan dipasarkan di dunia, Uni Eropa hanya memperbolehkan budidaya dua jenis tanaman transgenik untuk konsumsi manusia, yaitu kentang Amflora dari BASF dan jagung MON810 dari Monsanto. Sedangkan untuk pakan ternak, Uni Eropa telah melegalkan lebih dari 50 jenis tanaman transgenik (Anonim 2014). Hanya beberapa negara di wilayah Eropa yang memperbolehkan kedelai transgenik untuk diadopsi, sehingga sebagian besar masih merupakan kedelai konvensional atau non-transgenik (Davidson 2010).
Ketatnya aturan mengenai pangan transgenik merupakan langkah pemerintah Uni Eropa untuk melindungi penduduknya yang khawatir mengenai dampak kesehatan yang berpotensi timbul akibat konsumsi pangan transgenik. Mengenai pelaksanaan pengujian keamanan pangan transgenik, secara rinci dijelaskan dalam pedoman pengujian menggunakan hewan coba yang dikeluarkan oleh EFSA (2011), yaitu pedoman pelaksanaan studi toksisitas pangan/pakan dengan dosis berulang 90 hari pada hewan percobaan (Guidance on conducting repeated-dose 90-day oral toxicity study in rodents on whole food/feed). Evaluasi dilakukan terhadap darah dan urin, berat organ serta gambaran histopatologi (FAO-WHO 2000; FDA 2003; EFSA 2005; EFSA 2011).
9
ekspresi protein baru akibat gen dari spesies lain, dimana protein yang baru ini dapat memunculkan toksisitas dan alergi (Kuiper et al. 2001; Pettricione 2004; Domingo 2007; Dona dan Arvanitoyannis 2009; Seralinni et al. 2009). Selain itu, dikarenakan sifatnya yang menjadi tahan terhadap pestisida atau herbisida, dikhawatirkan residu paparan pestisida ini dapat mengontaminasi tanaman selama kultivasi dan dapat ikut terkonsumsi (Antoniou et al. 2012).
Umumnya pangan transgenik menggunakan virus mosaic dari kembang kol (Cauliflower Mozaic Virus / CaMV 35S) sebagai promotor. Dikhawatirkan virus ini dapat termutasi atau berpindah dan dapat menimbulkan penyakit, bersifat karsinogen dan mutagen atau dapat memunculkan reaktivitas dan generasi baru virus (Dona dan Arvanitoyannis 2009). Selain itu, sifat resisten terhadap antibiotik yang digunakan sebagai gen penanda (marker gene) pada proses rekayasa genetika menimbulkan ketakutan bahwa mungkin saja gen ini dapat mempengaruhi aktivitas mikroorganisme yang ada pada saluran pencernaan, walaupun kemungkinan akan terjadinya hal ini sangatlah jarang (Dona dan Arvanitoyannis 2009). Oleh karena itu penanganan pangan hasil rekayasa genetika (GMO) atau transgenik harus dilakukan melalui pendekatan kehati-hatian (precautionary approach) guna memastikan keamanannya. Pangan transgenik harus memenuhi beberapa persyaratan yang telah ditentukan sebelum diedarkan. Pemerintah telah menetapkan regulasi terkait sebagai upaya untuk melindungi masyarakat.
Kebijakan Pangan Transgenik di Indonesia
Di Indonesia, regulasi mengenai pangan transgenik diatur dalam Undang-Undang Republik Indonesia Nomor 18 tahun 2012 tentang Pangan bagian ke-empat pasal 77-79, yang secara jelas menyatakan larangan untuk mengedarkan dan menjual pangan yang berasal dari tanaman transgenik sebelum dilakukan pengujian keamanan. Undang-Undang Republik Indonesia Nomor 36 Tahun 2009 tentang Kesehatan, Pasal 109 menegaskan bahwa “Setiap orang dan/atau badan hukum yang memproduksi, mengolah, serta mendistribusikan makanan dan minuman yang diperlakukan sebagai makanan dan minuman hasil teknologi rekayasa genetik harus menjamin agar aman bagi manusia, hewan yang dimakan manusia, dan lingkungan”. Pemerintah mewajibkan pemeriksaan keamanan Produk Rekayasa Genetika (PRG) sebelum diedarkan (pre-market food safety assessment). Pengkajian keamanan dilakukan oleh Komisi Keamanan Hayati Produk Rekayasa Genetik (KKH PRG).
Pangan PRG yang telah dinyatakan aman untuk dikonsumsi wajib mencantumkan label keterangan pangan PRG pada kemasan sebelum diedarkan. Pelabelan mengacu pada Peraturan Pemerintah Nomor 69 Tahun 1999 tentang Label dan Iklan Pangan dan Peraturan Kepala Badan Pengawas Obat dan Makanan Nomor HK.03.1.23.03.12.1564 Tahun 2012 tentang Pengawasan Pelabelan Pangan Produk Rekayasa Genetik.
10
transgenik tidak menimbulkan bahaya terhadap kesehatan (Hemre et al. 2005; Tudisco et al. 2006; Appenzeller et al. 2008; Daleprane et al. 2009; Qi et al. 2012; Snell et al. 2012), namun pengujian terhadap tempe perlu dilakukan, karena belum pernah dilakukan sebelumnya.
Menguji Keamanan Pangan Transgenik
Dalam panduan yang dikeluarkan oleh European Food Safety Authority
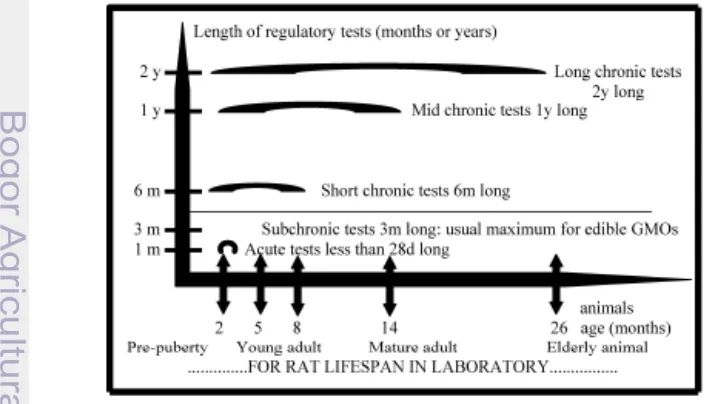
(EFSA 2011), pengujian keamanan pangan transgenik dilakukan mengikuti pedoman pengujian terhadap zat kimia atau dikenal sebagai uji toksisitas. Umumnya pengujian ini dilakukan untuk mengetahui dosis toksis suatu zat tertentu terhadap paparan manusia yang dilakukan melalui hewan percobaan. Pengujian toksisitas terbagi menjadi tiga, yaitu uji toksisitas akut, subkronis dan kronis. Toksisitas akut merupakan derajat efek toksik suatu senyawa yang terjadi dalam tempo singkat setelah pemberiannya dalam dosis tunggal atau pemberian berulang dalam waktu terbatas (umumnya 24 jam). Batasan waktu singkat adalah bisa dalam rentang 24 jam ataupun paling lama adalah 14 hari (Hodgson dan Levi 2000). Tujuan utama dilakukan pengujian ini adalah untuk menetapkan potensi ketoksikan akut, yakni kisaran dosis letal atau dosis toksik bahan uji pada satu hewan uji atau lebih. Selain itu pengujian toksisitas akut juga ditujukan untuk menilai berbagai macam gejala klinis yang timbul, adanya efek toksik yang khas dan mekanisme yang memerantarai terjadinya kematian hewan uji (Omaye 2004).
Uji ketoksikan sub kronis adalah uji ketoksikan suatu senyawa yang diberikan dengan dosis berulang pada hewan uji tertentu selama jangka waktu kurang lebih 10 % dari masa hidup hewan uji, misalnya 3 bulan untuk tikus dan 1 atau 2 tahun untuk anjing. Pengujian sub kronis ini bertujuan untuk menyelidiki efek toksik yang timbul karena pemberian berulang dari zat/senyawa/bahan tersebut dalam jangka waktu tertentu. Data pengujian sub kronis dapat memberikan informasi berharga mengenai efek kumulatif dari suatu zat pada organ sasaran, toleransi fisiologis dan metabolik pada dosis rendah dalam jangka waktu tertentu (Syabana 2010). Sedangkan uji ketoksikan kronis merupakan uji ketoksikan suatu zat/bahan/senyawa yang diberikan dengan dosis berulang pada hewan uji tertentu selama masa hidup hewan coba atau sekurang-kurangnya sebagian besar dari hidupnya, misal 18 bulan untuk mencit dan 24 bulan untuk tikus (Lu 1995; Omaye 2004). Jadi uji toksisitas subkronis dan akut hanya dibedakan berdasarkan waktunya saja.
Pengujian keamanan pangan transgenik yang dilakukan terhadap tikus percobaan harus dilakukan paling sedikit selama 90 hari (long term studies). Hal ini berdasarkan bahwa pangan transgenik akan dikonsumsi sepanjang masa. Penelitian subkronik selama 90 hari atau lebih dari tiga bulan lamanya dapat memberikan gambaran terhadap perubahan sistem metabolik, syaraf, imun, hormonal bahkan potensi kanker (Serallini et al. 2009). Ilustrasi mengenai pengujian pangan transgenik dapat dilihat pada Gambar 3.
11
profil hematologi, serum (atau plasma) dan urin; serta pengamatan terhadap histopatologi organ tikus percobaan (FDA 2000).
1. Pengamatan klinis hewan percobaan
Pada dosis tertentu paparan senyawa toksik terhadap suatu hewan uji tidak sampai mematikan hewan tersebut tetapi tetap dapat merusak organ sasarannya. Kerusakan terhadap organ tersebut kadang kala akan terlihat pada aktivitas dan tingkah laku keseharian hewan percobaan
2. Pengamatan terhadap berat badan dan konsumsi pakan
Pengamatan ini dilakukan untuk menilai apakah percobaan yang dilakukan berpengaruh terhadap konsumsi pakan hewan coba dan berkaitan dengan berat badannya.
3. Analisis kimiawi darah, serum atau urin
Analisis kimiawi darah biasanya mencakup hematokrit, hemoglobin, eritosit, leukosit dan trombosit. Pengujian yang dilakukan pada serum biasanya mencakup glukosa darah, SGOT, SGPT, alkalin fosfatase, protein total, lipid total, albumin, bilirubin, urea darah, kreatinin dan unsur-unsur anorganik seperti fosfor, kalium, kalsium, natrium dan klorida. Sedangkan pada urin mencakup pemeriksaan fisik warna, berat jenis, dan pH. Selain itu dilakukan juga pemeriksaan kimiawi yang mencakup protein, glukosa, keton, kreatinin, sel darah merah, kristal dan benda amorf.
Data hasil pengujian tersebut pada beberapa analisis dapat digunakan untuk menilai kerusakan organ tertentu, misalnya keberadaan enzim SGPT dan SGOT dan juga bilirubin yang tinggi dalam serum sampel mengindikasikan kerusakan hati, sedangkan jumlah kreatinin dan urea yang tinggi dalam serum dan urin mengindikasikan adanya kerusakan pada ginjal. 4. Pengamatan histologi terhadap organ/jaringan yang diduga menjadi sasaran
senyawa toksik.
Pengamatan histologi terhadap organ sasaran aksi senyawa toksik dilakukan untuk mengkonfirmasi adanya kerusakan organ tersebut. Pengamatan biasanya dilakukan terhadap kejadian kerusakan jaringan hati dan ginjal.
12
Perumusan dan Pendekatan Masalah
Total kebutuhan kedelai sebesar 2,5 juta ton per tahun, sebagian besar (78%) dipenuhi oleh impor dari negara yang mengadopsi kedelai transgenik. Adapun 50% dari total pasokan yang ada digunakan oleh produsen tempe. Tempe yang dibuat dari kedelai transgenik belum pernah diuji keamanannya, padahal landasan hukum mengenai pangan transgenik yang tercantum dalam Undang-undang Pangan no.18 tahun 2012 dan Undang-undang Kesehatan no. 36 tahun 2009 secara jelas menyatakan larangan untuk mengedarkan dan menjual pangan yang berasal dari tanaman transgenik sebelum dilakukan pengujian keamanan. Tempe sebagai pangan yang berasal dari tanaman hasil rekayasa genetika belum pernah diuji keamanannya.
Tujuan Penelitian
Tujuan penelitian ini adalah menguji keamanan tempe yang dibuat dari kedelai impor transgenik dan non-transgenik melalui pengujian toksisitas subkronis secara in vivo menggunakan tikus percobaan selama 90 hari. Analisis darah dan organ dilakukan terhadap tikus yang telah diterminasi. Parameter yang digunakan adalah profil hematologi (kadar hemoglobin, eritrosit, leukosit, trombosit dan hematokrit) serta profil serum (kadar SGOT, SGPT, protein total, albumin, globulin, trigeliserida, glukosa, ureum dan kreatinin). Pengamatan kualitatif di bawah mikroskop dilakukan terhadap jaringan hati dan ginjal tikus percobaan untuk melihat kondisi histopatologi.
Hipotesis Penelitian
Konsumsi jangka panjang akan tepung tempe yang berasal dari kedelai transgenik pada tikus percobaan tidak menimbulkan dampak buruk bagi kesehatan.
METODE PENELITIAN
Tempat dan Waktu
13
Bahan dan Alat
Bahan-bahan yang digunakan dalam penelitian ini adalah : tempe kedelai transgenik dan tempe kedelai non-transgenik yang didapat dari Rumah Tempe Indonesia (RTI) Cilendek Bogor, pati jagung, minyak jagung Mazola®, kasein, vitamin mix Fitkom®, mineral mix, alkohol 70%, larutan Bouin, alkohol 80%, alkohol 90%, alkohol absolut, xylol, paraffin, pewarna hematoksilin-eosin, serta reagen untuk analisis serum.
Peralatan yang digunakan adalah : seperangkat kandang tikus, syringe, alat bedah, cawan petri, tabung darah dengan EDTA, tabung sentrifuse, automatic hematology analyzer (Medonic M-series Haematology Analyzer, Boule Medical, Stockholm, Sweden), dan chemistry analyzer (Vital scientific Selectra Junior Clicinal Chemistry Analyzer, Dieren, The Netherlands), gelas objek, cover glass,
tissue embedding console (Tissue Tec® TEC), hot chamber, inkubator, mikrotom, mikroskop, serta kamera digital dino eye.
Tahapan Penelitian
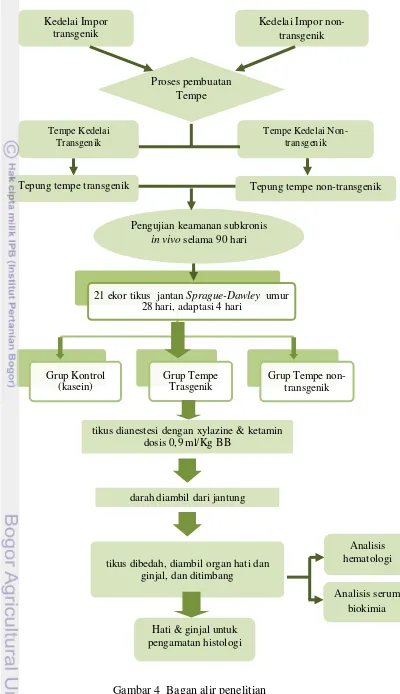
Penelitian ini dilakukan dalam enam tahapan yang terdiri dari : pembuatan tempe dan tepung tempe untuk formulasi ransum, pembuatan ransum tikus percobaan, perlakuan hewan percobaan, sampling untuk mengambil darah dan organ tikus percobaan, dan analisis statistika serta observasi histologi. Skema penelitian dapat dilihat pada Gambar 4.
1. Pembuatan tempe dan tepung untuk formulasi ransum
Tahapan pertama dalam penelitian ini adalah pembuatan tempe dan tepung tempe. Tempe dibuat di Rumah Tempe Indonesia, Cilendek, Bogor. Pembuatan tempe dilakukan secara terpisah untuk masing-masing jenis kedelai (kedelai transgenik dan kedelai non-transgenik). Proses pembuatan tempe dilakukan dengan cara sebagai berikut. Kedelai dicuci, direbus selama 30 menit, direndam 12 jam untuk mendapatkan pH sekitar 4.0–4.5, digiling untuk memecah biji, dicuci dan dibuang kulitnya. Biji kedelai tanpa kulit kemudian dicuci bersih, direbus selama 15 menit, ditiriskan dan didinginkan, diberi ragi komersial (satu gram per satu kilogram kedelai mentah), dan difermentasi selama 48 jam pada suhu 30–32oC.
Tempe segar diiris dan diblansir menggunakan uap panas selama 10 menit, digiling dan dikeringkan (dioven dengan suhu 60oC selama 8 jam), digiling dengan disc-mill dan diayak menggunakan saringan 40 mesh untuk mendapatkan tepung tempe.
2. Pembuatan ransum tikus percobaan
14
21 ekor tikus jantan Sprague-Dawley umur 28 hari, adaptasi 4 hari
Grup Kontrol (kasein)
Grup Tempe
Trasgenik Grup Tempe non-transgenik
tikus dianestesi dengan xylazine & ketamin dosis 0,9 ml/Kg BB
darah diambil dari jantung
tikus dibedah, diambil organ hati dan ginjal, dan ditimbang
Analisis hematologi
Analisis serum biokimia Tempe Kedelai
Non-transgenik
Hati & ginjal untuk pengamatan histologi
Gambar 4 Bagan alir penelitian
Pengujian keamanan subkronis
in vivo selama 90 hari Tempe Kedelai
Transgenik
Tepung tempe transgenik Tepung tempe non-transgenik
Kedelai Impor transgenik
Kedelai Impor non-transgenik
15
Tabel 6 Rumus formulasi komposisi ransum tikus percobaan
Komponen Sumber Jumlah Perhitungan
Protein Kasein / Tepung
tempe 10 % �=
Karbohidrat Pati jagung %
sisanya 100 – (lainnya)
Sumber : AOAC 1995
3. Perlakuan hewan percobaan
Pengujian keamanan tempe dari kedelai transgenik dan non-transgenik dilakukan secara in vivo dengan menggunakan tikus jantan Sprague-Dawley
selama 90 hari. Metode ini mengikuti pedoman pengujian pangan yang berasal dari tanaman transgenik yang dikeluarkan oleh European Food Safety Authorithy
(EFSA 2011) yaitu pedoman pelaksanaan studi toksisitas pangan/pakan dengan dosis berulang 90 hari pada tikus percobaan (Guidance on conducting repeated-dose 90-day oral toxicity study in rodents on whole food/feed) dengan beberapa modifikasi.
Tikus sebanyak 21 ekor dibagi dalam tiga kelompok, masing-masing sebanyak tujuh ekor. Kelompok tikus A dan B mendapatkan ransum tepung tempe dari kedelai transgenik dan tempe dari kedelai non-transgenik. Sebagai kontrol, kelompok tikus C mendapatkan ransum kasein sebagai sumber protein.
Setiap hari selama 90 hari perlakuan, tikus diberikan ransum secara ad libitum sesuai kelompoknya. Pengamatan terhadap perilaku tikus dan tanda-tanda klinis dilakukan setiap hari untuk mengamati adanya keganjilan yang muncul. Penimbangan bobot badan dilakuan setiap enam hari sekali.
4. Pengambilan darah untuk Analisis Hematologi dan Serum
Setelah 90 hari percobaan, seluruh tikus dikorbankan menggunakan obat bius campuran ketamin dan xylazine dosis anestesi 0.9 mg/kg bobot badan. Darah tikus diambil melalui jantung. Untuk analisis hematologi diambil sebanyak 0.5 ml dan dimasukkan ke dalam tabung darah yang telah diberi anti-koagulan EDTA.
Untuk analisis serum, darah diambil sebanyak 3 ml dan dimasukkan ke dalam tabung sentrifus. Analisis hematologi meliputi kadar hemoglobin (Hb), jumlah sel darah merah (eritrosit), sel darah putih (leukosit), keping darah (trombosit), dan hematokrit menggunakan alat hematology analyzer. Serum darah dianalisis menggunakan alat chemistry analyzer untuk menentukan kadar Serum Glutamic Oxaloacetic Transaminase (SGOT),
16
globulin, trigeliserida, glukosa, ureum dan kreatinin. Kedua analisis ini dilakukan di Laboratorium Kesehatan Daerah (Labkesda) Bogor. Organ hati dan ginjal ditimbang dan dianalisis lebih lanjut.
5. Analisis Histologi Jaringan Hati dan Ginjal
Setelah diambil darahnya, tikus dibedah untuk diambil organ hati dan ginjalnya. Kedua organ ditimbang dan dicuci dengan NaCl fisiologis, selanjutnya difiksasi menggunakan larutan Buoin. Jaringan yang telah difiksasi kemudian didehidrasi dengan alkohol bertingkat mulai dari konsentrasi 70, 80, 90, dan 95% masing-masing selama 24 jam, dilanjutkan dengan alkohol absolut selama 1 jam yang diulang sebanyak tiga kali. Setelah dehidrasi dilanjutkan dengan penjernihan menggunakan xilol sebanyak tiga kali masing-masing selama satu jam, dilanjutkan dengan infiltrasi parafin. Jaringan kemudian ditanam dalam media parafin. Berikutnya dilakukan penyayatan dengan ketebalan 4-5 mikron menggunakan mikrotom. Hasil sayatan dilekatkan pada kaca objek, kemudian diwarnai dengan pewarnaan hematoksilin-eosin (HE) untuk kemudian dilakukan pengamatan terhadap kelainan jaringan.
6. Analisis statistika dan pengamatan histologi
a. Hasil analisis profil hematologi dan serum darah kemudian diuji secara statistik menggunakan sidik ragam dan uji beda lanjut Duncan.
b. Pengamatan histologi dilakukan terhadap preparat jaringan hati dan ginjal yang telah diwarnai. Pengamatan dilakukan secara kualitatif terhadap morfologi jaringan tersebut.
HASIL DAN PEMBAHASAN
Formulasi Ransum Tikus Percobaan
17
Tabel 7 Analisis proksimat kasein dan tepung tempe Kandungan Gizi Kasein
(%)
Kadar protein (bk) 90.11 47.08 49.88
Serat kasar (bk) 0 4.69 5.08
Karbohidrat by difference 8.73 18.21 14.49
Tabel 8 Komposisi bahan dalam 100 gram ransum Komposisi
(gram)
Jenis protein ransum (dalam bentuk tepung) Kasein Tempe
Parameter Klinis dan Pertumbuhan Tikus Percobaan
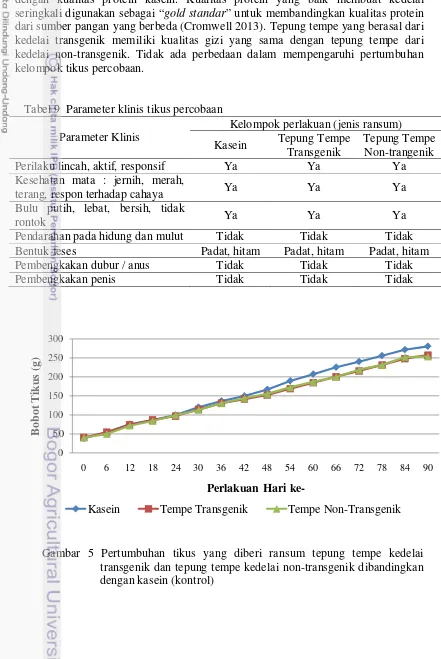
Dari hasil pengamatan terhadap beberapa parameter klinis, semua tikus tumbuh dengan sehat dan normal tanpa adanya kematian dalam setiap kelompoknya. Pengamatan terhadap tanda-tanda klinis dilakukan setiap hari selama masa percobaan 90 hari. Perilaku normal yang ditandai dengan keaktifan dan kelincahan serta tidak ditemukan perilaku agresif, mata yang berwarna merah, bulu yang tebal dan putih, tidak ditemukan adanya pembengkakan pada anus dan penis, serta tidak ditemukan adanya tikus yang mengalami diare, menandakan bahwa seluruh tikus dalam keadaan sehat (Tabel 9). Tidak ada perilaku yang menyimpang ataupun pengamatan klinis yang berbeda pada kelompok tikus dengan ransum tempe transgenik.
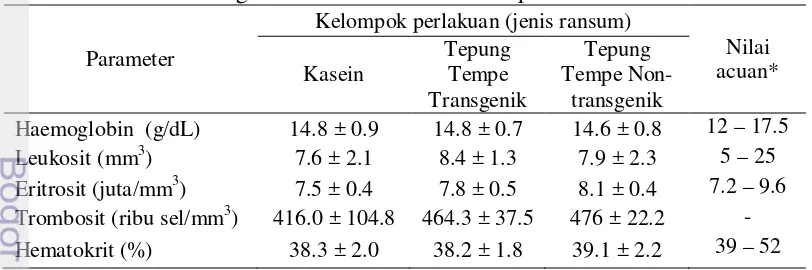
Kelompok tikus percobaan yang diberi ransum tepung tempe dari kedelai transgenik dan non-transgenik menunjukkan grafik pertumbuhan yang sama, tetapi sedikit lebih rendah dibandingkan kasein (Gambar 5). Parameter pertumbuhan tikus percobaan, yaitu kenaikan berat badan dan Feed Conversion Efficiency (FCE) tidak berbeda nyata (p>0.05) antar kelompok perlakuan (Lampiran 1 dan Tabel 10).
18
dibuat secara isogenik dengan kandungan protein sebesar 10%. Namun jika diamati grafik pertumbuhan kelompok tikus yang diberi tepung tempe dan tikus yang diberi kasein, serta parameter FCE ketiga kelompok yang tidak berbeda nyata secara statistik menunjukkan bahwa kualitas protein tempe dapat dikatakan sebanding dengan kualitas protein kasein. Kualitas protein yang baik membuat kedelai seringkali digunakan sebagai “gold standar” untuk membandingkan kualitas protein dari sumber pangan yang berbeda (Cromwell 2013). Tepung tempe yang berasal dari kedelai transgenik memiliki kualitas gizi yang sama dengan tepung tempe dari kedelai non-transgenik. Tidak ada perbedaan dalam mempengaruhi pertumbuhan kelompok tikus percobaan.
Tabel 9 Parameter klinis tikus percobaan Parameter Klinis
Kelompok perlakuan (jenis ransum) Kasein Tepung Tempe
Transgenik
Tepung Tempe Non-trangenik Perilaku lincah, aktif, responsif Ya Ya Ya Kesehatan mata : jernih, merah,
terang, respon terhadap cahaya Ya Ya Ya Bulu putih, lebat, bersih, tidak
rontok Ya Ya Ya
Pendarahan pada hidung dan mulut Tidak Tidak Tidak Bentuk feses Padat, hitam Padat, hitam Padat, hitam Pembengkakan dubur / anus Tidak Tidak Tidak
Pembengkakan penis Tidak Tidak Tidak
Gambar 5 Pertumbuhan tikus yang diberi ransum tepung tempe kedelai transgenik dan tepung tempe kedelai non-transgenik dibandingkan dengan kasein (kontrol)
0 50 100 150 200 250 300
0 6 12 18 24 30 36 42 48 54 60 66 72 78 84 90
B
ob
ot
T
ik
u
s
(g)
Perlakuan Hari
19
Tabel 10 Kenaikan bobot badan dan konsumsi ransum tikus selama 90 hari percobaan
Parameter Pertumbuhan
Kelompok perlakuan (jenis ransum) Kasein Tepung Tempe
Transgenik Keterangan : tidak ada perbedaan signifikan antar kelompok perlakuan
Profil Hematologi Tikus Percobaan
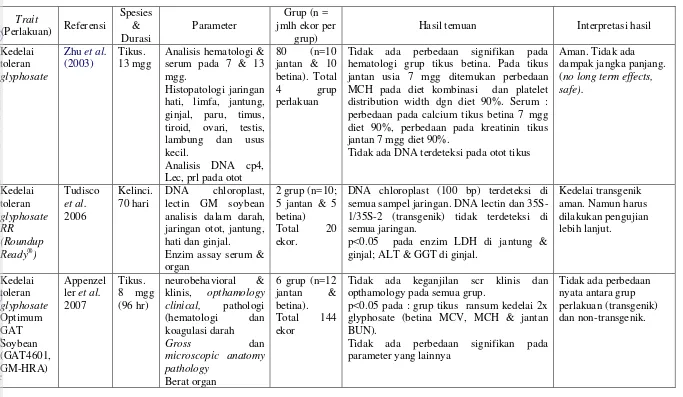
Hasil analisis terhadap darah tikus yang meliputi kadar haemoglobin, leukosit, eritrosit, trombosit dan hematokrit dapat dilihat pada Tabel 11. Dari hasil uji statistik menggunakan Anova (Lampiran 1), diperoleh hasil bahwa parameter hematologi haemoglobin, leuko sit, eritrosit, trombosit dan hematokrit tidak menunjukkan beda nyata (p>0.05) antar kelompok percobaan. Data tersebut, menunjukkan kelompok tikus yang diberi ransum tepung tempe dari kedelai transgenik dan non-transgenik tidak berbeda dengan kelompok kasein (kontrol) dan kisarannya masih dalam batas normal. Hal ini menunjukkan bahwa kelompok tikus dengan ransum tepung tempe dari kedelai transgenik sama sehatnya dengan kelompok pembanding, yaitu kelompok tempe dari kedelai non-transgenik dan kelompok kasein sebagai kontrol.
Tabel 11 Nilai hematologi darah tikus setelah 90 hari percobaan
Parameter
Kelompok perlakuan (jenis ransum)
Nilai
Keterangan : tidak ada perbedaan signifikan antar kelompok perlakuan (p>0.05) *sumber : Arrington, 1972
Hematologi dan biokimia serum sangat berguna dan merupakan indikator yang cukup sensitif untuk menggambarkan kesehatan tikus secara umum (Zhu et al.
20
Analisis hematologi adalah pemeriksaan yang dilakukan untuk mengetahui keadaan darah dan komponen-komponennya. Tujuan analisis hematologi adalah mendeteksi kelainan hematologi (misalnya anemia atau leukemia) dimana diduga ada kelainan jumlah dan fungsi dari sel-sel darah, mendeteksi penyakit pendarahan yang menunjukkan kelainan faal homeostatis, membantu diagnosis penyakit infeksi, dengan melihat kenaikan atau penurunan jumlah leukosit (dan hitung jenisnya), serta untuk mengetahui kelainan sistemik pada hati dan ginjal yang dapat mempengaruhi sel darah, baik bentuk atau fungsinya (Turner et al., 2008).
Sebagai komponen yang penting dalam sistem transport tubuh, darah berfungsi menyalurkan oksigen, nutrisi penting yang diperlukan oleh metabolisme, dan sisa-sisa zat buangan yang tidak diperlukan tubuh. Darah juga berperan dalam mekanisme pertahanan tubuh terhadap berbagai patogen dan toksin (Turner et al., 2008). Darah mengirimkan hormon dan regulator lain dari dan ke dalam sel dan jaringan. Darah juga menjaga homeostasis dengan cara berperan sebagai buffer dan berpartisipasi dalam proses koagulasi dan regulator panas. Darah terdiri dari sel dan turunannya, serta cairan kaya protein yang disebut plasma.
Sel darah dan turunannya terdiri dari sel darah merah/eritrosit (RBCs/Red
Blood Cells), leukosit atau sel darah putih (WBCs/White Blood Cells) dan trombosit atau dikenal sebagai keping darah/platelets. Perbandingan sel dan plasma darah adalah 45:55. Beberapa parameter yang dapat dianalisis dalam pengujian hematologi antara lain : hemoglobin (Hb), eritrosit, leuko sit, trombosit, hematokrit, Mean Corpuscular Volume (MCV), Mean Corpuscular Haemaglobin (MCH), Mean Corpuscular Haemaglobin Concentration (MCHC), RBC distribution width, platelet distribution width dan mean platelet volume (MPV).
Eritrosit mengandung hemoglobin (Hb), senyawa protein dan besi yang berfungsi membawa oksigen ke seluruh tubuh. Pemeriksaan kadar Hb digunakan
untuk mengetahui kelainan seperti anemia, yaitukeadaan saat jumlah sel darah
merah atau jumlah hemoglobin (protein pembawa oksigen) dalam sel darah merah berada di bawah normal, atau polisitopenia, yaitu pembentukan sel darah merah yang berlebihan di sumsum tulang belakang (Stockham dan Scott, 2008).
Leukosit berfungsi dalam mekanisme pertahanan tubuh terhadap bakteri maupun virus. Bila jumlah leukosit lebih tinggi dari nilai normal, maka keadaan tersebut disebutleuko sitosis, yang mengindikasikan terjadinya infeksi patogen atau kanker (leukemia). Trombosit atau keping darah berfungsi dalam proses pembekuan darah, berguna untuk mendiagnosis dan memantau perdarahan, serta gangguan pembekuan darah. Hematokrit merupakan perbandingan antara sel-sel darah merah, sel-sel darah putih dan trombosit dengan plasma darah. Pemeriksaan hematokrit dilakukan bersamaan dengan pemeriksaan Hb dan eritrosit yang digunakan untuk menentukan keadaan anemia, kehilangan darah, anemia hemolitik dan polisitemia (Stockham dan Scott, 2008).
21
kedelai transgenik dalam jangka panjang, namun lebih dikarenakan adanya keragaman antar individu tikus percobaan.
Dalam Zhu et al. (2004), perbedaan nyata ditemukan pada parameter MCH dan platelet distribution width pengukuran 7 minggu pada kelompok tikus jantan yang diberi perlakuan kedelai transgenik. Sementara pada parameter lainnya (jumlah leukosit, eritrosit, hemoglobin, hematokrit, trombosit, MCV, MCHC, Red Blood Cell
(RBC) distribution width, dan MPV pada pengukuran 7 dan 13 minggu, baik dalam kelompok perlakuan jantan dan betina, angkanya tidak menunjukkan perbedaan nyata antar kelompok percobaan (kedelai transgenik dan non-transgenik).
Parameter hematologi hematokrit dan hemoglobin kelompok tikus jantan Wistar yang diberi kedelai non-transgenik dan kedelai transgenik pada penelitian Daleprane et al. (2009) selama 455 hari menunjukkan angka yang lebih rendah (p<0.05) jika dibandingkan dengan kelompok kontrol yang diberi kasein. Hal ini kemungkinan besar dikarenakan bioavalabilitas zat besi (iron) pada kedelai yang rendah dikarenakan masih tingginya komponen antinutrisi seperti asam fitat, oksalat, tanin dan polifenol yang dapat membentuk kompleks dengan zat besi dan bersifat tidak larut dalam lumen lambung (Zijp et al. 2000 dalam Daleprane et al. 2009).
Penelitian jangka panjang selama dua tahun (104 minggu atau 728 hari) yang dilakukan oleh Sakamoto et al. (2008) terhadap 100 ekor tikus F344 jantan dan betina yang mengukur WBC, RBC, Hb, hematokrit, MCV, MCH, MCHC dan trombosit menemukan adanya perbedaan nyata (p<0.05) pada parameter MCHC pada kelompok tikus jantan yang diberi kedelai transgenik serta parameter Hb dan hematokrit pada kelompok tikus betina yang diberi kedelai transgenik. Namun hasil penelitian tersebut menyimpulkan bahwa perbedaan yang ditemukan bukan disebabkan oleh intervensi pemberian kedelai transgenik, namun lebih karena keragaman individu. Hasil analisis terhadap parameter hematologi MCV yang lebih rendah (p<0.05) pada kelompok ikan salmon yang diberi ransum kedelai transgenik dan non-transgenik dibandingkan dengan kontrol kelompok ikan yang diberi ransum komersial ditemukan juga pada penelitian Hemre et al.(2005).
Tidak adanya kelainan pada analisis hematologi yang dilakukan pada percobaan ini dan beberapa penelitian sebelumnya menunjukkan bahwa konsumsi kedelai transgenik dalam bentuk tepung tempe selama 90 hari tidak mengakibatkan adanya gangguan kesehatan.
Analisis Serum Darah Tikus Percobaan
Plasma terdiri dari 90% air, protein (7-8%) dan berbagai komponen terlarut (1-2%), termasuk berbagai elektrolit (Na+, K+, Ca2+, Mg2+, Cl-, HCO3-, PO43-, SO42-),
zat non protein (urea, asam urat, kreatinin, garam ammonia), nutrisi (glukosa, lipid, asam amino), gas darah (oksigen, CO2, nitrogen) dan komponen regulator (hormon
22
Protein yang berasal dari makanan akan diserap oleh usus halus dalam bentuk asam-asam amino. Asam-asam amino di hati kemudian dimetabolisme, disintesis menjadi protein kemudian akan menjdi protein hati atau protein plasma (Muchtadi 2008). Protein utama dalam plasma adalah albumin, yaitu setengah dari protein plasma. Albumin merupakan protein plasma terkecil (70 kD) dan disintesis di dalam hati. Albumin bertanggung jawab untuk mengerahkan gradien konsentrasi antara darah dan cairan jaringan ekstraseluler. Tekanan osmotik utama ini pada dinding pembuluh darah, yang disebut tekanan osmotik koloid, mempertahankan proporsi yang benar dari darah ke volume cairan jaringan. Ketika sejumlah protein albumin dilepaskan dari pembuluh darah ke jaringan pengikat atau terlepas dari darah ke urin di ginjal, tekanan koloid osmotik darah berkurang, sehingga mengakibatkan penumpukan cairan pada jaringan (edema). Albumin juga berperan sebagai protein pembawa yang mengikat dan membawa hormon transport (tyroxine), metabolit (bilirubin) dan obat-obatan (Ross dan Pawlina 2011).
Globulin, termasuk immunoglobulin, merupakan komponen terbesar dari fraksi protein globulin dan non-imun globulin. Imunoglobulin merupakan antibodi, suatu molekul fungsional sistem imun yang disekresikan oleh sel-sel plasma, sedangkan non-imun globulin disekresikan oleh hati. Protein globulin menjaga tekanan osmotik dalam sistem pembuluh darah dan juga berfungsi sebagai protein pembawa untuk berbagai zat seperti tembaga (dengan ceruloplasmin), besi (oleh transferin), dan hemoglobin protein (oleh haptoglobin). Non-imun globulin juga termasuk fibronektin, lipoprotein, faktor koagulasi, dan molekul lain yang dapat berpindah-pindah antara darah dan jaringan ikat ekstravaskuler (Ross dan Pawlina 2011).
Menurut Davidson dan Henry (1974) pengukuran total protein, albumin dan globulin dapat digunakan untuk mendeteksi kerusakan hati meskipun kurang spesifik. Terjadinya sirosis pada sel hepatosit dapat diindikasikan dari terjadinya penurunan konsentrasi total protein dan albumin (hipoalbuminemia). Hasil pengukuran terhadap kadar protein total, albumin dan globulin (Tabel 12) dan hasil analisis secara statistika terhadap rata-rata kadar ketiga parameter tersebut (Lampiran 1) menunjukkan bahwa tidak ada gangguan metabolisme protein yang terjadi pada seluruh tikus percobaan.
23
Dari hasil pengukuran terhadap kadar SGOT dan SGPT pada ketiga kelompok tikus percobaan (Tabel 12) tidak ditemukan adanya perbedaan nyata (p>0.05) antara kelompok tikus yang diberi tepung tempe transgenik dan non-transgenik dan kelompok tikus dengan ransum kasein. Hal ini menunjukkan tidak ada kerusakan pada sel-sel hati.
Analisis terhadap enzim serum dan enzim pada organ dilakukan oleh Tudisco
et al. (2006) setelah melakukan intervensi pemberian kedelai transgenik selama 70 hari pada 20 ekor kelinci percobaan. Hasil pengukuran terhadap creatine kinase
(CCK), aspartate aminotransferase (AST), alanin aminotransferase (ALT), lactic dehydrogenase (LDH), gamma glutamyltransferase (GGT) dan alkaline phosphatase
(ALP) pada serum darah tidak menunjukkan adanya perbedaan nyata antar kelompok perlakuan. Sedangkan pengukuran enzim dari organ ditemukan adanya perbedaan nyata (p<0.05), yaitu LDH pada jantung dan ginjal, serta ALT dan GGT pada ginjal. Namun demikian, kesimpulan dari penelitian tersebut menyatakan bahwa pemberian kedelai transgenik dalam jangka panjang tidak memberikan dampak yang buruk bagi kesehatan.
Lemak dari makanan yang dikonsumsi umumnya dalam bentuk trigliserida. Jika asupan kalori berlebih, kalori yang tidak dipergunakan akan diubah dalam bentuk trigliserida dan disimpan sebagai cadangan lemak di hati dan berbagai jaringan adiposa. Trigliserida ditemukan dalam jumlah sedikit dalam darah. Jika trigliserida dalam darah meningkat, telah terjadi gangguan pada proses metabolisme (Stockham dan Scott 2008). Rata-rata kadar trigliserida pada ketiga kelompok tikus percobaan (Tabel 12) tidak menunjukkan adanya perbedaan nyata (Lampiran 1). Data tersebut menunjukkan bahwa pada seluruh tikus percobaan tidak ditemukan adanya gangguan metabolisme lemak.
Karbohidrat yang telah dicerna di usus halus dalam bentuk glukosa kemudian akan masuk ke aliran darah. Selain dipergunakan oleh sel sebagai sumber energi dengan bantuan hormon insulin, glukosa akan disimpan di hati dan sebagian kecil di otot dalam bentuk glikogen (Muchtadi 2008). Salah satu gejala terjadinya gangguan metabolisme karbohidrat berupa diabetes, yang ditandai dengan meningkatnya kadar glukosa darah. Rata-rata kadar glukosa darah tikus percobaan (Tabel 12) antara kelompok tikus yang diberi tempe transgenik dan non transgenik tidak menunjukkan perbedaan nyata (p>0.05), begitu pula jika dibandingkan dengan kasein (Lampiran 1). Hal ini menunjukkan tidak ada gangguan metabolisme karbohidrat.
Hampir seluruh ureum (urea) yang dibentuk di hati berasal dari deaminasi protein. Urea berdifusi bebas masuk ke dalam cairan intra sel dan ekstrasel dan masuk ke ginjal untuk difiltrasi dan dibuang. Kadar ureum yang tinggi di dalam
darah mengindikasikan adanya gangguan terhadap fungsi hati dan ginjal (Stockham
dan Scott 2008).
24
difosforilasi dan memasuki metabolisme otot, dan hampir semua kreatin tubuh terdapat dalam otot (Panjaitan et al. 2007).
Kreatinin secara metabolik tidak aktif, berdifusi ke dalam plasma dan dieksresikan ke dalam urin. Pada kegagalan ginjal, kreatinin ditahan bersama unsur nitrogen non-protein (NNP) darah lainnya. Dibandingkan dengan urea plasma, kreatinin plasma lebih luas digunakan untuk mengukur fungsi ekskresi kegagalan ginjal kronik dan sebagai ukuran kuantitatif kerusakan ginjal karena kreatinin plasma hampir tidak dipengaruhi oleh diet seperti halnya urea plasma (Panjaitan et al. 2007). Dari hasil pengukuran kadar ureum dan kreatinin pada ketiga kelompok tikus percobaan (Tabel 12), tidak ada perbedaan nyata antara ketiga kelompok perlakuan (Lampiran 1), tidak ada gangguan yang terjadi pada fungsi ginjal dan hati. Tidak ada dampak buruk yang terjadi pada kesehatan tikus percobaan akibat mengonsumsi tepung tempe yang berasal dari kedelai transgenik
Tabel 12 Profil biokimia serum tikus setelah 90 hari percobaan Parameter
Kelompok perlakuan (jenis ransum) Kasein Tepung Tempe
Transgenik
Tepung Tempe Non-transgenik SGOT (U/L) 97.0 ± 15.6 122.0 ± 22.6 107 ± 10.7 SGPT (U/L) 49.2 ± 7.5 53.2 ± 10.5 50.5 ± 9.4 Protein Total (g/dL) 5.6 ± 0.2 5.5 ± 0.2 5.4 ± 0.2 Albumin (g/dL) 3.3 ± 0.2 3.2 ± 0.1 3.2 ± 0.1 Globulin (g/dL) 2.4 ± 0.1 2.3 ± 0.2 2.2 ± 0.1 Rasio Albumin/Globulin 1.4 ± 0.1 1.4 ± 0.1 1.4 ± 0.1 Glukosa (mg/dL) 164.8 ± 38.2 162.5 ± 14.6 182.3 ± 34.3 Trigliserida (mg/dL) 45.3 ± 14.2 50.7 ± 22.1 54.2 ± 24.8 Ureum (mg/dL) 25.8 ± 4.9 22.5 ± 5.3 21.8 ± 3.0 Kreatinin (mg/dL) 0.66 ± 0.2 0.68 ± 0.1 0.66 ± 0.2 Keterangan : tidak ada perbedaan signifikan antar kelompok perlakuan (p>0.05) SGOT = Serum Glutamic Oxaloacetic Transaminase (AST)
SGPT = Serum Glutamic Pyruvic Transaminase (ALT)
Dari hasil uji statistika menggunakan Anova terhadap seluruh parameter (Lampiran 1), diperoleh hasil bahwa tidak ditemukan adanya beda nyata (p>0.05) pada parameter SGOT, SGPT, protein total, albumin, globulin, glukosa, trigliserida, ureum dan kreatinin antara kelompok perlakuan. Tidak ada perbedaan hasil analisis serum darah antara kelompok tikus yang diberi ransum tepung tempe kedelai transgenik dan kelompok tikus yang diberi ransum tepung tempe kedelai non-transgenik, serta tidak adanya perbedaan kedua kelompok tersebut dengan kelompok kontrol (kasein) menunjukkan bahwa pada ketiga kelompok perlakuan tidak terjadi gangguan fungsi organ dan ginjal serta infeksi akut.
25
transgenik selama 90 hari tidak menimbulkan dampak yang berbahaya bagi kesehatan. Hal ini sejalan dengan beberapa penelitian sebelumnya, dimana parameter dalam serum darah tidak menunjukkan perbedaan nyata (p>0.05) antara kelompok tikus yang diberi kedelai transgenik dengan pembandingnya, yaitu kedelai non-transgenik dan, atau kelompok tikus dengan ransum komersial atau kasein (Zhu et al. 2004; Tudisco et al. 2006; Appenzeller et al. 2008; Sakamoto et al. 2008; Daleprane et al. 2009; Daleprane et al. 2010; Qi et al. 2012;).
Histologi Jaringan Hati dan Ginjal
Untuk memastikan bahwa tidak ada kerusakan jaringan hati dan ginjal, dilakukan pengamatan histologi pada kedua jaringan ini. Hati merupakan organ yang paling tepat digunakan sebagai model untuk mengevaluasi dampak dari pola diet, dikarenakan fungsinya yang mengontrol keseluruhan metabolisme dan sebagai organ yang berfungsi mendetoksifikasi komponen toksik dan xenobiotik (Malatesta et al.
2008). Ginjal merupakan organ yang penting dalam proses metabolisme, yaitu berfungsi untuk membuang sisa-sisa metabolisme yang tidak diinginkan tubuh. Selain itu, ginjal berperan dalam menjaga keseimbangan cairan dan elektrolit tubuh, sebagai regulator tekanan darah, pengatur keseimbangan asam basa, serta berperan dalam stimulasi produksi sel-sel darah merah.
Hati merupakan tempat utama terjadinya transformasi biologis berbagai komponen yang berasal dari saluran pencernaan. Hati berperan penting sebagai tempat pembentukan, penyimpanan dan distribusi berbagai nutrisi dan vitamin yang berasal dari pembuluh darah. Hati berperan penting dalam metabolisme karbohidrat dengan cara menjaga kecukupan nutrisi untuk metabolisme sel. Pada proses metabolisme glukosa, hati memfosforilasi glukosa yang berasal dari saluran pencernaan menjadi fosfat. Tergantung dari kebutuhan energi, glukosa-6-fosfat dapat disimpan di hati dalam bentuk glikogen atau digunakan dalam proses glikolisis. Pada keadaan puasa, glikogen dipecah melalui proses glikogenolisis menjadi glukosa dan dilepaskan ke darah (Ross dan Pawlina 2011). Sebagai organ eksokrin, hati berfungsi memproduksi cairan empedu yang berisi garam empedu, fosfolipid dan kolesterol (Stockham dan Scott 2008).
Hati meregulasi kadar Very Low Density Lipoprotein (VLDL) yang bersirkulasi dalam pembuluh darah. Hepatosit membuat asam lemak, trigliserida, kolesterol, dan apolipoprotein untuk lipoprotein, serta ester kolesterol untuk fosfolipid. Hepatosit mendegradasi kilomikron dari saluran darah dan membuang sisa lipoprotein (Ross dan Pawlina 2011).
Selain mensistesis protein albumin dan non-imun globulin, hati juga mensintesis sebagian besar VLDL, yang berperan dalam transportasi trigliserida dari hati ke berbagai organ. Hati juga memproduksi sebagian kecil protein plasma lipoprotein seperti Low Density Lipoprotein (LDL) dan High Density Lipoprotein